Note: Descriptions are shown in the official language in which they were submitted.
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
DERIVES ANTICANCEREUX, LEUR PRÉPARATION
ET LEUR APPLICATION EN THÉRAPEUTIQUE
La présente invention se rapporte à des dérivés anticancéreux, les
compositions les contenant et
leur application en thérapeutique. L'invention se rapporte aussi au procédé de
préparation de ces
composés ainsi qu'à certains des produits intermédiaires utilisés.
[L'art antérieur]
La demande WO 2005/073229 décrit des composés de formule (A) dans laquelle R5
représente un atome d'hydrogène, F, CI, Br, OH, NO2, CN, un groupe (C,-
C6)alkyle ou O-(C,-
C6)alcoxy éventuellement substitué par F, CI ou Br :
R6 O O
R7R$N
I Ri
R5 X N R2
R3 (A)
La demande EP 0978516 décrit des composés de formule (B) dans laquelle R4
représente un
atome d'hydrogène, un groupe alkyle éventuellement substitué ou un atome
d'halogène
R2 O O
R3
X
R4 N N
R' (B)
La demande japonaise JP 4077488 décrit des composés de formule (C) dans
laquelle Xi
représente un atome d'halogène et R3 réprésente un atome d'halogène, un groupe
alcoxy,
alkylthio, alkylsulfinyle, alkylsulfonyle, arylthio, arylsulfinyle ou
arylsulfonyle
R2 O
X1
R
3 A
Ri
(C)
Le brevet US 5622967 décrit des composés de formule (D) :
O
X
Z N
1
y (D)
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
2
dans laquelle Z représente un groupe aryle ou hétéroaryle éventuellement
substitué, un groupe
phényle-alkyle, hétérocycloalkyle,...
La demande WO 2006/016067 décrit des dérivés de pyrido-pyrimidine de formule
(E)
N Are
R1NH N N NHCONHR1 (E)
dont le noyau est différent du noyau des composés de l'invention.
Aucun de ces documents ne décrit les composés de l'invention.
[Description de l'invention]
Définitions utilisées
Dans le cadre de la présente invention, et sauf mention différente dans le
texte, on entend par :
= un atome d'halogène : un atome de fluor, de chlore, de brome ou d'iode
(avantageusement le
fluor) ;
= un groupe alkyle : un groupe hydrocarboné aliphatique saturé comprenant de 1
à 6 atomes de
carbone (avantageusement, de 1 à 4 atomes de carbone) linéaire ou ramifié
obtenu en
enlevant un atome d'hydrogène d'un alcane. A titre d'exemples, on peut citer
les groupes
méthyle, éthyle, propyle, isopropyle, butyle, iso-butyle, tertio-butyle,
pentyle, 2,2-
diméthylpropyle, hexyle ;
= un groupe alcoxy : un groupe -0-alkyle, où le groupe alkyle est tel que
défini ci-dessus ;
= un hétéroatome : un atome d'azote, d'oxygène ou de soufre ;
= un groupe cycloalkyle : un groupe alkyle cyclique comprenant entre 3 et 8
atomes de carbone
engagés dans la structure cyclique. A titre d'exemples, on peut citer les
groupes cyclopropyle,
cyclobutyle, cyclopentyle, cyclohexyle ;
= un groupe aryle : un groupe aromatique monocyclique ou bicyclique comprenant
6 à 10
chaînons, par exemple un groupe phényle ou naphtyle ;
= un groupe hétéroaryle : un groupe aromatique mono-, bi- ou tricyclique
comprenant entre 5 et
14 chaînons et comprenant un ou plusieurs hétéroatome(s) ;
= un groupe hétérocycloalkyle : un groupe cycloalkyle tel que défini
précédemment,
comprenant en outre 1 à 4 hétéroatomes engagés dans la structure cyclique. A
titre
d'exemple, on peut citer les groupes pyrrolidinyle, pipéridinyle,
tétrahydrofuryle, morpholinyle
et pipérazinyle ;
= groupe protecteur : un groupe destiné à protéger une fonction chimique de
réactions
chimiques indésirées introduit au cours d'une étape de protection et qui est
libéré au cours
d'une étape ultérieure. On trouvera des exemples de groupements protecteurs
dans
T.W.Greene et coll. Protective Groups in Organic Synthesis , 3rd edition,
1999, Wiley-
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
3
Interscience ou dans J.F.W. McOmie Protective Groups in Organic Chemistry ,
Plenum
Press, 1973 ;
= éventuellement substitué le fait que chacun des groupes précédents
puisse être substitué
par un ou plusieurs groupes, identiques ou différents les uns des autres,
choisis parmi :
hydroxy, (C,-C6)alcoxy, de préférence (C,-C4)alcoxy, (C,-C6)alkyle, de
préférence (C,-
C4)alkyle ou atome d'halogène.
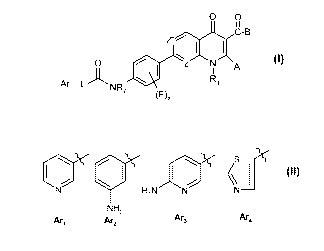
Selon un 1er aspect, la présente invention a pour objet un composé de formule
(I) :
O O
il
C-B
O I z N A
Ar- L IJ~ NR7 Ri
(F)X (I)
dans laquelle :
= R, représente : - un groupe (C3-C7)cycloalkyle ou
- un groupe (C,-C6)alkyle éventuellement substitué par un groupe -
NRaRb dans lequel :
(i) Ra et Rb représentent indépendamment l'un de l'autre un atome
d'hydrogène ou un groupe (C,-C4)alkyle ou
(ii) Ra et Rb forment ensemble avec l'atome d'azote auquel ils sont reliés,
un groupe hétérocycloalkyle comprenant éventuellement dans le cycle un
autre hétéroatome et éventuellement substitué ;
ou (iii) Ra représente un atome d'hydrogène et Rb représente un groupe -
C(=O)O(C,-C4)alkyle ;
= A représente un groupe -NR2R3 ;
= B représente un groupe -NR4R5 ou -OR6 ;
= R2 et R3 sont tels que :
o R2 et R3 représentent indépendamment l'un de l'autre un atome d'hydrogène
ou un groupe (C,-C6)alkyle ;
o ou R2 représente un atome d'hydrogène et R3 représente un groupe (C,-
C6)alkyle substitué par :
^ un groupe hétérocycloalkyle, éventuellement substitué ;
^ un groupe -NRcRd dans lequel :
(i) Rc et Rd représentent indépendamment l'un de l'autre un atome
d'hydrogène ou un groupe (C,-C4)alkyle ;
ou (ii) Rc et Rd forment ensemble avec l'atome d'azote auquel ils sont
reliés, un groupe hétérocycloalkyle comprenant éventuellement dans le
cycle un autre hétéroatome et éventuellement substitué ;
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
4
= R4 et R5 sont tels que
o R4 et R5 représentent indépendamment l'un de l'autre un atome d'hydrogène
ou un groupe (C,-C4)alkyle ou forment ensemble avec l'atome d'azote auquel
ils sont reliés un groupe hétérocycloalkyle, éventuellement substitué ;
o ou R4 représente un atome d'hydrogène et R5 représente un groupe (C,-
C6)alkyle substitué par :
^ un groupe hétérocycloalkyle, éventuellement substitué ;
^ un groupe -NReRf dans lequel :
(i) Re et Rf représentent un atome d'hydrogène ou un groupe (C,-
C4)alkyle ;
ou (ii) Re et Rf forment ensemble avec l'atome d'azote auquel ils sont
reliés, un groupe hétérocycloalkyle comprenant éventuellement dans le
cycle un autre hétéroatome et éventuellement substitué ;
ou (iii) Re représente un atome d'hydrogène et Rf représente un groupe -
C(=O)O(C,-C4)alkyle ;
o ou R4 représente un atome d'hydrogène et R5 représente l'un des groupes
suivants : -C(CH2OH)3 ; -[(CH2)2O]mCH2NH2 OU -[(CH2)3NH]m H dans lesquels
m est un nombre entier allant de 3 à 10 ;
avec la condition que si R2 représente un atome d'hydrogène et R3 représente
un groupe
(C,-C6)alkyle substitué par un groupe hétérocycloalkyle ou un groupe -NRcRd
alors R4 et
R5 sont respectivement identiques à R2 et R3 ;
= R6 représente un atome d'hydrogène ou un groupe (C,-C4)alkyle ;
= Z représente N ou CH ;
= Z' représente N ou CH si Z représente N et CH si Z représente CH ;
= x est un nombre entier allant de 0 à 4 ;
= R7 représente un atome d'hydrogène ou un groupe (C,-C4)alkyle ;
= L représente un groupe -CH=CH-, -CH2CH2-, -CH2CH[NHC(=O)O(C,-C4)alkyle)] ou -
(CH2),-Y- dans lequel n est un nombre entier allant de 1 à 4 et le groupe Y
(rattaché au
C=O) représente un atome d'oxygène ou un groupe -NR8- dans lequel R8
représente un
atome d'hydrogène ou un groupe (C,-C4)alkyle ;
= Ar représente un groupe choisi parmi
CN VH2NX N N
NHZ
Ar4
Art Ar2 Ar3
R, représente un groupe (C3-C7)cycloalkyle ou un groupe (C,-C6)alkyle
éventuellement substitué
par un groupe -NRaRb. Ra et Rb peuvent représenter indépendamment l'un de
l'autre un atome
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
d'hydrogène ou un groupe (C,-C4)alkyle.
Ra et Rb peuvent aussi former ensemble avec l'atome d'azote auquel ils sont
reliés, un groupe
hétérocycloalkyle comprenant éventuellement dans le cycle un autre hétéroatome
et
5 éventuellement substitué. Ce groupe hétérocycloalkyle pourra par exemple
être le groupe 4-
morpholinyle GN~
( ) ou pyrrolidinyle ( ).
Ra peut aussi représenter un atome d'hydrogène et Rb un groupe -COO(C,-
C4)alkyle, par exemple
le groupe -COOtBu.
R, peut être l'un de ceux du Tableau I.
A peut représenter un groupe -NR2R3.
R2 et R3 peuvent représenter indépendamment l'un de l'autre un atome
d'hydrogène ou un groupe
(C,-C6)alkyle. R2 et R3 peuvent représenter tous deux un atome d'hydrogène ou
bien R2 peut
représenter un atome d'hydrogène et R3 un groupe (C,-C6)alkyle. R2 peut aussi
représenter un
atome d'hydrogène et R3 un groupe (C,-C6)alkyle substitué par un groupe
hétérocycloalkyle,
éventuellement substitué, tel que par exemple, le groupe 4-pipéridinyle HN ou
4-N-alkYl-
0
pipéridinyle ( AIkN ), par ex. 4-N-méthyl-pipéridinyle, ou 2-tétrahydrofuryle
( ).
R2 peut aussi représenter un atome d'hydrogène et R3 un groupe (C,-C6)alkyle
substitué par un
groupe -NRcRd. Rc et Rd peuvent représenter indépendamment l'un de l'autre un
atome
d'hydrogène ou un groupe (C,-C4)alkyle. Rc et Rd peuvent aussi former ensemble
avec l'atome
d'azote auquel ils sont reliés, un groupe hétérocycloalkyle comprenant
éventuellement dans le
cycle un autre hétéroatome et éventuellement substitué : par exemple le groupe
4-morpholinyle
~N~
( ), pyrrolidinyle ( ), pipérazinyle (H ) ou N-alkyle-pipérazinyle
N N
Alk-
( N ), par ex. N-méthyl-pipérazinyle), pipéridinyle ( ). Comme exemples de
groupes hétérocycloalkyle substitués, on peut citer les groupes suivants : 2-
méthyl-pyrrolidinyle
Me
C~ F
( ), 4-hydroxy-pipéridinyle (HO ) ou 4,4'-difluoro-pipéridinyle ( F
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
6
On pourra choisir R2 et R3 ainsi que les combinaisons R2/R3 dans le Tableau I.
B peut représenter un groupe -NR4R5.
R4 et R5 peuvent représenter indépendamment l'un de l'autre un atome
d'hydrogène ou un groupe
(C,-C6)alkyle. R4 et R5 peuvent représenter tous deux un atome d'hydrogène ou
bien un groupe
(C,-C6)alkyle ou bien R4 peut représenter un atome d'hydrogène et R5 un groupe
(C,-C6)alkyle.
R4 et R5 peuvent aussi former ensemble avec l'atome d'azote auquel ils sont
reliés, un groupe
hétérocycloalkyle, éventuellement substitué, tel que le groupe pipérazinyle
(HN ) ou N-
~
alkyle-pipérazinyle ( Alk-N ), par ex. N-méthyl-pipérazinyle.
R4 peut représenter un atome d'hydrogène et R5 un groupe (C,-C6)alkyle
substitué par un groupe
hétérocycloalkyle, éventuellement substitué, tel que par exemple, le groupe 4-
pipéridinyle ou 4-N-
alkyl-pipéridinyle, par ex. 4-N-méthyl-pipéridinyle, ou 2-tétrahydrofuryle.
R4 peut représenter un atome d'hydrogène et R5 un groupe (C,-C6)alkyle
substitué par un groupe
-NReRf. Re et Rf peuvent représenter un atome d'hydrogène ou un groupe (C,-
C4)alkyle.
Re et Rf peuvent aussi former ensemble avec l'atome d'azote auquel ils sont
reliés, un groupe
hétérocycloalkyle comprenant éventuellement dans le cycle un autre hétéroatome
et étant
éventuellement substitué : par exemple le groupe 4-morpholinyle,
pyrrolidinyle, pipérazinyle ou N-
alkyle-pipérazinyle, par ex. N-méthyl-pipérazinyle, pipéridinyle. Comme
exemples de groupes
hétérocycloalkyle substitués, on peut citer les groupes suivants : 2-méthyl-
pyrrolidinyle, 4-
hydroxy-pipéridinyle ou 4,4'-difluoro-pipéridinyle.
Re peut aussi représenter un atome d'hydrogène et Rf un groupe -COO(C,-
C4)alkyle, comme le
groupe -COOtBu.
Enfin, R4 peut représenter un atome d'hydrogène et R5 l'un des groupes
suivants : -C(CH2OH)3 ; -
[(CH2)2O]mCH2NH2 OU -[(CH2)3NH]m H dans lesquels m est un nombre entier allant
de 3 à 10.
On pourra choisir R4 et R5 ainsi que les combinaisons R4/R5 dans le Tableau I.
B peut représenter un groupe -OR6 dans lequel R6 représente un atome
d'hydrogène ou un
groupe (C,-C4)alkyle. On pourra choisir R6 dans le Tableau I.
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
7
Z représente N ou CH et Z' représente N ou CH si Z représente N et CH si Z
représente CH. Le
cycle comprenant Z et Z' est donc l'un des 3 cycles suivants :
O O O O O O
il il il
C-B C-B C-B
~I I ~I I
N N A N A , jN N A
R1 CR1 c2 R1 C3
x représente le nombre d'atome(s) de fluor en tant que substituant du cycle ;
ce nombre entier
varie de 0 (aucun atome de fluor) à 4.
R7 représente un atome d'hydrogène ou un groupe (C1-C4)alkyle. De préférence,
il s'agit d'un
atome d'hydrogène. R7 peut être choisi dans le Tableau I.
L représente un groupe -CH=CH-, -CH2CH2-, -CH2CH[NHC(=O)O(C1-C4)alkyle)]- ou -
(CH2),-Y-
dans lequel n est un nombre entier allant de 1 à 4 et le groupe Y (rattaché au
C=O) représente un
atome d'oxygène ou un groupe -NR8- dans lequel R8 représente un atome
d'hydrogène ou un
groupe (C1-C4)alkyle. De préférence, dans le cas où L représente un groupe -
(CH2),-NR8-, l'un au
moins des deux groupes R7 ou R8 est un atome d'hydrogène. De préférence, les
deux groupes R7
ou R8 représentent un atome d'hydrogène (c'est-à-dire que le motif reliant Ar
et le cycle phényle
est -(CH2),-NH-C(=O)-NH-).
L peut être l'un de ceux décrits dans le tableau I. De préférence, L
représente le groupe -CH2-
NH-, -CH2-O- ou -CH=CH-. On préfère aussi, dans le cas où L représente le
groupe -CH=CH-,
les isomères E plutôt que les isomères Z.
Ar représente un groupe choisi parmi
CN' VH2NX N N
NHZ
Ar4
Art Ar2 Ar3
On distingue un 1er sous-groupe pour lequel
= R1 représente un groupe (C1-C6)alkyle ;
= A représente un groupe -NHR3 dans lequel R3 représente un atome d'hydrogène
ou un groupe
(C1-C4)alkyle ;
= B représente un groupe -NR4R5 dans lequel R4 représente un atome d'hydrogène
ou un
groupe (C1-C6)alkyle et R5 représente :
o un atome d'hydrogène ;
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
8
o ou un groupe (C,-C6)alkyle éventuellement substitué par :
^ un groupe hétérocycloalkyle, éventuellement substitué ;
^ un groupe -NReRf tel que défini précédemment ;
o ou l'un des groupes suivants : -C(CH2OH)3 ; -[(CH2)2O]mCH2NH2 OU -
[(CH2)3NH]m H dans
lesquels m est un nombre entier allant de 3 à 10.
Dans ce 1er sous-groupe, on peut distinguer les composés pour lesquels R3
et/ou R4 représentent
un atome d'hydrogène.
On distingue aussi un 2ème sous-groupe pour lequel
= Ri représente un groupe (C,-C6)alkyle substitué par un groupe -NRaRb tel que
défini
précédemment ;
= A représente un groupe -NH2 ;
= B représente un groupe -NR4R5 dans lequel R4 représente un atome d'hydrogène
ou un
groupe (C,-C6)alkyle.
On distingue aussi un 3ème sous-groupe pour lequel
= Ri représente un groupe (C,-C6)alkyle ;
= A et B représentent un groupe -NHR3 dans lequel R3 représente un groupe (C,-
C6)alkyle
substitué par un groupe hétérocycloalkyle ou par un groupe -NRcRd tel que
défini
précédemment.
Les composés du 3ème sous-groupe ont donc pour formule générale (II)
O O
il
Z C-NH-(Ci-C6)alkyle-Q
O z N NH-(CI i-C6)alkyle-Q
Ar L II I, NR7 Ri
(F)X (II)
dans laquelle Q désigne un groupe hétérocycloalkyle éventuellement substitué
ou bien le groupe
-NRcRd. Le groupe hétérocycloalkyle peut être plus particulièrement le groupe
morpholinyle,
pyrrolidinyle, pipérazinyle ou N-alkyle-pipérazinyle, par ex. N-méthyl-
pipérazinyle, pipéridinyle, 2-
méthyl-pyrrolidinyle, 4-hydroxy-pipéridinyle, 4,4'-difluoro-pipéridinyle, 2-
tétrahydrofuryle.
Pour tous ces sous-groupes, Ar, L, R7, R8, Z, Z' et x ont les mêmes
significations que
précédemment. Plus particulièrement, pour les composés de formule (I) ainsi
que pour les sous-
groupes :
= Ar représente le groupe Art
= et/ou R7 représente un atome d'hydrogène ;
= et/ou L représente CH2NH ;
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
9
= et/ou Z et Z' représentent respectivement N et CH.
Encore plus particulièrement, Ar=Ar1 ; R7=H ; L=CH2NH ; Z=N ; Z' = CH.
Parmi les composés objets de l'invention, on peut citer plus particulièrement
les composés du
Tableau I.
Les composés de l'invention peuvent exister à l'état de bases ou de sels
d'addition à un acide.
Ces sels sont avantageusement préparés avec des acides pharmaceutiquement
acceptables,
mais les sels d'autres acides utiles, par exemple, pour la purification ou
l'isolement des composés
font également partie de l'invention. Les composés selon l'invention peuvent
également exister
sous forme d'hydrates ou de solvats, à savoir sous forme d'associations ou de
combinaisons avec
une ou plusieurs molécules d'eau ou avec de solvant. Les composés peuvent
éventuellement
comporter un ou plusieurs atomes de carbone asymétriques et peuvent donc
exister sous forme
d'énantiomères et/ou de diastéréoisomères, ou de mélanges de ces formes.
Selon un 2ème aspect, l'invention a pour objet le procédé de préparation des
composés de
l'invention ainsi que certains des intermédiaires réactionnels.
Préparation des composés de formule (I) ou (II)
Les composés de formule (I) sont obtenus selon l'un des Schémas 1 ou 2 étant
entendu que dans
le cas particulier des composés de formule (II), seul le Schéma 2 utilisant P3
s'applique.
Schéma 1
o o
il
OK O O Z C-13
B-OK' Cil .
-B
O
[Pd]
z N A
Ar- L
NR7 (F) Hal z N A Ar- L NR7 R1
x
P1 P2 R1 (F)x (1)
Schéma 1
Le composé de formule (I) est obtenu selon le Schéma 1 par un couplage de type
Suzuki de Pl et
P2. Hal représente un atome d'halogène (chlore, brome, iode). Lorsque Z et Z'
représentent tous
les deux CH, le couplage est favorisé si Hal est un atome de brome ou d'iode.
Lorsque Z et Z'
représentent tous deux N ou respectivement N et CH, Hal peut être un atome de
chlore. Le
couplage est réalisé en présence d'un complexe de palladium (à l'état
d'oxydation (0) ou (II)) tel
que par exemple Pd(PPh3)4, PdCl2(PPh3)2, Pd(OAc)2 ou PdC12(dppf). Les
complexes les plus
fréquemment utilisés sont des complexes de palladium(O). Le couplage est aussi
favorisé en
présence d'une base, qui peut être par exemple K2CO3, NaHCO3, Et3N, K3PO4,
Ba(OH)2, NaOH,
KF, CsF, Cs2CO3... Le couplage peut être conduit dans un mélange d'un solvant
éthéré et d'un
alcool, par exemple un mélange diméthoxyéthane (DME)/éthanol. La température à
laquelle est
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
conduite la réaction peut être comprise entre 50 et 120 C.
On trouvera plus de détails sur le couplage de Suzuki, sur les conditions
opératoires ainsi que
sur les complexes de palladium utilisables dans : N.Miyaura et A.Suzuki, Chem.
Rev. 1995,
5 95, 2457-2483; A.Suzuki dans "Metal-catalyzed cross-coupling reactions";
Diederich, F.;
Stang, P.J. Eds. Wiley-VCH: Weinhein, Germany, 1998, chap. 2, 49-97 ; Littke,
A. et Fu, G.,
Angew. Chem. Int., Ed. 1999, 38, 3387-3388 et Chemler, S. R.
Angew.Chem.Int.Ed. 2001, 40,
4544-4568.
10 K et K' représentent un atome d'hydrogène, un groupe alkyle ou aryle,
éventuellement reliés entre
eux pour former ensemble avec l'atome de bore et les deux atomes d'oxygène un
cycle de 5 à 7
chainons éventuellement substitué par un ou plusieurs groupe(s) alkyle ou
éventuellement accolé
à un groupe phényle. Par exemple, on peut utiliser l'un des groupes suivants :
OH O O O
3CB-OH kB 0 B0 B~O }LO
0
Schéma 2
O I \
Z ' P4 Ar-(CHZ)~ YH (F)x
O O (i) Ar-(CF] -Y I~I NR 5
B ..C=O..
P5 Ar-CH=CH-000H
F)x
z N (II) Ar-CH=CH O NR7 \
1 A
Ri P6 Ar-CHZCHZ COOH O I \
NHR7 P3 (iii) - / (F)x
(F)x Ar-CHZCHZ NR
Schéma 2
Selon le Schéma 2, P3 réagit via -NHR7 avec :
= P4 de formule Ar-(CHZ),-YH en présence d'un agent permettant d'introduire le
motif "C=O"
(étape (i)). Cet agent peut être par exemple le phosgène, le triphosgène ou le
carbonate de
N,N'-disuccinimidyle (DSC). Avantageusement, la réaction est conduite en
présence de
triphosgène. Elle est conduite aussi de préférence en présence d'une base
telle que par
exemple la triéthylamine et à une température comprise entre -5 C et la
température ambiante
dans un solvant éthéré tel que le THF ; ou
= P5 de formule Ar-CH=CH-COOH (étape (ii)) ou P6 de formule Ar-CH2CH2-COOH
(étape (iii))
par une réaction d'amidification réalisée avantageusement en présence d'un
activateur d'acide
(ou agent de couplage, coupling agent ) dont la fonction est de favoriser
la formation de la
liaison amide ; comme exemple d'activateur d'acide, on peut citer le
benzotriazol-1-
yloxytris(dimethylamino)-phosphonium hexafluorophosphate (ou BOP, N CAS :
56602-33-6,
voir B.Castro., Dormoy, J.R. Tetrahedron Letter 1975, 16, 1219). Pour d'autres
activateurs
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
11
d'acides, voir Principles of peptide synthesis 1993, 2nd Ed, Bodanszky,
Springer Laboratory.
Dans le cas où Y représente NH, une alternative consiste à faire réagir P5' de
formule Ar-(CH2)n-
NH-C(=O)O-Ph-p-NO2 avec P3 dans les conditions de l'exemple 7.6. Un exemple de
P5' est le
pyridin-3-ylmethyl-carbamic acid 4-nitro-phenyl ester.
Préparation des composés intermédiaires
Préparation de Pl
Pl avec L=-(CH2)nY- est obtenu selon le Schéma 3 en faisant réagir P4 et P7 en
présence d'un
agent permettant d'introduire le motif "C=O" (par exemple le phosgène, le
triphosgène ou le
DSC) par une réaction semblable à celle de l'étape (ii) précédente :
OK
B-OK'
Ar-(CH2),,-YH + I "C=0 P
1
P4 NHR7 P7
(F)X
Schéma 3
L'exemple 1.5 illustre la préparation de Pl dans le cas où P4 représente la 3-
(aminométhyl)-
pyridine. Un exemple de P7 que l'on utilise avantageusement dans le Schéma 3
et dans les
suivants est le 4-(4,4,5,5-tétraméthyl-[1,3,2]dioxaborolan-2-yl)-phénylamine
(produit commercial).
Pl avec L= -CH=CH- ou -CH2CH2- est obtenu par une réaction d'amidification
entre P7 et
respectivement P5 ou P6 semblable à celle de l'étape (iii) ou (iv) du Schéma 2
précédent.
L'exemple 2.1 illustre la préparation d'un Pl dans le cas où P5 représente
l'acide 3-(3-
pyridyl)acrylique.
Pl avec L= -CH2CH[NHC(=O)O(C,-C4)alkyle]- est obtenu de même par une réaction
d'amidification entre P7 et le P'6 de formule : Ar-CH2CH[NHC(=O)O(C1-
C4)alkyle]-COOH. Par
N
O
tBuO N O
exemple, pour le composé n 16, on utilise pour P'6 le produit commercial
suivant : H OH
Préparation de P2 avec A=-NH2 et B=-NR4R5
cas où Z=N et Z'=CH
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
12
O O 0
OH R1NH2 I OH I F
Hal N Hal' (i) Hal Ni NH
( i i ) Hal N NH O NR4R5
I
I
Ps P9 R1 p Ri \ 0
CN CN 10 1 .105
RR,R,NH (iv) Hal N N NH2
CO2Et (iii) NR4R5 p11 P2 R1
O
Schéma 4
P2 est obtenu à partir d'un acide 2,6-dihalogéno-nicotinique P8 dans lequel
Hal et Hal'
représentent tous deux un atome d'halogène, par exemple il peut s'agir de
l'acide 2,6-dichloro-
nicotinique (Hal=Hal'=Cl). L'homme du métier pourra s'inspirer des conditions
données à
l'exemple 1 et les appliquer à d'autres groupes R1 et R5 :
étape i : la réaction avec l'amine R1NH2 peut avoir lieu à température
ambiante, dans un solvant
protique tel qu'un alcool ou l'eau (cf. ex. 1.1) ;
étape ii : transformation de l'acide P9 en fluorure d'acide P1o à l'aide par
exemple de fluorure
cyanurique et éventuellement d'une base telle que la pyridine. La réaction
peut avoir lieu à
température ambiante, dans du dichlorométhane (DCM) (cf. ex.1.2). Pour plus de
détails sur cette
réaction, on pourra consulter Synthesis 1973, 487, "Synthetic Methods and
Reactions; IV.1
Fluorination of Carboxylic Acids with Cyanuric Fluoride" ;
étape iii : cette réaction entre le cyanoacétate d'éthyle et l'amine (R4R5NH2
ou R5NH2) en excès
permettant d'obtenir une N-alkylcyanoacétamide peut avoir lieu dans un solvant
polaire tel que le
THF ou l'éthanol à une température allant de -50 C à l'ambiante (cf. ex. 1.3)
;
étape iv : on met en contact P1o et de P11 en présence d'au moins deux
équivalents d'une base
forte et on laisse réagir à température ambiante pendant quelques heures.
Puis, on ajoute un
autre équivalent de base forte au mélange réactionnel et le composé
intermédiaire formé se
cyclise in situ à température ambiante. La base forte peut être NaH ou bien
NaH associé à t-
BuOK. On ajoute de préférence par petites quantités une solution de P1o à une
solution de P11 (cf.
ex.1.4).
cas où Z =Z'=CH
O NR4R5
0 O CN
Il
r R1-Hal O NRR5 O
OH triphosgène
~/ ID
Hal ~NH (i) Hal (N 0 (il) Hal N" O (iii) Hal N NHz
2
is pia Ri
piz P R'
Schéma 4'
P2 est obtenu à partir d'un acide 2-amino-4-halogéno-benzoïque P12, par
exemple il peut s'agir de
l'acide 2-amino-4-bromo benzoïque (Hal=Br). L'homme du métier pourra
s'inspirer des conditions
données à l'exemple 7 et les appliquer à d'autres groupes R1 et R5.
étape i : réaction de P12 avec le triphosgène pour obtenir P13. La réaction
peut être conduite
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
13
dans le dioxane au reflux (cf. ex.7.1) ;
étape ii : réaction de P13 avec un halogénure R1Hal en présence d'une base
forte, par ex. NaH,
dans un solvant polaire, par ex. le DMF (cf. ex.7.2). L'halogénure est plus
particulièrement un
iodure (par ex. iodure d'éthyle) ;
étape iii : réaction entre P11 et P14 en présence d'une base forte, par ex.
NaH, dans un solvant
polaire, par ex. le DMF (cf. ex.7.3).
cas où Z=Z'=N
o o
0
N` OH (i) N CI EtOH N \ OEt R NH
i z N \ OR Et
HO N OH CI N Cl ( ) C CI (iii)
N CI~
Pis P16 P17 N NH Pis 1
Il O CN O NR,Rs
N R,Rs
(iv) OH (v) A F O N O
CI N NHR1 CI N NHR1 (vi) CI' N N NHz
P19 R,
Schéma 4"
P2 est obtenu à partir de l'acide 2,4-dihydroxy-pyrimidine-5-carboxylique P15.
L'homme du métier
pourra s'inspirer des conditions données à l'ex. 9 et les appliquer à d'autres
groupes R1 et R5 :
étape i : préparation du chlorure d'acide P16. On peut utiliser comme agent
acylant un mélange
POCI3 / PCI5 (cf. ex.9.1) ;
étape ii : préparation de l'ester P17 en mettant en contact le chlorure
d'acide et l'éthanol (cf.
ex.9.2) ;
étape iii : réaction de P16 avec l'amine R1NH2. La réaction peut avoir lieu
dans un solvant polaire
tel que le THF (cf. ex.9.3) ;
étape iv : transformation de la fonction ester -COOEt en fonction acide -COOH.
On peut utiliser
une base telle que la lithine dans de l'eau et acidifier ensuite (cf. ex.9.4)
;
étape v : préparation du fluorure d'acide. On peut utiliser le fluorure
cyanurique dans du DCM
(cf. ex.9.5) ;
étape (vi) : réaction de cyclisation entre P11 et le fluorure d'acide selon la
même méthode que
celle décrite à l'étape (iv) du Schéma 4 (cf. aussi ex.9.6).
Préparation de P2 avec A=-NH2 et B=-OR
6
On obtient ce composé selon le Schéma 5 par réaction de P20 dans lequel R
représente un
groupe (C1-C4)alkyle avec NH3. Plus particulièrement, R6=éthyle et/ou
R=méthyle.
O O O O
OR6 NH3 Z' OR6
Hal
z N SR Hal Z N NHz
I
P20 Ni P2 Ni
Schéma 5
La réaction peut être conduite en présence d'une solution d'ammoniaque
concentrée, à
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
14
température ambiante (cf. ex.3.5).
Préparation de P3
P3 avec R7=H est obtenu selon le Schéma 6 par un couplage de type Suzuki (dans
les conditions
détaillées précédemment) entre P7 et P2 :
OK O O O O
I il C-B
\ I B-OK' Z\ I I C -B [Pd] Z
H2N (F) Hal z i A z 1 A
x R1
Ni H2N
P7 P2 (F)x P. avec R7=H
Schéma 6
Dans le cas où R7 représente un groupe (C,-C4)alkyle, on utilise le Schéma 6'
(variante du
Schéma 6) dans lequel P7 est remplacé par P7'. P7' est obtenu en introduisant
le groupe R7 par
alkylation de la fonction amine de P7 préalablement protégée par le groupe
protecteur PG (PG
peut être par exemple le groupe tert-butyloxycarbonyle BOC).
OK OK O 0 O O
C-E
/ B-OK'i) protection / B-OK' Z C B [Pd] Z
ii) alkylation NPGR I + \\ I I ' / z N
H2N (F) (F) Hal z i A \ I R A
x x Ni PG-NR7 O 1O
P7 P7. P2 (F)x II
déprotection Z. C-B
/ I z N A
NHR7 R1
(F)x P3 avec R7 _ (C1-C4)alk'
Schéma 6'
Cas particulier où A et B représentent tous deux le groupe -NH-(C,-C6 alk le-Q
Dans ce cas, P3 est obtenu selon le Schéma 6" par un couplage de type Suzuki
entre P7 et P20
pour donner P21 suivi de la réaction de P21 avec le composé de formule H2N-(C,-
C6)alkyle-Q'. Q'
a la même définition que Q sauf lorsque Q représente un groupe -NH2, auquel
cas Q' représente
le groupe -NH-PG dans lequel PG représente un groupe protecteur de la fonction
amine (par ex.
BOC) et le couplage est alors suivi d'une étape de déprotection permettant de
former la fonction
-NH2.
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
OK O O O
B-OK' \ OR
+ Z' OR6 [Pd] Z I I 6
NHR7 \ J\ I SR z N SR
(F)x Hal N
R, R
NHR7 P21 ~
P7 P2o (F) O O
2HN-(C1-C6)alkyle-Q'l Z'I I NH-(C,-C6)-Q'
z N NH-(Ci-C6)-Q'
R1
NHR7 p3
(F)x
Schéma 6"
La réaction entre P21 et H2N-(C1-C6)alkyle-Q' s'effectue de préférence à une
température
supérieure à 100 C (cf. ex.8.7 ou 4.2) et de préférence pendant une longue
durée (> 10 h).
5
Préparation de P,o
P20 est préparé à partir de P'8 selon le Schéma 7 :
o o o o
CH2(CO2H)COOR0 yII~ xII
Z' OH z'CI zORs
nBuLi -
Hal z Hal' Hal/ z Hal Hal z Hal,
P.s P'16 P22
SR 00 O O
CS21 base SR \\Y OR, R,NH2.HCI Z., OR
s
RI z' O EtONa Hal z N SR
Halz -Hal' RI
P23 P2o
Schéma 7
10 étape i : l'acide est transformé en chlorure d'acide. On peut par exemple
utiliser le chlorure de
thionyle ou d'oxalyle (COCI)2 (cf. ex.3.1 ou 8.1). Dans le cas où Z=Z'=N, on
utilise pour obtenir
P'16 l'acide 2,4-dihydroxy-pyrimidine-5-carboxylique à la place de P'8 (voir
ex. 9.1) ;
étape ii : le chlorure d'acide réagit ensuite avec le monomalonate d'alkyle
CH2(CO2H)COOR6
qui au préalable aura été mis en présence n-BuLi pour donner un 3-céto-ester
P22 (cf. ex. 3.2 ou
15 8.2) ;
étape (iii) : le 3-céto-ester P22 est mis au contact d'une base telle que
K2CO3 et de CS2 dans un
solvant, par exemple le THF, puis on ajoute un iodure RI (cf. ex.3.3 ou 8.3)
pour obtenir P23;
étape (iv) : P20 est obtenu en faisant réagir P23 avec l'amine R1NH2 (base
libre ou chlorhydrate) en
présence d'une base, telle que par exemple NaHCO3 ou K2CO3 (cf. ex.3.4 ou
8.4). Cette étape
(iv) peut être conduite en une seule fois (cf. ex.3.4) soit en isolant un
composé intermédiaire (cf.
ex.8.4).
préparation de P7
0
Les composés P7 pour lesquels K et K' forment le groupe suivant: sont
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
16
commerciaux ou peuvent être préparés selon la réaction de couplage entre une
bromo-
aniline, éventuellement fluorée, et le bis(pinacolato)diboron qui est décrite
sur le schéma 2 en
page 150-151 de WO 2007/064931 ; par exemple, dans le cas des fluorés : 3-F (4-
amino-3-
fluorophénylboronic acid pinacol ester, CAS N 819058-34-9, société Boron
Molecular Inc, PO
Box 12592, Research Triangle Park, NC 27709) ; 2-F (4-amino-2-
fluorophénylboronic acid
pinacol ester, CAS N 819057-45-9, Boron Molecular, décrit en page 185 de WO
2007/064931) ; 2-F, 5-F (CAS N 939807-75-7, composé décrit en page 184 de WO
20071064931); 3-F, 5-F (CAS N 939968-08-8, décrit en page 182 de WO
2007/064931). Les
composés P7 fluorés pour lesquels K et K' représentent un atome d'hydrogène
peuvent être
préparés à partir de la bromo-aniline fluorée par les réactions décrites dans
Tetrahedron
Letters 2003, 44, 7719-7722.
préparation de l'amine R4RSNH ou RSNH
Les amines sont des produits commerciaux ou déjà décrits dans des documents
publiés ; par
exemple :
= 1-(2-aminoéthyl)pipéridine: CAS N 27578-60-5, décrit dans Justus Liebigs
Annalen der
Chemie 1950, 566, 210-44, commercialisé par ACROS ;
= 4-pipéridinol, 1-(2-aminoéthyl)-: CAS N 129999-60-6, décrit dans J.Med.Chem.
2005,
48(21), 6690-6695 ainsi qu'en page 17 de WO 2005/061453 (ref.ex.10) ;
= pyrrolidineéthanamine : CAS N 7154-73-6, décrit dans Anales de Quimica 1974,
70(9-10),
733-737, commercialisé par International Laboratory Ltd, 1067 Sneath Ln, San
Bruno,
CA94066, USA;
= 1-pipérazineéthanamine : CAS N 140-31-8, décrit dans EP 151232 ;
= 4-Morpholineethanamine : CAS N 2038-03-1, décrit dans Khimiya Prirodnykh
Soedinenii, (5),
707-12; 1989 ;
= 4,4-difluoro 1-pipéridineéthanamine : CAS N 605659-03-8, décrit en page 46
de US
2006058308;
= 4-pipéridineethanamine : CAS N 76025-62-2, décrit dans J.Org. Chem. 1961,
26, 3805-8 ;
= 2-furanméthanamine, tetrahydro- : CAS N 4795-29-3, décrit dans Ind.Alim. et
Agric. 1987,
104(1-2), 45-51 ;
= 2-amino-2-(hydroxyméthyl)propane-1,3-diol : CAS N 77-86-1, décrit dans EP
287419 (ex.1-3).
Une méthode générale d'obtention des amines est aussi décrite sur le Schéma 8
et s'inspire
du schéma 3 de Bioorg. Med. Chem. 2007, 15, 365-373 ou du schéma 2 de Bioorg.
Med.
Chem. Lett. 2008, 18, 1378-1381 :
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
17
o o
base
N (CI-C6)AIk-Br + NHReRf &N-(Cl-C6 )AIk NR0Rr
hydrazine
% O O
NH,-(C l-C6)Alk NR0Rf
Schéma 8
Une autre méthode générale décrite sur le Schéma 9 s'inspire de la figure 2 de
Bioorg. Med.
Chem. Lett. 2006, 16, 1938-1940:
base hydrogénation
NC-(Ci-C5)Alk-Br + NHReRf - NC-(Cl-C5)Alk-NReRf - NH2 (Ci-C6)Alk-NReRf
Schéma 9
composés P4
Ces produits sont soit commerciaux soit décrits dans des publications ou
demandes de brevet ;
par ex :
= 3-pyridineméthanamine : CAS N 3731-52-0, décrit dans Chem.-Eur.J. 2008,
14(31), 9491-
9494;
= 2-amino-5-aminométhylpyridine : CAS N 156973-09-0, décrit dans US 2005137395
(composé
117B, page 70) ;
= 3-(aminométhyl)aniline : CAS N 4403-70-7, produit commercial, décrit dans
Synthesis 2001, 1,
81-84 ;
= 3-pyridineéthanamine : CAS N 20173-24-4, décrit dans Chem. Ber. 1947, 80,
505-9 ;
= 5-thiazolemethanamine : CAS N 161805-76-1, produit commercial.
composés P- ou P6 (Ar-CH=CH-COOH ou Ar-CH2CH2-COOH)
Ces produits sont soit commerciaux soit décrits dans des publications ou
demandes de brevet,
par ex :
= acide 3-(3-pyridyl)-2-propénoïque : CAS N 1126-74-5, produit commercial
= acide 3-pyridinepropanoïque : CAS N 3724-19-4, décrit dans Chem. Ber. 1947,
80, 505-9 ;
= acide 3-(6-aminopyridin-3-yl)acrylique : CAS N 234098-57-8, décrit dans WO
00/32590
(ex.36) ;
= acide 6-amino-3-pyridinepropanoïque acid : CAS N 446263-96-3, décrit dans EP
1394159
(prépa.6, page 27) ;
= acide 3-(3-aminophényl)-2-propénoïque : CAS N 1664-56-8, produit commercial
;
= acide 3-aminobenzènepropanoïque : CAS 1664-54-6, produit commercial ;
= acide 3-(5-thiazolyl)-2-propénoïque: CAS N 355009-32-4, produit commercial
= acide 5-thiazolepropanoïque : CAS N 933724-95-9, disponible auprès de
CHEMSTEP, 20,
av.V.Hugo, 33560 France.
Dans les Schémas précédents, les composés de départ et les réactifs, quand
leur mode de
préparation n'est pas décrit, sont disponibles dans le commerce ou décrits
dans la littérature, ou
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
18
bien peuvent être préparés selon des méthodes qui y sont décrites ou qui sont
connues de
l'homme du métier. L'homme du métier pourra s'inspirer des conditions
opératoires données dans
les exemples qui sont décrits ci-après.
Dans les Schémas précédents, il peut être nécessaire d'utiliser à au moins une
des étapes un
groupe protecteur afin de protéger une fonction chimique (cf. par ex. Schéma
6'). Par exemple,
lorsque Rc et Rd représentent tous deux un atome d'hydrogène, la réaction du
Schéma 6' est
conduite avec le composé de formule H2N-(C,-C6)alkyle-NH-PG où PG désigne un
groupe
protecteur de la fonction amine (il s'agit avantageusement du groupe tert-
butyloxycarbonyle
BOC). La fonction -NH2 est ensuite obtenue par une étape de déprotection
permettant de passer
de -NH-PG à -NHZ, par exemple par un traitement en milieu acide. Ainsi, pour
le composé n 50,
on utilise le composé H2N-(CH2)6-NH-BOC.
Obtention des sels
Les sels sont obtenus par mise en contact de l'acide et du composé sous sa
forme base. Ils
peuvent aussi être obtenus lors d'une étape de déprotection en milieu acide.
Selon un 3ème aspect, l'invention concerne une composition pharmaceutique
comprenant un
composé tel que défini précédemment en combinaison avec un excipient
pharmaceutiquement
acceptable. L'excipient est choisi selon la forme pharmaceutique et le mode
d'administration
souhaité, parmi les excipients habituels qui sont connus de l'homme du métier.
Le mode
d'administration peut être la voie orale ou par intraveineuse.
Selon un 4ème aspect, l'invention a pour objet un médicament qui comprend un
composé tel que
défini précédemment ainsi que l'utilisation d'un composé tel que défini
précédemment, pour la
fabrication d'un médicament. Il peut être utile pour traiter un état
pathologique, en particulier le
cancer. Ce médicament peut trouver un emploi dans le traitement ou la
prévention des maladies
causées ou exacerbées par la prolifération des cellules et en particulier des
cellules tumorales.
Le médicament peut être administré en association avec un (ou plusieurs)
autre(s) anticancéreux, en
particulier choisi(s) parmi :
= les agents de chimiothérapie tels que les agents alkylants, les dérivés du
platine, les agents
antibiotiques, les agents antimicrotubules, les taxoïdes, les anthracyclines,
les inhibiteurs de
topoisomérases des groupes I et II, les fluoropyrimidines, les analogues de
cytidine, les
analogues d'adénosine, les enzymes, ainsi que les hormones oestrogéniques et
androgéniques ;
= les agents antivasculaires ;
= les agents anti-angiogéniques.
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
19
Il est également possible d'associer un traitement par des radiations. Ce
traitement peut être
administré simultanément, séparément ou bien séquentiellement. Le traitement
sera adapté par
le praticien en fonction du malade et de la tumeur à traiter.
Selon un 5eme aspect, l'invention concerne également une méthode de traitement
des
pathologies indiquées précédemment qui comprend l'administration, à un
patient, d'une dose
efficace d'un composé selon l'invention ou un de ses sels pharmaceutiquement
acceptables ou
hydrates ou solvats.
[Exemples]
Les exemples suivants illustrent la préparation de certains composés conformes
à l'invention. Les
numéros des composés exemplifiés renvoient à ceux donnés dans le tableau I ci-
après, qui
illustre les structures chimiques et les propriétés physiques de quelques
composés selon
l'invention.
conditions de spectrométrie de masse
conditions A à C : Les composés ont été analysés par couplage HPLC-UV-MS
(chromatographie
liquide, détection d'ultraviolet (UV) et détection de masse). L'appareil
utilisé est composé d'une
chaine chromatographique Agilent équipé d'un détecteur à barrette de diodes
Agilent et d'un
spectromètre de masse simple quadripôle ZQ Waters ou un spectromètre de masse
triple
quadripôle Quattro-MicroWaters. Les spectres de chromatographie phase
liquide/spectromètre de
masse (LC/MS) ont été enregistrés en mode électrospray (ESI) positif, afin
d'observer les ions
issus de la protonation de composés analysés (MH'), ou de la formation
d'adduits avec d'autres
cations tels que Na', K', etc... Les paramètres d'ionisation sont les suivants
:tension de cône: 20
V ; tension capillaire: 3 kV ; température source: 120 C ; température
désolvatation: 450 C ; gaz
désolvatation : N2 à 450 L/h.
conditions D : Les composés sont analysés par couplage HPLC-UV-MS
(chromatographie liquide
-détection UV et détection masse). L'appareil utilisé est composé d'une chaîne
chromatographique Gilson équipé d'un détecteur à barrette de diodes Agilent et
d'un spectromètre
de masse simple quadripôle Thermo Finnigan AQA. L'enregistrement des spectres
de masse est
effectué en mode électrospray (ESI) positif à une tension de cône de 20 kV,
afin d'observer les
ions issus de la protonation de composés analysés (MH+), ou de la formation
d'adduits avec
d'autres cations tels que Na+, K+, etc...
Les conditions de la LCMS sont choisies parmi l'une des méthodes suivantes :
Conditions A B C D
type de symétrie C18 symétrie C18 (50 x XTerra MS C18 Macherey-Nagel
colonne (50 x 2,1 mm ; 2,1 mm ; 3,5 Nm) (50 x 2,1 mm ; Nucleodur C18 (150 x
3,5 Pm) 3,5 Pm) 4,6 mm ; 5,0 Nm)
éluant A H2O + TFA H20+ TFA 0,005% AcONH4 10 mM à H2O + HCOOH 0,1% à
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
0,005% à à environ pH 3,1 pH-7 environ pH 2,0
environ pH 3,1
éluant B CH3CN +TFA CH3CN + TFA CH3CN CH3CN + HCOOH
0,005% 0,005% 0,1%
gradient 100:0 (0 min) à 100:0 (0 min) à 100:0 (0 min) à min (%B) : 0 (5%) ;
10:90 (10 min) à 10:90 (20 min) à 10:90 (10 min) à 11,5 (5%) ; 9,5 (95%) ;
100 :0 (15 min) 100:0 (30 min) 100:0 (20 min) 15,5 (95%) ; 16,3 (5%)
température 30 C 30 C 30 C 25 C
de colonne
débit 0,4 ml/min 0,4 ml/min 0,4 ml/min 1,0 ml/min
détection A = 220 nm A = 220 nm A = 220 nm A = 245-345 nm
longueur d'onde
lambda A
TFA: acide trifluoroacétique
LCMS (A) : tr=6,52 min signifie LCMS dans les conditions A avec temps de
rétention de 6,52 minutes
Exemplel : 2-Am ino-1-ethyl-4-oxo-7-[4-(3-pyrid in-3-ylmethyl-ureido)-phenyl]-
1,4-dihydro-
5 [1,8]naphthyridine-3-carboxylic acid methylamide (n 1)
1.1 :Acide 2-(aminoéthyl)-6-chloronicotinique
On agite à température ambiante pendant 72 heures une solution de 18,0 g (84,4
mmol) d'acide
2,6-dichloronicotinique dans 180 ml d'une solution d'éthylamine à 70% dans
l'eau. L'excès
d'amine est alors évaporé sous pression réduite, puis on additionne une
solution aqueuse d'acide
10 acétique à 10% jusqu'à la précipitation du produit. Le solide beige est
essoré, rincé avec de l'eau
froide et séché à l'étuve. On obtient 10,5 g du produit attendu. PF(point de
fusion)=158-160 C.
Rdt=62%
1.2 : Fluorure d'acide 2-(aminoéthyl)-6-chloronicotinique
15 A une suspension de 5,0 g (24,8 mmol) d'acide 2-(aminoéthyl)-6-
chloronicotinique dans 125 ml de
dichlorométhane, on ajoute 2 ml (24,8 mmol) de pyridine et 4,2 ml (49,8 mmol)
de fluorure
cyanurique. On agite le mélange pendant 3 h à température ambiante puis on
filtre. Le solide est
rincé avec 50 ml de dichlorométhane et le filtrat est lavé deux fois avec 60
ml d'eau glacée. On
sèche la phase organique sur Na2SO4 et on évapore le solvant sous pression
réduite. On obtient
20 5,01 g de produit sous forme d'huile orange. Rdt=99 %.
1.3 : N-méthylcyan acétamide
A une solution refroidie à -30 C de 10,0 g (116,38 mmol) d'acide cyanoacétique
à 99 % et 16,3 ml
(116,9 mmol) de triéthylamine dans 100 ml de THF anhydre, on ajoute goutte à
goutte 12,28 ml
(128,44 mmol) de chloroformate d'éthyle puis on agite à -30 C pendant 1 h et
demie. On
additionne ensuite goutte à goutte 300 ml de méthanol saturé en méthylamine
gazeuse puis on
agite à température ambiante pendant une nuit. On évapore les solvants sous
pression réduite et
on purifie le produit par chromatographie sur gel de silice en éluant par un
mélange
dichlorométhane:méthanol (95:5). On obtient 10,0 g de produit sous forme d'un
solide beige.
PF=99 C. Rdt=87 %
1.3 : N-méthvlcvanoacétamide (variante)
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
21
Dans une solution de 30,0 g (265,2 mmol) de cyanoacétate d'éthyle dans 220 mL
de THF on fait
passer durant 2 h un courant de méthylamine (gaz) en maintenant la température
inférieure à
25 C. On évaporer le THF et on obtient 25,86 g de solide blanc Rdt=99,4% ;
PF=100-102 C.
1.4 :2-amino-7-chloro-1-éthyl-N-méthyl-4-oxo-1,4-dihydro-1,8-naphthyridine-3-
carboxamide
A une solution refroidie à 0-5 C de 0,483 g (4,93 mmol) de N-méthylcyano-
acétamide dans 7 ml
de DMF anhydre, on ajoute par petites quantités 0,394 g (9,95 mmol) d'hydrure
de sodium à 60%
dans l'huile minérale. On poursuit l'agitation à cette température pendant dix
minutes puis on
additionne une solution de 1,0 g (4,93 mmol) de fluorure d'acide 2-
(aminoéthyl)-6-
chloronicotinique dans 5 ml de DMF. On agite le milieu pendant 1 nuit à
température ambiante
puis on rajoute par petites quantités 0,197 g (4,93 mmol) d'hydrure de sodium
à 60%. On poursuit
l'agitation à cette température pendant 10 minutes puis on additionne 0,56 ml
(9,78 mmol) d'acide
acétique. On ajoute ensuite 60 ml d'eau et on essore le solide que l'on rince
à l'eau puis sèche à
l'étuve. On obtient 1,30 g du produit attendu. PF=283-284 C. Rdt=94 %.
1.5 :1-Pyridinyl-3-ylméthyl-3-[4-(4,4,5,5-tetraméthyl-[1,3,21dioxaborolan-2-
yl)-phényll-urée
A un mélange de 15 g (68,47 mmol) de 4-(4,4,5,5-tetraméthyl-
[1,3,2]dioxaborolan-2-yl)-
phénylamine et de 12,19 g (41,08 mM) de triphosgène dans 1,5 L de THF,
refroidi par un bain
glace/eau, à une température comprise entre 0 C et 5 C, est introduit goutte à
goutte 57,2 ml
(410,8 mM) de triéthylamine. Après agitation pendant 1 h à une température
comprise entre 0 C
et 5 C, on ajoute au milieu réactionnel 8,29 g (76,68 mM) de 3-
(aminométhyl)pyridine. On agite le
milieu réactionnel pendant 20 h en laissant monter la température à
l'ambiante. Le THF est
évaporé. Le résidu est repris dans de l'eau puis extrait avec de l'acétate
d'éthyle. La phase
organique est ensuite séchée sur Na2SO4, filtrée et évaporée. Le résidu est
recristallisé dans un
minimum d'acétate d'éthyle. On obtient 13 g (rdt=53,8%) de solide blanc
composé de 89% de
composé attendu et 11% d'acide boronique correspondant (LC/MS (A); M+ 353 et
271 tr=6,25 et
3,65 min).
1.6 :2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-vlmethvl-ureido)-phenyll-1,4-
dihydro-
[1, 81naphthyridine-3-carboxvlic acid methylamide
Dans un tricol, on place 0,722 g (2,57 mmol) de composé obtenu à l'étape 1.4,
1,11 g (2,83
mmol) de composé obtenu à l'étape 1.5, 38 mL de DME, 7,5 mL d'éthanol et 17,7
mL de solution
saturée en NaHCO3. On dégaze avec de l'argon puis on ajoute 0,297 g (0,26
mmol) de
Pd(PPh3)4. On chauffe à 100 C pendant 2 h. Après retour à température
ambiante, on filtre et on
lave le précipité avec du DME et de l'eau. On sèche à l'étuve sur P2O5. On
obtient 0,896 g de
produit. Rdt = 74% LCMS(A) M=472 tr=5,74 min.
1.7 :2-Am ino-1-ethyl-4-oxo-7-[4-(3-pyrid in-3-vlmethvl-u reido)-phenyll-1,4-
dihydro[1,81naphthyridine-3-carboxvlic acid methylamide chlorhydrate
On dissout 0,790 g du composé obtenu à l'étape 1.6 dans du DMF et on ajoute
une solution
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
22
d'ether chlorhydrique, puis on évapore à sec. On reprend le résidu par du
méthanol et on filtre.
On sèche à l'étuve. On obtient 0,637 g du produit. Rdt=74,8% LCMS (A) M=472
tr=5,74 min
RMN 'H (DMSO-d6, 200 MHz) : 1,31 (t, 3) ; 2,8 (s, 3) ; 4,51 (d, 2) ; 4,59
(quad, 2) ; 7,26 (t, 1) ;
7,59 (d, 2) ; 7,88 (d, 1) ; 7,99 (dd, 1) ; 8,12 (d, 2) ; 8,46 (d, 2) ; 8,8 (d,
1) ; 8,85 (s, 1) ; 11,13 (s, 1)
; 11,69 (sl, 1).
IC50 (HCT116) = 0,2-0,5 nM.
Exemple 2 : 2-Amino-1-ethyl-4-oxo-7-[4-((E)-3-pyridin-3-yl-acryloylamino)-
phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid methylamide (n 7)
2.1 : (E)-3-Pyridin-3-vl-N-[4-(4,4,5,5-tetramethyl-[1,3,21dioxaborolan-2-yl)-
phenyll-acrylamide
On mélange 0,746 g (5 mmol) d'acide 3-(3-pyridyl)acrylique et 1,095 g (5 mmol)
de 4-(4,4,5,5-
tetraméthyl-[1,3,2]dioxaborolan-2-yl)-phénylamine en suspension dans 60 mL de
THF, et on
ajoute 0,7 mL de triéthylamine et 2,06 g (5 mmol) de BOP. On chauffe à reflux
pendant 18 h. On
évapore le THF et on reprend le résidu par de l'acétate d'éthyle. On lave la
phase organique avec
de l'eau et une solution saturée en NaCI. On sèche sur Na2SO4, on filtre et on
évapore. Le résidu
est purifié par chromatographie sur colonne de silice avec un mélange
CH2CI2:MeOH-95 :5. On
obtient 1,0 g de produit. Rdt=57% LCMS(A) M=351 ; tr=8,05 min.
2.2 :2-Amino-1-ethyl-4-oxo-7-[4-((E)-3-pyridin-3-yl-acryloylamino)-phenyll-1,4-
dihydro
[1, 81naphthyridine-3-carboxylic acid methylamide
On reprend les conditions du couplage de l'étape 1.6 en utilisant le composé
de l'étape 2.1
précédente et celui de l'étape 1.4, on obtient avec un rdt de 65,1% le composé
attendu LCMS (A)
M=469 tr=7,05 min RMN'H (DMSO-d6, 250 MHz) : 1,31 (t, 3) ; 2,79 (d, 3) ; 4,6
(quad, 2) ; 6,96
(d, 1) ; 7,46 (m, 1) ; 7,67 (d, 1) ; 7,8-7,98 (massif, 3) ; 8,05 (d, 1) ; 8,22
(d, 2) ; 8,49 (d, 1) ; 8,59
(d, 1) ; 8,84 (s, 1) ; 10,53 (s, 1) ; 11,12 (m, 1) ;11,73 (sl, 1). IC50
(HCT116) = 2 nM
Exemple 3: 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid ethyl ester (n 10)
3.1 : Chlorure d'acide 2,6-dichloronicotinique
A une suspension de 30,58 g (0,159 mol) d'acide 2,6-dichloronicotinique dans
200 ml de
chloroforme et 0,1 ml de DMF, on additionne goutte à goutte 58 ml (0,796 mol)
de chlorure de
thionyle, puis on chauffe à reflux pendant 17 heures. On laisse revenir à
température ambiante,
puis on évapore le solvant sous pression réduite. Le résidu obtenu est repris
dans du toluène et
évaporé à sec. On obtient 33,53 g d'un liquide ambre. Le rendement est
quantitatif.
3.2 : 3-(2,6-dichloro-3-pyridinyl)-3-oxopropanoate d'éthyle
A une solution refroidie de 41,3 g (0,313 mole) de mono-malonate d'éthyle dans
860 ml de THF
sous argon, on ajoute goutte à goutte 250 ml (0,625 mole) d'une solution de n-
butyllithium à 2,5 M
dans l'hexane. 10 minutes après la fin de l'addition, le milieu réactionnel
est refroidi à -50 C et on
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
23
additionne goutte à goutte une solution de 21,84 g (0,104 moles) de chlorure
d'acide 2,6-
dichloronicotinique dans 160 ml de THF. On laisse revenir à température
ambiante et on poursuit
l'agitation pendant 1 h. On ajoute ensuite 625 ml (0,625 mole) d'une solution
aqueuse d'acide
chlorhydrique à 1 N et on extrait plusieurs fois le produit avec de l'éther.
On sèche la phase
organique sur MgSO4 et on évapore le solvant sous pression réduite. On purifie
le produit par
chromatographie sur gel de silice en éluant par un mélange dichlorométhane : n-
heptane (9:1).
On obtient 23,65 g de produit sous forme d'huile. rdt = 87% LCMS(C) M=261
tr=8,04 min.
3.3 : 2-[(2,6-dichloro-3-pyridinyl)carbonyll-3,3-bis(méthylthio)acrylate
d'éthyle
A un mélange refroidi à -10 C sous argon de 10,25 g (39,11 mmol) du 3-céto-
ester (composé
obtenu à l'étape 3.2) et 16,21 g (117,29 mmol) de K2CO3 dans 78 ml de DMF, on
introduit goutte
à goutte une solution de 2,82 ml (46,9 mmol) de CS2 dans 0,5 ml de DMF. Après
deux minutes,
on ajoute rapidement une solution de 7,30 ml (117,28 mmol) d'iodure de méthyle
dans 4,5 ml de
DMF. On agite le milieu réactionnel pendant 2 h à 0-5 C puis on laisse
remonter la température à
l'ambiante pendant 1 heure. On évapore le solvant sous pression réduite et on
verse 250 ml d'eau
au résidu. Le produit est extrait plusieurs fois avec de l'acétate d'éthyle et
les phases organiques
combinées sont lavées à l'eau. On sèche la phase organique sur MgSO4 et on
évapore le solvant
sous pression réduite. On purifie le produit par chromatographie sur gel de
silice en éluant par le
dichlorométhane. On obtient 11,28 g de produit sous forme d'huile. rdt=79 %.
LCMS(A) M=365,
tr=9,70 min.
3.4 : 7-chloro-1-éthyl-2-(méthylthio)-4-oxo-1,4-dihvdro-1,8-naphthyridine-3-
carboxvlate d'éthyle
A une solution refroidie à 0-5 C de 11,12 g (30,36 mmol) du composé obtenu à
l'étape 3.3 dans
95 ml de dichlorométhane, on ajoute une solution de 2,59 g (31,76 mmol) de
chlorhydrate
d'éthylamine et 2,25 g (33,06 mmol) d'éthylate de sodium à 96 % dans 20 ml
d'éthanol absolu et
on agite pendant 22 h à température ordinaire. Le milieu réactionnel est
dégazé puis les solvants
sont évaporés sous pression réduite. Le résidu obtenu est repris dans 100 ml
de DMF puis on
ajoute 3,06 g (36,40 mmol) de NaHCO3 et on chauffe le mélange à 80 C pendant 5
h. On
évapore le solvant sous pression réduite et on reprend le résidu dans du
dichlorométhane. La
solution est ensuite lavée deux fois à l'eau puis avec une solution aqueuse
saturée en chlorure de
sodium. On sèche la phase organique sur Na2SO4 et on évapore le solvant sous
pression réduite.
On purifie le produit par chromatographie sur gel de silice en éluant par un
mélange de
n-heptane: acétate d'éthyle (2:1, puis 3:2). On obtient 7,09 g de produit sous
forme de miel jaune
pâle. rdt=72%. LCMS(A) M=326 tr=8,77 min
3.5 : 2-amino-7-chloro-1-éthyl-4-oxo-1,4-dihvdro-1,8-naphthyridine-3-
carboxvlate d'éthyle
A une solution de 1,86 g (5,69 mmol) du composé obtenu à l'issue de l'étape
3.4 dans 27 ml
d'acétonitrile, on ajoute 8 ml (56,9 mmol) d'une solution d'ammoniaque
concentré. Le récipient est
fermé de façon hermétique et le milieu réactionnel est agité à température
ambiante pendant 72
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
24
h. On évapore les solvants sous pression réduite et le résidu obtenu est
coévaporé deux fois avec
du toluène. Le résidu est repris dans 20 ml d'éther diéthylique glacé, le
mélange agité, puis le
solide obtenu est essoré et rincé avec de l'éther froid et séché sous vide. On
obtient 1,30 g de
solide blanc cassé. PF=252 C. rdt=77%.
3.6 : 2-Am ino-1-ethyl-4-oxo-7-f4-(3-pyrid in-3-vlmethvl-ureido)-phenyll-1,4-
dihydro-
f1,81naphthyridine-3-carboxvlic acid ethyl ester
Dans un tricol, on place 2,3 g (7,78 mmol) de composé obtenu à l'étape 3.5,
3,02 g (8,56 mmol)
de 1-Pyridinyl-3-ylméthyl-3-[4-(4,4,5,5-tetraméthyl-[1,3,2]dioxaborolan-2-yl)-
phényl]-urée dans
120 mL de DME, 24 mL éthanol et 55 mL solution saturée NaHCO3. On dégaze à
l'argon puis on
ajoute 0,899 g (0,78 mmol) de Pd(PPh3)4. On chauffe à 110 C pendant 3 h. Après
retour à
l'ambiante, on dilue avec de l'eau et on filtre, on lave le précipité avec de
l'eau et acétate
d'éthyle. On sèche sous vide sur P205 et on recristallise dans i-PrOH. On
obtient 3,64 g.
Rdt=96%. LCMS(A) : M=486 tr=5,68 min RMN'H (DMSO-d6 250 MHz) : 1,18-1,36
(massif, 6) ;
4,2 (quad, 2) ; 4,33 (d, 2) ; 4,57 (quad, 2) ; 6,82 (t, 1) ; 7,4 (dd, 1); 7,58
(d, 2) ; 7,72 (d, 1) ; 7,85
(d, 1) ; 8,1 (d, 2) ; 8,37 (d, 1) ; 8,45 (d, 1) ; 8,54 (s, 1) ; 8,69 (s, 2) ;
8,93 (s, 1). IC50 (HCT116) < 1
nM
Exemple 4 : 1-Ethyl-2-[2-(4-methyl-piperazin-1-yl)-ethylamino]-4-oxo-7-[4-(3-
pyridin-3-ylmethyl-
ureido)-phenyl]-1,4-dihydro-[1,8]naphthyridine-3-carboxylic acid [2-(4-methyl-
piperazin-1-yl)-
ethyl]-amide (n 46)
4.1 : 7-(4-Amino-phenyl)-1-ethyl-2-methylsulfanyl-4-oxo-1,4-dihvdro-f 1,
81naphthyridine-3-
carboxvlic acid ethyl ester
Dans un tricol, on place 6,24 g (19,09 mmol) du composé obtenu étape 3.4, 4,6
g (21 mmol) de 4-
(4,4,5,5-tetraméthyl-[1,3,2]dioxaborolan-2-yl)-phénylamine, 280 mL de DME, 50
mL d'éthanol et
130 mL de solution saturée en NaHCO3. On dégaze à l'argon et on ajoute 2,20 g
(1,91 mmol) de
Pd(PPh3)4. On chauffe à 100 C pendant 2 heures. On évaporer les solvants et on
reprend le
résidu par de l'eau et on filtre, on lave le precipité avec de l'eau, on sèche
sous vide sur P205. On
purifie par chromatographie sur silice avec un mélange CH2CI2-MeOH : 95-5. On
obtient 4,7 g de
produit. Rdt=64,2% LCMS(A) M=383 tr=8,51 min.
4.2 :7-(4-Amino-phenyl)-1-ethyl-2-f2-(4-methvl-piperazin-1-yl)-ethylamino]-4-
oxo-1,4-dihydro-
f 1, 81naphthyridine-3-carboxvlic acid f2-(4-methvl-piperazin-1-yl)-ethvll-
amide
Dans un ballon à vis, on place 0,575 g (1,5 mmol) de composé obtenu à l'étape
4.1 et 1,8 mL (18
mmol) de 2-(4-methyl-piperazin-1-yl)-ethylamine. On ferme hermétiquement et on
chauffe à
120 C pendant 18 h. On chromatographie le résidu sur silice avec un mélange
CH2CI2-MeOH-
NH4OH : 100-10-1. On obtient 0,685 g de produit. rdt= 79,4% LCMS(B) M=575
tr=6,36 min.
4.3 :1-Ethyl-2-F2-(4-methvl-piperazin-1-yl)-ethylamino]-4-oxo-7-f4-(3-pyrid in-
3-vlmethvl-ureido)-
phenyll-1,4-dihvdro-F1,81naphthyridine-3-carboxvlic acid f2-(4-methvl-
piperazin-1-yl)-ethvll-amide
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
0,657 g (1,14 mmol) de composé obtenu à étape 4.2 est mis en suspension dans
40 mL de THF.
On ajoute 0,38 mL (2,74 mmol) de triéthylamine, 0,167 g (1,37 mmol) de DMAP et
0,351 g (1,37
mmol) de DSC. On agite à l'ambiante pendant 18 h. On ajoute 0,148 g (1,37
mmol) de (3-
aminomethyl)pyridine et on poursuit l'agitation pendant 20 heures. On évapore
et purifie le résidu
5 par chromatographie sur silice avec un mélange CH2CI2-MeOH-NH4OH : 80-20-1.
On obtient une
huile qui concrétise par addition i-Pr20. On filtre et on sèche sous vide. On
obtient 360 mg
rdt=44,4% LCMS(A) M=709 tr =4,86 min RMN'H (DMSO-d6 400 MHz) : 1,38 (t, 3) ;
2,07 (s, 3) ;
2,16 (s, 3) ; 2,13-2,57 (massif, 20) ; 3,93 (quad, 2) ; 3,52 (quad, 2) ; 4,35
(d, 2) ; 4,56 (quad, 2) ;
6,86 (t, 1) ; 7,37 (dd, 1) ; 7,6 (d, 2) ; 7,73 (d, 1) ; 7,92 (d, 1) ; 8,14 (d,
2) ; 8,46 (d, 2) ; 8,55 (s, 1) ;
10 8,99 (s, 1) ; 11,14 (t, 1) ; 11,37 (t, 1). IC50 (HCT116) = 1,9 nM
Exemple 5: 2-Am ino-1 -ethyl-4-oxo-7-[4-(3-pyrid in-3-ylmethyl-ureido)-phenyl]-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (n 13)
On porte à reflux pendant 20 heures 1,338 g (2,75 mmol) de : 2-Amino-1-ethyl-4-
oxo-7-[4-(3-
15 pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-[1,8]naphthyridine-3-
carboxylicacid ethyl ester et
0,33 g (8,25 mmol) de soude dans 60 mL de dioxane + 6 mL d'eau et 28 mL
d'éthanol. Après
retour à l'ambiante, on filtre et on évapore le filtrat. On reprend le résidu
par de l'eau et on ajouter
une solution HCI 1 N jusqu'à dissolution ; on ajuste le pH à 6-7 par addition
de soude et on filtre le
précipité. On sèche sous vide sur P205. On reprend le précipité par 35 mL MeOH
à chaud, on
20 laisser revenir à l'ambiante et on filtre, puis on répète la même opération
avec 25 mL MeOH. On
obtient 0,460 g rdt=36,5% LCMS(A) M=458 tr=5,82 min. RMN'H (DMSO-d6 250 MHz) :
1,32 (t,
3) ; 4,34 (d, 2) ; 4,62 (quad, 2) ; 6,83 (t, 1) ; 7,36 (m, 1) ; 7.6 (d, 2) ;
7,72 (d, 1) ; 7,98 (d, 1) ; 8,15
(d, 2) ; 8,4-8,69 (massif, 4) ; 8,98 (s, 1) ; 10,41 (sl, 1). IC50 (HCT116) = 6
nM
25 Exemple 6: 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-morpholin-4-yl-ethyl)-amide (n 30)
6.1:2-Amino-7-(4-amino-phenyl)-1-ethyl-4-oxo-1,4-dihvdro-f 1, 81naphthyridine-
3-carboxvlic acid
ethyl ester
Dans un tube à vis, on place 1,3 g (3,39 mmol) de composé de l'étape 4.1, 20
mL d'acétonitrile et
0,385 g (6,78 mmol) d'une solution d'ammoniaque à 30%. On ferme hermétiquement
et on
chauffe à 85 C pendant 48 h. Après retour à l'ambiante, on évapore et on
reprend le résidu par
eau et on filtre et on sèche sous vide sur P205. On purifie par chromatoflash
avec un gradient 0-
10% MeOH dans CHZCIZ. On obtient 0,5 g de produit. rdt=41,8% LCMS(A) M=352
tr=6,62 min.
6.2 : 2-Amino-7-(4-amino-phenyl)-1-ethyl-4-oxo-1,4-dihvdro-f 1,
81naphthyridine-3-carboxvlic acid
(2-morpholin-4-yl-ethyl)-amide
Dans un tube à vis, on place 0,5 g (1,42 mmol) du composé de l'étape 6.1 et
3,72 mL (3,7 mmol)
de 2-morpholino-éthylamine ; on ferme hermétiquement et on chauffe à 125 C
pendant 20 h.
Après retour à l'ambiante, on reprend par CHZCIZ et on lave à l'eau et avec
une solution NaCI
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
26
saturée. On sèche sur Na2SO4, on filtre et on évapore. On purifie par
chromatoflash avec un
gradient 0-10% MeOH dans CHZCIZ. On obtient 0,530 g de produit. rdt = 85,6%
LCMS(A) M=436
tr=5,44 min.
6.3 :2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyll-1,4-
dihydro-
[1,81naphthyridine-3-carboxylic acid (2-morpholin-4-yl-ethyl)-amide
On dissout 0,530 g (1,21 mmol) du composé de l'étape 6.2 dans 50 mL de THF. On
ajoute 0,178
g (1,46 mmol) de DMAP puis 0,373 g (1,46 mmol) de DSC et on agite à l'ambiante
pendant 18
heures. On ajoute 0,41 mL (2,91 mmol) de triéthylamine et 0,158 g (1,46 mmol)
de (3-
aminométhyl)pyridine. On agite à l'ambiante pendant 24 h. On évapore, on
reprend le résidu par
un mélange eau- CHZCIZ. On filtre le précipité et on le sèche sous vide sur
P205, puis on purifie
par chromatoflash gradient 0-10% MeOH dans CHZCIZ. On obtient 0,080 g de
produit. rdt=11,5%
PF=245 C LCMS(A) M=570 tr=5,13 min. RMN 'H (DMSO-d6 250MHz) : 1,27 (t, 3) ;
2,29 - 2,41
(massif, 4) ; 3,36 (quad, 2) ; 3,48-3,62 (massif, 4) ; 4,31 (d, 2) ; 4,48
(quad, 2) ; 6,79 (t, 1) ; 7,33
(dd, 1) ; 7,55 (d, 2) ; 7,69 (d, 1) ; 7,85 (d, 1) ; 8,09 (d, 2) ; 8,4-8,47
(massif, 2) ; 8,51 (s, 1) ; 8,9 (s,
1) ; 11,29 (t, 1) ; 11,66 (sl, 1). IC50 (HCT1 16) = 0,1 nM
Exemple 7: 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-
1,4-dihydro-
quinoline-3-carboxylic acid amide (n 57)
o
OII
Jc:
Br 0
7.1 : 7-Bromo-1 H-benzo[dl[1,31oxazine-2,4-dione H
Dans un ballon de 250 mL, sous atmosphère d'azote, on dissout 5,0 g (23,1
mmol) d'acide 2-
amino-4-bromo benzoïque dans 50 mL de dioxane anhydre. La température du
mélange est
abaissée à 0 C à l'aide d'un bain de glace. On ajoute goutte à goutte 2,3 g
(7,6 mmol) de
triphosgène. Le bain de glace est remplacé par un bain d'huile et le mélange
est chauffé 16 h à
reflux. Après retour à température ambiante, on rajoute de l'eau (100 ml-) et
on filtre le précipité
formé, on le lave avec de Et20 (3x25 ml-) puis on le sèche dans une étuve afin
d'obtenir 5,6 g
(23,1 mmol) du composé sous la forme d'une poudre beige. Rdt=100%. RMN 'H DMSO
d6 (300
MHz) 7,29 (d, J=1,8 Hz, 1H) ; 7,41 (dd, J=8,4 Hz, J=1,8 Hz, 1 H) ; 7,82 (d,
J=8,4 Hz, 1 H) ; 11,81
(bs, 1 H).
0
0
Br' N O
7.2 :7-Bromo-1-ethyl-benzo[dl[1,31oxazine-2,4-dione
Dans un ballon de 250 mL, sous atmosphère d'azote, on met en suspension 1,0 g
(25,5 mmol) de
NaH à 60% dans 60 mL de DMF anhydre. La température du mélange est abaissée à
0 C à l'aide
d'un bain de glace. On ajoute goutte à goutte 5,6 g (23,1 mmol) du composé de
l'étape 7.1 puis
on agite le mélange 3 heures à température ambiante. On ajoute goutte à goutte
2 mL (25,5
mmol) d'iodoéthane puis on agiter le mélange 16 h à température ambiante. On
verse le mélange
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
27
sur de l'eau glacée (100 ml-) et on filtre le précipité formé. On le lave avec
de l'eau (3x25 ml-)
puis on le sèche dans une étuve afin d'obtenir 5,9 g de produit (21,8 mmol)
sous la forme d'une
poudre blanc cassé. Rdt=95%. RMN 'H DMSO d6 (300 MHz) 1,20 (t, J=7,1 Hz, 3H) ;
4,06 (q,
J=7,1 Hz, 2H) ; 7,50 (dd, J=8,4 Hz, J=1,5 Hz, 1 H) ; 7,75 (d, J=1,5 Hz, 1 H) ;
7,90 (d, J=8,4 Hz,
1 H).
7.3 : 2-Am ino-7-bromo-1-ethyl-4-oxo-1,4-dihvdro-quinoline-3-carboxvlic acid
amide
0 0
NHZ
Br N NHZ
Dans un ballon de 100 mL, sous atmosphère d'azote, on met en suspension 650 mg
(16,3 mmol)
de NaH à 60% dans 10 mL de DMF anhydre. La température du mélange est abaissée
à 0 C à
l'aide d'un bain de glace. On ajoute goutte à goutte une solution de 685 mg
(8,1 mmol) de
cyanoacétamide dilué dans 10 mL de DMF puis on agite le mélange 4 heures à
température
ambiante. La température du mélange est abaissée à 0 C à l'aide d'un bain de
glace. On ajoute
goutte à goutte une solution de 2,0 g (7,4 mmol) du composé de l'étape 7.2
dissout dans 10 mL
de DMF puis on agite le mélange 16 h à température ambiante. On verse le
milieu réactionnel sur
une solution aqueuse d'HCI 1N à 0 C (100 ml-) et on filtre le précipité formé.
On le sèche dans
une étuve afin d'obtenir 1,8 g (5,8 mmol) de produit sous la forme d'une
poudre jaune. Rdt=79%.
RMN 'H DMSO d6 (300 MHz) 1,14 (t, J=7,0 Hz, 3H) ; 3,12 (q, J=7,0 Hz, 2H) ;
6,74 (d, J=8,2 Hz,
1 H) ; 6,81 (s, 1 H) ; 7,28 (d, J=8,2 Hz, 1 H).
7.4: 2-Amino-7-(4-amino-phenyl)-1-ethyl-4-oxo-1,4-dihvdro-quinoline-3-
carboxvlic acid amide
0 0
NHZ
N NHZ
H2N /-J
Dans un ballon de 50 mL, on dissout 750 mg (2,4 mmol) de l'étape 7.3 dans 20
mL de THF. On
ajoute 530 mg (2,4 mmol) d'ester p-aniline boronique suivi de 3 mL (6,0 mmol)
d'une solution
aqueuse de Na2CO3 2M. On dégaze le mélange à l'aide d'un courant d'azote puis
on ajoute 280
mg (0,2 mmol) de Pd(PPh3)4 et chauffer le mélange 16 h à reflux. Après retour
à température
ambiante, le mélange est filtré sur papier filtre et les solvants sont
évaporés sous pression
réduite. Le résidu est purifié par flash chromatographie sur colonne de silice
(40-63 pm) (éluent:
EtOAc). Les fractions pures sont collectées puis le solvant est évaporé sous
pression réduite afin
d'obtenir 100 mg (0,3 mmol) de produit sous la forme d'une poudre brune.
Rdt=13%. RMN 'H
DMSO d6 (300 MHz) 1,31 (t, J=6,9 Hz, 3H) ; 4,29 (q, J=6,9 Hz, 2H) ; 5,39 (s,
2H) ; 6,69 (d, J=8,4
Hz, 2H) ; 7,15 (d, J=5,5 Hz, 1H) ; 7,45-7,60 (m, 5H) ; 8,18 (d, J=8,4 Hz, 1H)
; 10,70 (d, J=5,5 Hz,
1 H).
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
28
OI Z NOZ
H
7.5 : Pyridin-3-ylmethyl-carbamic acid 4-nitro-phenyl ester N
Dans un ballon de 100 mL, sous atmosphère d'azote, on dilue 1,9 mL (18,5 mmol)
de pyridin-3-yl
methylamine et 2,6 mL (18,5 mmol) de triéthylamine dans 20 mL de diéthyl éther
anhydre. Une
solution de 3,7 g (18,5 mmol) de 4-nitrophenyl chloroformate dissout dans 30
mL d'Et20 anhydre
est ajoutée goutte à goutte. Après 30 mn de réaction, un précipité apparaît.
Le mélange est
hydrolysé avec 50 mL d'eau puis extrait avec 3x20 mL d'Et20. Les phases
organiques sont
réunies puis lavées avec 50 mL d'une solution aqueuse saturée en NaCI. Après
séparation, la
phase organique est séchée sur MgSO4, filtrée et le solvant est évaporé sous
pression réduite. Le
résidu est purifié par flash chromatographie sur colonne de silice (40-63 pm)
(éluent:
CH2CI2/MeOH, 95-5). Les fractions pures sont collectées puis le solvant est
évaporé sous
pression réduite afin d'obtenir 1,1 g (4,0 mmol) du composé sous la forme
d'une poudre blanche.
Rdt= 22%. RMN 'H DMSO d6 (300 MHz) : 4,32 (d, J=5,9 Hz, 2H) ; 7,30-7,45 (m,
3H) ; 7,73 (d,
J=7,8 Hz, 1 H) ; 8,24 (d, J=9,1 Hz, 2H) ; 8,48 (d, J=4,7 Hz, 1 H) ; 8,54 (s, 1
H) ; 8,62 (t, J=5,9 Hz,
1 H).
7.6 :2-Amino-1-ethyl-4-oxo-7-[4-(pyridin-3-vlmethvl-ureido)-phenyll-1,4-
dihydro-quinoline-3-
o o
NH,
O N NH,
N~N Z J
carboxylic acid amide N
Dans un ballon de 25 mL, sous atmosphère d'azote, on dissout 85 mg (0,3 mmol)
du composé de
l'étape 7.5 dans 10 mL d'éthanol absolu. On ajoute 100 mg (0,3 mmol) du
composé de l'étape 7.4
et on chauffe le mélange 16 heures à reflux. Le solvant est évaporé sous
pression réduite. Le
résidu est purifié par flash chromatographie sur colonne de silice (40-63 pm)
(éluent:
AcOEt/MeOH, 85-15). Les fractions pures sont collectées puis le solvant est
évaporé sous
pression réduite afin d'obtenir 25 mg (0,05 mmol) du produit sous la forme
d'une poudre orange
pâle. Rdt=18%; PF=242 C. RMN 'H DMSO-d6 (300 MHz) 1,32 (t, J=6,6 Hz, 3H) ;
4,34 (m, 4H) ;
6,85 (t, J=5,2 Hz, 1 H) ; 7,19 (d, J=5,2 Hz, 1 H) ; 7,33-7,40 (dd, J=7,7 Hz,
J=4,8 Hz, 1 H) ; 7,54-7,58
(m, 3H) ; 7,68-7,74 (m, 4H) ; 8,23 (d, J=8,3 Hz, 1H) ; 8,46 (dd, J=4,8 Hz,
J=1,4 Hz, 1H) ; 8,54 (d,
J=1,8 Hz, 1 H) ; 8,91 (s, 1 H) ; 10,68 (d, J=5,0 Hz, 1H). IC50 (HCT116) = 0,26
nM.
Exemple 8: chlorhydrate du 1-Ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-2-(2-
pyrrol idin-1-yl-ethylamino)-1,4-dihydro-quinoline-3-carboxylic acid (2-
pyrrolidin-1-yl-ethyl)-amide
(n 61)
O
c1
8.1 : 4-Bromo-2-fluoro-benzoyl chloride Br F
Dans un ballon de 500 mL, sous atmosphère d'azote, on dissout 20,0 g (91,3
mmol) d'acide 2-
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
29
fluoro-4-bromo benzoïque dans 250 mL de dichlorométhane anhydre. On ajoute
goutte à goutte
10,7 mL (123,3 mmol) de chlorure d'oxalyle suivi de l'ajout de DMF goutte à
goutte jusqu'à
évolution gazeuse. La solution est agitée 4 h à température ambiante, puis les
solvants sont
évaporés sous pression réduite afin d'obtenir 21,7 g (91,3 mmol) de produit
brut sous la forme
d'une huile jaune utilisée directement pour l'étape suivante.
O O
j o
8.2 : 3-(4-Bromo-2-fluoro-phenyl)-3-oxo-propionic acid ethyl ester Br F
Dans un ballon de 500 mL, sous atmosphère d'azote, on dissout 26,5 g (200,9
mmol) de mono-
éthylmalonate dans 100 mL de THF anhydre. La température du mélange est
abaissée à 0 C à
l'aide d'un bain de glace puis 161 mL d'une solution de n-BuLi 2,5N dans le
THF est ajoutée
goutte à goutte. A la fin de l'addition, la température du mélange est
abaissée à -50 C à l'aide
d'un bain de carboglace dans l'acétone. Une solution de 21,7 g (91,3 mmol) du
composé 8.1
dissous dans 100 mL de THF anhydre est ajoutée goutte à goutte. Le mélange est
agité 16 h à
température ambiante. Le mélange est hydrolysé avec une solution aqueuse d'HCI
1N (250 ml-)
et extrait à l'acétate d'éthyle (4x100 mL). Les phases organiques sont réunies
puis lavées avec
150 mL d'une solution aqueuse saturée en NaCI. Après séparation, la phase
organique est
séchée sur MgSO4, filtrée et le solvant est évaporé sous pression réduite. Le
résidu est purifié par
flash chromatographie sur colonne de silice (40-63 pm) (éluent:
cyclohexane/AcOEt, 95-5). Les
fractions pures sont collectées puis le solvant est évaporé sous pression
réduite afin d'obtenir
22,7 g (78,5 mmol) de produit sous la forme d'une huile incolore. Ce produit
est un mélange entre
les formes cétone et énol (6/4) du produit. Rdt=86% RMN'H CDCI3 (300 MHz) :
1,24 (t, J=7,1 Hz,
3Hénol) ; 1,38 (t, J=7,1 Hz, 3Hcétone) ; 3,94 (d, J=3,6 Hz, 2Hcétone) ; 4,20
(q, J=7.1 Hz,
2Hénol) ; 4,37 (q, J=7,1 Hz, 2Hcétone) ; 5,81 (s, 1Hénol) ; 7,25-7,45 (m,
2Hénol, 2Hcétone) ;
O O OH O
O \ O
7,70-7,85 (m, 1 Hénol, 1 Hcétone) ; 12,67 (s, 1 Hénol). Br - F Br - F
-s O
s O
O
8.3 : 2-(4-Bromo-2-fluoro-benzoyl)-3,3-bis-methylsulfanyl-acrylic acid ethyl
ester Br F
Dans un ballon de 250 mL, sous atmosphère d'azote, on dissout goutte à goutte
17,7 g (61,2
mmol) de composé de l'étape 8.2 dans 125 mL de DMF anhydre. On ajoute 25.4 g
(183.6 mmol)
de K2CO3 et on agite 15 min à température ambiante. La température du mélange
est abaissée à
0 C à l'aide d'un bain de glace. On ajoute goutte à goutte une solution de 4,5
mL (73,4 mmol) de
CS2 dilué dans 10 mL de DMF puis on agite le mélange 15 mn à 0 C avant
d'ajouter rapidement
11,5 mL (183,6 mmol) d'iodure de méthyle. On agite le mélange en le laissant
revenir à
température ambiante et on poursuit l'agitation 2 h. Le solvant est évaporé
sous pression réduite,
le résidu est purifié par flash chromatographie sur colonne de silice (40-63
pm) (éluent:
Cyclohexane/AcOEt, 90-10). Les fractions pures sont collectées puis le solvant
est évaporé sous
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
pression réduite afin d'obtenir 7,5 g (19,6 mmol) d'un produit sous la forme
d'une poudre beige.
Rdt=32%. RMN 'H CDCI3 (300 MHz) 1,12 (t, J=7,1 Hz, 3H) ; 2,37 (bs, 6H) ; 4,15
(q, J=7,1 Hz,
2H) ; 7,30 (dd, J=8,4 Hz, J=1,6 Hz, 1 H) ; 7,39 (dd, J=8,4 Hz, J=1,6 Hz, 1 H)
; 7,79 (t, J=8,2 Hz,
1 H).
5
8.4:2-(4-Bromo-2-fluoro-benzoyl)-3-ethylamino-3-methvlsulfanvl-acrylic acid
ethyl ester
~--NH O
S O
co
-Br F
Dans un ballon de 250 mL, on dissout 7,5 g (19,1 mmol) de composé de l'étape
8.3 dans 100 mL
de THF. La température du mélange est abaissée à 0 C à l'aide d'un bain de
glace. On ajoute en
10 une seule fois 10 mL (20,0 mmol) d'éthylamine 2 M dans le THF. On agite le
mélange à
température ambiante pendant 24 h. Le solvant est évaporé sous pression
réduite, le résidu est
purifié par flash chromatographie sur colonne de silice (40-63 pm) (éluent:
cyclohexane/AcOEt, 1-
1). Les fractions pures sont collectées puis le solvant est évaporé sous
pression réduite afin
d'obtenir 3,1 g (10,5 mmol) de composé sous la forme d'une poudre blanche.
Rdt=55% RMN 'H
15 CDCI3 (300 MHz) 0,90 (t, J=7,1 Hz, 3H) ; 1,34 (t, J=7,2 Hz, 3H) ; 2,44 (s,
3H) ; 3,63 (q, J=7,1 Hz,
2H) ; 3,91 (q, J=7,2 Hz, 2H) ; 7,15-7,30 (m, 3H) ; 11,71 (bs, 1H).
8.5 : 7-Bromo-1-ethyl-2-methvlsulfanvl-4-oxo-1,4-dihvdro-quinoline-3-
carboxvlic acid ethyl ester
O O
Br ~ N S o--
20 Dans un ballon de 100 mL, sous atmosphère d'azote, on dissout 3,1 g (7,8
mmol) de composé de
l'étape 8.4 dans 20 mL de DMF anhydre. On ajoute en une portion 1,3 g (9,4
mmol) de K2CO3
puis on agite 16 h à 70 C. Le mélange est dilué avec 100 mL d'eau puis extrait
avec 3x50 mL
d'AcOEt. Les phases organiques sont réunies puis lavées avec 50 mL d'une
solution aqueuse
saturée en NaCI. Après séparation, la phase organique est séchée sur MgSO4,
filtrée et le solvant
25 est évaporé sous pression réduite. Le résidu est purifié par flash
chromatographie sur colonne de
silice (40-63 pm) (éluent: cyclohexane/AcOEt, 1-1). Les fractions pures sont
collectées puis le
solvant est évaporé sous pression réduite afin d'obtenir 2,7 g (7,2 mmol) de
composé sous la
forme d'une poudre blanche. Rdt=92% RMN 'H CDCI3 (300 MHz) 1,40 (t, J=7,1 Hz,
3H) ; 1,47 (t,
J=7,1 Hz, 3H) ; 2,57 (s, 3H) ; 4,43 (q, J=7,1 Hz, 2H) ; 4,65 (q, J=7,1 Hz, 2H)
; 7,48 (dd, J=8,6 Hz,
30 J=1,6 Hz, 1 H) ; 7,72 (d, J=1,6 Hz, 1 H) ; 8,28 (d, J=8,6 Hz, 1 H).
8.6 : 7-(4-Amino-phenyl)-1-ethyl-2-methvlsulfanvl-4-oxo-1,4-dihvdro-quinoline-
3-carboxvlic acid
O O
N g
ethyl ester H2N ZC
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
31
Dans un ballon de 250 mL, on dissout 2,7 g (7,2 mmol) de composé de l'étape
8.5 dans 100 mL
de THF. On ajoute 530 mg (7,9 mmol) d'ester p-aniline boronique suivi de 9 mL
(18,0 mmol)
d'une solution aqueuse de Na2CO3 2M. On dégaze le mélange à l'aide d'un
courant d'azote puis
on ajoute 840 mg (0,7 mmol) de Pd(PPh3)4 et on chauffe le mélange 16 h à
reflux. Après retour à
température ambiante, le mélange est filtré sur papier filtre et les solvants
sont évaporés sous
pression réduite. Le résidu est repris dans 100 mL d'eau puis extrait avec
3x50 mL d'AcOEt. Les
phases organiques sont réunies puis lavées avec 50 mL d'une solution aqueuse
saturée en NaCI.
Après séparation, la phase organique est séchée sur MgSO4, filtrée et le
solvant est évaporé sous
pression réduite. Le résidu est purifié par flash chromatographie sur colonne
de silice (40-63 pm)
(éluent: EtOAc). Les fractions pures sont collectées puis le solvant est
évaporé sous pression
réduite afin d'obtenir 1,1 g (2,9 mmol) de composé sous la forme d'une poudre
jaune. Rdt=40%
RMN'H CDCI3 (300 MHz) 1,40 (t, J=6,8 Hz, 3H) ; 1,48 (t, J=6,8 Hz, 3H) ; 2,57
(s, 3H) ; 4,43 (q,
J=6,8 Hz, 2H) ; 4,74 (q, J=6,8 Hz, 2H) ; 6,87 (d, J=8,5 Hz, 2H) ; 7,46 (d,
J=8,5 Hz, 2H) ; 7,53 (d,
J=8,4 Hz, 1 H) ; 7,61 (s, 1 H) ; 8,42 (d, J=8,4 Hz, 1 H).
8.7 : 7-(4-Amino-phenyl)-1-ethyl-4-oxo-2-(2-pyrrolidin-1-yl-ethvlamino)-1,4-
dihydro-quinoline-3-
0 0
N
I H
J N N~
carboxylic acid (2-pyrrolidin-1-yl-ethyl)-amide "2N
Dans un tube scellé de 5 mL, on mélange 270 mg (0,7 mmol) de composé de
l'étape 8.6 dans 2
mL de 1-(2-aminoéthyl)-pyrrolidine. On agite le mélange 16 h à 135 C. Après
retour à
température ambiante, on évapore l'excès d'amine sous pression réduite puis le
résidu est purifié
par flash chromatographie sur colonne de silice (40-63 pm) (éluent:
EtOAc/MeOH/TEA : 87-10-3).
Les fractions pures sont collectées puis le solvant est évaporé sous pression
réduite afin d'obtenir
260 mg (0,5 mmol) de composé sous la forme d'une huile incolore. Rdt=72% RMN
1H CDCI3 (300
MHz) 1,24 (t, J=6,8 Hz, 3H) ; 1,76 (m, 4H) ; 1,84 (m, 4H) ; 2,58 (m, 4H) ;
2,72 (m, 4H) ; 2,81 (m,
4H) ; 3,48 (m, 2H) ; 3,62 (m, 2H) ; 4,33 (q, J=6,8 Hz, 2H) ; 6,78 (d, J=8,4
Hz, 2H) ; 7,40-7,50 (m,
4H) ; 8,33 (d, J=8,4 Hz, 1H) ; 11,14 (s, 1H) ; 11,35 (s, 1H).
8.8 :7-[4-(pyridin-3-ylmethyl-ureido)-phenyll-1-ethyl-4-oxo-2-(2-pyrrolidin-1-
yl-ethvlamino)-1,4-
dihydro-quinoline-3-carboxvlic acid (2-pyrrolidin-1-yl-ethyl)-amide
hydrochloride sait
0 0
N N
H
C N NH N~ 2 HCI
N~N \
H H
N
Dans un ballon de 25 mL, sous atmosphère d'azote, on dissout 260 mg (0,5 mmol)
de composé
de l'étape 8.7 dans 10 mL de THF anhydre. On ajoute 193 mg (0,7 mmol) de N,N'-
disuccinimidyl
carbonate et 93 mg (0,7 mmol) de diméthylamino-pyridine puis on agite le
mélange 16 heures à
température ambiante. On ajouter 240 pL (1,5 mmol) de triéthylamine et une
solution de 82 mg
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
32
(0,7 mmol) de pyridin-3-yl méthylamine dissous dans 2 mL de THF anhydre puis
on agite le
mélange 6 h à température ambiante. Le solvant est évaporé sous pression
réduite. Le résidu est
purifié par flash chromatographie sur colonne d'alumine neutre (éluent:
AcOEt/MeOH, 90-10). Les
fractions pures sont collectées puis le solvant est évaporé sous pression
réduite. On dissout le
produit dans 2 mL d'AcOEt puis on ajoute goutte à goutte une solution d'HCI 2N
dans l'AcOEt
jusqu'à formation complète du sel. Le solvant est évaporé sous pression
réduite, puis le solide est
reprit dans de l'AcOEt, trituré et filtré afin d'obtenir 100 mg (0,1 mmol) de
composé sous la forme
d'un solide blanc. Rdt=30% ; PF=130-135 C. RMN 'H DMSO-d6 (300 MHz) 1,10-1,25
(m, 3H)
1,75-2,10 (m, 8H) ; 2,90-3,10 (m, 4H) ; 3,25-3,85 (m, 12H) ; 4,40-4,55 (m, 4H)
; 7,43 (m, 1H) ;
7,50-7,78 (m, 5H) ; 7,85 (s, 1 H) ; 8,04 (m, 1 H) ; 8,18 (m, 1 H) ; 8,50 (m, 1
H) ; 8,84 (m, 2H) ; 9,63
(s,1H) ; 10,50-10,80 (m, 2H) ; 11,19 (s, 1H) ; 11,36 (bs, 1H). RMN 13C DMSO-d6
(75 MHz)
14,57, 21,26, 23,18, 35,23, 44,20, 45,23, 53,17, 53,56, 53,79, 60,23, 99,19,
115,44, 118,43,
122,45, 124,23, 126,89, 127,32, 128,11, 131,91, 139,63, 140,97, 141,08,
141,40, 144,33, 144,69,
155,93, 162,93, 169,67, 170,79, 175,54. IC5o (HCT116) = 0,1 nM
Exemple 9 : 7-Amino-8-ethyl-5-oxo-2-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-
5,8-dihydro-
pyrido[2,3-d]pyrimid ine-6-carboxylic acid méthylamide (n 53)
O
N CI
9.1 : 2,4-Dihydroxy-pyrimidine-5-carbonyl chloride CIE -N CI
Dans un ballon de 250 mL, sous atmosphère d'azote, on dissout 10,0 g (64,0
mmol) d'acide 2,4-
dihydroxy-pyrimidine-5-carboxylique dans 46 mL (500,0 mmol) de POCI3. La
température du
mélange est abaissée à 0 C à l'aide d'un bain de glace puis 47,7 g (230 mmol)
de PCI5 sont
additionnés par petites portions. La solution est agitée 16 h à reflux puis
les solvants sont
évaporés sous pression réduite. Le résidu est repris et trituré dans 100 mL de
toluène puis filtré.
On répète cette opération trois fois puis le filtrat est évaporé sous pression
réduite pour donner
13,5 g (64,0 mmol) de composé sous la forme d'une huile jaune utilisée
directement pour l'étape
suivante. Rdt=100%.
o
N O~
9.2 : 2,4-dichloro-pyrimidine-5-carboxylic acid ethyl ester CI'N CI
Dans un ballon de 250 mL, sous atmosphère d'azote, on dissout 13,5 g (64,0
mmol) de composé
précédent dans 100 mL de THF anhydre. On ajoute 15 mL d'éthanol absolu et on
agite le
mélange 10 min à température ambiante. Le mélange est dilué avec une solution
aqueuse de
K2CO3 saturée (100 ml-) et extrait à l'acétate d'éthyle (4x100 mL). Les phases
organiques sont
réunies puis lavées avec 150 mL d'une solution aqueuse saturée en NaCI. Après
séparation, la
phase organique est séchée sur MgSO4, filtrée et le solvant est évaporé sous
pression réduite
afin d'obtenir 14,0 g (63,3 mmol) de composé sous la forme d'une huile orange.
Rdt=99%. RMN
1H DMSO d6 (300 MHz) : 1,34 (t, J=7,1 Hz, 3H) ; 4,37 (q, J=7,1 Hz, 2H) ; 9,16
(s, 1H).
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
33
oo
N \Y O~
CI,N NH
9.3. 2-Chloro-4-ethylamino-pyrimidine-5-carboxylic acid ethyl ester J
Dans un ballon de 250 mL, sous atmosphère d'azote, on dissout 14,0 g (63,3
mmol) de composé
de l'étape précédente dans 150 mL de THF anhydre. On ajoute 13 mL (95,0 mmol)
de
triethylamine puis 32 mL (64,0 mmol) d'éthylamine 2M dans THF et on agite 16 h
à température
ambiante. Le précipité formé est filtré et le filtrat est évaporé sous
pression réduite. Le résidu est
purifié par flash chromatographie sur colonne de silice (40-63 pm) (éluent:
cyclohexane/AcOEt, 1-
1). Les fractions pures sont collectées puis le solvant est évaporé sous
pression réduite afin
d'obtenir 9,2 g (39,9 mmol) de composé sous la forme d'une poudre blanche.
Rdt=63%. RMN'H
DMSO d6 (300 MHz) : 1,15 (t, J=7,2 Hz, 3H) ; 1,31 (t, J=7,1 Hz, 3H) ; 3,47 (m,
2H) ; 4,37 (q,
J=7,1 Hz, 2H) ; 8,50 (bs, 1 H) ; 8,59 (s, 1 H).
o
NOH
CIN NH
9.4 : 2-chloro-4-ethylamino-pyrimidine-5-carboxylic acid J
Dans un ballon de 500 mL, on dissout 9,2 g (39,9 mmol) de composé de l'étape
9.3 dans 250 mL
de THF. On ajoute 100 mL d'eau suivi de 2,5 g (60,0 mmol) de lithine
monohydrate. On agite le
mélange à température ambiante pendant 24 h. Le THF est évaporé sous pression
réduite, la
solution est acidifiée avec une solution aqueuse d'HCI 1N jusqu'à formation
complète du
précipité. On filtre le précipité formé puis le sèche dans une étuve afin
d'obtenir 8,0 g (39,5 mmol)
de composé sous la forme d'une poudre blanche. Rdt=99% RMN 'H DMSO d6 (300
MHz) : 1,15
(t, J=7,2 Hz, 3H) ; 3,45 (m, 2H) ; 8,55 (s, 1 H) ; 8,65 (bs, 1 H).
o
N~F
CIN NH
9.5. 2-Chloro-4-ethylamino-pyrimidine-5-carbonyl fluoride J
Dans un ballon de 250 mL, sous atmosphère d'azote, on dissout 4,0 g (20,0
mmol) de composé
de l'étape 9.4 dans 120 mL de DCM anhydre. On ajoute 2,8 mL (20,0 mmol) de
triethylamine puis
2,5 mL (30,0 mmol) de cyanuric fluoride et on agite 16 h à température
ambiante. Le mélange est
hydrolysé avec 50 mL d'une solution glacée de NaHCO3 saturée puis extrait avec
3x25 mL
d'AcOEt. Les phases organiques sont réunies puis lavées avec 25 mL d'une
solution aqueuse
saturée en NaCI. Après séparation, la phase organique est séchée sur MgSO4,
filtrée et le solvant
est évaporé sous pression réduite afin d'obtenir 3,2 g (15,8 mmol) de composé
sous la forme
d'une huile jaune utilisée directement pour l'étape suivante. Rdt=79%
9.6:7-Amino-2-chloro-8-ethyl-5-oxo-5,8-dihydro-pyrido[239.6:7-Amino-2-chloro-8-
ethyl-5-oxo-5,8-dihydro-pyrido dlpyrimidine-6-carboxylic acid
acid
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
34
o o
N H
CI~N N NH2
methvlamide J
Dans un ballon de 250 mL, sous atmosphère d'azote, on met en suspension 1,3 g
(33,0 mmol) de
NaH à 60% dans 35 mL de DMF anhydre. La température du mélange est abaissée à
0 C à l'aide
d'un bain de glace. On ajoute 1,6 g (16,5 mmol) de 2-cyano-N-methylacétamide
puis on agite le
mélange 15 min à 0 C et 1 h à température ambiante. La température du mélange
est abaissée à
0 C à l'aide d'un bain de glace avant d'être ajoutée goutte à goutte à une
solution à 0 C de 3,2 g
(15,8 mmol) du composé de l'étape 9.5 dissous dans 35 mL de DMF. Agiter le
mélange 2 heure à
température ambiante puis on ajoute 660 mg (16,5 mmol) de NaH à 60%. On
poursuit l'agitation
du mélange 2 h à température ambiante, et on verse le mélange sur de l'eau
glacée (50 ml-) et
on évapore le DMF sous pression réduite. On filtre le précipité formé, on le
lave à l'eau (2x25 ml-)
et on sèche dans une étuve afin d'obtenir 2,3 g (8,4 mmol) de composé sous la
forme d'une
poudre blanche. Rdt=53%. RMN 'H DMSO d6 (300 MHz) : 1,23 (t, J=7,1 Hz, 3H) ;
2,80 (d, J=4,7
Hz, 3H) ; 4,34 (q, J=7,1 Hz, 2H) ; 8,42 (bs, 1H) ; 9,11 (s, 1H) ; 10,71 (d,
J=4,7 Hz, 1H) ; 11,96 (bs,
1 H).
9.7 :7-Am ino-2-[4-(pyrid in-3-ylmethyl-ureido)-phenyll-8-ethyl-5-oxo-5,8-
dihydro-pyrido[2,3-
O O
NI ~ H
II O N JN NHZ
NxN
H H
d1pyrimidine-6-carboxylic acid methylamide N
Dans un ballon de 50 mL, on dissout 300 mg (1,1 mmol) de composé de l'étape
9.6 dans 15 mL
de THF. On ajoute 564 mg (1,6 mmol) de 1-pyridin-3-ylmethyl-3-[4-(4,4,5,5-
tetramethyl-
[1,3,2]dioxaborolan-2-yl)-phenyl]-urée suivi de 1,1 mL (2,2 mmol) d'une
solution aqueuse de
Na2CO3 2M. On dégaze le mélange à l'aide d'un courant d'azote puis ajoute 612
mg (0,5 mmol)
de Pd(PPh3)4 et on chauffe le mélange 4 h à reflux. Après retour à température
ambiante, le
mélange est filtré et le précipité est lavé à l'éthanol. Après
recristallisation dans l'éthanol et
lavage à l'éther éthylique, 462 mg (1,0 mmol) de composé sont isolés sous la
forme d'une poudre
jaune. Rdt=92% : PF=250 C. RMN 'H DMSO-d6 (300 MHz) 1,26 (t, J=6,8 Hz, 3H) ;
2,76 (d,
J=4,6 Hz, 3H) ; 4,33 (d, J=5,4 Hz, 2H) ; 4,50 (d, J=7,1 Hz, 2H) ; 7,20-7,30
(m, 1H) ; 7,33-7,38 (m,
1 H) ; 7,59 (d, J=8,7 Hz, 2H) ; 7,72 (d, J=7,8 Hz, 1 H) ; 8,33 (d, J=8,7 Hz,
2H) ; 8,44 (dd, J=4,8 Hz,
J=1,5 Hz, 1 H) ; 8,53 (s, 1 H) ; 9,11 (s, 1 H) ; 9,37 (bs, 1 H). LCMS (D) tr =
5,93 min. IC50 (HCT116)
= 6 nM.
Exemple 10 : composé n 27
RMN 'H DMSO-d6 (300 MHz) 1,31 (t, J=6,7 Hz, 3H) ; 2,80 (d, J=4,5 Hz, 3H) ;
4,20-4,40 (m, 4H) ;
6,81 (t, J=5,7 Hz, 1 H) ; 7,37 (m, 1 H) ; 7,56 (m, 3H) ; 7,65-7,75 (m, 4H) ;
8,23 (d, J=8,1 Hz, 1 H)
8,46 (d, J=4,8 Hz, 1 H) ; 8,54 (s, 1 H) ; 8,90 (s, 1 H) ; 11,31 (m, 1 H). LCMS
(D) : tr = 6,28 min. IC5o
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
(HCT116) = 0,1 nM
Exemple 11 : composé n 56
RMN 'H DMSO-d6 (300 MHz) 1,32 (t, J=6,6 Hz, 3H) ; 4,34 (m, 4H) ; 6,85 (t,
J=5,2 Hz, 1H) ; 7,19
5 (d, J=5,2 Hz, 1H); 7,33-7,40 (dd, J=7,7 Hz, J=4,8 Hz, 1H); 7,54-7,58 (m, 3H)
; 7,68-7,74 (m,
4H) ; 8,23 (d, J=8,3 Hz, 1 H) ; 8,46 (dd, J=4,8 Hz, J=1,4 Hz, 1 H) ; 8,54 (d,
J=1,8 Hz, 1 H) ; 8,91 (s,
1H) ; 10,68 (d, J=5,0 Hz, 1H). LCMS (D) : tr = 5,71 min. IC50 (HCT116) = 0,19
nM
Exemple 12 : composé n 59
10 RMN 'H CDCI3 (300 MHz) 1,18 (t, J=6,9 Hz, 3H) ; 1,50-1,70 (m, 2H) ; 1,80-
2,10 (m, 6H) ; 3,35-
3,50 (m, 3H) ; 3,58-3,69 (m, 1H) ; 3,70-3,82 (m, 2H) ; 3,82-3,96 (m, 2H) ;
4,03-4,16 (m, 2H) ; 4,28
(q, J=7,1 Hz, 2H) ; 4,46 (d, J=5,7 Hz, 2H) ; 6,32 (t, J=5,8 Hz, 1 H) ; 7,20-
7,30 (m, 1 H) ; 7,32-7,50
(m, 6H) ; 7,75 (d, J=7,8 Hz, 1 H) ; 8,00 (s, 1 H) ; 8,27 (d, J=8,3 Hz, 1 H) ;
8,46 (dd, J=4,8 Hz, J=1,4
Hz, 1H) ; 8,58 (m, 1H) ; 11,30-11,45 (m, 2H). RMN 13C CHCI3-d (75 MHz) 8,62,
138,2, 25,83,
15 29,06, 29,26, 41,4, 43,00, 45,68, 46,04, 52,92, 69,23, 68,53, 77,96, 99,07,
114,79, 119,36,
122,41, 123,87, 124,88, 127,23, 127,76, 133,72, 135,92, 136,39, 139,39,
139,95, 144,41, 147,57,
148,09, 155,90, 164,46, 169,37, 176,26. LCMS (D) : tr=6,52 min. IC5o (HCT116)
= 0,47 nM
Exemple 13 : composé n 60
20 RMN 1H CHCI3-d (300 MHz) 0,90-1,00 (m, 12H) ; 1,00-1,10 (m, 12H) ; 1,17 (t,
J=6,9 Hz, 3H) ;
2,62-2,77 (m, 4H) ; 2,90-3,14 (m, 4H) ; 3,25-3,35 (m, 2H) ; 3,35-3,48 (m, 2H)
; 4,22-4,33 (m, 2H) ;
4,44 (d, J=5,4 Hz, 2H) ; 6,20 (m, 1 H) ; 7,20 (m, 1 H) ; 7,35-7,50 (m, 6H) ;
7,67 (d, J=7,8 Hz, 1 H) ;
8,02 (bs, 1H) ; 8,27 (d, J=8,6 Hz, 1H); 8,46 (d, J=4,3 Hz, 1H); 8,54 (s, 1H);
10,81 (bs, 1H) 11,05 (bs, 1H). LCMS (D) : tr=5,12 min. IC50 (HCT116) = 0,1 nM
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
36
d
L N N N C N N
i X =~ Co X
X
Ç L L L O O L L O 4% O
CÇ U O O O O O O U U U
O 0 0 0 0 0
C)
3 U
oz z U o v U z z z
ô
LL CO N
d n n
C m
E Mo Q Q Q Q Q Q Q Q Q Q Q Q Q Q
O = V lf) V O CO O - N CO M CO O M
J d a+ Ln O cc cc O O cc O O
LO sri v m sri sri v m m
+ N M CO O M M O L() M N- CO CO O CO O CO W M
N 2 N- L() CO O f- Lf) CO L() CO CO CO L() CO N CO N- N-
~
N
f0 _
`. v m LLI x
m ~ 0
0=0
ai
O Z-~ ay z
yN cN cN cN cN cN cN cN cN cN cN cO NN cN cN
I.L Z c c c c c c c c x c c G x c c c
N m 2 2 2 2 2 2 2 2 2 2 U 2 2 2
M
r M
x x x x x x x x x x x x x x x x x x
ii x x x x x x x x x x x x x x x x x x
O Q
Z
W W W W W w 2 w w W W W W W W W W
x
U
x x x x x x x x x x x x x x x x x x
N U U U U U U U U U U U U U U U U U U
z z z z z z z z z z z z z z z z z z
x x x x x x x x x x x x x x x x x x
x O
x Z x x x x x x x x x x x p
J z x= z x z z z z z Z z z Z~z =
2 Z U 2 Z 2 x 2 2 2 2 = 2 2 2= m 2 U
U =
.92 U = U U U U U U U U U U U U U
U
3 Q Q Q Q Q iX Q Q Q Q Q Q Q Q Q Q Q Q Q Q
Ç N M W h CO 01 0 N M Ln CD r CO
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
37
C C
r L N M L N
C
E 0 O 0 O
E
o
OZ z Uz
LL v
d N
C m
Q Q Q Q Q Q Q Q o Q Q Q m Q Q Q Q
U i W M CO ln W M CO M M O N O M
J O r O W W W O V V N O CO V
M Il- W) V LO Il- LO CO CO V m V V
C
+ CO Il- Il- O N M Co I, M V O) I, N N
U S CO In W O N- V V If) N- CO V I~ CO O In LO I,
m CO CO If) 10 V V In 10 CO Co In CO If)
N
f0
~n O dj Z Qj
N~ N 2 N Z N N ~ N N Z U N Z
Z U = _ ~~ Z z Z U
Il Co ^m 2 x 2 2 x 2 2 U 2 2 z ~~ ^ 2 (~~ 2
rn U U a ~0 O U U
f0 x ~ O
= x = x ~ 2 x
M c
~~ x x x x x x x x x ~ ~ ~ x x x
N x x x x x x x x x x x x ~~ x x ~ x
~ II U / \\\\~~///JJl
Q O_ ~
x x 2
O ai
U x" g
2 m Z _ Z
W W W W W ^ W W W W W W W Z W 2
20 U ~~ U
U x
O U
x x x x x x x x x x x x x x x x x
N U U U U U U U U ~? U U 0 0 0 0 0 0
z z z z z z z z U z z z z z z z z
x x x x x x x x x x x x x x 2 x
x x x x x x x x x x x x x x x x
z z z z z z z z z z z z z z z z z
J x x x x x x x x x x x x x x x x x
U U U U U U U U U U 0 0 0 0 0 0 0
Q Q Q Q Q Q Q Q Q Q Q Q Q Q Q Q Q Q
O) O N M U) t0 h CO O) O N M U)
Ç - N N N N N N N N N N M M M M M M
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
38
C C C C C
r L N L N L N L N L N V
Ç =N (0 =N (0 =N (0 =N (0 =N (0 X
d
2 O 2 O 2 O 2 O 2 O
E
O O O O O O
E
O z z
C m
E M Q Q Q Q Q Q Q Q Q Q Q
O
J r M O N (D C(D O) O W W
'Ç V V V V V
C
N x Co N W W LO 0
LO LO LO m ( (D (D N-
N
o
0 O
/ = z
N C c~ z =
Z z C z~ z z z zD
I.L ~/ U U Z z 2 ~D
U) z z
2 2 2 2 2 /Z~ h
IQI
0- z
z
2 = = g
w z z w W z w W W W W
2 2 2 2 2 2 2 2 2 2 2
N U U U U U U U U U U U
z z z z z z z z z z z
x x x x x x x x x x x
x x x x x x x x
z z z z z z z z z z z
J 2 2 = = 2 2 2 2 2 = 2
U U U U U U U U U U U
Q Q Q Q Q Q Q Q Q Q Q Q
Ç M M M M CD
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
39
d a)
C C C
r L N L N L N O
i =N (0 =N (0 =N (0 X X
E 2 ~9 2 ~9 2 U U
E O O O
o
O Z U z U z
â o
C m
Q Q Q Q Q U Q Q o o Q
J M N ON COO M M O Co O
.Ç W) W) V LC) CO V I~
C ~ V V
+ W) Pl- M O) N- O O
N= V Co Co LO N N- CO LO Co Co
LO LO LO W) W) L LO N V CO CO
N
f0
0 O
~ = d Z Z = 2 Z 2
z U z
2 = = 2 = 2
Z
M Z
z
~~ 2 2 2 U 2 2 2 2 = 2 Z
~ p 2 2 2 U 2 2 2 2 =_ ~ \/
W W W W Z W W W W W W
2 2 2 2 2 2 2 2 2 2
N O O O O O O z O O U O O
z z z z z z z z z U z z
x x x x x x x x x x x x
x x x x x x x x x x x
z z z z z z z z z z z
J 2 2 2 2 2 2 2 2 2 2 2 2
O O O O O O O O 0 0 O O
Q Q Q Q Q Q Q Q Q Q Q Q Q
Ç h CO 01 O N M t0 h CO
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
Co
Ç X
d N
E Us
E U
O
O Z Z in z
â2 :~
Co
C m
E MO ô ô Q Q Q
J 0 r ln (N V M M
E
c N N N
c\j N- LO
N
f0
0m
00
Z Z O
Q z Z =
uJ _ U p
V 2 _ _ 2
v 2
N Z U 2 2 Z~ /Z
Q 2 = _ LL
W W W W W W
C
_ = O O
2 2 2 T c
N U U = 2 U U U ô a
1~ 2 2 U U 2
U U Z Z Z N a
- ~ C
y N
d 0 E
2 2 2 2 2 2 a~ Q E
>. O U
O
O N
O
N O' _
O U = O
2 2 2 2 2 2 m y
Z Z Z Z Z z
L O
J 2 2 2 2 2 2 - X
U U U U U U w
C E Ç O
O O
N =-- E
0] ~ O O O
Q Q Q Q Q Q Q f/J = E
ô Z o c
J L O O
6 U Q
w
Ln CD tO t0 CD CD N U LL
Lf)
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
41
Les composés du Tableau I ont pour nomenclature chimique déterminée à l'aide
du
logiciel AUTONOM :
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid methylamide (n 1)
=2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-yl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic
acid methylamide (n 2)
= 2-Amino-1-ethyl-4-oxo-7-{4-[3-(2-pyridin-3-yl-ethyl)-ureido]-phenyl}-1,4-
dihydro-[1,8]naphthyridine-3-
carboxylic acid methylamide (n 3)
= 2-Amino-1-ethyl-7-[3-fluoro-4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-4-oxo-
1,4-dihydro-[1,8]naphthyridine-
3-carboxylic acid methylamide (n 4)
= 2-Amino-7-[4-(3-(6-amino-pyridin-3-ylmethyl-ureido)-phenyl]-1-ethyl-4-oxo-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid methylamide (n 5)
= 2-Amino-1-methyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-
dihydro-[1,8]naphthyridine-3-
carboxylic acid methylamide (n 6)
=2-Amino-1-ethyl-4-oxo-7-[4-((E)-3-pyridin-3-yl-acryloylamino)-phenyl]-1,4-
dihydro-[1,8]naphthyridine-3-
carboxylic acid methylamide (n 7)
= 2-Amino-1-(2-dimethylamino-ethyl)-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid methylamide (n 8)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid amide (n 9)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid ethyl ester (n 10)
= 2-Amino-7-{4-[3-(3-amino-benzyl)-ureido]-phenyl}-1-ethyl-4-oxo-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid methylamide (n 11)
= 2-Amino-1-ethyl-7-[4-(3-methyl-3-pyridin-3-ylmethyl-ureido)-phenyl]-4-oxo-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid methylamide (n 12)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (n 13)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid dimethylamide (n 14)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (2-dimethylamino-ethyl)-amide (n 15)
= {1-[4-(7-Amino-8-ethyl-6-methylcarbamoyl-5-oxo-5,8-dihydro-[1,8]naphthyridin-
2-yl)-phenyicarbamoyl]-
2-pyridin-3-yl-ethyl}-carbamic acid tert-butyl ester (n 16)
=2-Amino-1-ethyl-4-oxo-7-[4-(3-thiazol-5-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid methylamide (n 17)
= [4-(7-Amino-8-ethyl-6-methylcarbamoyl-5-oxo-5,8-dihydro-[1,8]naphthyridin-2-
yl)-phenyl]-carbamic acid
pyridin-3-ylmethyl ester (n 18)
= 2-Amino-1-ethyl-7-[4-(1-methyl-3-pyridin-3-ylmethyl-ureido)-phenyl]-4-oxo-
1,4-dihydro-[1,8]naphtyridine-
3-carboxylic acid methylamide (n 19)
= [6-((2-amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-
dihydro-[1,8]naphtyridine-3-
carbonyl)-amino)-hexyl]-carbamic acid tert-butyl ester (n 20)
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
42
= 2-Amino-7-{4-[3-(6-amino-pyridin-3-ylmethyl)-ureido]-phenyl}-1-ethyl-4-oxo-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid methylamide (n 21)
= 2-(2-Dimethylamino-ethylamino)-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-
ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-dimethylamino-ethyl)-amide (n 22)
=2-Amino-1-ethyl-7-[4-(3-methyl-3-pyridin-3-ylmethyl-ureido)-phenyl]-4-oxo-1,4-
dihydro-
[1,8]naphthyridine-3-carboxylic acid amide (n 23)
= (6-{2-Amino-3-methylcarbamoyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-4H-[1,8]naphthyridin-1-
yl}-hexyl)-carbamic acid tert-butyl ester (n 24)
= 2-Amino-1-(6-amino-hexyl)-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid methylamide (n 25)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (6-amino-hexyl)-amide (n 26)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
quinoline-3-carboxylic acid
methylamide (n 27)
=1-Ethyl-2-methylamino-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-
dihydro-[1,8]naphthyridine-
3-carboxylic acid methylamide (n 28)
= 1-{4-[7-Amino-8-ethyl-6-(4-methyl-piperazine-1-carbonyl)-5-oxo-5,8-dihydro-
[l,8]naphthyridin-2-yl]-
phenyl}-3-pyridin-3-ylmethyl-urea (n 29)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (2-morpholin-4-yl-éthyl)-amide (n 30)
= 1-Ethyl-2-(2-morpholin-4-yl-ethylamino)-4-oxo-7-[4-(3-pyridin-3-ylmethyl-
ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-morpholin-4-yl-ethyl)-amide (n 31)
= 2-Amino-1-éthyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid [2-(2-{2-[2-(2-{2-[2-(2-amino-ethoxy)-ethoxy]-ethoxy}-ethoxy)-
ethoxy]-ethoxy}-ethoxy)-
ethyl]-àmide (n 32)
= 2-Amino-1-(2-morpholin-4-yi-ethyl)-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-1,4-dihydro-
[1,,8]naphthyridine-3-carboxylic acid methylamide (n 33)
= 1-Ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-2-(2-pyrrolidin-1-
yl-ethylamino)-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-pyrrolidin-1-yl-ethyl)-amide (n 34)
= 2-Amino-1-(2-dimethylamino-ethyl)-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-dimethylamino-ethyl)-amide (n 35)
= 2-Amino-l-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (2-pyrrolidin-1-yl-ethyl)-amide (n 36)
= 2-Amino-1-(2-morpholin-4-yi-ethyl)-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid amide (n 37)
= 2-Amino-7-[4-(3-methyl-3-pyridin-3-ylmethyl-ureido)-phenyl]-1-(2-morpholin-4-
yl-éthyl)-4-oxo-1,4-
dihydro[1,8]naphtyridine-3-carboxylic acid methylamide (n 38)
= 2-Amino-1-ethyl-7-[4-(3-methyl-3-pyridin-3-ylmethyl-ureido)-phenyl]-4-oxo-
1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-morpholin-4-yl-ethyl)-amide (n 39)
= 2-Amino-l-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid {3-[3-(3-amino-propylamino)-propylamino]-propyl}-amide (n 40)
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
43
= 2-Amino-1-(2-morpholin-4-yl-ethyl)-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-am ino-ethyl)-am ide (n 41)
= 1-Ethyl-4-oxo-2-(2-piperazin-1-yi-ethylamino)-7-[4-(3-pyridin-3-ylmethyl-
ureldo)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-piperazin-1-yl-ethyl)-amide (n 42)
=2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (2-piperazin-1-yl-ethyl)-amide (n 43)
= 1-Ethyl-4-oxo-2-[(piperidin-4-ylmethyl)-amino]-7-[4-(3-pyridin-3-ylmethyl-
ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (piperidin-4-ylmethyl)-amide (n 44)
= 1-Ethyl-7-[4-(3-methyl-3-pyridin-3-yimethyl-ureido)-phenyl]-2-(2-morpholin-4-
yl-ethylamino)-4-oxo-1,4-
dihydro-[1,8]naphthyridine-3-carboxylic acid (2-morpholin-4-yl-ethyl)-amide (n
45)
= 1-Ethyl-2-[2-(4-methyl-piperazin-1-yl)-ethylamino]4-oxo-7-[4-(3-pyridin-3-
ylmethyl-ureido)-phenyl]-1,4-
dihydro-[1,8]naphthyridine-3-carboxylic acid [2-(4-methyl-piperazin-1-yl)-
ethyl]-amide (n 46)
= 2-Amino-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1-(2-pyrrolidin-1-
yl-ethyl)-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid methylamide (n 47)
=2-Amino-1-ethyi-7-[4-(3-methyl-3-pyridin-3-ylmethyl-ureido)-phenyl]-4-oxo-1,4-
dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-piperazin-1-yl-ethyl)-amide (n 48)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid [2-(4-methyl-piperazin-1-yl)-ethyl]-amide (n 49)
= 2-(2-Amino-ethylamino)-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-
phenyl]-1,4-dihydro-
[1,8]naphthyridiné-3-carboxylic acid (2-amino-ethyl)-amide (n 50)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (piperidin-4-ylmethyl)-amide (n 51)
= 2-Amino-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1-(2-pyrrolidin-1-
yl-ethyl)-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid amide (n 52)
= 7-Amino-8-ethyl-5-oxo-2-[4-(3-pyridin-3-yimethyl-ureido)-phenyl]-5,8-dihydro-
pyrido[2,3-d]pyrimidine-6-
carboxylic acid methylamide (n 53)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-yimethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (1-methyl-piperidin-4-ylmethyl)-amide (n 54)
= 2-(2-Diisopropylamino-ethylamino)-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-
ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-carboxylic acid (2-diisopropylamino-ethyl)-amide (n 55)
= 2-Amino-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
quinoline-3-carboxylic acid
amide (n 56)
= 1-Ethyl-2-[2-(2-methyl-pyrrolidin-1-yl)-ethylamino]-4-oxo-7-[4-(3-pyridin-3-
ylmethyl-ureido)-phenyl]-1,4-
dihydro-[I,8]naphthyridine-3-carboxylic acid [2-(2-methyl-pyrrolidin-1-yl)-
ethyl]-amide (n 57)
=1-Ethyl-2-[2-(2-methyl-pyrrolidin-1-yl)-ethylamino]-4-oxo-7-[4-(3-pyridin-3-
ylmethyl-ureido)-phenyl]-1,4-
dihydro-[1,8]naphthyridine-3-carboxylic acid [2-(2-methyl-pyrrolidin-1-yl)-
ethyl]-amide (n 58)
= 1-Ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-2-[(tetrahydro-
furan-2-ylmethyl)-amino]-1,4-
dihydro-quinoline-3-carboxylic acid (tetrahydro-furan-2-ylmethyl)-amide (n 59)
= 2-(2-Diisopropylamino-ethylamino)-1-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-
ureido)-phenyl]-1,4-dihydro-
quinoline-3-carboxylic acid (2-diisopropylamino-ethyl)-amide (n 60)
= 1-Ethyl-4-oxo-7-[4-(3-pyridin-3-yimethyl-ureido)-phenyl]-2-(2-pyrrolidin-1-
yl-ethylamino)-1,4-dihydro-
quinoline-3-carboxylic acid (2-pyrrolidin-1-yl-ethyl)-amide (n 61)
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02730071 2011-01-06
WO 2010/004198 PCT/FR2009/051322
44.
= 1-Ethyl-2-[2-(4-hydroxy-piperidin-l-yl)-ethylamino]-4-oxo-7-[4-(3-pyridin-3-
ylmethyl-ureido)-phenyl]-1,4-
dihydro-[1,8]naphthyridine-3-carboxylic acid [2-(4-hydroxy-piperidin-1-yl)-
ethyl]-amide (n 62)
= 2-[2-(4,4-Difluoro-piperidin-1-yl)-ethylamino]-1-ethyl-4-oxo-7-[4-(3-pyridin-
3-ylmethyl-ureido)-phenyl]-
1,4-dihydro-[I,8]naphthyridine-3-carboxylic acid [2-(4,4-difluoro-piperidin-1-
yl)-ethyl]-amide (n 63)
=2-Amino-l-ethyl-4-oxo-7-[4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-1,4-dihydro-
[1,8]naphthyridine-3-
carboxylic acid (2-hydroxy-1, 1 -bis-hydroxymethyl-ethyl)-amide (n 64)
La prolifération et la viabilité cellulaire ont été déterminées dans un test
utilisant le 3-(4,5-
diméthylthiazol-2-yl)-5-(3-carboxyméthoxyphényl)-2-(4-sulfophényl)-2H-
tétrazolium (MTS) selon
Fujishita T. et* al. Oncology 2003, 64(4), 399-406 (voir page 401). Dans ce
test, on mesure la
capacité mitochondriale des cellules vivantes à transformer le MTS en un
composé coloré après
72 h d'incubation du composé testé. IC50 (nM) désigne la concentration en
composé qui conduit à
50% de perte de prolifération et de viabilité cellulaire.
Les composés du Tableau I ont fait l'objet d'essais expérimentaux in vitro sur
la lignée tumorale
HCT116 (réf. ATCC-CCL247). On a constaté que les valeurs de IC50 sont
comprises entre < 0,1
et 1 pM pour cette lignée (voir aussi valeurs données dans les exemples)
indiquant que lesdits
composés ont une activité anticancéreuse.
FEUILLE DE REMPLACEMENT (REGLE 26)