Note: Descriptions are shown in the official language in which they were submitted.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
1
NOUVEAUX DERIVES IMIDAZO[1,2-a]PYRIMIDINE, LEUR PROCEDE DE
PREPARATION, LEUR APPLICATION A TITRE DE MEDICAMENTS,
COMPOSITIONS PHARMACEUTIQUES ET NOUVELLE UTILISATION
NOTAMMENT COMME INHIBITEURS DE MET
La présente invention concerne de nouveaux dérivés imidazo[1,2-
a]pyrimidine, leur procédé de préparation, les nouveaux intermédiaires
obtenus, leur application à titre de médicaments, les compositions
pharmaceutiques les renfermant et la nouvelle utilisation de tels dérivés
imidazo[1,2-a]pyrimidine.
La présente invention concerne plus particulièrement de nouveaux dérivés
imidazo[1,2-a]pyrimidine présentant une activité anticancéreuse, via la
modulation de l'activité de protéines, en particulier des kinases.
A ce jour, la plupart des composés commerciaux utilisés en chimiothérapie
sont des cytotoxiques qui posent des problèmes importants d'effets
secondaires et de tolérance par les patients. Ces effets pourraient être
limités
dans la mesure où les médicaments utilisés agissent sélectivement sur les
cellules cancéreuses, à l'exclusion des cellules saines. Une des solutions
pour limiter les effets indésirables d'une chimiothérapie peut donc consister
en l'utilisation de médicaments agissant sur des voies métaboliques ou des
éléments constitutifs de ces voies, exprimés majoritairement dans les cellules
cancéreuses, et qui ne seraient pas ou peu exprimés dans les cellules
saines. Les protéines kinase sont une famille d'enzymes qui catalysent la
phosphorylation de groupes hydroxy de résidus spécifiques de protéines tels
que des résidus tyrosine, sérine ou thréonine. De telles phosphorylations
peuvent largement modifier la fonction des protéines : ainsi, les protéines
kinases jouent un rôle important dans la régulation d'une grande variété de
processus cellulaires, incluant notamment le métabolisme, la prolifération
cellulaire, l'adhésion et la motilité cellulaire, la différentiation
cellulaire ou la
survie cellulaire, certaines protéines kinases jouant un rôle central dans
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
2
l'initiation, le développement et l'achèvement des évènements du cycle
cellulaire.
Parmi les différentes fonctions cellulaires dans lesquelles l'activité d'une
protéine kinase est impliquée, certains processus représentent des cibles
attractives pour traiter certaines maladies. Comme exemple, on peut citer
notamment l'angiogénèse et le contrôle du cycle cellulaire et ainsi que celui
de la prolifération cellulaire, dans lesquels les protéines kinases peuvent
jouer un rôle essentiel. Ces processus sont notamment essentiels pour la
croissance des tumeurs solides ainsi que d'autres maladies : notamment des
molécules inhibitrices de telles kinases sont susceptibles de limiter des
proliférations cellulaires non désirées telles que celles observées dans les
cancers, et peuvent intervenir dans la prévention, la régulation ou le
traitement de maladies neurodégénératives telles que la maladie d'Alzheimer
ou encore l'apoptose neuronale.
La présente invention a pour objet de nouveaux dérivés dotés d'effets
inhibiteurs vis-à-vis de protéines kinases. Les produits selon la présente
invention peuvent ainsi notamment être utilisés pour la prévention ou le
traitement de maladies pouvant être modulées par l'inhibition de protéines
kinases.
Les produits selon la présente invention présentent notamment une activité
anticancéreuse, via la modulation de l'activité de kinases. Parmi les kinases
pour lesquelles une modulation de l'activité est recherchée, MET ainsi que
des mutants de la protéine MET sont préférées.
La présente invention concerne également l'utilisation desdits dérivés pour la
préparation d'un médicament destiné au traitement de l'homme.
Ainsi, un des objets de la présente invention est de proposer des
compositions ayant une activité anticancéreuse, en agissant en particulier vis-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
3
à-vis de kinases. Parmi les kinases pour lesquelles une modulation de
l'activité est recherchée, MET est préférée.
Dans la partie pharmacologique ci-après, il est montré dans des tests
biochimiques et sur des lignées cellulaires, que les produits de la présente
demande inhibent ainsi notamment l'activité d'autophosphorylation de MET et
la prolifération des cellules dont la croissance dépend de MET ou de ses
formes mutantes.
MET, ou Hepatocyte Growth Factor Receptor, est un récepteur à activité
tyrosine kinase exprimé en particulier par les cellules épithéliales et
endothéliales. Le HGF, Hepatocyte Growth Factor, est décrit comme le ligand
spécifique de MET. Le HGF est sécrété par les cellules mésenchymales et
active le récepteur MET qui s'homodimérise. Par voie de conséquence, le
récepteur s'autophosphoryle sur les tyrosines du domaine catalytique Y1230,
Y1234 et Y1235.
La stimulation de MET par le HGF induit la prolifération, le scattering (ou
dispersion), la motilité cellulaire, la résistance à l'apoptose, l'invasion et
l'angiogénèse.
MET de même que le HGF, sont retrouvés surexprimés dans de nombreuses
tumeurs humaines et une grande variété de cancers. MET est aussi retrouvé
amplifié dans des tumeurs gastriques et glioblastomes. De nombreuses
mutations ponctuelles du gène MET ont aussi été décrites dans des tumeurs,
en particulier dans le domaine kinase mais aussi dans le domaine
juxtamembranaire et le SEMA domain. Surexpression, amplification ou
mutations provoquent l'activation constitutive du récepteur et une
dérégulation de ses fonctions.
La présente invention concerne ainsi notamment de nouveaux inhibiteurs de
la protéine kinase MET et de ses mutants, pouvant être utilisés pour un
traitement anti-prolifératif et anti-métastatique notamment en oncologie.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
4
La présente invention concerne également de nouveaux inhibiteurs de la
protéine kinase MET et de ses mutants, pouvant être utilisés pour un
traitement anti- angiogénique, notamment en oncologie.
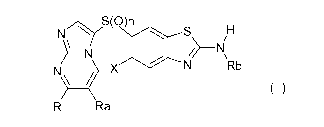
La présente invention a pour objet les produits de formule (I):
N ^ S(O)n S H
N
X N Rb
N~ ~ (I)
R Ra
dans laquelle
n = 0,1ou2;
X représente un atome d'hydrogène, un atome d'halogène ou un radical
alkyle;
R représente un atome d'hydrogène ou un radical NH2, NHalk ou N(alk)2;
Ra représente un atome d'hydrogène; un atome d'halogène; ou un radical -
O-cycloalkyle ; -0-alkyle, -O-aryle ; -O-hétéroaryle; -NRd(cycloalkyle) ; -
NRd(alkyle) ; -NRd(aryle) ; -NRd(hétéroaryle) ; alkyle ; cycloalkyle ;
hétérocycloalkyle ; un radical aryle; ou un radical hétéroaryle ; dans tous
ces
radicaux, les radicaux cycloalkyle ; alkyle, aryle et hétéroaryle étant
éventuellement substitués comme indiqué ci-après;
Rb représente un atome d'hydrogène, un radical Rc, -COORc, -CO-Rc ou un
radical -CO-NRcRd;
avec Rc représente un radical alkyle, cycloalkyle, hétérocycloalkyle, aryle et
hétéroaryle, tous ces radicaux étant éventuellement substitués comme
indiqué ci-après;
Rd représente un atome d'hydrogène ou un radical alkyle ou cycloalkyle ;
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
tous les radicaux définis ci-dessus alkyle, cycloalkyle, hétérocycloalkyle,
aryle
et hétéroaryle, étant éventuellement substitués par un ou plusieurs radicaux
choisis parmi les atomes d'halogène et les radicaux hydroxyle, alcoxy, CN,
CF3, -NR1 R2, -000H, -COOalk, -CONR1 R2, -NR1 COR2, COR1, oxo,
5 hétérocycloalkyle, aryle et hétéroaryle, ces derniers hétérocycloalkyle,
aryle
ou hétéroaryle étant eux-mêmes éventuellement substitués par un ou
plusieurs radicaux choisis parmi les atomes d'halogène, et les radicaux
hydroxyle, alcoxy, alkyle, CN, CF3, -NR3R4, COOH, -COOalk, -CONR3R4, -
NR3COR4, -COR3 et oxo;
les radicaux cycloalkyle, hétérocycloalkyle, aryle ou hétéroaryle étant de
plus
éventuellement substitués par un radical alkyle lui-même éventuellement
substitué par un ou plusieurs radicaux choisis parmi les atomes d'halogène et
les radicaux hydroxyle, alcoxy, alkyle, NR3R4, COOH, -COOalk, -CONR3R4,
-NR3COR4, et -COR3;
NR1 R2 étant tel que : soit , R1 et R2 étant identiques ou différents, l'un de
R1
et R2 représente un atome d'hydrogène ou un radical alkyle et l'autre de R1
et R2 représente un atome d'hydrogène, un radical -C02-alkyle, un radical
cycloalkyle ou un radical alkyle éventuellement substitué par un ou plusieurs
radicaux identiques ou différents choisis parmi les radicaux hydroxyle,
alcoxy,
NR3R4, hétérocycloalkyle, hétéroaryle ou phényle eux-mêmes
éventuellement substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène et les radicaux hydroxyle, alkyle, alcoxy, NH2; NHalk et
N(alk)2 ; soit R1 et R2 forment avec l'atome d'azote auquel ils sont liés un
radical cyclique renfermant de 3 à 10 chaînons et éventuellement un ou
plusieurs autres hétéroatomes choisi(s) parmi O, S et NH, ce radical y
compris l'éventuel NH qu'il contient étant éventuellement substitué;
NR3R4 étant tel que : soit, R3 et R4 étant identiques ou différents, l'un de
R3
et R4 représente un atome d'hydrogène ou un radical alkyle et l'autre de R3
et R4 représente un atome d'hydrogène, un radical cycloalkyle ou un radical
alkyle éventuellement substitué par un ou plusieurs radicaux identiques ou
différents choisis parmi les radicaux hydroxyle, alcoxy, hétérocycloalkyle,
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
6
hétéroaryle ou phényle eux-mêmes éventuellement substitués par un ou
plusieurs radicaux choisis parmi les atomes d'halogène et les radicaux
hydroxyle, alkyle, alcoxy, NH2; NHalk et N(alk)2 ; soit R3 et R4 forment avec
l'atome d'azote auquel ils sont liés un radical cyclique renfermant de 3 à 10
chaînons et éventuellement un ou plusieurs autres hétéroatomes choisi(s)
parmi O, S et NH, ce radical y compris l'éventuel NH qu'il contient étant
éventuellement substitué;
les radicaux cycliques que peuvent former R1 et R2 ou R3 et R4
respectivement avec l'atome d'azote auquel ils sont liés, étant éventuellement
substitués par un ou plusieurs radicaux identiques ou différents choisis parmi
les atomes d'halogène, les radicaux hydroxyle, oxo, alcoxy, NH2; NHalk,
N(alk)2, et les radicaux alkyle, cycloalkyle, hétérocycloalkyle, -CO-alkyle, -
CO2AIk, phényle, CH2-phényle et hétéroaryle, tels que dans ces derniers
radicaux les radicaux alkyle, hétérocycloalkyle, phényle et hétéroaryle sont
eux-mêmes éventuellement substitués par un ou plusieurs radicaux choisis
parmi les atomes d'halogène et les radicaux hydroxyle, alkyle et alcoxy
renfermant de 1 à 4 atomes de carbone, NH2; NHalk et N(alk)2 ;
R1, R2, R3 et R4 dans les radicaux -NRICOR2, -COR1, -NR3COR4 et
-COR3 étant choisis parmi les significations indiquées ci-dessus pour R1, R2,
R3 et R4 dans NR1 R2 et NR3R4 lorsque R1 et R2 d'une part et R3 et R4 ne
forment pas un radical cyclique avec l'atome d'azote auquel ils sont liés ;
tous les radicaux alkyle (alk) et alcoxy ci-dessus renfermant de 1 à 6 atomes
de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention concerne notamment les produits de formule (I) dans
laquelle R et Ra représentent tous deux un atome d'hydrogène, n représente
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
7
l'entier 0, 1 ou 2 et les substituants X et Rb sont choisis parmi les
significations indiquées ci-dessus ou ci-après pour ces substituants X et Rb,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention concerne notamment les produits de formule (I) dans
laquelle R représente un atome d'hydrogène, n représente l'entier 0, 1 ou 2 et
les substituants X, Ra et Rb sont choisis parmi les significations indiquées
ci-
dessus ou ci-après pour ces substituants X, Ra et Rb, Ra ne représentant
pas un atome d'hydrogène,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention concerne notamment les produits de formule (I) dans
laquelle Ra représente un atome d'hydrogène, n représente l'entier 0, 1 ou 2
et les substituants X, R et Rb sont choisis parmi les significations indiquées
ci-dessus ou ci-après pour ces substituants X, R et Rb, R ne représentant
pas un atome d'hydrogène,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention concerne notamment les produits de formule (I) dans
laquelle X représente un atome d'hydrogène, n représente l'entier 0, 1 ou 2 et
les substituants R, Ra et Rb sont choisis parmi les significations indiquées
ci-
dessus ou ci-après pour ces substituants R, Ra et Rb,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
8
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention concerne notamment les produits de formule (I) dans
laquelle X représente un atome de fluor, n représente l'entier 0, 1 ou 2 et
les
substituants R, Ra et Rb sont choisis parmi les significations indiquées ci-
dessus ou ci-après pour ces substituants R, Ra et Rb, lesdits produits de
formule (I) étant sous toutes les formes isomères possibles racémiques,
énantiomères et diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques ou avec les bases minérales et organiques
desdits produits de formule (I).
La présente invention a ainsi pour objet les produits de formule (I) tels que
définis ci-dessus dans laquelle
n = 0,1 ou 2;
X représente un atome d'hydrogène, un atome de fluor ou un radical méthyle;
R représente un atome d'hydrogène ou un radical NH2;
Ra représente un atome d'hydrogène; un atome d'halogène; ou un radical -
O-cycloalkyle ; -0-alkyle, -NRd(cycloalkyle) ; -NRd(alkyle) ; aryle; ou
hétéroaryle ; dans tous ces radicaux, les radicaux cycloalkyle ; alkyle, aryle
et
hétéroaryle étant éventuellement substitués comme indiqué ci-après;
Rb représente un atome d'hydrogène, un radical -CO-Rc ou un radical -CO-
N RcRd;
avec Rc représente un radical alkyle, cycloalkyle, hétérocycloalkyle ou aryle,
tous éventuellement substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène, les radicaux hydroxyle, alcoxy, NR1 R2 et les radicaux
alkyle, hétérocycloalkyle, aryle et hétéroaryle, eux-mêmes éventuellement
substitués comme indiqué ci-après ;
Rd représente un atome d'hydrogène ou un radical alkyle;
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
9
tous les radicaux définis ci-dessus alkyle, cycloalkyle, hétérocycloalkyle,
aryle
et hétéroaryle, étant éventuellement substitués par un ou plusieurs radicaux
choisis parmi les atomes d'halogène, et les radicaux hydroxyle, alcoxy, -
NR1 R2, -000H, -COOalk, -CONR1 R2, alkyle et hétérocycloalkyle lui-même
éventuellement substitué par un ou plusieurs radicaux choisis parmi les
atomes d'halogène, et les radicaux hydroxyle, alcoxy, alkyle, COOH, -
000alk, NR3R4 et -CONR3R4 ;
NR1 R2 étant tel que : soit , R1 et R2 étant identiques ou différents, l'un de
R1
et R2 représente un atome d'hydrogène ou un radical alkyle et l'autre de R1
et R2 représente un atome d'hydrogène, un radical CO2alk, un radical
cycloalkyle ou un radical alkyle éventuellement substitué par un ou plusieurs
radicaux identiques ou différents choisis parmi les radicaux hydroxyle,
alcoxy,
NR3R4, hétérocycloalkyle, hétéroaryle ou phényle eux-mêmes
éventuellement substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène et les radicaux hydroxyle, alkyle, alcoxy, NH2; NHalk et
N(alk)2; soit R1 et R2 forment avec l'atome d'azote auquel ils sont liés un
radical cyclique renfermant de 3 à 10 chaînons et éventuellement un ou
plusieurs autres hétéroatomes choisi(s) parmi O, S et NH, ce radical y
compris l'éventuel NH qu'il contient étant éventuellement substitué ,
NR3R4 étant tel que : soit, R3 et R4 étant identiques ou différents, l'un de
R3
et R4 représente un atome d'hydrogène ou un radical alkyle et l'autre de R3
et R4 représente un atome d'hydrogène, un radical cycloalkyle ou un radical
alkyle éventuellement substitué par un ou plusieurs radicaux identiques ou
différents choisis parmi les radicaux hydroxyle, alcoxy, hétérocycloalkyle,
hétéroaryle ou phényle eux-mêmes éventuellement substitués par un ou
plusieurs radicaux choisis parmi les atomes d'halogène et les radicaux
hydroxyle, alkyle, alcoxy, NH2; NHalk et N(alk)2 ; soit R3 et R4 forment avec
l'atome d'azote auquel ils sont liés un radical cyclique renfermant de 3 à 10
chaînons et éventuellement un ou plusieurs autres hétéroatomes choisi(s)
parmi O, S et NH, ce radical y compris l'éventuel NH qu'il contient étant
éventuellement substitué;
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
les radicaux cycliques que peuvent former R1 et R2 ou R3 et R4
respectivement avec l'atome d'azote auquel ils sont liés, étant éventuellement
substitués par un ou plusieurs radicaux identiques ou différents choisis parmi
les atomes d'halogène, les radicaux hydroxyle, oxo, alcoxy, NH2; NHalk,
5 N(alk)2 et les radicaux alkyle, cycloalkyle, hétérocycloalkyle, -CO-alkyle, -
CO2alk, phényle et CH2-phényle, dans lesquels les radicaux alkyle,
hétérocycloalkyle et phényle sont eux-mêmes éventuellement substitués par
un ou plusieurs radicaux identiques ou différents choisis parmi les atomes
d'halogène et les radicaux hydroxyle, alkyle, alcoxy, NH2, NHalk et N(alk)2 ,
10 tous les radicaux alkyle (alk) ou alcoxy ci-dessus renfermant de 1 à 6
atomes
de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention a ainsi pour objet les produits de formule (I) tels que
définis ci-dessus dans laquelle
n=0,1 ou 2
X représente un atome d'hydrogène ou un atome de fluor;
R représente un atome d'hydrogène ou un radical NH2 ;
Ra représente un atome d'hydrogène; un atome d'halogène; un radical -O-
cycloalkyle ; un radical -NH-cycloalkyle ; un radical -NH-alk-phényle ou un
radical phényle, tous ces radicaux cycloalkyle et phényle étant
éventuellement substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène, et les radicaux hydroxyle, alcoxy, -NR1 R2, -000H, -
000alk, -CONR1 R2, alkyle et hétérocycloalkyle eux-mêmes éventuellement
substitués par un ou plusieurs radicaux choisis parmi les atomes d'halogène,
et les radicaux alkyle, COOH, -COOalk et -CONR3R4 ;
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
11
Rb représente un atome d'hydrogène, un radical -CO-Rc ou un radical -CO-
N RcRd;
avec Rc représente un radical alkyle, cycloalkyle, hétérocycloalkyle ou aryle,
tous éventuellement substitués par un ou plusieurs radicaux choisis parmi les
radicaux hydroxyle, alcoxy, NR1 R2, alkyle, hétérocycloalkyle et phényle, ces
derniers radicaux alkyle, hétérocycloalkyle, et phényle étant eux-mêmes
éventuellement substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène et les radicaux hydroxyle, alcoxy, alkyle et NR3R4;
Rd représente un atome d'hydrogène ou un radical alkyle;
NR1 R2 est tel que soit , R1 et R2 étant identiques ou différents, l'un de R1
et
R2 représente un atome d'hydrogène ou un radical alkyle et l'autre de R1 et
R2 représente un atome d'hydrogène, un radical cycloalkyle, un radical
CO2AIk, ou un radical alkyle éventuellement substitué par un ou plusieurs
radicaux identiques ou différents choisis parmi les radicaux hydroxyle,
alcoxy,
NR3R4, ou phényle lui-même éventuellement substitué par un ou plusieurs
radicaux choisis parmi les atomes d'halogène et les radicaux hydroxyle,
alkyle, alcoxy, NH2; NHalk et N(alk)2; soit R1 et R2 forment avec l'atome
d'azote auquel ils sont liés un radical cyclique renfermant de 4 à 7 chaînons
et éventuellement un autre hétéroatome choisi parmi 0, S et NH, ce radical y
compris l'éventuel NH qu'il contient étant éventuellement substitué ;
NR3R4 étant tel que soit R3 et R4 identiques ou différents, représentent un
atome d'hydrogène ou un radical alkyle éventuellement substitué par un ou
plusieurs radicaux identiques ou différents choisis parmi les radicaux
hydroxyle ou alcoxy, soit R3 et R4 forment avec l'atome d'azote auquel ils
sont liés un radical cyclique renfermant de 4 à 7 chaînons et éventuellement
un autre hétéroatome choisi parmi 0, S et NH, ce radical y compris l'éventuel
NH qu'il contient étant éventuellement substitué ;
les radicaux cycliques que peuvent former R1 et R2 ou R3 et R4
respectivement avec l'atome d'azote auquel ils sont liés, étant éventuellement
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
12
substitués par un ou plusieurs radicaux identiques ou différents tels que
définis à l'une quelconque des revendications 1 ou 2 ,
tous les radicaux alkyle (alk) ou alcoxy ci-dessus renfermant de 1 à 4 atomes
de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention a ainsi pour objet les produits de formule (I) tels que
définis ci-dessus dans laquelle
n = 0,1 ou 2
X représente un atome d'hydrogène ou un atome de fluor;
R représente un atome d'hydrogène ou un radical NH2 ;
Ra représente un atome d'hydrogène; un atome d'halogène; un radical -O-
cycloalkyle ; un radical -NH-cycloalkyle ; un radical -NH-alk-phényle ou un
radical phényle, les radicaux phényle étant éventuellement substitués par un
ou plusieurs radicaux choisis parmi les atomes d'halogène et le radical
alkyle;
Rb représente un atome d'hydrogène, un radical -CO-Rc ou un radical -CO-
N RcRd;
avec Rc représente un radical alkyle, cycloalkyle, hétérocycloalkyle ou
phényle, tous éventuellement substitués par un ou plusieurs radicaux choisis
parmi les radicaux hydroxyle, alcoxy, NR1 R2, alkyle et hétérocycloalkyle, ces
derniers radicaux alkyle et hétérocycloalkyle étant eux-mêmes
éventuellement substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène et les radicaux hydroxyle, alcoxy, alkyle et NR3R4;
Rd représente un atome d'hydrogène ;
NR1 R2 étant tel que soit R1 et R2, identiques ou différents, représentent un
atome d'hydrogène ou un radical alkyle éventuellement substitué par un ou
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
13
plusieurs radicaux identiques ou différents choisis parmi les radicaux
hydroxyle, alcoxy, NH2 ; NHalk et N(alk)2 ou bien NR1 R2 représente le
radical -NHCO2alk ; soit R1 et R2 forment avec l'atome d'azote auquel ils
sont liés un radical cyclique renfermant de 4 à 7 chaînons et éventuellement
un autre hétéroatome choisi parmi O, S et NH, éventuellement substitué par
un ou plusieurs radicaux identiques ou différents choisis parmi les radicaux
oxo, NH2; NHalk, N(alk)2 et les radicaux alkyle, cycloalkyle,
hétérocycloalkyle, -CO-alkyle, -CO2alk, phényle et CH2-phényle, dans
lesquels les radicaux alkyle, hétérocycloalkyle et phényle sont eux-mêmes
éventuellement substitués par un ou plusieurs radicaux identiques ou
différents choisis parmi les atomes d'halogène et les radicaux alkyle,
hydroxyle,alcoxy, NH2, NHalk et N(alk)2 ;
NR3R4 étant tel que soit R3 et R4 identiques ou différents, représentent un
atome d'hydrogène ou un radical alkyle éventuellement substitué par un ou
plusieurs radicaux identiques ou différents choisis parmi les radicaux
hydroxyle ou alcoxy, soit R3 et R4 forment avec l'atome d'azote auquel ils
sont liés un radical cyclique renfermant de 4 à 7 chaînons et éventuellement
un autre hétéroatome choisi parmi O, S et NH, ce radical y compris l'éventuel
NH qu'il contient étant éventuellement substitué par un radical alkyle ou
phényle eux-mêmes éventuellement substitués par un ou plusieurs radicaux
identiques ou différents choisis parmi les atomes d'halogène et les radicaux
alkyle, hydroxyle,alcoxy, NH2, NHalk et N(alk)2 ;
tous les radicaux alkyle (alk) ou alcoxy ci-dessus renfermant de 1 à 4 atomes
de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention concerne notamment les produits de formule (I) dans
laquelle X et R représentent tous deux un atome d'hydrogène, n représente
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
14
l'entier 0, et les substituants Ra et Rb sont choisis parmi les significations
indiquées ci-dessus ou ci-après pour ces substituants X et Rb, lesdits
produits de formule (I) étant sous toutes les formes isomères possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention concerne donc les produits de formule (I) suivante ,
S H
/ \ (I)
N N N
N Rb
N\
Ra
dans laquelle Ra et Rb sont choisis parmi les significations indiquées ci-
dessus ou ci-après, lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et diastéréoisomères,
ainsi que les sels d'addition avec les acides minéraux et organiques ou avec
les bases minérales et organiques desdits produits de formule (I).
La présente invention a donc pour objet les produits de formule (I) dans
laquelle :
Ra représente un atome d'hydrogène; un atome d'halogène; un radical aryle;
ou un radical hétéroaryle, ces radicaux aryle et hétéroaryle étant
éventuellement substitués comme indiqué ci-après;
Rb représente un atome d'hydrogène, un radical Rc, -COORc, -CO-Rc ou un
radical -CO-NRcRd;
avec Rc représente un radical alkyle, cycloalkyle, hétérocycloalkyle, aryle et
hétéroaryle, tous ces radicaux étant éventuellement substitués comme
indiqué ci-après;
Rd représente un atome d'hydrogène ou un radical alkyle ou cycloalkyle ;
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
tous les radicaux définis ci-dessus alkyle, cycloalkyle, hétérocycloalkyle,
aryle
et hétéroaryle, étant éventuellement substitués par un ou plusieurs radicaux
choisis parmi les atomes d'halogène; et les radicaux hydroxyle, alcoxy, CN,
CF3, -NR1 R2, -000H, -COOalk, -CON R1 R2 et -NR1 COR2 ;
5 les radicaux alkyle étant de plus éventuellement substitués par un radical
aryle ou hétéroaryle eux-mêmes éventuellement substitués par un ou
plusieurs radicaux choisis parmi les atomes d'halogène et les radicaux
hydroxyle, alkyle, alcoxy et NR3R4 ;
les radicaux cycloalkyle, hétérocycloalkyle, aryle ou hétéroaryle étant de
plus
10 éventuellement substitués par un radical alkyle lui-même éventuellement
substitué par un ou plusieurs radicaux choisis parmi les atomes d'halogène et
les radicaux hydroxyle, alkyle, alcoxy et NR3R4 ,
NR1 R2 étant tel que : soit , R1 et R2 étant identiques ou différents, l'un de
R1
et R2 représente un atome d'hydrogène ou un radical alkyle et l'autre de R1
15 et R2 représente un atome d'hydrogène, un radical cycloalkyle ou un radical
alkyle éventuellement substitué par un ou plusieurs radicaux identiques ou
différents choisis parmi les radicaux hydroxyle, alcoxy, NR3R4,
hétérocycloalkyle, hétéroaryle ou phényle eux-mêmes éventuellement
substitués; soit R1 et R2 forment avec l'atome d'azote auquel ils sont liés un
radical cyclique renfermant de 3 à 10 chaînons et éventuellement un ou
plusieurs autres hétéroatomes choisi(s) parmi O, S, N et NH, ce radical y
compris l'éventuel NH qu'il contient étant éventuellement substitué ,
NR3R4 étant tel que : soit, R3 et R4 étant identiques ou différents, l'un de
R3
et R4 représente un atome d'hydrogène ou un radical alkyle et l'autre de R3
et R4 représente un atome d'hydrogène, un radical cycloalkyle ou un radical
alkyle éventuellement substitué par un ou plusieurs radicaux identiques ou
différents choisis parmi les radicaux hydroxyle, alcoxy, hétérocycloalkyle,
hétéroaryle ou phényle eux-mêmes éventuellement substitués soit R3 et R4
forment avec l'atome d'azote auquel ils sont liés un radical cyclique
renfermant de 3 à 10 chaînons et éventuellement un ou plusieurs autres
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
16
hétéroatomes choisi(s) parmi O, S, N et NH, ce radical y compris l'éventuel
NH qu'il contient étant éventuellement substitué;
les radicaux cycliques que peuvent former R1 et R2 ou R3 et R4
respectivement avec l'atome d'azote auquel ils sont liés, étant éventuellement
substitués par un ou plusieurs radicaux identiques ou différents choisis parmi
les atomes d'halogène, les radicaux hydroxyle, oxo, alcoxy, NH2; NHalk,
N(alk)2, et les radicaux alkyle, phényle, CH2-phényle et hétéroaryle, tels que
dans ces derniers radicaux les radicaux alkyle, phényle et hétéroaryle sont
eux-mêmes éventuellement substitués par un ou plusieurs radicaux choisis
parmi les atomes d'halogène et les radicaux hydroxyle, alkyle et alcoxy
renfermant de 1 à 4 atomes de carbone, NH2; NHalk et N(alk)2 ;
tous les radicaux alkyle (alk) et alcoxy ci-dessus renfermant de 1 à 6 atomes
de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention a ainsi pour objet les produits de formule (I) tels que
définis ci-dessus dans laquelle :
Ra représente un atome d'hydrogène ; un atome d'halogène; ou un radical
aryle ou hétéroaryle, ces radicaux aryle et hétéroaryle étant éventuellement
substitués comme indiqué ci-après;
Rb représente un atome d'hydrogène, un radical -CO-Rc ou un radical -CO-
N RcRd;
avec Rc représente un radical alkyle ou un radical cycloalkyle, tous deux
éventuellement substitués par un ou plusieurs radicaux choisis parmi les
radicaux hydroxyle, alcoxy, NR1 R2, hétérocycloalkyle, aryle et hétéroaryle
eux-mêmes éventuellement substitués comme indiqué ci-après ;
Rd représente un atome d'hydrogène ou un radical alkyle;
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
17
tous les radicaux définis ci-dessus alkyle, cycloalkyle, hétérocycloalkyle,
aryle
et hétéroaryle, étant éventuellement substitués par un ou plusieurs radicaux
choisis parmi les atomes d'halogène, et les radicaux hydroxyle, alcoxy,
-NR1 R2, -000H, -COOalk et -CONR1 R2,
NR1 R2 étant tel que : soit , R1 et R2 étant identiques ou différents, l'un de
R1
et R2 représente un atome d'hydrogène ou un radical alkyle et l'autre de R1
et R2 représente un atome d'hydrogène, un radical cycloalkyle ou un radical
alkyle éventuellement substitué par un ou plusieurs radicaux identiques ou
différents choisis parmi les radicaux hydroxyle, alcoxy, NR3R4,
hétérocycloalkyle, hétéroaryle ou phényle eux-mêmes éventuellement
substitués; soit R1 et R2 forment avec l'atome d'azote auquel ils sont liés un
radical cyclique renfermant de 3 à 10 chaînons et éventuellement un ou
plusieurs autres hétéroatomes choisi(s) parmi O, S, N et NH, ce radical y
compris l'éventuel NH qu'il contient étant éventuellement substitué ,
NR3R4 étant tel que : soit, R3 et R4 étant identiques ou différents, l'un de
R3
et R4 représente un atome d'hydrogène ou un radical alkyle et l'autre de R3
et R4 représente un atome d'hydrogène, un radical cycloalkyle ou un radical
alkyle éventuellement substitué par un ou plusieurs radicaux identiques ou
différents choisis parmi les radicaux hydroxyle, alcoxy, hétérocycloalkyle,
hétéroaryle ou phényle eux-mêmes éventuellement substitués soit R3 et R4
forment avec l'atome d'azote auquel ils sont liés un radical cyclique
renfermant de 3 à 10 chaînons et éventuellement un ou plusieurs autres
hétéroatomes choisi(s) parmi O, S, N et NH, ce radical y compris l'éventuel
NH qu'il contient étant éventuellement substitué;
les radicaux cycliques que peuvent former R1 et R2 ou R3 et R4
respectivement avec l'atome d'azote auquel ils sont liés, étant éventuellement
substitués par un ou plusieurs radicaux identiques ou différents choisis parmi
les atomes d'halogène, les radicaux hydroxyle, alcoxy, et les radicaux alkyle,
phényle et CH2-phényle, dans lesquels les radicaux alkyle ou phényle sont
eux-mêmes éventuellement substitués par un ou plusieurs radicaux
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
18
identiques ou différents choisis parmi les atomes d'halogène et les radicaux
alkyle, hydroxyle, alcoxy . NH2, NHalk et N(alk)2 ;
tous les radicaux alkyle (alk) ou alcoxy ci-dessus renfermant de 1 à 6 atomes
de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention a ainsi pour objet les produits de formule (I) tels que
définis ci-dessus dans laquelle :
Ra représente un atome d'hydrogène ; un atome d'halogène; ou un radical
phényle éventuellement substitué comme indiqué ci-après;
Rb représente un atome d'hydrogène, un radical -CO-Rc ou un radical
-CO-N RcRd;
avec Rc représente un radical alkyle ou cycloalkyle, tous deux
éventuellement substitués par un ou plusieurs radicaux choisis parmi les
radicaux hydroxyle, alcoxy, NR1 R2 et phényle lui-même éventuellement
substitué par un ou plusieurs radicaux choisis parmi les atomes d'halogène,
les radicaux hydroxyle, alcoxy, alkyle, NH2, NHalk et N(alk)2 ;
Rd représente un atome d'hydrogène ou un radical alkyle;
NR1 R2 est tel que soit , R1 et R2 étant identiques ou différents, l'un de R1
et
R2 représente un atome d'hydrogène ou un radical alkyle et l'autre de R1 et
R2 représente un atome d'hydrogène, un radical cycloalkyle ou un radical
alkyle éventuellement substitué par un ou plusieurs radicaux identiques ou
différents choisis parmi les radicaux hydroxyle, alcoxy, NR3R4, ou phényle
eux-mêmes éventuellement substitués; soit R1 et R2 forment avec l'atome
d'azote auquel ils sont liés un radical cyclique renfermant de 4 à 7 chaînons
et éventuellement un autre hétéroatome choisi parmi 0, S, N et NH, ce
radical y compris l'éventuel NH qu'il contient étant éventuellement substitué
,
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
19
NR3R4 étant tel que soit R3 et R4 identiques ou différents, représentent un
atome d'hydrogène ou un radical alkyle éventuellement substitué par un ou
plusieurs radicaux identiques ou différents choisis parmi les radicaux
hydroxyle ou alcoxy, soit R3 et R4 forment avec l'atome d'azote auquel ils
sont liés un radical cyclique renfermant de 4 à 7 chaînons et éventuellement
un autre hétéroatome choisi parmi O, S, N et NH, ce radical y compris
l'éventuel NH qu'il contient étant éventuellement substitué ,
les radicaux cycliques que peuvent former R1 et R2 ou R3 et R4
respectivement avec l'atome d'azote auquel ils sont liés, étant éventuellement
substitués par un ou plusieurs radicaux identiques ou différents tels que
définis à l'une quelconque des revendications 1 ou 2 ,
tous les radicaux alkyle (alk) ou alcoxy ci-dessus renfermant de 1 à 4 atomes
de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention a ainsi pour objet les produits de formule (I) tels que
définis ci-dessus dans laquelle :
Ra représente un atome d'hydrogène ; un atome d'halogène; ou un radical
phényle éventuellement substitué par un atome d'halogène ;
Rb représente un atome d'hydrogène, un radical -CO-Rc ou un radical -CO-
N RcRd;
avec Rc représente un radical alkyle ou cycloalkyle éventuellement substitués
par un ou plusieurs radicaux choisis parmi les radicaux hydroxyle, alcoxy et
NR1 R2;
Rd représente un atome d'hydrogène ;
NR1 R2 étant tel que soit R1 et R2, identiques ou différents, représentent un
atome d'hydrogène ou un radical alkyle éventuellement substitué par un ou
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
plusieurs radicaux identiques ou différents choisis parmi les radicaux
hydroxyle, alcoxy, NH2 ; NHalk et N(alk)2 soit R1 et R2 forment avec l'atome
d'azote auquel ils sont liés un radical cyclique renfermant de 4 à 7 chaînons
et éventuellement un autres hétéroatomes choisi(s) parmi O, S, N et NH,
5 éventuellement substitué par un radical alkyle, phényle ou -CH2-phényle, ces
derniers radicaux étant eux-mêmes éventuellement substitués par un ou
plusieurs radicaux identiques ou différents choisis parmi les atomes
d'halogène et les radicaux alkyle, hydroxyle, alcoxy,. NH2, NHalk et N(alk)2 ;
tous les radicaux alkyle (alk) ou alcoxy ci-dessus renfermant de 1 à 4 atomes
10 de carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
15 Dans les produits de formule (I) et dans ce qui suit :
- le terme radical alkyle (ou alk) désigne les radicaux, linéaires et le cas
échéant ramifiés, méthyle, éthyle, propyle, isopropyle, butyle, isobutyle, sec-
butyle, tert-butyle, pentyle, isopentyle, hexyle, isohexyle et également
heptyle, octyle, nonyle et décyle ainsi que leurs isomères de position
linéaires
20 ou ramifiés : on préfère les radicaux alkyles renfermant de 1 à 6 atomes de
carbone et plus particulièrement les radicaux alkyle renfermant de 1 à 4
atomes de carbone de la liste ci-dessus ;
- le terme radical alcoxy désigne les radicaux linéaires et le cas échéant
ramifiés, méthoxy, éthoxy, propoxy, isopropoxy, butoxy linéaire, secondaire
ou tertiaire, pentoxy ou hexoxy ainsi que leurs isomères de position linéaires
ou ramifiés : on préfère les radicaux alkoxy renfermant de 1 à 4 atomes de
carbone de la liste ci-dessus ,
- le terme atome d'halogène désigne les atomes de chlore, de brome, d'iode
ou de fluor et de préférence l'atome de chlore, de brome ou de fluor.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
21
- le terme radical cycloalkyle désigne un radical carbocyclique saturé
renfermant 3 à 10 atomes de carbone et désigne ainsi notamment les
radicaux cyclopropyle, cyclobutyle, cyclopentyle et cyclohexyle et tout
particulièrement les radicaux cyclopropyl, cyclopentyle et cyclohexyle ;
- le terme radical hétérocycloalkyle désigne ainsi un radical carbocyclique
monocyclique ou bicyclique, renfermant de 3 à 10 chaînons interrompu par
un ou plusieurs hétéroatomes, identiques ou différents, choisis parmi les
atomes d'oxygène, d'azote ou de soufre : on peut citer par exemple les
radicaux morpholinyle, thiomorpholinyle, homomorpholinyle, aziridyle,
azétidyle, pipérazinyle, pipéridyle, homopipérazinyle, pyrrolidinyle,
imidazolidinyle, pyrazolidinyle, tétrahydrofuryle, tétrahydrothiényle,
tetrahydropyranne, oxodihydropyridazinyle, ou encore oxétanyle tous ces
radicaux étant éventuellement substitués ; on peut citer notamment les
radicaux morpholinyle, thiomorpholinyle, homomorpholinyle, pipérazinyle,
pipéridyle, homopipérazinyle ou encore pyrrolidinyle,
- les termes aryle et hétéroaryle désignent des radicaux insaturés ou
partiellement insaturés, respectivement carbocycliques et hétérocycliques,
monocycliques ou bicycliques, renfermant au plus 12 chaînons, pouvant
éventuellement contenir un chaînon -C(O), les radicaux hétérocycliques
contenant un ou plusieurs hétéroatomes identiques ou différents choisis
parmi O, N, ou S avec N, le cas échéant, éventuellement substitué ;
- le terme radical aryle désigne ainsi des radicaux monocycliques ou
bicycliques renfermant 6 à 12 chaînons tels que par exemple les radicaux
phényle, naphtyle, biphényle, indényle, fluorényle et anthracényle, plus
particulièrement les radicaux phényle et naphtyle et encore plus
particulièrement le radical phényle. On peut noter qu'un radical carbocyclique
contenant un chaînon -C(O) est par exemple le radical tétralone ;
- le terme radical hétéroaryle désigne ainsi des radicaux monocycliques ou
bicycliques renfermant 5 à 12 chaînons : des radicaux hétéroaryles
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
22
monocycliques tels que par exemple les radicaux thiényle tel que 2-thiényle
et 3-thiényle, furyle tel que 2-furyle, 3-furyle, pyrannyle, pyrrolyle,
pyrrolinyle,
pyrazolinyle, imidazolyle, pyrazolyle, pyridyle tel que 2-pyridyle, 3-pyridyle
et
4-pyridyle, pyrazinyle, pyrimidinyle, pyridazinyle, oxazolyle, thiazolyle,
isothiazolyle, diazolyle, thiadiazolyle, thiatriazolyle, oxadiazolyle,
isoxazolyle
tel que 3- ou 4-isoxazolyle, furazannyle, tétrazolyle libre ou salifié, tous
ces
radicaux étant éventuellement substitués parmi lesquels plus
particulièrement les radicaux thiényle tel que 2-thiényle et 3-thiényle,
furyle tel
que 2-furyle, pyrrolyle, pyrrolinyle, pyrazolinyle, imidazolyle, pyrazolyle,
oxazolyle, isoxazolyle, pyridyle, pyridazinyle, ces radicaux étant
éventuellement substitués ; des radicaux hétéroaryles bicycliques tels que
par exemple les radicaux benzothiényle tel que 3-benzothiényle,
benzothiazolyle, quinolyle, isoquinolyle, dihydroquinolyle, quinolone,
tétralone, adamentyl, benzofuryle, isobenzofuryle, dihydrobenzofuranne,
éthylènedioxyphényle, thianthrényle, benzopyrrolyle, benzimidazolyle,
benzoxazolyle, thionaphtyle, indolyle, azaindolyle, indazolyle, purinyle,
th iénopyrazolyle, tétrahydroindazolyle, tétrahydrocyclopentapyrazolyle,
dihydrofuropyrazolyle, tétrahydropyrrolopyrazolyle,
oxotétrahydropyrrolopyrazolyle, tétrahydropyranopyrazolyle,
tétrahydropyridinopyrazolyle, oxodihydropyridino-pyrazolyle, ou
dihydroimidazo[1,2-a]pyrazine, tous ces radicaux étant éventuellement
substitués ,
Comme exemples de radicaux hétéroaryles ou bicycliques, on peut citer plus
particulièrement les radicaux pyrimidinyle, pyridyle, pyrrolyle, azaindolyle,
indazolyle ou pyrazolyle, benzothiazolyle ou benzimidazolyle éventuellement
substitués par un ou plusieurs substituants identiques ou différents comme
indiqué ci-dessus.
Le ou les radicaux carboxy des produits de formule (I) peuvent être salifiés
ou
estérifiés par les groupements divers connus de l'homme du métier parmi
lesquels on peut citer, par exemple :
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
23
- parmi les composés de salification, des bases minérales telles que, par
exemple, un équivalent de sodium, de potassium, de lithium, de calcium, de
magnésium ou d'ammonium ou des bases organiques telles que, par
exemple, la méthylamine, la propylamine, la triméthylamine, la diéthylamine,
la triéthylamine, la N,N-diméthyléthanolamine, le tris (hydroxyméthyl) amino
méthane, l'éthanolamine, la pyridine, la picoline, la dicyclohexylamine, la
morpholine, la benzylamine, la procaïne, la lysine, l'arginine, l'histidine,
la
N-méthylglucamine,
- parmi les composés d'estérification, les radicaux alkyle pour former des
groupes alcoxy carbonyle tel que, par exemple, méthoxycarbonyle,
éthoxycarbonyle, tert-butoxycarbonyle ou benzyloxycarbonyle, ces radicaux
alkyles pouvant être substitués par des radicaux choisis par exemple parmi
les atomes d'halogène, les radicaux hydroxyle, alcoxy, acyle, acyloxy,
alkylthio, amino ou aryle comme, par exemple, dans les groupements
chlorométhyle, hydroxypropyle, méthoxyméthyle, propionyloxyméthyle,
méthylthiométhyle, diméthylaminoéthyle, benzyle ou phénéthyle.
Les sels d'addition avec les acides minéraux ou organiques des
produits de formule (I) peuvent être, par exemple, les sels formés avec les
acides chlorhydrique, bromhydrique, iodhydrique, nitrique, sulfurique,
phosphorique, propionique, acétique, trifluoroacétique, formique, benzoïque,
maléique, fumarique, succinique, tartrique, citrique, oxalique, glyoxylique,
aspartique, ascorbique, les acides alcoylmonosulfoniques tels que par
exemple l'acide méthanesulfonique, l'acide éthanesulfonique, l'acide
propanesulfonique, les acides alcoyldisulfoniques tels que par exemple
l'acide méthanedisulfonique, l'acide alpha, bêta-éthanedisulfonique, les
acides arylmonosulfoniques tels que l'acide benzènesulfonique et les acides
aryldisulfoniques.
On peut rappeler que la stéréoisomérie peut être définie dans son
sens large comme l'isomérie de composés ayant mêmes formules
développées, mais dont les différents groupes sont disposés différemment
dans l'espace, tels que notamment dans des cyclohexanes monosubstitués
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
24
dont le substituant peut être en position axiale ou équatoriale, et les
différentes conformations rotationnelles possibles des dérivés de l'éthane.
Cependant, il existe un autre type de stéréoisomérie, dû aux arrangements
spatiaux différents de substituants fixés, soit sur des doubles liaisons, soit
sur
des cycles, que l'on appelle souvent isomérie géométrique ou isomérie cis-
trans. Le terme stéréoisomères est utilisé dans la présente demande dans
son sens le plus large et concerne donc l'ensemble des composés indiqués
ci-dessus.
Lorsque NR1 R2 ou NR3R4 forme un cycle comme défini ci-dessus, un tel
cycle aminé peut être choisi notamment parmi les radicaux azétidinyle,
pyrrolidinyle, pyrazolidinyle, pyrazolinyle, pipéridyle, azépinyle,
morpholinyle,
homomorpholinyle, pipérazinyle ou homopipérazinyle, ces radicaux étant eux-
mêmes éventuellement substitués comme indiqué ci-dessus ou ci-après : par
exemple par un ou plusieurs radicaux identiques ou différents choisis parmi
les atomes d'halogène et les radicaux alkyle, hydroxyle, alcoxy, phényle et
CH2-phényle, les radicaux alkyle ou phényle étant eux-mêmes
éventuellement substitués par un ou plusieurs radicaux identiques ou
différents choisis parmi les atomes d'halogène et les radicaux alkyle,
hydroxyle, alcoxy, NH2, NHalk et N(alk)2.
Le cycle NR1 R2 ou NR3R4 peut plus particulièrement être choisi parmi les
radicaux pyrrolidinyle, morpholino éventuellement substitué par un ou deux
radicaux alkyle ou pipérazinyle éventuellement substitué sur le second atome
d'azote par un radical alkyle, phényle et CH2-phényle, eux-mêmes
éventuellement substitués par un ou plusieurs radicaux identiques ou
différents choisis parmi les atomes d'halogène et les radicaux alkyle,
hydroxyle et alcoxy.
La présente invention a plus particulièrement pour objet les produits de
formule (I) tels que définis ci-dessus dans laquelle
n = 0,1 ou 2
X représente un atome d'hydrogène ou un atome de fluor;
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
R représente un atome d'hydrogène ou un radical NH2 ;
Ra représente un atome d'hydrogène; ou un radical -O-cycloalkyle ; un
radical -NH-cycloalkyle ; un radical -NH-alk-phényle ou un radical phényle,
les
radicaux phényle étant éventuellement substitués par un atome d'halogène;
5 Rb représente un atome d'hydrogène, un radical -CO-Rc ou un radical -CO-
N RcRd;
avec Rc représente un radical cycloalkyle éventuellement substitué par un
radical alkyle lui-même éventuellement substitué par un radical morpholino;
un radical hétérocycloalkyle éventuellement substitué par un radical alkyle ,
10 un radical phényle ; ou un radical alkyle substitué par un radical alcoxy,
NR1 R2 ou hétérocycloalkyle lui-même éventuellement substitué par un ou
plusieurs radicaux choisis parmi les atomes d'halogène et les radicaux alkyle;
Rd représente un atome d'hydrogène ,
NR1 R2 étant tel que soit R1 et R2, identiques ou différents, représentent un
15 atome d'hydrogène ou un radical alkyle ou bien NR1 R2 représente le radical
-
NHCO2alk ; soit R1 et R2 forment avec l'atome d'azote auquel ils sont liés un
radical cyclique renfermant de 4 à 7 chaînons et éventuellement un autre
hétéroatome choisi parmi 0, S, N et NH, éventuellement substitué par un ou
plusieurs radicaux identiques ou différents choisis parmi les radicaux oxo,
20 NH2, NHalk, N(alk)2 et les radicaux alkyle, cycloalkyle, hétérocycloalkyle,
-
CO-alkyle, -CO2alk, phényle et CH2-phényle, dans lesquels les radicaux
alkyle, hétérocycloalkyle et phényle sont eux-mêmes éventuellement
substitués par un ou plusieurs radicaux identiques ou différents choisis parmi
les atomes d'halogène et les radicaux alkyle, hydroxyle,alcoxy, NH2, NHalk et
25 N(alk)2 ,
les radicaux alkyle ou alcoxy ci-dessus renfermant de 1 à 4 atomes de
carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
26
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention a ainsi pour objet les produits de formule (I) tels que
définis ci-dessus dans laquelle :
Ra représente un atome d'hydrogène ;
Rb représente un atome d'hydrogène, un radical CO-Rc ou un radical -CO-
N RcRd;
avec Rc représente un radical cyclopropyle ou un radical alkyle
éventuellement substitué par un radical alcoxy ou NR1 R2;
Rd représente un atome d'hydrogène ,
NR1 R2 étant tel que soit R1 et R2 identiques ou différents, représentent un
atome d'hydrogène ou un radical alkyle soit R1 et R2 forment avec l'atome
d'azote auquel ils sont liés un radical morpholinyle;
les radicaux alkyle ou alcoxy ci-dessus renfermant de 1 à 4 atomes de
carbone,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréoisomères, ainsi que les sels d'addition
avec les acides minéraux et organiques ou avec les bases minérales et
organiques desdits produits de formule (I).
La présente invention a tout particulièrement pour objet les produits de
formule (I) tels que définis ci-dessus répondant aux formules suivantes :
- 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-amine
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]acétamide
- 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-[2-
(morphol in-4-yl)éthyl]urée
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
27
- 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-[2-
(pyrrolidin-1-yl)éthyl]urée
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfinyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfonyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
(pyrrolidin-1-yl)propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]benzamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-
méthylpipérazin-1-yl)acétamide
- (2-{[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]amino}-2-oxoéthyl)carbamate de 2-méthylpropan-2-yle
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]glycinamide, dichlorhydrate.
- (trans A)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]-2-(morpholin-4-ylméthyl)cyclopropanecarboxamide
- (trans B)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]-2-(morpholin-4-ylméthyl)cyclopropanecarboxamide
- 2-(4-éthylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]acétamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2,N2-diéthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]glycinamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
28
- 5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
amine
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
méthoxypropanam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-
méthyl-3-oxopipérazin-1-yl)acétamide
- N-{6-[(7-aminoimidazo[1,2-a]pyrimidin-3-yl)sulfanyl]-1,3-benzothiazol-
2-yl}cyclopropanecarboxam ide
- N-(6-{[6-(3-fluorophényl)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-
benzothiazol-2-yl)cyclopropanecarboxamide
- N-(6-{[6-(cyclohexyloxy)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-
benzoth iazol-2-yl)cyclopropanecarboxamide
- 3-[(2-amino-1,3-benzothiazol-6-yl)sulfanyl]-N-cyclohexylimidazo[1,2-
a]pyrimidin-6-amine
- N-(6-{[6-(benzylamino)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-
benzoth iazol-2-yl)cyclopropanecarboxamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]tétrahyd ro-2H-pyran-4-carboxam ide
ainsi que les sels d'addition avec les acides minéraux et organiques ou avec
les bases minérales et organiques desdits produits de formule (I).
La présente invention concerne également les produits de formule (I)
suivants :
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
(morpholin-4-yl)propanam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(morpholin-4-yl)acétam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-(4-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
29
méthylpipérazin-1-yl)propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(propan-2-yl)pipérazin-1-yl]acétamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2-éthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]glycinamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl] propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-
méthyl-1,4-diazépan-1-yl)acétamide
- 2-(4-éthyl-1,4-diazépan-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-[4-
(2,2,2-trifluoroéthyl)pipérazin-1-yl]propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(2,2,2-trifluoroéthyl)pipérazin-1-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(1-
méthylpipérid in-4-yl)acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-(1-
méthylpipérid in-4-yl)propanamide
- 2-(3-fluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 3-(3-fluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- 2-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
- 3-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-1-
méthylazétidine-3-carboxamide
5 - 2-(3,5-diméthylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(3,4,5-triméthylpipérazin-1-yl)acétamide
- 3-(3,5-diméthylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
10 ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
(3,4,5-triméthylpipérazin-1-yl)propanamide
- 3-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
15 - 2-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-cyclohexylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
20 (tétrahydro-2H-pyran-4-yl)pipérazin-1-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(4-méthyltétrahydro-2H-pyran-4-yl)pipérazin-1-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(2-méthylpropan-2-yl)pipérazin-1-yl]acétamide
25 - 2-[4-(diéthylamino)pipéridin-1-yl]-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
31
- 2-[3-(diéthylamino)pyrrolidin-1-yl]-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-acétylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-
1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(2-méthoxyéthyl)pipérazin-1-yl]acétamide
- 2-[4-(2-hydroxyéthyl)pipérazin-1-yl]-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 4-(2-{[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]amino}-2-oxoéthyl)pipérazine-1-carboxylate de méthyle
- 2-[4-(N,N-diméthylglycyl)pipérazin-1-yl]-N-[6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2,N2-diéthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]glycinamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(tétra h yd ropyra n-4-yl )acéta m ide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-(4-méthyl-1,4-diazépan-1-yl)acétamide
- 2-(4-éthyl-1,4-diazépan-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-(4-méthylpipérazin-1-yl)propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-[4-(2,2,2-trifluoroéthyl)pipérazin-1-yl]propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2,2,2-trifluoroéthyl)pipérazin-1-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
32
yl]-2-(1-méthylpipéridin-4-yl)acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-(1-méthylpipéridin-4-yl)propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-(3-fluoro-1-méthylpipéridin-4-yl)acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-(3-fluoro-1-méthylpipéridin-4-yl)propanamide
- 2-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 3-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-1-méthylazétidine-3-carboxamide
- 2-(3,5-diméthylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-(3,4,5-triméthylpipérazin-1-yl)acétamide
- 3-(3,5-diméthylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-(3,4,5-triméthylpipérazin-1-yl)propanamide
- 3-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[5-fluoro-6-
(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]propanamide
- 2-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[5-fluoro-6-
(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-cyclohexylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
33
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(tétrahydro-2H-pyran-4-yl)pipérazin-1-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(4-méthyltétrahydro-2H-pyran-4-yl)pipérazin-1 -yl]acétam ide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2-méthylpropan-2-yl)pipérazin-1-yl]acétamide
- 2-[4-(diéthylamino)pipéridin-1-yl]-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-[3-(diéthylamino)pyrrolidin-1-yl]-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-acétylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2-méthoxyéthyl)pipérazin-1-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2-hydroxyéthyl)pipérazin-1-yl]acétamide
- 4-(2-{[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yI]amino}-2-oxoéthyl)pipérazine-1-carboxylate de
méthyle
- 2-[4-(N,N-diméthylglycyl)pipérazin-1-yl]-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2,N2-diéthyl-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]g lyci namide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
34
yl]-2-[4-(propan-2-yl)pipérazin-1 -yl]acétamide
ainsi que les sels d'addition avec les acides minéraux et organiques ou avec
les bases minérales et organiques desdits produits de formule (I).
La présente invention a encore pour objet tout procédé de préparation des
produits de formule (I) tels que définis ci-dessus.
Les produits selon l'invention peuvent être préparés à partir de méthodes
conventionnelles de chimie organique.
Préparation de composés de formule (I)
Les schémas 1, 2 et 3 ci-dessous sont illustratifs des méthodes utilisées pour
la préparation des produits de formule (I). A ce titre, ils ne sauraient
constituer
une limitation de la portée de l'invention, en ce qui concerne les méthodes de
préparation des composés revendiqués.
Les produits de formule (I) tels que définis ci-dessus selon la présente
invention peuvent ainsi notamment être préparés selon le procédé décrit dans
les schémas 1, 2 et 3 ci-dessous.
La présente invention a ainsi également pour objet le procédé de préparation
de produits de formule (I) selon le schéma 1 tel que défini ci-après.
La présente invention a ainsi également pour objet le procédé de préparation
de produits de formule (I) selon le schéma 2 tel que défini ci-après.
La présente invention a ainsi également pour objet le procédé de préparation
de produits de formule (I) selon le schéma 3 tel que défini ci-après.
Schéma 1 :
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
S s
N, ,Br Hs couplage N~ hydrolyse N1
N + N NH N NHZ
N ~ NH N\ / 1
Ra 0 R Ra
Ra R
(A) (B) (0)
S S H S S
N ~Nfonctionnalisation N __NHz cyclisation
N N Rb N N
Ra
R Ra R
(I) (I)
Rb=H
X=H
X
n=0 =H
n=0
Dans le schéma 1 ci-dessus, les substituants Ra, Rb et R ont les
significations indiquées ci-dessus, X = H et n = 0.
Les composés (I) pour lesquels Ra, Rb, R et X ont les mêmes significations
5 et n = 0 peuvent être obtenus à partir des composés (I) pour lesquels Rb =
H.
Rc-COCI
\ S S S \ S H
N ~NHZ Rc-CO-O-CO-Rc N ~N
N/ X N N/ X N ~Rc
R Ra Rc-000H R Ra
(I) (I)
Rb = H Rb = CORc
n=0 n=0
Plus particulièrement, les composés (I) pour lesquels Rb = CORc (avec Rc
comme défini ci-dessus) peuvent être obtenus, par exemple :
- par réaction d'un chlorure d'acide de formule Rc-000I en présence, par
10 exemple, d'un solvant comme la pyridine à une température voisine de
2000,
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
36
- par réaction d'un anhydride d'acide de formule Rc-CO-O-CO-Rc, en
présence, par exemple d'un solvant comme la pyridine à une température
voisine de 20 0,
par réaction avec un acide carboxylique de formule Rc-000H dans les
conditions, par exemple, décrites par D. DesMarteau et coll., (Chem. Lett.,
2000, 9, 1052) en présence de 1-hydroxybenzotriazole et de 1-(3-
diméthylaminopropyl)-3-éthylcarbodiim ide et en présence d'une base telle la
triéthylamine, à une température comprise entre 20 C et la température du
reflux du solvant.
S
S S \ S H
N1 I/ N>_NH2 Rc-O-COX' N \ I I/ N~N 0
X N\ X O \Rc
Ra Ra
R R
(I) (I)
Rb = H Rb = CO-O-Rc
n=0 n=0
Plus particulièrement, les composés (I) pour lesquels Rb = CO-O-Rc (avec
Rc comme défini ci-dessus) peuvent être obtenus, par exemple, par réaction
avec un chlorocarbonate Rc-O-COX (X = CI) sur les composés (I) pour
lesquels Rb = H, dans un solvant tel le tétrahydrofurane, en présence d'une
base telle l'hydrogénocarbonate de sodium, ou dans la pyridine, à une
température voisine de 20 C.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
37
S S S S H
N~ />-NHZ Rw-O-COX' N />-N (D)
X N ~ ~ X N ~0~
N / N 0 Rw
Ra Ra
R R
(I)
Rb=H
n = 0 Rc(Rd)NH
S S
N DCCN /N Rd
X N\
N / 0 Rc
Ra
R
(I)
Rb = CON(Rc)Rd
n=0
Plus particulièrement, les composés (I) pour lesquels Rb = CON(Rc)Rd (avec
Rc et Rd comme définis ci-dessus) peuvent être obtenus, par exemple, par
réaction des carbamates (D) où Rw = phényl, avec des amines Rc(Rd)NH
(avec Rc et Rd tels que définis ci-dessus) en présence d'un solvant aprotique
tel le tétrahydrofurane, à une température voisine de 20 C.
Les carbamates (D) peuvent être obtenus, par exemple, par réaction avec un
chlorocarbonate Rw-O-COX (X = CI) sur les composés (I) pour lesquels Rb
= H, dans un solvant tel le tétrahydrofurane, en présence d'une base telle
l'hydrogénocarbonate de sodium, ou dans la pyridine, à une température
voisine de 20 C.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
38
S S Rc
S S H RcX N~ />
N N ,N N N N -0
N ~ ~ 0 Rw N ~ 0 Rw
Ra
R Ra (D) R (E)
déprotection
-S S S Rc
N 1 ~NH
,N z N H
- C / X" N N X N
N N
R Ra Ra
Rb=H Rb=Rc
n=0 n=0
Plus particulièrement, les composés (I) pour lesquels Rb = Rc (avec Rc
comme défini ci-dessus) peuvent être obtenus, par exemple
- par déprotection des carbamates (E) avec Rw = t-Butyl selon une
méthode usuelle pour l'homme de métier, par exemple avec de l'acide
trifluoroacétique, dans un solvant comme le dichlorométhane à une
température voisine de 20 C
- à partir des composés (I) pour lesquels Rb = H par application des
méthodes décrites dans le brevet EP 0408437 ou par R. A Glennon et
coll. (Journal of Medicinal Chemistry, 1981, 24, 766-769).
Les carbamates (E) peuvent être obtenus, par exemple, par réaction des
carbamates (D) où Rw = t-butyl, avec des halogénures Rc-X' (avec Rc tel que
défini ci-dessus) en présence d'un solvant comme la N,N-diméthylformamide,
en présence d'une base comme l'hydrure de sodium, à une température
comprise entre 20 C et 90 C
Les composés (I) pour lesquels Rb = H peuvent être obtenus par cyclisation
des composés (C) selon une méthode usuelle pour l'homme de métier, par
exemple par application des méthodes décrites par H. Masaichi et coll.
(Journal of Medicinal Chemistry, 2007, 50(18), 4453-4470), par réaction du
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
39
thiocyanate de potassium et du brome en présence d'acide comme l'acide
acétique à une température comprise entre 20 C et la température de reflux
du solvant.
Les composés (C) peuvent être obtenus par hydrolyse de la fonction
acétamide des composés (B) selon une méthode usuelle pour l'homme de
métier, par exemple à l'aide d'acide comme l'acide chlorhydrique, dans un
solvant comme l'éthanol, à une température comprise entre 20 C et le reflux
du solvant.
Les composés (B) peuvent être obtenus par couplage des composés (A)
avec Ra et R tels que définis ci-dessus avec le N-(4-
sulfanylphényl)acétam ide (produit commercial) dans les conditions décrites
par exemple par R. Varala et coll. (Chemistry Letters, 2004, 33(12), 1614-
1615), par M. Winn et coll. (Journal of Medicinal Chemistry, 2001, 44, 4393-
4403) en présence d'une base comme par exemple le carbonate de
potassium dans un solvant comme le diméthylsulfoxide à une température
comprise entre 20 C et la température de reflux du solvant. De telles
réactions peuvent également être réalisées sous irradiation microondes.
Les composés (B) peuvent également être obtenus par couplage des
composés (A) comme décrit ci-dessus avec d'autres dérivés de 4-
aminothiophénol comme des dérivés (4-NHR')Ph-SH ou la fonction amine est
libre ((4-NH2)Ph-SH, produit commercial) ou protégée par un groupement t-
Butyloxycarbonyl par exemple ((4-NHCO2tBu)Ph-SH, produit connu).
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
(A4)
H 2 NYN H2N N
N X B(OH)2
R R
X=Br
Ra-B(OH)2
ou Ra-X
Ra-B(OR)2
H2N\ /N CICH2CHO N
N ,N
(AZ) Ni Ra N
R ~Ra
R bromation
CICH2CHO Ra-B(OH)2 (Al)
ou Ra = aryle, hétéroaryle
Ra-B(OR)2
Br
N N~ N
\_ N KOH / alkylation ' -N bromation N
(A3) N~ Nr
R
gr R Ra R Ra
(Al) (A)
Ra = 0-cycloalkyle; 0-alkyle
0-aryle; 0-hétéroaryle
bromation
amination
-N
N
Ra
R
(Al)
Ra = NRd(cycloalkyle); NRd(alkyle)
NRc(aryle); NRd(hétéroaryle)
Les composés (A) sont soit commerciaux, soit préparés par bromation des
composés (Al), selon une méthode usuelle pour l'homme de métier, par
exemple selon les conditions décrites par S. C. Goodacre et coll., (Journal of
5 Medicinal Chemistry, 2006, 49(1) 35-38), à l'aide de brome ou de N-
bromosuccinimide dans un solvant comme l'éthanol ou le chloroforme, à une
température comprise entre 200C et le reflux du solvant.
Les composés (Al) sont soit commerciaux, soit peuvent être obtenus selon
une méthode usuelle pour l'homme de métier,par exemple par cyclisation des
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
41
composés 2-aminopyrimidines (A2) avec le choroacétaldéhyde comme décrit
par exemple par Y. Rival et coll. (European Journal of Medicinal Chemistry,
1991, 26, 13-18), en présence d'une base comme l'hydrogénocarbonate de
sodium, dans un solvant comme l'éthanol à une température comprise entre
20 C et la température du solvant.
Plus particulièrement, les composés (Al) pour lesquels Ra représente un
radical aryle ou hétéroaryle peuvent être obtenus à partir des composés (A3)
par réaction de couplage avec des acides boroniques Ra-B(OH)2 ou des
esters boroniques Ra-B(OR)2 en présence de palladium
tétrakistriphénylphosphine, de carbonate de sodium dans un solvant tel, par
exemple, la N,N-diméthylformamide, à une température voisine de 150 C
sous irradiation microondes.
Plus particulièrement, les composés (Al) pour lesquels Ra représente un
radical O-cycloalkyle ; -0-alkyle, -0-aryle et -0-hétéroaryle peuvent être
obtenus par traitement des composés (A3) avec une base comme par
exemple de la potasse et d'un halogénure de cycloalkyle ; d'alkyle, d'aryle et
d'hétéroaryle respectivement dans un solvant tel, par exemple, l'éthanol, à
une température voisine de 135 C sous irradiation microondes.
Plus particulièrement, les composés (Al) pour lesquels Ra représente un
radical NRd(cycloalkyle) ; -NRd(alkyle) ; -NRd(aryle) ; et -
NRd(hétéroaryle) peuvent être obtenus par amination des composés (A3)
dans un solvant tel, par exemple, l'acétonitrile, à une température voisine de
120 C sous irradiation microondes.
Les composés (A2) sont soit commerciaux, soit peuvent être obtenus selon
une méthode usuelle pour l'homme de métier.
Plus particulièrement, les composés (A2) pour lesquels Ra représente un
radical aryle ou hétéroaryle et R = H peuvent être obtenus par exemple
- à partir des 2-amino-5-halogénopyrimidines (produits commerciaux) par
réaction de couplage avec des acides boroniques Ra-B(OH)2 ou des
esters boroniques Ra-B(OR)2 par application des méthodes décrites par
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
42
Y. Gong et coll. (Synlett, 2000, 6, 829-831) ou M. Berlin et coll.
(Bioorganic & Medicinal Chemistry Letters, 2006, 16, 989-994)
- à partir de l'acide 5-(2-aminopyrimidine) boronique (produit commercial)
par réaction de couplage avec des composés commerciaux Ra-X (X = I,
CI, Br) par application des méthodes décrites par K. M. Clapham et coll.
(European Journal of Organic Chemistry, 2007, 34, 5712-5716).
Les composés (A3) sont soit commerciaux (R = H), soit peuvent être obtenus
selon une méthode usuelle pour l'homme de métier, par exemple par
cyclisation des composés 2-aminopyrimidines (A4) commerciaux ou connus
avec le choroacétaldéhyde comme décrit ci-dessus.
Schéma 2
YBr
N\
N
N\ ~Ra (A) S S H
~S S H réduction HS S H N I ~N
N N ~N R N X N Rc
N Rc X X N Rc N 0
0 couplage
(K) (L) R Ra Rb (')
Rc-COCI n = 0
ou
Rc-CO-O-CO-Rc Br
ou
Rc-COOH N \ _N
N (A) S S
N/ />,NH,
S aS réduction HS ~ S :oupiage
N
~NH2 />NH, N Ra (I )
(J) (M) R Rb H
n=0
Rw-O-CO-X'
~Br
N
S ~ S H N (A)
N
N / A couplage
X N %%0\ Ra
0 Rw R
(F)
Rc(Rd)NH /Y Br
N~
~N
N~ (A)
S S
H réduction HS S R Ra N N Rd
N/ ~N Rd H ~ i
N N, Rc X CN~N N Rd ~N~ X NN Rc
0 0 \ Rc couplage
R Ra (I)
(G) (H) Rb=CONHRc
n=0
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
43
Dans le schéma 2 ci-dessus, les substituants Ra, Rc, Rd, R et X ont les
significations indiquées ci-dessus.
Les composés (I) pour lesquels Ra, R et X ont les mêmes significations que
ci-dessus et pour lesquels Rb = H ou Rb = CON(Rc)Rd peuvent être obtenus
par réaction de couplage des composés (A) avec Ra et R tels que définis ci-
dessus avec les composés (H) avec Rc, Rd et X tels que définis ci-dessus,
comme décrit ci-dessus pour la préparation des composés (B).
Les composés (I) pour lesquels Ra, R et X ont les mêmes significations que
ci-dessus et pour lesquels Rb = H peuvent également être obtenus par
réaction de couplage des composés (A) avec Ra et R tels que définis ci-
dessus avec les composés (M) avec X tel que défini ci-dessus, comme décrit
ci-dessus pour la préparation des composés (B).
Les composés (I) pour lesquels Ra, R et X ont les mêmes significations que
ci-dessus et pour lesquels Rb = CORc peuvent être obtenus par réaction de
couplage des composés (A) avec Ra et R tels que définis ci-dessus avec les
composés (L) avec Rc et X tels que définis ci-dessus, comme décrit ci-
dessus pour la préparation des composés (B) ou par exemple en présence
de bis(diphénylphosphino) 9,9-d iméthylxanthène, de
tris(dibenzylidèneacétone)dipalladium (0) et de N,N-diisopropyléthylamine
dans un solvant comme le diméthylformamide à une température comprise
entre 20 C et la température de reflux du solvant. De telles réactions peuvent
également être réalisées sous irradiation microondes.
Les composés (H), (L) et (M) pour lesquels Rc, Rd et X ont les mêmes
significations indiquées ci-dessus peuvent être obtenus par exemple, à partir
des composés (G), (K) et (J) respectivement, par réduction avec du DL-
dithiotréitol, en présence d'hydrogénocarbonate de sodium ou de
dihydrogénophosphate de potassium dans un solvant tel l'éthanol et à une
température comprise entre 20 C et le reflux du solvant.
Les composés (G) pour lesquels Rc, Rd et X ont les mêmes significations
indiquées ci-dessus peuvent être obtenus par exemple à partir des composés
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
44
(F), comme décrit ci-dessus pour la préparation des composés (I) avec Rb =
CON(Rc)Rd.
Les composés (K) pour lesquels Rc et X ont les mêmes significations
indiquées ci-dessus peuvent être obtenus par exemple à partir des composés
(J), comme décrit ci-dessus pour la préparation des composés (I) avec Rb =
CORc
Les composés (F) peuvent être obtenus à partir des composés (J) comme
décrit ci-dessus pour la préparation des composés (D).
\ thiocyanation ~S DCCS
N /NHZ
X NHZ X N
(J)
Les composés (J) pour lesquels X a les mêmes significations indiquées ci-
dessus sont soit commerciaux, soit peuvent être préparés selon une méthode
usuelle pour l'homme du métier, par exemple par thiocyanation des anilines
correspondantes par réaction de thiocyanate de potassium et du brome en
présence d'acide acétique à une températire comprise entre 200C et la
température de reflux du solvant, soit par réaction de thiocyanate de sodium,
de bromure de sodium et du brome dans le méthanol comme décrit par
J.V.N. Vara Prasad et coll. (Tetrahedron Letters, 2000, 41, 4065-4068).
Schéma 3:
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
0
~S S H
N N X ~N
N Rb
N~
R
Ra (1)
n=1
S S H oxydation
N/ vN7 X />N\ et / ou
~CcN Rb
N 0i0
-S
R Ra N ~ I /Nv
rN X N Rb
(i) N~\
n=0
R Ra (I)
n=2
Dans le schéma 3 ci-dessus, les substituants Ra, Rb, R et X ont les
significations indiquées ci-dessus.
Les composés (I) pour lesquels Ra, Rb, R et X ont les mêmes significations
5 que ci-dessus et pour lesquels n = 1 ou 2 peuvent être obtenus par oxydation
des composés (I) pour lesquels n= 0 selon une méthode usuelle pour
l'homme du métier, en utilisant par exemple l'acide méta-chloroperbenzoique,
en présence d'un solvant comme le dichlorométhane par exemple, à une
température comprise entre 200C et la température de reflux du solvant.
10 Parmi les produits de départs de formules (A), (Al), (A2), (A3), (A4), (F),
(G)
(J), et (K), certains sont connus et peuvent être obtenus soit
commercialement, soit selon les méthodes usuelles connues de l'homme du
métier, par exemple à partir de produits commerciaux.
Il est entendu pour l'homme du métier que, pour la mise en oeuvre des
15 procédés selon l'invention décrits précédemment, il peut être nécessaire
d'introduire des groupements protecteurs des fonctions amino, carboxyle et
alcool afin d'éviter des réactions secondaires.
La liste suivante, non exhaustive, d'exemples de protection de fonctions
réactives peut être citée :
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
46
- les groupements hydroxyle peuvent être protégés par exemple par les
radicaux alkyle tels que tert-butyle, triméthylsilyle, tert-
butyldiméthylsilyle,
méthoxyméthyle, tétrahydropyrannyle, benzyle ou acétyle,
- les groupements amino peuvent être protégés par exemple par les radicaux
acétyles, trityle, benzyle, tert-butoxycarbonyle, BOC, benzyloxycarbonyle,
phtalimido ou d'autres radicaux connus dans la chimie des peptides,
Les fonctions acide peuvent être protégées par exemple sous forme d'esters
formés avec les esters facilement clivables tels que les esters benzyliques ou
ter butyliques ou des esters connus dans la chimie des peptides.
On trouvera une liste de différents groupements protecteurs utilisables dans
les manuels connus de l'homme du métier et par exemple dans le brevet BF
2 499 995.
On peut noter que l'on peut soumettre, si désiré et si nécessaire, des
produits
intermédiaires ou des produits de formule (I) ainsi obtenus par les procédés
indiqués ci-dessus, pour obtenir d'autres intermédiaires ou d'autres produits
de formule (I), à une ou plusieurs réactions de transformations connues de
l'homme du métier telles que par exemple :
a) une réaction d'estérification de fonction acide,
b) une réaction de saponification de fonction ester en fonction acide,
c) une réaction de réduction de la fonction carboxy libre ou estérifié en fonc-
tion alcool,
d) une réaction de transformation de fonction alcoxy en fonction hydroxyle, ou
encore de fonction hydroxyle en fonction alcoxy,
e) une réaction d'élimination des groupements protecteurs que peuvent porter
les fonctions réactives protégées,
f) une réaction de salification par un acide minéral ou organique ou par une
base pour obtenir le sel correspondant,
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
47
g) une réaction de dédoublement des formes racémiques en produits
dédoublés,
lesdits produits de formule (I) ainsi obtenus étant sous toutes les formes
isomères possibles racémiques, énantiomères et diastéréoisomères.
Les réactions a) à g) peuvent être réalisées dans les conditions usuelles
connues de l'homme du métier telles que, par exemple, celles indiquées ci-
après.
a) Les produits décrits ci-dessus peuvent, si désiré, faire l'objet, sur les
éventuelles fonctions carboxy, de réactions d'estérification qui peuvent être
réalisées selon les méthodes usuelles connues de l'homme du métier.
b) Les éventuelles transformations de fonctions ester en fonction acide des
produits décrits ci-dessus peuvent être, si désiré, réalisées dans les
conditions usuelles connues de l'homme du métier notamment par hydrolyse
acide ou alcaline par exemple par de la soude ou de la potasse en milieu
alcoolique tel que, par exemple, dans du méthanol ou encore par de l'acide
chlorhydrique ou sulfurique.
La réaction de saponification peut être réalisée selon les méthodes usuelles
connues de l'homme du métier, telles que par exemple dans un solvant tel
que le méthanol ou l'éthanol, le dioxane ou le diméthoxyéthane, en présence
de soude ou de potasse.
c) Les éventuelles fonctions carboxy libre ou estérifié des produits décrits
ci-
dessus peuvent être, si désiré, réduites en fonction alcool par les méthodes
connues de l'homme de métier : les éventuelles fonctions carboxy estérifié
peuvent être, si désiré, réduites en fonction alcool par les méthodes connues
de l'homme du métier et notamment par de l'hydrure de lithium et d'aluminium
dans un solvant tel que par exemple le tétrahydrofuranne ou encore le
dioxane ou l'éther éthylique.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
48
Les éventuelles fonctions carboxy libre des produits décrits ci-dessus peuvent
être, si désiré, réduites en fonction alcool notamment par de l'hydrure de
bore.
d) Les éventuelles fonctions alcoxy telles que notamment méthoxy des
produits décrits ci-dessus peuvent être, si désiré, transformées en fonction
hydroxyle dans les conditions usuelles connues de l'homme du métier par
exemple par du tribromure de bore dans un solvant tel que par exemple le
chlorure de méthylène, par du bromhydrate ou chlorhydrate de pyridine ou
encore par de l'acide bromhydrique ou chlorhydrique dans de l'eau ou de
l'acide trifluoro acétique au reflux.
e) L'élimination de groupements protecteurs tels que par exemple ceux
indiqués ci-dessus peut être effectuée dans les conditions usuelles connues
de l'homme de métier notamment par une hydrolyse acide effectuée avec un
acide tel que l'acide chlorhydrique, benzène sulfonique ou para-toluène
sulfonique, formique ou trifluoroacétique ou encore par une hydrogénation
catalytique.
Le groupement phtalimido peut être éliminé par l'hydrazine.
f) Les produits décrits ci-dessus peuvent, si désiré, faire l'objet de
réactions
de salification par exemple par un acide minéral ou organique ou par une
base minérale ou organique selon les méthodes usuelles connues de
l'homme du métier : une telle réaction de salification peut être réalisée par
exemple en présence d'acide chlorhydrique par exemple ou encore d'acide
tartrique, citrique ou méthane sulfonique, dans un alcool tel que par exemple
l'éthanol ou le méthanol .
g) Les éventuelles formes optiquement actives des produits décrits ci-dessus
peuvent être préparées par dédoublement des racémiques selon les
méthodes usuelles connues de l'homme du métier.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
49
Les produits de formule (I) tels que définis ci-dessus ainsi que leurs sels
d'addition avec les acides présentent d'intéressantes propriétés
pharmacologiques notamment en raison de leurs propriétés inhibitrices de
kinases ainsi qu'il est indiqué ci-dessus.
Les produits de la présente invention sont notamment utiles pour la thérapie
de tumeurs.
Les produits de l'invention peuvent également ainsi augmenter les effets
thérapeutiques d'agents anti-tumoraux couramment utilisés.
Ces propriétés justifient leur application en thérapeutique et l'invention a
particulièrement pour objet à titre de médicaments, les produits de formule
(I)
telle que définie ci-dessus, lesdits produits de formule (I) étant sous toutes
les
formes isomères possibles racémiques, énantiomères et diastéréoisomères,
ainsi que les sels d'addition avec les acides minéraux et organiques ou avec
les bases minérales et organiques pharmaceutiquement acceptables desdits
produits de formule (I).
L'invention a tout particulièrement pour objet, à titre de médicaments, les
produits répondant aux formules suivantes :
- 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-amine
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]acétamide
- 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-[2-
(morpholin-4-yl)éthyl]urée
- 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-[2-
(pyrrolidin-1-yl)éthyl]urée
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfinyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfonyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
(pyrrolidin-1-yl)propanamide
5 - N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]benzamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-
méthylpipérazin-1-yl)acétamide
- (2-{[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
10 y1]amino}-2-oxoéthyl)carbamate de 2-méthylpropan-2-yle
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]glycinamide, dichlorhydrate.
- (trans A)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]-2-(morpholin-4-ylméthyl)cyclopropanecarboxamide
15 - (trans B)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]-2-(morpholin-4-ylméthyl)cyclopropanecarboxamide
- 2-(4-éthylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]acétamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
20 ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2,N2-diéthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]glycinamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
25 - 5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
amine
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
51
méthoxypropanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-
méthyl-3-oxopipérazin-1-yl)acétamide
- N-{6-[(7-aminoimidazo[1,2-a]pyrimidin-3-yl)sulfanyl]-1,3-benzothiazol-
2-yl}cyclopropanecarboxamide
- N-(6-{[6-(3-fluorophényl)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-
benzoth iazol-2-yl)cyclopropanecarboxamide
- N-(6-{[6-(cyclohexyloxy)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-
benzoth iazol-2-yl)cyclopropanecarboxamide
- 3-[(2-amino-1,3-benzothiazol-6-yl)sulfanyl]-N-cyclohexylimidazo[1,2-
a]pyrimidin-6-amine
- N-(6-{[6-(benzylamino)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-
benzoth iazol-2-yl)cyclopropanecarboxamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]tétrahyd ro-2H-pyran-4-carboxam ide
ainsi que les sels d'addition avec les acides minéraux et organiques ou avec
les bases minérales et organiques pharmaceutiquement acceptables desdits
produits de formule (I).
La présente invention concerne également à titre de médicaments les
produits de formule (I) suivants :
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
(morpholin-4-yl)propanam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(morpholin-4-yl)acétam ide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-(4-
méthylpipérazin-1-yl)propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
52
(propan-2-yl)pipérazin-1-yl]acétamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2-éthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]glycinamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl] propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-
méthyl-1,4-diazépan-1-yl)acétamide
- 2-(4-éthyl-1,4-diazépan-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-[4-
(2,2,2-trifluoroéthyl)pipérazin-1-yl]propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(2,2,2-trifluoroéthyl)pipérazin-1-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(1-
méthylpipérid in-4-yl)acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-(1-
méthylpipérid in-4-yl)propanamide
- 2-(3-fluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 3-(3-fluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- 2-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 3-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
53
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-1-
méthylazétidine-3-carboxamide
- 2-(3,5-diméthylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(3,4,5-triméthylpipérazin-1-yl)acétamide
- 3-(3,5-diméthylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-
(3,4,5-triméthylpipérazin-1-yl)propanamide
- 3-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- 2-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-cyclohexylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(tétrahydro-2H-pyran-4-yl)pipérazin-1-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(4-méthyltétrahydro-2H-pyran-4-yl)pipérazin-1-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(2-méthylpropan-2-yl)pipérazin-1-yl]acétamide
- 2-[4-(diéthylamino)pipéridin-1-yl]-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-[3-(diéthylamino)pyrrolidin-1-yl]-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
54
- 2-(4-acétylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-
1,3-benzothiazol-2-yl]acétamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-[4-
(2-méthoxyéthyl)pipérazin-1-yl]acétamide
- 2-[4-(2-hydroxyéthyl)pipérazin-1-yl]-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 4-(2-{[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]amino}-2-oxoéthyl)pipérazine-1-carboxylate de méthyle
- 2-[4-(N,N-diméthylglycyl)pipérazin-1 -yl]-N-[6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2,N2-diéthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]glycinamide
- N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(tétra h yd ropyra n-4-yl )acéta m ide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-(4-méthyl-1,4-diazépan-1-yl)acétamide
- 2-(4-éthyl-1,4-diazépan-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-(4-méthylpipérazin-1 -yl)propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-[4-(2,2,2-trifluoroéthyl)pipérazin-1-yl]propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2,2,2-trifluoroéthyl)pipérazin-1-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-(1-méthylpipéridin-4-yl)acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
yl]-3-(1-méthylpipéridin-4-yl)propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-(3-fluoro-1-méthylpipéridin-4-yl)acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
5 yl]-3-(3-fluoro-1-méthylpipéridin-4-yl)propanamide
- 2-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 3-(3,3-difluoro-1-méthylpipéridin-4-yl)-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
10 - N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-1-méthylazétidine-3-carboxamide
- 2-(3,5-diméthylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
15 yl]-2-(3,4,5-triméthylpipérazin-1-yl)acétamide
- 3-(3,5-diméthylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]propanamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-(3,4,5-triméthylpipérazin-1-yl)propanamide
20 - 3-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[5-fluoro-6-
(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]propanamide
- 2-(5,6-dihydroimidazo[1,2-a]pyrazin-7(8H)-yl)-N-[5-fluoro-6-
(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
25 - 2-(4-cyclohexylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
56
yl]-2-[4-(tétrahydro-2H-pyran-4-yl)pipérazin-1 -yl]acétam ide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(4-méthyltétrahydro-2H-pyran-4-yl)pipérazin-1-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2-méthylpropan-2-yl)pipérazin-1-yl]acétamide
- 2-[4-(diéthylamino)pipéridin-1-yl]-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-[3-(diéthylamino)pyrrolidin-1-yl]-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-acétylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2-méthoxyéthyl)pipérazin-1-yl]acétamide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(2-hydroxyéthyl)pipérazin-1-yl]acétamide
- 4-(2-{[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yI]amino}-2-oxoéthyl)pipérazine-1-carboxylate de
méthyle
- 2-[4-(N,N-diméthylglycyl)pipérazin-1 -yl]-N-[5-fluoro-6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- 2-(4-cyclopropylpipérazin-1-yl)-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-
3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
- N2,N2-diéthyl-N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]g lyci namide
- N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-2-[4-(propan-2-yl)pipérazin-1-yl]acétamide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
57
ainsi que les sels d'addition avec les acides minéraux et organiques ou avec
les bases minérales et organiques pharmaceutiquement acceptables desdits
produits de formule (I).
L'invention concerne aussi des compositions pharmaceutiques contenant à
titre de principe actif l'un au moins des produits de formule (I) tels que
définis
ci-dessus ou un sel pharmaceutiquement acceptable de ce produit ou un
prodrug de ce produit et, le cas échéant, un support pharmaceutiquement
acceptable.
L'invention s'étend ainsi aux compositions pharmaceutiques contenant à titre
de principe actif l'un au moins des médicaments tels que définis ci-dessus.
De telles compositions pharmaceutiques de la présente invention peuvent
également, le cas échéant, renfermer des principes actifs d'autres
médicaments antimitotiques tels que notamment ceux à base de taxol, cis-
platine, les agents intercalants de l'ADN et autres.
Ces compositions pharmaceutiques peuvent être administrées par voie
buccale, par voie parentérale ou par voie locale en application topique sur la
peau et les muqueuses ou par injection par voie intraveineuse ou intra-
musculaire.
Ces compositions peuvent être solides ou liquides et se présenter sous
toutes les formes pharmaceutiques couramment utilisées en médecine
humaine comme, par exemple, les comprimés simples ou dragéifiés, les
pilules, les tablettes, les gélules, les gouttes, les granulés, les
préparations
injectables, les pommades, les crèmes ou les gels ; elles sont préparées
selon les méthodes usuelles. Le principe actif peut y être incorporé à des
excipients habituellement employés dans ces compositions pharmaceutiques,
tels que le talc, la gomme arabique, le lactose, l'amidon, le stéarate de
magnésium, le beurre de cacao, les véhicules aqueux ou non, les corps gras
d'origine animale ou végétale, les dérivés paraffiniques, les glycols, les
divers
agents mouillants, dispersants ou émulsifiants, les conservateurs.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
58
La posologie usuelle, variable selon le produit utilisé, le sujet traité et
l'affection en cause, peut être, par exemple, de 0,05 à 5 g par jour chez
l'adulte, ou de préférence de 0,1 à 2 g par jour.
La présente invention a également pour objet l'utilisation des produits de
formule (I) tels que définis ci-dessus ou de sels pharmaceutiquement
acceptables de ces produits pour la préparation d'un médicament destiné à
l'inhibition de l'activité d'une protéine kinase.
La présente invention a également pour objet l'utilisation de produits de
formule (I) tels que définis ci-dessus pour la préparation d'un médicament
destiné au traitement ou à la prévention d'une maladie caractérisée par le
dérèglement de l'activité d'une protéine kinase.
Un tel médicament peut notamment être destiné au traitement ou à la
prévention d'une maladie chez un mammifère.
La présente invention a également pour objet l'utilisation définie ci-dessus
dans laquelle la protéine kinase est une protéine tyrosine kinase.
La présente invention a également pour objet l'utilisation définie ci-dessus
dans laquelle la protéine tyrosine kinase est MET ou ses formes mutantes.
La présente invention a également pour objet l'utilisation définie ci-dessus
dans laquelle la protéine kinase est dans une culture cellulaire.
La présente invention a également pour objet l'utilisation définie ci-dessus
dans laquelle la protéine kinase est dans un mammifère.
La présente invention a notamment pour objet l'utilisation d'un produit de
formule (I) tel que défini ci-dessus pour la préparation d'un médicament
destiné à la prévention ou au traitement de maladies liées à une prolifération
non contrôlée.
La présente invention a particulièrement pour objet l'utilisation d'un produit
de
formule (I) tel que défini ci-dessus pour la préparation d'un médicament
destiné au traitement ou à la prévention d'une maladie choisie dans le groupe
suivant : troubles de la prolifération de vaisseaux sanguins, troubles
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
59
fibrotiques, troubles de la prolifération de cellules `mesangial', désordres
métaboliques, allergies, asthmes, thromboses, maladies du système nerveux,
rétinopathie, psoriasis, arthrite rhumatoïde, diabète, dégénérescence
musculaire et cancers.
La présente invention a ainsi tout particulièrement pour objet l'utilisation
d'un
produit de formule (I) tel que défini ci-dessus pour la préparation d'un
médicament destiné au traitement ou à la prévention de maladies en
oncologie et notamment destiné au traitement de cancers.
Parmi ces cancers, on s'intéresse au traitement de tumeurs solides ou
liquides, au traitement de cancers résistant à des agents cytotoxiques
Les produits de la présente invention cités peuvent notamment être utilisés
pour le traitement de tumeurs primaires et/ou de métastases en particulier
dans les cancers gastriques, hépatiques, rénaux, ovariens, du colon, de la
prostate, du poumon (NSCLC et SCLC), les glioblastomes, les cancers de la
thyroïde, de la vessie, du sein, dans les mélanomes, dans les tumeurs
hématopoiétiques lymphoïdes ou myéloïdes, dans les sarcomes, dans les
cancers du cerveau, du larynx, du système lymphatique, cancers des os et du
pancréas.
La présente invention a aussi pour objet l'utilisation des produits de formule
(I) telle que définie ci-dessus pour la préparation de médicaments destinés à
la chimiothérapie de cancers.
De tels médicaments destinés à la chimiothérapie de cancers peuvent être
utilisés seuls ou en en association.
Les produits de la présente demande peuvent notamment être administrés
seuls ou en association avec de la chimiothérapie ou de la radiothérapie ou
encore en association par exemple avec d'autres agents thérapeutiques.
De tels agents thérapeutiques peuvent être des agents anti-tumoraux
couramment utilisés.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
Comme inhibiteurs de kinases, on peut citer la butyrolactone, le flavopiridol
et
la 2(2-hydroxyéthylamino)-6-benzylamino-9-méthylpurine appelée olomucine.
La présente invention a encore pour objet à titre de produits industriels
nouveaux, les intermédiaires de synthèse de formules (A), (B), (C), (D), (E),
5 (F), (G), (H), (J), (K), (L) et (M) tels que définis ci-dessus et rappelés
ci-
après :
Br S S
N\ N N
NH ~ NHz
N\ N\ /0 N\
R Ra R Ra R Ra
(A) (B) (C)
N~YS S N N'YS ~S Rc S S H
N N~ 0 N ~N~ 0 N I~
X % X X N 0
N 0 Rw N 0 Rw 0 Rw
R Ra R Ra
(D) (E) (F)
S S HS. __S S
N % C /N Rd /N\ Rd N NHz
X N N Rc X N 0 N Rc X, N
(G) (H) (J)
S HS S H HS __S
N -N N~NRc NNH2
X N Rc X 0 X
0
(K) (~) (M)
tels que définis ci-dessus dans lesquels Ra, Rb, Rc, Rd, R et X ont les
définitions indiquées ci-dessus et Rw représente un radical t-butyl ou phényl.
10 Les exemples suivants qui sont des produits de formule (I) illustrent
l'invention sans toutefois la limiter.
Partie expérimentale
La nomenclature des composés de cette présente invention a été effectuée
avec le logiciel ACDLABS version 10Ø
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
61
Le four à microondes utilisé est un appareil Biotage, Initiator TM 2.0, 400W
max, 2450 MHz.
Les spectres de RMN 1 H à 400 MHz ont été effectués sur spectromètre
BRUKER AVANCE DRX-400 avec les déplacements chimiques (8 en ppm)
dans le solvant diméthylsulfoxide-d6 (DMSO-d6) référencé à 2,5 ppm à la
température de 303K.
Les spectres de masse (SM) ont été obtenus soit par la méthode A, soit par
la méthode B :
Méthode A :
Appareil WATERS UPLC-SQD ; Ionisation : électrospray en mode positif
et/ou négatif (ES+/-) ; Conditions chromatographiques : Colonne : ACQUITY
BEH C18 1,7 pm - 2,1 x 50 mm, Solvants : A : H2O (0,1 % acide formique) B :
CH3CN (0,1 % acide formique) ; Température de colonne : 50 C ; Débit : 1
ml/min ; Gradient (2 min) : de 5 à 50 % de B en 0,8 min ; 1,2 min : 100 % de
B ; 1,85 min : 100 % de B ; 1,95 : 5 % de B ; Temps de rétention = Tr (min).
Méthode B :
Appareil WATERS ZQ ; Ionisation : électrospray en mode positif et/ou négatif
(ES+/-) ; Conditions chromatographiques : Colonne : XBridge C18 2,5 pm - 3 x
50 mm ; Solvants : A : H2O (0,1 % acide formique) B : CH3CN (0,1 % acide
formique) ; Température de colonne : 70 C ; Débit : 0,9 ml/min ; Gradient (7
min):de5à100%deBen5,3min;5,5min:100%deB;6,3min:5%de
B ; Temps de rétention = Tr (min).
Exemple 1 : 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
amine
Exemple 1a : 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
amine
Le composé peut être préparé de la manière suivante:
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
62
Dans un tube en verre scellé, on charge 600 mg de 3-bromoimidazo[1,2-
a]pyrimidine (produit commercial), 1,05 g de 1-[2-(morpholin-4-yl)éthyl]-3-(6-
sulfanyl-1,3-benzothiazol-2-yl)urée, 840 mg de carbonate de potassium et 12
ml de diméthylsulfoxyde. Le milieu est chauffé par les pondes à 190 C
pendant 12 minutes. Après retour à température voisine de 20 C, le milieu est
versé sur 200 ml d'eau et de glace. Le précipité ainsi formé est isolé par
filtration sur verre fritté, rincé 3 fois avec 10 ml d'eau et séché. Le
filtrat est
extrait par 4 fois 15 ml de dichlorométhane et les extraits organiques réunis
sont séchés sur sulfate de magnésium, filtrés et concentrés à sec sous
pression réduite. Le résidu d'évaporation et le solide précédemment isolé
sont chromatographiés, sous pression d'argon, sur gel de silice (éluant
dichlorométhane/méthanol 9/1). On obtient ainsi 65 mg de 6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-amine sous forme d'un solide
marron clair.
Point de fusion > 260 C (Kôfler).
SM : méthode A ; [M+H]+: m/z = 300 ; Tr = 0,41 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 7.12 (dd, J=8.4, 2.2 Hz, 1 H) 7.19 (dd,
J=6.8, 4.2 Hz, 1 H) 7.23 (d, J=8.4 Hz, 1 H) 7.51 (s large, 2 H) 7.60 (d, J=2.2
Hz, 1 H) 8.19 (s, 1 H) 8.67 (dd, J=4.2, 2.0 Hz, 1 H) 8.89 (dd, J=6.8, 2.0 Hz,
1
H)
Exemple 1b : 1-[2-(morpholin-4-yl)éthyl]-3-(6-sulfanyl-1,3-benzothiazol-2-
yl)urée
Le composé peut être préparé de la manière suivante:
A une suspension de 900 mg de thiocyanate de 2-({[2-(morpholin-4-
yl)éthyl]carbamoyl}amino)-1,3-benzothiazol-6-yle dans 35 ml d'éthanol à
20 C, on ajoute une solution de 11 mg de dihydrogénophosphate de
potassium dans 2,3 ml d'eau suivi de 1,1 g de DL-dithiothreitol. La
suspension blanche est agitée 18h au reflux. On refroidit le mélange
réactionnel à 20 C puis on additionne 30 ml d'eau et on agite pendant 15
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
63
minutes. Le précipité formé est essoré puis lavé à grands volumes d'eau. On
obtient ainsi 633 mg de 1-[2-(morpholin-4-yl)éthyl]-3-(6-sulfanyl-1,3-
benzothiazol-2-yl)urée, sous forme d'un solide blanc.
SM : méthode B ; [M+H]+: m/z = 339 ; [M-H]-: m/z = 337 ; Tr = 2,31 min.
Exemple l c : thiocyanate de 2-({[2-(morpholin-4-yl)éthyl]carbamoyl}amino)-
1,3-benzothiazol-6-yle
Le composé peut être préparé de la manière suivante:
A une solution de 1 g de (6-thiocyanato-1,3-benzothiazol-2-yl)carbamate de
phényle dans 30 ml de tétrahydrofurane, on ajoute 0,44 ml de 2-morpholin-4-
yléthanamine à 20 C. Le milieu réactionnel est maintenu sous agitation à
C pendant 24 heures puis concentré par évaporation sous pression
réduite. Le résidu obtenu est chromatographié sur une cartouche Merck 70g
(dépôt solide; élution avec un gradient dichlorométhane puis
15 dichlorométhane/méthanol 90/10). On obtient ainsi 902 mg de thiocyanate
de 2-({[2-(morpholin-4-yl)éthyl]carbamoyl}amino)-1,3-benzothiazol-6-yle, sous
forme d'une mousse incolore.
SM : méthode A ; [M+H]+: m/z = 364 ; Tr = 0,99 min.
Exemple 1d : (6-thiocyanato-1,3-benzothiazol-2-yl)carbamate de phényle
20 Le composé peut être préparé de la manière suivante:
A une solution de 2,5 g de thiocyanate de 2-amino-1,3-benzothiazol-6-yle
(produit commercial) dans 94 ml de tétrahydrofurane, on ajoute, à 20 C, 7,5 g
de chlorocarbonate de phényle puis 4,05 g d'hydrogénocarbonate de sodium
et 9,4 ml d'eau. Le milieu réactionnel est agité à 20 C pendant 20 heures
puis extrait par 2 fois 150 ml d'acétate d'éthyle. Les phases organiques sont
rassemblées puis lavées 3 fois par 50 ml d'une solution aqueuse saturée
d'hydrogénocarbonate de sodium. La phase organique obtenue est séchée
sur sulfate de magnésium puis concentrée à sec sous pression réduite. On
reprend le résidu ainsi obtenu par 50 ml d'eau puis on essore et sèche sous
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
64
vide à 20 C. On obtient ainsi 3,45 g de (6-thiocyanato-1,3-benzothiazol-2-
yl)carbamate de phényle, sous forme d'un solide jaune pâle.
SM : méthode B ; [M+H]+: m/z = 328, [M-H]-: m/z = 326 ; Tr = 3,89 min.
Le composé 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
amine (exemple 1 et la) peut également être obtenu de la manière suivante :
Une suspension de 310 mg de 4-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)aniline,
de 25 ml d'acide acétique et de 500 mg de thiocyanate de potassium est
agitée jusqu'à la solubillisation . Sont ajoutés ensuite goutte à goutte 66 pl
de
brome en solution dans 3 ml d'acide acétique. Le milieu réactionnel est
maintenu sous agitation à température voisine de 20 C pendant 48 heures
puis versé sur 70 ml d'eau glacée. Le pH est amené aux environs de 11 par
ajout de soude 1 ON. Le précipité formé est filtré, lavé avec de l'eau, essoré
et
séché. On obtient ainsi 242 mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-
1,3-benzothiazol-2-amine sous forme d'un solide jaune.
Exemple le : 4-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)aniline
Le composé peut être préparé de la manière suivante:
Une solution de 770 mg de N-[4-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)phényl]acétamide (770 mg; 2,7 mmoles), de 5,2 ml d'acide
chlorhydrique (37% en volumes) et de 60 ml d'éthanol est portée au reflux
pendant 8 heures. Après retour vers la température ambiante, le milieu est
concentré à sec par évaporation sous pression réduite et le résidu obtenu est
repris avec une solution aqueuse saturée en hydrogénocarbonate de sodium
et extrait avec 3 fois 50 ml de dichlorométhane. Les extraits organiques
réunis sont séchés, filtrés et concentrés à sec sous pression réduite. Le
résidu d'évaporation est chromatographié, sous pression d'argon, sur gel de
silice (éluant : dichlorométhane/méthanol 94/6). On obtient ainsi 480 mg de 4-
(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)aniline sous forme d'un solide jaune.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
SM : méthode A ; [M+H]+: m/z = 243 ; Tr = 0,35 min.
Exemple 1f :N-[4-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)phényl]acétamide
Le composé peut être préparé de la manière suivante:
5 Dans un tube en verre scellé, on charge 1,42 g de 3-bromoimidazo[1,2-
a]pyrimidine (produit commercial), 1,18 g de N-(4-sulfanylphényl)acétamide
(produit commercial), 1,95 g de carbonate de potassium et 15 ml de
diméthylsulfoxyde. Le milieu est chauffé par les pondes à 180 C pendant 12
minutes. Après retour à température voisine de 20 C, le milieu est versé sur
10 250 ml d'eau et de glace. Le précipité ainsi formé est filtré, lavé par 3
fois 70
ml d'eau et séché et le filtrat est extrait par 150 ml de dichlorométhane. Les
extraits organiques réunis sont lavés par 2 fois 30 ml d'eau, séchés sur
sulfate de magnésium, filtrés et concentrés à sec par évaporation sous
pression réduite. Le précipité précédemment isolé et l'extrait sont réunis
pour
15 être chromatographiés sur gel de silice, sous pression d'argon (éluant
dichlorométhane/méthanol 9/1). On obtient ainsi 780 mg de N-[4-
(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)phényl]acétamide sous forme d'un solide
beige.
SM : méthode A ; [M+H]+: m/z = 285 ; [M-H]-: m/z = 283 ; Tr = 1,07 min.
Exemple 2 : N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]cyclopropanecarboxam ide
Le composé peut être préparé de la manière suivante:
A une solution de 135 mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-amine et de 5 ml de pyridine, on ajoute goutte à goutte 45 pL
de chlorure de cyclopropanecarbonyle. Le milieu réactionnel est agité à
température voisine de 20 C pendant 16 heures puis concentré à sec sous
pression réduite. Le résidu d'évaporation est chromatographié, sous pression
d'argon, sur gel de silice (éluant dichlorométhane/méthanol 94/6). Le solide
obtenu est trituré dans de l'acétate d'éthyle, filtré et séché. On obtient
ainsi 28
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
66
mg de N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide sous forme d'un solide jaune.
Point de fusion = 258 C (Kôfler).
SM : méthode B ; [M+H]+: m/z = 368, [M-H]-: m/z = 366 ; Tr = 3,23 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 0.86 - 0.96 (m, 4 H) 1.91 - 2.00 (m, 1
H) 7.15 - 7.25 (m, 2 H) 7.61 (d, J=8.3 Hz, 1 H) 7.82 (d, J=2.0 Hz, 1 H) 8.23
(s,
1 H) 8.69 (dd, J=4.2, 2.0 Hz, 1 H) 8.87 (dd, J=6.8, 2.0 Hz, 1 H) 12.54 - 12.68
(m étalé, 1 H)
Exemple 3 : N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]acétamide
Le composé peut être préparé de la manière suivante:
Une solution de 73 mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-amine, de 2 ml d'anhydride acétique et de 2 ml de pyridine est
portée pendant 8 heures au reflux. Après concentration à sec du milieu
réactionnel par évaporation sous pression réduite, le résidu obtenu est
chromatographié, sous pression d'argon, sur gel de silice (éluant
dichlorométhane/méthanol 95/5). Le solide obtenu est trituré dans 2 ml
d'isopropanol. Le solide obtenu est filtré, lavé 2 fois avec 1 ml
d'isopropanol,
3 fois avec 3 ml d'oxyde diisopropylique et séché. On obtient ainsi 51 mg de
N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
sous forme d'un solide jaune.
Point de fusion > 260 C (Kôfler).
SM : méthode A ; [M+H]+: m/z = 342, [M-H]-: m/z = 340 ; Tr = 0,58 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm2.17 (s, 3 H) 7.17 - 7.21 (m, 2 H) 7.62
(d, J=8.6 Hz, 1 H) 7.83 (d, J=2.0 Hz, 1 H) 8.23 (s, 1 H) 8.69 (dd, J=4.2, 2.0
Hz, 1 H) 8.86 (dd, J=6.7, 2.0 Hz, 1 H) 12.25 - 12.35 (m étalé, 1 H)
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
67
Exemple 4: 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]-3-[2-(morpholin-4-yl)éthyl]urée
Le composé peut être préparé de la manière suivante:
Un mélange de 171 mg de 1-[2-(morpholin-4-yl)éthyl]-3-(6-sulfanyl-1,3-
benzothiazol-2-yl)urée, de 5 ml d'éthanol, de 1 mg de potassium
dihydrogénophosphate, de 0,1 ml d'eau, de 100 mg de 3-bromoimidazo[1,2-
a]pyrimidine (produit commercial) et de 0,1 ml de triéthylamine est porté au
reflux pendant 16 heures. Le précipité apparu est éliminé par filtration sur
verre fritté, lavé avec de l'éthanol et le filtrat est concentré à sec sous
pression réduite. Le résidu isolé est chromatographié, sous pression d'argon,
sur gel de silice (éluant dichlorométhane/méthanol 9/1). On obtient ainsi 22
mg de 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-3-[2-
(morpholin-4-yl)éthyl]urée sous forme d'un solide blanc.
Point de fusion > 260 C (Kôfler).
SM : méthode A ; [M+H]+: m/z = 456, [M+H-C7H12N202]+: m/z = 300 ; Tr =
0,45 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 2.33 - 2.45 (m, 6 H) 3.25 (m
partiellement masqué, 2 H) 3.57 (m,4 H) 6.77 (m large 1 H) 7.13 - 7.21 (m, 2
H) 7.48 (d large, J=8.8 Hz, 1 H) 7.78 (s large, 1 H) 8.22 (s, 1 H) 8.67 (dd,
J=4.5, 2.1 Hz, 1 H) 8.88 (dd, J=6.7, 2.1 Hz, 1 H) 10.86 (m étalé, 1 H).
Exemple 5 : 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]-3-[2-(pyrrolidin-1-yl)éthyl]urée
Exemple 5a : 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-[2-(pyrrolidin-1 -yl)éthyl]urée.
Le composé peut être préparé de la manière suivante:
A une suspension de 0,46 g de [6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]carbamate de phényle dans 25 ml de tétrahydrofurane est
ajouté 0,15 ml de 2-(pyrrolidin-1-yl)éthanamine. Après 4 heures d'agitation à
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
68
une température voisine de 20 C, 0,015 ml de 2-(pyrrolidin-1-yl)éthanamine
est ajouté et le mélange réactionnel est agité 2 heures à une température
voisine de 20 C, puis une heure à 50 C puis 64 heures à une température
voisine de 20 C. Le mélange est alors refroidi à l'aide d'un bain de glace et
maintenu sous agitation pendant une heure. Le précipité formé est filtré sur
verre fritté, lavé par 10 ml de tétrahydrofurane et par 2 fois 10 ml d'éther
diéthylique. Le solide isolé est chromatographié, sous pression d'argon sur
gel de silice (éluant dichlorométhane/méthanol/NH4OH 90/10/0.5). On obtient
ainsi 0,3 g de 1-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-3-[2-(pyrrolidin-1-yl)éthyl]urée sous forme de solide blanc.
Point de fusion > 260 C (Banc-Kôfler)
SM : méthode A ; [M+H]+: m/z = 440, [M-H]-: m/z = 438 ;Tr = 0,46 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 1.69 (br. s., 4 H) 2.42 - 2.48 (m, 6 H)
3.20 - 3.27 (m, 2 H) 6.8 (br. s., 1 H) 7.12 - 7.25 (m, 2 H) 7.49 (d, J=8.0 Hz,
1
H) 7.78 (d, J=1.5 Hz, 1 H) 8.22 (s, 1 H) 8.68 (dd, J=4.3, 1.8 Hz, 1 H) 8.88
(dd,
J=7.0, 1.8 Hz, 1 H) 10.71 (br. s., 1 H).
Exemple 5b : [6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]carbamate de phényle
Le composé peut être préparé de la manière suivante:
A une suspension de 0,3 g de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-amine dans 5 ml de pyridine, sont ajoutés 0,13 ml de
chlorocarbonate de phényle. Le mélange est agité à une température voisine
de 20 C pendant 2 heures puis 0,13 ml de chlorocarbonate de phényle sont
rajoutés. Après une heure d'agitation à température voisine de 20 C, le milieu
réactionnel est refroidi à l'aide d'un bain de glace et 20 ml d'eau sont
ajoutés.
Après deux jours d'agitation à température ambiante, le précipité formé est
filtré sur verre fritté, lavé par 3 fois 10 ml d'eau et séché. On obtient
ainsi 0,46
g de [6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]carbamate
de phényle sous forme d'un solide jaune.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
69
Point de fusion > 260 C (Banc-Kôfler)
SM : méthode A; [M+H]+: m/z = 420 , [M-H]-: m/z = 418 ;Tr = 0,84 min.
Exemple 6 : N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfinyl)-1,3-benzothiazol-
2-yl]cyclopropanecarboxamide
Le composé peut être préparé de la manière suivante:
A une solution hétérogène de 49 mg de N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)- 1,3-benzothiazol-2-yl]cyclopropanecarboxamide et de 5 ml de
dichlorométhane, on ajoute 30 mg d'acide 3-chloroperbenzoïque et le milieu
réactionnel est agité à une température voisine de 20 C pendant 96h. Le
milieu est ensuite dilué avec 10 ml de dichlorométhane et 10 ml de solution
aqueuse saturée en hydrogénocarbonate de sodium. Après 10 minutes
d'agitation, la phase aqueuse est séparée et extraite par deux fois 10 ml de
dichlorométhane. Les extraits organiques réunis sont lavés par 15 ml d'eau
distillée, séchés sur sulfate de magnésium, filtrés et concentrés à sec sous
pression réduite. Le résidu d'évaporation est chromatographié sur gel de
silice, sous pression d'argon (éluant: dichlorométhane/méthanol 96/4). On
obtient ainsi 6,5 mg de N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfinyl)-1,3-
benzothiazol-2-yl]cyclopropane carboxamide sous forme d'un solide blanc.
Point de fusion > 260 C (Banc-Kôfler)
SM : méthode A ; [M+H]+: m/z = 384, [M-H]-: m/z = 382 ;Tr = 0,55 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 0.93 (d, J=5.6 Hz, 2 H) 1.95 (br. s., 1
H) 7.17 (dd, J=6.9, 4.2 Hz, 1 H) 7.61 (d, J=8.5 Hz, 1 H) 7.80 (d, J=8.5 Hz, 1
H) 8.29 (s, 1 H) 8.40 (br. s., 1 H) 8.72 (dd, J=4.2, 2 Hz, 1 H) 8.86 (dd,
J=6.9, 2
Hz, 1 H) 12.7 (br s, 1 H)
Exemple 7 : N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfonyl)-1,3-benzothiazol-
2-yl]cyclopropanecarboxam ide
Le composé peut être préparé de la manière suivante:
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
A une solution hétérogène de 200 mg de N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]cyclopropanecarboxamide et de 20 ml de
dichlorométhane, on ajoute 270 mg d'acide 3-chloroperbenzoïque et le milieu
réactionnel est agité à une température voisine de 20 C pendant 24 heures.
5 Le milieu est ensuite repris avec 25 ml d'une solution aqueuse saturée en
hydrogénocarbonate de sodium. Après 15 minutes d'agitation, la phase
organique est filtrée pour séparer un solide et le filtrat est extrait par 15
ml de
dichlorométhane. Les extraits organiques réunis sont lavés par 20 ml d'eau
distillée, séchés sur sulfate de magnésium, filtrés et concentrés à sec sous
10 pression réduite. Le résidu d'évaporation et le solide isolé sont réunis et
chromatographiés sur gel de silice, sous pression d'argon (éluant :
dichlorométhane/ méthanol 96/4). Le solide isolé est repris avec 2 ml d'éther
isopropylique, filtré et séché sous pression réduite. On obtient ainsi 145 mg
de N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfonyl)-1,3-benzothiazol-2-
15 yl]cyclopropanecarboxamide sous forme d'un solide beige.
Point de fusion = 232 C (Banc-Kôfler)
SM : méthode A ; [M+H]+: m/z = 400, [M-H]-: m/z = 398 ;Tr = 0,68 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 0.93 (d, J=5.6 Hz, 2 H) 1.95 (br. s., 0
H) 7.17(dd,J=6.9,4.2Hz,0H)7.61 (d, J=8.3 Hz, 0 H) 7.80 (d, J=8.8 Hz, 0 H)
20 8.29 (s, 0 H) 8.40 (br. s., 0 H) 8.72 (dd, J=4.3, 2.0 Hz, 0 H) 8.86 (dd,
J=6.8,
2.0 Hz,OH).
Exemple 8 : N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]-3-(pyrrolidin-1-yl)propanamide
25 Le composé peut être préparé de la manière suivante:
Une suspension de 0,3 g de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-amine, de 1,8 g de chlorhydrate de l'acide 3-(pyrrolidin-1-yl)
propionique, de 1,92 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide et de 20 ml de pyridine est maintenue sous agitation à une
30 température voisine de 20 C pendant 3 jours. Le milieu est ensuite porté à
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
71
50 C pendant 3 heures et l g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide sont ajoutés. Après 18 heures d'agitation à une
température voisine de 20 C, 50 ml d'eau et 150 ml d'acétate d'éthyle sont
ajoutés au milieu réactionnel. Les deux phases sont réunies et concentrées
par évaporation sous pression réduite. Le résidu ainsi obtenu est
chromatographié sur gel de silice, sous pression d'argon (éluant :
dichlorométhane/méthanol/ NH4OH 95/5/0,5). Le solide isolé est à nouveau
chromatographié sur gel de silice, sous pression d'argon (éluant : acétate
d'éthyle/méthanol 9/1). Le solide isolé est repris avec 20 ml d'éther
isopropylique, filtré, lavé 3 fois par 10 ml d'éther isopropylique puis séché.
On
obtient ainsi 220 mg de N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]-3-(pyrrol idin-1-yl)propanamide sous forme d'un solide
jaune.
Point de fusion = 247 C (Banc-Kôfler)
SM : méthode B ; [M+H]+: m/z = 425, [M-H]-: m/z = 423 ;Tr = 2,36 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm1.61 - 1.71 (m, 4 H) 2.43 - 2.48 (m, 4
H) 2.63 (d, J=6.3 Hz, 2 H) 2.74 (d, J=6.3 Hz, 2 H) 7.19 (dd, J=6.8, 4.1 Hz, 1
H) 7.22 (dd, J=8.5, 2.0 Hz, 1 H) 7.63 (d, J=8.5 Hz, 1 H) 7.84 (d, J=2.0 Hz, 1
H) 8.24 (s, 1 H) 8.69 (dd, J=4.1, 2.0 Hz, 1 H) 8.87 (dd, J=6.8, 2.0 Hz, 1 H).
Exemple 9 : N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-
2-yl]benzamide
Le composé peut être préparé comme dans l'exemple 2 mais à partir de 0,3 g
de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-amine, de 0,28
g de chlorure de benzoyle et de 5 ml de pyridine. On obtient ainsi 270 mg de
N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]benzamide
sous forme d'un solide jaune.
Point de fusion > 260 C (Banc-Kôfler)
SM : méthode A ; [M+H]+: m/z = 404, [M-H]-: m/z = 402 ;Tr = 0,83 min.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
72
RMN 1 H (400 MHz, DMSO-d6) b ppm 7,21 (dd, J=4,2 et 6,8 Hz, 1 H) ; 7,27
(dd, J=2,0 et 8,6 Hz, 1 H) ; 7,55 (t, J=7,8 Hz, 2 H) ; 7,61 à 7,71 (m, 2 H),
7,89
(d, J=2,0 Hz, 1 H) ; 8,11 (d large, J=7,8 Hz, 2 H) ; 8,25 (s, 1 H) ; 8,70 (dd,
J=2,2 et 4,2 Hz, 1 H) ; 8,88 (dd, J=2,2 et 6,8 Hz, 1 H) ; 12,87 (s large, 1
H).
Exemple 10 : N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]-2-(4-méthylpipérazin-1-yl)acétamide
Le composé peut être préparé comme dans l'exemple 8 mais à partir de 85
mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-amine, de
0,55 g de chlorhydrate de l'acide (4-méthylpipérazin-1-yl)acétique, de 0,54 g
de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide et de 3 ml
de pyridine. On obtient ainsi 65 mg de N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-méthylpipérazin-1-yl)acétamide sous
forme d'une huile orange cristallisante.
SM : méthode B ; [M+H]+: m/z = 440, [M-H]-: m/z = 438 ;Tr = 2,34 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 2,15 (s, 3 H) ; 2,25 à 2,58 (m
partiellement masqué, 8 H) ; 3,23 à 3,38 (m partiellement masqué, 2H) ; 7,19
(dd, J=4,2 et 6,8 Hz, 1 H) ; 7,23 (dd, J=2,1 et 8,4 Hz, 1 H) ; 7,64 (d, J=8,4
Hz,
1 H) ; 7,85 (d, J=2,1 Hz, 1 H) ; 8,24 (s, 1 H) ; 8,69 (dd, J=2,0 et 4,2 Hz, 1
H) ;
8,86 (dd, J=2,0 et 6,8 Hz, 1 H) ; 11,10 à 13,03 (m étalé, 1 H).
L'acide (4-méthylpipérazin-1-yl)acétique peut être préparé comme décrit dans
le brevet US 2005/0256164 p.27.
Exemple 11 : (2-{[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]amino)-2-oxoéthyl)carbamate de 2-méthylpropan-2-yle
Le composé peut être préparé comme dans l'exemple 8 mais à partir de 600
mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-ylamine, de 3,5
g d'acide tert-butoxycarbonylaminoacétique, de 3,83 g de chlorhydrate de 1-
(3-diméthylaminopropyl)-3-éthylcarbodiimide et de 30 ml de pyridine anhydre.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
73
On obtient 200 mg de 2-{[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]amino}-2-oxoéthyl) carbamate de 2-méthylpropan-2-yle
sous forme d'un solide crème.
Point de fusion > 260 C (Banc-Kôfler)
SM : méthode B ; [M+H]+: m/z = 457, [M-H]-: m/z = 455 ;Tr = 3,46 min.
RMN 1H (400 MHz, DMSO-d6) b ppm 1,39 (s, 9 H) ; 3,87 (d, J=6,0 Hz, 2 H),
7,13 (t large, J=6,0 Hz, 1 H) ; 7,19 (dd, J=4,2 et 6,8 Hz, 1 H), 7,22 (dd,
J=2,0
et 8,6 Hz, 1 H) ; 7,64 (d, J=8,6 Hz, 1 H) ; 7,84 (d, J=2,0 Hz, 1 H) ; 8,24 (s,
1
H) ; 8,69 (dd, J=2,0 et 4,2 Hz, 1 H); 8,87 (dd, J=2,0 et 6,8 Hz, 1 H) ; 12,36
(s
large, 1 H).
Exemple 12 : N-[6-(imidazo[ 1, 2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]glycinam ide, dichlorhydrate.
Une solution hétérogène de 390 mg de (2-{[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]amino}-2-oxoéthyl) carbamate de 2-
méthylpropan-2-yle et de 21,5 ml d'acide chlorhydrique dans l'éther éthylique
(solution 1 M) est agitée à une température voisine de 20 C pendant 4 heures.
Le milieu réactionnel est ensuite évaporé à sec sous pression réduite et le
résidu d'évaporation est trituré avec 10 ml d'acétate d'éthyle avant d'être
filtré,
lavé avec 5 ml d'acétate d'éthyle puis 2 fois 5 ml d'éther éthylique, essoré
et
séché sous pression réduite. On obtient ainsi 361 mg de 6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl] glycinamide dichlorhydrate
sous forme d'un solide jaune pâle.
Point de fusion - 242 C (Banc Kôfler)
SM : méthode A ; [M+H]+: m/z = 357, [M-H]-: m/z = 355 ;Tr = 0,39 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 3,94 (q, J=6,0 Hz, 2 H) ; 7,31 à 7,37
(m, 2 H) ; 7,71 (d, J=8,6 Hz, 1 H) ; 7,87 (d, J=2,0 Hz, 1 H) ; 8,32 (t large,
J=6,0 Hz, 3 H) ; 8,43 (s, 1 H) ; 8,82 (dd, J=2,0 et 4,2 Hz, 1 H) ; 8,98 (dd,
J=2,0 et 6,8 Hz, 1 H) ; 12,84 (s large, 1 H).
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
74
Exemple 13 : (trans A)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]-2-(morpholin-4-ylméthyl)cyclopropanecarboxamide et
Exemple 14 : (trans B)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]-2-(morpholin-4-ylméthyl)cyclopropanecarboxamide
Les composés peuvent être préparés comme dans l'exemple 8 mais à partir
de 300 mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-ylamine,
de 3 g d'acide (RR,SS)-trans-2-(morpholin-4-ylméthyl)-1-cyclopropane
carboxylique, de 2,59 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide et de 20 ml de pyridine anhydre. On obtient ainsi 195 mg
d'une poudre jaune. Les deux isomères (trans A et trans B) ont été séparés
par chromatographie (Chiralpak IC 5 pm, éluant
acétonitrile/éthanol/méthanol 8/l/1 puis acétonitrile/éthanol/méthanol 6/2/2).
On obtient ainsi 47,5 mg de (trans A)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(morpholin-4-
ylméthyl)cyclopropanecarboxamide sous forme d'un solide blanc et 52,3 mg
de (trans B)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]-
2-(morpholin-4-ylméthyl)cyclopropanecarboxamide sous forme d'un solide
blanc.
(trans A)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(morpholin-4-ylméthyl)cyclopropanecarboxamide:
SM : méthode B ; [M+H]+: m/z = 467, [M-H]-: m/z = 465 ;Tr = 2,54 min.
RMN 1H (400 MHz, DMSO-d6) b ppm 0,84 à 0,91 (m, 1 H), 1,13à 1,18 (m, 1
H) ; 1,43 à 1,49 (m, 1 H) ; 1,83 (m, 1 H) ; 2,27 (dd, J=7,3 et 13,0 Hz, 1 H);
2,37 (dd, J=6,4 et 13,0 Hz, 1 H) ; 2,41 (m, 4 H) ; 3,57 (m, 4 H) ; 7,20 (dd,
J=4,2 et 6,8 Hz, 1 H) ; 7,23 (dd, J=2,2 et 8,5 Hz, 1 H) ; 7,63 (d, J=8,5 Hz, 1
H)
7,83 (d, J=2,2 Hz, 1 H) ; 8,25 (s, 1 H) ; 8,70 (dd, J=2,0 et 4,2 Hz, 1 H) ;
8,88
(dd, J=2,0 et 6,8 Hz, 1 H), 12,62 (s large, 1 H).
(trans B)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-
(morpholin-4-ylméthyl)cyclopropanecarboxamide:
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
SM : méthode B ; [M+H]+: m/z = 467, [M-H]-: m/z = 465 ;Tr = 2,56 min.
RMN 1H (400 MHz, DMSO-d6) b ppm 0,85 à 0,91 (m, 1 H), 1,13 à 1,18 (m,
1 H) ; 1,43 à 1,49 (m, 1 H) ; 1,83 (m, 1 H) ; 2,27 (dd, J=6,9 et 12,7 Hz, 1 H)
;
2,37 (dd, J=6,4 et 12,7 Hz, 1 H) ; 2,41 (m, 4 H) ; 3,57 (m, 4 H) ; 7,20 (dd,
5 J=4,4 et 6,7 Hz, 1 H) ; 7,23 (dd, J=2,2 et 8,5 Hz, 1 H) ; 7,63 (d, J=8,5 Hz,
1 H)
7,83 (d, J=2,2 Hz, 1 H) ; 8,25 (s, 1 H) ; 8,70 (dd, J=2,0 et 4,4 Hz, 1 H) ;
8,88
(dd, J=2,0 et 6,7 Hz, 1 H), 12,62 (s large, 1 H)
L'acide (RR,SS)-trans-2-(morpholin-4-ylméthyl)-1-cyclopropane carboxylique
10 peut être préparé comme décrit dans le brevet WO 2001/02427, p.59.
Exemple 15: 2-(4-éthylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsu lfanyl)-1,3-benzoth iazol-2-yl]acétam ide
Le composé peut être préparé comme dans l'exemple 8 mais à partir de 300
15 mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-ylamine, de
1,27 g de bromhydrate de l' acide (4-éthylpipérazin-1-yl)acétique, de 0,96 g
de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide et de 20 ml
de pyridine anhydre. On obtient ainsi 280 mg de 2-(4-éthylpipérazin-1-yl)-N-
[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide sous
20 forme d'un solide beige.
Point de fusion = 210 C (Banc-Kôfler)
SM : méthode B ; [M+H]+: m/z = 454, [M-H]-: m/z = 452 ;Tr = 2,49 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 0,97 (t, J=7,2 Hz, 3 H) ; 2,31 (q, J=7,2
Hz, 2 H) ; 2,38 (s large, 4 H) ; 2,48 à 2,55 (m partiellement masqué, 4 H)
25 3,26 à 3,33 (m partiellement masqué, 2 H) ; 7,19 (dd, J=4,2 et 6,8 Hz, 1 H)
;
7,23 (dd, J=2,1 et 8,5 Hz, 1 H) ; 7,64 (d, J=8,5 Hz, 1 H) ; 7,85 (d, J=2,1 Hz,
1
H) ; 8,24 (s, 1 H) ; 8,69 (dd, J=2,0 et 4,2 Hz, 1 H) ; 8,86 (dd, J=2,0 et 6,8
Hz,
1 H) ; 12,02 (m étalé, 1 H)
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
76
L'acide (4-éthylpipérazin-1-yl)acétique peut être préparé comme décrit dans
le brevet US 2005/0256164 p.28.
Exemple 16: 2-(4-cyclopropylpipérazin-1 -yl)-N-[6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
Exemple 16a: 2-(4-cyclopropylpipérazin-1-yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)-1,3-benzothiazol-2-yl]acétamide
Le composé peut être préparé de la manière suivante
Une solution de 1,95 g de carboxylate de potassium de l' acide (4-
cyclopropylpipérazin-1-yl)acétique et 17,6 ml d'éther chlorhydrique (solution
2N dans l'éther diéthylique) est agitée à une température voisine de 20 C
pendant une nuit. Après concentration par évaporation sous pression réduite,
la poudre blanche ainsi obtenue est mise en réaction comme dans l'exemple
8 avec 260 mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-
ylamine, 1,69 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide et 20 ml de pyridine anhydre. On obtient ainsi 280 mg de 2-
(4-cyclopropylpipérazin-1 -yl)-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]acétam ide sous forme d'un solide beige.
Point de fusion = 224 C (Banc-Kôfler)
SM : méthode A ; [M+H]+: m/z = 466, [M-H]-: m/z = 464 ;Tr = 0,49 min.
RMN 1 H (400 MHz, DMSO-d6) b ppm 0,23 à 0,30 (m, 2 H) ; 0,36 à 0,42 (m,
2 H) ; 1,61 (m, 1 H) ; 2,45 à 2,58 (m partiellement masqué, 8 H) ; 3,26 à 3,33
(m partiellement masqué, 2 H) ; 7,19 (dd, J=4,2 et 6,8 Hz, 1 H) ; 7,23 (dd,
J=2,0 et 8,6 Hz, 1 H) ; 7,64 (d, J=8,6 Hz, 1 H) ; 7,85 (d, J=2,0 Hz, 1 H) ;
8,24
(s, 1 H) ; 8,69 (dd, J=2,0 et 4,2 Hz, 1 H) ; 8,86 (dd, J=2,0 et 6,8 Hz, 1 H) ,
11,98 (m étalé, 1 H).
Exemple 16b: carboxylate de potassium de l' acide (4-cyclopropylpipérazin-1-
yl)acétique
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
77
Le composé peut être préparé de la manière suivante:
Une solution de 1,39 g d'acide 2-bromoacétique et de 25 ml d'eau est
refroidie à l'aide d'un bain d'eau et de glace. Sont ajoutés alors 2 g de
dichlorhydrate de 4-cyclopropyl-pipérazine (produit commercial) et 2,76 g de
carbonate de potassium et le milieu réactionnel est maintenu sous agitation à
une température voisine de 20 C pendant 2 jours. Après concentration du
milieu réactionnel par évaporation sous pression réduite, le résidu obtenu est
repris par 50 ml de toluène puis concentré à nouveau par évaporation sous
pression réduite. Cette opération est répétée deux fois. La poudre blanche
ainsi obtenue est reprise par de l'éther diéthylique, filtrée, lavée par 3
fois 20
ml d'éther diéthylique et séchée. La poudre blanche ainsi obtenue est reprise
par 50 ml d'éthanol et la suspension résultante est agitée à une température
voisine de 20 C puis filtrée. Le résidu solide obtenu est lavé par 3 fois 20
ml
d'éthanol. Le filtrat est concentré par évaporation sous pression réduite, le
résidu solide est lavé avec 50 ml d'éther diéthylique. On obtient ainsi 1,95 g
de carboxylate de potassium de l' acide (4-cyclopropylpipérazin-1-yl)acétique
sous forme de poudre blanche.
SM : méthode B ; [M]+: m/z = 184, pic de base : m/z = 185 ;Tr = 0,40 min.
Exemple 17: N2,N2-diéthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]glycinam ide
Le composé peut être préparé comme dans l'exemple 16 mais à partir de 360
mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-ylamine, de
carboxylate de sodium de N,N-diéthylglycine, de 12 ml d'éther chlorhydrique
(solution 2N dans l'éther diéthylique), de 2,3 g de chlorhydrate de 1-(3-
diméthylaminopropyl)-3-éthylcarbodiim ide et de 30 ml de pyridine anhydre.
On obtient ainsi 220 mg de N2,N2-diéthyl-N-[6-(imidazo[1,2-a]pyrimidin-3-
ylsulfanyl)- 1,3-benzothiazol-2-yl]glycinamide sous forme d'un solide orange.
Point de fusion = 180 C (Banc-Kôfler)
SM : méthode A ; [M+H]+: m/z = 413 , [M-H]-: m/z = 411 ;Tr = 0,46 min.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
78
RMN 1 H (400 MHz, DMSO-d6) b ppm 0,98 (t, J=7,2 Hz, 6 H) ; 2,61 (q, J=7,2
Hz, 4 H) ; 3,38 (s, 2 H) ; 7,19 (dd, J=4,2 et 6,8 Hz, 1 H) ; 7,23 (dd, J=2,1
et
8,5 Hz, 1 H) ; 7,63 (d, J=8,5 Hz, 1 H), 7,84 (d, J=2,1 Hz, 1 H), 8,24 (s, 1
H),
8,69 (dd, J=2,1 et 4,2 Hz, 1 H) ; 8,86 (dd, J=2,1 et 6,8 Hz, 1 H) ; 11,69 (m
étalé, 1 H).
Exemple 18: N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]cyclopropanecarboxamide
Exemple 18a: N-[5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]cyclopropanecarboxam ide
Le composé peut être préparé de la manière suivante:
Dans un tube en verre scellé, on charge 352 mg de 3-bromoimidazo[1,2-
a]pyrimidine (produit commercial), 476 mg de N-[5-fluoro-6-sulfanyl-1,3-
benzothiazol-2-yl]cyclopropanecarboxam ide, 490 mg de carbonate de
potassium et 4 ml de diméthylsulfoxyde. Le milieu est chauffé par les pondes
à 185 C pendant 12 minutes. Après retour à une température voisine de
C, le milieu est versé sur 100 ml d'eau et de glace. Le précipité ainsi
formé est isolé par filtration sur verre fritté, lavé avec de l'eau et séché.
Le
solide isolé est ensuite en partie dissout dans un mélange dichlorométhane/
20 méthanol 90/10), filtré sur verre fritté et le filtrat est concentré à sec
par
évaporation sous pression réduite. Le solide isolé est chromatographié une
première fois sur gel de silice, sous pression d'argon (éluant
dichlorométhane/ méthanol 96/4). Les fractions intéressantes sont
concentrées à sec par évaporation sous pression réduite puis
chromatographiées une seconde fois, sous pression d'argon, sur gel de silice
(éluant dichlorométhane/ méthanol 98/2). On obtient ainsi 121 mg de N-[5-
fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide sous forme d'un solide beige.
Point de fusion > 260 C (Banc-Kôfler)
SM : méthode B ; [M+H]+: m/z = 386, [M-H]-: m/z = 384 ;Tr = 3,35 min.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
79
RMN 1 H (400 MHz, DMSO-d6) b ppm 0.86 - 0.99 (m, 4 H) 1.91 - 2.03 (m, 1
H) 7.23 (dd, J=6.9, 4.1 Hz, 1 H) 7.62 (d, J=10.5 Hz, 1 H) 7.68 (d, J=7.6 Hz, 1
H) 8.21 (s, 1 H) 8.70 (dd, J=4.1, 2.0 Hz, 1 H) 8.92 (dd, J=6.9, 2.0 Hz, 1 H)
12.67 (br. s., 1 H).
Exemple 18b: N-[5-fluoro-6-sulfanyl-1,3-benzothiazol-2-
yl]cyclopropanecarboxam ide
Le composé peut être préparé de la manière suivante:
Dans un monocol, on charge successivement 555 mg de thiocyanate de 2-
[(cyclopropylcarbonyl)amino]-5-fluoro-1,3-benzothiazol-6-yle, 18 ml d'éthanol,
une solution de 25 mg de dihydrogénophosphate de potassium dans 2 ml
d'eau distillée, 853 mg de 1,4-dithio-DL-threitol, et on porte la solution
hétérogène au reflux pendant 2 heures. Le milieu réactionnel est ensuite
versé sur 200 ml d'eau distillée, agité 10 minutes puis le solide est isolé
par
filtration, lavé à l'eau, essoré et séché sous pression réduite. On obtient
476
mg de N-[5-fluoro-6-sulfanyl-1,3-benzothiazol-2-yl]cyclopropanecarboxamide
sous forme d'un solide blanchâtre.
SM : méthode A ; [M+H]+: m/z = 269 , [M-H]-: m/z = 267 ;Tr = 0,91 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 0.88 - 1.02 (m, 4 H) 1.93 - 2.06 (m, 1 H)
5.47 (br. s., 1 H) 7.59 (d, J=10.3 Hz, 1 H) 8.01 (d, J=7.6 Hz, 1 H) 12.67 (br.
s.,
1 H).
Exemple 18c: Thiocyanate de 2-[(cyclopropylcarbonyl)amino]-5-fluoro-1,3-
benzothiazol-6-yle
Le composé peut être préparé selon l'exemple 2, à partir de 510 mg de
thiocyanate de 2-amino-5-fluoro-1,3-benzothiazol-6-yle, 262 pl de chlorure de
cyclopropanecarbonyle dans 10 ml de pyridine. On obtient ainsi 556 mg de
thiocyanate de 2-[(cyclopropylcarbonyl)amino]-5-fluoro-1,3-benzothiazol-6-yle
sous forme d'un solide blanchâtre.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
Point de fusion = 256 C (Banc-Kôfler).
SM : méthode A ; [M+H]+: m/z = 294, [M-H]-: m/z = 292 ;Tr = 0,90 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 0.89 - 1.06 (m, 4 H) 1.95 - 2.09 (m, 1 H)
7.83 (d, J=10.0 Hz, 1 H) 8.47 (d, J=7.1 Hz, 1 H) 12.91 (br. s., 1 H).
5
Exemple 18d: Thiocyanate de 2-amino-5-fluoro-1,3-benzothiazol-6-yle
Le composé peut être préparé de la manière suivante:
A une solution de 960 pl de 3-fluoroaniline dans 40 ml d'acide acétique, on
ajoute 3,9 g de thiocyanate de potassium et on agite le tout jusqu'à
10 dissolution totale de ce dernier. On coule ensuite goutte à goutte une
solution
de 1,02 ml de brome et 5 ml d'acide acétique. Le milieu réactionnel est agité
à une température voisine de 20 C pendant 16 heures. Le milieu épais est
ensuite versé sur 100 ml d'eau refroidie au bain de glace puis on alcalinise à
un pH voisin de 10 avec une solution d'ammoniaque à 28%. Le solide formé
15 est isolé par filtration, lavé à l'eau distillée, essoré et séché sous
pression
réduite puis chromatographié sur gel de silice, sous pression d'argon (éluant
dichlorométhane/méthanol 95/5). L'évaporation à sec sous pression réduite
des fractions permet d'obtenir 330 mg de thiocyanate de 2-amino-5-fluoro-
1,3-benzothiazol-6-yle sous forme d'un solide jaune.
20 SM : méthode A ; [M+H]+: m/z = 226, [M-H]-: m/z = 224 ;Tr = 0,65 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 7.36 (d, J=10.8 Hz, 1 H) 8.01 (s, 2 H)
8.11 (d, J=7.1 Hz, 1 H)
Exemple 19: 5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
25 benzothiazol-2-amine
Exemple 19a: 5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-amine
Le composé peut être préparé de la manière suivante:
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
81
Dans un tube en verre scellé, on charge 200 mg de 3-bromoimidazo[1,2-
a]pyrimidine (produit commercial), 240 mg de 2-amino-5-fluoro-1,3-
benzothiazole-6-thiol, 0,36 ml de N,N-diisopropyléthylamine, 170 mg de
bis(diphénylphosphino) 9,9-diméthylxanthène, 140 mg de
tris(dibenzylidèneacétone)dipalladium (0), 2 ml de 1,4-dioxane et deux
gouttes de diméthylformamide. Le milieu est chauffé par les pondes à 160 C
pendant 30 minutes. Après retour à température voisine de 20 C, le milieu est
concentré par évaporation sous pression réduite puis chromatographié sur
gel de silice, sous pression d'argon (éluant
dichlorométhane/méthanol/NH4OH 95/5/0,5). On ajoute aux fractions
contenant le produit attendu du méthanol et du méthanol chlorhydrique puis
on concentre par évaporation sous pression réduite. Le solide orange ainsi
obtenu est repris par une solution aqueuse de carbonate de potassium et
maintenu sous agitation. Le précipité formé est filtré sur verre fritté, lavé
par 3
fois 10 ml d'eau, 2 fois 10 ml d'éthanol et 2 fois 10 ml d'éther
isopropylique.
La poudre blanche ainsi obtenue est dissoute dans 2 ml de
diméthylsulfoxyde. Après avoir tiédi la suspension jusqu'à dissolution
complète puis refroidissement, un léger précipité est filtré. On ajoute alors
10
ml d'eau au filtrat et le précipité blanc obtenu est filtré sur verre fritté,
lavé par
3 fois 10 ml d'eau, 3 fois 10 ml d'éther diéthylique et séché. On obtient
ainsi
53 mg de 5-fluoro-6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
amine sous forme de poudre blanche.
Point de fusion > 264 C (Banc-Kôfler).
SM : méthode A ; [M+H]+: m/z = 318 , [M-H]-: m/z = 316 ;Tr = 0,54 min.
1H NMR (400 MHz, DMSO-d6) 8 ppm 7,19 (d, J=10,8 Hz, 1 H) ; 7,23 (dd,
J=4,3 et 6,7 Hz, 1 H) ; 7,53 (d, J=7,3 Hz, 1 H) ; 7,70 (s large, 2 H) ; 8,16
(s, 1
H) ; 8,68 (dd, J=2,1 et 4,3 Hz, 1 H) ; 8,93 (dd, J=2,1 et 6,7 Hz, 1 H)
Exemple 19b: 2-amino-5-fluoro-1,3-benzothiazole-6-thiol
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
82
Le composé peut être préparé comme dans l'exemple 18b mais à partir de 1
g de thiocyanate de 2-amino-5-fluoro-1,3-benzothiazol-6-yle, de 30 ml
d'éthanol, d'une solution de 14 mg de dihydrogénophosphate de potassium
dans 3 ml d'eau distillée et de 1,58 g de 1,4-dithio-DL-threitol. On obtient
ainsi
750 mg de 2-amino-5-fluoro-1,3-benzothiazole-6-thiol sous forme d'un solide
jaune pâle.
Point de fusion = 223 C (Banc-Kôfler).
SM : méthode A ; [M+H]+: m/z = 201;Tr = 0,58 min.
Exemple 20: N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]-3-méthoxypropanam ide
Le composé peut être préparé comme dans l'exemple 8 mais à partir de 320
mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-ylamine, de 1
ml d' acide acide 3-méthoxypropanoïque, de 2,05 g de chlorhydrate de 1-(3-
diméthylaminopropyl)-3-éthylcarbodiimide et de 20 ml de pyridine anhydre.
On obtient ainsi 45 mg de N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]-3-méthoxypropanamide sous forme d'un solide blanc.
Point de fusion = 225 C (Banc-Kôfler)
SM : méthode A ; [M+H]+ m/z = 386, [M-H]- m/z = 384 ; Tr = 0,64 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 2,70 (t, J=6,1 Hz, 2 H) ; 3,23 (s, 3 H) ;
3,63 (t, J=6,1 Hz, 2 H) ; 7,20 (dd, J=4,3 et 6,8 Hz, 1 H) ; 7,23 (dd, J=2,1 et
8,5
Hz, 1 H) ; 7,63 (d, J=8,5 Hz, 1 H) ; 7,85 (d, J=2,1 Hz, 1 H) ; 8,24 (s, 1 H) ,
8,69 (dd, J=2,1 et 4,3 Hz, 1 H) ; 8,87 (dd, J=2,1 et 6,8 Hz, 1 H) ; 12,35 (m
étalé, 1 H)
Exemple 21: N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzothiazol-2-yl]-2-(4-méthyl-3-oxopipérazin-1-yl)acétamide
Exemple 21a: N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
83
yl]-2-(4-méthyl-3-oxopipérazin-1 -yl)acétamide
Le composé peut être préparé comme dans l'exemple 8 mais à partir de 140
mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-ylamine, de 1
ml de chlorhydrate d' acide (4-méthyl-3-oxopipérazin-1-yl)acétique, de 0,94 g
de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide et de 10 ml
de pyridine anhydre. On obtient ainsi 160 mg de N-[6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]-2-(4-méthyl-3-oxopipérazin-1-
yl)acétamide sous forme d'un solide beige.
Point de fusion - 264 C (Banc-Kôfler)
SM : méthode B ; [M+H]+ m/z = 454, [M-H]- m/z = 452 ; Tr = 2,77 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 2,77 à 2,84 (m, 5 H) ; 3,16 (s, 2 H) ,
3,24 à 3,33 (m partiellement masqué, 2 H) ; 3,42 (s, 2 H) ; 7,19 (dd, J=4,3 et
6,8 Hz, 1 H) ; 7,23 (d large, J=8,5 Hz, 1 H) ; 7,62 (d large, J=8,5 Hz, 1 H) ,
7,84 (s large, 1 H) ; 8,24 (s, 1 H) ; 8,69 (dd, J=2,1 et 4,3 Hz, 1 H) ; 8,87
(dd,
J=2,1 et 6,8 Hz, 1 H) ; 12,17 (m étalé, 1 H)
Exemple 21 b: acide (4-méthyl-3-oxopipérazin-1 -yl)acétique
Le composé peut être préparé de la manière suivante:
Une solution de 0,61 g d'acide 2-bromoacétique, de 10 ml d'eau, de 0,74 g de
chlorhydrate de 1-méthyl-pipérazin-2-one (produit commercial) et de 0,61 g
de carbonate de potassium est maintenue sous agitation à une température
voisine de 20 C pendant 18 heures. Sont ajoutés alors 0,31 g de carbonate
de potassium et l'agitation est maintenue une heure. Le milieu réactionnel est
acidifié (pH-1) par ajout d'une solution aqueuse d'acide chlrorhydrique (1 N)
puis concentré par évaporation sous pression réduite. Le résidu obtenu est
repris par 2 fois 30 ml de toluène puis concentré. Le solide jaune obtenu est
repris par 5 ml d'éthanol, filtré sur verre fritté et lavé par deux fois 5 ml
d'éthanol. Le filtrat est concentré par évaporation sous pression réduite et
on
obtient ainsi 1,03 g de chlorhydrate d' acide (4-méthyl-3-oxopipérazin-1-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
84
yl)acétique sous forme de meringue jaune.
SM : méthode A ; [M+H]+: m/z = 173 , [M-H]-: m/z = 171 ;Tr = 0,11 min.
Exemple 22: N-{6-[(7-aminoimidazo[1,2-a]pyrimidin-3-yl)sulfanyl]-1,3-
benzothiazol-2-yl)cyclopropanecarboxamide
Exemple 22a: N-{6-[(7-aminoimidazo[1,2-a]pyrimidin-3-yl)sulfanyl]-1,3-
benzoth iazol-2-yl}cyclopropanecarboxam ide
Le composé peut être préparé comme dans l'exemple 18a mais à partir de
0,88 g de (2-bromoimidazo[1,2-a]pyrimidin-7-yl)imidodicarbonate de bis(2-
méthylpropan-2-yle), de 640 mg de N-(6-sulfanyl-1,3-benzothiazol-2-
yl)cyclopropanecarboxam ide, de 620 mg de carbonate de potassium et de 10
ml de diméthylsulfoxyde. On obtient ainsi 240 mg de N-{6-[(7-
aminoimidazo[1,2-a]pyrimidin-3-yl)sulfanyl]-1,3-benzothiazol-2-
yl}cyclopropanecarboxamide sous forme d'un solide jaune pâle.
Point de fusion > 264 C (Banc-Kôfler)
SM : méthode A ; [M+H]+ m/z = 383, [M-H]- m/z = 381 ; Tr = 0,54 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 0,90 à 0,98 (m, 4 H) ; 1,93 à 2,01 (m, 1
H) ; 6,35 (d, J=7,3 Hz, 1 H) ; 7,07 (s large, 2 H) ; 7,14 (dd, J=2,0 et 8,6
Hz, 1
H) ; 7,63 (d, J=8,6 Hz, 1 H) ; 7,66 (s, 1 H) ; 7,77 (d, J=2,0 Hz, 1 H) ; 8,22
(d,
J=7,3 Hz, 1 H), 12,63 (m étalé, 1 H)
Exemple 22b: N-(6-sulfanyl-1,3-benzothiazol-2-yl)cyclopropanecarboxamide
Le composé peut être préparé de la manière suivante:
A une suspension de 2 g de (6-thiocyanato-1,3-benzothiazol-2-
yl)cyclopropanecarboxamide et de 70 ml d'éthanol, on ajoute une solution de
33,6 mg de dihydrogénophosphate de potassium dans 8 ml d'eau à 20 C,
suivi de 3,2 g de 1,4-dithio-DL-threitol. Le milieu réactionnel est agité au
reflux pendant 5 heures puis ramené à une température voisine de 20 C. 400
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
ml d'eau sont alors ajoutés et le précipité formé est filtré sur verre fritté,
lavé
abondamment à l'eau, essoré puis séché. On obtient ainsi 1,5 g de N-(6-
sulfanyl-1,3-benzothiazol-2-yl)cyclopropanecarboxamide sous forme d'un
solide jaune pâle.
5 SM : méthode B ; [M+H]+ m/z = 251 ; [M-H]- m/z = 249 ; Tr = 3,77 min.
Exemple 22c : (6-thiocyanato-1,3-benzothiazol-2-
yl)cyclopropanecarboxam ide
Le composé peut être préparé de la manière suivante:
10 A une solution de 10 g de thiocyanate de 2-amino-1,3-benzothiazol-6-yle
(produit commercial) et de 100 ml de pyridine, on ajoute 5,3 ml de chlorure de
cyclopropanecarbonyle en maintenant la température voisine de 20 C. Le
milieu réactionnel est agité pendant 4 heures puis 500 ml d'eau sont ajoutés.
Le précipité formé est filtré sur verre fritté, lavé abondamment à l'eau,
essoré
15 puis séché. On obtient ainsi 13 g de (6-thiocyanato-1,3-benzothiazol-2-
yl)cyclopropanecarboxam ide sous forme d'une solide jaune pâle utilisé tel
quel dans les étapes ultérieures.
Le (2-bromoimidazo[1,2-a]pyrimidin-7-yl)imidodicarbonate de bis(2-
méthylpropan-2-yle) peut être préparé comme décrit dans le brevet WO
20 2002/074773 p.62.
Exemple 23: N-(6-{[6-(3-fluorophényl)imidazo[1,2-a]pyrimidin-3-
yl]su lfanyl}-1,3-benzoth iazol-2-yl)cyclopropanecarboxam ide
Exemple 23a: N-(6-{[6-(3-fluorophényl)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-
25 1,3-benzothiazol-2-yl)cyclopropanecarboxamide
Le composé peut être préparé de la manière suivante:
Dans un tube en verre scellé, on charge 450 mg de 3-bromo-6-(3-
fluorophényl)imidazo[1,2-a]pyrimidine, 400 mg de N-[6-sulfanyl-1,3-
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
86
benzothiazol-2-yl]cyclopropanecarboxamide, 430 mg de carbonate de
potassium et 10 ml de diméthylsulfoxyde. Le milieu est chauffé par les
pondes à 185 C pendant 12 minutes. Après retour à température voisine de
20 C, le milieu est versé sur 200 ml d'eau et de glace, extrait par 4 fois 50
ml
d'un mélange dichlorométhane/ méthanol 90/10. Les extraits organiques
réunis sont lavés par 2 fois 50 ml d'eau distillée, séchés sur sulfate de
magnésium, filtrés et concentrés à sec par évaporation sous pression réduite.
Le solide isolé est chromatographié une première fois sur gel de silice, sous
pression d'argon (éluant dichlorométhane/méthanol 96/4). Les fractions
intéressantes sont concentrées à sec par évaporation sous pression réduite
puis chromatographiées une seconde fois sur colonne Chiralpak IC 20 pM
(éluant acétonitrile/éthanol 90/10). On obtient ainsi 86 mg de N-(6-{[6-(3-
fluorophényl)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-benzothiazol-2-
yl)cyclopropanecarboxam ide sous forme d'un solide ocre.
SM : méthode B ; [M+H]+ m/z = 462, [M-H]- m/z = 460 ; Tr = 4,14 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 0,89 à 0,96 (m, 4 H), 1,91 à 2,01 (m, 1
H) ; 7,24 à 7,33 (m, 2 H) ; 7,55 (dt, J=6,3 et 8,1 Hz, 1 H) ; 7,62 (m, 2 H) ;
7,70
(td, J=2,0 et 10,5 Hz, 1 H) ; 7,89 (d, J=2,0 Hz, 1 H); 8,27 (s, 1 H) ; 9,07
(d,
J=2,7 Hz, 1 H) ; 9,08 (d, J=2,7 Hz, 1 H) ; 12,57 (m étalé, 1 H)
Exemple 23b: 3-Bromo-6-(3-fluorophényl)imidazo[1,2-a]pyrimidine
Le composé peut être préparé de la manière suivante:
Une solution de 426 mg de 6-(3-fluorophényl)imidazo[1,2-a]pyrimidine, 356
mg de N-bromosuccinimide et 20 ml de chloroforme est chauffée au reflux
pendant 5 heures. Après concentration à sec par évaporation sous pression
réduite du milieu réactionnel, le résidu obtenu est repris par 30 ml d'eau
distillée, agité 30 minutes et le solide est isolé par filtration, lavé à
l'eau
distillée puis avec 5 ml d'éthanol et ensuite 5 ml d'ether éthylique, essoré
et
séché sous pression réduite. On obtient ainsi 450 mg de 3-bromo-6-(3-
fluorophényl)imidazo[1,2-a]pyrimidine sous forme d'un solide beige.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
87
SM : méthode A ; [M+H]+ m/z = 292 ; Tr = 0,77 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 7.25 - 7.38 (m, 1 H) 7.59 (td, J=8.0, 6.2
Hz, 1 H) 7.68 - 7.76 (m,1 H) 7.81 (dt, J=10.5, 2.1 Hz, 1 H) 7.95 (s, 1 H) 8.95
-
9.03 (m, 2 H).
Exemple 23c: (3-fluorophényl)imidazo[1,2-a]pyrimidine
Le composé peut être préparé de la manière suivante:
Dans un tube en verre scellé, on charge 400 mg de 6-bromoimidazo[1,2-
a]pyrimidine (produit commercial), 345 mg d'acide 3-fluorophénylboronique,
69 mg de palladium tétrakistriphénylphosphine, 2m1 d'une solution aqueuse
2M de carbonate de sodium, et 8 ml de diméthylformamide. Le milieu est
chauffé par les pondes à 150 C pendant 20 minutes. Après retour à
température voisine de 20 C, le milieu est filtré sur lit de clarcel FLO M,
rincé
avec 2 fois 2 ml de diméthylformamide puis 2 fois 5 ml de méthanol. Le filtrat
est concentré à sec par évaporation sous pression réduite. Le solide isolé est
mis en suspension dans 80 ml d'eau distillée, agité, filtré, lavé avec de
l'eau
distillée, essoré et séché sous pression réduite. On obtient ainsi 430 mg de 6-
(3-fluorophényl)imidazo[1,2-a]pyrimidine sous forme d'un solide marron clair.
SM : méthode A ; [M+H]+ m/z = 214 ; Tr = 0,38 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 7.28 (td, J=8.5, 2.6 Hz, 1 H) 7.51 - 7.66
(m, 2 H) 7.69 (dt, J=10.5, 2.0 Hz, 1 H) 7.78 (d, J=1.5 Hz, 1 H) 7.92 (d, J=1.5
Hz, 1 H) 8.93 (d, J=2.7 Hz, 1 H) 9.38 (d, J=2.7 Hz, 1 H).
Exemple 24: N-(6-{[6-(cyclohexyloxy)imidazo[1,2-a]pyrimidin-3-
yl]sulfanyl}-1,3-benzothiazol-2-yl)cyclopropanecarboxamide
Exemple 24a: N-(6-{[6-(cyclohexyloxy)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-
1,3-benzothiazol-2-yl)cyclopropanecarboxamide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
88
Le composé peut être préparé comme dans l'exemple 19a mais à partir de 78
mg de 3-bromo-6-(cyclohexyloxy)imidazo[1,2-a]pyrimidine, de 85 mg de (6-
sulfanyl-1,3-benzothiazol-2-yl)cyclopropanecarboxamide, de 93 pl de N,N-
diisopropyléthylamine, de 36 mg de tris(dibenzylidèneacétone)dipalladium
(0), de 46 mg de 4,5-bis(diphénylphosphino) 9,9-diméthylxanthène et de 3 ml
de 1,4-dioxane. On obtient ainsi 44 mg de N-(6-{[6-
(cyclohexyloxy)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-benzothiazol-2-
yl)cyclopropanecarboxam ide sous forme d'un solide crème.
Point de fusion - 161 C (Banc-Kôfler).
SM : méthode A ; [M+H]+ m/z = 466 ; [M-H]- m/z = 464 ; Tr = 1,01 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 0,88 à 0,98 (m, 4 H) ; 1,14 à 1,41 (m, 5
H) ; 1,46 (m, 1 H) ; 1,55 à 1,66 (m, 2 H) ; 1,73 à 1,83 (m, 2 H) ; 1,93 à 2,02
(m, 1 H) ; 4,28 à 4,41 (m, 1 H) ; 7,26 (dd, J=2,0 et 8,6 Hz, 1 H) ; 7,63 (d,
J=8,6 Hz, 1 H) ; 7,85 (d, J=2,0 Hz, 1 H) ; 8,13 (s, 1 H) ; 8,26 (d, J=2,9 Hz,
1
H) ; 8,53 (d, J=2,9 Hz, 1 H) ; 12,60 (m étalé, 1 H)
Exemple 24b: 3-bromo-6-(cyclohexyloxy)imidazo[1,2-a]pyrimidine
Le 3-bromo-6-(cyclohexyloxy)imidazo[1,2-a]pyrimidine peut être préparé
comme dans l'exemple 23b mais à partir de 74 mg de 6-
(cyclohexyloxy)imidazo[1,2-a]pyrimidine, de 7 ml de chloroforme et de 65 mg
de N-bromosuccinimide. On obtient ainsi 79 mg de 3-bromo-6-
(cyclohexyloxy)imidazo[1,2-a]pyrimidine sous forme d'une huile marron.
SM : méthode B ; [M+H]+ m/z = 296 ; Tr = 3,84 min.
Exemple 24c : 6-(cyclohexyloxy)imidazo[1,2-a]pyrimidine
La 6-(cyclohexyloxy)imidazo[1,2-a]pyrimidine peut être préparée de la
manière suivante :
Dans un tube en verre, on charge 12 ml d'éthanol, 920 mg d'hydroxyde de
potassium en pastilles et 1 g de 6-bromoimidazo[1,2-a]pyrimidine. Le tube est
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
89
scellé et chauffé par les pondes à 135 C pendant 12 minutes. Après retour à
une température voisine de 20 C, on ajoute 1,5 ml de bromocyclohexane. Le
tube est de nouveau scellé et le tout chauffé par les pondes à 140 C pendant
15 minutes. Après retour à une température voisine de 20 C, le milieu
réactionnel est évaporé à sec sous pression réduite et le solide isolé est
chromatographié, sous pression d'argon, sur gel de silice (éluant
dichorométhane/méthanol 97/3). On obtient ainsi 75 mg de 6-
(cyclohexyloxy)imidazo[1,2-a]pyrimidine sous forme d'un solide beige.
SM : méthode B ; [M+H]+ m/z = 218 ; Tr = 2,54 min.
Exemple 25: 3-[(2-amino-1,3-benzothiazol-6-yl)sulfanyl]-N-
cyclohexylimidazo[1,2-a]pyrimidin-6-amine
Exemple 25a: 3-[(2-amino-1,3-benzothiazol-6-yl)sulfanyl]-N-
cyclohexylimidazo[1,2-a]pyrimidin-6-amine
Le composé peut être préparé comme dans l'exemple 19a mais à partir de
310 mg de 3-bromo-N-cyclohexylimidazo[1,2-a]pyrimidin-6-amine, de 230 mg
de (6-sulfanyl-1,3-benzothiazol-2-yl)cyclopropanecarboxamide, de 380 pl de
N,N-diisopropyléthylamine, de 140 mg de
tris(dibenzylidèneacétone)dipalladium (0), de 180 mg de 4,5-
bis(diphénylphosphino) 9,9-d iméthylxanthène, de 3 ml de 1,4-dioxane et de 5
gouttes de diméthylformamide. On obtient ainsi 25 mg de 3-[(2-amino-1,3-
benzothiazol-6-yl)sulfanyl]-N-cyclohexylimidazo[1,2-a]pyrimidin-6-amine sous
forme d'un solide beige.
SM : méthode A ; [M+H]+ m/z = 397, [M-H]- m/z = 395 ; Tr = 0,68 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 0,94 à 1,35 (m, 5 H), 1,50 à 1,69 (m, 3
H) ; 1,71 à 1,81 (m, 2 H) ; 2,97 à 3,10 (m, 1 H) ; 5,82 (d, J=7,6 Hz, 1 H) ;
7,08
(dd, J=2,1 et 8,6 Hz, 1 H) ; 7,23 (d, J=8,6 Hz, 1 H) ; 7,51 (s large, 2 H) ;
7,53
(d, J=2,9 Hz, 1 H) ; 7,58 (d, J=2,1 Hz, 1 H) ; 7,90 (s, 1 H) ; 8,32 (d, J=2,9
Hz,
1 H)
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
Exemple 25b: 3-bromo-N-cyclohexylimidazo[1,2-a]pyrimidin-6-amine
Le composé peut être préparé comme dans l'exemple 23b mais à partir de
720 mg de N-cyclohexylimidazo[1,2-a]pyrimidin-6-amine, de 60 ml de
5 chloroforme et de 530 mg de N-bromosuccinimide. On obtient ainsi 330 mg
de 3-bromo-N-cyclohexylimidazo[1,2-a]pyrimidin-6-amine sous forme d'une
poudre marron.
Point de fusion = 190 C (Banc-Kôfler).
SM : méthode A ; [M+H]+ m/z = 295 ; Tr = 0,72 min.
Exemple 25c: N-cyclohexylimidazo[1,2-a]pyrimidin-6-amine
Le produit peut être préparé de la manière suivante:
Dans un tube en verre, on charge 3,2 g de 6-bromoimidazo[1,2-a]pyrimidine,
5,5 ml de cyclohexylamine et 32 ml d'acétonitrile. Le tube est scellé et
chauffé
par les pondes à 120 C pendant 30 minutes. Après retour à une température
voisine de 20 C, on ajoute 100 ml d'une solution aqueuse de carbonate de
potassium et la phase aqueuse résultante est extraite par 3 fois 150 ml
d'acétate d'éthyle et 1 fois 150 ml de dichlorométhane. Les phases
organiques sont réunies, lavées par 2 fois 200 ml d'une solution aqueuse de
chlorure de sodium, séchées sur sulfate de sodium, filtrées et concentrées
par évaporation sous pression réduite. Le résidu obtenu est chromatographié
sur gel de silice (éluant dichlorométhane/méthanol 95/5).On obtient ainsi 720
mg de N-cyclohexylimidazo[1,2-a]pyrimidin-6-amine sous forme d'une huile
brune.
SM : méthode A ; [M+H]+ m/z = 217 ; Tr = 0,45 min.
Exemple 26: N-(6-{[6-(benzylamino)imidazo[1,2-a]pyrimidin-3-
yl]su lfanyl}-1,3-benzoth iazol-2-yl)cyclopropanecarboxam ide
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
91
Exemple 26a: N-(6-{[6-(benzylamino)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-
1,3-benzothiazol-2-yl)cyclopropanecarboxamide
Le N-(6-{[6-(benzylamino)imidazo[1,2-a]pyrimidin-3-yl]sulfanyl}-1,3-
benzothiazol-2-yl)cyclopropanecarboxam ide peut être préparé comme dans
l'exemple 19a mais à partir de 100 mg de N-benzyl-3-bromoimidazo[1,2-
a]pyrimidine-6-amine, de 95 mg de (6-sulfanyl-1,3-benzothiazol-2-
yl)cyclopropanecarboxam ide, de 114 pl de N,N-diisopropyléthylamine, de 43
mg de tris(dibenzylidèneacétone)dipalladium (0), de 55 mg de 4,5-
bis(diphénylphosphino) 9,9-diméthylxanthène et de 4 ml de 1,4-dioxane. On
obtient ainsi 65 mg de N-(6-{[6-(benzylamino)imidazo[1,2-a]pyrimidin-3-
yl]sulfanyl}-1,3-benzothiazol-2-yl)cyclopropanecarboxamide sous forme d'un
solide jaune clair.
Point de fusion > 260 C (Banc-Kôfler)
SM : méthode A ; [M+H]+ m/z = 473 ; [M-H]- m/z = 471 ; Tr = 0,81 min.
1 H NMR (400 MHz, DMSO-d6) 8 ppm 0,92 à 0,97 (m, 4 H) ; 1,94 à 2,03 (m, 1
H) ; 4,20 (d, J=6,0 Hz, 2 H) ; 6,68 (t, J=6,0 Hz, 1 H) ; 7,03 à 7,11 (m, 2 H)
,
7,18 (t, J=7,5 Hz, 2 H) ; 7,27 (d, J=7,5 Hz, 2 H) ; 7,53 à 7,61 (m, 2 H) ;
7,69
(d, J=2,0 Hz, 1 H) ; 7,94 (s, 1 H) ; 8,42 (d, J=2,9 Hz, 1 H) ; 12,62 (m étalé,
1
H)
Exemple 26b: N-benzyl-3-bromoimidazo[1,2-a]pyrimidin-6-amine
La N-benzyl-3-bromoimidazo[1,2-a]pyrimidine-6-amine peut être préparée
comme dans l'exemple 23b mais à partir de 110 mg de N-benzylimidazo[1,2-
a]pyrimidine-6-amine, de 10 ml de chloroforme et de 89 mg de N-
bromosuccinimide. On obtient ainsi 109 mg de N-benzyl-3-bromoimidazo[1,2-
a]pyrimidine-6-amine sous forme d'un solide beige.
SM : méthode A ; [M+H]+ m/z = 303 ; Tr = 0,66 min.
Exemple 26c: N-benzylimidazo[1,2-a]pyrimidine-6-amine
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
92
La N-benzylimidazo[1,2-a]pyrimidine-6-amine peut être préparée de la
manière suivante :
Dans un tube en verre, on charge 670 pl de benzylamine, 2 ml d'acétonitrile
et 400 mg de 6-bromoimidazo[1,2-a]pyrimidine. Le tube est scellé et chauffé
par les pondes à 120 C pendant 30 minutes. Après retour à une température
voisine de 20 C, le milieu réactionnel est évaporé à sec par évaporation sous
pression réduite et le solide isolé est chromatographié, sous pression d'argon
sur gel de silice (éluant dichorométhane/méthanol 95/5). On obtient ainsi 112
mg de N-benzylimidazo[1,2-a]pyrimidine-6-amine sous forme d'une laque
orange.
SM : méthode A ; [M+H]+ m/z = 225 ; Tr = 0,38 min.
Exemple 27: N-[6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-1,3-
benzoth iazol-2-yl]tétrahydro-2H-pyran-4-carboxamide
Le composé peut être préparé comme dans l'exemple 8 mais à partir de 350
mg de 6-(imidazo[1,2-a]pyrimidin-3-ylsulfanyl)-benzothiazol-2-ylamine, de 1,5
g d' acide tétrahydro-2H-pyran-4-carboxylique (produit commercial), de 2,24 g
de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide et de 20 ml
de pyridine anhydre. On obtient ainsi 200 mg de N-[6-(imidazo[1,2-
a]pyrimidin-3-ylsulfanyl)-1,3-benzothiazol-2-yl]tétrahydro-2H-pyran-4-
carboxamide sous forme d'un solide blanc.
Point de fusion = 270 C (Banc-Kôfler)
SM : méthode A ; [M+H]+ m/z = 412 ; [M-H]- m/z = 410 ; Tr = 0,66 min.
RMN 1H (400 MHz, DMSO-d6) b ppm 1,54 à 1,82 (m, 4 H) ; 2,67 à 2,87 (m,
1 H) ; 3,35 (m partiellement masqué, 2 H) ; 3,90 (m, 2 H) ; 7,14 à 7,27 (m, 2
H) ; 7,63 (m, 1 H) ; 7,85 (s, 1 H) ; 8,24 (s, 1 H) ; 8,69 (m, 1 H), 8,87 (m, 1
H),
12,34 (m étalé, 1 H)
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
93
Exemple 28: Composition pharmaceutique
On a préparé des comprimés répondant à la formule suivante :
Produit de l'exemple 1 ...................... 0,2 g
Excipient pour un comprimé terminé à .......... 1 g
(détail de l'excipient : lactose, talc, amidon, stéarate de magnésium).
L'exemple 1 est pris à titre d'exemple de préparation pharmaceutique, cette
préparation pouvant être réalisée si désiré avec d'autres produits en
exemples dans la présente demande.
Partie pharmacologique :
Protocoles expérimentaux
I) Expression et Purification de MET, domaine cytoplasmique
Expression en Baculovirus:
L'ADN recombinant His-Tev-MET (956-1390) en pFastBac(Invitrogen) est
transfecté dans des cellules d'insectes et après plusieurs étapes
d'amplification virale, le stock de baculovirus final est testé pour
l'expression
de la protéine d'intérêt.
Après infection pendant 72h à 27 C avec le virus recombinant, les cultures de
cellules SF21 sont récoltées par centrifugation et les culots cellulaires sont
stockés à -80 C.
Purification :
Les culots cellulaires sont remis en suspension dans le tampon de lyse
(tampon A [50 mM HEPES, pH 7.5, 250 mM NaCI, Glycérol 10%, TECP 1
mM ]; + cocktail d'inhibiteurs de protéases Roche Diagnostics sans EDTA,
réf 1873580), agités à 4 C jusqu'à homogénéité, puis lysés mécaniquement
en utilisant un appareil de type Dounce .
Après centrifugation, le surnageant de lyse est incubé 2h à 4 C avec de la
résine Nickel Chelate (His-Trap 6 Fast Flow TM, GE HealthCare). Après
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
94
lavage avec 20 volumes de Tp A, la suspension est packée dans une
colonne, et les protéines sont éluées par un gradient de tampon B (TpA + 290
mM imidazole).
Les fractions contenant la protéine d'intérêt au vu de l'analyse
électrophorétique (SDS PAGE) sont rassemblées, concentrés par
Ultrafiltration (cut-off lOkDa) et injectées sur une colonne de
chromatographie
d'exclusion (Superdex TM 200 , GE HealthCare) équilibrée en tampon A.
Après clivage enzymatique du tag Histidine, la protéine est réinjectée sur une
nouvelle colonne de chromatographie IMAC Nickel Chelate (His-Trap 6 Fast
Flow TM, GE HealthCare) équilibrée en Tampon A. Les fractions éluées par un
gradient de tampon B et contenant la protéine d'intérêt après électrophorèse
(SDS PAGE), sont finalement rassemblées et conservées à -80 C.
Pour la production de protéine autophosphorylée, les fractions précédentes
sont incubées 1 h à température ambiante après ajout d'ATP 2mM, MgCl2
2mM, et Na3VO4 4mM. Après arrêt de la réaction avec 5mM d'EDTA, le
mélange réactionnel est injecté sur une colonne de dessalage HiPrep (GE
HealthCare) préalablement équilibré en tampon A + Na3VO4 4mM, les
fractions contenant la protéine d'intérêt (analyse SDS PAGE) sont
rassemblées et stockées à -80 C. Le taux de phosphorylation est vérifié par
spectrométrie de masse (LC-MS), et par peptide mapping.
II) Tests A et B
A) Test A : Essai HTRF MET en format 96 puits
Dans un volume final de 50pl de réaction enzymatique, MET 5nM final est
incubé en présence de la molécule à tester (pour une gamme concentration
finale de 0,17 nM à 10 pM, DMSO 3% final) en tampon MOPS lOmM pH 7.4
DTT 1 mM, Tween 20 0.01 %. La réaction est initiée par la solution substrats
pour obtenir les concentrations finales de poly-(GAT) 1 pg/ml, ATP 10pM et
MgCl2 5mM. Après une incubation de 10 min à température ambiante, la
réaction est arrêtée par un mix de 30 pl pour obtenir une solution finale d'
Hepes 50mM pH 7.5, fluorure de potassium 500mM, BSA 0,1% et EDTA
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
133mM en présence de 80ng Streptavidine 61SAXLB Cis-Bio Int. et 18ng
anti-Phosphotyrosine Mab PT66-Europium Cryptate par puits. Après 2
heures d' incubation à température ambiante, la lecture est faite à 2 longueur
d' ondes 620nm et 665 nm sur un lecteur pour la technique TRACE / HTRF et
5 le % d' inhibition est calculé d' après les ratios 665/620.
Les résultats obtenus par ce test A pour les produits de formule (I) en
exemples dans la partie expérimentale sont tels que IC50 inférieure à 500nM
et notamment à 100nM.
B) Test B : Inhibition de l'autophosphorylation de MET ; technique ELISA
10 (pppY1230,1234,1235)
a) Lysats cellulaires : Ensemencer les cellules MKN45 en plaque 96 puits
(Ceil coat BD polylysine) à 20 000 cellules/puits sous 200pl en milieu RPMI +
10%SVF + 1 % L-glutamine. Laisser adhérer 24h à l'incubateur.
Les cellules sont traitées le lendemain de l'ensemencement avec les produits
15 à 6 concentrations en duplicate pendant l h. Au moins 3 puits contrôles
sont
traités avec la même quantité de DMSO finale.
Dilution des produits : Stock à lOmM dans le DMSO pur - Gamme de lOmM
à 30pM avec un pas de 3 en DMSO pur - Dilutions intermédiaires au 1/50
dans du milieu de culture puis prélèvement de 10pl ajoutés directement aux
20 cellules (200pl) : gamme finale de 10000 à 30nM.
A la fin de l'incubation, éliminer délicatement le surnageant et faire un
rinçage
avec 200pl de PBS. Puis mettre 100pl de tampon de lyse directement dans
les puits sur la glace et incuber à 4 C pendant 30minutes. Tampon de lyse :
lOmM Tris,HCI pH7.4, 100mM NaCI, 1 mM EDTA, 1 mM EGTA, 1% Triton X-
25 100, 10% glycerol, 0.1% SDS, 0.5% deoxycholate, 20mM NaF, 2mM
Na3VO4, 1 mM PMSF et cocktail anti protéases.
Les 100pl de lysats sont transférés dans une plaque en polypropylène fond
en V et l'ELISA est réalisé de suite ou la plaque est congelée à -80 C.
b) ELISA PhosphoMET BioSource Kit KH00281
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
96
Dans chaque puits de la plaque du kit, ajouter 70pl de tampon de dilution du
kit + 30pL de lysat cellulaire ou 30pl de tampon de lyse pour les blancs.
Incuber pendant 2h sous agitation douce à température ambiante.
Rincer 4 fois les puits avec 400pl de tampon de lavage du kit. Incuber avec
100pl d'Anticorps anti-phospho MET pendant 1 h à température ambiante.
Rincer 4 fois les puits avec 400pl de tampon de lavage du kit. Incuber avec
100 pl d'Anticorps anti-lapin HRP pendant 30 minutes à température
ambiante (sauf pour les puits chromogen seul).
Rincer 4 fois les puits avec 400pl de tampon de lavage du kit. Mettre 100pL
de chromogen et incuber 30minutes dans le noir à température ambiante.
Arrêter la réaction avec 100pl de solution stop. Lire sans tarder à 450nM 0,1
seconde au Wallac Victor plate reader.
C) Test C : Mesure de la prolifération cellulaire par pulse de 14C-thymidine
Les cellules sont ensemencées dans des plaques Cytostar 96 puits sous
180pl pendant 4 heures à 37 C et 5% C02 : Les cellules HCT1 16 à raison de
2500 cellules par puits dans du milieu DMEM + 10% sérum de veau foetal +
1 % de L-Glutamine et les cellules MKN45 à raison de 7500 cellules par puits
dans du milieu RPMI + 10% sérum de veau foetal + 1% de L-Glutamine.
Après ces 4 heures d'incubation, les produits sont ajoutés sous 10pl en
solution 20 fois concentrée selon la méthode de dilution citée pour l'ELISA.
Les produits sont testés à 10 concentrations en duplicate de 10000nM à
0,3nM avec un pas de 3.
Après 72h de traitement, ajouter 10pl de 14C-thymidine à 10pCi/ml pour
obtenir 0,1 pCi par puits. L'incorporation de 14C-thymidine est mesurée sur un
Micro-Beta (Perkin-Elmer) après 24 heures de pulse et 96h de traitement.
Toutes les étapes de l'essai sont automatisées sur les stations BIOMEK 2000
ou TECAN.
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
97
Les résultats obtenus par ce test B pour les produits de formule (I) en
exemples dans la partie expérimentale sont tels que IC50 inférieure à
1 OmicroM et notamment à 1 microM.
Les résultats obtenus pour les produits en exemples dans la partie
expérimentale sont donnés dans le tableau de résultats pharmacologiques ci-
après, comme suit :
pour le test A, le signe + correspond à inférieur à 500nM et le signe ++
correspond à inférieur à 100nM.
pour le test B le signe + correspond à supérieur inférieur( !!) à 500nM et le
signe ++ correspond à inférieur à 100nM.
pour le test C le signe + correspond à inférieur à 10microM et le signe ++
correspond à inférieur à 1 microM.
Tableau de résultats pharmacologiques
exemple Test A Test B Test C
1 ++ + ++
2 ++ ++ ++
3 ++ ++ ++
4 ++ ++ ++
5 ++ ++ ++
6 + ++
7 ++ ++ ++
8 ++ ++ ++
9 + ++
10 ++ ++ ++
11 ++ + ++
12 + ++
13 ++ ++ ++
14 ++ ++ ++
CA 02730964 2011-01-14
WO 2010/007318 PCT/FR2009/051408
98
15 ++ ++ ++
16 ++ ++ ++
17 ++ + ++
18 ++ ++ ++
19 ++ ++ ++
20 ++ ++ ++
21 ++ ++ ++
22 ++ ++ ++
23 ++ ++ ++
24 ++ ++ ++
25 ++ ++ ++
26 ++ ++ ++
27 ++ + ++
15