Note: Descriptions are shown in the official language in which they were submitted.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
1
DERIVES INDOLIQUES POUR LE TRAITEMENT DE MALADIES
NEURODEGENERATIVES
La présente invention concerne des composés possédant un motif indole
substitué par une chaîne aliphatique utiles pour le traitement de maladies
neurodégénératives, ainsi que leur procédé de préparation et leur utilisation.
Avec l'allongement de l'espérance de vie, de plus en plus de personnes sont
atteintes de maladies neurodégénratives telles que la maladie d'Alzheimer ou
la maladie
de Parkinson.
Une maladie neurodégénérative est caractérisée par une mort apoptotique
progressive de sous populations neuronales particulières, liée à un déficit
fonctionnel
des axes de transmission atteints. Ce type de maladie affecte le
fonctionnement du
système nerveux central, et en particulier du cerveau, de façon progressive,
la maladie
pouvant évoluer plus ou moins rapidement (quelques semaines à plusieurs
années), et
souvent de manière irréversible. Selon la région du système nerveux central
atteint par
la maladie, différentes fonctions pourront être affectées comme la motricité,
le langage,
la mémoire, la perception ou encore la cognition. Parmi les maladies
neurodégénératives les plus fréquentes, on peut citer en particulier la
maladie
d'Alzheimer et la maladie de Parkinson.
La maladie d'Alzheimer, qui touche environ 24 millions de personnes dans le
monde entier, est une maladie du tissu cérébral qui entraîne la perte
progressive et
irréversible des fonctions mentales. Le premier symptôme est la perte du
souvenir des
événements récents (amnésie), puis les déficits cognitifs s'étendent aux
domaines du
langage (aphasie), de l'organisation des mouvements (apraxie), de la
reconnaissance
visuelle (agnosie) et des fonctions exécutives (telles que la prise de
décision et la
planification).
La maladie de Parkinson, quant à elle, affecte le système nerveux central et
provoque des troubles moteurs d'évolution progressive, notamment des
tremblements du
corps.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
2
L'utilisation thérapeutique de neurotrophines, décrites dans la maintenance de
diverses populations neuronales, a été proposée à des fins curatives. Bien que
l'administration de neurotrophines recombinantes dans des modèles animaux
lésés ait
montré un effet bénéfique sur la survie neuronale, leur utilisation chez
l'homme,
d'abord encourageante, s'est trouvée rapidement limitée. En effet, la très
forte
hydrophilie de ces composés, leur interdisant le passage de la barrière
hématoencéphalique ainsi que leur dégradation enzymatique rapide imposent une
administration intracrânienne répétée, génératrice d'effets secondaires
dramatiques.
Par ailleurs, les autres médicaments prescrits pour ces différentes maladies
neurodégénératives permettent uniquement de retarder l'évolution de la
maladie, aucun
ne permettant de guérir la maladie, ni même d' arrêter son évolution,
Il existe donc actuellement un réel besoin de trouver de nouvelles molécules
plus
actives et pouvant passer la barrière hématoencéphalique pour le traitement de
ces
maladies neurodégénératives.
Le noyau indole est un motif présent dans de nombreux composés naturels ou
non présentant des activités biologiques diverses, des activités
antimicrobiennes,
antiparasitaires, antioxydantes, neurotrophiques, et anti-inflammatoires ayant
été
reportées.
Des composés présentant une longue chaine aliphatique greffée sur un indole
ont
été reportés pour leurs propriétés neurotrophiques (Coowar D. et al. J. Med.
Chem.
2004, 47, 6270). Ces structures déjà décrites présentent une chaine
directement couplée
au cycle indolique, cependant aucune structure dérivant de la tryptamine n'a
été étudiée
pour ces propriétés.
Les inventeurs ont alors découverts de manière intéressante que des dérivés
naturels de la tryptamine, de type N-acyltryptamine à longue chaine, extraits
de
certaines plantes de la famille des Annonaceae, notamment Annona atemoya,
Annona
reticulata et Rollinia mucosa (Wu Y.-C. et al. J. Nat. Prod. 2005, 68(3), 406-
408) et
d'autres analogues de synthèse dérivant de la tryptamine, possédaient une
activité
protectrice et différenciatrice des neurones dopaminergiques en culture.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
3
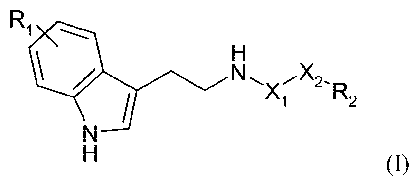
La présente invention a donc pour objet un composé de formule (I) suivante :
Ri \
N~ ~X2
2
I X~ R
N
N
H (I)
ou un sel pharmaceutiquement acceptable de celui-ci, un stéréoisomère ou un
mélange
de stéréoisomères en toutes proportions, en particulier un mélange
d'énantiomères, et
notamment un mélange racémique,
dans laquelle:
- Xi représente un groupe CH2 ou C=O,
- X2 représente une chaîne hydrocarbonée linéaire, saturée ou insaturée,
comportant de 1 à 24, de préférence de 8 à 22, atomes de carbone,
- Ri représente un atome d'hydrogène ou un groupe OH ou (Ci-C6)alcoxy, tel
que méthoxy, et
- R2 représente un groupe CH3 ou CH2OR3, avec R3 représentant un atome
d'hydrogène ou un groupe (Ci-C6)alkyle, CO-(Ci-C6)alkyle ou NH-(Ci-
C6)alkyle.
pour son utilisation en tant que médicament, notamment en tant que médicament
neurotrophique ou neuroprotecteur, destiné avantageusement au traitement ou à
la
prévention de maladies neurodégénératives telles que la maladie d'Alzheimer,
la
maladie de Parkinson, la sclérose en plaques ou les accidents vasculaires
cérébraux.
Par groupement (C,-C6)alkyle , on entend, au sens de la présente invention,
une chaîne hydrocarbonée saturée, linéaire ou ramifiée, comportant de 1 à 6
atomes de
carbone, en particulier les groupes méthyle, éthyle, n-propyle, isopropyle, n-
butyle, iso-
butyle, sec-butyle, tert-butyle, n-pentyle, n-hexyle. De préférence, il s'agit
d'un groupe
méthyle.
Par groupement (Ci-C6)alcoxy , on entend, au sens de la présente invention,
un groupe (Ci-C6)alkyle tel que défini ci-dessus lié à la molécule par
l'intermédiaire
d'un atome d'oxygène. Il s'agit en particulier des groupes méthoxy, éthoxy, n-
propoxy,
isopropoxy, n-butoxy, iso-butoxy, sec-butoxy, tert-butoxy, n-pentoxy. De
préférence, il
s'agit d'un groupe méthoxy.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
4
Par groupement CO-(Ci-C6)alkyle , on entend, au sens de la présente
invention, un groupe (Ci-C6)alkyle tel que défini ci-dessus lié à la molécule
par
l'intermédiaire d'un groupement CO. Il peut s'agir en particulier d'un
groupement acyle
(-COCH3) ou enbcore éthylcarbonyle (-COCH2CH3).
Par groupement NH-(Ci-C6)alkyle , on entend, au sens de la présente
invention, un groupe (Ci-C6)alkyle tel que défini ci-dessus lié à la molécule
par
l'intermédiaire d'un groupement NH.
Par insaturée , on entend, au sens de la présente invention, que la chaîne
hydrocarbonée peut comportée une ou plusieurs insaturation(s).
Par insaturation , on entend, au sens de la présente invention, une double
ou
une triple liaison et de préférence une double liaison.
Dans la présente invention, on entend par pharmaceutiquement acceptable ce
qui est utile dans la préparation d'une composition pharmaceutique qui est
généralement
sûr, non toxique et ni biologiquement ni autrement non souhaitable et qui est
acceptable
pour une utilisation vétérinaire de même que pharmaceutique humaine.
Par sels pharmaceutiquement acceptables d'un composé, on entend désigner
dans la présente invention des sels qui sont pharmaceutiquement acceptables,
comme
défini ici, et qui possèdent l'activité pharmacologique souhaitée du composé
parent. De
tels sels comprennent :
(1) les hydrates et les solvates,
(2) les sels d'addition d'acide formés avec des acides inorganiques tels que
l'acide
chlorhydrique, l'acide bromhydrique, l'acide sulfurique, l'acide nitrique,
l'acide
phosphorique et similaires ; ou formés avec des acides organiques tels que
l'acide
acétique, l'acide benzènesulfonique, l'acide benzoïque, l'acide
camphresulfonique,
l'acide citrique, l'acide éthane-sulfonique, l'acide fumarique, l'acide
glucoheptonique,
l'acide gluconique, l'acide glutamique, l'acide glycolique, l'acide
hydroxynaphtoïque,
l'acide 2-hydroxyéthanesulfonique, l'acide lactique, l'acide maléique, l'acide
malique,
l'acide mandélique, l'acide méthanesulfonique, l'acide muconique, l'acide 2-
naphtalènesulfonique, l'acide propionique, l'acide salicylique, l'acide
succinique,
l'acide dibenzoyl-L-tartrique, l'acide tartrique, l'acide p-toluènesulfonique,
l'acide
triméthylacétique, l'acide trifluoroacétique et similaires ; et
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
(3) les sels formés lorsqu'un proton acide présent dans le composé parent soit
est
remplacé par un ion métallique, par exemple un ion de métal alcalin (Na-', KK
ou Li-' par
exemple), un ion de métal alcalino-terreux (comme Ca 2+ ou Mg2+) ou un ion
d'aluminium ; soit se coordonne avec une base organique ou inorganique. Les
bases
5 organiques acceptables comprennent la diéthanolamine, l'éthanolamine, N-
méthylglucamine, la triéthanolamine, la trométhamine et similaires. Les bases
inorganiques acceptables comprennent l'hydroxyde d'aluminium, l'hydroxyde de
calcium, l'hydroxyde de potassium, le carbonate de sodium et l'hydroxyde de
sodium.
Dans la présente invention, on entend désigner par stéréoisomères , des
diastéréoisomères ou des énantiomères. Il s'agit donc d'isomères optiques. Les
stéréoisomères qui ne sont pas des images dans un miroir l'un de l'autre sont
ainsi
désignés par diastéréoisomères , et les stéréoisomères qui sont des images
dans un
miroir non superposables sont désignés par énantiomères .
Un atome de carbone lié à quatre substituants non identiques est appelé un
centre chiral .
Un mélange équimolaire de deux énantiomères est appelé mélange racémique.
Selon un mode de réalisation particulier de l'invention, un composé selon
l'invention pourra répondre à la formule (la) suivante
Ri
H
1 N~ m " P
I X~ R2
N
H (la)
dans laquelle:
- représente indépendamment une liaison simple ou double,
- Xi, Ri et R2 sont tels que définis ci-dessus, et
- m représente un nombre entier supérieur ou égal à 1, et n et p représentent,
indépendamment l'un de l'autre, un nombre entier supérieur ou égal à 0 avec
m+n+p+4<24 et de préférence 8 <m+n+p+4<22.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
6
Plus particulièrement, le composé de l'invention pourra répondre à la formule
(Ib) ou (le) suivantes :
Ri
N
x, R2
N
H (Ib)
ou
Ri
\
1 / ~ m n p
N X
1 R2
P.
H (le)
pour lesquelles :
- Ri, R2 et Xi sont tels que définis ci-dessus,
- q représente un nombre entier compris entre 1 et 24, de préférence entre 8
et
22, et
- m, n et p sont tels que définis ci-dessus.
Ri représente un substituant du noyau indole, situé sur l'un quelconque des
atomes de carbone du motif indole. Il s'agira avantageusement d'un atome
d'hydrogène.
R2 représentera avantageusement un groupe CH3 ou CH2OH.
Avantageusement, Xi représente un groupe CH2.
Les composés de l'invention pourront être choisis en particulier parmi :
la N lb N
Q. / O N O
H
le N Id N
N O N O
H H
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
7
le N if N
N O N O
H H
Ig N~ ky21 li N~ 13 OH
N O N O
H H
lh
q._~/ N 4
O
H
2a N 2b 9. N
N N
H H
2c N~ 2d / N,_,(,,,< _~/ ~~
_J ~~ N N
H H
2e N _IIe 2f N N
H H
2 1 / N2i 1 / Nui'~OH
g
N
H H
N s _ 4
2h
N
H
La présente invention concerne également l'utilisation d'un composé de formule
(I) tel que défini ci-dessus pour la fabrication d'un médicament, notamment
d'un
médicament neurotrophique ou neuroprotecteur, destiné avantageusement au
traitement
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
8
ou à la prévention de maladies neurodégénératives telles que la maladie
d'Alzheimer, la
maladie de Parkinson, la sclérose en plaques ou les accidents vasculaires
cérébraux.
La présente invention concerne également une méthode de traitement ou de
prévention de maladies neurodégénératives telles que la maladie d'Alzheimer,
la
maladie de Parkinson, la sclérose en plaques ou les accidents vasculaires
cérébraux,
comprenant l'administration à un patient en ayant besoin d'une quantité
efficace d'un
composé de formule (I) tel que défini ci-dessus.
La présente invention a également pour objet un composé de formule (I)
suivante :
Ri \
N~ ~X2
I X~ R
2
N
N
H (I)
ou un sel pharmaceutiquement acceptable de celui-ci, un stéréoisomère ou un
mélange
de stéréoisomères en toutes proportions, en particulier un mélange
d'énantiomères, et
notamment un mélange racémique,
dans laquelle:
- Xi représente un groupe CH2 ou C=O,
- X2 représente une chaîne hydrocarbonée linéaire, saturée ou insaturée,
comportant de 1 à 24 de préférence de 8 à 22 atomes de carbone,
- Ri représente un atome d'hydrogène ou un groupe OH ou (Ci-C6)alcoxy, tel
que méthoxy, et
- R2 représente un groupe CH3 ou CH2OR3, avec R3 représentant un atome
d'hydrogène ou un groupe (Ci-C6)alkyle, CO-(Ci-C6)alkyle ou NH-(Ci-
C6)alkyle.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
9
à l'exclusion des composés de formule :
/ N Y1u CH3
N
H , avec u = 14, 16 à 18 ou 20 à 24.
Les composés exclus sont décrits dans Wu Y.-C. et al. J. Nat. Prod. 2005,
68(3),
406-408, et Chàvez D. et al. J. Nat. Prod. 1999, 62(8), 1119-1122 en tant que
nouveaux
composés isolés de graines d'Annona atemoya ou de Rollinia mucosa.
Selon un mode de réalisation particulier de l'invention, un composé selon
l'invention pourra répondre à la formule (la) suivante
Ri
1 / N~ m P
I X, R2
H (la)
dans laquelle:
- représente indépendamment une liaison simple ou double,
- Xi, Ri et R2 sont tels que définis ci-dessus, et
- m représente un nombre entier supérieur ou égal à 1, et n et p représentent,
indépendamment l'un de l'autre, un nombre entier supérieur ou égal à 0 avec
m+n+p+4<24 et de préférence 8<ni +n+p+4<22.
Plus particulièrement, le composé de l'invention pourra répondre à l'une des
formules (Ib) et (le) suivantes
Ri
Xi R2
H (Ib)
ou
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
\
Ri X
%. 1 R2
N
(le)
pour lesquelles
- R,, R2 et X, sont tels que définis ci-dessus,
- q représente un nombre entier compris entre 1 et 24, de préférence entre 8
et
5 22, et
- m, n et p sont tels que définis ci-dessus.
Ri représentera avantageusement un atome d'hydrogène.
R2 représentera avantageusement un groupe C113 ou CH2OH.
10 Avantageusement, Xi représente un groupe CH2.
Les composés de l'invention peuvent être choisis en particulier parmi
la / N lb N
N O N O
H
Id / N li N~ ~1sOH
N ~/ ~~ O N O
H H
1 / N 6 4
lh
_~/ ~~
N
H
2a 1 / N 2b 1 / N
N N
H H
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
11
2c N 2d
I I
N N
H H
2e N 2f Ç?. Y__~ N N H H
2g / N 2i N~,OH
N.
H
1 / N 6 4
2h '
N
H
La présente invention a également pour objet une composition pharmaceutique
comprenant au moins un composé de formule (I) tel que décrit précédemment et
un
véhicule pharmaceutiquement acceptable.
Les composés selon l'invention peuvent être administrés par voie orale,
sublinguale, parentérale, sous-cutanée, intramusculaire, intraveineuse,
transdermique,
locale ou rectale, et de préférence par voie orale.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale, sublinguale, parentérale, sous-cutanée,
intramusculaire,
intraveineuse, transdermique, locale ou rectale, l'ingrédient actif peut être
administré
sous formes unitaires d'administration, en mélange avec des supports
pharmaceutiques
classiques, aux animaux ou aux êtres humains. Les formes unitaires
d'administration
appropriées comprennent les formes par voie orale telles que les comprimés,
les gélules,
les poudres, les granules et les solutions ou suspensions orales, les formes
d'administration sublinguale et buccale, les formes d'administration
parentérale, sous-
cutanée, intramusculaire, intraveineuse, intranasale ou intraoculaire et les
formes
d'administration rectale.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
12
Lorsque l'on prépare une composition solide sous forme de comprimés, on
mélange l'ingrédient actif principal avec un véhicule pharmaceutique tel que
la gélatine,
l'amidon, le lactose, le stéarate de magnésium, le talc, la gomme arabique ou
analogues.
On peut enrober les comprimés de saccharose ou d'autres matières appropriées
ou
encore on peut les traiter de telle sorte qu'ils aient une activité prolongée
ou retardée et
qu'ils libèrent d'une façon continue une quantité prédéterminée de principe
actif.
On obtient une préparation en gélules en mélangeant l'ingrédient actif avec un
diluant et en versant le mélange obtenu dans des gélules molles ou dures.
Une préparation sous forme de sirop ou d'élixir peut contenir l'ingrédient
actif
conjointement avec un édulcorant, un antiseptique, ainsi qu'un agent donnant
du goût et
un colorant approprié.
Les poudres ou les granules dispersibles dans l'eau peuvent contenir
l'ingrédient
actif en mélange avec des agents de dispersion ou des agents mouillants, ou
des agents
de mise en suspension, de même qu'avec des correcteurs de goût ou des
édulcorants.
Pour une administration rectale, on recourt à des suppositoires qui sont
préparés
avec des liants fondant à la température rectale, par exemple du beurre de
cacao ou des
polyéthylènes glycols.
Pour une administration parentérale, intranasale ou intraoculaire, on utilise
des
suspensions aqueuses, des solutions salines isotoniques ou des solutions
stériles et
injectables qui contiennent des agents de dispersion et/ou des agents
mouillants
pharmaco logiquement compatibles.
Le principe actif peut être formulé également sous forme de microcapsules,
éventuellement avec un ou plusieurs supports additifs.
Les composés de l'invention peuvent être utilisés à des doses comprises entre
0,01 mg et 1000 mg par jour, donnés en une seule dose une fois par jour ou
administrés
en plusieurs doses tout au long de la journée, par exemple deux fois par jour
en doses
égales. La dose administrée par jour est avantageusement comprise entre 5 mg
et 500
mg, encore plus avantageusement entre 10 mg et 200 mg. Il peut être nécessaire
d'utiliser des doses sortant de ces gammes ce dont l'homme du métier pourra se
rendre
compte lui-même.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
13
Selon un mode de réalisation particulier, la composition pharmaceutique telle
que définie ci-dessus pourra comprendre en outre un autre principe actif,
utile
notamment dans le traitement ou la prévention de maladies neurodégénératives,
et
avantageusement choisi parmi des inhibiteurs d'acétylcholinestérase tels que
le
donézépil, la galanthamine, la rivastigmine, la mémantine et la tacrine ; des
inhibiteurs
de monoamines oxydase tels que la sélégiline ; des inhibiteurs de
catécholamines O-
méthyltransférase tels que l'entacapone ; des inhibiteurs glutamatergiques
tels que
l'amantadine et le baclofène ; des agonistes cholinergiques tels que la
sabcoméline ; des
agonistes dopaminergiques tels que le pergolide, le cabergoline, le ropirinole
et le
pramipexole ; des analogues ou précurseurs de neuromédiateurs tels que la L-
3,4-
dihydroxyphénylalanine ; et des anticholinergiques tels que le trihexyphénidyl
et la
tropatépine.
La présente invention a également pour objet une composition pharmaceutique
telle que définie ci-dessus, pour son utilisation en tant que médicament,
notamment en
tant que médicament neurotrophique ou neuroprotecteur, destiné avantageusement
au
traitement ou à la prévention de maladies neurodégénératives telles que la
maladie
d'Alzheimer, la maladie de Parkinson, la sclérose en plaques ou les accidents
vasculaires cérébraux.
La présente invention a également pour objet un procédé de préparation d'un
composé de formule (I) tel que décrit ci-dessus, caractérisé en ce qu'il
comprend les
étapes suivantes :
(a) couplage entre la tryptamine et un composé de formule (II) suivante :
Z-X2-R2 (II)
pour laquelle Z représente une fonction acide carboxylique sous forme libre ou
sous forme activée et R2 et X2 sont tels que définis ci-dessus,
pour donner un composé de formule (I-1) suivante :
R~ \
1 / N X2, R2
P.
H (I-1)
pour laquelle RI, R2 et X2 sont tels que définis précédemment,
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
14
(b) éventuellement réduction de la fonction carbonyle du composé de formule (I-
1)
obtenu à l'étape (a) précédente pour donner un composé de formule (I-2)
suivante
Ri
N/X2. R2
N
H (I-2)
pour laquelle RI, R2 et X2 sont tels que définis précédemment, et
(c) séparation du milieu réactionnel du composé (I-1) ou (I-2) obtenu à
l'étape
précédente.
Etatea:
Par fonction acide carboxylique sous forme libre , on entend, au sens de la
présente invention, un groupe CO2H.
Par fonction acide carboxylique sous forme activée , on entend, au sens de
la
présente invention, une fonction acide carboxylique modifiée de manière à la
rendre
plus active vis-à-vis d'un nucléophile. Ces formes activées sont bien connues
de
l'homme du métier et peuvent être en particulier un chlorure d'acide (COCI).
Ainsi, Z représentera avantageusement un groupe CO2H ou COC1.
Le composé de formule (II) pourra être en particulier un acide gras ou
analogue
disponible commercialement lorsque Z = CO2H. Dans le cas où Z représente une
fonction acide carboxylique activée, le composé de formule (II) pourra être
obtenu
facilement à partir de l'acide carboxylique correspondant, disponible dans le
commerce
par activation de la fonction acide carboxylique par des techniques bien
connues de
l'homme du métier. Ainsi, un chlorure d'acide pourra être obtenu notamment par
réaction de l'acide carboxylique correspondant avec du chlorure d'oxalyle en
présence
de quelques gouttes de diméthylformamide (DMF). Cette réaction peut être
réalisée
dans un solvant tel que le dichlorométhane, notamment à température ambiante.
Selon un premier mode de réalisation particulier de l'invention, le composé de
formule (II) utilisé comporte un groupe Z = CO2H (forme acide libre). Dans ce
cas, la
réaction de couplage sera réalisée en présence d'un agent de couplage, tel que
le
diisopropylcarbodiimide (DIC), le dicyclohexylcarbodiimide (DCC), le
chlorhydrate de
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
1-(3-diméthylaminopropyl)-3-éthylcarbodiimide (EDC), le carbonyldiimidazole
(CDI),
le 2-H-benzotriazole-1-yl)-1,1,3,3-tetraméthyluronium hexafluorophosphate
(HBTU), le
2-(IH-benzotriazole-1-yl)-1,1,3,3-tetraméthyluronium tetrafluoroborate (TBTU)
ou
encore le O-(7-azobenzotriazol-l-yl)-1,1,3,3-tétraméthyluronium
hexafluorophosphate
5 (HATU), éventuellement associé à un auxiliaire de couplage tel que le N-
hydroxy
succinimide (NHS), le N-hydroxy benzotriazole (HOBt), le 3,4-dihydro-3-hydroxy-
4-
oxo-1,2,3-benzotriazole (HOOBt), le 1-hydroxy-7-azabenzotriazole (HAt) ou le N-
hydroxysylfosuccinimide (sulfo NHS). De préférence, le couplage sera réalisé
en
présence du couple EDC/HOBt.
10 Cette réaction peut être réalisée dans un solvant tel que le
dichlorométhane,
notamment à température ambiante, une base telle que la triéthylamine pouvant
être
utilisée.
Ce premier mode de réalisation particulier est particulièrement adapté à la
préparation de composés de formule (I) pour lesquels R2 = CH2OH.
15 Selon un second mode de réalisation particulier de l'invention, le composé
de
formule (II) utilisé comporte un groupe Z sous forme d'une fonction acide
carboxylique
activée, et plus particulièrement sous forme d'un chlorure d'acide. Dans ce
cas, la
réaction de couplage sera avantageusement réalisée en présence d'une base
telle que la
triéthylamine.
Cette réaction pourra être mise en oeuvre dans un solvant tel que le
dichlorométhane, notamment à température ambiante.
Ce second mode de réalisation particulier sera avantageusement utilisé lorsque
R2 :~ CH2OH, et en particulier lorsque R2 = CH3, car les groupements
hydroxyles (OH)
réagissent avec le chlorure d'oxalyle.
Etat e b :
Cette étape de réduction permet de réduire l'amide en amine pour passer d'un
composé de formule (I) pour lequel Xi = C=O à un composé de formule (I) pour
lequel
Xi = CH2.
Cette étape sera avantageusement réalisée en présence d'un hydrure tel que
LiA1H4. Elle pourra être mise en oeuvre dans un solvant tel que le
tétrahydrofurane.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
16
Par hydrure , on entend, au sens de la présente invention, un composé
chimique capable de libérer des ions hydrures H-, permettant d'effectuer une
réaction de
réduction.
Etat e c :
La séparation du produit final du milieu réactionnel pourra être réalisée par
des
techniques bien connue de l'homme du métier, comme par exemple par extraction,
évaporation du solvant ou encore par précipitation et filtration.
Le composé de formule (I) ainsi obtenu pourra par ailleurs être purifié si
nécessaire par des méthodes bien connues de l'homme du métier, comme par
recristallisation si le composé est cristallin, par distillation, par
chromatographie sur
colonne sur gel de silice ou encore par chromatographie liquide haute
performance
(HPLC).
La présente invention sera mieux comprise à la lumière des exemples non
limitatifs qui suivent.
FIGURE :
La Figure 1 représente des photographies de neurones fluorescents obtenus dans
les
conditions du test à la DHR-123 sans traitement (contrôle) ou après traitement
avec du
TroloX à 10 gM ou avec le composé lh à 10 nM.
La Figure 2 représente la coupe du cerveau en 3 parties réalisées dans
l'exemple 2.3.
Les Figures 3 et 4 représentent les chromatogrammes (abscisses : temps en
minutes ,
ordonnées : intensité relative en pourcent) obtenus par HPLC-MS/MS à partir
d'extraits
de cerveaux des souris utilisées dans les expériences de l'exemple 2.3.
mettant en
évidence la présence ou non du composé selon l'invention 2c. La Figure 4
correspond
aux chromatogrammes obtenus dans le cadre du traitement per os tandis que la
Figure 5
correspond aux chromatogrammes obtenus dans le cadre du traitement intra-
péritonéal.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
17
EXEMPLES :
1. Synthèse des composés de l'invention
1.1. Synthèse des composés de formule (I) pour lesquels X1 = C=O
= Procédure générale de synthèse à partir d'un chlorure d'acide :
A une solution d'acide gras (2 mmol) dans le dichlorométhane (10 mL) placée à
0 C
sous atmosphère inerte sont ajoutés trois gouttes de diméthylformamide sec et
du
chlorure d'oxalyle (1,04 mL, 12 mmol). Le mélange est agité à 0 C pendant 1h.
Le
dichlorométhane et l'excès de chlorure d'oxalyle sont évaporés sous vide. Le
chlorure
d'acide ainsi obtenu est dissous dans 5 mL de dichlorométhane sec.
A une solution de tryptamine (160 mg, 1 mmol) dans le dichlorométhane (10 mL)
à 0 C
sous atmosphère inerte d'azote, sont ajoutés de la triéthylamine (0,55 mL, 2
mmol) et
lentement le chlorure d'acide en solution dans le dichlorométhane (5 mL). Le
mélange
réactionnel est agité à température ambiante pendant 2h. La réaction est
hydrolysée,
puis extraite au dichlorométhane. La phase organique est séchée sur MgSO4
anhydre
puis concentrée sous vide. Les produits sont purifiés sur colonne de silice
dans un
mélange de cyclohexane et d'acétate d'éthyle en proportions 8:2.
N-(2-(IH-indol-3 yl)éthyl)tridécanamide (la)
Rendement : 95%
RMN1H (400MHz, CDC13) 8 ppm: 0.88 (t, J= 6.8 Hz, 3H); 1.25 (m, 17H); 1.58 (m,
5H); 2.09 (t, J= 7.2 Hz, 2H); 2.98 (t, J= 6.8 Hz, 2H); 3.59 (t, J= 6.8 Hz,
1H); 3.62 (t, J=
6.8 Hz, I H), 5.48 (s, I H), 7.04 (d, J= 1.6 Hz, I H), 7.13 (t, J= 7.2 Hz, I
H), 7.22 (t, J=
7.2 Hz, 1H); 7.38 (d, J= 8.0 Hz, IH); 7.61 (d, J= 8.0 Hz, 1H,); 8.05 (s, 1H).
RMN13C (100MHz, CDC13) 8 ppm: 14.1, 22.5, 25.2, 29.2, 29.3, 29.5, 31.8, 36.8,
39.5,
111.1, 113.1, 118.6, 119.4, 121.8, 122.1, 127.4, 136.4, 173Ø
ESI-MS m/z: 379 ( [M+Na]+, 100).
IR cm-': 608, 671, 719, 739, 801, 847, 913, 1009, 1068, 1094, 1130, 1222,
1246, 1271,
1294, 1340, 1377, 1424, 1456, 1470, 1554, 1629, 1650, 2851, 2918, 2955, 3089,
3264,
3387.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
18
N-(2-(IH-indol-3 yl)éthyl)pentadécanamide (1b)
Rendement : 77%
RMNiH (400MHz, CDC13) S ppm: 0.88 (t, J= 6.8 Hz, 3H); 1.25 (m, 22H); 1.61 (m,
4H); 2.10 (t, J= 7.0 Hz, 2H); 2.98 (t, J= 6.8 Hz, 2H); 3.58 (t, J= 6.4 Hz,
1H); 3.65 (t, J=
6.4 Hz, I H); 5.49 (s, I H); 7.04 (s, I H); 7.12 (t, J= 7.0 Hz, I H); 7.22 (t,
J= 7.8 Hz, I H);
7.38 (d, J= 7.6 Hz, 1 H); 7.61 (d, J= 8.2 Hz, 1 H); 8.04 (s, 1 H).
RMN13C (100MHz, CDC13) 8 ppm: 14.1, 22.6, 22.9, 23.7, 25.3, 28.9, 29.2, 29.4,
29.6,
31.8, 36.8, 39.6, 111.2, 112.9, 118.6, 119.3, 122.0, 127.3, 128.7, 130.8,
136.4, 173.1.
ESI-MS m/z: 407 ([M+Na]+, 100).
IR cm': 607, 718, 739, 801, 931, 1010, 1069, 1094, 1130, 1225, 1297, 1340,
1377,
1425, 1456, 1470, 1555, 1630, 1650, 2850, 2918, 2955, 3267, 3387.
N-(2-(IH-indol-3yl)éthyl)hexadécanamide (1c)
Rendement : 87%
RMN'H (400MHz, CDC13) 8 ppm: 0.88 (t, J= 6.9 Hz, 3H); 1.25 (m, 30H); 1.57 (m,
4H); 2.09 (t, J= 7.2 Hz, 2H); 2.98 (t, J= 6.9 Hz, 2H); 3.60 (t, J= 6.6 Hz,
1H); 3.62 (t, J=
6.6 Hz, I H), 5.56 (s, I H), 7.04 (d, J= 2.1 Hz, I H), 7.13 (t, J=.8 Hz, I H),
7.22 (t, J= 6.9
Hz, 1H); 7.37 (d, J= 8.1 Hz, 1H); 7.61 (d, J= 7.2 Hz, 1H); 8.06 (s, 1H).
RMN13C (100MHz, CDC13) 8 ppm: 14.1, 22.7, 25.2, 25.3, 25.7, 26.9, 29.1, 29.3,
29.4,
29.5, 29.6, 29.7, 31.9, 33.4, 36.9, 39.7, 111.2, 113.0, 118.7, 119.4, 122.0,
122.1, 127.4,
136.4, 173.1.
ESI-MS m/z: 421 ([M+Na]+, 100).
IR cm': 608, 718, 739, 801, 1011, 1094, 1225, 1293, 1340, 1377, 1456, 1553,
1630,
2850, 2918, 3267, 3387.
N-(2-(IH-indol-3yl)éthyl)heptadécanamide (Id)
Rendement : 93%
RMN1H (400MHz, CDC13) 8 ppm: 0.88 (t, J= 6.6 Hz, 3H); 1.25 (m, 26H); 1.57 (m,
2H); 2.09 (t, J= 7.6 Hz, 2H); 2.98 (t, J= 6.8 Hz, 2H); 3.60 (t, J= 6.6 Hz,
1H); 3.62 (t, J=
6.6 Hz, 1H); 5.49 (s, 1H); 7.04 (d, J= 2.1 Hz, 1H); 7.13 (t, J= 7.6 Hz, 1H);
7.21 (t, J=
7.6 Hz, I H), 7.38 (d, J= 8.0 Hz, I H); 7.61 (d, J= 8 Hz, I H); 8.09 (s, I H).
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
19
RMN13C (100MHz, CDC13) 8 ppm: 14.1, 22.7, 25.4, 25.7, 29.3, 29.4, 29.6, 29.7,
31.9,
36.9, 39.6, 111.2, 113.1, 118.7, 119.5, 121.9, 122.2, 127.3, 136.4, 173.1.
ESI-MS m/z: 435 ([M+Na]+, 100).
IR cm': 717, 739, 800, 1010, 1067, 1094, 1225, 1300, 1339, 1377, 1423, 1456,
1471,
1552, 1629, 1649, 2850, 2918, 3267, 3393.
N-(2-(IH-indol-3 yl)éthyl)octadécanamide (le)
Rendement : 95%
RMN'H (400MHz, CDC13) S ppm: 0.88 (t, J= 6.9 Hz, 3H); 1.25 (m, 27H); 1.57 (m,
2H); 2.09 (t, J= 7.2 Hz, 2H); 2.98 (t, J= 6.6 Hz, 2H); 3.60 (t, J= 6.3 Hz,
1H); 3.62 (t, J=
6.3 Hz, I H), 5.45 (s, I H), 7.03 (d, J= 2.1 Hz, I H), 7.13 (t, J= 7.8 Hz, I
H), 7.21 (t, J=
7.8 Hz, 1 H); 7.38 (d, J= 8.1 Hz, 1 H); 7.61 (d, J= 7.2 Hz, 1H); 8.07 (s, 1
H).
RMN13C (100MHz, CDC13) 8 ppm: 14.1, 22.7, 25.4, 25.7, 29.3, 29.4, 29.5, 29.6,
29.7,
31.9, 36.9, 39.6, 111.2, 113.2, 118.8, 119.5, 121.9, 122.2, 127.4, 136.4,
173.1.
ESI-MS m/z: 449 ([M+Na]+, 100).
IR cm': 609, 718, 739, 800, 1013, 1094, 1224, 1298, 1339, 1377, 1424, 1456,
1553,
1629, 1649, 2850, 2918, 3267, 3392.
N-(2-(IH-indol-3yl)éthyl)icosanamide (If)
Rendement : 50%
RMN'H (400MHz, CDC13) S ppm: 0.88 (t, J= 6.8 Hz, 3H); 1.25 (m, 30H); 1.57 (m,
2H); 2.09 (t, J= 7.6 Hz, 2H); 2.98 (t, J= 6.8 Hz, 2H); 3.60 (t, J= 6.4 Hz,
1H); 3.62 (t, J=
6.4 Hz, I H), 5.05 (s, I H), 7.04 (s, I H), 7.13 (t, J= 8.0 Hz, I H), 7.21 (t,
J= 7.6 Hz, I H),
7.38 (d, J= 8.0 Hz, 1H); 7.61 (d, J= 7.6 Hz, 1H); 8.10 (s, 1H).
RMN13C (100MHz, CDC13) 8 ppm: 14.1, 22.7, 25.4, 25.7, 29.3, 29.4, 29.5, 29.7,
31.9,
33.7, 36.9, 39.6, 111.2, 113.1, 118.7, 119.5, 121.9, 122.2, 136.6, 173.1.
ESI-MS m/z: 477 ([M+Na]+, 100).
IR cm-': 669, 718, 739, 799, 913, 1012, 1066, 1095, 1222, 1299, 1339, 1377,
1424,
1456, 1472, 1552, 1629, 1649, 2850, 2917, 3269, 3394.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
N-(2-(IH-indol-3 yl)éthyl)tricosanamide (1g)
Rendement : 88%
RMN1H (400MHz, CDC13) S ppm: 0.88 (t, J= 6.6 Hz, 3H); 1.25 (m, 38H); 1.57 (m,
2H); 2.09 (t, J= 7.2 Hz, 2H); 2.98 (t, J= 6.4 Hz, 2H); 3.60 (t, J= 6.4 Hz,
1H); 3.62 (t, J=
5 6.4 Hz, I H); 5.47 (s, I H); 7.04 (d, J= 2,0 Hz, I H); 7.13 (t, J= 7.6 Hz, I
H); 7.21 (t, J=
7.6 Hz, 1 H); 7.3 8 (d, J= 8.4 Hz, 1 H); 7.61 (d, J= 8,0 Hz, 1 H); 8.02 (s, 1
H).
RMN13C (100MHz, CDC13) 8 ppm: 14.1, 22.7, 25.4, 25.7, 29.3, 29.4, 29.5, 29.7,
31.9,
33.7, 36.9, 39.6, 111.2, 113.1, 118.7, 119.5, 121.9, 122.2, 136.6, 173.1.
ESI-MS m/z: 497 ([M+Na]+, 100).
10 IR cm-': 560, 580, 612, 719, 738, 800, 983, 1093, 1225, 1342, 1377, 1462,
1472, 1564,
1628, 2848, 2917, 2959, 3258, 3396.
(8Z, IIZ)-N-(2-(IH-indol-3yl)éthyl)heptadéca-8, 11-diènamide (1h)
Rendement : 81%
15 RMN1H (400MHz, CDC13) 8 ppm: 0.90 (t, J= 6.8 Hz, 3H); 1.25 (m, 14H); 1.59
(t, J=
6.8 Hz, 2H); 2.06 (m, 4H); 2.10 (t, J= 7.2 Hz, 2H), 2.79 (t, J= 6.4 Hz, 2H),
2.98 (t, J=
6.4 Hz, 2H); 3.59 (t, J= 6.4 Hz, 1H); 3.62 (t, J= 6.4 Hz, 1H); 5.37 (m, 4H),
5.63 (s, 1H);
7.00 (d, J= 1.6 Hz, I H); 7.12 (t, J= 7.6 Hz, I H); 7.21 (t, J= 7.6 Hz, I H);
7.37 (d, J= 8.0
Hz, 1H); 7.60 (d, J= 7.6 Hz, 1H); 8.47 (s, 1H).
20 RMN13C (100MHz, CDC13) 8 ppm: 14.0, 22.5, 25.3, 25.6, 25.7, 27.1, 29.1,
29.2, 29.3,
29.4, 29.6, 31.5, 36.8, 39.7, 111.3, 112.8, 118.6, 119.3, 122.0, 127.3, 127.8,
128.0,
130.0, 130.2, 136.4, 173.2.
ESI-MS m/z: 445 ([M+Na]+, 100).
IR cm': 560, 580, 608, 719, 739, 801, 931, 1011, 1069, 1094, 1126, 1225, 1269,
1299,
1340, 1377, 1425, 1456, 1555, 1629, 1650, 2851, 2920, 3010, 3264, 3386.
= Procédure générale de synthèse à partir d'un acide carboxque libre :
A une solution de tryptamine (320 mg, 2 mmol) et d'acide carboxylique (518 mg,
2
mmol) dans le dichlorométhane (40 mL) sont ajoutés de la triéthylamine (0,83
mL, 6
mmol), de 1'EDC (768 mg, 4 mmol) et de 1'HOBt (405 mg, 3 mmol). Le mélange est
agité une nuit à température ambiante sous atmosphère inerte d'azote. La
réaction est
hydrolysée, puis extraite au dichlorométhane et lavée avec une solution
aqueuse saturée
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
21
en NH4C1. La phase organique est séchée sur MgSO4 anhydre et concentrée sous
vide.
Le produit est purifié sur colonne de silice dans un mélange de
dichlorométhane et de
méthanol en proportions 95 : 5.
N-(2-(IH-indol-3 yl)éthyl)-15-hydroxypentadécanamide (Ii)
Rendement : 60%
RMN1H (400MHz, CDC13) I ppm: 1.25 (m, 22H); 1.57 (m, 4H); 2.09 (t, J= 7.2 Hz,
2H); 2.98 (t, J= 6.8 Hz, 2H); 3.59-3.65 (m, 4H); 5.48 (s, 1H); 7.04 (d, J= 1.6
Hz, 1H);
7.13 (t, J= 7.6 Hz, I H); 7.22 (t, J= 8.0 Hz, I H); 7.38 (d, J= 8.0 Hz, I H);
7.61 (d, J= 8.0
Hz, 1H); 8.06 (s, 1H).
RMN13C (100MHz, CDC13) ô ppm: 24.8, 25.4, 25.7, 26.3, 29.3, 29.4, 29.5, 30.4,
39.6,
63.1, 105.1, 111.2, 118.5, 118.8, 119.5, 121.9, 122.3, 127.4, 183.4.
ESI-MS m/z: 423 ([M+Na]+, 100).
IR cm': 606, 704, 727, 741, 758, 974, 1012, 1026, 1057, 1109, 1166, 1224,
1267,
1357, 1375, 1457, 1556, 1629, 1669, 1982, 2037, 2849, 2917, 3275, 3394.
1.2. Synthèse des composés de formule (I) pour lesquels X = CH2
Procédure générale :
A une solution d'amide (tel que préparé précédemment) (1 mmol) dans le THF (10
mL)
placée à 0 C sous atmosphère inerte d'azote est ajouté lentement du LiA1H4
(304 mg, 8
mmol) par petites portions. Le mélange est ensuite chauffé au reflux pendant
2h. Après
refroidissement, la réaction est hydrolysée doucement par 1 mL d'eau, puis une
solution de NaOH 1M est ajoutée goutte à goutte jusqu'à obtention d'un
précipité blanc.
Le mélange est filtré sur célite, lavé à l'acétate d'éthyle puis séché sur
MgSO4 anhydre et
concentrée sous pression réduite.
N-(2-(IH-indol-3 yl)éthyl)tridécan-1-amine (2a)
Rendement : 84%
RMN1H (300MHz, CDC13) 8 ppm: 0.88 (t, J= 6.9 Hz, 3H); 1.25 (m, 21H); 1.46 (m,
2H); 2.62 (t, J= 7.2 Hz, 2H); 2.97 (m, 4H); 7.04 (d, J= 2.1 Hz, 1H); 7.12 (td,
J= 0.9 Hz,
J= 7.8 Hz, 1H); 7.20 (td, J= 1.2 Hz, J= 7.2 Hz, 1H); 7.36 (d, J= 7.8 Hz, IH);
7.64 (d, J=
7.8 Hz, 1 H); 8.10 (s, 1 H).
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
22
RMN13C (75MHz, CDC13) 8 ppm: 14.1, 22.7, 25.8, 27.4, 29.3, 29.6, 29.7, 30.1,
32.0,
50.0, 111.1, 114.2, 118.9, 119.2, 121.8, 122.0, 127.5, 136.4.
ESI-MS m/z: 343 ([M+H]+, 100).
IR cm': 565, 592, 611, 722, 739, 804, 842, 886, 914, 1010, 1078, 1104, 1221,
1309,
1341, 1358, 1376, 1453, 1467, 1504, 1553, 1622, 2849, 2916, 3063, 3139, 3275,
3387.
N-(2-(IH-indol-3 yl)éthyl)pentadécan-1-amine (2b)
Rendement : 83%
RMNiH (300MHz, CDC13) S ppm: 0.89 (t, J= 6.9 Hz, 3H); 1.26 (m, 24H); 1.46 (m,
2H); 2.62 (t, J= 7.2 Hz, 2H); 2.97 (m, 4H); 7.04 (d, J= 1.8 Hz, 1H); 7.12 (td,
J= 1.2 Hz,
J= 7.8 Hz, 1H); 7.20 (td, J= 1.2 Hz, J= 8.1 Hz, 1H); 7.36 (d, J= 7.8 Hz, 1H);
7.64 (d, J=
7.5 Hz, 1H); 8.18 (s, 1H).
RMN13C (75MHz, CDC13) 8 ppm: 14.1, 22.7, 25.8, 27.4, 27.5, 29.4, 29.6, 29.7,
30.1,
31.9, 50.0, 111.1, 114.1, 117.4, 118.9, 119.2, 121.8, 122.0, 128.4, 133.4.
ESI-MS m/z: 371 ([M+H]+, 100).
IR cm-': 592, 611, 721, 739, 805, 874, 1011, 1104, 1222, 1341, 1454, 1630,
2649,
2916, 3387.
N-(2-(IH-indol-3yl)éthyl)hexadécan-1-amine (2c)
Rendement : 50%
RMNiH (300MHz, CDC13) S ppm: 0.88 (t, J= 6.9 Hz, 3H); 1.25 (m, 26H); 1.47 (m,
2H); 2.61 (t, J= 7.2 Hz, 2H); 2.97 (m, 4H); 7.04 (d, J= 1.8 Hz, 1H); 7.11 (td,
J= 1.2 Hz,
J= 8.1 Hz, I H), 7.19 (td, J= 1.2 Hz, J= 8.1 Hz, I H), 7.36 (d, J= 8.1 Hz, I
H), 7.62 (d, J=
7.8 Hz, 1H); 8.21 (s, 1H).
RMN13C (75MHz, CDC13) 8 ppm: 14.1, 22.7, 25.6, 27.3, 29.3, 29.5, 29.6, 29.7,
29.8,
30.0, 31.9, 50.0, 111.1, 113.8, 118.8, 119.2, 122.0, 127.4, 136.4.
ESI-MS m/z: 385 ([M+H]+, 100).
IR cm-': 565, 592, 611, 721, 739, 784, 803, 842, 886, 910, 1011, 1105, 1222,
1341,
1376, 1454, 1467, 1621, 2849, 2916, 3053, 3139.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
23
N-(2-(IH-indol-3 yl)éthyl)heptadécan-1-amine (2d)
Rendement : 90%
RMNiH (200MHz, CDC13) S ppm: 0.88 (t, J= 6.9 Hz, 3H); 1.25 (m, 28H); 1.46 (m,
2H); 2.61 (t, J= 7.2 Hz, 2H); 2.97 (m, 4H); 7.05 (d, J= 2.1 Hz, I H); 7.12 (t,
J= 7.8 Hz,
I H); 7.20 (t, J= 7.5 Hz, I H); 7.37 (d, J= 8.1 Hz, I H); 7.64 (d, J= 7.8 Hz,
I H); 8.05 (s,
1H).
RMN13C (50MHz, CDC13) 8 ppm: 14.1, 22.7, 25.9, 27.4, 29.3, 29.6, 29.7, 30.2,
31.9,
50.0, 111.1, 114.2, 118.9, 119.2, 121.8, 122.0, 127.5, 136.4.
ESI-MS m/z: 399 ([M+H]+, 100).
IR cm': 565, 592, 612, 721, 739, 805, 841, 871, 891, 1011, 1074, 1105, 1223,
1342,
1358, 1376, 1454, 1466, 1505, 1622, 2849, 2916, 3064, 3141.
N-(2-(IH-indol-3yl)éthyl)octadécan-1-amine (2e)
Rendement : 52%
RMNiH (300MHz, CDC13) S ppm: 0.88 (t, J= 6.9 Hz, 3H); 1.25 (m, 30H); 1.46 (m,
2H); 2.62 (t, J= 7.2 Hz, 2H); 2.98 (m, 4H); 7.04 (d, J= 1.8 Hz, I H); 7.12 (t,
J= 7.8 Hz,
I H), 7.20 (t, J= 7.8 Hz, I H), 7.36 (d, J= 8.1 Hz, I H), 7.63 (d, J= 7.8 Hz,
I H), 8.11 (s,
1H).
RMN13C (75MHz, CDC13) 8 ppm: 14.1, 22.7, 25.4, 27.4, 29.4, 29.7, 30.0, 32.0,
49.9,
111.1, 114.0, 118.9, 119.2, 121.8, 121.9, 122.0, 136.4.
ESI-MS m/z: 413 ([M+H]+, 100).
IR cm-': 563, 577, 600, 735, 805, 1010, 1125, 1223, 1339, 1455, 1619, 2848,
2916,
3417.
N-(2-(IH-indol-3yl)éthyl)icosan-1-amine (2f)
Rendement : 74%
RMN'H (300MHz, CDC13) S ppm: 0.88 (t, J= 6.9 Hz, 3H); 1.25 (m, 34H); 1.54 (m,
2H); 2.62 (t, J= 7.2 Hz, 2H); 2.97 (m, 4H); 7.04 (d, J= 2.1 Hz, I H); 7.11 (t,
J= 7.8 Hz,
I H), 7.19 (t, J= 7.8 Hz, I H), 7.36 (d, J= 7.8 Hz, I H), 7.63 (d, J= 8.1 Hz,
I H), 7.98 (s,
1H).
RMN13C (75MHz, CDC13) 8 ppm: 14.1, 22.7, 25.8, 27.4, 29.4, 29.7, 30.1, 31.9,
49.9,
111.1, 114.1, 119.1, 119.6,121.8,122.0,127.4,136.4.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
24
ESI-MS m/z: 441 ([M+H]+, 100).
IR cm': 562, 572, 592, 609, 720, 740, 806, 868, 1011, 1104, 1221, 1341, 1455,
1626,
2849, 2916, 3244.
N-(2-(IH-indol-3 yl)éthyl)tricosan-1-amine (2g)
Rendement : 52%
RMN1H (300MHz, CDC13) 8 ppm: 0.88 (t, J= 6.8 Hz, 3H); 1.25 (m, 40H); 1.47 (m,
2H); 2.63 (t, J= 7.6 Hz, 2H); 2.99 (m, 4H); 7.06 (s, 1H); 7.12 (t, J= 7.6 Hz,
1H); 7.20 (t,
J= 7.6 Hz, 1H); 7.36 (d, J= 8.0 Hz, 1H); 7.62 (d, J= 8,0 Hz, 1H); 8.03 (s,
1H).
RMN13C (75MHz, CDC13) 8 ppm: 14.1, 22.7, 25.6, 27.3, 29.2, 29.3, 29.4, 29.5,
29.7,
31.9, 49.8, 111.1, 113.9, 118.9, 119.3, 122.0, 127.4, 136.4.
ESI-MS m/z: 483 ([M+H]+, 100).
IR cm': 577, 668, 720, 735, 746, 805, 1091, 1215, 1463, 1619, 2849, 2916,
3418.
(8Z, IIZ)-N-(2-(IH-indol-3 yl)éthyl)heptadéca-8,11-diènamine (2h)
Rendement : 52%
RMN'H (300MHz, CDC13) ô ppm: 0.89 (t, J= 6.8 Hz, 3H); 1.25 (m,14H); 1.49 (m,
2H); 2.04(m, 4H); 2.64 (t, J= 7.2 Hz, 2H), 2.77 (t, J= 6.4 Hz, 2H), 3.00 (m,
4H); 5.34
(m, 4H); 7.04 (s, 1H); 7.11 (t, J= 7.6 Hz, 1H); 7.19 (t, J= 7.2 Hz, 1H); 7.36
(d, J= 8.0
Hz, 1H); 7.63 (d, J= 7.6 Hz, 1H); 8.10 (s, 1H).
RMN13C (75MHz, CDC13) b ppm: 14.1, 22.6, 25.5, 25.6, 27.2, 27.3, 29.2, 29.3,
29.5,
29.6, 29.7, 31.5, 49.8, 111.1, 113.8, 118.9, 119.3, 121.9, 122.0, 127.4,
127.9, 128.0,
130.1, 130.2, 136.4.
ESI-MS m/z: 409 ([M+H]+, 100).
IR cm': 625, 738, 803, 1010, 1108, 1231, 1354, 1456, 1620, 2853, 2923, 3009,
3415.
N-(2-(IH-indol-3yl)éthyl)-15-hydroxypentadécanamine (2i)
Rendement : 71%
RMN'H (300MHz, CDC13) 8 ppm: 1.24 (m, 24H); 1.47 (m, 4H); 2.62 (t, J= 7.6 Hz,
2H); 2.97 (m, 4H); 3.64 (t, J= 6.8 Hz, 2H); 7.04 (d, J= 1.6 Hz, 1H); 7.11 (t,
J= 7.6 Hz,
I H), 7.20 (t, J= 7.6 Hz, I H); 7.36 (d, J= 8.0 Hz, I H); 7.63 (d, J= 8.0 Hz,
I H); 8.03 (s,
1H).
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
RMN13C (75MHz, CDC13) ô ppm: 25.7, 25.8, 27.4, 29.4, 29.5, 30.1, 32.8, 50.0,
63.0,
111.1, 114.2, 118.9, 119.3, 121.8, 122.0, 124.5, 136.4.
ESI-MS m/z: 387 ([M+H]+, 100).
IR cm': 587, 669, 727, 740, 760, 974, 1010, 1024, 1044, 1108, 1149, 1216,
1355,
5 1374, 1457, 1466, 1668, 2848, 2923, 3299, 3425.
2. Résultats biologiques
Comme indiqué dans le préambule, il existe un réel besoin de trouver de
nouvelles molécules petites et peu hydrophiles pour pouvoir passer la barrière
10 hématoencéphalique, et capables de mimer l'effet des neurotrophines.
In vitro, l'activité neurotrophique des facteurs de croissance neuronaux est
caractérisée par leur capacité d'une part à promouvoir la survie neuronale et
d'autre part
à stimuler leur maturation.
Dans le cadre de la recherche de petites molécules mimant des activités
15 neurotrophiques, une approche originale consiste à étudier séparément les
propriétés
neuroprotectrices et neuritogéniques des composés étudiés, les composés
d'intérêt
devant présenter les deux activités. La mesure de la neuritogénèse constitue
un critère
morphologique représentatif de l'état de maturation neuronale.
Par ailleurs, des composés antioxydants possèdent également une capacité
20 neuroprotectrice. C'est pourquoi il est également intéressant d'évaluer la
capacité
antioxydante des composés de l'invention.
2.1. Activités neuroprotectrice et neuritogénique des composés de l'invention
= Mode opératoire
25 Dissection. La dissection consiste à extraire les embryons de l'utérus
d'une ratte à
quinze jours de gestation. Le cerveau de chaque embryon est ensuite disséqué
sous une
loupe binoculaire afin d'en extraire le mésencéphale ventral.
Ensemencement. Les mésencéphales sont regroupés dans un falcon contenant 2 mL
de
milieu L15 puis dissociés mécaniquement (30 aller-retours), 5 mL de milieu L15
sont
ajoutés. La suspension est laissée reposer 8 minutes. Les 5 mL de surnageant
sont
récupérés dans un nouveau falcon et les cellules sont dissociées à nouveau (30
aller-
retours). 5 mL de L15 sont de nouveau ajoutés et la suspension est laissée à
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
26
reposer 8 minutes. Les 5 mL de surnageant sont ajoutés aux précédents. Les
cellules
ainsi extraites sont alors centrifugées 5 minutes à 1000 tr.min-'. Le culot
cellulaire est
repris dans du milieu Neurobasal supplémenté de 1% de B27, 1% de glutamine et
1%
d'un mélange de pénicilline/ streptomycine. Les cellules sont ensuite
ensemencées à la
dilution appropriée (0,6 embryon par puit de plaque 24 puits et 0,4 par puits
de plaque
de 48 puits). Les cultures sont incubées à 37 C dans une atmosphère humide
enrichie de
5% en C02 en plaque 24 puits ou 48 puits.
Traitement. Après 24 heures les deux tiers du milieu de chaque puits sont
remplacés
par du milieu neuf enrichi en produit à tester à la dilution appropriée. Le
milieu est
remplacé de la même façon après 4 jours de culture.
Immunohistochimie. A 8 jours de culture, les cellules sont fixées par une
solution de
formaldéhyde à 4% puis lavées trois fois au PBS. Les cellules sont ensuite
soumises à
l'immunohistochimie anti-tyrosine hydroxylase (TH) révélée par un anticorps
secondaire couplé à un fluorochrome émettant dans le rouge (Cy3).
Analyses. La neuroprotection est évaluée par comptage des neurones TH positifs
de 10
champs par puits directement sous microscope à fluorescence inversée, rapporté
en
pourcentage du contrôle non traité. Les expériences sont réalisées à raison de
trois puits
par condition. Trois expériences indépendantes sont réalisées dans ces
conditions. La
longueur neuritique totale par cellule est calculée par le logiciel Neurite
Outgrowth par
Explora Nova sur 60 à 100 neurones photographiés indépendamment par condition.
= Résultats
Le mésencéphale ventral contient les neurones dopaminergiques provenant de la
substance noire qui dégénèrent dans la maladie de Parkinson, ainsi que ceux
présents
dans l'aire tegmentale ventrale.
Des cultures primaires de mésencéphale ventral embryonnaire peuvent être
réalisées après extraction et dissection des embryons, collection et
dissociation des
mésencéphales ventraux et ensemencement de la suspension cellulaire dans des
plaques
multi-puits.
Les cultures primaires de mésencéphale ventral sont des cultures mixtes. Deux
populations neurales y sont représentées, les neurones et la glie. Les
neurones présents
en culture sont essentiellement GABAergiques (~94%), accompagnés de neurones
dopaminergiques (z3%) et sérotoninergiques (z3%). La glie est essentiellement
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
27
astrocytaire, on trouve également des oligodendrocytes et des microglies (~3%)
en
proportions plus faibles. D'autres types cellulaires non neuraux sont
également présents
en très faibles proportions comme des érythrocytes, fibroblastes et cellules
endothéliales.
Les différentes populations cellulaires peuvent être identifiées par
immunocytochimie de marqueurs spécifiques. Les neurones dopaminergiques sont
identifiés par marquage de la tyrosine hydroxylase.
Des études antérieures décrivent une dégénérescence spontanée, progressive et
spécifique des neurones dopaminergiques dans les cultures primaires de
mésencéphale
ventral (Guerreiro S. et al. Mol. Pharmacol. 2008, 74, 980-989).
Au cours du temps, le nombre de neurones dopaminergiques (Neurones TH+)
diminue progressivement tandis que le nombre total de neurones n'est pas
affecté. Cette
observation a pu être exploitée comme modèle in vitro de la mort neuronale
dans la
maladie de Parkinson pour la recherche de composés neuroprotecteurs.
Dans ces mêmes conditions, les fibres des neurones restant ne sont pas
altérées
et la neuritogénèse peut être observée et quantifiée. Ce modèle est donc
particulièrement
intéressant dans notre étude puisqu'il permet en une même expérience d'obtenir
les
deux résultats attendus à savoir la quantification de la neuroprotection et de
la
neuritogénèse.
Le potentiel neurotrophique de nos composés a pu être évalué par la
réalisation
d'un double criblage incluant l'estimation du potentiel neuroprotecteur et la
capacité à
stimuler la croissance neuritique.
Les cultures primaires de mésencéphale ventral d'embryons de rattes à 15,5
jours de gestation, dans des conditions occasionnant la mort spontanée des
neurones
dopaminergiques, sont maintenues en présence ou en absence des composés à
tester
pendant 8 jours. Après fixation, les cultures sont soumises à
l'immunocytochimie
dirigée contre la tyrosine hydroxylase, un marqueur spécifique des neurones
dopaminergiques.
Le potentiel neuroprotecteur de chaque composé est ensuite estimé par comptage
du nombre de neurones restant (Neurones TH-) sous microscope à fluorescence.
Les
résultats pour les différents traitements sont exprimés en pourcentage du
nombre de
neurones restant par rapport aux cultures non traitées (Contrôle).
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
28
La neuritogénèse est quantifiée par mesure de la longueur neuritique totale
rapportée par neurone dopaminergique (Longueur neuritique/neurone TH-) à
l'aide d'un
analyseur d'images sur au minimum soixante neurones photographiés par
condition (10-
30% des neurones dopaminergiques totaux).
Toutes les expériences ont été réalisées par comparaison à un témoin positif,
la
dibutyryl-AMPcyclique (db-AMPc) (Mourlevat S. et al. Mol. Pharmacol. 2003,
64(3),
578-586).
Des tests de significativité ont été effectués pour comparer les données entre
elles, afin de différencier les probabilités obtenues pour les deux types
d'activités, nous
utiliserons les notations Pp et PN respectivement pour les probabilités
concernant
l'activité protectrice et l'activité neuritogénique. Pp/N sera utilisé lorsque
la probabilité
donnée concerne les deux activités.
Les composés de l'invention ont été testés à 1, 10, 100 et 1000 nM, avec un
effet
observé à 10 nM, les composés de cette série étant respectivement inactif ou
toxiques
aux concentrations inférieures et supérieures. Les résultats obtenus sont
présentés sur la
Tableau 1 qui suit.
Tableau 1
% relatif au contrôle SEM'
Produit + Longueur neuritique/
X1 X2 R2 Neurones TH
(10 nM) neurone TH+
Contrôle - - - 100 f 1,9 100 2,9
db-
- - - 149,9 3,6 333,1 8,7**
AMPc
le C=O (CH2)14 CH3 121,3 3,2** 168,6 11,5**
1f C-0 (CH2)18 CH3 121,8 2,0** 147,4 f 7,0**
2c CH2 (CH2)14 CH3 131,9 4,7** 197,0 f 14,0**
2e CH2 (CH2)16 CH3 129,9 3,5** 157,3 t 10,3**
2f CH2 (CH2)1a CH3 128,9 3,4** 132,6 6,2*
2g CH2 (CH2)21 CH3 129,6 3,5** 141,2 f 5,0**
2h CH2 Ab CH3 137,5 8,0** 156,7 f 6,7**
2i CH2 (CH2)13 CH2OH 129,4 5,0** 160,8 t 13,8**
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
29
SEM = Ecart standard à la moyenne obtenu sur trois expériences indépendantes
dont
les conditions sont répliquées trois fois
b A= [CH=CH-CH2-CH=CH-(CH2)4-CH3]
* P<0,05 vs contrôle, One-way ANOVA, analyse post-hoc de Dunnett ou t-test
**P<0,001 vs contrôle, One-way ANOVA, analyse post-hoc de Bonferroni.
Tous les composés de cette série possèdent une capacité à induire une
neuritogénèse à des concentrations de l'ordre du nanomolaire. Le potentiel
neuroprotecteur de ces composés semble meilleur pour les composés ayant une
fonction
amine au lieu d'une fonction amide (voir le vs 2c), les meilleures activités
étant
observées pour le composé 2c. Les variations en fonction de la longueur de la
chaîne
sont minimes, on observe toutefois que les composés les plus courts sont un
peu moins
actifs. Concernant la présence d'insaturations, aucune variation pour les deux
activités
n'a été observée (voir 2h vs 2e). La fonction hydroxyle terminale quant à elle
améliore
les deux activités uniquement en série amine.
Ces résultats montrent un rôle important de l'amine intrachaîne qui confère à
cette série la double activité recherchée. Néanmoins les meilleurs potentiels
neuroprotecteurs sont observés pour des longueurs de chaîne après l'atome
d'azote
(c'est-à-dire Xi-X2-R2) supérieures ou égales à 15 atomes de carbone (soit une
longueur
de chaîne X2 supérieure ou égale à 13 atomes de carbone), porteuses
éventuellement
d'un hydroxyle terminal. Les meilleures activités combinées ont été obtenues
avec les
composés 2c et 2i.
2.2. Capacité antioxydante des composés de l'invention
Deux tests ont été utilisés afin d'évaluer la capacité antioxydante des
composés
de l'invention, c'est-à-dire leur capacité à neutraliser des radicaux libres.
= Test à lABTS
L'ABTS, ou acide 2,2'-azino-bis-(3-éthylbenzthiazoline-6-sulfonique), est un
indicateur coloré de la présence de radicaux hydroxyles en solution. En effet,
l'attaque
d'un radical hydroxyle sur lABTS génère la formation d'un radical cation
ATBS+'
(Équation 1). Cette entité colorée confère à la solution une absorbance (Abs)
à 450 nm.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
ABTS + HO" s ABTS+' + HO
Équation 1
5 Au cours du test, les radicaux hydroxyles sont générés par la réaction de
Fenton
en présence de fer et de peroxyde d'hydrogène (Équation 2).
H202 + Fe2+ HO' + HO + Fe3+
Équation 2
Lorsqu'un piégeur de radicaux ou antioxydant est présent en solution, une
compétition avec dABTS s'installe pour la réduction des radicaux hydroxyles,
ce qui se
traduit par une diminution de l'absorbance (Abs) à 450 nm.
Le pourcentage de radicaux hydroxyles converti en ions hydroxyles (%
conversion) par le composé d'intérêt peut être calculé selon la Formule 1
AbsABTS - AbsABTS + Produit)
conversion = x 100
AbSABTS
Formule 1
La capacité antioxydante d'un composé peut alors être exprimée sous forme
d'IC50, reflétant la concentration à laquelle 50% des radicaux hydroxyles ont
été réduits
par le composé testé.
Ainsi, les composés à tester, ainsi que le Trolox , ont été solubilisés dans
l'éthanol de manière à obtenir des solutions à 1 mM. Par des dilutions en
cascades, nous
avons obtenu une gamme de concentrations allant de 1 mM à 10 nM. Ensuite, 90
L
d'un mélange eau-éthanol 1-1 ont été ajoutés sur une plaque ELISA 96 puits,
suivis de
15 L d'une solution aqueuse d'ABTS à 1 mM, 15 L d'une solution aqueuse de
Fe2SO4 à 0,5 mM, 15 .tL de chaque composé à tester à des concentrations
différentes
puis 15 L d'une solution aqueuse de peroxyde d'hydrogène à 100 mM. Les
mélanges
ainsi obtenus ont été agités à température ambiante, à l'abri de l'air pendant
30 minutes,
puis la valeur de l'absorbance à 405 nm a été mesurée. La capacité à réduire
les
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
31
radicaux hydroxyles de chacun des composés est déterminée par la diminution de
l'absorbance à 450 nm, la solution contrôle étant composée d'éthanol pur.
Le test à l'ABTS a donc été effectué par comparaison avec le Trolox . Les
mêmes gammes de 10 nm à 1 mM des indoles la, lc, lg, li, 2a, 4c, 2g, 2h, et 2i
ont été
testées. Les résultats sont présentés sur le Tableau 2 suivant.
Tableau 2
Composé IC50 SEMa (mM)
Trolox 0,55 0,02
(n=9)2a 0,81 0,14
(n= 12) 2c 0,62 0,05
HN (n= 19) 2g 0,67 0,01
N
I s- - 4 2h 0,34 0,01
HN
~_ N oH 2i 0,73 0,01
HN
a SEM : Ecart standard à la moyenne obtenu sur trois expériences
indépendantes.
De façon intéressante, les composés aminés de l'invention testés 2a, 2c, 2g,
2h
et 2i, possèdent des IC50 proches de celle du TroloX mettant en évidence
l'intérêt de la
fonction amine dans l'activité antioxydante de ces composés. La présence de
doubles
liaisons intrachaîne améliore l'activité antioxydante conduisant à une IC50
inférieure à
celle du TroloX (voir 2h).
= Test cellulaire à la Dihydrorhodamine 123
La dihydrorhodamine 123 ou DHR123 est utilisée comme indicateur d'espèces
réactives de l'oxygène (ROS). Non chargée et non fluorescente, elle traverse
passivement la membrane cellulaire avant d'être oxydée, au contact de radicaux
libres,
en rhodamine 123 émettant une fluorescence verte.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
32
COOCH3 COOCH3
/ Radicaux libres / \ \
H2N O NH2 H2N O NH
Dihydrorhodamine 123 Rhodamine 123
Lorsque les cellules sont traitées par un antioxydant, la quantité de ROS
intracellulaire se voit diminuée. Cette diminution se traduit, en présence de
DHR123,
par une décroissance quantifiable de la fluorescence émise.
Afin de pouvoir conclure quant au rôle de la capacité antioxydante des
composés
de l'invention dans l'activité neuroprotectrice observée, les cultures ont été
placées
strictement dans les mêmes conditions que pour le test de
neuroprotection/neuritogénèse. Ainsi les cultures ont été maintenues pendant
huit jours
en présence d'une concentration de 10 nM de chacun des dérivés tryptaminiques
testés.
Au Sème jour in vitro (DIV 8), 50 M de DHR-123 (Sigma) ont été ajoutés et les
cellules
ont été incubées 30 minutes à 37 C. Elles ont ensuite été lavées trois fois,
traitées à
nouveau par les composés de l'invention et placées dans un milieu dépourvu de
rouge
phénol. L'observation de neurones fluorescents vivants aussitôt photographiés
peut
ainsi être réalisée, la densité de fluorescence par neurone étant quantifiée
sous
microscope à fluorescence inversée par logiciel d'analyse d'images. Les
résultats
obtenus sont présentés sur le Tableau 3 suivant.
Tableau 3
Composé IF/ neurone (%)
Contrôle 100,0 3,3
TroloX 44,0 2,8**
/ \ H
12 le 55,9 3,0**
HN 0
N 11 OH li 56,5 2,7**
0
HN
J
4 lh 60,9 + 6,4**
HN I0 lv
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
33
/ \ N 2 2c 47,8 + 4,7**
HN
N ,OH 2i 44,0 3,6**
HN
6 2h 43,7 + 5,2**
Q i - H
HN
H
H
92 le 55,9 + 3,0**
HN 0
a Ecart standard à la moyenne obtenu sur trois expériences indépendantes.
**P<0,001 vs contrôle, One-way ANOVA, analyse post-hoc de Bonferronni
Les neurones des cultures traitées par les dérivés tryptaminiques à 10 nM
possèdent une quantité cytoplasmique de ROS significativement diminuée par
comparaison aux cultures non traitées, traduite par une diminution de 40-60%
de la
fluorescence émise. Ces composés ont donc une activité antioxydante
importante, de
l'ordre de celle observée pour le composé de référence, avec toujours une
meilleure
activité des dérivés amines comparativement aux dérivés amides (voir li vs 2i,
et lh vs
2h). Par ailleurs, la Figure 1 illustre la diminution de l'intensité de
fluorescence émise
dans les neurones après traitement par le composé lh à 10 nM, composé montrant
la
meilleure activité antioxydante, par comparaison au TroloX et au contrôle non
traité.
La forte capacité antioxydante observée pour les dérivés tryptaminiques dans
les
conditions et aux concentrations permettant d'observer leur activité
neuroprotectrice,
pourrait être un élément de réponse quant au mécanisme d'action de ces
composés dans
la composante neuroprotectrice.
Ces composés sont donc très intéressants puisqu'ils combinent à la fois un
effet
protecteur et régénératif, applicable dans le traitement de maladies
neurodégénératives.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
34
2.3. Etude du passage de la barrière hémato-encéphalique (BHE)
Cette étude a été réalisée en utilisant le composé 2c comme composé selon
l'invention.
Le but de cette étude est de vérifier par HPLC couplée à une spectrométrie de
masse, la présence de la molécule 2c selon l'invention dans le parenchyme
cérébral
après un traitement sub-chronique du chlorhydrate de la molécule 2c (2c/HC1)
par voie
orale ou intra-péritonéale (IP).
= Matériels et méthodes
Animaux : Des souris mâles RjOrl:SWISS, âgées approximativement de 5 semaines
et
pesant entre 20 et 24 g à leur arrivée (Centre d'élevage R Janvier, France)
sont
maintenues dans l'animalerie, à température constante (22 1 C) et sous
hygrométrie
contrôlée (55 + 20%), avec un cycle lumière/obscurité de 12 heures (8h00-
20h00).
Durant la période d'acclimatation et de l'étude, les souris ont libre accès à
la nourriture
et à la boisson. Toutes les expérimentations se sont déroulées en accord avec
les
conditions du décret n 2001-464 du 29 mai 2001 relatif aux expériences
pratiquées sur
les animaux.
Traitements : Deux traitements (par voie orale ou intra-péritonéale) sub-
chroniques de
5 jours ont été réalisés :
- Traitement par voie intra-péritonéale (IP) :
La solution de chlorhydrate de 2c/HC1 à injecter est préparée dans le véhicule
(10 %
Tween20 + 20 % DMSO + 70 % NaCI à 0,9% dans l'eau) à la concentration de 2,0
g/L.
Trois groupes ont été constitués :
(1) des souris qui ont reçu le véhicule par voie IP, à lOmL/kg (groupe N,
n=4),
(2) des souris traitées avec le 2c/HC1 par voie IP, à 20mg/kg et à 10mL/kg
(groupe R,
n=6), et
(3) des souris contrôles qui n'ont reçu aucun traitement (n=2).
Les souris traitées R4, R5 et R6 ainsi que les souris véhicules Ni, N2, N3 et
N4 ont reçu
les traitements suivants :
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
Lundi Mardi Mercredi Jeudi Vendredi
07/12/09 08/12/09 09/12/09 10/12/09 11/12/09
15h20 12h10 13h45 12h45 17h30 :i 11h20 Euthanasie
entre 15h20
et 17h40
Les souris traitées RI, R2 et R3 ont reçu les mêmes traitements que les souris
précédentes sauf pour le jeudi où elles n'ont pas reçu le deuxième traitement
:
Lundi Mardi Mercredi Jeudi Vendredi
07/12/09 08/12/09 09/12/09 10/12/09 11/12/09
15h20 12h10 13h45 12h45 11h20 Euthanasie
entre 13h25
et 14h55
5 - Traitement par voie orale (per os)
La solution de chlorhydrate de 2c à administrer est préparée dans le véhicule
(0,5 %
Tween80 + 99,5 % carboxy-methyl cellulose à 1%, dans NaC1 à 0,9% dans l'eau) à
la
concentration de 15,0 g/L.
10 Trois groupes ont été constitués :
(1) des souris qui ont reçu par voie orale le véhicule à lOmL/kg (Groupe V,
n=4),
(2) des souris traitées avec le 2c/HC1 par voie orale à 150mg/kg et à lOmL/kg
(Groupe
B, n=6), et
(3) des souris contrôles qui n'ont reçu aucun traitement (n=2).
Toutes les souris sont traitées 2 fois par jour pendant 4 jours. Le 5ème jour
elles reçoivent
un dernier traitement et sont euthanasiées entre 3h00 et 7h30 après ce dernier
traitement
selon le schéma suivant :
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
36
Lundi Mardi Mercredi Jeudi Vendredi
07/12/09 08/12/09 09/12/09 10/12/09 11/12/09
t
13h00 17h20 10h50 16h10 10h50 17h05 10h40 17h10 10h30 Euthanasie
entre 13h30
et 18h00
Euthanasie : Les souris sont anesthésiées par une injection de 0,1 mL d'une
solution de
pentobarbital sodique à 6 % puis les souris sont perfusées, afin d'enlever les
traces de
sang du cerveau, avec une solution de NaC1 à 0,9 % qui contient de l'héparine
(200 L
d'héparine choay à 5000 UI/mL dans un litre de NaC1 à 0,9 %). Chaque animal
est
perfusé avec au minimum 50 mL de cette solution. La souris est décérébrée. Le
cervelet,
le tronc cérébral et les bulbes olfactifs sont éliminés.
Le cerveau est disséqué en 3 parties selon le schéma présenté sur la Figure 2.
Les 3
parties du cerveau sont congelées dans l'isopentane à - 30 C pendant une
minute, puis
conservées séparément à - 80 C.
Méthode d'extraction : Chaque échantillon de cerveau est pesé, homogénéisé
dans le
MeOH (100 gL de McOH pour 10 mg de tissu cérébral) puis mélangé par
sonication.
Les suspensions ainsi obtenues sont centrifugées à 27 000 g pendant 10
minutes, à 4 C.
Les surnageants, dilués au demi dans le MeOH, sont transférés dans des vials
HPLC
pour l'analyse du composé 2c par HPLC-MS/MS.
Cependant, afin de conserver des échantillons pour de futures analyses, seules
les
parties 1 des cerveaux de souris ont été extraites et analysées. Les 3 parties
de cerveaux
d'une souris de chaque groupe (IP et per os) ont néanmoins été extraites afin
de vérifier
que le composé 2c ne se distribue pas préférentiellement dans l'une de ces 3
parties.
Tous les échantillons sont stockés à - 4 C avant et pendant la durée des
analyses. Toutes
les analyses de tous les échantillons sont réalisées le même jour, dans les
mêmes
conditions.
Contrôles positifs et négatifs : Les cerveaux des souris véhicules sont
utilisés pour les
contrôles positifs et négatifs. Pour le contrôle positif, 10 gl d'une solution
de
chlorhydrate de 2c à 1 g/mL sont ajoutés au surnageant et dilués au demi dans
le
McOH avant transfert dans un vial HPLC.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
37
Préparation de la gamme de composé 2c : Une solution mère de chlorhydrate de
2c
est préparée extemporanément dans le McOH à une concentration de 1,0 mg/mL.
Toutes les autres solutions sont préparées par dilution de cette solution mère
dans le
McOH puis stockées à - 4 C.
Instrumentation et conditions pour l'analyse du composé 2c : La détection et
la
quantification, basée sur l'aire des pics, sont réalisées par HPLC-MS/MS, en
mode
MRM.
Le système HPLC est composé d'une pompe Dionex Ultimate 3000 équipée d'un
injecteur automatique d'échantillon Dionex WPS-3000PL. Le spectromètre de
masse
utilisé est un Water-Micromass Quattro Ultima équipé d'une source d'ionisation
à
electrospray et d'un analyseur triple quadrupole. L'acquisition des données et
des
analyses est effectuée via Masslynx 3.5.
La chromatographie liquide est réalisée en mode isocratique avec une colonne
XBridgeTM (Waters) C18, 150 x 2,1 mm, possédant une taille de particule de 3,5
m. La
phase mobile est composée d'un mélange de deux phases A et B, en proportions
3/97.
La phase A est composée de 0,2 % de triéthylamine dans l'eau (v/v) (pH=11,5).
La
phase B est composée de 0,2 % de triéthylamine dans le McOH (v/v). Le débit
est fixé à
0,2 mL/min et le volume d'injection est de 10 L.
Le spectromètre de masse est relié au système HPLC en utilisant une source
d'ionisation à electrospray. Une vanne de commutation est programmée pour
envoyer
les trois premières minutes de la chromatographie à la poubelle dans le but
d'éviter
l'accumulation de sel au niveau du capillaire de la source. Le voltage du
capillaire est
réglé à 3000 V et le voltage du cône à 50 V, la température de la source est
réglée à
120 C, le gaz de désolvatation (N2) est réglé à un débit de 463 L/h et la
température à
350 C. Les spectres de masses sont obtenus en mode positif. Les paramètres
sont
optimisés pour obtenir le maximum d'ion moléculaire à m/z 385,66,
correspondant au
composé 2c. La collision est obtenue avec un gaz inerte (argon) et l'énergie
est fixé à
22eV en mode MS/MS pour détecter les transitions de masse : m/z 385,66 -*
254,23 et
385,66 -* 144,17.
La droite d'étalonnage est réalisée à partir d'une gamme de standard
comportant 7
concentrations (0,5 gg/mL; 0,1 gg/mL; 20 ng/mL; 4 ng/mL; 0,8 ng/mL; 0,16 ng/mL
et
0,08 ng/mL).
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
38
= Résultats
Validation de la méthode HPLC-MS/MS : L'aire des pics HPLC est fonction de la
concentration du composé 2c dans la gamme de 0,16 à 500,00 ng/mL avec un R2 de
0,9997. La limite de détection est de 0,08 ng/mL avec un rapport S/B
(signal/bruit) de
3 :1. Le temps de rétention du composé 2c est de 5,3 minutes et le temps
d'acquisition
est de 8 minutes.
Concentration du composé 2c dans les extraits de cerveaux :
- Voie per os :
Les chromatogrammes obtenus sont représentés dans la Figure 3. Le composé 2c
n'est
pas détectable dans l'extrait de cerveaux de souris traitées par du véhicule
et est
quantifié à 20,31 ng/mL dans le contrôle positif. Le composé 2c est quantifié
dans les
extraits de cerveaux de souris traitées per os à la concentration moyenne de
21,25
ng/mL 0,82 SEM (n=8).
- Voie IP :
Les chromatogrammes obtenus sont représentés dans la Figure 4. Le composé 2c
n'est
pas détectable dans l'extrait de cerveaux de souris traitées par du véhicule
et est
quantifié à 19,48 ng/mL dans le contrôle positif. Le composé 2c est quantifié
dans les
extraits de cerveaux de souris traitées IP à la concentration moyenne de 14,73
ng/mL f
0,58 SEM (n=8).
= Discussion et conclusion
Le composé 2c est capable de traverser in vivo la BHE après administration IP
et per os
de 2c/HC1. Le traitement par voie per os à 300 mg/kg/j permet d'obtenir des
concentrations environ 1,5 fois plus élevées que celle obtenues après un
traitement IP à
20 mg/kg/j.
CA 02754283 2011-09-02
WO 2010/100133 PCT/EP2010/052596
39
ABREVIATIONS UTILISEES :
EDC Chlorhydrate de 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide
ESI-MS Spectroscopie de Masse en mode électrospray
GC Chromatographie en phase gazeuse
HOBt N-Hydroxy benzotriazole
HPLC Chromatographie Liquide Haute Performance
HPLC-MS/MS Chromatographie Liquide Haute Performance couplé à un
spectromètre de masse en tandem
IR Absorption Infra Rouge
MRM Acquisition de transitions multiples
RMN 'H Résonnance Magnétique Nucléaire du proton
RMN 13 C Résonnance Magnétique Nucléaire du carbone