Note: Descriptions are shown in the official language in which they were submitted.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
1
DERIVES SOUFRES DE RESORCINOL, LEUR PREPARATION ET LEURS
UTILISATIONS COSMETIQUES
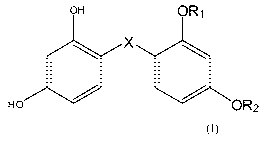
La présente invention concerne des nouveaux analogues du résorcinol sulfide,
du
résorcinol sulfoxyde et du résorcinol sulfone correspondant à la formule
générale (I) :
OH OR1
X
Ho OR2
(I)
dans laquelle :
X=S,SOouSO2,et;
l'un des radicaux Ri et R2 représente un atome d'hydrogène et l'autre un
radical :
= alkyle linéaire ou ramifié en Ci à Cig éventuellement substitué par un ou
plusieurs atome(s) d'halogène,
= alkényle linéaire ou ramifié en C2 à Cig en particulier un groupe allyle, ou
un
groupe 3,3 diméthylallyle, ou un groupe géranyle ou un groupe farnésyle,
éventuellement substitué par un ou plusieurs atome(s) d'halogène,
= un aralkyle, en particulier benzyle, éventuellement substitué par un ou
plusieurs
groupe(s) alkoxy en Ci à C6, ou
= COR3 ou CONHR3, mais non simultanément, où R3 représente un radical :
> aik_yl_c linéaire ou ramifié en Ci à Cig éventuellement substitué par un ou
plusieurs atome(s) d'halogène,
a1kuéj1y1e lis é-aire ou :Le mifi; en CC2 à C18, éventuellement substitué par
un
ou plusieurs atome(s) d'halogène,
> a atalkyle., en particutl e benzyle, u stitua par un ou
plusieurs groupe(s) alkoxy en C1 à C6,
un aralkényle éventuellement substitué par un ou plusieurs groupe(s)
alkoxy en C1 à C6 et/ou groupe(s) OH, ou bien
> pan radical aryle, en Particulier ; ,entuellement substitué par un ou
plusieurs group(e) alkoxy en C1 à C6.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
2
Le terme alkyle représente des chaînes hydrocarbonées aliphatiques
linéaires
ou ramifiées saturées et comprenant le nombre de d'atomes de carbone spécifié.
Le terme alkényle représente des chaînes hydrocarbonées aliphatiques
linéaires ou ramifiées insaturées et comprenant le nombre d'atomes de carbone
spécifié
par exemple un groupe allyle ou un groupe 3,3 diméthylallyle ou un groupe
géranyle
ou un groupe famésyle.
Le terme alkoxy représente une chaîne hydrocarbonée linéaire ou ramifiée
comprenant le nombre d'atomes de carbone spécifié et un atome d'oxygène par
exemple un groupe méthoxy, ou un groupe éthoxy, ou un groupe propoxy ou un
groupe
butoxy.
Le terme aryle représente tout cycle carboné aromatique monocyclique ou
bicyclique, comme par exemple le phényl ou le naphtyle.
Le terme aralkyle désigne un aryle lié par un alkyle, par exemple un
benzyle, éthylphényle, propylphényle.
Le terme aralkényl désigne un aryle lié par un alkényle, par exemple un
l'acrylate de phényle ou le (4-méthoxyphényl)acrylate ou le (3, 4-
diméthoxyphényl)acrylate.
Le terme halogène représente un fluor, chlore, brome ou iode.
Le terme oléoyle représente le radical univalent dérivé de l'acide oléique
par
la perte du groupe OH.
Le terme linoléoyle représente le radical univalent dérivé de l'acide
linoléique par la perte du groupe OH.
Le terme alpha-linolénoyle représente le radical univalent dérivé de
l'acide
alpha-linolénique par la perte du groupe OH.
Le terme gamma-linolénoyle représente le radical univalent dérivé de
l'acide
gamma-linolénique par la perte du groupe OH.
Le terme coumaroyl représente le 4-hydroxycinnamoyle.
Le terme cafféoyle représente le 3,4-dihydroxycinnamoyle.
Le terme féruoyle représente le 4-hydroxy-3-méthoxycinnamoyle.
Le terme sinapoyle représente le 4-Hydroxy-3,5-diméthoxycinnamoyle.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
3
Parmi les composés de formule générale (I) faisant partie de la présente
invention, une classe de composés particulièrement appréciée correspond aux
composés
de formule générale (I) dans laquelle X=S. De la même façon, la présente
invention
concerne particulièrement les composés de formule générale (I) dans laquelle
X=S et
R2=H.
De façon préférée, les composés selon l'invention correspondent aux composés
de formule (I) dans laquelle X=S, R2= H et R1 est sélectionné parmi le groupe
consistant en : un alkyle linéaire ou ramifié en Ci à Cig ou un alkényle
linéaire ou
ramifié en C2 à Cig ou COR3 et CONHR3.
Selon un mode de réalisation de la présente invention, les composés de formule
générale (I) sont ceux pour lesquels Ri représente :
- un alkyle linéaire ou ramifié en Ci à C8 et en particulier en C4 à Cg; ou
- un alkényle linéaire ou ramifié en C2 à C18 choisi parmi un groupe allyle ou
un groupe
3,3 diméthylallyle ou un groupe géranyle ou un groupe farnésyle; ou
- un benzyle.
Selon l'invention, une classe de composés particulièrement appréciée de
formule
générale (I) correspond aux composés pour lesquels R3 représente :
- un alkyle linéaire ou ramifié en C7 à C 15 et en particulier en C 11 à C15,
ou
- un alkényle linéaire ou ramifié en C 10 à C 18, ou
_ un benzyle; ou
- un aralkényle choisi parmi l'acrylate de phényle ou le (4-
méthoxyphényl)acrylate ou le
(3, 4-diméthoxyphényl)acrylate; ou
- un phényle.
Selon un mode de réalisation particulier de l'invention, les composés de
formule
générale (I) sont ceux dans lesquels COR3 représente /
- un oléoyle ou un linoléoyle ou un alpha-linolénoyle ou un gamma-linolénoyle.
Selon un autre mode de réalisation particulier de l'invention, les composés de
formule (I) sont ceux pour lesquels COR3 représente :
- un cinnamoyle substitué par un ou plusieurs groupe(s) alkoxy en Ci à C6
et/ou
groupe(s) OH choisi parmi le coumaroyle ou le 4-methoxycinnamoyle ou le 3,4-
diméthoxycinnamoyle ou le cafféoyle ou le féruoyle ou le sinapoyle.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
4
Selon un mode de réalisation de l'invention les composés de formule générale
(I) peuvent être choisis parmi les composés suivants:
- 4-(4-hydroxy-2-((2E,6E)-3,6,11-triméthyldodéca-2,6,10-
trienyloxy)phénylthio)benzène-1,3-diol,
- 4-(4-hydroxy-2-(3-méthylbut-2-enyloxy)phénylthio)benzène-1,3-diol,
- (E)-4-(2-(3,7-diméthylocta-2,6-diényloxy)-4-hydroxyphénylthio)benzène-
1,3-diol,
- 4-(2-butoxy-4-hydroxyphénylthio)benzène-1,3-diol,
- 4-(4-butoxy-2-hydroxyphénylthio)benzène-1,3-diol,
- 4-(4-hydroxy-2-(octyloxy)phénylthio)benzène-1,3-diol,
- 4-(2-hydroxy-4-(octyloxy)phénylthio)benzène-1,3-diol,
- 4-(2-(benzyloxy)-4-hydroxyphénylthio)benzène-1,3-diol,
- 4-(4-(benzyloxy)-2-hydroxyphénylthio)benzène-1,3-diol,
- 4-(4-hydroxy-2-(4-méthoxybenzyloxy)phénylthio)benzène-1,3-diol,
- 4-(2-(décyloxy)-4-hydroxyphénylthio)benzène-1,3-diol,
- 4-(2-(hexadécyloxy)-4-hydroxyphénylthio)benzène-1,3-diol,
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl dodécanoate,
- 2-(2,4-dihydroxyphenylthio)-5-hydroxyphenyl palmitate,
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl octanoate,
- 4-(2,4-dihydroxyphénylthio)-3-hydroxyphényl octanoate,
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl3-phénylpropanoate,
- 4-(2,4-dihydroxyphénylthio)-3-hydroxyphényl3-phénylpropanoate,
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl 3-méthylbutanoate,
- 4-(2,4-dihydroxyphénylthio)-3-hydroxyphényl3-méthylbutanoate,
- (9Z,12Z)-2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl octadeca-9,12-
dienoate
- (E)-2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl3-(4-
méthoxyphényl)acrylate,
- (E)-2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl3-(3,4-
diméthoxyphényl)acrylate,
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl octylcarbamate,
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
- 2-(2,4-dihydroxyphénylsulfinyl)-5-hydroxyphényl dodécanoate,
- (9Z,12Z)-2-(2,4-dihydroxyphénylsulfinyl)-5-hydroxyphényl octadéca-9,12-
diénoate
- 4-(2-(décyloxy)-4-hydroxyphénylsulfinyl)benzène-1,3-diol,
5 - 4-(2-(décyloxy)-4-hydroxyphénylsulfonyl)benzène-1,3-diol,
L'invention concerne également l'utilisation cosmétique des composés de
formule (I'), qui comprennent, en plus des nouveaux analogues de formule (I),
le
résorcinol sulfide, le résorcinol sulfoxyde et le résorcinol sulfone, et en
particulier leur
utilisation pour la dépigmentation de la peau, pour la mise en oeuvre d'une
méthode de
traitement cosmétique du vieillissement cutané. Formule générale (I')
OH OR1
X
Ho OR2
(I')
dans laquelle les radicaux X, Ri et R2 ont des significations identiques à
celles données
à propos de la formule (I), mais où Ri et R2 peuvent aussi représenter
simultanément un
atome d'hydrogène.
La présente invention concerne l'utilisation cosmétique des composés de
formule générale (I') ou de formule (I) en tant que principe actif antioxydant
ou en tant
que principe actif dépigmentant.
La présente invention a également pour objet l'utilisation des composés de
formule générale (I) en tant que médicament et en particulier en tant que
principe actif
antibactérien.
L'invention vise également les compositions pharmaceutiques ou cosmétiques
comprenant au moins un des composés de formule (I) ou de formule (I') en
association
avec au moins un excipient pharmaceutiquement ou cosmétiquement acceptable.
Dans la présente invention, on entend désigner par pharmaceutiquement ou
cosmétiquement acceptable ce qui est utile dans la préparation d'une
composition
pharmaceutique ou cosmétique, qui est généralement sûr, non toxique et ni
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
6
biologiquement ni autrement non souhaitable et qui est acceptable pour une
utilisation
thérapeutique ou cosmétique, notamment par application topique.
L'objet de l'invention concerne une composition cosmétique caractérisée en ce
que la quantité de composé de formule (I) ou de formule (I') varie entre 0,01%
et 10%
et de préférence de 0,1% à 5% en poids par rapport au poids total de la
composition.
La présente invention concerne un procédé de blanchiment et/ou
d'éclaircissement de la peau humaine et/ou des poils et/ou des cheveux
comprenant
l'application sur la peau et/ou les poils et/ou les cheveux d'une composition
cosmétique
contenant au moins un composé de formule (I) ou de formule (I') .
La présente invention concerne une méthode de traitement et/ou de prévention
cosmétique du vieillissement de la peau comprenant l'application sur la peau
d'une
composition cosmétique contenant au moins un composé de formule (I) ou de
formule
(I')
L'objet de l'invention s'étend également au procédé de synthèse des nouveaux
composés de formule (I).
Selon une autre caractéristique de la présente invention, celle-ci concerne
également un procédé de préparation d'un composé de formule générale (I)
caractérisé
en ce que l'on fait réagir le 4,4'-thiodibenzène-1,3-diol ou bien le 4,4'-
sulfinylbis-1,3-
benzènediol avec un halogénure de formule II :
Hal - R, (II)
dans laquelle :
Hal représente un atome d'halogène, et Ri a la même signification que celle
donnée
précédemment à propos de la formule (I) à l'exception d'un atome d'hydrogène.
Selon une autre caractéristique de la présente invention, celle-ci concerne
également un procédé de préparation d'un dérivé de résorcinol de formule (I)
dans
laquelle X représente SO ou S02, caractérisé en ce que l'on oxyde un composé
de
formule (I) dans laquelle X représente un atome de soufre, en particulier à
l'aide d'une
solution aqueuse de peroxyde d'hydrogène.
La présente invention sera mieux comprise en regard des exemples donnés ci-
après à simple titre illustratif.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
7
1. Synthèse des composés de l'invention.
1) Synthèse des analogues du résorcinol sulfide.
- Exemple 1 (résorcinol sulfide)
- 4,4'-thiodibenzene-1,3-diol
OH OH
YS
HO OH
RIVIN'H (400 MHz, DMSO-d6) : 6 : 6,19 (dd, 2H) ; 6,34 (d, 2H) ; 6,87 (d, 2H) ;
9,41
(s large, 2H); 9,50 (s large, 2H).
RMN 13C (100 MHz, DMSO d6) : 6 :102,58; 107,52; 111,46; 133,90; 157,04;
158,37.
MS (ESI-) : 249,1 [M-H]-
A) Synthèse des éthers : Synthèse des éthers par couplage du résorcinol
sulfide avec un
halogénure d'alkyle
A une suspension de 4,4'-thiodibenzene-1,3-diol (résorcinol sulfide, 3g,
12 mmol, 4 éq.) et de carbonate de potassium (497 mg, 3,6 mmol, 1,2 éq.) dans
20 ml
de DMF (=diméthylformamide) anhydre et sous azote, sont ajoutés 856 mg de
bromure
de farnésyle (3 mmol, 1 éq.) puis le mélange est agité à 80 C pendant 6
heures. La
réaction est suivie par CCM (=Chromatographie sur couche mince).
Après retour à température ambiante, le solvant est évaporé puis le résidu
extrait
avec un mélange Acétate d'éthyle/eau. La phase organique est lavée deux fois
par de
l'eau puis par une solution saturée en NaCI. Après séchage sur sulfate de
magnésium,
un solide est obtenu après évaporation du solvant. Le solide est lavé au DCM
(=dichlorométhane) puis collecté pour fournir 2g de résorcinol sulfide de
départ n'ayant
pas réagi.
Le filtrat (DCM) est alors évaporé pour conduire à une huile purifiée sur
silice
par le mélange heptane/Acétate d'éthyle (95/5 à 50/50) ou par HPLC
préparative. Le
produit obtenu sous forme d'une huile incolore est séché sous vide une nuit.
730 mg
sont alors obtenus avec un rendement de 55%.
La structure est déterminée par analyses RMN proton, carbone, HMBC, HMQC
et NOESY.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
8
-Exemple 2:
-4-(4-hydroxy-2-((2E,6E)-3,6,11-triméthyldodéca-2,6,10-
triénylo xy)phénylthio)b enzène
-1,3-diol
HO OH
S
O
OH
RMN 'H (500 MHz, CDC13) : 6 : 1,58 (s, 3H), 1,60 (s, 3H) ; 1,66 (s, 3H) ; 1,73
(s,
3H) ; 1,96 (m, 2H) ; 2,04 (m, 2H) ; 2,09 (m, 2H) ; 2,14 (m, 2H) ; 4,56 (d, j =
6,4 Hz,
2H) ; 5,01 (s, 1H, OH para S) ; 5,06 (s, 1H, OH para S) ; 5,07 (m, 1H) ; 5,11
(m, 1H) ;
5,51 (t, 1H) ; 6,29 (d, j = 8,5-2,4 Hz, 1H) ; 6,32 (d, j = 8,2-2,7 Hz, 1H) ;
6,38 (d, j = 2,4
Hz, 1H) ; 6,42 (d, j = 2,7 Hz, 1H) ; 7,08 (d, j = 8,5 Hz, 1H) ; 7,33 (s, 1H,
OH ortho S) ;
7,38 (d, j = 8,5 Hz, 1H).
RMN 13C (125 MHz, CDCl3) : 8 : 16,04; 16,75; 17,69; 25,70; 26,20; 26,70;
39,54;
39,66; 65,99; 100,68; 102,31; 108,18; 108,33; 110,79; 115,32; 118,49; 123,62;
124,34;
131,38; 133,99; 135,50; 137,54; 142,24; 156,88; 158,09; 158,48; 158,73.
MS (APCI) : 455,2 [M+H]+
Rf (1/1; Heptane/EtOAc) : 0,75
-Exemple 3:
- 4-(4-hydroxy-2-(3-méthylbut-2-enyloxy)phénylthio)benzène-1,3-diol
A partir du 1-Bromo-3-methylbut-2-ene (=halogénure d'alkyle)
HO / OH
S
C>O,-,Iy
OH
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
9
RIVIN 'H (400 MHz, CDC13) : 8 : 1,76 (s, 3H), 1,82 (s, 3H), 4,56 (d, 2H), 5,07
(m,
2H, 2xOH para S) ; 5,53 (t, 1H) ; 6,30 - 6,45 (m, 4H) ; 7,09 (d, 1H) ; 7,32
(s, 1H) ; 7,40
(d, 1H).
MS (APCI+) : 319.0 [M+H]+
- Exemple 4:
- (E)-4-(2-(3,7-diméthylocta-2,6-diényloxy)-4-hydroxyphénylthio)benzène-1,3-
diol
A partir du chlorure de géranyle
HO OH
S
~>O'~'~
OH
RMN 'H (400 MHz, CDC13) : 6 : 1,62 (s, 3H) ; 1,68 (s, 3H) ; 1,75 (s, 3H) ;
2,13 (m,
2H), 4,59 (d, 2H), 4,80 (s, 1H), 4,85 (s, 1H), 5,11 (s, 1H), 5,53 (t, 1H),
6,30 - 6,45
(m, 4H) ; 7,09 (d, 1H) ; 7,32 (s, 1H) ; 7,41 (d, 1H) .
MS (APCI+) : 386,9 [M+H]+
- Exemple 5:
- 4-(2-butoxy-4-hydroxyphénylthio)benzène-1,3-diol
A partir du 1-bromo-butane. Produit majoritaire (590 mg)
HO OH
S
O" ~/
OH
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
RIVIN 'H (400 MHz, CDC13) : 8: 1,01 (t, 3H), 1,53 (m, 2H), 1,88 (m, 2H), 4,02
(t,
2H) ; 4,78 (s large, 2H, 2 OH para S) ; 6,32 (m, 2H) ; 6,36 (s, 1H) ; 6,45 (s,
1H) ; 7,08
(d, 1H) ; 7,29 (s, 1H, OH ortho S) ; 7,40 (d, 1H) .
5 MS (APCI+) : 307,0 [M+H]+
- Exemple 6:
- 4-(4-butoxy-2-hydroxyphénylthio)benzène-1,3-diol
A partir du 1 -bromo-butane. Produit minoritaire (18 mg)
OH
110S OH
O
RMN 'H (400 MHz, CDC13): 6 : 1,02 (t, 3H), 1,44 (m, 2H), 1,72 (m, 2H), 3,90
(t,
2H) ; 6,34 (d, 1H) ; 6,41 (d, 1H) ; 6,43 (s, 1H) ; 6,49 (s, 1H) ; 7,25 (m, 3H)
.
MS (APCI+) : 307,1 [M+H]+
- Exemple 7:
- 4-(4-hydroxy-2-(octyloxy)phénylthio)benzène-1,3-diol
A partir du 1-bromo-octane. Produit majoritaire (1,3 g)
HO , OH
S
O H
RMN 'H (400 MHz, CDCl3) : 6 : 0,91 (t, 3H) ; 1,30 (m, 8H) ; 1,47 (m, 2H) ;
1,88 (m,
2H) ; 3,99 (t, 2H), 4,90 (s large, 2H) ; 6,30 (d, 1H) ; 6,35 (d, 1H), 6,36 (s,
1H) ; 6,45
(s, 1H) ; 7,07 (d, 1H) ; 7,32 (s large, 1H) ; 7,41 (d, 1H) .
MS (APCI+) : 363,2 [M+H]+
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
11
- Exemple 8:
- 4-(2-hydroxy-4-(octyloxy)phénylthio)benzène-1,3-diol
A partir du 1-bromo-octane. Produit minoritaire (100 mg)
OH
HO _(~_ S OH
RIVIN 'H (400 MHz, CDC13) : 6 : 0,87 (t, 3H) ; 1,27 (m, 8H) ; 1,41 (m, 2H) ;
1,72 (m,
2H) ; 3,90 (t, 2H) ; 6,34 (d, 1H) ; 6,41 (d, 1H) ; 6,44 (s, 1H) ; 6,48 (s, 1H)
; 7,25 (m, 3H)
MS (APCI+) : 363,1 [M+H]+
-Exemple 9:
- 4-(2-(benzyloxy)-4-hydroxyphénylthio)benzène-1,3-diol
A partir du bromure de benzyle. Produit majoritaire (600 mg)
HO OH
S
O
OH
RMN'H (400 MHz, CDC13) : 8 : 4,80 (m large, 2H) ; 5,14 (s, 2H) ; 6,34 (m, 2H)
; 6,44
(s, 2H) ; 7,02 (d, 1H) ; 7,08 (s, 1H) ; 7,34 - 7,41 (m, 6H) .
MS (APCI+) : 341,1 [M+H]+
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
12
- Exemple 10:
- 4-(4-(benzyloxy)-2-hydroxyphénylthio)benzène-1,3-diol
A partir du bromure de benzyle. Produit minoritaire (28 mg)
H
HO S OH
0
O
RIVIN 'H (400 MHz, CDC13) : 6 : 5,00 (s, 2H) ; 6,34 - 6,57 (m, 4H) ; 7,28 -
7,39 (m,
7H) .
MS (APCI+) : 341,1 [M+H]+
- Exemple 11:
- 4-(4-hydroxy-2-(4-méthoxybenzyloxy)phénylthio)benzène-1,3-diol
A partir du bromure de 4-methoxybenzyle. Produit majoritaire (600 mg)
HO %1-11 OH
S / O"
OH
RMN 'H (400 MHz, CDCl3) : 8: 3,82 (s, 3H), 5,04 (s, 2H), 5,24 (m large, 2H),
6,34
(m, 2H) ; 6,44 (m, 2H) ; 6,92 (d, 2H) ; 7,03 (d, 1H), 7,14 (s large, 1H), 7,37
(m, 3H).
MS (APCI+) : 371,0 [M+H]+
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
13
- Exemple 12:
- 4-(2-(décyloxy)-4-hydroxyphénylthio)benzène-1,3-diol
Mode opératoire de l'exemple 2 mais avec 2 équivalents de résorcinol sulfide,
1
équivalent de 1-Iododécane 16 heures à température ambiante.
Le produit est obtenu sous la forme d'un solide blanc après purification avec
un
rendement de 83%.
HO , OH
S
OH
RIVIN 'H (400 MHz, CDC13) : 8: 0,91 (t, 3H) ; 1,25 (m, 12H) ; 1,47 (m, 2H) ;
1,88 (m,
2H) ; 3,99 (t, 2H) ; 4,90 (s large, 2H) ; 6,30 (d, 1H) ; 6,35 (d, 1H), 6,36
(s, 1H) ; 6,45
(s, 1H) ; 7,07 (d, 1H) ; 7,32 (s large, 1H) ; 7,41 (d, 1H) .
RMN 13C (100 MHz, DMSO) : 8:13,89, 22,04; 25,39; 28,56; 28,65; 28,70; 28,89;
28,94; 31,24; 67,76; 100,18; 102,66; 107,47; 107,62; 107,98; 113,65; 130,42;
135,21;
156,83; 157,34; 158,20; 158,81MS (APCI+) : 391,1 [M+H]+
- Exemple 13:
- 4-(2-(hexadécyloxy)-4-hydroxyphénylthio)benzène-1,3-diol
Même synthèse que SP02-131 à partir du 1-Iodo-hexadécane
Produit obtenu sous la forme d'un solide blanc avec un rendement de 84%.
HO OH
S
OH
RMN 'H (400 MHz, CDC13) : 8: 0,88 (t, 3H), 1,2 (m, 24H) ; 1,47 (m, 2H) ; 1,84
(m,
2H) ; 3,92 (t, 2H) ; 5,31 (s large, 2H) ; 6,27 (dd, 1H) ; 6,33 (s, 1H), 6,36
(d, 1H) ; 6,45
(s, 1H) ; 7,05 (d, 1H) ; 7,38 (s large, 1H) ; 7,41 (d, 1H) .
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
14
RIVIN 13C (100 MHz, CDC13): 8: 14,11; 22,68; 25,95; 28,89; 29,35; 29,56;
29,61;
29,66; 29,70; 31,91; 69,22; 100,39; 102,29; 108,19; 108,54; 110,89; 115,01;
133,93;
137,49; 156,88; 158,19; 158,40; 158,44.
MS (ESI-) : 473,2 [M-H]
B) Synthèse des esters
a) Voie 1 : Couplage à partir du résorcinol sulfide
A une solution de 4,4'-thiodibenzène-1,3-diol (résorcinol sulfide, 1g, 4 mmol,
4 éq.) et de triéthylamine (177 l , 1,2 mmol, 1,2 éq.) dans 20 ml de THF
(tétrahydrofuranne) anhydre et sous azote, sont ajoutés goutte à goutte 219 mg
de
chlorure de lauroyle (l mmol, 1 éq.) puis le mélange est agité à température
ambiante
pendant 1 heure. La réaction est suivie par CCM.
Après retour à température ambiante, le solvant est évaporé puis le résidu
extrait
avec un mélange Acétate d'éthyle/eau. La phase organique est lavée deux fois
par de
l'eau puis par une solution saturée en NaCI. Après séchage sur sulfate de
magnésium,
un solide est obtenu après évaporation du solvant. Le solide est lavé au DCM
puis
collecté pour fournir 510 mg de résorcinol sulfide de départ n'ayant pas
réagi.
Le filtrat (DCM) est alors évaporé pour conduire à une huile purifiée sur
silice
par le mélange cyclohexane/acétate d'éthyle (9/1) ou par HPLC (chromatographie
en
phase liquide à haute performance) préparative. Le produit obtenu sous forme
d'une
huile incolore est séché sous vide une nuit. Le produit se solidifie à froid.
260 mg sont
alors obtenus sous la forme d'un solide blanc avec un rendement de 60%.
- Exemple 14:
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl dodécanoate
HO OH
S
O O
OH
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
RMN 1H (500 MHz, CDC13) : 8: 0,86 (t, J = 7 Hz, 3H) ; 1,32 (m, 17H) ; 1,79 (q,
J = 7,6
Hz, 2H) ; 2,63 (t, J = 7,5 Hz, 2H) ; 5,30 (s, 1H) ; 5,35 (s, 1H) ; 6,38 (dd, J
= 8,4 et 2,6
Hz, 1H) ; 6,45 (d, J = 2,7 Hz, 1H) ; 6,48 (dd, J = 8,5 et 2,7 Hz, 1H) ; 6,50
(d, J = 2,4 Hz,
1H), 6,73 (d, J = 8,5 Hz, 1H), 6,76 (s, 1H), 7,35 (d, j = 8,5 Hz, 1H).
5
RMN 13C (125 MHz, CDC13): 8: 14,12; 22,67; 24,83; 29,13; 29,22; 29,32; 29,44;
29,59; 31,89; 34,24; 103,01; 107,84; 108,72; 110,12; 114,67; 120,06; 130,45;
137,96;
148,93; 155,48; 158,48; 159,03; 172,98.
MS (APCI) : 433,1 [M+H]+
10 Rf (7/3; Heptane/EtOAc) : 0,58
-Exemple 15:
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl octanoate
A partir du chlorure d'octanoyle
HO~OH
S
O
O
15 OH
RMN 1H (400 MHz, CDCl3) : 8: 0,82 (t, 3H), 1,29 (m, 8H), 1,63 (m, 2H), 2,35
(t,
2H) ; 6,41 (d, 1H), 6,49 (s, 1H), 6,56 (s, 1H), 6,57 (d, 1H), 6,81 (d, 1H),
7,39 (d,
1H).
MS (APCI+) : 377,1 [M+H]+
- Exemple 16:
- 4-(2,4-dihydroxyphénylthio)-3-hydroxyphényl octanoate
A partir du chlorure d'octanoyle
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
16
HO OS OH
0
O
O
RIVIN 'H (400 MHz, CDC13) : 8: 0,88 (t, 3H), 1,33 (m, 8H), 1,72 (m, 2H), 2,53
(t,
2H) ; 6,36 (d, 1H) ; 6,41 (s, 1H) ; 6,58 (d, 1H) ; 6,71 (s, 1H) ; 7,31 (m,
2H).
MS (APCI+) : 377,1 [M+H]+
- Exemple 17:
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl 3-phénylpropanoate
A partir du chlorure d'hydro-cinnamoyle
HO OH
S
O
O
OH
RMN 'H (400 MHz, CDC13) : 6 : 2,98 (t syst AB, 2H) ; 3,13 (t syst AB, 2H) ;
5,40 (s
large, 2H) ; 6,41 (d, 1 H) ; 6,46 (s, 1 H) ; 6,48 (s, 1 H) ; 6,54 (d, 1 H) ;
6,79 (d, 1 H) ; 7,22 -
7,38 (m, 6H).
MS (APCI+) : 383,1 [M+H]+
- Exemple 18:
- 4-(2,4-dihydroxyphénylthio)-3-hydroxyphényl 3-phénylpropanoate
A partir du chlorure d'hydro-cinnamoyle
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
17
HO O OH
O
O
RIVIN 'H (400 MHz, CDC13) : 8: 2,86 (t syst AB, 2H) ; 3,04 (t syst AB, 2H) ;
6,36 (d,
1H) ; 6,42 (s, 1H) ; 6,50 (d, 1H) ; 6,61 (s, 1H) ; 7,22 - 7,38 (m, 7H).
MS (APCI+) : 383,1 [M+H]+
- Exemple 19:
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl 3-méthylbutanoate
A partir du chlorure d'isovaléroyle
HOOH
S
O
OH
RMN 'H (400 MHz, CDC13) : 8: 1,10 (d, 6H), 2,31 (m, 1H), 2,53 (d, 2H), 4,79 (s
large, 1H), 4,87 (s large, 1H), 6,42 (d, 1H), 6,49 (s, 1H), 6,56 (s, 1H), 6,58
(d, 1H),
6,76 (s, 1H) ; 6,82 (d, 1H) ; 7,40 (d, 1H).
MS (APCI+) : 335,0 [M+H]+
- Exemple 20:
- 4-(2,4-dihydroxyphénylthio)-3-hydroxyphényl 3-méthylbutanoate
A partir du chlorure d'isovaléroyle
OH
HO S OH
O
0 -c~
O
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
18
RMN 'H (400 MHz, CDC13) : 8: 1,03 (d, 6H), 2,22 (m, 1H), 2,40 (d, 2H), 4,75 (s
large, 2H) ; 6,38 (d, 1H), 6,46 (s, 1H), 6,57 (d, 1H), 6,69 (s, 1H), 7,30 (m,
3H).
MS (APCI+) : 335,1[M+H]+
- Exemple 21:
- (9Z,12Z)-2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl octadeca-9,12-dienoate
A partir du chlorure de linoléoyle
HO OH
S
\ O O
OH
RMN 'H (400 MHz, CDC13) : 6 : 0,88 (t, 3H) ; 1,32 (m, 14H) ; 1,80 (m, 2H) ;
2,04 (m,
4H), 2,63 (t, 2H), 2,79 (t, 2H), 5,35 (m, 4H), 6,38 (d, 1H), 6,45 (s, 1H),
6,51 (m,
2H) ; 6,73 (d, 1H), 7,35 (d, 1H).
MS (ESI) : 513,2 [M+H]+
Rf (1/1; Heptane/EtOAc) : 0,75
b) Voie 2 : Couplage via Carbodiimide
A une solution de N-(3-Diméthylaminopropyl)-N'-éthylcarbodiimide
hydrochloride (960 mg, 5 mmol) et de 4-DMAP (4-diméthylaminopyridine) (0,5
mmol)
dans 20 ml de DMF anhydre sous N2 sont ajoutés 620 mg d'acide 4-
Méthoxycinnamique (3,5 mmol) puis le mélange est agité 15 minutes. 3,5g de
4,4'-
thiodibenzène-1,3-diol (résorcinol sulfide, 14 mmol, 4 éq.) sont ajoutés puis
le mélange
est agité à température ambiante pendant 4 jours.
Le solvant est évaporé puis le résidu purifié sur silice CHC13/MeOH (95/5)
pour
fournir 320 mg de produit pur sous la forme d'un solide blanc après
évaporation et
séchage à l'étuve à vide.
Rendement : 22%
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
19
- Exemple 22:
- (E)-2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl 3-(4-méthoxyphényl)acrylate
O
H
HO Is
OMe (>O
O
OH
RMN 'H (400 MHz, CDC13) : 8 : 3,86 (s, 3H) ; 5,00 (s large, 1H) ; 5,07 (s
large, 1H) ;
6,40 (dd, 1H), 6,48 (d, 1H), 6,60 (m, 2H) ; 6,64 (d, 1H) ; 6,85 (d, 1H) ; 6,95
(d, 2H),
7,40 (d, 1H); 7,58 (d, 2H) ; 7,91 (d, 1H).
MS (APCI+) : 411,0 [M+H]+
Rf (l/1; Heptane/EtOAc) : 0,14
- Exemple 23:
- (E)-2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl 3-(3,4-
diméthoxyphényl)acrylate
A partir de l'acide 3,4-Diméthoxycinnamique
HO , OH
OMe
s
O \ aôMe
O
OH
RMN 'H (400 MHz, DMSO-d6) : 8: 3,82 (s, 3H), 3,84 (s, 3H); 6,22 (d, 1H), 6,37
(d,
1H), 6,61 (s, 1H), 6,64 (d, 1H), 6,77 (d, 1H), 6,92 (m, 2H) ; 7,01 (d, 1H),
7,31 (d,
1H); 7,43 (s, 1H) ; 7,72 (d, 1H) ; 9,58 (m, 2H) ; 9,78 (m, 1H).
MS (ESI+) : 441,0 [M+H]+
Rf (95/5; DCM/MeOH) : 0,66
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
C. Synthèse des carbamates
A une solution de 4,4'-thiodibenzène-1,3-diol (résorcinol sulfide, 5g, 20
mmol,
4 éq.) dans 40 ml de THF anhydre et sous azote, sont ajoutés goutte à goutte
0,88 ml
d'octyl isocyanate (5 mmol, 1 éq.) puis le mélange est agité 9 heures au
reflux. La
5 réaction est suivie par CCM.
Après retour à température ambiante, le solvant est évaporé puis le résidu
extrait
avec un mélange Acétate d'éthyle/eau. La phase organique est lavée deux fois
par de
l'eau puis par une solution saturée en NaCI. Après séchage sur sulfate de
magnésium,
un solide est obtenu après évaporation du solvant. Le solide est lavé au DCM
puis
10 collecté pour fournir du résorcinol sulfide de départ n'ayant pas réagi.
Le filtrat (DCM) est alors évaporé pour conduire à une huile purifiée sur
silice
par le mélange cyclohéxane/acétate d'éthyle ou HPLC préparative. Le produit
obtenu
sous forme d'une huile incolore est séché sous vide une nuit. 540 mg sont
alors obtenus
sous la forme d'une huile incolore avec un rendement de 27%.
- Exemple 24:
- 2-(2,4-dihydroxyphénylthio)-5-hydroxyphényl octylcarbamate
HOOH
S H
OyN
O
OH
RIVIN 'H (400 MHz, CDCI3) : 8: 0,86 (t, 3H), 1,26 (m, 8H), 1,35 (m, 2H), 1,59
(m,
2H) ; 3,32 (m, 2H) ; 5,30 (t, 1H) ; 5,93 (s large, 1H) ; 6,23 (s large, 1H) ;
6,35 (m, 2H) ;
6,41 (s, 1H) ; 6,52 (s, 1H) ; 6,63 (d, 1H) ; 7,32 (s large, 1H) ; 7,35 (d, 1H)
.
MS (ESI+) : 406,1 [M+H]+
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
21
2) Synthèse des analogues du résorcinol sulfoxyde
- Exemple 25 (résorcinol sulfoxyde) :
- 4,4'-sulfinyldibenzene-1,3-diol
OH O OH
11 ",à
HO OH
RIVIN'H (400 MHz, DMSO-d6) : 6 : 6,32 (m, 4H), 7,10 (d, 2H), 9,82 (s large,
2H);
10,13 (s large, 2H).
MS (APCI) : 267,0 [M+H]+
A) Synthèse des esters
Une suspension de 4,4'-sulfinylbis-1,3-benzenediol (résorcinol sulfoxyde,
2,66g,
10 mmol, 4 éq.) dans 100 ml de THF anhydre est solubilisée à chaud et sous
azote puis
sont ajoutés après 5 minutes à température ambiante, 420 L de triéthylamine
(12 mmol, 1,2 eq). Une précipitation rapide est observée puis 547 mg de
chlorure de
lauroyle (2,5 mmol, 1 eq) sont ajoutés goutte à goutte. Le mélange est agité
pendant 2
heures à température ambiante. La réaction est suivie par CCM.
Après retour à température ambiante, le solide est filtré puis le filtrat est
évaporé
pour conduire à une huile purifiée sur silice par le mélange heptane/Acétate
d'éthyle
(80/20 à 50/50) ou par HPLC préparative. Le produit est obtenu sous forme d'un
solide
blanc est séché sous vide une nuit. 511 mg sont alors obtenus avec un
rendement de
46%.
- Exemple 26:
- 2-(2,4-dihydroxyphénylsulfinyl)-5-hydroxyphényl dodecanoate
HO OH
>O
S
O O
OH
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
22
RMN 'H (400 MHz, DMSO-d6) : 8: 0,86 (t, 3H), 1,24 (m, 16H), 1,53 (m, 2H), 2,45
(m, 2H), 6,28 (d, 1H), 6,33 (dd, 1H), 6,53 (s, 1H), 6,83 (dd, 1H), 7,12 (d,
1H), 7,43
(d, 1H), 9,88 (sl, 1H); 10,19 (sl, 1H); 10,27 (sl, 1H).
MS (APCI+) : 449,2 [M+H]+Rf (1/1; Heptane/EtOAc) : 0,42
- Exemple 27. (9Z,12Z)-2-(2,4-dihydroxyphénylsulfinyl)-5-hydroxyphényl
octadeca-
9,12-dienoate
A partir du chlorure de linoléoyle
HO OH
\ I ,O
O O
OH
RMN 'H (400 MHz, DMSO-d6) : 8: 0,84 (t, 3H), 1,29 (m, 14H), 1,55 (m, 2H), 2,00
(m, 4H) ; 2,42 (t, 2H) ; 2,76 (t, 2H) ; 5,33 (m, 4H), 6,28 (s, 1H), 6,35 (ds,
1H), 6,53 (s,
1H) ; 6,82 (d, 1H) ; 7,12 (d, 1H) ; 7,43 (d, 1H) ; 9,88 (s, I H), 10,19 (s, I
H), 10,27 (s,
I H).
MS (ESI) : 529,2 [M+H]+
Rf (7/3; Heptane/EtOAc) : 0,45
B) Synthèse des éthers par oxydation des analogues du résorcinol sulfide
A une solution de l'exemple 12 (=4-(2-(decyloxy)-4-
hydroxyphénylthio)benzène-1,3-diol) (320 mg) dans 10 ml d'acide acétique sont
ajoutés
260 L d'une solution de peroxyde d'hydrogène à 30% dans H20 (2,5 mmol, 3 éq)
puis
le mélange est agité 3 heures à température ambiante.
50 mL d'eau sont ajoutés pour précipiter le produit. Le solide obtenu est
collecté, puis repris dans de l'acétate d'éthyle puis cette phase organique
est lavée à
l'eau puis avec une solution saturé en chlorure de sodium. Après séchage sur
MgS04, le
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
23
solvant est évaporé pour conduire à un solide beige séché une nuit à l'étuve à
vide
(50mbar, 50 C). 310 mg de produit sont obtenus avec un rendement de 90%.
- Exemple 28 :
- 4-(2-(décyloxy)-4-hydroxyphénylsulfinyl)benzène-1,3-diol
HO OH
.1O
S
OH
RMN 'H (400 MHz, DMSO d6) : 8: 0,86 (t, 3H), 1,23 (m, 14H), 1,54 (m, 2H), 3,77-
3,92 (m, 2H), 6,26 (d, 1H), 6,29 (s, 1H), 6,40 (d, 1H), 6,49 (dd, 1H), 6,98
(d, 1H),
6,76 (s, 1H), 7,28 (d, 1H), 9,80 (s, 1H); 9,98 (s, 1H); 10,06 (s, 1H).
RMN 13C (100 MHz, DMSO d6) : 8: 13,89; 22,03; 25,14; 25,38; 28,29; 28,64;
28,66;
28,90; 28,93; 31,25; 67,86; 99,86; 102,38; 107,12; 107,49; 120,17; 121,72;
127,19;
127,68; 156,82; 157,07; 160,95; 161,18.
MS (ESI+) : 407,2 [M+H]+
Rf (l/1; Heptane/EtOAc) : 0,12
3) Synthèse des analogues du résorcinol sulfone
A) Synthèse du résorcinol sulfone
A une solution de 4,4'-thiodibenzene-1,3-diol (résorcinol sulfide, 10 mmol,
2,5g)
dans un mélange acétone/acide acétique (1/1, 60 mL) sont ajoutés 5,12 mL d'une
solution de peroxyde d'hydrogène 30% dans H2O (30 mmol) puis le mélange est
agité
72 heures à température ambiante.
Le solvant est évaporé puis le solide obtenu est repris par de l'acétate
d'éthyle
pour obtenir un solide blanc. Filtration du solide puis le filtrat est évaporé
puis le résidu
ainsi obtenu est purifié sur silice pour conduire à 320 mg d'un solide blanc
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
24
- Exemple 29:
- 4,4'-sulfonyldibenzène-1,3-diol (résorcinol sulfone)
OH
O
HO S OH
0
HO
RMN 'H (400 MHz, DMSO-d6) : 8: 6,24 (d, 2H), 6,33 (dd, 2H), 7,61 (d, 2H),
10,06
(s, 1 H); 10,16 (s, 1 H).
RMN 13C (100 MHz, DMSO d6) : 8:102,73, 106,41; 117,98; 131,54; 157,14; 162,86.
Rf (9/1; DCM/MeOH) : 0,6
B) Synthèse des analogues du résorcinol sulfone par oxydation des analogues du
résorcinol sulfide en résorcinol sulfone
A une solution de l'exemple 12 (=4-(2-(décyloxy)-4-
hydroxyphénylthio)benzène-1,3-diol) (195 mg, 0,5 mmol) dans 10 ml d'acide
acétique
sont ajoutés 2,8 mL d'une solution de peroxyde d'hydrogène à 30% dans H20 (25
mmol, 50 éq) puis le mélange est agité 48 heures à température ambiante.
50 mL d'eau sont ajoutés pour précipiter le produit. Le solide obtenu est
collecté
sur frité, puis lavé deux fois à l'eau puis deux fois au n-pentane. Le solide
est alors
séché une nuit à l'étuve à vide (50mbar, 50 C) pour conduire à un solide
blanc. 135 mg
de produit sont obtenus avec un rendement de 64%.
- Exemple 30:
- 4-(2-(decyloxy)-4-hydroxyphenylsulfonyl)benzene-1,3-diol
HO , OH
"O
O
HO
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
RMN'H (400 MHz, DMSO d6) : 8: 0,87 (tl, 3H), 1,26 (m, 14H), 1,44 (ml, 2H) ;
3,77
(ml, 2H) ; 6,22 (s, 1H) ; 6,30 (d, 1H) ; 6,35 (s, 1H) ; 6,44 (d, 1H) ; 7,59
(d, 1H) ; 7,74 (d,
I H); 9,97 (s, I H); 10,10 (s, I H), 10,30 (s, I H).
5 RMN 13C (100 MHz, DMSO d6) : 8: 13,89; 22,02; 25,29; 28,25; 28,64; 28,75;
28,88;
28,92; 31,24; 67,96; 99,78; 102,66; 106,04; 106,28; 117,91; 119,88; 131,65;
131,82;
156,97; 157,69; 162,77; 163,15.
II Résultats des tests biologiques
10 1) Protocoles
A) Détermination de l'activité dépigmentante sur test in vitro acellulaire :
test de
l'inhibition de la tyrosinase)
- Principe :
Ce test est utilisé pour évaluer l'activité dépigmentante des molécules
testées. La
15 tyrosinase est une enzyme limitante dans la mélanogénèse.
Elle appartient à la famille des oxydoréductases. Elle possède notamment la
fonction : monophénol mono oxygénase (MPMO) et polyphénol oxydase (PPO).
Elle est synthétisée au niveau des mélanocytes. Elle est activée lors de sa
migration vers les kératinocytes via les mélanosomes. Elle transforme la
tyrosine en
20 DOPA puis dopaquinone, ce qui conduit in fine à une polymérisation soit une
production de pigments (voir schéma ci-dessous).
Tyrosinase 0 Y" HO I / C02H
lent 02 HO
HO I / NH C 2O2H rapide O / NH2O2H Mélanine
Tyrosine r Monophénol DOPA rPolyphénol Dopaquinone
mono oxygénas e ox dase
MPMO PPO
Le substrat : la L-tyrosine, est transformée en L-DOPA par la fonction
25 monophénol mono oxygénase qui est transformée par la fonction polyphénol
oxydase
de la tyrosinase en dopaquinone. Cette dernière va s'auto-oxyder en dopachrome
qui est
mesuré en spectrophotométrie à 490 nm.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
26
Plus précisément, c'est l'activité tyrosinase globale (MPMOg) qui est mesurée
puisque c'est le dopachrome in fine qui est dosé. Ainsi les produits testés
sur MPMOg
(= mesure de l'activité sur PPO et MPMO) peuvent cumuler l'inhibition des
2 fonctions,
- inhiber uniquement la fonction MPMO stricto sensus (transformation de la
tyrosine en DOPA) en complément du test PPO,
- pourraient inhiber PPO uniquement
- Conditions générales expérimentales :
Lecteur : Synergy HT programme : tyrosinase 280-490 cinétique : cinétique sur
45 min,
lecture à t = l0minutes, Essais en 96 puits transparents, Tampon Phosphate -
pH 6.8,
Enzyme : mushroom tyrosinase - Sigma = T-3824Substrat: L-Tyrosine - Sigma = T-
3754, Témoin positif : Acide kojique (AK) - fluka = 60890 (inhibiteur de
référence)
- Molécules de référence pour le test :
Acide kojique : 9 M< IC 50 <20 M (PPO), 3 M< IC 50 <7 M (MPMO)
Vitamine C : 20 M< IC 50 <40 M (PPO)
Glutathion réduit : 55% inhibition à 25 M (PPO), IC 50 = 1-2 M (MPMO)
Hydroquinone : IC 50 = 3-4 M (MPMO)
Arbutine : 57% inhibition à 88 M (MPMO)
Ces molécules exogènes sont connues pour réguler négativement la mélanogenèse.
L'hydroquinone inhibe la synthèse de mélanine en se présentant comme substrat
de la
tyrosinase afin de détourner son activité. L'arbutine contenant de
l'hydroquinone agit de
la même manière. L'acide kojique diminue l'activité de la tyrosinase en
inhibant
l'hyperpigmentation induite par les UV. La vitamine C inhiberait la tyrosinase
mais se
comporterait également comme un réducteur puissant en empêchant la coloration
de la
mélanine par oxydation. La vitamine A diminue l'expression de la tyrosinase.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
27
B) Test du dosage de la mélanine dans des cellules B16-F10 :
- Principe :
Il s'agit d'un test de mesure de la synthèse de mélanine par dosage
colorimétrique sur une lignée cellulaire de mélanomes murins: la lignée B16-
F10. Ce
test permet d'évaluer le pouvoir dépigmentant de principes actifs.
Les cellules B16-F10 sont ensemencées dans des plaques 96 puits dans du
milieu DMEM supplémenté de SVF (sérum de veau foetal), et incubées 24 heures à
37 C, 5%CO2. Les cellules sont ensuite stimulées à l'a-MSH 0.1 M (pour
stimuler la
synthèse de mélanine, la stimulation observée est d'environ 150%) et traitées
72 heures
avec les actifs à tester. Chaque concentration d'actif est testée au moins en
triplicata. La
mélanine totale suivie de la mélanine intracellulaire dissoute dans du tampon
de lyse
sont alors dosées par lecture d'absorbance à 405 nm. Les protéines totales
sont dosées
dans le lysat et les résultats sont exprimés en mg mélanine / mg protéines. Le
pourcentage d'activité est calculé comme suit :
Moyenne normalisée du témoin - Moyenne normalisée du traité
% d'activité = x 100
Moyenne normalisée du témoin
Une valeur négative indique une inhibition, alors qu'une valeur positive
indique une
induction de la synthèse de mélanine.
- Conditions générales expérimentales :
- Matériel :
- Incubateur cellulaire à C02 (Heraeus), Etuve, Centrifugeuse (Heraeus), Hotte
à flux
d'air laminaire, Plaques 96 puits à fond plat transparent - Falcon, Cônes
stériles - Treff
Lab, Polylabo,Mithras LB940 (Berthold Technologies)- 154/MIPA/003
- Matériel biologique :
- Lignée cellulaire B 16-F 10 entre P 10 et P20 (mélanocytes murins) (ATCC,
CRL-6475)
- Réactifs :
- DMEM sans rouge de phénol (GIBc0BRL, 31053-028), Glutamax-I Supplément à
200mM (GIBcoBRL, 35050-038), D-PBS (GIBcoBRL, 14190-094), Sérum de veau
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
28
foetal (Invitrogen, 10270-098), Trypsine-EDTA (GIBcoBRL, 25300-054), NaOH
(Sigma, S8045-500G), DMSO (Sigma, 471267-1L), Nle, Phe - Melanocyte
Stimulating
Hormon (Sigma, M-8764), Mélanine (Sigma, M-0418), BCA-CoPPER (SIGMA, B9643
et C2284), BSA (SIGMA, P0914)
C) Test pour l'étude de la capacité antioxydante par chemiluminiscence
(Photochem
analytic Jena)
- Principe :
Ce test est utilisé pour déterminer la capacité antioxydante des molécules.
C'est
une méthode qui génère des radicaux libres par un signal photochimique.
L'intensité de
l'oxydation est 1000 fois supérieure à celles obtenues en conditions normales.
La détection se fait par chemiluminescence. Elle permet l'évaluation de
molécules ou extraits anti-oxydants hydrosolubles et liposolubles.
Les résultats sont exprimés respectivement en quantité équivalente de vitamine
C ou de Trolox (acide 6-Hydroxy-2,5,7,8-tétramethylchroman-2-carboxylique ).
La
sensibilité est de l'ordre de la nanomole.
L'activité anti-oxydante étudiée dans ce test représente la capacité à piéger
spécifiquement les anions superoxydes par chemiluminescence.
Les résultats quantifiés sont exprimés en équivalent Trolox (standard) soit en
g de produit pour 1 g de Trolox . Cela signifie qu'il faut une quantité x
d'échantillon pour obtenir une activité équivalente à l'activité détectée pour
1 g de
standard. C'est un pouvoir anti-oxydant relatif à une référence, cela nous
affranchit de
la concentration testée.
- Génération de radicaux libres oxygénés :
Le radical superoxide : Oz est généré par une réaction photochimique :
L+hv(UV)+02 > L*02 > L'+ +Oz'-
L*: luminol à l'état excité
L'+.- radical luminol
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
29
- Détection du signal :
Une partie des anions superoxydes est quenchée par les anti-oxydants. Les
radicaux libres restants sont quantifiés par chemiluminescence.
L'+ +02.- > N2 + AP*2_ > AP2- + hv (luminescence)
AP*2- : aminophtalate à l'état excité
Nom Conditions Photosensibilisant Antioxydant
Blanc 100% 020 générés + -
Gamme standard: Vitamine C
Standards +
De 1 à 3 nmol Ou trolox
Essai +/- Oz générés + Molécule x à tester
D) Test de protection de l'acide linoléique suite à un stress UV.
- Cible : protection de l'acide linoléique en condition de Fenton, irradiation
UV
L'acide linoléique appartient à la famille des acides gras polyinsaturés
(AGPI).
Sensible à l'oxydation, l'acide linoléique est une cible privilégiée pour les
radicaux
libres (RLO) dans les milieux biologiques. Lorsque les membranes biologiques
sont
exposées à un stress oxydant, les composants les plus affectés sont les
phospholipides
constitués d'AGPI et le cholestérol. Leur dégradation conduit à la
peroxydation
lipidique et généralement à une déstructuration. La peroxydation lipidique est
un
processus auto catalytique qui implique généralement les RLO. La peroxydation
lipidique est en partie responsable du vieillissement cutané.
La méthode employée pour évaluer la peroxydation lipidique repose sur le
couplage de l'acide thiobarbiturique (TBA) et des produits secondaires de
dégradation
conduisant à des composés colorés détectables en spectrofluorométrie. Le
composé
secondaire essentiel de dégradation final est le malondialdehyde, MDA. Le MDA
est un
aldéhyde cancérigène et mutagène, il agit sur les protéines, et ADN.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
- Principe du test :
L'échantillon à tester est mis en contact avec l'acide linoléique dans un
rapport
poids/ poids. L'échantillon subit une irradiation 10 DEM (Dose Erythémale
Minimale)
en condition de Fenton à savoir en présence de H202 et de fer II dans un
simulateur
5 solaire.
Suite à l'irradiation, le réactionnel est repris dans le méthanol et
dérivatisé à
90 C avec le TBA. Le chromogène, le complexe MDA-TBA, représentatif de la
production équimolaire de MDA se dose en fluorimétrie (excitation à 525 nm,
émission
à 549 nm).
10 Les résultats sont exprimés en unités de fluorescence, en fonction d'une
gamme
étalon de MDA-TBA puis exprimés en concentration du complexe MDA-TBA. Ensuite,
le pourcentage du rapport MDA / Acide linoléique de départ (AL) est déterminé.
Puis le pourcentage de protection d'acide linoléique est déterminé.
15 E) Détermination de la concentration minimale inhibitrice(CMI) :
Ce test est utilisé pour déterminer l'activité antibactérienne d'un composé.
Des tests ont été réalisés avec 4 souches de bactéries en utilisant le
principe de
microdilution. Les CMI sont déterminées par microméthode en milieu liquide.
Les
dilutions successives de raison 2 des produits tests dans le bouillon de
culture (Trypcase
20 Soja) sont réalisées en microplaques à 96 puits dans un volume final de 0,1
ml. Les
puits sont ensemencés avec O,Olml des suspensions bactériennes titrées à
environ 107
UFC/ml. Les microplaques sont incubées en conditions optimales de croissance
et la
CMI est lue visuellement.
2) Résultats :
25 A) Détermination de l'activité dépigmentante sur test in vitro acellulaire
: test de
l'inhibition de la tyrosinase.
L'ensemble des résultats a été regroupé dans le Tableau 1 récapitulatif inséré
plus loin.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
31
- Légende des résultats pour le test tyrosinase :
activité intéressante +++ rès bonne activité > 80% dose de 250 à 150 pM
activité intéressante ++ bonne activité > 30% dose de 250 à 150 pM
B) Test du dosage de la mélanine dans des cellules B16-F10 :
Les résultats ont également été regroupés dans le Tableau 1 récapitulatif ci-
après.
- Interprétation des résultats :
Une valeur négative indique une inhibition, alors qu'une valeur positive
indique
une induction de la synthèse de mélanine.
On constate que la majorité des composés testés présentent une bonne capacité
d'inhibition de la synthèse de mélanine. L'invention concerne donc
l'utilisation
cosmétique pour la dépigmentation de la peau des composés de formule générale
(I) ou
(I').
C) Test pour l'étude de la capacité antioxydante par chemiluminiscence
(Photochem
analytic Jena)
Les résultats ont également été regroupés dans le Tableau 1 récapitulatif ci-
après.
La majorité des composés a une bonne activité antioxydante. L'échelle pour
interpréter les résultats est la suivante :
g éch pour Activité
Produits
1 g de Trolox
Très bonne
Vitamine C 0.1 à 3.0
BHT 3.01 à 50 Bonne
Cystéine 50.1 à 1000 Moyenne
Albumine > 1000 Faible
Acide Nulle
NEGATIF
Lipoïque
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
32
La plupart des composés présentent des résultats comparables à la vitamine C.
Tous les composés montrent des résultats inférieurs à 1000 g de trolox (301 g
étant le
plus faible résultat obtenu avec le résorcinol sulfone) ; ils ont donc tous
une activité
anti-oxydante intéressante. L'invention concerne également l'utilisation
cosmétique
pour la prévention et/ou le traitement du vieillissement de la peau des
composés de
formule générale (I) ou (I').
D) Test de protection de l'acide linoléique suite à un stress UV
Les résultats ont également été regroupés dans le Tableau 1 récapitulatif ci-
après. Le contrôle négatif est l'acide linoléique non stressé par les
radiations UV et
chimiquement : donc non irradié (NI). Il est représentatif de l'oxydation
basale liée à
l'environnement. Il correspond à la production basale non spécifique de MDA,
et est
très faible (de l'ordre de 7 10E-7 M).
Le contrôle positif est la quercétine qui a une protection quasi totale à 1%
et qui
protège partiellement (environ 50%) à 0.1%.
La dose de produit est exprimée en rapport poids/poids c'est-à-dire en
pourcentage massique par rapport à la quantité initiale totale d'acide
linoléique. Le taux
maximal de MDA est déterminé par la condition UV + H202 + fer II (F).
Le pourcentage de protection d'acide linoléique représente : le rapport % de
MDA en condition de stress maximale non-traité sur % de MDA en condition de
stress
traité par le produit.
Une molécule est considérée comme significativement active si son pourcentage
de protection de l'acide linoléique est supérieur à 20%. L'ensemble des
molécules
testées est donc significativement actif.
Tableau 1
Résultat activité Résultats activité g d'échantillon % Protection
Exemple dépigmentante B16 pour 1 g de Acide linoléique
Tyrosinase -% à X M Trolox Sous UV/Fenton
Exemple + + +
1 1 M -50% (61 M) 23 90%
Exemple + +
2 -50% (14 M) 9,7 92%
Exemple +++ -41%(20 M) 4,7 87%
3
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
33
Exemple + + + -35% (10 M) 5,2 89%
4
Exemple + + + -27% (20 M) 2,8 89%
Exemple + + + -30% (20 M) 14,9 -
6
Exemple + + + -50% (10 M) 3,4 92%
7
Exemple + + + -40% (10 M) 18,8 97%
8
Exemple + + + -31% (20 M) 3,2 85%
9
Exemple + + + -20% (20 M) 22 94%
Exemple +++ -34%(20 M) 3,5 91%
11
Exemple +++ - 3,4 96%
12
Exemple - - 5,7 95%
13
Exemple + + + o
14 7 M -50 /o (48 M) 4,8 -
Exemple + + -20% (10 M) 30 75%
Exemple + + + - 33,2 91%
16
Exemple + + + -50% (92 M) 3,9 87%
17
Exemple + + + -20% (50 M) 24,1 90%
18
Exemple + + + -20% (50 M) 2,8 88%
19
Exemple +++ -24%(50 M) 25,6 91%
Exemple + + + o
21 11 M -50 /o (32 M) 5,9 -
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
34
Exemple + + + - 2,5 97%
22
Exemple + + + - 2,8 96%
23
Exemple + + + -26% (50 M) 3,8 97%
24
Exemple + + +
2512 M -50% (73 M) 73 79%
Exemple +++ - 69 80%
26
Exemple +++ - 40 78%
27
Exemple ++ - 28 94%
28
Exemple - - 301 25%
29
Exemple
30 - - 147 34%
E) Détermination de la concentration minimale inhibitrice (CMI)
Les résultats ont été regroupés dans le Tableau 2. On considère qu'un composé
présente une très bonne activité antibactérienne quand il présente une CMI
inférieure à
1 ppm. L'activité antibactérienne est considérée comme bonne lorsque la CMI
est
comprise entre 1 ppm et 100 ppm. L'activité antibactérienne d'un composé est
considérée comme moyenne quand elle est comprise entre 100 ppm et 1000 ppm.
15
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
Tableau (2)
Souches de Exemple 5 Exemple 7 Exemplel2 Exemple 13
bactéries
Staphylococcus
aureus 6 ppm 0.78 ppm 0.78 ppm 190 ppm
IP4.83
ATCC6538
Staphylococcus
epidermidis 3 ppm 0.39 ppm 0.39 ppm 156 ppm
IP 6821
P. acnes
IP53.117 3 ppm 0.09 ppm 0.09 ppm 90 ppm
ATCC6919
Escherichia
Coli - 390 ppm 780 ppm -
IP53126
ATCC8739
5 Les composés testés présentent une activité antibactérienne significative.
En
particulier, les exemples 7 et 12 présentent une activité antibactérienne
forte contre la
souche Propionibacterium acnes.
III. Composition selon l'invention.
Ingrédients (noms INCI désignation Pourcentage Fonction
commerciaux) en poids
1. Eau purifiée eau QSP 100%
Hydrolite 5 Pentylène Glycol 3 Humectant,
Conservateur
EDTA, 2Na Disodium EDTA 0.1 Agent complexant
Microcare PM4 Phenoxyethanol- 0.8 Conservateurs
Parabène
PCL Hydrosoluble Trideceth-9 & PEG-5 1.5 Emollient aqueux
Ethylhexanoate
II. Pemulen TR-1 Acrylates/C10-30 0.5 Gélifiant, agent
AlkylCrosspolymer stabilisant
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
36
III. Stearine TP acide stéarique 2 Emulsionnant,
facteur de
consistance
PCL Liquide Cetearylethylhexanoate 3 Emollient
& Isopropylmyristate
DC200 Diméthicone 0.3 Emollient
Myritol 318 Triglycerides caprique 3 Emollient
ou caprylique
Primol 352 paraffine liquide 2 Emollient
IV. Actif Actif
Dépigmentant
NaOH 0,08 Ajusteur de pH
V. Soude
Dans une telle composition, le pourcentage du principe actif peut varier entre
0,01% et 10% en poids et de préférence de 0,1 % à 5% en poids par rapport au
poids
total de la composition.
L'invention vise également les compositions pharmaceutiques ou cosmétiques
comprenant au moins un des composés de formule (I) ou de formule (I') en
association
avec au moins un excipient pharmaceutiquement ou cosmétiquement acceptable
Selon un mode de réalisation particulier de l'invention, les compositions
pharmaceutiques ou cosmétiques comprennent au moins un des composés de formule
(I) ou de formule (I') en association avec au moins un excipient
pharmaceutiquement
ou cosmétiquement acceptable et une phase grasse.
Selon un mode de réalisation particulier de l'invention, les compositions
pharmaceutiques ou cosmétiques comprennent au moins un des composés de formule
(I) ou de formule (I') en association avec au moins un excipient
pharmaceutiquement
ou cosmétiquement acceptable et un émollient.
La présente invention concerne une composition cosmétique dépigmentante de
la peau et/ou des cheveux et/ou des poils caractérisée en ce qu'elle comprend
au moins
un composé de formule (I) ou de formule (I').
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
37
L'invention vise également une composition cosmétique anti-vieillissement de
la peau, caractérisée en ce qu'elle comprend au moins un composé de formule
(I) ou de
formule (I').
L'invention s'étend également à une composition pharmaceutique désinfectante
de la peau caractérisée en ce qu'elle comprend au moins un composé de formule
(I).
La composition selon l'invention peut comprendre en outre des adjuvants
cosmétiques classiques notamment choisis parmi les phases grasses, les
solvants
organiques, les épaississants, les adoucissants, les opacifiants, les
stabilisants, les
émollients, les agents anti-mousse, les agents hydratants, les parfums, les
conservateurs
comme les parabens, les polymères, les charges, les séquestrants, les
bactéricides, les
absorbeurs d'odeur, les agents alcalinisants ou acidifiants, les tensio-
actifs, les ami-
radicaux libres, les antioxydants, les vitamines E et C, les a-hydroxyacides,
ou des eaux
thermales comme l'eau thermale d'Avène ou tout autre ingrédient habituellement
utilisé
en cosmétique, en particulier pour la fabrication de compositions de ce type.
La composition selon l'invention peut en outre comprendre une phase grasse. La
phase grasse peut être constituée par une huile ou une cire ou leurs mélanges,
et
comprendre également les acides gras, les alcools gras et les esters d'acides
gras. Les
huiles peuvent être choisies parmi les huiles animales, végétales, minérales
ou de
synthèse et notamment parmi l'huile de vaseline, l'huile de paraffine, les
huiles de
silicone, volatiles ou non comme la dimethicone ; les isoparaffines, les
polyoléfines, les
huiles fluorées et perfluorées. De même, les cires peuvent être choisies parmi
les cires
animales, fossiles, végétales ou de synthèse telles que les cires d'abeille,
les cires de
candelila, les cires de canauba, le beurre de karité, de la cire de pétrole
(ou cire
microcristalline), la paraffine, et leurs mélanges.
La composition selon l'invention peut comprendre en outre un polyol miscible à
l'eau à la température ambiante (environ 25 C), notamment choisi parmi les
polyols
ayant notamment de 2 à 20 atomes de carbones, de préférence ayant de 2 à 10
atomes de
carbone, et préférentiellement ayant de 2 à 6 atomes de carbones, tels que la
glycérine ;
les dérivés de glycol tel que le propylène glycol, le butylène glycol, le
pentylène glycol,
l'hexylène glycol, le dipropylène glycol, le diéthylène glycol ; les éthers de
glycol tels
que les éthers d'alkyle en C1-C4 de mono-, di- ou tri-propylène glycol, les
éthers
d'alkyle en C1-C4 de mono-, di- ou tri-éthylène glycol ; et leurs mélanges.
CA 02757534 2011-0&30
WO 2010/115945 PCT/EP2010/054619
38
La composition selon l'invention peut également comprendre des agents
épaississant ou des agents de modification de la rhéologie, tels que par
exemple des
uréthanes non ioniques éthoxylés hydrophobiquement modifiés, des acides
polycarboxyliques épaississants tels que des copolymères d'acrylates/stéareth-
20
méthacrylate, des carbomères, des copolymères d'acrylates réticulés et leurs
mélanges.
La composition selon l'invention peut également comprendre des acides et des
bases permettant d'ajuster la zone de pH de ladite composition. Les bases
peuvent être
minérales (soude, potasse, ammoniaque, etc.) ou organiques telles que la mono-
, di- ou
tri-éthano lamine, un aminométhylpropanediol, la N-méthyl-glucamine, les
acides
aminés basiques comme l'arginine et la lysine, et leurs mélanges.
La composition selon l'invention peut également comprendre des agents de
conditionnement de la peau. Des exemples d'agents de conditionnement de la
peau
comprennent, sans y être limité, des émulsifiants anioniques, cationiques et
non
ioniques tels que le sulfate de lauryle de sodium, le sulfosuccinate de
dioctyle de
sodium, le stéarate de sodium, l'ester de sorbitane ; des acides gras
éthoxylés ; des
alcools gras éthoxylés tels que le trideceth-9 et le PEG-5 éthylhexanoate ;
l'acide
stéarique ; tout autre émulsifiant et agent de conditionnement connu de
l'homme du
métier ; et leurs mélanges.
La composition selon l'invention peut en outre contenir d'autres principes
actifs
conduisant à un effet complémentaire.
La composition selon l'invention peut être présentée sous n'importe quelle
forme
appropriée pour une application topique, notamment sur la peau et/ ou les
cheveux. En
particulier, elles peuvent se présenter sous la forme d'émulsions obtenues par
la
dispersion d'une phase grasse dans une phase aqueuse, par exemple une émulsion
huile-
dans-eau ou eau-dans-huile ou multiple, ou sous la forme d'un gel ou d'un
produit
anhydre liquide, pâteux ou solide, ou sous la forme d'une dispersion en
présence de
sphérules. La composition selon l'invention peut également être moins fluide
et se
présenter sous la forme d'une crème blanche ou colorée, d'une pommade, d'un
lait,
d'une lotion, d'un sérum, d'une pâte, d'un masque, d'une poudre, d'un stick
solide, ou
éventuellement d'un aérosol, d'une mousse ou d'un spray.