Note: Descriptions are shown in the official language in which they were submitted.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
1
OCTASACCHARIDES N-ACYLES ACTIVATEURS DES RECEPTEURS DES
FGFs, LEUR PRÉPARATION ET LEUR APPLICATION EN THÉRAPEUTIQUE
La présente invention se rapporte à des octasaccharides N-acylés agonistes du
système FGFs/FGFRs, à leur préparation et à leur application en thérapeutique.
L'angiogenèse est un processus de génération de nouveaux vaisseaux
capillaires. Lors de l'obstruction d'un vaisseau sanguin, l'angiogenèse,
associée à
l'artériogenèse (dilatation des capillaires), améliore la revascularisation de
la zone
obstruée. Il a été montré in vitro et in vivo que plusieurs facteurs de
croissance, tels
que les Fibroblast Growth Factors (FGFs), stimulent le processus de
néovascularisation.
Les FGFs sont une famille de 23 membres. Le FGF2 (ou FGF basique) est une
protéine de 18 kDa. Le FGF2 induit au niveau des cellules endotheliales en
culture leur
prolifération, leur migration et la production de protéases. In vivo, le FGF2
favorise les
phénomènes de néovascularisation. Le FGF2 interagit avec les cellules
endothéliales
par l'intermédiaire de deux classes de récepteurs, les récepteurs de haute
affinité à
activité tyrosine kinase (FGFRs) et les récepteurs de basse affinité de type
héparane
sulfate protéoglycane (HSPG).
Il est connu que les récepteurs de la surface cellulaire à activité tyrosine
kinase
s'associent sous forme de dimère à un complexe formé de deux molécules de
ligand et
à une molécule d'héparane sulfate. La formation de ce complexe permet de
déclencher une cascade de signaux intracellulaires aboutissant à l'activation
de la
prolifération et de la migration cellulaire, deux processus clé impliqués dans
l'angiogenèse.
Ainsi, le FGF2 et ses récepteurs représentent des cibles très pertinentes pour
les thérapies visant à activer ou à inhiber les processus d'angiogenèse.
Des oligosaccharides de synthèse ont également fait l'objet d'études
d'interactions avec les récepteurs des FGFs (C. Tabeur et al., Bioorg. & Med.
Chem.,
1999, 7,2003-2012 ; C. Noti et al., Chem. Eur. J., 2006, 12, 8664-8686).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
2
Nous avons maintenant trouvé de nouveaux composés oligosaccharidiques de
synthèse capables de faciliter la formation du complexe FGF/FGFRs et de
favoriser
ainsi la survie des cellules endotheliales in vitro et d'augmenter la
formation de néo-
vaisseaux in vitro et in vivo.
La présente invention a pour objet de nouveaux composés octasaccharidiques
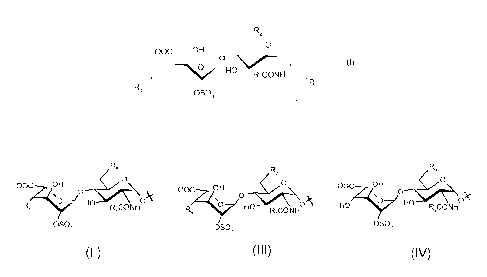
répondant à la formule (I) :
R2
0
-00C OH
0
\o
HO
R,CONH
R1 (I)
Ftõ
OSO,
dans laquelle :
- le trait ondulé désigne une liaison située soit au-dessous, soit au-
dessus du
plan du cycle pyranosique de l'unité glucosamine,
- R1 représente un groupe 0-alkyle, dans lequel ledit groupe alkyle
comporte de
1 à 16 atomes de carbone et est éventuellement substitué par un ou plusieurs
(par
exemple 1 ou 2) groupes, identiques ou différents, choisis parmi les groupes
aryles et
cycloalkyles,
- R2 représente soit un groupe 0S03-, soit un groupe hydroxyle,
- R3 représente un groupe alkyle, cycloalkyle ou alkyl-cycloalkyle, et
- R4 représente un disaccharide de formule (II) :
Ft,
0
-00C OH
0
\0 HO 0 (II)
R, R,CONH
OSO,
dans laquelle :
- R3 est tel que défini ci-dessus,
- R5 représente soit un groupe 0S03-, soit un groupe hydroxyle, et
- R6 représente un disaccharide de formule (III) :
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
3
R,
0
-00C OH
0
\0 0 (III)
HO ________________________________________
R, R,CONH
OSO,
dans laquelle :
- R3 est tel que défini ci-dessus,
- R7 représente soit un groupe 0S03-, soit un groupe hydroxyle, et
- R8 représente un disaccharide de formule (IV) :
R,
0
00C OH
0
\o 0 (IV)
HO HO
R,CONH
Os0,-
dans laquelle :
- R3 est tel que défini ci-dessus,
- R9 représente soit un groupe 0S03-, soit un groupe hydroxyle.
Dans le cadre de la présente invention, et sauf mention différente dans le
texte,
on entend par:
- groupe alkyle : un groupe aliphatique saturé linéaire ou ramifié. Sauf
indication différente dans le texte, un tel groupe alkyle comprend
avantageusement
entre 1 et 6 atomes de carbone. A titre d'exemples, on peut citer les groupes
méthyle,
éthyle, propyle, isopropyle, butyle, isobutyle, tert-butyle, pentyle, etc;
- groupe cycloalkyle: un groupe alkyle cyclique comprenant de 3 à 6 atomes
de carbone, par exemple un groupe cyclopentyle ou cyclohexyle ;
- groupe alkyle-cycloalkyle : un groupe alkyle lui-même substitué par un
groupe cycloalkyle, lesdits groupes alkyle et cycloalkyle étant tels que
définis ci-
dessus ; et
- groupe aryle : un groupe aromatique cyclique comprenant entre 5 et 10
atomes de carbone, tel qu'un groupe phényle. Un tel groupe aryle est
éventuellement
substitué par un ou plusieurs groupes tels que les atomes d'halogène et les
groupes
alkyles, alcoxy, thioalkyles, trifluorométhyle et phényle.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
4
Les octasaccharides selon l'invention sont des oligosaccharides de synthèse,
c'est-à-dire qu'il s'agit de composés obtenus par synthèse totale à partir de
synthons
intermédiaires, comme cela sera décrit en détail dans ce qui suit. A ce titre
ils diffèrent
d'oligosaccharides obtenus par dépolymérisation ou isolement à partir de
mélanges
complexes de polysaccharides, de type héparines ou héparines de bas poids
moléculaires. Notamment, les composés selon l'invention présentent une
structure bien
déterminée résultant de leur synthèse chimique et se présentent sous forme
d'octasaccharides purs, c'est-à-dire exempts d'autres espèces
oligosaccharidiques.
L'invention englobe les composés de formule (I) sous forme acide ou sous la
forme de l'un quelconque de leurs sels pharmaceutiquement acceptables. Dans la
forme acide, les fonctions -000- et -S03- sont respectivement sous forme -COOH
et
-S03H.
On entend par sel pharmaceutiquement acceptable des composés de
l'invention, un composé dans lequel une ou plusieurs des fonctions -000- ou/et
-S03-
sont liées de façon ionique à un cation pharmaceutiquement acceptable. Les
sels
préférés selon l'invention sont ceux dont le cation est choisi parmi les
cations des
métaux alcalins, notamment le cation Na.
Les composés de la formule (I) selon l'invention comprennent également ceux
dans lesquels un ou plusieurs atomes d'hydrogène ou de carbone ont été
remplacés
par leur isotope radioactif, par exemple le tritium ou le carbone 014. De tels
composés
marqués sont utiles dans les travaux de recherche, de métabolisme ou de
pharmacocinétique, en tant que ligands dans les essais biochimiques.
Dans la formule (I) des composés selon la présente invention, il est entendu
que:
- le disaccharide de formule (II) est lié à l'unité disaccharidique
représentée
dans la formule (I) par l'atome d'oxygène situé en position 1 de son unité
glucosamine,
- de même, le disaccharide de formule (III) est lié au disaccharide de
formule
(Il) par l'atome d'oxygène situé en position 1 de son unité glucosamine,
- de même, le disaccharide de formule (IV) est lié au disaccharide de
formule
(III) par l'atome d'oxygène situé en position 1 de son unité glucosamine.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
On entend par unité glucosamine l'unité monosaccharidique de formule
suivante :
HO R,CONH
5
L'autre type d'unité saccharidique présente dans les composés selon
l'invention
est un acide uronique, plus précisément un acide iduronique, répondant à la
formule
suivante :
-00C OH
0s03-
10O
Ainsi, les composés de formule (I) selon l'invention, qui sont des
octasaccharides, peuvent également être représentés selon la formule (I')
comme suit,
dans laquelle se succèdent les unités iduroniques et les unités glucosamines
et dans
laquelle R1, R2, R3, R5, R7 et R9 sont tels que définis précédemment :
R2
R5 0
R7o
R,
00C OH HO
R,CONH
77_7/0 0 HO R,CONH
HO R,CONH OSO,
HO R,CONH OSO,
OS0,
OS0,
(r)
Parmi les composé de formule (I)/(1') objets de l'invention, on peut citer un
sous-
groupe de composés dans lequel R1 représente :
- soit un groupe 0-alkyle, dans lequel ledit groupe alkyle comporte de 5 à
16
atomes de carbone, avantageusement de 5 à 12 atomes de carbone (par exemple un
groupe -0-pentyle, -0-undécyle ou 2-propyl-pentyle),
- soit un groupe 0-alkyle, dans lequel ledit groupe alkyle comporte de 1 à
8
atomes de carbone, avantageusement de 3 à 6 atomes de carbone (par exemple un
groupe -0-propyle ou -0-pentyle), et est substitué par 1 ou 2 groupes,
identiques ou
différents, choisis parmi les groupes aryles et cycloalkyles (par exemple les
groupes
phényles et cycloalkyles, tel que le cyclohexyle).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
6
Parmi les composé de formule (I)/(1') objets de l'invention, on peut citer un
autre
sous-groupe de composés, dans lequel R3 représente soit un groupe alkyle
comprenant de 2 à 6 atomes de carbone (par exemple un groupe propyle ou
pentyle),
soit un groupe cycloalkyle (par exemple un groupe cyclopentyle).
Parmi les composé de formule (I)/(1') objets de l'invention, on peut citer un
autre
sous-groupe de composés, dans lequel au moins l'un des groupes R2, R5, R7 et
R9
représente un groupe hydroxyle.
Un autre sous-groupe de composés objets de l'invention est tel que au moins
l'un des groupes R2, R5, R7 et R9 représente un groupe hydroxyle et au moins
l'un des
groupes R2, R5, R7 et R9 représente un groupe 0S03-.
D'autres sous-groupes d'octasaccharides selon l'invention peuvent présenter
plusieurs des caractéristiques énoncées ci-dessus pour chacun des sous-groupes
définis précédemment.
On peut en particulier citer le sous-groupe de composés de formule (I) dans
lequel :
- R1 représente :
. soit un groupe 0-alkyle, dans lequel ledit groupe alkyle comporte de 5 à
16 atomes de carbone, avantageusement de 5 à 12 atomes de carbone (par exemple
un groupe -0-pentyle, -0-undécyle ou 2-propyl-pentyle),
. soit un groupe 0-alkyle, dans lequel ledit groupe alkyle comporte de 1 à
8 atomes de carbone, avantageusement de 3 à 6 atomes de carbone (par exemple
un
groupe -0-propyle ou -0-pentyle), et est substitué par 1 ou 2 groupes,
identiques ou
différents, choisis parmi les groupes aryles et cycloalkyles (par exemple les
groupes
phényles et cycloalkyles, tel que le cyclohexyle),
- R3 représente soit un groupe alkyle comprenant de 2 à 6 atomes de carbone
(par exemple un groupe propyle ou pentyle), soit un groupe cycloalkyle (par
exemple
un groupe cyclopentyle), et
- au moins l'un des groupes R2, R5, R7 et R9 représente un groupe
hydroxyle.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
7
Parmi les composés de l'invention, on peut notamment citer les octasaccharides
suivants :
- Pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sodi um
su lfonato-a-L-idopyranosyl uronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-
sodium sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-P-D-glucopyranoside (n 1) ;
- Pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
désoxy-2-(1-oxobutyl)amino-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-désoxy-2-(1-
oxobutyl)amino-6-0-sodium
sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-(1-
oxobutyl)amino-6-
0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sod iu m
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-2-désoxy-2-(1-oxobutyl)amino-6-0-sodium
sulfonato-P-D-glucopyranoside (n 2) ;
- Pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
désoxy-2-(1-oxohexyl)amino-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-désoxy-2-(1-
oxohexyl)amino-6-0-sodium
sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-(1-
oxohexyl)amino-
6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sod iu m
sulfonato-a-L-
idopyranosyluronate de sodium )-(14)-2-désoxy-2-(1-oxohexyl)am ino-6-0-sodi um
sulfonato-P-D-glucopyranoside (n 3) ;
- Pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
[(cyclopentylcarbonyl)amino]-2-désoxy-6-0-sod iu m
sulfonato-a-D-glucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-
[(cyclopentylcarbonyl)amino]-2-désoxy-6-0-sod iu m
sulfonato-a-D-glucopyranosyl)-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
8
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-
[(cyclopentylcarbonyl)amino]-2-désoxy-6-0-sod iu m
sulfonato-a-D-glucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-2-
[(cyclopentylcarbonyl)amino]-2-désoxy-6-0-sod iu m
sulfonato-P-D-glucopyranoside
(n 4) ;
- Undecyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sodi um
su lfonato-a-L-idopyranosyl uronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-
sodium sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-P-D-glucopyranoside (n 5) ;
- 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-
6-
0-sodium su Ifonato-a-D-glucopyranosyl)-(1 4)-(2-0-sod iu m
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-P-D-glucopyranoside (n 6) ;
- Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium sulfonato-a-D-glucopyranosyI)-[(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-
sodium sulfonato-a-D-glucopyranosyl)]2-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-
D-glucopyranoside (n 7) ;
- Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-
sodium sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
9
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-a-D-glucopyranosy1)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-acétamido-
2-désoxy-6-0-sodium sulfonato-a-D-glucopyranoside (n 8) ;
- Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sodi um
su lfonato-a-L-idopyranosylu ronate de
sod iu m)-(14)-(2-acétam ido-2-désoxy-6-0-
sodium sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-a-D-glucopyranosy1)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-acétamido-
2-désoxy-6-0-sodium sulfonato-a-D-glucopyranoside (n 9) ;
-
Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-a-D-glucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-acétamido-2-désoxy-
a-
D-glucopyranoside (n 10) ;
-
Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-a-D-glucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-acétamido-2-désoxy-
6-
0-sodium sulfonato-a-D-glucopyranoside (n 11) ;
- Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sod
iu m
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-a-D-
glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
sodium su lfonato-a-L-idopyranosylu ronate de sodium )-(14)-2-acétam ido-2-
désoxy-a-
D-glucopyranoside (n 12) ;
- Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
5
acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sod
iu m
su lfonato-a-L-idopyranosyl uronate de
sodium )-(14)-(2-acétam ido-2-désoxy-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-(14)-(2-0-
sodium su lfonato-a-L-idopyranosylu ronate de sodium )-(14)-2-acétam ido-2-
désoxy-6-
10 0-sodium sulfonato-a-D-glucopyranoside (n 13) ;
- 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-
(14)-(2-0-sodium su lfonato-a-L-idopyranosyl uronate de sodium )-(14)-(2-
désoxy-2-
(1-oxobutyl)amino-6-0-sodium sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium
su lfonato-a-L-idopyranosyl uronate de sodium )-(14)-(2-désoxy-2-(1-
oxobutyl)am ino-a-
D-glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-désoxy-2-(1-oxobutyl)amino-p-D-glucopyranoside (n 14) ;
- 2-propyl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-
(14)-(2-0-sodium su lfonato-a-L-idopyranosyl uronate de sodium )-(14)-(2-
désoxy-2-
(1-oxobutyl)amino-6-0-sodium
sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium
su lfonato-a-L-idopyranosyl uronate de sodium )-(14)-(2-désoxy-2-(1-
oxobutyl)am ino-a-
D-glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-désoxy-2-(1-oxobutyl)amino-P-D-glucopyranoside (n 15) ;
- 3-cyclohexyl-propyl (2-0-sodium su lfonato-a-L-idopyranosyl u ronate de
sodium )-(14)-(2-désoxy-2-acétam ido-6-0-sod iu m su
Ifonato-a-D-glucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-
acétamido-6-0-sodium sulfonato-a-D-glucopyranosyI)-(14)-(2-0-sodium sulfonato-
a-
L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-acétamido-a-D-
glucopyranosy1)-
(14)-(2-0-sodium su lfonato-a-L-idopyranosylu ronate de sodium )-(14)-2-désoxy-
2-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
11
acétamido-P-D-glucopyranoside (n 16) ;
- 3-cyclohexyl-propyl (2-0-sodium su lfonato-a-L-idopyranosyl u ronate de
sodium )-(14)-(2-désoxy-2-(1-oxobutyl)am ino-6-0-sod iu m
sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium
sulfonato-a-D-glucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-
(1-oxobutyl)amino-a-D-glucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de
sodium)-(14)-2-désoxy-2-(1-oxobutyl)amino-p-D-
glucopyranoside (n 17) ;
-
3,3-diphényl-propyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sod iu m
sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium sulfonato-a-D-glucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-
(1-oxobutyl)amino-a-D-glucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de
sodium )-(14)-2-désoxy-2-(1-oxobutyl)am ino-p-D-
glucopyranoside (n 18) ; et
- 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1 4)-(2-désoxy-2-(3-méthy1-1-oxobutyl)am ino-6-0-sod iu m
sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1 4)-(2-désoxy-2-(3-méthy1-1-oxobutyl)am ino-6-0-sod iu m
sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(3-méthy1-1-oxobutyl)am ino-a-D-glucopyranosyI)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-désoxy-2-(3-méthy1-
1-
oxobutyl)amino-P-D-glucopyranoside (n 19).
Dans son principe, le procédé de préparation des composés selon l'invention
utilise des synthons de base di- ou oligosaccharidiques préparés comme
précédemment rapporté dans la littérature. On se réfèrera notamment aux
brevets ou
demandes de brevet EP 0 300 099, EP 0 529 715, EP 0 621 282 et EP 0 649 854,
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
12
ainsi qu'à la publication de C. Van Boeckel et M. Petitou parue dans Angew.
Chem. Int.
Ed. Engl., 1993, 32, 1671-1690. Ces synthons sont ensuite couplés les uns aux
autres
de façon à fournir un équivalent entièrement protégé d'un octasaccharide selon
l'invention. Cet équivalent protégé est ensuite transformé en un composé selon
l'invention. Dans les réactions de couplage évoquées ci-dessus, un di- ou
oligosaccharide "donneur", activé sur son carbone anomère, réagit avec un di-
ou
oligosaccharide "accepteur", possédant un hydroxyle libre.
Les schémas spécifiques des synthèses seront décrits dans les exemples
détaillés qui suivent.
La présente invention concerne donc un procédé pour la préparation des
octasaccharides de formule (1)/(1'), caractérisé en ce que:
- dans une première phase, un équivalent complètement protégé de
l'octasaccharide (1) désiré est synthétisé,
- dans une seconde phase, les positions devant comporter des groupements
sulfates sur la molécule finale sont déprotégées, puis 0-sulfatées,
- dans une troisième phase, on déprotège l'ensemble du composé, et
- dans une quatrième phase, les groupements N-acylés sont introduits
(introduction des groupements R3-00-).
La synthèse de l'équivalent complètement protégé de l'octasaccharide (1)
désiré
est réalisée selon des réactions bien connues de l'Homme de l'art, en
utilisant les
méthodes pour la synthèse d'oligosaccharides (par exemple G.J. Boons,
Tetrahedron
(1996), 52, 1095-1121 et demandes de brevets WO 98/03554 et WO 99/36443), dans
lesquelles un oligosaccharide donneur de liaison glycosidique est couplé avec
un
oligosaccharide accepteur de liaison glycosidique pour conduire à un autre
oligosaccharide dont la taille est égale à la somme des tailles des deux
espèces
réactives. Cette séquence est répétée jusqu'à l'obtention du composé de
formule (1),
éventuellement sous forme protégée. La nature et le profil de la charge du
composé
final désiré déterminent la nature des entités chimiques utilisées dans les
différentes
étapes de la synthèse, selon les règles bien connues de l'Homme de l'art. On
pourra
se référer par exemple à C. Van Boeckel et M. Petitou, Angew. Chem. Int. Ed.
Engl.
(1993), 32, 1671-1690 ou encore à H. Paulsen, Advances in selective chemical
syntheses of complex oligosaccharides , Angew. Chem. Int. Ed. Engl. (1982),
21,
155-173.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
13
Les composés de l'invention peuvent naturellement être préparés en utilisant
différentes stratégies connues par l'Homme de l'art de la synthèse des
oligosaccharides. Le procédé décrit ci-dessus est le procédé préféré de
l'invention.
Toutefois, les composés de formule (I)/(1') peuvent être préparés par d'autres
méthodes bien connues de la chimie des sucres, décrites par exemple dans
Monosaccharides, Their chemistry and their roles in natural products , P.M.
Collins
et R.J. Ferrier, J. Wiley & Sons (1995) et par G.J. Boons dans Tetrahedron
(1996), 52,
1095-1121.
Les groupes protecteurs utilisés dans le procédé de préparation des composés
de formule (I)/(1') sont ceux qui permettent, d'une part, de protéger une
fonction
réactive telle qu'un hydroxy ou une amine pendant une synthèse et, d'autre
part, de
régénérer la fonction réactive intacte en fin de synthèse. On utilise, pour la
mise en
oeuvre du procédé selon l'invention, les groupes protecteurs couramment
utilisés dans
la chimie des sucres, tels que décrits par exemple dans Protective Groups in
Organic
Synthesis , Green et al., 3rd Edition (John Wiley & Sons, Inc., New York).
Les groupes
protecteurs sont choisis par exemple parmi les groupes acétyle, méthyle,
pentènyle,
benzoyle, lévulinyle, benzyle, benzyle substitué, azides, carbamate de
benzyle, tert-
butyldiméthylsilyle (tBDMS) ou tert-butyldiphénylsilyle (tBDPS).
Des groupes activateurs peuvent également être utilisés ; il s'agit de ceux
classiquement utilisés en chimie des sucres, par exemple selon G.J. Boons,
Tetrahedron (1996), 52, 1095-1121. Ces groupes activateurs sont choisis par
exemple
parmi les imidates ou les thioglycosides.
Le procédé décrit ci-dessus permet d'obtenir les composés de l'invention sous
forme de sels, avantageusement sous forme de sel de sodium. Pour obtenir les
acides
correspondants, les composés de l'invention sous forme de sels peuvent mis en
contact avec une résine échangeuse de cations sous forme acide. Les composés
de
l'invention sous forme d'acides peuvent être ensuite neutralisés par une base
pour
obtenir le sel souhaité. Pour la préparation des sels des composés de formule
(I)/(1'),
on peut utiliser toute base minérale ou organique donnant, avec les composés
de
formule (I)/(1'), des sels pharmaceutiquement acceptables.
L'invention a également pour objet les composés de formule (V) ci-dessous,
dans laquelle Alk représente un groupe alkyle, R1 est tel que défini
précédemment en
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
14
rapport avec les composés de formule (I)/(1'),bet Pg, Pg' et Pg", identiques
ou
différents les uns des autres, représentent des groupes protecteurs :
0Pg'
AlkO2C 0Pg 0____C\LI\vR1 (V)
HO 0/ pgo z..7/
NHCOOPg
Pg"0
De tels composés sont utiles en tant qu'intermédiaires de synthèse des
composés de formule (1)/(1').
En particulier, l'invention a pour objet les composés (V) dans lesquels Alk
représente un groupe méthyle et Pg, Pg' et Pg" représentent respectivement des
groupes benzyle, tBDPS et acétyle. Plus particulièrement parmi ces composés de
formule (V), l'invention vise ceux dans lesquels R1 est choisi parmi les
groupes
suivants : -0-méthyle, -0-(CH2)5-phényle, -0-CH2-CH(C3H7)2, -0-(CH2)3-C6H11 et
-0-
(CH2)2-CH(phényle)2.
De tels composés correspondent aux disaccharides 58, 131, 132, 133 et 134
illustrés dans les schémas de synthèse ci-après, qui sont utiles pour la
synthèse des
composés n 10, 11 et 14 à 19 selon l'invention, comme cela sera détaillé dans
ce qui
suit.
L'invention a également pour objet les composés de formule (VI) ci-dessous,
dans laquelle Alk représente un groupe alkyle et Pg, Pg' et Pg", identiques ou
différents les uns des autres, représentent des groupes protecteurs :
0Pg"
AlkO2C 0Pg 0
(VI)
Pg'0
0
pg.0"..\--\11"0C(NH)CCI3
NHCOOPg
Pg"0
De tels composés sont utiles en tant qu'intermédiaires de synthèse des
composés de formule (1)/(1').
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
En particulier, l'invention a pour objet le composé (VI) dans lequel Alk
représente un groupe méthyle et Pg, Pg' et Pg" représentent respectivement des
groupes benzyle, lévulinyle et acétyle. Un tel composé correspond au
disaccharide 24
illustré dans les schémas de synthèse ci-après, qui est utile pour la synthèse
des
5 composés n 1 à 4 selon l'invention, comme cela sera détaillé dans ce qui
suit.
Les exemples qui suivent décrivent la préparation de certains composés
conformes à l'invention. Ces exemples ne sont pas limitatifs et ne font
qu'illustrer la
présente invention. Les composés de départ et les réactifs, quand leur mode de
10 préparation n'est pas expressément décrit, sont disponibles dans le
commerce ou
décrits dans la littérature, ou bien peuvent être préparés selon des méthodes
qui y sont
décrites ou qui sont connues de l'Homme du métier.
Les abréviations suivantes sont utilisées :
15 [a]): pouvoir rotatoire
Ac: acétyle
Bn : benzyle
00M: Chromatographie sur Couche Mince
DDQ : 2,3-dichloro-5,6-dicyano-1,4-benzoquinone
ESI : Electron Spray Ionisation
h : heure
LC-MS (*) : chromatographie liquide, couplée à la spectrométrie de masse
Lev: lévulinyle
min : minutes
Me: méthyle
PMB : para-méthoxybenzyle
Rf : Retardation factor (temps de rétention mesuré sur la CCM par rapport au
front du solvant de migration)
tBDMS : tert-butyldiméthylsilyle
tBDPS : tert-butyldiphénylsilyle
TFA : acide trifluoroacétique
TR : temps de rétention mesuré par LC-MS*
Z: benzyloxy-carbonyle
* Les LC-MS sont effectuées sur un appareil ZQ4000 de marque Waters. La
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
16
colonne utilisée est une Symetry 018 3.5pm (2.1x50 mm). L'éluant A est
constitué
d'H20 + TFA 0.005% pH 3.15. L'éluant B est constitué d'acétonitrile + TFA
0.005%. Le
gradient varie de 0 à 90% d'éluant B en 10 (ou 30) min + 5 min à 90% d'éluant
B. Le
débit est de 0.4 mL/min.
Préparation des intermédiaires de synthèse :
N, H2N ZHN
Me02C OBn Me02C OBn Me02C OBn
Lev0 2k:i7 -JI.'Lev0,27 0 -JI.'
0 0
OB OB OB
Ac0 Ac0 Ac0
20 21 22
OAc OAc
0
Me02CAr. 7/00Bn 0B__no 0 oc(NH)cci, ....c_
OAc
NHZ
NHZ
Lev0
Ac0 Ac0
24 23
Préparation du (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-2-amino-1,6-an hydro-3-0-benzy1-2-désoxy-13-D-
glucopyranose (n 21)
A une solution du composé 20 (21.6 g, 31 mmol) (C.A.A. Van Boeckel et coll., J
Carbohydr. Chem., 4 (1985) 293-321) dans du N,N-diméthylformamide (155 mL),
est
additionnée de la triéthylamine (Et3N) (65 mL, 15 équivalents molaire), puis
du 1,3-
propanedithiol (47 mL, 15 équivalents molaire). Après 17h d'agitation
magnétique, le
mélange réactionnel est dilué par de l'acétate d'éthyle, lavé à l'eau, séché
(Na2SO4),
filtré et concentré, puis purifié sur gel de silice (acétone - cyclohexane)
pour conduire à
21(15.8 g, 76%).
LC-MS m/z 672.2 [(M + H)+]. TR = 0.94 min
Préparation du (méthyl 2-0-acéty1-3-0-benzy1-4-0-
1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-1,6-anhydro-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-[3-D-qlucopyranose (n 22)
A une solution du composé 21 (128.12 g, 190.7 mmol) dans du
dichlorométhane (240 mL), est additionnée une solution aqueuse saturée
d'hydrogénocarbonate de sodium (240 mL) puis, à 0 C, du chlorure de benzyle
oxycarbonyle (35.5 mL, 1.3 équivalent molaire). Après 15 min d'agitation
magnétique
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
17
vigoureuse à 0 C, le mélange réactionnel est dilué par du dichlorométhane,
lavé à
l'eau jusqu'à neutralité, séché (Na2SO4), filtré et concentré. Le produit brut
est engagé
dans l'étape suivante sans purification.
LC-MS m/z 806.2 [(M + 1-1)+]= TR = 1.55 min
Préparation du (méthyl 2-
0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-1,6-di-O-acétyl-3-0-benzyl-2-désoxy-2-
1(benzyloxy)carbonyllamino-a,[3-D-q1ucopyranose (n 23)
Le résidu obtenu à l'étape précédente est dissous dans de l'anhydride acétique
(1.05 L), puis est additionné, à 0 C et en 15 min, de l'acide
trifluoroacétique (TFA) (105
mL). Le mélange réactionnel est agité pendant 10 min à 0 C, 18 h à température
ambiante, puis est concentré, coévaporé au toluène, et purifié sur gel de
silice
(cyclohexane - acétone), pour donner le composé 23 (138.9 g, 80%, 2 étapes).
LC-MS m/z 930.3 RNA + Na)]. TR = 21.68/21.84 min
Préparation du (méthyl 2-
0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzyl-2-désoxy-2-
1(benzyloxy)carbonyllamino-a,[3-D-qlucopyranose trichloroacétimidate (n 24)
A une solution du composé 23 (25 g, 27.5 mmol) dans de l'éther diéthylique
(1.1
L), est additionnée, à 0 C, de la benzylamine (BnNH2) (109 mL, 36 équivalents
molaire). Après 1 h d'agitation à 0 C, puis 4.5h à température ambiante, le
mélange
réactionnel est dilué par de l'acétate d'éthyle, puis neutralisé avec de l'HCI
1N à froid
(0-4 C), lavé à l'eau, séché (Na2SO4), filtré et concentré, et purifié sur gel
de silice
(acétone - cyclohexane) pour conduire au (méthyl 2-0-acéty1-3-0-benzy1-4-0-
lévulinoyl-a-L-idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-désoxy-2-
Rbenzyloxy)carbonynamino-a,[3-D-glucopyranose (18.5 g, 78%).
LC-MS m/z 888.3 RNA + Na)]. TR = 19.95/20.60 min
A une solution du composé ainsi obtenu (18.5 g, 21.4 mmol) dans le
dichlorométhane (405 mL) est additionné sous argon et à 0 C, du carbonate de
césium
(C52CO3) (11.1 g, 1.6 équivalent molaire), du trichloroacétonitrile (CCI3CN)
(14.8 mL,
5.0 équivalents molaire). Après 1h d'agitation à température ambiante, le
mélange
réactionnel est filtré, puis concentré. Le résidu est purifié sur gel de
silice (acétone -
cyclohexane + 0.1% de triéthylamine) pour donner 24 (17.2 g, 80%).
Rf = 0.47 (acétate d'éthyle ¨ cyclohexane 7/3).
Déplacements chimiques des protons anomériques (500 MHz, CDCI3) O
5.17 IdoUAll, 6.28 Gicla
LC-MS m/z 866.3 RM + Na)]. TR1 = 19.91 min
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
18
OAc OAc
Me0 OBn
7
Me0,0A)70Bn 0 _._#,===\....\.,10
20A
0 Bn0 OC(NH)CCL 0 Bn0
NHZ NHZ
Lev0 Lev0 )
Ac0 Ac0
24 25
OAc
Me02077.7/0Bn
Bn0
NHZ
HO
Ac0 26
OAc
OAc OAc
0
OBn 0 0(CH2),CHCH2
Me02C OBn ______&=.\...\\O Me 2C
Bn0 0
NHZ
Ns
OC(NH)CCL
Me027 0,0Bn
s
Lev0 Bn0 Ac0 Lev0
N
Ac0 Ac0 27
28
\
OAc
OAc 0
OBn 0 0(CH2),CHCH2
Me02C OBn O_____&eCie:2C
Bn0
77/Bn0 NHZ
Ns 0
HO Ac0
Ac0
29
+27
OAc
OAc
OAc 0 MeO2CA;7/0Bn 0 ____&07.\õ.
0(CH2),CHCH2
0 M2C/A0:,>
Me02C7 OBn e0 0 Bn0
NHZ
0 Bn0
Ns 0
Ns 0 Ac0
Lev0 6n0 Ac0
Ac0 30
OAc
OAc
0 Me02CA77/Bn0 NHZ
OBn
OAc
0 Me02C/A0:,>
Me02C OBn 0
0 Bn0
Ns 0
7/6n0
Ns 0 Ac0
HO Ac0
Ac0
31
Préparation du 4-pentènyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzyl-2-désoxy-2-
1(benzyloxy)carbonyllamino-6-D-qlucopyranoside (n 25)
Une solution de triflate de tert-butyldiméthylsilyle dans du dichlorométhane
(1M,
0,2 mole par mole d'imidate) est ajoutée, sous argon, à -20 C, à une solution
de
l'imidate 24 (13.7 g, 13.56 mmol) et de l'alcool allylique (6.8 mL, 5
équivalents
molaires) dans du dichlorométhane (590 mL) en présence de tamis moléculaire 4
A
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
19
(17.6 g). Après 20 minutes d'agitation (CCM), on ajoute une solution aqueuse
saturée
d'hydrogénocarbonate de sodium. Après filtration, lavage à l'eau, sèchage
(Na2SO4),
filtration, et on évaporation à sec, le mélange est purifié sur gel de silice
pour conduire
au composé 25 (10.7 g, 85%).
LC-MS m/z 934.5 [(M + I-I)+]= TR = 24.00 min
Préparation du 4-pentènyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 26)
A une solution du composé 25 (10.6 g, 11.35 mmol) dans un mélange 1:2
toluène/éthanol (1.2 L) est ajouté de l'acétate d'hydrazine (5.2 g, 5
équivalents
molaire). Après 2.5h d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 26 (6.98 g, 74%).
LC-MS m/z 858.4 [(M + Na)]. TR = 22.62 min
Préparation du 4-pentènyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
6-0-acéty1-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-13-D-
qlucopyranoside (n
28)
Une solution de triflate de tert-butyldiméthylsilyle dans du dichlorométhane
(1M,
0,15 mole par mole d'imidate) est ajoutée, sous argon, à - 20 C, à une
solution de
l'imidate 27 (9.0 g, 9.98 mmol) (C. Tabeur et coll., BioOrg. Med. Chem. (1999)
7, 2003-
2012) et d'accepteur de glycosyle 26 (6.95 g, 8.32 mmol) dans du
dichlorométhane
(350 mL) en présence de tamis moléculaire 4 A (7.5 g). Après 18h à -20 C
(CCM), on
ajoute de l'hydrogénocarbonate de sodium solide. Après filtration, lavage par
une
solution d'hydrogénocarbonate de sodium aqueuse à 2%, à l'eau, séchage
(Na2SO4),
filtration et évaporation à sec, le résidu est purifié sur gel de silice pour
conduire à 28
(9.04 g, 69%).
Rf = 0.38 (acétone ¨ toluène 1/4).
Préparation du 4-pentènyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-
(1-4)-
6-0-acéty1-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-13-D-
qlucopyranoside
(n 29)
A une solution du composé 28 (9.0 g, 5.7 mmol) dans un mélange 1:2
toluène/éthanol (570 mL) est ajouté de l'acétate d'hydrazine (2.6 g, 5
équivalents
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
molaire). Après 1h d'agitation magnétique, le mélange est concentré sous vide
puis
purifié sur gel de silice pour donner le composé 29 (7.15 g, 85%).
Rf = 0.29 (acétone ¨ toluène 1/4).
5 Préparation du 4-pentènyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-
désoxy-2-
10 1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 30)
Une solution de triflate de tert-butyldiméthylsilyle dans du dichlorométhane
(1M,
0,15 mole par mole d'imidate) est ajoutée, sous argon, à - 20 C, à une
solution de
l'imidate 27 (4.80 g, 5.32 mmol) et d'accepteur de glycosyle 29 (7.15 g, 4.84
mmol)
dans du dichlorométhane (180 mL) en présence de tamis moléculaire 4 A (3.99
g).
15 Après 18h à -20 C (CCM), on ajoute de l'hydrogénocarbonate de sodium
solide. Après
agitation magnétique à température ambiante (30 min), filtration, lavage par
une
solution d'hydrogénocarbonate de sodium aqueuse à 2%, puis à l'eau, séchage
(Na2SO4) et évaporation à sec, le résidu est purifié sur gel de silice pour
conduire à 30
(5.23 g, 49%).
20 Rf = 0.18 (acétone ¨ éther diisopropylique 1/4).
Préparation du 4-pentènyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-
désoxy-2-
1(benzyloxy)carbonyllamino-P-D-qlucopyranoside (n 31)
A une solution du composé 30 (5.21 g, 2.35 mmol) dans un mélange 1:2
toluène/éthanol (180 mL) est ajouté de l'acétate d'hydrazine (1.08 g, 5
équivalents
molaire). Après 1h10 d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 31(4.78 g, 96%).
Rf = 0.47 (acétone ¨ éther diisopropylique 1/3).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
21
N, N3 N3
OBn OBn OBn
t BDMS007/0 0 -71m. tBDMS0 0 0 -)11.- t BD MSO
0
0
14
OB OB OB
PMBO PMBO Ac0
32 33 34
OAc OAc N3
3;1=70 0
Me02C7/
/z<ti0Bn 0 ..µ.,...\.....\.,1 Me0 1
.011r-
OAc Bn0 0
Bn0 Bn0
N3 N3 OB
Bn0 Bn0
Ac0 Ac0 Ac0
37 36 35
OAc
MeO,C744;tc)7/0Bn 0 _______\1.0
OC(NH)CCI,
Bn0
N3
Bn0
Ac0
38
Préparation du (3,4-d i-O-benzy1-
2-0-(4-méthoxy)benzyl-6-0-tert-
butyldiméthylsilyl-a-L-idopyranosyl)-(1-4)-1,6-anhydro-2-azido-3-0-benzyl-2-
désoxy-[3-
D-qlucopyranose (n 33)
A une solution du composé 32 (32.3 g, 42.2 mmol) (W02006/021653) dans du
N,N-diméthylformamide (210 mL) est ajouté, à 0 C et sous argon, du bromure de
benzyle (25 mL, 5 équivalents molaire) puis du NaH à 55% (3 g, 1.5 équivalent
molaire). Après 20 min d'agitation magnétique, du méthanol est additionné (30
mL), le
milieu réactionnel est concentré sous vide, le brut réactionnel est dilué à
l'acétate
d'éthyle, lavé à l'eau puis par une solution aqueuse saturée en chlorure de
sodium,
séché (Na2SO4), filtré et concentré. Le résidu obtenu est engagé dans l'étape
suivante
sans purification.
LC-MS m/z 871.7 [(M + NH4)]. TR = 13.86 min
Préparation du (2-0-acéty1-3,4-
di-O-benzyl-6-0-tert-butyldiméthylsilyl-a-L-
idopyranosyl)-(1-4)-1,6-anhydro-2-azido-3-0-benzyl-2-désoxy-13-D-qlucopyranose
(n
34)
A une solution de 33 brut (38.6 g) dans du dichlorométhane (1.6 L) sont
ajoutés
de l'eau (80 mL) puis, à 0 C, du DDQ (14.2 g, 1.5 équivalent molaire). Après
4h45
d'agitation à 0 C, le milieu est dilué par du dichlorométhane et une solution
d'hydrogénocarbonate de sodium est additionnée. La phase organique est ensuite
lavée à l'eau, séchée (Na2SO4), filtrée et concentrée. Le composé obtenu est
engagé
dans l'étape suivante sans purification.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
22
Le résidu obtenu est dissous dans du dichlorométhane (350 mL), puis de la
triéthylamine (13 mL), de la 4-diméthylaminopyridine (2 g), et de l'anhydride
acétique
(60 mL) sont additionnés. Après 10 min d'agitation magnétique à 0 C, puis 1h45
à
température ambiante, le mélange réactionnel est dilué par du dichlorométhane,
puis
successivement lavé par une solution aqueuse à 10% d'hydrogénosulfate de
potassium, d'eau, puis la phase organique est séchée (Na2SO4), filtrée et
concentrée.
Le résidu obtenu est purifié sur silice (acétate d'éthyle ¨ cyclohexane) pour
fournir 34 (26.8 g, 83%, 3 étapes).
LC-MS m/z 798.3 [(M + Na)]. TR = 12.97 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-1,6-anhydro-2-azido-3-0-benzyl-2-désoxy-6-D-qlucopyranose (n 35)
A une solution de 34 (26.3 g, 33.9 mmol) dans l'acétone (1.4 L) est
additionnée,
à 0 C, une solution de Cr03 (10.5 g, 3.1 équivalents molaire) dans du H2SO4
3.5M
aqueux (47 mL). Après 4h d'agitation mécanique à 0 C, le milieu réactionnel
est dilué
avec du dichlorométhane, lavé à l'eau jusqu'à neutralité, puis la phase
organique est
séchée (Na2SO4), filtrée et concentrée. Le composé obtenu est engagé dans
l'étape
suivante sans purification.
Le résidu obtenu est dissous dans du N,N-diméthylformamide (210 mL), et de
l'hydrogénocarbonate de potassium (17 g, 5 équivalents molaire) ainsi que de
l'iodure
de méthyle (21 mL, 10 équivalents molaire) sont additionnés. Le mélange
réactionnel
est agité à température ambiante pendant 16h, puis concentré sous vide. Le
résidu est
dilué par de l'acétate d'éthyle puis lavé à l'eau, avec une solution aqueuse
saturée de
thiosulfate de sodium, avec une solution aqueuse saturée en chlorure de
sodium, puis
séchée (Na2SO4), filtrée et concentrée. Le composé obtenu est engagé dans
l'étape
suivante sans purification.
LC-MS m/z 707.3 [(M + NH4)]. TR = 10.37 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-1,6-d i-O-acéty1-2-azido-3-0-benzyl-2-désoxy-a,6-D-qlucopyranose (n 36)
Le résidu brut obtenu à l'étape précédente est dissous dans de l'anhydride
acétique (177 mL), puis est additionné de l'acide trifluoroacétique (TFA)
(17.7 mL). Le
mélange réactionnel est agité pendant 16h, puis est concentré, co-évaporé au
toluène,
et purifié sur gel de silice (cyclohexane - acétate d'éthyle), pour donner le
composé 36
(17.4 g, 65%, 3 étapes).
LC-MS m/z 809.3 [(M + NH4)]. TR = 10.81 min
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
23
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a,[3-D-qlucopyranose (n 37)
A une solution du composé 36 (7 g, 8.84 mmol) dans de l'éther diéthylique (303
mL), est additionnée, à 0 C et sous argon, de la benzylamine (BnNH2) (29.7 mL,
36
équivalents molaire). Après 1h d'agitation magnétique à 0 C puis 6h à
température
ambiante, le mélange réactionnel est neutralisé avec de l'HCI 1N à froid (0-4
C), lavé à
l'eau, séché (Na2SO4), filtré et concentré, et purifié sur gel de silice
(acétate d'éthyle -
cyclohexane) pour conduire à 37 (5.95 g, 90%).
LC-MS m/z 767.7 [(M + NH4)]. TR = 1.64 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a,[3-D-qlucopyranose
trichloroacétimidate (n 38)
A une solution du composé 37 (5.94 g, 7.9 mmol) dans le dichlorométhane (150
mL) sont additionnés, sous argon, du carbonate de césium (C52CO3) (4.1 g, 1.6
équivalent molaire), puis du trichloroacétonitrile (CCI3CN) (3.9 mL, 5.0
équivalents
molaire). Après 45 min d'agitation à température ambiante, le mélange
réactionnel est
filtré, puis concentré. Le résidu est purifié sur gel de silice (acétate
d'éthyle ¨
cyclohexane + 0.1% de triéthylamine) pour donner 38 (5.7 g, 81%).
LC-MS m/z 912.0 [(M + NH4)]. TR = 1.81 min
OAc
OAc
OAc Me0 C OBn
0 Me02C/z(:)>0
Me02C OBn
NHZ
Bn0
N, 0
N3 0 Ac0
HO Ac0
Ac0
31
OAc
N3 OC(NHPC13
Bn0
Ac0
38
OAc
OAc
OAc 0 Me0 OBn 0
O 0(CH2)3CHCH2
0
OAc 0 Me020/z(y/OBn
0 0 Bn0 e02C/z(B7>0
Me0 M
2C OBn 0 Bn0 NHZ
N3 0
µ0 Bn0
N3 0 Ac0
N3 0 Ac0
Bn0 Ac0
Ac0
39
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
24
Préparation du 4-pentènyl (méthyl 2-
0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-
benzy1-2-
désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 39)
Une solution de triflate de tert-butyldiméthylsilyle dans du dichlorométhane
(1M,
0,1 mole par mole d'imidate) est ajoutée, sous argon, à -15 C, à une solution
de
l'imidate 38 (2.61 g, 2.92 mmol) et d'accepteur de glycosyle 31(4.78 g, 2.25
mmol)
dans du dichlorométhane (146 mL) en présence de tamis moléculaire 4 A (1.99
g).
Après 2h d'agitation magnétique à -15 C (CCM), de l'imidate 38 est à nouveau
ajouté à
intervalles de temps compris entre 15 et 30 min, jusqu'à consommation maximale
de
l'accepteur 31. En fin de réaction (CCM), de l'hydrogénocarbonate de sodium
solide
est additionné jusqu'à neutralisation, et après agitation magnétique à
température
ambiante (15 min), filtration, lavage par une solution d'hydrogénocarbonate de
sodium
aqueuse à 2%, puis à l'eau, séchage (Na2SO4) et évaporation à sec, le résidu
est
purifié sur gel de silice pour conduire à 39 (3.71 g, 58%).
Rf = 0.21 (acétone ¨ toluène 15/85).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
OAc
OAc 0
OAc
0 13-----&.\¨\\n0 0(CH2)3CHCH2
Me02C
OAc 0 Me02C/zç7/0 0 0
0 Me02C/z(tOt ;7 NHZ
Me02C OBn 0 0 OBn oBn
N3 0
0 Bn0
N3 0 Ac0
/7¨=<).07/ Bn0
N3 0 A
B nO Ac0 39 c0 1
Ac0
OH
OH
OH 0 Me02C OBn 0
0(CH2)3CHCH2
OH 0 Me02C/zç7
0 Me02C/z(tOt ;7 0 0 Bn0
Me02C OBn 0 0 Bn0
N3 0 NHZ
0 Bn0
N3 0 HO
Bn0
AVBn0
HO 40
N3 0 HO
1
HO
OS03
OS03
OS03 0 Me02C/z4)7.00Bn 0 ____õ
0(CH2)3CHCH2
OS03 0 Me02C/z(404;71 0
0 Me02C/z<Ot B) n7 Bn0
Me02C OBn 0 0 Bn0
N3 0 NHZ
0 Bn0
N3 0 -03SO sel de triéthylammonium
Bn0
7Bn0
03S0 41
N3 0 03SO
1
03SO
OSO3Li
OSO3Li
OSO3Li 0 LiO2C/z(C:7, 0 Bn0 NHZ
___,.0(CH2)3CHCH2
OSO3Li 0 LiO2C/A0:4;7,
0 LiO2C/z<0;70 0
0 Bn0
N3 0
LiO2C OBn
/z(444,7
0
0 Bn0 0
N3 Bn0
N3 0
L LiO3S0
iO3S0
Bn0 LiO3S0 42 1
Lio3so
OSO Na
OSO3N a
OSO3Na 0 Na02CA). 70H 0
0(CH2)4CH3
OSO3Na 0 Na02C/z( 0 44Hyy
0 N a02C/z(04;7 0 0
Na02C OH HO 0 0 HO
NH HO 20 NH2
0
NH20 Na03S0
7---/7/D
NH20 HO Na03S0
HO Na03S0
Na03S0 43
Préparation du 4-pentènyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-
5 (1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzyl-a-
L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-(méthyl 3-
0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-
0-benzyl-a-L-idopyranosyluronate)-
(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyl1amino-13-D-qlucopyranoside (n
40)
10 A une
solution de 39 (300 mg, 0.105 mmol) dans un mélange 3/2 de
méthanol/dichlorométhane (31 mL) est ajoutée, à 0 C, une solution méthanolique
1M
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
26
de méthylate de sodium (0.31 mL), en présence de tamis moléculaire 3 A. Après
agitation à 0 C pendant 1 h et à température ambiante pendant 15 h, le mélange
est
neutralisé par de la résine H+ Dowex 50WX4. Après filtration et concentration
partielle,
le mélange réactionnel est purifié sur colonne d'exclusion LH-20 en utilisant
un
mélange 1:1 méthanol/dichlorométhane comme éluant, puis après rassemblement
des
fractions contenant le produit et concentration sous vide, le résidu est
purifié sur gel de
silice avec un mélange dichlorométhane/acétate d'éthyle/éthanol pour fournir
le
composé 40 (185 mg, 69%).
Rf = 0.22 (CH2C12-AcOEt-Et0H 9/1/0.3).
Préparation du 4-pentènyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium
su lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-glucopyranosyl)-(1-4)-(méthyl 3-
0-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-glucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-0-
benzy1-2-désoxy-6-0-triéthylam mon iu m sulfonato-a-D-glucopyranosyl)-(1-4)-
(méthyl
3-0-benzy1-2-0-triéthylam mon iu m
sulfonato-a-L-idopyranosyl uronate)-(1-4)-3-0-
benzy1-2-désoxy-2-Rbenzyloxy)carbonyllam ino-6-0-triéthylam mon iu m
sulfonato-13-D-
glucopyranoside (n 41)
On ajoute du complexe triéthylamine/trioxyde de soufre (513 mg, 5 moles par
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (6.3 mL, 90
L/mol)
du composé 40 (178 mg, 70.8 pmol). Après 17 heures d'agitation magnétique à 55
C
à l'abri de la lumière, on ajoute à 0 C du méthanol et après 0.5 h d'agitation
à 0 C puis
0.5 h à température ambiante, le milieu réactionnel est purifié à l'aide d'une
colonne
LH-20 en utilisant un mélange 9:1 méthanol/N,N-diméthylformamide comme éluant.
Les fractions contenant le produit sont alors concentrées sous vide poussé
pour
conduire au composé désiré 41(241 mg, 87%).
Rf = 0.33 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du 4-pentènyl (3,4-d i-O-benzy1-2-0-lith iu m
su lfonato-a-L-
idopyranosylu ronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m sulfonato-a-
L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
27
1(benzyloxy)carbonyllamino-6-0-lithium sulfonato-p-D-qlucopyranoside (n 42)
A une solution du composé 41 (238 mg, 60 pmol) dans un mélange 1 :1
méthanol/tétrahydrofurane (9.6 mL) est ajoutée, à 0 C, une solution aqueuse
molaire
de Li0H. Après 1h d'agitation à 0 C puis 16 h à température ambiante, le
milieu
réactionnel est purifié à l'aide d'une colonne LH-20 en utilisant un mélange
9:1
méthanol/N,N-diméthylformamide comme éluant. Les fractions contenant le
produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 42.
Rf = 0.42 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(1-4)-(2-amino-2-désoxy-6-0-sod iu m su Ifonato-a-D-qlucopyranosyl)-
(1-4)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-2-
désoxy-
6-0-sodium su Ifonato-a-D-qlucopyranosyl)-(1-4)-(2-0-sod iu m
sulfonato-a-L-
idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-
D-
glucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1-4)-2-amino-2-désoxy-6-0-sodium sulfonato-P-D-qlucopyranoside (n 43)
A une solution dans un mélange 1 :1 tert-butanol/eau (14 mL) du composé 42
précédemment obtenu sont ajoutés successivement du formiate d'ammonium (617
mg,
9.8 mmol) puis du Pd/C 10% (1.55 g). Après 4h d'agitation vigoureuse à
température
ambiante, le milieu réactionnel est filtré, partiellement concentré sous vide,
puis on
dépose la solution au sommet d'une colonne de Sephadex G-25 éluée par du
chlorure de sodium 0,2 M. On concentre les fractions contenant le produit et
on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 43
(123
mg, 61% (2 étapes)).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.11
IdoUAvIll, 5.38 Glcvll, 5.19 IdoUAvI, 5.38 Glcv, 5.19 IdoUe, 5.38 Gle, 5.21
IdoUAll, 4.70
GIcI
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
28
OAc
OAc
OAc 0 Me0227.<0;7/1 0
0(CH2)3CHCH2
OAc 0 me02c/z(04B)>
NHZ
0 m e 0 2 c/ z SI3:7 / 0 0 Bn0
Me02C OBn 0 0 Bn0 0
N3
0 Bn0 0
7Bn0 0 N, Ac0
- Ac0 39
N,
Bn0 - Ac0
Ac0
OAc
OAc
OAc 0 Me02C/z<;>,
0,......\,0(CH2),R,
OAc 0 me02cs0;7/1
NHZ
0 me02c/z<0;7/ 0 0 Bn0
Me02C 0 Bn 0 0 Bn0 0
0 Bn0 0
/7-=<.t.î7Bn0 0 Ac0 44: R1= CHCH(CH2)5CH3
- Ac0
N, 45: R1= CHCHC6I-15
Bn0 - Ac0
Ac0
OH
OH
OH 0 Me02C/z<;7/1 0
___&.=,.,0(CH2),Ri
OH 0 me02c/z/sOt B1
,1 NHZ
7/
0 me02c/z<Ot B, n7/ 0 0 Bn0
Me02C OBn 0 0 Bn0 0
N,
0 Bn0 0
7-.4c77/Bn0 0 N, - HO 46: R1= CHCH(CH2)5CH3
N, - HO
Bn0 - HO 47: R1= CHCHC6I-15
HO
050,-
050,-
0
050,- 0(CH2),Ri
050,- Mo e02C/z<;71
0 Bn0 NHZ
0 Me02C/z<Ot B)>1
A 0 Me02C 0,13n
Me02C OBn 0 Bn0
0 Bn0 0 N 0, -0,50 48: R1= CHCH(CH2)5CH3
0770Bn0 0 N3 -0350
Bn0 N3 -0,50 49: R1= CHCHC6I-15
0,50
sel de triéthylammonium
osop
050,Li
0
_......0/0500,\....\ _\Li 020/zçr e.e\....\oo2c 0,13n
0(CH2)3R1
OSO,Li
0 Bn0 NHZ
-\02c/zçr> 0
02C OBn 0 0 Bn0 0
Bn0 0 Bn0
/z(4,7
N, 0
- L10350 Bn0 N, 0
7,
- Li0350 N3 Li0,50 50: R1=
CHCH(CH2)5CH3
51: R1= CHCHC6I-15
Li0,50
050 ,Na
050 ,Na
0503
Na 0 Na02C/zçH 0 0(CH2),R2
050 ,Na 0 Na02C/z(04H,7
0 Na02C/44.;7 o¨'
0Ho
Na02C OH 0 0 HoNH2
Hz(ty,
0
HO NH
0 , 53: R2= C6H5
0
Na0,50
' Na0,50
0 Ho NH20
' NH20
O/
Na03S0 52: R2 = (CH2)5CH3
Na0,50
Préparation du (Z/E) undéc-4-ènyl (méthyl 2-0-acéty1-3,4-d i-O-benzyl-a-L-
idopyranosyluronate)-(1 ¨4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1 ¨>4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1 ¨4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosyl)-(1 ¨>4)-(méthyl
2-0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1 ¨4)-(6-0-acéty1-2-azido-3-0-
benzy1-2-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
29
désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 44)
A une solution du composé 39 (610 mg, 214 pmol) dans du dichlorométhane
(10.7 mL) sont additionnés du 1-octène (67 pL, 2 équivalents molaires), du
catalyseur
de Grubbs première génération (C44H74Cl2P2Ru) (18 mg, 0.1 équivalent molaire).
Après
chauffage à reflux pendant 6h puis agitation la nuit à température ambiante,
le
mélange est concentré sous vide poussé et peut-être engagé dans les mêmes
conditions en cas de réaction incomplète. Le brut réactionnel est purifié par
chromatographie sur gel de silice (toluène-acétone) pour conduire au produit
souhaité
44 (131 mg, 20%).
Rf = 0.18 (toluène-acétone 85/15).
Préparation du (Z/E) 5-phény1-4-pentènyl (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-
L-idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-
benzy1-2-
désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-P-D-qlucopyranoside (n 45)
A une solution du composé 39 (100 mg, 35 pmol) dans du dichlorométhane (1
mL) sont additionnés du styrène (16 pL, 4 équivalents molaires) et du
catalyseur de
Grubbs seconde génération (0461-165Cl2N2PRu) (1.8 mg, 0.06 équivalent
molaire). Après
chauffage à reflux pendant 8h puis agitation la nuit à 35 C, les réactifs sont
éventuellement rajoutés si nécessaire. Le mélange est ensuite concentré sous
vide
poussé puis purifié par chromatographie sur gel de silice (toluène-acétate
d'éthyle)
pour conduire au produit souhaité 45 (38 mg, 37%).
Rf = 0.25 (toluène-AcOEt 7/3).
Préparation du (Z/E) undéc-4-ènyl (méthyl
3,4-d i-O-benzyl-a-L-
idopyranosylu ronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-
a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-
0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyl1amino-13-
D-
glucopyranoside (n 46)
A une solution de 44 (152 mg, 0.052 mmol) dans un mélange 3/2 de
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
méthanol/dichlorométhane (15 mL) est ajoutée, à 0 C, une solution méthanolique
1M
de méthylate de sodium (154 pL), en présence de tamis moléculaire 3 A. Après
agitation à 0 C pendant 1 h et à température ambiante pendant 15 h, le mélange
est
neutralisé par de la résine H+ Dowex 50WX4. Après filtration et concentration
partielle,
5 le mélange réactionnel est purifié sur colonne d'exclusion LH-20 en
utilisant un
mélange 1:1 méthanol/dichlorométhane comme éluant, puis après rassemblement
des
fractions contenant le produit et concentration sous vide, le résidu est
purifié sur gel de
silice avec un mélange toluène/acétone/acétate d'éthyle/éthanol pour fournir
le
composé 46 (83 mg, 61%).
10 Rf = 0.25 (toluène-acétone-Et0H 7/3/0.1).
Préparation du (Z/E) 5-phény1-4-pentènyl (méthyl 3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosyl)-(1-
4)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-
a-D-
15 glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-
(2-azido-3-
0-benzy1-2-désoxy-a-D-glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyl1amino-13-
D-
glucopyranoside (n 47)
A une solution de 45 (229 mg, 0.078 mmol) dans un mélange 3/2 de
20 méthanol/dichlorométhane (23 mL) est ajoutée, à 0 C, une solution
méthanolique 1M
de méthylate de sodium (232 pL), en présence de tamis moléculaire 3 A. Après
agitation à 0 C pendant 1 h et à température ambiante pendant 15 h, le mélange
est
neutralisé par de la résine H+ Dowex 50WX4. Après filtration et concentration
partielle,
le mélange réactionnel est purifié sur colonne d'exclusion LH-20 en utilisant
un
25 mélange 1:1 méthanol/dichlorométhane comme éluant, puis après
rassemblement des
fractions contenant le produit et concentration sous vide, le résidu est
purifié sur gel de
silice avec un mélange dichlorométhane/acétate d'éthyle/éthanol pour fournir
le
composé 47 (141 mg, 69%).
Rf = 0.15 (toluène-acétone-Et0H 7/3/0.1).
Préparation du (Z/E) undéc-4-ènyl (méthyl
3,4-d i-O-benzy1-2-0-
triéthylammon iu m su lfon ato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-
0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-glucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-0-
benzy1-2-désoxy-6-0-triéthylam mon iu m sulfonato-a-D-glucopyranosyl)-(1-4)-
(méthyl
3-0-benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-
(2-azido-
3-0-benzy1-2-désoxy-6-0-triéthylam mon iu m sulfonato-a-D-glucopyranosyl)-
(1-4)-
(méthyl 3-0-benzy1-2-0-triéthylammonium sulfonato-a-L-idopyranosyluronate)-
(1¨>4)-3-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
31
0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-6-0-triéthylammonium sulfonato-8-
D-
glucopyranoside (n 48)
On ajoute du complexe triéthylamine/trioxyde de soufre (225 mg, 5 moles par
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (2.8 mL, 90
L/mol)
du composé 46 (81 mg, 31 pmol). Après 16 heures d'agitation magnétique à 50 C
à
l'abri de la lumière, on ajoute à 0 C du méthanol (0.2 mL) et après 35 min
d'agitation à
0 C puis 2.5 h à température ambiante, le milieu réactionnel est purifié à
l'aide d'une
colonne LH-20 en utilisant un mélange 1:1:0.1 méthanol/dichlorométhane/N,N-
diméthylformamide comme éluant. Les fractions contenant le produit sont alors
concentrées sous vide poussé pour conduire au composé désiré 48 (122 mg, 99%).
Rf = 0.36 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du (Z/E) 5-phény1-4-pentènyl (méthyl 3,4-di-O-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-0-
benzy1-2-désoxy-6-0-triéthylam mon iu m sulfonato-a-D-qlucopyranosyl)-(1-4)-
(méthyl
3-0-benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-
(2-azido-
3-0-benzy1-2-désoxy-6-0-triéthylam mon iu m
sulfonato-a-D-qlucopyranosyl)-(1-4)-
(méthyl 3-0-benzy1-2-0-triéthylammonium sulfonato-a-L-idopyranosyluronate)-(1-
4)-3-
0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-6-0-triéthylammonium sulfonato-8-
D-
glucopyranoside (n 49)
On ajoute du complexe triéthylamine/trioxyde de soufre (385 mg, 5 moles par
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (4.7 mL, 90
L/mol)
du composé 47 (138 mg, 53 pmol). Après 16 heures d'agitation magnétique à 50
C à
l'abri de la lumière, on ajoute à 0 C du méthanol (0.35 mL) et après 30 min
d'agitation
à 0 C puis 1 h à température ambiante, le milieu réactionnel est purifié à
l'aide d'une
colonne LH-20 en utilisant un mélange 1:1:0.1 méthanol/dichlorométhane/N,N-
diméthylformamide comme éluant. Les fractions contenant le produit sont alors
concentrées sous vide poussé pour conduire au composé désiré 49 (194 mg, 92%).
Rf = 0.35 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du (Z/E) undéc-4-ényl (3,4-di-O-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium )-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lith iu m
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m sulfonato-a-
L-
idopyranosyluronate de
lithium )-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lith iu m
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium )-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lith iu m
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
32
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium )-(1-4)-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-6-0-lithium sulfonato-P-D-qlucopyranoside (n 50)
A une solution du composé 48 (119 mg, 29 pmol) dans un mélange 1 :1
méthanol/tétrahydrofurane (4.7 mL) est ajoutée, à 0 C, une solution aqueuse
molaire
de LiOH (1.18 mL). Après 1h d'agitation à 0 C puis 19.5 h à température
ambiante, le
milieu réactionnel est purifié à l'aide d'une colonne LH-20 en utilisant un
mélange 4:1
méthanol/N,N-diméthylformamide comme éluant. Les fractions contenant le
produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 50.
Rf = 0.40 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du (Z/E) 5-phény1-4-pentènyl (3,4-di-O-benzy1-2-0-lithium
sulfonato-
a-L-idopyranosyluronate de lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de lithium )-(1-4)-(2-
azido-3-0-benzy1-2-désoxy-6-0-lith iu m
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium )-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lith iu m
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium )-(1-4)-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-6-0-lithium sulfonato-13-D-qlucopyranoside (n 51)
A une solution du composé 49 (190 mg, 47 pmol) dans un mélange 1 :1
méthanol/tétrahydrofurane (7.4 mL) est ajoutée, à 0 C, une solution aqueuse
molaire
de LiOH (1.88 mL). Après 1h d'agitation à 0 C puis 16 h à température
ambiante, le
milieu réactionnel est purifié à l'aide d'une colonne LH-20 en utilisant un
mélange 9:1
méthanol/N,N-diméthylformamide comme éluant. Les fractions contenant le
produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 51.
Rf = 0.44 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du undécyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyl)-(1-4)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-2-
désoxy-
6-0-sodium su Ifonato-a-D-qlucopyranosyl)-(1-4)-(2-0-sod iu m
sulfonato-a-L-
idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-
D-
glucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1-4)-2-amino-2-désoxy-6-0-sodium sulfonato-P-D-qlucopyranoside (n 52)
A une solution dans un mélange 1 :1 tert-butanol/eau (6 mL) du composé 50
précédemment obtenu sont ajoutés successivement du formiate d'ammonium (260
mg,
4.1 mmol) puis du Pd/C 10% (672 mg). Après 4h05 d'agitation vigoureuse à
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
33
température ambiante, le milieu réactionnel est filtré, partiellement
concentré sous vide,
puis on dépose la solution au sommet d'une colonne de Sephadex G-25 éluée par
du
chlorure de sodium 0,2 M. On concentre les fractions contenant le produit et
on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 52 (34
mg,
49% (2 étapes)).
Masse : méthode "ESI", mode négatif : masse théorique = 2337.81 ; masse
expérimentale : 2337.27 0,06 u.m.a [M-4Na+4H].
Préparation du 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate
de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyl)-
(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-
2-
désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-
L-
idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-
D-
glucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1-4)-2-amino-2-désoxy-6-0-sodium sulfonato-13-D-qlucopyranoside (n 53)
A une solution dans un mélange 1 :1 tert-butanol/eau (9.2 mL) du composé 51
précédemment obtenu sont ajoutés successivement du formiate d'ammonium (407
mg,
6.47 mmol) puis du Pd/C 10% (1.05 g). Après 4h05 d'agitation vigoureuse à
température ambiante, le milieu réactionnel est filtré, partiellement
concentré sous vide,
puis on dépose la solution au sommet d'une colonne de Sephadex G-25 éluée par
du
chlorure de sodium 0,2 M. On concentre les fractions contenant le produit et
on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 53 (79
mg,
72% (2 étapes)).
Méthode "ESI", mode négatif : ion multichargé détecté m/z 537.0713 [M-4H]4-
(forme acide).
OAc OH
OAc
Me0/0Bn Me0 C
0 -3.
Me02C 0,0Bn 0.__,,,.,,
HO
7(4\77/
Bn0 OMe
ZHN Lev0 Bn0 OMe
ZHN Lev0 Bn0
OMe
ZHN
Ac0 54 Ac0 55 Ac0 56
OTBDPS
OTBDPS
Me027_<;17/C n 0
-a-
Bn0
-3. ZHN
Bn0 OMe HO OMe
ZHN
Lev0 Ac0
Ac0
57 58
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
34
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(14)-6-0-acéty1-3-0-benzy1-2-benzyloxycarbonylam ino-2-
désoxy-a-D-qlucopyranoside (n 55)
A une solution du composé 54 (23,5 g, 30 mmol; Carbohydrate Research
(1987), 167, 67-75) dans le dichlorométhane (600 mL) sont ajoutés, à 0 C et
sous
atmosphère inerte, la 4-diméthylaminopyridine (733 mg, 6 mmol),
l'hydrochlorure de
1-(3-dimétylaminopropyI)-3-éthylcarbodiimide (11,5 g, 60 mmol) et l'acide
lévulinique
(6,2 mL; 60 mmol). Après 16 heures d'agitation à température ambiante, le
mélange
est dilué avec du dichlorométhane (1,5 L). La phase organique est lavée
successivement avec une solution aqueuse d'hydrogénosulfate de potassium à
10%,
avec de l'eau, avec une solution saturée d'hydrogénocarbonate de sodium puis
avec
de l'eau, séchée sur sulfate de sodium, filtrée puis évaporée à sec. Le résidu
est purifié
par flash chromatographie sur une colonne de gel de silice
(cyclohexane/acétate
d'éthyle 1/3) pour donner le composé 55 (22,6 g).
Rf = 0,37, gel de silice, cyclohexane/acétate d'éthyle 1/3
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(14)-3-0-benzy1-2-benzyloxycarbonylam ino-2-désoxy-a-D-
glucopyranoside (n 56)
A une solution du composé 55 (20,2 g, 23 mmol) dans un mélange
tétrahydrofurane/méthanol 1/1 (140 mL) est ajouté, sous atmosphère inerte, du
[tBu2SnCI(OH)]2 (226 mg, 0,79 mmol) préparé selon A. Orita et al., Chem. Eur.
J.
(2001) 7, 3321. Le milieu réactionnel est agité pendant 38 heures à 35 C.
Après
concentration, le résidu (20,8 g) est engagé sans purification dans l'étape
suivante.
Rf = 0,23, gel de silice, cyclohexane/acétate d'éthyle 1/3
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(14)-3-0-benzy1-2-benzyloxycarbonylam ino-6-0-
tertbutyldiphénylsilyI-2-désoxy-a-D-qlucopyranoside (n 57)
A une solution du composé brut 56 (23 mmol) dans le dichlorométhane (190
mL) sont ajoutés, à 0 C et sous atmosphère inerte, la triéthylamine (8 mL,
57,5 mmol),
la 4-diméthylaminopyridine (1,4 g, 11,5 mmol) et le chlorure de tert-
butyldiphénylsilyle
(12 mL, 46,0 mmol). Le milieu réactionnel est agité pendant 16 heures à
température
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
ambiante. Le mélange réactionnel est dilué avec du dichlorométhane. La phase
organique est lavée successivement avec une solution saturée de chlorure de
sodium
puis avec l'eau, séchée sur sulfate de sodium, filtrée puis évaporée. Le
résidu est
purifié par flash chromatographie sur colonne de gel de silice
(cyclohexane/acétate
5 d'éthyle 2/1) pour donner le composé 57 (24,4 g).
Rf = 0,42, gel de silice, cyclohexane/acétate d'éthyle 2/1
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-3-0-benzy1-2-benzyloxycarbonylam ino-6-0-tert-butyldi phénylsilyI-2-
désoxy-a-D-
10 glucopyranoside (n 58)
A une solution du composé 57 (22,6 g, 20,0 mmol) dans un mélange
toluène/éthanol 1/2 (2,5 L) est ajouté l'acétate d'hydrazine (9,21 g, 100,0
mmol). Le
milieu réactionnel est agité pendant 30 minutes à température ambiante. Après
concentration, le résidu est purifié par flash chromatographie sur colonne de
gel de
15 silice (cyclohexane/acétate d'éthyle 2/1) pour donner 17,6 g du composé
58.
Rf = 0,40, gel de silice, cyclohexane/acétate d'éthyle 2/1.
Déplacements chimiques des protons anomériques (500 MHz, CDCI3) 5
5.19 IdoUAll, 4.63 GIcI
LC-MS m/z 978.5 [(NA + 1-1)+]. TR = 12.29 min
OH
OTBDPS
OAc
Me0 C OBn
_],.... Lev0 Me02C OB7n
Me02C 0Ac 77.00Bn 0 __*µ*µ*=\.._\ /7 ..<4,î0B---,\--
\\ /77/0B-------\\
2 nO
N3 Bn0 N3
OAc nO N30Ac
Lev0
Lev0
A
Ac0 c0
Ac0
59 60 61
OTBDPS
OTBDPS
OH
Me027/0Bn 0 __....007\LO
Bn0 N3
OC(NH)CCI3 Me027(0:4,7/C n
Bn0 Lev0
N3
Lev0
Ac0
Ac0
6
63 2
Préparation du (méthyl 2-0-acéty1-
3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-1-0-acéty1-2-azido-3-0-benzyl-2-désoxy-a-D-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
36
glucopyranose (n 60)
A une solution de 59 (11 g, 13.7 mmol) (C. Tabeur, et coll., Carbohydr. Res.,
281 (1996) 253-276) dans un mélange 1:1 méthanol/tétrahydrofurane (80 mL) est
additionné du [tBu2SnCI(OH)]2 (0.55 g, 0.14 équivalents molaires) préparé
selon
A. Orita et al., Chem. Eur. J. (2001) 7, 3321. Après agitation à 35 C pendant
5.5h, puis
à température ambiante pendant 16h, puis à nouveau à 35 C pendant 4h, le
mélange
réactionnel est concentré sous vide puis purifié par chromatographie pour
conduire au
composé 60 (5.97 g, 57%).
LC-MS m/z 780.2 [(M + Na)]. TR = 9.14 min
Préparation du (méthyl 2-
0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-1-0-acéty1-2-azido-3-0-benzyl-6-0-tert-
butyldiphénylsily1-
2-désoxy-a-D-qlucopyranose (n 61)
Le composé 60 (5.97 g, 7.88 mmol) est mis en solution dans du
dichlorométhane (63 mL). A 0 C et sous argon, sont additionnés successivement
du 4-
diméthylaminopyridine (0.481 g, 0.5 équivalent molaire), de la triéthylamine
(2.7 mL,
2.5 équivalents molaire), et du chlorure de tert-butyldiphénylsilyle (4 mL, 2
équivalents
molaire). Après 4h d'agitation magnétique, le milieu réactionnel est dilué par
du
dichlorométhane, lavé par une solution aqueuse d'hydrogénosulfate de potassium
à
10%, à l'eau, séché (Na2SO4), filtré et concentré. Le résidu obtenu est
purifié sur silice
(acétate d'éthyle ¨ heptane) pour fournir 61 (7 g, 90%).
LC-MS m/z 1018.3 [(M + Na)]. TR = 12.33 min
Préparation du (méthyl 2-
0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a,13-D-qlucopyranose (n 62)
A une solution du composé 61 (7 g, 7.03 mmol) dans de l'éther diéthylique (70
mL), est additionnée, à 0 C, de la benzylamine (BnNH2) (29 mL, 38 équivalents
molaire). Après 15 min d'agitation à 0 C, puis 6h à température ambiante, le
mélange
réactionnel est dilué par de l'acétate d'éthyle, puis neutralisé avec de l'HCI
1N à froid
(0-4 C), lavé à l'eau, séché (Na2SO4), filtré et concentré, et purifié sur gel
de silice
(acétate d'éthyle - toluène) pour conduire à 62 (5.86 g, 87%).
LC-MS m/z 976.3 [(M + Na)]. TR = 27.6/27.8 min
Préparation du (méthyl 2-0-acéty1-3-
0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a,13-D-qlucopyranose trichloroacétimidate (n 63)
A une solution du composé 62 (6.5 g, 6.81 mmol) dans le dichlorométhane (140
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
37
mL) et en présence de tamis moléculaire 4 A en poudre (7 g), est additionné
sous
argon, du carbonate de césium (Cs2003) (3.5 g, 1.6 équivalent molaire), puis à
0 C, du
trichloroacétonitrile (CCI3CN) (3.4 mL, 5.0 équivalents molaire). Après 15 min
d'agitation à 0 C, puis 5h à température ambiante, le mélange réactionnel est
filtré,
puis concentré. Le résidu est purifié sur gel de silice (1:4 acétate d'éthyle
¨ toluène +
0.1% de triéthylamine) pour donner 63 (6.33 g, 85%).
LC-MS in/z 1119.1 [(NA + Na)]. TR = 31.2 min
OTBDPS
0
OTBDPS Me02C OBn
Me02C 00
Bn0 OMe
Lev
/z.s7
0
Bn0
N3 OC(NH)CCI3 HO
Ac0 ZHN
()
Ac0
63
58
OTBDPS
OTBDPS 0
0
Me0 0 Me02c/z..70Bn 0
2;z7/0Bn
0 Bn0 OMe
ZHN
0 Bn0 0
N3
Lev() Ac0
Ac0 64
OTBDPS
OTBDPS
Me0C OBn
OBn
Me02;z7
0 2
B7-1.--\\ OMe
ZHN
Bn0 0
N3
HO Ac0
Ac0
6
5
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-a-
D-qlucopyranosyl)-(14)-(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-3-0-benzy1-2-benzyloxycarbonylamino-6-0-tert-butyldiphénylsily1-2-désoxy-
a-D-
glucopyranoside (n 64)
Un mélange de l'accepteur de glycosyle 58 (8,80 g, 9,00 mmol), de l'imidate 63
(6,58 g, 6,00 mmol) et de tamis moléculaire 4 A en poudre (4,50 g) dans le
dichlorométhane (210 mL) est agité sous atmosphère d'argon pendant 1 heure à
25 C.
Le mélange réactionnel est refroidi à -20 C et on ajoute une solution 1M de
triflate de
tert-butyldiméthylsilyle dans le dichlorométhane (900 pL). Après 1 heure 20,
le milieu
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
38
réactionnel est neutralisé par addition d'hydrogénocarbonate de sodium solide.
Après
filtration sur Celite et concentration, le résidu obtenu est chromatographié
sur colonne
Sephadex LH20 (190 x 3,2 cm, dichlorométhane/éthanol 1/1) pour donner 8,26 g
du
composé 64.
Rf = 0,30, gel de silice, cyclohexane/acétate d'éthyle 2/1
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranosy1)-
(14)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(14)-3-0-
benzy1-2-
benzyloxycarbonylamino-6-0-tert-butyldiphénylsilyI-2-désoxy-a-D-
qlucopyranoside
(n 65)
Le composé 64 (8,26 g, 4,31 mmol) est transformé en composé 65 (6,41 g)
selon le même mode opératoire que celui décrit pour la synthèse de 58.
Rf = 0,34, gel de silice, cyclohexane/acétate d'éthyle 2/1
OTBDPS
OTBDPS
OBn
0 Me020zs7
Me020 OBn
/z...7/0
Bn0 /
N, 0
ZHN
HO AcO
Bn0 OMe
Ac0
OTBDPS
0
Me020 OBn 0
OC(NH)CCI3
Lev() 0 Bn0
/z..7/
N3
Ac0 63 Y OTBDPS
OTBDPS 0
OTBDPS Me020 OBn 0
72;z7/0Bn
Me020 OBn
^ Bn0 OMe
0
ZHN
Lev() 0
/z(4)7/
Bn0 0
N3
AcO Bn0
66 N3 0
Ac0
Ac0
OTBDPS
OTBDPS 0
OTBDPS Me020 OBn 0
C OBn
OBn
/z(
Me020 2;7_70
0 ___>\.:.
^ Bn0 OMe
HO 0
4)7/
Bn0 0
N3
AcO Bn0
N3 0
Ac0 ZHN
Ac0
67
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
39
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-a-
D-qlucopyranosyl)-(14)-(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranosy1)-
(14)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(14)-3-0-benzy1-2-
benzyloxycarbonylamino-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranoside
(n 66)
Un mélange de l'accepteur de glycosyle 65 (7,42 g, 4,09 mmol), de l'imidate 63
(6,73 g, 6,1 mmol), et de tamis moléculaire 4 A en poudre (4,60 g) dans le
dichlorométhane (215 mL) est agité sous atmosphère d'argon pendant 1 heure à
25 C.
Le mélange réactionnel est refroidi à -20 C et on ajoute une solution 1M de
triflate de
tert-butyldiméthylsilyle dans le dichlorométhane (920 pL). Après 1 heure 30,
le milieu
réactionnel est neutralisé par addition d'hydrogénocarbonate de sodium solide.
Après
filtration sur Celite , le milieu réactionnel est dilué avec du
dichlorométhane (800 mL).
La phase organique est lavée successivement avec une solution
d'hydrogénocarbonate de sodium à 2%, avec de l'eau puis séchée sur sulfate de
sodium, filtrée puis évaporée à sec. le résidu obtenu est purifié par
chromatographie
sur colonne Sephadex LH20 (190 x 3,2 cm, dichlorométhane/éthanol 1/1) suivie
d'une
chromatographie sur colonne de gel de silice (toluène/acétate d'éthyle 6/1)
pour
donner 6,13 g du composé 66.
Rf = 0,46, gel de silice, toluène/acétate d'éthyle 4/1
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranosy1)-
(14)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-
benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosy1)-(14)-(méthyl
2-0-
acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(14)-3-0-benzy1-2-
benzyloxycarbonylam ino-6-0-tert-butyldi phénylsily1-2-désoxy-a-D-
qlucopyranoside
(n 67)
Le composé 66 (7,14 g, 2,59 mmol) est transformé en composé 67 (6,07 g)
selon le même mode opératoire que celui décrit pour la préparation du composé
58.
Rf = 0,37, gel de silice, cyclohexane/acétate d'éthyle 2/1
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
OH
OTBDPS
OAc
0N3 N Me0
)11. Bn0 Me0 C OBn
-.. Me02CA)00/7/Bn
Bn0 3 OAc 7
OAc 0 Bn0
OAc
Bn0
N3 Bn0
Bn0 Ac0
Ac0
Ac0
36 68 69
OTBDPS
OTBDPS
0
Me02C 0,0Bn o
7Bno,(%)07/
N3 OC(NH)CCI3
OH
Bn0 Me02/z4077C OBn oBno
0
N3
Bn0
Ac0
Ac0
71 70
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
5 (1-4)-1-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranose (n 68)
A une solution de 36 (5.05 g, 6.3 mmol) dans un mélange 1 :1
méthanol/tétrahydrofurane (76 mL) est additionné du [tBu2SnCI(OH)]2 (0.25 g,
0.14
équivalent molaire) préparé selon A. Orita et al., Chem. Eur. J. (2001) 7,
3321. Après
agitation à température ambiante pendant 72h, le mélange réactionnel est
concentré
10 sous vide puis purifié par chromatographie pour conduire au composé 68
(2.89 g,
64%).
LC-MS m/z 772.4 [(M + Na)]. T R = 10.23 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
15 (1-4)-1-0-acéty1-2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-
D-
glucopyranose (n 69)
Le composé 68 (2.89 g, 3.86 mmol) est mis en solution dans du
dichlorométhane (31 mL). A 0 C et sous argon, sont additionnés successivement
de la
triéthylamine (1.3 mL, 2.5 équivalents molaire), de la 4-diméthylaminopyridine
(0.235 g,
20 0.5 équivalent molaire), et du chlorure de tert-butyldiphénylsilyle (2
mL, 2 équivalents
molaire). Après 3h d'agitation magnétique, le milieu réactionnel est dilué par
du
dichlorométhane, lavé par une solution aqueuse d'hydrogénosulfate de potassium
à
10%, à l'eau, séché (Na2SO4), filtré et concentré. Le résidu obtenu est
purifié sur silice
(acétate d'éthyle ¨ cyclohexane) pour fournir 69 (3.4 g, 90%).
25 LC-MS m/z 1010.6 [(M + Na)]. T R
= 13.10 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-2-azido-3-0-benzyl-6-0-tert-butyldiphénylsily1-2-désoxy-a,13-D-
qlucopyranose
(n 70)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
41
A une solution du composé 69 (3.44 g, 3.48 mmol) dans de l'éther diéthylique
(35 mL), est additionnée, à 0 C, de la benzylamine (BnNH2) (14.5 mL, 38
équivalents
molaire). Après 8h d'agitation à température ambiante, le mélange réactionnel
est
placé à -18 C pendant 16h, puis à nouveau 2.5h à température ambiante. Le
milieu est
alors dilué par de l'acétate d'éthyle, puis neutralisé avec de l'HCI 1N à
froid (0-4 C),
lavé à l'eau, séché (Na2SO4), filtré et concentré, et purifié sur gel de
silice (acétate
d'éthyle ¨ cyclohexane 15/85) pour conduire à 70 (3.83 g, 91%).
LC-MS m/z 963.6 RM + NH4)]. TR = 12.37, 12.47 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-2-azido-3-0-benzyl-6-0-tert-butyldiphénylsily1-2-désoxy-a,[3-D-
qlucopyranose
trichloroacétimidate (n 71)
A une solution du composé 70 (2.99 g, 3.16 mmol) dans le dichlorométhane (60
mL) et en présence de tamis moléculaire 4 A en poudre (3 g), sont additionnés,
à 0 C
sous argon, du carbonate de césium (C52CO3) (1.6 g, 1.6 équivalent molaire),
puis du
trichloroacétonitrile (CCI3CN) (1.6 mL, 5.0 équivalents molaire). Après 20 min
d'agitation à 0 C, 7h à température ambiante, stockage à -18 C pendant 16h,
puis
agitation magnétique 8h à température ambiante, stockage à -18 C pendant 16h,
et
enfin agitation magnétique 1h à température ambiante, le mélange réactionnel
est
filtré, puis concentré. Le résidu est purifié sur gel de silice (acétate
d'éthyle ¨
cyclohexane 15:85 + 0.1% de triéthylamine) pour donner 71(2.69 g, 78%).
LC-MS m/z 1113.4 [(N/1 + Na)]. TR = 14.58 min
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
42
OTBDPS
OTBDPS
OTBDPS MeO,C OBn 0
OBn
0 Me02C
N 7
Me02C OBn 0 ed-70--...\ OMe
Ac0
HO 0
0 Bn0 .(4)07/ 0A.D,7 Bn0
3
Ac0 N3
Ac0 ZHN
67
OTBDPS
Me02C OBn _........;\....\sv
Bn0
7/
0
Bn0
N3 OC(NH)CCI3
Y
OTBDPS
Ac0 71 OTBDPS
OTBDPS 0 Me02C OBn
OTBDPS 0,13n 0 0
Me0
0 Me0 07¨<..077 Bn0
ZHN Me
____ 0,Bn Bn0
2C 0 0 N3
Bn0
O Bn0 N3 0
Ac0 Bn0 N3 0
72 Aco Aco
Aco
OTBDPS OTBDPS
OTBDPS Me02C OBn 0
OTBDPS OBn
0 Me02C
OBn
0 Me02/z.z..y/C /7
Me0 0
ZHN
0,13n 0 0
2C N3
Bn0
o Bn0 N3 0
H: Bn0 N3 0
73 HO HO
HO
OH OH
OH 0 Me02C3
OH OBn
0 Meo2c
n Bn0 OMe
0 Me02C OBn 0
ZHN
0,Bn 0 0
Me02C ____________________________________________ N3
Bn0
O Bn0 N3 0
HO Bn0 N3 0
HO HO
HO 74
0S03-
0S03-
0S03- OBn
0S03- OBn
0 Me02C
0 Me02C OBn 0
ZHN Me
0,13n 0 0
/7-14=;).007/ Bn0 0
Me02C N3
Bn0
/z<44,7
0 Bn0 N3 0
Bn0 N3 0
sel de triéthylammonium
-03S0 -03S0 75 -03S0 -03S0
OSO3Li OSO3Li
OSO3Li LiO0C OBn
OSO3Li OBn 0---&=0\¨\\
0 LiO0C
0 LiO0C OBn Bn0
ZHN Me
c/z<:"70Bn 0 0 /7---(4:,97/0/444;4C77/
Li00
s Bn0 0
N3 N3 LiO3S0
0 Bn0 0 LiO3S0
N3
Bn0
Lio3so LiO3S0 76
OS03N a OS03N a
0
0N
OS03N a OH a00/7_,(i707/,C
OSO3Na OH
0 N a 000/ z7/,0C 0
NH2
0,H 0 0 HO
NH20
Na00C
HO HO
NH
2 Na03S0 HO
NH
Na03S0 - Na03S0
Na03S0 77
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
43
Préparation du méthyl (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzyl-6-0-tert-butyldiphénylsily1-2-
désoxy-a-
D-qlucopyranosy1)-(14)-Rméthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranosy1)-
(14)12-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(14)-3-0-benzy1-
2-
benzyloxycarbonylamino-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranoside
(n 72)
Un mélange de l'accepteur de glycosyle 67 (3,50 g, 1,32 mmol), de l'imidate 71
(2,16 g, 1,98 mmol) et de tamis moléculaire 4 A en poudre (1,48 g) dans le
dichlorométhane (69 mL) est agité sous atmosphère d'argon pendant 1 heure à
température ambiante. Le mélange réactionnel est refroidi à - 20 C et on
ajoute une
solution 1M de triflate de tert-butyldiméthylsilyle dans le dichlorométhane
(297 pL).
Après 2 heures 30, le milieu réactionnel est neutralisé par addition
d'hydrogénocarbonate de sodium solide. Après filtration sur Celite , le milieu
réactionnel est dilué avec du dichlorométhane (400 mL). La phase organique est
lavée
successivement avec une solution d'hydrogénocarbonate de sodium à 2%, avec de
l'eau puis séchée sur sulfate de sodium, filtrée puis évaporée à sec. Le
résidu obtenu
est purifié par chromatographie sur colonne Sephadex LH20 (190 x 3,2 cm,
dichlorométhane/éthanol 1/1) suivie d'une chromatographie sur colonne de gel
de silice
(cyclohexane/acétate d'éthyle 4/1) pour donner 3,04 g du composé 72.
Rf = 0, 30, gel de silice, cyclohexane/acétate d'éthyle 3/1
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(14)-
(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosy1)-
(14)-
1(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(14)12-(méthyl 3-0-benzyl-a-L-
idopyranosyluronate)-(14)-3-0-benzy1-2-benzyloxycarbonylamino-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranoside (n 73)
A une solution du composé 72 (2,23 g, 0,623 mmol) dans un mélange
dichlorométhane/méthanol 2/3 (187 mL) contenant du tamis 3Å (78 mg) est
ajoutée
sous atmosphère d'argon et à 0 C une solution 1 M de méthylate de sodium dans
le
méthanol (99,7 pL). Après 24 heures à température ambiante, le milieu
réactionnel est
neutralisé avec de la résine Dowex AG 50 WX4 H. Après filtration et
concentration, le
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
44
résidu est chromatographié sur colonne Sephadex LH20 (120 x 3 cm,
dichlorométhane/éthanol 1/1) suivie d'une flash chromatographie sur colonne de
gel de
silice (cyclohexane/acétate d'éthyle 1/0¨>66/34) pour donner 1,80 g du composé
73.
Rf = 0,38, gel de silice, cyclohexane/acétate d'éthyle 3/1
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(14)-
(2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosyl)-(14)-Rméthyl 3-
0-benzyl-a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosyl)-
(14)12-(méthyl 3-
0-benzyl-a-L-idopyranosyl uronate)-(14)-3-0-benzy1-2-
benzyloxycarbonylamino-2-désoxy-a-D-qlucopyranoside (n 74)
A une solution du composé 73 (44,0 mg, 0,013 mmol) dans le méthanol (1,7
mL) est ajouté le fluorure d'ammonium (38,0 mg, 1,03 mmol). Après 140 heures
d'agitation à température ambiante, le mélange réactionnel est déposé sur une
colonne Sephadex LH20 (95 x 2 cm, dichlorométhane/éthanol 1/1) suivie d'une
flash
chromatographie sur colonne de gel de silice (toluène/acétone 3/2) pour donner
le
composé 74 (24,2 mg).
Rf = 0,46, gel de silice, toluène/acétone 3/2
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium sulfonato-
a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium
su Ifonato-a-D-glucopyranosyl)-R1 4)-(méthyl 3-0-benzy1-2-0-triéthylammonium
su Ifonato-a-L-idopyranosyl uronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-glucopyranosy1)12-(14)-(méthyl 3-0-benzy1-2-0-
triéthylam mon iu m su Ifonato-a-L-idopyranosyl uronate)-(14)-3-0-benzy1-2-
benzyloxycarbonylamino-2-désoxy-6-0-triéthylammonium sulfonato-a-D-
glucopyranoside (n 75)
Le composé 74 (24,2 mg, 9,96 pmol) est séché par co-distillation de N,N-
diméthylformanide (3 x 1,0 mL) puis est mis en solution dans le N,N-
diméthylformanide
(1,0 mL). A cette solution on ajoute le complexe triéthylamine- trioxyde de
soufre (72,2
mg, 0,4 mmol). Le mélange est agité pendant 16 heures à 55 C à l'abri de la
lumière
puis l'excès de réactif est détruit avec du méthanol (16,2 pL). Le milieu
réactionnel est
déposé sur une colonne Sephadex LH20 (120 x 3 cm) éluée par mélange
dichlorométhane/éthanol 1/1 pour conduire au composé 75 (29,0 mg).
Rf = 0,26, gel de silice, acétate d'éthyle/pyridine/acide acétique/eau
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
28/16/3,8/9.
Préparation du méthyl (3,4-di-O-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
5 sulfonato-a-D-glucopyranosyl)-R1 4)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-glucopyranosy1)12-(14)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-3-0-benzy1-2-benzyloxycarbonylamino-2-
désoxy-6-0-lithium sulfonato-a-D-qlucopyranoside (n 76)
10 A une solution du composé 75 (78,5 mg, 30,1 pmol) dans un mélange
tétrahydrofurane/méthanol 1/1 (3,2 mL) est ajoutée, à 0 C, une solution 0,7 M
d'hydroxyde de lithium dans l'eau (440 pL). Après 1 heure à 0 C puis 16 heures
à
température ambiante, la solution est déposée sur une colonne Sephadex LH20
(3 x
120 cm) éluée par mélange diclorométhane/éthanol/eau 50/50/1 pour donner le
15 composé 76 (60,3 mg).
[a]) 13,1 (c 1,0; Me0H)
Préparation du méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-amino-2-désoxy-6-0-sodium su Ifonato-a-D-glucopyranosyl)-R1 4)-
20 (2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-amino-2-
désoxy-
6-0-sodium sulfonato-a-D-glucopyranosy1)12-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-2-amino-2-désoxy-6-0-sodium sulfonato-a-D-
glucopyranoside (n 77)
A une solution du composé 76 (19,3 mg, 6,16 pmol) dans un mélange tert-
25 butanol/eau 1/1 (1,2 mL) sont ajoutés successivement le formiate
d'ammonium (50,8
mg) et le Paladium/C 10% (125 mg). Après 4 heures à température ambiante, le
mélange réactionnel est filtré (filtre Millipore LSWP 5 pm) puis déposé sur
une
colonne de gel Sephadex G-25 fine(95 x 2 cm) éluée par une solution aqueuse
de
NaCI 0,2 M. Les fractions contenant le composé attendu sont réunies, et
déposées sur
30 une colonne de Sephadex G-25 fine (95 x 2 cm) éluée par de l'eau et on
obtient 11,2
mg du composé 77.
Masse : méthode "ESI", mode négatif : masse théorique = 2285,47 ; masse
expérimentale : 2197,20 0,34 u.m.a. (acides iduroniques observés sous forme
COOH)
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
46
......\.....\\OT130DPS
OTBDPS
0 Me02;70Bn
0
Me02C , o
HO 0 Bn0
N, 0
AcO Bn0
Me
OBn
ZHN
Ac0 65
OAc
Me02C/zÇ7/
N,
OBn ..............\me
0 OC(NH)CCI,
0 Bn0
Lev0
Ac0 27 OTBDPS
OTBDPS 0
OAc 0 Me02c/z7/Bn
OBn
Me02C OBn
0
0 0 BnO OMe
0
ZHN
Lev0 0
/z7/ 0 Me02C
Bn0 0
N3 Bn0 ç
Ac0 78 N, 0
Ac0
Ac0
OTBDPS
OAc OTBDPS
OBn
0 Me02C/z7/
0
OBn 0
0 Me02C ,0 Bno
0 0 BnO OMe
Me02C OBn 0
ZHN
Ac0
HO 0
Bn0 0
N3
Ac0 N, 0
Ac0
79
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(14)-(6-0-acéty1-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(14)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-
(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyI)-
(14)-
(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(14)-3-0-benzy1-2-
benzyloxycarbonylamino-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranoside
(n 78)
Un mélange de l'accepteur de glycosyle 65 (1,82 g, 1,00 mmol), de l'imidate 27
(1,35 g, 1,50 mmol), et de tamis moléculaire 4 A en poudre (1,12 g) dans le
dichlorométhane (52 mL) est agité sous atmosphère d'argon pendant 1 heure à 25
C.
Le mélange réactionnel est refroidi à -20 C et on ajoute alors une solution 1M
de
triflate de tert-butyldiméthylsilyle dans le dichlorométhane (224 pL). Après
50 minutes,
le milieu réactionnel est neutralisé par addition d'hydrogénocarbonate de
sodium
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
47
solide. Après filtration sur Celite , le milieu réactionnel est dilué avec du
dichlorométhane (500 mL). La phase organique est lavée successivement avec une
solution aqueuse d'hydrogénocarbonate de sodium à 2%, avec de l'eau puis
séchée
sur sulfate de sodium, filtrée puis évaporée à sec. Le résidu obtenu est
chromatographié sur colonne (Sephadex LH20, 190 x 3,2 cm,
dichlorométhane/éthanol 1/1) suivie d'une chromatographie flash sur colonne de
gel de
silice (toluène-acétone 1/0¨>3/1) pour donner 1,57 g du composé 78.
Rf = 0,47, gel de silice, toluène/acétone 3/1
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosy1)-(14)-(méthyl
2-
0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(14)-(2-azido-3-0-benzy1-6-0-
tert-
butyldi phenylsily1-2-désoxy-a-D-qlucopyranosyI)-(14)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(14)-3-0-benzy1-2-benzyloxycarbonylam ino-6-0-tert-
butyldiphenylsilyI-2-désoxy-a-D-qlucopyranoside (n 79)
Le composé 78 (1,56 g, 0,61 mmol) est transformé en composé 79 (1,44 g)
selon le même mode opératoire que celui décrit pour la préparation du composé
58.
Rf = 0,52, gel de silice, toluène/acétate d'éthyle 1/1
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
48
OTBDPS
OTBDPS
OAc meo2c OBn 0
OBn
oMeO,C
0 ----"--\\ sO Bro\---\\ OMe
/
Me02C OBn 0 ,
HO Bn0
z(44,7
0 Bn0
N3 17-14\77/
79 N3
ZHN
Ac0 Ac0 Ac0
OAc
Me02C OBn _...../007\vo
Bn0
F...<44)07/
0
Bn0
N3 OC(NH)CCI3
Ac0 38 OTBDPS
OTBDPS
0
OAc Y meo2c OBn 0
OAc OBn
() Me02C
0 Me02C OBn 0---&¨\\ '0
BOMe
ZHN
0,13n 0 0
B0 0
Me02C N3
Bn0
A)/
Bn0 N3 0/2%;..C.'77/
Bn0 n
N3
Aco Ac0 Aco Aco
OTBDPS OTBDPS
0
OH me02C OBn 0
OH OBn
() Me02C
0 Me02C OBn ^ 137-1-
0.\¨\\OMe
ZHN
0,13n 0 0
Bn0 0
Me02C N3
Bn0
Bn0 N3 07."(sî7/
Bn0
N3
HO HO 81 HO HO
OTBDPS OTBDPS
0
0503- mec) OBn 0
0S03- OBn
() Me02C
0 Me02C OBn ^ 13,71O 0Me
03S0
ZHN
0,13n 0 0
/7---.7n
< B0 0
Me02C N3
Bn0
/z/y/
0 Bn0 N3 07."(sî7/
Bn0
N3
-03S0 -03S0
sel de triéthylammonium
'03SO 82
O
0
0503 H OH
- 0 mec) OBn
0S03- 7...4)D70Bn 0
0 Me02C7(4)70Bn
o//Z7/13---s OMe
ZHN
0,13n 0 0 nO
Me02C N3
Bn0
/z(77
0 Bn0 N3 0 .
Bn0 0 Me0
N3
83 -03S0 -03S0
sel d'ammonium
'03SO 03S0
OH OH
LiO0C OBn
OSO OSO3Li 3Li OBn 0
0 LiO0C
0 LiO0C OBn ,0 0 n0 0 s B Me
n0
ZHN
o0Bn 0 0
Li00
µ0 Bn0 0
N3 N3
Bn0 0 LiO3S0 LiO3S0
N3 84
Bn0 LiO3S0
LiO3S0
OH OH
0
OSO3N a OH
oNa00A)7C
OSO3Na OH 0 0
Na00C OH 0 OMe
Na00C OH NH2
s ,4.0,7 0 Na00077/C
0 20
HO 0 HO
NH
Na03S0
2 Na03S0 HO
NH HO NH
Na03S0 - Na03S0
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
49
Préparation du méthyl (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(14)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyI)-(14)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(14)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosy1)-(14)-(méthyl 2-0-
acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(14)-(2-azido-3-0-benzy1-6-0-tert-
butyldi phénylsily1-2-désoxy-a-D-qlucopyranosyI)-(14)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyl uronate)-(14)-3-0-benzy1-2-benzyloxycarbonylam ino-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranoside (n 80)
Un mélange de l'accepteur de glycosyle 79 (1,0 g, 0,41 mmol), de l'imidate 38
(543 mg, 0,61 mmol) et de tamis moléculaire 4 A en poudre (455 mg) dans le
dichlorométhane (21 mL) est agité sous atmosphère d'argon pendant 1 heure à
température ambiante. Le mélange réactionnel est refroidi à -20 C et on ajoute
une
solution 1M de triflate de tert-butyldiméthylsilyle dans le dichlorométhane
(91,0 pL).
Après 1 heure 10, le milieu réactionnel est neutralisé par addition
d'hydrogénocarbonate de sodium solide. Après filtration sur Celite , le milieu
réactionnel est dilué avec du dichlorométhane (250 mL). La phase organique est
lavée
successivement avec une solution aqueuse d'hydrogénocarbonate de sodium à 2%,
avec de l'eau puis séchée sur sulfate de sodium, filtrée puis évaporée à sec.
Le résidu
obtenu est purifié par chromatographie sur colonne Sephadex LH20 (190 x 3,2
cm,
dichlorométhane/éthanol 1/1) suivie d'une flash chromatographie sur colonne de
gel de
silice (toluène/acétate d'éthyle 1/0¨)0/1 ) pour donner le composé 80 (822,4
mg).
Rf = 0,44, gel de silice, toluène/acétate d'éthyle 3/1
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(14)-
(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(14)-(méthyl 3-0-benzyl-a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosy1)-
(14)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranosy1)-(14)-(méthyl 3-0-benzyl-a-L-
idopyranosyluronate)-(14)-3-0-benzy1-2-benzyloxycarbonylamino-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranoside (n 81)
Le composé 80 (820 mg, 0,257 mmol) est saponifié selon la méthode utilisée
pour la préparation du composé 73 pour donner l'octasaccharide 81 (593,8 mg)
après
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
flash chromatographie sur colonne de gel de silice (toluène/acétone 1/0¨)0/1).
Rf = 0,57, gel de silice, toluène/acétone 2/1
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium sulfonato-
5 a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium
sulfonato-a-D-qlucopyranosyI)-(14)-(méthyl 3-0-benzy1-2-0-triéthylammonium
sulfonato-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-qlucopyranosyI)-(14)-(méthyl 3-0-benzy1-2-0-
triéthylammonium sulfonato-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-6-
0-
10 tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyI)-(14)-(méthyl 3-0-
benzy1-2-0-
triéthylammonium sulfonato-a-L-idopyranosyluronate)-(14)-3-0-benzy1-2-
benzyloxycarbonylamino-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-
qlucopyranoside
(n 82)
Le composé 81(130 mg, 44,3 pmol) est transformé en composé 82 (164,1 mg)
15 selon le même mode opératoire que celui décrit pour la préparation du
composé 75.
Masse : méthode "ESI", mode négatif : masse théorique = 4024,90 ; masse
expérimentale : 4024
Préparation du méthyl (méthyl 2-0-ammonium sulfonato-3,4-di-O-benzyl-a-L-
20 idopyranosyluronate)-(14)-(6-0-ammonium sulfonato-2-azido-3-0-benzy1-2-
désoxy- -
a-D-qlucopyranosy1)-(14)-(méthyl 2-0-ammonium sulfonato-3-0-benzyl- -a-L-
idopyranosyluronate)-(14)-( 6-0-ammonium sulfonato-a-2-azido-3-0-benzy1-2-
désoxy-D-qlucopyranosyl)-(14)-(méthyl 2-0-ammonium sulfonato-3-0-benzyl-a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(14)-
25 (méthyl 2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(14)-
3-0-
benzy1-2-benzyloxycarbonylamino-2-désoxy-a-D-qlucopyranoside (n 83)
A une solution du composé 82 (91,8 mg, 22,8 pmol) dans le méthanol (3,0 mL)
est ajouté le fluorure d'ammonium (67,6 mg, 1,82 mmol). Après 48 heures
d'agitation à
C, le mélange réactionnel est déposé sur une colonne Sephadex LH20 (120 x 3
30 cm, dichlorométhane/éthanol 1/1) suivie d'une flash chromatographie sur
colonne de
gel de silice (méthanol/eau 95/5) pour donner le composé 83 (62,7 mg).
Rf = 0,32, gel de silice, acétate d'éthyle/pyridine/acide acétique/eau
17/9/2,2/5.
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
51
Préparation du méthyl (3,4-di-O-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-qlucopyranosyl)-(14)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-qlucopyranosyl)-(14)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(14)-(3-0-benzyl-2-0-lithium sulfonato-a-L-idopyranosyluronate
de
lithium)-(14)-3-0-benzy1-2-benzyloxycarbonylamino-2-désoxy-a-D-qlucopyranoside
(n 84)
A une solution du composé 83 (86 mg, 24,2 pmol) dans un mélange
tétrahydrofurane/méthanol 1/1 (3,9 mL) est ajoutée, à 0 C, une solution 1 M
d'hydroxyde de lithium dans l'eau (780 pL). Après 1 heure à 0 C puis 16 heures
à
température ambiante, la solution est déposée sur une colonne de gel Sephadex
LH20 (95 x 2 cm) éluée par mélange méthanol/eau 95/5 pour donner le composé
84 (65,3 mg).
Rf = 0,27, gel de silice, acétate d'éthyle/pyridine/acide acétique/eau
17/9/2,2/5.
Préparation du méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyI)-(14)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-amino-2-
désoxy-
6-0-sodium sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-amino-2-désoxy-a-D-qlucopyranosy1)-(14)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-amino-2-désoxy-
a-D-qlucopyranoside (n 85)
Le composé 84 (95,0 mg, 32,3 pmol) est traité selon le même mode opératoire
que celui décrit pour la préparation du composé 77 pour donner le composé 85
(47,3
mg)
Masse : méthode "ESI", mode négatif : masse théorique = 2081,38 ; masse
expérimentale : 1993,15 0,11 u.m.a. (acides iduroniques observés sous forme
COOH).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
52
OTBDPS
OTBDPS
0
OH Me0 C OBn
OH ,B,7n 0
2 '0 Bn0 OMe
Me02o
O Me020/z<13,17/1 0
ZHN
/z(t.4), 7/0Bn 'ID Bn0 0
N3
0 'ID Bn0 0
N3 HO
0 Bn0 N3 0 HO
Bn0 HO 81
1
OH
HO OTBDPS
0
OH 0 Me02c0Bn 0
OH OBn 0
O MeO2C/zzON ;71 0
0 Bn0
ZHN "OMe
Me0
2c/ HO
7/0Bn 0 'ID Bn0 0
N3
0 µIp Bn0 0
N3 HO
0 Bn N3 0
Bn0 HO 86
HO
1 OTBDPS OSO,
0
OS03 Me0 C OBn
OS03 OBn 0
2 '0 no OMe
Me0
O Me02C7(4, B ZHN
0:>
2c/z(t.%), OBn 0 'ID Bn0 0
N
0 'ID Bn0 0 3 -03S0
Bn0 0 N3 -03S0
Bn0 N3 -03S0 87 sel de tréthylammonium
03SO
OS03
OH
0S03
OS03 OBn
_______=01:3\Ae02A,07/0
n Me0 C OBn 0 Me02C/z(77/0Bn 0
Bn0
"OMe
ZHN
Me02c0Bn 2/7.<,4,3 70 Bn0 0
0 Bn0 0 N3
Bn0
03SO
0 0 N3
03S0
N3
Bn0 03S0 88 sel d'ammonium
03SO
OSO3Lii OH 0 Li000 OBn
ZHN
OSO3Li OBn
0 Li00;z7.,:sp7/0
O LiO0C/z(B1 0
Brio OMe
Bn
ZHN
Li00 OBn 0 0 Bn0 0
7....<;C
Bn0 0 N3
LiO3S0
0 Bn0 0 N3
LiO S0
3
N3
Bn0)/LiO3S0 89
Lio3so
OSO3Na
0
OSO3Na
OH 1
OSO3Na OH
0 N a00C/z(OÇ7 0 sO Ho
OMe
oNa00C OH 0
oo/z(;)70H N 0 0 HO NH2 0 NH2
Na0
0 0 HO NH 0 Na03S0
HO
H 0 0 Na00;z<t)7
2 Na03S0
HO 2 Na03S0
Na03S0
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(14)-
5 (2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosyl)-(14)-(méthyl 3-0-benzyl-
a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosy1)-
(14)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-glucopyranosy1)-(14)-(méthyl 3-0-benzyl-a-L-
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
53
idopyranosyluronate)-(14)-3-0-benzy1-2-benzyloxycarbonylamino-2-désoxy-a-D-
glucopyranoside (n 86)
A une solution du composé 81(50 mg, 0,017 mmol) dans le méthanol (2,2 mL)
est ajouté le fluorure d'ammonium (25 mg, 0,68 mmol). Après 7 heures
d'agitation à
température ambiante puis 16 heures à 20 C, le mélange réactionnel est dilué
avec du
dichlorométhane. La phase organique est lavée à l'eau, séchée sur sulfate de
sodium,
filtrée puis évaporée à sec. Le résidu est purifié par flash chromatographie
sur colonne
de gel de silice (toluène/méthanol 100/0¨>82/18) pour donner 27,7 mg de
composé 86.
Rf = 0,16, gel de silice, toluène/méthanol 85/15
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium sulfonato-
a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium
sulfonato-a-D-qlucopyranosy1)-(14)-(méthyl 3-0-benzy1-2-0-triéthylammonium
sulfonato-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-qlucopyranosy1)-(14)-(méthyl 3-0-benzy1-2-0-
triéthylammonium sulfonato-a-L-idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-6-
0-
tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosy1)-(14)-(méthyl 3-0-benzy1-2-
0-
triéthylammonium sulfonato-a-L-idopyranosyluronate)-(14)-3-0-benzy1-2-
benzyloxycarbonylamino-2-désoxy-6-0-triéthylammonium sulfonato-a-D-
glucopyranoside (n 87)
Le composé 86 (94 mg, 34,8 pmol) est traité selon le même mode opératoire
que celui décrit pour la préparation du composé 75 pour donner le composé 87
(131,9
mg).
Rf = 0,37, gel de silice, acétate d'éthyle/pyridine/acide acétique/eau
17/9/2,2/5.
Préparation du méthyl (méthyl 2-0-ammonium sulfonato-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(14)-(6-0-ammonium sulfonato-2-azido-3-0-benzy1-2-désoxy-
a-D-qlucopyranosyl)-(14)-(méthyl 2-0-ammonium sulfonato-3-0-benzyl-a-L-
idopyranosyluronate)-(14)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(14)-
(méthyl 2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(14)-(2-
azido-
3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(14)-(méthyl 3-0-benzyl-a-L-
idopyranosyluronate)-(14)-6-0-ammonium sulfonato-3-0-benzy1-2-
benzyloxycarbonylamino-2-désoxy-a-D-qlucopyranoside (n 88)
Le composé 87 (130 mg, 32,8 pmol) est traité selon le même mode opératoire
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
54
que celui décrit pour la préparation du composé 74 pour donner le composé 88
(102,0
mg).
Rf = 0,33, gel de silice, acétate d'éthyle/pyridine/acide acétique/eau
17/9/2,2/5.
Préparation du méthyl (3,4-di-O-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-qlucopyranosyl)-(14)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-qlucopyranosyl)-(14)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de lithium)-(14)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(14)-(3-0-benzyl-2-0-lithium sulfonato-a-L-idopyranosyluronate
de
lithium)-(14)-3-0-benzy1-2-benzyloxycarbonylamino-2-désoxy-6-0-lithium
sulfonato-
a-D-qlucopyranoside (n 89)
Le composé 88 (100 mg, 26,8 pmol) est traité selon le même mode opératoire
que celui décrit pour la préparation du composé 76 pour donner le composé 89
brut qui
est engagé tel quel dans l'étape suivante.
Rf = 0,25, gel de silice, acétate d'éthyle/pyridine/acide acétique/eau
17/9/2,2/5.
Préparation du méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyI)-(14)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-amino-2-
désoxy-
6-0-sodium sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-amino-2-désoxy-a-D-qlucopyranosy1)-(14)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-amino-2-désoxy-
6-0-sodium sulfonato-a-D-qlucopyranoside (n 90)
Le composé brut 89 (75 mg, 24,8 pmol) est traité selon le même mode
opératoire que celui décrit pour la préparation du composé 77 pour donner le
composé
90 (48,2 mg).
Masse : méthode "ESI", mode négatif : masse théorique = 2183,42 ; masse
expérimentale : 2095,07 0,24 u.m.a. (acides iduroniques observés sous forme
COOH)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
OAc OTBDPS
MeO,C OBn 0 \.....\.2z Me02C OBn
Lev0
Air7/
Bn0 N3 OC(NH)CCI3
HO Bn0
Z-HN Me
Ac0 27 Ac0 58
OTBDPS
OAc
0 MeO2c/z()7 0
Me02C OBn OBn
Lev0
Air7/
0
Bn0
N3
AcO Bn0
Z-HN OMe
Ac0 91
OTBDPS
OAc
0 Me02C0Bn 0
Me02C OBn
HO
0
Bn0
N3
AcO Bn0
Z-HN OMe
Ac0 92
OAc
Me02C
Lev0
Bn0 N OC(NH)CCI3
3
Ac0 27
Y
O
OAc
2C 0
OAc OBn 0
0 Mez
OBn 0
0 Me02A)07/C
Me02C OBn 0 Bn0
Lev0
Aii)07/
N3 0 Bn0
N3 0
/Ac07 Z-HN OMe
Ac0 Ac0 93
OBn
HO
OAc OTBDPS
0
OAc OBn 0
0 Me02z(6 Z-HN C
OBn 0
0 Me02CA)07/
Me00 Bn0 OMe
2CA/ ii)07
0
N3
AcO Bn0
N0"'
Ac0
Ac0 94
OTBDPS
Me02CR OBn
Bn0
ty/
Bn0 N OC(NH)CCI3
3
Ac0 71
OTBDPS OTBDPS
0
OAc OAc Me02C OBn 0
0 Me02C OBn
0 Me02C OBn 0 s Bn0
Z-HN Me
7
Me02C
Bn0 0
Bn0
N 0
A OBn
3
Ac0
95 Ac0 N3
Ac0
Ac0
OH OTBDPS
0
OH Me0 C OBn
OTBDPS 0 Me02C OBn 0 2 so 0
0 Me0 C OBn 0
Me02C OBn 2/ZZey,0
7-117 Bn0 0
Bn0 0
0 Bn0 Bn0 Z-HN OMe
N3
Bn0 0
N3
96 N3
HO H: HO HO
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
56
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-
(1-4)-
3-0-benzy1-6-0-tert-butyldi phénylsilyle-2-désoxy-2-Rbenzyloxy)carbonyllam ino-
a-D-
glucopyranoside (n 91)
Une solution de triflate de tert-butyldiméthylsilyle dans du dichlorométhane
(1M,
0,15 mole par mole d'imidate) est ajoutée, sous argon, à - 20 C, à une
solution de
l'imidate 27 (3.26 g, 3.62 mmol) et d'accepteur de glycosyle 58 (3.22 g, 3.29
mmol)
dans du dichlorométhane (115 mL) en présence de tamis moléculaire 4 A (2.5 g).
Après 1h40 à -20 C (CCM), on ajoute de l'hydrogénocarbonate de sodium solide.
Après filtration, lavage par une solution aqueuse d'hydrogénocarbonate de
sodium à
2%, par une solution aqueuse de chlorure de sodium, puis séchage (Na2SO4) et
évaporation à sec, le résidu est purifié sur gel de silice (toluène-acétone)
pour conduire
à 91(4.66 g, 83%).
Rf = 0.49 (toluène-acétone 7/3).
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-6-0-tert-
butyldiphénylsilyle-2-désoxy-2-Rbenzyloxy)carbonyllamino-a-D-qlucopyranoside
(n 92)
A une solution du composé 91 (4.66 g, 2.71 mmol) dans un mélange 1:2
toluène/éthanol (542 mL) est ajouté de l'acétate d'hydrazine (1.2 g, 5
équivalents
molaire). Après 2h d'agitation magnétique, la même quantité de réactif est
rajoutée et
après 2h, le mélange est concentré sous vide puis purifié sur gel de silice
(toluène-
acétone) pour donner le composé 92 (3.83 g, 87%).
Rf = 0.42 (toluène-acétone 3/1).
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-
butyldiphénylsilyle-2-désoxy-2-Rbenzyloxy)carbonyllamino-a-D-qlucopyranoside
(n 93)
Une solution de triflate de tert-butyldiméthylsilyle dans du dichlorométhane
(1M,
0,15 mole par mole d'imidate) est ajoutée, sous argon, à - 20 C, à une
solution de
l'imidate 27 (3.2 g, 3.55 mmol) et d'accepteur de glycosyle 92 (3.83 g, 2.36
mmol) dans
du dichlorométhane (106 mL) en présence de tamis moléculaire 4 A (1.8 g).
Après 2.5h
à -20 C (CCM), on ajoute de l'hydrogénocarbonate de sodium solide. Après
filtration,
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
57
lavage par une solution aqueuse d'hydrogénocarbonate de sodium à 2%, par une
solution aqueuse de chlorure de sodium, séchage (Na2SO4) et évaporation à sec,
le
résidu est purifié sur gel de silice (acétate d'éthyle/toluène) pour conduire
à 93 (3.36 g,
61%).
Rf = 0.47 (toluène-acétate d'éthyle 1/1).
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosylu ronate)-(1-4)-(6-0-acéty1-2-azido-3-0-
benzy1-2-
désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-désoxy-2-
1(benzyloxy)carbonyllamino-a-D-qlucopyranoside (n 94)
A une solution du composé 93 (3.36 g, 1.42 mmol) dans un mélange 1:2
toluène/éthanol (280 mL) est ajouté de l'acétate d'hydrazine (0.645 g, 4.93
équivalents
molaire). Après 2.5h d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 94 (3.01 g, 96%).
Rf = 0.43 (toluène-acétone 4/1).
Préparation du méthyl (méthyl 2-
0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-
(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-(6-0-acéty1-2-azido-3-0-
benzy1-2-
désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-désoxy-2-
1(benzyloxy)carbonyllamino-a-D-qlucopyranoside (n 95)
Une solution 0.1M de triflate de tert-butyldiméthylsilyle dans du
dichlorométhane
(1 mL) est ajoutée, sous argon, à - 20 C, à une solution de l'imidate 71(0.29
g, 0.3
mmol) et d'accepteur de glycosyle 94 (3.01 g, 1.33 mmol) dans du
dichlorométhane (60
mL) en présence de tamis moléculaire 4 A (0.93 g). Après 10 min d'agitation
magnétique à -20 C (CCM), de l'imidate 71 est à nouveau ajouté à intervalle de
temps
compris entre 10 min et 2.5h, jusqu'à une quantité totale de 3.19 g. Après 20h
à -20 C
(CCM), de l'hydrogénocarbonate de sodium solide est additionné jusqu'à
neutralisation, et après filtration, lavage par une solution aqueuse
d'hydrogénocarbonate de sodium à 2%, par une solution aqueuse de chlorure de
sodium, séchage (Na2SO4) et évaporation à sec, le résidu est purifié sur gel
de silice
pour conduire à 95 (2.58 g, 61%).
Rf = 0.45 (toluène-acétone 4/1).
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
58
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(1-4)-
(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-
a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-
azido-3-
0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-désoxy-2-
1(benzyloxy)carbonyllamino-a-D-qlucopyranoside (n 96)
A une solution de 95 (1.18 g, 0.37 mmol) dans un mélange 3/2 de
méthanol/dichlorométhane (111 mL) est ajoutée une solution méthanolique 1M de
méthylate de sodium (1.1 mL), en présence de tamis moléculaire 3 A (463 mg).
Après
agitation pendant 20 h à température ambiante, le mélange est neutralisé par
de la
résine H+ Dowex 50WX4. Après filtration et concentration le résidu est purifié
sur gel
de silice avec un mélange toluène/acétone pour fournir le composé 96 (773 mg,
77%).
Rf = 0.51 (toluène-acétone 4/1).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
59
OTBDPS
OH 0
OH
0 TBDPS 0 MeO2C/z(0;70
0 gn0 OMe
0 Me02C/z<0;71 /
Z-HN
Me02C OBn 0 0 Bn0
N, 0
0 Bn0
N3 0 HO
Bn0
7=<.t,.07 Bn0
N3 0 HO
HO 96
HO
OSO, OTBDPS
OSO,
OTBDPS 0 Me02C/z<B,11
0
0 Me02C/z<0;7 0 0 Bn0 OMe
Me02C OBn 0 0 Bn0 NHZ
0 Bn0
N3 07 03S0 sel de
triéthylammonium
Ai7ign0
N3 0 03S0
Bn0 03S0
03S0 97
oso3 OH
OSO,
OH 0 Me02C/z(B),1
2C 0
0 MeO/Ç 0 0 Bn0 OMe
Me02C OBn 0 0 Bn0 NHZ
N3 0
0 Bn0 7
N3 0 -03SO sel
d'ammonium
A
N 0 03S0
Bn0VBn0 3 03S0
03S0 98
oso3Li OH
OSO,Li
OH 0 LiO2C/zSB> 0
0 LiO2C/z<7/ 0 0 Bn0 OMe
LiO2C OBn 0;
B nO Bn0 0 0 Bn0 NHZ
0 LiO2C/OBn
N3 0
0
N3 0 LiO3S0
A)7.0
N3 0 LiO3S0
Bn0 LiO,S0
LiO,S0 99
OSO,Na OH
OSO,Na 0 Na02C/z<;477/
OH 0 Na0207.<;
C 7 0
0 Na02/z<0:1)7/ 0 0 H0 OMe
NH2
Na02C OH 0 0 HO
NH20
0 HO
NH20 Na03S0
7 H0
0
NH2 Na03S0
HO/ Na03S0
Na03S0 100
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium sulfonato-
a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsilyle-2-
désoxy-a-D-dlucopyranosyl)-(1-4)-(méthyl 3-
0-benzy1-2-0-triéthylammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-
dlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-dlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyluronate)-(1-4)-3-0-
benzy1-6-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
0-tert-butyldiphénylsilyle-2-désoxy-2-Rbenzyloxy)carbonyllamino-a-D-
qlucopyranoside
(n 97)
On ajoute du complexe triéthylamine/trioxyde de soufre (761 mg, 5 moles par
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (11 mL, 90
L/mol) du
5 composé 96 (324 mg, 120 pmol). Après 17 heures d'agitation magnétique
à 55 C à
l'abri de la lumière, on ajoute à 0 C du méthanol et après 0.5 h d'agitation à
0 C puis
0.5 h à température ambiante, le milieu réactionnel est dilué par du méthanol
puis
purifié à l'aide d'une colonne LH-20 en utilisant un mélange 1:1
méthanol/dichlorométhane comme éluant. Les fractions contenant le produit sont
alors
10 concentrées sous vide poussé et, si nécessaire, remises à réagir
dans les mêmes
conditions. Le composé obtenu 97 est alors directement engagé dans l'étape
suivante.
Rf = 0.5 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du méthyl (méthyl 2-0-ammonium sulfonato-3,4-di-O-benzyl-a-L-
15 idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-
ammonium sulfonato-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl
2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-ammonium
su Ifonato-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
20 ammonium su
Ifonato-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-2-
désoxy-2-Rbenzyloxy)carbonyllam ino-a-D-qlucopyranoside (n 98)
A une solution du composé 97 précédemment obtenu dans du méthanol (16
mL) est ajouté du fluorure d'ammonium (361 mg, 80 équivalents molaires). Après
agitation magnétique à 55 C pendant 48 h, le mélange réactionnel est purifié à
l'aide
25 d'une colonne LH-20 en utilisant un mélange 75/20/5 méthanol/N,N-
diméthylformamide/eau comme éluant. Les fractions contenant le produit sont
alors
concentrées sous vide poussé pour fournir le composé 98 (410 mg, 95%, 2
étapes).
Rf = 0.28 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
30 Préparation du méthyl (3,4-di-O-benzy1-2-0-lithium
sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-
glucopyranosyl)-(1-4)-(3-0-benzy1-2-0- lithium sulfonato-a-L-
idopyranosyluronate de
35 lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-
glucopyranosyl)-(1-4)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-a-D-
qlucopyranoside
(n 99)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
61
A une solution du composé 98 (202 mg, 57 pmol) dans un mélange 1:1
méthanol/tétrahydrofurane (9 mL) est ajoutée, goutte à goutte et à 0 C, une
solution
aqueuse 1N de LiOH (1.8 mL, 7.9 équivalents/fonction ester méthylique). Après
1h
d'agitation à 0 C, puis 16 h à température ambiante, le milieu réactionnel est
purifié à
l'aide d'une colonne LH-20 en utilisant un mélange 75/20/5 méthanol/N,N-
diméthylformamide/eau comme éluant. Les fractions contenant le produit sont
alors
concentrées sous vide poussé pour conduire au composé désiré 99 qui est
directement engagé dans l'étape suivante.
Rf = 0.41 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16)
Préparation du méthyl (2-0-lithium sulfonato-a-L-idopyranosyluronate de
lithium)-(1-4)-(2-amino-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(2-0-lithium
sulfonato-a-
L-idopyranosyluronate de lithium)-(1-4)-(2-amino-2-désoxy-6-0-lithium
sulfonato-a-D-
glucopyranosyl)-(1-4)-(2-0-lithium sulfonato-a-L-idopyranosyluronate de
lithium)-
(1-4)-(2-amino-2-désoxy-6-0-lithium sulfonato-a-D-qlucopyranosyl)-(1-4)-(2-0-
lithium
sulfonato-a-L-idopyranosyluronate de
lithium )-(1-4)-2-amino-2-désoxy-a-D-
glucopyranoside (n 100)
A une solution dans un mélange 1:1 tert-butanol/eau (13 mL) du composé 99
précédemment obtenu sont ajoutés successivement du formiate d'ammonium (529
mg,
8.4 mmol) puis du Pd/C 10% (1.24 g). Après 4h15 d'agitation vigoureuse à
température
ambiante, le milieu réactionnel est filtré, partiellement concentré sous vide,
puis on
dépose la solution au sommet d'une colonne de Sephadex G-25 éluée par du
chlorure de sodium 0,2 M. On concentre les fractions contenant le produit et
on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 100
(78
mg, 66%, 2 étapes).
Masse : méthode "ESI", mode négatif : masse théorique = 1992.8 ; masse
expérimentale [M ¨ Na ¨ H] : 1971.03 0.10 u.m.a. (acides iduroniques
observés sous
forme COOH).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
62
OTBDPS
OH
OH 0 Me0,c/z<4477/0Bn
OTBDPS 0 Me02C/z<44,07/0Bn 0
0 Me02;z<44)7/0Bn
7 0 0 Bno OMe
Z-HN
Me02C OBn 0 .0 Bn0 0
µ0 Bn0 3 0 N3
HO
N
0 HO
N3
Bn0 HO 96
HO
OHOH
OH
OTBDPS 0 Me02C/z<44,07/0Bn 0
0 Me02C/z(y/OBn 0 0 Bno OMe
Z-HN
Me02C OBn 0 .0 Bn0 0
7 µ0 Bn0 0 N3
HO
N
0 3 HO
N3
Bn0 HO 10 1
HO
OS03
OS03-
0S03
Me020Bn
OTBDPS OBn
0 2/z(44,7 0
0 Me02C/4.;71 0 0 Bn0
0
Me0C
OMe
NHZ
Me02C OBn 0 µ0 Bn0 0
µ0 Bn0 N3 _
A.07/Bn0 N3 03S0 sel de
triéthylammonium
O 03SO
N3
Bn0 03S0 102
03SO
OS03 OS03
OS03
OH 0 Me02C0Bn 0
0 Me027.../y/OBn 0 0 Bn0 OMe
Me02C7 OBn 0 .0 Bn0 0
03S0 NHZ
µ0 Bn0 0 N3 _
¨.74;7/ Bn0 N3 sel d'ammonium
O
03SO
N3
Bn0 03SO
03S0 103
oso3Li osop
OSO3Li
OH 0 LiO2C/z(B;71 0
0 LiO2C/z(13,117 0 0 Bn0
0 LiO2C0Bn
Nee
0 .0 Bn0
LiO2C OBn 0
N3
µ0 Bn0 0 LiO3S0
7*e*-1;.0/ Bn0 0 N3
LiO3S0
,7
N3
Bn0 LiO3S0 104
Lio3so
OSO3Na
OSO3Na
OH 0
OSO3Na Na02C/z(04;7/0 0 0
H
0 Na02C/z<OÇ7 0 Ho OMe
0 Na02C/z<OH
N3
Na02C OH
7
NH
µ0 HO
NH30 Na03S0
NH30 Na03S0
HO Na03S0 105
Na03S0
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(1-4)-
(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-désoxy-a-D-glucopyranosyl)-
(1-4)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-
a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
63
0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-
0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyl1amino-a-D-
glucopyranoside (n 101)
A une solution du composé 96 (570 mg, 194 pmol) dans du méthanol (66 mL)
est ajouté du fluorure d'ammonium (575 mg, 80 équivalents molaires). Après
agitation
magnétique à température ambiante pendant 14 h, le mélange réactionnel est
concentré sous vide puis purifié sur colonne de silice (toluène/acétone) pour
fournir le
composé 101 (282 mg, 54%).
Rf = 0.37 (toluène-acétone 7/3).
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium sulfonato-
a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsilyle-2-
désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-
0-benzy1-2-0-triéthylammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-3-0-
benzy1-2-
désoxy-2-Rbenzyloxy)carbonyllam ino-6-0-triéthylam mon iu m
sulfonato-a-D-
glucopyranoside (n 102)
On ajoute du complexe triéthylamine/trioxyde de soufre (376 mg, 5 moles par
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (5.3 mL, 90
L/mol)
du composé 101 (160 mg, 59 pmol). Après 17 heures d'agitation magnétique à 55
C à
l'abri de la lumière, on ajoute à 0 C du méthanol et après 0.5 h d'agitation à
0 C puis
0.5 h à température ambiante, le milieu réactionnel est dilué par du méthanol
puis
purifié à l'aide d'une colonne LH-20 en utilisant un mélange 1:1
éthanol/dichlorométhane comme éluant. Les fractions contenant le produit sont
alors
concentrées sous vide poussé. Le composé obtenu est alors directement engagé
dans
l'étape suivante.
Rf = 0.52 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du méthyl (méthyl 2-0-ammonium sulfonato-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-
4)-
(méthyl 2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-
ammonium sulfonato-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl
2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-ammonium
su Ifonato-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
ammonium
sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-6-0-ammonium
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
64
sulfonato-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-a-D-qlucopyranoside
(n 103)
A une solution du composé 102 précédemment obtenu dans du méthanol (2.5
mL) est ajouté du fluorure d'ammonium (42 mg, 60 équivalents molaires). Après
agitation magnétique à température ambiante pendant 3h, à 45 C pendant 18 h,
puis à
55 C pendant 4 h, du fluorure d'ammonium (14 mg, 20 équivalents molaires) est
à
nouveau ajouté, et le mélange réactionnel est agité pendant 24h à 55 C puis à
température ambiante pendant 60h. Le mélange réactionnel est ensuite purifié à
l'aide
d'une colonne LH-20 en utilisant un mélange 75/20/5 méthanol/N,N-
diméthylformamide/eau comme éluant. Les fractions contenant le produit sont
alors
concentrées sous vide poussé pour fournir le composé 103 (35 mg, 54%).
Rf = 0.54 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du méthyl (3,4-di-O-benzy1-2-0-lithium
sulfonato-a-L-
idopyranosyluronate de lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-
glucopyranosyl)-(1-4)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-
glucopyranosyl)-(1-4)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-6-0-lithium
sulfonato-a-D-qlucopyranoside (n 104)
A une solution du composé 103 (155 mg, 41.6 pmol) dans un mélange 1:1
méthanol/tétrahydrofurane (7 mL) est ajoutée, goutte à goutte et à 0 C, une
solution
aqueuse 1N de LiOH (1.4 mL, 8.4 équivalents/fonction ester méthylique). Après
1h
d'agitation à 0 C, puis 15 h à température ambiante, le milieu réactionnel est
purifié à
l'aide d'une colonne LH-20 en utilisant un mélange 95/5 méthanol/eau comme
éluant.
Les fractions contenant le produit sont alors concentrées sous vide poussé
pour
conduire au composé désiré 104 (114 mg, 90%).
Rf = 0.25 (AcOEt-pyridine-Ac0H-H20 11/7/1.6/4).
Préparation du méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(1-4)-(2-amino-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(2-0-sodium su
lfonato-
a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium
sulfonato-
a-D-qlucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(1-4)-(2-amino-2-désoxy-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-(1-4)-(2-
0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-2-amino-2-désoxy-6-0-
sodium sulfonato-a-D-qlucopyranoside (n 105)
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
A une solution dans un mélange 1:1 tert-butanol/eau (8 mL) du composé 104
(110 mg, 36 pmol) sont ajoutés successivement du formiate d'ammonium (298 mg,
4.72 mmol) puis du Pd/C 10% (715 mg). Après 4h15 d'agitation vigoureuse à
température ambiante, le milieu réactionnel est filtré, partiellement
concentré sous vide,
5 puis on dépose la solution au sommet d'une colonne de Sephadex G-25
éluée par du
chlorure de sodium 0,2 M. On concentre les fractions contenant le produit et
on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 105
(63
mg, 80%).
10 Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.08
IdoUAvIll, 5.23* Glcvll, 5.14 IdoUAvI, 5.24* Glcv, 5.14 IdoUe, 5.24* Gel, 5.14
IdoUAll,
4.73 GIcI
* : Les signaux peuvent être interchangés.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
66
OTBDPS
OTBDPS
OAc
0
Me02C/z).007/0Bn 0
Bn0 OMe
Ac0
0 \Me02C/z44.)D7OBn
Bn0 OC(NH)CCI3 Z-HN
N3 Me02C OBn Bn0 0
Lev0 N3
HO
Ac0
63 Ac0 92
OTBDPS
OAc
0
OTBDPS
2A)07/
0 Me02C/z<0;71 0 _..,;\r'
Me0 C OBn
0 Bn0 OMe
Z-HN
Me02C OBn
Bn0 0
/7---. 0 N3
Ac0
N3
Lev0 0 Ac0
Ac0 106
OTBDPS
OAc
0
OBn
OTBDPS
OBn 2 Bn0 OMe
7.(tie7/
0 Me02C/o.,.µ-\:\r'
Me02C OBn Me0 C
0
Z-HN
Bn0 0
7¨' Ac0
Bn0 0 N3
N3
HO Ac0
Ac0 107
OAc
Me02C/zçjc/OBn
Bn0 0 __......\....\0
Bn0 OC(NH)CCI3
N3
Ac0 38
OTBDPS
OAc
OTBDPS
0
OAc OMe
Z-HN Me02C/4440;70 0 Me0277/C OBn 0
0 0
Me02C OBn 0
Bn0
t).0
N3 µ0 Bn0 Bn0 Ac0
N3
Ac0
Ac0 N3
Bn0/z<7/ 108
Ac0
OTBDPS
OH
OTBDPS
0
OH 0 Me02C/z(0;71
OMe
Z-HN Me02C/4440;70 0 Me02/z(y/C OBn 0
Me02C OBn 0 Bn0 0
N3
µ0 Bn0 0 HO
/7--'.7 Bn0 N 0 N3
HO
3
Bn0 HO
HO 109
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évu linoyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-tert-
butyldiphénylsilyle-
a-D-glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-
(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosyl)-(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-6-0-tert-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
67
butyldiphénylsilyle-2-désoxy-2-Rbenzyloxy)carbonyllamino-a-D-qlucopyranoside
(n 106)
Une solution de triflate de tert-butyldiméthylsilyle (1M, 0,2 mole par mole
d'imidate) dans du dichlorométhane est ajoutée, sous argon, à - 15 C, à une
solution
de l'imidate 63 (0.59 g, 0.54 mmol) et d'accepteur de glycosyle 92 (0.58 g,
0.36 mmol)
dans du dichlorométhane (25 mL) en présence de tamis moléculaire 4 A (0.4 g).
Après
45 min à -15 C (CCM), on ajoute à nouveau de l'imidate 63 (0.39 g, 0.35 mmol)
puis du
triflate de tert-butyldiméthylsilyle dans du dichlorométhane (1M, 1.1 mL).
Après 1h10 à
-15 C (CCM), de l'hydrogénocarbonate de sodium solide est additionné jusqu'à
neutralisation. Après filtration, lavage par une solution aqueuse
d'hydrogénocarbonate
de sodium à 2%, séchage (Na2SO4) et évaporation à sec, le résidu est purifié à
l'aide
d'une colonne LH-20 en utilisant un mélange 1/1 éthanol/dichlorométhane comme
éluant. Les fractions contenant le produit sont alors concentrées sous vide
poussé puis
le résidu est purifié sur gel de silice (acétate d'éthyle/toluène) pour
conduire à 106
(0.69 g, 75%).
Rf = 0.16 (toluène ¨ acétone 9/1).
Préparation du méthyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-tert-butyldiphénylsilyle-a-D-
qlucopyranosyl)-
(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-acéty1-
2-
azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-
désoxy-2-
1(benzyloxy)carbonyllamino-a-D-qlucopyranoside (n 107)
A une solution du composé 106 (1.41 g, 0.552 mmol) dans un mélange 1:2
toluène/éthanol (110 mL) est ajouté de l'acétate d'hydrazine (0.254 g, 2.76
équivalents
molaire). Après 2h40 d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 107 (1.15 g, 85%).
Rf = 0.16 (toluène ¨ acétone 9/1).
Préparation du méthyl (méthyl 2-0-acéty1-
3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(2-azido-3-0-benzy1-2-désoxy-6-0-tert-butyldiphénylsilyle-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-acéty1-2-
azido-3-
0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-désoxy-2-
1(benzyloxy)carbonyllamino-a-D-qlucopyranoside (n 108)
Une solution 0.1M de triflate de tert-butyldiméthylsilyle dans du
dichlorométhane
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
68
(1.1 mL) est ajoutée, sous argon, à - 20 C, à une solution de l'imidate 38
(0.67 g, 0.75
mmol) et d'accepteur de glycosyle 107 (1.23 g, 0.49 mmol) dans du
dichlorométhane
(32 mL) en présence de tamis moléculaire 4 A (0.55 g). Après 1.5 h à -20 C
(CCM), de
l'hydrogénocarbonate de sodium solide est additionné jusqu'à neutralisation,
et après
filtration, lavage par une solution aqueuse d'hydrogénocarbonate de sodium à
2%,
séchage (Na2SO4) et évaporation à sec, le résidu est purifié à l'aide d'une
colonne LH-
20 en utilisant un mélange 1/1 éthanol/dichlorométhane comme éluant. Les
fractions
contenant le produit sont alors concentrées sous vide poussé puis le résidu
est purifié
sur gel de silice pour conduire à 108 (0.93 g, 59%).
Rf = 0.24 (cyclohexane ¨ acétone 7/3).
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(1-4)-
(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-
0-benzyl-a-L-
idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldi phénylsilyle-
2-désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-
azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-
0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-désoxy-2-
1(benzyloxy)carbonyllamino-a-D-qlucopyranoside (n 109)
A une solution de 108 (1.17 g, 0.36 mmol) dans un mélange 3/2 de
méthanol/dichlorométhane (109 mL) est ajoutée une solution méthanolique 1M de
méthylate de sodium (1.6 mL), en présence de tamis moléculaire 3 A (458 mg).
Après
agitation pendant 18 h à température ambiante, le mélange est neutralisé par
de la
résine H+ Dowex 50WX4. Après filtration et concentration le résidu est purifié
sur gel
de silice avec un mélange cyclohexane/acétate d'éthyle pour fournir le composé
109
(680 mg, 69%).
Rf = 0.34 (toluène ¨ acétone 7/3).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
69
OTBDPS
OH
0
OTBDPS
OH 0 Me02C/,/, 0
0 Bn0 OMe
0 Me02C/z<B:7 Z-HN
Me02C OBn 0 0 Bn0 0
N3
0 Bn0 0
7/Bn0 0 N3 HO
N3
Bn0 HO 109
HO
HO
OS03 OTBDPS
OTBDPS 0 N3 /Z Me02C/z<B,>,
0 Me02C/z<B,>, 0
0 Me02C/z<0;71 0 Bn0 OMe
Me02C OBn 0 0 Bn0 0 NHZ
OS03
0 Bn0 0 N3
03S0 sel de
triéthylammonium
. / Bn0 0 N3
03SO
Bn0 03S0
03SO 110
OS03 OH
OH
OS03 0 Me02C7(0:4)>,
0 0 Bn0 OMe
0 OBn sel
OBn 0 0 Bn0 0 NHZ
0 Bn0 0 N3
03SO
7(....77.0 Bn0 0 N3 sel d'ammonium
03S0
N3
Bn0 03S0
03S0 111
OH
OSO3Li
OH Li0 C OBn
0 ----00 \""=-\\
0 2 s
OSO3Li 0 LiO2CÇo____&00\....\\
0 LiO2C/z, 0 Bn0 OMe
LiO2C OBn <B> 0 / 0 Bn0 0 NHZ
0 Bn0 0 N3
LiO3S0
7% LiO3S0Bn0 0 N3
N3
Bn0 LiO3S0
LiO3S0 112
OSO3Na OH
0
OH Na0 C OH
OSO3Na
0 2 so Ho
OMe
NH2
0 HO
NH20
Na03S0
NaO2C OH 0 0 Na02c/zel,-710
HO 0 HO
7s7/
NH2
Na03SO H NH2
Na03S0
Na03S0 113
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium sulfonato-
a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium
sulfonato-a-D-dlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-
triéthylammonium
su Ifonato-a-L-idopyranosylu ronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldi phénylsilyle-a-D-dlucopyranosyl)-(1-4)-(méthyl 3-
0-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylam mon iu m sulfonato-a-D-
dlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-3-0-
benzy1-2-
désoxy-2-Rbenzyloxy)carbonyllamino-6-0-tert-butyldiphénylsilyle-a-D-
dlucopyranoside
(n 110)
On ajoute du complexe triéthylamine/trioxyde de soufre (267 mg, 5 moles par
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (4.4 mL, 90
L/mol)
du composé 109 (144 mg, 49 pmol). Après 16 heures d'agitation magnétique à 55
C à
l'abri de la lumière, on ajoute à 0 C du méthanol et après 0.5 h d'agitation à
0 C puis
0.5 h à température ambiante, le milieu réactionnel est dilué par du méthanol
puis
5 purifié à l'aide d'une colonne LH-20 en utilisant un mélange 1:1
méthanol/dichlorométhane comme éluant. Les fractions contenant le produit sont
ensuite concentrées sous vide poussé. Le composé obtenu est alors directement
engagé dans l'étape suivante.
Rf = 0.42 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-ammonium sulfonato-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-ammonium sulfonato-
a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
sulfonato-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzyl-a-D-qlucopyranosyl)-(1-4)-
(méthyl 3-
0-benzy1-2-0-ammonium su
lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-
benzy1-2-désoxy-6-0-ammoni um sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-ammonium su
lfonato-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-2-
désoxy-2-Rbenzyloxy)carbonyllamino-a-D-qlucopyranoside (n 111)
A une solution du composé 110 précédemment obtenu dans du méthanol (5
mL) est ajouté du fluorure d'ammonium (133 mg, 80 équivalents molaires). Après
agitation magnétique à 55 C pendant 48 h, le mélange réactionnel est purifié à
l'aide
d'une colonne LH-20 en utilisant un mélange 95/5 méthanol/eau comme éluant.
Les
fractions contenant le produit sont alors concentrées sous vide poussé. Si
nécessaire,
le brut réactionnel est engagé et traité à nouveau dans les mêmes conditions
pour
fournir le composé 111 (117 mg, 85%, 2 étapes).
Rf = 0.31 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du méthyl (3,4-di-O-benzy1-2-0-lithium
sulfonato-a-L-
idopyranosyluronate de
lithium )-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lith iu m
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-
glucopyranosyl)-(1-4)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-a-D-
qlucopyranoside
(n 112)
A une solution du composé 111 (80 mg, 22.3 pmol) dans un mélange 1:1
méthanol/tétrahydrofurane (3.6 mL) est ajoutée, goutte à goutte et à 0 C, une
solution
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
71
aqueuse 1N de LiOH (0.7 mL, 7.8 équivalents/fonction ester méthylique). Après
2h45
d'agitation à 0 C, puis 17.5 h à température ambiante, le milieu réactionnel
est purifié à
l'aide d'une colonne LH-20 en utilisant un mélange 75/20/5 méthanol/N,N-
diméthylformamide/eau comme éluant. Les fractions contenant le produit sont
alors
concentrées sous vide poussé pour conduire au composé désiré 112 (64 mg, 98%).
Rf = 0.25 (AcOEt-pyridine-Ac0H-H20 56/32/7.6/18).
Préparation du méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(1-4)-(2-amino-2-désoxy-6-0-sod iu m su Ifonato-a-D-qlucopyranosyl)-
(1-4)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(1-4)-(2-amino-2-désoxy-6-0-sodium su
Ifonato-a-D-qlucopyranosyl)-(1-4)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-2-amino-2-désoxy-a-D-
glucopyranoside (n 113)
A une solution dans un mélange 1:1 tert-butanol/eau (4.3 mL) du composé 112
(64 mg, 21.7 pmol) sont ajoutés successivement du formiate d'ammonium (178 mg,
2.8
mmol) puis du Pd/C 10% (0.42 g). Après 4h30 d'agitation vigoureuse à
température
ambiante, le milieu réactionnel est filtré, partiellement concentré sous vide,
puis on
dépose la solution au sommet d'une colonne de Sephadex G-25 éluée par du
chlorure de sodium 0,2 M. On concentre les fractions contenant le produit et
on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 113
(29.5
mg, 65%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.18
IdoUAvIll, 5.43 Glcvll, 5.24 IdoUAvI, 5.45 Glcv, 5.25 IdoUe, 5.43 Gle, 5.26
IdoUAll, 5.01
GIcI
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
72
OTBDPS
OH 0
OBn
OTBDPS , Me0 C
OH 0 Me02c0Bn
0 Me02C0Bn Bn0 OMe
MeO2C OBn 0 .0 Bn0 0 Z-HN
0 µ0 Bn0 0 N3
HO
N3
7--- .(e4.I7/ Bn0 0 HO
N3
Bn0 HO 109
HO
OH
OH 0
OBn
OTBDPS 0 MeO2C 0
OH 0 Me02cOBn
O ..0 Bno OMe
Z-HN
MeO2C OBn 0 Me02COBno
Bn0 N3 HO
0 Bn0 0
Bn0 0
:0
O Bn0
7...<4.4,7
N3 0 0 0
114 HO N3
HO
OS03
OS03 0
OBn
OTBDPS 0 Me02c/z<s)7
OS03 0 Me02c/z(\OBn
O 0 Bn0 OMe
NHZ
MeO2C< N3 OBn 0 Me02C7.70Bno 0 Bn0 0
Bn0 0
03:0
O Bn0
7..4.4,7
i/
N3 0
Bn0
0
03SO N3
03SO
sel de triéthylammonium
o3so 115
oso3 oso3
0
OBn
OH 0 Me02c/z<s)7
OS0 c
3 0 Me02/z<s0Bn
O 0 Bn0 OMe
NHZ
MeO2C OBn 0 Me02C/770Bno 0 Bn0 0
Bn0 0
O Bn0
7..< "7
4.4,7
N3 0
03:0 Bn0
N3 0
03s0 N3
03SO sel d'ammonium
o3so 116
oso3Li oso3Li
0
OH
c
OSO3Li OBn
0 LiO2s
OBn
0 LiO2C/z(\i/ 0 0 Bn0
0 LiO2C/z(s)70Bn
OMe
Li02C OBn 0 0 Bn0 0
LiO3S0
NHZ
/z<)7
N3
Bn0 0
O Bn0
/z<e4e.)7/
N3 0
LiO3L Bn0
0
LiO3S0 N3
117
Lio3so
oso3Na OSO3Na
0
OH 0 NaO2C/z<;7
<
OSO3N a 0 Na02C7..o 0 H0 OMe
0 Na02C/z<H)70 NH2
NaO2C OH 0 µ0 HO
NH20
0 HO
7....//
NH
HO 20
Na03SOC) HO NH20
Na03S0 Na03S0
O
Na03S0 118
Préparation du méthyl (méthyl 3,4-di-O-benzyl-a-L-idopyranosyluronate)-(1-4)-
(2-azido-3-0-benzy1-2-désoxy-a-D-glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsilyle-2-
désoxy-
a-D-glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-
(1¨>4)-(2-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
73
azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-
0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyl1amino-a-D-
glucopyranoside (n 114)
A une solution du composé 109 (135 mg, 46 pmol) dans du méthanol (16 mL)
est ajouté du fluorure d'ammonium (136 mg, 80 équivalents molaires). Après
agitation
magnétique à température ambiante pendant 9 h, puis à -25 C pendant 15h, le
mélange réactionnel est concentré sous vide puis purifié sur colonne de silice
(toluène/acétone) pour fournir le composé 114 (57 mg, 46%).
Rf = 0.30 (toluène-méthanol 85/15).
Préparation du méthyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium sulfonato-
a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium
sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-
0-benzy1-2-0-triéthylammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsilyle-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-3-0-
benzy1-2-
désoxy-2-Rbenzyloxy)carbonyllam ino-6-0-triéthylam mon iu m
sulfonato-a-D-
glucopyranoside (n 115)
On ajoute du complexe triéthylamine/trioxyde de soufre (317 mg, 5 moles par
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (4.5 mL, 90
L/mol)
du composé 114 (135 mg, 50 pmol). Après 16 heures d'agitation magnétique à 55
C à
l'abri de la lumière, on ajoute à 0 C du méthanol et après 0.5 h d'agitation à
0 C puis
0.5 h à température ambiante, le milieu réactionnel est dilué par du méthanol
puis
purifié à l'aide d'une colonne LH-20 en utilisant un mélange 1:1
éthanol/dichlorométhane comme éluant. Les fractions contenant le produit sont
alors
concentrées sous vide poussé. Le composé 115 (168 mg, 86%) est alors obtenu.
Rf = 0.29 (AcOEt-pyridine-Ac0H-H20 56/32/7.6/18).
Préparation du méthyl (méthyl 2-0-ammonium sulfonato-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-ammonium su Ifonato-2-azido-3-0-benzy1-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-ammonium
sulfonato-3-0-benzyl-a-L-
idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(6-0-
ammonium sulfonato-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl
2-0-ammonium sulfonato-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-6-0-ammonium
su Ifonato-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllam ino-a-D-
qlucopyranoside
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
74
(n 116)
A une solution du composé 115 (168 mg, 43 pmol) dans du méthanol (5.6 mL)
est ajouté du fluorure d'ammonium (128 mg, 80 équivalents molaires). Après
agitation
magnétique à 55 C pendant 48 h, le mélange réactionnel est purifié à l'aide
d'une
colonne LH-20 en utilisant un mélange 95/5 méthanol/eau comme éluant. Si
nécessaire, le résidu peut être engagé dans les mêmes conditions en contrôlant
l'avancement de la réaction (CCM) et purifié de la même manière. Les fractions
contenant le produit sont alors concentrées sous vide poussé pour fournir le
composé
116 (109 mg, 81%).
Rf = 0.21 (AcOEt-pyridine-Ac0H-H20 56/32/7.6/18).
Préparation du méthyl (3,4-di-O-benzy1-2-0-lithium
sulfonato-a-L-
idopyranosyluronate de
lithium )-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lith iu m
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
sulfonato-a-D-
glucopyranosyl)-(1-4)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-6-0-lithium
sulfonato-a-D-qlucopyranoside (n 117)
A une solution du composé 116 (89 mg, 28.5 pmol) dans un mélange 1:1
méthanol/tétrahydrofurane (3.8 mL) est ajoutée, goutte à goutte et à 0 C, une
solution
aqueuse 1N de LiOH (0.7 mL). Après 3h d'agitation à 0 C, puis 19h à
température
ambiante, le milieu réactionnel est purifié à l'aide d'une colonne LH-20 en
utilisant un
mélange 75/20/5 méthanol/N,N-diméthylformamide/eau comme éluant. Les fractions
contenant le produit sont alors concentrées sous vide poussé et si nécessaire,
la
réaction est à nouveau engagée puis traitée de la même manière pour conduire
au
composé désiré 117 (70 mg, 81%).
Rf = 0.12 (AcOEt-pyridine-Ac0H-H20 56/32/7.6/18).
Préparation du méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(1-4)-(2-amino-2-désoxy-6-0-sod iu m su Ifonato-a-D-qlucopyranosyl)-
(1-4)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(1-4)-(2-amino-2-désoxy-6-0-sodium su
Ifonato-a-D-qlucopyranosyl)-(1-4)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-2-amino-2-désoxy-6-0-
sodium sulfonato-a-D-qlucopyranoside (n 118)
A une solution dans un mélange 1 :1 tert-butanol/eau (2.3 mL) du composé 117
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
(35 mg, 11.6 pmol) sont ajoutés successivement du formiate d'ammonium (95 mg,
1.51
mmol) puis du Pd/C 10% (229 mg). Après 4h30 d'agitation vigoureuse à
température
ambiante, le milieu réactionnel est filtré, partiellement concentré sous vide,
puis on
dépose la solution au sommet d'une colonne de Sephadex G-25 éluée par du
5 chlorure de sodium 0,2 M. On concentre les fractions contenant le produit
et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 118
(11.1
mg, 45%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.17
10 IdoUAvIll, 5.42 Glcvll, 5.25 IdoUAvI, 5.45 Glcv, 5.24 IdoUe, 5.44 Gle,
5.26 IdoUAll, 5.03
GIcI
OAc OAc OH
0
OR
Lev0 Me02Cti
OB n
_____==\....\,,OR
Me02;z4).070Bn 0Bn0 NHZ
0
OC(NH)CCL _Dm.. MeO Lev02C/z).070Bn
-7,-
B nO Lev0A7 0
Bn0
NHZ NHZ
Ac0 Ac0 Ac0
24 119: R = (CH2)5Ph 123: R = (CH2)5Ph
120: R = CH2CHPr2 124: R = CH2CHPr2
121: R = (CH2)3C6H11 125: R = (CH2)3C6H11
122: R = (CH2)2CHPh2 126: R = (CH2)2CHPh2
OTBDPS
OTBDPS
0
OR
Me02C/z/s).070Bn 0 __#,===,..\.r OR
0
...r__.
Bn0 0 Bn0
NHZ NHZ
HO
Me0A)70Bn _____==\....\"
Lev0
Ac0 Ac0
131: R = (CH2)5Ph 127: R = (CH2)5Ph
132: R = CH2CHPr2 128: R = CH2CHPr2
133: R = (CH2)3C6H11 129: R = (CH2)3C6H11
134: R = (CH2)2CHPh2 130: R = (CH2)2CHPh2
OTBDPS
Bn0 OC(NH)CCL
N3
Lev0
Ac0 63
y
OTBDPS
OTBDPS
OTBDPS OTBDPS
0 Me02C/z,Ç>o_OR
Me02C OBn
0 Bn0 -a- 0 0 Bn0
Lev0 Ac0
N3 0 Bn0 0
N3
Me02C 0013n
HO Ac0
Ac0 Ac0
135: R = (CH2)5Ph 139: R = (CH2)5Ph
136: R = CH2CHPr2 140: R = CH2CHPr2
137: R = (CH2)3C6H11 141: R = (CH2)3C6H11
138: R = (CH2)2CHPh2 142: R = (CH2)2CHPh2
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
76
Préparation du 5-phényl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 119)
Du triflate de tert-butyldiméthylsilyle (1.13 mL, 0,2 mole par mole d'imidate)
dans du dichlorométhane est ajouté, sous argon, à - 20 C, à une solution de
l'imidate
24 (24.9 g, 24.6 mmol) et de 5-phénylpentanol (8.3 mL, 2 équivalents molaires)
dans
du dichlorométhane (1.1 L) en présence de tamis moléculaire 4 A (31 g). Après
10 minutes (CCM), on ajoute une solution aqueuse d'hydrogénocarbonate de
sodium
saturée à 0 C, et l'agitation est maintenue pendant 1h. On filtre la solution,
on la lave
par une solution aqueuse d'hydrogénocarbonate de sodium à 2%, par une solution
aqueuse saturée de chlorure de sodium, on sèche (Na2SO4) et on évapore à sec.
Une
purification sur gel de silice conduit à 119 (21.9 g, 88%).
LC-MS m/z 1034.3 [(M + Na)]. TR = 1.80 min
Préparation du 2-propyl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-
idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzyl-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 120)
Une solution 0.1 M de triflate de tert-butyldiméthylsilyle (2.78 mL, 0,2 mole
par
mole d'imidate) dans du dichlorométhane est ajouté, sous argon, à - 20 C, à
une
solution de l'imidate 24(1.2 g, 1.19 mmol) et de 2-propylpentanol (1 mL, 5
équivalents
molaires) dans du dichlorométhane (63 mL) en présence de tamis moléculaire 4 A
(1.8
g). Après 10 minutes (CCM), on ajoute une solution aqueuse
d'hydrogénocarbonate de
sodium saturée à 0 C. On filtre la solution, on la lave avec de l'eau, on
sèche (Na2SO4)
et on évapore à sec. Une purification sur gel de silice conduit à 120 (0.91 g,
76%).
LC-MS m/z 1000.3 [(M + Na)]. TR = 1.86 min
Préparation du 3-cyclohexyl-propyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-
lévulinoyl-a-L-idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-p-D-qlucopyranoside (n 121)
Le composé 24(1.2 g, 1.19 mmol) est traité selon un protocole similaire à
celui
décrit pour la synthèse de 120 pour fournir le composé 121 (1.09 g, 91%).
LC-MS m/z 1012.3 [(M + Na)]. TR = 1.88 min
Préparation du 3,3-d iphényl-propyl
(méthyl 2-0-acéty1-3-0-benzy1-4-0-
1évulinoyl-a-L-idopyranosyluronate)-(1-4)-6-0-acéty1-3-0-benzyl-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 122)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
77
Le composé 24(1.2 g, 1.19 mmol) est traité selon un protocole similaire à
celui
décrit pour la synthèse de 120 pour fournir le composé 122 (1.02 g, 82%).
Rf = 0.34 (cyclohexane-acétone 7/3).
Préparation du 5-phényl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyl1amino-
13-D-
glucopyranoside (n 123)
A une solution de 119 (21.9 g, 21.6 mmol) dans un mélange 1:1
méthanol/tétrahydrofurane (260 mL) est additionné du [tBu2SnCI(OH)]2 (0.926 g,
0.15
équivalent molaire) préparé selon A. Orita et al., Chem. Eur. J. (2001) 7,
3321. Après
agitation à 35 C pendant 7.5h puis à température ambiante pendant 17h, le
mélange
réactionnel est concentré sous vide puis engagé directement dans l'étape
suivante.
LC-MS m/z 992.3 [(M + Na)]. TR = 1.74 min
Préparation du 2-propyl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyl1amino-13-
D-
glucopyranoside (n 124)
A une solution de 120 (0.9 g, 0.93 mmol) dans un mélange 1:1
méthanol/tétrahydrofurane (12 mL) est additionné du [tBu2SnCI(OH)]2 (0.037 g,
0.14
équivalent molaire) préparé selon A. Orita et al., Chem. Eur. J. (2001) 7,
3321. Après
agitation à température ambiante pendant 16h puis à 35 C pendant 4h, le
mélange
réactionnel est concentré sous vide puis engagé directement dans l'étape
suivante.
LC-MS m/z 959.2 [(M + Na)]. TR = 1.79 min
Préparation du 3-cyclohexyl-propyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-
1évulinoyl-a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-[3-D-qlucopyranoside (n 125)
Le composé 121 (1.09 g, 1.10 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 124 pour fournir le composé 125 qui est
directement
engagé dans l'étape suivante.
LC-MS m/z 970.3 [(M + Na)]. TR = 10.75 min
Préparation du 3,3-d iphényl-propyl
(méthyl 2-0-acéty1-3-0-benzy1-4-0-
lévu linoyl-a-L-idopyranosylu ronate)-(1-4)-3-0-benzy1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 126)
Le composé 122 (0.844 g, 0.80 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 124. En cas de non complétion de la réaction,
la même
quantité de réactif peut éventuellement être rajoutée. Après traitement, le
composé
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
78
126 est directement engagé dans l'étape suivante.
Rf = 0.41 (cyclohexane-acétone 3/2).
Préparation du 5-phényl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
1(benzyloxy)carbonyllamino-6-D-qlucopyranoside (n 127)
Le composé 123 précédemment obtenu est mis en solution dans du
dichlorométhane (173 mL). A 0 C et sous argon, sont additionnés successivement
de
la triéthylamine (7.6 mL, 2.5 équivalents molaire), du 4-diméthylaminopyridine
(1.3 g,
0.5 équivalent molaire), et du chlorure de tert-butyldiphénylsilyle (11.2 mL,
2
équivalents molaire). Après 5.5h d'agitation magnétique, le milieu réactionnel
est dilué
par du dichlorométhane, lavé par une solution aqueuse d'hydrogénosulfate de
potassium à 10%, par une solution aqueuse saturée de chlorure de sodium, séché
(Na2SO4), filtré et concentré. Le résidu obtenu est partiellement purifié sur
silice
(acétone ¨ toluène) qui est engagé dans l'étape suivante.
LC-MS m/z 1231.2 [(NA+ Na)]. TR = 2.13 min
Préparation du 2-propyl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsilyI-2-désoxy-2-
f(benzyloxy)carbonyllamino-6-D-qlucopyranoside (n 128)
Le composé 124 précédemment obtenu est mis en solution dans du
dichlorométhane (7.4 mL). A 0 C et sous argon, sont additionnés successivement
du
4-diméthylaminopyridine (57 mg, 0.5 équivalent molaire), de la triéthylamine
(0.32 mL,
2.5 équivalents molaire), et du chlorure de tert-butyldiphénylsilyle (0.48 mL,
2.0
équivalents molaire). Après 18h d'agitation magnétique, le milieu réactionnel
est dilué
par du dichlorométhane, lavé par une solution aqueuse d'hydrogénosulfate de
potassium à 10%, par une solution aqueuse à 2% d'hydrogénocarbonate de sodium,
puis par une solution aqueuse saturée de chlorure de sodium, séché (Na2SO4),
filtré et
concentré. Le résidu obtenu est purifié sur silice (acétone ¨ cyclohexane)
pour
conduire à 128 (962 mg, 88% (2 étapes)).
Rf = 0.46 (cyclohexane-acétone 3/2).
Préparation du 3-cyclohexyl-propyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-
lévulinoyl-a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldi
phénylsilyI-2-
désoxy-2-Rbenzyloxy)carbonyllamino-6-D-qlucopyranoside (n 129)
Le composé 125 précédemment obtenu est traité selon un protocole similaire à
celui décrit pour la synthèse de 128 pour fournir le composé 129 (1.12 g, 86%
(2
étapes)).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
79
LC-MS m/z 1208.4 [(M + Na)]. TR = 13.01 min
Préparation du 3,3-diphényl-propyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-
lévulinoyl-a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldi
phénylsilyI-2-
désoxy-2-Rbenzyloxy)carbonyllamino-13-D-qlucopyranoside (n 130)
Le composé 126 précédemment obtenu est traité selon un protocole similaire à
celui décrit pour la synthèse de 128 pour fournir le composé 130 (0.97 g, 81%
(2
étapes)).
LC-MS m/z 1278.3 [(M + Na)]. TR = 12.72 min
Préparation du 5-phényl-pentyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 131)
A une solution du composé 127 précédemment obtenu dans un mélange 1:2
toluène/éthanol (1.01 L) est ajouté de l'acétate d'hydrazine (9.3 g, 5
équivalents
molaire). Après 1h10 d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 131 (16.7 g, 70% (3 étapes)).
LC-MS m/z 1133.3 [(M + Na)]. TR = 2.12 min
Déplacements chimiques des protons anomériques (500 MHz, CDCI3) 5
5.19 IdoUAll, 4.63 GIcI
Préparation du 2-propyl-pentyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 132)
A une solution du composé 128 (0.96 g, 0.82 mmol) dans un mélange 1:2
toluène/éthanol (164 mL) est ajouté de l'acétate d'hydrazine (0.38 g, 5
équivalents
molaire). Après 1h d'agitation magnétique, le mélange est concentré sous vide
puis
purifié sur gel de silice pour donner le composé 132 (0.84 g, 96%).
Rf = 0.42 (cyclohexane-acétone 7/3).
Masse : méthode "ESI", mode positif : masse théorique = 1076.3326 ; masse
expérimentale : 1098.5109 [M+Na]+.
Déplacements chimiques des protons anomériques (500 MHz, CDCI3) 5
5.15 IdoUAll, 4.61 GIcI
Préparation du 3-cyclohexyl-propyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 133)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
Le composé 129 (1.12 g, 0.94 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 132 pour fournir le composé 133 (1.03 g,
98%).
LC-MS m/z 1110.4 RM + Na)]. TR = 13.05 min
Déplacements chimiques des protons anomériques (500 MHz, CDCI3) 5
5 5.22 IdoUAll, 4.64 GIcI
Préparation du 3,3-d iphényl-propyl
(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
1(benzyloxy)carbonyllamino-[3-D-qlucopyranoside (n 134)
10 Le composé 130 (0.96 g, 0.77 mmol) est traité selon un protocole
similaire à
celui décrit pour la synthèse de 132 pour fournir le composé 134 (833 mg,
94%).
LC-MS m/z 1180.5 [(M + Na)]. TR = 12.22 min
Déplacements chimiques des protons anomériques (500 MHz, CDCI3) 5
5.21 IdoUAll, 4.54 GIcI
Préparation du 5-phényl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-
(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsilyI-2-désoxy-2-
Rbenzyloxy)carbonyllam ino-13-
D-qlucopyranoside (n 135)
Du triflate de tert-butyldiméthylsilyle (0.51 mL, 0,15 mole par mole
d'imidate)
dans du dichlorométhane est ajouté, sous argon, à - 20 C, à une solution de
l'imidate
63 (24.7 g, 22.5 mmol) et d'accepteur de glycosyle 131 (16.7 g, 15 mmol) dans
du
dichlorométhane (788 mL) en présence de tamis moléculaire 4 A (16.9 g). Après
2h45
à -20 C (CCM), on ajoute de l'hydrogénocarbonate de sodium solide. Après
filtration,
lavage par une solution d'hydrogénocarbonate de sodium aqueuse à 2%, par une
solution aqueuse saturée de chlorure de sodium, puis séchage (Na2SO4) et
évaporation à sec, le résidu est purifié sur gel de silice pour conduire à 135
(20.6 g,
67%).
Déplacements chimiques des protons anomériques (500 MHz, CDCI3) 5 5.35
IdoUe, 4.77 Gle, 5.30 IdoUAll, 4.61 GIcI
Rf = 0.41 (toluène-acétone 9/1).
Préparation du 2-propyl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-
(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsilyI-2-désoxy-2-
Rbenzyloxy)carbonyllam ino-13-
D-qlucopyranoside (n 136)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
81
Une solution 0.1 M de triflate de tert-butyldiméthylsilyle dans du
dichlorométhane (1.1 mL, 0,15 mole par mole d'imidate) est ajouté, sous argon,
à -
20 C, à une solution de l'imidate 63 (0.81 g, 0.73 mmol) et d'accepteur de
glycosyle
132 (0.84 g, 0.78 mmol) dans du dichlorométhane (26 mL) en présence de tamis
moléculaire 4 A (0.55 g). Après 2h30 à -20 C (CCM), on ajoute de
l'hydrogénocarbonate de sodium solide. Après filtration, lavage par une
solution
d'hydrogénocarbonate de sodium aqueuse à 2%, par une solution aqueuse saturée
de
chlorure de sodium, puis séchage (Na2SO4) et évaporation à sec, le résidu est
purifié
sur gel de silice pour conduire à 136 (0.66 g, 47%).
Rf = 0.23 (cyclohexane-acétone 4/1).
Préparation du 3-cyclohexyl-propyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-
1évulinoyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-
2-
1(benzyloxy)carbonyllamino-P-D-qlucopyranoside (n 137)
Le donneur de glycosyle 63 (0.63 g, 0.57 mmol) et l'accepteur de glycosyle 133
(1.03 g, 0.95 mmol) sont traités selon un protocole similaire à celui décrit
pour la
synthèse de 136 pour fournir le composé 137 (716 mg, 62%).
Rf = 0.20 (cyclohexane-acétone 3/1).
Préparation du 3,3-diphényl-propyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-
1évulinoyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-
2-
1(benzyloxy)carbonyllamino-P-D-qlucopyranoside (n 138)
Le donneur de glycosyle 63 (0.63 g, 0.57 mmol) et l'accepteur de glycosyle 134
(0.83 g, 0.72 mmol) sont traités selon un protocole similaire à celui décrit
pour la
synthèse de 136 pour fournir le composé 138.
Rf = 0.34 (cyclohexane-acétone 7/3).
Préparation du 5-phényl-pentyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-
(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
Rbenzyloxy)carbonyllamino-13-
D-qlucopyranoside (n 139)
A une solution du composé 135 (20.6 g, 10.0 mmol) dans un mélange 1:2
toluène/éthanol (500 mL) est ajouté de l'acétate d'hydrazine (4.6 g, 5
équivalents
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
82
molaire). Après 1h20 d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 139 (16.8 g, 86%).
Rf = 0.37 (toluène-acétone 9/1).
Préparation du 2-propyl-pentyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-
(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
Rbenzyloxy)carbonyllamino-8-
D-qlucopyranoside (n 140)
A une solution du composé 136 (20.6 g, 10.0 mmol) dans un mélange 1:2
toluène/éthanol (500 mL) est ajouté de l'acétate d'hydrazine (4.6 g, 5
équivalents
molaire). Après 1h20 d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 140 (16.8 g, 86%).
Rf = 0.36 (toluène-méthanol 95/5).
Préparation du 3-cyclohexyl-propyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-
(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsilyI-2-désoxy-2-
Rbenzyloxy)carbonyllam ino-8-
D-qlucopyranoside (n 141)
Le composé 137 (0.71 g, 0.35 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 140 pour fournir le composé 141 (0.65 g,
96%).
Rf = 0.37 (cyclohexane-acétone 7/3).
Préparation du 3,3-diphényl-propyl (méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-
désoxy-
a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-
(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-2-
Rbenzyloxy)carbonyllamino-8-
D-qlucopyranoside (n 142)
Le composé 138 obtenu à l'étape précédente est traité selon un protocole
similaire à celui décrit pour la synthèse de 140 pour fournir le composé 142
(0.518 g,
45% (2 étapes)).
Rf = 0.37 (toluène-acétone 9/1).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
83
OTBDPS
OTBDPS
0
me0 c OBn 0(CH2)5Ph
_____=07.\\O 2 , 0
me02cA OBn
0 Bn0
). 7 Bn0 0 NHZ
N,
HO Ac0
Ac0
139
OAc
me02c/444).070Bn
OC(NH)CCI3
Bn0
N3
Lev0
Y
Ac0 27
OTBDPS
OTBDPS
OAc 0
ecme02c/z44/7/0Bn 0 0(CH2),Ph
0 me02c/A;1
me0 OBn 7 0
2c
'C' Bn0 0
7 0 N3 0 Bn0 NHZ
Ac0
Lev0 Bn0 N3 Ac0 143
Ac0
OTBDPS
OTBDPS
OAc 0 Me02C/ç 0 ____.õ0(CH2)5Ph
0 me02c/A0;71
me02c OBn 0 0 Bn0
NHZ
0 0
7"7,S007/ Bn0 C6n0 0 N3
N, Ac0
HO Ac0 144
Ac0
OAc
me02c0Bn
OC(NH)CCI3
Bn0
N3
Bn0
Ac0
38 y OTBDPS
OTBDPS
0
OAc
Lme0 2 c OBn 0
0(CH2)5Ph
me02c OBn .........0 .7_.(7
OAc 0 me02c/A0;7/1
0
0 /z 0 Bn0
me02c OBn 0 0 Bn0 \ ;)
0 NHZ
N,
0 Bn0
Bn 0
Ac0
Bn0 0 N, 7 N, 0 Ac0
Ac0
Ac0 145
Préparation du 5-phényl-pentyl (méthyl 2-0-acéty1-3-0-benzy1-4-0-1évulinoyl-a-
L-idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-dlucopyranosyl)-
(1-4)-
(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-
6-0-tert-
butyldiphénylsily1-2-désoxy-2-Rbenzyloxy)carbonyllamino-13-D-dlucopyranoside
(n 143)
Du triflate de tert-butyldiméthylsilyle (0.42 mL, 0,15 mole par mole
d'imidate)
dans du dichlorométhane est ajouté, sous argon, à - 20 C, à une solution de
l'imidate
27 (11.1 g, 12.3 mmol) et d'accepteur de glycosyle 139 (16.8 g, 8.6 mmol) dans
du
dichlorométhane (430 mL) en présence de tamis moléculaire 4 A (10.4 g). Après
3h
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
84
d'agitation magnétique à -20 C (CCM), on ajoute de l'hydrogénocarbonate de
sodium
solide. Après filtration, lavage par une solution d'hydrogénocarbonate de
sodium
aqueuse à 2%, par une solution aqueuse saturée de chlorure de sodium, puis
séchage
(Na2SO4) et évaporation à sec, le résidu est purifié sur gel de silice pour
conduire à 143
(14.71 g, 64%).
Rf = 0.31 (toluène-acétone 85/15).
Préparation du 5-phényl-pentyl (méthyl 2-
0-acéty1-3-0-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(2-azido-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-2-Rbenzyloxy)carbonyllamino-6-D-qlucopyranoside (n
144)
A une solution du composé 143 (13.51 g, 5.0 mmol) dans un mélange 1:2
toluène/éthanol (252 mL) est ajouté de l'acétate d'hydrazine (2.31 g, 5
équivalents
molaire). Après 0.5h d'agitation magnétique, le mélange est concentré sous
vide puis
purifié sur gel de silice pour donner le composé 144 (9.41 g, 72%).
Rf = 0.18 (toluène-acétone 85/15).
Préparation du 5-phényl-pentyl (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-
2-
1(benzyloxy)carbonyllamino-6-D-qlucopyranoside (n 145)
Une solution 0.1 M de triflate de tert-butyldiméthylsilyle (7.2 mL, 0,15 mole
par
mole d'imidate) dans du dichlorométhane est ajouté, sous argon, à -20 C, à
une
solution de l'imidate 38 (4.29 g, 4.8 mmol) et d'accepteur de glycosyle 144
(10.33 g,
4.0 mmol) dans du dichlorométhane (170 mL) en présence de tamis moléculaire 4
A
(3.7 g). Après 19h45 à -20 C (CCM), on ajoute de l'hydrogénocarbonate de
sodium
solide. Après filtration, lavage par une solution d'hydrogénocarbonate de
sodium
aqueuse à 2%, par une solution aqueuse saturée de chlorure de sodium, puis
séchage
(Na2SO4) et évaporation à sec, le résidu est purifié sur gel de silice pour
conduire à 145
(7.74 g, 58%).
Rf = 0.4 (toluène-acétone 85/15).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
N, N3
HO2C OBn 0 Me0 C OBn
HO 0 HO"ZYI
Ac0 Ac0 0
MeO2CA7.007/Bn no 0
oc(NH)cc 13
N3
146 147 N Bn0
Ac0 38
OAc OAc
OAc N3
Me0 c OBn OAc
Me0 OBn 0 0
...r_ Me n02C OB0 Bno Me 2C/Zis;70
0
2C
N3 0 0
N3 0 N3
Bn0 Ac0 0 Bn 0
Bn0 Ac0 Ac0
Ac0 149 148
OAc
OAc
OAc
OAc 0
0 Me02C/z00Bn Bno O
OC(NH)CCI3
0
Me02C OB n 0 Me02CA/OBn OH
0
B nO
N3 0 N3
0 Bn0 _30..Me02C 00Bn
7--17/ Bn0 N3 Bn0 Ac0
N3 0
B nO Ac0 Ac0
Ac0 150 151
5
Préparation du (méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-
1,6-an hydro-2-azido-3-0-benzy1-2-désoxy-13-D-qlucopyranose (n 147)
A une solution du composé 146 (11.1 mmol) (W02006/021653) dans du N,N-
diméthylformamide (78 mL) est ajouté, à 0 C et sous argon, de
l'hydrogénocarbonate
de potassium (5.56 g, 5 équivalents molaire), puis de l'iodure de méthyle (6.9
mL, 10
10 équivalents molaire). Après 17h d'agitation magnétique, les réactifs
peuvent être à
nouveau additionnés si nécessaire. Après complétion de la réaction (CCM), le
milieu
réactionnel est concentré sous vide, le brut réactionnel est dilué à l'acétate
d'éthyle,
lavé à l'eau puis par une solution aqueuse saturée en thiosulfate de sodium,
séché
(Na2SO4), filtré et concentré. Le résidu obtenu est engagé dans l'étape
suivante sans
15 purification.
LC-MS m/z 465.3 RM + NH4)]. TR = 0.8 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 2-
20 0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-1,6-anhydro-2-azido-3-0-
benzy1-
2-désoxy-13-D-qlucopyranose (n 148)
Une solution 1 M de triflate de tert-butyldiméthylsilyle (0.95 mL, 0,15 mole
par
mole d'imidate) dans du dichlorométhane est ajoutée, sous argon, à - 20 C, à
une
solution de l'imidate 38 (5.68 g, 6.35 mmol) et d'accepteur de glycosyle 147
(4.2 g,
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
86
7 mmol) dans du dichlorométhane (222 mL) en présence de tamis moléculaire 4 A
(4.8 g). Après 1.5h à -20 C (CCM), du catalyseur est éventuellement addition
jusqu'à
complétion de la réaction (CCM), puis on ajoute de l'hydrogénocarbonate de
sodium
solide. Après filtration, lavage par une solution d'hydrogénocarbonate de
sodium
aqueuse à 2%, par une solution saturée de chlorure de sodium, séchage
(Na2SO4),
filtration et évaporation à sec, le résidu est purifié sur gel de silice pour
conduire à 148
(3.15 g, 38%).
Rf = 0.41 (cyclohexane-acétate d'éthyle 3/2).
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-1,6-d i-O-acéty1-2-azido-3-
0-
benzy1-2-désoxy-a,[3-D-qlucopyranose (n 149)
Le résidu obtenu à l'étape précédente est dissous dans de l'anhydride acétique
(13 mL), puis est additionné, à 0 C et en 15 min, de l'acide trifluoroacétique
(TFA) (1.3
mL). Le mélange réactionnel est agité pendant 10 min à 0 C, 18 h à température
ambiante, puis est concentré, coévaporé au toluène, et purifié sur gel de
silice
(heptane ¨ acétate d'éthyle), pour donner le composé 149 (2.99 g, 88%).
LC-MS in/z 1456.0 [(M + Na)]. TR = 1.96 min
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-6-0-acéty1-2-azido-3-0-
benzy1-2-
désoxy-a,[3-D-qlucopyranose (n 150)
A une solution du composé 149 (2.99 g, 2.09 mmol) dans de l'éther diéthylique
(42 mL), est additionnée, à 0 C, de la benzylamine (BnNH2) (8.2 mL, 36
équivalents
molaire). Après 1.5h d'agitation à 0 C, puis 4.5h à température ambiante, le
mélange
réactionnel est neutralisé avec de l'HCI 1N à froid (0-4 C), lavé à l'eau,
séché
(Na2SO4), filtré et concentré, et purifié sur gel de silice (heptane ¨ acétate
d'éthyle)
pour conduire à 150 (2.6 g, 90%).
Rf = 0.21 (cyclohexane-acétate d'éthyle 3/2).
Préparation du (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-idopyranosyluronate)-
(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 2-
0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-6-0-acéty1-2-azido-3-0-
benzy1-2-
désoxy-a,[3-D-qlucopyranose trichloroacétimidate (n 151)
A une solution du composé 150 (2.6 g, 1.9 mmol) dans le dichlorométhane (36
mL) est additionné sous argon et à 0 C, du carbonate de césium (C52CO3) (0.97
g, 1.6
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
87
équivalent molaire) puis du trichloroacétonitrile (CCI3CN) (0.94 mL, 5.0
équivalents
molaire). Après lh d'agitation à température ambiante, le mélange réactionnel
est filtré,
puis concentré. Le résidu est purifié sur gel de silice (acétate d'éthyle -
cyclohexane +
0.1% de triéthylamine) pour donner 151 (2.25 g, 80%).
Rf = 0.38 (cyclohexane-acétate d'éthyle 3/2).
OTBDPS
OTBDPS 140: R = CH2CHPr2
r OBn 0
Me02C7
OR
141: R (CH2)3C6H11
OBn
/
"...).07 Bn0 N, o' 'y
NHZ
142: R (CH2)3Ph2
HO Ac0
Ac0
OAc
OAc
0 meo2c/z7/0Bn
Me02C OBn 0
0 Bn0
A.77/.0 Bn0
N2
Bn0 Ac0
Ac0 OTBDPS
151 OTBDPS
OAc 0 me02;z<B)>&C,OR
OAc
0 0
Me02C OBn 7
C/Z<B)11 0 0 Bn0
Bn0
Bn0 N2 Ac0
7--=<;;7/ Bn0
Ac0
Bn0 Ac0
Ac0
152: R = CH2CHPr2
153: R = (CH2)3C6H11
154: R = (CH2)3Ph2
Préparation du 2-propyl-pentyl (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-dlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-
2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 152)
Une solution 0.1 M de triflate de tert-butyldiméthylsilyle (0.46 mL, 0,15 mole
par
mole d'imidate) dans du dichlorométhane est ajouté, sous argon, à - 20 C, à
une
solution de l'imidate 151 (0.56 g, 0.36 mmol) et d'accepteur de glycosyle 140
(0.59 g,
0.31 mmol) dans du dichlorométhane (11 mL) en présence de tamis moléculaire 4
A
(0.27 g). Après 5h à -20 C (CCM), on ajoute de l'hydrogénocarbonate de sodium
solide. Après filtration, lavage par une solution d'hydrogénocarbonate de
sodium
aqueuse à 2%, par une solution aqueuse saturée de chlorure de sodium, puis
séchage
(Na2SO4) et évaporation à sec, le résidu est purifié sur gel de silice pour
conduire à 152
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
88
(0.82 g, 82%).
Rf = 0.32 (cyclohexane-acétone 7/3).
Préparation du 3-cyclohexyl-propyl (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyluronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-
0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-
2-
1(benzyloxy)carbonyllamino-P-D-qlucopyranoside (n 153)
Le donneur de glycosyle 151 (0.56 g, 0.36 mmol) et l'accepteur de glycosyle
141 (0.65 g, 0.34 mmol) sont traités selon un protocole similaire à celui
décrit pour la
synthèse de 152 pour fournir le composé 153 (808 mg, 73%).
Rf = 0.36 (cyclohexane-acétone 3/2).
Préparation du 3,3-diphényl-propyl (méthyl 2-0-acéty1-3,4-di-O-benzyl-a-L-
idopyranosyluronate)-(1-4)-(6-0-acétyl-2-azido-3-0-benzyl-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-benzyl-a-L-idopyranosyl uronate)-
(1-4)-
(6-0-acéty1-2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-
acéty1-3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-6-0-tert-
butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl 2-0-acéty1-3-0-
benzyl-
a-L-idopyranosyluronate)-(1-4)-3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-
2-
1(benzyloxy)carbonyllamino-13-D-qlucopyranoside (n 154)
Le donneur de glycosyle 151 (0.51 g, 0.33 mmol) et l'accepteur de glycosyle
142 (0.52 g, 0.26 mmol) sont traités selon un protocole similaire à celui
décrit pour la
synthèse de 152 pour fournir le composé 154 (635 mg, 73%).
Rf = 0.25 (cyclohexane-acétone 7/3).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
89
OTBDPS
OTBDPS 0
OAcOR
OAc
0 Me02C/ze,17/1 0 \Me02C OBn 0
Bn0
C OBn 0 0 Me02C7 OBn
Me027
7 _________________________________ ).07/ Bn0 0 N HZ
Bn0 0
0
Ac0
Bn0
Na 0
µ Bn0
Na 0
Ac0 Na
Ac0 145: R = (CH2)5Ph
152: R = CH2CHPr2
Ac0
153: R = (CH2)3C6H11
OTBDPS 154: R = (CH2)3Ph2
OTBDPS
0
OH Me0 C OBn OR
OH 0 Me02C/z<t)70Bn 0 0 2 s0 Bn0 NHZ
0
0 Me02C 7 OBn
Me02C OBn 0 µ0 Bn0 0
0 / .(11107/ Bn0 0 Na
Na HO 155: R = (CH2)5Ph
7.--õ7/ Bn0 Na 0
HO
Bn0 HO 156: R = CH2CHPr2
HO
157: R = (CH2)3C6H11
158: R = (CH2)3Ph2
OTBDPS
OTBDPS
OSO,M0C OBn C :
OSO OR
, 0 e2 7 0
0 Me02C 7 OBn 0 0 Me02Bn
Me02C OBn 0 Bn0 0
Bn0 0
Bn0 07
Bn0 N,
-0,S0 N, 0
0,S0 _
0,S0
159: R = (CH2)5Ph
0350 160: R = CH2CHPr2
sel de triéthylammonium 161: R = (CH2)3C6H11
162: R = (CH2)3Ph2
OH
OH/
050,- Me0 C OBn OR
030,- 0 Me02C7(04;71 0 27.../...,,70
0 0 Me02C/ze:71
N,0 0 0
"\--\..--NHZ
OBn
Me02C 0 B----&e
0
/4sty/
Bn0 _
Bn0
N, 0
-0,S0
0,SO N,
-0,S0 163: R = (CH2)5Ph
164: R = CH2CHPr2
Bn0
-0,so
sel d'ammonium
165: R = (CH2)3C6H11
166: R = (CH2)3Ph2
OH
OH
OSO,Li 0 LiO2Cç71
OSO,Li 0 LiO2C OBn 0
0 Bn0
LiO2C OBn 0
LiO3S0 167: R = (CH2)5Ph
LiO2Cs70Bn
0 0 Bn0 0 NHZ
Bn0
/z.,(4,7/
0
N, 0
LiO3S0 N, 0
LiO,S0 N,
168: R = CH2CHPr2
LiO,S0
169: R = (CH2)3C6H11
170: R = (CH2)3Ph2
OH
OH 0
OSO,Na Na0 C OH
OSO Na
OR
, 0 Na0 2C/ 444 OH
070a02/0 0 2/Z(....). 70
0 -----&=07.\\ 0 H-0-&e\---
\..--
0 Na02C7 OH 0
0 HO
NH20 NH2
Na02;z<;-7/1 0 7 __ 4;7 HO
NH2
NaO,S0
0 HO
0 171: R = (CH2)5Ph
N aO,
NH S0
HO 2
NaO,S0
NaO3S0 172: R = CH2CHPr2
173: R = (CH2)3C6H11
174: R = (CH2)3Ph2
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
Préparation du 5-phényl-pentyl (méthyl
3,4-d i-O-benzyl-a-L-
idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 3-0-benzyl-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-a-D-
5
glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-
azido-3-
0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 3-0-
benzyl-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsily1-
2-
désoxy-2-Rbenzyloxy)carbonyllam ino-P-D-qlucopyranoside (n 155)
A une solution de 145 (639 mg, 0.192 mmol) dans un mélange 3/2 de
10
méthanol/dichlorométhane (57 mL) en présence de tamis moléculaire 3 A (230 mg)
est
ajouté, à 0 C, une solution méthanolique 1M de méthylate de sodium (0.427 mL).
Après agitation à 0 C pendant 3 h et à température ambiante pendant 15 h, le
mélange est neutralisé à 0 C par de la résine H+ Dowex 50WX4. Après filtration
et
concentration, le résidu est purifié sur gel de silice avec un mélange
toluène/acétate
15 d'éthyle/éthanol pour fournir le composé 155 (444 mg, 80%).
Rf = 0.28 (toluène-acétate d'éthyle-éthanol 7/3/0.3).
Préparation du 2-propyl-pentyl (méthyl
3,4-d i-O-benzyl-a-L-
idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
20
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-
a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-
azido-3-
0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 3-0-
benzyl-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsily1-
2-
désoxy-2-Rbenzyloxy)carbonyllam ino-P-D-qlucopyranoside (n 156)
25 Le
composé 152 (420 mg, 0.128 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 155 pour fournir le composé 156 (178 mg,
46%).
Rf = 0.20 (cyclohexane-acétone 7/3).
Préparation du 3-cyclohexyl-propyl (méthyl
3,4-d i-O-benzyl-a-L-
30 idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-
a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-
azido-3-
0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 3-0-
benzyl-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsily1-
2-
35 désoxy-2-Rbenzyloxy)carbonyllamino-13-D-qlucopyranoside (n 157)
Le composé 153 (402 mg, 0.122 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 155 pour fournir le composé 157 (276 mg,
75%).
Rf = 0.40 (cyclohexane-acétone 7/3).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
91
Préparation du 3,3-d iphényl-propyl (méthyl
3,4-d i-O-benzyl-a-L-
idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-qlucopyranosyl)-
(1-4)-
(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-
a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzyl-a-L-idopyranosyluronate)-(1-4)-(2-
azido-3-
0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-
(méthyl 3-0-
benzyl-a-L-idopyranosyl uronate)-(1-4)-3-0-benzy1-6-0-tert-butyldi phénylsily1-
2-
désoxy-2-Rbenzyloxy)carbonyllam ino-P-D-qlucopyranoside (n 158)
Le composé 154 (315 mg, 0.093 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 155 pour fournir le composé 158 (244 mg,
84%).
Rf = 0.13 (cyclohexane-acétone 7/3).
Préparation du 5-phényl-pentyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-0-
benzy1-6-0-tert-butyldi phénylsily1-2-désoxy-a-D-qlucopyranosyl)-(1-4)-(méthyl
3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyluronate)-(1-4)-3-0-
benzy1-6-
0-tert-butyldiphénylsily1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
qlucopyranoside
(n 159)
On ajoute du complexe triéthylamine/trioxyde de soufre (775 mg, 5 moles par
fonction hydroxyle) à une solution dans le N,N-diméthylformamide (12.8 mL, 90
L/mol)
du composé 155 (438 mg, 142 pmol). Après 17 heures d'agitation magnétique à 50
C
à l'abri de la lumière, on ajoute à 0 C du méthanol et après 0.5 h d'agitation
à 0 C puis
1 h à température ambiante, le milieu réactionnel est dilué par du méthanol
puis purifié
à l'aide d'une colonne LH-20 en utilisant un mélange 9:1 méthanol/N,N-
diméthylformamide comme éluant. Les fractions contenant le produit sont alors
concentrées sous vide poussé pour conduire au composé désiré 159 (571 mg,
96%).
Rf = 0.48 (AcOEt-pyridine-Ac0H-H20 29/13/3.4/7).
Préparation du 2-propyl-pentyl (méthyl 3,4-di-O-benzy1-2-0-triéthylammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyluronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyluronate)-(1¨>4)-(2-
azido-3-0-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
92
benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-plucopyranosyl)-(1-4)-(méthyl
3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyluronate)-(1-4)-3-0-
benzy1-6-
0-tert-butyldiphénylsily1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
plucopyranoside
(n 160)
Le composé 156 (178 mg, 0.054 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 159 pour fournir le composé 160 (196 mg,
75%).
Rf = 0.48 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du 3-cyclohexyl-propyl (méthyl
3,4-di-O-benzy1-2-0-
triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-
benzy1-2-
désoxy-6-0-triéthylam mon iu m sulfonato-a-D-plucopyranosyl)-(1-4)-(méthyl
3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-0-
benzy1-2-désoxy-6-0-triéthylam mon iu m sulfonato-a-D-plucopyranosyl)-(1-4)-
(méthyl
3-0-benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-
(2-azido-
3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-plucopyranosyl)-(1-4)-
(méthyl 3-
0-benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyluronate)-(1-4)-3-0-
benzy1-
6-0-tert-butyldiphénylsily1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
plucopyranoside
(n 161)
Le composé 157 (345 mg, 0.113 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 159 pour fournir le composé 161 (332 mg,
70%).
Rf = 0.48 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du 3,3-diphényl-propyl (méthyl
3,4-di-O-benzy1-2-0-
triéthylam mon iu m
sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-
désoxy-6-0-triéthylammonium sulfonato-a-D-plucopyranosyl)-(1-4)-(méthyl 3-0-
benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyl uronate)-(1-4)-(2-
azido-3-0-
benzy1-2-désoxy-6-0-triéthylam mon iu m sulfonato-a-D-plucopyranosyl)-(1-4)-
(méthyl
3-0-benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyluronate)-(1-4)-(2-
azido-
3-0-benzy1-6-0-tert-butyldiphénylsily1-2-désoxy-a-D-plucopyranosyl)-(1-4)-
(méthyl 3-
0-benzy1-2-0-triéthylam mon iu m sulfonato-a-L-idopyranosyluronate)-(1-4)-3-0-
benzy1-
6-0-tert-butyldiphénylsily1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
plucopyranoside
(n 162)
Le composé 158 (300 mg, 0.096 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 159. Si nécessaire, le mélange obtenu peut
être purifié
en phase inverse sur colonne RP-18 en utilisant un mélange méthanol-eau comme
éluant pour fournir le composé 162 (211 mg, 52%).
Rf = 0.47 (AcOEt-pyridine-Ac0H-H20 29/13/3.4/7).
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
93
Préparation du 5-phényl-pentyl (méthyl 3,4-di-O-benzy1-2-0-ammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
sulfonato-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-6-D-
glucopyranoside (n 163)
A une solution du composé 159 (520 mg, 125 pmol) dans du méthanol (16 mL)
est ajouté du fluorure d'ammonium (370 mg, 80 équivalents molaires). Après
agitation
magnétique à 55 C pendant 24 h puis à température ambiante pendant 16 h, le
mélange réactionnel est purifié à l'aide d'une colonne LH-20 en utilisant un
mélange
9:1 méthanol/N,N-diméthylformamide comme éluant. Les fractions contenant le
produit
sont alors concentrées sous vide poussé puis le résidu est purifié sur gel de
silice avec
un mélange acétate d'éthyle/pyridine/acide acétique/eau comme éluant. Les
fractions
contenant le produit sont alors partiellement concentrées puis le résidu est
purifié à
l'aide d'une colonne LH-20 en utilisant un mélange 9:1 méthanol/N,N-
diméthylformamide comme éluant. Les fractions contenant le produit sont alors
concentrées sous vide poussé pour fournir le composé 163 (295 mg, 74%).
Rf = 0.45 (AcOEt-pyridine-Ac0H-H20 29/13/3.4/7).
Préparation du 2-propyl-pentyl (méthyl 3,4-di-O-benzy1-2-0-ammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su Ifonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
sulfonato-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-6-D-
glucopyranoside (n 164)
Le composé 160 (196 mg, 0.048 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 163. La durée de la réaction peut
éventuellement être
raccourcie en fonction du suivi par CCM. Par ailleurs, une purification en
phase inverse
peut s'avérer nécessaire pour fournir le composé 164 (104 mg, 59%).
Rf = 0.32 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du 3-cyclohexyl-propyl (méthyl 3,4-di-O-benzy1-2-0-ammonium
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
94
su lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
sulfonato-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-p-D-
glucopyranoside (n 165)
Le composé 161 (230 mg, 0.055 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 164 pour fournir le composé 165 (115 mg,
56%).
Rf = 0.57 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du 3,3-diphényl-propyl (méthyl 3,4-di-O-benzy1-2-0-ammonium
su lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-
ammonium sulfonato-a-D-qlucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
su lfonato-a-L-idopyranosyl uronate)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(méthyl 3-0-benzy1-2-0-ammonium
sulfonato-a-L-
idopyranosyluronate)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-p-D-
glucopyranoside (n 166)
Le composé 162 (43 mg, 10.2 pmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 163 pour fournir le composé 166.
Rf = 0.32 (AcOEt-pyridine-Ac0H-H20 29/13/3.4/7).
Préparation du 5-phényl-pentyl (3,4-di-O-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m
sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m sulfonato-a-
L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
qlucopyranoside
(n 167)
A une solution du composé 163 (289 mg, 91 pmol) dans du méthanol (3.59 mL)
sont ajoutés, à 0 C, une solution aqueuse de péroxyde d'hydrogène à 30% (2.23
mL)
puis, goutte à goutte, une solution aqueuse 5N de LiOH (1.46 mL). Après 3h
d'agitation
à 0 C, 16 h à température ambiante, puis 27 h à 45 C, le milieu réactionnel
est
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
neutralisé à 0 C par addition d'acide chlorhydrique 3N, puis purifié à l'aide
d'une
colonne LH-20 en utilisant un mélange 9:1 méthanol/N,N-diméthylformamide comme
éluant. Les fractions contenant le produit sont alors concentrées sous vide
poussé
pour conduire au composé désiré 167 (267 mg, 95%).
5 Rf = 0.25 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du 2-propyl-pentyl (3,4-d i-O-benzy1-2-0-lith iu m su lfonato-a-L-
idopyranosylu ronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m su
lfonato-a-L-
10 idopyranosylu ronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m su
lfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
qlucopyranoside
15 (n 168)
Le composé 164 (104 mg, 0.029 mmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 167 pour fournir le composé 168.
Rf = 0.28 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
20
Préparation du 3-cyclohexyl-propyl (3,4-di-O-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m su
lfonato-a-L-
idopyranosylu ronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m su
lfonato-a-L-
25 idopyranosylu ronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
glucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
qlucopyranoside
(n 169)
Le composé 165 (110 mg, 0.030 mmol) est traité selon un protocole similaire à
30 celui décrit pour la synthèse de 167 pour fournir le composé 169 (76 mg,
83%).
Rf = 0.20 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du 3,3-diphényl-propyl (3,4-di-O-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
35 su
Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m su lfonato-a-L-
idopyranosylu ronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-6-0-lithium
su Ifonato-a-D-qlucopyranosyl)-(1-4)-(3-0-benzyl-2-0-lith iu m su
lfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-(2-azido-3-0-benzy1-2-désoxy-a-D-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
96
glucopyranosyl)-(1-4)-(3-0-benzy1-2-0-lithium sulfonato-a-L-
idopyranosyluronate de
lithium)-(1-4)-3-0-benzy1-2-désoxy-2-Rbenzyloxy)carbonyllamino-P-D-
qlucopyranoside
(n 170)
Le composé 166 est traité selon un protocole similaire à celui décrit pour la
synthèse de 167. Si nécessaire, le résidu obtenu peut être engagé dans les
mêmes
conditions pour fournir le composé 170 (27 mg, 87% (2 étapes)).
Rf = 0.39 (AcOEt-pyridine-Ac0H-H20 57/29/7.2/16).
Préparation du 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate
de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyl)-
(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-
2-
désoxy-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-(1-4)-(2-0-sod iu m su
lfonato-a-L-
idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-a-D-qlucopyranosyl)-(1-
4)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-2-amino-2-
désoxy-
13-D-qlucopyranoside (n 171)
A une solution dans un mélange 1:1 tert-butanol/eau (16.1 mL) du composé
167 précédemment obtenu sont ajoutés successivement du formiate d'ammonium
(658
mg, 10.4 mmol) puis du Pd/C 10% (1.61 g). Après 4h d'agitation vigoureuse à
température ambiante, le milieu réactionnel est filtré, partiellement
concentré sous vide,
puis on dépose la solution au sommet d'une colonne de Sephadex G-25 éluée par
du
chlorure de sodium 0,2 M. On concentre les fractions contenant le produit et
on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 171
(109
mg, 62%).
Méthode "ESI", mode négatif : ion multichargé détecté m/z 663.08 [M-31-1]3
-
(forme acide).
Préparation du 2-propyl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate
de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyl)-
(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-
2-
désoxy-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-(1-4)-(2-0-sod iu m su
lfonato-a-L-
idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-a-D-qlucopyranosyl)-(1-
4)-
(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-2-amino-2-
désoxy-
13-D-qlucopyranoside (n 172)
Le composé 168 est traité selon un protocole similaire à celui décrit pour la
synthèse de 171 pour fournir le composé 172 (47 mg, 74% (2 étapes)).
Déplacements chimiques des protons anomériques (500 MHz, D20) 5 5.29*
IdoUAvw, 5.50 Glcv", 5.29* IdoUAv', 5.48** Glcv, 5.29* IdoUA'v, 5.48** Gle,
5.22*
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
97
IdoUAll, 4.78** GIcI
* et ** : Les signaux peuvent être interchangés.
Préparation du 3-cyclohexyl-pentyl (2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-
D-
glucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1-4)-(2-amino-2-désoxy-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(1-4)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-a-
D-
glucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1-4)-2-amino-2-désoxy-p-D-glucopyranoside (n 173)
Le composé 169 (88 mg, 29 pmol) est traité selon un protocole similaire à
celui
décrit pour la synthèse de 171 pour fournir le composé 173 (63 mg, 99%).
Déplacements chimiques des protons anomériques (500 MHz, D20) 5 5.29*
IdoUAvIll, 5.50** Glcvll, 5.29* IdoUAvI, 5.48** Glcv, 5.29* Idolle, 5.48**
Gle, 5.22*
IdoUAll, 4.78** GIcI
* et ** : Les signaux peuvent être interchangés.
Préparation du 3,3-diphényl-pentyl (2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-amino-2-désoxy-6-0-sodium sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1-4)-(2-amino-2-désoxy-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(1-4)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(1-4)-(2-amino-2-désoxy-a-
D-
glucopyranosyl)-(1-4)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1-4)-2-amino-2-désoxy-p-D-glucopyranoside (n 174)
Le composé 170 (17.4 mg, 5.6 pmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 171 pour fournir le composé 174 (5.5 mg,
44%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.15
IdoUAvIll, 5.42 Glcvll, 5.23 IdoUAvI, 5.40 Glcv, 5.23 Idolle, 5.38 Gle, 5.19
IdoUAll, 4.39
GIcI
Exemples de composés selon l'invention :
EXEMPLE 1 : Pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-sod iu m sulfonato-a-D-
glucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su
Ifonato-a-D-glucopyranosyl)-(14)-(2-0-sodi um
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
98
sodium sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-
P-
D-qlucopyranoside (composé n 1)
OSO Na
OSO,Na
OSO,Na 0 Na02CA). 70
OH C\i... 243
O(CH)CH
) CH
0
OSO,Na 0 Na02C7(0470 HO
Na02C/z(04;70 ;
H3NH
NaO2C OH 0
7...< ..77/ 0 HO H3CCONH 0 CCO
0 HO H3CCONH 0 Na03S0
0 HO H3CCONH 0 Na03S0
HO Na03S0
Na03S0
A une solution aqueuse saturée d'hydrogénocarbonate de sodium (2.1 mL) du
composé 43 (39 mg, 16.6 pmol) sont additionnés de l'hydrogénocarbonate de
sodium
(223 mg, 2.66 mmol), puis goutte à goutte et à 0 C, de l'anhydride acétique
(126 pL,
1.33 mmol). Après 3h d'agitation vigoureuse à 0 C puis 15h à température
ambiante, le
milieu réactionnel est déposé au sommet d'une colonne de Sephadex G-25 éluée
par
du chlorure de sodium 0,2 M. On concentre les fractions contenant le produit
et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 1 (30
mg,
73%).
Déplacements chimiques des protons anomériques (500 MHz, D20) 5 5.14
IdoUAvIll, 5.13 Glcvll, 5.16 IdoUAvI, 5.13 Glcv, 5.15 IdoUe, 5.14 Gle, 5.17
IdoUAll, 4.51
GIcI
Masse : méthode "ESI", mode négatif : masse théorique = 2509.72 ; masse
expérimentale : 2508.82 0,34 u.m.a.
EXEMPLE 2 : Pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(14)-(2-désoxy-2-(1-oxobutyl)am ino-6-0-sod iu m
sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium sulfonato-a-D-qlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-
(1-oxobutyl)amino-6-0-sodium
sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-désoxy-2-(1-oxobutyl)amino-
6-
0-sodium sulfonato-P-D-qlucopyranoside (composé n 2)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
99
oso3Na
OSO3Na
OSO3Na 0 Na02C/4%;7/
, 0 O 7
O(CH)CH
3
OSO3Na 0 Na02C7(01)70 HO
0 Na02C/z(04;7
Na02 0 :
C OH 0
...< ..77/ 0 HO 0 H3C(CH2)2CONH
0 HO () H3C(CH2)2CONH
Na03S0
0 HO 0 H3C(CH2)2CONH
Na03S0
HO H3 (CH2)2CONH
Na03S0
Na03S0
A une solution du composé 43 (26 mg, 11.1 pmol) dans un mélange 7:3 N,N-
diméthylformamide/eau (2.9 mL) sont additionnés goutte à goutte et à 0 C de la
diisopropyléthylamine (33 pL, 17 équivalents molaires) en solution dans du N,N-
diméthylformamide (100 pL), ainsi que du butyrate de N-hydroxysuccinimide
(27.4 mg,
13 équivalents molaires) en solution dans du N,N-diméthylformamide (100 pL).
Une
agitation est maintenue à température ambiante pendant 4h, puis la même
quantité de
réactif est additionnée dans les mêmes conditions à deux reprises. Après un
total de
18h d'agitation à température ambiante, le milieu réactionnel est déposé au
sommet
d'une colonne de Sephadex G-25 éluée par du chlorure de sodium 0,2 M. On
concentre les fractions contenant le produit et on dessale en utilisant la
même colonne
éluée par l'eau. Les fractions contenant le produit sont alors concentrées
sous vide
poussé pour conduire au composé désiré 2 (26 mg, 89%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.14
IdoUAvIll, 5.12* Glcvll, 5.14 IdoUAvI, 5.11* Glcv, 5.14 IdoUe, 5.10* Gle, 5.15
IdoUAll,
4.50 GIcI
* : Les signaux peuvent être interchangés.
Méthode "ESI", mode négatif : ion multichargé détecté m/z 588.1095 [M-4H]4
(forme acide).
EXEMPLE 3 : Pentyl (2-0-sodium sulfonato-a-L-idobyranosyluronate de
sodium )-(14)-(2-désoxy-2-(1-oxohexyl)am ino-6-0-sod iu m
sulfonato-a-D-
glucopyranosyl)-(14)-(2-0-sodium sulfonato-a-L-idobyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxohexyl)amino-6-0-sodium
sulfonato-a-D-qlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idobyranosyluronate de sodium)-(14)-(2-désoxy-2-
(1-oxohexyl)amino-6-0-sodium
sulfonato-a-D-qlucopyranosyl)-(14)-(2-0-sodium
sulfonato-a-L-idobyranosyluronate de sodium)-(14)-2-désoxy-2-(1-oxohexyl)amino-
6-
0-sodium sulfonato-P-D-qlucopyranoside (composé n 3)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
100
OSO Na
OSO,Na
OSO3Na 0 NaO,CA). 70H 0 C: 7
O(CH)CH 3
OSO3Na 0 Na02C7(0470 HO
N0 a02C/z(04;7
NaO2 0 ;
C OH 0 0 HO 0 H3C(CH2)4CONH
0 HO 0
HO H3C(CH2)4CONH
...< ..77/
Na03S0
0 HHO3 0
(CH2)4CONH Na03S0 H3C(CH2)4CONH Na03S0
Na03S0
A une solution du composé 43 (10 mg, 4.27 pmol) dans l'eau (0.3 mL) sont
additionnés goutte à goutte et à 0 C de la diisopropyléthylamine (20 pL, 26.8
équivalents molaires) en solution dans du N,N-diméthylformamide (200 pL),
ainsi que
de l'hexanoate de N-hydroxysuccinimide (18.2 mg, 20 équivalents molaires) en
solution
dans du N,N-diméthylformamide (500 pL). Une agitation est maintenue à 0 C
pendant
min puis à température ambiante pendant 16h. Le milieu réactionnel est ensuite
10 déposé au sommet d'une colonne de Sephadex G-25 éluée par du chlorure
de
sodium 0,2 M. On concentre les fractions contenant le produit et on dessale en
utilisant
la même colonne éluée par l'eau. Les fractions contenant le produit sont alors
concentrées sous vide poussé pour conduire au composé désiré 3 (4 mg, 34%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 6 5.11
15 IdoUAvIll, 5.08 Glcvll, 5.14 IdoUAvI, 5.09 Glcv, 5.13 IdoUe, 5.10 Gle,
5.14 IdoUAll, 4.47
GIcI
Méthode "ESI", mode négatif : ion multichargé détecté m/z 627.6120 [M-4H]4
(forme acide).
EXEMPLE 4: Pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(24(cyclopentylcarbonyl)aminol-2-désoxy-6-0-sodium sulfonato-a-
D-
glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(24(cyclopentylcarbonyl)amino1-2-désoxy-6-0-sodium sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(24(cyclopentylcarbonyl)amino1-2-désoxy-6-0-sodium sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-24(cyclopentylcarbonyl)amino1-2-désoxy-6-0-sodium sulfonato-6-D-
glucopyranoside (composé n 4)
OSO Na
OSO Na
OSO3Na 0 Na02C/zç/o
0(CH ) CH
OSO3Na 0 Na02C/zçH7
0 Na02C/zÇ7 0 0 HO
0 0 HO 0 NH
NaO2C OH 0
NH 0
0
HO
0 HO NH 0
0::::] Na03S0
HO
NH 0
Oii:1 Na03S0 0 ii:] Na03S0
Na03S0
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
101
A une solution du composé 43 (9 mg, 3.84 pmol) dans de l'eau (0.3 mL) sont
additionnés goutte à goutte et à 0 C du N,N-diméthylformamide (0.5 mL), de la
diisopropyléthylamine (7 pL, 2.6 équivalents molaires par amine libre) en
solution dans
du N,N-diméthylformamide (50 pL), ainsi que du cyclopentane carboxylate de N-
hydroxysuccinimide (6.6 mg, 2 équivalents molaires par amine libre) en
solution dans
du N,N-diméthylformamide (50 pL). Une agitation est maintenue à température
ambiante pendant 2h, puis la même quantité de réactif est additionnée dans les
mêmes conditions à quatre reprises. Après un total de 18h d'agitation à
température
ambiante, le milieu réactionnel est déposé au sommet d'une colonne de Sephadex
G-
25 éluée par du chlorure de sodium 0,2 M. On concentre les fractions contenant
le
produit et on dessale en utilisant la même colonne éluée par l'eau. Les
fractions
contenant le produit sont alors concentrées sous vide poussé pour conduire au
composé désiré 4 (5.6 mg, 55%). En cas de réaction incomplète, le produit
obtenu peut
être ré-engagé dans les mêmes conditions. Si nécessaire, il peut être purifié
par
chromatographie d'échange d'ions en utilisant une colonne Dionex CarboPac
PA100
semi-préparative (9 x 250 mm) avec un gradient partant d'un éluant A vers un
éluant B,
l'éluant A étant constitué d'un mélange eau/acétonitrile (4/1) + 0.01% de
diméthylsulfoxyde, et l'éluant B d'un mélange d'une solution de chlorure de
sodium 2N
et d'acétonitrile (4/1). On concentre alors les fractions contenant le produit
et on
dessale en utilisant une colonne de Sephadex G-25 éluée à l'eau. Les
fractions
contenant le produit sont alors concentrées sous vide poussé pour conduire au
composé désiré 4.
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.06*
IdoUAvIll, 5.05 Glcvll, 5.08* IdoUAvI, 5.03** Glcv, 5.06* IdoUe, 5.05' Gle,
5.08*
IdoUAll, 4.44** GIcl
* et ** : Les signaux peuvent être interchangés.
[]D 15.4 (c 0.25; H20).
EXEMPLE 5: Undecyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-sod iu m
sulfonato-a-D-qlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su
Ifonato-a-D-qlucopyranosyl)-(14)-(2-0-sodi um
su lfonato-a-L-idopyranosyl uronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-
sodium sulfonato-a-D-
qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-
6-
D-qlucopyranoside (composé n 5)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
102
OSO3 Na
OSO,Na
OSO3Na 0 Na02C/zny
OH
\.:..\213 3
O(CH) CH
0
OSO3Na 0 Na02C/z4;70 Na02C/zÇ17 0 HO
AcNH
Na02C OH 0 0 HO
AcNH
0 HO
7.--D/7/ 11 AcNH AcNH Na03S0
Na03S0
HO Na03S0
Na03S0
A une solution aqueuse saturée d'hydrogénocarbonate de sodium (2.3 mL) du
composé 52 (32 mg, 13.2 pmol) sont additionnés de l'hydrogénocarbonate de
sodium
(174 mg, 2.08 mmol), puis goutte à goutte et à 0 C, de l'anhydride acétique
(100 pL,
1.05 mmol). Après 2.5h d'agitation vigoureuse à 0 C puis 15h à température
ambiante,
le milieu réactionnel est déposé au sommet d'une colonne de Sephadex G-25
éluée
par du chlorure de sodium 0,2 M. On concentre les fractions contenant le
produit et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 5 (31
mg,
91%).
Déplacements chimiques des protons anomériques (500 MHz, D20) 5 5.14
IdoUAvIll, 5.13* Glcvll, 5.14** IdoUAvI, 5.13* Glcv, 5.15
IdoUe, 5.13* Gle, 5.16
IdoUAll, 4.50 GIcI
* et ** : Les signaux peuvent être interchangés.
[]i) 18.6 (c 1 ; H20).
EXEMPLE 6 : 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate
de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyI)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su
Ifonato-a-D-qlucopyranosyl)-(14)-(2-0-sodi um
su lfonato-a-L-idopyranosyl uronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-
sodium sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-
P-
D-qlucopyranoside (composé n 6)
OSO Na
OSO3Na
OSO3Na 0 Na02C/zçyy0
OH
;\:..\2, 6 ,
0(CH ) C H
OSO3Na 0 Na02C/z(0:77/0 0 HO
AcNH
0 0 HO
Na0
07/ 2C OH 0 0 Na02c/A0;71
AcNH
HO
AcNH Na03S0
0 HO
AcNH Na03S0
HO Na03S0
Na03S0
A une solution aqueuse saturée d'hydrogénocarbonate de sodium (2.7 mL) du
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
103
composé 53 (36 mg, 14.8 pmol) sont additionnés de l'hydrogénocarbonate de
sodium
(199 mg, 2.38 mmol), puis goutte à goutte et à 0 C, de l'anhydride acétique
(112 pL,
1.19 mmol). Après 2.5h d'agitation vigoureuse à 0 C puis 15h à température
ambiante,
le milieu réactionnel est déposé au sommet d'une colonne de Sephadex G-25
éluée
par du chlorure de sodium 0,2 M. On concentre les fractions contenant le
produit et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 6
(25.6 mg,
68%). Si nécessaire, il peut être purifié par chromatographie d'échange d'ions
en
utilisant une colonne Dionex CarboPac PA100 semi-préparative (9 x 250 mm)
avec un
gradient partant d'un éluant A vers un éluant B, l'éluant A étant constitué
d'un mélange
eau/acétonitrile (4/1) + 0.01% de diméthylsulfoxyde, et l'éluant B d'un
mélange d'une
solution de chlorure de sodium 2N et d'acétonitrile (4/1). On concentre alors
les
fractions contenant le produit et on dessale en utilisant une colonne de
Sephadex G-
25 éluée à l'eau. Les fractions contenant le produit sont alors concentrées
sous vide
poussé pour conduire au composé désiré 6.
Déplacements chimiques des protons anomériques (500 MHz, D20) 5 5.14
IdoUAvIll, 5.12 Glcvll, 5.16 IdoUAvI, 5.12 Glcv, 5.16 IdoUe, 5.12 Gle, 5.17
IdoUAll, 4.48
GIcI
Méthode "ESI", mode négatif : ion multichargé détecté m/z 579.0867 [M-4H]4
(forme acide).
EXEMPLE 7 : Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-
1(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosy1)12-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-acétamido-2-désoxy-6-0-
sodium sulfonato-a-D-qlucopyranoside (composé n 7)
OSO3Na
OSO3Na 0
OSO3Na 0 Na02C/z(40;7/0
OSO3Na n Na C OH
Na C OH 0 Ho
OMe
AcNH
NaO2C/z(04H)7/oe\_\
0 2 µo 0H
0 Ho
AcNH
AcNH Na03S0
0 Ho
AcNH Na03S0
HO Na03S0
Na03S0
A une solution du composé 77 (10,8 mg, 4,73 pmol) dans une solution saturée
d'hydrogénocarbonate de sodium (472 pL) sont ajoutés successivement, à 0 C et
sous
atmosphère inerte, l'hydrogénocarbonate de sodium solide (64 mg) et
l'anhydride
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
104
acétique (36 pL). Après 18h d'agitation à température ambiante, le mélange
réactionnel est filtré (filtre Millipore LSWP 5 pm) puis déposé sur une
colonne de gel
Sephadex G-25 fine éluée par une solution aqueuse de NaCI 0,2 M. Les
fractions
contenant le composé attendu sont réunies, et déposées sur une colonne de
Sephadex G-25 fine (95 x 2 cm) éluée par de l'eau et on obtient 6,7 mg du
composé
7.
1H RMN (D20) 5 des protons anomériques : 5,20 ; 5,18 (2 H) ; 5,17 (2H) ; 5,16
;
5,15 ; 4,78 ppm.
Masse : méthode "ESI", mode négatif : masse théorique = 2453,62 ; masse
expérimentale : 2453,22 0,17 u.m.a.
EXEMPLE 8 : Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-a-D-
glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranoside (composé
n 8)
OSO3Na
OH 0
OSO Na03Na .......&00\..\\ C
0
0 2 , H
OSO3Na 0 Na02;z<>0:77/0
0 HO AcNHOMe
No aO2C/z(t0;7/
0 0 HO
Na020 OH 0
AcNH
HO 0 HO
/zist),07/
AcNH
NaO,SO HO
AcNH
Na03S0 Na03S0
Na03S0
Le composé 85 (23,0 mg, 11,1 pmol) est traité selon le même mode opératoire
que celui décrit pour la préparation du composé 7 pour donner le composé 8
(25,2
mg).
1H RMN (D20) 5 des protons anomériques : 5,45; 5,42 (2 H) ; 5,22 ; 5,21 ; 5,20
; 5,18; 5,03 ppm.
Masse : méthode "ESI", mode négatif : masse théorique = 2249,53 ; masse
expérimentale : 2249,19 0,18 u.m.a.
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
105
EXEMPLE 9 : Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-
acétamido-2-désoxy-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-(1 4)-(2-0-sodi
um
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-a-D-
glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1 4)-2-acétamido-2-désoxy-a-D-qlucopyranoside (composé n 9)
OH
OH 0
S0 NH
OSO3Na 0 Na02C/z(40:4)71 /0
OSO3Na n Na0 C OH
AcNHOMe
Na02C/z(04;17/0
0 2 µo 0 H Ho
Ac
AcNH NaO,S0
0 Ho
AcNH Na03
HO Na03S0
Na03S0
Le composé 90 (52,1 mg, 23,9 pmol) est traité selon le même mode opératoire
que celui décrit pour la préparation de l'exemple 7 pour donner le composé 9
(50,7
mg).
1H RMN (D20) 5 des protons anomériques : 5,18 ; 5,16 (2H); 5,14 ; 5,15; 5,13 ;
5,09 ; 4,75 ppm.
Masse : méthode "ESI", mode négatif : masse théorique = 2351,57 ; masse
expérimentale : 2350,88 0,10 u.m.a.
EXEMPLE 10 : Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(1 4)-(2-acétam ido-2-désoxy-a-D-qlucopyranosyl)-(1 4)-(2-0-sod iu m
su lfonato-a-L-idopyranosyl uronate de sodi u m)-(1 4)-(2-acétam ido-2-
désoxy-6-0-
sodium sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-
L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-qlucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(1 4)-2-acétamido-2-désoxy-a-D-qlucopyranoside (composé n 10)
OH
OSO,Na
OSONa o Na02C/z(tOtt,7
H
C\:...\\
OH 0 Na02C/z(041)-17 0
0 0 Ho
AcNHOMe
0 Na02C/4.;17
0 0 Ho
Na02C OH 0 AcNH
0 Ho
AcNH Na03S0
0 Ho
AcNH Na03S0
HO Na03S0
Na03S0
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
106
A une solution aqueuse saturée d'hydrogénocarbonate de sodium (3.7 mL) du
composé 100 (76 mg, 37 pmol) sont additionnés de l'hydrogénocarbonate de
sodium
(497 mg, 5.92 mmol), puis goutte à goutte et à 0 C, de l'anhydride acétique
(283 pL,
3.0 mmol). Après 3h d'agitation vigoureuse à 0 C puis 15h à température
ambiante, le
milieu réactionnel est déposé au sommet d'une colonne de Sephadex G-25 éluée
par
du chlorure de sodium 0,2 M. On concentre les fractions contenant le produit
et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 10 (61
mg,
73%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.13
IdoUAvIll, 5.13 Glcvll, 5.15 IdoUAvI, 5.13 Glcv, 5.16 IdoUe, 5.10 Gle, 5.16
IdoUAll, 4.75
GIcI
Masse : méthode "ESI", mode négatif : masse théorique = 2249.53 ; masse
expérimentale : 2249.02 0,35 u.m.a.
EXEMPLE 11 : Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(14)-(2-acétam ido-2-désoxy-a-D-qlucopyranosyI)-(14)-(2-0-sod iu m
su lfonato-a-L-idopyranosyl uronate de sodium )-(14)-(2-acétam ido-2-
désoxy-6-0-
sodium sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-qlucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranoside (composé
n 11)
OSO Na
OSO3Na
OSONa o Na02C/440N)7
H
C4.\\
OH 0 Na02C/z(tOtH)7 0
0 0 Ho
AcNHOMe
0 Na02C7.77/
0 0 Ho
/z(44,7
Na02C OH 0 AcNH
0 Ho 0
AcNH Na03S0
0 Ho
AcNH Na03S0
HO Na03S0
Na03S0
A une solution aqueuse saturée d'hydrogénocarbonate de sodium (2.6 mL) du
composé 105 (56 mg, 26 pmol) sont additionnés de l'hydrogénocarbonate de
sodium
(349 mg, 4.16 mmol), puis goutte à goutte et à 0 C, de l'anhydride acétique
(194 pL,
2.05 mmol). Après 3h d'agitation vigoureuse à 0 C puis 15h à température
ambiante, le
milieu réactionnel est déposé au sommet d'une colonne de Sephadex G-25 éluée
par
du chlorure de sodium 0,2 M. On concentre les fractions contenant le produit
et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
107
sont alors concentrées sous vide poussé pour conduire au composé désiré 11 (45
mg,
74%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.13
IdoUAvIll, 5.12 Glcvll, 5.16 IdoUAvI, 5.12 Glcv, 5.15 IdoUe, 5.13 Gel, 5.17
IdoUAll, 4.72
GIcI
Masse : méthode "ESI", mode négatif : masse théorique = 2351.57 ; masse
expérimentale : 2351.13 0.06 u.m.a.
EXEMPLE 12: Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-sod iu m sulfonato-a-D-
qlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-
acétamido-2-désoxy-a-D-qlucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-qlucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-acétamido-2-désoxy-a-D-qlucopyranoside (composé n 12)
OH
OSO3Na
OH o Na02C/z(i7
OSO3Na 0 Na02C/z(40.H)7 0
0 0 Ho OMe
0 /z( Na02C/z(t041,->
AcNH
Na02 0C OH 0 %).7/ 0 Ho
AcNH
0 Ho 0
AcNH Na03S0
0 Ho
AcNH Na03S0
HO Na03S0
Na03S0
A une solution aqueuse saturée d'hydrogénocarbonate de sodium (1.4 mL) du
composé 113 (29.5 mg, 14 pmol) sont additionnés de l'hydrogénocarbonate de
sodium
(188 mg, 2.24 mmol), puis goutte à goutte et à 0 C, de l'anhydride acétique
(105 pL,
1.12 mmol). Après 3h d'agitation vigoureuse à 0 C puis 15h à température
ambiante, le
milieu réactionnel est déposé au sommet d'une colonne de Sephadex G-25 éluée
par
du chlorure de sodium 0,2 M. On concentre les fractions contenant le produit
et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 12 (29
mg,
92%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.12
IdoUAvIll, 5.06 Glcvll, 5.14 IdoUAvI, 5.11 Glcv, 5.13 IdoUe, 5.09 Gle, 5.14
IdoUAll, 4.73
GIcl
Dal) 115.3 (c 0.3 ; H20).
EXEMPLE 13 : Méthyl (2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium )-(14)-(2-acétam ido-2-désoxy-6-0-sod iu m
sulfonato-a-D-qlucopyranosyl)-
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
108
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-(14)-(2-
acétamido-2-désoxy-a-D-qlucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-acétamido-2-désoxy-6-0-sodium sulfonato-
a-D-qlucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-acétamido-2-désoxy-6-0-sodium sulfonato-a-D-qlucopyranoside (composé
n 13)
H 3.\OSO Na
OSO3Na
OH o Na02C/zitt0.)7
OSO3Na 0 Na02C/z(40.H)7 0
0 0 Ho \
\OMe
0 /z Na02C/z(t04;7
AcNH
Na02 0C OH 0 0
Ho
HO 0 Ho (41477/
AcNH
Na03S0
0 Ho
AcNH 0
Na03S0 AcNH
Na03S0
Na03S0
A une solution aqueuse saturée d'hydrogénocarbonate de sodium (1.26 mL) du
composé 118 (27 mg, 12.6 pmol) sont additionnés de l'hydrogénocarbonate de
sodium
(169 mg, 2.02 mmol), puis goutte à goutte et à 0 C, de l'anhydride acétique
(95 pL,
1.01 mmol). Après 3h d'agitation vigoureuse à 0 C puis 16h à température
ambiante, le
milieu réactionnel est déposé au sommet d'une colonne de Sephadex G-25 éluée
par
du chlorure de sodium 0,2 M. On concentre les fractions contenant le produit
et on
dessale en utilisant la même colonne éluée par l'eau. Les fractions contenant
le produit
sont alors concentrées sous vide poussé pour conduire au composé désiré 13
(26.5
mg, 89%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.12
IdoUAvIll, 5.05 Glcvll, 5.13 IdoUAvI, 5.10 Glcv, 5.13 IdoUe, 5.10 Gel, 5.14
IdoUAll, 4.72
GIcI
Masse : méthode "ESI", mode négatif : masse théorique = 2351.57 ; masse
expérimentale : 2350.96 0.20 u.m.a.
EXEMPLE 14 : 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate
de sodium )-(14)-(2-
désoxy-2-(1-oxobutyl)am ino-6-0-sod iu m sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium
sulfonato-a-D-qlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-
(1-oxobutyl)amino-a-D-qlucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de
sodium)-(14)-2-désoxy-2-(1-oxobutyl)amino-p-D-
glucopyranoside (composé n 14)
CA 02771056 2012-02-13
WO 2011/018588
PCT/FR2010/051703
109
OH
OH
OSO,Na Na0 C OH O
0(CH)Ph
7CONH
2 ,
OSO,Na 0 Na02C/z(40;"
0 HO
0 0 HO C3H,CONH0
C3H7CONH 2,
Na02C OH 0 0 Na02c/ze7-71
HO
0 HO 0
C3H7CONH
Na03S0 HO 0
C3H
Na03S0 Na03S0
Na03S0
A une solution du composé 171 (126 mg, 56.9 pmol) dans un mélange 7 :3
N,N-diméthylformamide/eau (12.6 mL) sont additionnés goutte à goutte et à 0 C
de la
diisopropyléthylamine (148 pL, 14.9 équivalents molaires) en solution dans du
N,N-
diméthylformamide (100 pL), ainsi que du butyrate de N-hydroxysuccinimide (116
mg,
11 équivalents molaires) en solution dans du N,N-diméthylformamide (100 pL).
Une
agitation est maintenue à température ambiante pendant 3h, puis la même
quantité de
réactif est additionnée dans les mêmes conditions à trois reprises. Après un
total de
23h d'agitation à température ambiante, le milieu réactionnel est déposé au
sommet
d'une colonne de Sephadex G-25 éluée par du chlorure de sodium 0,2 M. On
concentre les fractions contenant le produit et on dessale en utilisant la
même colonne
éluée par l'eau. Les fractions contenant le produit sont alors concentrées
sous vide
poussé pour conduire au composé désiré 14(133 mg, 93%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.07
IdoUAvIll, 4.99 Glcvll, 5.09 IdoUAvI, 5.04 Glcv, 5.10 IdoUe, 5.01 Gle, 5.06
IdoUAll, 4.38
GIcI
[]p 50.5 (c 1 ; H20).
EXEMPLE 15 : 2-propyl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate
de sodium )-(1 4)-(2-d ésoxy-2-(1-oxobutyl)am in o-6-0-sod iu m
sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(1 4)-(2-d ésoxy-2-(1-oxobutyl)am in o-6-0-sod iu m
sulfonato-a-D-dlucopyranosyl)-
(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-
(1-oxobutyl)amino-a-D-dlucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-
idopyranosyluronate de
sodium)-(14)-2-désoxy-2-(1-oxobutyl)amino-p-D-
glucopyranoside (composé n 15)
OH
OH 0
OSO NaOC 0
,Na
OCH CHPr,
C3H7CONH 2
OSO,Na 0 Na0,C/z(0.H)70__&e\_\
0 Na0,C/zçiey0 0 ,. Ho
HO
NaO,C OH 0 0 HO 0
HO
0 HO 0
C3H7CONH
Na03S0
0 HO 0
C3H7CONH
Na03S0 C3H7CONH
Na03S0
Na03S0
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
110
Le composé 172 (47 mg, 22 pmol) est traité selon un protocole similaire à
celui
décrit pour la synthèse de 14 pour fournir le composé 15 (46 mg, 85%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.33
IdoUAvIll, 5.30 Glcvll, 5.35 IdoUAvI, 5.24 Glcv, 5.36 Idolle, 5.27 Gle, 5.32
IdoUAll, 4.63
GIcI
[a],, 60 (c 1 ; H20).
EXEMPLE 16: 3-cyclohexyl-propyl (2-0-sodium sulfonato-
a-L-
idopyranosyluronate de sodium)-(14)-(2-désoxy-2-acétamido-6-0-sodium sulfonato-
a-D-qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-(2-désoxy-2-acétamido-6-0-sodium su Ifonato-a-D-qlucopyranosyl)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-(2-désoxy-2-acétamido-
a-
D-qlucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de
sodium)-
(14)-2-désoxy-2-acétamido-13-D-qlucopyranoside (composé n 16)
OH
OH
OSO3Na Na0 C OH O
0(CH 2)3C 61-1
H3CCONH
õ
OSO
,0 2
0 HO
0 Na02C/440N;7
Na02C OH 0 0 HO H3CCONH 0
0 HO H3CCONH 0 Na03S0
7.<4C):07/ H0
HO H3CCONH 0 Na03S0
Na03S0
Na03S0
Le composé 172 (10 mg, 4.56 pmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 13 pour fournir le composé 16(8.8 mg, 82%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.15
IdoUAvIll, 5.08 Glcvll, 5.17 IdoUAvI, 5.13 Glcv, 5.17 Idolle, 5.11 Gle, 5.16
IdoUAll, 4.50
GIcI
[a],, +40.9 (c 0.88; H20).
EXEMPLE 17: 3-cyclohexyl-propyl (2-0-sodium sulfonato-
a-L-
idopyranosyluronate de sodium)-(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium
sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate
de sodium )-(14)-(2-
désoxy-2-(1-oxobutyl)am ino-6-0-sod iu m sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-a-D-qlucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-désoxy-2-(1-oxobutyl)amino-
p-
D-qlucopyranoside (composé n 17)
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
1 1 1
OH
OH 0
OSO,Na Na0 C :
0(CH2)3C,Hõ
OSO3Na 0 Na02C/z/s:H)70.07\
0 Na02C/44,4041,170 HO 3 7
0 2 O.,
C H CONH
Na02C OH 0 0 HO 0
HO
0 HO 0
C3H,CONH
Na03S0
C3H,CONH
Na03S0 C H CONH
3 7
Na03S0
Na03S0
Le composé 173 (10 mg, 4.56 pmol) est traité selon un protocole similaire à
celui décrit pour la synthèse de 14 pour fournir le composé 17 (7.7 mg, 69%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.23
IdoUAvIll, 5.20 Glcvll, 5.25 IdoUAvI, 5.15 Glcv, 5.26 IdoUe, 5.17 Gle, 5.22
IdoUAll, 4.57
GIcI
[a]) +53.8 (c 0.77; H20).
EXEMPLE 18: 3,3-diphényl-propyl (2-0-sodium
sulfonato-a-L-
idopyranosyluronate de sodium)-(14)-(2-désoxy-2-(1-oxobutyl)amino-6-0-sodium
sulfonato-a-D-qlucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-
idopyranosyluronate
de sodium )-(14)-(2-
désoxy-2-(1-oxobutyl)am ino-6-0-sod iu m sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(1-oxobutyl)amino-a-D-qlucopyranosy1)-(14)-(2-0-sodium
sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-désoxy-2-(1-oxobutyl)amino-
p-
D-qlucopyranoside (composé n 18)
OH
OH
OSO,Na Na0 C OH
O 0(CH2)2CHPh2
OSO
0 2 , 3Na 0
Na02C7(0.H.,70_007..\\
0 HO
0 Na02C/z(OtH)7
C3H,CONH
0 0 HO 0
Na02C OH 0
C3H,CONH
HO
A4,7
0 HO 0
C3H,CONH
Na03S0
C3H,CONH
Na03S0 Na03S0
Na03S0
A une solution du composé 174 (5.5 mg, 2.4 pmol) dans un mélange 2 :1 N,N-
diméthylformamide/eau (4.8 mL) sont additionnés goutte à goutte et à 0 C de la
diisopropyléthylamine (63 pL, 15 équivalents molaires) en solution dans du N,N-
diméthylformamide (43 pL), ainsi que du butyrate de N-hydroxysuccinimide (49
mg, 11
équivalents molaires) en solution dans du N,N-diméthylformamide (43 pL). Une
agitation est maintenue à température ambiante pendant 3h, puis la même
quantité de
réactif est additionnée dans les mêmes conditions à trois reprises. Après un
total de
24h d'agitation à température ambiante, le milieu réactionnel est déposé au
sommet
d'une colonne de Sephadex G-25 éluée par du chlorure de sodium 0,2 M. On
concentre les fractions contenant le produit et on dessale en utilisant la
même colonne
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
112
éluée par l'eau. Les fractions contenant le produit sont alors concentrées
sous vide
poussé pour conduire au composé désiré 18 (6 mg, 98%).
Déplacements chimiques des protons anomériques (600 MHz, D20) 6 5.22
IdoUAvIll, 5.19 Glcvll, 5.23 IdoUAvI, 5.13 Glcv, 5.23 IdoUe, 5.17 Gle, 5.20
IdoUAll, 4.48
GIcI
[a],, +24 (c 0.48, H20).
EXEMPLE 19 : 5-phényl-pentyl (2-0-sodium sulfonato-a-L-idopyranosyluronate
de sodium)-(14)-(2-désoxy-2-(3-méthy1-1-oxobutyl)amino-6-0-sodium sulfonato-a-
D-
glucopyranosy1)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(3-méthy1-1-oxobutyl)amino-6-0-sodium sulfonato-a-D-
glucopyranosyI)-(14)-(2-0-sodium sulfonato-a-L-idopyranosyluronate de sodium)-
(14)-(2-désoxy-2-(3-méthy1-1-oxobutyl)am ino-a-D-qlucopyranosyI)-(14)-(2-0-
sodium sulfonato-a-L-idopyranosyluronate de sodium)-(14)-2-désoxy-2-(3-méthy1-
1-
oxobutyl)amino-P-D-qlucopyranoside (composé n 19)
OH
OH 0
OSO3Na 0 Na02C0%;70
0(CH2)513h
OSO3Na 0 Na02C/zzÇ70
0 Na02C/z(40:4,17 0 Ho
NaO2C OH 0 0 HO 0 (CH3)2CHCH2CONH
0
0 HO 0 (CHH3 )2CHCH2CONH
HO )/ (CH3)2CHCH200NH
A
Na03S0 Na03S0 (CH3)2CHCH2CONH Na03S0
Na03S0
Une solution du composé 171 (84 mg, 37.8 pmol) dans un mélange 7:3 N,N-
diméthylformamide/eau (8.4 mL) est traité avec de la 1-[(3-methylbutanoyl)oxy]
pyrrolidine-2,5-dione selon un procédé analogue à la synthèse du composé 14
pour
conduire au composé désiré 19 (41.8 mg, 43%). Si nécessaire, il peut être
purifié par
chromatographie d'échange d'ions en utilisant une colonne Dionex CarboPac
PA100
semi-préparative (9 x 250 mm) avec un gradient partant d'un éluant A vers un
éluant B,
l'éluant A étant constitué d'un mélange eau/acétonitrile (4/1) + 0.01% de
diméthylsulfoxyde, et l'éluant B d'un mélange d'une solution de chlorure de
sodium 2N
et d'acétonitrile (4/1). On concentre alors les fractions contenant le produit
et on
dessale en utilisant une colonne de Sephadex G-25 éluée à l'eau. Les
fractions
contenant le produit sont alors concentrées sous vide poussé pour conduire au
composé désiré 19 pur.
Déplacements chimiques des protons anomériques (600 MHz, D20) 5 5.23
IdoUAvIll, 5.19 Glcvll, 5.24 IdoUAvI, 5.13 Glcv, 5.25 IdoUe, 5.17 Gle, 5.22
IdoUAll, 4.55
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
113
GIcI
Méthode "ESI", mode négatif : ion multichargé détecté m/z 581.3517 [M-4H]4-
(forme acide).
Les composés selon l'invention ont fait l'objet d'essais pharmacologiques
permettant de déterminer leur effet agoniste des récepteurs des FGFs et leur
activité
sur l'angiogenèse, ainsi que sur la revascularisation post-ischémique.
Modèle d'angiogenèse in vitro : activité spécifique envers le FGF2
Le modèle d'angiogenèse in vitro correspond à un réarrangement de cellules
endothéliales veineuses humaines sur une matrice biologique. La matrice est
réalisée
en distribuant, dans chaque puits d 'une plaque de 96 puits (Becton Dickinson
353872), 60 pl de Matrigel dilué au 1/3 (Growth factor reduced Matrigel :
Becton
Dickinson 356230) dans du collagène (rat Tail collagène, type I : Becton
Dickinson
354249). La matrice biologique se durcit après 1 heure à 37 C.
Des cellules endothéliales veineuses humaines (HUVEC réf : C-12200 -
Promocell) ensemencées sur la matrice biologique à 7800 cellules/puits dans
120 pl
de milieu EBM (Endothelial Basal Medium, Lonza C3121) + 2% SVF (sérum de veau
foetal - Lonza) + hEGF (Epidermal Growth Factor Humaine Recombinante - Lonza)
10 pg/ml. Les cellules sont stimulées avec le FGF2 (R&D Systems /234 - FSE - 0
50)
10 ng/ml ou avec les produits de l'invention pendant 18 heures à 37 C en
présence
de 5% de CO2. Après 24 heures, les cellules sont observées au microscope
(objectif
X4) et l'analyse de la longueur des pseudo-tubules est effectuée à l'aide d'un
logiciel
d'image (BIOCOM-logiciel Visiolab 2000).
Dans ce test d'angiogenèse in vitro, les composés de l'invention présentent
une
activité spécifique comprise entre 10-6 M et 10-12M. Par exemple, les composés
n 1 et
2 sont actifs à 10-11M.
Modèle d'implant en cellulose chez la souris
Ce modèle est une adaptation du modèle décrit par Andrade et al.
(Microvascular Research, 1997, 54, 253-61) afin de tester des produits
pharmacologiques susceptibles d'activer l'apparition de l'angiogenèse.
Les animaux (souris blanches BALB/c J consanguines) sont anesthésiées avec
un mélange Xylazine (Rompun , 10 mg/kg) / Kétamine (Imalgène 1000, 100 mg/kg)
par voie intra-péritonéale. Le dos de l'animal est rasé et désinfecté à
l'Héxomédine .
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
114
Une poche d'air est créée en sous-cutané sur le dos de la souris par injection
de 5 ml
d'air stérile. Une incision d'environ 2 cm, sur le haut du dos de l'animal est
réalisée afin
d'introduire un implant de cellulose stérile (disque de 1 cm de diamètre, 2 mm
d'épaisseur, Cellspon ref 0501) imprégné avec 50 pl de solution stérile
contenant le
produit à tester. L'incision est ensuite suturée et nettoyée à l'Héxomédine .
Les jours suivants la pose de l'implant, les souris peuvent recevoir dans
l'implant le produit par une injection à travers la peau (50 pl/implant/jour)
sous
anesthésie gazeuse (lsoflurane à 5% (Aerrane , Baxter)).
Sept jours après la pose de l'éponge, les souris sont sacrifiées par une dose
létale de Pentobarbital sodique (CEVA santé animale), administrée par voie
intra-
péritonéale. La peau est ensuite découpée, environ 1 cm autour de l'éponge en
évitant
la cicatrice afin de dégager la peau et l'éponge. L'éponge est ensuite
découpée en
plusieurs morceaux et placée dans un tube Ribolyser contenant 1 ml de tampon
de
lyse (Oeil Death Detection ELISA, Roche). Les tubes sont agités 4 fois
consécutives,
durant 20 secondes, force 4, au broyeur cellulaire (FastPrep FP 120). Les
tubes sont
ensuite centrifugés 10 minutes à 2000 g à 20 C et les surnageants sont
congelés à
-20 C en attendant le dosage de l'hémoglobine. Le jour du dosage, les tubes
sont à
nouveau centrifugés après décongélation et la concentration d'hémoglobine est
mesurée avec le réactif de Drabkin (Sigma, volume à volume) par lecture au
spectrophotomètre à 405 nm contre une gamme étalon d'hémoglobine bovine
(Sigma).
La concentration d'hémoglobine dans chaque échantillon est exprimée en
mg/mi d'après la régression polynomiale réalisée à partir de la gamme. Les
résultats
sont exprimés en valeur moyenne ( sem) pour chaque groupe. Les différences
entre
les groupes sont testées avec une ANOVA suivie d'un test de Dunnett sur la
racine
carrée des valeurs.
Dans ce test in vivo, les composés de l'invention ont démontré une activité
spécifique comprise entre 5 et 45 ng/site. Par exemple, les composés n 1 et 2
sont
actifs à 45 ng/site, et le composé n 7 est actif à 15 ng/site.
A titre de comparaison par rapport à un composé analogue au composé n 7
selon l'invention, mais dans lequel tous les groupes -NH-acyle sont remplacés
par des
groupes -NH-503-, le composé n 7 selon l'invention présente dans ce test une
activité
supérieure de 21% par rapport audit analogue entièrement sulfaté, ce qui
montre
l'importance des groupements N-acyles dans les composés selon l'invention.
Pharmacocinétique
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
115
Le profil pharmacocinétique des composés selon l'invention est évalué après
administration sous-cutanée , chez la souris OF1 ou C57/BL6 , à une
concentration de
30 mg/kg. L 'exposition systémique des composés est évaluée après une
administration unique chez l'animal prélablement anesthésié au pentobarbital.
Le
sang est prélevé au niveau de la veine cave, puis transféré dans des tubes
en plastique contenant de l'héparine de lithium. Après centrifugation (2000 g
pour 10
minutes à 8 C ), la concentration des composés dans le plasma est quantifiée
par
LC/MS-MS.
D'une façon générale, les composés testés présentent un profil
pharmacocinétique amélioré (notamment AUC et concentration plasmatique plus
élevées, temps de demi-vie plus longs) par rapport à des composés analogues
entièrement sulfatés (remplacement des groupes N-acyles par des groupes -NH-
S03-).
A titre d'exemple, les paramètres pharmacocinétiques des composés n 1, 6 et 7
selon
l'invention sont décrits dans le tableau qui suit, en comparaison avec un
analogue
entièrement sulfaté n 175 de formule suivante :
OSO3Na
OSO3Na
OSO3Na 0 Na02C/z<;7
H
OSO3Na
0 Na02;z<e)17-17 0
0 Na02C/zi:;7" 0 0 HO OMe
Na03SNH
0 0 HO Na03SNH 0
Na0 C __ H
0 HO Na03SNH 0
27---)7 HO 0 Na03S0
Na03SNH Na03S0
HO Na03S0
Na03S0
Composé 175
Composé AUC (0-Clast) T112 (h) Plasma conc., t = 4h
(ng.h/mL) (ng/mL)
N 1 18 000 1 924
N 6 95 000 0.46 5740
N 7 22 000 0.40 425
N 175 15 000 0.33 20
. AUC (0-tlast) : Aire sous la courbe ( Area Under the Curve ) entre le
temps 0
(temps initial d'administration du composé) et tlast (le temps de la dernière
mesure.
. T1/2 (h) : Temps de demi-vie
. Plasma conc., t = 4h : Concentration plasmatique à 4h
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
116
Ces résultats montrent l'importance des groupements N-acyles dans les
composés selon l'invention, qui les rendent particulièrement adaptés à leur
utilisation
en tant que médicaments.
Il ressort de ce qui précède que les composés selon l'invention ont une
activité
agoniste des récepteurs des FGFs et une activité sur l'angiogenèse, ainsi que
sur la
revascularisation post-ischémique. Les composés selon l'invention peuvent donc
être
utilisés pour la préparation de médicaments, notamment de médicaments utiles
pour le
traitement des maladies nécessitant une activation des récepteurs des FGFs ou
de
médicaments utiles dans des pathologies nécessitant une activation de
l'angiogenèse
et une revascularisation post-ischémique.
Ainsi, selon un autre de ses aspects, l'invention a donc pour objet des
médicaments qui comprennent un composé de formule (I)/(1') selon l'invention,
ou un
sel pharmaceutiquement acceptable de ce dernier.
Ces médicaments trouvent leur emploi en thérapeutique, notamment dans le
traitement de l'ischémie (ischémie cardiaque, ischémie artérielle des membres
inférieurs), le traitement des maladies associées à un rétrécissement ou à une
obstruction des artères ou des artérites, le traitement des angines de
poitrine, le
traitement de la thromboangéite oblitérante, le traitement de
l'athérosclérose, le
traitement de l'inhibition de la resténose après angioplastie ou
endoartérectomie, le
traitement de la cicatrisation, le traitement pour la régénération musculaire,
le
traitement pour la survie des myoblastes, le traitement de la neuropathie
périphérique,
le traitement des dommages nerveux post-opératoires, le traitement de
déficiences
nerveuses telles que la maladie de Parkinson, la maladie d'Alzheimer, la
maladie du
prion et la dégénérescence neuronale chez l'alcoolique, le traitement de
démences, le
traitement pour l'amélioration de la survie du greffon de pancréas
bioartificiel chez le
patient diabétique, le traitement de l'amélioration de la la revascularisation
des greffons
et de la survie des greffes, le traitement de la dégénérescence rétinienne, le
traitement
de la rétinite pigmentaire, le traitement de l'ostéoarthrite, le traitement de
la pré-
éclampsie ou le traitement des lésions vasculaires et du syndrome de détresse
respiratoire aiguë, le traitement pour la réparation des cartilages, le
traitement pour la
réparation et la protection osseuse, le traitement pour la réparation et la
protection des
follicules pileux et pour la protection et la régulation de la croissance
capillaire.
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
117
L'ischémie est une diminution de la circulation artérielle dans un organe
entraînant une baisse de la concentration en oxygène dans les tissus lésés.
Dans les
mécanismes de revascularisation post-ischémiques, deux mécanismes principaux
entrent en jeu : l'angiogenèse et l'artériogenèse. L'angiogenèse est le
processus de
génération de nouveaux vaisseaux capillaires à partir de vaisseaux pré-
existants.
L'artériogenèse contribue au développement (augmentation en taille et en
calibre) des
vaisseaux collatéraux autour de la zone ischémiée ou avasculaire.
Parmi les facteurs de croissance impliqués dans ces processus de
revascularisation, la famille des FGF et notamment le FGF-2 a été la plus
largement
décrite (Post, M. J., Laham, R., Sellke, F. W. & Simons, M. Therapeutic
angiogenesis
in cardiology using protein formulations. Cardiovasc Res 49, 522-31 , 2001).
Ainsi, le
FGF2 et ses récepteurs représentent des cibles très pertinentes pour les
thérapies
visant à induire les processus d'angiogenèse et d'artériogenèse (Khurana, R. &
Simons, M. Insights from angiogenesis trials using fibroblast growth factor
for
advanced arteriosclerotic disease. Trends Cardiovasc Med 13, 116-22, 2003).
L'une des applications des composés de l'invention est le traitement post-
ischémique après occlusion au niveau cardiaque ou des artères périphériques.
En ce
qui concerne le traitement de l'ischémie cardiaque, un des essais cliniques
les plus
prometteurs est un essai clinique où du FGF-2 était séquestré dans des micro-
sphères
d'alginate en présence d'héparine (Laham, R. J. et al. Local perivascular
delivery of
basic fibroblast growth factor in patients undergoing coronary bypass surgery:
results
of a phase I randomized, double-blind, placebo-controlled trial. Circulation
100, 1865-
71, 1999). Ces micro-sphères étaient implantées proche du foyer ischémique au
niveau du myocarde. Après 90 jours, tous les patients traités au FGF2 ne
présentaient
aucun symptôme cardiaque ischémique. En comparaison, dans le groupe contrôle,
3
des 7 patients possédaient à 90 jours des symptômes persistants et 2 patients
ont eu
recours à de la chirurgie vasculaire. De façon intéressante, le bénéfice de la
thérapie
étaient maintenu après 3 ans de suivi. Ces observations suggèrent que des
composés
mimant le FGF2 peuvent représenter une thérapie de choix pour le traitement
des
conséquences de l'ischémie cardiaque.
Trois essais cliniques sur l'injection de FGF2 dans l'artère coronaire ont été
réalisés lors de traitement du rétrécissement des artères coronaires (Laham,
R. J. et al.
lntracoronary basic fibroblast growth factor (FGF-2) in patients with severe
ischemic
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
118
heart disease: results of a phase I open-label dose escalation study. J Am
Coll Cardiol
36, 2132-9, 2000; Simons, M. et al. Pharmacological treatment of coronary
artery
disease with recombinant fibroblast growth factor-2: double-blind, randomized,
controlled clinical trial. Circulation 105, 788-93, 2002 ; Unger, E. F. et al.
Effects of a
single intracoronary injection of basic fibroblast growth factor in stable
angina pectoris.
Am J Cardiol 85, 1414-9, 2000). Le résultat de ces trois essais montre que les
infusions intra-coronaires de FGF2 sont bien tolérées et améliorent
significativement
l'état des patients. Ainsi, les composés décrits dans l'invention peuvent
trouver une
application dans le traitement des maladies associées à un rétrécissement des
artères
coronaires et notamment dans le traitement des angines de poitrine.
Les maladies des artères distales et notamment les artérites des membres
inférieurs sont dues à l'obstruction chronique des artérioles irriguant les
extrémités.
Ces pathologies touchent principalement les membres inférieurs. Dans un essai
clinique de phase I, des patients ayant des pathologies des artères
périphériques
entraînant la claudication ont reçu des injections de FGF2 (Lazarous, D. F. et
al., Basic
fibroblast growth factor in patients with intermittent claudication: results
of a phase I
trial. J Am Coll Cardiol 36, 1239-44, 2000). Dans ce contexte, le FGF2 était
bien toléré
chez ces patients et les données cliniques suggèrent un effet bénéfique du
FGF2
notamment sur l'amélioration de la marche. Ces données cliniques suggèrent que
les
composés de l'invention représentent un outil thérapeutique de choix pour le
traitement
des maladies associées à une obstruction des artères distales.
La maladie de Buerger ou thromboangéite oblitérante affecte les structures
vasculaires distales et se caractérisent par une artérite distale des jambes
avec
douleurs et ulcérations. Dans ce contexte, une induction de l'angiogenèse et
de la
vasculogenèse représenterait une thérapie pour cette pathologie. Les composés
de
ladite invention représentent une thérapie de choix pour la thromboangéite
oblitérante.
La neuropathie périphérique est une atteinte axonale ou démyélinisante du nerf
périphérique moteur et/ou sensitif qui entraîne une désensibilisation des
membres
distaux. Une des complications secondaires majeures du diabète est le
développement
chronique d'une neuropathie périphérique. Dans ce contexte, Il a été démontré
que le
FGF2 induisait une régénération axonale qui pourrait être une thérapie de
choix dans
dans le traitement de la lésion des nerfs périphériques et donc dans la
neuropathie
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
119
périphérique (Basic fibroblast growth factor isoforms promote axonal
elongation and
branching of adult sensory neurons in vitro. Klimaschewski L, Nindl W, Feurle
J,
Kavakebi P, Kostron H. Neuroscience. 2004;126(2):347-53). De par l'activité
agoniste
des récepteurs du FGF, les composés de ladite invention représenteraient un
traitement de choix dans la neuropathie périphérique chez le patient sain ou
diabétique.
Il est clairement établit que le FGF2 est un activateur des cellules nerveuses
durant le développement. Des résultats récents suggèrent que le FGF2 serait
également un facteur pivotai pour promovoir la régénération des neurones chez
l'adulte (Sapieha PS, Peltier M, Rendahl KG, Manning WC, Di Polo A.,
Fibroblast
growth factor-2 gene delivery stimulates axon growth by adult retinal ganglion
cells
after acute optic nerve injury. Mol Oeil Neurosci. 2003 Nov;24(3):656-72.).
Par leurs
activités agonistes des récepteurs des FGF, les composés de ladite invention
représenterait une thérapie de choix dans la réparation des dommages nerveux
post-
opératoires, dans la réparation de déficiences nerveuses tel que la maladie de
Parkinson, la maladie d'Alzheimer, la maladie du prion, la dégénérescence
neuronale
chez l'alcoolique ou dans les cas de démences.
La prolifération et la migration des cellules musculaires lisses vasculaires
contribuent à l'hypertrophie intimale des artères et joue ainsi un rôle
prépondérant
dans l'athérosclérose et dans la resténose après angioplastie et
endoarterectomie. Il a
été démontré qu'un facteur angiogène, le VEGF, réduisait significativement
l'épaississement de l'intima en accélérant la ré-endothélialisation (Van
Belle, E.,
Maillard, L., Tio, F. O. & lsner, J. M. Accelerated endothelialization by
local delivery of
recombinant human vascular endothelial growth factor reduces in-stent intimai
formation. Biochem Biophys Res Commun 235, 311-6, 1997). Ainsi, les composés
de
la présente invention, possédant une activité pro-angiogène, peuvent être
utiles dans
le traitement de l'athérosclérose et dans l'inhibition de la resténose après
angioplastie
ou endoartérectomie.
Le réseau vasculaire est essentiel au développement et à la préservation des
tissus. En promouvant la délivrance des nutriments, de l'oxygène et des
cellules, les
vaisseaux sanguins aident à maintenir l'intégrité fonctionnelle et structurale
des tissus.
Dans ce contexte, l'angiogenèse et la vasculogenèse permettent de préserver et
de
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
120
perfuser les tissus après une ischémie. Les facteurs de croissance
angiogéniques
comme le VEGF et le FGF2 favorisent ainsi la revascularisation pour la
régénération
des tissus. Les composés présentés dans l'invention pourraient représenter un
traitement de choix dans le traitement pour la régénération des muscles.
Les processus de régénération musculaire sur les muscles dystrophiques ou
normaux dépendent de l'apport de cytokines et de facteurs de croissance
angiogéniques au niveau local (Fibbi, G., D'Alessio, S., Pucci, M., Cerletti,
M. & Del
Rosso, M. Growth factor-dependent proliferation and invasion of muscle
satellite cells
require the cell-associated fibrinolytic system. Biol Chem 383, 127-36, 2002).
Il a été
proposé que le système FGF était un système critique de la régénération
musculaire,
de la survie et de la prolifération des myoblastes (Neuhaus, P. et al. Reduced
mobility
of fibroblast growth factor (FGF)-deficient myoblasts might contribute to
dystrophic
changes in the musculature of FGF2/FGF6/mdx triple-mutant mice. Mol Oeil Biol
23,
6037-48, 2003). Le FGF2 ainsi que les composés de ladite invention pourraient
être
exploités afin de promouvoir la régénération cardiaque. Ils amélioreraient
ainsi la
perfusion du myocarde après ischémie (Hendel, R. C. et al. Effect of
intracoronary
recombinant human vascular endothelial growth factor on myocardial perfusion:
evidence for a dose-dependent effect. Circulation 101, 118-21, 2000) ainsi que
la
survie et la progression de myoblastes transplantés et notamment dans la
dystrophie
musculaire de Duchenne.
L'angiogenèse est un phénomène essentiel durant la cicatrisation cutanée. Les
nouveaux vaisseaux formés apportent l'oxygène et les nutriments nécessaires à
la
réparation tissulaire. Dans le cas de patient diabétique, la cicatrisation est
un
processus lent et difficile présentant des défauts d'angiogenèse. Les FGFS
font partie
des facteurs de croissance les plus impliqués dans les processus d'angiogenèse
durant la phase de cicatrisation. Certains FGF sont fortements sur-régulés
dans les
cellules du derme après une blessure cutanée. Par leurs activités agonistes
des
récepteurs du FGF, les composés de ladite invention représenteraient une
thérapie de
choix pour le traitement de la cicatrisation chez le patient sain ou
diabétique
La transplantation de pancréas bio-artificiel est une technique très
prometteuse
pour le traitement de certains type de diabète. Il a été démontré, chez le rat
diabétique,
que la vascularisation dans les pancréas bio-artificiel était beaucoup plus
importante
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
121
quand les pancréas étaient imprégnées de microsphères portant du FGF2
(Sakurai,
Tomonori; Satake, Akira, Sumi, Shoichiro, moue, Kazutomo, Nagata, Natsuki,
Tabata,
Yasuhiko. The Efficient Prevascularization lnduced by Fibroblast Growth Factor
2 With
a Collagen-Coated Device Improves the Oeil Survival of a Bioartificial
Pancreas.
Pancreas. 28(3):e70-e79, April 2004). Cette revasculaisation améliore ainsi la
survie
des pancréas bio-artificiel implantés et par conséquent la survie du greffon.
Par leurs
activités agonistes des récepteurs du FGF, les composés de ladite invention
représenteraient une thérapie de choix dans l'amélioration de la survie du
greffon de
pancréas bioartificiel chez le patient diabétique et de façon plus générale
dans
l'amélioration de la la revascularisation des greffons et par conséquent dans
la survie
des greffes.
La rétinite pigmentaire est une pathologie impliquant la dégénérescence
progressive de la rétine caractérisée par une dégénérescence des
photorécepteurs et
une oblitération des vaisseaux rétiniens. Lahdenranta et al. (An anti-
angiogenic state in
mice and humans with retinal photoreceptor cell degeneration. Proc Natl Acad
Sci USA
98, 10368-73, 2001) ont proposé que des facteurs de croissance angiogéniques
régulent la coordination neurale et la vascularisation associée de la rétine
en
fonctionnant simultanément comme facteurs de survie des photorécepteurs et
comme
régulateur des cellules endothéliales. Dans ce contexte, l'injection intra-
vitréenne de
FGF2 retarde la dégénérescence des photorécepteurs en agissant sur la survie
et sur
l'angiogenèse rétinienne (Faktorovich, E. G., Steinberg, R. H., Yasumura, D.,
Matthes,
M. T. & LaVail, M. M. Basic fibroblast growth factor and local injury protect
photoreceptors from light damage in the rat. J Neurosci 12, 3554-67,1992). Ces
observations démontrent l'intérêt des composés décrits dans l'invention comme
thérapie dans la dégénérescence rétinienne et notamment dans la rétinite
pigmentaire.
Dans le domaine de l'osteoarthrite, de nombreuses études sont réalisées pour
restaurer le cartilage articulaire détruit. Dans ce contexte, il a été reporté
que la
prolifération et la différenciation des chondrocytes étaient stimulées par le
FGF2 in vitro
(Kato Y, Gospodarowicz D. Sulfated proteoglycan synthesis by confluent
cultures of
rabbit costal chondrocytes grown in the presence of fibroblast growth factor.
J Oeil Biol.
1985 Feb;100(2):477-85). De plus, Cuevas et al. ont montré que le FGF2 induit
la
réparation du cartilage in vivo (Cuevas P, Burgos J, Baird A. Basic fibroblast
growth
factor (FGF) promotes cartilage repair in vivo. Biochem Biophys Res Commun.
1988
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
122
Oct 31;156(2):611-8). Takafuji et al. ont également montré que des implants de
FGF2
amélioraient de façon significative des cartilages temporo-mandibulaires de
lapins
souffrant d'ostéoarthrites (Takafuji H, Suzuki T, Okubo Y, Fujimura K, Bessho
K
Regeneration of articuler cartilage defects in the temporomandibular joint of
rabbits by
fibroblast growth factor-2: a pilot study. Int J Oral Maxillofac Surg. 2007
Oct;36(10):934-7). Ces observations démontrent l'intérêt des composés décrits
dans
l'invention comme thérapie dans le traitement de l'ostéoarthrite et de la
réparation des
cartilages.
Dans le domaine de la réparation osseuse, un des besoins essentiels est de
trouver des agents qui stimulent la formation de l'os. Parmi les principaux
facteurs de
croissance, il est établi que l'administration systémique de FGF2 facilite la
réparation
de l'os (Acceleration of fracture healing in nonhuman primates by fibroblast
growth
factor-2. Kawaguchi H, Nakamura K, Tabata Y, Ikeda Y, Aoyama I, Anzai J,
Nakamura
T, Hiyama Y, Tamura M. J Clin Endocrinol Metab. 2001 Feb;86(2), 875-880).
L'application locale de FGF2 dans des matrices de gélatine accélère la
réparation
osseuse chez des primates suggérant l'utilité clinique du FGF2 dans le
traitement des
fractures. Par les propriétés agonistes pour les récepteurs du FGF, les
composés de
ladite invention pourrait représenter un traitement de choix dans la
réparation osseuse
La pré-eclampsie est une pathologie du placenta associée à un défaut de
vascularisation (Sherer, D. M. & Abulafia, O. Angiogenesis during
implantation, and
placental and early embryonic development. Placenta 22, 1-13, 2001). Ces
défauts de
vascularisation seraient dus à un défaut d'angiogenèse et entraîneraient des
perturbations au niveau du placenta pouvant aboutir à la mort du foetus. Les
composés
de l'invention pourraient être un traitement de choix pour pallier à un défaut
d'angiogenèse dans les placentas pré-éclamptiques.
En plus des effets inducteurs de l'angiogenèse, les facteurs de croissance
comme le VEGF ou le FGF2 protègent les cellules endothéliales des inducteurs
intrinsèques et extrinsèques de l'apoptose. La voie de signalisation
intrinsèque est
activée par les mitochondries en réponse à un stress comme la déprivation ou
les
dommages sur l'ADN, alors que la voie de signalisation extrinsèque est induite
par la
liaison de facteurs pro-apoptotique comme le TNF-a ou Fas. Il est maintenant
clairement décrit que le VEGF et le FGF2 sont deux facteurs de survie des
cellules
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
123
endothéliales (Role of Raf in Vascular Protection from Distinct Apoptotic
Stimuli : A
Alavi, J.D. Hood, R. Frausto, D. G. Stupack, D.A. Cheresh : Science 4 July
2003: Vol.
301. no. 5629, pp. 94-96). Le Syndrome de Détresse Respiratoire Aiguë (ARDS)
se
caractérisent par des problèmes cardio-vasculaires et neuropsychiatriques.
Dans le
cadre des problèmes cardio-vasculaires les patients présentent des lésions
vasculaires
importantes et notamment une induction de l'apoptose des cellules
endothéliales
élevée. Récemment, Hamacher & al. ont démontré que les fluides de lavages
bronchoalvéolaires de patients atteint d'ARDS présentaient une activité pro-
apoptotique contre les cellules endothéliales micro-vasculaire de poumon
(Tumor
necrosis factor-alpha and angiostatin are mediators of endothelial
cytotoxicity in
bronchoalveolar lavages of patients with acute respiratory distress syndrome.
Am J
Respir Crit Care Med. 2002 Sep 1;166(5):651-6 : Hamacher J, Lucas R, Lijnen
HR,
Buschke S, Dunant Y, Wendel A, Grau GE, Suter PM, Ricou B.). Par leur activité
de
survie sur les cellules endothéliales, les produits de l'invention pourraient
présenter un
traitement de choix dans l'amélioration vasculaire des patients atteints de
lésions
vasculaires et notamment des patients atteint d'ARDS.
La surrégulation endogène de FGF7 (ou KGF) et de FGF18 semble être un
important mécanisme pour favoriser la prolifération, la migration et la
protection des
follicules pileux dans des cas pathologiques ou suite à un traitement tumoral
(Comprehensive Analysis of FGF and FGFR Expression in Skin: FGF18 Is Highly
Expressed in Hair Follicles and Capable of lnducing Anagen from Telogen Stage
Hair
Follicles. Mitsuko Kawano, Akiko Komi-Kuramochi, Masahiro Asada, Masashi
Suzuki,
Junko Oki, Ju Jiang and Toru lmamura). Par leur activité agoniste sur les
récepteurs
du FGF, les composés de ladite invention pourraient présenter un traitement de
choix
pour la réparation et la protection des follicules pileux et dans la
protection et la
régulation de la croissance capillaire.
Selon un autre de ses aspects, la présente invention concerne des
compositions pharmaceutiques comprenant, en tant que principe actif, un
composé
selon l'invention. Ces compositions pharmaceutiques contiennent une dose
efficace
d'au moins un composé selon l'invention, ou un sel pharmaceutiquement
acceptable
dudit composé, ainsi qu'au moins un excipient pharmaceutiquement acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
CA 02771056 2012-02-13
WO 2011/018588 PCT/FR2010/051703
124
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'Homme
du métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale, sublinguale, sous-cutanée, intramusculaire, intra-
veineuse,
topique, locale, intratrachéale, intranasale, transdermique ou rectale, le
principe actif
de formule (I)/(1') ci-dessus ou son sel peut être administré sous forme
unitaire
d'administration, en mélange avec des excipients pharmaceutiques classiques,
aux
animaux et aux êtres humains pour la prévention ou le traitement des troubles
ou des
maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale telles que les comprimés, les gélules molles ou dures, les poudres,
les
granules et les solutions ou suspensions orales, les formes d'administration
sublinguale, buccale, intratrachéale, intraoculaire, intranasale, par
inhalation, les
formes d'administration topique, transdermique, sous-cutanée, intramusculaire
ou
intraveineuse, les formes d'administration rectale et les implants. Pour
l'application
topique, on peut utiliser les composés selon l'invention dans des crèmes,
gels,
pommades ou lotions.
Les formes d'administration injectables sont particulièrement avantageuses,
comprenant de façon classique le composé actif mis en solution dans de l'eau
pour
injection, en présence de chlorure de sodium. La dose unitaire de composé
actif doit
être adaptée à l'effet thérapeutique recherché ; elle peut être comprise par
exemple
entre 0.1 et 100 mg de principe actif.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration à un patient d'une dose efficace d'un composé selon
l'invention ou un
de ses sels pharmaceutiquement acceptables.