Note: Descriptions are shown in the official language in which they were submitted.
CA 02782469 2013-10-09
1
DERIVES AZABICYCLO[3.1.0]HEX-2-YL, LEUR PROCEDE DE PREPARATION ET LES
COMPOSITIONS PHARMACEUTIQUES QUI LES CONTIENNENT
La présente invention concerne de nouveaux dérivés azabicyclo[3.1.0]hex-2-yl,
leur
Les composés de la présente invention sont particulièrement intéressants d'un
point de vue
pharmacologique pour leur interaction avec les systèmes histaminergiques
centraux in
vivo.
Le vieillissement de la population, du fait de l'augmentation de l'espérance
de vie à la
naissance, a entraîné parallèlement un large accroissement de l'incidence des
neuropathologies liées à l'âge, et notamment de la maladie d'Alzheimer. Les
principales
manifestations cliniques du vieillissement cérébral et surtout des
neuropathologies liées à
l'âge, sont les déficits des fonctions mnésiques et cognitives qui peuvent
conduire à la
démence.
Au niveau du système nerveux central, des études neuropharmacologiques ont
montré que
l'histamine via les systèmes histaminergiques centraux jouait un rôle de
neurotransmetteur
ou neuromodulateur en situations physiologiques ou physiopathologiques (Pei!
et Green,
Annu. Rev. Neurosci., 1986, 9 209-254; Schwartz et al., Physiol. Rev., 1991,
71, 1-51).
Ainsi, il a été montré que l'histamine intervenait dans divers processus
physiologiques et
comportementaux tels que la thermorégulation, la régulation
neuroendocrinienne, la
nociception, le rythme circadien, les états cataleptiques, la motricité,
l'agressivité, le
comportement alimentaire, l'apprentissage et la mémorisation, ainsi que la
plasticité
synaptique (Hass et al., Histaminergic neurones : morphology and function,
Boca Raton,
FL: CRC Press, 1991, pp. 196-208; Brown et al., Prog. Neurobiology, 2001, 63,
637-
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
2
Des études, réalisées chez l'animal, ont montré que l'augmentation des taux
endogènes
extra-synaptiques d'histamine permettait de promouvoir les états de vigilance,
les
processus d'apprentissage et de mémoire et de réguler la prise alimentaire
(Brown et al.,
Prog. NeurobioL, 2000, 63, 637-672; Passani et al., Neurosci. Biobehav. Rev.,
2000, 24,
107-113). En conséquence, les indications thérapeutiques potentielles pour des
composés
capables d'augmenter le turn-over ou la libération d'histamine au niveau
central sont le
traitement des déficits cognitifs associés au vieillissement cérébral, aux
maladies
neurodégénératives aigues et chroniques, à la schizophrénie, ainsi que le
traitement des
troubles de l'humeur, du syndrome de Tourette (Gulhan Ercan-Sencicek et al,
New
England Journal of Medicine, May 20, 2010, 1901-1908), de la schizophrénie,
des troubles
du sommeil et du rythme veille-sommeil, du syndrome d'hyperactivité avec
déficits
attentionnels. Par ailleurs, des travaux ont montré qu'une injection
d'histamine au niveau
des noyaux centraux hypothalamiques impliqués dans la régulation de la satiété
atténue
l'alimentation chez le rat. De plus, un hypofonctionnement de la transmission
histaminergique a été mis en évidence chez des rats génétiquement obèses
(Machidori et
al., Brain Research, 1992, 590, 180-186). En conséquence, les troubles du
comportement
alimentaire et l'obésité sont également des indications thérapeutiques
potentielles pour les
composés de la présente invention.
La présente invention concerne de nouveaux dérivés azabicycliques qui se
distinguent des
composés exemplifiés dans la demande W02005/089747 par la présence d'un noyau
2-azabicyclo [3 .1.0]hexane.
Au niveau neurologique, ces nouveaux composés ouvrent la voie non seulement à
de
nouveaux traitements des troubles cognitifs liés au vieillissement cérébral,
aux maladies
neurodégénératives ou aux traumatismes crâniens, mais également au traitement
des
troubles psychocomportementaux associés à ces pathologies tels que les
troubles du
sommeil, l'apathie et/ou les états dépressifs. Par ailleurs, le profil
pharmacologique des
composés de l'invention permet aussi d'envisager de nouveaux traitements dans
le
domaine psychiatrique, pour le syndrome de Tourette, la schizophrénie, les
troubles de
l'humeur ou du sommeil par exemple.
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
3
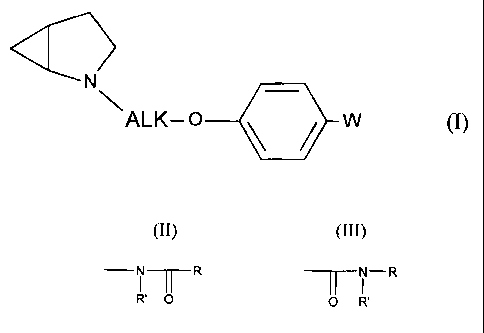
La présente invention concerne plus particulièrement les composés de formule
(I) :
N, (I)
4/11 W
ALK-0
dans laquelle :
= ALK représente une chaîne alkylène,
= W représente un groupement N __ R OU ____
I I l NI R
où R et R' représentent, indépendamment l'un de l'autre, un atome d'hydrogène
ou un
groupement alkyle (Ci-C6) linéaire ou ramifié éventuellement substitué par un
ou
plusieurs groupements choisis parmi halogène, hydroxy et alkoxy,
étant entendu que:
- le terme alkylène désigne un radical bivalent, linéaire ou ramifié,
contenant de 2 à 6
atomes de carbone,
- le terme alkoxy désigne un groupement alkyle-oxy dont la chaîne alkyle,
linéaire ou
ramifiée, contient de 1 à 6 atomes de carbone,
leurs énantiomères et diastéréoisomères, ainsi que leurs sels d'addition à un
acide ou à une
base pharmaceutiquement acceptable.
Parmi les acides pharmaceutiquement acceptables, on peut citer à titre non
limitatif les
acides chlorhydrique, bromhydrique, sulfurique, phosphonique, acétique,
trifluoroacétique,
lactique, pyruvique, malonique, succinique, glutarique, fumarique, tartrique,
maléique,
citrique, ascorbique, oxalique, méthane sulfonique, camphorique, etc.
CA 02782469 2013-10-09
4
Parmi les bases pharmaceutiquement acceptables, on peut citer à titre non
limitatif
l'hydroxyde de sodium, l'hydroxyde de potassium, la triéthylamine, la
tertbutylamine, etc.
Les composés de formule (I) préférés sont ceux pour lesquels le groupement W
est situé en
position para.
Un aspect de l'invention vise les composés de formule (I) pour lesquels ALK
représente un
radical bivalent linéaire contenant de 2 à 6 atomes de carbone comme, par
exemple, le
groupe éthylène ou propylène, et plus préférentiellement encore un groupe
propylène, leurs
énantiomères et diastéréoisomères, ainsi que leurs sels d'addition à un acide
ou à une base
pharmaceutiquement acceptable.
Un aspect particulier de l'invention concerne les composés de formule (I) pour
lesquels
W représente le groupement ____ N R leurs énantiomères et diastéréoisomères,
ainsi
Il
0 R'
que leurs sels d'addition à un acide ou à une base pharmaceutiquement
acceptable.
Un autre aspect particulier de l'invention concerne les composés de formule
(I) pour lesquels W représente le groupement fil H R, leurs
énantiomères et
R 0
diastéréoisomères, ainsi que leurs sels d'addition à un acide ou à une base
pharmaceutiquement acceptable.
De manière avantageuse, R et R' représentent, indépendamment l'un de l'autre,
l'atome
d'hydrogène, le groupement méthyle ou le groupement éthyle, ces groupements
étant
éventuellement substitués par un méthoxy, leurs énantiomères et
diastéréoisomères, ainsi
que leurs sels d'addition à un acide ou à une base pharmaceutiquement
acceptable.
Plus particulièrement, W représente le groupement -CO-NH-CH3, -CO-N(CH3)2,
-CO-NI-12, -CO-N(CH2CH3)2, -NH-CO-CH3, -N(CH3)-CO-CH3 ou -NH-CO-CH2-0CH3,
leurs énantiomères et diastéréoisomères, ainsi que leurs sels d'addition à un
acide ou à une
base pharmaceutiquement acceptable.
CA 02782469 2013-10-09
4a
Encore plus particulièrement, l'invention concerne les composés de formule (I)
qui sont :
- le 4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}-N,N-
diméthylbenzamide,
- le 4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}-N,N-
diéthylbenzamide,
=
- le N-(4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}phény1)-N-
méthylacétamide,
- le 4[3-(cis-2-azabicyclo[3.1.0]hex-2-y1) propoxy]benzamide,
- le N-(4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxylphényl)acétamide,
- le 4- {3 -(cis-2-azabicyclo[3. 1 .0]hex-2-yl)propoxyl -N-
méthylbenzamide,
- le N-(4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}phényI)-2-
méthoxyacétamide,
- le N-(4-{2-(cis-2-azabicyclo[3.1.0]hex-2-ypethoxy}phényl)acétamide,
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
et leurs énantiomères ainsi que leurs sels d'addition à un acide ou à une base
pharmaceutiquement acceptables.
Parmi les sels d'addition à un acide pharmaceutiquement acceptable, on préfère
plus
particulièrement les chlorhydrate, oxalate et citrate.
5 L'invention s'étend également au procédé de préparation des composés de
formule (I)
caractérisé en ce que l'on utilise comme produit de départ le composé de
formule (II) :
W
= OH (II)
dans laquelle W est tel que défini dans la formule (I),
composé de formule (II) sur lequel on condense en milieu basique le composé de
formule
(III) :
Br-ALK-CI (III)
dans laquelle ALK est tel que défini dans la formule (I),
pour obtenir le composé de formule (IV) :
W
0-ALK-CI (W)
dans laquelle W et ALK sont tels que définis précédemment,
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
6
sur lequel on condense le composé de formule (V) :
<0 (V)
N
H
pour conduire au composé de formule (I) tel que défini précédemment :
<0 (D
N,
\ = W
ALK-0
qui peut être purifié selon une technique classique de séparation, que l'on
transforme, si on
le souhaite, en ses sels d'addition à un acide ou à une base
pharmaceutiquement acceptable
et dont on sépare éventuellement les isomères optiques selon une technique
classique de
séparation.
Les composés de formules (II), (III) et (V) sont soit commerciaux, soit
accessibles à
l'homme du métier par des réactions chimiques classiques et décrites dans la
littérature.
Alternativement, les composés de formule (VI) :
<0 0 (VI)
N,\
OH
ALK-0
dans lesquels le groupement ALK est tel que défini précédemment,
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
7
peuvent être utilisés en tant qu'intermédiaires de synthèse des composés de
formule (lia),
cas particuliers des composés de formule (I) pour lesquels W représente un
groupement
-CONRR', par couplage avec une amine de formule NHRR', où R et R' ont la même
signification que dans la formule (I).
De même, les composés de formule (VII) :
<0 0 (VII)
N
\
ALK-0 411 CI
dans lesquels le groupement ALK est tel que défini précédemment,
peuvent être utilisés en tant qu'intermédiaires de synthèse des composés de
formule (lia),
cas particuliers des composés de formule (I) pour lesquels W représente un
groupement
-CONRR', par couplage avec une amine de formule NHRR', où R et R' ont la même
signification que dans la formule (I).
De plus, les composés de formule (lia), cas particuliers des composés de
formule (I) pour
lesquels W représente un groupement -CONRR', peuvent aussi être obtenus par
condensation de l'amine NHRR', où R et R' ont la même signification que dans
la formule
(I), en utilisant les composés de formule (VIII) :
<0 0 (WH)
N
\
ALK-0 . OR"
dans lesquels le groupement ALK est tel que défini précédemment et R"
représente un
groupement alkyle (Ci-C6) linéaire ou ramifié ou un groupement benzyle,
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
8
les composés de formule (VIII) étant préparés via l'acide carboxylique (VI) ou
le chlorure
d'acyle (VII) correspondant présentés précédemment.
Enfin, il est également possible d'obtenir les composés de formule (Va) en
hydrolysant des
composés de formule (IX) :
<0
N (DC)
N,
\ /
ALK-0 11
dans lesquels le groupement ALK est tel que défini précédemment.
Au niveau neurologique, les composés selon l'invention peuvent être utiles
dans le
traitement des troubles cognitifs liés au vieillissement cérébral ou aux
maladies
neurodégénératives telles que la maladie d'Alzheimer, la maladie de Parkinson,
la maladie
Da de Pick, les démences à corps de Lewy, les démences frontales et sous-
corticales, les
démences frontotemporales, les démences vasculaires, la maladie de Huntington,
la
sclérose en plaques, dans de nouveaux traitements des troubles cognitifs liés
aux
traumatismes crâniens, mais également dans le traitement des troubles
psychocomportementaux associés à ces pathologies tels que les troubles du
sommeil,
l'apathie et les états anxio-dépressifs. Les troubles du sommeil associés à la
maladie
d'Alzheimer et à la maladie de Parkinson, tels que les hypersomnolences
diurnes, sont
particulièrement visés.
Au niveau psychiatrique, ces composés peuvent être utiles dans le traitement
des troubles
de l'humeur, et plus particulièrement le traitement des états anxio-
dépressifs, du syndrome
de Tourette, de la schizophrénie et des troubles cognitifs qui lui sont
associés, de la
douleur, ainsi que dans le traitement des troubles du sommeil, du rythme
veille-sommeil et
du syndrome d'hyperactivité avec déficits attentiormels (ADHD). Parmi les
troubles du
sommeil, on peut citer plus particulièrement la narcolepsie et l'apnée du
sommeil. Les
troubles du sommeil tels que les hypersomnies survenant lors du syndrome
d'apnée
obstructive du sommeil ou du syndrome d'hyperactivité avec déficits
attentionnels, ainsi
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
9
que les somnolences diurnes sont également visés.
La présente invention a également pour objet les compositions pharmaceutiques
contenant
un composé de formule (I) en combinaison avec un ou plusieurs excipients
pharmaceutiquement acceptables.
Dans les compositions pharmaceutiques selon l'invention, la fraction massique
en principe
actif (masse du principe actif sur la masse totale de la composition) est
comprise entre 1 et
50%.
Parmi les compositions pharmaceutiques selon l'invention, on pourra citer,
plus
particulièrement celles qui conviennent pour l'administration orale,
parentérale, nasale, per
ou transcutanée, rectale, perlinguale, oculaire ou respiratoire et notamment
les comprimés
simples ou dragéifiés, les comprimés sublinguaux, les sachets, les paquets,
les gélules, les
glossettes, les tablettes, les suppositoires, les crèmes, les pommades, les
gels dermiques, et
les ampoules buvables ou injectables.
La posologie varie selon le sexe, l'âge et le poids du patient, la voie
d'administration, la
nature de l'indication thérapeutique, ou des traitements éventuellement
associés et
s'échelonne entre 0,05 mg et 500 mg par 24 heures pour un traitement en 1 à 3
prises par
jour.
L'association d'un composé de formule (I) avec un inhibiteur de
l'acétylcholinesterase fait
aussi partie intégrante de l'invention, et plus particulièrement encore
l'association d'un
composé de formule (I) avec le donépézil, la rivastigmine ou la galantamine.
Les
associations de ce type peuvent être utilisées dans le traitement des troubles
cognitifs
associés à la maladie d'Alzheimer.
Les exemples suivants illustrent l'invention et ne la limitent en aucune
façon. Les
structures des composés, décrits dans les exemples, ont été déterminées selon
les
techniques spectrophotométriques usuelles (infrarouge, RMN, spectrométrie de
masse...).
CA 02782469 2013-10-09
A titre d'information, les composés ci-dessous correspondent à des racémates
de
configuration cis. En d'autres termes, ces composés correspondent à des
mélanges
racémiques de squelettes (1R,5S)-2-azabicyclo[3.1.0]hex-2-y1 et de squelettes
(1S,5R)-2-
azabicyclo[3.1.0]hex-2-yl.
5 Tels que mentionnés dans les exemples ci-dessous, les mélanges racémiques
peuvent être
séparés pour obtenir les énantiomères purs par des techniques de séparation
chirale sur
colonne HPLC, par exemple, de type CHIRALCELmc OF, CHIRALPACKmc AS-H,
CHIRALPACKmc T304, ou CHIRALPACKmc AD-H.
Exemple 1, voie de synthèse A: Chlorhydrate de 4[3-(cis-2-azabicyclo[3.1.01hex-
2-y1)
10 propoxy] benzamide
Stade 1 : 4-(3-Chloropropoxy)benzamide
Un mélange constitué de 0,004 mole de 4-hydroxybenzamide, de 0,004 mole de
1-bromo-3-chloropropane et de 0,006 mole de carbonate de césium dans 10 ml
d'acétonitrile est chauffé au reflux pendant 5 heures.
Stade 2: 4-1-3-(cis-2-Azabicyclo[3.1.0]hex-2-Apropoxylbenzarnide
Dans le milieu réactionnel du Stade 1 à température ambiante sont ajoutées
0,004 mole de
cis-2-azabicyclo[3.1.0]hexane, dont la synthèse est décrite dans J. Org. Chem.
1994, 59,
276-277, et 0,002 mole d'iodure de sodium. Le chauffage au reflux est ensuite
repris
pendant 16 heures. Le précipité est filtré, rincé avec de l'acétonitrile. Le
filtrat est
concentré à sec. Le résidu est repris dans du dichlorométhane. Cette solution
est extraite
avec de la soude, puis de l'eau, avant d'être séchée sur sulfate de magnésium
et concentrée
à sec. Le résidu est purifié par technique de chromatographie préparative sur
phase
Lichroprep RP-18.
Stade 3. Chlorhydrate de 4-[3-(cis-2-azabicyclo[3.1.0]hex-2-
yl)propoxylbenzamide
Le produit obtenu au Stade 2 est dissous dans 10 ml d'éthanol auxquels sont
ajoutés 2 ml
d'éther chlorhydrique 2 N. Le produit ainsi obtenu est filtré, rincé avec de
l'éthanol et
séché sous vide.
CA 02782469 2012-05-30
WO 2011/070253
PCT/FR2010/000823
11
Microanalyse élémentaire .=
%C %H %N %Cl %Cl-
Calculé 60,70 7,13 9,44 11,95 11,95
Trouvé 60,44 7,28 9,47 12,30 11,75
Exemple 1, voie B: Chlorhydrate de 4-13-(cis-2-azabicyc1o[3.1.0]hex-2-
Apropoxy]
benzamide
Stade 1 : : 4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}benzonitrile
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stades 1
et 2, en remplaçant au Stade 1 le 4-hydroxybenzamide par le 4-
hydroxybenzonitrile.
Stade 2: Chlorhydrate de 4-[3-(cis-2-azabicyclo[3.1.0]hex-2-
yl)propoxylbenzamide
Le composé obtenu au Stade précédent (2,2 g) est mis en solution dans 90 ml
d'éthanol et
chauffé à reflux en présence de 5,1 g de KOH pendant 18 h. Le milieu est versé
dans 90 ml
d'eau puis concentré à mi-volume sous vide. Le solide obtenu est filtré, rincé
avec de
l'éther isopropylique, puis dissous dans 10 ml d'éthanol auxquels sont ajoutés
2 ml d'éther
chlorhydrique 2 N. Le produit ainsi obtenu est filtré, rincé avec de l'éthanol
et séché sous
vide.
Microanalyse élémentaire.
%C %H %N %Cl %Cl-
Calculé 60,70 7,13 9,44 11,95 11,95
Trouvé 60,50 7,20 9,50 12,45 12,35
Exemple 1, voie C: Chlorhydrate de 443-(cis-2-azabicyclo[3.1.0]hex-2-
yl)propoxy1
benzamide
Stade 1 : 4-{3-(cis-2-Azabicyclo[3.1.0]hex-2-yl)propoxylbenzoate de méthyle
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stades 1
et 2, en remplaçant au Stade 1 le 4-hydroxybenzamide par le 4-hydroxybenzoate
de
méthyle.
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
12
Stade 2 : Acide 4-0-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}benzoïque
Un mélange de 3,5 g du composé du Stade 1, de 12,7 ml de soude 2 N et de 8 ml
de
méthanol est chauffé à reflux pendant une heure. Dans le milieu réactionnel
refroidi au
bain de glace sont ajoutés 12,7 ml d'HC1 2 N. Le précipité est lavé à l'eau et
séché sous
vide.
Stade 3: Chlorure de 4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}benzoyle,
chlorhydrate
Un mélange de 1,8 g de produit décrit au Stade 2 et de 20 ml de chlorure de
thionyle est
chauffé à reflux pendant 2 heures. Le milieu réactionnel est concentré sous
vide, coévaporé
deux fois avec du toluène. Le résidu solide est homogénéisé dans l'éther
éthylique, filtré et
séché sous vide.
Stade 4. Chlorhydrate de 4-[3-(cis-2-azabicyclo[3.1.01hex-2-
yl)propoxyPenzamide
Dans une solution de 1 g de produit décrit au Stade 3 dans le dichlorométhane
à 0 C, sont
ajoutés goutte à goutte 4 ml de méthanol ammoniacal 2 N. Le mélange est
ensuite agité
1 heure à température ambiante, lavé avec un solution de soude 2 N, puis de
l'eau. La
phase organique est séchée sur sulfate de magnésium et concentrée. Le solide
obtenu est
filtré, rincé avec de l'éther isopropylique, puis mis en solution dans 10 ml
d'éthanol
auxquels sont ajoutés 2 ml d'éther chlorhydrique 2 N. Le produit ainsi obtenu
est filtré,
rincé avec de l'éthanol et séché sous vide.
Microanalyse élémentaire :
%C %H %N %Cl %Cl-
Calculé 60,70 7,13 9,44 11,95 11,95
Trouvé 60,44 7,28 9,47 12,30 11,75
Exemple 2 : Chlorhydrate de 4- {2-(cis-2-azabicyclo [3.1.0] hex-2-y1)éthoxy)
benzamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A, en
remplaçant au Stade 1 le 1-bromo-3-chloropropane par le 1-bromo-2-
chloroéthane.
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
13
Microanalyse élémentaire :
%C %H %N %Cl %Cl-
Calculé 59,47 6,77 9,91 12,54 12,54
Trouvé 59,60 6,99 9,97 12,30 12,16
Exemple 3: Chlorhydrate de N-(4-{3-(cis-2-azabieyelo[3.1.0]hex-2-y1)propoxyl
phényl)acétamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A, en
remplaçant au Stade 1 le 4-hydroxybenzamide par le N-(4-
hydroxyphényl)acétamide.
Microanalyse élémentaire :
%C %H %N %Cl %Cl-
Calculé 61,83 7,46 9,01 11,41 11,41
Trouvé 61,62 7,38 9,01 11,55 11,38
Exemple 4: Chlorhydrate de N-(4-{2-(cis-2-azabicyclo[3.1.01hex-2-
y1)éthoxy}phényl)
acétamide
Le procédé expérimental est identique à celui de l'Exemple 2 en remplaçant au
Stade 1 le
4-hydroxybenzamide par le N-(4-hydroxyphényl)acétamide.
Microanalyse élémentaire :
%C %H %N %Cl %Cl-
Calculé 60,70 7,13 9,44 11,95 11,95
Trouvé 60,25 7,01 9,59 11,95 11,84
Exemple 5: Chlorhydrate de 4-{3-(cis-2-azabicyclo[3.1.01hex-2-yl)propoxy}-N,N-
diméthylbenzamide
Stade 1 : 4-[3-(cis-2-Azabicyclo[3.1.01hex-2-yl)propoxyl-N,N-
diméthylbenzamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stades 1
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
14
et 2, en remplaçant au Stade 1 le 4-hydroxybenzamide par le 4-hydroxy-N,N-
diméthylbenzamide.
Microanalyse élémentaire :
%C %H %N
Calculé 70,80 8,39 9,71
Trouvé 69,33 8,47 9,52
Stade 2: Chlorhydrate de 4-[3-(cis-2-azabicyclo[3.1.01hex-2-yl)propoxyl-N,N-
diméthylbenzamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stade 3.
Exemple 6: Chlorhydrate de 4-{3-(cis-2-azabieyelo[3.1.01hex-2-yl)propoxy}-N,N-
diéthylbenzamide
Stade 1 : 4-[3-(cis-2-Azabicyclo[3.1.0]hex-2-yl)propoxyl-N,N-diéthylbenzamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stades 1
et 2, en remplaçant au Stade 1 le 4-hydroxybenzamide par le 4-hydroxy-N,N-
diéthylbenzamide.
Microanalyse élémentaire .=
%C %H %N
Calculé 72,12 8,92 8,85
Trouvé 71,69 8,72 8,64
Stade 2: Chlorhydrate de 4-[3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxyl-N,N-
diéthylbenzamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stade 3.
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
Exemple 6a: Chlorhydrate de 4-13-(cis-2-azabicyclo[3.1.01hex-2-yl)propoxyl-N,N-
diéthylbenzamide (énantiomère 1)
L'énantiomère 1 a été obtenu par séparation préparative sur colonne chirale
CHIRALPACK T304 chargée à 1g/kg, mélange éluant : acétonitrile/diéthylamine
5 (100/0.1), débit 100m1/min, détection UV à 270nm.
Pouvoir rotatoire : [aD]589nm2e = - 53.790 (c = 0,98; Me0H)
Exemple 6b : Chlorhydrate de 4-{3-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxy}-
N,N-
diéthylbenzamide (énantiomère 2)
L'énantiomère 2 a été obtenu par séparation préparative sur colonne chirale
10 CHlRALPACK T304 chargée à 1g/kg, mélange éluant :
acétonitrile/diéthylamine
(100/0.1), débit 100m1/min, détection UV à 270nm.
Pouvoir rotatoire : [ad .589,7m2e = + 54.02 (c = 1.02; Me0H)
Exemple 7: Chlorhydrate de 443-(cis-2-azabicyclo13.1.01hex-2-yl)propoxyl-N-
méthylbenzamide
15 Stade I : 4-[3-(cis-2-Azabicyclo[3.1.0]hex-2-yl)propoxyl-N-
méthylbenzamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stades 1
et 2, en remplaçant au Stade 1 le 4-hydroxybenzamide par le 4-hydroxy-N-
méthylbenzamide.
Microanalyse élémentaire :
%C %H %N
Calculé 70,04 8,08 10,21
Trouvé 69,57 8,04 10,17
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
16
Stade 2: Chlorhydrate de 4-P-(cis-2-azabicyclo[3.1.0]hex-2-yl)propoxyl-N-
méthylbenzamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A Stade 3.
Exemple 7a: Chlorhydrate de 4-{3-(cis-2-azabicyclo[3.1.01hex-2-yl)propoxy}-N-
méthylbenzamide(énantiomère 1)
L'énantiomère 1 a été obtenu par séparation préparative sur colonne chirale
CHERALPACK IA 20 m chargée à 0.3g/650g, mélange éluant :
acétonitrile/diéthylamine
(100/0.1), débit 100m1/min, détection UV à 280nm.
Pouvoir rotatoire : [ap] 589n22 = - 58.06 (c = 1.0; Me0H)
Exemple 7b: Chlorhydrate de 4-13-(cis-2-azabicyclo[3.1.01hex-2-yl)propoxyl-N-
méthylbenzamide(énantiomère 2)
L'énantiomère 2 a été obtenu par séparation préparative sur colonne chirale
CHIRALPACK IA 20 m chargée à 0.3g/650g, mélange éluant :
acétonitrile/diéthylamine
(100/0.1), débit 100m1/min, détection UV à 280nm.
Pouvoir rotatoire : [cie]589nm22
+ 58.81 (c = 1.0; Me0H)
Exemple 8: Chlorhydrate de N-(4-{3-(cis-2-azabicyclo [3.1.0] hex-2-yl)propoxy}
phény1)-N-méthylacétamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A, en
remplaçant au Stade 1 le 4-hydroxybenzamide par le N-(4-hydroxyphény1)-N-
méthylacétamide.
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
17
Microanalyse élémentaire :
%C %H %N %Cl-
Calculé 62,86 7,76 8,62 10,91
Trouvé 62,08 7,12 8,48 11,02
Exemple 8a: Chlorhydrate de N-(4-{3-(cis-2-azabicyclo13.1.01hex-2-yl)propoxy}
phény1)-N-méthylacétamide
L'énantiomère 1 a été obtenu par séparation préparative sur colonne chirale
CHIRALPACK IA 20m chargée à 0.5g/650g, mélange éluant :
acétonitrile/diéthylamine
(100/0.1), débit 100m1/min, détection UV à 295nm.
Pouvoir rotatoire : [ad sionm22 = - 23.52 (c = 1.02; Me0H)
Exemple 8b: Chlorhydrate de N-(4-{3-(cis-2-azabicyclo13.1.01hex-2-yl)propoxy}
phény1)-N-méthylacétamide
L'énantiomère 2 a été obtenu par séparation préparative sur colonne chirale
CHIRALPACK IA 20 m chargée à 0.5g/650g, mélange éluant :
acétonitrile/diéthylamine
(100/0.1), débit 100m1/min, détection UV à 295nm.
Pouvoir rotatoire : [ad ss9nm22 = +24.17 (c = 1.0; Me0H)
Exemple 9: Chlorhydrate de N-(4-{3-(cis-2-azabicyclo[3.1.01hex-2-Apropoxy}
phény1)-2-méthoxyacétamide
Le procédé expérimental est identique à celui de l'Exemple 1, voie de synthèse
A, en
remplaçant au Stade 1 le 4-hydroxybenzamide par le N-(4-hydroxyphény1)-2-
méthoxyacétamide.
Microanalyse élémentaire :
%C %H %N %Cl-
Calculé 60,92 7,67 7,89 9,99
Trouvé 59,91 7,63 7,76 9,65
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
18
ETUDE PHARMACOLOGIQUE
EXEMPLE A: Dosages cérébraux de la Nt-Méthylhistamine chez la souris NMRI
Cette étude réalisée selon la méthode de Taylor et Con. (Biochem. Pharm.,
1992, 44, 1261-
1267), a pour objectif d'évaluer l'activité ex vivo des composés de la
présente invention en
tant qu'antagonistes des récepteurs histaminergiques centraux de type H3.
Cette activité est
révélée par la mesure, après traitement par voie orale des composés sous
étude, des taux
centraux de W-Méthylhistamine, métabolite principal de l'histamine. Une
augmentation
des concentrations cérébrales de W-Méthylhistamine signe une augmentation du
turn-over
de l'histamine par blocage des récepteurs histaminergiques centraux de type
113.
Des souris N1VIRI (18-20 g) sont traitées par voie orale par les composés de
la présente
invention ou par leur véhicule (20 ml/kg). Une heure après le traitement
pharmacologique,
les animaux sont sacrifiés, les cerveaux sont prélevés, congelés dans l'azote
liquide, pesés
et homogénéisés dans HC104 0,1 N à 4 C. Les homogénats sont centrifugés
(15000 g,
17 min, 4 C). Les surnageants sont récupérés et aliquotés. Les aliquotes sont
congelés
dans l'azote liquide et stockés à ¨80 C jusqu'à leur analyse.
La détermination des taux cérébraux de W-Méthylhistamine est réalisée par
électrophorèse
capillaire. Les taux tissulaires de NT-Méthylhistamine sont exprimés en lig/g
de cerveau
frais. La comparaison des taux cérébraux de Nt-Méthylhistamine entre les
animaux traités
par le véhicule (témoins) et les animaux traités par les composés de la
présente invention
est effectuée par une analyse de variance à un facteur suivie si nécessaire
par une analyse
complémentaire (test de Durmett).
Les résultats montrent que les composés de la présente invention sont
capables, à la dose
de 3 mg/kg PO, d'augmenter de façon significative les concentrations
cérébrales
endogènes de Nt-Méthylhistamine de plus de 200 %.
A titre d'exemple, les composés des Exemples 4, 9, 8, 7, 6 et 3, administrés à
3 mg/kg PO,
augmentent les concentrations cérébrales endogènes de Nt-Méthylhistamine,
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
19
respectivement de:
Composé de l'Exemple 4: +221%
Composé de l'Exemple 9: +250%
Composé de l'Exemple 8: +276%
Composé de l'Exemple 7: +377%
Composé de l'Exemple 6: +225%
Composé de l'Exemple 3: +272%
Ces résultats indiquent que les composés de la présente invention sont de
puissants
antagonistes des récepteurs histaminergiques centraux de type H3.
EXEMPLE B : Affinité sur les récepteurs H3 murins
L'objectif est de mesurer l'affmité des composés de la présente invention pour
les
récepteurs histaminergiques murins de type 113 transfectés dans des cellules
CHO.
Les composés sont incubés à différentes concentrations en présence des
cellules CHO
transfectées, d'un ligand radiomarqué, le iodoproxifan, spécifique des
récepteurs H3 et de
billes de scintillant pendant 24h à température ambiante.
A l'issue de l'incubation, le déplacement de la liaison spécifique du ligand
par les
composés étudiés est mesuré, et les constantes d'affmité de ces composés pour
les
récepteurs 113 de souris sont déterminées.
Les résultats montrent que les composés de l'invention sont affins pour les
récepteurs
histaminergiques de type H3. A titre d'exemple :
Composé de l'Exemple 1: Ki = 2.4 tM
Composé de l'Exemple 3: Ki = 0.75 1..tM
Composé de l'Exemple 5: Ki = 0.18
Composé de l'Exemple 9: Ki = 0.39 M
CA 02782469 2012-05-30
WO 2011/070253 PCT/FR2010/000823
EXEMPLE C: Compositions pharmaceutiques
Formule de préparation pour 1000 comprimés dosés à 100 mg:
Composé de l'Exemple 4 .....................................................
100 g
Hydroxypropylcellulose .....................................................
20 g
5 Polyvinylpyrrolidone ..................................................
20 g
Amidon de blé ..............................................................
150 g
Lactose ....................................................................
900 g
Stéarate de magnésium ......................................................
30 g