Note: Descriptions are shown in the official language in which they were submitted.
CA 02783697 2012-06-07
WO 2011/080405 1 PCT/FR2010/000785
PROCEDE D'ELIMINATION DE COMPOSES ACIDES D'UN EFFLUENT
GAZEUX AVEC UNE SOLUTION ABSORBANTE A BASE DE DIAMINES
Domaine de l'invention
La présente invention concerne l'élimination de composés acides (H2S, C02,
COS, CS2, mercaptans, ...) dans un effluent gazeux au moyen d'une solution
aqueuse
absorbante comportant des diamines. L'invention s'applique avantageusement au
traitement de gaz d'origine industrielle et de gaz naturel.
Art antérieur
Traitement des gaz d'origine industrielle
La nature des effluents gazeux que l'on peut traiter est diverse, on peut
citer de
façon non limitative les gaz de synthèse, les fumées de combustion, les gaz de
raffinerie, les gaz obtenus en queue du procédé Claus, les gaz de fermentation
de
biomasse, les gaz de cimenterie et les gaz de hauts-fourneaux.
Tous ces gaz contiennent.des composés acides tels que par exemple le dioxyde
de carbone (CO2), l'hydrogène sulfuré (H2S), I'oxysulfure de carbone (COS), le
disulfure de carbone (CS2) et les mercaptans (RSH), principalement le
méthylmercaptan (CH3SH), l'éthylmercaptan (CH3CH2SH) et les propylmercaptans
(CH3CH2CH2SH).
Par exemple, dans le cas des fumées de combustion, l'effluent gazeux contient
de l'azote, du C02, de l'oxygène et quelques impuretés soufrées ou azotées. Le
C02
est le composé acide que l'on cherche à éliminer. En effet, le dioxyde de
carbone est
un des gaz à effet de serre largement produits par différentes activités de
l'homme et
30. a un impact direct sur la pollution atmosphérique. Afin de diminuer les
quantités de
dioxyde de carbone émises dans l'atmosphère, il est possible de capter le C02
contenu
dans un effluent gazeux. A titre d'illustration, une unité de captage du C02
en post-
combustion a pour objectif de réduire de 90% les émissions de C02 d'une
centrale
thermique. La décarbonatation est généralement réalisée par un lavage du gaz
par
une solution absorbante contenant une ou plusieurs amines.
CA 02783697 2012-06-07
WO 2011/080405 2 PCT/FR2010/000785
En outre, dans le cas du gaz de synthèse, l'effluent gazeux contient du
monoxyde de carbone CO, de l'hydrogène H2i de la vapeur d'eau et du dioxyde de
carbone C02. Il contient, en outre, des impuretés soufrées (H2S, COS, etc.),
azotées
(NH3, HCN) et halogénées qu'il s'agit d'éliminer afin que le gaz n'en
contienne plus
qu'à des teneurs résiduelles. Les impuretés présentes dans le gaz de synthèse
non
purifié peuvent entraîner une corrosion accélérée des installations et sont
susceptibles
d'empoisonner les catalyseurs utilisés pour les procédés de synthèse chimique
tels
que ceux utilisés dans la synthèse Fischer-Tropsch ou du méthanol, ou encore
d'atténuer les performances des matériaux utilisés dans les piles à
combustibles. Des
considérations environnementales imposent également l'élimination des
impuretés
présentes dans les gaz. Dans le cas particulier de la synthèse Fischer-
Tropsch, les
spécifications requises en entrée de l'unité Fischer-Tropsch sont
particulièrement
sévères, les teneurs présentes dans le gaz de synthèse devant être
généralement
inférieures à 10 ppb poids pour les impuretés soufrées. Pour atteindre des
teneurs
aussi basses en impuretés soufrées, on réalise généralement un lavage du gaz
par
une solution absorbante contenant des amines, combiné à l'utilisation de
masses de
captation.
Traitement de gaz naturel
La désacidification du gaz naturel a pour objectif l'élimination des composés
acides tels que le dioxyde de carbone (CO2), mais aussi l'hydrogène sulfuré
(H2S),
l'oxysulfure de carbone (COS), le disulfuré de carbone (CS2) et les mercaptans
(RSH),
principalement le méthylmercaptan (CH3SH), l'éthylmercaptan (CH3CH2SH) et les
propylmercaptans (CH3CH2CH2SH). Les spécifications généralement effectuées sur
le
gaz désacidifié sont 2% de C02, voire 50 ppm volume de C02 pour réaliser
ensuite
une liquéfaction du gaz naturel ; 4 ppm d'H2S, et 10 à 50 ppm volume de soufre
total.
La désacidification est donc souvent réalisée en premier lieu, notamment afin
d'éliminer les gaz acides toxiques tel que l'H2S dans la première étape de la
chaîne de
procédés et afin d'éviter la pollution des différentes opérations unitaires
par ces
composés acides, notamment la section de déshydratation et la section de
condensation et de séparation des hydrocarbures les plus lourds. La
désacidification
est généralement réalisée par un lavage du gaz par une solution absorbante
contenant une ou plusieurs amines.
CA 02783697 2012-06-07
WO 2011/080405 3 PCT/FR2010/000785
De par le monde, on peut trouver des gaz naturels ayant des compositions en
gaz acides diverses et variées. 'Ainsi, on peut trouver des gaz ne contenant
principalement que de l'H2S, ou que du C02, ou ces deux gaz en mélange. Par
ailleurs,
on peut trouver des gaz naturels très riches (jusqu'à 40% vol.) ou très
pauvres (une
centaine dè'-ppm.) en composés acides. En plus des contraintes dues à la
nature du
gaz à traiter, l'opérateur qui est amené désacidifier ce gaz doit prendre en
compte des
contraintes de spécification de transport (2% de C02 pour un transport en
pipeline, et
50 ppm volume pour un transport par bateau après liquéfaction) et des
contraintes
liées aux autres unités de la chaîne de traitement du gaz (par exemple, une
unité de
type Claus transformant l'H2S toxique en souffre inerte, ne tolère pas plus de
65% de
C02). Pour répondre à toutes ces contraintes, l'opérateur peut être amené à
réaliser
une désacidification totale (C02 et H2S), une désacidification sélective de
l'H2S, ou
bien encore une désacidification suivie d'une étape d'enrichissement du gaz
acide en
H2S.
Élimination des composés acides par absorption
La désacidification des effluents gazeux est généralement réalisée par lavage
par une solution absorbante. La solution absorbante permet d'absorber les
composés
acides présents dans l'effluent gazeux (notamment C02, H2S, mercaptans, COS,
CS2).
D'une manière générale, pour le traitement d'effluents acides comprenant des
composés acides comme par exemple H2S, C02, mercaptans, COS, S02, CS2,
l'utilisation de composés à base d'amines est intéressante, en raison de leur
facilité de
mise en oeuvre en solution aqueuse.
Les solvants couramment utilisés aujourd'hui sont les solutions aqueuses
d'alcanolamine = primaire, secondaire ou tertiaire, en association avec un
éventuel
solvant physique. On peut citer par exemple le document FR 2 820 430 qui
propose
des procédés de désacidification d'effluents gazeux. On peut aussi citer par
exemple le
brevet US 6 852 144 qui décrit une méthode d'élimination des composés acides
des
hydrocarbures. La méthode utilise une solution absorbante eau-
méthyldiéthanolamine
ou eau-triéthanolamine contenant une forte proportion d'un composé appartenant
au
groupe suivant : piperazine et/ou méthylpiperazine et/ou morpholine.
CA 02783697 2012-06-07
WO 2011/080405 . 4 PCT/FR2010/000785
Le brevet US4240923 préconise l'utilisation d'amines dites stériquement
.encombrées pour enlever les composés acides d'un effluent gazeux en
comprenant,
ces amines présentant notamment des avantages en terme de capacité
d'absorption
et d'énergie de régénération. Les structures décrites sont notamment des
hétérocycliques azotées dérivés de la pipéridine dont la position en a de
l'atome
d'azote est encombrée par un groupement alkyle ou alcool notamment.
Par exemple, dans le cas du captage du C02, le C02 absorbé réagit plus ou
moins rapidement avec l'alcanolamine présente en solution selon une réaction
exothermique réversible, bien connue de l'homme du métier et conduisant à la
formation d'hydrogénocarbonates, de carbonates et/ou de carbamates, permettant
une élimination du C02 dans le gaz à traiter.
De même, pour l'élimination de l'H2S dans le gaz à traiter, l'H2S absorbé
réagit
15. instantanément avec l'alcanolamine présente en solution selon une réaction
exothermique réversible, bien connue de l'homme du métier et conduisant à la
formation d'hydrogénosulfure.
Il est bien connu de l'homme du métier que les amines tertiaires ou les amines
secondaires avec un encombrement stérique sévère ont une cinétique de captage
du
C02 plus lente que des amines primaires ou secondaires peu encombrées. En
revanche, les amines tertiaires ou secondaires avec un encombrement stérique
sévère
ont une cinétique de captage de l'H2S instantanée, ce qui permet de réaliser
une
élimination sélective de l'H2S basée sur des performances cinétiques
distinctes (brevet
US 4,405,581).
Une des limitations des solvants couramment utilisés aujourd'hui dans des
applications de désacidification totale est une cinétique de captage du C02 ou
du COS
trop lente. Dans le cas où la teneur en C02 (ou éventuellement en COS) dans le
gaz
brut est au dessus des spécifications désirées et que l'on souhaite donc
éliminer ce
gaz acide, il est nécessaire de dimensionner la colonne d'absorption en
fonction de la
cinétique de réaction entre l'amine et le C02 (ou éventuellement le COS). Plus
la
cinétique de réaction est lente, plus la hauteur de la colonne sera importante
toute
CA 02783697 2012-06-07
WO 2011/080405 5 PCT/FR2010/000785
chose égale par ailleurs, sachant qu'il existe plusieurs ordre de grandeur
entre la
cinétique de réaction pour une amine tertiaire ou fortement encombrée
stériquement,
et une amine primaire ou secondaire. Cette limitation est particulièrement
importante
dans le cas de la décarbonatation d'un gaz naturel ou la désulfuration du gaz
de
synthèse, puisque la colonne d'absorption est sous pression, et représente
donc la
majeure partie des investissements.
Une autre limitation des solvants couramment utilisés aujourd'hui dans des
applications de désacidification sélective de l'H2S est une cinétique de
captage du C02
trop rapide. En effet, dans certains cas de désacidification du gaz naturel,
on
recherche une élimination sélective de H2S en limitant au maximum l'absorption
du
C02. Cette contrainte est particulièrement importante pour des gaz à traiter
contenant
déjà une teneur en C02 inférieure ou égale à la spécification désirée. On
recherche
alors une capacité d'absorption de H2S maximale avec une sélectivité maximale
d'absorption de H2S vis-à-vis du C02. Cette sélectivité permet de récupérer un
gaz
acide en sortie de régénérateur ayant une concentration la plus élevée
possible en
H2S ce qui limite la taille des unités de la chaîne soufre en aval du
traitement et
garanti un meilleur fonctionnement. Dans certains cas, une unité
d'enrichissement en
H2S est nécessaire pour concentrer en H2S le gaz acide. On recherchera là
aussi
l'amine la plus sélective. Des amines tertiaires, comme la
Méthyldiéthanolamine, ou
encombrées présentant une cinétique de réaction lente avec le C02 sont
couramment
utilisées, mais présentent des sélectivités limitées à des taux de charge en
H2S élevés.
Que l'on recherche un cinétique de captage du C02 maximale dans une
application désacidification totale, ou une cinétique de captage du CO2
minimale dans
une application sélective, on désire toujours utiliser un solvant ayant la
capacité
cyclique la plus grande possible. En effet, plus le solvant a une forte
capacité cyclique,
plus les débits de solvant qu'il faudra mettre en oeuvre pour désacidifier de
gaz à
traiter seront restreints.
Un des aspects primordial des opérations de traitement de gaz ou fumées
industrielles par solvant est l'étape d'absorption. Le dimensionnement de la
colonne
d'absorption est crucial pour assurer un bon fonctionnement de l'unité. Si
comme
énoncé précédemment la cinétique de captage du C02 est un critère déterminant
la
CA 02783697 2012-06-07
WO 2011/080405 6 PCT/FR2010/000785
hauteur de la colonne, la capacité cyclique du solvant est un critère
déterminant le
diamètre de la colonne. En effet, plus le solvant aura une grande capacité
cyclique,
plus le débit de solvant nécessaire pour traiter le gaz acide sera faible.
Ainsi, plus le
débit de solvant à circuler dans la colonne est faible, plus le diamètre de la
colonne
d'absorption peut être faible, sans que ne se produise de phénomène
d'engorgement
de la colonne. Dans une application où la colonne d'absorption est sous
pression,
comme le traitement du gaz naturel ou du gaz de synthèse, le diamètre de la
colonne
a un impact énorme sur la masse d'acier constituant la colonne d'absorption,
et donc
son coût.
Dans des cas de désacidification à pression atmosphérique, le coût associé à
la
construction de la colonne d'absorption est moindre, mais ne peut généralement
pas
être négligé. Si on prend l'exemple du captage du C02 en post-combustion, où
la
concentration en C02 très faible, on' remarque que le débit de gaz à traiter
est souvent
un critère plus dimensionnant que la capacité du solvant. Néanmoins, la
capacité du
solvant, et donc le débit à faire circuler dans l'unité, va avoir un impact
important sur
divers coûts d'investissements et opératoire de l'unité. On peut citer par
exemple les
coûts associés aux pompes et la puissance électrique nécessaire pour les faire
fonctionner.
Un autre aspect primordial des opérations de traitement de gaz ou fumées
industrielles par solvant reste la, régénération de l'agent de séparation. En
fonction du
type d'absorption (physique et/ou chimique), on envisage généralement une
régénération par détente, et/ou par distillation et/ou par entraînement par un
gaz
vaporisé appelé "gaz de strippage".
Une des limitations des, solvants couramment utilisés aujourd'hui est une
consommation énergétique nécessaire la régénération du solvant qui est trop
importante. Ceci est particulièrement vrai dans le cas où la pression
partielle de gaz
acides est faible. Par exemple, pour une solution aqueuse de MonoEthanolAmine
à
30% poids utilisée pour le captage du C02 en post-combustion dans une fumée de
centrale thermique, où la pression partielle de C02 est de l'ordre d,e 0,12
bar, l'énergie
de régénération représente 3,7 G) environ par tonne de CO2 captée. Une telle
CA 02783697 2012-06-07
WO 2011/080405 7 PCT/FR2010/000785
consommation énergétique représente un coût opératoire considérable pour le
procédé de captage du C02.
Il est bien connu de l'homme du métier que l'énergie nécessaire à la
régénération par distillation d'un solvant chimique peut se décomposer selon
trois
différents postes : l'énergie nécessaire pour réchauffer le solvant entre la
tête et le
fond du régénérateur, l'énergie nécessaire pour abaisser la pression partielle
de gaz
acide dans le régénérateur par vaporisation d'un gaz de strippage, et enfin
l'énergie
nécessaire pour casser la liaison chimique entre l'amine et le CO2.
Ces deux premiers postes sont inversement proportionnels aux débits de
solution absorbante qu'il est nécessaire de faire circuler dans l'unité pour
réaliser une
spécification donnée. Pour diminuer la consommation énergétique associée à la
régénération du solvant, il est donc préférable encore une fois de maximiser
la
capacité cyclique du solvant.
Le dernier poste concerne l'énergie à fournir pour casser la liaison créée
entre
l'amine utilisée et le C02. Pour diminuer la consommation énergétique associée
à la
régénération du solvant, il est donc préférable de minimiser l'enthalpie de
liaison AH.
Néanmoins, il n'est pas évident de trouver un solvant présentant une forte
capacité
cyclique et une faible enthalpie de réaction. Le meilleur solvant d'un point
de vue
énergétique est donc celui qui permettra d'avoir le meilleur compromis entre
une forte
capacité cyclique Aa et une faible enthalpie de liaison AH.
Il est difficile de trouver des composés, ou une famille de composés,
permettant
aux différents procédés de désacidification de fonctionner à moindre coûts
opératoires
(dont l'énergie de régénération et les coûts de circulation du solvant) et
d'investissements (dont la hauteur et le diamètre de la colonne d'absorption),
aussi
bien dans une problématique de désacidification totale que dans une
problématique
d'élimination sélective de l'H2S.
La demanderesse a découvert que les composés répondant à la définition des
diamines ci-après décrites présentent un intérêt important dans l'ensemble des
procédés de traitement d'effluents gazeux pour l'élimination de composés
acides.
Résumé de l'invention
CA 02783697 2012-06-07
WO 2011/080405 8 PCT/FR2010/000785
La présente invention a donc pour objet de pallier un ou plusieurs des
inconvénients de l'art antérieur en proposant une méthode pour éliminer les
composés
acides, tels que le C02, l'H2S, le COS, le CS2, le S02 et les mercaptans, d'un
gaz par
l'utilisation d'une amine spécifique dont les propriétés absorbantes sont
supérieures à
celles des amines de références utilisées dans les applications de captage du
C02 en
post-combustion et dans les applications de le traitement du gaz naturel, à
savoir la
monoéthanolamine (MEA) et la méthyldiéthanolamine (MDEA) respectivement.
La présente invention décrit un procédé d'élimination des composés acides
contenus
dans un effluent gazeux, dans lequel on effectue une étape d'absorption des
composés acides par mise en . contact de l'effluent avec une solution
absorbante
comprenant:
a - de l'eau;
b - entre 21% et 80% poids d'une diamine comportant une fonction amine
tertiaire et une fonction amine primaire ou secondaire, la diamine répondant à
la
formule générale (I) suivante
N rR61H
R2" 3
R5 R7 R
a (I)
dans laquelle
= a est un nombre entier compris entre 1 et 11,
= chacun des radiaux Ri et R2 est choisi indépendamment parmi un groupe C1-C12
alkyle ou un groupe C1-C12 alcoxyalkyle,
= chacun des radiaux R3, R4, R5, R6 et R7 est choisi parmi un atome
d'hydrogène,
un groupe C1-C12 alkyle, et un groupe C1-C12 alcoxyalkyle.
= Le radical R3 est différent de R1 et de R2.
Selon l'invention, Ri et R2 peuvent être reliés entre eux pour former un
hétérocycle
de type pipéridine, pyrolidine, homopipéridine ou morpholine, le cycle étant
constitué
de 5 à 8 atomes.
De préférence, le radical R3 peut être choisi parmi un. groupe C1-C12 alkyle
et un
groupe C1-C12 alcoxyalkyle.
CA 02783697 2012-06-07
WO 2011/080405 9 PCT/FR2010/000785
La diamine peut être choisie parmi le groupe constitué de la (N-
morpholinoéthyl)
isopropylamine, de la (N-pipéridinoéthyl) isopropylamine, de la [N,N-diméthyl-
N'-(3-
méthoxypropyl)]-1,2-propanediàmine, de la [N,N-diméthyl-N'-(méthane-2-
tétrahydrofurfuryl)] - 1,2-propanediamine, de la [N,N-diméthyl-N'-(2-butyl)]-
1,3-
propanediamine, de la [N,N-diméthyl-N'-(2-butyl)]-1,3-propanediamine, de la
[N,N-
diméthyl-N'-butyl]-1,3-propanediamine, de la [N,N-diméthyl-N'-(méthyl-2-
propyl)]-
1,3-propanediamine, de la [N,N-diméthyl]-1,6-hexanediamine, de la [N,N-
diéthyl]-
1,6-hexanediamine et de la N,-diéthyl-1,4-pentanediamine.
La fonction amine primaire ou secondaire peut être liée à au moins un carbone
quaternaire ou deux carbones tertiaires. Dans ce cas, la diamine peut être
choisie
parmi le groupe constitué de la (N-morpholinoéthyl) tertiobutylamine, de la
[N,N-
diméthyl-N'-isopropyl]- 1,2-propanediamine, de la [N,N-diméthyl-N'-
tertiobutyl]-1,2-
propanediamine, de la [N,N-diméthyl-N'-tertiooctyl]-1,2-propanediamine, de la
[N,N-
diméthyl-N'-(2-butyl)]-1,2-propanediamine et de la [N,N-diméthyl-N'-terbutyl]-
1,3-
propanediamine.
La solution absorbante peut comporter entre 10% et 60% poids de diamine et
entre
10 et 90% poids d'eau. La solution absorbante peut comporter, en outre, une
quantité,
non nulle et inférieure à 20 % poids d'un composé activateur, ledit composé
comportant une fonction amine primaire -ou secondaire. Le composé activateur
peut
être choisi dans le groupe constitué par
- MonoEthanolAmine,
- N-butylethanolamine
- Aminoethylethanolamine,
- Diglycolamine,
- Pipérazine,
- N-(2-hydroxyethyl)Pipérazine,
- N-(2-aminoethyl)Pipérazine,
= Morpholine,
3-(metylamino)propylamine.
La solution absorbante peut comporter en outre un solvant physique choisi
parmi le
méthanol et la sulfolane.
CA 02783697 2012-06-07
WO 2011/080405 10 PCT/FR2010/000785
L'étape d'absorption des composés acides peut être réalisée à une pression
comprise
entre 1 bar et 120 bars, et à une température comprise entre 20 C et 100 C.
Dans le procédé selon l'invention, on peut effectuer une étape de régénération
de la
solution absorbante chargée en, composés acides dans laquelle on effectue au
moins
l'une des opérations suivantes: chauffage, détente, distillation. L'étape de
régénération peut être réalisée à une pression comprise entre 1 bar et 10 bars
et une
température comprise entre 100 C et 180 C.
L'effluent gazeux peut être choisi parmi le gaz naturel, les gaz de synthèse,
les
fumées de combustion, les gaz de raffinerie, les gaz obtenus en queue du
procédé
Claus, les gaz de fermentation de biomasse, les gaz de cimenterie, les fumées
d'incinérateur.
Le procédé selon l'invention peut être mis en oeuvre pour l'élimination
sélective de
l'H2S d'un effluent gazeux comportant de l'H2S et du C02.
En effet, la demanderesse a découvert que les composés répondant à la
définition des diamines selon l'invention permettent d'obtenir des capacités
cycliques
plus importantes que les amines de référence, aussi bien dans des applications
où la
pression partielle de gaz acide est faible (par exemple pour le captage du C02
contenu
dans des fumées de combustion) , que dans des applications où la pression
partielle
de gaz acide est élevée (par exemple le traitement du gaz naturel). Cette
performance est certainement accrue du fait d'une plus grande densité de sites
amine
rapportée à la masse molaire des molécules, mais aussi du fait de posséder sur
la
même molécule, une fonction amine primaire ou secondaire, et une fonction
tertiaire
ne pouvant pas former de carbamates. Par ailleurs, en faisant varier
l'encombrement
stérique de la fonction amine primaire ou secondaire, il est possible
d'obtenir des
amines performantes aussi bien dans des applications de désacidification
totale, que
dans des applications. où l'on recherche une élimination sélective de l'H2S.
D'autres caractéristiques 'et avantages de l'invention seront mieux compris et
apparaîtront clairement à la lecture de la description faite, ci-après, en se
référant à la
figure 1 représentant un schéma de principe d'un procédé de traitement
d'effluents de
gaz acides.
CA 02783697 2012-06-07
WO 2011/080405 11 PCT/FR2010/000785
Description détaillée de l'invention
L'invention concerne un procédé pour absorber les composés acides d'un
effluent gazeux, en mettant en contact l'effluent gazeux avec une solution
absorbante
liquide comprenant
- de l'eau;
- au moins une diamine dans lesquelles les 2 fonctions amines ne sont pas
reliées entre elles par des cycles et dont la fonction amine en position a est
toujours
tertiaire et la fonction amine située en position ai est toujours soit
primaire, soit
secondaire, cette fonction étant plus ou moins encombrée stériquement suivant
l'application visée, la diamine répondant à la formule générale (I) suivante
et
conditionnée par les règles précisées ci-après.
R~~N Rs H
R2~ R3.
R5 R7
a (I)
avec
= a = 1 à 11, de préférence a = 1 à 5 et encore de préférence a = 1, 2 ou 5
= Ri et R2 sont choisis parmi un groupe Cl à C12, de préférence Cl à C6,
alkyle
et/ou un groupe Cl à C12, de préférence Cl à C6, alcoxyalkyle, linéaires,
ramifiés ou cycliques. De préférence, Ri et R2 sont indépendamment choisis
parmi un groupement méthyle et un groupement éthyle.
= Selon un mode de réalisation, Ri et R2 sont indépendants, c'est à dire
qu'ils ne
sont pas reliés entre eux. Alternativement, selon un autre mode de
réalisation,
Ri et R2 peuvent être reliés entre eux pour former un hétérocycle par exemple
de type pipéridine, pyrolidine, homopipéridine ou morpholine, le cycle étant
constitué de 5 à 8 atomes, de préférence un cycle à 5 ou 6 atomes.
= R3 est choisi parmi
o un atome d'hydrogène ou
o un groupe alkyle ou alcoxyalkyle de Cl à C12, de préférence de Cl à C6,
linéaires, ramifiés ou cycliques,
= Le radical R3 est différent de R1 et de R2.
CA 02783697 2012-06-07
1L
WO 2011/080405 PCT/FR2010/000785
= R4, R5, R6 et R7 sont indifféremment choisis parmi des atomes d'hydrogène ou
des groupes alkyle ou alcoxyalkyle de Cl à C12 linéaires, ramifiés ou
cycliques.
De préférence, R4 et R5 sont des atomes d'hydrogène. De préférence, R6 et R7
sont choisis indépendamment parmi un atome d'hydrogène et un groupement
méthyle.
De préférence, R3 est choisi parmi un groupe alkyle ou alcoxyalkyle de Cl à
C12,
de préférence de Cl à C6, linéaires, ramifiés ou cycliques.
Dans la présente description, on entend par groupe alcoxyalkyle un groupe
hydrocarboné renfermant un ou plusieurs atome d'oxygène dont au moins un est
sous
la forme d'une fonction éther
De préférence, la solution absorbante mise en oeuvre dans le procédé selon
l'invention ne comporte pas de TMHDA.
De préférence, la solution absorbante mise en oeuvre dans le procédé selon
l'invention comporte une diamine selon l'invention répondant à la formule (I)
précédemment décrite, à l'exception des dérivés alkylés de la 1,6-
hexanediamine.
Dans la présente description les dérivés alkylés de la 1,6-hexanediamine
désignent les
composés répondant à la formule (I) dans laquelle chacun des radicaux Ri et R2
est
choisi indépendamment parmi un groupe alkyle contenant de 1 à 4 atomes de
carbone
et dans laquelle le radical R3 est choisi parmi un atome d'hydrogène ou un
groupe
alkyle contenant de 1 à 4 atomes de carbone.
De préférence, la solution absorbante mise en oeuvre dans le procédé selon
l'invention comporte une diamine selon l'invention répondant à la formule (I)
précédemment décrite, à l'exception des composés suivants : la N,N-
dimethylhexane-
1,6-diamine et la N,N,N'-trimethylhexane-1,6-diamine.
De manière particulière, l'invention concerne un procédé d'élimination
sélective
de H2S dans un gaz contenant H2S et du CO2. Pour cette application, la diamine
selon
l'invention est choisie de telle sorte que la fonction amine primaire ou
secondaire soit
sévèrement encombrée, c'est-à-dire que la fonction amine primaire ou
secondaire soit
CA 02783697 2012-06-07
WO 2011/080405 13 PCT/FR2010/000785
reliée à au moins un carbone quaternaire ou à deux carbones tertiaires. En
d'autres
termes, la fonction amine primaire ou secondaire sévèrement encombrée est
reliée à
un carbone quaternaire, un carbone quaternaire et un carbone tertiaire, deux
carbones tertiaires, ou deux carbones quaternaires. De préférence, la diamine
sévèrement encombrée selon l'invention comporte une fonction amine secondaire.
Des exemples de composés de formule générale (I) sévèrement encombrés,
peuvent être données
= dans le cas où la diamine selon l'invention possède un carbone
quaternaire en alpha de la fonction -NH-, par exemple le composé de
formule générale (I) est tel que les groupes R6 et R7 soient des
hydrogènes et le groupe R3 est un groupe tertiobutyle
= dans le cas où la molécule possède deux carbones tertiaires en alpha et
en a ' de la fonction -NH-, par exemple le composé de formule générale
(I) est tel que le groupe R6 soit un groupe méthyle, le groupe R7 un
hydrogène et le groupe R3 un groupe isopropyle.
= dans le cas où l'atome de carbone adjacent à l'atome d'azote d'une
amine primaire serait quaternaire, par exemple le composé de formule
générale (I) est tel que R3 est un atome d'hydrogène et où R6 et R7 sont
chacun un radical méthyle.
Les composés de formules générales (I) présentent un intérêt dans l'ensemble
des procédés de traitement de gaz acides (gaz naturel, fumées de combustion,
gaz de
synthèse, etc.), dans une composition aqueuse de solution absorbante.
La présente invention propose d'éliminer les composés acides d'un effluent
gazeux en mettant en oeuvre un composé absorbant en solution aqueuse. Les
diamines selon l'invention, présentent une capacité d'absorption plus
importante avec
les composés acides (notamment le C02, l'H2S, le COS, le S02, le CS2 et les
mercaptans) que la monoéthanolamine (MEA) et la méthyldiéthanolamine (MDEA),
classiquement utilisées. En effet, les diamines selon l'invention présentent
la
particularité d'avoir des taux de charge a = ngaz acide/namine (a désignant le
ratio entre le
nombre de mole de composés acides absorbés ngaz acide par- une portion de
solution
absorbante par' rapport au nombre de mole de d'amine namine contenu dans
ladite
portion de solution absorbante) très importants quelque soit l'application
envisagée,
CA 02783697 2012-06-07
WO 2011/080405 14 PCT/FR2010/000785
comparativement à la MEA et à la MDEA, classiquement utilisées. L'utilisation
d'une
solution absorbante aqueuse selon l'invention permet d'économiser sur le coût
d'investissement et les coûts opératoires d'une unité de désacidification
(traitement de
gaz et captage du C02). Dans le cas particulier des diamines selon l'invention
pour
lesquels la fonction amine secondaire est sévèrement encombrée, l'invention
permet
de réduire la quantité de C02 captée pour un taux de charge en H2S plus
important
par rapport à la MDEA. Ce gain de capacité et de sélectivité entraîne des
économies
sur les coûts d'investissement et les coûts opératoires de l'unité de
désacidification
ainsi que de l'unité Claus en aval qui traite un gaz plus riche en H2S.
Nature des effluents gazeux
Les solutions absorbantes selon l'invention peuvent être mises en oeuvre pour
désacidifier les effluents gazeux suivants : le gaz naturel, les gaz de
synthèse, les
fumées de combustion, les gaz. de raffinerie, les gaz obtenus en queue du
procédé
Claus, les gaz de fermentation de biomasse, les gaz de cimenterie, les fumées
d'incinérateur. Ces effluents gazeux contiennent un ou plusieurs des composés
acides
suivants : le C02, l'H2S, des mercaptans, du COS, du CS2, le S02.
Les fumées de combustion sont produites notamment par la combustion
d'hydrocarbures, de biogaz, de charbon dans une chaudière ou pour une turbine
à gaz
de combustion, par exemple dans le but de produire de l'électricité. Ces
fumées ont
une température comprise entre 20 et 60 C, une pression comprise entre 1 et 5
bars
et peuvent comporter entre 50 et 80 % d'azote, entre 5 et 40 % de dioxyde de
carbone, entre 1 et 20 % d'oxygène, et quelques impuretés comme des SOx et des
NOx, s'ils n'ont pas été éliminés en aval du procédé de désacidification.
Le gaz de synthèse contient du monoxyde de carbone CO, de l'hydrogène H2
(généralement dans un ratio H2/CO égale à 2), de la vapeur d'eau (généralement
à
saturation à la température où le lavage est effectué) et du dioxyde de
carbone C02
(de l'ordre de la dizaine de %). La pression est généralement comprise entre
20 et
30 bars, mais peut atteindre jusqu'à 70 bars. Il contient, en outre, des
impuretés
soufrées (H2S, COS, etc.), azotées (NH3, HCN) et halogénées.
Le gaz naturel est constitué majoritairement d'hydrocarbures gazeux, mais peut
contenir plusieurs des composés acides suivants : le C02, l'H2S, des
mercaptans, du
CA 02783697 2012-06-07
WO 2011/080405 15 PCT/FR2010/000785
COS, du CS2. La teneur de ces composés acides est très variable et peut aller
jusqu'à
40% pour le C02 et l'H2S. La température du gaz naturel peut être comprise
entre
20 C et 100 C. La pression du gaz naturel à traiter peut être comprise entre
10 et
120 bars.
Exemples de voies de synthèse des composés répondant à la formule générale (I)
Les diamines de l'invention peuvent être synthétisées selon différents chemins
réactionnels. Sans être exhaustif, on cite les voies suivantes
A/ par exemple les réactions de condensation
R4 r Re
R1~N NH2 + R3-W eHW
R2 R5 R7
a
en excès Ra Rs H
Rl-,, N N
R3
R2~
R5 R7
a
R4 I61
Rl-,, N W + R3-NH2 eHW
RZ
R5 Ri en excès
a
dans lesquelles W est un groupe libérable au sens de la chimie organique. Il
est
généralement choisi parmi un atome d'halogène notamment un atome de chlore, de
brome ou d'iode. W peut également être un radical tosylate ou mésylate bien
connus
comme groupements libérables. Dans certains cas les groupes nitro peuvent
satisfaire
à la réaction.
Il s'agit de réactions de condensation conventionnelles. L'obtention de la
fonction
amine secondaire est conditionnée par l'excès d'amine primaire c'est à dire le
rapport
du nombre de mole d'amine primaire par rapport à celui du synthon porteur du
groupement libérable W. Le rapport idéal pour obtenir sélectivement une. amine
secondaire et éviter une deuxième réaction de condensation qui conduirait à
une
fonction amine tertiaire est à déterminer spécifiquement pour chaque réaction.
Généralement ce rapport se situe entre 2 et 10 et le plus souvent entre 3 et
7.
On notera que l'un des précurseurs de ces réactions est toujours porteur d'une
fonction amine tertiaire. Dans certains cas, ces fonctions pourront être
présentes sous
forme d'halohydrates par exemple de chlorhydrates.
CA 02783697 2012-06-07
WO 2011/080405 16 PCT/FR2010/000785
B/ par exemple les voies suivantes qui peuvent conduire à des diamines selon
l'invention. Il s'agit de l'addition d'une amine primaire sur l'insaturation
d'un dérivé de
l'acrylamide ou sur l'insaturation de l'acrylonitrile suivie de
l'hydrogénation de la
fonction carbonyle qui converti la fonction amide en amine ou de
l'hydrogénation de la
fonction nitrile qui la converti en fonction amine primaire
H
N-R3 H H2
R~ jNH + H2C=CH-C~~ . R1 ~NCHC. N-R3 R1 jN+CHi-N-R3
R2 O R2 2 O R2 3
H2
Ri-,, NH + H2C=CH-C=-N jNCH~C=N H2 Ri-NH2
R2 R2 J 2 R2 3
C/ par exemple la réaction de condensation d'un synthon, porteur d'une amine
primaire avec un synthon porteur d'une fonction carbonyle cétone ou aldéhyde
ce qui
conduit à l'obtention d'une imine puis après hydrogénation à une amine
secondaire et
que l'on peut illustrer ainsi
R4 rRs R8 ~2 R4 R6
N NH2 + O=C/ - R1~N N=C/ 8
R2 R5 L R7 R9 R2 R5 R7 R9
a a
H2
R R4 R6 H R8
N N-CH
R2/ R5 R7 R9
a
ou
CA 02783697 2012-06-07
WO 2011/080405 17 PCT/FR2010/000785
R4 R6 RIR8 R4 Re R11 R8
Rj~ /~ 1 GH2O Rj~,, 1 1
C + H2N-C-R9 N C=N-C-R9
N
I -f 1 1 1 1
R2. R5 R7 O R1o R2/ R5 R7 R1o
a-1 a-1
H2
R4 R6 R11 R8
R1 1 H I
/N CH-N-CI-R9
RZ
R5 R7 R1o
a-1
avec ici des radicaux -CHR8R9 et -CR8R9R10 compatibles avec la définition de
R3
dans la formule générale (I) et un radical R11 compatible avec la définition
de R6 ou
de R7 dans la formule générale (I).
D/ par exemple, on peut accéder à des diamines selon l'invention en procédant
à
l'alkylation partielle d'une diamine primaire ou secondaire grâce aux moyens
connus
pour effectuer ce type de réaction telle la réaction d'une amine primaire ou
secondaire
avec un aldéhyde ou une cétone en présence d'hydrogène et avec l'aide d'un
catalyseur.
Le schéma suivant illustre cette route de synthèse représentée à titre
d'exemple à
partir d'une diamine possédant deux fonctions amine primaire, de formaldéhyde
et
d'hydrogène. Ici, 8 produits de degrés d'alkylation différents peuvent être
obtenus. 2
d'entre eux correspondent à une diamine selon l'invention.
CA 02783697 2012-06-07
WO 2011/080405 18 PCT/FR2010/000785
R4 R6 R4 R6
N H H
N N
/ - /
R5. R7 R5 LR7
a a
R4 R6 H Ra R6
Ra R6 Fi2CO /N R5 1j: RR7
H2N
NH2 a
++-
cat
R5 R7
a R4 R6 R4 RjN NH2 H2N R5 R7 1i:(
a a
R4 R6 R4 R6 H
/N NH2 H2N N
R5. R7 R5 LR7
a a
Le schéma suivant illustre cette route de synthèse représentée à titre
d'exemple à
partir d'une diamine dont l'une des fonctions est tertiaire et l'autre
primaire, de
formaldéhyde et d'hydrogène. Ici, 2 produits de degrés d'alkylation différents
peuvent
être obtenus. L'un d'entre eux correspond à une diamine selon l'invention.
R4 R6 H2CO Ra R6 Ra R6
N NH H2 R1-. N + R1~N N/
Rz/ R5 1 2 cat R2/ R5 LR7ja \ R2/ R7
a a
Exemples de diamines répondant à la formule générale (I)
Parmi les molécules de l'invention, on peut sans être exhaustif citer les
molécules
suivantes. On distingue les molécules de la liste a) présentant un
encombrement
faible ou modéré de la fonction -NH- à la liste b) de molécules présentant un
encombrement sévère de la fonction -NH-. Les molécules de la liste b) sont
particulièrement adaptées à une élimination sélective de. H2S dans un gaz
contenant
H2S et C02
a) Molécules avec un encombrement faible ou modéré
CA 02783697 2012-06-07
WO 2011/080405 19 PCT/FR2010/000785
H
(N-morpholinoéthyl) isopropylamine
oJ
H
(N-pipéridinoéthyl) isopropylamine "
H
[N,N-diméthyl-N'-(3-méthoxypropyl)]-
1,2-propanediamine I I
\ N
[N,N-diméthyl-N'-(méthane-2-
tétrahydrofurfuryl)]-1,2-
propanediamine
[N,N-diméthyl-N'-(2-butyl)]-1,3-
H
propanediamine
[N,N-diméthyl-N'-butyl]-1,3- H
propanediamine
[N,N-diméthyl-N'-(méthyl-2-propyl)]-
1,3-propanediamine H
NHy
N,-diéthyl-1,4-pentanediamine
et éventuellement
[N,N-diméthyl]-1,6-hexanediamine NHZ
[N,N-diéthyl]-1,6-hexanediamine /\N NHZ
J
CA 02783697 2012-06-07
WO 2011/080405 20 PCT/FR2010/000785
b) Molécules avec un encombrement sévère
(N-morpholinoéthyl) tertiobutylamine
oJ n
[N,N-diméthyl-N'-isopropyl]-1,2-
propanediamine [N,N-diméthyl-N'-tertiobutyl]-1,2- \N~
propanediamine
[N,N-diméthyl-N'-tertiooctyl]-1,2- NA A
propanediamine
H
[N,N-diméthyl-N'-(2-butyl)]-1,2-
propanediamine
[N,N-diméthyl-N'-terbutyl]-1,3- ~N~~N^
H
propanediamine
Composition de la solution aqueuse absorbante
Les diamines selon l'invention peuvent être en concentration variable par
exemple comprise entre 21% et 80% poids, de préférence entre 25% et 60% poids,
de manière très préférée entre 30% et 50% poids, dans la solution aqueuse.
La solution absorbante peut contenir entre 10% et 90% poids d'eau, de
manière préférée de 50% à 70% d'eau.
Dans un mode de réalisation, les composés de formule générale (I) peuvent
être formulées avec une autre amine, contenant au moins une fonction amine
primaire ou secondaire (activateur), jusqu'à une concentration de 20% poids,
de
CA 02783697 2012-06-07
WO 2011/080405 21 PCT/FR2010/000785
préférence inférieure à 15% poids, de préférence inférieure à 10% poids. Ce
type de
formulation est particulièrement intéressante dans le cas du captage du C02
dans les
fumées industrielles, ou le traitement du gaz naturel contenant du C02 et/ou
du COS
au dessus de la spécification désirée. En effet, pour ce type d'applications,
on cherche
à augmenter la cinétique de captage du C02 et/ou du COS afin de réduire la
taille des
équipements.
Une liste non exhaustive de composés pouvant être utilisés comme activateurs
est
donnée ci-dessous
- MonoEthanolAmine,
- N-butylethanolamine
- Aminoethylethanolamine,
- Diglycolamine,
- Pipérazine,
- N-(2-hydroxyethyl)Pipérazine,
- N-(2-aminoethyl)Pipérazine,
- Morpholine,
- 3-(metylamino)propylamine.
La solution absorbante peut comprendre un solvant physique, par exemple le
méthanol ou la sulfolane.
Dans un mode de réalisation, les composés de formule générale (I) peuvent
être formulés avec une autre amine, ayant une cinétique de captage du C02
lente,
comme par exemple une amine tertiaire. Dans ce mode de réalisation, c'est le
composé de formule générale (I) qui joue le rôle d'activateur.
Procédé d'élimination des composés acides dans un effluent gazeux
La mise en oeuvre d'une solution absorbante pour désacidifier un effluent
gazeux est réalisée de façon schématique en effectuant une étape d'absorption
suivie
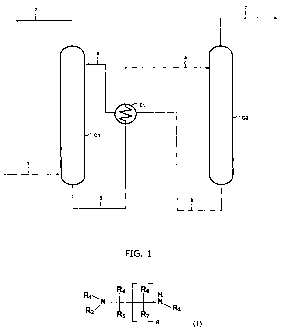
d'une étape de régénération, par exemple tel que représenté par la figure 1.
L'étape
d'absorption consiste à mettre en contact l'effluent gazeux contenant les
composés
acides à éliminer avec la solution absorbante dans une colonne d'absorption
Cl.
L'effluent gazeux à traiter 1 et la solution absorbante 4 alimentent la
colonne Cl. Lors
CA 02783697 2012-06-07
WO 2011/080405 22 PCT/FR2010/000785
du contact, les composés organiques munis d'une fonction amine de la solution
absorbante 4 réagissent avec les composés acides contenus dans l'effluent 1 de
manière à obtenir un effluent gazeux appauvri en composés acides 2 qui sort en
tête
de colonne Cl et une solution absorbante enrichie en composés acides 3 qui
sort en
fond de colonne Cl. La solution absorbante enrichie en composés acides 3 est
envoyée vers un échangeur El, où elle est réchauffée par le flux 6 provenant
de la
colonne de régénération C2. La solution absorbante 5 chargée et réchauffée en
sortie
de l'échangeur El alimente la colonne à distiller (ou colonne de régénération)
C2 dans
laquelle a lieu la régénération de la solution absorbante chargée en composés
acides.
Eventuellement, avant d'être introduite dans la colonne C2, la solution
absorbante 3
ou 5 chargée en composés acides peut être détendue. L'étape de régénération
peut
donc consister à chauffer, éventuellement à détendre, ou à distiller la
solution
absorbante enrichie en composés acides afin de libérer les composés acides qui
sortent en tête de colonne C2 sous forme gazeuse 7. La solution absorbante
régénérée, c'est-à-dire appauvrie en composés acides 6, sort en fond de
colonne C2,
puis passe dans l'échangeur El, dans lequel elle cède de la chaleur au flux 3
comme
décrit précédemment. La solution. absorbante régénérée et refroidie 4 est
ensuite
recyclée vers la colonne d'absorption Cl.
L'étape d'absorption des composés acides peut être réalisée à une pression
comprise entre 1 bar et 120 bars, de préférence entre 20 bars et 100 bars pour
le
traitement d'un gaz naturel, de préférence entre 1 bar et 3 bars pour le
traitement
des fumées industrielles, et à une température comprise entre 20 C et 100 C,
préférentiellement comprise entre 30 C et 90 C, voire entre 30 et 60 C.
L'étape de régénération du procédé selon l'invention peut être réalisée par
régénération thermique, éventuellement complétée par une ou plusieurs étapes
de
détente.
La régénération peut être effectuée à une pression comprise entre 1 bar et
5 bars, voire jusqu'à 10 bars et à une température comprise entre 100 C et 180
C, de
préférence comprise entre 130 C et 170 C. De manière préférée, la température
de
régénération est . comprise entre 155 C et 180 C dans le cas où l'on souhaite
réinjecter les gaz acides. De manière préférée, la température de régénération
est
comprise entre 115 C et 130 C dans les cas où le gaz acide est envoyé à
CA 02783697 2012-06-07
WO 2011/080405 23 PCT/FR2010/000785
l'atmosphère ou dans un procédé de traitement aval, comme un procédé Claus ou
un
procédé de traitement de gaz de queue.
Exemples :
Le mode opératoire, de synthèse est donné pour quelques molécules
appartenant à la famille des composés (I).
On utilise comme solution absorbante dans ces exemples des solutions
aqueuses comportant 30% poids de diamine selon l'invention.
Les performances (i.e capacité de captage du C02) sont comparées notamment
à celle d'une solution aqueuse de MonoEthanolAmine à 30% poids, qui constitue
la
solution absorbante de référence pour une application de captage des fumées en
post-
combustion et à celle d'une solution aqueuse de MethylDiéthanolAmine à 40%
poids,
qui constitue la solution absorbante de référence pour une application de
traitement
de gaz naturel.
Pour l'élimination sélective de l'H2S, on compare les performances (i.e. taux
de
charge et sélectivité) d'une solution aqueuse d'un composé (I) dont la
fonction amine
est sévèrement encombrée est comparée à une solution aqueuse de
Méthyldiéthanolamine, qui constitue le solvant de référence pour une
application de
désacidification sélective en traitement du gaz naturel et à une solution de t-
butylaminoéthanol, monoamine secondaire sévèrement encombrée également
préconisée pour une telle application (brevet US 4,405,581).
Exemple 1 : Mode opératoire de synthèse d'amines de formule générale (I)
A titre indicatif, les exemples suivants illustrent la synthèse de certaines
molécules de
l'invention étant entendu que toutes les possibilités de synthèse de ces
molécules tant
au niveau des routes de synthèses considérées que des modes opératoires
possibles
ne sont pas ici.décrites.
[N,N'-diméthyl-N'-tertiobutyl]-1,=2-propanediamine
CA 02783697 2012-06-07
WO 2011/080405 24 PCT/FR2010/000785
Dans un réacteur autoclave, on introduit 57.7g (0.79 moles) de
tertiobutylamine, 80
ml d'éthanol puis 25.Og (0.158 moles) de 1-diméthylamino-2-chloropropane sous
sa
forme chlorhydrate. Le milieu est porté à la température de 110 C pendant 5
heures,
puis après retour à la température ambiante, le milieu est neutralisé avec
13.3g de
soude en pastilles pendant 1 heure à 80 C. Après filtration, on procède à la
distillation
du milieu. Après élimination de l'amine en excès et du solvant, on recueille
216.8g
d'une fraction distillant entre 170 et 174 C à la pression atmosphérique et
dont le
spectre RMN est conforme avec la structure théorique souhaitée.
[N,N'-diméthyl-N'-(3-méthoxypropyl)]-1,2-propanediamine
Dans un ballon on introduit 164.9g ( 1.85 moles) de 3-méthoxypropylamine et
59g
(0.37 moles) de 1-diméthylamino-2-chloropropane sous sa forme chlorhydrate. Le
milieu est porté à la température de 118 C pendant 5 heures. Après évaporation
de
l'amine en excès, à la température ambiante, le milieu est neutralisé avec une
solution de 32.4g de soude dans 130 ml d'eau. On procède à l'évaporation de
l'eau
sous pression réduite puis à la filtration du sel précipité. Le solide est
lavé avec de
l'éther puis on joint la fraction éthérée au produit et on procède à la
distillation du
milieu. On recueille 37.6g d'une fraction distillant entre 36 et 38 C sous 0.5
mm Hg
et dont le spectre RMN est conforme avec la structure théorique souhaitée.
On peut aussi préparer cette molécule par condensation d'une mole de 3-
méthoxypropyla mine avec 1.5 moles de diméthylaminoacétone à une température
légèrement supérieure à 100 C permettant d'éliminer l'eau de condensation en
continu au moyen d'un séparateur de Dean & Strark. Puis après évaporation de
la
diméthylaminoacétone en excès et séchage du milieu, on procède, à la
température
ambiante, à l'hydrogénation de l'imine obtenue avec une quantité
stoechiomérique de
tetrahydroborate de sodium. Cette opération conduit à la molécule souhaitée.
Exemple 2 : Capacité de captage d'amines de formule générale (I) dont les deux
atomes azotes sont séparés par deux ou trois atomes de carbone
On réalise un test d'absorption sur des solutions aqueuses d'amine au sein
d'un
réacteur fermé parfaitement agité et dont la température est contrôlée par un
système de régulation. Pour chaque solution, l'absorption est réalisée dans un
volume
CA 02783697 2012-06-07
WO 2011/080405 25 PCT/FR2010/000785
liquide de 50 cm3 par des injections de C02 pur à partir d'une réserve. La
solution
absorbante est préalablement tirée sous vide avant toute injections de C02. La
pression de la phase gaz dans le réacteur est alors suivi en fonction du temps
suite
aux injections de C02. Un bilan matière global sur la phase gaz permet de
mesurer le
taux de charge du solvant a = nb de mole gaz acide/nb de mole amine, en
fonction de
la pression partielle de gaz acide.
A titre d'exemple, on peut comparer les taux de charge (a = nb de mole gaz
acide/nb
de mole amine) obtenus à 40 C pour différentes pressions partielles de C02
entre des
solutions absorbantes [N,N-diméthyl-N'-tertiobutyl]-1,2-propanediamine et de
N,N-
diméthyl-N'-(3-méthoxypropyl)]-1,2-propanediamine selon l'invention et une
solution
absorbante de MonoEthanolAmine à 30% en poids pour une application de captage
du
C02 en post-combustion; ainsi qu'une solution absorbante de
MéthylDiéthanolAmine à
40% en poids pour une application de décarbonatation du gaz naturel pour
répondre
aux spécifications du gaz naturel liquéfié.
Pour passer d'une grandeur du taux de charge obtenu au laboratoire à une
grandeur
caractéristique du procédé, quelques calculs sont nécessaires, et sont
explicités ci-
dessous pour les deux applications visées.
Dans le cas d'une application de captage du C02 des fumées en post-combustion,
les
pressions partielles de C02 dans l'effluent à traiter sont typiquement 0,1 bar
avec une
température de 40 C, et l'on souhaite abattre 90% du gaz acide. On calcule la
capacité cyclique oapc exprimée en moles de C02 par kg de solvant, en
considérant
que la solution absorbante atteint sa capacité thermodynamique maximale en
fond de
colonne d'absorption appco2=o,lbar et doit au moins être régénéré en dessous
de sa
capacité thermodynamique dans les conditions de la tête de colonne
appc02=0,olbar pour
réaliser 90% d'abattement du CO2.
AaPC = (aPPC02=o,1bar - aPPC02=o,olbar ). [A] = 101M
où [A] est la concentration d'amine exprimée en % poids, et M la masse molaire
de
l'amine en g/mol.
CA 02783697 2012-06-07
WO 2011/080405 26 PCT/FR2010/000785
L'enthalpie de réaction peut être obtenue par calcul à partir de plusieurs
isothermes
d'absorption du C02 en appliquant, la loi Van't Hoff.
Dans le cas d'une application de décarbonatation d'un gaz naturel pour une
application visant l'obtention d'un gaz naturel liquéfié (LNG), les pressions
partielles
de C02 dans le gaz à traiter sont par exemple 0,3 bar et 1 bar avec une
température
de 40 C. On souhaite ici atteindre une spécification de 50ppm, ce qui en
première
approximation correspond à un solvant complètement régénéré (a5oppm-0). Comme
précédemment, on calcule la capacité cyclique ALNG exprimée en moles de C02
par kg
de solvant, en considérant que le solvant atteint sa capacité thermodynamique
maximale en fond de colonne d'absorption cPPC02=0,3bar et PPC02=lbar pour des
pressions
partielles de 0,3 et 1 bar respectivement.
0aLNGar = (aPPC02=0,3bar - a50ppm J. [A] -101 M z (apPC02=0,3bar ). [A] = 101
M
Aalbar -(a -a )=[A]=101M~(a )=[A]=101M
LNG = PPC02=1bar 50ppm PPC02=1bar
où [A] est la concentration d'amine exprimée en % poids, et M la masse molaire
de
l'amine en g/mol.
Cas relatif au captage du C02 en post-combustion
T PPCO PPC0 - 011 Au (mol OH
Nom Générique Concentration ( C) Il 0,01 bar bar 2 C02/kg (kJ/mol
(D Solvant) C02)
[N,N-diméthyl-N'-
% poids 40 0 0.36 0.88 0.97 64
tertiobutyl]-1,2-
ai
propanediamine x
MonoEthanolAmine 30 % poids 40 0.44 0.52 0.38 92
CA 02783697 2012-06-07
WO 2011/080405 27 PCT/FR2010/000785
Cas relatif à la décarbonatation du gaz naturel pour une spécification LNG
T Ac 0,3bar (MOI AaIbar (MOI
Nom Générique Concentration (-C) barC02 = 0,3 C02/kg ba CO2 = 1 C02/kg
Solvant) Solvant)
rn=
[N,N-diméthyl-N'-
tertiobutyl]-1,2- 30 % poids 40 1.14 2.16 1.45 2.74
propanediamine x
:3 c
cc
MethylDiEthanolAmine 40 % poids 40 0.50 1.68 0.70 2.35
Cet exemple montre les taux de charge plus importants qui peuvent être
obtenus grâce à une solution absorbante selon l'invention, comprenant 30 %
poids de
molécules de formule générale (I) aussi bien à des faibles qu'à des fortes
pressions
partielles de gaz acides.
De plus, pour, une application captage des fumées en post-combustion où la
pression partielle de C02 dans l'effluent à traiter est de 0.1 bar, cet
exemple illustre la
plus grande capacité cyclique en moles de C02 par kilogramme de solvant
obtenue
grâce à une solution absorbante selon l'invention, comprenant 30 % poids de
molécules de formule générale (I) pour atteindre un taux d'abattage de 90% en
sortie
d'absorbeur. Dans cette application, où l'énergie associé à la régénération du
solvant
est critique, on peut remarquer que les amines répondant à la formule générale
(I)
permettent d'obtenir un bien meilleur compromis que la MEA, en terme de
capacité
cyclique et d'enthalpie de réaction.
De plus, pour une application décarbonatation d'un gaz naturel où la pression
partielle de C02 dans l'effluent à traiter est compris entre 0,3 et 1 bar, cet
exemple
illustre la plus grande capacité cyclique en moles de CO? par kilogramme de
solution
absorbante obtenue grâce à une solution absorbante selon l'invention,
comprenant
% poids de molécules de formule générale (I) pour atteindre une spécification
de
50 ppm de C02 dans le gaz traité.
CA 02783697 2012-06-07
WO 2011/080405 28 PCT/FR2010/000785
Exemple 3 : Capacité et sélectivité d'élimination de H2S d'un effluent gazeux
contenant H2S et C02 par une solution d'amine de formule (I) dont la fonction
amine
secondaire est sévèrement encombrée
On réalise un test d'absorption à 40 C sur des solutions aqueuses d'amine au
sein
d'un réacteur parfaitement agité ouvert coté gaz.
Pour chaque solution, l'absorption est réalisée dans un volume liquide de 50
cm3 par
bullage d'un courant gazeux constitué d'un mélange azote : dioxyde de carbone
hydrogène sulfuré de 89:10:1 en proportions volumiques, d'un débit de 30NL/h
pendant 90 minutes.
On mesure à l'issue du test le taux de charge en H2S obtenu (a =nb de mole de
H2S
/kg de solvant) ainsi que la sélectivité d'absorption vis-à-vis du CO2.
Cette sélectivité S est défini de la manière suivante
(Concentration du mélange gazeux en C02)
S = (H2s/ac02). soit dans les conditions du test
(Concentration du mélange gazeux en H2S)
décrit ici S= 10(aH2s/aco2)
A titre d'exemple, on peut comparer les taux de charge et la sélectivité entre
une
solution absorbante de (N-morpholinoéthyl)tertiobutylamine selon l'invention
et une
solution absorbante de Méthyldiéthanolamine ainsi qu'une solution absorbante
de
tertiobutylaminoéthanol à 40% en poids (US 4,405,581).
Taux de
Composé Concentration T( C) charge en H2S Sélectivité
(mole/kg)
MDEA 40% 40 0,15 6
t-butylaminoéthanol 40% 40 0,36 7.6
(N-
morpholinoéthyl)tertio 40% 40 0,29 19.2
butylamine
Cet exemple illustre les gains en taux de charge et en sélectivité pouvant
être atteint
avec une solution absorbante selon l'invention, comprenant 40%pds de molécules
de
formule générale (I) avec un encombrement sévère de la fonction amine
secondaire.