Note: Descriptions are shown in the official language in which they were submitted.
WO 2011/121245 PCT/FR2011/050726
PROCEDE DE PREPARATION DE DERIVES D'AMINO-BENZOFURANE
La présente invention se rapporte, d'une manière générale, à la préparation de
dérivés d'amino-benzofurane.
Plus précisément, l'invention concerne un procédé pour la préparation de
dérivés
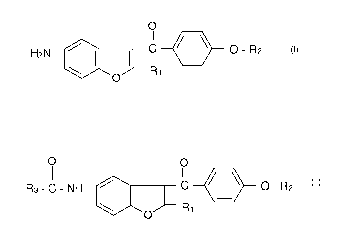
de 5-amino-benzofurane de formule générale:
O
Il
H2N I I C /_\ O - R2
O R1
ainsi que de ses sels d'addition d'acide, dans laquelle R, représente
l'hydrogène ou un
groupe alkyle et R2 représente un groupe alkyle ou dialkylaminoalkyle.
Dans la formule I ci-dessus:
= R, représente, en particulier, un groupe alkyle, linéaire ou ramifié, en Cl-
C8
notamment un groupe alkyle, linéaire ou ramifié, en Cl-C4 tel que méthyle,
éthyle, n-
propyle, isopropyle, n-butyle, sec-butyle ou tert-butyle,
= R2 représente, en particulier, un groupe alkyle, linéaire ou ramifié, en Cl-
C8
notamment un groupe alkyle, linéaire ou ramifié, en Cl-C4 tel que méthyle,
éthyle, n-
propyle, isopropyle, n-butyle, sec-butyle ou tert-butyle ou encore un groupe
dialkylaminoalkyle dans lequel chaque groupe alkyle, linéaire ou ramifié, est
en C,-
C8 notamment dans lequel chaque groupe alkyle, linéaire ou ramifié, est en C1-
C4 tel
que méthyle, éthyle, n-propyle, isopropyle, n-butyle, sec-butyle ou tert-
butyle.
En particulier, R, représente n-butyle et R2 représente 3-(di-n-butylamino)-
propyle.
Parmi les composés de formule I ci-dessus, le 2-n-butyl-{4-[3-(di-n-
butylamino)-
propoxy]-benzoyl}-5-amino-benzofurane décrit dans le brevet EP 0471609 s'est
révélé
particulièrement utile comme produit intermédiaire pour la préparation finale
de dérivés
aminoalkoxybenzoyl-benzofurane en particulier pour la préparation du 2-n-butyl-
3-{4-[3-
(di-n-butylamino)-propoxy]-benzoyl}-5-méthanesulfonamido-benzofurane
communément
dénommé dronédarone ainsi que de ses sels pharmaceutiquement acceptables. Ce
WO 2011/121245 PCT/FR2011/050726
2
dérivé de méthanesulfonamido-benzofurane a été décrit dans le brevet cité
précédemment de même que ses applications thérapeutiques notamment dans le
domaine cardiovasculaire où il s'est révélé particulièrement intéressant par
exemple
comme antiarythmique.
En outre, on a rapporté dans ce même brevet EP 0471609 un procédé pour la
synthèse du 2-n-butyl-3-{4-[3-(di-n-butylamino)-propoxy]-benzoyl}-5-amino-
benzofurane
mettant en oeuvre le 2-n-butyl-3-{4-[3-(di-n-butylamino)-propoxy]-benzoyl}-5-
nitro-
benzofurane que l'on réduit, sous pression, avec l'hydrogène en présence
d'oxyde de
platine comme catalyseur, ce qui produit le composé désiré.
Toutefois, ce procédé n'est pas dépourvu d'inconvénients inhérents notamment
au type
de réaction utilisée à savoir une hydrogénation sous pression qui comporte un
risque
industriel.
La recherche d'un procédé de préparation du 2-n-butyl-3-{4-[3-(di-n-
butylamino)-
propoxy]-benzoyl}-5-amino-benzofurane capable de pallier cet inconvénient et
désavantage reste donc d'un intérêt primordial.
La demande de brevet US 4 666 931 et les articles Chemistry of Heterocyclic
Compounds
(1975), vol. 11, p. 1361-1364, Journal of Organometallic Chemistry (1998),
vol. 560, p.
163-167, Bulletin of the Chemical Society of Japan (1967), vol. 40, p. 1724-
1726,
décrivent des dérivés N-phényl-alkylamide et 5-N-alkylamido-benzofurane mais
ne
suggèrent aucunement leur utilisation dans la préparation de composés de
formule (I)
selon l'invention.
De plus, WO 03/040120 décrit un procédé de préparation de la Dronédarone, en 6
étapes, mettant en oeuvre une réaction de Friedel et Crafts. Toutefois, ce
document ne
décrit pas la préparation de la Dronédarone comportant une simple étape de
traitement
d'un dérivé 5-N-alkylamido-benzofurane de formule (Ila) selon l'invention avec
un acide
fort.
Selon l'invention, les dérivés de 5-amino-benzofurane de formule I peuvent
être
préparés en traitant, avec un acide fort tel qu'un hydracide, par exemple
l'acide
chlorhydrique, un dérivé de 5-N-alkylamido-benzofurane de formule générale :
WO 2011/121245 PCT/FR2011/050726
3
O / \
R3-C-NH I C _ O-R2
\IO R,
II
dans laquelle R, et R2 ont la même signification que précédemment et R3
représente
un groupe alkyle, linéaire ou ramifié, en C,-C4i par exemple méthyle, pour
former un
sel d'addition d'acide du composé de formule I, sel qui est lui-même traité,
si
nécessaire, avec un agent basique tel qu'un hydroxyde de métal alcalin, pour
produire
ce composé de formule I sous forme de base libre.
Dans ce qui précède et ce qui suit, et sauf mention spécifique
Par acide fort , on entend tout composé chimique qui a une très forte
affinité à
apporter des protons dans le milieu réactionnel et qui est caractérisé, en
solution
aqueuse, par un pKa inférieur ou égal à 1. Par acide fort , on entend
notamment tout
hydracide tel que choisi parmi l'acide chlorhydrique, l'acide bromhydrique ou
l'acide
fluorhydrique.
Par agent basique , on entend tout composé chimique qui a une forte
affinité pour
les protons H+ et qui est caractérisé, en solution aqueuse, par un pKa
supérieur à 7. Par
agent basique , on entend notamment tout type de bases tel que choisies parmi
les
bases organiques, les bases faibles et les bases fortes, notamment choisies
parmi les
amines tertiaires, les carbonates de métal alcalin et les hydroxydes de métal
alcalin.
Par base forte , on entend tout composé chimique qui a une très forte
affinité pour
les protons H+ et qui est caractérisé, en solution aqueuse, par un pKa
supérieur à 14. Par
base forte , on entend notamment tout hydroxyde de métal alcalin, tel que
choisi parmi
l'hydroxyde de sodium ou de potassium.
Le traitement acide peut être entrepris dans un solvant polaire tel qu'un
alcool par
exemple l'éthanol, au moyen d'un acide généralement en excès par exemple de 1
à 6
équivalents de cet acide par équivalent de composé de formule Il.
D'autre part, le sel d'addition d'acide du composé de formule I peut être
traité avec
un agent basique, après isolation du milieu réactionnel dans lequel il se
forme ou, au
contraire, in situ c'est-à-dire au sein de ce même milieu réactionnel.
Les composés de départ de formule Il peuvent être préparés selon le schéma
réactionnel suivant :
WO 2011/121245 PCT/FR2011/050726
4
0
O 0
R3-C-NH R3C-NH C - H
OH OH
III IV
O
il
R40-C-CH-Ri
0 o 1 v
i il O Hal
R3-C- NH C-H il
O-CH-C-O-R4
Ri VI
O 0
Il il 0
R3CNH C - H II
O - CH - C - OH
R1
VII
O
R3-CNH /
VIII
O Ri
O
Hal - C / \ O-R5 lx
WO 2011/121245 PCT/FR2011/050726
O O
R3 -C-NH C / \ O-R5
O R1
X
O O
il Il
R3-C-NH C OH
R1
XI
Hal - R2
XII
O O
11 5~11' 11
R3 - C - NH C O-R2
O R1
il
c'est-à-dire au départ d'un composé de formule III, dans laquelle R3 a la même
5 signification que précédemment, composé que l'on chauffe en présence d'acide
trifluoroacétique dans un solvant approprié habituellement une amine, par
exemple
l'hexaméthylènetétramine pour former un dérivé de N-phényl-alkylamide de
formule IV
dans laquelle R3 a la même signification que précédemment.
On fait alors réagir cet amide de formule IV avec un ester de formule V dans
laquelle R,
a la même signification que précédemment, R4 représente un groupe alkyle,
linéaire ou
ramifié, en C,-C4 et Hal représente un halogène, par exemple brome, en
présence d'un
agent basique généralement une base faible telle qu'un carbonate de métal
alcalin et par
chauffage dans un solvant polaire de manière à former un ester de formule VI
dans
laquelle R,, R3 et R4 ont la même signification que précédemment.
L'ester de formule VI est alors saponifié en présence d'une base forte
généralement
un hydroxyde de métal alcalin, la réaction se déroulant habituellement à
température
WO 2011/121245 PCT/FR2011/050726
6
ambiante et dans un solvant approprié, par exemple un éther, pour donner un
sel de
dérivé d'acide carboxylique que l'on traite avec un acide fort, tel qu'un
hydracide par
exemple l'acide chlorhydrique, ce qui fournit un dérivé d'acide carboxylique
de formule VII
dans laquelle R, et R3 ont la même signification que précédemment.
Le composé de formule VII ainsi produit est alors cyclisé en un dérivé de
benzofurane de formule VIII dans laquelle R, et R3 ont la même signification
que
précédemment et ce, en présence d'une base organique généralement une amine
tertiaire et d'un halogénure de benzènesulfonyle. La réaction est
habituellement conduite
par chauffage dans un solvant approprié, en général un solvant aprotique tel
qu'un
hydrocarbure aromatique ou un éther.
Le dérivé de benzofurane de formule VIII ainsi obtenu est alors couplé avec un
halogène d'acyle de formule IX dans laquelle R5 représente un groupe alkyle,
linéaire ou
ramifié, en C,-C4 par exemple méthyle et Hal a la même signification que
précédemment
par exemple chlore et ce, en présence d'un acide de Lewis par exemple le
chlorure
ferrique et dans un solvant non polaire par exemple un composé halogéné. Le
milieu
réactionnel ainsi obtenu est ensuite hydrolysé en présence d'un acide fort,
par exemple
un hydracide, pour produire une cétone de formule X dans laquelle R,, R3 et R5
ont la
même signification que précédemment.
Cette cétone de formule X est alors déalkylée par chauffage en présence de
chlorure
d'aluminium et dans un solvant non polaire habituellement un solvant halogéné
tel que le
chlorobenzène pour former un dérivé 4-hydoxy-phényle de formule XI dans
laquelle R, et
R3 ont la même signification que précédemment.
Par la suite, le composé de formule XI est mis en réaction avec un halogénure
d'alkyle de formule XII dans laquelle R2 a la même signification que
précédemment et Hal
a la même signification que précédemment par exemple chlore, la réaction ayant
lieu en
présence d'un agent basique tel qu'un carbonate de métal alcalin et par
chauffage
habituellement dans un solvant polaire tel qu'une cétone pour produire le
composé désiré
de formule Il.
Un autre objet de la présente invention se rapporte aux dérivés de N-phényl-
alkylamide de formule générale :
O 0
R3-C-NH C-H
O-Y
XIII
WO 2011/121245 PCT/FR2011/050726
7
dans laquelle R3 a la même signification que précédemment et Y représente
l'hydrogène
ou un groupe de formule générale
O
-CH-C-O-R6
1
Ri
XIV
dans laquelle R,' et R6 représentent chacun, indépendamment l'un de l'autre,
l'hydrogène
ou un groupe alkyle, linéaire ou ramifié, en Cl-C4
à l'exclusion des composés pour lesquels R3 = Me, Et, isopropyle et Y= H.
Parmi les dérivés de N-phényl-alkylamide de formule générale XIII, on peut
citer ceux
dans lesquels R3 représente un groupe alkyle, linéaire ou ramifié, en Cl-C4 et
y
représente un groupe de formule générale XIV :
O
-CH-C-O-R6
Ri
XIV
dans laquelle R,' et R6 représentent chacun, indépendamment l'un de l'autre,
l'hydrogène
ou un groupe alkyle, linéaire ou ramifié, en C,-C4.
Parmi les composés de formule XIII, on peut citer le sous-groupe suivant dans
lesquels
Y représente l'hydrogène ou le groupe XIV dans lequel R, représente n-butyle,
de même
que les composés de formule XIII dans lesquels R3 représente méthyle.
D'autre part, parmi les composés de formule XIII, on peut également citer les
sous-
groupes dans lesquels R3 représente méthyle, Y représente l'hydrogène ou le
groupe XIV
dans lequel R, représente n-butyle et R6 représente l'hydrogène ou méthyle.
En conséquence, les sous-groupes des dérivés de N-phényl-alkylamide de formule
XIII
peuvent être ceux dans lesquels
WO 2011/121245 PCT/FR2011/050726
8
a) R3 représente méthyle et Y représente le groupe XIV dans lequel R,'
représente
n-butyle et R6 représente méthyle,
b) R3 représente méthyle et Y représente le groupe XIV dans lequel R,'
représente
n-butyle et R6 représente l'hydrogène.
En outre, un autre objet de la présente invention concerne les dérivés de 5-N-
alkylamido-benzofurane de formule générale.
O
Il Z
Ra- C - NH
\O R1
-T -
1
XV
dans laquelle R,' et R3 ont la même signification que précédemment et Z
représente
l'hydrogène ou un groupe de formule générale
O
- il-~
O-R2
XVI
dans laquelle R2' représente l'hydrogène, un groupe alkyle, linéaire ou
ramifié, en Cl-C4
ou un groupe dialkylaminoalkyle dans lequel chaque groupe alkyle, linéaire ou
ramifié, est
en Cl-C4
à l'exclusion des composés pour lesquels R3 = Me, Z=H et R'1 = H, Me, Et, n-
Bu.
Parmi les dérivés de 5-N-alkylamido-benzofurane de formule générale XV, on
peut citer
ceux dans lesquels R,' représente l'hydrogène ou un groupe alkyle, linéaire ou
ramifié en
Cl-C4 et R3 représente un groupe alkyle linéaire ou ramifié en Cl-C4 et Z un
groupe de
formule générale XVI
O
IC o-R2
XVI
WO 2011/121245 PCT/FR2011/050726
9
dans laquelle R2' représente l'hydrogène, un groupe alkyle, linéaire ou
ramifié, en C,-C4
ou un groupe dialkylaminoalkyle dans lequel chaque groupe alkyle, linéaire ou
ramifié, est
en Cl-C4.
Parmi les composés de formule XV ci-dessus, on peut citer ceux dans lesquels
R,'
représente n-butyle, de même que les composés de formule XV dans laquelle R3
représente méthyle.
D'autre part, parmi les composés de formule XV, on peut citer les sous-groupes
suivants, dans lesquels Z représente l'hydrogène ou un groupe XVI dans lequel
R2'
représente hydrogène, méthyle ou 3-(di-n-butylamino)-propyle.
Par ailleurs, parmi les composés de formule XV, on peut également citer ceux
dans
lesquels R,' représente n-butyle, R3 représente méthyle et R2' représente
hydrogène,
méthyle ou 3-(di-n-butylamino)-propyle.
En conséquence, des sous-groupes des dérivés de 5-N-alkylamido-benzofurane de
formule XV peuvent être ceux dans lesquels:
a) R,' représente n-butyle, R3 représente méthyle et Z représente le groupe
XVI
dans lequel R2' représente l'hydrogène,
b) R,' représente n-butyle, R3 représente méthyle et Z représente le groupe
XVI
dans lequel R2' représente méthyle,
c) R,' représente n-butyle, R3 représente méthyle et Z représente le groupe
XVI
dans lequel R2' représente 3-(di-n-butylamino)-propyle.
Un objet supplémentaire de la présente invention concerne l'utilisation de
composés
de formule Il pour la préparation de la dronédarone et de ses sels
pharmaceutiquement
acceptables.
Ainsi, selon une autre caractéristique de la présente invention, la
dronédarone de
formule
O
I I
H3C - S02 - NH O - (CH2)3-N(C4H9 - n)2
O C4H9- n
et ses sels pharmaceutiquement acceptables, peuvent être obtenus
WO 2011/121245 PCT/FR2011/050726
a) en traitant un dérivé de 5-N-alkylamido-benzofurane de formule générale :
I I R3 - C - NH O (CH2)3-N(C4H9 n)2
5
O C4H9- n
Ila
dans laquelle R3 a la même signification que précédemment, par exemple
méthyle, avec
10 un acide fort tel qu'un hydracide par exemple l'acide chlorhydrique, pour
former un sel
d'addition (aussi nommé sel d'addition d'acide ) du 2-n-butyl-3-{4-[3-(di-n-
butylamino)-
propoxy]-benzoyl}-5-amino-benzofurane de formule :
O
Il
H2N I I O - (CH2)3-N(C4H9 - n)2
\ O C4H9- n
la
sel qui est lui-même traité par un agent basique tel qu'un hydroxyde de métal
alcalin, pour
produire ce composé de formule la sous forme de base libre,
b) en couplant ce dérivé de 5-amino-benzofurane de formule la avec le chlorure
de
méthanesulfonyle pour former le composé dronédarone sous forme de base libre
qui peut
être mise en réaction, si nécessaire, avec un acide pour produire un sel
pharmaceutiquement acceptable de ce composé.
Les dérivés de 5-N-alkylamido-benzofurane de formule lia peuvent être obtenus,
quant
à eux, par mise en oeuvre d'une suite d'étapes selon lesquelles :
a) on fait réagir un dérivé de N-phényl-alkylamide de formule générale :
O O
il il
R3-C-NH C - H
\OH
IV
WO 2011/121245 PCT/FR2011/050726
11
dans laquelle R3 a la même signification que précédemment, avec un ester de
formule générale :
O
R40-C-CH-C4H9-n
1
Hal
Va
dans laquelle R4 et Hal ont la même signification que précédemment et ce, en
présence d'un agent basique et par chauffage dans un solvant polaire pour
former
un ester de formule générale :
O O
Il il
O
M3-L;- NH C-H
Il
O-CH-C-OR4
C4H9-n
Vla
dans laquelle R3 et R4 ont la même signification que précédemment,
b) on saponifie l'ester de formule VIa en présence d'une base forte, la
réaction se
déroulant à température ambiante et dans un solvant approprié pour donner un
sel de dérivé d'acide carboxylique que l'on traite avec un acide fort pour
former le
dérivé d'acide carboxylique de formule générale:
O O
Il il O
R3-C-NH ,,>-H II
\ O-CH-C-OH
1
C4H9-n
VI la
dans laquelle R3 a la même signification que précédemment,
WO 2011/121245 PCT/FR2011/050726
12
c) on cyclise le dérivé d'acide carboxylique de formule VIIa par chauffage
dans un
solvant aprotique et en présence d'une base organique et d'un halogénure de
benzène sulfonyle pour former un dérivé de benzofurane de formule générale
O
il
R3-C-NH
<)7O C4H9-n
Villa
dans laquelle R3 a la même signification que précédemment,
d) on couple le dérivé de benzofurane de formule Villa avec un halogénure
d'acyle
de formule générale :
0
Il
Hal - C> O-R5
lX
dans laquelle R5 et Hal ont la même signification que précédemment et ce, en
présence d'un acide de Lewis et dans un solvant non polaire, le milieu
réactionnel
ainsi formé étant ensuite hydrolysé en présence d'un acide fort pour former
une
cétone de formule générale :
O 0
il -.<7>
R3-lC-IVH C O-R5
O C4Hs-n
\s-n
Xa
dans laquelle R3 et R5 ont la même signification que précédemment,
WO 2011/121245 PCT/FR2011/050726
13
e) on déalkyle la cétone de formule Xa en présence de chlorure d'aluminium et
dans
un solvant non polaire pour former un dérivé 4-hydroxy-phényle de formule
générale
O O
il Il
R3-C-NH C / \ OH
UOC4H9-n
Xla
dans laquelle R3 a la même signification que précédemment,
f) on fait réagir le dérivé 4-hydroxy-phényle de formule Xla avec un
halogénure
d'alkyle de formule générale :
Hal-(CH2)3-N(C4H9-n)2 Xlla
dans laquelle Hal a la même signification que précédemment, la réaction ayant
lieu en présence d'un agent basique et par chauffage dans un solvant polaire,
pour former le composé désiré de formule Ila.
L'Exemple non limitatif suivant illustre l'invention.
30
WO 2011/121245 PCT/FR2011/050726
14
PREPARATIONS
A. N-(3-Formel-4-hydroxy-phénol)-acétamide (composé IV : R3= CH3)
Dans un réacteur de 500 ml, on charge 25 g de N-(4-hydroxy-phényl)-acétamide
(0,165 mole ; 1 équivalent) et 92,7 g d'acide trifluoroacétique (0,661 mole ;
4 équivalents).
On agite puis on ajoute, par petites portions, 92,7 g d'hexaméthylènetétramine
(0,661
mole ; 4 équivalents). La réaction est exothermique. On maintient alors une
température
de 70 C durant 18 heures tout en contrôlant l'évolution de la réaction par
chromatographie sur couche mince (éluant : toluène/éthanol 8/2). On laisse
revenir à
température ambiante le milieu réactionnel qui s'épaissit et que l'on dilue
par ajout de 200
ml d'eau pour faciliter l'agitation. On ajoute ensuite 100 ml d'acétate
d'éthyle. On agite et
on laisse décanter. On ajoute 300 ml d'eau et 200 ml d'acétate d'éthyle, on
agite puis on
décante. On soutire d'abord la phase aqueuse ensuite la phase organique. On
lave alors
deux fois la phase organique avec 150 ml d'eau au total pour recueillir, après
décantation,
une nouvelle phase organique et une nouvelle phase aqueuse. On concentre alors
cette
nouvelle phase organique à l'évaporateur rotatif (t = 45 C ; 50 mm Hg). On
obtient ainsi
14 g du composé désiré, sous la forme de cristaux récupérés à partir d'une
solution rouge
orangée.
RMN 'H (DMSO-d6)
OH
1 CH=O
6 2
5 3
4
NH
0 CH3
Déplacements Multiplicité Intégra-tion Constantes de Attri-
chimiques couplage (IJI bution
b 0,01 ppm 0,5 Hz)
2,00 Singulet 3 - CH3
6,94 Doublet 1 3JH6-H5=9,0 Hz H(6)
WO 2011/121245 PCT/FR2011/050726
7,64 Doublet de 1 3JH5-H5=9,0 Hz H(5)
doublets 4JH5-H3=2,5 Hz
7,88 Doublet 1 4JH3-H5=2,5 Hz H(3)
9,86 Singulet large 1 - NH
10,24 Singulet 1 - CH(7)
10,44 Singulet large 1 - OH
RMN 13C (DMSO-d6)
5
Déplacements chimiques Nombre de Attribution
b 0,1 ppm carbones
23,6 1 CH3
117,3 1 CH(6)
118,5 1 CH(3)
121,8 1 C quaternaire (2)
127,9 1 CH(5)
131,5 1 C quaternaire (4)
156,6 1 C quaternaire (1)
167,9 1 CH-C=O
191,0 1 CH(7) -aldéhyde-
B. 2-(2-Formyl-4-N-acétamido-phénoxy)-hexanoate de méthyle (composé VI: R1= n-
C4H9 ; R3= CH3 ; R4= CH3)
10 Dans un erlenmeyer, on charge 5,1 g de N-(3-formyl-4-hydroxy-phényl)-
acétamide
(composé IV) (0,028 mmole ; 1 équivalent) et 10 ml de N,N-diméthylformamide (2
volumes). On agite le mélange réactionnel à 50 C ce qui fournit une première
solution
orange foncé.
Dans un réacteur de 50 ml, on introduit du carbonate de potassium (0,6
15 équivalent) et 8 ml de N,N-diméthylformamide (1,5 volume). On agite à 50 C
puis on
ajoute la première solution. On continue à agiter durant 1H à 50 C ce qui
fournit une
deuxième solution.
WO 2011/121245 PCT/FR2011/050726
16
On prépare, ensuite, une solution de 6,5 g de 2-bromo-hexanoate de méthyle
(composé V) (1,05 équivalent) dans 5 ml de N,N-diméthylformamide que l'on
ajoute à la
deuxième solution puis on agite l'ensemble à 75 C pendant 5H. On reprend le
mélange
réactionnel avec 15 ml de dichlorométhane et 15 ml d'eau, on agite, décante et
soutire les
2 phases. On lave la phase de dichlorométhane avec de l'eau (3 x 10 ml) puis
on
concentre cette phase à l'évaporateur rotatif pour obtenir 9 g de cristaux de
couleur
marron. On ré-empâte ces cristaux avec 20 ml d'eau puis on les concasse à la
spatule
pour récupérer des cristaux finement divisés en suspension dans l'eau. On
filtre ensuite,
ce qui fournit 8,9 g de cristaux humides que l'on reprend dans 25 ml de méthyl
tert-butyl
éther. On ajoute 5 ml de méthanol et on chauffe alors au reflux pendant 1 h en
présence
de noir (0,1 g). On filtre le mélange réactionnel chaud sur célite puis on le
concentre à
50%. On récupère ainsi 4 g d'un précipité de 98 % de pureté organique. On
concentre à
nouveau le filtrat puis on agite à température ambiante ce qui provoque
l'apparition d'un
nouveau précipité que l'on filtre et sèche. On récupère de cette manière 1,6 g
du
composé désiré.
RMN 'H (CDC13)
7
0
0
4CH=
N H
'00 14
C) 13 3
0
11 1
Déplacements Multipli-cité Intégra- Constantes de Attri-bution
chimiques tion couplage (IJI 0,5
b 0,01 ppm Hz)
0,92 Triplet 3 3JCH3-CH2=7,5 Hz CH3 (12)
1,38 Sextuplet 2 3JCH2-CH3=7,5 Hz CH2 (11)
3JCH2-CH2=7,5 HZ
r---l Quintuplet 2 3JCH2-CH2=7,5 Hz CH2 (10)
WO 2011/121245 PCT/FR2011/050726
17
2,01 Multiplet 2 CH2 (9)
2,15 Singulet 3 - CH3 (16)
3,74 Singulet 3 - CH3 (14)
4,74 Triplet 2 3JCH-CH2=6,0 Hz CH(8)
6,79 Doublet 1 3JH6-H5=9,0 Hz H(6)
7,62 Doublet 1 4JH3-H5=3,0 Hz H(3)
8,09 Doublet de 1 3JH5-H6=9,0 Hz H(5)
doublets 4JH5-H3=3,0 Hz
8,11 Singulet large 1 - NH
10,51 Singulet 1 - CH(7)
RMN 13C (CDC13)
Déplacements chimiques Nombre de Attribution
b 0,1 ppm carbones
13,9 1 CH3 (12)
22,3 1 CH2 (11)
24,3 1 CH3 (16)
27,3 1 CH2 (10)
32,4 1 CH2 (9)
52,5 1 CH3 (14)
77,4 1 CH(7)
114,1 - 119,2 - 128,4 3 CH(3,5,6)
125,4 1 C quaternaire (2)
132,7 1 C quaternaire (4)
156,8 1 C quaternaire (1)
168,9 - 171,6 2 C=O (13,15)
189,5 1 CH(7) - aldéhyde-
WO 2011/121245 PCT/FR2011/050726
18
C. Acide 2-(2-formel-4-N-acétamido-phénoxy)-hexanoïciue
(composé VII: R,= n-C4H9 ; R3= CH3)
Dans un ballon, on introduit 3,5 g de 2-(2-formyl-4-N-acétamido-phénoxy)-
hexanoate
de méthyle (composé VI) (0,0114 mole ; 1 équivalent) puis environ 15 ml de
méthyl tert-
butyl éther (environ 3 volumes). On agite à température ambiante de manière à
former
une suspension de cet ester. On ajoute ensuite une solution d'hydroxyde de
sodium (0,57
g/5 ml d'eau)et on agite durant 1 H. On ajoute alors 5 ml d'eau et on continue
l'agitation
jusqu'à obtention d'une solution totale du composé ester. On récupère ainsi
deux phases,
l'une de méthyl tert-butyl éther, l'autre aqueuse contenant un acide
carboxylique. On
décante ces deux phases puis, à la phase aqueuse (pH = 14), on ajoute 5 ml
d'acide
chlorhydrique 36%/5 ml d'eau. On amène la phase aqueuse à pH = 1, ce qui
provoque
l'apparition d'un précipité jaune, puis on agite durant 30 min à température
ambiante. On
filtre le précipité sur verre fritté, ce qui fournit une masse de 3,1 g de
99,7 % de pureté
organique et de couleur jaune orangé. On reprend cette masse dans 20 ml
d'acétone, on
porte au reflux puis on filtre à chaud. On récupère ainsi 1,7 g de composé
blanc humide
que l'on sèche pour donner 1,5 g de composé désiré sous forme de cristaux
blancs d'une
pureté organique de 99,7 %.
RMN 'H (DMSO-d6)
~ 1a
W3
12
0 OH
WO 2011/121245 PCT/FR2011/050726
19
Déplacements Multipli-cité Intégra- Constantes de Attri-bution
chimiques tion couplage (IJI
b 0,01 ppm 0,5 Hz)
0,89 Triplet 3 3JCH3-CH2=7,0 CH3 (11)
1,35 Sextuplet 2 3JCH2-CH3=7,0 CH2 (10)
3JCH2-CH2=7,0
1,48 Quintuplet 2 3JCH2-CH2=7,0 CH2 (9)
1,94 Triplet de 2 3JCH2-CH2=7,0 CH2 (8)
doublets 3JCH2-CH=6,0
larges
2,02 Singulet 3 - CH3 (13)
4,90 Triplet 1 3JH7-H8=6,0 CH(7)
7,07 Doublet 1 3JH6-H5=9,0 CH(6)
7,76 Doublet de 1 3JH5-H5=9,0 CH(5)
doublets 4JH5-H3=2,5
7,93 Doublet 1 4JH3-H5=2,5 CH(3)
9,98 Singulet 1 NH
10,43 Singulet 1 - CH
(aldéhyde)
13,12 Singulet large 1 - COOH
RMN 13C (DMSO-d6)
Déplacements chimiques Nombre de Attribution
b 0,1 ppm carbones
13,7 1 CH3 (11)
21,7 1 CH2 (10)
23,7 1 CH3 (13)
26,7 1 CH2 (9)
31,5 1 CH2 (8)
76,4 1 CH(7)
114,9 - 117,3 - 126,9 3 CH aromatiques (3, 5, 6)
124,6 1 C quaternaire aromatique (2)
WO 2011/121245 PCT/FR2011/050726
133,2 1 C quaternaire aromatique (4)
156,0 1 C quaternaire aromatique (1)
168,1 - 172,0 2 C=O (12,14)
189,0 1 CH (aldéhyde)
D. 2-n-Butyl-5-N-acétamido-benzofurane (composé VIII: R,= n-C4H9 ; R3= CH3)
5
Dans un ballon, on charge 1 g de chlorure de benzènesulfonyle et 1 ml de
toluène. On
agite, on introduit 1,3 g de triéthylamine (3,6 équivalents) et on agite à
nouveau à 80 C
pendant 20 min ce qui noircit de plus en plus le milieu réactionnel. On
introduit ensuite
une solution de 1 g d'acide 2-(2-formyl-4-N-acétamido-phénoxy)-hexanoïque
(composé
10 VII) (0,00355 mole ; 1 équivalent) dans 3 ml de toluène et 2 ml de méthyl
tert-butyl éther.
On chauffe à 80 C pendant 2H tout en contrôlant la cinétique de la réaction
par
chromatographie en phase gazeuse. On ramène le mélange réactionnel à environ
50 C et
on hydrolyse par ajout de 4 ml d'eau. On décante et soutire la phase
toluénique et la
phase aqueuse. A cette phase organique, on ajoute 2 ml d'eau et 0,2 d'acide
15 chlorhydrique à 36 %. On agite durant 5 min, décante et soutire les deux
phases. On lave
la phase toluénique avec 2 ml d'eau, décante et soutire les deux phases. On
lave la
phase organique avec une solution de 0,9 g d'hydroxyde de sodium à 23 % dans
1,5 ml
d'eau. On agite, décante et lave la phase toluénique avec une solution de 2 g
de chlorure
de sodium à 10 %. On décante, soutire les deux phases et concentre la phase
toluénique
20 à l'évaporateur rotatif pour récupérer 1,1 g de composé désiré sous forme
d'une huile
brune.
RMN'H (CDC13)
WO 2011/121245 PCT/FR2011/050726
21
0
3
14 4
- NH
H3C
13
~ 9 11
Déplacements Multipli-cité Intégra- Constantes de Attri-
chimiques tion couplage (IJI 0,5 bution
b 0,01 ppm Hz)
0,94 Triplet 3 3JCH3-CH2=7,5 Hz CH3 (12)
1,40 Sextuplet 2 3JCH2-CH3=3JCH2-CH2= CH2 (11)
7,5 Hz
1,70 Quintuplet 2 3JCH2-CH2=7,5 Hz CH2 (10)
2,14 Singulet 3 CH3 (13)
2,73 Triplet 2 3JCH2-CH2=7,5 Hz CH2 (9)
6,29 Singulet 1 H(2)
7,12 Doublet de 1 3JH5-H6=8,5 Hz H(5)
doublets 4JH5-H3=2,0 Hz
7,28 Doublet 1 3JH6-H5=8,5 Hz H(6)
7,64 Singulet large 1 NH
7,72 Doublet 1 4JH3-H5=2,0 Hz H(3)
RMN 13C (CDC13)
Déplacements chimiques Nombre de Attribution
b 0,1 ppm carbones
13,8 1 CH3 (12)
22,3 1 CH2 (11)
WO 2011/121245 PCT/FR2011/050726
22
24,4 1 CH3 (13)
28,2 1 CH2 (10)
29,8 1 CH2 (9)
102,1 1 CH(2)
110,6 - 112,5 -116,5 3 CH(3), CH(5), CH(6)
129,5 - 132,8 - 151,8 - 5 Carbones quaternaires
160,8 - 168,6 aromatiques (1,4,7,8) et
C=O (14)
E. 2-n-butyl-3-(4-méthoxy-benzoyl)-5-N-acétamido-benzofurane (composé X: R,= n-
C4H9 ;
R3= CH3 ; R5=CH3)
Dans un réacteur de 250 ml, on charge 10 g de 2-n-butyl-5-N-acétamido-
benzofurane
(composé VIII) (0,04 mole ; 1 équivalent) puis une solution de 29,4 g de
chlorure de 4-
méthoxy-benzoyle (composé IX) (0,054 mole ; 1,25 g équivalent) dans du
dichloréthane.
On agite l'ensemble à 40 C jusqu'à dissolution totale puis on ajoute par
petites portions
8,8 g de chlorure ferrique (0,054 mole ; 1,25 équivalent). On maintient la
température à
40 C pendant 1 H tout en contrôlant l'évolution de la réaction. On hydrolyse
le milieu
réactionnel par ajout de 100 ml d'eau et on chauffe à 50 C. On décante ensuite
les deux
phases et on récupère la phase organique que l'on concentre, sous vide, à
l'évaporateur
rotatif. On obtient ainsi 21 g d'une huile orangée qui forme des cristaux. On
reprend cette
huile dans 40 ml d'acétate d'éthyle (2 volumes) et on amène au reflux dans un
ballon, ce
qui provoque la solubilisation des cristaux. Sous agitation, on laisse le
milieu réactionnel
revenir à la température ambiante, ce qui provoque l'apparition d'un précipité
que l'on
maintient au contact d'un bain glacé (5 C) pendant 10 min. On filtre le milieu
réactionnel
et on récupère des cristaux jaune pâle. On sèche à l'étuve sous vide et à 50 C
ce qui
fournit 10,1 g de cristaux. On reprend ces cristaux dans l'acétate d'éthyle (4
volumes) puis
on porte l'ensemble au reflux jusqu'à dissolution. On laisse revenir le milieu
réactionnel à
température ambiante puis on filtre, sur verre fritté, les cristaux formés. On
rince avec 10
ml d'acétate d'éthyle et on sèche à l'étuve à 50 C et sous vide les cristaux
obtenus ce qui
fournit 8,2 g de composé désiré sous forme d'un premier jet de cristaux
(pureté
organique : 99,7 %) et 1,3 g du même composé sous forme d'un deuxième jet de
cristaux
(pureté organique : 99,1%).
RMN' H (CDC13)
WO 2011/121245 PCT/FR2011/050726
23
0 17 i8 CFA
H,3c 10 17' 18`
13 5 7 0 ] 12
s ~ tt
Déplacements Multipli-cité Intégra- Constantes de Attri-bution
chimiques tion couplage (IJI 0,5
b 0,01 ppm Hz)
0,86 Triplet 3 3JCH3-CH2=7,5 Hz CH3 (12)
1,32 Sextuplet 2 3JCH2-CH3=3JCH2-CH2= CH2 (11)
7,5 Hz
1,71 Quintuplet 2 3JCH2-CH2=7,5 Hz CH2 (10)
2,08 Singulet 3 CH3 (13)
2,84 Triplet 2 3JCH2-CH2=7,5 Hz CH2 (9)
3,86 Singulet 3 CH3 (20)
6,93 Doublet 2 3JH18-H17=9,0 Hz H(18,18')
(système AB) 3JH18'-H17'=9,0 Hz
7,32 Doublet 1 4JH3-H5=2,0 Hz H(3)
7,36 Doublet 1 3JH6-H5=9,0 Hz H(6)
7,54 Doublet de 1 3JH5-H6=9,0 Hz H(5)
doublets 4JH5-H3=2,0 Hz
7,57 Singulet large 1 NH
7,80 Doublet 2 3JH17-H18=9,0 Hz H(17,17')
(système AB) 3JH17'-H18'=9,0 Hz
RMN 13C (CDC13)
WO 2011/121245 PCT/FR2011/050726
24
Déplacements Nombre de Attribution
chimiques carbones
b 0,1 ppm
13,7 1 CH3 (12)
22,4 1 CH2 (11)
24,3 1 CH3 (13)
28,0 1 CH2 (10)
30,1 1 CH2 (9)
55,5 1 CH3 (20)
111,0 - 113,0 - 118,2 3 CH(3), CH(5), CH(6)
113,8 2 CH (18,18')
131,7 2 CH (17,17')
116,9 - 127,5 - 131,7 - 8 Carbones quaternaires
133,8 - 150,7 - 163,6 - aromatiques
165,4 - 168,5 (1,2,4,7,8,16,19) et
C=O(14)
190,4 1 C=O(15)
F. 2-n-Butyl-3-(4-hydroxy-benzoyl)-5-N-acétamido-benzofurane (composé XI: R,=
n-C4H9
R3= CH3)
Dans un réacteur de 250 ml, on charge 5 g de 2-n-butyl-3-(4-méthoxy-benzoyl)-5-
N-
acétamido-benzofurane (composé X) (0,0137 mole ; 1 équivalent) et 15 ml de
chlorobenzène (3 volumes). On agite à 60 C jusqu'à dissolution partielle du
dérivé
méthoxy puis on ajoute, en une fois, 5,5 g de chlorure d'aluminium (0,0411
mole ; 3
équivalents) ce qui provoque un changement du milieu réactionnel. On dissout
le dérivé
méthoxy et on maintient une température de 60 C durant 4 heures. On hydrolyse
ensuite
par ajout de 15 ml d'eau (3 volumes) tout en agitant à environ 45 C +/- 5 C.
On extrait
alors le milieu réactionnel avec du n-butanol et à une température d'environ
45 C. On
décante à chaud et on soutire les deux phases. On récupère ainsi une phase de
butanol
dans laquelle on observe un précipité qui apparaît lorsque la température
s'abaisse. On
filtre la phase organique et on récupère ainsi 2 g d'un produit blanc. On
concentre le filtrat
sous vide à l'évaporateur rotatif puis on reprend dans l'acétate d'éthyle (2
volumes) les 4
g d'huile ainsi obtenue ainsi que le précipité. On chauffe alors au reflux
pour dissoudre les
WO 2011/121245 PCT/FR2011/050726
particules tout en laissant revenir le milieu à température ambiante. On
filtre les cristaux
obtenus et on récupère ainsi 1,3 g de produit légèrement jaune (pureté
organique : 97,9
%). On effectue une nouvelle recristallisation dans l'acétate d'éthyle à
partir du filtrat
obtenu ce qui permet de récupérer 0,8 g de composé désiré d'une pureté
organique de
5 96,6%.
RMN 1H (DMSO-d6)
iï 18
3 2 15 16 19 H
14 NH
Hic I 1Ã 17' i
13 5 7 0 1 12
6 9 it
Déplacements Multipli-cité Intégra- Constantes de Attri-bution
chimiques tion couplage (IJI 0,5
b 0,01 ppm Hz)
0,77 Triplet 3 3JCH3-CH2=7,5 Hz CH3 (12)
1,21 Sextuplet 2 3JCH2-CH3=3JCH2-CH2= CH2 (11)
7,5 Hz
1,61 Quintuplet 2 3JCH2-CH2=7,5 Hz CH2 (10)
1,98 Singulet 3 CH3 (13)
2,75 Triplet 2 3JCH2-CH2=7,5 Hz CH2 (9)
6,87 Doublet 2 3JH18-H17=8,5 Hz H(18,18')
3JH18'-H17'=8,5 Hz
7,51 Multiplet 2 - H(3), H(5),
7,64 Doublet 1 H(6)
7,66 Doublet 2 3JH17-H18=8,5 Hz H(17,17')
3JH17'-H18'=8,5 Hz
9,90 Singulet large 1 - NH ou OH
WO 2011/121245 PCT/FR2011/050726
26
10,43 Singulet très 1 NH ou OH
large
RMN 13C (DMSO-d6)
Déplacements Nombre de Attribution
chimiques carbones
b 0,1 ppm
13,3 1 CH3 (12)
21,5 1 CH2 (11)
23,8 1 CH3 (13)
27,0 1 CH2 (10)
29,4 1 CH2 (9)
110,7 - 116,5 3 CH(3), CH(5), CH(6)
115,3 2 CH (18,18')
131,5 2 CH (17,17')
116,5 - 126,7 - 129,4 - 8 Carbones quaternaires
135,4 - 149,1 - 162,2 - aromatiques
163,4 - 167,9 (1,2,4,7,8,16,19) et C=O(14)
189,1 1 C=O(15)
G. 2-n-Butyl-3-{4-[3-(di-n-butylamino)-propoxyl-benzoyl}-5-N-acétamido-
benzofurane
(composé Il: R1= n-C4H9 ; R2= 3-(di-n-butylamino)-propyle ; R3= CH3)
Dans un ballon tricol, on charge 4 g de 2-n-butyl-3-(4-hydroxy-benzoyl)-5-N-
acétamido-
benzofurane (composé XI) (0,0114 mole ; 1 équivalent), 2,1 g de carbonate de
potassium
(1,3 équivalent) et 15 ml de méthyl éthyl cétone. On agite le milieu
réactionnel, on ajoute,
à la température de 80 C, 2,8 g de 1-choro-3-(di-n-butylamino)-propane
(composé XII)
(0,0137 mole ; 1,2 équivalent) et on chauffe l'ensemble à la température de
reflux de la
méthyl éthyl cétone durant au moins 8 heures. On reprend le dépôt blanc formé
autour du
ballon puis on agite à nouveau en additionnant 0,1 équivalent de chloramine
supplémentaire. On poursuit le chauffage durant environ 5 heures puis on
concentre le
milieu réactionnel sous vide à l'évaporateur rotatif. On reprend l'huile ainsi
obtenue dans
WO 2011/121245 PCT/FR2011/050726
27
15 ml d'eau et 15 ml de méthyl tert-butyl éther, on décante et on soutire les
deux phases.
On lave la phase organique avec 0,5 équivalent d'acide acétique dans 15 ml
d'eau. On
agite, décante et lave la phase organique avec 15 ml d'eau. On concentre cette
phase
organique et on récupère ainsi 5,2 g de composé désiré sous forme d'une huile
blanchâtre.
RMN 'H (CDC13)
O O h i j k
11 12
il 3 2 1 8 II 0 3 e f 9 CH2-CH2-CH2-CH3
H3C-C-NH C O CH2 CH2 CH2 N
9 - CH2-CH2-CH2-CH3
4 \ 6 O
5 CH2-CH2-CH2-CH3
d C b a
Déplacements Multiplicité Intégration Attribution
chimiques
b 0,01 ppm
0,87 Triplet 3 CH3 (a)
0,89 Triplet 6 2xCH3 (k)
1,31 Sextuplet 6 CH2 (b)
2x CH2(j)
1,48 Multiplet 4 2x CH2 (i)
1,72 Quintuplet 2 CH2 (c)
2,00 Multiplet 2 CH2 (f)
2,09 Singulet 3 CH3-C=O
2,54 Triplet 4 2x CH2 (h)
2,72 Triplet 2 CH2 (g)
2,85 Triplet 2 CH2 (d)
4,07 Triplet 2 CH2 (e)
6,91 Doublet 2 2x CH(12)
7,26 Doublet 1 CH(2)
7,37 Doublet 1 CH(5)
7,61 Doublet dédoublé 1 CH(4)
WO 2011/121245 PCT/FR2011/050726
28
EXEMPLE
Chlorhydrate du 2-n-butyl-3-f 4-[3-(di-n-butylamino)-propoxyl-benzoyl}-5-amino-
benzofurane (composé I: R,= n-C4H9 ; R2= 3-(di-n-butylamino)-propyle)
Dans un réacteur, on introduit 1 équivalent de 2-n-butyl-3-{4-[3-(di-n-
butylamino)-
propoxy]-benzoyl}-5-N-acétamido-benzofurane (composé II) et 4 volumes
d'éthanol. On
ajoute alors 6 équivalents d'acide chlorhydrique à 36 % et on chauffe le
milieu réactionnel
au reflux, ce qui forme le chlorhydrate désiré. On effectue ensuite, à
température
ambiante, un lavage du milieu réactionnel avec une solution aqueuse de
carbonate de
sodium de manière à libérer ce chlorhydrate qui passe dans la phase aqueuse où
il est
extrait.
De cette manière, on obtient le composé désiré avec une pureté organique de 93
0/0
Taux de conversion du composé II: 100 %
La conversion du chlorhydrate du 2-n-butyl-3-{4-[3-(di-n-butylamino)-propoxy]-
benzoyl}-5-amino-benzofurane en chlorhydrate de dronédarone est ensuite
réalisée
comme décrit dans le brevet EP 0471609.