Note: Descriptions are shown in the official language in which they were submitted.
CA 02862287 2014-07-22
1
wo 2013/121157 PCT/FR2013/050315
IMMUNOGLOBULINE CHIMÉRIQUE MONOCLONALE ANTI-HLA,
PROCÉDÉ ET KIT METTANT EN UVRE UNE TELLE
IMMUNOGLOBULINE CHIMÉRIQUE MONOCLONALE
L'invention concerne un procédé de détermination de la
quantité d'anticorps anti-HLA d'un milieu liquide contenant des anticorps.
L'invention concerne aussi une immunoglobuline chimérique monoclonale anti-
HLA de classe I ou anti-HLA de classe II pour la mise en oeuvre d'un tel
procédé.
L'invention concerne en particulier une telle immunoglobuline chimérique
monoclonale adaptée pour pouvoir notamment être utilisée à titre de réactif de
standardisation pour le dépistage et la quantification des anticorps anti-HLA
d'un
milieu liquide -notamment d'un milieu liquide biologique-. L'invention
concerne en
particulier une telle immunoglobuline chimérique monoclonale présentant d'une
part la fonction d'un anticorps monoclonal et d'autre part une structure
chimérique.
L'invention vise aussi un procédé standardisé de dépistage des anticorps anti-
HLA
d'un milieu liquide et un procédé de quantification des anticorps anti-HLA
d'un
milieu liquide dans lesquels on utilise une telle immunoglobuline chimérique
monoclonale. En particulier, l'invention concerne un tel procédé de
quantification
des anticorps anti-HLA du sérum d'un patient -notamment d'un patient greffé ou
en
attente d'une greffe-.
L'invention concerne en outre un kit de diagnostic pour la
mise en oeuvre d'un tel procédé. En particulier, l'invention concerne un tel
procédé
et un tel kit de diagnostic adaptés pour permettre une quantification des
anticorps
anti-HLA d'un milieu liquide -notamment d'un fluide biologique prélevé sur un
patient- qui soit précise, fiable et rapide.
Dans le domaine de la transplantation d'organes, il est connu
depuis les années 1930 que la compatibilité entre le groupe tissulaire du
donneur, tel
que défini par les antigènes HLA (Human Leucocytes Antigen), et le système
immunitaire -notamment les anticorps- du receveur est essentielle pour la
réussite
de la greffe d'organe.
CA 02862287 2014-07-22
2
WO 2013/121157 PCT/FR2013/050315
Les antigènes HLA sont portés par deux types de protéines
membranaires qui sont très immunogènes : les molécules HLA de classe I et les
molécules HLA de classe II. Ainsi, l'exposition d'un individu à des allo-
antigènes
HLA, c'est-à-dire des antigènes étrangers et distincts des siens, peut
entraîner le
développement d'une réponse immunitaire contre ces antigènes. Cette réponse
immunitaire peut être à médiation cellulaire (lymphocytes T allo-réactifs) ou
humorale (synthèse d'anticorps anti-HLA).
Les antigènes HLA de classe I sont codés par trois gènes
HLA-A, HLA-B et HLA-C dont le polymorphisme est responsable des trois séries
d'allèles respectivement HLA-A, HLA-B et HLA-C. Les antigènes HLA de classe
H sont codés par les gènes HLA-DP, HLA-DQ et HLA-DR.
En transplantation d'organes, il est crucial de minimiser
-voire de supprimer- les risques de proposer à un patient en attente d'un
greffon un
greffon exprimant des antigènes HLA contre lequel ce patient est d'ores et
déjà
immunisé. En effet, dans cette situation le risque qu'intervienne un rejet
humoral
hyper-aigu -c'est-à-dire dans un délai inférieur à 24 heures suivant la greffe-
est
majeur. En outre, dans le cadre du suivi de greffe, le dépistage précoce de
l'apparition d'anticorps dirigés contre les antigènes du greffon chez le
patient
receveur du greffon permet de traiter ledit patient receveur du greffon le
plus
précocement possible afin de tenter d'enrayer le développement de la réponse
humorale susceptible d'entrainer la destruction du greffon.
Le suivi de l'allo-immunisation aussi bien des patients greffés
que des patients en attente d'une greffe est donc primordial pour assurer la
survie
des greffons et des patients greffés.
Dans ce contexte, il est indispensable de pouvoir rechercher,
identifier et quantifier les anticorps anti-HLA chez les patients en attente
de greffe
et chez les patients greffés. De nombreuses techniques de recherche de ces
anticorps
anti-HLA ont déjà été mises au point.
On connaît en particulier la technique dite de micro-
lymphocytotoxicité dépendante du complément . Cette technique consiste à
présenter le sérum d'un patient -notamment un receveur de greffe- à une série
de
CA 02862287 2014-07-22
3
WO 2013/121157 PCT/FR2013/050315
cellules dont le typage HLA est connu en présence de complément de lapin. Si
des
anticorps (Ac) spécifiques des antigènes HLA portés par ces cellules sont
présents
dans le sérum testé, et que ces anticorps sont capables d'activer le
complément
(anticorps de classe IgM et de sous-classe IgG-1 et IgG-3), la lyse cellulaire
complément dépendante (CDC, Complement Dependent Cytotoxycity) révèle la
présence des anticorps. Grâce à un panel de cellules exprimant différents
antigènes
HLA il est ainsi possible de dépister les anticorps, puis d'identifier leur(s)
spécificité(s). Cette technique de référence permet de détecter les anticorps
anti-
HLA cytolytiques qui sont les plus dangereux pour le greffon. Cependant, cette
technique présente une sensibilité faible au regard des techniques plus
récentes.
Cette technique qui nécessite soit de disposer d'une grande variété de
lymphocytes
provenant de donneurs dont le phénotype HLA est connu, soit de cultiver in
vitro un
grand nombre de lignées cellulaires typées HLA est donc complexe et lourde
dans
sa mise en oeuvre.
On connaît aussi des techniques plus sensibles, comme le
dosage immunoenzymatique sur support solide ( ELISA , pour Enzyme-Linked
ImmunoSorbent Assay . En outre, récemment, est apparue la technique
d'immunofluorimétrie couplée à une détection en flux conçue sur le principe du
cytomètre en flux. Le principe de l'immunofluorimétrie en flux consiste en la
fixation d'antigènes purifiés HLA de classe I ou HLA de classe II à la surface
de
billes de polystyrène. Les anticorps anti-HLA qui reconnaissent les antigènes
HLA
de classe I ou HLA de classe II, se lient aux antigènes liés à la surface des
billes et
sont révélés par des anticorps secondaires anti-IgG couplés à un groupement
fluorescent après lavage des billes de polystyrène. Les anticorps secondaires
sont
détectés par fluorimétrie en flux. Leur intensité de fluorescence est en outre
quantifiée.
Pour des tests de dépistage, on utilise en mélange une pluralité
de types de billes, chaque type de billes portant en surface une pluralité
d'antigènes
HLA, soit de classe I, soit de classe II. Une telle approche permet de
détecter la
présence d'anticorps anti-HLA sans toutefois permettre l'identification de
leur(s)
spécificité(s).
CA 02862287 2014-07-22
4
WO 2013/121157 PCT/FR2013/050315
En revanche, pour l'identification et la caractérisation de la
spécificité de l'anticorps, on utilise en mélange une pluralité de types de
billes,
chaque type de billes portant en surface un antigène HLA unique.
Des kits pour la détection et l'identification d'anticorps anti-
HLA sont connus. Ils comprennent des billes de polystyrène revêtues
d'antigènes
HLA de classe I ou d'antigènes HLA de classe II et des billes de polystyrène
revêtues d'IgG humaines. Sont également commercialisés, un anticorps
secondaire
anti-IgG humaine couplée à la phycoérythrine et un sérum dépourvu d'anticorps
anti-HLA à titre de contrôle négatif. Un tel contrôle négatif est adapté pour
quantifier la fixation non spécifique de l'anticorps secondaire sur les billes
de
polystyrène. De tels kits ne comprennent aucun contrôle positif, ni aucun
contrôle
de la sensibilité, ni aucun standard permettant de déduire précisément la
concentration des anticorps anti-HLA (exprimée, par exemple, en mole/L ou en
g/L)
dans le milieu analysé à partir de l'intensité de fluorescence mesurée.
En outre de tels kits dépourvus de témoin de calibration et/ou
de sensibilité ne permettent pas de déterminer le seuil de sensibilité de la
méthode
d'analyse, c'est-à-dire la valeur minimale du signal permettant d'affirmer que
le
signal observé est significativement supérieur au bruit de fond de la mesure.
Pour pallier à ce défaut de contrôle positif dans les méthodes
de dépistage et/ou de quantification des anticorps anti-HLA, les laboratoires
d'immunologie et d'histocompatibilité utilisent, à titre de contrôle positif,
un
mélange de plusieurs sérums de plusieurs individus immunisés contre plusieurs
antigènes HLA.
Dans un tel contrôle positif, la concentration respective de
chacun des anticorps des sérums des individus immunisés est inconnue. Un tel
mélange de sérum ne permet pas de corréler l'intensité de la mesure de
fluorescence
avec une concentration (mol/L ou g/L) d'un anticorps spécifique du mélange de
sérums. Il ne permet donc pas de quantifier les anticorps présents dans le
sérum du
patient greffé ou en attente d'une greffe. Il ne permet donc pas non plus
d'évaluer
les risques réels de la survenue d'une réponse humorale hyper-aigue.
CA 02862287 2014-07-22
WO 2013/121157 PCT/FR2013/050315
La réactivité d'un tel mélange de sérums est variable d'un
antigène à l'autre et leur utilisation ne permet pas de fixer le seuil de
détection pour
chaque antigène HLA étudié. De plus, un tel mélange d'anticorps polyclonaux
issu
de sérums de patient est disponible en quantité limitée et est rapidement
épuisé. Il
5 doit
donc être remplacé par un autre mélange lui aussi disponible en quantité
variable qui ne permet pas des échanges dudit mélange entre les laboratoires
en vue
d'une standardisation des résultats. La variabilité des mélanges de sérums
d'un lot à
l'autre nécessite une validation fréquente de ces lots qui ne sont ni
comparables ni
reproductibles d'un lot à l'autre.
En utilisant un tel mélange de sérums, les inventeurs ont
montré (figures 2, 3 et 4) que la valeur de l'intensité de la fluorescence
associée à
chacun des types de billes de polystyrène dépend de la nature de l'antigène
HLA de
classe I ou de classe II porté par chacun des types de billes de polystyrène.
En outre,
cette valeur d'intensité de fluorescence associée à chacun des types de billes
de
polystyrène montre une variabilité importante dans le temps -notamment sur une
période de l'ordre de cinq mois-. Cette valeur varie (figure 4, histogrammes
hachurés) entre 1000 et 20000 unités de fluorescence moyenne.
Il en résulte que la valeur moyenne de l'intensité de
fluorescence mesurée sur l'ensemble des billes de polystyrène présente une
dispersion (calculée par son écart-type) importante qui ne permet pas de
quantifier
les anticorps anti-HLA du milieu liquide. Une telle dispersion est présentée
en
figure 4 (histogrammes hachurés) de la présente demande de brevet donnée à
titre
d'illustration d'un standard de l'art antérieur.
Une telle dispersion des mesures d'intensité de fluorescence
ne permet pas -en particulier pour les valeurs faibles d'intensité de
fluorescence- de
distinguer une valeur faible d'intensité de fluorescence mais traduisant la
présence
d'une faible concentration d'anticorps anti-HLA, d'une valeur faible
d'intensité de
fluorescence qui ne peut être distinguée du bruit de fond de la mesure.
Pour les mêmes raisons exposées précédemment, une telle
préparation utilisée à titre de contrôle positif dans l'état de la technique
ne permet
pas de déterminer précisément la concentration d'anticorps présent dans le
milieu
CA 02862287 2014-07-22
6
WO 2013/121157 PCT/FR2013/050315
liquide, notamment dans un sérum prélevé sur un patient greffé ou en attente
d'une
greffe.
L'invention vise à résoudre ces inconvénients en proposant
une immunoglobuline chimérique monoclonale comme réactif de standardisation et
de contrôle positif et de sensibilité dans l'analyse sérologique des anticorps
anti-
HLA de classe I ou des anticorps anti-HLA de classe II -notamment dans le
contexte de la transplantation d'organes-.
L'invention vise à pallier les inconvénients précédemment
évoqués en proposant une immunoglobuline chimérique monoclonale adaptée pour
permettre une quantification fiable d'anticorps anti-HLA dans le sérum d'un
patient.
Une telle immunoglobuline chimérique monoclonale est en particulier adaptée
pour
permettre la détection de la survenue chez un patient d'anticorps dirigés
contre les
antigènes du greffon, même pour une très faible concentration de cet
anticorps.
L'invention vise à proposer une immunoglobuline chimérique
monoclonale adaptée pour la standardisation des méthodes de détection
d'anticorps
anti-HLA. En permettant en particulier de définir précisément le seuil de
détection,
l'immunoglobuline chimérique monoclonale selon l'invention permet au
biologiste
de valider la méthode de recherche d'anticorps.
L'invention vise à proposer une immunoglobuline chimérique
monoclonale adaptée pour permettre une détection la plus précoce possible de
la
survenue d'anticorps anti-HLA dirigés contre les antigènes HLA du greffon. Une
telle détection précoce permet en particulier de déceler la plus rapidement
possible
le rejet humoral et donc de prescrire rapidement le traitement curatif du
rejet de
l'organe transplanté.
L'invention vise à proposer une telle immunoglobuline
chimérique monoclonale permettant de standardiser et de calibrer les méthodes
de
recherche d'anticorps anti-HLA dans un liquide biologique.
L'invention vise aussi à proposer une telle immunoglobuline
chimérique monoclonale susceptible de permettre l'accréditation d'une méthode
standardisée de dépistage, de quantification et de caractérisation d'anticorps
anti-
HLA selon les nouvelles normes réglementaires d'accréditation des laboratoires
CA 02862287 2014-07-22
7
WO 2013/121157 PCT/FR2013/050315
d'analyse médicale. En France, les laboratoires d'analyse -notamment
d'immunologie- médicale doivent satisfaire à la norme 15189 du COFRAC (Comité
Français d'Accréditation).
L'invention vise aussi à proposer une composition d'au moins
une immunoglobuline chimérique monoclonale comme réactif de calibration
quantitative dans les tests de dépistage des anticorps anti-HLA, notamment par
immunofluorimétrie.
L'invention vise en particulier à proposer une telle
composition d'au moins une immunoglobuline chimérique monoclonale comme
standard de quantification dans les tests de dépistage des anticorps anti-HLA
par la
technologie Luminex .
L'invention vise aussi à proposer une telle composition d'au
moins une immunoglobuline chimérique comme étalon quantitatif dans les tests
de
dépistage des anticorps anti-HLA par cytométrie en flux, par la technique
ELISA ou
la micro-lymphocytotoxicité dépendante du complément.
L'invention vise donc à proposer une telle immunoglobuline
chimérique monoclonale et une telle composition d'au moins une immunoglobuline
chimérique monoclonale à utiliser comme étalon quantitatif en lieu et place
d'un
mélange complexe d'anticorps issu du mélange d'un ou de plusieurs sérums de
patients.
L'invention vise aussi à proposer une telle immunoglobuline
chimérique monoclonale qui soit disponible en grande quantité et dont la
production
est parfaitement standardisée en termes de concentration d'anticorps anti-HLA
et en
termes de composition.
L'invention vise en outre à proposer une solution aqueuse
stable d'une telle immunoglobuline chimérique monoclonale dont la
concentration
en immunoglobuline chimérique monoclonale est parfaitement connue pour la
standardisation d'une méthode de dépistage et/ou de quantification et/ou de
caractérisation d'anticorps anti-HLA d'un milieu liquide.
CA 02862287 2014-07-22
8
WO 2013/121157 PCT/FR2013/050315
Pour ce faire, l'invention concerne un procédé de
détermination de la quantité d'anticorps anti-HLA d'un milieu liquide
contenant des
anticorps, dans lequel :
- on réalise une pluralité de solutions (Sn) -notamment de
solutions aqueuses- d'une immunoglobuline chimérique monoclonale, chaque
solution (Sn) présentant une valeur (Ce) de concentration déterminée de ladite
immunoglobuline chimérique monoclonale, puis ;
- on place chaque solution (Sn) en contact avec une même
quantité déterminée d'au moins un antigène HLA immobilisé, et ;
- on construit une courbe d'étalonnage dans laquelle on
associe chaque valeur (Ce) de concentration déterminée à une valeur (Va)
mesurée
d'un paramètre, ladite valeur (Va) mesurée étant représentative d'une quantité
(Qn)
de l'immunoglobuline chimérique monoclonale liée à la quantité déterminée de
chaque antigène HLA immobilisé ;
- on forme, à partir des paires (Ce, Vn) de concentration (Ce)
déterminée et de valeur (Va) mesurée, la courbe d'étalonnage et de variation
de la
valeur (Va) mesurée en fonction de la concentration (Ce) déterminée en
immunoglobuline chimérique monoclonale de chaque solution (S.)
d'immunoglobuline chimérique monoclonale, et;
- on calcule une valeur, dite valeur seuil, du paramètre au-
delà de laquelle la concentration en immunoglobuline chimérique monoclonale
est
significativement supérieure à 0 ;
procédé dans lequel l'immunoglobuline chimérique monoclonale est formée de :
- deux chaînes polypeptidiques, dites chaînes (H) lourdes,
de poids moléculaire compris entre 40 kDa et 60 kDa, et de;
- deux chaînes polypeptidiques, dites chaînes (L) légères,
de poids moléculaire compris entre 20 kDa et 30 kDa ;
caractérisé en ce que :
- chaque chaîne (H) lourde comprend :
o une région (VH) variable d'une chaîne lourde d'un anticorps
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
CA 02862287 2014-07-22
9
WO 2013/121157 PCT/FR2013/050315
épitopes mono-morphiques des antigènes HLA de classe I et des anticorps
monoclonaux spécifiques des épitopes mono-morphiques des antigènes HLA de
classe II, et ;
o une région (CH) constante d'une chaîne lourde d'une
immunoglobuline humaine choisie dans le groupe formé des IgA, des IgG et des
IgM ;
et en ce que :
- chaque chaîne (L) légère comprend :
o une région (VL) variable d'une chaîne légère d'un anticorps
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
épitopes mono-morphiques des antigènes HLA de classe I et des anticorps
monoclonaux spécifiques des épitopes mono-morphiques des antigènes HLA de
classe II, et ;
o une région (CL) constante d'une chaîne légère d'une
immunoglobuline humaine choisie dans le groupe formé des chaînes Kappa et des
chaînes Lambda.
Dans tout le texte, les expressions antigène HLA de
classe I et antigène HLA de classe II (HLA pour Human Leucocyte
Antigen ) désignent des antigènes qui sont humains par nature.
L'invention consiste donc aussi à proposer un procédé de
quantification in vitro d'anticorps anti-HLA dans lequel on réalise une courbe
d'étalonnage à partir d'une solution d'au moins une immunoglobuline chimérique
monoclonale selon l'invention, ladite immunoglobuline chimérique monoclonale
présentant une concentration connue dans ladite solution.
En effet, les inventeurs ont constaté qu'il n'existe pas de
solution connue dans l'état de la technique pour permettre une évaluation
quantitative qui soit fiable et reproductible de la concentration en anticorps
anti-
HLA de classe I et de classe II dans un milieu liquide.
Avantageusement et selon l'invention, le paramètre est choisi
dans le groupe formé des paramètres de fluorescence, des paramètres de
luminescence et des paramètres de colorimétrie.
CA 02862287 2014-07-22
'o
WO 2013/121157 PCT/FR2013/050315
Avantageusement et selon l'invention, la concentration (Cg)
déterminée en immunoglobuline chimérique monoclonale est au plus égale à
104 g/mL, notamment comprise entre 10-1 g/mL et 10-4 g/mL. Toute
concentration
inférieure à 10-4 g/mL peut être obtenue par dilution d'une solution de
concentration
élevée, en particulier de l'ordre de 10-4 g/mL.
Avantageusement, on réalise des dilutions progressives
croissantes de l'immunoglobuline chimérique monoclonale selon l'invention. On
utilise ces solutions (Sn) d'immunoglobuline chimérique monoclonale selon
l'invention de concentrations connues pour associer chaque concentration (Ce)
des
solutions (Sn) d'immunoglobuline chimérique monoclonale avec une valeur (Va)
mesurée d'un paramètre choisi dans le groupe formé d'un paramètre de
fluorescence -notamment d'un paramètre de fluorescence mesuré par immuno-
fluorimétrie quantitative (technique Luminex avec des billes revêtues
d'antigènes
HLA) ou par la technique de cytométrie en flux (réalisée avec des lymphocytes)-
,
d'un paramètre de luminescence -notamment d'un paramètre de
chemiluminescence- et d'un paramètre de colorimétrie.
Avantageusement et selon l'invention, dans un procédé selon
l'invention, on choisit chaque anticorps monoclonal spécifique des épitopes
mono-
morphiques des antigènes HLA de classe I et chaque anticorps monoclonal
spécifique des épitopes mono-morphiques des antigènes HLA de classe II dans le
groupe formé des anticorps monoclonaux d'un vertébré, en particulier des
anticorps
monoclonaux d'un mammifère -notamment de souris, de rat, de lapin, de hamster
et
de l'homme- et des anticorps monoclonaux d'un vertébré non mammifère -
notamment d'un batracien, d'un oiseau, en particulier d'un galliforme-.
Avantageusement et selon l'invention, le paramètre est choisi
dans le groupe formé des paramètres de fluorescence, des paramètres de
luminescence et des paramètres de colorimétrie.
Avantageusement et selon l'invention, le paramètre de
fluorescence est une intensité de fluorescence. Ainsi, chaque valeur (Va) du
paramètre de fluorescence est une intensité de fluorescence.
CA 02862287 2014-07-22
11
wo 2013/121157 PCT/FR2013/050315
Avantageusement et selon l'invention, on mesure chaque
valeur (Va) mesurée du paramètre par une technique choisie dans le groupe
formé
de l'immuno-fluorimétrie quantitative multiplexée, de la cytométrie en flux,
d'une
méthode par dosage immunoenzymatique sur support solide (ELISA), d'une
Avantageusement dans une première variante d'un procédé
selon l'invention :
a) chaque antigène HLA immobilisé étant un antigène HLA immobilisé en
surface de particules d'un support solide à l'état divisé formé de particules
;
b) on met en contact les antigènes HLA immobilisés et chaque solution
d'immunoglobuline chimérique monoclonale dirigée contre les antigènes
HLA du support solide dans des conditions adaptées pour former une liaison
stable entre les antigènes HLA du support solide et l'immunoglobuline
chimérique monoclonale de chaque solution d'immunoglobuline chimérique
monoclonale, puis ;
c) on élimine par lavage les immunoglobulines chimériques monoclonales non
liées aux antigènes HLA du support solide, puis ;
d) on met en contact les immunoglobulines chimériques monoclonales liées aux
antigènes HLA du support solide avec une solution d'un anticorps secondaire
choisi dans le groupe formé des anticorps secondaires fluorescents, des
anticorps secondaires luminescents et des anticorps secondaires photo-
absorbants et dirigé contre l'immunoglobuline chimérique monoclonale,
dans des conditions adaptées pour former une liaison stable entre
l'immunoglobuline chimérique monoclonale et l'anticorps secondaire, puis ;
e) on élimine par lavage l'anticorps secondaire non lié à l'immunoglobuline
chimérique monoclonale, puis ;
f) on mesure au moins un paramètre de l'anticorps secondaire lié à chaque
particule du support solide et on attribue à cette mesure une valeur (Va)
mesurée dudit paramètre choisi dans le groupe formé d'un paramètre de
fluorescence -notamment d'un paramètre de fluorescence mesuré par
CA 02862287 2014-07-22
12
WO 2013/121157 PCT/FR2013/050315
immuno-fluorimétrie quantitative (technique Luminex avec des billes
revêtues d'antigènes HLA) ou par la technique de cytométrie en flux
(réalisée avec des lymphocytes)-, d'un paramètre de luminescence
-notamment d'un paramètre de chemiluminescence- et d'un paramètre de
colorimétrie, puis ;
g) on forme la courbe de calibration, puis ;
h) on déduit de cette courbe de calibration une valeur seuil d'intensité de
fluorescence significative de la présence de l'anticorps anti-HLA dans une
solution à analyser.
Avantageusement, dans une deuxième variante et selon
l'invention, chaque antigène HLA immobilisé est un antigène HLA présenté en
surface d'au moins une cellule -notamment une cellule en culture in vitro-.
Avantageusement, dans cette deuxième variante d'un procédé
selon l'invention :
i) chaque antigène HLA immobilisé étant un antigène HLA présenté en surface
d'au moins une cellule ;
j) on met en contact les antigènes HLA présentés en surface d'au moins une
cellule et chaque solution d'immunoglobuline chimérique monoclonale dans
des conditions adaptées pour former une liaison stable entre les antigènes
HLA de la (des) cellule(s) et l'immunoglobuline chimérique monoclonale de
chaque solution d'immunoglobuline chimérique monoclonale, puis ;
k) on élimine par lavage l'immunoglobuline chimérique monoclonale non liée
aux antigènes HLA de la (des) cellule(s), puis ;
1) on met en contact l'immunoglobuline chimérique monoclonale liée aux
antigènes HLA de la (des) cellule(s) avec une solution d'un anticorps
secondaire dirigé contre l'immunoglobuline chimérique monoclonale, dans
des conditions adaptées pour former une liaison stable entre
l'immunoglobuline chimérique monoclonale et l'anticorps secondaire, puis ;
m) on élimine par lavage l'anticorps secondaire non lié à l'immunoglobuline
chimérique monoclonale, puis ;
CA 02862287 2014-07-22
13
WO 2013/121157 PCT/FR2013/050315
n) on mesure au moins un paramètre de l'anticorps secondaire lié à chaque
cellule et on attribue à cette mesure une valeur (Va) mesurée dudit paramètre
choisi dans le groupe formé d'un paramètre de fluorescence -notamment
d'un paramètre de fluorescence mesuré par immuno-fluorimétrie quantitative
(technique Luminex avec des billes revêtues d'antigènes HLA) ou par la
technique de cytométrie en flux (réalisée avec des lymphocytes)-, d'un
paramètre de luminescence -notamment d'un paramètre de
chemiluminescence- et d'un paramètre de colorimétrie, puis ;
o) on forme la courbe de calibration, puis ;
p) on déduit de cette courbe de calibration une valeur seuil d'intensité de
fluorescence significative de la présence de l'anticorps anti-HLA dans une
solution à analyser.
Avantageusement et selon l'invention, le support solide à
l'état divisé est sous forme de particules de forme sensiblement sphériques et
de
dimension adaptée pour permettre leur analyse par fluorimétrie en flux.
Avantageusement et selon l'invention, on détermine la courbe
de calibration par régression non linéaire à partir des mesures d'intensité de
fluorescence.
Avantageusement et selon l'invention, le milieu liquide est
choisi dans le groupe formé des fluides biologiques -notamment d'un sérum-
prélevé sur un individu.
Avantageusement et selon l'invention, l'individu est un
patient choisi dans le groupe formé des patients en attente d'une greffe et
des
patients greffés.
Avantageusement et selon l'invention, l'anticorps monoclonal
spécifique des épitopes mono-morphiques des antigènes HLA de classe I est
l'anticorps W6/32.
Avantageusement et selon l'invention, l'anticorps monoclonal
spécifique des épitopes mono-morphiques des antigènes HLA de classe II est
l'anticorps F3.3.
CA 02862287 2014-07-22
14
WO 2013/121157 PCT/FR2013/050315
L'invention vise aussi l'utilisation d'une immunoglobuline
chimérique monoclonale dans une méthode de dépistage -notamment une méthode
de recherche ou une méthode d'identification- ou de quantification d'
anticorps anti-
HLA choisie dans le groupe formé des méthodes par immuno-fluorimétrie
quantitative multiplexée, des méthodes par cytométrie en flux, des méthodes
par
dosage immuno-enzymatique sur support solide (ELISA) et des méthodes par
micro-lymphocytotoxicité dépendante du complément.
L'invention vise en particulier l'utilisation d'une
immunoglobuline chimérique monoclonale à titre de réactif de standardisation
et de
contrôle positif et de sensibilité dans une méthode de dépistage ou de
quantification
d'anticorps anti-HLA choisie dans le groupe formé des méthodes par immuno-
fluorimétrie quantitative multiplexée, des méthodes par cytométrie en flux,
des
méthodes par dosage immuno-enzymatique sur support solide et des méthodes par
micro-lymphocytotoxicité dépendante du complément, caractérisée en ce
l'immunoglobuline chimérique monoclonale est formée de:
- deux chaînes polypeptidiques, dites chaînes (H) lourdes,
de poids moléculaire compris entre 40 kDa et 60 kDa, et de ;
- deux chaînes polypeptidiques, dites chaînes (L) légères,
de poids moléculaire compris entre 20 kDa et 30 kDa ;
caractérisée en ce que:
- chaque chaîne (H) lourde comprend :
o une région (VH) variable d'une chaîne lourde d'un anticorps
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
épitopes mono-morphiques des antigènes HLA de classe I et des anticorps
monoclonaux spécifiques des épitopes mono-morphiques des antigènes HLA de
classe II, et ;
o une région (CH) constante d'une chaîne lourde d'une
immunoglobuline humaine choisie dans le groupe formé des IgA, des IgG et des
IgM ;
et en ce que:
- chaque chaîne (L) légère comprend :
CA 02862287 2014-07-22
WO 2013/121157 PCT/FR2013/050315
0 une région (VL) variable d'une chaîne légère d'un anticorps
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
épitopes mono-morphiques des antigènes HLA de classe I et des anticorps
monoclonaux spécifiques des épitopes mono-morphiques des antigènes HLA de
5 classe II, et;
o une région (CL) constante d'une chaîne légère d'une
immunoglobuline humaine choisie dans le groupe formé des chaînes Kappa et des
chaînes Lambda.
On utilise donc une immunoglobuline chimérique
10 monoclonale selon l'invention dans laquelle les parties constantes (CH)
des chaînes
lourdes et les parties constantes (CL) des chaînes légères sont constituées
des parties
constantes d'une IgA humaine dans des essais de compétition. De telles
immunoglobulines chimériques monoclonales de classe IgA selon l'invention sont
adaptées pour inhiber au moins partiellement la fixation d'anticorps poly-
clonaux
15 anti-HLA de classe IgG (ou IgM) présent dans le sérum des malades.
L'inhibition
de la fixation des IgG du sérum par les immunoglobulines chimériques
monoclonales de classe IgA selon l'invention permet de démontrer la
spécificité de
la fixation des IgG sur les supports immuno-adsorbants utilisés dans les tests
de
dépistage d'anticorps anti-HLA par immuno-fluorimétrie quantitative
multiplexée
avec lecture en flux sur appareil Luminex , par cytométrie en flux, par
les
techniques ELISA, et par la micro-lymphocytotoxicité dépendante du complément.
En particulier, les immunoglobulines chimériques
monoclonales de classe IgA permettent de différencier un signal spécifique
correspondant à la présence réelle d'IgG anti-HLA dans le sérum, vis-à-vis
d'un
signal non spécifique correspondant à l'adsorption des IgG sur le support
présentateur des antigènes HLA. Cette compétition des immunoglobulines
chimériques monoclonales de classe IgA selon l'invention pour la recherche
d'IgG
anti-HLA a été démontrée par d'immuno-fluorimétrie quantitative sur Luminex .
Les immunoglobulines chimériques monoclonales de classe
IgG et de classe IgM selon l'invention peuvent être employées comme contrôles
positifs et contrôles de sensibilité de l'épreuve de compatibilité directe
(cross-
CA 02862287 2014-07-22
16
WO 2013/121157 PCT/FR2013/050315
match) entre un receveur et un donneur d'organe réalisée juste avant la greffe
d'organe par toute technique adaptée (micro-lymphocytotoxicité dépendante du
complément ou en cytométrie en flux) et dans toute technique de détection des
anticorps de classe IgG ou IgM sur un support immunoabsorbant (ELISA ou
immuno-fluorimétrie quantitative sur bille de polystyrène).
L'invention concerne aussi une immunoglobuline chimérique
monoclonale spécifique des antigènes HLA de classe I formée de :
- deux chaînes polypeptidiques, dites chaînes (H) lourdes,
de poids moléculaire compris entre 40 kDa et 60 kDa, et de ;
- deux chaînes
polypeptidiques, dites chaînes (L) légères,
de poids moléculaire compris entre 20 kDa et 30 kDa;
caractérisée en ce que :
- chaque chaîne (H) lourde comprend :
o une région (VH) variable d'une chaîne lourde d'un anticorps
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
épitopes mono-morphiques des antigènes HLA de classe I, et;
o une région (CH) constante d'une chaîne lourde d'une
immunoglobuline humaine choisie dans le groupe formé des IgA, des IgG et des
IgM ;
et en ce que:
- chaque chaîne (L) légère comprend :
o une région (VL) variable d'une chaîne légère d'un anticorps
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
épitopes mono-morphiques des antigènes HLA de classe, et;
o une région (CL) constante d'une chaîne légère d'une
immunoglobuline humaine choisie dans le groupe formé des chaînes Kappa et des
chaînes Lambda.
Avantageusement, un anticorps monoclonal spécifique d'un
épitope mono-morphique des antigènes HLA de classe I est conformé pour pouvoir
reconnaitre un épitope commun à tous les antigènes HLA de classe I.
CA 02862287 2014-07-22
17
WO 2013/121157 PCT/FR2013/050315
Avantageusement et selon l'invention, l'immunoglobuline
chimérique monoclonale spécifique des antigènes HLA de classe I est choisie
dans
le groupe formé :
¨ des immunoglobulines chimériques monoclonales
comprenant au moins une chaine légère de séquence SEQ ID_NO 1, et:
¨ des immunoglobulines chimériques monoclonales
comprenant au moins une chaine lourde choisie dans le groupe formé des chaines
lourdes de séquence SEQ ID_NO 2, des chaines lourdes de séquence SEQ ID_NO 3
et des chaines lourdes de séquence SEQ ID_NO 4.
L'invention concerne aussi une immunoglobuline chimérique
monoclonale spécifique des antigènes HLA de classe II formée de :
¨ deux chaînes polypeptidiques, dites chaînes (H) lourdes,
de poids moléculaire compris entre 40 kDa et 60 kDa, et de ;
¨ deux chaînes polypeptidiques, dites chaînes (L) légères,
de poids moléculaire compris entre 20 kDa et 30 kDa;
caractérisée en ce qu'elle est choisie dans le groupe formé :
¨ des immunoglobulines chimériques monoclonales
comprenant au moins une chaine légère de séquence SEQ ID_NO 5, et:
¨ des immunoglobulines chimériques monoclonales
comprenant au moins une chaine lourdes choisie dans le groupe formé des
chaines
lourdes de séquence SEQ ID_NO 6, des chaines lourdes de séquence SEQ ID_NO 7
et des chaines lourdes de séquence SEQ ID_NO 8.
Avantageusement, un anticorps monoclonal spécifique d'un
épitope mono-morphique des antigènes anti-HLA de classe II est conformé pour
pouvoir reconnaitre un épitope commun à sensiblement tous les antigènes HLA de
classe II.
Avantageusement, une immunoglobuline chimérique
monoclonale spécifique des antigènes HLA de classe I ou de classe II selon
l'invention désigne une immunoglobuline dans laquelle :
o les chaînes lourdes et les chaînes légères sont humaines par nature
dans leurs parties constantes. En particulier, les parties constantes des
chaînes
CA 02862287 2014-07-22
18
WO 2013/121157 PCT/FR2013/050315
lourdes sont choisies dans le groupe formé des parties constantes des chaînes
lourdes d'une IgA, des parties constantes des chaînes lourdes d'une IgG et des
parties constantes des chaînes lourdes d'une IgM et les parties constantes des
chaînes légères sont choisies dans le groupe formé des chaînes Kappa et des
chaînes
Lambda, et;
o les parties variables des chaines légères et des chaînes
lourdes sont
choisies dans le groupe formé des anticorps monoclonaux spécifiques des
épitopes
mono-morphiques des antigènes HLA de classe I et des anticorps monoclonaux
spécifiques des épitopes mono-morphiques des antigènes HLA de classe II. Dans
une telle immunoglobuline chimérique monoclonale, les parties constantes (CH)
des
chaînes lourdes de l'anticorps humain et les parties constantes (CL) des
chaînes
légères de l'anticorps humain représentent ensemble de l'ordre de 60 % en
masse de
l'immunoglobuline chimérique monoclonale. En outre, une telle immunoglobuline
chimérique monoclonale est un anticorps monoclonal, c'est-à-dire spécifique
d'un
épitope mono-morphique unique.
Avantageusement, chaque anticorps monoclonal est choisi
dans le groupe formé des anticorps monoclonaux d'un organisme vertébré
-notamment d'un organisme vertébré non humain- spécifiques des épitopes mono-
morphiques des antigènes HLA de classe I et des anticorps monoclonaux d'un
organisme vertébré -notamment d'un organisme vertébré non humain- spécifiques
des épitopes mono-morphiques des antigènes HLA de classe II.
Dans tout le texte, on entend par organisme vertébré non
humain , un être vivant organisé supérieur à l'exclusion de l'homme. Un tel
organisme vertébré est en particulier pourvu d'un système immunitaire. Un tel
organisme vertébré est en particulier choisi dans le groupe formé des
mammifères
non humains -notamment de la souris, du rat, du lapin et du hamster- des
batraciens
et des oiseaux -notamment des galliformes-. De tels organismes vertébrés non
humains sont en particulier des animaux de laboratoire. Cependant, un tel
anticorps
monoclonal peut être choisi dans le groupe formé des anticorps monoclonaux
humains.
CA 02862287 2014-07-22
19
wo 2013/121157 PCT/FR2013/050315
Avantageusement et selon l'invention, chaque anticorps
monoclonal spécifique des épitopes mono-morphiques des antigènes HLA de classe
I et chaque anticorps monoclonal spécifique des épitopes mono-morphiques des
antigènes HLA de classe II est choisi dans le groupe formé des anticorps
monoclonaux d'un vertébré, en particulier des anticorps monoclonaux d'un
mammifère -notamment de souris, de rat, de lapin, de hamster et de l'homme- et
des
anticorps monoclonaux d'un vertébré non mammifère -notamment d'un batracien,
d'un oiseau, en particulier d'un galliforme-.
Avantageusement et selon l'invention, l'anticorps monoclonal
spécifique des épitopes mono-morphiques des antigènes HLA de classe I est
l'anticorps W6/32.
Avantageusement et selon l'invention, l'anticorps
monoclonal spécifique des épitopes mono-morphiques des antigènes HLA de
classe II est l'anticorps F3.3.
L'invention vise en outre une solution stable d'au moins une
immunoglobuline chimérique monoclonale selon l'invention dans une composition
aqueuse.
L'invention vise aussi une telle solution aqueuse d'au moins
une immunoglobuline chimérique monoclonale selon l'invention, ladite solution
aqueuse présentant une concentration prédéterminée de ladite immunoglobuline
chimérique monoclonale.
L'invention vise aussi une telle immunoglobuline chimérique
monoclonale adaptée pour pouvoir permettre une détermination de la quantité
d'anticorps anti-HLA d'un milieu liquide contenant des anticorps.
L'invention s'étend par ailleurs à un kit de quantification in
vitro d'anticorps anti-HLA d'un milieu liquide, ledit kit comprenant une
quantité
prédéterminée d'au moins une immunoglobuline chimérique monoclonale selon
l'invention et une notice explicative pour la mise en oeuvre d'un procédé
selon
l'invention.
Ainsi, l'invention vise un kit de quantification in vitro
d'anticorps anti-HLA d'un milieu liquide, ledit kit comprenant une quantité
CA 02862287 2014-07-22
WO 2013/121157 PCT/FR2013/050315
prédéterminée d'au moins une immunoglobuline chimérique monoclonale
comprenant :
- deux chaînes polypeptidiques, dites chaînes (H) lourdes,
de poids moléculaire compris entre 40 kDa et 60 kDa, et de ;
5 - deux
chaînes polypeptidiques, dites chaînes (L) légères,
de poids moléculaire compris entre 20 kDa et 30 kDa;
caractérisée en ce que:
- chaque chaîne (H) lourde comprend :
o une région (VH) variable d'une chaîne lourde d'un anticorps
10
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
épitopes mono-morphiques des antigènes HLA de classe I et des anticorps
monoclonaux spécifiques des épitopes mono-morphiques des antigènes HLA de
classe II, et ;
o une région (CH) constante d'une chaîne lourde d'une
15
immunoglobuline humaine choisie dans le groupe formé des IgA, des IgG et des
IgM ;
et en ce que :
- chaque chaîne (L) légère comprend :
o une région (VL) variable d'une chaîne légère d'un anticorps
20
monoclonal choisi dans le groupe formé des anticorps monoclonaux spécifiques
des
épitopes mono-morphiques des antigènes HLA de classe I et des anticorps
monoclonaux spécifiques des épitopes mono-morphiques des antigènes HLA de
classe II, et ;
o une région (CL) constante d'une chaîne légère d'une
immunoglobuline humaine choisie dans le groupe formé des chaînes Kappa et des
chaînes Lambda ;
ledit kit comprenant aussi une notice explicative pour la mise en oeuvre d'un
procédé selon l'invention.
L'invention concerne également un procédé de détermination
de la quantité d'anticorps anti-HLA d'un milieu liquide contenant des
anticorps, une
immunoglobuline chimérique monoclonale, son utilisation et un kit pour cette
CA 02862287 2014-07-22
21
WO 2013/121157 PCT/FR2013/050315
détermination, caractérisés en combinaison par tout ou partie des
caractéristiques
mentionnées ci-dessus ou ci-après.
D'autres buts, caractéristiques et avantages de l'invention
apparaîtront à la lecture de la description suivante qui se réfère aux figures
annexées
représentant des modes de réalisation préférentiels de l'invention, donnés
uniquement à titre d'exemples non limitatifs, et dans lesquels :
¨ la figure 1 est une représentation graphique de la variation
temporelle de l'intensité de fluorescence de 17 types de billes traitées selon
un
contrôle négatif ;
¨ la figure 2 est une représentation graphique de la variation
de l'intensité de fluorescence de 12 types de billes porteuses d'antigènes HLA
de
classe I d'un contrôle positif selon l'état de la technique en fonction du
temps ;
¨ la figure 3 est une représentation graphique de la variation
de l'intensité de fluorescence de 5 types de billes HLA de classe II d'un
contrôle
positif selon l'état de la technique en fonction du temps ;
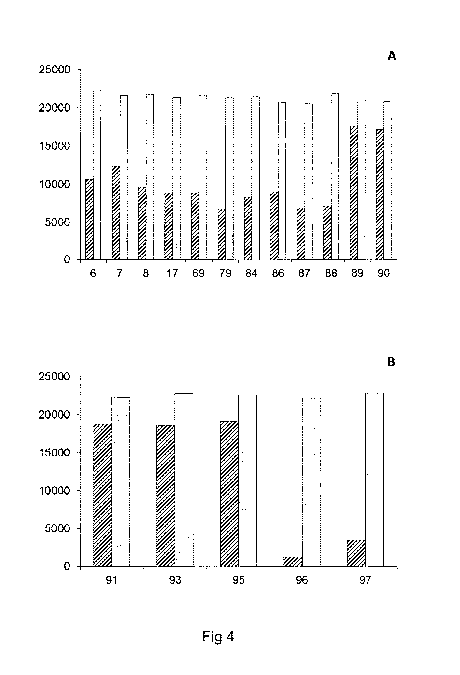
¨ la figure 4 est une représentation comparative en
histogramme de l'intensité de fluorescence d'un contrôle positif selon l'état
de la
technique et d'un contrôle positif selon l'invention, dans laquelle ;
o la figure 4A est une représentation en histogramme de l'intensité de
fluorescence mesurée sur 12 types de billes HLA de classe I traitées
avec un contrôle positif selon l'état de la technique (histogramme
hachuré) et avec un contrôle positif selon l'invention (histogramme
plein) ;
o la figure 4B est une représentation en histogramme de l'intensité de
fluorescence mesurée sur 5 types de billes HLA de classe II traitées
avec un contrôle positif selon l'état de la technique (histogramme
hachuré) et avec un contrôle positif selon l'invention (histogramme
plein) ;
¨ la figure 5 est une analyse par cytométrie en flux de la
fixation d'immunoglobulines monoclonales chimériques de classe I et de classe
II
selon l'invention sur des lymphocytes T et des lymphocytes B ;
CA 02862287 2014-07-22
22
WO 2013/121157 PCT/FR2013/050315
- la figure 6A est une représentation graphique de 12 courbes
dose/réponse superposées correspondant à 12 types de billes HLA de classe I
traitées avec un contrôle positif selon l'invention. La concentration en
immunoglobuline chimérique monoclonale selon l'invention est exprimée en
lui g /mL ;
- la figure 6B est une représentation graphique de la courbe
dose/réponse moyenne de 12 types de billes HLA de classe I traitées avec un
contrôle positif selon l'invention correspondant à la figure 6A. La
concentration en
immunoglobuline chimérique monoclonale selon l'invention est exprimée en
lui g/mL ;
- la figure 7A est une représentation graphique de 5 courbes
dose/réponse superposées correspondant à 5 types de billes HLA de classe II
traitées avec un contrôle positif selon l'invention. La concentration en
immunoglobuline chimérique monoclonale selon l'invention est exprimée en
pig/mL ;
- la figure 7B est une représentation graphique de la courbe
dose/réponse moyenne des 5 types de billes HLA de classe II traitées avec un
contrôle positif selon l'invention correspondant à la figure 7A. La
concentration en
immunoglobuline chimérique monoclonale selon l'invention est exprimée en
lui g /mL ;
- la figure 8A est une représentation graphique comparative
de la courbe dose/réponse d'une immunoglobuline chimérique monoclonale anti-
HLA de classe I selon l'invention conservée dans un tampon salin (carré blanc)
et
conservée dans une solution d'albumine humaine à 60 g/L (losange noir) ;
- la figure 8B est une représentation graphique comparative
de la courbe dose/réponse d'une immunoglobuline chimérique monoclonale anti-
HLA de classe II selon l'invention conservée dans un tampon salin (carré
blanc) et
conservée dans une solution d'albumine humaine à 60 g/L (losange noir) ;
- la figure 9 est une représentation de la séquence peptidique
de la chaîne légère de l'immunoglobuline chimérique monoclonale anti-HLA de
classe I (Hu-IgG1 K [W6/32]) et correspond à la séquence SEQ ID_NO 1;
CA 02862287 2014-07-22
23
WO 2013/121157 PCT/FR2013/050315
- la figure 10 est une représentation de la séquence
peptidique de la chaîne lourde de l'immunoglobuline chimérique monoclonale Hu-
IgG1 K [W6/32] et correspond à la séquence SEQ ID_NO 2;
- la figure 11 est une représentation de la séquence
peptidique de la chaîne lourde de l'immunoglobuline chimérique monoclonale Hu-
IgA2 K [W6/32] et correspond à la séquence SEQ ID_NO 3;
- la figure 12 est une représentation de la séquence
peptidique de la chaîne lourde de l'immunoglobuline chimérique monoclonale Hu-
IgM K [W6/32] et correspond à la séquence SEQ ID_NO 4;
- la figure 13 est une représentation de la séquence
peptidique de la chaîne légère de l'immunoglobuline chimérique monoclonale Hu-
IgG1 K [F3.3] et correspond à la séquence SEQ ID_NO 5 ;
- la figure 14 est une représentation de la séquence
peptidique de la chaîne lourde de l'immunoglobuline chimérique monoclonale Hu-
IgA2 K [F3.3] et correspond à la séquence SEQ ID_NO 6;
- la figure 15 est une représentation de la séquence
peptidique de la chaîne lourde de l'immunoglobuline chimérique monoclonale Hu-
IgG1 K [F3.3] et correspond à la séquence SEQ ID_NO 7;
- la figure 16 est une représentation de la séquence
peptidique de la chaîne lourde de l'immunoglobuline chimérique monoclonale Hu-
IgM K [F3.3] et correspond à la séquence SEQ ID_NO 8.
EXEMPLE 1 - Obtention d'une immunoglobuline chimérique
monoclonale IgG/anti-HLA de classe I (Hu-IgG1 K [W6/32]) selon l'invention.
L'anticorps W6/32 a été décrit pour la première fois dans la
publication de Barnstable et al. en 1978 (Barnstable CJ, Bodmer WF, Brown G,
Galfre G, Milstein C, Williams AF, Ziegler A., 1978, Celle, 14(1), 9-20.
Production
of monoclonal antibodies to group A erythrocytes, HLA and other human cell
surface antigens-new tools for genetic analysis). Cet anticorps est sécrété
par un
hybridome de souris provenant de la fusion de cellules d'une lignée de myélome
de
souris (lignée P3-NSI/1 Ag4-1 non sécrétrice d'immunoglobuline de souris) avec
les
lymphocytes d'une souris immunisée contre des cellules humaines. Il a été
CA 02862287 2014-07-22
24
WO 2013/121157 PCT/FR2013/050315
démontré que cet anticorps réagit avec un épitope public retrouvé sur les
molécules
HLA de classe I (HLA-A, HLA-B, HLA-C). L'épitope reconnu est un épitope de
conformation qui dépend de l'association entre la chaîne lourde alpha de
classe I et
de la microglobuline bêta 2. L'épitope requiert la présence d'une arginine en
position 3 de la bêta-2-microglobuline et d'une lysine en position 121 de la
chaîne
alpha (Ladasky JJ, Shum BP, Canavez F, Seuànez HN, Parham P., (1999),
Immunogenetics, 49(4), 312-320. Residue 3 of beta2-microglobulin affects
binding
of class I MHC molecules by the W6/32 antibody).
Dans une première étape, les transcrits codant la chaîne lourde
et de la chaîne légère de l'anticorps W6/32 ont été clonés et séquencés.
La copie ADN des ARNm (ADNc) de la chaîne lourde a été
amplifiée par PCR à l'aide de deux amorces, l'une spécifique de la région
codant le
peptide amorce ( leader peptide ), l'autre ciblant la partie 5' qui code le
domaine
CH1 de la partie constante.
Pour l'amplification de l'ADNc de la chaîne légère, une
amorce ciblant l'exon du peptide leader et une amorce ciblant la partie 5' du
domaine C Kappa ont été utilisées. Les fragments d'ADNc des deux chaînes ont
été
clonés dans E coli. Les fragments clonés ont été séquencés. L'alignement des
séquences a permis d'établir les consensus des ADNc de la chaîne lourde et de
la
chaîne légère avec un seuil d'identité de 98%. Les régions codant les parties
variables ont été déterminées par comparaison avec les séquences présentes
dans la
banque de données de l'IMGT ( International Immunogenetics Information
System ).
Des séquences codant un peptide amorce de chaîne légère ou
de chaîne lourde suivant le cas ont été ajoutées en 5' et les séquences en 3'
ont été
modifiées de façon à créer un site de restriction B siWI pour l'ADN de la
chaîne
légère et un site de restriction NheI pour la chaîne lourde. Ces sites de
restrictions
sont adaptés pour permettre une insertion de ces séquences nucléiques dans les
vecteurs de clonages pFUSE-CLIg et pFUSE-CHIg (InvivoGen, Toulouse, France).
Les séquences ainsi définies ont été synthétisées puis clonées dans des
vecteurs
d'expression comportant soit la partie codant le domaine constant de la chaîne
CA 02862287 2014-07-22
WO 2013/121157 PCT/FR2013/050315
Kappa humaine (allotype Km 01; numéro d'accès Genbank : J00241) soit la partie
constante des IgG1 humaines. Le site de restriction du vecteur d'expression
permettant d'insérer les ADNc des parties variables en phase avec les régions
codant les parties constantes des chaînes d'immunoglobuline.
5 Deux
vecteurs d'expression, l'un codant pour une chaîne
légère chimère associant la partie variable de la chaîne légère de l'anticorps
W6/32
et le domaine C Kappa humain (chaîne VL [W6/32]-C Kappa humaine), l'autre
associant la partie variable de la chaîne lourde de l'anticorps W6/32 et le
domaine C
gamma 1 humain (VL [W6/32]-C gammal humaine) ont été ainsi obtenus.
10 Ces
deux vecteurs ont été introduits par transfection dans des
cellules CHO (Chinese Hamster Ovary cells). Pour ce faire, les cellules ont
d'abord
été transfectées par le vecteur codant la chaîne légère puis par celui codant
la chaîne
lourde. Les vecteurs d'expression comportent des facteurs de résistances à des
drogues cytotoxiques permettant de sélectionner efficacement les cellules
15
doublement transfectées. Après la période de sélection, les cellules
doublement
transfectées ont été clonées par dilution limite et la présence des IgG1 Kappa
humaines ont été révélée dans le surnageant des clones par une technique
d'ELISA
sandwich. Les clones producteurs ainsi révélés ont été soumis à une pluralité
de
cycles de clonage par dilution limite de manière à recruter les clones les
plus
20
efficaces dans la sécrétion de l'IgG1 Kappa chimère dénommée ci-après Hu-IgG1
K
[W6/32] .
Les Hu-IgG1 K [W6/32] sécrétées dans le surnageant de
culture des cellules CHO transfectées ont été purifiées par capture-élution
sur la
protéine A du staphylocoque liée à des billes de Sépharose . Les IgG1 Kappa
ont
25 été
éluées à pH acide dans un tampon glycine à pH 2. L'éluat a été tamponné
extemporanément par une solution aqueuse de phosphate di-sodique à la
concentration de 750 mM. Les solutions d'Hu-IgG1 K [W6/32] sont conservées à
4 C ou à -80 C.
La séquence peptidique de la chaîne légère de
l'immunoglobuline chimérique monoclonale (IgGl-anti-HLA classe I) Hu-
IgG1 K [W6/32] est représentée en figure 9 et correspond à la séquence SEQ
CA 02862287 2014-07-22
26
WO 2013/121157 PCT/FR2013/050315
ID_NO 1. La séquence peptidique de la chaîne lourde de l'immunoglobuline
chimérique monoclonale (IgGl-anti-HLA classe I) Hu-IgG1 K [W6/32] est
représentée en figure 10 et correspond à la séquence SEQ ID_NO 2.
La vérification de la spécificité de la liaison de
l'immunoglobuline chimérique monoclonale Hu-IgG1 K [W6/32] selon l'invention
a été réalisée sur des lymphocytes T ou sur des lymphocytes B séparées sur
gradient
de densité à partir de sang humain prélevé sur tube EDTA. Les cellules ont été
marquées par des anticorps anti-CD3, anti-CD19 et anti-CD45. Les lymphocytes T
(CD3+) et B (CD19+) sont définis parmi la population des lymphocytes CD45+.
On incube l'immunoglobuline chimérique monoclonale Hu-
IgG1 K [W6/32] en présence de cellules mononuclées humaines (lymphocytes T ou
lymphocytes B) du sang périphérique, puis on réalise trois lavages successifs
desdites cellules mononuclées humaines suivi de trois lavages en tampon
phosphate
salin (PBS). On révèle la fixation des immunoglobulines chimériques
monoclonales
fixées sur les cellules mononuclées humaines au moyen d'anticorps de chèvre
anti-
Fcy humain. Les résultats sont présentés en figure 5 et indiquent que
l'anticorps Hu-
IgG1 K [W6/32] se fixe sur les lymphocytes B (figure 5A) et avec les
lymphocytes
T (figure 5C) alors que l'anticorps Hu-IgG1 K [F3.3] se fixe sur les
lymphocytes B
(figure 5B) et pas sur les lymphocytes T (figure 5D).
EXEMPLE 2 ¨ Spécificité des immunoglobulines
chimériques monoclonales Hu-IgG1 K [W6/32]
La spécificité des immunoglobulines chimériques
monoclonales Hu-IgG1 K [W6/32] a ensuite été déterminée par une technique de
fluorimétrie quantitative multiplexée en utilisant des trousses commerciales
distribuées par la société One Lambda . Cette détermination est fondée sur une
réaction d'immunofluorescence indirecte et utilisent des billes de latex
revêtues
d'antigène HLA de divers groupes. Les anticorps capables de reconnaitre les
antigènes HLA présents sur les billes de latex sont révélés par des anticorps
anti
IgG humaines couplés à la phycoérythrine. La fluorescence est quantifiée sur
chaque bille par cytométrie en flux sur un appareil Luminex . Un marquage
fluorescent spécifique de chaque type de billes permet de mettre en jeu
plusieurs
CA 02862287 2014-07-22
27
WO 2013/121157 PCT/FR2013/050315
variétés de billes (reconnaissable par leur fluorescence), chaque bille étant
revêtue
d'un mélange d'antigènes HLA donné. Ceci permet de démontrer que toutes les
billes de classe I sont reconnues avec sensiblement la même intensité (figure
4A,
billes de classe I). Ceci nous permet de conclure que l'immunoglobuline
chimérique
monoclonale Hu-IgG1 K [W6/32] reconnait un épitope public présent sur toutes
les
molécules HLA de classe I.
Des expériences de compétition ont permis de démontrer que
l'anticorps monoclonal de souris W6/32 sécrété par l'hybridome de souris
inhibe la
fixation de l'immunoglobuline chimérique monoclonale Hu-IgG1 K [W6/32]
EXEMPLE 3 - Obtention d'anticorps monoclonaux
chimériques anti-HLA de classe I d'isotype IgA2 et IgM (Hu-IgA2 K [W6/32] et
Hu-IgM K [W6/32]) selon l'invention.
La partie variable de la chaîne lourde W6/32 (VH[W6/32]) a
été clonée dans deux autres vecteurs d'expression le premier permet de
produire des
chaînes mu chimères (partie variable de W6/32 et partie constante de la chaîne
lourde humaine mu (Numéro d'accès Genbank : AY510104.1), l'autres des chaînes
alpha 2 chimère (partie variable de W6/32 et partie constante de la chaîne
lourde
humaine alpha 2, allotype A2m(1) (Numéro d'accès Genbank : J00221). Ces deux
vecteurs ont été utilisés pour transfecter des cellules de la lignée CHO
préalablement transfectées par le vecteur permettant l'expression de la chaîne
légère
chimère VL[W6/32]-K humaine. Nous avons ainsi isolé un clone de cellules CHO
sécrétant de grandes quantités d'immunoglobuline chimérique monoclonale Hu-
IgA2 K [W6/32] et un autre clone sécrétant une immunoglobuline chimérique
monoclonale Hu-IgM K [W6/32]. Les IgA chimériques ont été purifiées sur un
support d' agarose couplé au peptide M (InvivoGen, Toulouse, France) et les
IgM
chimériques ont été purifiées sur un support d' agarose couplé à la protéine L
(InvivoGen, Toulouse, France) selon les recommandations du fournisseur.
La séquence peptidique de la chaîne lourde de
l'immunoglobuline chimérique monoclonale (IgA2-anti-HLA classe I) Hu-IgA2 K
[W6/32] est représentée en figure 11 et correspond à la séquence SEQ ID_NO 3.
La séquence peptidique de la chaîne lourde de
CA 02862287 2014-07-22
28
WO 2013/121157 PCT/FR2013/050315
l'immunoglobuline chimérique monoclonale (IgM-anti-HLA classe I) est
représentée en figure 12 et correspond à la séquence SEQ ID_NO 4.
La réactivité des immunoglobulines chimériques
monoclonales Hu-IgA2 K [W6/32] et Hu-IgM K [W6/32] a été vérifiée en
technique Luminex avec les trousses Labscreen mixed (One Lambda ) et, à
titre
d'anticorps secondaires fluorescents, des anticorps de chèvre anti-IgA
humaines ou
anti-IgM humaines couplés à la phycoérythrine.
EXEMPLE 4 ¨ Obtention d'un anticorps monoclonal anti-
HLA de classe II (Hu-IgG1 K [F3.3]) selon l'invention.
Dans son principe, le procédé d'obtention d'un anticorps
monoclonal anti-HLA de classe II est comparable au procédé d'obtention d'un
anticorps monoclonal anti-HLA de classe I (W6/32).
L'anticorps F3.3 (Elsasser, D., Valerius, T., Repp, R., Weiner,
G.J., Deo, Y., Kalden, J.R., van de Winkel, J.G., Stevenson, G.T., Glennie,
M.J. and
Gramatzki, M., (1996), Blood, 87(9), 3803-3812. HLA class II as potential
target
antigen on malignant B cells for therapy with bispecific antibodies in
combination
with granulocyte colony-stimulating factor) est le produit d'un clone unique
d'hybridome de souris. L'anticorps F3.3 reconnait au moins un épitope public
présent à la surface de toutes les cellules humaines exprimant les molécules
HLA de
classe II. En particulier, l'anticorps F3.3 reconnait tous les antigènes DR,
tous les
antigènes DP et tous les antigènes du groupe DQ2. Les séquences complètes
codantes des parties variables de l'anticorps F3.3 sont accessibles sur
GenBank
(numéros d'accès : AY058910 [VL] pour la chaîne légère et AY058911 [VH] pour
la chaîne lourde).
Les séquences des parties variables ont été synthétisées et
clonées en phase dans les vecteurs de clonage pFUSE-CHIg (InvivoGen, Toulouse,
France) pour les chaînes lourdes et pFUSE-CLIg (InvivoGen, Toulouse, France)
pour les chaînes légères. Le vecteur (pFUSE-CHIg) permet la production de la
chaîne lourde chimère VH[F3.3]-C gamma 1 humaine et le vecteur (pFUSE-CLIg)
permet la production de la chaîne légère VL[F3.3]-C Kappa humaine. Ces deux
CA 02862287 2014-07-22
29
WO 2013/121157 PCT/FR2013/050315
vecteurs d'expressions sont utilisés pour transfecter des cellules de la
lignée CHO
comme décrit à l'exemple 1.
En outre, la partie variable VH[F3.3] a été clonée dans des
vecteurs d'expression permettant la production de chaînes lourdes chimères
VH[F3.3]-C mu humaine et VH[F3.3]-C alpha 2 humaine.
La séquence peptidique de la chaîne légère de
l'immunoglobuline chimérique monoclonale anti-HLA de classe II (Hu-IgG1 K
[F3.3]) est représentée en figure 13 et correspond à la séquence SEQ ID_NO 5.
La séquence peptidique de la chaîne lourde de
l'immunoglobuline chimérique monoclonale anti-HLA de classe II (Hu-IgA2 K
[F3.3]) est représentée en figure 14 et correspond à la séquence SEQ ID_NO 6.
La séquence peptidique de la chaîne lourde de
l'immunoglobuline chimérique monoclonale anti-HLA de classe II (Hu-IgG1 K
[F3.3]) est représentée en figure 15 et correspond à la séquence SEQ ID_NO 7.
La séquence peptidique de la chaîne lourde de
l'immunoglobuline chimérique monoclonale anti-HLA de classe II (Hu-IgM K
[F3.3]) est représentée en figure 16 et correspond à la séquence SEQ ID_NO 8.
Les immunoglobulines chimériques monoclonales Hu-IgG1 K
[F3.3], Hu-IgA2 K [F3.3] et Hu-IgM K [F3.3] dirigés contre les antigènes HLA
de
classe II ont été produits par des cellules CHO transfectées par les vecteurs
appropriés. Les IgG1 chimères ont été purifiées sur protéine A Sépharose. Les
IgA
chimères ont été purifiées sur peptide M-agarose (InvivoGen, Toulouse,
France).
Les IgM chimères ont été purifiées sur protéine L-Agarose (InvivoGen,
Toulouse,
France).
On vérifie la spécificité de la liaison de l'immunoglobuline
chimérique monoclonale Hu-IgG1 K [F3.3] selon l'invention par une technique
d'immunofluorescence indirecte par cytométrie en flux sur des cellules
humaines
mononuclées telle que décrite à l'exemple 1. Les résultats sont présentés à la
figure 5 et indiquent que l'anticorps Hu-IgG1 K [F3.3] selon l'invention
réagit
fortement contre les cellules humaines, notamment avec les lymphocytes B
(figure
5B) et avec les lymphocytes T (figure 5D).
CA 02862287 2014-07-22
WO 2013/121157 PCT/FR2013/050315
En outre, on étudie la spécificité des immunoglobulines
chimériques monoclonales anti-HLA de classe II selon l'invention par la
technique
d'immunofluorimétrie quantitative multiplexée sur Luminex à l'aide de
trousses
Labscreen mixed et Labscreen single antigen (One Lambda ).
5 L'anticorps Hu-IgG1 K [F3.3] s'est fixé sur toutes les
billes
portant les antigènes HLA de classe II du kit Labscreen mixed et sur toutes
les
billes portant les antigènes HLA-DR, HLA-DP et HLA-DQ2 du kit Labscreen
single antigen class Il .
Il a été démontré, par des expériences de compétition, que les
10 immunoglobulines chimériques monoclonales Hu-IgG1 K [F3.3] et Hu-IgA2 K
[F3.3] reconnaissent le même épitope. La réactivité de l'immunoglobuline
chimérique monoclonale Hu-IgA2 K [F3.3] a été étudiée par technique Luminex
avec les trousses Labscreen mixed (One-Lambda ) en utilisant, comme
révélateur
de la fixation des immunoglobulines chimériques monoclonales Hu-IgA2 K [F3.3],
15 des anticorps de chèvre anti-IgA humaines couplés à la phycoérythrine. La
réactivité de l'immunoglobuline chimérique monoclonale Hu-IgA2 K [F3.3] s'est
révélée identique à celle de l'immunoglobuline chimérique monoclonale Hu-IgG1
K [F3.3].
EXEMPLE 5 - Procédé de quantification in vitro des
20 anticorps anti-HLA
Dans un procédé de quantification in vitro d'anticorps anti-
HLA d'un milieu liquide contenant des anticorps par immunofluorescence selon
l'invention, on utilise, à titre d'exemple non limitatif, un kit de
laboratoire
Labscreen mixed (LSM12, One Lambda Inc., USA) comprenant :
25 - des billes de polystyrène liées de façon covalente à des
antigènes HLA de classe I (HLA-A, HLA-B et HLA-C) purifiés, et, en mélange ;
- des billes de polystyrène liées de façon covalente à des
antigènes HLA de classe II (HLA-DR, HLA-DQ et HLA-DP) purifiés ;
- des billes de polystyrène, dites billes de contrôle positif,
30 liées à des IgG ;
CA 02862287 2014-07-22
31
WO 2013/121157 PCT/FR2013/050315
¨ des billes de polystyrène, dites billes de contrôle négatif,
dépourvues d'antigène surface. Un tel kit de laboratoire (Labscreen mixed )
comprend une suspension aqueuse de billes de polystyrène de dépistage des
anticorps anti-HLA de classe I et des anticorps anti-HLA de classe II. Les
billes de
polystyrène de cette suspension comprennent une pluralité de type de billes de
polystyrène, chaque type de bille de polystyrène étant différencié des autres
types
de bille de polystyrène au moyen d'un marqueur fluorescent et comprenant des
billes de polystyrène porteuses d'antigènes HLA de classe I et d'antigène HLA
de
classe II distincts. En pratique, chaque type de bille de polystyrène présente
en
surface des billes de polystyrène jusqu'à six antigènes HLA-A (classe I), six
antigènes HLA-B (classe I), six antigènes HLA-C (classe I), ou six antigènes
HLA-
DQ (classe II), six antigènes HLA-DR (classe II), six antigènes HLA-DP (classe
II).
Le kit de laboratoire (Labscreen mixed ) comprend 12 types
de billes de polystyrène classe I et 5 types de billes de classe II dont
l'intensité de
fluorescence de chacun des 17 types de billes de polystyrène est susceptible
d'être
mesurée simultanément. Ainsi, on calcule la moyenne de l'intensité de
fluorescence
de chacun des types de billes de polystyrène liée à un même ensemble
d'antigènes
HLA. Au sein de ce mélange de billes de polystyrène, certaines sont dépourvues
d'antigène HLA de classe I et d'antigène HLA de classe II et servent de
contrôle
négatif.
L'utilisation du kit de laboratoire (Labscreen mixed )
nécessite en outre un sérum témoin négatif (LabScreen Negative Control (LSNC)
serum) lors de la réaction de dépistage des anticorps anti-HLA. Ce sérum est
caractérisé par le fabriquant comme étant dépourvu d'anticorps anti-HLA de
classe
I et d'anticorps anti-HLA de classe II.
Les valeurs moyennes de l'intensité de fluorescence observée
sur une durée de cinq mois associée à chacun des 12 types de billes porteuses
d'antigènes de classe I et à chacun des 5 types de billes porteuses
d'antigènes de
classe II traitées avec un tel contrôle négatif sont données au tableau 1 ci-
après.
CA 02862287 2014-07-22
32
WO 2013/121157 PCT/FR2013/050315
Classe d'Ag
HLA Numéro de bille Moyenne de fluorescence Ecart-type
reconnue
6 79,82 30,26
7 110,87 39,45
88 118,09 30,31
17 94,16 38,98
69 136,93 54,01
79 136,67 49,73
Classe I
84 109,79 35.61
86 102,07 27,77
87 119.96 32,50
88 100,67 30,04
89 90,89 25,85
90 157,12 73,60
91 112,79 35,91
93 143,52 39,21
Classe II 95 104,89 34,79
96 153,14 55,02
97 117,61 46,14
Tableau 1
Les valeurs présentées au tableau 1 sont faibles et traduisent la
fluorescence générée par la liaison non spécifique des IgG sur les billes de
polystyrène, et la liaison non spécifique de l'anticorps secondaire sur ces
billes.
Contrôle positif
Le kit de laboratoire (Labscreen mixed ) comprend, à titre de
contrôle positif, des billes de polystyrène en surface desquelles sont
greffées des
IgG humaines purifiées. Un tel contrôle positif est limité dans son
utilisation à la
vérification de la fonctionnalité de l'anticorps secondaire. Un tel contrôle
positif ne
permet pas la conversion d'une valeur d'intensité de fluorescence en une
valeur de
concentration d'anticorps anti-HLA dans un milieu liquide.
CA 02862287 2014-07-22
33
WO 2013/121157 PCT/FR2013/050315
Contrôle positif polyclonal
Les utilisateurs du kit (Labscreen mixed ) -notamment les
laboratoires d'immunologie- préconisent d'utiliser, à titre de contrôle
positif lors du
dépistage des anticorps anti-HLA in vitro selon l'état de la technique, un
mélange de
sérums provenant d'individus polyimmunisés contre les antigènes HLA. A titre
d'exemple, les valeurs moyennes de l'intensité de fluorescence mesurée sur une
période de 5 mois associée à chaque type de billes HLA de classe I et de
classe II de
ce contrôle polyclonal sont données dans le tableau 2 ci-après.
Classe d'Ag
HLA Numéro de bille Moyenne de fluorescence Ecart-type
reconnue
6 3821,21 1980,68
7 5313,44 2261,91
88 4103,80 1812,89
17 3808,23 1726,83
69 2699,31 1759,92
79 2316,98 1341,26
Classe I
84 2437,50 1672,73
86 3163,40 1765,90
87 1836,57 1379,55
88 2082,32 1364,82
89 15691,55 1791,89
90 15158,40 2072,65
91 14433,92 2197,01
93 13343,17 2492,20
Classe II 95 14550,62 2162,28
96 207,17 232,44
97 589,34 670,31
Tableau 2
La valeur calculée de la fluorescence moyenne mesurée sur
les billes HLA de classe I traitées avec un contrôle qualitatif selon l'état
de la
CA 02862287 2014-07-22
34
wo 2013/121157 PCT/FR2013/050315
technique est de l'ordre de 5200 unités de fluorescence et l'écart type est de
l'ordre
de 4900 unités de fluorescence.
La valeur calculée de la fluorescence moyenne mesurée sur
les billes HLA de classe II traitées avec un contrôle qualitatif selon l'état
de la
technique est de l'ordre de 8600 unités de fluorescence et l'écart type est de
l'ordre
de 7500 unités de fluorescence.
L'intensité de fluorescence de chacun des types de bille de
polystyrène du contrôle qualitatif varie entre 1000 et 20000. Une telle
variabilité de
la réponse de chacun des types de billes de polystyrène (HLA-A, HLA-B, HLA-C,
HLA-DQ, HLA-DR et HLA-DP) ne permet pas de définir une courbe unique de
conversion de l'intensité de fluorescence mesurée en une concentration
d'anticorps
anti-HLA de référence. En outre, une telle courbe de conversion de l'intensité
de
fluorescence mesurée ne peut être obtenue, compte tenu du fait que la
concentration
en anticorps HLA spécifique de chacun des types d'antigène HLA ne peut être
déterminée dans le contrôle qualitatif de l'état de la technique.
A titre d'exemple d'un contrôle qualitatif de l'état de la
technique, une analyse de la fluorescence de chaque type de bille de
polystyrène du
kit Labscreen mixed montre que la fluorescence associée à chaque type de
bille
porteur d'un antigène de classe I (type de bille n 6, 7, 8, 17, 69, 79, 84,
86, 87, 88,
89 et 90 en figure 4A) varie entre une valeur de l'ordre de 7000 unités de
fluorescence moyenne et 12000 unités de fluorescence moyenne. La valeur
moyenne des intensités de fluorescence mesurée sur chaque type de bille HLA de
classe I est de l'ordre de 9600 unités de fluorescence. La valeur de l'écart
type de
ces valeurs est de l'ordre de 3100 unités de fluorescence.
En outre, cette analyse de la fluorescence de chaque type de
bille de polystyrène du kit Labscreen mixed montre que la fluorescence
associée à chaque type de bille porteur d'un antigène de classe II (type de
bille n
91, 93, 95, 96 et 97 en figure 4B) varie entre une valeur de l'ordre de 1000
unités de
fluorescence moyenne et 19000 unités de fluorescence moyenne. La valeur
moyenne des intensités de fluorescence mesurée sur chaque type de bille HLA de
CA 02862287 2014-07-22
WO 2013/121157 PCT/FR2013/050315
classe II est de l'ordre de 13000 unités de fluorescence. La valeur de l'écart
type de
ces valeurs est de l'ordre de 8300 unités de fluorescence.
Un tel contrôle est donc limité dans son utilisation à une
analyse purement qualitative dès lors que la concentration de chaque anticorps
dans
5 le mélange de sérum n'est pas connue.
Immunoglobuline chimérique monoclonale selon l'invention
On utilise, à titre de contrôle quantitatif du kit de laboratoire
(Labscreen mixed ), une immunoglobuline chimérique monoclonale selon
l'invention. On prépare des solutions d'une immunoglobuline chimérique
10 monoclonale anti-HLA de classe I (Hu-Ig 1 K [W6/32]) et/ou anti-HLA de
classe II
(Hu-Igl K [F3.3]) telles que décrites aux exemples 1 à 4 à une concentration
connue
de 2 pig/mL. On réalise une analyse de l'intensité de fluorescence moyenne
associée
à chaque type de bille de polystyrène porteur d'un antigène-HLA de classe I ou
de
classe II. Les résultats obtenus sont présentés en figure 4 (histogrammes
blancs).
15 On observe, pour chaque type de bille de polystyrène du
kit Lab screen mixed une intensité de fluorescence de l'ordre de 22000
unités
de fluorescence moyenne.
En particulier, cette analyse montre que :
- la fluorescence associée à chaque type de bille porteur d'un
20 antigène de classe I (type de bille n 6, 7, 8, 17, 69, 79, 84, 86, 87,
88, 89 et 90 en
figure 4A, histogrammes pleins) est sensiblement constante et de l'ordre de
22000
unités de fluorescence moyenne. La valeur moyenne des intensités de
fluorescence
mesurée sur chaque type de bille HLA de classe I est de l'ordre de 21500
unités de
fluorescence. La valeur de l'écart type de ces valeurs est de l'ordre de 450
unités de
25 fluorescence ;
- la fluorescence associée à chaque type de bille porteur d'un
antigène de classe II (type de bille n 91, 93, 95, 96 et 97 en figure 4B,
histogrammes pleins) est sensiblement constante et de l'ordre de 22000 unités
de
fluorescence moyenne. La valeur de l'écart type de ces valeurs est de l'ordre
de 700
30 unités de fluorescence.
CA 02862287 2014-07-22
36
WO 2013/121157 PCT/FR2013/050315
Cette valeur d'intensité de fluorescence est sensiblement
constante quelle que soit le type de bille de polystyrène (quel que soit
l'antigène
HLA porté par le type de bille de polystyrène) et correspond à une
concentration en
anticorps de 2 pig/mL. De tels anticorps monoclonaux chimériques selon
l'invention
sont adaptés pour permettre un étalonnage quantitatif de la réponse en
fluorescence
en fonction de la concentration en anticorps monoclonaux chimériques selon
l'invention.
A titre comparatif de l'invention (histogrammes pleins en
figure 4A et 4B) et de l'état de la technique (histogrammes hachuré en figure
4A et
4B), les valeurs de la fluorescence moyenne (et écart-type) relevée sur les
billes
porteuses d'antigènes HLA de classe I et sur les billes porteuses d'antigènes
HLA
de classe II sont représentées en figure 4.
EXEMPLE 6 ¨ Procédé de quantification in vitro des
anticorps anti-HLA ¨ Courbes Dose/réponse
Pour réaliser une courbe dose/réponse , on distribue dans
chacun des puits d'une plaque multi-puits à micro filtre (Multiscreen ) 300
luiL d'un
tampon de lavage (PBS). Après 10 minutes on élimine par aspiration le tampon
de
lavage et on ajoute 5 luiL de suspension homogénéisée de billes
Labscreen mixed . Une gamme de solutions d'anticorps monoclonaux
chimériques selon l'invention de concentrations en anticorps monoclonaux
chimériques décroissantes est obtenue par des dilutions successives sériées.
Les
contrôles négatif et positif sont traités de la même façon en parallèle. On
distribue
20 lut de chacune de ces dilutions sériées en contact des billes de
polystyrène
préalablement placées dans les puits de la plaque de multi-puits. Les mélanges
de
billes de polystyrène et des anticorps monoclonaux chimériques sont incubés à
température ambiante et à l'abri de la lumière pendant 30 minutes. A l'issue,
on
réalise cinq lavages successifs de chacun des puits avec 250 lut d'un tampon
de
lavage. On ajoute ensuite 100 lut d'une solution d'anticorps secondaire dilué
au
1/100ème. Les anticorps secondaires utilisés pour le marquage fluorescent des
anticorps anti-HLA liés aux billes de polystyrène sont, par exemple, des
anticorps
de chèvre anti-IgA couplé à la phycoérythrine (anti-IgA-PE, AbSerotec, USA) ou
CA 02862287 2014-07-22
37
WO 2013/121157 PCT/FR2013/050315
les anticorps de chèvre anti-IgG couplé à la phycoérythrine (anti-IgG-PE,
InGen,
USA). Bien entendu, tout autre groupement fluorescent couplé à un anticorps
susceptible de reconnaître et de se lier aux chaînes constantes de
l'immunoglobuline
chimérique monoclonale selon l'invention peut être utilisé. Les plaques multi-
puits
sont placées pendant 30 min à l'abri de la lumière et à la température
ambiante
avant analyse dans un lecteur d'immunofluorescence Luminex .
Des courbes d'étalonnage du type dose/réponse obtenues
par un procédé selon l'invention sont représentées en figures 6 (anti-HLA
classe I)
et 7 (anti-HLA classe II). La valeur de l'intensité de fluorescence est donnée
en
fonction de la concentration en immunoglobuline chimérique monoclonale selon
l'invention exprimée en luig/mL.
Les valeurs moyennes et les écart-types de la mesure
d'intensité de fluorescence mesurée sur chaque type de billes HLA de classe I
(figure 6B) et HLA de classe II (figure 7B) sont reprises dans le tableau 3 ci-
après.
Anticorps, HLA de classe I HLA de classe II
lui g /mL Moyenne Ecart-type Moyenne Ecart-type
5 .10-4 589,25 31,15 316,30 29,6
2 .10-3 1433,18 103,03 1086,38 72,15
7,8. 10-3 3028,43 143,22 3518,68 145,09
3,13. 10-2 7781,63 342,02 9129,82 273,56
1,25. 10-1 15190,29 685,49 17955,55 298,79
5 .10-1 20548,53 441,7 22755,75 160,45
2.10 22621,17 255,88 23578,19 167
Tableau 3
On réalise une analyse statistique par régression non linéaire
sigmoïde de type Boltzmann des données relatives aux courbes de titration
décrites
ci-dessus. On détermine la valeur minimale de fluorescence observée (MIN)
c'est-à-
dire la valeur de l'asymptote à la courbe lorsque la concentration en
immunoglobuline chimérique monoclonale tend vers la valeur 0, la valeur
maximale
de fluorescence observée (MAX) c'est-à-dire la valeur de l'asymptote à la
courbe
lorsque la concentration en immunoglobuline chimérique monoclonale tend vers
la
CA 02862287 2014-07-22
38
WO 2013/121157 PCT/FR2013/050315
valeur infinie et la valeur de la concentration en immunoglobuline chimérique
monoclonale correspondant à 50% du signal spécifique (MAX ¨ MIN). Ces valeurs
sont données dans le tableau 4 ci-après.
Immunoglobuline chimérique MIN MAX (MAX-MIN)*50%,
monoclonale lui g/mL
Anti-Classe I 65 22400 0,06
Anti-Classe II 88 24600 0,05
Tableau 4
EXEMPLE 7 ¨ Analyse de la stabilité des immunoglobulines
chimériques monoclonales Hu-IgG1 K [W6/32] et Hu-IGg 1 K 1F3.3] selon
l'invention dans un milieu tampon albumineux.
On prépare des dilutions sériées des immunoglobulines
chimériques monoclonales selon l'invention conservées pendant une durée de
deux
mois dans un milieu tampon aqueux contenant de l'albumine humaine à une
concentration de 60 g/L. On réalise des courbes dose/réponse telles que
décrites
à l'exemple 6 par la technique Luminex . Les résultats obtenus avec
l'immunoglobuline chimérique monoclonale dirigée contre les antigènes HLA de
classe I (Hu-IgG1 K [W6/32]) sont présentés en figure 8A et les résultats
obtenus
avec l'immunoglobuline chimérique monoclonale dirigée contre les antigènes HLA
de classe II (Hu-IgG1 K [F3.3]) sont présentés en figure 8B. Les résultats
obtenus
avec les immunoglobulines chimériques monoclonales conservées dans le tampon
salin sont identifiés par des carrés blancs (o) et les résultats obtenus avec
les
immunoglobulines chimériques monoclonales conservés dans le tampon
albumineux sont identifiés par des losanges noirs (*). Aucune différence
significative n'est observée entre les immunoglobulines chimériques
monoclonales
conservées en tampon salin et les immunoglobulines chimériques monoclonales
conservées en tampon albumineux.