Note: Descriptions are shown in the official language in which they were submitted.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
1
UTILISATION DE PLL POUR AMELIORER LA STABILITE DE MOLECULES EN SOLUTION
La présente invention a pour objet un complexe moléculaire particulier
comprenant un
conjugué à base de polylysine (PLL) et une molécule instable en solution. Elle
vise également
une composition comprenant un tel complexe, un procédé d'obtention et son
utilisation.
L'invention a aussi pour objet l'utilisation d'un ou plusieurs conjugués à
base de PLL pour
améliorer le caractère hydrophile et l'efficacité! l'activité d'une molécule
instable en solution
sur une période de temps compatible avec l'utilisation de ladite molécule.
La présente invention concerne également un procédé d'identification d'un
conjugué ou
d'une combinaison de plusieurs conjugués à base de PLL permettant d'améliorer
le caractère
hydrophile et l'efficacité / l'activité d'une molécule instable en solution
ainsi qu'un kit pour sa
mise en oeuvre.
Un grand nombre de macromolécules d'intérêt général, en particulier dans le
domaine
pharmaceutique, cosmétique, nutritionnel ou du diagnostic, sont instables en
solution, peu
solubles ou insolubles. Elles perdent, partiellement ou en totalité, leur
activité en solution et
deviennent donc difficilement utilisables ou même totalement inutilisables
alors qu'elles
présentent une activité pharmacologique, cosmétique, nutritionnelle et/ou de
diagnostic.
Les raisons d'une telle instabilité en solution sont diverses mais résultent
généralement de
l'inaptitude de la molécule à conserver un équilibre entre différentes
interactions stabilisantes
et son entropie structurelle qui tend à déstabiliser l'ensemble.
Cette instabilité a des répercussions importantes en particulier pour
l'industriel ayant investi
des moyens dans un programme de recherche et développement aboutissant à cette
molécule inutilisable, mais également pour les personnes privées de ses effets
bénéfiques.
Les solutions techniques qui sont actuellement connues pour pallier ce
phénomène
d'instabilité, sont souvent très onéreuses, nécessitent un temps de
développement
considérable et sont aussi peu adaptées à une utilisation thérapeutique,
cosmétique,
nutritionnelle ou comme réactif de diagnostic de la molécule.
Par exemple, les solutions instables de molécules à visée pharmaceutique sont
généralement
conservées à des températures avoisinant les -80 C. Elles doivent être
réchauffées et
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
2
administrées à un patient sous traitement. Ceci présente en outre un
inconvénient majeur lié
aux dépenses énergétiques nécessaires au maintien d'une température de
stabilisation de -
80 C, un problème logistique lié à la synchronisation nécessaire entre les
étapes de
réchauffement de la solution en prenant soin d'éviter la précipitation de la
molécule, donc
l'incertitude quant à la quantité réelle de molécule active administrée, et la
voie
d'administration pour les produits pharmaceutiques.
Par ailleurs, des méthodes de stabilisation de macromolécules sont déjà
connues telles que la
micro-encapsulation, la formation de nanoparticules ou encore la
vectorisation, mais ces
méthodes ne sont pas non plus satisfaisantes.
.. La micro-encapsulation est un procédé par lequel un produit, solide,
liquide ou pâteux, est
incorporé dans des microparticules. Dans le domaine de la santé on utilise les
microparticules
afin de réaliser un dépôt d'une quantité de médicament qui se libère lentement
dans
l'organisme. Ce système, bien qu'efficace dans certains cas pour stabiliser et
libérer une
molécule d'intérêt in-vivo, est incapable de la stabiliser en solution liquide
ex-vivo si celle-ci
est instable en solution. En outre, les polymères généralement utilisés pour
la formation de
ces microcapsules sont les dérivés des acides lactique et glycolique (PLGA,
PLA), l'éthyl-
cellulose, ou la poly-epsilon-caprolactone qui sont biodégradables et
susceptibles de laisser
des traces polluantes'> pour le receveur et l'environnement.
Les nanoparticules sont utilisées en recherche biomédicale et en médecine. Les
nanoparticules sont des particules ultrafines dont une des trois dimensions
est inférieure à
100 nm. Cette technologie, outre son coût généralement prohibitif, présente un
certain
nombre de limitations et d'inconvénients. En effet, la synthèse de ces
produits doit être
parfaitement reproductible, leurs propriétés physico-chimiques doivent être
étudiées en
profondeur et avec grande précision, la surface des nanoparticules doit le
plus souvent être
.. recouverte de molécules ou polymères permettant d'en augmenter la stabilité
colloïdale et la
biocompatibilité. Enfin, les mécanismes de dégradation des nanoparticules
doivent également
être étudiés de manière approfondie, et les risques de toxicité cellulaire,
physiologique et
histologique doivent être sérieusement évalués. L'utilisation de la
nanotechnologie implique
donc des risques physiques non négligeables pouvant être à la fois des risques
.. environnementaux et des risques pour la santé des personnes qui les
utilisent mais aussi des
personnes qui manipulent les nanoparticules pendant leur production. D'autres
inconvénients
sont liés au fait que l'exposition aux nanoparticules doit être réduite et/ou
contrôlée par une
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
3
traçabilité qui doit permettre à tout moment de savoir où se trouvent les
nanoparticules, dans
quel produit, dans quel emballage.
Ainsi, les méthodes connues, bien que permettant dans une certaine proportion
de
stabiliser une macromolécule in-vivo , c'est-à-dire notamment d'accroitre sa
biodisponibilité et sa stabilité vis-à-vis de sa dégradation par des enzymes
et autres protéines
telles que les protéases, les lipases et les glucosidases par exemple, sont
incapables de
stabiliser une macromolécule ex-vivo , c'est-à-dire notamment :
- d'une part, de maintenir la macromolécule en solution (sans qu'elle ne
précipite) en
phase liquide, par exemple pour une solution principalement aqueuse, à une
température
.. supérieure à environ 0 C pendant une durée suffisamment longue (pouvant
aller jusqu'à
plusieurs mois ou années) pour permettre une manipulation aisée de la
macromolécule en
solution et son stockage en phase solide (sous forme congelée) mais aussi en
phase liquide
(par exemple à température ambiante),
- et d'autre part, de maintenir également son activité en phase solide et en
phase
liquide, à une température supérieure à 0 C, pendant toute la durée de son
stockage (pouvant
aller jusqu'à plusieurs mois ou années).
En général, une macromolécule d'intérêt formulée avec l'une quelconque des
méthodes de
l'état de la technique n'est stable en solution liquide ex-vivo que pendant
très peu de temps,
de quelques secondes à quelques minutes, voire quelques heures.
II existe donc un besoin important en un système alternatif permettant, non
seulement de
conserver les avantages d'une bonne vectorisation de la macromolécule in-vivo,
mais
également, la stabilisation de la macromolécule en solution liquide ex-vivo
afin d'améliorer
son stockage et sa manipulation.
Il existe également un besoin tout aussi important pour un système palliant au
moins l'un des
inconvénients précités en référence aux systèmes déjà connus, en particulier
un système :
- permettant la stabilisation dans une solution d'une molécule instable en
solution, de
préférence à une température où la solution est en phase liquide et pendant
une durée
suffisamment longue pour permettre la manipulation et/ou le stockage de la
macromolécule,
- permettant le maintien de l'activité, notamment de l'activité biologique,
d'une
molécule instable en solution même sous forme complexée,
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
4
- permettant le maintien de l'activité en solution, notamment de l'activité
biologique,
d'une molécule instable en solution de préférence à une température où la
solution
est en phase liquide et pendant une durée suffisamment longue pour permettre
la
manipulation et/ou le stockage de la macromolécule,
- ne possédant pas de caractère d'immunogénicité,
- facile à mettre en oeuvre,
- peu coûteux à mettre en oeuvre,
- permettant de protéger la molécule instable en solution, de
l'inactivation chimique,
biochimique, enzymatique ou immunologique que la molécule est susceptible de
subir,
- permettant d'améliorer la pharmacocinétique et notamment permettant une
libération contrôlée de la molécule instable en solution, et donc de garder sa
concentration dans la zone d'efficacité thérapeutique,
- pas ou peu toxique pour l'environnement,
- permettant la réduction des effets secondaires non désirés de la molécule
évitant des
phénomènes de métabolisme, d'élimination ou de toxicité,
- permettant de réduire les effets toxiques, tout en assurant la délivrance
d'une quantité
suffisante de la molécule dans le site actif,
- permettant une libération sélective et spécifique de la macromolécule,
par
l'intermédiaire des ligands susceptibles d'interagir avec des cellules cibles,
- permettant le maintien de l'activité pharmacologique, cosmétique,
nutraceutique ou
autre de la molécule lorsqu'elle est utilisée.
Pour y répondre la présente invention vise un complexe moléculaire non
covalent comprenant
au moins un conjugué, préférentiellement un conjugué nnonofonctionnel, d'une
PLL.
L'utilisation d'un tel conjugué avec une molécule instable en solution permet
d'améliorer la
solubilité de la molécule, sa stabilité et de prolonger et/ou maintenir
l'activité de la molécule
en solution.
Les conjugués de PLL sont connus en particulier pour leur utilisation dans le
domaine
pharmaceutique. La demande de brevet internationale W096/15810 notamment,
divulgue
l'utilisation de ces conjugués pour la préparation de compositions
pharmaceutiques utiles
dans le traitement de la dégénérescence neuronale, l'autoimmunité, la
prolifération cellulaire
maligne.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
Néanmoins ces conjugués n'ont jamais été utilisés pour former des complexes
moléculaires
via des liaisons non covalentes avec des molécules instables en solution pour
améliorer leur
stabilité en solution et prolonger ou maintenir leur activité.
C'est l'objet de l'invention qui vise un complexe moléculaire comprenant :
5 o au moins un conjugué PLL, comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire compris entre 50
Daltons et 1000 Daltons, liée de façon covalente à ladite chaîne
principale,
o au moins une molécule M instable en solution,
le ou les conjugué(s) et la ou les molécule(s) M étant liés / interagissant
par liaison non
covalente.
L'invention a également pour objet un procédé d'obtention d'un tel complexe,
des
compositions le contenant et son utilisation.
L'invention vise aussi l'utilisation d'au moins un conjugué PLL, comprenant :
= une chaîne principale linéaire de PLL, et
= au moins une molécule F ayant un poids moléculaire compris entre 50
Daltons et 1000 Daltons, liée de façon covalente à ladite chaîne
principale,
dans une solution hydrophile, pour améliorer la stabilité en solution d'une
molécule M
instable en solution, en formant un complexe moléculaire avec cette molécule M
par une
liaison non covalente. L'invention a aussi pour objet un kit pour la mise en
oeuvre de cette
utilisation.
Enfin, l'invention se rapporte également à un procédé d'identification d'un
moins un conjugué
PLL capable de se lier de façon non covalente à une molécule M donnée instable
en solution,
ainsi qu'un kit pour la mise en oeuvre de ce procédé.
D'une manière générale, l'invention permet de stabiliser en solution une
molécule M sous
forme d'un complexe moléculaire. En effet, de façon inattendue et surprenante
l'invention
permet de donner une seconde "vie" à de nombreuses molécules instables en
solution, en
particulier des macromolécules, notamment des macromolécules d'intérêts
thérapeutiques,
délaissées ou non-utilisées à leur juste valeur, en combinant ladite molécule
avec un ou
plusieurs conjugué(s) à base de PLL sélectionnée(s) en fonction de la molécule
étudiée.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
6
Contre toute attente, il a été montré que les molécules qui étaient instables
en solution,
généralement en solution à caractère hydrophile et principalement aqueuse,
peuvent, grâce
à la présence de certains conjugués PLL, être stockées/maintenues en solution
liquide, c'est
à-dire par exemple à une température supérieure à 0 C pour les solutions
principalement
aqueuses, et même à température ambiante, pendant plusieurs jours, mois et
même
probablement années, sans perte notable de leur activité pharmacologique
initiale ou de l'une
ou l'autre de leurs propriétés.
De manière toute aussi surprenante, les complexes de l'invention ainsi formés
et stables ex-
vivo, peuvent aussi être directement utilisés invivo dans des applications
thérapeutiques,
cosmétiques, nutritionnelles, chirurgicales ou diagnostiques, et notamment
être administrés
à un patient, sans qu'il n'y ait de problèmes particuliers liés à la toxicité.
En ces termes, les
complexes de l'invention peuvent également agir en tant que vecteurs
thérapeutiques,
protégeant in-vivo la molécule M complexée contre les attaques, notamment, des
systèmes
métaboliques enzymatiques et immunitaires du corps humain ou animal.
D'autres avantages et caractéristiques de l'invention ressortiront de la
description détaillée
qui va suivre, faite en regard d'exemples non limitatifs et de figures
annexées sur lesquelles :
- la figure 1A représente le spectre IRFT obtenu pour le conjugué cystéine-G-
PLL selon
l'invention ; sur cette figure on peut observer la PLL identifiée par la zone
1700-1550 cm-1 et
la cystéine représentée par les pics vers 1300 et 700 cm-1,
- la figure 1B représente le spectre IRFT obtenu pour le conjugué méthionine-G-
PLL
selon l'invention ; sur cette figure on peut observer la PLL identifiée par la
zone 1700-1550 cm
-
1 et la méthionine représentée par les pics vers 1300, 900 et 700 cm-1,
- la figure 1C représente le spectre IRFT obtenu pour le conjugué
glutathion-G-PLL
selon l'invention ; sur cette figure on peut observer la PLL identifiée par la
zone 1700-1550
cm-1 et la glutathion représentée par les pics vers 1300 et 1200 cm-1,
- la figure 1D représente le spectre IRFT obtenu pour le conjugué taurine-G-
PLL selon
l'invention ; sur cette figure on peut observer la PLL identifiée par la zone
1700-1550 cm-1 et
la taurine représentée par les pics vers 1300, 1000 et 700 cm-1,
- la figure lE représente le spectre IRFT obtenu pour le conjugué orotyl-
PLL selon
l'invention. Sur cette figure on peut observer la PLL identifiée par la zone
1700-1550 cm-1 et
la orotyl représentée par les pics vers 1300 et 800 cm-1,
- la figure 2 représente la structure protéique du facteur VIII par étude
in silico,
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
7
- la figure 3 représente la structure protéique de l'hémoglobine par étude in
silico,
- la figure 4 représente la structure protéique de l'albumine par étude in
silico.
DEFINITIONS
Au sens de la présente invention, on entend par complexe ou complexe
moléculaire , une
entité formée par la mise en contact d'une molécule M instable en solution et
d'un ou
plusieurs conjugué(s) d'une PLL lié(s) par liaison non covalente.
Au sens de l'invention, on entend par conjugué PLL , une molécule issue d'un
couplage
covalent sur une PLL, d'une ou plusieurs molécules F. Par conjugué
monofonctionnel de PLL ,
on entend le produit de couplage d'une molécule F à la PLL. Par conjugué
polyfonctionnel de
PLL , on entend le produit de couplage d'au moins deux molécules F. Par
exemple, un
conjugué bifonctionnel peut être représenté par la formule : molécule F1 - PLL
- molécule F2.
Au sens de l'invention, on entend par molécule F un substituant ou une
molécule non-
immunogénique.
On entend par substituant une molécule de faible poids moléculaire
généralement compris
entre environ 50 Daltons et environ 1000 Daltons, de préférence compris entre
environ 200
Daltons et environ 600 Daltons, et de préférence encore compris entre environ
150 Daltons
et environ 500 Daltons, pouvant être liée par liaison covalente ou interagir
par liaison
covalente à une PLL en position epsilon (E)-aminé de la chaîne carbonée.
On entend par immunogénique toute molécule capable d'induire une réaction
immunitaire.
Une molécule non immunogénique est donc une molécule qui n'induit pas de
réaction
immunitaire.
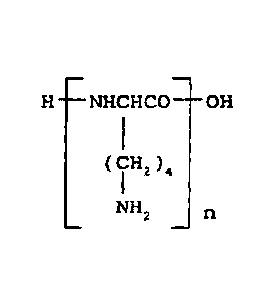
Au sens de la présente invention, on entend par PLL ou polylysine un
polypeptide ou
homopolymère constitué principalement de L ou D-Lysine linéaire (c'est-à-dire
non-ramifiée
par une autre ou d'autres lysines) ou principalement de L-lysine linéaire.
Elle répond à la
formule :
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
8
H ¨NHCHCO-- OH
i
(Cil-12 )4
I
NHz n
¨ ¨
(cf Merck Index, 10ème édition, abrégé N 7444).
Au sens de l'invention, on entend par molécule M instable en solution une
molécule
instable en solution, préférentiellement une macromolécule. Il peut s'agir
notamment d'une
protéine, d'un lipide, d'un sucre, d'un acide nucléique ou de toute autre
biomolécule de
grande taille ; Par instable en solution on entend une molécule présentant
une diminution
ou une perte d'activité lorsqu'elle est mise en solution dans un solvant,
notamment dans un
solvant aqueux. Il peut s'agir de molécules hydrophobes ou peu hydrophiles, ou
de molécules
hydrophiles mais dont l'activité est diminuée en solution.
Au sens de la présente description, on entend par liaison non-covalente
toute liaison qui
n'est pas covalente, notamment une liaison de type ionique, hydrogène, ou Van
Der Waals.
Au sens de l'invention on entend par activité pharmacologique ou biologique
la
conséquence observée que peut avoir l'absorption d'une molécule ou d'une
substance par un
organisme telle qu'obtenue par une méthode d'analyse permettant la détection
d'une telle
activité. Celle-ci peut être évaluée, par exemple, en observant et évaluant
l'occupation
sélective d'un récepteur ou l'interaction spécifique avec une enzyme ou
protéine (e.g.
l'interaction antigène-anticorps) de la molécule ou substance d'intérêt. Dans
le cadre de la
présente demande, la diminution ou la perte de l'activité pharmacologique
d'une substance
ou macromolécule d'intérêt en solution liquide est une indication de
l'instabilité de ladite
substance en solution liquide.
Au sens de la présente invention, on entend par activité biologique initiale
ou activité
pharmacologique initiale , l'activité biologique ou pharmaceutique d'un
complexe selon
l'invention telle que mesurée pour la première fois après sa mise en solution.
Le temps écoulé
entre la mise en solution du complexe et la première mesure d'activité peut
être variable et
sujet à l'influence de divers paramètres dont notamment la rapidité
d'exécution de la prise de
mesure qu'elle soit automatisée ou manuelle. Pour améliorer la
reproductibilité de
l'expérimentation, on pourra standardiser la prise de la première mesure qui
pourra être
effectuée, par exemple, environ au moins 3 minutes, de préférence environ 15
minutes, après
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
9
la mise en solution du complexe selon l'invention. On entend par activité
biologique
d'origine ou activité pharmacologique d'origine l'activité biologique ou
pharmacologique
d'une molécule avant sa mise en contact (i.e. sa complexation) avec un ou
plusieurs conjugués
tels que définis dans la présente demande. On entend par variation de
l'activité
pharmacologique ou biologique , la valeur absolue de la différence entre la
valeur observée
et mesurée de l'activité initiale et la valeur observée et mesurée de
l'activité à un instant t
après la mise en solution de la macromolécule. On entend par maintien de
l'activité
pharmacologique ou biologique , une variation de l'activité pharmacologique ou
biologique
telle que définie ci-dessus d'au plus 30%, de préférence d'au plus 20%, de
préférence d'au
plus 10%, de préférence encore d'au plus 5% ou bien encore d'au plus 1%.
Au sens de la présente invention, on entend par solvant aqueux un solvant
principalement
ou essentiellement aqueux, c'est-à-dire contenant au moins environ 70% d'eau,
de préférence
au moins environ 80% d'eau et de préférence encore au moins environ 90% d'eau
ou bien
encore au moins environ 95% d'eau.
Au sens de l'invention, on entend par solution en phase liquide ou solution
à l'état liquide
une solution qui n'a pas atteint son point de congélation. A titre d'exemple,
une solution
aqueuse ou principalement aqueuse conservée à une température inférieure à
environ 0 C,
de préférence inférieure à environ -5 C, ne peut être considérée comme étant
en phase
liquide.
DESCRIPTION DETAILLEE
Complexe moléculaire
Selon un premier aspect, l'invention concerne donc un complexe moléculaire
comprenant :
o au moins un conjugué PLL, comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris
entre 50 Da ltons et 1000 Da ltons, liée de façon covalente à ladite chaîne
principale, et
o au moins une molécule M instable en solution,
le ou les conjugué(s) et la ou les molécule(s) M étant liés par liaison non
covalente, c'est-à-
dire interagissant par liaison non covalente.
Coniuqué PLL
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
Le conjugué PLL peut être nnonofonctionnel ou polyfonctionnel. Un même
complexe s'il
contient plusieurs conjugués PLL, peut contenir uniquement des conjugués
monofonctionnels, uniquement des conjugués polyfonctionnels ou un mélange de
conjugué(s) nnonofonctionnel(s) et polyfonctionnel(s). Préférentiellement le
conjugué PLL est
5 monofonctionnel.
Il comprend une chaîne linéaire de PLL et au moins une molécule F ayant un
poids moléculaire
moyen compris entre 50 et 1000 Daltons. La ou les molécules F sont liée(s) de
façon covalente
à la chaîne principale. Le conjugué PLL peut être constitué exclusivement
d'une chaîne
principale linéaire de PLL et d'au moins une molécule F ayant un poids
moléculaire moyen
10 compris entre 50 Daltons et 1000 Daltons, liée de façon covalente à
ladite chaîne principale.
La chaîne PLL a un poids moléculaire moyen préférentiellement compris entre
2000 et 300000
Daltons, ce qui signifie que son degré de polymérisation (c'est à dire la
valeur de l'indice n de
la formule donnée dans la partie définition) est compris entre environ 15 et
environ 2360 soit
127 résidus lysyl.
Selon un mode de réalisation préféré de l'invention, la chaîne PLL présente
dans le complexe
moléculaire selon l'invention a un poids moléculaire moyen qui est
généralement compris
entre 2000 et 300000 Daltons, ce qui signifie que son degré de polymérisation
est compris
entre environ 15 et environ 2360, préférentiellement entre 20000 et 50000
Daltons ce qui
signifie un degré de polymérisation de 155 et 394 soit entre 155 et 374
lysines. Encore plus
préférentiellement, la chaîne PLL comprend entre 30 et 150 lysines
correspondant à un poids
moléculaire moyen compris entre 3800 et 19100 Daltons, de préférence encore
entre 50 et
100 lysines correspondant à un poids moléculaire moyen pour la chaîne PLL
compris entre
6400 et 13000 Daltons.
La chaîne linéaire principale PLL du conjugué est préférentiellement une
chaîne linéaire alpha.
La molécule F a préférentiellement un poids moléculaire compris entre 100
Daltons et 1000
Daltons, encore plus préférentiellement entre 200 Daltons et 1000 Daltons, en
particulier
entre 300 Daltons et 1000 Daltons, encore plus particulièrement entre 400
Daltons et 1000
Daltons, et de préférence entre 500 Daltons et 1000 Daltons.
Les molécules F sont des substituants ou des molécules non-immunogéniques. Des
molécules
telles que décrites dans la demande de brevet PCT W096/15810 peuvent notamment
être
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
11
utilisées pour la présente invention. Les molécules F sont préférentiellement
choisies dans
l'une des trois catégories suivantes :
- Les molécules à caractère "acide gras ou lipidique", qui comprennent :
* les acides gras mono- ou dicarboxyliques, ci-après communément désignés
par le
terme (di)acide gras, à chaîne linéaire ou ramifiée, saturés ou insaturés,
comprenant
généralement de 4 à 24 atomes de carbone ;
* les composés impliqués dans le mécanisme d'ancrage des protéines aux
membranes
cellulaires, ces composés intervenant notamment dans le cycle du mévalonate,
en particulier
les isoprénoïdes liés à une cystéine ;
* le cholestérol et ses dérivés, notamment les hormones hydrophobes.
- Les molécules à caractère "anti-oxydant", qui comprennent :
* la vitamine A, la vitamine C, la vitamine E ou l'un de leurs dérivés ;
* la cystéine et ses dérivés, de formule : R1S-R2-CH(NH2)-COOH dans
laquelle R1
représente H ou CH3 et R2 représente un C1-C3 alkylène.
-Les molécules à caractère "acide aminé ou neurotransmetteur", qui comprennent
:
* les indolealkylamines ;
* les catécholamines;
* les acides aminés de formule : R3-CH(NH2)-COOH dans laquelle R3
représente
l'hydrogène, un groupe imidazol-2-ylméthyle, un groupe carboxyméthyle ou un
groupe
aminopropyle ;
* les acides amino(C1-05)alkylsulfoniques ou sulfiniques;
* la carnitine ou la carnosine;
* les diamines de formule : 2HN-A-NH2 dans laquelle A représente un (C1-
C6)alkylène
ou un groupe -(CH2)m-NH-B-(CH2)p- dans lequel m et p, indépendamment l'un de
l'autre, sont
des entiers allant de 1 à 5, et B représente rien ou un groupe -(CH2)n-NH-, n
étant un entier
allant de 1 à 5;
* l'acétylcholine et
* l'acide y-aminobutyrique.
On distinguera donc trois sortes de conjugués (qu'ils soient monofonctionnels
ou
polyfonctionnels) : les conjugués "acide gras ou lipidiques"; les conjugués
"anti-oxydants"; et
les conjugués "acides aminés ou neurotransmetteurs".
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
12
Généralement, le (di)acide gras comprend de 4 à 24 atomes de carbone, comme
par exemple
l'acide butyrique, maléique, succinique, glutarique, adipique, pimélique,
subérique,
sébasique, caproïque, caprylique, caprique, laurique, myristique, palmitique,
palmitoléique,
stéarique, oléique, linoléique, [gamma]-linolénique, [alpha]-linolénique,
arachidique,
gadoléique, arachidonique, béhénique, érucique ou azélaïque. De préférence,
l'acide est
choisi parmi l'acide myristique, l'acide palmitique, l'acide stéarique,
l'acide oléique ou le
(di)acide, l'acide azélaïque, par exemple.
Les isoprénoïdes liés à une cystéine comprennent généralement de 6 à 20 atomes
de carbone.
Préférentiellement, on utilise dans le cadre de l'invention le farnésyl-
cystéine, le géranyl-
géra nyl-cystéine ou le mévalonate-cystéine.
Comme hormone hydrophobe, on utilise préférentiellement la progestérone ou le
2-
méthoxyoestradiol.
Comme dérivé de la cystéine, on utilise préférentiellement l'homocystéine ou
la méthionine.
Les indolealkyleamines et catécholamines utilisées dans le cadre de
l'invention comprennent
notamment le tryptophane, le 5-méthoxytryptophane, la sérotonine, la
tryptamine, la 5-
méthoxytryptaminc, la mélatonine, la phénylalanine, la 3,4-
dihydroxyphénylalanine et la
tyrosine.
Comme acides aminés, on utilise de préférence l'histidine, la glycine,
l'aspartate. Les acides
amino(C1-05)alkylsulfoniques ou sulfiniques utilisés selon l'invention
incluent notamment la
taurine, l'homotaurine et l'hypotaurine. Les diamines utilisées de manière
préférentielle dans
le cadre de l'invention sont la putrescine, la cadavérine, la spermine et la
spermidine.
A titre d'exemple non limitatif, on peut citer comme conjugué PLL utilisable
pour la mise en
oeuvre de l'invention l'acide oléique-PLL, l'acide azélaïque-PLL et le 5-
méthoxytryptamine-
PLL.
De préférence, on utilisera une cystéine-PLL, une méthionine-PLL, une taurine-
PLL, une
glutathion-PLL ou une acidethiotique-PLL. Ainsi la ou les molécule(s) F
liée(s) de façon
covalente à la chaîne principale PLL est (sont) choisie(s) parmi la cystéine,
la méthionine, la
thorine, le glutathion et l'acide thiotique.
Selon un mode de réalisation adapté, le rapport massique moléculaire et l'aire
des pics entre
la ou les molécules F et la chaîne principale (déterminé par IRTF) est compris
entre environ 10
et environ 20.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
13
Molécule M instable en solution
La molécule M est préférentiellement une macromolécule, c'est-à-dire une
molécule ayant un
poids moléculaire de préférence supérieur à 1000, préférentiellement à 2000
Daltons, encore
plus préférentiellement supérieur à 5000 Daltons et en particulier supérieure
à 10000 Daltons.
Les molécules M peuvent être organiques et/ou minérales et peuvent être
d'origine naturelle
et/ou synthétique. Préférentiellement il s'agit de molécules organiques.
De préférence les molécules M sont des molécules utiles dans les systèmes
biologiques, de
préférence utiles dans les domaines thérapeutiques, cosmétiques, nutritionnels
et/ou de
diagnostiques. La ou les molécules M sont donc très préférentiellement des
molécules
présentant une activité pharmacologique et/ou nutritionnelle et/ou cosmétique
et/ou est un
réactif de diagnostic.
Préférentiellement, elles appartiennent à la famille des glucides, des
protéines, des lipides,
des protides (aussi dénommés protéines conjuguées) telles que, par exemple,
les
lipoprotéines, les mucoprotéines, les nucléoprotéines, les acides nucléiques
(telles que ADN,
ARN, ARN interférents, ARNt, ARNcyst etc..) et les protéines métalliques
(exemple :
méta I loprotéi nes).
Parmi les molécules M de type glucide, on peut citer les oligosaccharides
(sucres composés de
2 à 10 unités de base de monosaccharides), les polysaccharides. Les exemples
de molécules
M de type oligosaccharide et polysaccharide pouvant être mis en oeuvre dans
l'invention sont
notamment le collagène, la cellulose, l'amidon, le Facteur VIII, des
immunoglobulines.
Parmi les molécules M de type protéine on peut citer notamment, les protéines
de structure
qui permettent à la cellule de maintenir son organisation dans l'espace ; les
protéines de
transport qui assurent le transfert des différentes molécules dans et en
dehors des cellules ;
les protéines régulatrices qui modulent l'activité d'autres protéines ou qui
contrôlent
l'expression des gènes ; les protéines de signalisation qui captent les
signaux extérieurs et
assurent leur transmission dans la cellule ou l'organisme telles que, par
exemple, les protéines
hormonales ; les protéines réceptrices qui détectent les molécules messagères
et les autres
signaux pour que la cellule agisse en conséquence telles que, par exemple, les
protéines
sensorielles et les récepteurs d'hormone comme l'insuline ; les protéines
motrices qui
permettent aux cellules ou organismes ou à certains éléments de se mouvoir ou
se déformer
telles que l'actine et la myosine ; les protéines de défense qui protègent la
cellule contre les
virus telle que par exemple, les anticorps ; les protéines de stockage qui
permettent la mise
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
14
en réserve d'acides aminés pour pouvoir créer d'autres protéines telle que,
par exemple,
l'ovalbumine et les enzymes. Les exemples de molécules M de type protéine
pouvant être mis
en oeuvre dans l'invention sont les immunoglobulines, les protéines de la
coagulation, les
facteurs VIII et IX, l'albumine, etc.
.. Parmi les molécules M de type lipides, on peut citer les acides gras
saturés et insaturés, les
glycérides, (mono, di et tri) et les phospholipides. Les exemples de molécules
M de type lipide
pouvant être mis en oeuvre dans l'invention sont les lipoprotéines par exemple
la lipoproteine
A.
Préférentiellement la molécule M est une protéine.
La ou les molécule(s) M et le ou les conjugué(s) PLL sont liés de façon non
covalente par au
moins une liaison non covalente. Une molécule M et un conjugué PLL peuvent
être liés par
une ou plusieurs liaisons non covalentes.
Selon un mode de réalisation adapté, le rapport entre la concentration
moléculaire du ou des
conjugué(s) et celle de la ou des molécule(s) M est compris entre 1 et 30.
Composition
Selon un autre aspect, l'invention concerne également une composition
comprenant un ou
plusieurs complexe(s) moléculaire(s) selon l'invention en solution dans un
solvant hydrophile,
de préférence choisi parmi l'eau, un tampon phosphate, du sérum physiologique
ou un
mélange de ceux-ci.
Les solvants hydrophiles utiles pour mettre en oeuvre l'invention peuvent être
variés dans la
mesure où ils permettent la mise en solution de la (ou des) molécule(s) M et
du (ou des)
conjugué(s) sélectionné(s).
La composition peut comprendre en plus du ou des complexe(s) moléculaire(s)
selon
l'invention et du solvant hydrophile, au moins un autre composé. Il peut
s'agir par exemple
.. d'un autre composé pharmaceutiquement compatible choisi parmi un excipient,
un
tensioactif, un véhicule, etc.
Procédé d'obtention
Synthèse des conjugués PLL
Les méthodes de couplage entre les molécules F et la PLL, pour l'obtention des
conjugués PLL
selon l'invention sont les méthodes de couplage chimique classiques bien
connues de
l'homme du métier, entre un groupe fonctionnel de chaque molécule et le groupe
fonctionnel
c-amine de la PLL. Ces couplages sont réalisés par l'intermédiaire d'un agent
de couplage,
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
choisi par exemple parmi le glutaraldéhyde, l'anhydride succinique ou
glutarique, les
carbodiimides, le chloroformiate d'éthyle ou l'hexaméthylène diisocyanate. Des
exemples de
telles méthodes de couplage sont notamment celles décrites dans Geffard et
al., C.R. Acad.
Sci. Paris : 295, 797-802, (1982). On peut également associer les molécules à
la PLL par simple
5 adsorption. Des exemples de méthodes de couplage appropriées sont
décrites en détail dans
les préparations ci-après.
A titre illustratif, le couplage entre lesdites molécules et la PLL peut être
effectué entre la
fonction e-amine de la PLL et une fonction carboxylique desdites molécules ou
autres
fonctions chimiques activa bles.
10 Ainsi, dans le cas des acides gras, notamment l'acide myristique,
l'acide palmitique, etc., ainsi
que dans le cas des isoprénoïdes liés à une cystéine, notamment de la farnésyl-
cystéine, la
liaison avec la PLL est effectuée entre une fonction amine de cette dernière
et la fonction
carboxylique des molécules susmentionnées.
De même, dans le cas de la cystéine et de ses dérivés, la liaison avec la PLL
se fait
15 avantageusement entre une fonction amine de cette dernière et la
fonction acide de ces
molécules.
Alternativement, la cystéine et ses dérivés peuvent être préalablement activés
par couplage
avec l'anhydride succinique ou glutarique, la liaison se faisant alors entre
la fonction L-amine
de la PLL et la fonction acide libre de la molécule succinylée ou glutarylée.
Ou bien encore, la
cystéine et ses dérivés peuvent être liés à la PLL par réaction avec le
glutaraldéhyde, la réaction
se faisant notamment comme décrit par Geffard et al., Brain Res. : 294, 161-
165, (1984). Dans
le cas du cholestérol et de ses dérivés, le couplage avec la PLL est
avantageusement réalisé
par l'intermédiaire du groupe hydroxyle du cholestérol.
Dans une variante, le cholestérol et ses dérivés sont adsorbés sur la PLL.
Dans le cas des hormones hydrophobes, le couplage avec la PLL est
avantageusement réalisé
par l'hexa méthylène diisocyanate.
Dans le cas de la vitamine A (acide rétinoïque), la liaison entre cette
molécule et la PLL
s'effectue entre la fonction aminée de cette dernière et la fonction acide de
la molécule.
Dans le cas de la vitamine C (acide ascorbique), la liaison entre cette
molécule et la PLL
s'effectue entre la fonction amine de cette dernière et la fonction oxo de la
molécule.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
16
Dans le cas de la vitamine E ([alpha]-tocophérol), la liaison entre cette
molécule et la PLL
s'effectue entre la fonction aminée de cette dernière et la fonction acide
libre du succinate
acide de la molécule.
Dans le cas des acides anninoalkylsulfoniques ou sulfiniques, notamment la
taurine,
l'homotaurine et l'hypota urine, la liaison entre ces molécules et la PLL
s'effectue par activation
préalable des molécules avec un anhydride d'acide (succinique ou glutarique),
ou bien par
couplage avec le glutaraldéhyde.
Dans le cas des acides aminés, de certains composés indolealkylamines,
notamment le
tryptopha ne, et des catécholamines, on peut effectuer la liaison entre ces
molécules et la PLL
soit directement, soit par couplage avec le carbodiimide, le glutaraldéhyde,
un anhydride
d'acide ou un chlorure d'acide, par exemple le chloroformiate d'éthyle.
Dans le cas des diamines, on peut effectuer la liaison entre ces molécules et
la PLL par
couplage avec le glutaraldéhyde ou un anhydride d'acide. La liaison entre la
carnitine ou la
canosine d'une part, et la PLL d'autre part, s'effectue par couplage avec le
carbodiimide.
Procédé d'obtention du complexe moléculaire selon l'invention
Le complexe moléculaire selon l'invention peut être obtenu par un procédé
comprenant les
étapes suivantes :
o fourniture d'un ou plusieurs conjugués PLL, comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris
entre 50 Da ltons et 1000 Da ltons, liée de façon covalente à ladite chaîne
principale, et
o fourniture d'une ou plusieurs molécules M,
o mise en contact du (ou des) conjugué(s) avec la ou les molécule(s) M dans
des
conditions permettant la formation de liaison(s) non-covalente(s) entre le (ou
les) conjugué(s) et la ou les molécule(s) M.
L"étape de fourniture du (ou des) conjugué(s) comprend préférentiellement la
fourniture
d'une solution comprenant le (ou les) conjugué(s) dans un solvant hydrophile.
De façon préférée l'étape de mise en contact est réalisée à une température
comprise entre
environ 4 C et 25 C et dans une solution tamponnée.
De même, l'étape de fourniture de la ou des molécule(s) M comprend
préférentiellement la
fourniture d'une solution comprenant la ou les molécule(s) M dans un solvant
hydrophile.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
17
Selon un mode de réalisation particulièrement adapté, le temps de mise en
contact du (ou
des) conjugué(s) avec la ou les molécule(s) M est compris entre 1 heure et 24
heures.
Utilisations du complexe moléculaire
Les complexes moléculaires ou les compositions le contenant, peuvent être
utilisés pour
diverses applications, liées en particulier à la nature et à l'efficacité des
molécules M.
Dans le cas d'une molécule M présentant une activité pharmacologique, c'est-à-
dire un actif
pharmacologique, le complexe moléculaire selon l'invention peut être utilisé
en tant que
médicament.
Préférentiellement pour cette utilisation le complexe moléculaire est
administré au sein d'une
composition, en particulier une composition selon l'invention.
Le complexe moléculaire selon l'invention est préférentiellement administré
par voie
intraveineuse, intra musculaire sous cutanée ou orale, spray nasal, buccal ou
auriculaire ou
cutané et solution ophtalmique.
Avantageusement les complexes de l'invention conservent ou améliorent
l'activité
pharmacologique d'origine de la molécule M. La présence de conjugués à base de
PLL n'affecte
donc pas cette activité ex-vivo (ou in-vitro). Il a également été démontré que
leur présence
n'est pas nuisible à l'action de la molécule M in-vivo (i.e. après
administration à un patient).
Par ailleurs, et contre toute attente, la présence des conjugués a également
un effet bénéfique
sur l'activité pharmacologique de la molécule M en améliorant sa
biodisponibilité.
II est donc possible d'utiliser les complexes de l'invention comprenant une
molécule M à visée
thérapeutique en tant que médicament et dans des méthodes de traitement du
corps humain
ou animal par thérapie, chirurgie ou bien dans des méthodes de diagnostique.
La nature du traitement dépendra bien évidemment du type d'activité
pharmacologique de la
molécule M complexée.
A titre d'exemple on peut citer le traitement des troubles de l'hémostase.
Les complexes selon l'invention peuvent être utilisés également en vue
d'améliorer le goût ou
la texture des aliments, de réduire la teneur en lipides, ou d'encapsuler les
nutriments, par
exemple les vitamines des aliments, afin qu'ils ne se dégradent pas au cours
de la durée de
conservation. Par ailleurs, ils peuvent être utilisés en vue de fabriquer des
emballages
permettant de conserver les aliments plus longtemps.
Utilisation des conjugués pour stabiliser des molécules instables en solution
L'invention a également pour objet l'utilisation d'au moins un conjugué PLL,
comprenant :
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
18
= une chaîne principale linéaire de PLL, et
= au moins une molécule F ayant un poids moléculaire moyen compris
entre 50 Da ltons et 1000 Da ltons, liée de façon covalente à ladite chaîne
principale, et
dans une solution hydrophile, pour :
- améliorer le caractère hydrophile, et/ou
- améliorer la stabilité en solution, et/ou
- améliorer et/ou maintenir en solution l'activité pharmacologique
et/ou nutritionnelle
et/ou cosmétique et/ou de diagnostic d'un réactif de diagnostic
d'une molécule M instable en solution, en formant un complexe moléculaire
selon l'invention
par liaison non covalente.
Si la molécule M est une substance active pharmaceutique, le maintien de
l'activité
pharmacologique de la molécule M en solution correspond préférentiellement à
une variation
de l'activité pharmacologique d'au moins 5% par rapport à l'activité
pharmacologique initiale
à une température d'au moins 1 C pendant 1 heure.
L'invention vise également selon une variante, l'utilisation d'au moins un
conjugué PLL,
comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris
entre 50 Da ltons et 1000 Da ltons, liée de façon covalente à ladite chaîne
principale, et
dans une solution hydrophile contenant une molécule M instable en solution non
désirée dans
ladite solution, pour former un complexe moléculaire selon l'invention par
liaison non
covalente et décontaminer ladite solution.
L'invention a également pour objet un kit pour la mise en oeuvre de ces
utilisations. Ce kit
comprend au moins une solution hydrophile comprenant au moins un conjugué PLL
comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris
entre 50 Da ltons et 1000 Da ltons, liée de façon covalente à ladite chaîne
principale.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
19
Procédé d'identification
L'invention vise aussi un procédé d'identification d'un moins un conjugué PLL
capable de se
lier de façon non covalente à une molécule M présentant une activité
pharmacologique,
instable en solution, et de maintenir l'activité pharmacologique de ladite
molécule M dans
une solution hydrophile, ledit procédé comprenant :
a) la fourniture d'une molécule M instable en solution présentant une
activité
pharmacologique ;
b) la fourniture d'au moins un complexe moléculaire comprenant ladite
molécule
M selon l'invention ;
c) la
comparaison entre l'activité pharmacologique initiale et l'activité
pharmacologique dudit ou desdits complexes moléculaires comprenant la molécule
M;
d) l'identification d'un ou plusieurs complexes moléculaires dont
l'activité
pharmacologique en solution en phase liquide est maintenue après la mise en
solution ;
e) l'identification d'un conjugué PLL ou d'une combinaison de plusieurs
conjugués
PLL permettant ledit maintien de l'activité pharmacologique.
Le poids moléculaire de la molécule M est préférentiellement supérieur à 1000
Daltons.
De façon préférée l'étape c) de comparaison est effectuée entre l'activité
pharmacologique
initiale de la molécule M et l'activité pharmacologique du ou des complexe(s)
moléculaire(s)
mesurées plusieurs fois à intervalles de temps déterminés à partir de la
formation du ou des
complexe(s), au moins toutes les 24 heures.
Préférentiellement, l'étape d) d'identification du ou des complexe(s) comprend
en outre :
- la comparaison de l'évolution de l'activité pharmacologique de chaque
complexe
moléculaire testé en fonction du temps ;
-
l'identification du ou des complexe(s) dont la variation d'activité
pharmacologique est
d'au moins 5% par rapport à l'activité pharmacologique de référence de ladite
macromolécule à une température d'au moins 1 C pendant au moins 1 heure.
La méthode d'identification selon l'invention comprend donc préférentiellement
au moins
trois étapes :
- l'étude de la solubilité du (ou des) complexe(s) macromolécule conjugué(s)
en solution,
- la vérification que la macromolécule conserve bien son activité
pharmacologique d'origine,
et
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
- le suivi de l'activité pharmacologique du (ou des) complexe(s) macromolécule-
conjugué(s)
soluble(s), c'est-à-dire ayant validé l'étape précédente au cours du
temps.
Une analyse in-silico telle que celle décrite ci-dessus est facultative mais
avantageuse dans la
plupart des cas car elle permet de restreindre relativement rapidement le
nombre de
5 conjugués possibles à la formation de complexes solubles et donc de
simplifier la suite de
l'analyse d'identification.
La solubilité de la macromolécule en présence du ou des conjugués ou de leurs
mélanges
(éventuellement sélectionnés par la méthode d'analyse in-silico) est étudiée
en solution
liquide. Les méthodes utilisées pour déterminer une telle solubilité sont
standards et connues
10 de l'homme du métier. On pourra néanmoins citer une analyse par mesure
de la densité
optique ou toute méthode de pharmacopée connue de l'homme du métier.
Les solvants préférés pour mettre en oeuvre le procédé selon l'invention sont
les solvants
physiologiquement compatibles, de préférence hydrophiles, de préférence encore
aqueux
tels que l'eau distillée, les tampons phosphate et le sérum physiologique.
D'autres solvants
15 comme les alcools en C1-C3 ou le diméthylsulfoxide (DMSO) peuvent être
présents et dont la
quantité totale ne dépasse généralement pas 10% en volume par rapport au
volume total de
la solution de complexe.
En règle générale, l'insolubilité d'une molécule en solution est visible
rapidement à l'oeil nu,
en une durée de l'ordre de quelques secondes à quelques minutes dans certains
cas. Par
20 conséquent, une simple étude visuelle des échantillons des différents
complexes en solution
pourrait suffire à déterminer la ou les solutions de complexes pouvant
convenir à la seconde
étape d'analyse temporelle d'activité.
Cependant, des analyses de densité optique par exemple, permettent d'obtenir
une mesure
plus précise de ce phénomène.
L'activité d'origine des complexes solubles est tout d'abord vérifiée puis
l'activité est ensuite
mesurée à différents intervalles de temps à partir de la formation dudit ou
desdits complexes,
de préférence toutes les heures, de préférence encore toutes les 24 heures,
puis tous les 3-4
jours.
Pour une molécule à visée thérapeutique, la mesure de l'activité
pharmacologique peut se
faire à partir de n'importe quelle méthode d'analyse appropriée sans aucune
limitation. Ces
méthodes d'analyse sont bien connues de l'homme du métier et leur utilisation
dépend
essentiellement de la nature de la macromolécule à visée thérapeutique
d'intérêt. A titre
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
21
d'exemple, lorsque la macromolécule est un anticorps, on pourra utiliser toute
méthode
permettant l'évaluation de son affinité avec son antigène et ses analogues
telles que les
méthodes immuno enzymatiques. Lorsque la macromolécule est une séquence ADN ou
ARN
par exemple, on pourra utiliser la méthode de spectrométrie MALDI-TDF,
électrophorèse ou
chromatographie liquide (HPLC) à haute performance.
Lorsque la molécule M n'a pas de visée thérapeutique particulière comme par
exemple, les
polymères naturels ou synthétiques, les résines, et autres additifs
polymériques, on ne peut
bien entendu plus parler d'activité pharmacologique ou biologique, mais le
procédé tel que
décrit précédemment sera mis en oeuvre en remplaçant l'activité
pharmacologique par les
caractéristique(s) ou propriété(s) de la molécule M. Tout ce qui est décrit
dans la présente
demande en référence à l'activité pharmacologique d'une macromolécule à visée
thérapeutique s'applique également en référence aux caractéristiques ou
propriétés d'une
molécule M d'intérêt non-thérapeutique.
Selon un autre aspect, l'invention concerne un kit pour la détermination d'un
conjugué ou
d'une combinaison de plusieurs conjugués permettant le maintien de l'activité
pharmacologique d'une ou plusieurs macromolécule(s) en solution, de préférence
en phase
liquide, comprenant au moins deux conjugués monofonctionnels ou
polyfonctionnels
identiques ou différents ou au moins deux mélanges de conjugués
monofonctionnels ou
polyfonctionnels identiques ou différents, et dans lequel chacun desdits
conjugués comprend
une chaîne principale de type PLL linéaire alpha et une ou plusieurs molécules
ayant chacune
un poids moléculaire d'au moins 50 Daltons et d'au plus 1000 Daltons liée de
façon covalente
à ladite chaîne principale.
Le kit selon l'invention peut comprendre au moins deux conjugués ou mélanges
de conjugués
PLL tels que définis précédemment, de préférence entre deux et dix.
La nature chimique des conjugués PLL pouvant être inclus dans le kit selon
l'invention est telle
que décrite dans la présente demande.
Selon une variante, le kit selon l'invention comprend des conjugués PLL ou des
mélanges de
conjugués conditionnés dans des récipients séparés. Les récipients pouvant
être utilisés sont
par exemple des flacons ou des doses à usage unique.
Le kit permet de faire un screening rapide par le laboratoire pour le choix
des composés PLL-
F1 et PLL-F2 qui correspond le mieux à la recherche de stabilité.
22
Stabilité et mesure d'efficacité compléteront l'analyse et permettront de
valider si oui ou non
la macro molécule est traitable avec un composé PLL-F et d'orienter les
composés qui
seront greffés par liaisons non covalente.
EXEMPLE ET EXPÉRIMENTATIONS
Les propriétés remarquables des complexes selon l'invention ont été mises en
évidence par
les expérimentations décrites ci-après
Appareillages et méthodes
Etude in silico
L'analyse in silico est une analyse entièrement réalisée au moyen d'un
ordinateur et du
logiciel Pymol. Elle permet de déterminer et sélectionner les conjugués PLL
particuliers
pouvant interagir avec une molécule M donnée en fonction de la répartition des
acides
aminés polaires et donc en fonction des charges de la molécule M.
Les sources utilisées sont les suivantes :
- Protéines humaines : Pubmed/Protein Data Base/Uniprot
- Immunoglobuline d'isotypie G :Saphire EO et al. Crystal structure of a
neutrakzing human IGG
against 1-11V-1: a template for vaccine design. Science. 2001
- Facteur de coagulation VIII Ngo JC et al. Crystal structure of human factor
VIII:
implications for the formation of the factor IXa-factor Villa complex.
Structure. 2008
- Facteur de coagulation IX: Wang, S. et al. Studies of benzothiophene
template as
potent factor IXa (FIXa) inhibitors in thrombosis. J.Med.Chem. 2010
- Hémoglobine : Safo, M. K. et al. The enigma of the liganded hemoglobin
end state: a
novel quaternary structure of human carbonmonoxy hemoglobin. Biochemistry
2005.
- Albumine : Bhattacharya, A.A. et al. Binding of the general anesthetics
propofol and
halothane to human serum albumin. High resolution crystal structures. 2000)
J.Biol.Chem.
Le logiciel utilisé pour rétude des structures protéiques est Pymol tel que
décrit sur le site de
PyMol de Schrôdinger.
Sédimentation
En biochimie, la sédimentation est la séparation de protéines en solution qui
ont la capacité
de sédimenter dans un champ centrifuge élevé.
On pratique l'ultracentrifugation et dans ce cas les molécules sont mises en
mouvement et
sédimentées par suite de leur densité qui est supérieure à celle du solvant.
On peut donc
Date Reçue/Date Received 2022-08-16
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
23
déterminer différentes macro molécules et leur masse molaire ainsi que leur
constante de
sédimentation mesurée en Svedberg (S).
centrifugation
La centrifugation est un procédé de séparation des composés d'un mélange en
fonction de
leur différence de densité en les soumettant à une force centrifuge.
L'appareil utilisé est une machine tournante à grande vitesse appelée
centrifugeuse.
Au cours de cette opération de séparation, les composés dans le fluide situés
à une distance r
de l'axe de rotation sont soumis à différentes forces :
= La force de pesanteur descendante Fp
= La poussée d'Archimède ascendante Fa
= Une force de friction Fv
= La force centripète F'c
= La force centrifuge Fc
La séparation s'opère par l'action de la force centrifuge Fc sur les composés.
Cette force
centrifuge, exprimée en newtons, est donnée par la relation Fc = myc avec yc =
rw2 en m/s2
dont :
= La masse m du composé à séparer
= La distance r du tube à l'axe de rotation de la centrifugeuse
= La vitesse angulaire w exprimée en radians par seconde ou en tours par
minute.
Le rapport de la force centrifuge Fc sur le poids Fp est appelé intensité de
la pesanteur
artificielle et s'exprime en "G"3. Les valeurs utilisées en centrifugation
sont d'environ 400 à 10
000 G, ce qui correspond à des vitesses de rotation de l'ordre 2 000 à 10 000
tr/min suivant le
rayon des rotors.
Certaines applications comme la séparation des macromolécules biologiques
(protéines,
acides nucléiques), nécessite la méthode d'ultracentrifugation mise au point
par Svedberg qui
utilise des intensités de pesanteur artificielle très élevées de l'ordre de
200 000 G, et qui
nécessite de ce fait des vitesses de rotation de plusieurs dizaines de
milliers de tours par
minute.
Densité optique
L'absorbance ou densité optique mesure la capacité d'un milieu à absorber la
lumière qui le
traverse.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
24
L'absorbance diffère selon la nature de la substance étudiée, selon la
longueur d'onde sous
laquelle elle est analysée, et selon la concentration de cette substance dans
le milieu traversé.
Ce milieu peut être solide, liquide ou gazeux, pour autant qu'il soit
transparent. Elle est
mesurée par un spectrophotomètre. La loi de Beer-Lambert établit une
proportionnalité entre
la concentration d'une entité chimique en solution (ou la pression partielle
de cette entité en
phase gazeuse), l'absorbance de celle-ci et la longueur du trajet parcouru par
la lumière dans
la solution.
La concentration est exprimée en molri ou en mol.m-3.
ELISA
.. L'ELISA est une technique biochimique utilisant un ou deux anticorps. L'un
de ceux-ci est
spécifique de l'antigène, tandis que l'autre réagit aux complexes immuns
(antigène-anticorps)
et est couplé à une enzyme. Cet anticorps secondaire peut aussi causer
l'émission d'un signal
par un substrat chromogène ou fluorophore.
Le protocole ELISA dans le cadre de l'invention est le suivant :
Expériences de titre et d'affinité :
- Sensibilisation des puits maxisorp :
Chaque puits reçoit 200 I d'une solution de tampon carbonate 0,05 M (pH =
9,6) contenant
l'antigène à la concentration de 10 g/ml. Des puits contrôles sont réalisés
avec la protéine
porteuse modifiée par l'agent couplant à la même concentration. Les plaques
sont mises 16
heures à 4 C sous agitation.
- Saturation :
Les plaques sont vidées puis remplies par 200 I de tampon PBS-Tw Sérum
albumine bovine
(BSA) 2,5g/I . Les plaques sont mises à incuber pendant 1 heure à 37 C.
- Lavages :
Les plaques sont vidées et lavées 3 fois avec du PBS-Tw.
- Incubations des anticorps :
Les anticorps sont dilués dans différents tampons :
= Le tampon contrôle : le même que le tampon de saturation
= Le tampon tests : c'est du tampon de saturation contenant un
composé PLL-F.
Ainsi, trois solutions, c'est-à-dire trois concentrations différentes (10-4M,
10-5M et 10-6M) ont
été testées par conjugué PLL-F.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
Les PLL-F testés sont les suivants :
o Méthionine-G-PLL
o Glutathion-G-PLL
o Taurine-G-PLL
5 o Cystéine-G-PLL
Les anticorps ainsi dilués sont déposés sur la plaque à raison de 200 1.11 par
puits. Ce test
comprend une étude de dilution de l'anticorps (1:2 500 à 1:80 000) et une
étude d'affinité
(dilution 30 de l'antigène de 1.10-6 à 1.10-12M).
L'étude de dilution de l'anticorps permet de déterminer la concentration en
anticorps et donc
10 de déterminer la dilution en anticorps à utiliser pour l'étude
d'affinité et de spécificité.
[Mangas et al. Chapter 1. Brain Molecules : From Vit to molecules for axonal
guidance. 2008].
L'absence de signal à la fin du test ELISA (A) indique que tous les sites
d'anticorps
reconnaissent la cible, c'est à dire qu'il a une haute affinité pour la cible.
Un signal élevé à la
fin de l'essai (B) est interprété comme une faible affinité de l'anticorps
pour l'antigène.
15 [Mangas et al. Chapter 1. Brain Molecules : From Vit to molecules for
axonal guidance. 2008]
- Lavages :
Les plaques sont vidées et lavées 3 fois avec du PBS-Tw (Tw=tween)
- Incubation des anticorps secondaires :
Les puits reçoivent 200 ill de tampon PBS-Tw, BSA 2,5g/I contenant des
immunoglobulines
20 dirigées contre les IgG de l'espèce hôte marquées à la peroxydase et
diluées au 1/10 000. Les
plaques sont incubées pendant 1 heure à 37 C.
- Lavages :
Les plaques sont vidées et lavées 3 fois avec du PBS-Tw.
- Révélation :
25 Les puits reçoivent 200 I de Tampon de révélation (Citrate 50 mM,
Phosphate 100 mM, H202
0,03%, pH5) additionnée d'ortho-phénylène diamine à 0,2%.
On laisse la coloration se développer à l'obscurité pendant 10 minutes et on
stoppe la réaction
à l'aide 50 I d'HCI 2N par puits.
La densité optique est ensuite lue à 492 nm.
Dot Blot
Dans un dot blot , on transfère les acides nucléiques (ADN ou ARN) ou les
protéines depuis
un milieu liquide directement sur une membrane, sans séparation préalable. Le
transfert peut
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
26
être réalisé par diffusion simple, par diffusion dans un champs électrique
(électrodiffusion) ou
par aspiration sous vide.
La détection est similaire à celles utilisées dans les transferts avec
séparation : par exemple
des séquences de nucléotides pour l'ADN ou l'ARN ou des anticorps pour les
protéines.
Protocole Dot Blot dans le cadre de l'invention :
A titre d'exemple, un anticorps monoclonal de souris (AcM) a été pris comme
modèle: anti-
11DehydroThromboxane B2 (11DHTB2-BSA), clone 2E1-B4 (IgGl, K) (surnageant de
cellules).
Le composé antigénique correspondant : anti-11DehydroThromboxane 62-BSA.
- Sensibilisation de la membrane de nitrocellulose :
Transfert de l'antigène depuis un milieu liquide directement sur une membrane,
par
aspiration sous vide. Chaque puits reçoit 200 I d'une solution de tampon Tri-
NaCI (TBS) 1X
contenant l'antigène. Des puits contrôles sont effectués avec la protéine
porteuse modifiée
par l'agent couplant à la même concentration.
Le système est mis sous vide à température ambiante pendant 1h.
- Saturation :
Retirer la membrane et faire des légères coupures pour délimiter les futures
bandes de
dépôt . Immerger ensuite la membrane dans du tampon de saturation TBS 1X-Tw,
BSA 1%1
pendant 1 heure à température ambiante sous agitation.
- Lavages :
La membrane est ensuite lavée une fois avec du TBS lx.
- Incubation des anticorps :
Découper la membrane en bandes de dépôt. Chaque bande est immergée dans une
solution
contenant l'anticorps à une dilution donnée à 4 C pendant 16h. C'est-à-dire
que les anticorps
sont dilués dans différents tampons:
= Le tampon contrôle : le même que le tampon de saturation
= Le tampon tests : c'est du tampon de saturation contenant un
composé PLL-F. Ainsi, trois solutions, c'est-à-dire trois
concentrations différentes (10-4M, 10-5M et 10-6M) ont été testées
par composé PLL-F.
Les PLL-F testés sont les suivants :
o Méthionine-G-PLL
o Glutathion-G-PLL
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
27
o Taurine-G-PLL
o Cystéine-G-PLL
Ce test permet d'étudier l'influence du composé PLL-F sur l'interaction Ag/Ac
en suivant la
densité du spot de dot-blot.
- Lavages :
Les bandes sont lavées 3 fois avec du TBS1X-TW 0,005%.
- Incubation des anticorps secondaires
Les bandes sont immergées dans du tampon TBS1XTW (0,005%)-BSA(0,1%) contenant
des
immunoglobulines dirigées contre les IgG de l'espèce hôte marquées à la
peroxydase et
diluées au 1/5 000 pendant 1h à température ambiante sous agitation.
- Lavages :
Les bandes lavées 3 fois avec du TBS1X-TVV 0,005% et un dernier lavage au
TBS1X pour enlever
la mousse.
- Révélation :
Les bandes sont immergées dans du tampon de révélation. La coloration se
développe à
l'obscurité pendant 10 minutes et la réaction est stoppée à l'aide 50 I d'HCI
2N par bande.
L'intensité des spots est estimée par l'expérimentateur.
Comptage cellulaire
La méthode utilisée est la méthode de comptage par Cellule de Malassez et bleu
de trypan.
Le bleu de trypan est un réactif chromophore (couleur bleue) chargé
négativement et qui
n'interagit pas avec la membrane si cette dernière est intacte. Il ne va donc
colorer que les
cellules endommagées, permettant de déterminer la viabilité d'un échantillon.
Les
échantillons sont dilués puis mélangés avec le bleu de trypan. Une fois placés
sur une cellule
de comptage classique (Cellule de Malassez), le nombre de cellules totales est
déterminé puis
les cellules apparaissant de couleur bleue (cellules avec membrane endommagée)
sont à leur
tour dénombrées. La biomasse est déterminée à partir du nombre total de
cellules alors que
la viabilité est déterminé à partir de cette formule :
Viabilité = [n(cellules bleues)/n(total)] .100%
Une cellule de Malassez est une lame spéciale quadrillée qui permet le
comptage de
différents types de cellules.
La totalité de la cellule de Malassez est composée de 100 rectangles dont les
dimensions sont
: Long.= 0,25 mm / larg.= 0,20 mm / Prof. = 0,20 mm. Le volume total de la
cellule est de 1
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
28
mm3 (100x2,5 x 0,2 x 0,20). Le quadrillage est donc constitué de 10 bandes
verticales (0,25
mm) et de 10 bandes horizontales (0,20 mm) formant ainsi 100 rectangles,
On ne compte les cellules que dans 10 des 25 rectangles non contigus pris au
hasard dans la
cellule.
On totalise le nombre de cellules présentes dans chaque rectangle.
Arbitrairement, il est convenu de ne tenir compte que des cellules
positionnées sur les côtés
droits et inférieurs.
On calcule le nombre moyen de cellules par rectangle (total des cellules
observées dans 10
rectangles divisé par le nombre de rectangles comptés). On multiplie le nombre
obtenu par
100 pour connaître le nombre d'entités cellulaires par mm3.
IRFT
Le spectromètre Infra-Rouge à Transformée de Fourier (IRTF) est un outil
d'analyse très utilisé
pour l'identification et la quantification de molécules et protéines. La
région principale de la
spectroscopie vibrationnelle est le moyen infrarouge (4 000 à 400 cm-1) du
spectre
électromagnétique. Le nombre d'onde est défini par l'inverse de la longueur
d'onde, exprimé
en centimètre. La spectroscopie peut être définie comme l'étude de
l'interaction d'une onde
électromagnétique avec la matière. Ainsi cette technique permet d'identifier
les groupes
fonctionnels chimiques de toute molécule via les vibrations caractéristiques
de ses liaisons
chimiques. Le résultat obtenu est un spectre IR de la molécule étudiée, soit
en mode
transmittance, soit en mode d'absorbance, où les pics sont interprétables
grâce à des tables
de corrélation de fréquences des vibrations de valence. Les analyses
effectuées sur les
conjugués Poly-L-lysine permettent de vérifier le greffage des petites
molécules sur la PLL
(shift sur les pics de l'amide de la PLL) et de déterminer les pics
spécifiques aux petites
molécules greffées. Il est observé une modification de l'allure spectrale d'un
mélange PLL-F et
molécule M, en comparaison avec les spectres d'origine du conjugué PLL-F et
molécule M.
Synthèse des conjugués selon l'invention
La synthèse des conjugués selon l'invention a été réalisée conformément aux
protocoles et
indications décrits dans la demande de brevet W09615810.
Dans ce qui suit, les molécules de poids moléculaire d'au moins 50 Daltons et
d'au plus 1000
Daltons liées de façon covalente à la chaîne principale de la PLL seront
dénommées
molécules F .
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
29
Pour des raisons de simplification de la notation, les conjugués selon
l'invention sont identifiés
par l'abréviation : molécule F - type de couplage - PLL.
Par exemple, le conjugué cystéine-G-PLL correspond à une cystéine greffée
sur une PLL par
l'intermédiaire d'un bras espaceur (ou linker en terminologie anglo-saxonne)
de type
glutaraldéhyde. Le conjugué orotyl-PLL , quant à lui, correspond à l'acide
orotique greffé sur
une PLL par l'intermédiaire d'un linker de type chlorure d'acide.
Procédure générale de synthèse
D'une manière générale, deux types d'activation concernent les molécules F,
suivant leur
famille moléculaire (acides aminés ou autres), la synthèse par activation au
glutaraldéhyde et
la synthèse par activation par un chlorure d'acide.
Les molécules F activées par la voie de synthèse du glutaraldéhyde et greffées
sur la PLL
suivent les réactions suivantes :
- lère étape : réaction de condensation et formation des imines
H
R-"M + -RIH2
'mu-7 Ri
4-0 molécule porteuse
ÇOH
R Ri + H2O
- 2ème étape : réduction des imines instables
BI-14
Na1302 +4 Flq
R . Na2}1,0 R1
Chaque molécule F est activée par le glutaraldéhyde (G), qui agit comme agent
couplant en
activant le groupe amine de la petite molécule. La réaction de condensation
forme des imines.
Ce composé intermédiaire, petite molécule et agent couplant, est lié sur le
groupe amine
epsilon du résidu lysyl de la poly-L-lysine, formant une liaison amide. Les
imines instables sont
stoppées par borohydrure de sodium. Ce produit est purifié par dialyse dans
des solutions
tampons.
A titre d'exemple on peut citer la synthèse du composé cystéine-G-PLL. Le
procédé comprend
la mise en oeuvre des étapes suivantes :
- Pesée de la cystéine : 400 mg
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
- Solubilisation dans un tampon acétate : 20 ml
- Activation par glutaraldéhyde 5% : 6 ml
- Greffage sur la PLL: 10 ml
- Réduction des innines par NaBH4 5M : 2 ml
5 - Purification par dialyse
Les molécules F activées par la voie de synthèse de l'éthyl chloroformiate et
greffées sur la PLL
suivent les réactions suivantes :
0
_,....----õ,
R OH + C Ir) ___________ le HCI + R 0
_
haptène chloroformiate d'éthyle:
ECF
Chaque molécule F est activée par l'éthyl chloroformiate (ECF), qui agit comme
agent couplant
en activant le groupe carboxylique de la petite molécule. Ce composé
intermédiaire, petite
10 molécule et agent couplant, est lié sur le groupe amine epsilon du
résidu lysyl de la poly-L-
lysine, formant une liaison amide. Ce produit est purifié par dialyse dans des
solutions
tampons.
A titre d'exemple on peut citer la synthèse du composé orotyl-PLL. Le procédé
comprend la
mise en oeuvre des étapes suivantes :
15 - Pesée de l'acide orotique : 400 mg
- Solubilisation dans le méthanol : 20 ml
- Ajout de triéthylamine : 0,4 ml
- Activation par éthyl chloroformiate : 0,25 ml
- Greffage sur la PLL: 10 ml
20 - Purification par dialyse
Caractérisation des conjugués selon l'invention
La caractérisation des conjugués selon l'invention a été effectuée par la
technique analytique
de l'infra-rouge à Transformée de Fourier (IRTF). Cette technique
spectroscopique permet
d'identifier le greffage et les pics spécifiques de la petite molécule sur la
PLL. Bien que cette
25 méthode soit généralement très efficace, d'autres méthodes pourront
également être
utilisées telles que, par exemple, la RMN, ou la dynamisation de lumière ou la
cristallographie.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
31
Des exemples de caractérisation de conjugué selon l'invention sont reproduit
dans les figures
1A à 1E.
Formation des complexes de l'invention
Procédure générale
Dans un réacteur, on introduit le(s) conjugué(s) selon l'invention
synthétisé(s) à l'étape
précédemment décrite et la macromolécule d'intérêt avec inertage à l'azote le
cas échéant
selon le Protocole spécifique à la molécule M (Cf. 4)
Formation d'un complexe selon l'invention comprenant un anticorps monoclonal
de souris
(AcM)
Dans cet exemple, la molécule M est un anticorps monoclonal de souris (AcM).
Pour l'étude in vitro les conditions sont les suivantes :
L'AcM (surnageant de cellules) : anti-11DehydroThromboxane B2 (11DHTB2-BSA),
clone 2E1-
B4 (IgG1, K)
Le composé antigénique correspondant : anti-11DehydroThromboxane B2-BSA.
Tampon dilution AcM :
Tampon contrôle TBS1X
Composés PLL-F testés : ie Tampon Contrôle + PLL-F
- Cystéine-G-PLL (10-4M, 10-5M et 10-6M)
- Méthionine-G-PLL (Idem)
- Glutathion-G-PLL (Idem)
- Taurine-G-PLL (Idem)
Formation d'un complexe selon l'invention comprenant le Facteur VIII
Dans cet exemple, la molécule M est le facteur VIII.
Le facteur VIII joue un rôle central dans la coagulation. Il s'agit du
cofacteur de facteur IX. Le
facteur VIII, activé par la thrombine, devint le catalyseur de la réaction
d'activation du facteur
X par le facteur IX activé, en présence d'ion calcium et de phospholipides. La
réaction
d'activation du facteur X est accélérée environ 200 000 fois en présence du
facteur VIII.
Le facteur X activé acquiert une activité catalytique qui lui permet de
transformer la
prothrombine en thrombine. Celle-ci dégrade le fibrinogène en fibrine. Le
caillot ainsi formé
sera stabilisé par le facteur XIII, ce qui permet l'arrêt du saignement.
Également appelé facteur Christmas ou facteur antihémophilique B, le facteur
IX est l'un des
intervenants indispensables de la coagulation sanguine. La protéine (57-kDa
vitamin K-
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
32
dependent procoagulant glycoprotein), codée par le gène F9, se trouve à l'état
inactif dans la
circulation sanguine. Lorsqu'un vaisseau est endommagé, des éléments étrangers
s'infiltrent.
Dès qu'elle entre en contact avec l'un d'eux, elle s'active et permet la
synthèse d'une enzyme,
la thronnbokinase, qui intervient dans la suite des réactions de la
coagulation aboutissant à la
formation d'un caillot sanguin. Dans le cas de l'absence de ce facteur IX, les
personnes
souffrent d'hémophilie B.
- Etude in-silico
La structure protéique du facteur VIII est représentée sur la figure 2.
Le logiciel permet de visualiser en couleur sur la structure 3D représentée
sur la figure 2 :
o les acides aminés à chaîne latérale polaire sans fonction acide-base :
sérine,
asparagine, thréonine, glutamine
o Les acides aminés à chaîne latérale polaire avec fonction acide base
anionique
: aspartate, glutamate.
o Les acides aminés à chaîne latérale polaire avec fonction acide base
cationique : lysine, arginine
o Les acides aminés à chaîne latérale polaire avec fonction acide base
neutre :
cystéine, tyrosine, histidine
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
33
Le tableau ci-dessous représente le nombre de fonctions relevées par cette
méthode
Facteur AA sans AA fonction AA fonction AA fonction
VIII fonction Acide-Base Acide-Base Acide-Base
Acide-Base Anionique neutres Cationique
Nombre 218 123 122 121
total
Nombre de 135 96 79 101
résidus en
surface
Facteur VIII Total Représentation en
% par rapport au
total des AA
Nombre 584 40
total
Nombre de 411 28
résidus en
surface
Formation d'un complexe selon l'invention comprenant une hémoglobine
Dans cet exemple, la molécule M est une hémoglobuline.
L'activité de l'hémoglobine est mesurée par saturation en oxygène.
L'hémoglobine humaine
est constituée de quatre chaînes identiques deux à deux : deux chaînes a de
141 acides aminés
chacune et de deux chaînes p de 146 acides aminés chacune (ce qui donne un
total de 574
acides aminés pour l'hémoglobine). Chacune de ces chaînes est associée à un
groupement
prosthétique : l'hème. On la symbolise par Hb . Une molécule d'hème est
constituée d'un
ion fer complexé par une porphyrine.
- Etude in-silico
La structure protéique de l'hémoglobine est représentée sur la figure 3.
Le logiciel permet de visualiser en couleur sur la structure 3D représentée
sur la figure 3 :
o les acides aminés à chaîne latérale polaire sans fonction acide base :
sérine,
asparagine, thréonine, glutamine
o Les acides aminés à chaîne latérale polaire avec fonction acide base
anionique :
aspartate, glutamate.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
34
o Les acides aminés à chaîne latérale polaire avec fonction acide base
cationique
: lysine, arginine
o Les acides aminés à chaîne latérale polaire avec fonction acide base
neutre :
cystéine, tyrosine, histidine
Le tableau ci-dessous représente le nombre de fonctions relevées par cette
méthode :
AA sans
AA fonction AA fonction AA fonction
fonction
Hémoglobine Acide-Base Acide-Base Acide-Base
Acide-
Anionique neutres
Cationique
Base
Nombre total
92 54 56 56
par Catégorie
Nombre de
résidus en 92 50 42 50
surface
Représentation en
Hémoglobine Total % par rapport au
total des AA
Nombre total
258 45
par Catégorie
Nombre de
résidus en 234 41
surface
Formation d'un complexe selon l'invention comprenant une albumine
Dans cet exemple, la molécule M est une albumine.
L'albumine sérum humaine est l'une des protéines les plus abondantes dans le
système
circulatoire. Elle joue un rôle clé dans le transport des acides gras, des
métabolites et des
médicaments et stimule fortement la distribution des médicaments dans le
corps. Sans une
protéine pour distribuer les médicaments tels que des antibiotiques, il serait
beaucoup plus
difficile de combattre la maladie ; l'albumine humaine permet à certaines
substances actives
de se lier et d'être transportées dans tout le corps. La structure de
l'albumine humaine
représente un modèle quaternaire. La masse moléculaire de la protéine est
67000, avec 585
acides aminés. La protéine a environ 67% de l'hélice alpha et étonnamment
aucun rifeuillet.
CA 02971019 2017-06-14
WO 2016/097618 PCT/FR2015/053568
Sa structure permet de se lier à une grande variété de molécules naturelles et
synthétiques.
L'albumine humaine est impliquée dans le maintien de la pression osmotique
colloïdale. La
pression osmotique colloïdale est une forme de pression qui doit être
appliquée pour
empêcher la quantité excessive d'eau à travers la membrane semi-perméable.
5 - Etude in-silico
La structure protéique de l'albumine est représentée sur la figure 4.
Le logiciel permet de visualiser en couleur sur la structure 3D représentée
sur la figure 4:
o les acides aminés à chaîne latérale polaire sans fonction acide base :
sérine,
asparagine, thréonine, glutamine
10 o Les acides aminés à chaîne latérale polaire avec fonction acide
base anionique
: aspartate, glutamate.
o Les acides aminés à chaîne latérale polaire avec fonction acide base
cationique
: lysine, arginine
o Les acides aminés à chaîne latérale polaire avec fonction acide base
neutre :
15 cystéine, tyrosine, histidine
Le tableau ci-dessous représente le nombre de fonctions relevées par cette
méthode
AA
AA sans
fonction AA fonction AA fonction
fonction
HSA Acide- Acide-Base Acide-Base
Acide-
Base neutres
Cationique
Base
Anionique
Nombre
89 96 68 82
total
Nombre
de
résidus 75 83 51 80
en
surface
Représentation en
HSA Total % par rapport au
total des AA
Nombre
335 57%
total
Nombre de
résidus en 289 49%
surface
36
Exemples d'Analyse de stabilité et de solubilité en solution et en culture
cellulaire
a. Stabilité des Immunoglobulines (1q) en solution aqueuse dans différents
tampons
pour des applications thérapeutiques
Pour cela, des composés PLL-F sont utilisés. Deux démarches sont appliquées :
o Etude in silico par la recherche bibliographique et l'étude de la
structure
des Ig
o Etude in vitro par la technique ELISA / Dot Blot :
= Binding direct
= Affinité
= Spécificité
b. Stabilité des hybridomes monoclonaux en solution aqueuse dans différents
milieux
de culture
Pour cela, des composés PLL-F sont utilisés. L'évaluation est réalisée par une
étude in vitro
qui comprend :
- L'observation de l'aspect des cellules avec les différents milieux de
culture
- Le comptage cellulaire pour le suivi de la croissance
Applications
Les complexes selon l'invention peuvent être utilisés dans de nombreuses
applications
thérapeutiques ou non thérapeutiques.
Pour le Facteur VIII par exemple : aujourd'hui en cas de nécessité l'hémophile
doit hydrater
sa solution lyophilisée, puis préparer le bon dosage et enfin se l'injecter.
Avec l'invention le
patient aura juste à prendre la seringue pré-remplie mise à sa disposition et
s'injecter le bon
nombre d'unités. Plus de risque de sous ou surdosage, plus de risque de
contamination durant
la préparation et donc une sécurité totale pour le patient.
Dans le domaine du diagnostic l'utilisation de complexes selon l'invention
permet des dosages
plus facile et dans le nutraceutique il permet de mettre en solution un actif
stable dans un
yaourt ou autre par exemple.
***
Selon certains aspects, une ou plusieurs des réalisations suivantes sont
décrites :
Réalisation 1. Complexe moléculaire comprenant :
- au moins un conjugué polylysine (PLL), comprenant :
Date Reçue/Date Received 2023-02-07
37
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris entre 50
Daltons et 1000 Daltons, liée de façon covalente à ladite chaîne principale,
caractérisée en ce que la molécule F est non immunogénique et liée de façon
covalente à ladite chaîne principale de PLL en position epsilon (E)-amine de
la
chaîne carbonée et
- au moins une molécule M présentant une diminution ou une perte d'activité
lorsqu'elle est mise en solution dans un solvant, caractérisée en ce que la
molécule M
est une molécule organique ou une protéine,
dans lequel le ou les conjugué(s) et la ou les molécule(s) M sont liés par
liaison non covalente.
Réalisation 2. Le complexe moléculaire selon la réalisation 1, caractérisé en
ce que le
rapport entre la concentration molaire du ou des conjugué(s) et celle de la ou
des molécule(s)
M est compris entre 1 et 30.
Réalisation 3. Le complexe moléculaire selon la réalisation 1 ou 2,
caractérisé en ce que le
rapport massique moléculaire et l'aire des pics entre la ou les molécules F et
la chaîne
principale est d'environ 10 à environ 20.
Réalisation 4. Le complexe moléculaire selon la réalisation 3, dans lequel le
rapport
massique moléculaire et l'aire des pics entre la ou les molécules F et la
chaîne principale est
déterminé par la méthode IRFT.
Réalisation 5. Le complexe moléculaire selon l'une quelconque des réalisations
1 à 4,
caractérisé en ce que la ou les molécule(s) F liée(s) de façon covalente à la
chaîne principale
est (sont) la cystéine, la méthionine, la taurine, le glutathion ou l'acide
thiotique.
Réalisation 6. Le complexe moléculaire selon l'une quelconque des réalisations
1 à 5,
caractérisé en ce que la au moins une molécule M liée de façon non covalente
au conjugué
PLL est une molécule présentant une activité pharmacologique.
Réalisation 7. Le complexe moléculaire selon l'une quelconque des réalisations
1 à 6,
caractérisé en ce que la au moins une molécule M liée de façon non covalente
au conjugué
PLL est une molécule présentant une activité nutritionnelle.
Réalisation 8. Le complexe moléculaire selon l'une quelconque des réalisations
1 à 7,
caractérisé en ce que la au moins une molécule M liée de façon non covalente
au conjugué
PLL est une molécule présentant une activité cosmétique.
Date Reçue/Date Received 2023-02-07
38
Réalisation 9. Le complexe moléculaire selon l'une quelconque des réalisations
1 à 8,
caractérisé en ce que la au moins une molécule M liée de façon non covalente
au conjugué
PLL est un réactif de diagnostic.
Réalisation 10. Le complexe moléculaire selon l'une quelconque des
réalisations 1 à 9,
caractérisé en ce que le poids moléculaire de chaque molécule M est supérieur
à 1000 Daltons.
Réalisation 11. Le complexe moléculaire selon l'une quelconque des
réalisations 1 à 9,
caractérisé en ce que la PLL comprend entre 155 et 394 lysines.
Réalisation 12. Le complexe moléculaire selon l'une quelconque des
réalisations 1 à 11,
caractérisé en ce que la PLL du conjugué est une chaîne linéaire alpha.
Réalisation 13. Le complexe moléculaire selon l'une quelconque des
réalisations 1 à 10,
caractérisé en ce que le poids moléculaire de chaque PLL est compris entre
3000 Daltons et
50000 Daltons.
Réalisation 14. Composition comprenant au moins le complexe défini selon l'une
quelconque des réalisations 1 à 13, en solution dans un solvant hydrophile.
Réalisation 15. La composition selon la réalisation 14, caractérisée en ce
qu'elle comprend
en plus du complexe moléculaire, au moins un excipient, un tensioactif ou un
véhicule.
Réalisation 16. Procédé d'obtention du complexe moléculaire défini selon l'une
quelconque
des réalisations 1 à 13, comprenant les étapes suivantes :
- fourniture d'un ou plusieurs conjugués PLL, comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris entre 50
Daltons et 1000 Daltons, liée de façon covalente à ladite chaîne principale,
caractérisée en ce que la molécule F est non immunogénique et liée de façon
covalente à ladite chaîne principale de PLL en position epsilon (E)-amine de
la
chaîne carbonée, et
- fourniture d'une ou plusieurs molécules M présentant une diminution ou une
perte
d'activité lorsqu'elle(s) est(sont) mise(s) en solution dans un solvant,
caractérisée(s) en
ce que la ou les molécule(s) M est(sont) une ou des molécule(s) organique(s)
ou, une
ou des protéine(s),
mise en contact du (ou des) conjugué(s) avec la ou les molécule(s) M dans des
conditions
permettant la formation de liaison(s) non-covalente(s) entre le (ou les)
conjugué(s) et la (ou
les) molécule(s) M.
Date Reçue/Date Received 2023-02-07
39
Réalisation 17. Le procédé selon la réalisation 16, caractérisé en ce que
ladite étape de mise
en contact est réalisée à une température comprise entre 4 C et 25 C et dans
une solution
ta mpon née.
Réalisation 18. Le procédé selon la réalisation 16 ou 17, caractérisé en ce
que l'étape de
fourniture du (ou des) conjugué(s) comprend la fourniture d'une solution
comprenant le (ou
les) conjugué(s) dans un solvant hydrophile.
Réalisation 19. Le procédé selon l'une quelconque des réalisations 16 à 18,
caractérisé en
ce que ladite étape de fourniture de la ou des molécule(s) M comprend la
fourniture d'une
solution comprenant la (ou les) molécule(s) M dans un solvant hydrophile.
Réalisation 20. Le procédé selon l'une quelconque des réalisations 16 à 19,
caractérisé en
ce que le temps de mise en contact du (ou des) conjugué(s) avec la (ou les)
molécule(s) M est
compris entre 1 heure et 24 heures.
Réalisation 21. Complexe moléculaire selon l'une quelconque des réalisations 1
à 13, la
molécule M étant une substance active pharmaceutique, pour son utilisation en
tant que
médicament.
Réalisation 22. Le complexe pour une utilisation selon la réalisation 21,
caractérisé en ce
que le complexe moléculaire est formulé pour une administration au sein d'une
composition
selon la réalisation 14 ou 15.
Réalisation 23. Le complexe pour une utilisation selon la réalisation 21 ou
22, caractérisé en
ce que le complexe moléculaire est formulé pour une administration par voie
intraveineuse ;
IM sous cutané ou orale ; spray nasal, buccal ou auriculaire ; ou cutanée ; ou
en solution
ophtalmique.
Réalisation 24. Utilisation d'au moins un conjugué PLL, comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris entre 50
Daltons
et 1000 Daltons, liée de façon covalente à ladite chaîne principale,
caractérisée en ce
que la molécule F est non immunogénique et liée de façon covalente à ladite
chaîne
principale de PLL en position epsilon (E)-amine de la chaîne carbonée et
dans une solution hydrophile, pour améliorer le caractère hydrophile d'une
molécule M
présentant une diminution ou une perte d'activité lorsqu'elle est mise en
solution dans un
solvant, caractérisée en ce que la molécule M est une molécule organique ou
une protéine,
en formant un complexe moléculaire défini selon l'une quelconque des
réalisations 1 à 13.
Date Reçue/Date Received 2023-02-07
40
Réalisation 25. Utilisation d'au moins un conjugué PLL, comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris entre 50
Daltons
et 1000 Daltons, liée de façon covalente à ladite chaîne principale,
caractérisée en ce
que la molécule F est non immunogénique et liée de façon covalente à ladite
chaîne
principale de PLL en position epsilon (E)-amine de la chaîne carbonée et
dans une solution hydrophile, pour améliorer la stabilité en solution d'une
molécule M
présentant une diminution ou une perte d'activité lorsqu'elle est mise en
solution dans un
solvant, caractérisée en ce que la molécule M est une molécule organique ou
une protéine,
en formant un complexe moléculaire défini selon l'une quelconque des
réalisations 1 à 13.
Réalisation 26. Utilisation d'au moins un conjugué PLL, comprenant :
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris entre 50
Daltons
et 1000 Daltons, liée de façon covalente à ladite chaîne principale,
caractérisée en ce
que la molécule F est non immunogénique et liée de façon covalente à ladite
chaîne
principale de PLL en position epsilon (E)-amine de la chaîne carbonée et
dans une solution hydrophile, pour améliorer en solution l'activité
pharmacologique, d'une
molécule M présentant une diminution ou une perte d'activité lorsqu'elle est
mise en solution
dans un solvant, caractérisée en ce que la molécule M est une molécule
organique ou une
protéine, en formant un complexe moléculaire défini selon l'une quelconque des
réalisations
1 à 13.
Réalisation 27. L'utilisation selon la réalisation 26, pour, en outre,
améliorer en solution
l'activité nutritionnelle de la molécule M.
Réalisation 28. L'utilisation selon la réalisation 26 ou 27, pour, en outre,
améliorer en
solution l'activité cosmétique de la molécule M.
Réalisation 29. L'utilisation selon l'une quelconque des réalisations 26 à 28,
pour, en outre,
améliorer en solution l'activité de diagnostic comme réactif de diagnostic, de
la molécule M.
Réalisation 30. L' utilisation selon la réalisation 26, caractérisée en ce que
l'amélioration de
l'activité pharmacologique de la molécule M en solution correspond à une
variation de
l'activité pharmacologique d'au moins 5% par rapport à l'activité
pharmacologique initiale de
la molécule M à une température d'au moins 1 C pendant 1 heure.
Réalisation 31. Utilisation d'au moins un conjugué PLL, comprenant :
Date Reçue/Date Received 2023-02-07
41
= une chaîne principale linéaire de PLL et
= au moins une molécule F ayant un poids moléculaire moyen compris entre 50
Daltons
et 1000 Daltons, liée de façon covalente à ladite chaîne principale,
caractérisée en ce
que la molécule F est non immunogénique et liée de façon covalente à ladite
chaîne
principale de PLL en position epsilon (E)-amine de la chaîne carbonée et
dans une solution hydrophile contenant une molécule M présentant une
diminution ou une
perte d'activité lorsqu'elle est mise en solution dans un solvant non désirée
dans ladite
solution, caractérisée en ce que la molécule M est une molécule organique ou
une protéine,
pour former un complexe moléculaire défini selon l'une quelconque des
réalisations là 13 et
décontaminer ladite solution.
Réalisation 32. Procédé d'identification d'un moins un conjugué PLL capable de
se lier de
façon non covalente à une molécule M présentant une diminution ou une perte
d'activité
lorsqu'elle est mise en solution dans un solvant, caractérisé en ce que la
molécule M est une
molécule organique ou une protéine, et de maintenir l'activité pharmacologique
de ladite
molécule M dans une solution hydrophile, ledit procédé comprenant :
a) la fourniture d'une molécule M présentant une diminution ou une perte
d'activité
lorsqu'elle est mise en solution dans un solvant présentant une activité
pharmacologique ;
b) la fourniture d'au moins un complexe moléculaire comprenant ladite molécule
M,
tel que défini dans l'une quelconque des réalisations 1 à 13;
c) la comparaison entre l'activité pharmacologique initiale et l'activité
pharmacologique dudit ou desdits complexes moléculaires comprenant la molécule
M;
d) l'identification d'un ou plusieurs complexes moléculaires dont l'activité
pharmacologique en solution en phase liquide est maintenue après la mise en
solution ;
et
e) l'identification d'un conjugué PLL ou d'une combinaison de plusieurs
conjugués PLL
permettant ledit maintien de l'activité pharmacologique.
Réalisation 33. Le procédé d'identification selon la réalisation 32,
caractérisé en ce que le
poids moléculaire de la molécule M est supérieur à 1,000 Daltons.
Réalisation 34. Le procédé d'identification selon la réalisation 32 ou 33,
caractérisé en ce
que l'étape c) de comparaison est effectuée entre l'activité pharmacologique
initiale de la
molécule M et l'activité pharmacologique du ou des complexe(s) moléculaire(s)
mesurées
Date Reçue/Date Received 2023-02-07
42
plusieurs fois à intervalles de temps déterminés à partir de la formation du
ou des
complexe(s), au moins toutes les 24 heures.
Réalisation 35. Le procédé d'identification selon l'une quelconque des
réalisations 32 à 34,
caractérisé en ce que l'étape d) d'identification du ou des complexe(s)
comprend en outre :
- la comparaison de l'évolution de l'activité pharmacologique de chaque
complexe
moléculaire testé en fonction du temps ; et
- l'identification du ou des complexe(s) dont la variation d'activité
pharmacologique est
d'au moins 5% par rapport à l'activité pharmacologique de référence de ladite
macromolécule à une température d'au moins 1 C pendant au moins 1 heure.
Date Reçue/Date Received 2023-02-07