Note: Descriptions are shown in the official language in which they were submitted.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
1
Catalyseur hybride de type P/Métal-N-C
La présente invention concerne un catalyseur hybride destiné à la
production d'énergie électrique à partir d'énergie chimique dans divers
dispositifs de
conversion électrochimique de l'énergie tels qu'une pile à combustible à
membrane
électrolyte polymère (ci-après abrégé PEMFC , à savoir l'acronyme anglais
pour
Polymer Electrolyte Membrane Fuel Cell ).
Les dispositifs de conversion électrochimique ayant la plus haute densité
d'énergie sont ceux dans lesquels le dioxygène est utilisé comme comburant,
car le
dioxygène est disponible dans l'air et n'a donc pas besoin d'être stocké dans
le
véhicule ou dans l'appareil. Le dioxygène est réduit électrochimiquement en
eau lors
de la production d'énergie électrique dans ces systèmes. A basse température
(à
savoir jusqu'à 200 C), cette réaction électrochimique complexe nécessite des
catalyseurs adéquats pour atteindre des densités de puissance acceptables.
Dans le cadre de la présente invention, par métal de transition, on
entend un élément qui a une sous-couche d incomplète ou qui peut donner un
cation
ayant une sous-couche d incomplète Cette définition qui est celle donnée par
l'Union
internationale de chimie pure et appliquée (UICPA) inclut donc l'ensemble des
lanthanides et des actinides.
Dans le cadre de la présente invention, on entend par catalyseur de
type Métal-N-C , un catalyseur comprenant une matrice carbonée dopée en azote
sur laquelle est lié de manière covalente au moins un métal de transition non
précieux. Les métaux de transition non précieux peuvent être choisis parmi le
titane,
le vanadium, le chrome, le manganèse, le nickel, le cuivre, le fer et le
cobalt. De
préférence, il s'agit du fer et du cobalt. Ainsi, un catalyseur de type Fe-N-C
et un
catalyseur de type Co-N-C sont des catalyseurs qui comprennent comme métal de
transition respectivement du fer et du cobalt. Les métaux de transition non
précieux
constituent des sites actifs de ces catalyseurs de type Métal-N-C.
Dans le cadre de la présente invention, on entend par catalyseur
hybride de type P/Métal-N-C , un catalyseur de type Métal-N-C qui comprend en
outre au moins un métal de transition précieux P. Lesdits métaux de transition
précieux P peuvent être choisis parmi le ruthénium, le rhodium, le palladium,
l'argent,
l'or, le rhénium, l'osmium, l'iridium, le platine et le cérium. De préférence,
il s'agit du
platine. De tels catalyseurs hybrides comprennent au moins un de ces métaux de
transition précieux ou un alliage de ces métaux de transition précieux.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
2
Jusqu'à présent, le principe catalytique des catalyseurs hybrides de type
P/Métal-N-C envisagés pour divers dispositifs tels que les PEMFC réside
majoritairement dans la réactivité des atomes de métal de transition précieux
tels que
le platine pour la réduction de l'oxygène. A cet égard, la publication de Gang
Wu et al.
intitulée Nitrogen-doped magnetic onion-like carbon as support for Pt
particles in a
hybrid cathod catalyst for fuel cells , Journal of materials chemistry, Royal
society of
chemistry, GB, vol. 10, 2010, pages 3059-3068, décrit un exemple de tels
catalyseurs
hybrides de type P/Métal-N-C. Ces catalyseurs hybrides P/Métal-N-C sont
caractérisés
par une activité catalytique très supérieure à celle des matériaux de
référence Métal-
N-C synthétisés de manière identique mais sans dépôt ultérieur de métal
précieux P.
C'est pourquoi les cathodes de PEMFC comprenant des catalyseurs hybrides de
type
P/Métal-N-C ou comprenant des catalyseurs non hybrides à base de particules de
métal de transition précieux (par exemple platine) supportées sur un matériau
non
catalytique nécessitent une masse de métal de transition précieux relativement
élevée et généralement comprise entre 0,2 et 0,4 mg par centimètre carré
d'électrode. Par exemple, il peut s'agir d'une masse de 0,4 g de platine par
kW
électrique de puissance produite par une pile PEMFC, soit 40 g de platine pour
un
véhicule automobile ayant une puissance de 100 kW.
Un autre inconvénient des catalyseurs décrits ci-dessus et dont l'activité
catalytique provient majoritairement des atomes de métal de transition
précieux est
leur empoisonnement par un nombre important de substances chimiques qui
peuvent
provenir soit du carburant, soit de l'air utilisé à la cathode. Par exemple,
la surface de
platine est rapidement empoisonnée en présence de monoxyde de carbone ou
d'ammoniac (présents dans le dihydrogène réformé à partir de gaz naturel) ou
en
présence d'anions halogénures (F-, Cl-, Br-, I-) qui peuvent se trouver dans
l'atmosphère, le comburant de la cathode des piles à combustibles et des
batteries
métal-air.
En outre, les catalyseurs non hybrides à base de métaux de transition
précieux (par exemple le platine) et les catalyseurs hybrides actuels de type
P/Métal-
N-C sont non-sélectifs. En effet, ils catalysent non seulement la réduction du
dioxygène en eau, mais aussi la réduction du peroxyde d'hydrogène en eau. Cela
permet l'élimination du peroxyde d'hydrogène formé en faible quantité lors de
la
réaction principale de réduction du dioxygène en eau dans le dispositif
électrochimique.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
3
Les catalyseurs non hybrides à base de métaux de transition précieux (par
exemple le platine) et les catalyseurs hybrides actuels de type P/Métal-N-C
présentent
de bonnes performances électrochimiques.
Cependant, du fait du principe catalytique basé sur la réactivité des
atomes de métal de transition précieux, la masse de métal de transition
précieux dans
les électrodes comprenant des catalyseurs non hybrides à base de métaux de
transition précieux (par exemple le platine) ou des catalyseurs hybrides
actuels de
type P/Métal-N-C est élevée ; ce qui induit des coûts importants de
fabrication de ces
catalyseurs du fait de l'onérosité de leurs matières premières. De plus, la
rareté des
métaux de transition précieux et leur faible production annuelle mondiale (par
exemple, environ 200 tonnes de platine sont produites par an) constituent
aussi des
obstacles à leur mise en oeuvre dans des véhicules propulsés avec des PEMFC ou
dans
d'autres applications destinées au grand public telles que des dispositifs
électroniques
portables pour lesquelles les séries de fabrication sont importantes.
C'est pourquoi, au vu de ces inconvénients quant à l'approvisionnement
en métaux de transition précieux pour les catalyseurs non hybrides à base de
métaux
de transition précieux ou hybrides de type P/Métal-N-C, on a également cherché
à
développer d'autres catalyseurs qui soient suffisamment catalytiques tout en
étant
dépourvus de ces métaux de transition précieux. L'intérêt s'est donc porté sur
les
catalyseurs de type Métal-N-C.
Des avancées importantes ont ainsi été réalisées ces dernières années
dans le domaine de la synthèse et des propriétés des catalyseurs de type Métal-
N-C
utilisés pour la réduction électrochimique du dioxygène.
Cependant, si les activités et les performances de tels catalyseurs sont
maintenant acceptables en début de fonctionnement du dispositif
électrochimique, la
durabilité de tels catalyseurs demeure très limitée jusqu'à présent entraînant
une
faible durée de vie du système électrochimique. En effet, une diminution des
performances est déjà visible après seulement quelques heures de
fonctionnement du
dispositif électrochimique, alors qu'une application technologique de ces
électrodes
pourra nécessiter une durée de vie de plusieurs centaines ou milliers
d'heures.
Les catalyseurs de type Métal-N-C ont ainsi pour inconvénient de
présenter une faible durabilité, et en particulier une faible durabilité
lorsqu'ils sont
utilisés pour la réduction électrochimique de l'oxygène, par exemple dans une
PEMFC,
en particulier dans les PEMFC à électrolyte acide conducteur de protons.
Les mécanismes de dégradation des catalyseurs de type Métal-N-C sont
encore peu connus. Une étude récente du laboratoire des demanderesses a
démontré
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
4
que les faibles quantités de peroxyde d'hydrogène produites lors de la
réduction
électrochimique du dioxygène en eau sont à l'origine de la majeure partie de
la
dégradation de ces catalyseurs au cours du fonctionnement en régime
stationnaire de
l'électrode.
En effet, contrairement aux catalyseurs hybrides de type P/Métal-N-C qui
sont non-sélectifs, les catalyseurs de type Métal-N-C sont sélectifs : ils ne
catalysent
pratiquement que la réduction du dioxygène et ne sont que très faiblement
capables
de catalyser la réduction du peroxyde d'hydrogène en eau.
C'est pourquoi, dans les dispositifs électrochimiques comprenant un
catalyseur de type Métal-N-C utilisé pour catalyser la réduction du dioxygène
en eau,
le peroxyde d'hydrogène formé parallèlement lors de la réduction du dioxygène
en
eau s'accumule dans l'électrolyte ou dans l'électrode et réagit chimiquement
avec les
sites actifs à base du métal de transition non précieux pour former des
espèces
radicalaires très oxydantes (par exemple par réaction de type Fenton). Ces
espèces
radicalaires attaquent alors le catalyseur de type Métal-N-C et/ou
l'électrolyte
polymère intégré dans l'électrode, réduisant considérablement la durée de vie
du
dispositif électrochimique.
La présente invention surmonte ces inconvénients quant aux catalyseurs
de type Métal-N-C en proposant un nouveau catalyseur hybride de type P/Métal-N-
C
stable au cours du temps et qui ne présente pas en outre les inconvénients
inhérents
aux catalyseurs non hybrides à base de métal de transition précieux ou aux
catalyseurs hybrides de type P/Métal-N-C connus à ce jour et qui ont été
rappelés ci-
dessus, à savoir leurs coûts de production du fait de matières premières
onéreuses, la
quantité élevée de métal de transition précieux nécessaire par kW électrique
et leur
empoisonnement rapide par un nombre important de substances chimiques pouvant
être présentes dans de tels dispositifs électrochimiques.
La performance d'une électrode comprenant un catalyseur hybride de
type P/Métal-N-C selon l'invention demeure stable au cours du temps lors du
fonctionnement à la cathode d'une PEMFC.
Le catalyseur hybride P/Métal-N-C selon l'invention présente une
durabilité plus grande que les catalyseurs de type Métal-N-C connus à ce jour.
La présente invention a ainsi pour objet un catalyseur hybride de type
P/Métal-N-C qui comprend au moins une matrice carbonée dopée en azote sur
laquelle est lié de manière covalente au moins un métal de transition non
précieux,
ledit catalyseur se caractérise en ce qu'il comprend en outre au moins un
métal de
transition précieux P partiellement oxydé et dont le pourcentage massique est
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
inférieur ou égal à 4,0 %, de préférence inférieur ou égal à 2,0 %, par
rapport à la
masse dudit catalyseur hybride de type P/Métal-N-C.
Dans le cadre de la présente invention, on entend par un métal de
transition précieux P partiellement oxydé , un métal de transition précieux P
qui a un
5 degré d'oxydation moyen compris entre 0,5 et 4,0, de préférence entre 0,5
et 2,5.
Dans le cadre de la présente invention, on entend par degré
d'oxydation moyen d'un métal de transition précieux P la valeur qui serait
obtenue
en sommant le degré d'oxydation de chaque atome de métal précieux P présent
dans
le catalyseur puis en divisant cette somme par le nombre total d'atomes de
métal
précieux P présents dans le catalyseur.
De préférence, le pourcentage massique en métal de transition précieux
P est compris entre 0,1 % et 4,0 %, préférentiellement entre 0,2 % et 2 %, par
rapport
à la masse dudit catalyseur hybride de type P/Métal-N-C selon l'invention.
Le pourcentage massique de métal de transition précieux est
avantageusement compris entre 0,2 et 2,0 % par rapport à la masse du
catalyseur
hybride de type P/Métal-N-C selon l'invention. Cela correspond ainsi à une
quantité
comprise entre 8 et 80 microgrammes de métal de transition précieux par
centimètre
carré d'électrode pour une électrode chargée à 4 milligrammes par centimètre
carré
de catalyseur hybride de type P/Métal-N-C. Une quantité comprise entre 8 et 80
microgrammes de métal de transition précieux par centimètre carré d'électrode
est
inférieure au seuil de 0,1 milligrammes de platine par centimètre carré qui
est la
valeur seuil adoptée par l'industrie automobile pour la prochaine génération
de
catalyseurs de cathode pour PEMFC.
Dans le catalyseur hybride de type P/Métal-N-C selon l'invention, la
quantité de métal de transition précieux est donc très inférieure à celle que
comprennent les catalyseurs de l'état de l'art tels que :
- les catalyseurs hybrides de type P/Métal-N-C qui comprennent un
métal de transition précieux sous forme métallique (cette forme
métallique du métal de transition précieux dans ces catalyseurs
hybrides provient du fait que les sels de métal de transition précieux
qui ont été utilisés en tant que matières premières de ces catalyseurs
hybrides ont été complètement réduits au cours de la fabrication
desdits catalyseurs hybrides) ou
- les
catalyseurs à base de métaux de transition précieux ou d'alliages
métalliques de métal de transition précieux avec divers métaux de
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
6
transition (par exemple un alliage de platine de type Pt3M, où M est
un métal de transition tel que le fer, le cobalt ou le nickel),
dans lesquels la réaction de réduction de l'oxygène a lieu à la surface du
métal de
transition précieux. Par exemple, dans les catalyseurs de type Pt3M, 75 % des
atomes
de métal sont des atomes de platine. Dans ces catalyseurs de l'état de l'art,
l'activité
électrochimique est inhérente à l'activité électrochimique des métaux de
transition
précieux qu'ils comprennent tels que du platine.
La quantité réduite de métal de transition précieux dans le catalyseur
hybride de type P/Métal-N-C selon l'invention présente l'avantage de réduire
d'environ 20 à 30 % le coût complet de la PEMFC dans laquelle il est intégré
(ce
pourcentage dépendant du coût du métal de transition précieux), et ce tout en
assurant une durabilité plus grande dudit catalyseur selon l'invention par
rapport aux
catalyseurs de type Métal-N-C.
Par exemple, un catalyseur hybride selon l'invention de type Pt/Fe-N-C (à
savoir le métal de transition non précieux est le fer et le métal de
transition précieux
est le platine) dont le pourcentage massique de platine est de 1,0 % est
totalement
stable pendant au moins 80 heures de fonctionnement dans une PEMFC et la
densité
d'énergie est de 0,12 g de platine par kW, c'est-à-dire proche du seuil cible
de 0,1 g de
platine par kW.
Les atomes de métal de transition non précieux correspondant aux sites
catalytiques les plus actifs pour la réduction du dioxygène dans le catalyseur
hybride
de type P/Métal-N-C selon l'invention sont dispersés de manière atomique sur
ladite
matrice carbonée dopée en azote. Ces sites catalytiques sont ci-après dénommés
sites actifs MétalNxCy . L'indice x indique le nombre d'atomes d'azote
présents dans
la première sphère de coordination autour de l'atome central de métal de
transition
non précieux et qui sont liés par liaison chimique à ce dernier, tandis que
l'indice y
indique le nombre d'atomes de carbone présents dans la seconde sphère de
coordination autour de l'atome central de métal de transition. Ces atomes de
carbone
sont soit (i) liés par liaison chimique à au moins un atome d'azote
appartenant lui-
même à la première sphère de coordination autour du métal, soit (ii) situés à
une
distance radiale de l'atome de métal non précieux qui est équivalente à la
distance
radiale entre atome de métal et les atomes de carbone définis en (i).
La dispersion au niveau atomique des atomes de métal non précieux (pas
de liaisons chimiques ou physiques entre deux atomes de métal non précieux)
sous
formes d'ions stabilisés par des liaisons chimiques avec des atomes d'azote
et/ou de
carbone est responsable de l'activité catalytique du catalyseur hybride de
type
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
7
P/Métal-N-C selon la présente invention. Cette dispersion au niveau atomique
peut
être démontrée :
- par la spectroscopie d'absorption des rayons X : absence de signal
correspondant aux interactions Métal-Métal pour les particules métalliques
(degré
d'oxydation zéro du métal), carbures de métal, oxydes de métal, des métaux de
transition non précieux, tels que le fer et le cobalt,
- le cas échéant pour les catalyseurs Fe-N-C, par spectrométrie 57Fe
Mbssbauer : absence des sextets et singlets caractéristiques aux carbures de
fer,
oxydes de fer et fer métallique (degré d'oxydation zéro) dans le spectre
Mbssbauer.
Les atomes de métal non précieux dans les catalyseurs de la présente
invention sont, en plus d'être dispersés atome par atome dans la matrice de
carbone
azotée, situés à la surface de la matrice de carbone azotée, et non dans la
masse de
cette matrice. Ce positionnement en surface des ions de métal est vérifiable
par
spectroscopie d'absorption des rayons X en mode operando , c'est-à-dire en
mesurant une série de spectres d'absorption des rayons X d'une électrode de
catalyseur Métal-N-C immergée dans un électrolyte acide et correspondants à
une
série de potentiels électrochimiques (différence de potentiel électrique entre
la
surface du catalyseur et l'électrolyte) appliqués à l'électrode. La
modification des
spectres d'absorption des rayons X autour du seuil du fer avec le potentiel
électrochimique appliqué à l'électrode, et le recoupement des différents
spectres à
des points dits isobestiques démontre que les sites MétalNxCy sont situés en
surface
de la matrice de carbone dopée en azote. Du fait de la dispersion atome par
atome et
du positionnement en surface des sites MétalNxCy, l'utilisation des atomes de
métal
non précieux pour la réaction catalytique de réduction de l'oxygène est donc
maximisée.
Dans le catalyseur hybride de type P/Métal-N-C selon l'invention, une
fraction des atomes de métal de transition non précieux peut cependant être
aussi
présente sous la forme de particules métalliques ou de carbures métalliques.
Ces
phases cristallines du métal de transition non précieux peuvent être produites
en
parallèle avec les sites actifs MétalNxCy lors de la synthèse à haute
température du
catalyseur Métal-N-C qui est un constituant de départ du catalyseur hybride de
type
P/Métal-N-C selon l'invention.
Le métal de transition non précieux peut être choisi parmi le titane, le
vanadium, le chrome, le manganèse, le nickel, le cuivre, le fer et le cobalt,
pris seul ou
en mélange de ceux-ci ou sous la forme d'un alliage de métaux de transition
non
précieux. De préférence, il s'agit du fer et du cobalt.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
8
Le métal de transition précieux peut être choisi parmi le ruthénium, le
rhodium, le palladium, l'argent, l'or, le rhénium, l'osmium, l'iridium, le
platine et le
cérium, pris seul ou en mélange de ceux-ci ou sous la forme d'un alliage avec
au moins
un métal de transition précieux ou non précieux. De préférence, il s'agit du
platine.
De préférence, le métal de transition précieux se présente sous la forme
de nanoparticules. De manière avantageuse, la taille desdites nanoparticules
est
comprise entre 1 nm et 10 nm, de préférence entre 2 nm et 4 nm, et encore plus
préférentiellement entre 1 nm et 2 nm.
Le catalyseur hybride de type P/Métal-N-C selon l'invention comprend
des micropores (à savoir des pores de taille inférieure à 20 Ångstrbm) et/ou
des
mésopores (à savoir des pores de taille comprise entre 20 et 500 Ångstrbm)
dans
lesquels se trouvent les nanoparticules du métal de transition précieux.
La surface spécifique générée par les différents types de pores peut être
supérieure à 300 m2g-1. Dans un mode de réalisation de l'invention, ladite
surface
spécifique est comprise entre environ 100 m 2g-1 et environ 1600 m2g-1.
Le métal de transition précieux peut être dispersé de manière homogène
et situé à proximité des sites actifs MétalNxCy du catalyseur de type P/Métal-
N-C
selon l'invention.
Dans le cadre de la présente invention, on entend par situé à
proximité)> que, si on considère un centre catalytique représentatif à base de
métal
de transition non précieux (autrement dit un site actif MétalNxCy), la
particule de
métal de transition précieux la plus proche dudit site actif MétalNxCy se
situe à une
distance inférieure à 50 nm, de préférence à une distance inférieure à 20 nm.
Les particules du métal de transition précieux partiellement oxydé
décomposent chimiquement les espèces radicalaires produites lors de la
réduction de
dioxygène par ces sites actifs en des composés inoffensifs pour le catalyseur
et
l'électrolyte tels que l'eau et le dioxygène.
Cette fonction catalytique des particules de métal de transition précieux
partiellement oxydé est différente de celle des particules de métal de
transition
précieux utilisées jusqu'à présent dans les catalyseurs hybrides de type
P/Métal-N-C
ou dans les catalyseurs non hybrides à base de métal de transition précieux.
Dans ces catalyseurs de l'état de l'art, les atomes de métal de transition
précieux sont sous leur forme réduite (à savoir à un degré d'oxydation zéro) à
l'intérieur des particules de métaux de transition précieux, ce qui octroie
une
propriété électro-catalytique à la fois pour la réduction électrochimique du
dioxygène
et pour la réduction électrochimique du peroxyde d'hydrogène. Par exemple, le
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
9
platine métallique au degré d'oxydation zéro est connu pour être le catalyseur
le plus
actif pour l'électro-réduction du peroxyde d'hydrogène.
Dans le catalyseur hybride de type P/Métal-N-C selon l'invention, le
découplage des fonctions catalytiques :
- d'électro-réduction du
dioxygène assurée par les sites actifs
Métal NC, et
- de
décomposition chimique des espèces radicalaires, assurée
par les particules de métal de transition précieux partiellement oxydé,
permet de réduire significativement la quantité de métal de transition
précieux par
rapport à celle des catalyseurs de l'état de l'art, tout en conservant une
bonne activité
catalytique de réduction du dioxygène et en assurant une bonne stabilité dudit
catalyseur selon l'invention.
De plus, le catalyseur hybride de type P/Métal-N-C selon l'invention est
moins sensible, voire insensible aux substances chimiques connues pour être
des
poisons pour les surfaces de métal de transition précieux (par exemple les
ions
halogénures et monoxyde de carbone pour le platine), du fait de l'état
partiellement
oxydé des particules de métal de transition précieux dans le catalyseur selon
l'invention et de l'insensibilité connue des sites actifs à base de métal de
transition
non précieux (à savoir les sites actifs MétalNxCy) à ces substances chimiques.
Dans le catalyseur hybride de type P/Métal-N-C selon l'invention, le métal
de transition précieux est utilisé comme stabilisateur des sites actifs
MétalNxCy pour la
réduction du dioxygène lors du fonctionnement du dispositif électrochimique.
C'est pourquoi, à la différence des catalyseurs hybrides de type P/Métal-
N-C connus de l'état de l'art, dans le catalyseur selon l'invention, le métal
de
transition précieux qu'il comprend ne contribue pas à l'activité catalytique
pour la
réduction du dioxygène dudit catalyseur, mais il protège dans la durée et au
cours du
fonctionnement du dispositif électrochimique les sites actifs à base de métaux
de
transition non précieux (à savoir les sites actifs MétalNxCy) de ces
catalyseurs. La
fonction catalytique de réduction du dioxygène en eau est uniquement assurée
par les
sites actifs MétalNxCy.
De plus, à la différence des catalyseurs non hybrides à base de métal de
transition précieux et des catalyseurs hybrides de type P/Métal-N-C connus de
l'état
de l'art où les atomes de métal de transition précieux situés à l'intérieur
des particules
de métal de transition précieux sont dans un degré d'oxydation zéro, dans le
catalyseur hybride de type P/Métal-N-C selon l'invention, les atomes de métal
de
transition précieux qu'il comprend sont dans un état partiellement oxydé, et
ce même
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
à l'intérieur des particules de métal de transition précieux. Ceci confère au
catalyseur
hybride de type P/Métal-N-C selon l'invention une signature spectroscopique du
métal de transition précieux clairement distincte de celle du métal de
transition
précieux situé dans les catalyseurs non hybrides à base de métal de transition
5 précieux
ou des catalyseurs hybrides de type P/Métal-N-C connus de l'état de l'art
pour la réduction du dioxygène. A cet égard, l'état chimique et
l'environnement
structurel autour des atomes de platine dans un catalyseur hybride Pt/Fe-N-C
selon
l'invention ont été étudiés par spectrométrie d'absorption des rayons X au
seuil
d'absorption L3 du platine et les résultats sont détaillés dans la partie
expérimentale
10 qui suit.
Le catalyseur hybride de type P/Métal-N-C selon l'invention présente
aussi des caractéristiques techniques liées à son procédé de fabrication.
C'est pourquoi, la présente invention concerne aussi un catalyseur
hybride de type P/Métal-N-C susceptible d'être obtenu par un procédé de
fabrication
qui comprend au moins les étapes suivantes :
a) on dispose d'un catalyseur de type Métal-N-C,
b) on imprègne ledit catalyseur de type Métal-N-C avec au moins une solution
de
sel de métal de transition précieux P de manière à obtenir un mélange
homogène,
c) on effectue au moins un traitement thermique sur le mélange homogène
obtenu à l'étape b), ledit traitement thermique consistant en un chauffage à
une température comprise entre 0 et 700 C, de préférence entre 100 C et
700 C, sous une atmosphère inerte ou réductrice (de préférence faiblement
réductrice) de manière à obtenir un catalyseur hybride de type P/Métal-N-C
dans lequel ledit métal de transition précieux P est partiellement oxydé (en
d'autres termes seulement partiellement réduit par rapport à son degré
d'oxydation initial en tant que sel de métal, ou encore autrement dit
partiellement oxydé avec un degré moyen d'oxydation supérieur à zéro dans le
catalyseur hybride final),
la concentration de la solution de sel de métal de transition précieux P étant
choisie
de manière déterminée de telle sorte que le pourcentage massique dudit métal
de
transition précieux P soit inférieur ou égal à 4,0 %, de préférence inférieur
ou égal à
2,0 %, par rapport à la masse du catalyseur hybride de type P/Métal-N-C obtenu
à
l'issue de l'étape c).
La concention de ladite solution de sel de métal de transition précieux
peut être choisie de manière déterminée de telle sorte que le pourcentage
massique
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
11
en métal de transition précieux est compris entre 0,1 % et 4,0 %,
préférentiellement
entre 0,2 % et 2 %, par rapport à la masse du catalyseur hybride de type
P/Métal-N-C
obtenu à l'issue de l'étape c), à savoir le catalyseur selon l'invention.
La détermination de la concentration de la solution de sel de métal de
transition précieux pour obtenir un catalyseur hybride de type P/Métal-N-C
selon
l'invention pour lequel le pourcentage massique en métal de transition
précieux se
situe dans les intervalles tels que décrits ci-dessus est parfaitement à la
portée de
l'homme du métier.
En effet, en fonction de la teneur massique en métal de transition
précieux souhaitée dans le catalyseur hybride de type P/Métal-N-C selon
l'invention,
l'homme du métier saura préparer sans difficulté la solution de sel de métal
de
transition précieux à une concentration déterminée (autrement dit à une
concentration appropriée).
Le catalyseur de type Métal-N-C dont on dispose à l'étape a) peut avoir
été obtenu par voie pyrolytique ou par synthèse organique.
Par exemple, la synthèse organique peut être réalisée en greffant de
manière covalente des macrocycles à base de métal de transition non précieux à
la
surface d'une matrice carbonée ou de tout autre support conducteur
électronique.
Un macrocycle est soit une macromolécule cyclique ou la partie cyclique
d'une macromolécule, soit une molécule organique ou organométallique de masse
moléculaire insuffisante pour être définie comme une macromolécule (on entend
par
macromolécule une molécule qui contient au moins environ 1000 atomes) mais qui
contient une grande structure cyclique (typiquement, un cycle de 15 atomes ou
plus).
Parmi les macrocycles organométalliques de synthèse les plus connus, on peut
citer
les phtalocyanines de métal et les porphyrines de métal. Parmi les molécules
existant
en biologie et contenant des macrocycles impliquant un métal de transition non
précieux, on peut citer la vitamine B 12 (cycle autour d'un motif central
CoN4) ou
encore les métalloprotéines qui contiennent la sous-structure hème (l'hème est
une
porphyrine de fer, et contient un cycle d'atomes autour d'un motif central
FeN4).
Des supports conducteurs électroniques partiellement carbonés ou
totalement non carbonés et adéquats pour une utilisation dans un appareil
électrochimique sont, par exemple, des carbures de métaux (carbure de titane,
carbure de tungstène), des oxydes (oxyde de titane, oxyde d'étain, oxyde de
tungstène, oxyde de molybdène). Certains de ces oxydes sont de faibles
conducteurs
électroniques mais peuvent être dopés par un deuxième élément métallique, ce
qui
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
12
augmente leur conductivité électronique Un des métaux les plus couramment
utilisés
pour doper les oxydes mentionnés ci-dessus est l'antimoine.
La pyrolyse peut être réalisée sous atmosphère inerte ou réductrice en
présence de précurseurs organiques ou organométalliques et de sels de métaux
de
transition non précieux.
Dans un mode de réalisation de l'invention, le catalyseur de type Métal-
N-C a été obtenu à l'issue d'une pyrolyse à 1050 C sous argon pendant une
heure des
précurseurs dudit catalyseur de type Métal-N-C.
La fabrication d'un catalyseur de type Métal-N-C par voie pyrolytique ou
par voie de synthèse organique est parfaitement à la portée de l'homme du
métier.
L'étape b) peut être réalisée à température ambiante et sous pression
atmosphérique.
De préférence, à l'étape b), la solution de sel de métal de transition
précieux est une solution de sel de platine. Par exemple, il peut s'agir d'une
solution
d'un sel de platine de formule [Pt(NH3)4]C12*H20 de pureté 99 %, commercialisé
par la
société INTERCHIM et qui a été dissout dans de l'eau.
Dans un mode de réalisation de l'invention, le traitement thermique de
l'étape c) consiste en un chauffage pendant 2 heures à 560 C dans une
atmosphère
comprenant un mélange de dihydrogène et de diazote (par exemple 5% de
dihydrogène et 95 % de diazote exprimés en pourcentages molaires).
Dans un mode de réalisation de l'invention, le traitement thermique de
l'étape c) est réalisé à une température comprise entre environ 300 C et
environ
600 C, pendant une durée comprise entre environ 15 minutes et environ 2
heures,
dans un four chauffé électriquement.
Le traitement thermique peut être réalisé dans :
- un four dit classique , à savoir un four qui monte en température par
dissipation d'énergie électrique dans des résistances,
- un four dont le principe est basé sur des radiations électromagnétiques,
tels
que les fours micro-ondes ou les fours à lampes.
La durée suffisante du traitement thermique est déterminée en fonction
de l'appareil de chauffage choisi pour effectuer cette étape c).
Au cours du traitement thermique, l'atmosphère est inerte (par exemple
diazote ou argon) ou réductrice, de préférence faiblement réductrice (par
exemple
dihydrogène, ammoniac ou mélange de ces deux gaz réducteurs avec un gaz
inerte).
Lorsque l'atmosphère est réductrice et comprend un mélange de gaz
inerte (par exemple diazote, argon, hélium) et réducteur (par exemple
dihydrogène,
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
13
méthane, propane, acétylène), le degré de réduction du sel de métal de
transition
précieux est contrôlé principalement par le biais du pourcentage molaire de
gaz
réducteur présent dans ledit mélange de gaz.
Lorsque l'atmosphère est inerte, le degré de réduction du sel est contrôlé
par des paramètres secondaires à la nature de l'atmosphère, tel que la
température
de pyrolyse et/ou la durée de pyrolyse.
Avantageusement, au cours du traitement thermique, l'atmosphère est
un mélange gazeux contenant entre 2 % et 20 % molaire de gaz réducteur, de
façon à
ce que le temps de traitement thermique nécessaire pour réduire partiellement
le sel
du métal de transition précieux ne soit ni trop long (ce qui serait coûteux)
ni trop court
(ce qui poserait des problèmes du fait de la limitation en temps court de
l'appareil de
chauffage, en particulier pour les fours chauffés par résistance électrique).
Dans un mode de réalisation de l'invention dans lequel on obtient un
catalyseur hybride de type Pt/Fe-N-C qui comprend des nanoparticules de
platine
partiellement oxydées avec un degré d'oxydation moyen des atomes de platine
compris entre 0,5 et 2,5, l'appareillage de chauffage utilisé pour le
traitement
thermique de l'étape c) inclut un four tubulaire à charnière de la société
THERMCRAFT
(modèle Express-line, 1 zone de chauffe), un tube de quartz de 4 cm de
diamètre
environ et une nacelle de quartz.
La poudre du précurseur de catalyseur hybride de type Pt/Fe-N-C (à
savoir un sel [Pt(NH3)4]C12*H20 préalablement mélangé avec un catalyseur de
type Fe-
N-C de telle sorte que la teneur massique de platine dans ledit catalyseur
hybride de
type Pt/Fe-N-C soit de 1%) est déposée dans la nacelle de quartz, et le tube
de quartz
comprenant la nacelle est relié à du diazote.
Après évacuation de l'air dans le tube de quartz par le flux de diazote, le
four tubulaire (toujours sous flux gazeux de diazote) comprenant le tube de
quartz et
la nacelle est monté en température, à une vitesse moyenne de 4 C par minute,
jusqu'à la température de 560 C, puis laissé pendant 2 heures à la
température de
560 C sous flux d'un mélange gazeux comprenant 5 % de dihydrogène et 95 % de
diazote exprimés en pourcentages molaires. Ensuite, le four tubulaire est
ouvert, le
tube de quartz est retiré de la zone de chauffe, et il refroidit naturellement
à
température ambiante sous flux de diazote.
Optionnellement, le procédé de fabrication comprend en outre une
étape de refroidissement du catalyseur hybride de type P/Métal-N-C obtenu à
l'issue
de l'étape c).
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
14
A l'issue du procédé de fabrication, on obtient un catalyseur hybride de
type P/Métal-N-C de haute surface spécifique, et à la surface duquel des
particules de
métal de transition précieux ont été déposées. La haute surface spécifique du
catalyseur hybride est générée par des micropores et des mésopores dans
lesquels
sont intégrées les particules du métal de transition précieux. De préférence,
les
particules de métal de transition précieux sont des nanoparticules telles que
décrites
ci-dessus.
La présente invention concerne aussi un catalyseur hybride de type
P/Métal-N-C susceptible d'être obtenu par un procédé de fabrication légèrement
différent de celui décrit ci-dessus et qui comprend au moins les étapes
suivantes :
i. on mélange des précurseurs d'un catalyseur de type Métal-N-C avec au
moins
une solution de sel de métal de transition précieux P de manière à obtenir un
mélange homogène,
ii. on effectue au moins un traitement thermique sur le mélange homogène
obtenu à l'étape i), ledit traitement thermique consistant en un chauffage à
une température comprise entre 500 et 1100 C sous une atmosphère inerte
ou réductrice de manière à obtenir un catalyseur hybride de type P/Métal-N-C
dans lequel ledit métal de transition précieux P est partiellement oxydé,
la concentration de la solution de sel de métal de transition précieux P étant
choisie
de manière déterminée de telle sorte que le pourcentage massique dudit métal
de
transition précieux P soit inférieur ou égal à 4,0 %, de préférence inférieur
ou égal à
2,0 %, par rapport à la masse du catalyseur hybride de type P/Métal-N-C obtenu
à
l'issue de l'étape ii).
La concention de ladite solution de sel de métal de transition précieux
peut être choisie de manière déterminée de telle sorte que le pourcentage
massique
en métal de transition précieux est compris entre 0,1 % et 4,0 %,
préférentiellement
entre 0,2 % et 2 %, par rapport à la masse du catalyseur hybride de type
P/Métal-N-C
selon l'invention.
La détermination de la concentration de sel de métal de transition
précieux pour obtenir un catalyseur hybride de type P/Métal-N-C selon
l'invention
pour lequel le pourcentage massique en métal de transition précieux se situe
dans les
intervalles tels que décrits ci-dessus est parfaitement à la portée de l'homme
du
métier.
Les caractéristiques de l'étape ii) de ce 2Ième procédé de fabrication
peuvent être identiques à celles du fer procédé de fabrication décrit ci-
dessus.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
La présente invention a aussi pour objet un dispositif électrochimique qui
comprend au moins un catalyseur hybride de type P/Métal-N-C selon l'invention
tel
que décrit ci-dessus.
De manière avantageuse, ledit dispositif électrochimique est choisi parmi
5 les batteries métal air, les piles à combustible fonctionnant à basse
température, par
exemple les PEFMC.
Dans un mode de réalisation de l'invention, le dispositif électrochimique
est un dispositif dans lequel la réaction électrochimique à la cathode
consiste en la
réduction de l'oxygène. La cathode est dite dépolarisante.
10 L'invention sera bien comprise à l'aide de la description détaillée
qui suit,
en référence, au dessin annexé en représentant, à titre d'exemple non
limitatif, les
résultats expérimentaux obtenus à partir de catalyseurs hybride de type P/Fe-N-
C
selon l'invention et comparés avec ceux obtenus avec des catalyseurs de l'état
de l'art.
La figure 1 représente des courbes de polarisation de réduction du
15 dioxygène en électrode à disque tournant pour 6 catalyseurs.
La figure 2 représente la partie cinétique des courbes présentées à la
figure 1, après correction des courbes pour la limitation due à la diffusion
du
dioxygène dans un électrolyte acide, en utilisant l'équation de Koutecky-
Levich.
La figure 3 représente les courbes de polarisation de réduction
(l'intensité i étant inférieure à 0) et d'oxydation (l'intensité i étant
supérieure à 0) du
peroxyde d'hydrogène en électrode à disque tournant pour 4 des catalyseurs
testés.
La figure 4 représente les courbes de polarisation de la réduction des
protons en dihydrogène (l'intensité i étant inférieure à 0) et l'oxydation du
dihydrogène en protons (l'intensité i étant supérieure à 0) en électrode à
disque
tournant pour 4 des catalyseurs testés.
La figure 5 représente les courbes de polarisation en PEMFC pour 5 des
catalyseurs testés.
La figure 6 représente la densité de courant en fonction du temps avec
un potentiel de PEMFC fixé à 0,5 V pour 5 des catalyseurs testés.
La figure 7 représente les courbes de polarisation, après correction afin
de tenir compte de la résistance ohmique de la membrane, et ce après 50 heures
de
fonctionnement de la PEMFC à 0,5 V pour 5 des catalyseurs testés.
La figure 8a représente l'activité pour la réaction de réduction du
dioxygène à 0,8 V en pile, avant et après 50 heures de fonctionnement de la
PEMFC à
0,5 V pour 5 des catalyseurs testés.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
16
La figure 8b représente la densité de courant en fonction du temps avec
un potentiel de PEMFC fixé à 0,5 V pour le catalyseur E testé sur une durée de
200
heures.
La figure 8c représente l'activité catalytique à un potentiel de PEMFC fixé
à 0,8 V pour le catalyseur E testé, avant et après 200 heures de
fonctionnement de la
PEMFC à un potentiel de 0,5 V.
La figure 9 représente les spectres d'absorption de rayons X autour du
seuil d'absorption L3 du platine des catalyseurs C et E et d'une feuille
métallique de
platine.
La figure 10 représente un grossissement des spectres de la figure 9
autour du seuil d'absorption L3 du platine.
La figure 11 est un graphe de la transformée de Fourier du signal
d'absorption des rayons X en structure fine (ci-après abrégé signal EXAFS )
du
platine des catalyseurs C et E selon l'invention en comparaison avec la
transformée de
Fourier du signal EXAFS du platine de la feuille métallique de platine.
La figure 12 représente des courbes de test de détection électrochimique
de monoxyde de carbone, une molécule sonde très connue pour caractériser des
particules de platine métallique (atomes de platine ayant un degré d'oxydation
zéro à
l'intérieur de la particule) ; et la comparaison de telles courbes avant et
après un test
de 50 heures en pile PEMFC à 0,5 V réalisé avec le catalyseur D.
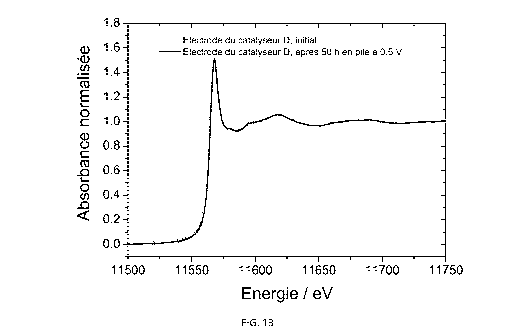
La figure 13 représente les spectres d'absorption de rayons X autour du
seuil d'absorption L3 du platine du catalyseur D, avant et après un test en
pile à 0,5 V
pendant 50 heures.
Les expérimentations suivantes ont été réalisées de manière à comparer
les propriétés et les performances de trois catalyseurs hybrides selon
l'invention par
rapport à celles de catalyseurs à base de métal de transition précieux connus
de l'état
de l'art.
Les caractéristiques techniques des catalyseurs testés étaient les
suivantes :
- catalyseur A: catalyseur de type Fe-N-C, à savoir un catalyseur
comprenant une matrice carbonée dopée à l'azote et sur laquelle
est lié de manière covalente des atomes de fer;
-
catalyseur B: le catalyseur A qui a été soumis à un traitement
thermique détaillé ci-après. Ce traitement a eu pour effet
d'augmenter la surface spécifique du catalyseur B par rapport à
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
17
celle du catalyseur A. Ce catalyseur B était le catalyseur Fe-N-C
sans platine dit de référence ;
- catalyseur C: fer catalyseur selon l'invention qui a été obtenu
après post-fonctionnalisation du catalyseur A. La post-
fonctionnalisation a consisté en le même traitement thermique
que celui du catalyseur B mais en présence en outre de sel
métallique de platine qui a été réduit. La teneur massique en
platine dans le catalyseur C était de 0,5 % par rapport à la masse
totale du catalyseur C;
- catalyseur D : 2ième catalyseur selon l'invention qui a été obtenu
après post-fonctionnalisation du catalyseur A. La post-
fonctionnalisation a consisté en le même traitement thermique
que celui du catalyseur B mais en présence en outre de sel de
platine qui a été partiellement réduit. La teneur massique en
platine dans le catalyseur D était de 1,0 % par rapport à la masse
totale du catalyseur D;
- catalyseur E : 31ème catalyseur selon l'invention qui a été obtenu
après post-fonctionnalisation du catalyseur A. La post-
fonctionnalisation a consisté en le même traitement thermique
que celui du catalyseur B mais en présence en outre de sel de
platine qui a été partiellement réduit. La teneur massique en
platine dans le catalyseur E était de 2,0 % par rapport à la masse
totale du catalyseur E;
- catalyseur F : catalyseur commercial de type Pt/C, à savoir un
catalyseur comprenant une matrice carbonée et sur laquelle ont
été synthétisées des nanoparticules de platine. Le pourcentage
massique de platine était de 46 % par rapport à la masse totale du
catalyseur F. Ce catalyseur est commercialisé par la société
japonaise Tanaka Kikinzoku.
Le précurseur du catalyseur A de type Fe-N-C a été fabriqué dans un
broyeur planétaire à partir :
- d'un solide hybride poreux cristallisé comprenant des cations
Zn(II) et des ligands méthyl-imidazolate, de formule ZnN4C8H12,
commercialisé par la société BASF sous la dénomination
35.
commerciale Basolite Z1200, ci-après abrégé ZIF-8 ,
- d'un sel de Fe(II), à savoir l'acétate de fer non-hydraté,
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
18
- d'un
deuxième ligand azoté pour les ions Fe(II), à savoir 1,10-
p hé na ntroli ne.
Les poudres sèches de ZIF-8, du sel de fer et de la phénantroline ont été
pesées dans les proportions voulues puis déposées dans un creuset en oxyde de
zirconium. Le précurseur de catalyseur avant broyage contenait 1 % en masse de
fer
et le ratio massique de la phénantroline sur ZIF-8 était de 20/80. Ensuite,
100 billes
d'oxyde de zirconium de 5 mm de diamètre ont été ajoutées dans le creuset qui
a été
scellé sous air et disposé dans un broyeur planétaire commercialisé par la
société
FRITSCH sous la dénomination commerciale Pulverisette 7 Premium 8. 4 cycles de
30
minutes à une vitesse de 400 tour/minute ont été effectués pour mélanger les
poudres. Le précurseur de catalyseur A ainsi obtenu a été pyrolysé à 1050 C
sous
argon pendant une heure de manière à obtenir le catalyseur A.
Les catalyseurs hybrides C à E selon l'invention ont été obtenus de la
manière suivante :
300 mg du catalyseur A ont été imprégnés avec une solution de sel de
platine, à savoir un sel de platine de formule [Pt(NH3)4]C12*H20 de pureté 99
%,
commercialisé par la société INTERCHIM, qui était dissout dans de l'eau.
Pour ce faire, pour chacun des catalyseurs C à E, on a versé en tout 550 I
de solution de sel de platine, par portion de 100 L, sur la poudre de
catalyseur, tout
en pilonnant le mélange ainsi obtenu avec un mortier entre chaque versement de
100
L. A la fin de l'imprégnation, le mélange obtenu présentait un aspect
légèrement
boueux qui est caractéristique d'un remplissage complet des pores du
catalyseur A de
type Fe-N-C par la solution de sel de platine.
Pour obtenir les teneurs massiques en platine détaillées ci-dessus des
catalyseurs C à E, la concentration de la solution de sel de platine a été
ajustée de
manière appropriée.
Les échantillons imprégnés ainsi obtenus ont été séchés dans une étuve
sous air pendant 2 heures à 80 C.
La poudre qui a été obtenue à l'issue de ce séchage a été disposée dans
une nacelle de quartz qui a elle-même été placée dans un tube en quartz.
L'ensemble
a été introduit dans un four tubulaire pour subir un traitement thermique
consistant
en un chauffage pendant 2 heures à 560 C dans une atmosphère comprenant un
mélange de dihydrogène et de diazote (5 % de dihydrogène et 95 % de diazote
exprimés en pourcentages molaires).
Ensuite, à l'issue de ce traitement thermique, la poudre a été refroidie
sous une atmosphère de diazote.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
19
Le catalyseur B a été préparé à partir d'un catalyseur A qui n'a pas été
imprégné de la solution de sel de platine mais qui a subi ce même traitement
thermique et cette étape de refroidissement détaillés ci-dessus.
La surface spécifique des catalyseurs A à E a été déterminée par
adsorption de diazote et par analyse de l'isotherme d'adsorption avec
l'équation de
Bru na ue r-Em mett-Te lie r.
Le tableau 1 ci-dessous détaille la surface spécifique des catalyseurs A à E
mesurée par adsorption de diazote, ainsi que le pourcentage d'augmentation de
surface des catalyseurs B à E par rapport à la surface du catalyseur A,
autrement dit le
pourcentage d'augmentation de la surface après le traitement thermique
détaillé ci-
dessus.
catalyseur Surface en m2/g % d'augmentation
de la surface
A 370 0
B 520 40
C 560 51
D 530 43
E 550 49
Tableau 1 surface spécifique des catalyseurs A à E et augmentation relative de
la
surface spécifique des catalyseurs B à E après le traitement thermique
Au vu du tableau 1, on relève que le traitement thermique a augmenté
considérablement la surface des catalyseurs et que la quantité de platine n'a
pas eu
d'influence majeure sur l'augmentation de la surface, tel que démontré par le
catalyseur B (sans platine). Ainsi, seul le traitement thermique sous
dihydrogène/diazote a induit une augmentation de la surface des catalyseurs.
Des films catalytiques comprenant les catalyseurs A à E ont été déposés
sur les électrodes à disque tournant de la manière suivante :
Une encre catalytique a été préparée avec 10 mg du catalyseur concerné,
108 uL d'une solution de Nafion (5 % en poids de polymère Neon dispersé dans
une solution à base d'alcools) commercialisée par la société DuPont, 300 uL
d'éthanol
de pureté à 99 % commercialisé par la société API France et 36 uL d'eau ultra-
pure.
L'encre catalytique a été homogénéisée dans un bain à ultra-sons pendant au
moins
minutes. Ensuite, 7 uL de cette encre ont été déposés sur un disque de
diamètre de
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
5 mm réalisé en carbone vitreux de manière à obtenir une électrode à disque
tournant
avec un film catalytique dont la charge en catalyseur était de 800 ug /cm2.
Pour chacune des électrodes testées, la charge totale en catalyseur était
de 800 ug /cm2.
5 Donc, la teneur en platine à l'électrode comprenant le :
- catalyseur C était de 4 ug /cm2
- catalyseur D était de 8 ug /cm2
- catalyseur E était de 16 ug /cm2.
Pour l'électrode comprenant le catalyseur F, la charge en platine à cette
10
électrode était de 20 ug /cm2. Pour ce faire, 1,4 mg du catalyseur F ont été
dispersés
dans 3 mL d'eau par un traitement ultrasonique, et 20 uL ont été déposés sur
un
embout de carbone vitreux et séchés sous air.
Le dispositif électrochimique comprenant l'électrode à disque tournant
comportait en outre :
15 - une cellule en verre,
- un électrolyte acide de pH 1 contenant HC104 à une concentration de 0,1
mol/L,
- une contre-électrode en graphite,
- une électrode de référence à hydrogène (ci-après abrégé ERH ),
constituée
20 d'un fil
de platine immergé dans un compartiment séparé et contenant le
même électrolyte mais saturé en dihydrogène, ce compartiment étant relié de
manière électrolytique au compartiment principal par un fritté en verre,
- un potentiostat commercialisé par la société Princeton Applied Research
sous
la dénomination commerciale Versastat 8.
Les conditions expérimentales du dispositif comprenant l'électrode à
disque tournant étaient les suivantes :
- température ambiante,
- vitesse de rotation de l'électrode : 1600 tour/minute,
- 20 cycles voltampérométriques entre 0,05 et 1,1 V par rapport à l'ERH
ont été conduits pour nettoyer l'électrode à disque tournant.
Ensuite, les cycles voltampérométriques ont été conduits entre 0,2 et
1,0 VERH à une vitesse de balayage de 10 mV/s dans l'électrolyte saturé en
diazote,
puis en dioxygène, et les courbes mesurées sous diazote ont été soustraites à
celles
mesurées sous dioxygène, afin d'éliminer les courants non faradiques (c'est-à-
dire les
courants non reliés à la réduction du dioxygène, tel que le courant
capacitif). De plus,
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
21
les courbes ont été corrigées pour la chute ohmique dans l'électrolyte
(environ 20
Ohms de résistance pour ce dispositif).
Sur la figure 1 sont représentées les courbes de polarisation de la
réduction du dioxygène obtenues à partir d'une électrode à disque tournant, et
ce
avec les catalyseurs A à F testés.
Les courbes de la figure 1 indiquent que le meilleur catalyseur pour la
réduction du dioxygène est le catalyseur F. En effet, la cinétique de la
réaction de
réduction de l'oxygène est visible autour de 0,9 - 1,0 VERI-1.
A plus bas potentiel, la courbe du catalyseur F montre un plateau en
courant qui n'est pas lié à la cinétique électrochimique de réduction du
dioxygène,
mais défini par :
i) le flux maximum possible de diffusion du dioxygène dissous dans
l'électrolyte vers l'électrode (cela dépend de la vitesse de rotation de
l'électrode) et par
ii) la sélectivité du catalyseur pour la réaction de réduction du
dioxygène (réduction du dioxygène en eau principalement, mais
réduction également de quelques pourcentages de molécules de
dioxygène en peroxyde au lieu de l'eau).
Le catalyseur A présente une partie cinétique de sa courbe de
polarisation pour la réaction de réduction de l'oxygène qui est décalée vers
les
potentiels plus négatifs, d'environ - 150 mV. Cela signifie une cinétique
moins rapide.
Le courant limite de diffusion à bas potentiel est néanmoins proche de celui
du
catalyseur F indiquant que le produit de la réaction de réduction du dioxygène
sur le
catalyseur A est principalement de l'eau.
Le catalyseur B correspond au catalyseur A qui a été soumis à un
traitement thermique ; ce qui a eu pour conséquence d'augmenter sa surface.
L'activité du catalyseur B est supérieure d'environ 50 mV à celle du
catalyseur A et
inférieure d'environ 100 mV à celle du catalyseur F. Le régime cinétique des
courbes se situe entre 0 et -2 mA/cm2. Son courant limite de diffusion est
égal à celui
du catalyseur F indiquant principalement une réduction du dioxygène en eau.
Au vu de la quasi-superposition des parties des courbes des catalyseurs B
à E entre 0 et -2 mA/cm2 (à savoir le régime cinétique), les trois catalyseurs
hybrides C
à E selon l'invention ont une activité pour la réaction de réduction du
dioxygène
quasiment identique à celle du catalyseur B de référence.
Cela témoigne que la fonction de catalyse de la réaction de réduction du
dioxygène des catalyseurs C à E selon l'invention réside uniquement dans la
surface
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
22
catalytique du catalyseur Fe-N-C, obtenue avec le traitement thermique, et non
du sel
de platine qui a été ajouté avant la mise en oeuvre du traitement thermique.
Le tableau 2 ci-dessous détaille pour les catalyseurs A à E les activités par
masse de catalyseur à différents potentiels (à savoir à 0,8 VERH, 0,85 VERH et
0,9 VERH).
catalyseurs 0,8 VERH 0,85 VERH 0,8 VERH
A 2,3 0,5 0,1
B 6,5 1,3 0,3
C 9,2 1,8 0,3
D 6,6 1,9 0,4
E 7,7 1,5 0,3
Tableau 2 détaillant les activités par masse de catalyseur à différents
potentiels
Au vu du tableau 2, en comparant les activités du catalyseur A avec celles
des catalyseurs B à E, on relève que le traitement thermique a eu pour effet
d'augmenter 3 à 4 fois l'activité du catalyseur. Cette augmentation de
l'activité du
catalyseur est à corréler à l'augmentation de la surface du catalyseur suite
au
traitement thermique mentionnée ci-dessus avec les résultats du tableau 1.
La figure 2 représente la partie cinétique des courbes représentées à la
figure 1, après correction des courbes pour corriger la limitation due à la
diffusion du
dioxygène, et ce en utilisant l'équation de Koutecky-Levich.
La cinétique de la réaction du dioxygène est définie par une loi
exponentielle entre le courant et le potentiel électrochimique, c'est-à-dire
une droite
en échelle semi-logarithmique EERH vs log(i).
La figure 2 montre que :
- les pentes des courbes sont semblables : ce qui signifie que le mécanisme de
la
réaction de réduction du dioxygène est semblable pour les différents
catalyseurs, mais
- les
cinétiques sont différentes : l'activité de la réaction de réduction du
dioxygène est quantifiable en relevant la densité de courant à un potentiel
électrochimique donné, par exemple à 0,9 V vs. ERH : environ 6 mA/cm2 pour
le catalyseur F, 0,2 mA/cm2 pour le catalyseur B et entre 0,2 et 0,3 mA/cm2
pour les catalyseurs C à E.
Cette quantification précise de l'activité de la réaction de réduction du
dioxygène permet de démontrer que le platine dans les catalyseurs C à E selon
l'invention n'est pas actif pour la réaction de réduction du dioxygène. En
effet, il n'y a
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
23
pas d'augmentation significative de l'activité du catalyseur C à E selon
l'invention par
rapport à celle du catalyseur B de référence.
Or, malgré la faible teneur massique en platine (à savoir : 0,5, 1 ou 2 %)
dans les catalyseurs C à E selon l'invention, si la structure des particules
de platine
dans les catalyseurs selon l'invention C à E était la même que celle dans le
catalyseur F
(à savoir des nanoparticules de platine métallique avec un degré d'oxydation
zéro),
une augmentation de l'activité des catalyseurs C à E selon l'invention par
rapport à
celle dudit catalyseur B aurait dû être observée.
L'électrode comprenant le catalyseur F contient en effet 20 ug de platine
par cm2 et l'électrode comprenant le catalyseur E contient une teneur quasi
équivalente de platine, à savoir 16 ug/cm2, et eu égard aussi fait que la
taille des
nanoparticules de platine dans ces deux catalyseurs est semblable, une
activité de la
réaction de réduction du dioxygène similaire aurait dû être constatée entre
ces deux
catalyseurs E et F. Hors, cela n'a pas été pas le cas.
Cela témoigne que le platine contenu dans les catalyseurs hybrides C à E
selon l'invention n'est donc pas actif pour la réaction de réduction du
dioxygène. Sa
structure est différente de celle du platine métallique contenu dans le
catalyseur F.
Avec cette même technique expérimentale d'électrode à disque tournant
mettant en oeuvre les catalyseurs détaillés ci-dessus, la cinétique de
réaction de
réduction du peroxyde d'hydrogène a été étudiée.
La figure 3 représente les courbes de polarisation de réduction du
peroxyde d'hydrogène en électrode à disque tournant.
Dans ces expérimentations, les conditions expérimentales du dispositif
comprenant l'électrode à disque tournant étaient les suivantes :
- électrolyte acide de pH 1 contenant HC104 à une concentration de 0,1 mol/L
saturé en diazote et avec une concentration de 3 mmol/L de peroxyde
d'hydrogène,
- température ambiante,
- vitesse de rotation de l'électrode : 1600 tour/minute.
Au vu des courbes de la figure 3, on constate que le catalyseur F est très
actif :
- pour la réaction de réduction électrochimique du peroxyde d'hydrogène en
eau, et ce eu égard aux courants négatifs, ainsi que
- pour l'oxydation électrochimique du peroxyde d'hydrogène en dioxygène, et
ce eu égard aux courants positifs,
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
24
avec un potentiel à courant zéro de 0,9 - 0,95 V vs ERH, ce qui est
caractéristique
d'une surface de platine réduit.
A l'opposé, les catalyseurs A, B et D sont peu actifs pour les réactions de
réduction et d'oxydation du peroxyde d'hydrogène. Cela est caractéristique des
catalyseurs dont les sites actifs sont à base de fer.
Ainsi, les courbes de la figure 3 témoignent également clairement que les
structures de platine que comprennent les catalyseurs selon l'invention ne
sont pas du
platine métallique comme celui du catalyseur F. Le platine présent dans les
catalyseurs selon l'invention ne contribue pas à la réduction électrochimique
de
faibles quantités de peroxyde d'hydrogène produites lors de la réaction de
réduction
du dioxygène.
Ensuite, une 3Ième fonction catalytique du platine présent dans les
catalyseurs selon l'invention a été étudiée, à savoir l'oxydation
électrochimique du
dihydrogène. En effet, dans une PEMFC, un faible flux de dihydrogène traverse
la fine
membrane polymère séparant l'anode et la cathode. Le dihydrogène qui a diffusé
à
travers la membrane peut réagir chimiquement avec le dioxygène de la cathode
pour
former des espèces radicalaires extrêmement oxydantes telles que OH et 00H.
Ces
espèces radicalaires peuvent attaquer la membrane ou le catalyseur.
C'est pourquoi, par la même technique expérimentale d'électrode à
disque tournant, la cinétique d'oxydation du dihydrogène en protons H+, et de
réduction des protons H+ en dihydrogène a été étudiée.
La figure 4 représente les courbes de polarisation de la réduction des
protons et l'oxydation du dihydrogène en électrode à disque tournant.
Les conditions expérimentales du dispositif comprenant l'électrode à
disque tournant étaient les suivantes :
- électrolyte acide de pH 1 contenant HC104 à une concentration de 0,1
mol/L
saturé en dihydrogène,
- température ambiante,
- vitesse de rotation de l'électrode : 1600 tour/minute.
Au vu des courbes de la figure 4, on relève que :
- lorsqu'on utilise un catalyseur F à la cathode, la faible quantité de
dihydrogène
qui arrive de l'anode à la cathode par diffusion à travers la membrane est
immédiatement électro-oxydée en protons ;
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
- le
catalyseur A est totalement inactif pour cette réaction (cf. la courbe A sur
la
figure 4). Ce catalyseur favorise plutôt une réaction chimique entre le
dihydrogène et le dioxygène pour former des radicaux libres.
Sur la figure 4, on relève que la courbe du catalyseur E selon l'invention
5 est
presque superposée à la courbe théorique (cf. courbe calculée) correspondant à
une cinétique infinie d'oxydation du dihydrogène, à savoir que la seule perte
expérimentalement observable est due à la diffusion du dihydrogène dissous
dans
l'électrolyte vers l'électrode, la cinétique étant tellement plus rapide que
la diffusion
que la cinétique n'est alors pas quantifiable par cette méthode expérimentale.
10 Les
courbes de la figure 4 témoignent que les structures de platine dans
les catalyseurs hybrides selon l'invention sont actives pour la réaction
d'oxydation du
dihydrogène, et ce eu égard aux courants positifs de la figure 4, mais aussi
pour la
réduction des protons en dihydrogène, et ce eu égard aux courants négatifs de
la
figure 4.
15 Au vu de
la figure 4, le catalyseur A est totalement inactif pour les
réactions d'oxydation du dihydrogène et de réduction des protons. Cette
inactivité vis-
à-vis du dihydrogène et des protons est une propriété connue pour la famille
des
catalyseurs de type Fe-N-C et Co-N-C.
Les catalyseurs hybrides C à E selon l'invention montrent une
20
augmentation proportionnelle de leur activité catalytique pour le dihydrogène
et les
protons H+ avec l'augmentation de la teneur en platine. Cela peut être relié à
la
meilleure stabilisation observée en PEFMC des catalyseurs D et E selon
l'invention
dont la teneur massique en platine est respectivement de 1 % et 2 %. Les
catalyseurs
A à E ont en effet aussi été testés dans des PEMFC. Cette meilleure
stabilisation est
25 détaillée ci-après.
Les courbes de polarisation initiales en PEMFC des assemblages anode-
membrane-cathode dans lesquels seul variait le catalyseur de la cathode (à
savoir les
catalyseurs A à E testés) sont représentées à la figure 5.
Les courbes montrent la différence de potentiel électrique cathode
moins anode de la PEMFC en fonction de la densité de courant, et ce après
correction afin de tenir compte de la résistance ohmique de la membrane.
Des encres catalytiques de cathode ont été préparées en mélangeant 20
mg du catalyseur concerné, 652 uL d'une solution à 5 % en masse de Nafion
contenant en masse 15-20 % d'eau, 326 uL d'éthanol et 272 uL d'eau désionisée.
Les
encres ont été homogénéisées en les soumettant alternativement à des ultra-
sons et
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
26
à une agitation mécanique dans un agitateur vortex toutes les 15 minutes, et
ce
pendant une durée totale d'une heure.
Ensuite, 405 I d'encre de catalyseur ont été déposés successivement sur
une couche microporeuse d'un tissu de carbone d'une surface de 4,84 cm2
commercialisée par la société SGL Group - The Carbon Company sous la
dénomination commerciale SIGRACET 510-BC de manière à obtenir une cathode
comprenant une charge de catalyseur de 4 mg/cm2.
La cathode a été disposée dans une étuve sous vide à 90 C pendant une
heure pour être séchée.
L'anode contenait un catalyseur commercial de type Pt/C dont la charge
en platine était de 0,5 mg/cm2, pré-déposé sur une couche microporeuse du même
tissu de carbone, à savoir Sigracet 510-BC.
L'assemblage anode-membrane-cathode a été préparé en pressant à
chaud à 135 C pendant 2 minutes 4,48 cm2 de l'anode et de la cathode de part
et
d'autre d'une membrane commercialisée par la société DuPont sous la
dénomination
commerciale Nafion NRE-211.
Les expérimentations avec les PEMFC ont été réalisées dans une pile à
combustible commerciale mono-cellule comprenant des canaux de distribution de
gaz
en forme de serpentin (société Fuel Cell Technologies), en utilisant un banc
de test de
PEMFC interne au laboratoire, et en contrôlant le potentiel électrique de la
pile et le
courant produit avec un potentiostat commercial de la société Biologic, couplé
à un
amplificateur de 50 A de la même société.
Les conditions expérimentales étaient les suivantes :
- température de cellule : 80 C,
- gaz : dihydrogène et dioxygène humidifiés à 100 % à une température de 85 C,
- pression relative des gaz de 1 bar à l'entrée de l'anode et de la
cathode,
- flux de gaz de 50-70 cm3 / minute pour le dioxygène humidifié et le
di hyd rogè ne,
- les courbes de polarisation ont été enregistrées à une vitesse de
balayage de
30-1.
0,5 mV=s .
Au vu de la figure 5, on relève que les courbes de polarisation initiales
pour les catalyseurs B à E sont quasiment identiques. En effet, les faibles
différences
sont dues à l'erreur de reproductibilité lors de la synthèse des catalyseurs
et/ou lors
de la préparation de l'assemblage anode-membrane-cathode.
Les catalyseurs B à E sont plus performants initialement que le catalyseur
A, les densités de courant initiales à 0,5 V des catalyseurs B à E étant plus
élevées que
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
27
celle du catalyseur A d'environ 150 mA/cm2. Cela s'explique par le fait que
les
catalyseurs B à E ont subi un traitement thermique. Cela témoigne ainsi de
l'effet du
traitement thermique sur les catalyseurs de type Métal-N-C.
Afin de tester la stabilité à moyen terme des catalyseurs hybrides C à E
selon l'invention pour la réaction de réduction du dioxygène à la cathode, la
différence de potentiel de la PEMFC a été fixée à 0,5 V et la densité de
courant a été
mesurée sur 50 heures. Cette durée est suffisante pour observer une diminution
des
performances du catalyseur Fe-N-C de référence, c'est-à-dire le catalyseur B.
La figure 6 représente la densité de courant en fonction du temps pour
potentiel de PEMFC fixé à 0,5 V pendant 50 heures.
Au vu de la figure 6, on relève que les catalyseurs Fe-N-C (catalyseurs A et
B), de manière reproductible, s'activent durant les premières heures de
fonctionnement de la PEFMC, puis montrent une dégradation continue des
performances avec le temps (environ 20-25 % de perte de courant par rapport au
maximum observé après 3-6 heures).
L'ajout de platine n'augmente pas la performance initiale à 0,5 V mais
stabilise les catalyseurs hybrides (pente moindre pour le catalyseur hybride C
et
aucune perte observable sur 50 heures avec les catalyseurs hybrides D et E
selon
l'invention).
Ceci montre que les particules de platine dans les catalyseurs hybrides
selon l'invention doivent être présentes avantageusement à une teneur
suffisante
pour stabiliser de manière efficace le catalyseur Métal-N-C. Le catalyseur
hybride C
selon l'invention n'est pas complètement stable du fait de la faible teneur en
platine
(à savoir 0,5 %). Ceci est possiblement relié à une trop grande distance
moyenne entre
un site catalytique quelconque à base de fer et la plus proche particule de
platine dans
ce catalyseur hybride.
La figure 7 représente les courbes de polarisation corrigées en tenant
compte de la résistance ohmique de la membrane, mesurées après 50 heures de
fonctionnement à 0,5 V de la PEMFC.
Au vu de la figure 7, on relève qu'a bas potentiel électrique, les courbes
de polarisation correspondant aux catalyseurs D et E sont meilleures après le
test de
50 heures qu'avant le test de 50 heures. Cela est dû à une amélioration des
propriétés
de transport des espèces (dioxygène, eau, protons) dans la cathode, alors que
l'activité catalytique à 0,8 V n'est pas ou peu modifiée comme en témoignera
la figure
8 décrite ci-après.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
28
La figure 8a représente l'activité pour la réaction de réduction du
dioxygène à 0,8 V en PEMFC, avant et après le test de 50 heures.
En tenant compte de l'erreur de reproductibilité des mesures, les
activités initiales de la réaction de réduction du dioxygène pour les
catalyseurs B à E
sont quasiment identiques.
De plus, on relève que, pour chaque catalyseur, l'activité finale de la
réaction de réduction du dioxygène se rapproche de plus en plus de l'activité
initiale
avec l'augmentation de la teneur en platine des catalyseurs hybrides C à E.
Cela
témoigne que la faible teneur en platine que comprennent les catalyseurs
hybrides
selon l'invention a pour effet de stabiliser leurs sites actifs à base du
métal de
transition non précieux.
La figure 8b représente la densité de courant (i) en fonction du temps
(exprimé en heures) avec un potentiel de PEMFC fixé à 0,5 V pour le catalyseur
E testé
sur une durée de 200 heures. La figure 8b montre que la stabilisation observée
sur 50
heures (figure 6) est également effective sur de plus longues durées telles
que 200
heures. Au vu de la courbe de la figure 8b et de la courbe E de la figure 6,
on relève
que la performance finale à 0,5 V est également semblable à celle observée
après 50
heures de test.
La figure 8c représente l'activité catalytique avec un potentiel de PEMFC
fixé à 0,8 V (densité de courant divisée par le chargement total en catalyseur
E de type
P/Métal-N-C) pour le catalyseur E testé, avant et après 200 heures de
fonctionnement
de la PEMFC. Etant donné l'incertitude de la mesure d'activité en
électrochimie (de
l'ordre de plus ou moins 20%), on relève que l'activité initiale et l'activité
finale sont
très semblables. Ceci démontre que le platine partiellement oxydé dans le
catalyseur
selon l'invention peut stabiliser le catalyseur Fe-N-C à long terme, et
démontre
également que le platine ne s'est pas réduit (activé) lors du test à 0,5 V.
Dans le cas
contraire, une augmentation significative de l'activité aurait été observée
après 200
heures, ce qui n'est pas le cas.
La figure 9 représente des spectres d'absorption de rayons X autour du
seuil d'absorption L3 du platine à 11562 eV (connu sous l'acronyme anglophone
XANES )> pour X-ray Absorption Near Edge Structure ) des atomes de platine
des
catalyseurs hybrides C et E selon l'invention en comparaison du spectre XANES
autour
du seuil d'absorption L3 du platine d'une feuille métallique de platine dans
laquelle les
atomes de platine sont sous forme métallique. La figure 9 représente les
spectres
XANES de quelques eV en dessous du seuil L3 du platine jusqu'à 50 eV au dessus
de ce
seuil.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
29
Dans la feuille métallique de platine, les atomes de platine ont un degré
d'oxydation zéro et ont une structure cristalline cubique face centrée (à
savoir chaque
atome de platine a 12 atomes de platine voisins). Le spectre XANES de
nanoparticules
de platine métallique d'une structure de platine présente dans les catalyseurs
non
hybrides à base de platine ou dans les catalyseurs hybrides de type Pt/Métal-N-
C de
l'état de l'art est très similaire à celui d'une feuille de platine
métallique.
La figure 10 représente un agrandissement des spectres de la figure 9 au
niveau du seuil d'absorption L3 du platine, à savoir à 11562 eV.
La partie XANES du spectre d'absorption est caractéristique de l'ordre
local autour de l'atome absorbeur des rayons X, ici le platine. Le type
d'atome et le
nombre d'atomes autour des atomes de platine est donc d'après les figures 9 et
10
fondamentalement différent entre le catalyseur hybride selon l'invention et
les
catalyseurs de l'état de l'art.
Au vu des différences de spectres du platine entre les catalyseurs selon
l'invention et la feuille métallique de platine, on relève que le platine que
comprennent les catalyseurs selon l'invention n'a pas une structure de platine
sous
forme métallique (à savoir une structure cubique face centrée). En
particulier, entre
11562 et 11565 eV, on note que les spectres des catalyseurs selon l'invention
sont
décalés positivement de 0,5-1,0 eV par rapport au spectre de la feuille
métallique de
platine. Ce décalage positif de 0,5-1,0 eV par rapport à la feuille de platine
métallique
correspond à un degré moyen d'oxydation entre 1,1 et 2,3 des atomes de platine
situés dans les catalyseurs hybrides de type Pt/Fe-N-C selon l'invention.
Ainsi, l'état d'oxydation moyen des atomes de platine des catalyseurs
hybrides selon l'invention n'est pas égal à zéro comme cela est le cas pour le
platine
de la feuille métallique de platine. Le précurseur de sel de platine n'a donc
pas été
complètement réduit pendant la fabrication du catalyseur selon l'invention,
c'est-à-
dire pendant le traitement thermique sous mélange gazeux de dihydrogène et
diazote.
La figure 11 est un graphe de la transformée de Fourier des
expérimentations de spectroscopie d'absorption des rayons X en structure fine
(à
savoir des expérimentations ci-après abrégées EXAFS acronyme anglophone
pour
Extended X-ray Absorption Fine Structure ) du platine des catalyseurs
hybrides C et
E selon l'invention en comparaison avec la transformée de Fourier du signal
EXAFS
pour le platine de la feuille métallique de platine.
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
Cette analyse permet de tracer l'amplitude du signal EXAFS (k2z(R)), qui
dépend du nombre moyen d'atomes voisins autour de chaque atome de platine, en
fonction de la distance entre l'atome de platine absorbeur et les atomes
voisins.
La figure 11 montre que la structure à longue distance autour des atomes
5 de platine des catalyseurs hybrides de l'invention est également très
différente de
celle des atomes de platine dans une structure métallique cubique face
centrée.
En effet, au vu de la figure 11, on relève que le nombre de coordination
du platine des catalyseurs selon l'invention est moins élevé que celui du
platine de la
feuille métallique de platine.
10 Le signal EXAFS observé à une distance radiale de 2,5 angstrôm,
distance
correspondant aux atomes de platine les plus proches d'un atome de platine
donné,
est effectivement beaucoup plus faible pour le platine des catalyseurs selon
l'invention que pour le platine métallique de structure cubique face centrée
de la
feuille métallique de platine. Cela montre que le nombre de coordination du
platine
15 par d'autres atomes de platine est beaucoup plus faible dans les
catalyseurs de
l'invention que dans la structure cubique face centrée de platine dont le
nombre de
coordination est 12.
De plus, le signal EXAFS observé à 1,5 A pour les catalyseurs hybrides de
type Pt/Fe-N-C selon l'invention peut être attribué à des liaisons platine-
carbone et
20 platine-azote, à savoir des liaisons absentes dans la structure cubique
face centrée de
platine de la feuille métallique de platine.
La figure 12 représente des courbes de test de détection électrochimique
de monoxyde de carbone. Le monoxyde de carbone est une molécule connue pour
caractériser des particules de platine métallique (atomes de platine ayant un
degré
25 d'oxydation zéro à l'intérieur de la particule). Le monoxyde carbone est
utilisé
classiquement dans le domaine de l'électrochimie pour quantifier la surface de
catalyseurs à base de platine réduit.
Le monoxyde de carbone est dans un premier temps injecté dans le
système de la pile sous forme de gaz à la cathode. La molécule de monoxyde de
30 carbone s'adsorbe fortement sur la surface de platine réduit, recouvrant
toute sa
surface d'une monocouche. Le gaz monoxyde de carbone non adsorbé et en excès
est
ensuite purgé de la cathode avec un gaz inerte qui est le diazote. Seule cette
monocouche de monoxyde de carbone adsorbé sur le platine réduit reste présente
dans la cathode (le potentiel de la cathode est contrôlé autour de 0 V pendant
ce
temps, pour éviter toute oxydation prématurée du monoxyde de carbone).
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
31
La quantité de monoxyde de carbone adsorbé est ensuite quantifiée en
désorbant de manière électrochimique le monoxyde de carbone (oxydation
électrochimique du monoxyde de carbone qui se désorbe alors sous forme
oxydée),
en augmentant progressivement le potentiel électrochimique de la cathode de 0
à 1 V.
La charge électrique correspondant à l'aire sous le pic d'oxydation du
monoxyde de carbone dans le voltampérogramme est directement proportionnelle à
la quantité de monoxyde de carbone adsorbé, et donc à l'aire de platine réduit
dans le
catalyseur. La position de ce pic d'oxydation du monoxyde de carbone est
environ à
0,8 V vs. une électrode de référence à hydrogène.
La figure 12 présente la comparaison de courbes avant et après un test
de 50 heures en PEMFC à 0,5 V réalisé avec le catalyseur D.
Plus précisément, sur la figure 12 :
- la courbe intitulée initial représente le voltampérogramme déterminé
après injection de monoxyde de carbone, puis de diazote à la cathode ;
- la courbe intitulée blanc> représente le voltampérogramme déterminé
après uniquement une injection de diazote (donc sans aucune injection de
monoxyde de carbone);
- la courbe intitulée après 50 heures> représente le voltampérogramme
déterminé après injection de monoxyde de carbone, de diazote à la cathode,
puis la réalisation d'un test de fonctionnement de 50 heures en PEMFC à 0,5
V.
La figure 12 ne montre aucun signal correspondant à l'oxydation
électrochimique de monoxyde de carbone pour le catalyseur D, ni avant ni après
le
test en pile de 50 heures. La courbe intitulée initial est en effet
totalement
superposée à la courbe intitulée blanc . Cela démontre qu'aucune molécule
de
monoxyde de carbone ne s'est adsorbée sur le platine du catalyseur hybride
selon
l'invention. Ceci est inattendu et s'explique par la structure différente des
particules
de platine et par l'état différent de leur surface dans le catalyseur selon
l'invention.
Ceci est aussi corrélé à l'inactivité du platine pour la réduction du
dioxygène.
La figure 12 montre l'absence d'adsorption du monoxyde de carbone sur
le platine présent dans le catalyseur D. L'absence de pic d'oxydation (c'est-à-
dire
l'oxydation du monoxyde carbone potentiellement adsorbé sur le platine, qui se
traduirait par un pic de courant positif lors de l'augmentation du potentiel
électrochimique de 0 à 1 V) démontre que le platine est initialement incapable
d'adsorber le monoxyde de carbone. Ceci s'explique par l'état partiellement
oxydé du
platine dans le catalyseur selon l'invention. Après 50 heures de
fonctionnement en
CA 02997616 2018-03-05
WO 2017/042520 PCT/FR2016/052289
32
pile à 0,5 V, le platine est toujours incapable d'adsorber le monoxyde de
carbone,
démontrant que le platine ne s'est pas réduit lors du test en pile.
La figure 13 représente des spectres d'absorption de rayons X autour du
seuil d'absorption L3 du platine à 11562 eV des atomes de platine du
catalyseur D
(c'est-à-dire des spectres XANES ), avant et après un test en pile à 0,5 V
pendant 50
heures. La superposition des spectres montre que la coordination et le degré
d'oxydation moyen du platine dans le catalyseur D n'a pas changé au cours du
test en
pile. Le platine est donc inactif pour la réaction de réduction d'oxygène tout
au long
du test, mais il stabilise les sites catalytiques de fer de type FeNxCy.