Note: Descriptions are shown in the official language in which they were submitted.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
1
Description
Titre de l'invention : composition pour la protection et la reparation
de la barriere hematoencephalique (BHE)
Domaine technique
La présente invention se rapporte à une composition pharmaceutique
pour son application comme médicament, en particulier pour son utilisation
pour la protection de la barrière hématoencéphalique.
La présente invention se rapporte également à une composition
pharmaceutique pour son application comme médicament, en particulier
pour son utilisation pour la réparation et/ou la restauration de la barrière
hématoencéphalique.
La présente invention se rapporte à une composition pharmaceutique
pour son application comme médicament, en particulier pour son utilisation
pour la protection et/ou la réparation et/ou la restauration de la barrière
hématoencéphalique.
La présente invention trouve une application notamment dans les
domaines thérapeutiques, pharmaceutiques et vétérinaires.
Dans la description ci-dessous, les références entre parenthèses ( )
renvoient à la liste des références présentée à la fin du texte.
Etat de la technique
La barrière hématoencéphalique (BHE), également nommée barrière
hémo-encéphalique ou hémato-méningée, est constituée d'une
monocouche de cellules endothéliales dans les micro-vaisseaux cérébraux.
Ces cellules endothéliales présentent entre elles des jonctions serrées
limitant ainsi les échanges para- et trans-cellulaires entre le compartiment
sanguin et le compartiment parenchymateux. Les cellules endothéliales sont
entourées d'une membrane basale, de pieds astrocytaires et de péricytes
renforçant ainsi la BHE (Sharif et al., 2018 [16]). La lame basale sous-
jacente à l'endothélium cérébral participe activement à la dynamique de la
BHE, est constituée de 3 couches. La première synthétisée par les cellules
endothéliales est caractérisée par la présence de la laminine 4 et 5. La
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
2
deuxième, se caractérise par la présence de laminine -1 et -2, et est
synthétisée par les astrocytes. La troisième caractérisée par la présence du
collagène IV, se trouve entre les deux premières, elle est formée par les
deux types cellulaires. Ces trois couches sont également constituées de
différents types de collagène, de glycoprotéines et de protéoglycanes
notamment les héparanes sulfates protéoglycanes (HSPGs) (Cardoso et al.,
2010 [4]).
La lame basale contient aussi de nombreuses protéines,
métalloprotéases (MMPs) et leurs inhibiteurs qui sont impliqués dans la
régulation dynamique de la BHE dans les conditions physiologiques ainsi
que pathologiques.
La BHE protège les neurones contre les facteurs présents dans la
circulation systémique et maintient le milieu interne du système nerveux
central, nécessaire au bon fonctionnement synaptique et neuronal (Sharif
et al., 2018 [16]).
L'altération de la BHE a été rapportée dans de nombreuses maladies
cérébrales telles que la maladie d'Alzheimer, la maladie de Parkinson, la
maladie d'Huntington, la sclérose en plaque, l'accident vasculaire cérébral
(AVC), l'encéphalopathie traumatique chronique, mais aussi les infections
cérébrales (Abdullahi et al., 2018 [1]; Sweeney et al., 2018 [19]; Erickson
and Banks 2018 [5]). LA BHE est également altérée en présence de
tumeurs du cerveau ainsi qu'à la suite d'une irradiation encéphalique dans
le cadre d'une radiothérapie (Katherine Elizabeth Warren., 2018 [22]). La
perturbation de la BHE permet l'influx dans le cerveau d'agents
neurotoxiques dérivés du sang, de cellules et de pathogènes microbiens et
est associée à des réponses inflammatoires et immunitaires, qui peuvent
initier et exacerber plusieurs voies de mort neuronale (Sharif et al., 2018
[16]).
Il existe dans l'état de la technique des protocoles et/ou stratégies
thérapeutiques visant à protéger les composants de la structure de la
BHE : jonctions serrées et récepteurs cellulaires ; ou à lutter contre les
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
3
causes de sa perméabilité : inflammation ; oxydation ; activation des MMPs
(Sifat et al., 2017 [17]). Toutefois ces protocoles et/ou stratégies
thérapeutiques n'ont pas démontré de réel efficacité et/ou un effet
thérapeutique significatif, notamment pour la protection de la BHE.
D'autres stratégies concernant la protection de la BHE ont été
également envisagées. Par exemple, il existe dans l'état de la technique des
documents brevets décrivant des procédés ciblant des molécules de voies
de signalisation cellulaires (delta-PKC) (demande de brevet
US20090062208A1) ; des facteurs de transcription (HMGB1) (demande
W02018207792A1), la protéine S100B (document Brevet CN101632728B),
ou même les jonctions cellulaires (Claudin-5) (document Brevet
CN105148276B) en liaison avec la BHE. Cependant, aucun de ces
procédés et/ou stratégies n'a aboutie à un traitement ou une application
clinique et à ce jour. En outre, il n'existe pas, dans l'état de la technique,
de
produits connus pour agir directement comme protecteur ou pour favoriser
la restauration de la BHE. En d'autres termes, il n'existe pas actuellement
de composé et/ou de composition pharmaceutique susceptible de protéger
et/ou réparer et/ou de restaurer la Barrière Hématoencéphalique.
Il existe donc un réel besoin dans l'état de la technique de trouver un
composé et/ou une composition permettant de protéger la BHE, par
exemple de lésions et/ou altérations dues, par exemple à des pathologies
et/ou traitement, par exemple de chimiothérapies et/ou de radiothérapies,
par exemple de l'encéphale.
Il existe également un réel besoin dans l'état de la technique de trouver
un composé et/ou une composition permettant de réparer les altération et/ou
lésions de la BHE, par exemple dues à des pathologies, par exemple la
maladies d'Alzheimer, de Parkinson, d'Huntington, dans la sclérose en
plaque, suite à un accident vasculaire cérébral (AVC), une encéphalopathie
traumatique, par exemple chronique, des infections cérébrales, par exemple
des méningites, par exemple virales ou bactériennes, des altérations et/ou
lésion dues par exemple à la présence de tumeurs du cerveau et/ou
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
4
traitement, par exemple de chimiothérapies et/ou de radiothérapies, par
exemple de l'encéphale.
Il existe en outre un réel besoin dans l'état de la technique de trouver
un composé et/ou une composition permettant une restauration
fonctionnelle de la BHE, par exemple après une lésion et/ou altération de
ladite BHE.
Description de l'invention
La présente invention a précisément pour but de répondre à ces
besoins en fournissant une composition pharmaceutique pour son
application ou utilisation comme médicament pour la protection et/ou la
réparation et/ou restauration, de préférence fonctionnelle, de la barrière
hématoencéphalique, ladite composition comprenant
- un polymère biocompatible de formule générale (I) suivante
AaXxYy (I)
dans laquelle :
A représente un monomère,
X représente un groupement Ri COOR2, ou ¨ R9(C=0)Rio
Y représente un groupement 0 ou N-sulfonate et répondant à l'une
des formules suivante ¨R30S03R4, -R5NS03R6, ¨R7S03R8 dans
lesquelles :
Ri, R3, R5 et Rg représentent indépendamment une chaîne
hydrocarbonée aliphatique, éventuellement ramifiée et/ou insaturée
et qui contient éventuellement un ou plusieurs cycles aromatiques à
l'exception de la benzylamine et de la benzylamine sulfonate,R2, R4,
R6 et R8 représentent indépendamment un atome d'hydrogène ou
un cation M+, etR7 et Rio représentent indépendamment une liaison,
une chaîne hydrocarbonée aliphatique, éventuellement ramifiée
et/ou insaturée,
a représente le nombre de monomères,
x représente le taux de substitution des monomères A par des
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
groupements X,
y représente le taux de substitution des monomères A par des
groupements Y.
5 La présente invention a précisément pour but de répondre à ces
besoins en fournissant une composition pharmaceutique pour son utilisation
comme médicament pour la protection et/ou la réparation et/ou restauration,
de préférence fonctionnelle, de la barrière hématoencéphalique, ladite
composition comprenant
- un polymère biocompatible de formule générale (I) suivante
AaXxYy (I)
dans laquelle :
A représente un monomère,
X représente un groupement Ri COOR2, ou ¨ R9(C=0)Rio
Y représente un groupement 0 ou N-sulfonate et répondant à l'une
des formules suivante ¨R30S03R4, -R5NS03R6, ¨R7S03R8 dans
lesquelles :
Ri, R3, R5 et Rg représentent indépendamment une chaîne
hydrocarbonée aliphatique, éventuellement ramifiée et/ou insaturée
et qui contient éventuellement un ou plusieurs cycles aromatiques à
l'exception de la benzylamine et de la benzylamine sulfonate,R2, R4,
R6 et R8 représentent indépendamment un atome d'hydrogène ou
un cation M+, etR7 et Rio représentent indépendamment une liaison,
une chaîne hydrocarbonée aliphatique, éventuellement ramifiée
et/ou insaturée,
a représente le nombre de monomères,
x représente le taux de substitution des monomères A par des
groupements X,
y représente le taux de substitution des monomères A par des
groupements Y.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
6
Avantageusement, l'inventeur a démontré de manière surprenante que
l'utilisation de polymère biocompatible selon l'invention permet
avantageusement de consolider, renforcer et/ou réparer la barrière
hématoencéphalique (BHE).
En particulier, les inventeurs ont démontré de manière surprenante que
l'utilisation de polymère biocompatible selon l'invention permet
avantageusement, lorsque la barrière hématoencéphalique (BHE) a été
altérée, par exemple présente une inflammation et/ou lésion et/ou toute
altération connue de l'homme du métier, quelque qu'en soit la cause ou
l'origine, de réparer et/ou renforcer et/ou restaurer la barrière
hématoencéphalique (BHE).
Les inventeurs ont également démontré de manière surprenante et
inattendue que l'utilisation du polymère selon l'invention permet
avantageusement d'accélérer et d'améliorer la récupération fonctionnelle de
la barrière hématoencéphalique (BHE). En outre, les inventeurs ont
démontré de manière surprenante et inattendue, que lorsque l'altération de
la BHE a un effet sur les fonctions motrices et/ou cognitives, l'utilisation
du
polymère selon l'invention permet en outre d'accélérer et/ou d'améliorer la
récupération fonctionnelle motrices et cognitives.
Dans la présente par protection de la barrière hématoencéphalique on
entend, par exemple une amélioration de structure de la membrane basale
de la barrière hématoencéphalique et/ou une stimulation des cellules
endothéliales de la barrière hématoencéphalique et/ou un renforcement des
jonctions serrées de la barrière hématoencéphalique. Avantageusement la
protection de la barrière hématoencéphalique permet, par exemple, une
protection de celle-ci des agressions extérieures, par exemple de
rayonnement ionisant, par exemple des rayons X, de rayons gamma, de
composés isotopiques, par exemple des composés xénobiotiques,
différentes toxines et pathogènes. La protection de la barrière
hématoencéphalique peut également permettre le maintien de
l'homéostasie du système nerveux central, par exemple une régulation du
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
7
flux ionique, et/ou régulation du flux moléculaire et cellulaire, notamment
entre le compartiment sanguin et le système nerveux central. Ces flux
peuvent être délétères pour le système nerveux central en cas de lésion et
de perméabilité de ladite barrière.
Dans la présente par réparation de la barrière hématoencéphalique on
entend, par exemple la reformation et/ou amélioration de la structure de la
barrière hématoencéphalique, par exemple lorsque la structure de ladite
barrière a été altérée, par exemple due à une lésion, une agression
extérieure, par exemple un pathogène, une maladie, due à une inflammation
et/ou tout évènement connu de l'homme du métier susceptible d'altérer et/ou
modifier la structure et/ou fonction de la barrière hématoencéphalique. Il
peut s'agir par exemple d'une accélération de la cicatrisation d'une lésion de
la barrière hématoencéphalique, d'une diminution d'une inflammation de la
barrière hématoencéphalique, d'une cicatrisation et/ou amélioration de la
membrane basale de de la barrière hématoencéphalique et/ou des cellules
endothéliales de la barrière hématoencéphalique et/ou des jonctions serrées
de la barrière hématoencéphalique.
Dans la présente par restauration de la barrière hématoencéphalique
on entend réparation structurelle et/ou reformation de la barrière
hématoencéphalique et restauration / amélioration de la fonction barrière
hématoencéphalique, par exemple de la perméabilité de la barrière
hématoencéphalique et/ou de toute fonction physiologique de la barrière
hématoencéphalique.
Dans la présente par monomère on entend par exemple un
monomère choisi dans le groupe comprenant les sucres, les esters, les
alcools, les acides aminés ou les nucléotides.
Dans la présente invention, les monomères A constituent les
éléments de base des polymères de formule I peuvent être identiques ou
différents.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
8
Dans la présente invention, les monomères A peuvent être
indépendamment des monomères de formule suivante :
-istru-0
\> _________________________________ 0
P. 1
dans laquelle Ru i et R12 représente indépendamment un atome d'oxygène,
une chaîne hydrocarbonée aliphatique, éventuellement ramifiée et/ou
insaturée, un groupe hétéroaryle comprenant indépendamment un ou
plusieurs atomes d'oxygène et/ou d'azote, une fonction aldéhyde, un groupe
acide carboxylique, un diol, un diol substitué, un groupement de formule
-R13-(X)n-R14 dans laquelle R13 représente une chaine carbonée aliphatique
en Ci à C4, éventuellement ramifiée et/ou insaturée, X représente un
hétéroatome choisi parmi l'oxygène et l'azote, est un entier compris de 1 à
4 et Ru est un atome d'hydrogène, une chaîne hydrocarbonée aliphatique,
éventuellement ramifiée et/ou insaturée, un groupe hétéroaryle comprenant
indépendamment un ou plusieurs atomes d'oxygène et/ou d'azote, une
fonction aldéhyde, un groupe acide carboxylique, un diol, un diol substitué.
Dans la présente invention, l'association de monomères peut
permettre de former un squelette polymérique, par exemple un squelette
polymérique de nature polyester, polyalcool, polysaccharidique, du type des
acides nucléiques ou des protéines.
Dans la présente invention, parmi les polyesters, il peut s'agir par
exemple de copolymères de biosynthèse ou synthèse chimique, par
exemple des polyesters aliphatiques ou d'origine naturelle par exemple les
polyhydroxyalconaotes.
Dans la présente invention, les polysaccharides et leurs dérivés
peuvent être d'origine bactérienne, animale, fongique et/ou d'origine
végétale. Il peut s'agir par exemple de polysaccharides à chaîne simple, par
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
9
exemple les polyglucoses, par exemple le dextran, la cellulose, le bêta
glucan, ou d'autres monomères comprenant des unités plus complexes, par
exemple les xanthanes, par exemple le glucose, mannose et acide
glucuronique ou encore des glucuronanes et glucoglucuronane.
Dans la présente invention, les polysaccharides d'origine végétale
peuvent être à simple chaîne, par exemple la cellulose (glucose), les
pectines (acide galacturonique), les fucanes, l'amidon ou plus complexe
comme les alginates (acide galuronique et mannuronique).
Dans la présente invention, les polysaccharides d'origine fungique
peuvent être par exemple le stéroglucane.
Dans la présente invention, les polysaccharides d'origine animale
peuvent être par exemple les chitines ou le chitosan (glucosamine).
Dans la présente invention, les monomères A constituant les éléments
de base des polymères de formule I peuvent être avantageusement
identiques.
Dans la présente invention, les monomères A constituant les éléments
de base des polymères de formule I peuvent être avantageusement le
glucose.
Le nombre de monomères A défini dans la formule (I) par a peut
être tel que la masse desdits polymères de formule (I) est environ entre 2
000 et 6 000 daltons, par exemple ce qui correspond à au moins 10
monomères de glucose. Par exemple masse desdits polymères de formule
(I) peut environ entre 3000 daltons et 6000 daltons, par exemple ce qui
correspond à 12 à 20 monomères de glucose.
Le nombre de monomères A défini dans la formule (I) par a peut
être également tel que la masse desdits polymères de formule (I) est
inférieure à environ 2 500 000 daltons (ce qui correspond à 7000
monomères de glucose). De façon avantageuse, la masse desdits
polymères de formule (I) peut être comprise de 3000 à 250 000 daltons, par
exemple de 3000 à 6000 daltons, ou par exemple de 20 000 à 250 000
daltons, ou par exemple de 75 000 à 150 000 daltons.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
Dans la présente invention, dans le groupement -R1C00R2
représentant X, Ri peut être un alkyle en Ci à C6, par exemple un méthyl,
un éthyl, un butyl, un propyl, un pentyl, de préférence un groupement méthyl,
et R2 peut être une liaison, un alkyle en Ci à C6, par exemple un méthyl, un
5 éthyl,
un butyl, un propyl, un pentyl, un groupement R21 R22 dans lequel R21
est un anion et R22 un cation choisi dans le groupe des métaux alcalins.
De préférence, le groupement X est le groupement de formule
-RiCOOR2 dans laquelle Ri est un groupement méthyle ¨CH2- et R2 un
groupement R21 R22 dans lequel R21 est un anion et R22 un cation choisi dans
10 le groupe des métaux alcalins, de préférence le groupement X est un
groupement de formule ¨CH2-000- ou carboxyméthyl.
Dans la présente invention, dans le groupement ¨R9(C=0)Rio
représentant X, Rg peut être un alkyle en Ci à C6, par exemple un méthyl,
un éthyl, un butyl, un propyl, un pentyl, de préférence un groupement méthyl,
et Rio peut être une liaison, un alkyle en Ci à C6, par exemple un méthyl, un
éthyl, un butyl, un propyl, un pentyl, un hexyl.
Le taux de substitution de l'ensemble des monomères A par les
groupements X défini dans la formule générale (I) par x peut être compris
de 10 à 150%, de 40 à 80%, et de préférence de l'ordre de 50% ou 60%.
Dans la présente invention, dans le groupement répondant à l'une des
formules suivantes ¨R30S03R4, -R5NSO3R6, ¨R7S03R8 et représentant le
groupement Y, R3 peut être une liaison, un alkyle en Ci à C6, par exemple
un méthyl, un éthyl, un butyl, un propyl, un pentyl, de préférence un
groupement méthyl, R5 peut être une liaison, un alkyle en Ci à C6, par
exemple un méthyl, un éthyl, un butyl, un propyl, un pentyl, de préférence
un groupement méthyl, R7 peut être une liaison, un alkyle en Ci à C6, par
exemple un méthyl, un éthyl, un butyl, un propyl, un pentyl, de préférence
un groupement méthyl, R4, R6 et R8 peuvent être indépendamment un atome
d'hydrogène ou un cation M+, par exemple M+ peut être un métal alcalin.
De préférence, le groupement Y est le groupement de formule
¨R7S03R8 dans lequel R7 est une liaison et R8 est un métal alcalin choisi
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
11
dans le groupe comprenant le lithium, le sodium, le potassium, le rubidium
et le césium. De préférence, le groupement Y est un groupement ¨S03-,
¨S03- Na.
Le taux de substitution de l'ensemble des monomères A par les
groupements Y défini dans la formule générale (I) par y peut être compris
de 10 à 170%, de 30 à 150%, de 55 à 160%, de 55 à 85%, de 120 à 160%,
et de préférence de l'ordre de 70, 140 ou 150%.
Dans la présente invention, la définition des taux de substitutions ci-
dessus, on entend par un taux de substitution x de 100%, le fait que
chaque monomère A du polymère de l'invention contient statistiquement un
groupement X. De même, on entend par un taux de substitution y de
100%, le fait que chaque monomère du polymère de l'invention contient
statistiquement un groupement Y. Les taux de substitution supérieurs à
100% traduisent le fait que chaque monomère porte statistiquement plus
d'un groupement du type considéré ; à l'inverse, les taux de substitution
inférieurs à 100% traduisent le fait que chaque monomère porte
statistiquement moins d'un groupement du type considéré.
Les polymères peuvent également comprendre des groupements
chimiques fonctionnels, désignés Z, différents de X et Y.
Dans la présente invention, les groupements Z peuvent être identiques
ou différent, et peuvent indépendamment être choisis dans le groupe
comprenant des acides aminés, des acides gras des alcools gras, des
céram ides, ou des dérivés de ceux-ci, ou des séquences nucléotidiques
d'adressages, des anticorps, des fragments d'anticorps.
Les groupements Z peuvent également représenter des agents actifs
identiques ou différents. Il peut s'agir par exemple d'agents thérapeutiques,
d'agents de diagnostic, d'un anti-inflammatoire, d'un antimicrobien, d'un
antibiotique, d'un facteur de croissance, d'une enzyme, d'un composé
antioxydant, polyphénols, des tanins, des anthocyanes, des lycopènes, des
terpenoides et le resvératrol. Dans la présente invention, le groupement Z
peut être avantageusement un acide gras saturé ou insaturé. Il peut s'agir
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
12
par exemple d'un acide gras choisi dans le groupe comprenant l'acide
acétique, l'acide caprylique, l'acide caprique, l'acide laurique, l'acide
myristique, l'acide palmitique, l'acide stéarique, l'acide arachidique,
l'acide
béhénique, l'acide lignocérique, l'acide cérotique, l'acide myristoléique,
l'acide palmitoléique, l'acide sapiénique, l'acide oléique, l'acide élaïdique,
l'acide trans-vaccénique, l'acide linoléique, l'acide linolélaïdique, l'acide
a-
linolénique, l'acide y-linolénique, l'acide dihomo-y-linolénique, l'acide
arachidonique, l'acide eicosapentaénoïque, l'acide clupanodonique ou
l'acide docosahexaénoïque. De préférence, l'acide gras est l'acide acétique.
Dans la présente invention, le groupement Z peut être
avantageusement un acide aminé de la série L ou D choisi dans le groupe
comprenant l'alanine, l'asparagine, une chaine aromatique par exemple la
tyrosine, la phénylalanine, le tryptophane, la thyroxine ou l'histidine. De
préférence, l'acide aminé est la phénylalanine.
Dans la présente invention, le groupement Z peut être un antioxydant,
par exemple la vitamine A, C, E, B9, B6, le glutathion, le sélénium, les
polyphénols, par exemple les catéchines, par exemple du thé vert, les
flavonoïdes, les tanins, les anthocyanes, par exemple des fruits rouges, les
lycopènes, les terpenoïdes et le resvératrol.
Dans la présente invention, le groupement Z peut être des composés
anti-âges, par exemple des rétinoïdes, des allantoïnes.
Dans la présente invention, le groupement Z peut être des anticorps,
des fragments d'anticorps, par exemple des fragments Fab. Il peut s'agir par
exemple d'anticorps et/ou de fragments d'anticorps d'adressages, par
exemple des anticorps et/ou fragments d'anticorps susceptible de cibler la
Barrière Hématoencéphalique.
Avantageusement, les groupements Z peuvent conférer aux
polymères des propriétés biologiques ou
physicochim igues
supplémentaires. Par exemple les groupements Z peuvent augmenter la
solubilité ou la lipophilie dudit polymère permettant par exemple une
meilleure diffusion ou pénétration tissulaire.
CA 03141923 2021-11-25
WO 2020/239356 PCT/EP2020/062081
13
Avantageusement, les groupements Z peuvent conférer aux
polymères des propriétés biologiques ou physicochimiques
supplémentaires Ainsi, les polymères de l'invention, par exemple lorsque le
groupement Z est choisi parmi un composé antioxydant, un composé anti-
âge, les polymères de l'invention peuvent avantageusement véhiculer ces
composés et ainsi fournir un effet biologique additionnel et/ou
complémentaire.
Des polymères dans lesquels Z est présent peuvent répondre à la
formule II suivante :Aa Xx Yy Zz (II)
dans laquelle, A, X, Y, a, x, y sont tel que défini ci-dessus et z représente
le
taux de substitution par des groupements Z.
Dans la présente invention le taux de substitution par des groupements
Z représenté par z peut être compris de 1 à 50%, de 10 à 25%, de
préférence égale à 15, 20 ou 25%.
Les groupements X, Y et Z peuvent être indépendamment fixés sur le
monomère A et/ou indépendamment fixés les uns aux autres. Lorsqu'au
moins un des groupements X, Y et Z est indépendamment fixé sur un
groupement X, Y et Z différent du premier, un desdits groupements X, Y ou
Z est fixé au monomère A.
Ainsi, les groupements Z peuvent être fixés par covalence directement
sur les monomères A ou fixés par covalence sur les groupements X et/ou Y.
Dans la présente invention les groupements Z peuvent aussi être
conjugués aux polymères de formule AaXxYy par des liaisons autres que
covalentes, par exemple par des liaisons ioniques, par exemple via des
interactions ioniques, des liaisons hydrophiles ou des liaisons hydrophobes.
Les polymères de l'invention peuvent alors constituer un système de
vectorisation de Z.
Dans la présente invention, le polymère peut être par exemple un
polymère choisi dans le groupe comprenant les composés 0TR4120,
0TR41201, 0TR41202, 0TR41203, 0TR41205, 0TR41210 0TR41301,
0TR41302, OTR41303, OTR41305, OTR 41310, 0TR3131.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
14
Dans la présente, le polymère peut être par exemple un polymère
choisi dans le groupe comprenant les composés 0TR41201, 0TR41202,
0TR41203, 0TR41205, 0TR41210, 0TR4120, 0TR4122, 0TR4125,
0TR41301, 0TR41302, 0TR41303, 0TR41305, 0TR41310, 0TR3131,
0TR4132, 0TR4135, 0TR415 avec les caractéristiques mentionnées dans
le tableau 1 ci-dessous
Tableau 1 : Polymères des familles Aa Xx Yy (I) et Aa Xx Yy Zz (II) dans
lesquels A est le glucose (PM 180D), X est CarboxyMéthyl (PM 58 D) Y:
S03- (PM 80D) et Z est Acétate (PM 43D) ou phénylalanine (PM 165D).
X Y
polymère A : glucose
-CH2C00 -S03- -OCCH3
phénylalanine
Polymère
Poids M `)/0 de
de Dextran `)/0 de `)/0 de
Nom du moléculaire substitution
de départ substitution substitution
RGTA moyen OCCH3
(PM en CM /glucose SO4 / glucose)
+/-15% /glucose
Dalton)
CMDS
0TR4120 3 000 1 500 60+/-20 150+/-20 0
1
CMDS
0TR4120 6 000 3 000 60+/-20 150+/-20 0
2
CMDS
0TR4120 10 000 5 000 60+/-20 150+/-20 0
3
CMDS
0TR4120 20 000 10 000 60+/-20 150+/-20 0
5
CMDS
0TR4121 40 000 20 000 60+/-20 150+/-20 0
0
CMDS
80 000 40 000 60+/-20 150+/-20 0
OTR4120
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
CMDS
220 000 110 000 60+/-20 150+/-20 0
OTR4122
CMDS
500 000 250 000 60+/-20 150+/-20 0
OTR4125
CMDSA
0TR4130 3 000 1 500 60+/-20 140+/-20 20+/-5
1
CMDSA
0TR4130 6 000 3 000 60+/-20 140+/-20 20+/-5
2
CMDSA
0TR4130 10 000 5 000 60+/-20 140+/-20 20+/-5
3
CMDSA
0TR4130 20 000 10 000 60+/-20 140+/-20 20+/-5
5
CMDSA
0TR4131 40 000 20 000 60+/-20 140+/-20 20+/-5
0
CMDSA
80 000 40 000 60+/-20 140+/-20 20+/-5
OTR4131
CMDSA
220 000 110 000 60+/-20 140+/-20 20+/-5
OTR4132
CMDSA
500 000 250 000 60+/-20 140+/-20 20+/-5
OTR4135
CMDSP
5000 60+/-20 70+/-15 15+/-5
OTR415
Dans la présente invention, la composition peut comprendre une
concentration de 0,1 à 100pg/mL en poids de polymère biocompatible par
rapport au volume de la composition. Par exemple la composition peut
5 comprendre une concentration de 1 à 10pg/mL en poids de polymère
biocompatible par rapport au volume total de la composition.
Dans la présente invention, la composition peut être formulée et/ou
adaptée selon son administration. Par exemple, pour une administration par
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
16
voie parentérale la composition peut être administrée afin de délivrer une
dose de polymère biocompatible comprise de 0,01 à 5 mg par kilogramme
de poids corporel, de préférence de 0,1 à 1,5 mg par kilogramme de poids
corporel à la fréquence d'une administration par semaine.
Par exemple, pour une administration par voie orale la composition
peut être administrée afin de délivrer une dose de polymère biocompatible
comprise de 0,1 à 5 mg par kilogramme de poids corporel, de préférence de
0,01 à 1,5 mg/kg à la fréquence d'une administration quotidienne ou bi
hebdomadaire.
Pour une administration sublinguale la prise peut être quotidienne ou
bi hebdomadaire et comprise entre 0,5 pg/kg et 100pg /kg.
Par exemple, pour une administration intra-artérielle, le polymère
biocompatible peut être à une concentration comprise de 0,1 à 100 pg/mL
en poids de polymère biocompatible par rapport au volume total de la
composition, de préférence de 1 à 20 mL.
Avantageusement, lorsque la composition et/ou polymère est
administré par voie intra-artérielle, l'administration peut être effectuée
dans
une voie d'abord au cerveau, par exemple dans l'artère carotide interne.
Par exemple, pour une injection intracrânienne, le polymère
biocompatible peut être à une concentration comprise de 0,1 à 100 pg/mL
en poids de polymère biocompatible par rapport au volume total de la
composition, de préférence de 5 à 20 pl.
Avantageusement, lorsque la composition et/ou polymère est
administré par voie intracrânienne, l'administration peut être effectuée de
manière simultanée ou successive dans différentes régions intracrânienne.
Par exemple, pour une injection intraventiculaire ou intrathécale, le
volume administré peut être compris de 5p1 à 2m1, par exemple de 500p1,
par exemple de 2m. Par exemple, pour une injection intraventiculaire ou
intrathécale le volume administré peut être isovolumetrique, par exemple
jusqu'à 2 ml. Par exemple, le volume administré peut être tel que décrit dans
Marks et al., 2008 [10], Raffi et al, 2014 [13] et/ou Blaney et al, 2004 [3].
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
17
Pour une administration orale par exemple sous forme de pilule ou
gélule la dose de polymère biocompatible peut être comprise de 0,0001 à 5
mg par kilogramme de poids corporel.
Pour une administration orale par exemple sous forme de pilule ou
gélule, la prise peut être quotidienne.
Selon l'invention, le poids moléculaire du polymère biocompatible peut
être compris de 3000 D à 2 500 000 Daltons.
Par exemple, le poids moléculaire du polymère biocompatible peut être
compris de 3000 à 6000 Daltons, de 6000 à 2 500 000 daltons, de
préférence de 20 000 à 250 000 daltons et par exemple de 75 000 à 150 000
daltons.
Avantageusement, le poids moléculaire des polymères biocompatibles
présents dans la composition peuvent être choisi en fonction de la voie
d'administration de la composition et la fréquence d'administration. Par
exemple pour une injection par voie intravasculaire, par exemple intra-
artérielle, le poids moléculaire du polymère biocompatible peut être compris
de 3000 à 200 000 Daltons selon le niveau d'atteinte de la lésion de la
barrière hémato-encéphalique, de préférence de 3000 à 150 000 Daltons.
Avantageusement, le poids moléculaire des polymères biocompatibles
présents dans la composition peuvent être choisi en fonction de l'altération
et/ou l'état de la Barrière Hémato-Encéphalique.
Par exemple, lorsque la Barrière Hémato-Encéphalique subit des
altérations structurelles importantes, par exemple à une lésion induisant une
grande perméabilité de la Barrière Hémato-Encéphalique, le poids
moléculaire du polymère biocompatible peut être compris de 3000 à 200 000
Daltons, de préférence de 70 000 à 150 000 daltons.
Avantageusement, le poids moléculaire du polymère biocompatible
peut être adapté à la suite et/ou en fonction de la réparation progressive de
la Barrière Hémato-Encéphalique. Par exemple, lorsque la Barrière Hémato-
Encéphalique présente des altérations structurelles importantes, le poids
moléculaire du polymère biocompatible peut être compris de 3000 à 200 000
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
18
Daltons, de préférence de 70 000 à 150 000 daltons. Par la suite, le poids
moléculaire utilisé peut être réduit par exemple 3000 à 100 000 Daltons, de
préférence de 10 000 à 70 000 daltons.
Selon l'invention, la composition peut comprendre en outre un
hydrogel.
Dans la présente, par hydrogel on entend tout hydrogel adapté connu
de l'homme du métier. Il peut s'agir par exemple d'un hydrogel choisi dans
le groupe comprenant de l'acide hyaluronique ou dérivé de celui-ci,
d'hydrogels biocompatibles utilisés dans le remplissage de l'espace cérébral
après lésion. Il peut s'agir par exemple d'hydrogel décrit dans le document
Vladimir A. Kornev et al: Hydrogel-assisted neuroregeneration approaches
towards brain injury therapy: A state-of-the-art review. Computational and
Structural Biotechnology Journal 16 j.csbj.2018.10.011 [24] et/ou décrit dans
le document Gopalakrishnan A, Shankarappa SA, Rajanikant GK. Hydrogel
Scaffolds: Towards Restitution of lschemic Stroke-lnjured Brain 2019
Feb;10(1):1-18 [25].
Dans la présente la composition peut comprendre une concentration
d'hydrogel de 0,1 % à 50,/0 ,
de préférence de 0,5% à 2,5% en poids
d'hydrogel.
Selon l'invention, la composition peut comprendre de l'acide
hyaluronique et/ou au moins un hydrogel et/ou un mélange de ceux-ci
Dans la présente par acide hyaluronique on entend tout acide
hyaluronique connu de l'homme de l'Homme du métier, par exemple un
glycosaminoglycane linéaire non sulfaté composé d'unités répétitives
d'acide D-glucuronique et de N-acétyl-D-glucosamine. Il peut s'agir par
exemple d'acide hyaluronique (HA) sous sa forme acide ou sous forme de
sel (hyaluronate), d'acide hyaluronique réticulé Le HA est un
glycosaminoglycane linéaire non sulfaté composé d'unités répétitives de D-
acide glucuronique et de N-acetyl-D-glucosamine (Tammi R., Agren UM.,
Tuhkanen AL., Tammi M. Hyaluronan metabolism in skin. Progress in
Histochemistry & Cytochemistry. 29(2):1-81, 1994 [26]). Il peut s'agir par
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
19
exemple d'acide hyaluronique ayant des fractions de poids moléculaire
moyen de 5 000 à 3 000 000 Dalton, de préférence entre 50 000 et
2 000 000 Dalton. Dans la présente l'acide hyaluronique peut être obtenu
par tout procédé connu de l'homme du métier. Il peut s'agir par exemple de
procédés décrits dans la revue Hyaluronan fragments: an information-rich
system (R. Stern et al., European Journal of Cell Biology 58 (2006) 699-
715[27]). Il peut s'agir également d'acide hyaluronique naturel ou modifiés,
disponible dans le commerce, quel que soit leurs désignations et/ou poids
moléculaire, par exemple d'acide hyaluronique commercial choisi parmi
Hyactive CPN ; Cristalhyal ; Nutra HA; Oligo HA; D Factor; Hyaluderm ;
juvelift ; Restylane; Revitacare sans que cette liste soit exhaustive. Il peut
s'agir également d'acide hyaluronique commercialisé par la société Contipro
(https://www. conti pro. com/portfol io/m anufacturer-of-anti-ageing-cosmetic-
raw-materials/HyActive") et/ou
Givaudan
(https://www. g ivaudan. com/fragrances/active-
beauty/products/cristalhyal%C2%AE-range).
Dans la présente, la composition peut comprendre une concentration
de 0,1 à 5% en poids d'acide hyaluronique par rapport au poids total de la
composition. Par exemple la composition peut comprendre une
concentration de 0,5% à 2,5% en poids d'acide hyaluronique par rapport au
poids total de la composition.
Dans la présente, la composition d'hydrogel peut être formulée pour
une administration par voie intracrânienne directe, pour injection locale
intracrânienne, notamment via une voie d'abord intra-artérielle, la
composition peut comprendre une concentration de 1 à 10 mg/mL en poids
d'acide hyaluronique par rapport au volume total de la composition.
Dans la présente, par composition pharmaceutique on entend
toute forme de composition pharmaceutique connue de l'Homme du métier.
Dans la présente, la composition pharmaceutique peut être par exemple une
solution injectable. Il peut s'agir par exemple une solution injectable, par
exemple pour une injection locale ou systémique, par exemple en sérum
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
physiologique, en solution glucose injectable, en présence d'excipients, par
exemple de Dextrans, par exemple a des concentrations connues de
l'homme du métier, par exemple du microgramme à quelques milligrammes
par mL. La composition pharmaceutique peut être par exemple un
5 médicament destiné à une administration orale choisie dans le groupe
comprenant une formulation liquide, une forme posologique effervescente
orale, une poudre orale, un système multiparticule, une forme galénique
orodispersible.
Par exemple, lorsque la composition pharmaceutique est pour
10 administration orale, elle peut être sous la forme d'une formulation
liquide
choisie dans le groupe comprenant une solution, un sirop, une suspension,
une émulsion. Lorsque la composition pharmaceutique est sous la forme
d'une forme posologique effervescente orale, elle peut être sous une forme
choisie dans le groupe comprenant les comprimés, les granules, les
15 poudres. Lorsque la composition pharmaceutique est sous la forme d'une
poudre orale ou un système multiparticulaire, il peut être sous une forme
choisie dans le groupe comprenant des billes, des granulés, des mini-
comprimés et les microgranules. Lorsque la composition pharmaceutique
est sous la forme d'une forme posologique orodispersible, elle peut être sous
20 une forme choisie dans le groupe comprenant des comprimés
orodispersibles, gaufrettes lyophilisées, films minces, un comprimé à
mâcher, d'un comprimé, d'une capsule ou d'une gomme médicale à mâcher.
Selon la présente invention, la composition pharmaceutique peut être
une composition pharmaceutique pour administration par voir orale, par
exemple buccale et/ou sublingual, par exemple choisie dans le groupe
comprenant les comprimés buccaux ou sublinguaux, les pastilles, gouttes,
une solution pour pulvérisations.
Selon la présente invention, la composition pharmaceutique peut être
une composition pharmaceutique pour administration topique,
transdermique, par exemple choisie dans le groupe comprenant les
pommades, crèmes, gels, lotions, patchs et mousses.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
21
Selon la présente invention, la composition pharmaceutique peut être
une composition pharmaceutique pour administration nasale, par exemple
choisi dans le groupe comprenant des gouttes nasales, spray nasal, de la
poudre nasale.
Selon la présente invention, la composition pharmaceutique peut être
une composition pharmaceutique pour administration parentérale, par
exemple sous-cutanée, intramusculaire, intraveineuse, intra-artérielle,
intracranienne, intrathécale. De préférence la composition pharmaceutique
peut être une composition pharmaceutique pour administration intra-
artérielle et/ou intracranienne.
La composition de la présente invention peut également comprendre
au moins un autre ingrédient actif, particulièrement un autre ingrédient
thérapeutiquement actif, par exemple pour une utilisation simultanée,
séparée ou étalée dans le temps suivant la formulation galénique utilisée.
Cet autre ingrédient peut être par exemple un ingrédient actif utilisé par
exemple dans le traitement de maladies opportunes qui peuvent se
développer chez un patient présentant une altération et/ou lésion de la
barrière hématoencéphalique. Il peut s'agir également de produits
pharmaceutiques connus de l'homme du métier, par exemple des
antibiotiques, anti-inflammatoires, anticoagulants, des neuroprotecteurs,
des inhibiteurs de l'acétylcholinestérase, des antidépresseurs, des
antiviraux
Selon l'invention, la composition peut être, par exemple, administrée
quotidiennement, biquotidiennement et hebdomadairement. Il peut s'agir
par exemple d'une administration une fois par jour, deux fois par jour ou
plus.
Selon l'invention, la composition peut être, par exemple, administrée
sur une durée de 1 jour à 3 mois, par exemple pendant 2 mois. Par exemple,
la composition peut être administrée sur une période de 3 mois avec une
fréquence d'administration tous les jours.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
22
La présente invention a également pour objet l'utilisation d'une
composition pharmaceutique comprenant un polymère biocompatible de
formule AaXxYy (I) ou AaXxYyZz (II) pour la fabrication d'un médicament
pour la protection et/ou la réparation/restauration de la barrière
hématoencéphalique.
Le polymère biocompatible est tel que défini ci-dessus.
Dans ce mode de réalisation, par médicament on entend une
composition pharmaceutique telle que définie ci-dessus.
Avantageusement, les inventeurs ont démontré que le polymère
biocompatible permet, de manière surprenante à la fois d'accélérer la
réparation/reformation de la Barrière Hémato-Encéphalique lorsque que
celle-ci est altérée tant au niveau structurelle et/ou fonctionnelle. En
outre,
les inventeurs ont démontrés que le polymère biocompatible permet
avantageusement et de manière surprenante une restauration fonctionnelle
de la Barrière Hémato-Encéphalique, en particulier une restauration de sa
perméabilité, quelle que soit la cause et/ou l'origine de sa modification
et/ou
altération.
Brève description des figures
La figure 1 représente l'évolution de la perméabilité de la barrière
hémato-encéphalique (BHE) après un accident vasculaire ischémique en
fonction du temps, l'ordonné correspond à la perméabilité et l'abscisse le
temps en heures.
La figure 2 représente un exemple de structure de polymère
biocompatible, par exemple la structure du composé OTR4132.
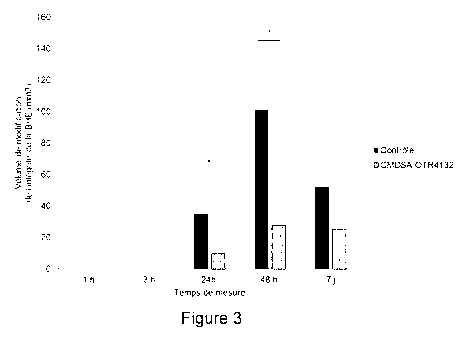
La figure 3 est un diagramme en bâton représentant l'évolution de la
perméabilité de la BHE dans des régions d'intérêt étudiée par IRM. Sur
cette figure, l'abscisse correspond au temps en heures ou jours après
l'ischémie cérébrale: 1 h, 3 h, 24 h, 48 h, et 7 jours après l'ischémie. Les
valeurs obtenue correspondent au moyenne +/- écart type. Sur cette
figure, l'ordonnée correspond au volume de modification de l'intégrité de la
BHE en mm3 Les valeurs obtenues pour des rats pour lesquels une
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
23
composition comprenant un polymère biocompatible (0TR4132) a été
administrée sont représentées par des bâtons blanc, les valeurs obtenues
pour des rats pour lesquels une composition contrôle a été administré sont
représentées par des bâtons noirs.
La figure 4 est un diagramme en bâton représentant la perméabilité
de la BHE après une ischémie cérébrale par coloration au bleu d'Evans.
Sur cette figure, l'ordonné représente la quantité de bleu d'Evans en pg/g
de tissu cérébral en fonction de la zone ischémiée du système nerveux
central, à savoir ipsalatéral ou controlatéral. Les valeurs obtenus pour des
rats pour lesquels une composition comprenant un polymère biocompatible
(0TR4132) a été administrée sont représentées par des bâtons grisés, les
valeurs obtenues pour des rats pour lesquels une composition contrôle a
été administré sont représentées par des bâtons noirs.
D'autres avantages pourront encore apparaître à l'Homme du métier
à la lecture des exemples ci-dessous, illustrés par les figures annexées,
donnés à titre illustratif.
Exemples
Exemple 1: Utilisation d'un polymère biocompatible pour le traitement
d'une Barrière Hémato-encéphalique altérée et restauration
fonctionnelle de la Barrière Hémato-encéphalique
N Préparation des polymères biocompatibles.
La synthèse des polymères biocompatibles, RGTA, est largement
décrite dans l'art antérieur, par exemple dans le brevet U57396923
intitulé
procédé de sulfonation de composes comprenant des
groupements hydroxyles (OH) libres ou des amines primaires ou
secondaires et également dans la référence bibliographique Yasunori I.
et al.,
Biomaterials 2011, 32 :769e776) et Petit E. et al,.
Biomacromolecules. 2004 Mar-Apr; 5(2):445-52 [28].
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
24
Plusieurs RGTA sont connus et décrits ont été utilisés dont le
0TR4120 décrit de nombreuses publications précliniques et cliniques
(RGTA -based matrix therapy - A new branch of regenerative medicine in
locomotion. Barritault D, Desgranges P, Meddahi-Pellé A, Denoix JM, Saffar
JL. Joint Bone Spine. 2017 May;84(3):283-292. doi:
10.1016/j.jbspin.2016.06.012 [29], RGTA or ReGeneraTing Agents mimic
heparan sulfate in regenerative medicine: from concept to curing patients.
Barritault D, Gilbert-Sirieix M, Rice KL, Sifieriz F, Papy-Garcia D, Baudouin
C, Desgranges P, Zakine G, Saffar JL, van Neck J. Glycoconj J. 2017
Jun;34(3):325-338. doi: 10.1007/s10719-016-9744-5 [2]. Le composé
0TR4131 est un composé comprenant un radical Z qui est un acide gras, à
savoir l'acide acétique tel que décrit dans Frescaline G. et al., Tissue Eng
Part A. 2013 Jul;19(13-14):1641-53. doi: 10.1089/ten.TEA.2012.0377 [30]),
Randomized controlled trial demonstrates the benefit of RGTA based
matrix therapy to treat tendinopathies in racing horses. Jacquet-Guibon S,
Dupays AG, Coudry V, Crevier-Denoix N, Leroy S, Sifieriz F, Chiappini F,
Barritault D, Denoix JM. PLoS One. 2018 Mar 9;13(3):e0191796. doi:
10.1371/journal.pone.0191796 [31]. D'autres composés également décrits
dans les documents brevets US06689741, US2014301972A1 dans lequel
Z est un acide aminé comme la phénylalanine (Heparan sulfate
proteoglycans mediate internalization and propagation of specific
proteopathic seeds. Holmes BB, DeVos SL, Kfoury N, Li M, Jacks R,
Yanamandra K, Ouidja MO, Brodsky FM, Marasa J, Bagchi DP, Kotzbauer
PT, Miller TM, Papy-Garcia D, Diamond MI. Proc Natl Acad Sci U S A. 2013
Aug 13;110(33):E3138-47. doi: 10.1073/pnas.1301440110 [32]) ou autre
composé hydrophobe (Structure-activity studies of heparan mimetic
polyanions for anti-prion therapies. Ouidja MO, Petit E, Kerros ME, Ikeda Y,
Morin C, Carpentier G, Barritault D, Brugère-Picoux J, Deslys JP, Adjou K,
Papy-Garcia D. Biochem Biophys Res Commun. 2007 Nov 9;363(1):95-100
[33]).
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
B/ Restauration fonctionnelle de la Barrière Hémato-encéphalique avec un
polymère biocompatible
Dans le présent exemple, une évaluation les effets de polymère
biocompatible selon l'invention, RGTA, sur la perméabilité de la BHE après
5 altération, par exemple suite à un Accident Vasculaire Cérébral (AVC).
Dans cet exemple un modèle d'AVC chez le rat a été utilisé. Il s'agissait
d'une ischémie cérébrale de 1 heure, obtenue par l'occlusion de l'artère
cérébrale par voie intraluminale suivie d'une reperfusion. Les rats utilisés
étaient des rats mâles Sprague Dawley d'un poids moyen de 300-350g. Le
10 nombre de rats utilisés était de quatre à six rats par groupe et par
temps.
Dans ce modèle, il est bien connu que la perméabilité de la BHE augmente
progressivement pour atteindre un pic à 24-48h après l'induction de
l'ischémie cérébrale (Garrigue et al. 2016 [6]; Sharif et al., 2018 [16]). La
figure 1 représente l'évolution de la perméabilité en fonction du temps dans
15 le modèle utilisé tel que décrit dans Abdullahi et al ., 2018.
L'évaluation de la perméabilité de la BHE a été effectuée par IRM
après une injection d'un agent de contraste, le DOTAREM , à différents
temps : 1 h, 3 h, 24 h, 48 h, et 7 jours après l'ischémie cérébrale. Cet agent
de contraste ne traverse pas la BHE en conditions physiologique. L'agent
20 de contraste a été injecté par voie intraveineuse, via la veine
fémorale. La
quantité d'agent de contraste administrée par injection était de 200pm01/kg
(DOTAREM (marque déposée), Guerbet S.A.).
Des rats, à savoir quatre à cinq animaux par groupe et par temps ont
été traités avec un polymère biocompatible, à savoir le RGTA 0TR4132
25 avec un poids moléculaire compris de 100 000 à 150 000 Da, la figure 2
représente la structure dudit polymère. Le polymère biocompatible
0TR4132 a été administré 1 heure après l'ischémie cérébrale, le volume de
composition administrée comprenant une concentration de 0,5 mg/kg de
OTR4132 étaient de 300p1 par veine caudale.
Des rats, à savoir quatre à cinq animaux par groupe et par temps (ont
été traités avec une solution contrôle à savoir du sérum physiologique
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
26
(solution saline à 0.9% NaC1). La solution contrôle a été administrée de
manière identique à la composition comprenant le composé 0TR4132 à
savoir 1 heure après l'ischémie cérébrale, le volume de composition
administrée étaient de 250p1 administré par la veine fémorale.
L'observation de la perméabilité et de la diffusion de l'agent de
contraste a été réalisée par observation sur des images obtenues par IRM.
Les régions du système nerveux central observées étaient situées dans
l'hémisphère cérébral touché par l'ischémie ainsi que l'hémisphère
controlatéral sain. La détermination de la diffusion de l'agent de contraste
sur les images obtenues a été réalisée par l'analyse des IRM utilisant un
logiciel approprié (Image J (marque déposée) (Wayne Rasband, NIMH,
Maryland, USA)).Les résultats concernant la diffusion de l'agent de
contraste et/ou perméabilité de la Barrière Hémato-encéphalique sont
représentés sur la figure 3.
Tel que représenté sur le diagramme de la figure 3, les rats ayant reçu
l'agent de contraste et la solution contrôle montre une perméabilité
augmentée de la Barrière Hémato-encéphalique 24 heures, 48 heures et 7
jours après l'AVC (bâtons noirs), ces résultats étaient en accord avec ceux
obtenus dans l'état de la technique (Garrigue et al. 2016 [6]). Ce diagramme
démontre également clairement et de manière surprenante, que le
traitement des rats avec le polymère biocompatible 0TR4132 permet de
réduire significativement la perméabilité de la BHE à 24 et 48 h post-
ischémie dans le groupe de rats traités avec du RGTA par rapport aux rats
du groupe ischémié ayant reçu la solution contrôle. En particulier, les
résultats ont démontré une différence statistique significative entre les rats
traités avec une solution contrôle par rapport aux rats traités avec une
composition comprend un polymère biocompatible selon l'invention (ANOVA
suivie d'un test post-hoc HSD de Tukey p < 0.05).
Les résultats obtenus et illustrés sur la figure 3 démontrent clairement
que l'utilisation de polymères biocompatibles selon l'invention permet de
préserver l'intégrité de la BHE après un AVC. En particulier, ces résultats
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
27
démontrent clairement que l'utilisation de polymère biocompatible selon
l'invention permet à la fois de protéger la BHE, de favoriser sa réparation
et,
dans le cas où les propriétés physiologiques de la BHE sont
altérées/modifiées, de restaurer les propriétés physiologiques et/ou de
réduire leurs modifications.
De façon complémentaire aux résultats obtenus par IRM, la
perméabilité de la BHE a été mesurée par coloration au bleu d'Evans après
induction de l'ischémie cérébrale selon le procédé décrit dans le document
Hone et al., 2018 [7]. Les rats utilisés étaient des rats mâles Sprague Dawley
d'un poids moyen de 300-350g, l'expérience a été réalisée sur 11 rats dont
cinq rats pour lesquels du bleu d'Evans, qui ne traverse pas la BHE dans
des conditions physiologique, a été injecté en intraveineux à une
concentration de 2%, 72 h après l'ischémie cérébrale, le volume injecté était
de 4 ml/kg soit de 1,2 à 1,4 ml pour un rat de 300 à 350g respectivement.
Six rats avaient été traités avec un polymère biocompatible, à savoir le
RGTA 0TR4132 avec un poids moléculaire compris de 100 000 à 150 000
Da, administré 1 heure après l'ischémie cérébrale, le volume de composition
administrée comprenant une dose de 2,22 pg de 0TR4132 étaient de 50p1
par voie intra-artérielle à travers la carotide interne.
Cinq rats avaient été traités avec une solution contrôle à savoir du
sérum physiologique (solution saline à 0,9% NaC1) administrée de manière
identique à la composition comprenant le composé 0TR4132 à savoir 1
heure après l'ischémie cérébrale, le volume de composition administrée
étaient de 50p1 par voie intra-artérielle à travers la carotide interne.
Trente minutes après l'administration de bleu d'Evans, une perfusion
intracardiaque de l'animal avec du sérum physiologique a été réalisée, le
cerveau a été prélevé et les hémisphères séparés. Les échantillons ont été
ensuite broyés dans du Tampon phosphate salin puis mis à 4 C en présence
d'acide trichloroacétique à 60 %. Les échantillons ont été ensuite centrifugés
(1000g pendant 30 minutes) et le surnagent récupéré pour une lecture au
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
28
spectrophotomètre à 610nm. En parallèle une gamme de concentration
ascendante de Bleu d'Evans a été préparée.
Le bleu d'Evans tissulaire présent dans le surnagent récupéré a été
ensuite quantifié par spectrophotométrie avec une mesure à 610 nm.
La figure 4 représente les résultats obtenus en fonction des individus.
Les résultats obtenus dans le groupe des animaux contrôle montrent une
altération significative de la perméabilité de la BHE dans l'hémisphère
ipsilatéral par rapport à l'hémisphère controlatéral (ANOVA à 2 facteurs (p
groupe = 0,1582 ; p hémisphère = 0,0933; p groupe*hémisphère = 0,0175)
suivie d'un test post hoc HSD de Tukey p = 0,0374). De manière surprenante
et inattendue, aucune différence n'a été observée entre l'hémisphère
ipsilatéral et controlatéral dans le groupe des animaux traités avec le
polymère biocompatible 0TR4132 (ANOVA à 2 facteurs (p groupe =
0,1582; p hémisphère = 0,0933; p groupe*hémisphère = 0,0175) suivie
d'un test post hoc HSD de Tukey p = 0,9965). En outre, les analyses
démontrent également une diminution statistiquement significative de
l'altération de la BHE dans l'hémisphère ipsilatéral des animaux traités avec
le polymère biocompatible 0TR4132 par rapport aux animaux contrôle
(ANOVA 2 facteurs (p groupe = 0,1582; p hémisphère = 0,0933; p
groupe*hémisphère = 0,0175) suivie d'un test post hoc HSD de Tukey p =
0,0439).
Cet exemple démontre clairement que des exemples de composition
selon l'invention comprenant un polymère de formule AaXxYy ou AaXxYyZz
permet avantageusement de protéger la BHE et/ou de restaurer les
propriétés physiologique de la BHE. En particulier, cet exemple démontre
clairement que des exemples de composition selon l'invention comprenant
un polymère de formule AaXxYy ou AaXxYyZz permet de préserver
l'intégrité de la BHE après un AVC. En particulier, ces résultats démontrent
clairement que l'utilisation de polymère biocompatible selon l'invention
permet à la fois de protéger la BHE, de favoriser sa réparation, et, dans le
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
29
cas où les propriétés physiologiques de la BHE sont altérées/modifiées, de
restaurer les propriétés physiologiques et/ou de réduire leurs modifications.
Exemple 2: Utilisation d'un polymère biocompatible pour le traitement
d'une Barrière Hémato-encéphalique altérée et restauration
fonctionnelle de la Barrière Hémato-encéphalique
Un individu, homme de 75 ans (75 kg) souffrant de troubles
neurologiques, notamment de troubles cognitifs, notée par neurologues
attribués à plusieurs AVC, qui ont altéré la Barrière Hémato-encéphalique,
a été traité avec un polymère biocompatible, à savoir le composé OTR4120,
une prise quotidienne de 30 mL d'un solution aqueuse à 100pg/mL de
0TR4120 sur 45 jours. La dose administrée était de 3 mg/Jour/pour 75 kg
ou 40 pg/kg/jour. Suite à l'administration une amélioration des performances
cognitives a été observée par des neurologues et également le médecin
traitant ou référent et sa famille.
Un autre individu, une femme de 85 ans avec troubles de mémoire
majeurs, notamment difficulté de lecture, de reconnaissance des individus,
notamment proches (familles), impossibilité d'écrire etc.. L'individu était
notée Alzheimer avec coefficient d'handicap, impliquant ainsi une altération
de la Barrière Hémato-Encéphalique a été traitée par prise sublinguale bi-
hebdomadaire d'une dosette de 300 microL à 100 pg/mL de 0TR4120
(pesant autour de 60 kg) soit 0,5pg (0,5 pg/kg bihebdomadaire). Après
traitement pendant 6 mois, une amélioration des fonctions cognitives, des
relations sociales, par exemple avec son environnement, notamment
familiale et médical, capable de téléphoner, de se déplacer, de revoir ses
amis, de jouer au scrabble etc. Ces améliorations étaient notamment liées
une amélioration et récupération des fonctions de la Barrière Hémato-
Encéphalique.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
Références
1. Abdullahi W, Tripathi D, Ronaldson PT. Blood-Brain Barrier Dysfunction
in Ischemic Stroke: Targeting Tight Junctions and Transporters for Vascular
Protection. Am J Physiol Cell Physiol. 2018 Jun 27. doi:
5 10.1152/ajpce11.00095.2018. [Epub ahead of print] PubMed PMID:
29949404
2. Barritault D, Gilbert-Sirieix M, Rice KL, Sifieriz F, Papy-Garcia D,
Baudouin C, Desgranges P, Zakine G, Saffar JL, van Neck J. RGTA(C)) or
ReGeneraTing Agents mimic heparan sulfate in regenerative medicine: from
10 concept to curing patients. Glycoconj J. 2017 Jun;34(3):325-338. doi:
10.1007/s10719-016-9744-5. Epub 2016 Dec 7. Review. PubMed PMID:
27924424; PubMed Central PMCID: PMC5487810.
3. Blaney, S. M., Balis, F. M., Berg, S., Arndt, C. A., Heideman, R., Geyer,
J. R., & Aikin, A. (2005). Intrathecal mafosfamide: a preclinical
15 pharmacology and phase I trial. Journal of clinical oncology, 23(7),
1555-
1563.
4. Cardoso, F. L., Brites, D., & Brito, M. A. (2010). Looking at the blood¨
brain barrier: molecular anatomy and possible investigation
approaches. Brain research reviews, 64(2), 328-363.
20 5. Erickson MA. and Banks WA. Neuroimmune Axes of the Blood¨Brain
Barriers and Blood¨Brain Interfaces: Bases for Physiological Regulation,
Disease States, and Pharmacological Interventions. Pharmacol Rev. 2018
Apr;70(2):278-314. doi: 10.1124/pr.117.014647. Review.
6. Garrigue P, Giacomino L, Bucci C, Muzio V, Filannino MA, Sabatier F,
25 Dignat-George F, Pisano P, Guillet B. Single photon emission computed
tomography imaging of cerebral blood flow, blood-brain barrier disruption,
and apoptosis time course after focal cerebral ischemia in rats. Int J Stroke.
2016 Jan;11(1):117-26.
7. Hone EA, Hu H, Sprowls SA, Farooqi I, Grasmick K, Lockman PR, et al.
30 Biphasic Blood-Brain Barrier Openings after Stroke. Neurol Disord Stroke
Int. 2018; 1(2): 1011.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
31
8. Hynes RO, Naba A. Overview of the matrisome--an inventory of
extracellular matrix constituents and functions. Cold Spring Harb Perspect
Biol. 2012 Jan 1;4(1):a004903. doi: 10.1101/cshperspect.a004903. Review.
PubMed PMID: 21937732; PubMed Central PMCID: PMC3249625.
9. Khelif, Y., Toutain, J., Quittet, M. S., Chantepie, S., Laffray, X.,
Valable,
S., & Barritault, D. (2018). A heparan sulfate-based matrix therapy reduces
brain damage and enhances functional recovery following stroke.
Theranostics, 8(21), 5814.
Marks Jr, W. J., Ostrem, J. L., Verhagen, L., Starr, P. A., Larson, P. S.,
10 Bakay, R. A., ... & Bartus, R. T. (2008). Safety and tolerability of
intraputaminal delivery of CERE-120 (adeno-associated virus serotype 2¨
neurturin) to patients with idiopathic Parkinson's disease: an open-label,
phase I trial. The Lancet Neurology, 7(5), 400-408.
11. Môbius-Winkler, S., Linke, A., Adams, V., Schuler, G., & Erbs, S. (2010).
How to improve endothelial repair mechanisms: the lifestyle
approach. Expert review of cardiovascular therapy, 8(4), 573-580.
12. Peschillo S, Diana F, Berge J, Missori P. A comparison of acute vascular
damage caused by ADAPT versus a stent retriever device after
thrombectomy in acute ischemic stroke: a histological and ultrastructural
study in an animal model. J Neurointerv Surg. 2017 Aug;9(8):743-749. doi:
10.1136/neurintsurg-2016-012533. Epub 2016 Jul 7. PubMed PMID:
27387708. PMID: 11152991.
13. Rafii, M. S., Baumann, T. L., Bakay, R. A., Ostrove, J. M., Siffert, J.,
Fleisher, A. S., & Chu, Y. (2014). A phase1 study of stereotactic gene
delivery of AAV2-NGF for Alzheimer's disease. Alzheimer's &
Dementia, 10(5), 571-581.
14. Rajendran P, Rengarajan T, Thangavel J, Nishigaki Y, Sakthisekaran D,
Sethi G,Nishigaki I. The vascular endothelium and human diseases. Int J
Biol Sci. 2013 Nov 9;9(10):1057-69. doi: 10.7150/ijbs.7502. eCollection
2013. Review. PubMed PMID: 24250251; PubMed Central PMCID:
PMC3831119.
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
32
15. Ronaldson, P. T., & Davis, T. P. (2015). Targeting transporters:
promoting blood¨brain barrier repair in response to oxidative stress injury.
Brain research, 1623, 39-52.
16. Sharif Y, Jumah F, Coplan L, Krosser A, Sharif K, Tubbs RS. The Blood
Brain Barrier: A Review of its Anatomy and Physiology in Health and
Disease. Clin Anat. 2018 Apr 10. doi: 10.1002/ca.23083. [Epub ahead of
print] PubMed PMID: 29637627.
17. Sifat, A. E., Vaidya, B., & Abbruscato, T. J. (2017). Blood-brain barrier
protection as a therapeutic strategy for acute ischemic stroke. The AAPS
journal, 19(4), 957-972.
18. Steiner E, Enzmann GU, Lyck R, Lin S, Ruegg MA, Kroger S, and
Engelhardt B. The heparan sulfate proteoglycan agrin contributes to barrier
properties of mouse brain endothelial cells by stabilizing adherens junctions.
Cell Tissue Res 358: 465-479, 2014.
19. Sweeney MD, Sagare AP, Zlokovic BV. Blood-brain barrier breakdown
in Alzheimer disease and other neurodegenerative disorders. Nat Rev
Neurol. 2018 Mar;14(3):133-150. doi: 10.1038/nrneuro1.2017.188. Epub
2018 Jan 29. Review. PubMed PMID: 29377008; PubMed Central PMCID:
PMC5829048.
20. Teng D, Pannell JS, Rennert RC, Li J, Li YS, Wong VW, Chien S,
Khalessi AA. Endothelial trauma from mechanical thrombectomy in acute
stroke: in vitro live-cell platform with animal validation. Stroke. 2015
Apr;46(4):1099-106. doi: 10.1161/STROKEAHA.114.007494. Epub 2015
Feb 24. PubMed PMID: 25712942.
21. Thomsen MS, Routhe LJ, Moos T. The vascular basement membrane in
the healthy and pathological brain. J Cereb Blood Flow Metab. 2017
Oct;37(10):3300-3317. doi: 10.1177/0271678X17722436. Epub 2017 Jul
28. Review.
22. Warren, K, E Beyond the Blood: Brain Barrier: The Importance of Central
Nervous System (CNS) Pharmacokinetics for the Treatment of CNS
Tumors, Including Diffuse Intrinsic Pontine Glioma Front. Oncol., 03 July
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
33
2018 I https://doi.org/10.3389/fonc.20. Review
23. Wilgus A. 2012 Growth Factor¨Extracellular Matrix Interactions Regulate
Wound Repair. Advances in Wound Care, 1 (6): 249-254. doi:
10.1089/wound.2011.0344.
24. Vladimir A. Kornev et ai: Hydrogel-assisted neuroregeneration
approaches towards brain injury therapy: A state-of-the-art review.
Computational and Structural Biotechnology Journal 16 j.csbj.2018.10.011.
25. Gopalakrishnan A, Shankarappa SA, Rajanikant GK. Hydrogel
Scaffolds: Towards Restitution of Ischemic Stroke-Injured Brain 2019
Feb;10(1):1-18.
26. Tammi R., Agren UM., Tuhkanen AL., Tammi M. Hyaluronan metabolism
in skin. Progress in Histochemistry & Cytochemistry. 29(2):1-81, 1994
27. R. Stern et al., European Journal of Cell Biology 58 (2006) 699-715.
28. Yasunori I. et al., Biomaterials 2011, 32 :769e776) et Petit E. et al,.
Biomacromolecules. 2004 Mar-Apr; 5(2):445-52
29. RGTAC)-based matrix therapy - A new branch of regenerative medicine
in locomotion. Barritault D, Desgranges P, Meddahi-Pellé A, Denoix JM,
Saffar JL. Joint Bone Spine. 2017 May;84(3):283-292. doi:
10.1016/j.jbspin.2016.06.012
30. Frescaline G. et al., Tissue Eng Part A. 2013 Jul;19(13-14):1641-53. doi:
10.1089/ten.TEA.2012.0377
31. Randomized controlled trial demonstrates the benefit of RGTA based
matrix therapy to treat tendinopathies in racing horses. Jacquet-Guibon S,
Dupays AG, Coudry V, Crevier-Denoix N, Leroy S, Sifieriz F, Chiappini F,
Barritault D, Denoix JM. PLoS One. 2018 Mar 9;13(3):e0191796. doi:
10.1371/journal.pone.0191796
32. Heparan sulfate proteoglycans mediate internalization and propagation
of specific proteopathic seeds. Holmes BB, DeVos SL, Kfoury N, Li M, Jacks
R, Yanamandra K, Ouidja MO, Brodsky FM, Marasa J, Bagchi DP,
Kotzbauer PT, Miller TM, Papy-Garcia D, Diamond MI. Proc Natl Acad Sci
U S A. 2013 Aug 13;110(33):E3138-47. doi: 10.1073/pnas.1301440110
CA 03141923 2021-11-25
WO 2020/239356
PCT/EP2020/062081
34
33. Structure-activity studies of heparan mimetic polyanions for anti-prion
therapies. Ouidja MO, Petit E, Kerros ME, Ikeda Y, Morin C, Carpentier G,
Barritault D, Brugère-Picoux J, Deslys JP, Adjou K, Papy-Garcia D.
Biocshem Biophys Res Commun. 2007 Nov 9;363(1):95-100