Note: Descriptions are shown in the official language in which they were submitted.
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
1
Description
MODULATEURS DE CFTR DE TYPE
N2-ARYLMETHYL-4-HALOALKYL-PYRIDAZIN-3-ONE POUR LE
TRAITEMENT DE LA MUCOVISCIDOSE
Domaine technique
[0001] La présente invention concerne de nouveaux composés de type N2-
arylméthy1-4-haloalkyl-pyridazin-3-one de Formule I et leur utilisation dans
le
traitement et/ou la prévention de maladies ou affections associées à un
dysfonctionnement de l'activité du canal CFTR, en particulier la
mucoviscidose.
Etat de la technique
[0002] La mucoviscidose est la maladie génétique héréditaire létale la plus
fréquente dans la population caucasienne. En France, tous les trois jours, un
enfant naît atteint de cette pathologie. Cette maladie est due à une mutation
autosomique récessive sur le gène CFTR (Cystic Fibrosis Transmembrane
conductance Regulator) codant la protéine du même nom, un canal
transmembranaire qui permet les échanges d'ions, notamment chlorure,
bicarbonate et de petites molécules. Cette maladie atteint une multitude
d'organes
dont les poumons, le pancréas, le foie et les intestins. Les atteintes
respiratoires et
digestives sont les principales causes de morbidité et de mortalité chez les
patients.
[0003] Une fois diagnostiquées (le test est désormais réalisé systématiquement
dans le cadre des soins post-natals), les personnes atteintes de mucoviscidose
sont suivies au sein de centres de soins spécialisés appelés CRCM (Centre de
Ressources et de Compétences de la Mucoviscidose). Actuellement le traitement
qui leur est proposé est symptomatique : il vise à réduire les manifestations
de la
maladie et leurs complications. Il repose essentiellement sur la prise de
mucolytiques et de fluidifiants bronchiques, associée à des séances régulières
de
kinésithérapie. Un traitement antibiotique préventif est prescrit pour limiter
le
risque d'infections respiratoires. Lorsque l'insuffisance respiratoire est
terminale,
une oxygénothérapie devient nécessaire. Afin de traiter les manifestations
extra-
pulmonaires, des traitements antiinflammatoires, des extraits pancréatiques,
des
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
2
vitamines et supplémentations caloriques sont également prescrits. Ce
traitement
symptomatique est cependant insatisfaisant en raison de sa lourdeur (près de
2h
de soins quotidiens), de son coût (prise en charge thérapeutique, coût
d'hospitalisation...) et des limites parfois évidentes de son efficacité.
[0004] Depuis la découverte du gène CFTR défectueux en 1989, les efforts de
recherche se sont accentués permettant de réelles avancées dans la
compréhension de cette maladie et ont ouverts plusieurs pistes de
développement
thérapeutique.
[0005] L'idée première ayant émergé a été de corriger les anomalies génétiques
responsables de la maladie par thérapie génique. Cette approche utilise un
vecteur viral modifié pour introduire puis remplacer au sein des cellules
souches
pulmonaires le gène muté par sa version normale. Les essais cliniques conduits
jusqu'à présent ont été décevants car les vecteurs utilisés (adénovirus,
lentivirus)
sont apparus immunogènes et le succès du ciblage des cellules souches,
aléatoire.
[0006] La seconde alternative (par thérapie pharmacologique) consiste à
corriger
le fonctionnement de la protéine CFTR. Les mutations responsables des
dysfonctions de l'activité canal chlorure de CFTR sont divisées en sept
classes :
absence de synthèse d'expression génique (IA), protéique (IB), défaut
d'adressage protéique à la membrane (II), absence de fonction à la membrane
(III),
réduction de la fonction à la membrane (IV), réduction de la quantité de
protéine à
la membrane (V) et réduction de la stabilité à la membrane (VI). La mutation
la
plus répandue au sein de la population (F508del CFTR ¨ classe II) engendre un
défaut de repliement de cette protéine CFTR sur elle-même, l'empêchant de
s'intégrer à la membrane cellulaire. Mais d'autres versions de la protéine
mutée
dysfonctionnent bien qu'elles soient présentes dans la membrane (mutation
G551D par exemple ¨ classe III). C'est dans ce cadre qu'a été initié récemment
l'objectif de développer des molécules qui interagiraient avec la protéine
CFTR
pour lui permettre de s'intégrer dans la membrane (correcteurs), ou pour
améliorer
son fonctionnement lorsqu'elle est présente mais inactive (potentialisateurs).
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
3
[0007] Ainsi, en 2012, le premier médicament potentialisateur, Kalydeco
(Ivacaftor) développé par les laboratoires Vertex Pharmaceuticals, a reçu une
autorisation européenne de mise sur le marché. Alors uniquement destiné aux
patients porteurs de la mutation G551D (soit environ 4% des diagnostics), la
commercialisation de ce médicament a été élargie à 7 autres mutations en
juillet
2014, puis à 23 mutations complémentaires en mai 2017 par la FDA. Vertex a
également développé l'association de deux molécules (l'une correctrice et
l'autre
potentialisatrice) Orkambi (association de Lumacaftor, un correcteur de CFTR,
et
d'Ivacaftor) permettant de traiter les sujets porteurs de la mutation la plus
fréquente F508del (détectée chez environ 80% des patients sur au moins un
allèle,
2500 malades en France).
[0008] Ces molécules innovent par rapport aux traitements disponibles
précédemment car, au lieu de soigner les symptômes de la maladie, elles
corrigent une partie des anomalies cellulaires liées à la mucoviscidose.
Cependant,
ces traitements ont un prix très élevé (220 000 euros/an pour Kalydeco et
160 000 euros/an pour Orkambi ) et des effets secondaires lourds (diarrhées,
vertiges).
[0009] La demande de brevet US 2014/274933 Al décrit des composés de type
phtalazinone et leur utilisation dans le traitement de pathologies impliquant
la
protéine CFTR et notamment la mucoviscidose.
[0010] La demande de brevet WO 2016/066973 Al décrit des pyridazin-3-ones
fluorées et leur utilisation en tant qu'inhibiteur de PDE4 pour le traitement
de la
composante inflammatoire des affections broncho-pulmonaires. Cependant, ces
composés ne ciblent pas le canal CFTR.
[0011] II existe toutefois toujours un besoin de nouveaux composés permettant
de
restaurer l'activité du canal CFTR, notamment pour le traitement de la
mucoviscidose.
Résumé de l'invention
[0012] Les inventeurs ont maintenant réussi à mettre au point de nouveaux
composés permettant de restaurer l'activité du canal CFTR.
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
4
[0013] L'invention concerne donc des composés de Formule I, leurs sels et
solvates pharmaceutiquement acceptables ainsi que l'utilisation de ces
composés,
ou leurs solvates ou compositions pour le traitement et/ou la prévention de
maladies ou affections associées à un dysfonctionnement de l'activité du canal
CFTR.
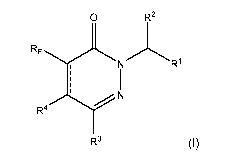
[0014] Dans un premier aspect, l'invention concerne des composés de Formule I
:
[0015] [Chem. 1]
O R2
RF N R1
1
1
1
1
1
1
R`I N
R3 (1)
ou ses sels ou solvates pharmaceutiquement acceptables,
dans laquelle
1:11 est cycloalkyle, hétéroaryle ou aryle optionnellement substitué par un
groupement choisi parmi alkyle, alkoxy et arylalkyle ;
R2 est H ou alkyle ;
R3 est cycloalkyle, hétéroaryle ou aryle optionnellement substitué par un ou
deux
groupements indépendamment choisis parmi alkyle, alkoxy et haloalkoxy ;
R4 est H ou alkyle ;
RF est haloalkyle ; et
1 est une simple liaison ou une double liaison.
[0016] Selon un autre aspect, l'invention concerne des compositions
pharmaceutiques comprenant au moins un composé selon l'invention ou un de
ses sels ou solvates pharmaceutiquement acceptables et au moins un excipient
pharmaceutiquement acceptable
[0017] Comme indiqué plus haut, l'invention concerne également l'utilisation
des
composés selon l'invention ou un de ses sels ou solvates pharmaceutiquement
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
acceptables pour la restauration de l'activité du canal CFTR. Par conséquent,
les
composés de l'invention et leurs solvates pharmaceutiquement acceptables sont
utiles dans le traitement et/ou la prévention de maladies ou affections
associées à
un dysfonctionnement de l'activité du canal CFTR. L'invention concerne donc
5 également les composés selon l'invention pour utilisation en tant que
médicament,
notamment dans le traitement et/ou la prévention de maladies ou affections
associées à un dysfonctionnement de l'activité du canal CFTR, en particulier
la
mucoviscidose.
[0018] Enfin, l'invention concerne des compositions pharmaceutiques comprenant
au moins un composé selon l'invention ou un de ses sels ou solvates
pharmaceutiquement acceptables et au moins un agent thérapeutique
supplémentaire.
[0019] D'autres caractéristiques, détails et avantages apparaîtront à la
lecture de
la description détaillée ci-après.
Description détaillée de l'invention
[0020] Comme détaillé ci-dessus, l'invention concerne des composés de Formule
I ainsi que leurs solvates pharmaceutiquement acceptables.
[0021] Des composés de Formule I et leurs sels et solvates pharmaceutiquement
acceptables préférés sont ceux dans lesquels 1:11, R2, R3, R4 et RF sont
définis de
la manière suivante :
R' est cycloalkyle en C5 à C7, hétéroaryle en C5 à C6, ou aryle en C6 à C10,
optionnellement substitué par un groupement choisi parmi alkyle en Cl à C6,
alkoxy en Cl à C4 et arylalkyle en Cl à C4 ; de préférence 1:11 est
cycloalkyle en
C5 à C6, hétéroaryle en C5 à C6, ou aryle en C6, optionnellement substitué par
un groupement choisi parmi alkyle en Cl à C6, alkoxy en Cl à C2 et arylalkyle
en
Cl à C2 ; de préférence encore R' est cyclohexyle, thiophényle, pyridinyle ou
phényle, optionnellement substitué par un groupement choisi parmi alkyle en Cl
à
C4, alkoxy en Cl à C2 et arylalkyle en Cl à C2 ; plus préférentiellement 1:11
est
cyclohexyle, thiophényle, ou phényle, optionnellement substitué par un
groupement choisi parmi méthyle, méthoxy et phényléthyle ;
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
6
R2 est H ou alkyle en Cl à C6 ; de préférence R2 est H ou alkyle en Cl à C4 ;
de
préférence encore R2 est H ou alkyle en Cl à C2 ; plus préférentiellement, R2
est
H ou méthyle ; encore plus préférentiellement, R2 est H ;
R3 est cycloalkyle en C5 à C7, hétéroaryle en C4 à C6, ou aryle en C6 à C10,
optionnellement substitué par un ou deux groupements indépendamment choisis
parmi alkyle en Cl à C6, alkoxy en Cl à C4 et haloalkoxy en Cl à C4 ; de
préférence R3 est cycloalkyle en C5 à C6, hétéroaryle en C4, à C6, ou aryle en
C6,
optionnellement substitué par un ou deux groupements indépendamment choisis
parmi alkyle en Cl à C6, alkoxy en Cl à C2 et haloalkoxy en Cl à C2 ; de
préférence encore, R3 est cyclohexyle, thiophényle, pyridinyle ou phényle
optionnellement substitué par un ou deux groupements indépendamment choisis
parmi alkyle en Cl à C4, alkoxy en Cl à C2 et haloalkoxy en Cl à C2 ; plus
préférentiellement R3 est cyclohexyle, pyridinyle ou phényle, optionnellement
substitué par un ou deux groupements indépendamment choisis parmi méthoxy et
difluorométhoxy ;
R4 est H ou alkyle en Cl à C6 ; de préférence R4 est H ou alkyle en Cl à C4 ;
de
préférence encore R4 est H ou alkyle en Cl à C2 ; plus préférentiellement, R4
est
H ou méthyle ; encore plus préférentiellement, R4 est H ;
RF est haloalkyle en Cl à C6 ; de préférence, RF est haloalkyle en Cl à C4; de
préférence encore RF est haloalkyle en Cl à C2 ; plus préférentiellement, RF
est
fluoroalkyle en Cl à C2 ; encore plus préférentiellement, RF est
trifluorométhyle.
[0022] En fait et sans vouloir être lié par une quelconque théorie, les
inventeurs
pensent que la capacité des composés de l'invention à restaurer l'activité du
canal
CFTR est obtenue notamment grâce au groupement 1:11 situé en position
benzylique par rapport au noyau pyridazinone ou dihydropyridazinone.
[0023] Dans un premier mode de réalisation, les composés de l'invention sont
ceux de la Formule Il:
[0024] [Chem. 2]
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
7
O R2
RF N R1
1 1
R4 N
R3 (Il)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle 1:11, R2, R3, R4 et RF sont tels que définis ci-dessus par
rapport à la
Formule I.
[0025] Des composés préférés de la formule II sont ceux de la formule lia :
[0026] [Chem. 3]
O R2
F3c
N R1
1 1
N
R3 (lia)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle R', R2 et R3 sont tels que définis ci-dessus par rapport à la
Formule I.
[0027] D'autres composés préférés de la formule II sont ceux de la formule Ilb
:
[0028] [Chem. 4]
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
8
O R2
F3c
N R1
1 1
N
0R5
R6 (11b)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle 1:11 et R2 sont tels que définis ci-dessus par rapport à la
Formule 1, et
R5 et R6 sont indépendamment l'un de l'autre choisis parmi alkoxy et
haloalkoxy;
de préférence R5 et R6 sont indépendamment choisis parmi alkoxy en Cl à C4 et
haloalkoxy en Cl à C4; de préférence encore R5 et R6 sont indépendamment
choisis parmi alkoxy en Cl à C2 et haloalkoxy en Cl à C2 ; plus
préférentiellement, R5 et R6 sont indépendamment choisis parmi méthoxy et
difluorométhoxy.
[0029] D'autres composés préférés de la formule 11 sont ceux de la formule Ilc
:
[0030] [Chem. 5]
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
9
O R2
F3c
N Ri
1 1
N
S (11c)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle R' et R2 sont tels que définis ci-dessus par rapport à la
Formule I.
[0031] D'autres composés préférés de la formule 11 sont ceux de la formule Ild
:
[0032] [Chem. 6]
0 R2
F3C
N R1
1 1
N
N
I
(11d)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle R' et R2 sont tels que définis ci-dessus par rapport à la
Formule I.
[0033] Dans un second mode de réalisation, les composés de l'invention sont
ceux de la Formule III :
[0034] [Chem. 7]
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
O R2
RF N R1
1
R4 N
R3 (III)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle 1:11, R2, R3, R4 et RF sont tels que définis ci-dessus par
rapport à la
Formule I.
5 [0035] Des composés préférés de la formule III sont ceux de la formule
Illa :
[0036] [Chem. 8]
O R2
F3C
N R1
1
N
R3 (111a)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle 1:11, R2 et R3 sont tels que définis ci-dessus par rapport à la
Formule I.
10 [0037] D'autres composés préférés de la formule III sont ceux de la
formule Illb :
[0038] [Chem. 9]
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
11
0 R2
F3C
N R1
1
N
0R5
R6 (111b)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle 1:11 et R2 sont tels que définis ci-dessus par rapport à la
Formule 1, et
R5 et R6 sont indépendamment l'un de l'autre choisis parmi alkoxy et
haloalkoxy;
de préférence R5 et R6 sont indépendamment choisis parmi alkoxy en Cl à C4 et
haloalkoxy en Cl à C4 ; de préférence encore R5 et R6 sont indépendamment
choisis parmi alkoxy en Cl à C2 et haloalkoxy en Cl à C2 ; plus
préférentiellement, R5 et R6 sont indépendamment choisis parmi méthoxy et
difluorométhoxy.
[0039] D'autres composés préférés de la formule III sont ceux de la formule
111c :
[0040] [Chem. 10]
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
12
0 R2
F3c
N Ri
1
N
S(111c)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle 1:11 et R2 sont tels que définis ci-dessus par rapport à la
Formule I.
[0041] D'autres composés préférés de la formule III sont ceux de la formule
Illd :
[0042] [Chem. 11]
O R2
F3c
N R1
1
N
N
I
(111d)
et leurs sels et solvates pharmaceutiquement acceptables,
dans laquelle R' et R2 sont tels que définis ci-dessus par rapport à la
Formule I.
[0043] Des composés particulièrement préférés de l'invention sont ceux listés
dans le Tableau 1 ci-dessous :
[0044] [Tableau 1]
Composé Structure Nom
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
13
0
F3C
1 Y lel 2-benzy1-6-(3,4-
N
diméthoxyphényI)-4-
1
el (trifluorométhyl)pyridazin-3(2H)-
one
OMe
OMe
0
F3C
1 Y lel 6-(3,4-diméthoxyphenyI)-2-(4-
2
1\1
méthylbenzyI)-4-
I. (trifluorométhyl)pyridazin-3(2H)-
one
OMe
OMe
0
F3C
1 Y lel 6-(3,4-diméthoxyphenyI)-2-(4-
3
A\1
OMe méthoxybenzyI)-4-
el (trifluorométhyl)pyridazin-3(2H)-
one
OMe
OMe
0
F3C
1 Y la 6-(4-(difluorométhoxy)-3-
Av
OMe méthoxyphényI)-2-(4-
4 méthoxybenzyI)-4-
el OMe (trifluorométhyl)pyridazin-3(2H)-
one
o,CHF2
0
F3C1 lel
A\I 2-benzy1-6-cyclohexy1-4-
(trifluorométhyl)pyridazin-3(2H)-
one
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
14
0
F3C
1 YCI 2-(cyclohexylméthyl)-6-(3,4-
6
N
diméthoxyphényI)-4-
lel (trifluorométhyl)pyridazin-3(2H)-
one
OMe
OMe
0
F3C
1 Y 6-(3,4-diméthoxyphényI)-2-
N s 7 (thiophén-3-ylméthyl)-4-
el (trifluorométhyl)pyridazin-3(2H)-
one
OMe
OMe
0
F3C
1 Y 6-(4-(difluorométhoxy)-3-
N s méthoxyphényI)-2-(thiophén-3-
8 ylméthyl)-4-
el OMe (trifluorométhyl)pyridazin-3(2H)-
one
o,CHF2
0
F3C
1 Y 1.1 6-(4-(difluorométhoxy)-3-
N méthoxyphényI)-2-(1-
9 phényléthyl)-4-
1.1 OMe (trifluorométhyl)pyridazin-3(2H)-
one
o,CH F2
0
F3C
1 ri 6-(3,4-diméthoxyphényI)-2-(4-
N
phénéthylbenzyI)-4-
ite (trifluorométhyl)pyridazin-3(2H)-
ne
OMe o
OMe
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
0
F3C
I Y 6-(4-(difluorométhoxy)-3-
N méthoxyphény1)-2-(4-
11 phénéthylbenzy1)-4-
l
OMe
el (trifluorométhyl)pyridazin-3(2H)-
one
o,CHF2
0
F3C
N
gOl
i 2-benzy1-6-(3,4-
12
N
diméthoxyphény1)-4-
el (trifluorométhyl)-4,5-
dihydropyridazin-3(2H)-one
OMe
OMe
0
F3C m 01
Y 6-(3,4-diméthoxyphény1)-2-(4-
13
N
méthylbenzy1)-4-
ige (trifluorométhyl)-4,5-
dihydropyridazin-3(2H)-one
OMe
OMe
0
2-benzy1-6-(pyridin-2-y1)-4-
14 F3CNII =(trifluorométhyl) pyridazin-3(2H)-
one
0
1
0
F3C õ, SY 6-(4-(difluorométhoxy)-3-
N
OMe méthoxyphény1)-2-(4-
15 méthoxybenzy1)-4-
lel (trifluorométhyl)-4,5-
OMe dihydropyridazin-3(2H)-one
o,CHF2
0
F3C m gs
li 2-benzy1-6-cyclohexy1-4-
16 N (trifluorométhyl)-4,5-
dihydropyridazin-3(2H)-one
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
16
0
F3C N goi
i 6-(4-(difluorométhoxy)-3-
N méthoxyphényI)-2-(4-
17 méthylbenzyI)-4-
lel (trifluorométhyl)-4,5-
OMe dihydropyridazin-3(2H)-one
o,CH F2
0
F3C
1 Y 1.1 6-(3,4-diméthoxyphényI)-2-(1-
18
N
phényléthyl)-4-
S (trifluorométhyl)pyridazin-3(2H)-
one
OMe
OMe
0
F3CN la
1 2-benzy1-6-(pyridin-2-y1)-4-
N
19 (trifluorométhyl)-4,5-
dihydropyridazin-3(2H)-one
0
I
0
F3c,,, Y fs
2-(4-méthylbenzyI)-6-(pyridin-2-
20 N y1)-4-(trifluorométhyl)-4,5-
dihydropyridazin-3(2H)-one
0
I
0
F3C) LN Y 2-(4-méthoxybenzyI)-6-(pyridin-
N
21 OMe 2-y1)-4-(trifluorométhyl)-4,5-
dihydropyridazin-3(2H)-one
0
I
0
F3C
N
gOl
i
N 2-benzy1-6-(4-(difluorométhoxy)-
22
3-méthoxyphény1)-4-
el (trifluorométhyl)-4,5-
dihydropyridazin-3(2H)-one
OMe
o,CHF2
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
17
[0045] Les composés de Formule I peuvent être préparés selon des réactions
connues de l'Homme du métier. Les schémas réactionnels décrits dans la partie
Exemples illustrent des approches de synthèse possibles.
[0046] Dans un deuxième aspect, l'invention concerne l'utilisation des
composés
de l'invention ou leurs sels ou solvates pharmaceutiquement acceptables pour
la
restauration de l'activité du canal CFTR.
[0047] Les composés de l'invention sont ainsi utiles dans le traitement et/ou
la
prévention de maladies ou affections à un dysfonctionnement de l'activité du
canal
CFTR. L'invention concerne donc également les composés selon l'invention ou
leurs sels ou solvates pharmaceutiquement acceptables pour utilisation en tant
que médicament, notamment pour utilisation dans le traitement et/ou la
prévention
de maladies ou affections associées à un dysfonctionnement de l'activité du
canal
CFTR.
[0048] Ces maladies ou affections comprennent la mucoviscidose et les
complications qui y sont liées.
[0049] Dans un mode de réalisation préféré, l'invention concerne les composés
de
formule I tels que décrits ci-dessus pour utilisation dans le traitement de la
mucoviscidose.
[0050] La présente invention, selon un autre de ses aspects, concerne
également
une méthode de traitement des maladies et affections ci-dessus indiquées
comprenant l'administration, à un patient, d'une dose efficace d'un composé
selon
l'invention, ou d'un de ses sels ou solvates pharmaceutiquement acceptables.
De
préférence, le patient est un animal à sang chaud, plus préférentiellement un
humain.
[0051] Selon un autre aspect, l'invention porte sur une méthode de
restauration de
l'activité du canal CFTR chez un patient, de préférence un animal à sang
chaud,
plus préférentiellement un humain, en ayant besoin, ladite méthode comprenant
l'administration à ce patient d'une dose efficace d'un composé selon
l'invention, ou
d'un de sels ou ses solvates pharmaceutiquement acceptables.
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
18
[0052] Selon un mode de réalisation, les composés de l'invention, leurs sels
ou
solvates pharmaceutiquement acceptables peuvent être administrés dans le cadre
d'une polythérapie. Ainsi, sont inclus dans le cadre de la présente invention
des
modes de réalisation comprenant la co-administration de compositions ou de
médicaments qui contiennent, en plus d'un composé de la présente invention, ou
d'un sel ou solvate pharmaceutiquement acceptable de celui-ci en tant
qu'ingrédient actif, un ou des agents thérapeutiques supplémentaires et/ou
ingrédients actifs. De tels régimes thérapeutiques multiples, souvent appelés
polythérapie, peuvent être utilisés dans le traitement et/ou la prévention de
la
mucoviscidose.
[0053] Ainsi, les méthodes de traitement et les compositions pharmaceutiques
de
la présente invention peuvent utiliser les composés de l'invention ou leurs
sels ou
solvates pharmaceutiques acceptables sous forme de monothérapie, mais ces
méthodes et compositions peuvent également être utilisés sous forme de
polythérapie dans laquelle un ou plusieurs composés de l'invention ou leurs
sels
ou solvates pharmaceutiquement acceptables sont co-administrés en combinaison
avec un ou plusieurs autres agents thérapeutiques. De tels agents
thérapeutiques
supplémentaires comprennent, sans s'y limiter, l'Ivacaftor, le Lumacaftor
et/ou le
Tezacaftor, de préférence l'Ivacaftor. En particulier, les tels agents
thérapeutiques
supplémentaires sont choisis parmi l'Ivacaftor et le Lumacaftor.
[0054] L'invention concerne également une composition pharmaceutique
comprenant au moins un composé de Formule I ou l'un de ses sels ou solvates
pharmaceutiquement acceptables et au moins un excipient pharmaceutiquement
acceptable. Lesdits excipients sont choisis selon la forme pharmaceutique et
le
mode d'administration souhaité, parmi les excipients habituels qui sont connus
de
l'Homme du métier. Comme indiqué ci-dessus, l'invention concerne également
des compositions pharmaceutiques qui contiennent, en plus d'un composé de la
présente invention, ou un sel ou un solvate pharmaceutiquement acceptable de
celui-ci en tant qu'ingrédient actif, un ou des agents thérapeutiques
supplémentaires et/ou des ingrédients actifs.
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
19
[0055] La composition pharmaceutique de la présente invention peut être
choisie
parmi les compositions pharmaceutiques pour administration orale, sublinguale,
sous-cutanée, intramusculaire, intraveineuse, topique, locale, intratrachéale,
intranasale, transdermique ou rectale. Dans ces compositions, le principe
actif de
Formule I ci-dessus, ou son solvate pharmaceutiquement acceptable, peut être
administré sous forme unitaire d'administration, en mélange avec des
excipients
pharmaceutiques classiques, aux animaux et aux êtres humains pour le
traitement
et/ou la prévention des maladies ou affections ci-dessus indiquées. Les formes
unitaires d'administration appropriées comprennent les formes par voie orale
telles
que les comprimés, les gélules molles ou dures, les poudres, les granules et
les
solutions ou suspensions orales, les formes d'administration sublinguale,
buccale,
intratrachéale, intraoculaire, intranasale, par inhalation, les formes
d'administration
topique, transdermique, sous-cutanée, intramusculaire ou intraveineuse, les
formes d'administration rectale et les implants. Pour l'application topique,
on peut
utiliser les composés selon l'invention dans des crèmes, gels, pommades ou
lotions. Dans un mode de réalisation préféré, il s'agit d'une composition
pharmaceutique pour administration orale. De telles formes d'administration
appropriées qui peuvent se présenter sous forme solide, semi-solide ou liquide
en
fonction du mode d'administration, sont généralement connues de l'homme du
métier, référence étant faite à la dernière édition de l'ouvrage Remington's
Pharmaceutical Sciences .
Définition S
[0056] Les définitions et explications ci-dessous concernent les termes et
expressions telles qu'utilisés dans la présente demande, comprenant la
description ainsi que les revendications.
[0057] Pour la description des composés de l'invention, les termes et
expressions
utilisées doivent, sauf indication contraire, être interprétés selon les
définitions ci-
après.
[0058] Le terme halo ou halogéno , seul ou en tant que partie d'un
autre
groupement, désigne fluoro, chloro, bromo, ou iodo. Les groupements halo
préférés sont chloro et fluoro, fluoro étant particulièrement préféré.
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
[0059] Le terme alkyl(e) , seul ou en tant que partie d'un autre
groupement,
désigne un radical hydrocarbure de formule CnH2n+1 dans lequel n est un nombre
entier supérieur ou égal à 1.
[0060] Le terme haloalkyl(e) ou halogénoalkyl(e) , seul ou en tant que
5 partie d'un autre groupement, désigne un radical alkyle tel que défini ci-
dessus
dans lequel un ou plusieurs atomes d'hydrogène sont remplacés par un
groupement halo tel que défini ci-dessus. Les radicaux haloalkyle selon la
présente invention peuvent être linéaires ou ramifiés, et comprennent, sans y
être
limités, des radicaux de formule CnF2n+1 dans lequel n est un nombre entier
10 supérieur ou égal à 1, de préférence un nombre entier compris entre 1 et
10. Des
radicaux haloalkyle préférés comprennent le trifluorométhyle, le
difluorométhyle, le
fluorométhyle, le pentafluoroéthyle, l'heptafluoro-n-propyle, le nonafluoro-n-
butyle,
le 1,1,1-trifluoro-n-butyle, le 1,1,1-trifluoro-n-pentyle et le 1,1,1-
trifluoro-n-hexyle, le
trifluorométhyle et le difluorométhyle étant particulièrement préférés.
15 [0061] Le terme alcoxy , seul ou en tant que partie d'un autre
groupement,
désigne un radical alkyle tel que défini ci-dessus lié à un atome d'oxygène.
Des
radicaux alcoxy préférés comprennent le méthoxy, l'éthoxy, le propyloxy et le
butyloxy, le méthoxy étant particulièrement préféré.
[0062] Le terme haloalcoxy ou halogénoalcoxy , seul ou en tant que
partie
20 d'un autre groupement, désigne un radical haloalkyle tel que défini ci-
dessus lié à
un atome d'oxygène. Des radicaux haloalcoxy préférés comprennent le
fluorométhoxy, le difluorométhoxy, le trifluorométhoxy, le chlorométhoxy, le
dichlorométhoxy, le trichlorométhoxy, le fluoroéthoxy, le difluoroéthoxy, le
trifluoroéthoxy, le chloroéthoxy, le dichloroéthoxy et le trichloroéthoxy, le
difluorométhoxy étant particulièrement préféré.
[0063] Le terme cycloalkyl(e) , seul ou en tant que partie d'un autre
groupement, désigne un radical hydrocarbure mono-, di- ou tri-cyclique saturé
ayant 3 à 12 atomes de carbone, notamment 5 à 10 atomes de carbone, plus
particulièrement 6 à 10 atomes de carbone. Des radicaux cycloalkyl appropriés
comprennent, sans y être limités, cyclopropyle, cyclobutyle, cyclopentyle,
cyclohexyle, cycloheptyle, cyclooctyle, norbornyle, adamantyle, notamment
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
21
adamant-1-yle et adamant-2-yle, 1-décalinyle. Des groupements cycloalkyle
préférés comprennent cyclopropyle, cyclohexyle, et cycloheptyle. Un groupement
cycloalkyle particulièrement préféré est le cyclohexyle.
[0064] Le terme aryl(e) , seul ou en tant que partie d'un autre groupement,
désigne un radical hydrocarbure aromatique polyinsaturé ayant un seul cycle
(phényle) ou plusieurs cycles aromatiques condensés ensemble (par exemple
naphtyle) contenant typiquement 5 à 12 atomes de préférence 6 à 10, dans
lequel
au moins un des cycles est aromatique. Un groupement aryle particulièrement
préféré est le phényle.
[0065] Le terme hétéroaryl(e) , seul ou en tant que partie d'un autre
groupement, désigne, sans y être limités, des cycles aromatiques ou systèmes
cycliques contenant un à deux cycles condensés entre eux, contenant
typiquement 5 à 12 atomes, dans lequel au moins un des cycles est aromatique,
et dans lequel un plusieurs atomes de carbone dans un ou plusieurs de ces
cycles
sont remplacés par des atomes d'oxygène, d'azote et/ou de soufre, les
hétéroatomes d'azote et de soufre pouvant éventuellement être oxydés et les
hétéroatomes d'azote pouvant éventuellement être quaternisé. Des groupements
hétéroaryle préférés mais non limitatifs sont le pyridinyle, le pyrrolyle, le
furanyle,
le thiophényle. Des groupements hétéroaryles particulièrement préférés sont le
thiophényle et le pyridinyle.
[0066] Les composés de l'invention contenant un groupe fonctionnel basique
peuvent être sous la forme de sels pharmaceutiquement acceptables. Les sels
pharmaceutiquement acceptables des composés de l'invention contenant un ou
plusieurs groupes fonctionnels basiques comprennent notamment leurs sels
d'addition d'acides. Les sels d'addition d'acide appropriés sont formés à
partir
d'acides qui forment des sels non toxiques. Des exemples de sels comprennent
l'acétate, l'adipate, l'aspartate, le benzoate, bésylate, le
bicarbonate/carbonate, le
bisulfate/sulfate, le borate, le camsylate, le citrate, le cyclamate,
l'édisylate,
l'ésylate, le formiate, le fumarate, le gluceptate, le gluconate, le
glucuronate,
l'hexafluorophosphate, l'hibenzate, le chlorhydrate/chlorure, le
bromhydrate/bromure, l'iodhydrate/iodure, l'iséthionate, le lactate, le
malate, le
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
22
maléate, le malonate, le mesylate, le méthylsulfate, le naphtylate, le 2-
napsylate,
le nicotinate, le nitrate, l'orotate, l'oxalate, le palmitate, le pamoate, le
phosphate/hydrogénophosphate/dihydrogénophosphate, le pyroglutamate, le
saccharate, le stéarate, le succinate, le tannate, le tartrate, le tosylate,
le
trifluoroacétate et le xinofoate.
[0067] Des sels pharmaceutiquement acceptables de composés de formules I et
de ses sous-formules peuvent par exemple être préparés comme suit:
(i) faire réagir le composé de formule I ou l'une quelconque de ses sous-
formules
avec l'acide désiré; ou
(ii) convertir un sel du composé de formule I ou l'une de ses sous-formules en
un
autre par réaction avec un acide approprié ou au moyen d'une colonne
échangeuse d'ions appropriée.
[0068] Toutes ces réactions sont généralement effectuées en solution. Le sel
peut
précipiter de la solution et être recueilli par filtration ou peut être
récupéré par
évaporation du solvant. Le degré d'ionisation dans le sel peut varier de
complètement ionisé à presque non ionisé.
[0069] Les composés de Formule I peuvent exister sous forme de solvates, à
savoir sous forme d'associations ou de combinaisons avec une ou plusieurs
molécules de solvant, tel que par exemple de l'éthanol ou de l'eau. Lorsque le
solvant est de l'eau, on utilise le terme hydrate .
[0070] Toutes les références à des composés de Formule I désignent également
les solvates de ceux-ci.
[0071] Les composés de l'invention sont les composés de Formule I et leurs
solvates tels que défini ci-dessus, y compris tous leurs polymorphes et formes
cristallines, leurs prodrogues et les composés ou solvates portant un label
isotopique.
[0072] Le terme patient désigne un animal à sang chaud, de préférence un
humain, qui attend ou reçoit un traitement médical.
[0073] Le terme humain désigne des sujets des deux sexes et à tout stade
de
développement (c'est-à-dire néonatal, infantile, juvénile, adolescent et
adulte).
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
23
Dans un mode de réalisation, il s'agit d'un adolescent ou d'un adulte, de
préférence d'un adulte.
[0074] Les termes traiter et traitement doivent être entendus dans leur
signification générale et comprennent ainsi l'amélioration et l'abrogation
d'un état
pathologique.
[0075] Les termes prévenir et prévention désignent le fait d'éviter ou
de
retarder l'apparition d'une maladie ou affection et des symptômes liés, ainsi
excluant un patient de développer une maladie ou affection ou réduisant le
risque
d'un patient de développer une maladie ou affection.
[0076] Le terme dose thérapeutiquement efficace ou dose efficace
désigne
la dose de principe actif (composé de Formule I) qui est suffisant pour
atteindre le
résultat thérapeutique ou prophylactique désiré chez le patient auquel il est
administré.
[0077] Le terme pharmaceutiquement acceptable désigne qu'un composé ou
un composant n'est pas nocif pour le patient et que dans le cadre d'une
composition pharmaceutique il est compatible avec les autres composants.
[0078] La présente invention sera mieux comprise en référence aux exemples
suivants. Ces exemples sont représentatifs de certains modes de réalisation de
l'invention et ne limitent en aucun cas la portée de l'invention. Les figures
servent
à illustrer les résultats expérimentaux.
Brève description des dessins
Fig. 1
[0079] [Fig. 1] montre le screening in vitro de la restauration de l'activité
du canal
CFTR des composés 1 et 4 selon l'invention en comparaison avec celle de
l'Ivacaftor, du Lumacaftor et de l'Orkambi.
Fig. 2
[0080] [Fig. 2] montre le screening in vitro de la restauration de l'activité
du canal
CFTR des composés 1 à 6 selon l'invention.
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
24
Fig. 3
[0081] [Fig. 3] montre le screening in vitro de la restauration de l'activité
du canal
CFTR des composés 7 à 11 et 13 selon l'invention.
Fig. 4
[0082] [Fig. 4] montre l'évaluation in vitro de la restauration de l'activité
du canal
CFTR des composés selon l'invention.
Fig. 5
[0083] [Fig. 5] montre l'évaluation in vitro de la restauration de l'activité
du canal
CFTR des composés 1 et 4 selon l'invention en association avec l'Ivacaftor et
le
Lumacaftor en comparaison avec l'Orkambi.
Exemples
SYNTHESE CHIMIQUE
[0084] Toutes les températures sont exprimées en C et toutes les réactions
ont
été effectuées à température ambiante (TA), sauf indication contraire.
[0085] Le suivi des réactions a été réalisé par chromatographie sur couche
mince
(CCM) réalisée sur des feuilles d'aluminium prêtes à l'emploi et recouvertes
d'un
gel de silice et d'un indicateur de fluorescence UV254 (Kieselgel 60 F254
Merck
de 0,2 mm d'épaisseur). La visualisation de tâches est obtenue par la lumière
UV
(254 ou 366 nm). Les révélateurs utilisés sont de l'iode ; pour les amines ou
une
solution de ninhydrine (0,3 g de ninhydrine et 3 mL d'acide acétique dans 100
mL
de butan-1-ol ou 0,2 g de ninhydrine dans 100 mL d'éthanol).
[0086] Les chromatographies préparatives sur colonne ont été réalisées par la
technique chromatographique sur gel de silice. Les chromatographies sur
colonne
de silice dites normale sont réalisées avec un gel de silice 60 ACC Chromagel
S.D.S. de granulométrie 70 à 200 pm. Les chromatographies sur colonne de
silice flash sont réalisées avec un gel de silice de granulométrie de 40 à
63 pm
de la marque Kieselgel 60 Merck .
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
[0087] Les analyses RMN ont été réalisées sur un spectromètre BRUKER 199
DPX 300 à aimant supraconducteur de 7,05 T (1H résonne à 300 MHz et 13C à
75 MHz. Les spectres sont enregistrés en solution soit dans le chloroforme
deutéré (CDCI3), avec le tétraméthylsilane (TMS) comme référence interne, soit
5 dans le méthanol deutéré (CD30D) ou encore dans le diméthylsulfoxyde deutéré
(DMSO-d6). Les déplacements chimiques sont donnés en ppm, suivis pour les
spectres de proton de la multiplicité, où s, d, t, q, dd, td et m désignent
respectivement les singlets, doublets, triplets, quadruplets, doublets de
doublets,
triplets de doublets et multiplets (ou massifs peu résolus). Les multiplicités
sont
10 suivies le cas échéant de la valeur des constantes de couplages notées J et
exprimées en Hertz (Hz).
[0088] Les spectres de masse basse (SM) et haute résolution (HREIMS) en
impact électronique (1E) à -70eV sont enregistrés sur un appareil WATERS
MICROMASS OCT CA 170. Les spectres de masse par ionisation électrospray
15 (ESI), en mode positif (ESI+) ou en mode négatif (ESI-) sont enregistrés
sur un
appareil MSQ de marque THERMOFINNIGAN couplé à un détecteur quadripolaire.
[0089] Les solvants, les réactifs et les matières de départ ont été achetés
auprès
de fournisseurs de produits chimiques bien connus tels que Sigma Aldrich,
Acros
Organics, Fluorochem, Eurisotop, VWR International, Sopachem et Polymer et,
20 sauf indication contraire, ont été utilisés sans purifications
additionnelles.
[0090] Les abréviations suivantes ont été utilisées :
AcOH : acide acétique,
AE : acétate d'éthyle,
CCM : chromatographie sur couche mince,
25 Eq. ou equiv. : équivalent,
EP : éther de pétrole,
Et0H : éthanol,
Me0H : méthanol,
MS : spectrométrie de masse,
RMN : résonnance magnétique nucléaire,
TA : température ambiante,
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
26
TBAB : bromure de tétrabutylammonium,
TFA : acide trifluoroacétique,
THF : tetrahydrofurane.
[0091] [Schéma 1]
\¨oK
RF /SEt R3 RF SEt RF 0 NH2NH2 RF /0
F SEt R4¨ SEt R4 < SEt NH
0 0
R3 R3 R3
[b] [c] [d]
R2
iii iv
H2NHN
RF /9 R2 RF /0
/
j- \J¨( R NH
<
¨N R1
R3 R3
[f] [e]
R2
I iv k
Cr -R1
RF //0 RF p
- \
¨(R5 i< R2
N¨(
¨Ni R1 ¨N, R1
R3 R3
II II
Réactifs et conditions. (i) THF, 0-25 C, 10 h ; (ii) TFA, eau, reflux ; (iii)
AcOH,
reflux ou Et0H, TA ; (iv) CuC12, CH3CN, reflux, 4 h ; (v) K2CO3, TBAB, CH3CN,
reflux, 4h.
[0092] L'approche générale part d'un composé de type dithiocétal de cétène
fluoré
de formule [a] avec RF correspondant à CF3.
[0093] Le composé [a] est mis à réagir avec un énolate de potassium, dans le
tétrahydrofurane (THF) en tant que solvant, à une température comprise entre 0
et
25 C pendant une durée de l'ordre de 10 h. On obtient ainsi l'intermédiaire
[b]
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
27
représenté sur la figure et correspondant à un composé de type dithiocétal
perfluoré.
[0094] Cet intermédiaire de formule [b] est ensuite soumis à une réaction
d'hydrolyse acide en présence d'acide trifluoroacétique (TFA) et d'eau dans un
chauffage à reflux. Cette réaction d'hydrolyse acide permet l'obtention d'un
second intermédiaire de type thioester de formule [c].
[0095] Le composé intermédiaire [c] peut alors être soumis à une réaction de
condensation avec de l'hydrazine (NH2NH2). La réaction est effectuée en
présence d'acide acétique glacial, dans un dispositif de chauffage à reflux,
pendant une durée de l'ordre de 4 à 5h. Après refroidissement, le solvant est
avantageusement évaporé sous vide. Le composé [d] selon l'invention est alors
purifié par colonne chromatographique. Selon un mode de réalisation
préférentiel,
la purification dudit composé [d] est effectuée par chromatographie sur gel de
silice, avantageusement en présence d'un mélange d'éther de pétrole et
d'acétate
d'éthyle.
[0096] Le composé [d] est mélangé, sous atmosphère d'argon dans
l'acétonitrile,
avec du chlorure cuivrique. Ce mélange est porté à reflux pendant 4h. Après
refroidissement le brut réactionnel est purifié par colonne chromatographique
pour
permettre d'obtenir les composés [e].
[0097] Le composé [e] est mélangé, sous atmosphère d'argon dans
l'acétonitrile,
avec du carbonate de potassium (K2CO3) et du bromure de tétrabutylammonium
(TBAB). Après 2h les halogénures de benzyles sont additionnés au milieu
réactionnel. Ce mélange est porté à reflux pendant 4h. Après refroidissement
le
brut réactionnel est purifié par colonne chromatographique pour permettre
d'obtenir les composés selon l'invention.
[0098] De façon complémentaire certains composés selon l'invention peuvent
être
obtenus après addition directe de benzylhydrazine fonctionnalisée sur
l'intermédiaire [c]. Les produits intermédiaires [f] obtenus étant alors
oxydés en
présence de chlorure cuivrique dans l'acétonitrile. Le mélange est porté à
reflux
pendant 4h. Après refroidissement le brut réactionnel est purifié par colonne
chromatographique pour permettre d'obtenir les composés selon l'invention.
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
28
[0099] Mode opératoire général de synthèse des intermédiaires de synthèse
[b]
- On mélange, de préférence sous atmosphère d'argon à 0 C, une solution
d'hydrure de potassium et une solution de l'acétophénone en présence de
solvant,
de préférence du tétrahydrofurane (THF), ceci constitue le mélange 1 ;
- On ajoute audit mélange 1, après 10 à 20 min d'agitation, de préférence
15 min,
une solution de dithiocétal de perfluorocétène de formule [a], ceci constitue
le
mélange 2(i) ;
- On agite ledit mélange 2, à température ambiante pendant 2h45 à 3h30, de
préférence 3h ;
- On hydrolyse la réaction en cours se produisant au sein du mélange 2 avec
de
l'eau ;
- On extrait la phase aqueuse du mélange 2, notamment avec de l'éther ;
- On sèche la phase organique du mélange 2, de préférence sur sulfate de
magnésium ;
- On filtre et on évapore la phase organique du mélange 2, de préférence
sous
pression réduite ;
- On réalise une chromatographie sur colonne pour obtenir, avantageusement
sous forme d'huile, les composés [b].
[0100] 1-(3,4-d i méthoxyphényI)-4,4-bis(éthylth io)-3-(trifl uorométhyl)but-3-
én-
1-one [b1]
Le composé [b1] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [b] à partir du (perfluoroprop-1-ène-1,1-
diy1)bis(éthylsulfane) [a] (500 mg, 2,13 mmol, 1 éq), de la 1-(3,4-
diméthoxyphényl)éthanone (471 mg, 2,56 mmol, 1,2 éq) et de l'hydrure de
potassium (683 mg, 4,26 mmol, 2 éq) et obtenu après purification par
chromatographie sur colonne de silice flash (EP/AE : 90/10) sous la forme d'un
liquide jaune. Rendement : 70% (587 mg).
RMN 1H (CDCI3): 5 1.22 (t, 3JH,H= 7.5 Hz, 3H, CH3CH2S), 1.34 (t, 3JH,H= 7.5
Hz,
3H, CH3CH2S), 2.81-2.91 (m, 4H, CH3CH2S), 3.93 (s, 3H, OCH3), 3.97 (s, 3H,
OCH3), 4.40 (s, 2H, CH2), 6.92 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.56 (d, 4JH,H=
1.8 Hz,
1H, CHAr), 7.63 (dd, 3JH,H= 8.4, 4JH,H= 2.1 Hz, 1H, CHAr).
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
29
[0101] 1-(4-difluorométhoxy)-3-méthoxyphényI)-4,4-bis(éthylthio)-3-
(trifluorométhyl)but-3-én-1-one [b2]
Le composé [b2] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [b] à partir du (perfluoroprop-1-ène-1,1-
diy1)bis(éthylsulfane) [a] (187 mg, 0,8 mmol, 1 éq), de la 1-(4-
(difluorométhoxy)-3-
méthoxyphényl)éthanone (208 mg, 0,96 mmol, 1,2 éq) et de l'hydrure de
potassium (257 mg, 1,6 mmol, 2 éq) et obtenu après purification par
chromatographie sur colonne de silice flash (EP/AE : 98/2) sous la forme de
cristaux incolores. Rendement : 85% (291 mg).
RMN 1H (CDCI3): 5 1.26 (t, 3JH,H= 7.2 Hz, 3H, CH3CH2S), 1.34 (t, 3JH,H= 7.5
Hz,
3H, CH3CH2S), 2.81-2.91 (m, 4H, CH3CH2S), 3.94 (s, 3H, OCH3), 4.41 (s, 2H,
CH2), 6.65 (t, 2JH,F= 74.4 Hz, 1H, OCHF2), 7.25 (d, 3JH,H= 7.2 Hz, 1H, CHAr),
7.58
(dd, 3JH,H= 8.4, 4JH,H= 2.1 Hz, 1H, CHAr), 7.64 (d, 4JH,H= 2.1 Hz, 1H, CHAr).
[0102] 1-cyclohexy1-4,4-bis(éthylthio)-3-(trifluorométhyl)but-3-én-1-one [b3]
Le composé [b3] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [b] à partir du (perfluoroprop-1-ène-1,1-
diy1)bis(éthylsulfane) [a] (700 mg, 3,0 mmol, 1 éq), de la 1-
cyclohexyléthanone
(519 !IL, 3,6 mmol, 1,2 éq) et de l'hydrure de potassium (962 mg, 6,0 mmol, 2
éq)
et obtenu après purification par chromatographie sur colonne de silice flash
(EP/AE : 99.5/0.5) sous la forme d'un liquide jaune pâle. Rendement : 74% (760
mg).
RMN 1H (CDCI3): 5 1.21 (t, 3JH,H= 7.2 Hz, 3H, CH3CH2S), 1.29 (t, 3JH,H= 7.2
Hz,
3H, CH3CH2S), 1.34-1.46 (m, 6H, 3 x CH2cyciohexyl), 1.65-1.92 (m, 4H, 2 x
CH2cyclohexyl), 2.38-2.48 (m, 1H, CHcyclohexyl), 2.83 (q, 3JH,H = 7.5 Hz, 4H,
2 x
CH3CH2S), 3.87 (s, 2H, CH2).
[0103] 4,4-bis(éthylthio)-1-(pyridin-2-yI)-3-(trifluorométhyl)but-3-én-1-one
[b4]
Le composé [b4] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [b] à partir du (perfluoroprop-1-ène-1,1-
diy1)bis(éthylsulfane) [a] (469 mg, 2,0 mmol, 1 éq), de la 1-(pyridin-2-
y1)éthanone
(291 mg, 2,4 mmol, 1,2 éq) et de l'hydrure de potassium (642 mg, 4,0 mmol, 2
éq)
et obtenu après purification par chromatographie sur colonne de silice flash
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
(EP/AE : 95/5) sous la forme d'un liquide jaune. Rendement : 70% (561 mg).
RMN 1H (CDCI3): 5 1.21 (t, 3JH,H= 7.2 Hz, 3H, CH3CH2S), 1.34 (t, 3JH,H= 7.5
Hz,
3H, CH3CH2S), 2.80-2.91 (m, 4H, CH3CH2S), 4.70 (s, 2H, CH2), 7.48-7.53 (m, 1H,
CHAr), 7.85 (dt, 3JH,H= 8.1, 4JH,H= 1.8 Hz, 1H, CHAr), 8.06 (d, 3JH,H= 7.8 Hz,
1H,
5 CHAr), 8.71 (d, 4JH,H= 4.5 Hz, 1H, CHAr).
[0104] Mode opératoire général de synthèse des intermédiaires de synthèse
[c]
- On mélange ledit composé [b] avec de l'eau et de l'acide
trifluoroacétique (TFA),
ceci constitue le mélange 3(ii) ;
10 - Le mélange 3 est porté à reflux, pendant une durée de l'ordre de 10h ;
- Après refroidissement, on neutralise le mélange 3 avec une solution
aqueuse
saturée, de préférence avec du NaHCO3;
- On extrait la phase aqueuse du mélange 3, de préférence avec du chlorure
de
méthylène ;
15 - On sèche, filtre et évapore les phases organiques du mélange 3;
- On réalise une chromatographie sur colonne pour obtenir, avantageusement
sous forme d'huile, les composés [c].
[0105] 4-(3',4'-diméthoxyphény1)-2-trifluorométhy1-4-oxo-butanethioate de S-
éthyle [cl]
20 Le composé [cl] est préparé selon le mode opératoire général de synthèse
des
intermédiaires de synthèse [c] à partir de la 1-(3,4-diméthoxyphényI)-4,4-
bis(éthylthio)-3-(trifluorométhyl)but-3-én-1-one [bl] (594 mg, 1,5 mmol, 1
éq), de
TFA (1,04 mL, 13,6 mmol, 9 éq) et d'eau (0,082 mL, 4,53 mmol, 3 éq) et obtenu
après purification par chromatographie sur colonne de silice flash (EP/AE :
90/10)
25 sous la forme d'une huile jaune. Rendement : 89% (470 mg).
RMN 1H (CDCI3): 5 1.28 (t, 3JH,H= 7.5 Hz, 3H, CH3CH2S), 2.85-3.10 (m, 2H,
n,H= -H . -.-, 3JH,H=
CH3CH2S), 3.31 (dd, 2 ,i -I ./
3.0 Hz, 1H, CHAHBCO), 3.85 (dd, 2JH,H=
15.0, 3JH,H= 12.0 Hz, 1H, CHAHBCO), 3.91 (s, 3H, OCH3), 3.96 (s, 3H, OCH3),
4.0-
4.2 (m, 1H, CHCF3), 6.90 (d, 3JH,H= 8.3 Hz, 1H, CHAr), 7.51 (d, 4JH,H= 3.0 Hz,
1H,
30 CHAr), 7.61 (dd, 3JH,H= 8.3, 4JH,H= 3.0 Hz, 1H, CHAr).
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
31
[0106] 4-(4-(difluorométhoxy)-3-méthoxyphény1)-4-oxo-2-
(trifluorométhyl)butanethioate de S-éthyle [c2]
Le composé [c2] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [c] à partir de la 1-(4-difluorométhoxy)-3-
méthoxyphényI)-4,4-bis(éthylthio)-3-(trifluorométhyl)but-3-én-1-one [b2] (290
mg,
0,67 mmol, 1 éq), de TFA (0,467 mL, 6,06 mmol, 9 éq) et d'eau (0,036 mL, 2,01
mmol, 3 éq) et obtenu après purification par chromatographie sur colonne de
silice
flash (EP/AE : 95/5) sous la forme d'un liquide orange. Rendement : 78% (200
mg).
RMN 1H (CDCI3): 5 1.29 (t, 3JH,H= 7.5 Hz, 3H, CH3CH2S), 2.87-3.07 (m, 2H,
CH3CH2S), 3.32 (dd, 2JH,H= 18.0 Hz, 3JH,H= 3.0 Hz, 1H, CHAHBCO), 3.88 (dd,
2JH,H
= 18.0 Hz, 3JH,H= 10.2 Hz, 1H, CHAHBCO), 3.94 (s, 3H, OCH3), 4.02-4.15 (m, 1H,
CHCF3), 6.65 (t, 2JH,H= 74.3 Hz, 1H, CHCF2), 7.24 (d, 3JH,H= 7.8 Hz, 1H,
CHAr),
7.56-7.59 (m, 2H, 2 x CHAr).
[0107] 4-cyclohexy1-4-oxo-2-(trifluorométhyl)butanethioate de S-éthyle [c3]
Le composé [c3] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [c] à partir de la 1-cyclohexy1-4,4-bis(ethylthio)-
3-
(trifluoromethyl)but-3-en-1-one [b3] (750 mg, 2,20 mmol, 1 éq), de TFA (1,527
mL,
19,8 mmol, 9 éq) et d'eau (0,119 mL, 6,60 mmol, 3 éq) sous la forme d'un
liquide
brun. Rendement :95% (618 mg).
RMN 1H (CDCI3): 5 1.27 (t, 3JH,H= 7.5 Hz, 3H, CH3CH2S), 1.23-1.42 (m, 4H, 2 x
CH2cyclohexyl), 1.66-1.94 (m, 6H, 3 x CH2cycionexyl), 2.33-2.42 (m, 1H,
CHcyclohexyl),
2.82 (dd, 2JH,H= 18.3 Hz, 3JH,H= 3.3 Hz, 1H, CHAHBCO), 2.95 (dq, 2JH,H= 7.5
Hz,
3JH,H= 3.3 Hz, 2H, CH3CH2S), 3.32 (dd, 2JH,H= 18.3 Hz, 3JH,H= 10.2 Hz, 1H,
CHAHBCO), 3.83-3.96 (m, 1H, CHCF3).
[0108] 4-oxo-4-(pyridin-2-y1)-2-(trifluorométhyl)butanethioate de S-éthyle
[c4]
Le composé [c4] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [c] à partir de la 4,4-bis(ethylthio)-1-(pyridin-2-
yI)-3-
(trifluoromethyl)but-3-en-1-one [b4] (550 mg, 1,64 mmol, 1 éq), de TFA (1,137
mL,
14,80 mmol, 9 éq) et d'eau (0,088 mL, 4,92 mmol, 3 éq) et obtenu après
purification par chromatographie sur colonne de silice flash (EP/AE : 90/10)
sous
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
32
la forme d'une laque jaune. Rendement : 26% (120 mg).
1H NMR (CDCI3): 5 1.28 (t, 3JH,H = 7.5 Hz, 3H, CH3CH2S), 2.91-3.04 (m, 2H,
CH3CH2S), 3.69 (dd, 2JH,H= 18.6 Hz, 3JH,H= 2.1 Hz, 1H, CHAHBCO), 4.02-4.20 (m,
2H, CHAHBCO, CHCF3), 7.52 (ddd, 3JH,H= 7.5 Hz, 3JH,H= 4.8 Hz, 4JH,H= 1.5 Hz,
1H,
CHAr), 7.86 (dt, 3JH,H= 7.8 Hz, 4JH,H= 1.8 Hz, 1H, CHAr), 8.03 (td, 3JH,H= 8.1
Hz,
4JH,H= 1.2 Hz, 1H, CHAr), 8.71 (d, 3JH,H= 4.5 Hz, 1H, CHAr).
[0109] Mode opératoire général de synthèse des intermédiaires de synthèse
[d]
- On mélange ledit composé [c] avec de l'acide acétique glacial et de
l'hydrazine
monohydrate ; ceci constitue le mélange 4(iii) ;
- Le mélange 4 est porté à reflux, de préférence pendant une durée de
l'ordre de
1h ;
- Après filtration, lavage et séchage sous vide, on obtient les produits
[d] purs ou
sous forme de mélange ;
- Au besoin, on réalise une chromatographie sur colonne pour obtenir,
avantageusement les composés [d].
[0110] 6-(3',4'-Diméthoxyphény1)-4-trifluorométhy1-4,5-dihydropyridazin-
3(211)-one [dl]
Le composé [dl] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [d] à partir du 4-(3',4'-diméthoxyphény1)-2-
trifluorométhy1-4-oxo-butanethioate de S-éthyle [cl] (500 mg, 1,4 mmol, 1 éq)
et
de l'hydrazine (35 % dans l'eau) (1,616 mL, 17,8 mmol, 12,5 éq) et obtenu
après
purification par chromatographie sur colonne de silice flash (CH2C12/Me0H :
99/1)
sous la forme d'un solide blanc. Rendement: 76% (320 mg).
RMN 1H (CDCI3): 5 3.09-3.43 (m, 3H, CH2CHCF3), 3.93 (brs, 6H, 2 x OCH3), 6.88
(d, 3JH,H= 8.3 Hz, 1H, CHAr), 7.18 (d, 3JH,H= 8.3 Hz, 1H, CHAr), 7.40 (brs,
1H, CHAr),
8.91 (brs, 1H, NH).
[0111] 4-(difluorométhoxy)-3-méthoxyphény1)-4-(trifluorométhyl)-4,5-
dihydropyridazin-3(211)-one [d2]
Le composé [d2] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [d] à partir du 4-(4-(difluorométhoxy)-3-
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
33
méthoxyphényI)-4-oxo-2-(trifluorométhyl)butanethioate de S-éthyle [c2] (100
mg,
0,25 mmol, 1 éq) et de l'hydrazine (35 % dans l'eau) (0,282 mL, 3,13 mmol,
12,5
éq) et obtenu après purification par chromatographie sur colonne de silice
flash
(EP/AE : 80/20) sous la forme d'un solide beige. Rendement : 100% (086 mg).
RMN 1H (CD30D): 53.17 (dd, 2JH,H= 17.7 Hz, 3JH,H= 9.9 Hz, 1H, CHAHBCHCF3),
3.37 (dd, 2JH,H= 17.4 Hz, 3JH,H= 7.5 Hz, 1H, CHAHBCHCF3), 3.61-3.76 (m, 1H,
CHCF3), 6.90 (t, 2JH,F= 73.8 Hz, 1H, OCHF2), 7.18 (d, 3JH,H= 9.0 Hz, 2H, 2 x
CHAr),
7.84 (d, 3JH,H= 9.0 Hz, 2H, 2 x CHAr).
[0112] Mode opératoire général de synthèse des intermédiaires de synthèse
[e]
- On mélange, sous atmosphère d'argon, le composé [d] dans l'acétonitrile
anhydre avec du chlorure cuivrique, ceci constitue le mélange 5(iv) ;
- Le mélange 5 est porté à reflux, de préférence pendant la durée de
l'ordre de
4h;
- Après refroidissement, on évapore et purifie par chromatographie sur colonne
le
mélange 5 pour obtenir les produits [e] sous forme d'un solide.
[0113] 6-(3',4'-Diméthoxyphény1)-4-trifluorométhyl-pyridazin-3(211)-one [el]
Le composé [el] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [e] à partir de la 6-(3',4'-diméthoxyphényI)-4-
trifluorométhy1-4,5-dihydropyridazin-3(211)-one [dl] (300 mg, 1,0 mmol, 1 éq)
et du
chlorure de cuivre(II) (269 mg, 2,0 mmol, 2 éq) et obtenu après purification
par
chromatographie sur colonne de silice flash (CH2C12/Me0H : 98/2) sous la forme
d'un solide jaune intense. Rendement : 85% (256 mg).
RMN 1H (CDCI3): 5 3.95 (s, 3H, OCH3), 3.98 (s, 3H, OCH3), 6.95 (d, 3JH,H= 8.3
Hz,
1H, CHAr), 7.29 (d, 3JH,H= 8.3 Hz, 1H, CHAr), 7.46 (brs, 1H, CHAr), 8.06 (m,
1H,
CHpyr), 11.9 (brs, 1H, NH).
[0114] 6-(4-(difluorométhoxy)-3-méthoxyphény1)-4-(trifluorométhyl) pyridazin-
3(2H)-one [e2]
Le composé [e2] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [e] à partir de la 6-(4-(difluorométhoxy)phény1)-4-
(trifluorométhyl)-4,5-dihydropyridazin-3(211)-one [d2] (16 mg, 0,05 mmol, 1
éq) et
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
34
du chlorure de cuivre(II) (13 mg, 0,10 mmol, 2 éq) et obtenu après
purification par
chromatographie sur colonne de silice flash (EP/AE : 80/20) sous la forme de
cristaux beiges. Rendement :81% (13 mg).
RMN 1H (CD30D): O 3.96 (s, 3H, OCH3), 6.80 (t, 2JH,F= 75.0 Hz, 1H, OCHF2),
7.25
(d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.49 (dd, 2JH,H= 8.4 Hz, 3JH,H= 1.8 Hz, 1H,
CHAr),
7.65 (d, 4i/H,H= 2.1 Hz, 1H, CHAr), 8.36 (d, 5JH,H= 1.2 Hz, 1H, CHpyr).
[0115] Mode opératoire général de synthèse des intermédiaires de synthèse
Ifl
- On mélange ledit composé [c] avec de l'acide acétique glacial et de la
benzylhydrazine fonctionnalisée; ceci constitue le mélange 4(iii) ;
- Le mélange 4 est porté à reflux, de préférence pendant une durée de
l'ordre de
1h ;
- Après filtration, lavage et séchage sous vide, on obtient les produits
[f] purs.
[0116] 2-benzy1-6-(3,4-d imethoxyphény1)-4-(trifluorométhyl)-4,5-
dihydropyridazin-3(211)-one [fi]
Le composé [fi] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [f] à partir du 4-(3',4'-diméthoxyphény1)-2-
trifluorométhy1-4-oxo-butanethioate de S-éthyle [cl] (100 mg, 0,29 mmol, 1 éq)
et
de la benzylhydrazine dihydrochlorée (718 mg, 3,68 mmol, 12,5 éq) et obtenu
par
purification par chromatographie sur colonne de silice flash (EP/AE : 80/20)
sous
la forme d'un solide beige. Rendement : 47% (54 mg).
RMN 1H (CDCI3): 53.05-3.23 (m, 2H, CH2CHCF3), 3.27-3.41 (m, 1H, CHCF3), 3.91
(s, 6H, 2 x OCH3), 5.01 (d, 2JH,H= 14.4 Hz, 1H, NCHAHB), 5.08 (d, 2JH,H= 14.4
Hz,
1H, NCHAHB), 6.86 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.18 (dd, 3JH,H= 8.4 Hz,
4JH,H=
2.1 Hz, 1H, CHAr), 7.26-7.42 (m, 6H, 6 x CHAr).
[0117] 6-(3,4-climéthoxyphény1)-2-(4-méthylbenzyl)-4-(trifluorométhyl)-4,5-
dihydropyridazin-3(211)-one [f2]
Le composé [f2] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [f] à partir du 4-(3',4'-diméthoxyphényI)-2-
trifluorométhy1-4-oxo-butanethioate de S-éthyle [cl] (100 mg, 0,29 mmol, 1 éq)
et
de la 4-méthylbenzylhydrazine dihydrochlorée (626 mg, 3,63 mmol, 12,5 éq) et
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
isolé après purification par chromatographie sur colonne de silice flash
(EP/AE :
80/20) sous la forme d'un solide blanc. Rendement : 32% (40 mg).
RMN 1H (CDCI3): 5 2.33 (s, 3H, CH3), 3.05-3.25 (m, 2H, CH2CHCF3), 3.25-3.40
(m,
1H, CHCF3), 3.92 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 4.97 (d, 2JH,H= 14.3 Hz,
1H,
5 NCHAHB), 5.04 (d, 2JH,H= 14.3 Hz, 1H, NCHAHB), 6.87 (d, 3JH,H= 8.4 Hz, 1H,
CHAr),
7.13 (d, 3JH,H= 7.8 Hz, 2H, 2 x CHAr), 7.18 (dd, 3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz,
1H,
CHAr), 7.31 (d, 3JH,H= 7.8 Hz, 2H, 2 x CHAr), 7.38 (d, 4JH,H= 2.1 Hz, 1H,
CHAr).
[0118] 6-(3,4-diméthoxyphény1)-2-(4-méthoxybenzy1)-4-(trifluorométhyl)-4,5-
di hyd ropyridazi n-3(211)-one [f3]
10 Le composé [f3] est préparé selon le mode opératoire général de synthèse
des
intermédiaires de synthèse [f] à partir du 4-(3',4'-diméthoxyphény1)-2-
trifluorométhy1-4-oxo-butanethioate de S-éthyle [cl] (100 mg, 0,29 mmol, 1 éq)
et
de la 4-méthoxylbenzylhydrazine (789 mg, 3,63 mmol, 12,5 éq) et isolé après
purification par chromatographie sur colonne de silice flash (EP/AE : 80/20)
sous
15 la forme d'un solide jaune. Rendement : 51 /o (62 mg).
RMN 1H (CDCI3): 5 3.04-3.22 (m, 2H, CH2CHCF3), 3.24-3.39 (m, 1H, CHCF3),
3.79 (s, 3H, OCH3), 3.92 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 4.94 (d, 2JH,H=
14.1
Hz, 1H, NCHAHB), 5.02 (d, 2JH,H= 14.1 Hz, 1H, NCHAHB), 6.83-6.88 (m, 3H, 3 x
CHAr), 7.18 (dd, 3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz, 1H, CHAr), 7.33-7.39 (m, 3H, 3
x
20 CHAr).
[0119] 6-(4-(difluorométhoxy)-3-méthoxyphény1)-2-(4-méthoxybenzy1)-4-
(trifluorométhyl)-4,5-dihydropyridazin-3(211)-one [f4]
Le composé [f4] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [f] à partir du 4-(4-(difluorométhoxy)-3-
25 méthoxyphényI)-4-oxo-2-(trifluorométhyl)butanethioate de S-éthyle [c2] (100
mg,
0,26 mmol, 1 éq) et de la 4-méthoxylbenzylhydrazine (703 mg, 3,24 mmol, 12,5
éq) et isolé après purification par chromatographie sur colonne de silice
flash
(EP/AE : 80/20) sous la forme d'un solide beige. Rendement : 62% (0,074 g).
RMN 1H (CDCI3): O 3.07-3.41 (m, 3H, CH2CHCF3), 3.79 (s, 3H, OCH3), 3.93 (s,
3H,
30 OCH3), 4.95 (d, 2JH,H= 14.1 Hz, 1H, NCHAHB), 5.03 (d, 2JH,H = 14.1 Hz, 1H,
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
36
NCHAHB), 6.59 (t, 2JH,F= 74.7 Hz, 1H, CHF2), 6.86 (d, 3JH,H= 8.7 Hz, 2H, 2 x
CHAr),
7.19 (s, 2H, 2 x CHAr), 7.35 (d, 3JH,H= 8.7 Hz, 2H, 2 x CHAr), 7.42 (s, 1H,
CHAr).
[0120] 2-benzy1-6-cyclohexy1-4-(trifluorométhyl)-4,5-dihydropyridazin-3(211)-
one [f5]
Le composé [f5] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [f] à partir du 4-cyclohexy1-4-oxo-2-
(trifluorométhyl)butanethioate de S-éthyle [c3] (150 mg, 0,50 mmol, 1 éq) et
de la
benzylhydrazine dihydrochlorée (1257 mg, 6.25 mmol, 12,5 éq) et isolé après
purification par chromatographie sur colonne de silice flash (EP/AE : 90/10)
sous
la forme d'une huile beige. Rendement : 83% (141 mg).
RMN 1H (CDCI3): 5 1.26-1.34 (m, 5H, 5 x CHcyclohexyl), 1.68-1.82 (m, 5H, 5 X
CHcyclohexyl), 2.22-2.30 (m, 1H, CHcyclohexyl), 2.66 (s, 1H, CHAHBCHCF3), 2.68
(s, 1H,
CHAHBCHCF3), 3.13-3.27 (m, 1H, CHCF3), 4.88 (d, 2JH,H= 14.6 Hz, 1H, NCHAHB),
4.95 (d, 2JH,H= 14.6 Hz, 1H, NCHAHB), 7.24-7.35 (m, 5H, 5 x CHph).
[0121] 2-(cyclohexylméthyl)-6-(3,4-diméthoxyphény1)-4-(trifluorométhyl)-4,5-
dihyd ropyridazi n-3(211)-one [f6]
Le composé [f6] est préparé selon le mode opératoire général de synthèse des
intermédiaires de synthèse [f] à partir du 4-(3',4'-diméthoxyphény1)-2-
trifluorométhy1-4-oxo-butanethioate de S-éthyle [cl] (100 mg, 0,29 mmol, 1 éq)
et
de la cyclohexylméthylhydrazine hydrochlorée (597 mg, 3,63 mmol, 12,5 éq) et
isolé après purification par chromatographie sur colonne de silice flash
(EP/AE :
90/10) sous la forme d'une huile jaune. Rendement : 25% (29 mg).
1H NMR (CDCI3): 50.85-0.95 (m, 2H, CH2cyclohexyl), 1.14-1.24 (m, 2H,
CH2cyclohexyl),
1.46-1.88 (m, 7H, CHcyclohexyl, 3 X CH2cyclohexyl), 3.07-3.23 (m, 2H, CH2),
3.25-3.40
(m, 1H, CH-CF3), 3.67 (dd, 2JH,H= 13.2 Hz, 3JH,H= 6.9 Hz, 1H, NCH2), 3.80 (dd,
2JH,H= 13.2 Hz, 3JH,H= 7.2 Hz, 1H, NCH2), 3.93 (s, 3H, OCH3), 3.95 (s, 3H,
OCH3),
6.90 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.22 (dd, 3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz, 1H,
CHAr),
7.40 (d, 4JH,H= 2.1 Hz, 1H, CHAr).
[0122] 2-benzy1-6-(pyridin-2-y1)-4-(trifluorométhyl)-4,5-dihydropyridazin-
3(2H)-one [f7]
Le composé [f7] est préparé selon le mode opératoire général de synthèse des
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
37
intermédiaires de synthèse [f] à partir du 4-oxo-4-(pyridin-2-yI)-2-
(trifluorométhyl)butanethioate de S-éthyle [c4] (73 mg, 0,25 mmol, 1 éq) et de
la
benzylhydrazine dihydrochlorée (74 mg, 0,38 mmol, 12,5 éq) et obtenu après
purification par chromatographie sur colonne de silice flash (EP/AE : 80/20)
sous
la forme d'une laque orange. Rendement : 100% (83 mg).
1H NMR (CD30D): 63.41 (dd, 2JH,H = 18.0 Hz, 3JH,H= 9.6 Hz, 1H, CHAHBCH-CF3),
3.64 (dd, 2JH,H = 18.0 Hz, 3JH,H= 7.8 Hz, 1H, CHAHBCH-CF3), 3.72-3.87 (m, 1H,
CH2CH-CF3), 5.04 (d, 2JH,H= 14.6 Hz, 1H, NCHAHB), 5.11 (d, 2JH,H = 14.6 Hz,
1H,
NCHAHB), 7.24-7.49 (m, 6H, 6 x CHAr), 7.92 (dt, 3JH,H= 7.5 Hz, 4JH,H= 1.2 Hz,
1H,
CHAr), 8.11 (d, 3JH,H= 7.8 Hz, 1H, CHAr), 8.63 (d, 3JH,H= 5.1 Hz, 1H, CHAr).
[0123] Exemple 1 : 2-benzy1-6-(3,4-diméthoxyphény1)-4-(trifluorométhyl)pyri-
dazin-3(211)-one
Le précurseur [f1] correspondant (20 mg, 0,05 mmol, 1 éq) est mis en solution,
sous atmosphère d'argon, dans l'acétonitrile anhydre avec du chlorure
cuivrique
(35 mg, 0,25 mmol, 5 éq, en trois ajouts), ceci constitue le mélange 5(1v). Le
mélange est porté à reflux pendant une durée de l'ordre de 4h. Après
refroidissement et évaporation, le brut réactionnel est purifié par
chromatographie
sur colonne de silice flash (EP/AE : 90/10) pour obtenir le composé 1 sous
forme
d'un solide jaune. Rendement :70% (10 mg).
RMN 1H (CDCI3) : O 3.94 (s, 3H, OCH3), 3.96 (s, 3H, OCH3), 5.44 (s, 2H, NCH2),
6.94 (d, 3JH,H = 8.4 Hz, 1H, CHAr), 7.27 (dd, 3JH,H = 8.1 Hz, 4JH,H = 2.4 Hz,
1H,
CHAr), 7.31-7.39 (m, 4H, 4 x CHAr), 7.52 (dd, 3JH,H = 7.8 Hz, 4JH,H = 1.8 Hz,
1H,
CHAr), 7.52 (m, 1H, CHAr), 7.93 (s, 1H, CHpyr).
[0124] Exemple 2: 6-(3,4-diméthoxyphényI)-2-(4-méthylbenzy1)-4-(trifluoro-
méthyl)pyridazin-3(211)-one
Le précurseur [f2] correspondant (25 mg, 0,062 mmol, 1 éq) est mis en
solution,
sous atmosphère d'argon, dans l'acétonitrile anhydre avec du chlorure
cuivrique
(34 mg, 0,24 mmol, 4 éq, en deux ajouts), ceci constitue le mélange 5(1v). Le
mélange est porté à reflux pendant une durée de l'ordre de 4h. Après
refroidissement et évaporation, le brut réactionnel est purifié par
chromatographie
sur colonne de silice flash (EP/AE : 85/15) pour obtenir le composé 2 sous
forme
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
38
d'un solide jaune. Rendement : 64% (20 mg).
RMN 1H (CDCI3): O 2.33 (s, 3H, CH3), 3.94 (s, 3H, OCH3), 3.96 (s, 3H, OCH3),
5.39 (s, 2H, NCH2), 6.93 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.16 (d, 3JH,H= 8.1 Hz,
2H, 2
X CHAr), 7.27 (dd, 3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz, 1H, CHAr), 7.35 (d, 4JH,H=
2.1 Hz,
1H, CHAr), 7.42 (d, 3JH,H= 7.8 Hz, 2H, CHAr), 7.92 (d, 1H, 4JH,H= 1.2 Hz,
CHpyr).
[0125] Exemple 3: 6-(3,4-diméthoxyphény1)-2-(4-méthoxybenzy1)-4-(trifluoro-
méthyl)pyridazin-3(211)-one
Le précurseur [f3] correspondant (30 mg, 0,070 mmol, 1 éq) est mis en
solution,
sous atmosphère d'argon, dans l'acétonitrile anhydre avec du chlorure
cuivrique
(38 mg, 0,28 mmol, 4 éq, en deux ajouts), ceci constitue le mélange 5(1v). Le
mélange est porté à reflux pendant une durée de l'ordre de 4h. Après
refroidissement et évaporation, le brut réactionnel est purifié par
chromatographie
sur colonne de silice flash (EP/AE : 80/20) pour obtenir le composé 3 sous la
forme d'une huile jaune. Rendement : 24% (7 mg).
RMN 1H (CDCI3): O 3.79 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 3.97 (s, 3H, OCH3),
5.37 (s, 1H, NCH2), 6.87 (d, 3JH,H= 8.7 Hz, 2H, 2 x CHAr), 6.94 (d, 3JH,H= 8.4
Hz,
1H, CHAr),7.27 (dd, 3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz, 1H, CHAr), 7.35 (d, 4JH,H=
2.1 Hz,
1H, CHAr), 7.48 (d, 3JH,H= 8.7 Hz, 2H, 2 x CHAr), 7.91 (s, 1H, CHpyr).
[0126] Exemple 4: 6-(4-(difluorométhoxy)-3-methoxyphény1)-2-(4-méthoxy-
benzy1)-4-(trifluorométhyl)pyridazin-3(211)-one
Le précurseur [f4] correspondant (38 mg, 0,070 mmol, 1 éq) est mis en
solution,
sous atmosphère d'argon, dans l'acétonitrile anhydre avec du chlorure
cuivrique
(19 mg, 0,14 mmol, 2 éq), ceci constitue le mélange 5(1v). Le mélange est
porté à
reflux pendant une durée de l'ordre de 4h. Après refroidissement et
évaporation, le
brut réactionnel est purifié par chromatographie sur colonne de silice flash
(EP/AE : 90/10) pour obtenir le composé 4 sous la forme d'une laque jaune.
Rendement :91% (30 mg).
RMN 1H (CDCI3): O 3.78 (s, 3H, OCH3), 3.97 (s, 3H, OCH3), 5.38 (s, 2H, NCH2),
6.61 (t, 2JH,F= 74.4 Hz, 1H, OCHF2), 6.87 (dd, 3JH,H= 8.4 Hz, 4JH,H= 1.8 Hz,
2H, 2
x CHAr), 7.26-7.27 (m, 2H, 2 x CHAr), 7.40 (d, 4JH,H= 1.5 Hz, 1H, CHAr), 7.47
(d,
3JH,H= 8.4 Hz, 2H, 2 x CHAr), 7.91 (s, 1H, CHpyr).
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
39
[0127] Exemple 5: 2-benzy1-6-cyclohexy1-4-(trifluorométhyl)pyridazin-3(211)-
one
Le précurseur [f5] correspondant (88 mg, 0,26 mmol, 1 éq) est mis en solution,
sous atmosphère d'argon, dans l'acétonitrile anhydre avec du chlorure
cuivrique
(70 mg, 0,52 mmol, 2 éq), ceci constitue le mélange 5(1v). Le mélange est
porté à
reflux pendant une durée de l'ordre de 4h. Après refroidissement et
évaporation, le
brut réactionnel est purifié par chromatographie sur colonne de silice flash
(EP/AE : 95/5) pour obtenir le composé 5 sous la forme d'une huile incolore.
Rendement : 53% (50 mg).
RMN 1H (CDCI3): O 1.18-1.35 (m, 5H, 5 x CHcyclohexyl), 1.65-1.84 (m, 5H, 5 x
CHcyclohexyl), 2.46-2.54 (m, 1H, CHcyclohexyl), 5.23 (s, 2H, NCH2), 7.18-7.29
(m, 3H, 3
x CHAr), 7.34 (d, 5JH,H= 0.9 Hz, 1H, CHpyr), 7.38-7.41 (m, 2H, 2 x CHAr).
[0128] Exemple 6: 2-(cyclohexylméthyl)-6-(3,4-diméthoxyphény1)-4-(trifluoro-
méthyl)pyridazin-3(211)-one
Le précurseur [f6] correspondant (15 mg, 0,038 mmol, 1 éq) est mis en
solution,
sous atmosphère d'argon, dans l'acétonitrile anhydre avec du chlorure
cuivrique
(20 mg, 0,150 mmol, 4 éq, en deux ajouts), ceci constitue le mélange 5(1v). Le
mélange est porté à reflux pendant une durée de l'ordre de 4h. Après
refroidissement et évaporation, le brut réactionnel est purifié par
chromatographie
sur colonne de silice flash (EP/AE : 90/10) pour obtenir le composé 6 sous la
forme d'une laque jaune. Rendement : 61 /o (90 mg).
RMN 1H (CDCI3): O 1.04-1.33 (m, 6H, 3 x CH2cycionexyl), 1.70-1.74 (m, 4H, 2 x
CH2cyclohexyl), 1.98-2.10 (m, 1H, CHcyclohexyl), 3.95 (s, 3H, OCH3), 3.98 (s,
3H, OCH3),
4.14 (d, 2JH,H= 7.2 Hz, 2H, NCH2), 6.95 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.29
(dd,
3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz, 1H, CHAr), 7.36 (d, 4JH,H= 2.1 Hz, 1H, CHAr),
7.94 (s,
1H, CHpyr).
[0129] Exemple 7: 6-(3,4-d I méthoxyphény1)-2-(thlophén-3-y1
méthyl)-4-
(trifluorométhyl)pyridazin-3(211)-one
La pyridazinone N2-H [el] (50 mg, 0,17 mmol, 1 éq) est mise en solution dans
l'acétonitrile avec du K2CO3 (59 mg, 0,43 mmol, 2,5 éq), du Bu4NBr (3 mg,
0,009
mmol, 0,05 éq), et le chlorure de 3-méthylthiophène (25 mg, 0,18 mmol, 1,1
éq),
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
ceci constitue le mélange 6(v). Ce mélange est chauffé à 60 C pendant une
durée
de l'ordre de 2 à 4h. Après refroidissement, le solvant est évaporé et le brut
est
repris dans l'eau et extrait au chlorure de méthylène. Après séchage de la
phase
organique, filtration, évaporation sous pression réduite, le brut réactionnel
est
5 purifié par chromatographie sur colonne de silice flash (EP/AE : 80/20) pour
obtenir le composé 7 sous la forme de cristaux jaunes. Rendement : 70% (47
mg).
RMN 1H (CDCI3): 5 3.94 (s, 3H, OCH3), 3.97 (s, 3H, OCH3), 5.44 (s, 2H, NCH2),
6.94 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.23-7.25 (m, 1H, CHAr), 7.29 (dd, 3JH,H=
5.1 Hz,
4JH,H= 2.7 Hz, 2H, 2 x CHAr), 7.34 (d, 4JH,H= 2.1 Hz, 1H, CHAr), 7.44 (dd,
3JH,H=
10 2.7 Hz, 4JH,H= 1.2 Hz, 1H, CHAr), 7.93 (s, 1H, CHpyr).
[0130] Exemple 8: 6-(4-(difluorométhoxy)-3-méthoxyphény1)-2-(thlophén-3-
ylméthyl)-4-(trifluorométhyl)pyridazin-3(211)-one
La pyridazinone N2-H [e2] (50 mg, 0,15 mmol, 1 éq) est mise en solution dans
l'acétonitrile avec du K2CO3 (52 mg, 0,38 mmol, 2,5 éq), du Bu4NBr (3 mg,
0,009
15 mmol, 0,05 éq), et le chlorure de 3-méthylthiophène (23 mg, 0,17 mmol, 1,1
éq),
ceci constitue le mélange 6(v). Ce mélange est chauffé à 60 C pendant une
durée
de l'ordre de 2 à 4h. Après refroidissement, le solvant est évaporé et le brut
est
repris dans l'eau et extrait au chlorure de méthylène. Après séchage de la
phase
organique, filtration, évaporation sous pression réduite, le brut réactionnel
est
20 purifié par chromatographie sur colonne de silice flash (EP/AE : 80/20)
pour
obtenir le composé 8 sous la forme de cristaux beiges. Rendement : 78% (50
mg).
RMN 1H (CDCI3): 54.00 (s, 3H, OCH3), 5.48 (s, 2H, NCH2), 6.64 (t, 2JH,F= 74.4
Hz,
1H, OCHF2), 7.23 (dd, 3JH,H= 4.8 Hz, 4JH,H= 1.5 Hz, 1H, CHAr), 7.27 (d, 3JH,H=
2.4
Hz, 2H, 2 x CHAr), 7.30 (dd, 3JH,H= 4.8 Hz, 4JH,H= 3.3 Hz, 1H, CHAr), 7.40 (d,
3JH,H
25 = 1.8 Hz, 1H, CHAr), 7.44 (dd, 3JH,H= 3.0 Hz, 4JH,H= 1.2 Hz, 1H, CHAr),
7.92 (s, 1H,
CHpyr).
[0131] Exemple 9: 6-(4-(difluorométhoxy)-3-méthoxyphény1)-2-(1-phényl-
éthyl)-4-(trifluorométhyl)pyridazin-3(211)-one
La pyridazinone N2-H [e2] (100 mg, 0,30 mmol, 1 éq) est mise en solution dans
30 l'acétonitrile avec du K2CO3, du Bu4NBr, et le 1-chloro-1-phényléthane (90
1.11_,
0,66 mmol, 2,1 éq, en deux ajouts), ceci constitue le mélange 6(v). Ce mélange
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
41
est chauffé à 60 C pendant une durée de l'ordre de 2 à 4h. Après
refroidissement,
le solvant est évaporé et le brut est repris dans l'eau et extrait au chlorure
de
méthylène. Après séchage de la phase organique, filtration, évaporation sous
pression réduite, le brut réactionnel est purifié par trituration dans l'éther
diéthylique pour obtenir le composé 9 sous la forme d'un solide beige.
Rendement : 50% (64 mg).
RMN 1H (DMSO-d6): 51.77 d, 3JH,H= 6.9 Hz, 3H, CH3), 3.90 (s, 3H, OCH3), 6.27
(q, 3JH,H= 6.9 Hz, 1H, NCHCH3), 7.15 (t, 2JH,F= 74.4 Hz, 1H, OCHF2), 7.25-7.62
(m, 6H, 6 x CHAr), 7.57 (dd, 3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz, 1H, CHAr), 7.62 (d,
4JH,H
= 2.1 Hz, 1H, CHAr), 8.48 (s, 1H, CHpyr).
[0132] Exemple 10: 6-(3,4-diméthoxyphény1)-2-(4-phénéthylbenzy1)-4-
(trifluorométhyl)pyridazin-3(211)-one
La pyridazinone N2-H [el] (50 mg, 0,17 mmol, 1 éq) est mise en solution dans
l'acétonitrile avec du K2CO3 (59 mg, 0,43 mmol, 2,5 éq), du Bu4NBr (3 mg,
0,009
mmol, 0,05 éq), et le 4-(chlorométhyl)-1,2-diphényléthane (42 mg, 0,18 mmol,
1,1
éq), ceci constitue le mélange 6(v). Ce mélange est chauffé à 60 C pendant une
durée de l'ordre de 2 à 4h. Après refroidissement, le solvant est évaporé et
le brut
est repris dans l'eau et extrait au chlorure de méthylène. Après séchage de la
phase organique, filtration, évaporation sous pression réduite, le brut
réactionnel
est purifié par chromatographie sur colonne de silice flash (EP/AE : 85/15)
pour
obtenir le composé 10 sous la forme d'une laque jaune vif. Rendement : 65% (55
mg).
RMN 1H (CDCI3) 5 2.90 (s, 4H, 2 x CH2), 3.94 (s, 3H, OCH3), 3.96 (s, 3H,
OCH3),
5.41 (s, 2H, NCH2), 6.94 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.16-7.21 (m, 5H, 5 x
CHAr),
7.24-7.29 (m, 5H, 5 x CHAr), 7.35 (d, 4JH,H= 2.1 Hz, 1H, CHAr), 7.45 (d,
3JH,H= 6.0
Hz, 2H, 2 x CHAr), 7.93 (s, 1H, CHpyr).
[0133] Exemple 11: 6-(4-(difluorométhoxy)-3-méthoxyphény1)-2-(4-phénéthyl-
benzy1)-4-(trifluorométhyl)pyridazin-3(211)-one
La pyridazinone N2-H [e2] (50 mg, 0,15 mmol, 1 éq) est mise en solution dans
l'acétonitrile avec du K2CO3 (52 mg, 0,38 mmol, 2,5 éq), du Bu4NBr (3 mg,
0,009
mmol, 0,05 éq), et le 4-(chlorométhyl)-1,2-diphényléthane (38 mg, 0,16 mmol,
1,1
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
42
éq), ceci constitue le mélange 6(v). Ce mélange est chauffé à 60 C pendant une
durée de l'ordre de 2 à 4h. Après refroidissement, le solvant est évaporé et
le brut
est repris dans l'eau et extrait au chlorure de méthylène. Après séchage de la
phase organique, filtration, évaporation sous pression réduite, le brut
réactionnel
est purifié par chromatographie sur colonne de silice flash (EP/AE : 90/10)
pour
obtenir le composé 11 sous la forme de cristaux blancs. Rendement : 86% (69
mg).
RMN 1H (CDCI3) 5 2.89 (s, 4H, 2 x CH2), 3.96 (s, 3H, OCH3), 5.41 (s, 2H,
NCH2),
6.61 (t, 2JH,F= 74.7 Hz, 1H, OCHF2), 7.15-7.30 (m, 9H, 9 x CHAr), 7.41-7.45
(m, 3H,
3 x CHAr), 7.92 (d, 5JH,H= 0.9 Hz, 1H, CHpyr).
[0134] Exemple 12: 2-benzy1-6-(3,4-diméthoxyphény1)-4-(trifluorométhyl)-4,5-
dihydropyridazin-3(211)-one
Le précurseur [cl] (100 mg, 0,29 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la benzylhydrazine; ceci constitue le mélange 4(i11).
Ce
mélange 4 est porté à reflux pendant une durée de l'ordre de 1h. Après
filtration,
lavage et séchage sous vide, le brut réactionnel est purifié par
chromatographie
sur colonne de silice flash (EP/AE : 80/20) pour obtenir le composé 12 sous la
forme d'un solide beige. Rendement : 47% (54 mg).
RMN 1H (CDCI3): 53.05-3.23 (m, 2H, CH2CHCF3), 3.27-3.41 (m, 1H, CHCF3), 3.91
(s, 6H, 2 x OCH3), 5.01 (d, 2JH,H= 14.4 Hz, 1H, NCHAHB), 5.08 (d, 2JH,H= 14.4
Hz,
1H, NCHAHB), 6.86 (d, 3JH,H= 8.4 Hz, 1H, CHAr), 7.18 (dd, 3JH,H= 8.4 Hz,
4JH,H=
2.1 Hz, 1H, CHAr), 7.26-7.42 (m, 6H, 6 x CHAr).
[0135] Exemple 13: 6-(3,4-diméthoxyphény1)-2-(4-méthylbenzy1)-4-(trifluoro-
méthyl)-4,5-dihydropyridazin-3(211)-one
Le précurseur [cl] (100 mg, 0,29 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la 4-méthylbenzylhydrazine (626 mg, 3,63 mmol, 12,5
éq),
ceci constitue le mélange 4(111). Ce mélange 4 est porté à reflux pendant une
durée de l'ordre de 1h. Après filtration, lavage et séchage sous vide, le brut
réactionnel est purifié par chromatographie sur colonne de silice flash (EP/AE
:
80/20) pour obtenir le composé 13 sous la forme d'un solide blanc. Rendement :
100% (40 mg).
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
43
RMN 1H (CDCI3): 5 2.33 (s, 3H, CH3), 3.05-3.25 (m, 2H, CH2CHCF3), 3.25-3.40
(m,
1H, CHCF3), 3.92 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 4.97 (d, 2JH,H= 14.3 Hz,
1H,
NCHAHB), 5.04 (d, 2JH,H= 14.3 Hz, 1H, NCHAHB), 6.87 (d, 3JH,H= 8.4 Hz, 1H,
CHAr),
7.13 (d, 3JH,H= 7.8 Hz, 2H, 2 x CHAr), 7.18 (dd, 3JH,H= 8.4 Hz, 4JH,H= 2.1 Hz,
1H,
CHAr), 7.31 (d, 3JH,H= 7.8 Hz, 2H, 2 x CHAr), 7.38 (d, 4JH,H= 2.1 Hz, 1H,
CHAr).
[0136] Exemple 14: 2-benzy1-6-(pyridin-2-y1)-4-(trifluorométhyl)pyrida zin-
3(211)-one (14)
Le précurseur [f7] correspondant (30 mg, 0,90 mmol, 1 éq) est mis en solution,
sous atmosphère d'argon, dans l'acétonitrile anhydre avec du chlorure
cuivrique
(242 mg, 1,80 mmol, 2 éq), ceci constitue le mélange 5(1v). Le mélange est
porté
à reflux pendant une durée de l'ordre de 4h. Après refroidissement et
évaporation,
le brut réactionnel est purifié par chromatographie sur colonne de silice
flash
(EP/AE : 90/10) pour obtenir le composé 14 sous forme de laque transparente.
Rendement : 20% (5 mg).
RMN 1H (CDCI3) : 65.46 (s, 2H, NCH2), 7.32-7.39 (m, 4H, 4 x CHAr), 7.52-7.54
(m,
2H, 2 x CHAr), 7.83 (t, 3JH,H= 7.8 Hz, 1H, CHAr), 8.13 (bs, 1H, CHAr), 8.65
(bs, 1H,
CHAr), 8.72 (s, 1H, CHAr).
[0137] Exemple 15: 6-(4-(difluorométhoxy)-3-méthoxyphény1)-2-(4-
méthoxybenzy1)-4-(trifluorométhyl)-4,5-dihydropyridazin-3(211)-one
Le précurseur [c2] (100 mg, 0,26 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la 4-méthoxybenzylhydrazine (703 mg, 3,24 mmol, 12,5
éq),
ceci constitue le mélange 4(111). Ce mélange 4 est porté à reflux pendant une
durée de l'ordre de 1h. Après filtration, lavage et séchage sous vide, le brut
réactionnel est purifié par chromatographie sur colonne de silice flash (EP/AE
:
80/20) pour obtenir le composé 15 sous la forme d'un solide beige. Rendement :
62% (70 mg).
RMN 1H (CDCI3): O 3.07-3.41 (m, 3H, CHCH2CF3), 3.79 (s, 3H, OCH3), 3.93 (s,
3H,
OCH3), 4.95 (d, 2JH,H= 14.1 Hz, 1H, NCHAHB), 5.03 (d, 2JH,H = 14.1 Hz, 1H,
NCHAHB), 6.59 (t, 2JH,F= 74.7 Hz, 1H, CHF2), 6.86 (d, 3JH,H= 8.7 Hz, 2H, 2 x
CHAr),
7.19 (s, 2H, 2 x CHAr), 7.35 (d, 3JH,H= 8.7 Hz, 2H, 2 x CHAr), 7.42 (s, 1H,
CHAr).
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
44
[0138] Exemple 16: 2-benzy1-6-cyclohexy1-4-(trifl uorométhyl)-4,5-di hyd ro-
pyridazin-3(211)-one
Le précurseur [c3] (150 mg, 0,50 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la benzylhydrazine, ceci constitue le mélange 4(111).
Ce
mélange est porté à reflux pendant une durée de l'ordre de 1h. Après
filtration,
lavage et séchage sous vide, le brut réactionnel est purifié par
chromatographie
sur colonne de silice flash (EP/AE : 90/10) pour obtenir le composé 16 sous la
forme d'une huile beige. Rendement : 43% (50 mg).
RMN 1H (CDCI3): 5 1.26-1.34 (m, 5H, 5 x CHcyclohexyl), 1.68-1.82 (m, 5H, 5 x
CHcyclohexyl), 2.22-2.30 (m, 1H, CHcyclohexyl), 2.66 (s, 1H, CHAHBCHCF3), 2.68
(s, 1H,
CHAHBCHCF3), 3.13-3.27 (m, 1H, CHCF3), 4.88 (d, 2JH,H= 14.6 Hz, 1H, NCHAHB),
4.95 (d, 2JH,H= 14.6 Hz, 1H, NCHAHB), 7.24-7.35 (m, 5H, 5 x CHph).
[0139] Exemple 17: 6-
(4-(difluorométhoxy)-3-méthoxyphény1)-2-(4-
méthylbenzy1)-4-(trifluorométhyl)-4,5-dihydropyridazin-3(211)-one
Le précurseur [c2] (77 mg, 0,20 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la 4-méthylbenzylhydrazine (340 mg, 2,50 mmol, 12,5
éq),
ceci constitue le mélange 4(111). Ce mélange est porté à reflux pendant une
durée
de l'ordre de lh. Après filtration, lavage et séchage sous vide, le brut
réactionnel
est purifié par chromatographie sur colonne de silice flash (EP/AE : 90/10)
pour
obtenir le composé 17 sous la forme d'un solide beige. Rendement : 65% (57
mg).
RMN 1H (CDCI3): O 2.33(s, 3H, CH3), 3.07-3.25 (m, 2H, CH2CHCF3), 3.28-3.39 (m,
1H, CHCF3), 3.92 (s, 3H, OCH3), 4.97 (d, 2JH,H= 14.1 Hz, 1H, NCHAHB), 5.05 (d,
2JH,H = 14.1 Hz, 1H, NCHAHB), 6.59 (t, 2JH,F= 74.7 Hz, 1H, CHF2), 7.12-7.18
(m, 4H,
4 x CHAr), 7.29 (d, 3JH,H= 7.8 Hz, 2H, 2 x CHAr), 7.42 (s, 1H, CHAr).
[0140] Exemple 18: 6-(3,4-
(diméthoxyphény1)-2-(1-phényléthyl)-4-
(trifluorométhyl)pyridazin-3(211)-one
La pyridazinone N2-H [el] (50 mg, 0,16 mmol, 1 éq) est mise en solution dans
l'acétonitrile avec du K2CO3 (57 mg, 0,42 mmol, 2,5 éq), du Bu4NBr (3 mg,
0,007
mmol, 0,05 éq), et le 1-chloro-1-phényléthane (25 1.11_, 0,18 mmol, 1,1 éq),
ceci
constitue le mélange 6(v). Ce mélange est chauffé à 60 C pendant une durée de
l'ordre de 2 à 4h. Après refroidissement, le solvant est évaporé et le brut
est repris
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
dans l'eau et extrait au chlorure de méthylène. Après séchage de la phase
organique, filtration, évaporation sous pression réduite, le brut réactionnel
est
purifié par chromatographie sur colonne de silice flash (EP/AE : 90/10) pour
obtenir le composé 18 sous la forme d'une laque jaune. Rendement : 57% (38
mg).
5 RMN 1H (CDCI3): 51.86 (d, 3JH,H= 7.2 Hz, 3H, CH3), 3.94 (s, 3H, OCH3), 3.95
(s,
3H, OCH3), 6.46 (q, 3JH,H= 7.2 Hz, 1H, NCHCH3), 6.94 (d, 3JH,H= 8.4 Hz, 1H,
CHAr), 7.26-7.38 (m, 5H, 5 x CHAr), 7.51-7.55 (m, 2H, 2 x CHAr), 7.90 (d,
4JH,H= 0.9
Hz, 1H, CHAr).
[0141] Exemple 19: 2-benzy1-6-(pyridin-2-y1)-4-(trifluorométhyl)-4,5-dihydro
10 pyridazin-3(2H)-one
Le précurseur [c4] (73 mg, 0,25 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la benzylhydrazine (74 mg, 0.38 mmol, 1,5 éq), ceci
constitue le mélange 4(111). Ce mélange est porté à reflux pendant une durée
de
l'ordre de lh. Après filtration, lavage et séchage sous vide, le brut
réactionnel est
15 purifié par chromatographie sur colonne de silice flash (EP/AE : 80/20)
pour
obtenir le composé 19 sous la forme d'une laque orangée. Rendement : 80% (66
mg).
RMN 1H (CD30D): 63.41 (dd, 2JH,H= 18.0 Hz, 3JH,H= 9.6 Hz, 1H, CHAHBCHCF3),
3.64 (dd, 2JH,H = 18.0 Hz, 3JH,H= 7.8 Hz, 1H, CHAHBCHCF3), 3.72-3.87 (m, 1H,
20 CH2CH-CF3), 5.04 (d, 2JH,H= 14.6 Hz, 1H, NCHAHB), 5.11 (d, 2JH,H= 14.6 Hz,
1H,
NCHAHB), 7.24-7.49 (m, 6H, 6 x CHAr), 7.92 (dt, 3JH,H= 7.5 Hz, 4JH,H= 1.2 Hz,
1H,
CHAr), 8.11 (d, 3JH,H= 7.8 Hz, 1H, CHAr), 8.63 (d, 3JH,H= 5.1 Hz, 1H, CHAr).
[0142] Exemple 20: 2-(4-méthyl benzyI)-6-(pyricl I n-2-yI)-4-(trifl
uorométhyl)-
4,5-dihydropyridazin-3(2F1)-one
25 Le précurseur [c4] (44 mg, 0,15 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la 4-méthylbenzylhydrazine (31 mg, 0.25 mmol, 1,5 éq),
ceci
constitue le mélange 4(111). Ce mélange est porté à reflux pendant une durée
de
l'ordre de lh. Après filtration, lavage et séchage sous vide, le brut
réactionnel est
purifié par chromatographie sur colonne de silice flash (EP/AE : 90/10) pour
30 obtenir le composé 20 sous la forme d'un solide blanc. Rendement : 71 /o
(37 mg).
RMN 1H (CDCI3): 6 2.33 (s, 3H, CH3), 3.33-3.41 (m, 2H, CH2CHCF3), 3.56-3.68
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
46
(m, 1H, CH-CF3), 5.07 (d, 2JH,H= 14.3 Hz, 1H, NCHAHB), 5.05 (d, 2JH,H= 14.3
Hz,
1H, NCHAHB), 7.14 (d, 3JH,H= 7.8 Hz, 2H, 2 x CHAr), 7.28-7.31 (m, 1H, CHAr),
7.31
(d, 3JH,H= 7.8 Hz, 2H, 2 x CHAr), 7.73 (dt, 3JH,H= 7.5 Hz, 4JH,H= 1.2 Hz, 1H,
CHAr),
8.06 (d, 3JH,H= 7.8 Hz, 1H, CHAr), 8.59 (d, 3JH,H= 5.1 Hz, 1H, CHAr).
[0143] Exemple 21: 2-(4-méthoxybenzyI)-6-(pyrid I n-2-yI)-4-(trifl uorométhyl)-
4,5-di hydropyridazi n-3(2H)-one
Le précurseur [c4] (73 mg, 0,25 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la 4-méthoxybenzylhydrazine (57 mg, 0,38 mmol, 1,5 éq),
ceci constitue le mélange 4(111). Ce mélange est porté à reflux pendant une
durée
de l'ordre de 1h. Après filtration, lavage et séchage sous vide, le brut
réactionnel
est purifié par chromatographie sur colonne de silice flash (EP/AE : 90/10)
pour
obtenir le composé 21 sous la forme d'un solide blanc. Rendement : 36% (33
mg).
RMN 1H (CDCI3): O 3.26-3.40 (m, 2H, CH2CHCF3), 3.55-3.68 (m, 1H, CH-CF3),
3.79 (s, 3H, OCH3), 4.96 (d, 2JH,H= 14.1 Hz, 1H, NCHAHB), 5.03 (d, 2JH,H= 14.1
Hz,
1H, NCHAHB), 6.86 (d, 3JH,H= 8.6 Hz, 2H, 2 x CHAr), 7.29-7.33 (m, 1H, CHAr),
7.36
(d, 3JH,H= 8.6 Hz, 2H, 2 x CHAr), 7.74 (dt, 3JH,H= 7.5 Hz, 4JH,H= 1.5 Hz, 1H,
CHAr),
8.07 (d, 3JH,H= 8.1 Hz, 1H, CHAr), 8.59 (d, 3JH,H= 5.1 Hz, 1H, CHAr).
[0144] Exemple 22: 6-(4-(difluorométhoxy)-3-méthoxyphény1)-2-(4-méthyl
benzy1)-4-(trifluorométhyl)-4,5-dihydropyridazin-3(2H)-one
Le précurseur [c2] (58 mg, 0,15 mmol, 1 éq) est mis en solution dans de
l'acide
acétique glacial et de la benzylhydrazine (377 mg, 1,875 mmol, 12,5 éq), ceci
constitue le mélange 4(111). Ce mélange est porté à reflux pendant une durée
de
l'ordre de lh. Après filtration, lavage et séchage sous vide, le brut
réactionnel est
purifié par chromatographie sur colonne de silice flash (EP/AE : 80/20) pour
obtenir le composé 22 sous la forme d'un solide beige. Rendement : 70% (45
mg).
RMN 1H (CDCI3): O 3.09-3.26 (m, 2H, CH2CH-CF3), 3.31-3.45 (m, 2H, CH2CH-
CF3), 3.91 (s, 3H, OCH3), 5.02 (d, 2JH,H= 14.4 Hz, 1H, NCHAHB), 5.08 (d, 2JH,H
=
14.4 Hz, 1H, NCHAHB), 6.59 (t, 2JH,F= 74.7 Hz, 1H, CHF2), 7.18 (s, 2H, 2 x
CHAr),
7.38-7.41 (m, 6H, 6 x CHAr).
ÉVALUATION BIOLOGIQUE
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
47
[0145] Pour évaluer l'action des composés selon l'invention sur la
restauration de
l'activité CFTR, lesdits composés ont été testés in vitro en utilisant un kit
Premo
Halid Sensor (Invitrogen) adapté.
[0146] Le principe repose sur la mesure de fluorescence (à 515-530 nm) émise
par une sonde en présence ou en absence des composés de type N-
benzylpyridazinones permettant de moduler l'activité de la protéine CFTR et
donc
de restaurer l'activité chlorure du canal.
[0147] Le transport d'ions chlorures CFTR-dépendant est ainsi évalué dans un
premier temps dans des ostéoblastes à l'aide d'une sonde fluorescente (halide-
sensitive yellow fluorescent protein (YFP)-H1480/I152 L protein (Life
Technologies, Saint Aubin, France)) (Figure 1).
[0148] 48h après transfection de la sonde dans la cellule, l'activité du canal
CFTR
est stimulée à l'aide d'une solution composée de forskoline, de 3-isobuty1-1-
méthylxanthine et d'apigenine (chaque composant à une concentration de 10 pM).
Une solution iodée (140 mM) est alors ajoutée et la fluorescence est
enregistrée à
l'aide d'un lecteur de plaque (400 ms/point ; Ft) sur une période de 60s
(ligne de
base ; FO). La diminution du rapport Ft/F0 représente la restauration de
l'activité
chlorure du canal CFTR.
[0149] Un inhibiteur spécifique du canal CFTR (CFTRinh-172 (10 pM)) est
utilisé
pour vérifier le signal émis par les ostéoblastes non traités. En présence de
cet
inhibiteur (contrôle) aucune décroissance de la fluorescence n'est observée.
[0150] Pour les analyses quantitatives les pentes des signaux obtenus sont
traitées dans des régressions non-linéaires et corrélées au niveau de la
conductance des ions chlorures.
[0151] Les résultats obtenus pour les composés 1 et 4 selon l'invention sont
présentés dans la figure 1.
[0152] Les mesures indiquent une restauration de l'activité du canal CFTR
(150%
en moyenne) des composés 1 et 4 selon l'invention par rapport à des substances
de références (Ivacaftor, Lumacaftor, Orkambi). La figure 1 montre que les
composés 1 et 4 permettent d'obtenir une meilleure restauration de l'activité
du
CA 03163176 2022-05-27
WO 2021/105641 PCT/FR2020/052228
48
canal CFTR que celles obtenues avec l'Ivacaftor et le Lumacaftor, et que le
composé 1 permet d'obtenir une restauration de l'activité du canal CFTR
similaire
à celle obtenue avec l'Orkambi.
[0153] Les composés 1 à 11 et 13 selon l'invention ont été évalués dans un
modèle de cellules épithéliales pulmonaires. Les figures 2 et 3 présentent les
résultats obtenus pour 12 d'entre eux dont l'efficacité est lisible après 60
secondes
d'enregistrement comparativement à la condition basale (DMSO). Ces résultats
montrent une restauration de l'activité du canal CFTR de 102 à 132% en
moyenne.
[0154] La figure 4 présente l'analyse à 2 secondes de l'activité du canal CFTR
et
conforte l'effet des composés 1 à 8 et 10 à 18 selon l'invention selon
l'invention
comparativement à la condition basale. Ces résultats montrent une restauration
de
l'activité du canal CFTR de 102% à 152% en moyenne.
[0155] La figure 5 présente l'évaluation in vitro de la restauration de
l'activité du
canal CFTR des composés 1 et 4 selon l'invention en combinaison avec
l'Ivacaftor
ou le Lumacaftor, en comparaison avec l'Orkambi.