Note: Descriptions are shown in the official language in which they were submitted.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
1
Description
Titre : Mousse de lysat plaquettaire pour la culture
cellulaire, la thérapie cellulaire et la régénération
tissulaire et procédé d'obtention
Domaine technique
[0ool] La présente invention concerne l'élaboration d'un biomatériau obtenu
par
séchage d'un hydrogel de lysat plaquettaire (LP) par CO2 supercritique.
Technique antérieure
[0002] Le lysat plaquettaire (LP) est un dérivé sanguin riche en facteurs de
croissance. Il est utilisé en routine pour la culture cellulaire et des pistes
existent
pour son éventuelle utilisation en thérapeutique humaine. Le lysat
plaquettaire
obtenu par simple destruction de la membrane plasmique des plaquettes
circulantes
du sang offre actuellement de nouvelles stratégies pour la culture cellulaire,
la
cicatrisation et la régénération tissulaire.
[0003] En effet, la présence dans les lysats plaquettaires, de facteurs de
croissance et cytokines tels que le VEGF, le PDGF, l'EGF et le TGF-6 qui
seront
libérés lors de l'implantation du concentré dans le milieu (contribuant ainsi
à la
croissance des tissus) constitue un argument important pour l'utilisation
biomédicale des concentrés plaquettaires (Amable PR et al., Mesenchymal
stromal cell proliferation, gene expression and protein production in human
platelet-
rich plasma-supplemented media. PloS One 2014;9(8):e104662).
[0004] Il a été proposé dans l'état de la technique, des hydrogels de lysat
plaquettaire. Cependant, la présence d'eau dans le lysat plaquettaire et le
gel ne
permet pas une bonne conservation ni une bonne manipulation pour
l'implantation
in vivo.
[0005] La gélification est un processus qui fait apparaitre, au sein d'une
solution,
une phase solide qui s'organise pour constituer un réseau continu
tridimensionnel
qui emprisonnera le solvant.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
2
[0006] Un gel est donc un système biphasique
solide-liquide
thermodynamiquement stable constitué d'un double réseau interpénétré continu
tridimensionnel, l'un solide et le second liquide.
[0007] Des systèmes alternatifs aux hydrogels ont été proposés, comme les
mousses. Une mousse est une dispersion de gaz dans une phase condensée,
autrement dit, c'est un système familier, de comportement complexe et aux
propriétés ambiguës. Par exemple, les mousses ont une très faible densité,
mais
peuvent être parfois parfaitement rigides, voire solides"
[0008] On citera, à titre illustratif, une mousse d'un mélange de fibrine et
d'autres
substances telles que de la thrombine, de la prothrombine, des extraits de
plaquettes sanguines, des inhibiteurs de protéases, des antibiotiques, pour
absorber des substances biochimiques et des substrats pour une hémostase
accélérée et un contrôle biochimique optimisé de la fermeture de la plaie. La
mousse est obtenue par lyophilisation (US4442655). Cependant, la
lyophilisation
nécessite une étape de congélation du réseau de fibres qui, lorsqu'elle est
mal
contrôlée, entraine l'éclatement de la mousse et la rend inutilisable. De
plus, la
lyophilisation, sauf si elle est effectuée en salle blanche, ne permet pas la
fabrication
de biomatériaux stériles. La lyophilisation en salle blanche impose par
ailleurs, une
contrainte et des coûts supplémentaires.
[0009] Des mousses et matrices de fibrines à délivrance contrôlée améliorée
sont
également décrites dans le document US20130183279. Des facteurs bioactifs tels
que des facteurs de croissance sont additionnés avant la polymérisation de la
fibrine.
Ces facteurs bioactifs sont donc ajoutés et ne sont pas naturellement présents
dans
la composition de précurseur.
Problème technique
[00u] II est ainsi nécessaire de concevoir un biomatériau d'origine naturelle
qui
soit aisément manipulable, présente une bonne conservation, et qui soit
également
capable d'induire une régénération tissulaire chez l'hôte par la constitution
d'une
matrice qui favorise l'envahissement, le développement, la prolifération et
l'activité
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
3
des cellules du receveur. Il est également nécessaire de proposer un procédé
simple à mettre en oeuvre et permettant d'obtenir un biomatériau stérile.
Exposé de l'invention
[0011] La présente invention concerne une mousse de lysat plaquettaire obtenue
à partir de dérivé sanguin (allogénique ou autologue) qui conserve les
propriétés
biologiques des lysats plaquettaires et possède des propriétés, notamment
mécaniques mais également de conservation, optimales qui permettent sa
commercialisation et facilitent sa manipulation.
[0012] La mousse de lysat plaquettaire selon la présente invention peut être
utilisée directement à l'état sec autorisant ainsi une pénétration immédiate
des
cellules, facteurs de croissance et fluides biologiques présents sur le site
d'implantation, ou hydratée pour retrouver la forme gélifiée. Elle permet
également
une libération lente et prolongée de facteurs de croissance naturellement
présents
dans la mousse de lysat plaquettaire.
[0013] De par la libération lente et prolongée des facteurs de croissance, la
mousse de lysat plaquettaire selon l'invention favorise avantageusement
l'envahissement, le développement et la prolifération cellulaire.
[0014] Ainsi, la mousse de lysat plaquettaire selon la présente invention est
avantageusement utilisée à des fins thérapeutiques, de culture cellulaire et
peut être
envisagée à des fins de thérapie cellulaire.
[0015] La présente invention concerne également un procédé d'obtention d'une
mousse de lysat plaquettaire par un procédé de séchage en atmosphère CO2
supercritique et une mousse de lysat plaquettaire susceptible d'être obtenue
par ce
procédé.
Description Détaillée
[0016] La présente invention concerne une mousse de lysat plaquettaire
caractérisée en ce qu'elle comprend du TGF-beta, de l'EGF, du PDGF-AB, de
l'IGF-
1, du VEGF et du bFGF, au sein d'une matrice de fibrine polymérisée.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
4
[0017] Les mousses de lysat plaquettaires selon la présente invention sont
directement obtenues à partir de lysats plaquettaires et conservent
avantageusement les propriétés biologiques des lysats plaquettaires.
[0018] Une mousse est une dispersion de gaz dans une phase condensée. Dans
le domaine des mousses, on distingue d'un côté, les mousses dites humides qui
contiennent une fraction volumique de liquide élevée et que l'on peut
considérer
comme des dispersions de gaz dans un liquide et les mousses dites sèches, qui
contiennent très peu de liquide.
[0019] La mousse selon la présente invention est une mousse sèche.
[0020] Typiquement, la teneur en eau de la mousse selon l'invention est
inférieure
à 10% par rapport au poids total de la mousse, préférentiellement inférieure à
7,5%
et de manière préférée, la teneur en eau est inférieure à 5%.
[0021] Typiquement, la teneur en eau de la mousse selon l'invention est
d'environ
4.5%.
[0022] La teneur en eau peut être mesurée par toute technique connue de
l'homme
du métier. Typiquement, on citera la balance à infrarouge ou la
thermogravimétrie.
[0023] Lysat plaquettaire
[0024] On entend par lysat plaquettaire , le produit de la lyse de
plaquettes,
c'est-à-dire le produit obtenu après désintégration de la membrane cellulaire
qui
conduit à la libération des molécules telles que les facteurs de croissance et
les
cytokines normalement contenues à l'intérieur des plaquettes.
[0025] Le lysat plaquettaire utilisé pour la fabrication de la mousse pourra
être
obtenu par achat de pools de lysats plaquettaires conçus à partir
d'échantillons
sanguins de plusieurs donneurs ou par conception directe à partir de
prélèvements
chez un patient. Le sang, recueilli dans des tubes citratés est centrifugé
pour
séparer les phases de globules rouges, de globules blancs et du plasma.
L'isolation
du plasma concentré en plaquettes permet ensuite de lui faire subir des cycles
de
congélation-décongélation ou de sonication pour détruire la membrane des
plaquettes et aboutir au lysat plaquettaire. Une phase de déleucocytation est
applicable pour éliminer tout résidu de leucocytes dans la solution.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
[0026] Naturellement présents
[0027] Les facteurs de croissance présents dans la mousse de lysat
plaquettaire
sont les facteurs de croissance naturellement présents dans le lysat
plaquettaire
(Fekete et al. "Platelet lysate from whole blood-derived pooled platelet
concentrates
5 and apheresis-derived platelet concentrates for the isolation and expansion
of
human bone marrow mesenchymal stromal cells: production process, content and
identification of active components. 2012 May;14(5):540-54. doi:
10.3109/14653249.2012.655420. Epub 2012 Feb 2).
[0028] Ainsi, on entend par naturellement présents , le fait d'obtenir des
mousses de lysats plaquettaires comprenant les facteurs de croissance présents
dans les lysats plaquettaires.
[0029] Naturellement présents s'oppose à additionnés . En effet, les
facteurs de croissance présents dans la mousse de lysat plaquettaire selon la
présente invention sont présents dans la composition du précurseur c'est à
dire
dans le lysat plaquettaire utilisé pour l'obtention de la mousse de lysat
plaquettaire.
[0030] En effet, le procédé selon l'invention permet avantageusement de
conserver les éléments présents dans le lysat plaquettaire, précurseur de la
mousse
de lysat plaquettaire selon l'invention.
[0031] On opposera le terme naturellement présents aux termes
additionnés , ajoutés ou tout autre synonyme, ou encore au terme
facteur
bioactif ajouté , tel qu'utilisé dans l'état de la technique, par exemple
dans la
demande US20130183279. Un facteur bioactif ajouté ou additionné
désigne,
dans l'état de la technique un facteur bioactif (par exemple un facteur de
croissance
et/ou une cytokine et/ou des ions bioactifs) qui n'est pas présent dans la
composition du précurseur, la formulation de fibrine et/ou la matrice de
fibrine, mais
qui est ajouté en laboratoire à la composition de précurseur et/ou à la
formulation
et/ou matrice de fibrine. Ces facteurs bioactifs sont donc artificiellement
incorporés dans la formulation lors de la formation de la mousse.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
6
[0032] Avantageusement, la présence de facteurs de croissance d'origine
humaine en quantités naturelles dans le précurseur est compatible avec les
mécanismes de cicatrisation et de régénération tissulaires chez l'Homme.
[0033] Il n'est ainsi pas nécessaire d'ajouter des facteurs de croissance,
contrairement au biomatériau de l'état de la technique pour obtenir les
propriétés
biologiques des lysats plaquettaires.
[0034] Le lysat plaquettaire contient entre 110 et 150 pg/mL de 13 FGF
(déviation
standard relative : 8.09%), entre 550 et 600 pg/mL de VEGF (déviation
standard relative : 5.03%), entre 25 et 29 ng/mL de PDGF-AB (déviation
standard relative : 7.77%), entre 70 et 75 ng/mL de TGF-beta
(déviation
standard relative : 4.34%), environ 2 ng/mL de EGF (déviation standard
relative :
6.02%), entre 60 et 80ng/mL d'IGF-1 (d'après la composition du lysat
plaquettaire
LP100 commercialisé par la société MACOPHARMA).
[0035] Par exemple, le lysat plaquettaire, précurseur de la mousse de lysat
plaquettaire selon l'invention comprend environ 2 ng/mL de EGF, 26,5 ng/mL de
PDGF-AB, 72,5 ng/mL d'IGF-1, 575 pg/mL de VEGF, 125 pg/mL de p. FGF, 70
ng/mL de TGF-beta.
[0036] Les concentrations en facteurs de croissance des mousses de lysat
plaquettaire selon la présente invention sont proportionnelles à la quantité
de lysat
introduite pour créer la mousse. Avantageusement, les concentrations des
facteurs
de croissance dans la mousse finale ne sont pas affectées par le procédé
d'élaboration.
[0037] Typiquement, la concentration en TGF-beta dans la mousse selon la
présente invention est comprise entre 1,84.10-3% massique et 1,84.10-
5%massique,
et est préférentiellement d'environ 7.10-7g dans 3,8.10-2g de mousse soit
1,84.10-
4% massique.
[0038] Typiquement, la concentration en EGF dans la mousse selon la présente
invention est comprise entre 3,63 10-5 et 3,63 10-7 % massique et est
préférentiellement d'environ 1,38 10-9 g dans 3,8 10-2 g de mousse soit 3,63
10-6 %
massique.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
7
[0039] Typiquement, la concentration en PDGF-AB dans la mousse selon la
présente invention est comprise entre 4,79 10-4 % massique et 4,79 10-6 %
massique et est préférentiellement d'environ 1,82 10-5 g dans 3,8 10-2 g de
mousse
soit 4,79 10-5 % massique.
[0040] Typiquement, la concentration en IGF-1dans la mousse selon la présente
invention est comprise entre 1,31 10-3 % massique et 1,31 10-5 % massique et
est
préférentiellement d'environ 4,99 10-5 g dans 3,8 10-2 g de mousse soit 1,31
10-4 %
massique.
[0041] Typiquement, la concentration en VEGF dans la mousse selon la présente
invention est comprise entre 1,04 10-5 % massique et 1,04 10-7 % massique et
est
préférentiellement d'environ 3,95 10-10 g dans 3,8 10-2 g de mousse soit 1,04
10-6 %
massique.
[0042] Typiquement, la concentration en bFGF dans la mousse selon la présente
invention est comprise entre 2,26 10-6 % massique et 2,26 10-5 % massique et
est
préférentiellement d'environ 8,6 10-11 g dans 3,8 10-2 g de mousse soit 2,26
10-7 %
massique.
[0043] Selon un mode de réalisation, la mousse de lysat plaquettaire selon la
présente invention comprend en outre de l'acide tranexamique et/ou du calcium.
[0044] Selon un mode de réalisation, la mousse de lysat plaquettaire selon la
présente invention comprend en outre de l'acide tranexamique et/ou du calcium,
et/ou du chlorure, et/ou du sodium.
[0045] Avantageusement, la mousse de lysat plaquettaire selon la présente
invention n'affecte pas l'activité des facteurs de croissance et conserve les
propriétés de ces facteurs de croissance ainsi que des éléments introduits
pour
former l'hydrogel de lysat et notamment les éléments préférentiellement
introduits
que sont le sodium, le chlorure, l'acide tranexamique et le calcium. Ainsi, à
l'exception des solvants, tous les éléments introduits dans la formule de
l'hydrogel
qui après séchage formeront la mousse sont conservés dans le matériau sec
final.
Ces éléments sont ensuite susceptibles d'être libérés dans le milieu
environnant et
capables d'apporter une activité supplémentaire. L'acide tranexamique étant un
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
8
anti-fibrinolytique il pourra entre autre permettre de stabiliser le caillot
sanguin
autour du matériau greffé. Le calcium possède un rôle non négligeable dans les
phénomènes de coagulation (en participant notamment à l'activation des
facteurs X
et II) jusqu'à l'étape de transformation du fibrinogène en monomères de
fibrine prêts
à polymériser.
[0046] Le diamètre des pores majoritairement présents de la mousse de lysat
plaquettaire selon l'invention est compris entre 0,1 et 100 m.
[0047] Cette taille de pore est discriminante de la méthode d'obtention de la
mousse de lysat plaquettaire. Le procédé de séchage en atmosphère CO2
supercritique permet d'obtenir une mousse ayant un diamètre des pores
majoritairement présents compris entre 0,1 et 100 m.
[0048] Par exemple, le diamètre des pores majoritairement présents est compris
entre 1 m et 10 m, préférentiellement entre 2 et 7 m, et préférentiellement
entre
3,2 et 4 m. Typiquement le diamètre des pores majoritairement présents est
d'environ 3,5 m.
[0049] Le diamètre des pores majoritaires présents peut être mesuré par toute
technique connue de l'homme du métier. Typiquement, on citera la porosimétrie
mercure ou porométrie au mercure qui est un instrument d'investigation des
milieux
poreux, connu de l'homme du métier.
[0050] Cette méthode consiste à utiliser la pression pour faire pénétrer le
mercure
(liquide non mouillant) à l'intérieur du réseau poreux du matériau et d'en
mesurer le
taux d'intrusion en relation avec la pression appliquée. Cette méthode permet
de
déterminer le pourcentage de porosité mesuré entre 3nm et 360 m ainsi que la
dimension des pores qui constituent le réseau (brochure AutoPoreTM IV
Series,
Automated Mercury Porosimeters, de la société Micromeritics ).
[0051] On entend par diamètre des pores majoritairement présents, le diamètre
des pores pour lesquels le porosi mètre à mercure enregistre les taux
d'intrusion de
mercure les plus importants. Le diamètre des pores majoritairement présents
est
donc mesuré à partir du volume de mercure introduit.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
9
[0052] L'homme du métier pourra, par exemple, utiliser l'appareil AutoPore IV,
de
la société Micromeritics (voir par exemple le manuel d'utilisation Autopore
IV
Operator's manual, Micromeritics 2004) pour mesurer le diamètre des pores
majoritairement présents.
[0053] Avantageusement, ce diamètre de pores majoritairement présents permet
une colonisation du matériau par les cellules ainsi qu'une diffusion des
fluides, des
ions et des molécules environnantes jusqu'au coeur du biomatériau.
[0054] La mousse selon l'invention possède toutefois des pores dont les
diamètres
varient de 7nm (permettant de laisser diffuser les fluides) à 100 m
(permettant le
passage des cellules et des vaisseaux sanguins). Le diamètre des pores ainsi
que
des pores majoritairement présents sont représentés à la Figure 4.
[0055] Selon un mode de réalisation, la mousse de lysat plaquettaire selon
l'invention possède une porosité moyenne comprise entre 70% et 95%,
préférentiellement entre 75% et 90%, de manière encore plus préférée entre 75%
et 82%, préférentiellement encore entre 79% et 89%, et de manière encore plus
préférée, entre 77 et 89%.
[0056] Préférentiellement, la mousse possède une porosité moyenne d'environ
80%.
[0057] On entend par porosité moyenne, ou taux de porosité, le volume du
réseau
poreux moyen du matériau correspondant au volume non-occupé par la matière qui
constitue le matériau. Elle indique les espaces dans lesquels les fluides, les
molécules et plus tardivement les cellules pourront s'insinuer entre les
fibres du
réseau. Un taux de porosité trop faible limitera les phénomènes de diffusion
et la
colonisation par les cellules de la mousse et/du gel correspondant à la mousse
hydratée.
[0058] La porosité de la mousse peut être mesurée par toute technique connue
de
l'homme du métier. On citera également à titre illustratif, la porosimétrie au
mercure.
[0059] L'homme du métier pourra, par exemple, utiliser l'appareil AutoPore IV,
de
la société Micromeritics O (voir par exemple le manuel d'utilisation Autopore
IV
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
Operator's manual, Micromeritics 2004) pour mesurer la porosité moyenne de la
mousse.
[0060] La mousse de lysat plaquettaire selon la présente invention conserve
avantageusement l'agencement tridimensionnel de son réseau de fibrine et
permet
5 de libérer des facteurs de croissance dans le milieu au cours du temps.
Les facteurs
de croissance sont en effet enchâssés dans le réseau de fibrine (i.e ; au sein
de la
matrice de fibrine). Ce réseau va permettre de libérer de manière prolongée
les
facteurs de croissance.
[0061] Avantageusement encore, la mousse de lysat plaquettaire selon la
présente
10 invention est une mousse solide du fait de la polymérisation.
[0062] Ces mousses solides de lysat plaquettaire présentent une nette
augmentation de leur résistance à la compression par rapport aux hydrogels de
lysat plaquettaire.
[0063] Les mousses de lysat plaquettaire selon l'invention ont donc des
propriétés
mécaniques supérieures et peuvent facilement se manipuler à la pince ou à la
main
sans se déliter.
[0064] Procédé d'obtention de la mousse de Ivsat plaquettaire
[0065] La présente invention concerne également un procédé d'obtention d'une
mousse de lysat plaquettaire comprenant les étapes:
- d'obtention d'un hydrogel par polymérisation d'un lysat plaquettaire ;
- substitution par lavage du solvant aqueux;
- puis séchage par un procédé de séchage en atmosphère CO2 supercritique.
[0066] Obtention d'un hydrogel par polymérisation d'un lysat plaquettaire
[0067] L'hydrogel de lysat plaquettaire est obtenu par polymérisation d'un
lysat
plaquettaire ou par polymérisation de fibrinogène, le lysat plaquettaire ou le
fibrinogène étant combiné avec au moins un élément choisi parmi un initiateur
de la
polymérisation, un facteur favorisant la polymérisation, un stabilisateur de
la
coagulation, un agent permettant le maintien de l'isotonie et le gonflement du
gel,
un agent favorisant la dégradation du réseau, un agent favorisant les liaisons
dans
le réseau.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
11
[0068] On citera parmi les initiateurs de la polymérisation, le chlorure de
calcium
(CaCl2), la thrombine, la genepine.
[0069] Avantageusement, le chlorure de calcium aura également un pouvoir
gélifiant.
[0070] On citera parmi les facteurs favorisant la polymérisation le facteur
XIII, le 1-
éthy1-3-(3-dimethylaminopropyl) carbodiimide;
[0071] Avantageusement, le 1-
éthy1-3-(3-dimethylaminopropyl)
carbodiimide favorise également la création de liaisons à l'intérieur du
réseau.
[0072] On citera parmi les stabilisateurs de la coagulation, l'acide
tranexamique,
qui est un stabilisateur de la coagulation par action anti-fibrinolytique,
l'acide amino-
caproique, qui est un stabilisateur par action anti-dégradation du réseau de
fibres,
la fibronectine, qui est un stabilisateur de la coagulation par adhésion des
cellules
à la matrice extracellulaire.
[0073] On citera parmi les agents permettant le maintien de l'isotonie et le
gonflement du gel le chlorure de sodium (NaCI).
[0074] On citera parmi les agents favorisant la dégradation du réseau le
plasminogène. Cette dégradation du réseau s'effectue une fois le biomatériau
implanté.
[0075] On citera parmi les agents favorisant les liaisons dans le réseau le N-
hydroxysuccinimide.
[0076] D'autres facteurs tels que les facteurs permettant de donner de
l'élasticité
au réseau de fibres, des facteurs ayant des propriétés stimulatrices des
cellules de
l'hôte et/ou antibactériennes et/ou anti-inflammatoires, des facteurs
permettant de
stimuler les cellules de l'hôte, des facteurs permettant d'entraîner une
précipitation
de cristaux et de créer des structures proches de celle des tissus naturels
minéralisés, des facteurs de croissances ou cytokines supplémentaires, des
facteurs de la coagulation, des facteurs stabilisateurs du caillot pourront
être
combinés avec le lysat plaquettaire pour l'obtention d'une mousse de lysat
plaquettaire.
Parmi les facteurs permettant de donner de l'élasticité au réseau de fibres et
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
12
d'accentuer encore son biomimétisme, on citera le collagène et l'élastine ;
Parmi les facteurs permettant de donner de l'élasticité au réseau de fibres on
citera
l'acide hyaluronique ;
Ces facteurs permettront de rendre le biomatériau final plus élastique.
Parmi les facteurs ayant des propriétés stimulatrices des cellules de l'hôte
et/ou
antibactériennes et/ou anti-inflammatoires), on citera les ions bioactifs.
Les ions bioactifs correspondent à des cations connus pour leur activité
biologique
tels que Sr2+, Mg2+, Cu2+, Zn2+, Ag+.
Parmi les facteurs permettant de stimuler les cellules de l'hôte on citera la
BMP-2
recombinante.
Les facteurs tels que la BMP-2 recombinante, permettront de conférer au
biomatériau une fonction de stimulation de la régénération osseuse.
Parmi les facteurs permettant d'entraîner une précipitation de cristaux et de
créer
des structures proches de celle des tissus naturels minéralisés, on citera le
phosphate de calcium.
Typiquement, ces facteurs permettent de précipiter des cristaux de phosphate
de
calcium analogues aux cristaux qui constituent la phase minérale de l'os
naturel.
[0077] Les facteurs de croissances ou cytokines supplémentaires sont choisis
parmi des membres de la superfamille du TGF8 (transforming growth factor 13),
les
isoformes du facteur de croissance d'origine plaquettaire (le platelet-derived
growth
factor ou PDGF), les facteurs de croissance de la famille de l'EGF (epithelial
growth
factor), le VEGF (vascular endothelial growth factor).
Parmi les membres de la superfamille du TGF8, on citera les membres de la sous
famille des activines tels que l'inhibine A et l'inhibine B, les membres de la
sous-
famille du gène de la Drosophile Decapentaplegic (dpp) qui comprend les gènes
codant pour les facteurs de la morphogenèse osseuse, le facteur BMP4, les
facteurs
ostéogénétiques BMP3, BMP5, BMP6, BMP7, BMP8 de la sous-famille 60A. Tous
ces facteurs ont une activité inductrice, sur la formation du cartilage et de
l'os.
Parmi les membres de la famille de l'EGF, on citera l'amphiréguline (AR), le
TGF-a
(transforming growth factor a), l'épigène (EPG), la betacelluline (BTC), l'HB-
RGF
(heparin-binding EGF), l'épiréguline (EPR), les neurégulines (NRG).
Parmi les isoformes du PDGF, on citera le PDGF-AA et le PDGF-BB.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
13
Parmi les membres de la famille des peptides VEGF, on citera le PIC F, le VEGF-
C
et le VEGF-B.
Parmi les facteurs de la coagulation, on citera la thrombine.
Parmi les facteurs stabilisateurs du caillot, on citera l'alpha-1 antitrypsine
(inhibiteur
de la sérine protéase), l'aprotinine (anti-fibrinolytique) ou encore l'acide
amino-
caproïque (inhibiteur de la plasmine).
[0078] Selon un mode de réalisation, l'hydrogel de lysat plaquettaire est
obtenu
par polymérisation d'un lysat plaquettaire, le lysat plaquettaire étant
combiné avec
au moins un élément choisi parmi le chlorure de calcium (CaCl2), le chlorure
de
sodium (NaCI), la thrombine, l'acide amino-caproïque, le facteur XIII, la
fibronectine,
le plasminogène, le 1-éthy1-3-(3-dimethylaminopropyl) carbodiimide, le N-
hydroxysuccinimide, la genepine, l'acide tranexamique (ou acide 4-
(méthylamino)cyclohexanecarboxylique).
[0079] Dans un mode de réalisation, l'hydrogel de lysat plaquettaire est
obtenu à
partir de fibrinogène combiné avec au moins l'un des éléments choisi parmi le
chlorure de calcium (CaCl2), le chlorure de sodium (NaCI), la thrombine,
l'acide
amino-caproïque, le facteur XIII, la fibronectine, le plasminogène, le 1-éthy1-
3-(3-
dimethylaminopropyl) carbodiimide, le N-hydroxysuccinimide, la genepine,
l'acide
tranexamique,
[0080] Selon un mode de réalisation, l'hydrogel est obtenu par polymérisation
d'un
lysat plaquettaire, ledit lysat plaquettaire étant combiné avec du chlorure de
calcium,
du chlorure de sodium, et de l'acide tranexamique.
[0081] Selon un mode de réalisation, le lysat plaquettaire représente entre 60
et
80% en volume, le chlorure de calcium représente entre 2 et 3% en volume, le
chlorure de sodium représente entre 20 et 30% en volume et l'acide
tranexamique
représente entre 0,1 et 0,5% en volume.
[0082] Avantageusement, l'hydrogel ainsi obtenu permet d'obtenir un réseau
tridimensionnel de fibrine qui possède un maillage serré dans lequel il a été
montré
que des cellules stromales mésenchymateuses humaines pouvaient proliférer et
se
différencier.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
14
[0083] Selon un mode de réalisation, le temps de polymérisation de l'hydrogel
est
compris entre 10 minutes et 12 heures, préférentiellement 15 minutes et 1
heure, et
de manière encore préféré, le temps de polymérisation est d'environ 30
minutes, la
polymérisation étant réalisée à température ambiante .
[0084] Avantageusement, ce temps de polymérisation permet d'obtenir un
hydrogel de qualité et la formation du réseau fibreux.
[0085] Les hydrogels de lysat plaquettaires ainsi obtenus sont utilisés pour
obtenir
des mousses de lysat plaquettaire capables de fournir les mêmes propriétés
biologiques que les lysats plaquettaires tout en démontrant des qualités
supérieures
en vue d'une commercialisation.
[0086] Substitution par lavage du solvant aqueux par un solvant polaire
[0087] La présente invention concerne également un procédé d'obtention d'une
mousse de lysat plaquettaire comprenant les étapes:
- d'obtention d'un hydrogel par polymérisation d'un lysat plaquettaire ;
- substitution par lavage du solvant aqueux par un solvant polaire
- puis séchage par un procédé de séchage en atmosphère CO2 supercritique.
[0088] Selon un mode de réalisation, le solvant polaire est un solvant polaire
miscible au CO2, choisi parmi l'éthanol, l'acétone, le benzène, le butane, le
dioxane,
l'éthane, l'ethylacétoacétate, l'isopropanol.
[0089] Préférentiellement, le solvant polaire est l'acétone ou l'éthanol.
[0090] Typiquement, l'hydrogel va être trempé dans un bain de solvant polaire
afin
de retirer l'eau contenue dans l'hydrogel de lysat plaquettaire.
[0091] A titre illustratif, l'hydrogel est trempé dans le bain de solvant
polaire
pendant une durée comprise entre 24h et 96h, préférentiellement 36h et 72h.
Selon
un mode de réalisation, l'hydrogel est trempé dans le bain de solvant
organique
pendant une durée d'environ 48 heures.
[0092] Après l'étape de trempage, l'hydrogel est séparé de son support avant
d'être placé dans le réacteur fermé du sécheur pour le séchage par CO2
supercritique.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
[0093] Procédé de séchage en atmosphère CO2 supercritique
[0094] Selon un mode de réalisation, l'étape de séchage par CO2 supercritique
comprend une étape de rinçage préalable, cette étape comprenant
avantageusement entre 1 et 5 rinçages en CO2 liquide ou avec le CO2 à l'état
5 supercritique.
[0095] L'étape de rinçage en CO2 permet l'élimination du solvant polaire piégé
dans l'hydrogel et sa substitution par du CO2 liquide, ou à l'état
supercritique. Les
rinçages en CO2 permettent de supprimer tous résidus de solvant et empêchent
la
rétractation du réseau fibreux tridimensionnel obtenu. L'architecture de
l'hydrogel
10 est ainsi maintenue.
[0096] Typiquement, l'étape de rinçage en CO2 à l'état supercritique est
réalisée
par circulation dans le réacteur de CO2 à l'état supercritique.
[0097] Typiquement, 3 étapes de rinçages en CO2 liquide ou à l'état
supercritique
pourront être réalisées.
15 [0098] A titre illustratif, les étapes de rinçage en CO2 liquide sont
réalisées à une
température de 5 Celsius et une pression de 40 à 50 bars, la durée de chaque
rinçage étant d'environ 1 heure.
[0099] Selon un mode de réalisation, l'atmosphère supercritique est atteinte
par
une montée en température au-delà de 39 C et en pression au-delà de 90bar5,
puis
maintenue entre 10min et 12h, préférentiellement entre 30 min et 10h, de
manière
préférée entre 1 h et 8h, préférentiellement entre 2h et 6h,
préférentiellement encore
entre 3h et 5h, préférentiellement pendant 4heures.
[0100] Le maintien de l'atmosphère supercritique pendant une durée d'environ 4
heures permet la pénétration du CO2 au coeur du réseau.
[0101] Avantageusement, le maintien de l'atmosphère supercritique permet le
maintien de la structure en trois dimensions et le séchage jusqu'au coeur du
réseau.
[0102] Typiquement, le maintien de l'atmosphère supercritique est réalisé à
une
température d'environ 40 Celsius et une pression de 90 bars environ.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
16
[0103] Selon un mode de réalisation le gradient de dépression est compris
entre
lbar/s et 20bar5/min, et est préférentiellement de lbar/s.
[0104] Avantageusement, le dégazage rapide de 1 bans permet d'obtenir la
structure poreuse de la mousse de lysat plaquettaire. Ainsi, la mousse va être
figée.
Un dégazage trop rapide, i.e., supérieur à lbads entraine l'éclatement de la
mousse.
Un dégazage trop lent, supérieur à 20bar5/min entraine une perte de volume de
la
mousse qui va se rétracter et se tasser.
[0105] L'étape de séchage au CO2 supercritique permet avantageusement un
maintien de la structure tridimensionnelle de l'hydrogel au cours de
l'opération de
séchage et permet d'obtenir une mousse de lysat plaquettaire possédant des
propriétés mécaniques supérieures à celles de l'hydrogel initial. Le matériau,
grâce
à ce procédé est avantageusement stérile sans recours à une salle blanche,
contrairement au procédé de lyophilisation utilisé dans l'état de la
technique.
[0106] Selon un mode de réalisation, la présente invention concerne également
une mousse de lysat plaquettaire susceptible d'être obtenue par le procédé de
l'invention.
[0107] La mousse de lysat plaquettaire obtenue conserve avantageusement son
agencement fibreux tridimensionnel et également ses facteurs de croissance
permettant d'obtenir des propriétés biologiques identiques à celles des lysats
plaquettaires et ses éléments majeurs tels que l'acide tranexamique, le
sodium, le
chlore, et le calcium.
[0108] Utilisation à des fins thérapeutiques et de culture cellulaire
[0109] La présence naturelle de facteurs de croissance tels que le TGF-13,
l'EGF,
le PDGF-AB, l'IGF-1, le VEGF et le bFGF et leur libération prolongée du fait
de
l'agencement tridimensionnel fibreux de la mousse de lysat plaquettaire selon
l'invention et son délitement progressif constitue un argument important pour
l'utilisation thérapeutique et à des fins de culture et thérapie cellulaire,
des mousses
de lysat plaquettaire selon l'invention.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
17
[0110] En effet, les mousses de lysat plaquettaire selon l'invention sont un
support
qui permet une libération ciblée et prolongée des facteurs de croissance in
situ et
ainsi favorise la réparation ou la régénération de tissus endommagés.
[0111] De plus, les facteurs de croissance étant nécessaires à la croissance,
la
prolifération et la différenciation cellulaire, ils présentent un intérêt
thérapeutique
important et permettent l'utilisation du matériau à des fins de thérapie
cellulaire.
[0112] Le VEGF (Vascular Endothelium Growth Factor) est une protéine qui est
principalement responsable de l'initiation de la formation de nouveaux
vaisseaux
sanguins. Il stimule également la perméabilité des micro-vaisseaux et semble
être
impliqué dans la migration des monocytes / macrophages (Ehrbar M, et al.,
Endothelial cell proliferation and progenitor maturation by fibrin-bound VEGF
variants with differential susceptibilities to local cellular activity. J
Control Release
Off J Control Release Soc 2005;101(1-3):93-109). Il est ainsi impliqué dans la
néoangionenèse, la prolifération et la migration des cellules endothéliales
[0113] Le PDGF (facteur de croissance dérivé des plaquettes), en interaction
avec
le récepteur de la tyrosine kinase, est également impliqué dans la croissance
et la
multiplication cellulaire durant l'angiogenèse, la formation cutanée ou même
le
développement rénal (Andrae J, et al. Role of platelet-derived growth factors
in
physiology and medicine. Genes Dey 2008;22(10):1276-1312).
[0114] L'EGF (Epidermal Growth Factor) favorise la prolifération cellulaire,
la
migration et la différenciation au cours de la formation du système
épithélial,
cardiovasculaire et nerveux (Zeng F, Harris RC. Epidermal growth factor, from
gene
organization to bedside. Semin Cell Dey Biol 2014;28:2-11).
[0115] Le TGF-13 (Transforming Growth Factor) est classé comme une cytokine et
est principalement impliqué dans la croissance des tissus lors de la liaison à
son
récepteur lié à la voie Smad (hi Y, Massagué J. Mechanisms of TGF-13 Signaling
from Cell Membrane to the Nucleus. Cell 2003;113(6):685-700).
[0116] L'IGF1 (insulin-like growth factor) permet notamment la croissance par
la
stimulation de la formation du cartilage (Wang J, Zhou J, Bondy CA. Igf1
promotes
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
18
longitudinal bone growth by insulin-like actions augmenting chondrocyte
hypertrophy. FASEB J 1999; 13:1985-90; PMID:10544181).
[0117] Le bFGF (basic fibroblast growth factor ou FGF2) est impliqué dans de
très
nombreux processus de prolifération cellulaire, cicatrisation, régénération et
même
dès l'embryogenèse (Dvorak et al. Expression and Potential Role of Fibroblast
Growth Factor 2 and Its Receptors in Human Embryonic Stem Cells, Stem Cells
2005;23:1200-1211)
[0118] Utilisation pour la culture cellulaire
[0119] Dans un mode de réalisation, la présente invention concerne
l'utilisation de
mousse de lysat plaquettaire selon l'invention pour la culture cellulaire.
[0120] En effet, le lysat plaquettaire a été proposé comme une alternative à
l'utilisation du sérum de veau foetal (SVF), le plus utilisé des adjuvants
pour milieux
de culture cellulaire (Shanbhag S et al., Efficacy of Humanized Mesenchymal
Stem
Cell Cultures for Bone Tissue Engineering: A Systematic Review with a Focus on
Platelet Derivatives. Tissue Eng Part B Rev 2017;23(6):552-569.), en raison de
la
présence potentielle d'agents pathogènes xénogènes (le risque de contamination
par les prions ou les virus n'est pas nul) dans le SVF. En effet, les lysats
plaquettaires humains regroupés (hLP) ne présentent pas de risque de rejet
immunitaire ou de transmission de pathogènes xénogènes. La culture de cellules
souches en milieux enrichis de lysat plaquettaire permet d'une part de valider
l'utilisation thérapeutique chez l'Homme de ces cellules et d'autre part il a
été montré
que d'une manière générale les cellules stromales mésenchymateuses
présentaient de meilleurs taux de prolifération et une plus importante
activité
métabolique en présence de lysat plaquettaire (Ma J, et al. Osteogenic
capacity of
human BM-MSCs, AT-MSCs and their co-cultures using HUVECs in FBS and PL
supplemented media. J Tissue Eng Regen Med 2015;9(7):779-788).
[0121] Utilisation à des fins de thérapie cellulaire
[0122] La réalisation d'une mousse qui possède les mêmes propriétés
biologiques
que les lysats plaquettaires et qui est constituée d'un réseau tridimensionnel
poreux
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
19
qui favorise l'envahissement, la prolifération et la différenciation
cellulaire constitue
un intérêt important pour son utilisation dans le domaine de la thérapie
cellulaire.
[0123] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire pour son utilisation dans une méthode de thérapie cellulaire.
[0124] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention dans une méthode de thérapie
cellulaire.
[0125] La présente invention concerne également une méthode de thérapie
cellulaire comprenant l'administration, à un patient en ayant besoin, d'une
mousse
de lysat plaquettaire selon la présente invention.
[0126] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné à une méthode de thérapie cellulaire.
[0127] Utilisation à des fins thérapeutiques
[0128] Utilisation pour favoriser la cicatrisation cutanée, la régénération du
derme
et la régénération tissulaire
[0129] Pour traiter les ulcères cutanés chroniques et favoriser la
cicatrisation
cutanée, des particules d'alginate de calcium (Mon i M, et al. Calcium
alginate
particles for the combined delivery of platelet lysate and vancomycin
hydrochloride
in chronic skin ulcers. Int J Pharm 2014;461(1-2):505-513), des gels de
collagène
(Lima AC, Mano JF, Concheiro A, Alvarez-Lorenzo C. Fast and mild strategy,
using
superhydrophobic surfaces, to produce collagen/platelet lysate gel beads for
skin
regeneration. Stem Cell Rev 2015;11(1):161-179.), des pansements spongieux à
base de glutamate de chitosan et d'hyaluronate de sodium (Rossi S, Faccendini
A,
Bonferoni MC, Ferrari F, Sandri G, Del Fante C, et al. "Sponge-like" dressings
based
on biopolymers for the delivery of platelet lysate to skin chronic wounds. Int
J Pharm
2013;440(2):207-215), des microparticules poreuses de silice (Fontana F, Mon i
M,
Riva F, Mâkilà E, Liu D, Salonen J, et al. Platelet Lysate-Modified Porous
Silicon
Microparticles for Enhanced Cell Proliferation in Wound Healing Applications.
ACS
Appl Mater Interfaces 2016;8(1):988-996) et des micelles ioniques de chitosan
et
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
d'acide oléique chargées en sulfadiazine argentique (Dellera E, Bonferoni MC,
Sandri G, Rossi S, Ferrari F, Del Fante C, et al. Development of chitosan
oleate
ionic micelles loaded with silver sulfadiazine ta be associated with platelet
lysate for
application in wound healing. Eur J Pharm Biopharm Off J Arbeitsgemeinschaft
5 Pharm Verfahrenstechnik EV 2014;88(3):643-650) ont été proposés. Ces
matériaux ont été conçus afin de permettre l'absorption de lysat plaquettaire
et la
libération progressive de facteurs de croissance à la surface de la peau et
ainsi que
la prolifération des fibroblastes dans le réseau créé par le lysat
plaquettaire.
[0130] Pour la réparation du derme cutané, des solutions de lysat plaquettaire
ont
10 été testées en application directe sur des plaies de rat, concluant que de
tels
traitements étaient favorables à la cicatrisation, avec un effet qui croit en
rapport
avec la concentration des solutions en lysat plaquettaire (Sergeeva NS,
Shanskii
YD, Sviridova IK, Karalkin PA, Kirsanova VA, Akhmedova SA, et al. Analysis of
Reparative Activity of Platelet Lysate: Effect on Cell Monolayer Recovery In
Vitro
15 and Skin Wound Healing In Vivo. Bull Exp Biol Med 2016;162(1):138-145).
[0131] D'autres matériaux préalablement imprégnés de lysat plaquettaire ont
été
proposés afin d'augmenter le temps de persistance du lysat plaquettaire au
niveau
de la plaie et augmenter ainsi l'efficacité du traitement. Ainsi, une matrice
collagène/gélatine a été testée chez la souris Mo R, Morimoto N, Pham LH,
Taira
20 T, Kawai K, Suzuki S. Efficacy of the controlled release of concentrated
platelet
lysate from a collagen/gelatin scaffold for dermis-like tissue regeneration.
Tissue
Eng Part A 2013;19(11-12):1398-1405) et des particules de pectine/chitosan
(Tenci M, Rossi S, Bonferoni MC, Sandri G, Boselli C, Di Lorenzo A, et al.
Particulate
systems based on pectin/chitosan association for the delivery of manuka honey
components and platelet lysate in chronic skin ulcers. Int J Pharm 2016;509(1-
2):59-70) ont été appliquées sur des plaies de rats.
[0132] Dans le domaine de la chirurgie plastique, les implants en polyéthylène
poreux synthétiques (PP) sont largement utilisés pour la reconstruction en
trois
dimensions des tissus perdus ou fortement déformés. Le lysat plaquettaire est
alors
utilisé associé aux implants PP tridimensionnels en vue de réduire les
complications
post-opératoires (Ozturk S, Sahin C, Tas AC, Muftuoglu T, Karagoz H. Effect of
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
21
Allogeneic Platelet Lysate and Cyanoacrylate Tissue Glue on the
Fibrovascularization of the Porous Polyethylene Implant. J Craniofac Surg
201 6 ;27(1):253-257).
[0133] La présente invention concerne donc une mousse de lysat plaquettaire
selon la présente invention pour son utilisation dans une méthode pour
favoriser la
cicatrisation cutanée, la régénération du derme et la régénération tissulaire.
[0134] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour favoriser la cicatrisation
cutanée,
la régénération du derme et la régénération tissulaire.
[0135] La présente invention concerne également une méthode de traitement pour
favoriser la cicatrisation cutanée, la régénération du derme et la
régénération
tissulaire, comprenant l'administration, à un patient en ayant besoin, d'une
mousse
de lysat plaquettaire selon la présente invention.
[0136] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné à favoriser la cicatrisation cutanée, la régénération du derme et la
régénération tissulaire.
[0137] Le terme favoriser n'est pas un terme absolu, et, lorsqu'il est
appliqué à
la cicatrisation cutanée, la régénération du derme et à la régénération
tissulaire, il
désigne une procédure ou un plan d'action conçu, même avec une probabilité
faible
de succès, mais devant induire un effet bénéfique global tel que la diminution
de la
gravité d'un ou plusieurs symptômes ou la stabilisation.
[0138] Typiquement, favoriser la cicatrisation cutanée, la régénération du
derme
et la régénération tissulaire s'entend de l'amélioration de l'hémostase
plaquettaire,
de la formation du caillot, de la stabilisation du caillot et du recrutement
cellules
inflammatoires sous l'influence de la mousse de lysat plaquettaire selon
l'invention,
mais également de l'amélioration du remodelage de la matrice extracellulaire
et du
bon déroulé des mécanismes de cicatrisation.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
22
[0139] Selon un mode de réalisation, la mousse de lysat plaquettaire selon la
présente invention est utilisée pour son utilisation dans le traitement de
l'ulcère
cutané chronique.
[0140] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour le traitement de l'ulcère
cutané
chronique.
[0141] La présente invention concerne également une méthode de traitement de
l'ulcère cutané chronique comprenant l'administration, à un patient en ayant
besoin,
d'une mousse de lysat plaquettaire selon la présente invention.
[0142] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné au traitement de l'ulcère cutané chronique.
[0143] Utilisation pour favoriser l'ostéogenèse et la régénération osseuse
[0144] Des évaluations de la formation osseuse dans des sites sous-cutanés
ectopiques ou directement sur des modèles osseux ont été menées depuis environ
dix ans. La capacité du lysat plaquettaire à favoriser la différenciation des
CSM en
cellules de la lignée ostéoblastique est évidente et leur permet de générer
une
formation osseuse même sur des sites non osseux (Chevallier N, Anagnostou F,
Zilber S, Bodivit G, Maurin S, Barrault A, et al. Osteoblastic differentiation
of human
mesenchymal stem cells with platelet lysate. Biomaterials 2010;31(2):270-278).
L'association de lysat plaquettaire avec des cellules stromales
mésenchymateuses
est prometteuse et nécessite de trouver une matrice approprié. Des matrices
constituées de collagène et de fibrine ont ainsi été testées avec succès sur
un
modèle de prothèse de hanche chez le mouton (Dozza B, Di Bella C, Lucarelli E,
Giavaresi G, Fini M, Tazzari PL, et al. Mesenchymal stem cells and platelet
lysate
in fibrin or collagen scaffold promote non-cemented hip prosthesis
integration. J
Orthop Res Off Publ Orthop Res Soc 2011;29(6):961-968). Chakar et al. ont
étudié
le potentiel ostéogénique du lysat plaquettaire seul, respectivement avec des
fémurs et des calvaria chez le lapin, et ont montré que le lysat plaquettaire
autologue
permettait d'obtenir une régénération osseuse (Chakar C, Naaman N, Soffer E,
Cohen N, El Osta N, Petite H, et al. Bone formation with deproteinized bovine
bone
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
23
minerai or biphasic calcium phosphate in the presence of autologous platelet
lysate:
comparative investigation in rabbit. Int J Biomater 2014;2014:367265; Chakar
C,
Soffer E, Cohen N, Petite H, Naaman N, Anagnostou F. Vertical bone
regeneration
with deproteinised bovine bone minerai or biphasic calcium phosphate in the
rabbit
calvarium: effect of autologous platelet lysate. J Mater Sci Mater Med
201 5 ;26(1):5339).
[0145] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation dans une méthode
pour
favoriser l'ostéogenèse et la régénération osseuse.
[0146] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour favoriser l'ostéogenèse et
la
régénération osseuse.
[0147] La présente invention concerne également une méthode pour favoriser
l'ostéogenèse et la régénération osseuse comprenant l'administration, à un
patient
en ayant besoin, d'une mousse de lysat plaquettaire selon la présente
invention.
[0148] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné à favoriser l'ostéogenèse et la régénération osseuse.
[0149] Le terme favoriser n'est pas un terme absolu, et, lorsqu'il est
appliqué à
l'ostéogenèse et la régénération osseuse, il désigne une procédure ou un plan
d'action conçu, même avec une probabilité faible de succès, mais devant
induire un
effet bénéfique global tel que la diminution de la gravité d'un ou plusieurs
symptômes ou la stabilisation.
[0150] Typiquement, favoriser l'ostéogenèse et la régénération osseuse
s'entend de la capacité de la mousse de lysat plaquettaire à améliorer la
différenciation des CSM en cellules de la lignée ostéoblastique, par la
libération
constante et progressive de facteurs de croissance et de cytokines et ainsi
générer
une formation osseuse, pour augmenter la quantité d'os et favoriser sa
minéralisation.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
24
[0151] Dans le traitement de l'arthrose, des injections intra-articulaires de
lysats
plaquettaires autologues ont été réalisées chez des chevaux arthrosiques
améliorant ainsi significativement les performances physiques des animaux
(Tyrnenopoulou P, Diakakis N, Karayannopoulou M, Savvas I, Koliakos G.
Evaluation of intra-articular injection of autologous platelet lysate (PL) in
horses with
osteoarthritis of the distal interphalangeal joint. Vet Q 2016;36(2):56-62).
Les
auteurs ont conclu que le lysat plaquettaire autologue injecté par voie intra-
articulaire est une méthode efficace pour gérer temporairement l'arthrose de
l'articulation interphalangienne distale chez les chevaux de sport.
[0152] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation pour le
traitement de
l'arthrose.
[0153] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour le traitement de
l'arthrose.
[0154] La présente invention concerne également une méthode de traitement de
l'arthrose comprenant l'administration, à un patient en ayant besoin, d'une
mousse
de lysat plaquettaire selon la présente invention.
[0155] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné au traitement de l'arthrose.
[0156] Utilisation pour la régénération cartilagineuse
[0157] Dans le cadre de la régénération cartilagineuse, la libération in situ
de lysat
plaquettaire est utilisée pour favoriser la différenciation des cellules
stromales
mésenchymateuses vers un phénotype chondroblastique et favoriser ainsi la
réparation/régénération du cartilage déficient ou endommagé. Un hydrogel de
chitosan et de chondroïtine sulfate capable d'absorber du lysat plaquettaire a
ainsi
été proposé (Santo VE, Popa EG, Mano JF, Gomes ME, Reis RL. Natural assembly
of platelet lysate-loaded nanocarriers into enriched 3D hydrogels for
cartilage
regeneration. Acta Biomater 2015;19:56-65).
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
[0158] Basé sur le même principe, dans la réparation des tendons, les
biomatériaux proposés sont destinés à servir de réservoir de biomolécules
imprégnées au moment de l'utilisation et capables de soutenir/favoriser
l'activité des
cellules présentent in situ ou celle de cellules dérivées de tendons humains
(hTDC)
5 associées au moment de l'implantation.
[0159] Les matériaux sont alors des patches de lysats de plaquettes réticulés
par
la génipine (Costa-Almeida R, Franco AR, Pesqueira T, Oliveira MB, Babo PS,
Leonor IB, et al. The effects of platelet lysate patches on the activity of
tendon-
derived cells. Acta Biomater 2018. doi:10.1016/j.actbio.2018.01.006), des
hydrogels
10 d'alginate de sodium et de sulfate de chondroïtine (Sandri G, Bonferoni MC,
Rossi
S, Ferrari F, Mon i M, Cervio M, et al. Platelet lysate embedded scaffolds for
skin
regeneration. Expert Opin Drug Deliv 2015;12(4):525-545) ou des hydrogels
photoréticulables composés de sulfate de chondroïtine méthacrylé (MA-CS)
enrichis en nanoparticules magnétiques à base de fer (Silva ED, Babo PS, Costa-
15 Almeida R, Domingues RMA, Mendes BB, Paz E, et al. Multifunctional magnetic-
responsive hydrogels to engineer tendon-to-bone interface. Nanomedicine
Nanotechnol Biol Med 2017. doi:10.1016/j.nano.2017.06.002).
[0160] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation dans une méthode
pour
20 favoriser la régénération cartilagineuse.
[0161] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour favoriser la régénération
cartilagineuse.
[0162] La présente invention concerne également une méthode de traitement pour
25 favoriser la régénération cartilagineuse comprenant l'administration, à
un patient en
ayant besoin, d'une mousse de lysat plaquettaire selon la présente invention.
[0163] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné à la régénération cartilagineuse.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
26
[0164] Le terme favoriser n'est pas un terme absolu, et, lorsqu'il est
appliqué à
la régénération cartilagineuse, il désigne une procédure ou un plan d'action
conçu,
même avec une probabilité faible de succès, mais devant induire un effet
bénéfique
global tel que la diminution de la gravité d'un ou plusieurs symptômes ou la
stabilisation.
[0165] Typiquement, favoriser la régénération cartilagineuse s'entend de la
capacité de la mousse de lysat plaquettaire à favoriser la différenciation des
cellules
stromales mésenchymateuses vers un phénotype chondroblastique et favoriser
ainsi la réparation/régénération du cartilage déficient ou endommagé.
[0166] Utilisation pour le traitement des lésions cornéennes telles que les
lésions
chroniques de la cornée
[0167] Dans le traitement des plaies chroniques de la cornée, les dispositifs
doivent permettre d'augmenter le temps de persistance précornéale des facteurs
de croissance contenus dans le lysat plaquettaire réduit en raison d'un
drainage
important par le flux lacrymal déclenché par le larmoiement.
[0168] Des collyres thermosensibles et mucoadhésifs obtenus à base de
chondroïtine sulfate de sodium (CS) et d'hydroxypropylméthylcellulose (HPMC)
(Sandri G, Bonferoni MC, Rossi S, Ferrari F, Mon i M, Del Fante C, et al.
Thermosensitive eyedrops containing platelet lysate for the treatment of
corneal
ulcers. Int J Pharm 2012;426(1-2):1-6), des gels de chitosan ou des supports
en
acide polyacrylique (Sandri G, Bonferoni MC, Rossi S, Ferrari F, Mon i M, Del
Fante
C, et al. Platelet lysate formulations based on mucoadhesive polymers for the
treatment of corneal lesions. J Pharm Pharmacol 2011;63(2):189-198) ou le
traitement de divers types de lentilles de contact par du sulfate de
chondroïtine
destiné à favoriser le maintien du lysat plaquettaire instillé dans l'oeil et
d'améliorer
ainsi le traitement des lésions cornéennes (Sandri G, Bonferoni MC, Rossi S,
Delfino A, Riva F, lcaro Cornaglia A, et al. Platelet lysate and chondroitin
sulfate
loaded contact lenses to heal corneal lesions. Int J Pharm 2016;509(1-2)188-
196).
[0169] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation pour le
traitement des
lésions cornéennes, telles que les lésions chroniques de la cornée.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
27
[0170] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour le traitement des lésions
cornéennes, telles que les lésions chroniques de la cornée.
[0171] La présente invention concerne également une méthode de traitement des
lésions cornéennes, telles que les lésions chroniques de la cornée, comprenant
l'administration, à un patient en ayant besoin, d'une mousse de lysat
plaquettaire
selon la présente invention.
[0172] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné au traitement des lésions cornéennes, telles que les lésions
chroniques de
la cornée.
[0173] Le terme traitement n'est pas un terme absolu, et, lorsqu'il est
appliqué
au traitement des lésions cornéennes, il désigne une procédure ou un plan
d'action
conçu, même avec une probabilité faible de succès, mais devant induire un
effet
bénéfique global tel que le retard d'apparition de la pathologie ou la
diminution de
la gravité d'un ou plusieurs symptômes ou la stabilisation.
[0174] Typiquement, le traitement d'une lésion cornéenne s'entend de la
capacité
de la mousse de lysat plaquettaire à maintenir le lysat plaquettaire instillé
dans l'oeil
et augmenter le temps de persistance précornéale des facteurs de croissance
contenus dans le lysat plaquettaire du fait de la libération prolongée.
[0175] Utilisation dans le traitement des troubles neurodégénératifs tels que
la
maladie de Parkinson
[0176] La maladie de Parkinson, avec sa morbidité élevée, a été étudiée
récemment dans des modèles cellulaires traités par exposition aux lysats
plaquettaires humains regroupés/poolés (hLP). Les résultats confirment que de
telles thérapies pourraient être utilisées pour prévenir la perte neuronale in
vivo car
le lysat plaquettaire présente des propriétés protectrices contre les voies de
mort
cellulaire et certains inducteurs du stress oxydatif (Gouel F, Do Van B, Chou
M-L,
Jonneaux A, Moreau C, Bordet R, et al. The protective effect of human platelet
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
28
lysate in models of neurodegenerative disease: involvement of the Akt and MEK
pathways. J Tissue Eng Regen Med 2017;11(11):3236-3240 ).
[0177] Également, un spray nasal contenant un lysat plaquettaire a été testé
avec
des résultats encourageants chez les souris atteintes de la maladie de
Parkinson
(Chou M-L, Wu J-W, Gouel F, Jonneaux A, Timmerman K, Renn T-Y, et al. Tailor-
made purified human platelet lysate concentrated in neurotrophins for
treatment of
Parkinson's disease. Biomaterials 2017;142:77-89).
[0178] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation pour le
traitement de
troubles neurodégénératifs tels que la maladie de Parkinson.
[0179] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour le traitement de troubles
neurodégénératifs tels que la maladie de Parkinson.
[0180] La présente invention concerne également une méthode de traitement de
troubles neurodégénératifs tels que la maladie de Parkinson, comprenant
l'administration, à un patient en ayant besoin, d'une mousse de lysat
plaquettaire
selon la présente invention.
[0181] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné au traitement de troubles neurodégénératifs tels que la maladie de
Parkinson.
[0182] Le terme traitement n'est pas un terme absolu, et, lorsqu'il est
appliqué
au traitement de troubles neurodégénératifs et plus particulièrement de la
maladie
de Parkinson, il désigne une procédure ou un plan d'action conçu, même avec
une
probabilité faible de succès, mais devant induire un effet bénéfique global
tel que le
retard d'apparition de la pathologie ou la diminution de la gravité d'un ou
plusieurs
symptômes ou la stabilisation.
[0183] Typiquement, le traitement de la maladie de Parkinson s'entend de la
capacité de la mousse de lysat plaquettaire à prévenir et/ou diminuer la perte
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
29
neuronale in vivo pour réduire la progression de la Maladie de Parkinson et
ses
séquelles.
[0184] Utilisation dans le traitement des suites d'un AVC
[0185] La prise en charge des séquelles de maladies graves telles que les
accidents vasculaires cérébraux peut également être envisagée en présence de
lysats plaquettaires humains regroupés/poolés (hLP) ou pools de lysats
plaquettaires. Les modèles d'AVC ischémiques sont courants chez les rats pour
évaluer les déficits neurologiques ou les fonctions motrices après l'occlusion
des
vaisseaux sanguins. Qu'il soit utilisé pour cultiver des cellules stromales
mésenchymateuses avant injection ou directement injecté dans des sites
ischémiques, le lysat plaquettaire montre des résultats favorables sur les
fonctions
neuro-motrices post-attaque (Yamauchi T, Saito H, lto M, Shichinohe H, Houkin
K,
Kuroda S. Platelet lysate and granulocyte-colony stimulating factor serve safe
and
accelerated expansion of human bone marrow stromal cells for stroke therapy.
Transl Stroke Res 2014;5(6):701-710).
[0186] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation pour favoriser
les
fonctions neuro-motrices suite à un accident vasculaire cérébral (AVC).
[0187] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour favoriser les fonctions
neuro-
motrices suite à un accident vasculaire cérébral (AVC).
[0188] La présente invention concerne également une méthode de traitement pour
favoriser les fonctions neuro-motrices suite à un accident vasculaire cérébral
(AVC),
comprenant l'administration, à un patient en ayant besoin, d'une mousse de
lysat
plaquettaire selon la présente invention.
[0189] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné à favoriser les fonctions neuro-motrices suite à un accident
vasculaire
cérébral (AVC).
[0190] Utilisation dans la régénération des tissus parodontaux
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
[0191] Les données récentes concernant la régénération des tissus parodontaux
ont été obtenues par Babo et al. qui ont étudié l'intérêt de la stabilisation
au contact
de la racine dentaire des protéines contenues dans le lysat plaquettaire, et
ont
démontré que cela favorisait la régénération des tissus parodontaux du rat, en
5 particulier l'os alvéolaire et le cément, les deux tissus minéralisés du
parodonte
(Babo PS, Cai X, Plachokova AS, Reis RL, Jansen J, Gomes ME, et al. Evaluation
of a platelet lysate bilayered system for periodontal regeneration in a rat
intrabony
three-wall periodontal defect. J Tissue Eng Regen Med 2017.
doi:10.1002/term.2535 ; Babo PS, Cai X, Plachokova AS, Reis RL, Jansen JA,
10 Gomes ME, et al. The Role of a Platelet Lysate-Based Compartmentalized
System
as a Carrier of Cells and Platelet-Origin Cytokines for Periodontal Tissue
Regeneration. Tissue Eng Part A 201 6 ;22(19-20):1164-1175)
[0192] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation dans une méthode
pour
15 favoriser la régénération des tissus parodontaux.
[0193] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour favoriser la régénération
des
tissus parodontaux.
[0194] La présente invention concerne également une méthode de traitement pour
20 favoriser la régénération des tissus parodontaux, comprenant
l'administration, à un
patient en ayant besoin, d'une mousse de lysat plaquettaire selon la présente
invention.
[0195] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
25 destiné à favoriser la régénération des tissus parodontaux.
[0196] Le terme favoriser n'est pas un terme absolu, et, lorsqu'il est
appliqué à
la régénération des tissus parodontaux, il désigne une procédure ou un plan
d'action
conçu, même avec une probabilité faible de succès, mais devant induire un
effet
bénéfique global tel que la diminution de la gravité d'un ou plusieurs
symptômes ou
30 la stabilisation.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
31
[0197] Typiquement, régénération des tissus parodontaux s'entend de la
capacité de la mousse de lysat plaquettaire à stabiliser au contact de la
racine
dentaire des protéines contenues dans le lysat plaquettaire et ainsi augmenter
la
quantité et la densité des tissus parodontaux et plus particulièrement de
redonner
au parodonte une structure originelle basée sur la présence de cément à la
surface
de la dent, d'os alvéolaire et de ligament desmodontal entre les deux.
[0198] Utilisation pour le traitement de l'alopécie
[0199] Il a été montré que le lysat était capable d'activer des voies anagènes
favorisant la croissance des cheveux (Dastan M, Najafzadeh N, Abedelahi A,
Sarvi
M, Niapour A. Human platelet lysate versus minoxidil stimulates hair growth by
activating anagen promoting signaling pathways. Biomed Pharmacother
Biomedecine Pharmacother 2016;84:979-986).
[0200] Ainsi, la présente invention concerne également une mousse de lysat
plaquettaire selon la présente invention pour son utilisation pour le
traitement de
l'alopécie.
[0201] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour le traitement de
l'alopécie.
[0202] La présente invention concerne également une méthode de traitement de
l'alopécie, comprenant l'administration, à un patient en ayant besoin, d'une
mousse
de lysat plaquettaire selon la présente invention.
[0203] La présente invention concerne également l'utilisation d'une mousse de
lysat plaquettaire selon la présente invention pour la fabrication d'un
médicament
destiné au traitement de l'alopécie.
Brève description des dessins
[0204] D'autres caractéristiques, détails et avantages de l'invention
apparaîtront à
la lecture de la description détaillée ci-après, et à l'analyse des dessins
annexés,
sur lesquels :
Fig. 1
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
32
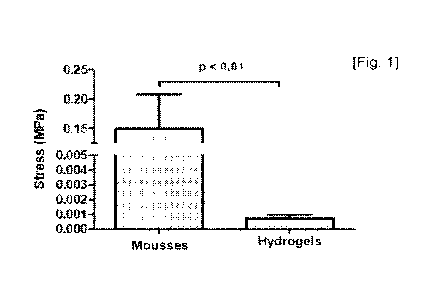
[0205] [Fig. 1] montre la résistance à la compression des mousses de lysat
plaquettaire selon l'invention ( Mousses ), en comparaison avec les
hydrogels
initiaux ( Hydrogels ) (n = 12) ;
Fig. 2
[0206] [Fig. 2] montre la cinétique de dégradation en milieu aqueux de la
mousse
de lysat plaquettaire selon l'invention ;
Fig. 3
[0207] [Fig. 3] montre la libération du facteur de croissance le VEGF (en
pg/ml) au
cours du temps (en jours) en fonction des différentes formes (mousse de lysat
plaquettaire selon l'invention, hydrogel de lysat plaquettaire et liquide
contrôle);
Exemples
[0208] Exemple 1 : obtention d'hydrogel à partir de lysat plaquettaire
[0209] Des hydrogels de lysat plaquettaire ont été obtenus à partir de lysat
plaquettaire combiné avec les différents éléments sous forme liquide selon les
proportions telles que résumées dans le tableau 1 ci-après :
[0210] [Tableau 1]
Constituants Proportion ( /0)
Lysat plaquettaire entre 60 et 80%
CaCl2 entre 2 et 3%
NaCI entre 20 et 30%
Acide
Entre 0,1 et 0,5%
Tranexamique
[0211] Les hydrogels ainsi obtenus possèdent des structures fibreuses et
poreuses
optimales, notamment pour promouvoir la prolifération, la migration et la
différenciation cellulaire.
[0212] Avantageusement, ces hydrogels de lysat plaquettaires sont utilisés
pour
obtenir des mousses de lysat plaquettaire capables de fournir les mêmes
propriétés
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
33
que les lysats plaquettaires tout en démontrant des qualités supérieures en
vue
d'une commercialisation. L'utilisation des mousses de lysat plaquettaire est
facilitée
et peut convenir à toutes les pathologies traitées par ingénierie tissulaire
ou
cellulaire.
[0213] Exemple 2 : Procédé d'obtention d'une mousse de Ivsat plaouettaire
[0214] L'hydrogel de lysat plaquettaire obtenu est ensuite séché dans le
réacteur
d'un sécheur en CO2 supercritique. Ce type de réacteur permet avantageusement
un maintien de la structure tridimensionnelle de l'hydrogel au cours de
l'opération
de séchage.
[0215] En vue de retirer l'eau contenue dans l'hydrogel de lysat plaquettaire,
celui-
ci est trempé 48h dans un bain d'acétone puis séparé de son support avant
d'être
placé dans le réacteur fermé du sécheur. Préférentiellement, l'hydrogel est
mis à
tremper dans un récipient en verre ou un récipient métallique.
[0216] La température de la chambre du réacteur est abaissée à une température
inférieure à 10 C pour permettre l'entrée du CO2 à l'état liquide. Le réacteur
avec le
CO2 liquide est rempli jusqu'à immerger les échantillons puis l'ensemble est
laissé
à tremper pendant 45 minutes afin de permettre au CO2 liquide de pénétrer le
réseau poreux du gel. Un rinçage est ensuite effectué par vidange du CO2
présent
dans la chambre et entrée d'une même nouvelle quantité de liquide. Cette
opération
de trempage/rinçage est reproduite trois fois. A l'issue des cycles, le
réservoir est
de nouveau rempli jusqu'à mi-hauteur, le réacteur fermé puis on élève
progressivement sa température jusqu'à 40 C et la pression jusqu'à 90 bar. Le
réacteur étant clos, lorsque la température augmente, la pression à
l'intérieur du
réacteur augmente. L'état supercritique, qui correspond au 4ème état de la
matière,
est atteint lorsque la température est supérieure à 31 C et la pression
supérieure à
74 bars. Le réacteur est maintenu à cette température et à cette pression
durant 4
heures puis dégazé et dépressurisé rapidement en 90 secondes.
[0217] L'ensemble de l'acétone présent dans l'hydrogel a été substitué par du
CO2
liquide au cours des phases de trempage/rinçage, puis lors de la montée en
température et en pression, toute trace de solvant est éliminée, le réseau de
fibre
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
34
est désormais sec et le gel sec se présente sous forme d'une mousse fibreuse
poreuse.
[0218] Comme démontré dans les exemples suivants, la mousse de lysat
plaquettaire obtenu conserve avantageusement son agencement fibreux
tridimensionnel (exemple 3) et les éléments majeurs tels que le sodium, le
chlore,
le phosphore, le soufre et le calcium (exemple 4).
[0219] La mousse de lysat plaquettaire possède par ailleurs des propriétés
mécaniques supérieures à celles de l'hydrogel initial (exemple 5). La mousse
ainsi
obtenue est un matériau sec capable de se conserver et se réhydrate facilement
(exemple 6), ce qui favorise la pénétration rapide des fluides biologiques et
des
cellules mais également l'activité cellulaire par le relargage de facteurs de
croissance et autres protéines (exemple 7).
[0220] Exemple 3 : caractérisation de la microstructure
[0221] Le réseau de fibres de la mousse de lysat plaquettaire a été observé en
microscopie électronique à balayage environnemental avec métallisation avant
et
après séchage au CO2 supercritique.
[0222] Le procédé permet d'obtenir un réseau fibreux telle une matrice 3D.
Avantageusement, le réseau de fibrine conserve son agencement fibreux
tridimensionnel.
[0223] Le maillage du réseau fibreux est plus large après séchage, ce qui
permet
de contrôler la porosité. Il est ainsi possible en modifiant la porosité
moyenne et le
diamètre moyen des pores majoritairement présents dans le réseau
tridimensionnel
de modifier les phénomènes de diffusion à l'intérieur du matériau poreux.
[0224] Ainsi, il est ainsi possible de modifier la pénétration des fluides et
des
cellules (ainsi que la cinétique de libération des facteurs de croissance).
[0225] Ces deux paramètres modifient la cinétique de libération des facteurs
de
croissance et de tout ce qui aura été intégré dans la mousse. Cela ne modifie
pas
la quantité libérée mais la vitesse à laquelle les facteurs de croissance vont
être
libérés et par la même, la durée d'action de la mousse.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
[0226] D'une manière générale, la vitesse de libération croît lorsque la
porosité
moyenne augmente et lorsque la taille moyenne des pores augmente.
[0227] La porosité de la mousse de lysat plaquettaire a été quantifiée et le
réseau
poreux a été caractérisé.
5 [0228] La méthode utilisée est la porosimétrie mercure (appareil : Autopore
III,
Micromeritics). La méthode consiste à faire pénétrer le mercure dans les pores
de
la mousse de lysat plaquettaire sous pression croissante. Un échantillon de
mousse
de lysat plaquettaire va être pesé dans une cellule de conductance avant et
après
remplissage de mercure. Une analyse du différentiel de pression mercurielle va
être
10 réalisée afin de quantifier la porosité et caractériser le réseau poreux.
[0229] Avantageusement, les mousses de lysat plaquettaire selon l'invention
ont
une porosité moyenne d'environ 80%. Avantageusement, une porosité moyenne
d'environ 80% permet aux fluides, aux molécules, ions et aux cellules de
s'insinuer
entre les fibres du réseau et ainsi favoriser leur pénétration.
15 [0230] Le diamètre des pores majoritairement présents de la mousse de lysat
plaquettaire est de 3,5 m. Avantageusement, ce diamètre des pores
majoritairement présents permet aux fluides, ions, molécules et cellules
environnantes de pénétrer jusqu'au coeur du réseau.
[0231] On observera de manière minoritaire des pores ayant un diamètre moyen
20 compris entre 10 et 11 m, des pores ayant un diamètre moyen compris
entre 6.5 et
8 m, des pores ayant un diamètre moyen compris entre 0.4 et 2 m.
[0232] Exemple 4: caractérisation des propriétés mécaniques
[0233] Des tests de compression TAX T2 ont été réalisés afin de caractériser
les
propriétés mécaniques des mousses de lysat plaquettaire séchées au CO2
25 supercritique. Ces propriétés mécaniques ont été comparées à celles des
hydrogels
initiaux ( hydrogels sur la figure 1).
[0234] Les conditions étaient les suivantes :
- Vitesse de mise en charge : 2mm/min ;
- Analyse du comportement jusqu'à 60% de compression ;
30 -Appareil : TA.XT Plus Texture Analyzer.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
36
[0235] Les réseaux séchés présentent une nette augmentation de leur résistance
à la compression par rapport aux hydrogels initiaux (n=4 ; p<0.01).
[0236] Les mousses de lysat plaquettaire selon l'invention présentent donc des
propriétés mécaniques supérieures à celles de l'hydrogel initial. Ces mousses
peuvent ainsi facilement se manipuler à la pince ou à la main sans se déliter
comme
le fait l'hydrogel.
[0237] Exemple 5 : détermination du taux de réhydratation après séchage
[0238] Le taux de réhydratation après séchage des mousses de lysat
plaquettaire
selon l'invention a été déterminé. La méthode utilisée est la méthode des
pesées.
[0239] Les conditions sont les suivantes :
- Les échantillons ont été trempés dans 1200pL d'eau à 25 C pendant 48h ;
- Le taux de réhydratation est calculé grâce à la formule :
[0240] [Math. 1]
(poids hum.icide s¨poids sec)
taux de réhydratation ___________________________________ x 100
poLs15 [0241] Le taux de réhydratation moyen calculé est de 804.9%.
[0242] La mousse de lysat plaquettaire possède ainsi un taux de réhydratation
important. Avantageusement également, et en l'absence d'eau, la mousse de
lysat
plaquettaire présente une conservation favorable à sa commercialisation. En
effet,
et en l'absence d'eau, le matériau sec ne se dégrade pas au cours du temps.
[0243] Exemple 6 : Cinétique de dégradation et libération prolongée
[0244] La cinétique de dégradation en milieux aqueux et le relargage d'un
facteur
de croissance compris dans la mousse de lysat plaquettaire ont été évalués.
[0245] Cinétique de dégradation en milieu aqueux
[0246] La méthode utilisée est celle des pesées.
[0247] Les conditions sont les suivantes :
- Echantillons trempés dans 20mL d'eau à 25 C ;
- Suivi de la dégradation par pesée du matériau.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
37
[0248] Comme illustré sur la figure 2, la mousse de lysat plaquettaire selon
l'invention est délitée au bout de 5 jours. Les facteurs de croissance sont
donc
libérés de manière prolongée et non pas immédiate comme c'est le cas avec le
liquide de lysat plaquettaire.
[0249] Relargage d'un facteur de croissance, le VEGF
[0250] Le VEGF a été dosé afin d'évaluer son relargage. La méthode utilisée
est
celle du Test ELISA Human VEGF Pre-Coated ELISA Kit, Biogems. La libération du
VEGF par la mousse de lysat plaquettaire selon l'invention a été comparée avec
la
cinétique de libération par l'hydrogel de lysat plaquettaire. Un liquide a été
utilisé en
contrôle, et ce tel qu'illustré à la Figure 3.
[0251] L'hydrogel de lysat plaquettaire a été préparé par le procédé décrit à
l'exemple 1 et la mousse de lysat plaquettaire a été préparée par le procédé
décrit
à l'exemple 2.
[0252] La mesure de l'absorbance a été mesurée à 450 nm.
[0253] Comme illustré à la figure 3, le VEGF est libéré progressivement sur 5
jours
jusqu'à atteindre sa concentration maximale. Le relargage prolongé du VEGF se
poursuit sur 25 jours.
[0254] Ainsi, et avantageusement, la mousse de lysat plaquettaire selon la
présente invention initialement composée à base de lysat plaquettaire riche en
facteurs de croissance, relargue du VEGF au cours du temps. Cela démontre que
les facteurs de croissance sont enchâssés dans le réseau de fibrine et sont
accessibles pour les cellules.
[0255] Cette libération est prolongée et en quantité similaire à celle de
l'hydrogel
de lysat plaquettaire, confirmant l'absence de perte de matériel protéique
durant le
procédé de séchage.
[0256] Avantageusement donc, les mousses de lysat plaquettaire selon
l'invention
peuvent être utilisées dans de nombreuses applications biologiques telles que
la
régénération et la réparation des tissus endommagés.
CA 03176724 2022-09-23
WO 2021/191525 PCT/FR2021/050427
38
[0257] En effet, la présence naturelle de facteurs de croissance et de
cytokines
tels que le VEGF, le PDGF, l'EGF et le TGF13 qui seront libérés lors de
l'implantation
de la mousse de lysat plaquettaire selon l'invention dans le milieu,
contribuant ainsi
à la croissance des tissus et au développement des organes, constitue un
argument
important pour l'utilisation biomédicale des mousses de lysat plaquettaire
selon
l'invention.
[0258] Outre leur avantage de libération prolongée par rapport aux hydrogels
de
lysat plaquettaire, les mousses de lysat plaquettaire selon l'invention sont
de plus,
plus facilement manipulables et possèdent des propriétés de conservation et
mécaniques améliorées.