Note: Descriptions are shown in the official language in which they were submitted.
WO 2021/234261
PCT/FR2021/050854
1
Procédé de détection d'une forme agrégée en feuillets 13 d'une protéine
formant
des agrégats de type feuillets 13
Domaine technique
[0001] L'invention concerne un procédé in vitro de détection dans un
échantillon d'une
forme agrégée en feuillets 13 d'une protéine formant des agrégats de type
feuillets 13
(PAU) comprenant une étape de désagrégation d'une PAF13 afin d'obtenir une
forme
non-agrégée en feuillets 13 de la protéine formant des agrégats de type
feuillets 13
(PNAF13) et une étape de mesure de la teneur en PNAF13.
Technique antérieure
[0002] L'accumulation de protéines souvent mal repliées conduit à leur
agrégation dans la
cellule, entra inant des dérégulations cellulaires, caractéristiques de
certaines pathologies
neurodégénératives notamment. Les peptides amyloïdes 13 et plus
particulièrement le
peptide amyloïde 13 1-42 ont été largement étudiés pour la formation de
fibrilles
contenant des feuillets p puis de plaques dans la maladie d'Alzheimer. Le
processus
d'agrégation des peptides amyloïdes 13 est bien caractérisé et ce processus
dépend d'un
certain nombre de facteurs notamment leur concentration, le pH et la
température. De
nombreuses autres protéines, telles que les protéines de liaison à l'ARN et à
l'ADN, qui
contiennent un domaine de type prion ( prion like-domain ) peuvent également
former des agrégats du même type [1]. Les protéines contenant un domaine de
type
prion sont des protéines formant des agrégats de type feuillets 13 (PF13).
[0003] Les domaines de type prion contiennent des acides aminés hydrophobes
favorisant la
formation de fibrilles riches en feuillets p. Les formes agrégées en feuillets
13 d'une
protéine formant des agrégats de type feuillets 13 (PAF[3) ne sont pas
solubles dans l'eau
à pH neutre.
[0004] Le diagnostic actuel de ces maladies neurodégénératives induites par
une PAFp
repose le plus souvent sur l'imagerie, qui complète l'examen clinique et
neuropsychologique. C'est une procédure lourde et onéreuse qui requiert
plusieurs
étapes de diagnostic.
[0005] Différentes techniques de diagnostic permettant de mettre en évidence
ou de
quantifier l'agrégation ou l'oligomérisation des PF13 dans un échantillon
biologique ont
également été décrites dans la littérature.
[0006] Des techniques d'analyse structurale ont permis de mettre en évidence
les différents
niveaux d'agrégation de certaines PF[3, notamment les peptides amyloïdes 13 et
les
protéines Tau ou TDP-43 : microscopie électronique, microscopie de force
atomique,
Cryo EM, Dichroïsme Circulaire, Résonance Magnétique Nucléaire, diffraction
aux rayons
X. Néanmoins ces techniques permettent difficilement de mesurer la teneur,
même de
manière relative, en agrégats présents dans un échantillon. L'effet éventuel
de composés
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
2
sur le niveau d'agrégation (notamment l'inhibition de l'agrégation) d'une PFP
ne peut
donc pas vraiment être étudié par ces
[0007] Des techniques capables de séparer des protéines en fonction de leur
poids
moléculaires permettent de discriminer les PAFP de haut poids moléculaire des
PNAFP de
faible poids moléculaire. Certaines d'entre elles permettent aussi de
discriminer des
agrégats de différentes tailles. On peut citer par exemple l'électrophorèse
sur gel de
polyacrylamide (PAGE et SDS-PAGE) associé ou non à une détection par Western
Blot.
Les conditions expérimentales actuellement décrites dans ces techniques
peuvent
toutefois fausser la mesure du niveau d'agrégation. C'est notamment le cas
pour le SDS-
PAGE dans lequel l'utilisation combinée d'un détergent et d'un agent réducteur
(DTT,
beta-mercaptoethanol ou TCEP) peut dissocier tout ou partie des agrégats. Du
fait de
leurs contraintes expérimentales (temps de mise en oeuvre, quantité importante
d'échantillons, manque de sensibilité), ces techniques ne sont pas vraiment
adaptées à
la caractérisation de composés capables de moduler le niveau d'agrégation des
PFp.
[0008] Des techniques basées sur de l'immuno-détection ont également été
décrites :
- Filtration combinée à de l'immuno-détection : dans cette méthode
l'échantillon
biologique est filtré sur une membrane capable de retenir les espèces de haut
poids
moléculaire et notamment les PAF. On applique ensuite sur la membrane un
anticorps
spécifique de la PAFP marqué de manière directe ou indirecte avec un traceur
colorimétrique ou fluorescent, voire luminescent. Le signal mesuré est
directement
proportionnel à la quantité de PAFP. Cette méthode peut être adaptée à un
format
microplaque pour étudier les paramètres d'agrégation d'une protéine amyloïde
ou bien
l'effet d'un composé sur son niveau d'agrégation. Toutefois, l'automatisation
et le débit
de la méthode sont limités du fait des étapes de filtration et lavages que
nécessite cette
technique [2].
- ELISA : différentes stratégies de test ELISA ont été décrites afin de
permettre la
caractérisation de l'agrégation des PFP. La première stratégie consiste à
utiliser un
même anticorps pour la capture des PAF P sur la phase solide et comme traceur
permettant leur détection. Cette méthode permet de détecter uniquement les PAF
p qui
possèdent plusieurs épitopes de l'anticorps utilisé en capture et en
détection. A l'inverse,
l'anticorps de capture et l'anticorps de détection ne pourront donc pas se
fixer
simultanément sur une PNAFP car celle-ci ne possède qu'un seul épitope reconnu
par
l'anticorps utilisé. Aucun signal ne sera donc généré en présence de PNAFP
[3]. La
seconde stratégie consiste à associer dans un test ELISA un anticorps
reconnaissant
spécifiquement des PAFp avec un anticorps reconnaissant toutes les formes de
PFp
présentes dans l'échantillon (PAFp et PNAFp) [4]. Dans ce format, l'anticorps
spécifique
des PAFp est généralement l'anticorps de capture mais un format utilisant
celui-ci
comme anticorps de détection a aussi été décrit [5]. Une troisième stratégie
consiste à
utiliser deux anticorps différents reconnaissants tous les deux la PAFP
d'intérêt. Cette
dernière stratégie semble améliorer la spécificité de détection des agrégats
[6]. Tous ces
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
3
tests ELISA permettent de déterminer le niveau d'agrégation des P193 d'intérêt
et de
déterminer l'effet d'un composé sur ins, la détection
seule de la PAF 13 ne suffit pas car, à un signal donné, on ne peut pas se
rendre compte
du niveau d'agrégation par rapport à l'état initial, à moins de comparer les
mesures à
une gamme standard qui biaise forcément les mesures de l'échantillon
biologique testé.
- TR-FRET (Transfert d'énergie en temps résolu) : des kits basés sur cette
méthode ont
été développés et commercialisés afin de détecter l'agrégation de TAU et de
l'alpha-
synucléine dans des échantillons biologiques (voir site Web Cisbio, références
commerciales 6FTAUPEG et 6FASYPEG). Ces tests utilisent un même anticorps
marqué
respectivement au donneur et à l'accepteur de fluorescence. En présence d'une
PA193, du
fait de l'agrégation, les deux anticorps marqués se lieront simultanément à la
PAF13
induisant un transfert d'énergie entre le donneur et l'accepteur de
fluorescence situés à
proximité l'un de l'autre. L'anticorps accepteur émettra alors un signal de
FRET
spécifique qui sera mesuré en temps résolu. En revanche, seul un des deux
anticorps
pourra se lier sur la PNAF13 empêchant ainsi toute proximité entre le donneur
et
l'accepteur. Il sera alors impossible d'obtenir un signal de FRET sur la
PNAFf3. Ces kits
permettent de déterminer le niveau d'agrégation de la P193 d'intérêt et de
déterminer
l'effet d'un composé sur son niveau d'agrégation dans des formats miniaturisés
et à haut
débit. Néanmoins, ces kits nécessitent l'utilisation d'anticorps capables de
reconnaitre
des épitopes de P193 même si celles-ci sont agrégées, ce qui s'avère
quelquefois limitant
voire bloquant dans le développement des tests de détection, étant donné que
les
immunisations sont généralement réalisées avec des PNAF[3, ce qui peut rendre
difficile
l'obtention d'anticorps anti-PAF.
[0009] Les méthodes décrites dans l'art antérieur visent donc à détecter
directement une
PA193 dans un échantillon, notamment en utilisant un ou plusieurs ligands de
la PA193.
Néanmoins, détecter directement la PAF13 peut rendre ces techniques difficiles
à mettre
en oeuvre, peu précises et/ou peu adaptées à une utilisation à grande échelle.
De plus,
la détection seule de la PAF13 ne suffit pas car, à un signal donné, on ne
peut pas se
rendre compte du niveau d'agrégation par rapport à l'état initial, à moins de
comparer
les mesures à une gamme standard qui biaise forcément les mesures de
l'échantillon
biologique testé.
[0010] Un diagnostic des maladies liées à l'agrégation d'une P193 plus aisé,
plus rapide et
plus fiable est donc nécessaire.
[0011] La Demanderesse a mis au point un protocole simple et facile à mettre
en oeuvre qui
permet de désagréger tout ou partie de la PAF13 présente dans un échantillon
afin
d'obtenir une PNA93. Ce protocole a permis à la Demanderesse de mettre au
point un
procédé de détection de la PA193 réalisé au travers de la mesure de la teneur
en PNAF13,
ce qui permet de s'affranchir de toutes les contraintes liées à la détection
de la PAF[3.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
4
Résumé de l'invention
100121 Selon un premier aspect, l'inventice détection dans
un échantillon d'une forme agrégée en feuillets 13 d'une protéine formant des
agrégats
de type feuillets [3 (PAF3), comprenant
les étapes suivantes :
a) Dans un premier contenant :
ai) introduire un échantillon susceptible de contenir une PAF[3,
a2) ajuster le pH à un pH allant de 9,7 à 13,2 pour désagréger tout ou partie
de la
PAF3 afin d'obtenir une forme non-agrégée en feuillets [3 de la protéine
formant des
agrégats de type feuillets 13 (PNAF[3),
a3) ajuster le pH à un pH allant de 6 à 9,
b) Mesurer la teneur en PNAF3 dans le premier contenant avec une méthode
immunologique appropriée ;
c) Dans un deuxième contenant :
cl) introduire un même échantillon qu'à l'étape al),
c2) ajuster le pH à un pH allant de 6 à 9;
d) Mesurer la teneur en PNAF13 dans le deuxième contenant avec la même méthode
qu'à
l'étape b) ;
e) Comparer les teneurs mesurées aux l'étapes b) et d), une diminution de la
teneur
mesurée à l'étape d) par rapport à la teneur mesurée à l'étape b) indiquant
que
l'échantillon contient une PAF13.
[0013] Selon un deuxième aspect, l'invention concerne un procédé in vitro de
suivi de
l'efficacité thérapeutique d'un traitement d'une maladie associée à une PAF[3,
comprenant les étapes suivantes :
A) Mettre en oeuvre le procédé selon l'invention sur un premier échantillon
dans lequel
l'étape e) consiste à déterminer le ratio entre la teneur mesurée à l'étape b)
et la teneur
mesurée à l'étape d) ( Ratio b)/d) de l'échantillon 1 ) ;
B) Mettre en oeuvre un même procédé qu'à l'étape A) sur un second échantillon,
pour
déterminer le Ratio b)/d) de l'échantillon 2 ;
C) Comparer les ratios déterminés aux étapes A) et B), dans lequel une
efficacité
thérapeutique est observée lorsque le ratio déterminé à l'étape B) est
inférieur au ratio
déterminé à l'étape A).
[0014] Selon un troisième aspect, l'invention concerne un procédé in vitro de
mesure de
l'efficacité pharmacologique d'une molécule sur une maladie associée à une
PAF13,
comprenant les étapes suivantes :
A) Mettre en oeuvre le procédé selon l'invention sur un premier échantillon
dans lequel
l'étape e) consiste à déterminer le ratio entre la teneur mesurée à l'étape b)
et la teneur
mesurée à l'étape d) ( Ratio b)/d) de l'échantillon 1 ) ;
B) Mettre en oeuvre un même procédé qu'à l'étape A) sur un second échantillon,
pour
déterminer le Ratio b)/d) de l'échantillon 2 ;
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
C) Comparer les ratios déterminés aux étapes A) et B), dans lequel une
efficacité
pharmacologique est observée lorsqu est inférieur au
ratio déterminé à l'étape A).
5 Description détaillée
[0015] Définitions
[0016] L'expression protéine formant des agrégats de type feuillets 13 ou
PF13
désigne une protéine capable de former des agrégats riches en feuillets 13,
c'est-à-dire
une protéine capable de former une forme multimérique (ou une forme
oligomérique)
riche en feuillets p. Généralement, une forme non-agrégée de la PF13 est
normale, mais
une forme agrégée de celle-ci caractérise, en particulier, par une maladie
neurodégénérative, telle que la maladie d'Alzheimer, la maladie de Creutzfeldt-
Jakob, la
maladie de Parkinson ou la sclérose latérale amyotrophique (SLA). Il peut
s'agir d'une
protéine humaine ou animale, native ou recombinante. Dans le cadre de la
présente
invention, la forme non-agrégée d'une PF13 est désignée par l'expression
forme non-
agrégée en feuillets 13 d'une protéine formant des agrégats de type feuillets
13 ou
PNAF13 . La forme agrégée d'une PF13 est désignée par l'expression forme
agrégée
en feuillets 13 d'une protéine formant des agrégats de type feuillets 13 ou
PAFI3 .
[0017] La PF13, qui peut être sous forme agrégée (PAF13) ou sous forme non-
agrégée
(PNAF13), peut être choisie parmi FUS (Fused in sarcoma), TAF15, EVVSR1,
DAZAP1, TIA-
1, TTR (transthyrétine), cystatine C, 132-microglobuline, peptide amyloïde p
(tel que
peptide amyloïde 131-40 ou peptide amyloïde 13 1-42), TAU (Tubulin-Associated
Unit), a-
synucléine, 13-synucléine, y-synucléine, Huntingtine (HTT), SOD1 (superoxyde
dismutase
1), prion, et TDP-43 (TAR DNA-binding protein 43). Par exemple, lorsque PF13
est TDP-
43, on parlera de TDP-43 NAF13 pour la forme non-agrégée de TDP-43 et de
TDP-
43 AF13 pour la forme agrégée de TDP-43.
[0018] Les PF13 listées ci-dessus sont notamment impliquées dans des maladies
neuro-
dégénératives. Par exemple, FUS impliqué dans la sclérose latérale
amyotrophique,
TAF15 impliqué dans la sclérose latérale amyotrophique, les peptides amyloïde
13
impliqués dans la maladie d'Alzheimer et l'angiopathie amyloïde cérébrale
héréditaire, le
prion impliqué dans la maladie de Creutzfeldt-Jakob et l'encéphalopathie
spongiforme,
l'a-synucléine impliquée dans la maladie de Parkinson, la protéine TAU
impliquée dans la
maladie d'Alzheimer, les démences frontotemporales, la transthyrétine
impliquée dans
l'amylose systémique sénile ou la polyneuropathie familiale amyloïde, la
cystatine C
impliquée dans l'angiopathie amyloïde cérébrale héréditaire, la 132-
microglobuline
impliquée dans l'amylose liée à l'hémodialyse, la Huntingtine impliquée dans
la maladie
de Huntington, la SOD1 impliquée dans la sclérose latérale amyotrophique, TDP-
43
impliquée dans la sclérose latérale amyotrophique et les démences
frontotemporales. De
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
6
préférence, la P93 est choisie parmi le peptide amyloïde 131-42, le peptide
amyloïde 13 1-
40, l'a-synucléine ou la TDP-43.
[0019] L'échantillon dans lequel le procédé de l'invention est mis en oeuvre
peut être tout
échantillon susceptible de contenir au moins une PA93. Il peut s'agir d'un
échantillon
biologique d'origine humaine ou animale, ou d'un échantillon de cellules ou de
tissu
cultivé in vitro.
[0020] Le terme procédé in vitro signifie un procédé mis en oeuvre en
dehors du corps
humain ou animal, par exemple sur micro-organismes, organes, tissus, cellules,
sous-
fractions cellulaires (ex. noyaux, mitochondries) ou des protéines (natives ou
recombinantes). Le terme in vitro englobe ex vivo.
[0021] L'échantillon peut par exemple provenir d'un individu, homme ou animal,
ayant ou
étant suspecté d'avoir une maladie associée à une PA93, par exemple une
maladie
neurodégénérative telle que décrite ci-dessus. Par exemple, l'échantillon peut
être choisi
parmi un échantillon de sang, un échantillon de plasma, un échantillon de
sérum ou un
échantillon de liquide céphalo-rachidien. L'échantillon peut également être
préparé à
partir d'un tissu ou de cellules provenant de l'individu, par exemple à partir
de cerveau,
de tissus du système nerveux central, d'organes tels que la rate et
l'intestin.
L'échantillon peut donc être un lysat cellulaire, un homogénat cellulaire, un
lysat
tissulaire ou un homogénat tissulaire, tel qu'un homogénat de cerveau.
L'échantillon
peut également comprendre des cellules (ex. une lignée cellulaire), des sous-
fractions
cellulaires (ex. noyaux, mitochondries) ou des protéines (natives ou
recombinantes).
[0022] L'échantillon peut également provenir de cellules ou d'un tissu
cultivé(es) in vitro ou
ex vivo, de préférence provenir d'un modèle cellulaire ou tissulaire d'une
maladie
associée à une PA93. Par exemple, l'échantillon peut être choisi parmi un
lysat cellulaire,
un homogénat cellulaire, un lysat tissulaire, un homogénat tissulaire, un
surnageant de
culture cellulaire ou un surnageant de culture tissulaire.
[0023] De préférence, l'échantillon est un lysat cellulaire ou un homogénat
cellulaire.
[0024] Le terme contenant désigne un puits d'une plaque, un tube à essai
ou tout autre
contenant approprié au mélange d'un échantillon avec les réactifs nécessaires
à la mise
en uvre du procédé selon l'invention.
[0025] Au sens de l'invention, le terme ligand désigne une molécule
capable de lier à
une molécule cible. Dans le cadre de l'invention, la molécule cible est la
PNA93. On parle
alors de ligand de la PNA93 . Le ligand peut être de nature protéique (ex.
une
protéine ou un peptide) ou de nature nucléotidique (ex. un ADN ou un ARN).
Dans le
cadre de l'invention, le ligand est avantageusement choisi parmi un anticorps,
un
fragment d'anticorps, un peptide ou un aptamère, de préférence un anticorps ou
un
fragment d'anticorps.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
7
[0026] Au sens de l'invention, le terme ligand capable de se lier
spécifiquement à la
PNAFI3 ou paire de ligands capabPNAFI3 désigne
un ligand ou une paire de ligands qui se lie préférentiellement à la PNAFp par
rapport à
la PAF, c'est-à-dire un ligand ou une paire de ligands capable de générer un
signal (ex.
un signal ELISA ou un signal de RET) vis-à-vis d'une PNAFp au moins deux fois
supérieur, par exemple au moins trois, au moins quatre, au moins cinq ou au
moins six
fois supérieur, au signal généré vis-à-vis de la PAFP correspondante. Les
exemples 1-4
et 25 de la présente demande décrivent des méthodes ELISA et FRET qui
permettent de
déterminer facilement si un ligand ou une paire de ligands est capable de se
lier
spécifiquement à la PNAFP.
[0027] Avantageusement, le ligand capable de se lier spécifiquement à la
PNAFP ou la
paire de ligands capable de se lier spécifiquement à la PNAFP est capable de
se lier à
une PNAFp avec une affinité au moins 2 fois supérieure à l'affinité pour la
PAFp
correspondante, par exemple une affinité au moins 2 fois supérieure, au moins
3 fois
supérieure, au moins 4 fois supérieure, au moins 5 fois supérieure, au moins 6
fois
supérieure, au moins 7 fois supérieure, au moins 8 fois supérieure, au moins 9
fois
supérieure, au moins 10 fois supérieure à l'affinité pour la PAFP
correspondante.
Lorsqu'il s'agit d'une paire de ligands capable de se lier spécifiquement à la
PNAFP, il
n'est pas nécessaire que les deux ligands de la paire de ligands soient
spécifiques de la
PNAFp pour que la paire de ligands soit spécifique de la PNAFp. En effet, il
suffit qu'au
moins un des deux ligands de la paire de ligands soit un ligand spécifique de
la PNAFp
pour que la paire de ligands soit spécifique de la PNAFp. Néanmoins, les deux
ligands de
la paire de ligands peuvent être des ligands spécifiques de la PNAFP.
[0028] Le terme affinité fait référence à la force de l'ensemble des
interactions non-
covalentes entre un ligand et un antigène. L'affinité est généralement
représentée par la
constante de dissociation (Kd). Plus la valeur Kd est basse, plus l'affinité
de liaison entre
le ligand et sa cible est élevée. La constante de dissociation (Kd) peut être
mesurée par
des méthodes bien connues, par exemple en FRET, en ELISA ou en SPR. Les
techniques
décrites dans la littérature permettent donc de savoir aisément si un ligand
ou une paire
de ligands est spécifique de la PNAFp.
[0029] Le terme anticorps , également appelé immunoglobuline désigne un
hétérotétramère constitué de deux chaînes lourdes d'environ 50-70 kDa chacune
(dites
les chaînes H pour Heavy) et de deux chaînes légères d'environ 25 kDa chacune
(dites
les chaînes L pour Light), liées entre elles par des ponts disulfures intra et
intercaténaires. Chaque chaîne est constituée, en position N-terminale, d'une
région ou
domaine variable, dit VL pour la chaîne légère, VH pour la chaîne lourde, et
en position
C-terminale, d'une région constante, constitué d'un seul domaine dit CL pour
la chaîne
légère et de trois ou quatre domaines nommés CH1, CH2, CH3, CH4, pour la
chaîne
lourde. Chaque domaine variable comprend généralement 4 régions charnières
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
8
(appelées FR1, FR2, FR3, FR4) et 3 régions directement responsables de la
liaison avec
l'antigène, dites CDR (appelées orps peut être
d'origine mammifère (ex. humain ou de souris ou de rat ou de camélidé),
humanisé,
chimérique, recombinant. Il s'agit de préférence d'un anticorps monoclonal
produit de
manière recombinante par des cellules génétiquement modifiées selon des
techniques
largement connues de l'homme de l'art. L'anticorps peut être de n'importe quel
isotype,
par exemple IgG, IgM, IgA, Ig D ou IgE, de préférence IgG.
[0030] On entend par fragment d'anticorps , toute partie d'une
immunoglobuline
obtenue par digestion enzymatique ou obtenue par bio-production comprenant au
moins
un pont disulfure et qui est capable de se lier à l'antigène reconnu par
l'anticorps entier,
par exemple Fv, Fab, Fab', Fab'-SH, F(ab')2, les diabodies, les anticorps
linéaires (aussi
appelés Single Domain Antibodies ou sdAb, ou nanobodies), les anticorps
avec une
seule chaine (ex. les scFv). La digestion enzymatique des immunoglobulines par
la
pepsine génère un fragment F(ab')2 et un fragment Fc scindé en plusieurs
peptides.
F(ab')2 est formé de deux fragments Fab' liés par des ponts disulfures
intercaténaires.
Les parties Fab sont constituées des régions variables et des domaines CH1 et
CL. Le
fragment Fab' est constitué de la région Fab et d'une région charnière. Fab'-
SH fait
référence à un fragment Fab' dans lequel le résidu cystéine de la région
charnière porte
un groupe thiol libre.
zo
[0031] On entend par traceur un agent chimique ou biologique capable
d'émettre
directement ou indirectement un signal qui pourra être détecté avec un
appareil de
détection approprié. Il peut s'agir d'un traceur fluorescent, luminescent,
radioactif ou
enzymatique. Dans un mode de réalisation particulier, le traceur est un membre
d'un
couple de partenaires de RET.
[0032] Le terme RET (de l'anglais Resonance Energy Transfer ) désigne
les
techniques de transfert d'énergie. Le RET peut être un FRET ou un BRET.
[0033] Le terme FRET (de l'anglais Fluorescence Resonance Energy
Transfer )
désigne le transfert d'énergie entre deux molécules fluorescentes. Le FRET est
défini
comme un transfert d'énergie non radiatif résultant d'une interaction
dipôle¨dipôle entre
un donneur et un accepteur d'énergie. Ce phénomène physique nécessite une
compatibilité énergétique entre ces molécules. Cela signifie que le spectre
d'émission du
donneur doit recouvrir, au moins partiellement, le spectre d'absorption de
l'accepteur. En
accord avec la théorie de Fôrster, le FRET est un processus qui dépend de la
distance
séparant les deux molécules, donneur et accepteur : lorsque ces molécules sont
à
proximité l'une de l'autre, un signal de FRET sera émis.
[0034] Le terme BRET (de l'anglais Bioluminescence Resonance Energy
Transfer )
désigne le transfert d'énergie entre une molécule bioluminescente et une
molécule
fluorescente.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
9
[0035] Le terme couple de partenaires de RET désigne un couple constitué
d'un
composé donneur d'énergie (ci-après mposé accepteur
d'énergie (ci-après composé accepteur ); lorsqu'ils sont à proximité l'un
de l'autre et
lorsqu'ils sont excités à la longueur d'onde d'excitation du composé donneur,
ces
composés émettent un signal de RET. Il est connu que pour que deux composés
soient
partenaires de RET, le spectre d'émission du composé donneur doit recouvrir
partiellement le spectre d'excitation du composé accepteur. Par exemple, on
parle de
couples de partenaires de FRET lorsqu'on utilise un composé fluorescent
donneur et
un composé accepteur ou de couple de partenaires de BRET lorsqu'on utilise
un
composé bioluminescent donneur et un composé accepteur.
[0036] Le terme signal de RET désigne tout signal mesurable représentatif
d'un RET
entre un composé donneur et un composé accepteur. Par exemple, un signal de
FRET
peut donc être une variation de l'intensité ou de la durée de vie de
luminescence du
composé fluorescent donneur ou du composé accepteur lorsque ce dernier est
fluorescent.
[0037] Procédé de détection 2 contenants
[0038] Selon un premier aspect, l'invention concerne un procédé in vitro de
détection dans
un échantillon d'une forme agrégée en feuillets 13 d'une protéine formant des
agrégats
de type feuillets 13 (PAF13), comprenant les étapes suivantes:
a) Dans un premier contenant :
ai) introduire un échantillon susceptible de contenir une PAF13,
a2) ajuster le pH à un pH allant de 9,7 à 13,2 pour désagréger tout ou partie
de
la PAFB afin d'obtenir une forme non-agrégée en feuillets 13 de la protéine
formant
des agrégats de type feuillets 13 (PNAF13),
a3) ajuster le pH à un pH allant de 6 à 9,
b) Mesurer la teneur en PNAF13 dans le premier contenant avec une méthode
immunologique appropriée ;
c) Dans un deuxième contenant :
c1) introduire un même échantillon qu'à l'étape a1),
c2) ajuster le pH à un pH allant de 6 à 9;
d) Mesurer la teneur en PNAFP dans le deuxième contenant avec la même méthode
qu'à l'étape b) ;
e) Comparer les teneurs mesurées aux étapes b) et d), une diminution de la
teneur
mesurée à l'étape d) par rapport à la teneur mesurée à l'étape b) indiquant
que
l'échantillon contient une PAF13.
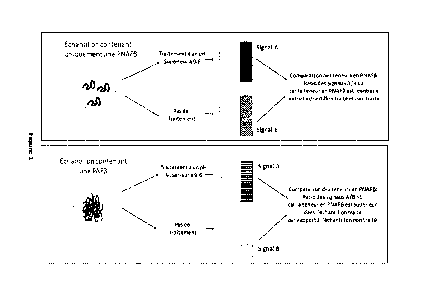
[0039] Le principe général du procédé selon l'invention est illustré à la
Figure 1.
[0040] Ci-après, le procédé est décrit en détail étape par étape.
[0041] Etape a)
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
[0042] L'étape al) consiste à, dans un premier contenant, introduire un
échantillon
susceptible de contenir une PAFI3. L'tnt préparé pour
pouvoir réaliser convenablement les étapes du procédé, notamment l'étape de
mesure
de la teneur en PNAF13. Par exemple, lorsque l'échantillon est un tissu ou des
cellules, il
5 peut être préparé préalablement en le lysant, broyant, filtrant et/ou en
le mettant en
solution dans un solvant approprié tel que de l'eau. L'Homme du métier n'aura
aucune
difficulté à préparer l'échantillon.
[0043] L'étape a2) consiste à ajuster le pH à un pH allant de 9,7 à 13,2 pour
désagréger
tout ou partie de la PAF13 afin d'obtenir une forme non-agrégée en feuillets
13 de la
10 protéine formant des agrégats de type feuillets 13 (PNAF13). La
demanderesse s'est en
effet aperçue qu'un pH allant de 9,7 à 13,2 permet de désagréger la PAFI3. Ce
phénomène de désagrégation permet d'obtenir une PNAF13 à partir de la PAF13.
[0044] Ce phénomène de désagrégation à pH allant de 9,7 à 13,2 est tout à fait
surprenant
puisque les méthodes de désagrégation décrites dans l'art antérieur consistent
plutôt à
traiter les PNAFP à pH acide, avec des détergents puissants et/ou par
sonication. Par
exemple, les travaux décrits dans [7] montrent différentes méthodes permettant
d'obtenir des protéines amyloïdes relativement monomériques à partir de fibres
amyloïdes. Dans une première approche, une préparation de fibres amyloïdes est
traitée
en combinant un acide, l'acide formique à 88%, avec un détergent de type
tensioactif
fort, le Sodium Dodecyl Sulfate (SDS). Une alternative consiste à combiner un
agent
chaotropique, une solution saturée de Guanidine Thiocyanate (6.8M) avec le
SDS. Dans
les 2 cas, les auteurs ont pu noter la disparition des fibres amyloïdes au
profit de
protéines amyloïdes relativement monomériques (mélange de monomères et de
dimères). Une autre étude [8] décrit différentes méthodes de traitement
d'échantillons
biologiques pour désagréger des protéines amyloïdes (peptide amyloïde fi 1-42)
qu'ils
contiennent avant de les doser via un test ELISA. Des extraits de cerveaux de
souris ou
des liquides céphalo-rachidiens de patients sont traités par une solution
d'alcool fluoré
(HFIP) ou d'acide (TFA) couplée à une sonication pendant 15 minutes pour
désagréger
les protéines amyloïdes. L'HFIP ou le TFA sont ensuite enlevés par séchage
sous flux
constant d'azote. Les échantillons à sec, contenant les protéines amyloïdes
désagrégées,
sont ensuite repris par une solution à 1% NH4OH avant d'être analysés. Les
auteurs
suggèrent que ces 2 types de traitement permettent de désagréger les agrégats
de
peptide amyloïde 13142 et par la même d'améliorer leur quantification.
[0045] Néanmoins la demanderesse a montré que les procédés de désagrégation
décrits
dans l'art antérieur ne permettent pas de mesurer la teneur en PNAF13 avec des
méthodes immunologiques, qui nécessitent d'être mis en uvre à un pH
physiologique
(cf. Exemples 5 à 17).
[0046] Le procédé de l'invention ne nécessite pas de traitement à un pH acide
pour
désagréger la PAF13. Au contraire, la Demanderesse a non seulement montré
qu'une
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
11
désagrégation était possible en traitant une PAFP à un pH allant de 9,7 à
13,2, mais
également que ce traitement était mise en oeuvre
ultérieure d'une méthode immunologique visant à mesurer la teneur en PNAF[3.
[0047] Avantageusement, l'étape a2) consiste à ajuster le pH à un pH allant de
10 à 13,2,
par exemple un pH allant de 11 à 13,2, un pH allant de 11,5 à 13,2, un pH
allant de 12 à
13,2, un pH allant de 12,5 à 13,2, un pH allant de 12,8 à 13,2, un pH allant
de 10 à 13,
un pH allant de 11 à 13, un pH allant de 12 à 13, par exemple environ 12,8.
[0048] Le pH est ajusté avec une base, par exemple une base forte telle que
KOH ou NaOH,
de préférence NaOH.
[0049] La durée de l'étape a2) pourra dépendre de différents paramètres tels
que la base
utilisée ou la PFP testée. En particulier, l'étape a2) pourra durer au moins
30 secondes,
par exemple au moins 1 minute, au moins 2 minutes, au moins 5 minutes, au
moins 10
minutes, au moins 15 minutes, par exemple entre 30 secondes et 60 min ou entre
5
minutes et 30 minutes. L'Homme du métier n'aura aucune difficulté à adapter la
durée
de l'étape a2) pour arriver à désagréger tout ou partie de la PAF 13 afin
d'obtenir une
PNAF13.
[0050] L'étape a3) consiste à ajuster le pH à un pH allant de 6 à 9. Cette
étape est
importante puisqu'elle permet de mettre en oeuvre la méthode immunologique de
l'étape
b).
[0051] Avantageusement, l'étape a3) consiste à ajuster le pH à un pH allant de
6,4 à 9, par
exemple un pH allant de 6,4 à 8,4, un pH allant de 6 à 8,5, un pH allant de 7
à 8,5.
[0052] Le pH est ajusté avec un acide, par exemple un acide fort, tel que HCI.
[0053] Etape b)
[0054] L'étape b) consiste à mesurer la teneur en PNAF13 dans le premier
contenant avec
une méthode immunologique appropriée (ou immunoassay approprié).
[0055] Il est nécessaire que la méthode immunologique de l'étape b) permette
d'obtenir des
teneurs qui soient comparables entre elles. Néanmoins, il n'est pas nécessaire
que la
méthode immunologique de l'étape b) soit quantitative, bien qu'elle puisse
l'être. La
méthode immunologique de l'étape b) doit permettre a minima de mesurer une
teneur
relative pouvant être comparée à une autre teneur relative mesurée par une
même
méthode immunologique.
[0056] Dans un mode de réalisation particulier la méthode immunologique mise
en oeuvre à
l'étape b) utilise :
(i) un ligand capable de se lier spécifiquement à la PNAF13, ledit ligand
étant marqué
avec un traceur, ou
(ii) une paire de ligands capable de se lier spécifiquement à la PNA93, au
moins un
ligand de ladite paire de ligands étant marqué avec un traceur.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
12
[0057] Le ligand (i) peut être choisi parmi un anticorps, un fragment
d'anticorps, un peptide
ou un aptamère, de préférence un &peut être choisie
parmi une paire d'anticorps, une paire de fragments d'anticorps, une paire de
peptides
ou une paire d'aptamères, de préférence une paire d'anticorps.
[0058] L'Homme du métier n'aura aucune difficulté à obtenir et/ou sélectionner
des
anticorps ou des fragments d'anticorps ayant les propriétés recherchées, par
exemple en
immunisant une souris avec une PFp, en faisant une hybridation lymphocytaire à
partir
des lymphocytes de la rate de la souris immunisée afin de générer des
hybridomes et en
testant les anticorps de chaque hybridome pour leurs capacités à se lier
spécifiquement
à la PNAFP. Des exemples de protocole complet de génération d'anticorps anti-
PNAFp
puis de sélection des anticorps spécifiques sont détaillés aux exemples 1-4 et
25. Il est
donc très facile d'obtenir des anticorps ou des paires d'anticorps dirigés
contre n'importe
quelle PNAFp pour la mise en oeuvre du procédé selon l'invention, par exemple
en
mettant en oeuvre les procédés décrits aux exemples 1-4 et 25.
[0059] L'obtention des PNAFP et des PAFP est à la portée de l'Homme du métier.
Par
exemple, pour les protéines dites prion-like , telles que TDP-43, FUS,
TAF15 et
EWSR1, la production de ces protéines fusionnées à la Gluthatione-S-
Transférase (GST)
(fusion N- ou C-terminale selon les protéines) permet d'obtenir des protéines
en fusion
GST dont l'analyse par turbidimétrie montre qu'elles sont sous forme non-
agrégées
[9][10][13]. Lorsqu'un site de clivage à la Tobacco etch Virus protéase (TEV)
est inséré
entre la PFp d'intérêt et la GST, un traitement des protéines GST à la TEV
suivie d'une
étape de purification permet d'obtenir les protéines sans étiquette GST.
Lorsque celles-ci
sont laissées 1h30 à température ambiante sous agitation, l'analyse par
turbidimétrie
montre qu'elles sont sous forme agrégées [10][13]. Des PFP fusionnées à GST
sont
également disponibles dans le commerce, par exemple chez Abnova : GST-TDP-43
(Réf.
H00023435-P02), GST-FUS1 (Réf. H00002521-P01), GST-TAF15 (Réf. H00008148-P02)
GST-EWSR1 (Réf. H00002130-Q01).
[0060] Les peptides amyloïdes, notamment les formes p 1-40 et p 1-42, sont
également
disponibles auprès de nombreux fournisseurs sous forme de poudre. La
solubilisation de
ces poudres dans du HFIP ou de NH4OH permet d'obtenir des solutions stocks
contenant
plus de 90% de formes non-agrégées. L'utilisation extemporanée de ces
solutions
préalablement diluées dans des tampons présentant des pH physiologiques permet
de
disposer d'échantillons de formes non-agrégées. A l'inverse, une incubation de
plusieurs
heures à plusieurs jours, par exemple une incubation de plus de 24 h, de ces
mêmes
solutions stock dans un tampon physiologique à température ambiante permet
d'obtenir
un échantillon contenant de très fortes proportions de formes agrégées [11].
[0061] Des échantillons contenant des PNAFP et des PAFP peuvent également être
obtenues
auprès de la société StressMarq (www.stressmarq.com). C'est notamment le cas
pour les
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
13
alpha, beta et gamma synucléines, la protéine TAU, la protéine Cu/Zn
superoxide
dismutase 1 (SOD1) ou la Transthyreti
[0062] Avantageusement, la méthode immunologique mise en uvre aux étapes b)
est une
méthode ELISA ou une méthode RET, telle qu'un FRET ou un BRET.
[0063] Selon la méthode utilisée, la mesure de l'étape b) peut se faire
directement dans le
premier contenant en y rajoutant les réactifs appropriés ou dans un autre
contenant
avec tout ou partie du contenu du premier contenant. Par exemple, les réactifs
d'une
méthode RET peuvent être ajoutés directement dans le premier contenant. A
l'inverse, la
méthode ELISA se fera de préférence dans un autre contenant adapté à la mise
en
oeuvre de la méthode ELISA, notamment dans un contenant au fond duquel a
préalablement été immobilisé un ligand de la PNAFB.
[0064] Dans un mode de réalisation particulier, l'étape b) est réalisée par
une méthode RET
et consiste à :
(b1) introduire dans le contenant un premier ligand de la PNAFB marqué par un
premier membre d'un couple de partenaires de RET et un second ligand de la
PNAFB
marqué par un second membre du couple de partenaires de RET, la paire de
ligands
étant capable de se lier spécifiquement à la PNAFB, et
(b2) mesurer le signal de RET émis dans le contenant.
[0065] Bien évidemment, pour la mise en uvre de la méthode RET, le premier
ligand et le
second ligand ne doivent pas entrer en compétition pour la liaison à la PNAFB,
par
exemple le premier ligand et le deuxième ligand ne doivent pas lier le même
épitope sur
la PNAFB. Il est facile de sélectionner une paire de ligands appropriée en
mettant en
oeuvre le procédé décrit aux exemples 1-4 et 25.
[0066] Les ligands peuvent être marqués de manière directe ou indirecte. Le
marquage
direct du ligand par un membre d'un couple de partenaires de RET peut être
effectué
par les méthodes classiques connues de l'homme du métier, reposant sur la
présence de
groupes réactifs sur le ligand. Par exemple, lorsque le ligand est un
anticorps ou un
fragment d'anticorps, les groupes réactifs suivants peuvent être utilisés : le
groupe
amino terminal, les groupes carboxylates des acides aspartique et glutamique,
les
groupes amines des lysines, les groupes guanidines des arginines, les groupes
thiols des
cystéines, les groupes phénols des tyrosines, les cycles indoles des
tryptophanes, les
groupes thioéthers des méthionines, les groupes imidazoles des histidines.
[0067] Les groupes réactifs peuvent former une liaison covalente avec un
groupe réactif
porté par un membre d'un couple de partenaires de RET. Les groupes réactifs
appropriés, portés par le membre d'un couple de partenaires de RET, sont bien
connus
de l'homme du métier, par exemple un composé donneur ou un composé accepteur
fonctionnalisé par un groupe maléimide sera par exemple capable de se lier de
manière
covalente avec les groupes thiols portés par les cystéines portées par une
protéine ou un
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
14
peptide, par exemple un anticorps ou un fragment d'anticorps. De même, un
composé
donneur/accepteur portant un ester dole de se fixer de
manière covalente à une amine présente sur une protéine ou un peptide.
[0068] Le ligand peut également être marqué par un composé fluorescent ou
bioluminescent de manière indirecte, par exemple en introduisant dans le
milieu de
mesure un anticorps ou un fragment d'anticorps, lui-même lié de manière
covalente à un
composé accepteur/donneur, ce deuxième anticorps ou fragment d'anticorps
reconnaissant de manière spécifique le ligand.
[0069] Un autre moyen de marquage indirect très classique consiste à fixer de
la biotine sur
le ligand à marquer, puis d'incuber ce ligand biotinylé en présence de
streptavidine
marquée par un composé accepteur/donneur. Des ligands biotinylés appropriés
peuvent
être préparés par des techniques bien connues de l'homme du métier ; la
société Cisbio
Bioassays commercialise par exemple de la streptavidine marquée avec un
fluorophore
dont la dénomination commerciale est d2 (réf. 610SADLA).
[0070] Avantageusement, l'un des membres du couple de partenaires de RET est
un
composé fluorescent donneur ou luminescent donneur et l'autre membre du couple
de
partenaires de RET est un composé fluorescent accepteur ou un composé
accepteur non
fluorescent (quencher).
[0071] Lorsque le RET est un FRET, le composé fluorescent donneur peut être un
partenaire
de FRET choisi parmi : un cryptate d'europium, un chélate d'europium, un
chélate de
terbium, un cryptate de terbium, un chélate de ruthénium, un quantum dot, les
allophycocyanines, les rhodamines, les cyanines, les squaraines, les
coumarines, les
proflavines, les acridines, les fluorescéines, les dérivés du boron-
dipyrrométhène et le
nitrobenzoxadiazole. Lorsque le RET est un FRET, le composé fluorescent
accepteur peut
être un partenaire de FRET choisi parmi : les allophycocyanines, les
rhodamines, les
cyanines, les squaraines, les coumarines, les proflavines, les acridines, les
fluorescéines,
les dérivés du boron-dipyrrométhène, le nitrobenzoxadiazole, un quantum dot,
la GFP,
les variants GFP choisis parmi GFP10, GFP2 et eGFP, la YFP, les variants YFP
choisis
parmi eYFP, YFP topaz, YFP citrine, YFP venus et YPet, le mOrange, le DsRed.
[0072] Lorsque le RET est un BRET, le composé luminescent donneur peut être un
partenaire de BRET choisi parmi : la Luciférase (luc), Renilla Luciférase
(Rluc), les
variants de Rénilla Luciférase (Rluc8) et la Firefly Luciférase. Lorsque le
RET est un
BRET, le composé fluorescent accepteur est un partenaire de BRET choisi parmi
: les
allophycocyanines, les rhodamines, les cyanines, les squaraines, les
coumarines, les
proflavines, les acridines, les fluorescéines, les dérivés du boron-
dipyrrométhène, le
nitrobenzoxadiazole, un quantum dot, la GFP, les variants GFP choisis parmi
GFP10,
GFP2 et eGFP, la YFP, les variants YFP choisis parmi eYFP, YFP topaz, YFP
citrine, YFP
venus et YPet, le mOrange, le DsRed.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
[0073] Dans un mode de réalisation particulier, l'étape b) est réalisée par
une méthode
ELISA et consiste à :
(bl) introduire tout ou partie de l'échantillon dans un contenant au fond
duquel a été
immobilisé un premier ligand de la PNAFp, puis introduire un second ligand de
la PNAFp
5 marqué avec un traceur, la paire de ligands étant capable de se lier
spécifiquement à la
PNAFp,
(b2) mesurer le signal ELISA émis dans le contenant.
[0074] La méthode ELISA est largement décrite dans l'art antérieur et ne
présente aucune
difficulté de mise en oeuvre pour l'Homme du métier.
10 [0075] Etape c)
[0076] L'étape c) consiste à, dans un premier contenant, cl) introduire un
même échantillon
qu'à l'étape al).
[0077] Contrairement à l'étape a), le pH n'est pas ajusté à un pH allant de
9,7 à 13,2 lors de
l'étape c). Le pH est directement ajusté à un pH allant de 6 à 9 (étape c2)),
de
15 préférence au même pH que le pH de l'étape a3).
[0078] Le pH à l'étape c2) peut être ajusté avec un mélange acide/base, par
exemple un
mélange acide fort/base forte. Il peut s'agir par exemple d'un mélange
Na0H/HCI. De
préférence, l'acide utilisé à l'étape c2) est le même que celui utilisé à
l'étape a3) et la
base utilisée à l'étape c2) est la même que la base utilisée à l'étape a2).
[0079] Etape d)
[0080] L'étape d) consiste à mesurer la teneur en PNAFp dans le deuxième
contenant avec
la même méthode qu'à l'étape b). L'étape d) est mise en oeuvre de la même
manière
que l'étape b) pour pouvoir comparer les mesures et mettre en uvre l'étape
e).
[0081] Ainsi, lorsque l'étape b) est réalisée par une méthode RET, l'étape d)
consiste à :
(dl) introduire dans le contenant un premier ligand de la PNAFp marqué par un
premier membre d'un couple de partenaires de RET et un second ligand de la
PNAFp
marqué par un second membre du couple de partenaires de RET, la paire de
ligands
étant capable de se lier spécifiquement à la PNAFp, et
(d2) mesurer le signal de RET émis dans le contenant.
[0082] De la même manière, lorsque l'étape b) est réalisée par une méthode
ELISA, l'étape
d) consiste à :
(dl) introduire tout ou partie de l'échantillon dans un contenant au fond
duquel a été
immobilisé un premier ligand de la PNAFp, puis introduire un second ligand de
la PNAFp
marqué avec un traceur, la paire de ligands étant capable de se lier
spécifiquement à la
PNAFp,
(d2) mesurer le signal ELISA émis dans le contenant.
[0083] Etape e)
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
16
[0084] L'étape e) consiste à comparer les teneurs mesurées à l'étape b) et à
l'étape d), une
diminution de la teneur mesurée à l'éiesurée à l'étape
b) indiquant que l'échantillon contient une PAF13.
[0085] Bien évidemment, si on permute le premier et le deuxième contenant,
l'étape e)
consistera à comparer les teneurs mesurées à l'étape b) et à l'étape d), une
augmentation de la teneur mesurée à l'étape d) par rapport à la teneur mesurée
à
l'étape b) indiquant que l'échantillon contient une PAF13.
[0086] L'homme du métier pourra facilement comparer les teneurs mesurées aux
étapes b)
et d) et définir un seuil lui permettant de qualifier l'augmentation ou la
diminution. Par
exemple un écart entre les teneurs mesurées supérieur à 5%, supérieur à 100/0,
supérieur à 15%, supérieur à 20%, supérieur à 25%. La détermination du seuil
pourra
dépendre de la variabilité inhérente à la méthode immunologique choisie.
[0087] L'homme du métier pourra par exemple calculer le ratio entre les
teneurs mesurées
aux étapes b) et d). De manière générale, plus l'écart entre les teneurs
mesurées est
important, plus le ratio entre les teneurs mesurées sera important et plus la
quantité de
PAFB dans l'échantillon sera importante.
[0088] Lorsque la méthode immunologique est une méthode ELISA ou une méthode
RET,
on va comparer les signaux de RET ou les signaux ELISA mesurés aux étapes b)
et d).
Par conséquent, une diminution du signal de RET ou une diminution du signal
ELISA
indiquera que l'échantillon contient une PAFB. Avantageusement on calculera un
ratio
entre le signal mesuré dans le premier contenant (étape b)) et le signal
mesuré dans le
deuxième contenant (étape d)). Le calcul du ratio pourra se faire manuellement
ou
automatiquement.
[0089] De préférence, la durée entre l'étape a3) et l'étape b) et/ou entre
l'étape c2) et
l'étape d) sera adaptée pour éviter que la PNAFB se ré-agrège en PAF13. La
durée sera de
préférence inférieure à 24 heures, par exemple inférieure à 5 heures.
Avantageusement,
les étapes b) et d) sont réalisées dans la foulée des étapes a3) et c2)
respectivement,
c'est-à-dire moins de 30 minutes après les étapes a3) et c2). L'Homme du
métier n'aura
aucune difficulté à adapter la durée de l'étape a3) et/ou de l'étape c2) pour
éviter que
tout ou partie de la PNAFB se ré-agrège en PAFB avant l'étape c) et/ou l'étape
d).
[0090] La comparaison des teneurs dans les deux échantillons à l'étape e)
permet de
mesurer le niveau d'agrégation de façon très précise, notamment par rapport à
la
plupart des méthodes de l'art antérieur.
[0091] Procédé de suivi de l'efficacité thérapeutique
[0092] La présente invention concerne également un procédé in vitro de suivi
de l'efficacité
thérapeutique d'un traitement d'une maladie associée à une PAF B chez un
patient,
comprenant les étapes suivantes :
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
17
A) Mettre en uvre le procédé selon l'invention sur un premier échantillon
dudit patient,
dans lequel l'étape e) consiste à déterurée à l'étape b)
et la teneur mesurée à l'étape d) ( Ratio b)/d) de l'échantillon 1 ) ;
B) Mettre en oeuvre un même procédé qu'à l'étape A) sur un second échantillon
dudit
patient, pour déterminer le Ratio b)/d) de l'échantillon 2 ;
C) Comparer les ratios déterminés aux étapes A) et B), dans lequel une
efficacité
thérapeutique est observée lorsque le ratio déterminé à l'étape B) est
inférieur au ratio
déterminé à l'étape A).
[0093] Le traitement peut être un traitement connu de la maladie associée à
une PAF3 ou
un traitement expérimental. L'échantillon provient, de préférence, d'un
individu ayant
une maladie associée à la PAF3.
[0094] Pour pouvoir suivre l'efficacité d'un traitement, le premier
échantillon et le second
échantillon sont prélevés sur le patient à des moments différents, par exemple
le
premier échantillon est prélevé à un temps T1 et le deuxième échantillon est
prélevé à
un temps T2. Avantageusement, le premier échantillon est prélevé avant le
second
échantillon, par exemple le premier échantillon est prélevé à un temps Ti
avant le
traitement du patient ou au cours dudit traitement, et le second échantillon
est prélevé à
un temps T2 après ledit traitement ou au cours dudit traitement. Le temps qui
s'écoule
entre le prélèvement du premier échantillon et le prélèvement du second
échantillon
sera choisi pour pouvoir détecter une efficacité thérapeutique du traitement.
[0095] Procédé de suivi de mesure de l'efficacité pharmacologique
[0096] La présente invention concerne également un procédé in vitro de mesure
de
l'efficacité pharmacologique d'une molécule médicament ou d'un candidat
médicament
sur une maladie associée à une PAU; dans un échantillon test, comprenant les
étapes
suivantes :
A) Mettre en uvre le procédé selon l'invention sur un premier échantillon
dudit
échantillon test, dans lequel l'étape e) consiste à déterminer le ratio entre
la teneur
mesurée à l'étape b) et la teneur mesurée à l'étape d) ( Ratio b)/d) de
l'échantillon
1 ) ;
B) Mettre en oeuvre un même procédé qu'à l'étape A) sur un second échantillon
dudit
échantillon test, pour déterminer le Ratio b)/d) de l'échantillon 2 ;
C) Comparer les ratios déterminés aux étapes A) et B), dans lequel une
efficacité
pharmacologique est observée lorsque le ratio déterminé à l'étape B) est
inférieur au
ratio déterminé à l'étape A).
[0097] La molécule peut être un médicament ou un candidat médicament.
L'échantillon
provient, de préférence, de cellules ou d'un tissu cultivé(es) in vitro. Par
conséquent, la
molécule médicament ou le candidat médicament est de préférence testé sur un
modèle
in vitro de maladie associée à une PAF3. De tels modèles sont largement
décrits dans la
littérature.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
18
[0098] L'échantillon test correspond à un échantillon qui permet de tester in
vitro un
médicament ou un candidat médicamin échantillon de
cellules cultivé in vitro ou un échantillon de tissu cultivé in vitro.
L'échantillon test
correspond à ce qu'on appelle couramment un modèle in vitro de maladie
associée à
une PAF 3 . Ainsi, pour pouvoir mesurer l'efficacité pharmacologique d'une
molécule
médicament ou d'un candidat médicament, le premier échantillon et le second
échantillon sont prélevés à partir de l'échantillon test à des moments
différents, par
exemple le premier échantillon est prélevé à un temps T1 et le second
échantillon est
prélevé à un temps T2. Avantageusement, le premier échantillon est prélevé
avant le
second échantillon, par exemple le premier échantillon est prélevé à un temps
Ti avant
le traitement de l'échantillon test avec une molécule médicament ou d'un
candidat
médicament, et le second échantillon est prélevé à un temps Ti après ledit
traitement.
Le temps qui s'écoule entre le prélèvement du premier échantillon et le
prélèvement du
second échantillon sera choisi pour pouvoir détecter une efficacité
pharmacologique de
la molécule médicament ou du candidat médicament.
[0099] La présente invention sera maintenant illustrée par les exemples non
limitatifs
suivants.
EXEMPLES
[0100] Exemple 1: Méthode permettant d'identifier des anticorps spécifiques
d'une PNAFI3
[0101] Génération d'anticorps anti-PNA93
[0102] Immunisations des souris
[0103] Des souris BALB/c sont immunisées par injection de la protéine PNA93
préalablement
diluée dans du tampon phosphate préparé en conditions physiologiques.
L'absence de
présence de multimères ou d'agrégats de la PNA93 est vérifiée dans le tampon
destiné à
réaliser les injections afin de diriger la réponse immune des souris sur les
formes non-
agrégées. La primo-injection est suivie de trois rappels à intervalle d'un
mois.
[0104] Quinze jours après chaque injection, des ponctions sanguines sont
réalisées sur les
souris pour vérifier la présence d'une réponse immunitaire par titration des
anticorps.
[0105] Titration des immun-sérums en anticorps anti-PNAFb par tests ELISA
[0106] Pour cela, des tests d'immuno-détection de type ELISA sont mis en place
en fonction
de la nature de la P93. Pour les P93 de type amyloïde ou les peptides, de la
PNA93 est
préalablement marquée sur ses lysines primaires avec de la biotine par
l'utilisation d'un
réactif composé de biotine, d'un linker carboné et d'un groupement réactif NHS
(N-
Hydroxysuccinimide). Pour les P93 hors amyloïde ou non, de la PNAFa en fusion
GST est
directement immobilisée sur des plaques 96 puits via le tag GST par
l'utilisation de
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
19
microplaques ELISA fonctionnalisées avec un groupement glutahion. Les
protéines
marquées à la biotine sont immobilisémia la biotine par
l'utilisation de microplaques fonctionnalisées avec de la streptavidine. Pour
cela, 100 pL
de solution de PNAF13 en fusion GST et/ou biotinylées sont ajoutées dans
chaque puits
puis incubées pendant 2h à température ambiante. Les puits sont ensuite lavés
trois fois
en tampon PBS supplémenté de 0.05% de Tween-20. Après retrait de la solution
de
lavage, chaque puits est ensuite incubé pendant toute une nuit à 4 C avec 200
pL d'une
solution de saturation composée de PBS, 5% BSA.
[0107] Les dilutions sérielles d'un facteur 10 à 100 millions des ponctions
sanguines
(immun-sérums) sont ensuite ajoutées, en doublets, à hauteur de 100 pL par
puit en
tampon PBS + 0.1% BSA et incubées sous agitation pendant 2h. Les anticorps non
spécifiques non fixés à la PNAF13 immobilisée sont éliminés par trois étapes
de lavages
de 200 pL en tampon PBS 1X, 0.05% Tween20. La présence éventuelle d'anticorps
spécifiques est détectée à l'aide de 100 pL par puits d'anticorps secondaire
anti-Fc de
souris couplé à la HRP (horseradish peroxidase) (Sigma #A0168 diluée au 1/10
000 dans
du PBS, BSA 0.1%). Après 1h d'incubation à température ambiante sous agitation
puis
trois lavages sous 200 pL en tampon PBS 1X, 0.05% Tween20, la révélation de la
HRP
est réalisée par dosage colorimétrique à 450 nm suite à l'incubation de son
substrat TMB
(3,3',5,5'-Tétraméthylbenzidine, Sigma #T0440) pendant 20 min à température
ambiante et sous agitation. Cette solution de saturation est ensuite retirée
par aspiration
et les plaques sont stockées à 4 C en vue d'une utilisation future.
[0108] Afin de s'assurer que les anticorps détectés par le test ELISA sont
bien dirigés contre
la protéine PNAF13 et non contre le tag GST ou la biotine, les mêmes ponctions
sont
testées sur le test ELISA après pré-incubation avec un excès d'une autre
protéine
orthogonale tagguée avec la GST ou la biotine. Ainsi, les anticorps anti-TAG
se fixent sur
la protéine orthogonale taguée et donc pas sur la protéine PNAF13 immobilisée
au fond
des puits ; auquel cas aucun signal HRP ou une diminution du signal HRP est
détecté.
[0109] Fusion & clonages
[0110] Les souris présentant les meilleurs titres d'anticorps anti-PNAF13
(signal, c'est-à-dire
densité optique à 450 nm élevée) et le moins de baisse de signal dans le cas
contrôle
anti-TAG sont sélectionnées pour l'étape suivante d'hybridation lymphocytaire,
aussi
appelée fusion. La rate des souris est extraite afin d'isoler un mélange des
lymphocytes
et plasmocytes. Cet échantillon pluri-cellulaire est fusionné i vitro avec
une lignée
cellulaire de myélome en présence d'un catalyseur de la fusion cellulaire du
type
polyéthylène glycol (PEG). Une lignée cellulaire de myélome mutante,
déficiente pour
l'enzyme HGPRT (Hypoxanthine Guanosin Phosphoribosyl Transferase) est utilisée
pour
permettre une sélection des cellules hybrides, appelées hybridomes. Ces
cellules sont
cultivées dans un milieu contenant de l'hypoxanthine, de l'aminopterine
(methotrexate)
et de la thyamine (milieu HAT), pour permettre l'élimination des cellules de
myélome
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
non fusionnées et ainsi sélectionner les hybridomes d'intérêt. Les cellules de
rate non
fusionnées quant à elle meurent puiscer in vitro. Ainsi,
seuls les hybridomes survivent à cette pression de sélection in vitro.
[0111] Ces hybridomes sont cultivés dans des plaques de culture. Les
surnageants de ces
5 hybridomes sont testés pour évaluer leur capacité à produire des
anticorps anti-PNAFp.
Pour cela, un test ELISA comme décrit ci-dessus est réalisé. Le seuil minimal
retenu pour
sélectionner un clone est de quatre fois celui du non spécifique. Les
meilleurs
hybridomes sont clonés avec une étape de dilution limite afin d'obtenir des
clones
stables d'hybridome.
10 [0112] Les clones retenus sont mis en culture en vue de constituer une
banque
d'hybridomes, testés en viabilité cellulaire et stockés dans de l'azote
liquide. A cette
étape, les anticorps produits par les clones peuvent être facilement séquences
par des
méthodes bien décrites dans l'art antérieur afin de pouvoir produire les
anticorps, par
exemple, dans des cellules productrices. Alternativement, les anticorps sont
produits
15 comme décrit ci-après.
[0113] Production d'anticorps anti-PNAFI3
[0114] Les clones d'hybridomes d'intérêt sont remis en culture et l'inoculum
cellulaire est
ensuite injecté dans des souris BALB/c (injection intra-péritonéale, IP) afin
de permettre
la production des anticorps en grande quantité dans le liquide d'ascite.
20 [0115] Après caractérisation du contenu des liquides d'ascites par
diverses techniques visant
à quantifier et à qualifier le contenu en anticorps, ceux-ci sont ensuite
purifiés après
précipitation éventuelle par des sels, via une chromatographie d'affinité sur
des colonnes
comportant des résines greffées avec la protéine A. Après lavage de la colonne
pour
éliminer les constituants en dehors des anticorps, le contenu en anticorps est
élue par un
choc à pH acide en tampon glycine. Après neutralisation du pH et dialyse
contre un
tampon à pH neutre, les anticorps anti-PNAFp sont prêts pour stockage à 4 C ou
congélation et utilisation/caractérisation ultérieures (isotypage, dosage,
tests
fonctionnels).
[0116] Sélection d'une paire d'anticorps capable de se lier spécifiquement à
une PNAFp
(méthode ELISA)
[0117] Afin de sélectionner une paire d'anticorps reconnaissant
préférentiellement une
PNAFp vis-à-vis d'une PAFp, un test de type ELISA est mis en place. Pour se
faire, un
des anticorps de la paire testée est biotinylé en utilisant le kit Lightning-
Link Rapid Biotin
Type A (Expedeon, référence SKU 370-0005) selon les recommandations du
fournisseur.
Le deuxième anticorps de la paire testée, préalablement dilué en tampon PBS à
des
concentrations comprises entre 1 et 20 pg/mL, est adsorbé sur des plaques 96
puits de
type ELISA high binding . Pour cela 100 pL d'anticorps sont ajoutés dans
chaque
puits puis incubés pendant 20h à 4 C suivi de trois lavages en tampon PBS lx,
0.05%
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
21
Tween20. Après retrait de la solution de lavage, chaque puits est ensuite
incubé pendant
toute une nuit à 4 C avec 200 pL d'tsée de PBS, 5%
BSA. Cette solution de saturation est ensuite retirée par aspiration et les
plaques sont
stockées à 4 C en vue d'une utilisation future.
[0118] Des dilutions sérielles d'un facteur 1 à 1/100ème d'échantillons
contenant la même
concentration initiale de PNAF5 ou de PAFP sont ajoutées à hauteur de 100
pL/puit et
incubées pendant 2h à température ambiante sous agitation. Les PNAFp ou PAFp
non
fixés à l'anticorps adsorbé sur les plaques sont éliminés par trois étapes de
lavages en
tampon PBS 1X, 0.05% Tween20. L'anticorps biotinylé, préalablement dilué en
tampon
PBS à une concentration comprise entre 10 et 200 ng/nnL, est ajouté à hauteur
de 100
pL/puits et incubé pendant 2h à température ambiante sous agitation. Les
anticorps
biotinylés non fixés aux PNAFp ou PAFp sont éliminés par trois étapes de
lavages en
tampon PBS 1X, 0.05% Tween20. La détection des anticorps fixés est réalisée à
l'aide
d'une streptavidine-HRP (R&D Systems, Réf. DY998) diluée au 1/10ème dans du
PBS,
BSA 0.1%. Après 30 minutes d'incubation à température ambiante sous agitation,
puis
trois lavages en tampon PBS 1X, 0,05% Tween20, la révélation de la HRP est
réalisée
par mesure de la densité optique à 450 nm (D.O. 450 nm) suite à l'incubation
de son
substrat TMB (3,3',5,5'-Tétraméthylbenzidine, Sigma #T0440) pendant 20 min à
température ambiante sous agitation.
zo
[0119] Dans une première étape, la dilution de référence des échantillons de
PNAFP ou
PAFp est déterminée en analysant la D.O. 450 nm mesurée avec les différentes
dilutions
de PNAFp. Comme indiqué dans la Figure 2, la dilution de référence est celle
pour
laquelle 80% de la D.O. 450nm maximale est obtenue.
[0120] Dans une deuxième étape, la D.O. 450nm obtenue avec la dilution de
référence de
l'échantillon de PNAFp est comparée avec la D.O. 450 nm mesurée avec une
dilution
identique de l'échantillon de PAFp. Comme illustré dans la Figure 3, une paire
d'anticorps
capable de se lier spécifiquement à la PNAFp donnera une D.O. 450nm 50% plus
faible
sur l'échantillon PAFp par rapport à la D.O. 450 nm mesurée sur l'échantillon
PNAFp.
[0121] Sélection d'une paire d'anticorps capable de se lier spécifiquement à
une PNAFp
(méthode FRET)
Afin de sélectionner une paire d'anticorps reconnaissant préférentiellement
une PNAFp
vis-à-vis d'une PAFp, un test de FRET est mis en place. Ce test est basé sur
la
Technologie HTRFC) de Cisbio Bioassays. Le principe de cette technique repose
sur un
transfert d'énergie de fluorescence entre une molécule donneuse, un cryptate
de
Terbium (Donneur), et une molécule fluorescente acceptrice d'énergie le d2
(Accepteur).
Ces deux molécules fluorescentes sont greffées par couplage covalent à des
anticorps
pour mettre en oeuvre un dosage immunologique tel qu'illustré à la Figure 4.
Pour se
faire, un des anticorps de la paire testée est marqué avec le donneur Lumi4
Terbium en
utilisant le kit Terbium Cryptate labeling kit (Cisbio Bioassays, référence
62TBSPEA)
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
22
selon les recommandations du fabricant. Avant utilisation, l'anticorps marqué
au donneur
est dilué dans un tampon Hepes 20rruentration de 0.5
nM. Le deuxième anticorps de la paire testée est marqué avec l'accepteur d2 en
utilisant
le kit d2 labeling kit (Cisbio Bioassays référence 62D2DPEA) selon les
recommandations
du fournisseur. Avant utilisation, l'anticorps marqué au donneur est dilué
dans un
tampon Hepes 20mM pH=7.4, BSA 0.1% à une concentration de 5nM. Des dilutions
sérielles d'un facteur 1 à 1/100ème d'échantillons contenant la même
concentration
initiale de PNAFp ou de PAFp sont distribuées dans une microplaque 384 à
hauteur de
16pL/puits. 2pL de la solution à 0.5nM d'anticorps marqué au donneur et 2pL de
la
solution à 5 nM d'anticorps marqué à l'accepteur sont ensuite ajoutés dans
chaque puits.
La microplaque est incubée 20 h à température ambiante. La détection du signal
de
FRET dans les différentes plaques été réalisée sur un appareil PHERAstar FS
Lamp (BMG
Labtech) en utilisant un module de détection HTRF.
[0122] Dans une première étape, la dilution de référence des échantillons de
PNAFp ou
PAFp est déterminée en analysant le signal HTRF mesuré avec les différentes
dilutions
de PNAFp. Comme indiqué dans la Figure 5, la dilution de référence est celle
pour
laquelle 80% du signal HTRF maximum est obtenu, avant le plateau de saturation
de
l'immuno-essai.
[0123] Dans une deuxième étape, le signal HTRF obtenu avec la dilution de
référence de
l'échantillon de PNAFp est comparé avec le signal HTRF mesuré avec une
dilution
identique de l'échantillon de PAFp. Comme illustré dans la Figure 6, une paire
d'anticorps
capable de se lier spécifiquement à la PNAFP donnera un signal HTRF 50% plus
faible
sur l'échantillon PAFP par rapport au signal HTRF mesuré sur l'échantillon
PNAFP.
[0124]
Exemple 2: Méthode permettant d'identifier des couples d'anticorps
capables de se lier spécifiquement à la TDP-43 NAFI3 (Méthode FRET)
[0125] Une méthode alternative d'obtention d'échantillons contenant des TDP-43
AFp ou
des TDP-43 NAFP consiste à cultiver des cellules HeLa et à les traiter ou non
pendant au
moins 6h par de la staurosporine. L'analyse des lysats cellulaires réalisée
par SDS-PAGE
et Western-Blot montre que les lysats de cellules HeLa non traitées
contiennent des
TDP-43 NAFp tandis que les lysats de HeLa traités à la staurosporine
contiennent
essentiellement des TDP-43 AFp [12].
[0126] La méthode est basée sur la technologie FRET (Technologie HTRF de
Cisbio
Bioassays) décrite dans l'exemple 1.
[0127] Préparation des anticorps à tester
[0128] Cinq anticorps dirigés contre TDP-43 ont été marqués respectivement
avec le
Donneur et avec l'Accepteur. Ces marquages ont été réalisés en utilisant les
kits de
marquage commercialisés par Cisbio Bioassays (Références commerciales 62EUSUEA
et
62D2DPEA). Les taux de marquage obtenus (nombre de molécules fluorescentes par
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
23
anticorps) étaient conformes aux attentes. Les taux de marquage au Donneur
étaient
compris entre 5.9 et 7.9. Les taux de ompris entre 2.3
et 3.3.
[0129] Le tableau ci-dessous donne les caractéristiques des anticorps qui ont
été testés.
[0130] [Table 1]
Identification de Référence
Fournisseur
l'anticorps commerciale
Ac1 SIG-39854 Biolegend
Ac2 89789BF Cell Signaling
Technology
Ac3 MABN774 Merck Millipore
Ac4 ab238443 Abcam
Ac5 ab248546 Abcam
[0131] Pour être testés, tous les anticorps ont été dilués dans un tampon pour
obtenir des
concentrations respectives de 3 nM pour les anticorps marqués au Donneur et de
30 nM
pour ceux marqués à l'Accepteur.
[0132] Préparation d'un échantillon de TDP-43 NAFB (Monomères)
[0133] Des cellules HeLa ont été ensemencées à 5 millions de cellules en
flasque (175 cm2)
en milieu de culture complet (MEM alpha medium + 2 mM Hepes + 10% sérum de
veau
foetal décomplémenté + 1% d'antibiotiques, Pénicilline 5000 ( mi et
Streptomycine 5000
pg/ml). Après 78 heures, le milieu de culture a été aspiré. Les cellules ont
ensuite été
lysées avec un tampon de lyse cellulaire. Le lysat obtenu (ci-après
échantillon
Monomères ), contenant la TDP-43 NAF13, a été congelé à -80 C en vue de son
utilisation. Un contrôle de cet échantillon a été réalisé par western blot
comme préconisé
dans la littérature [12] afin de s'assurer que celui-ci contient
essentiellement de la
TDP43 non agrégée (TDP-43 NAF[3).
[0134] Préparation d'un échantillon de TDP-43 AFB (Agrégats)
[0135] Des cellules HeLa ont été ensemencées à 5 millions de cellules en
flasque (175 cm2)
en milieu de culture complet (MEM alpha medium + 2 mM Hepes + 10% sérum de
veau
foetal décomplémenté + 1% d'antibiotiques, Pénicilline 5000 U/ml et
Streptomycine 5000
pg/ml). Après 72 heures, le milieu de culture a été aspiré. Une solution de
staurosporine
à 1 pM en milieu complet a été ajoutée sur les cellules en culture pendant 6h.
Le
traitement des cellules à la staurosporine permet d'agréger TDP-43 pour
obtenir des
TDP-43 AFB. Le milieu de culture a ensuite été aspiré avant d'ajouter un
tampon de lyse
cellulaire. Le lysat obtenu (ci-après échantillon Agrégats ), contenant la
TDP-43 AFB,
a été congelé à -80 C en vue de son utilisation ultérieure. Un contrôle de cet
échantillon
a été réalisé par western blot comme préconisé dans la littérature [12] afin
de s'assurer
que celui-ci contient essentiellement de la TDP43 agrégée (TDP-43 AFI3).
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
24
[0136] Criblage des paires d'anticorps sur les Monomères ou les Agrégats
_
I-01371 Le jour du test, es échantillons écongelés avant
distribution dans des microplaques 384 puits (Greiner référence 784075).
[0138] Les réactifs suivants ont été ajoutés dans les microplaques selon
l'ordre ci-dessous :
- 16 pL d'échantillon Monomères ou d'échantillon Agrégats,
- 2 pL d'anticorps Donneur
- 2 pL d'anticorps Accepteur
[0139] Les plaques ont ensuite été incubées une nuit à température ambiante.
[0140] La détection du signal de FRET dans les différentes plaques a été
réalisée sur un
appareil PHERAstar FS Lamp (BMG Labtech) en utilisant un module de détection
HTRF.
Pour toutes les paires d'anticorps testés, les signaux obtenus en FRET sur
l'échantillon
Monomères et sur l'échantillon Agrégats ont été comparés en calculant un
rapport des
signaux de FRET (Monomères / Agrégats), tel qu'illustré dans la Figure 7 avec
la paire
Ac1-Donneur / Ac4-Accepteur.
[0141] Le rapport des signaux de FRET (Monomères / Agrégats) a été calculé
pour toutes
les paires d'anticorps testés. Le tableau 2 ci-dessous récapitule les
résultats obtenus.
Toutes les paires d'anticorps présentant un rapport (Monomère / Agrégats)
supérieur à 2
sont considérées sélectives de la TDP-43 NAFp vis-à-vis de la TDP-43 AFp.
[0142] [Table 2]
Donneur
_____________________________ Acl Ac2 Ac3 Ac4 Ac5
Acl 5.5 1.0 1.1 4.2
Ac2 2.2 1.1 1.1 1.9
Ac3 1.1 0.9 1.1 1.0
0-
al
Ac4 6.0 1.3 1.0 2.9
Ac5 3.9 3.0 1.0 1.1
[0143] 7 paires d'anticorps ont permis de discriminer la TDP-43 NAFp de la TDP-
43 AFp car
elles présentent un rapport Monomère / Agrégats supérieur à 2. Elles sont
listées dans le
tableau 3.
[0144] [Table 3]
Donneur Accepteur
Acl Ac2
Acl Ac4
Ad. Ac5
Ac2 Acl
Ac2 Ac5
Ac5 Acl
Ac5 Ac4
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
[0145] Exemple 3: Méthode permettant d'identifier des couples
d'anticorps
capable de se lier spécifiquemde 1-40 NAFI3
(Méthode FRET)
[0146] La méthode est basée sur la technologie FRET (Technologie HTRF de
Cisbio
5 Bioassays), comme détaillé dans l'exemple 1.
[0147] Paire d'anticorps testée
[0148] Les anticorps dirigés contre le peptide beta amyloïde 1-40 marqués
respectivement
au Donneur et à l'Accepteur sont ceux contenus dans le kit Amyloid Beta 1-40
HTRF
commercialisé par Cisbio Bioassays (référence 62B4OPEG). Ils ont été dilués
dans le
10 diluant référence 62RB3FDG tel que préconisé par le manuel du kit
Amyloid Beta 1-40
HTRF.
[0149] Préparation de peptide beta amyloïde 1-40 NAFp (Monomères)
[0150] Le peptide amyloïde beta 1-40 humain lyophilisé (ERI275BAS, The ERI
Amyloid
Laboratory, LLC, Oxford) a été re-suspendu selon les recommandations du
fournisseur
15 puis dilué en tampon 10 mM Sodium Phosphate pH 7,4 à une concentration
de 30 pM.
La solution (ci-après échantillon Monomères ), contenant le peptide
amyloïde beta 1-
40 NAFP, a ensuite été congelée à -80 C. Un test à la Thioflavine T a été
réalisé sur
cette solution. Il indique que celle-ci contient plus de 90% de monomères de
peptide
beta amyloïde 1-40.
20 [0151] Préparation de peptide beta amyloïde 1-40 AFP (Agrégats)
[0152] Le peptide amyloïde beta 1-40 humain lyophilisé (ERI275BAS, The ERI
Amyloid
Laboratory, LLC, Oxford) a été re-suspendu selon les recommandations du
fournisseur
puis dilué en tampon 10 mM Sodium Phosphate pH 7,4 à une concentration de
30pM.
Cette solution est ensuite incubée 495 heures à 25 C, ce qui permet d'agréger
le peptide
25 beta amyloïde 1-40 pour obtenir le peptide beta amyloïde 1-40 AFP. La
solution (ci-après
échantillon Agrégats ), contenant le peptide beta amyloïde 1-40 AFp, a
ensuite été
congelée à -80 C. Un test à la Thioflavine T a été réalisé sur cette solution.
Il indique
que celle-ci contient plus de 90% d'agrégats de peptide beta amyloïde 1-40.
[0153] Test de la paire d'anticorps sur les Monomères ou les Agrégats
[0154] Le jour du test, les échantillons Monomères et Agrégats ont été
décongelés puis
dilués en tampon 10 mM Sodium Phosphate pH 7,4 à une concentration de 20,3
ng/mL
avant distribution dans une microplaque 384 puits (Greiner référence 784075).
[0155] Les réactifs suivants ont été ajoutés dans les microplaques selon
l'ordre ci-dessous :
- 5 pL d'échantillon Monomère ou d'échantillon Agrégat
- 5 pL de diluant (Réf. 62DL1DDD, Cisbio Bioassays)
- 5 pL d'anticorps Donneur
- 5 pL d'anticorps Accepteur
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
26
[0156] Les plaques ont ensuite été incubées une nuit à une température
comprise entre 2 C
et 8 C.
[0157] La détection du signal FRET dans les différentes plaques été réalisée
sur un appareil
PHERAstar FS Lamp (BMG Labtech) en utilisant un module de détection HTRF. Les
signaux obtenus en FRET sur l'échantillon Monomères et sur l'échantillon
Agrégats ont
été comparés en calculant le rapport des signaux de FRET (Monomères /
Agrégats) tel
que montré à la Figure 8.
[0158] Le rapport des signaux de FRET (Monomère / Agrégat) de la paire
d'anticorps est
supérieur à 2 (valeur de 3,1). Cela indique que cette paire d'anticorps
discrimine le
peptide beta amyloïde 1-40 NAFp du peptide beta amyloïde 1-40 AFE, c'est-à-
dire que
cette paire d'anticorps est spécifique du peptide beta amyloïde 1-40 NAFp.
[0159] Exemple 4: Méthode permettant d'identifier des couples
d'anticorps
capable de se lier spécifiquement au peptide amyloïde beta 1-42 NAFI3
(Méthode FRET)
[0160] La méthode est basée sur la technologie FRET (Technologie HTRFC) de
Cisbio
Bioassays), comme détaillé dans l'exemple 1.
[0161] Paire d'anticorps testée
[0162] Deux anticorps dirigés contre le peptide amyloïde beta 1-42 marqués
respectivement
au Donneur et à l'Accepteur ont été dilués à des concentrations respectives de
3 nM
(Donneur) et 30 nM (Accepteur).
[0163] Préparation de peptide beta amyloïde 1-42 NAFp (Monomères)
[0164] Le peptide amyloïde beta 1-42 humain lyophilisé (The ERI Amyloid
Laboratory, LLC,
Oxford) a été re-suspendu selon les recommandations du fournisseur puis dilué
en
tampon 10 mM Sodium Phosphate pH 7,4 à une concentration de 30 pM. La solution
(ci-
après échantillon Monomères ), contenant le peptide beta amyloïde 1-42
NAFp, a
ensuite été congelée à -80 C. Un test à la Thioflavine T a été réalisé sur
cette solution. Il
indique que celle-ci contient plus de 90% de monomères de peptide beta
amyloïde 1-42.
[0165] Préparation de peptide beta amyloïde 1-42 AFp (Agrégats)
[0166] Le peptide amyloïde beta 1-42 humain lyophilisé (ERI275BAS, The ERI
Amyloid
Laboratory, LLC, Oxford) a été re-suspendu selon les recommandations du
fournisseur
puis dilué en tampon 10 nnM Sodium Phosphate pH 7,4 à une concentration de 30
pM.
Cette solution est ensuite incubée 188 heures à 25 C. La solution (ci-après
échantillon
Agrégats ), contenant le peptide beta amyloïde 1-42 AFp, a ensuite été
congelée à -
80 C. Un test à la Thioflavine T a été réalisé sur cette solution. Il indique
que celle-ci
contient plus de 90% d'agrégats de peptide beta amyloïde 1-42.
[0167] Test de la paire d'anticorps sur les Monomères ou les Agrégats
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
27
[0168] Le jour du test, les échantillons Monomère et Agrégat ont été
décongelés puis dilués
en tampon 10 mM Sodium PhosphatE2,4 ng/mL avant
distribution dans des microplaques 384 puits (Greiner référence 784075).
[0169] Les réactifs suivants ont été ajoutés dans les microplaques selon
l'ordre ci-dessous :
- 16 pL d'échantillon Monomères ou d'échantillon Agrégats
- 2 pL d'anticorps Donneur
- 2 pL d'anticorps Accepteur
[0170] Les plaques ont été incubées une nuit à température comprise entre 2 C
et 8 C.
[0171] La détection du signal FRET dans les différentes plaques été réalisée
sur un appareil
PHERAstar FS Lamp (BMG Labtech) en utilisant un module de détection HTRF. Le
signal
obtenu en FRET sur l'échantillon Monomères et sur l'échantillon Agrégats ont
été
comparés en calculant le rapport des signaux de FRET (Monomère / Agrégats) tel
que
montré à la Figure 9.
[0172] Le rapport des signaux de FRET (Monomère / Agrégat) de la paire
d'anticorps
étudiée est supérieur à 2 (valeur de 4,5). Cela indique que cette paire
d'anticorps
discrimine la amyloïde beta 1-42 NAFB de la amyloïde beta 1-42 AFB, c'est-à-
dire que
cette paire d'anticorps est spécifique du peptide amyloïde beta 1 -42 NA93.
[0173] Exemple 5 : Test de l'effet du Hexafluoroisopropanol
(HFIP) sur la
capacité de détection d'une méthode utilisant une paire d'anticorps capable
de se lier spécifiquement au TDP-43 NAFI3
[0174] Le HFIP a été utilisé pur (100%) ou dilué dans du tampon de lyse pour
obtenir des
solutions à 20%, 10% et 2%.
[0175] Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre
suivant:
1) 8 pL d'un échantillon de TDP-43 NAFB préparé selon le protocole décrit à
l'Exemple 2.
2) 8 pL des différentes solutions de HFIP à 100%, 20%, 10% et 2% ou de tampon
de
lyse supplémenté.
3) Ajout des réactifs de détection FRET :
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0176] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0177] La Figure 10 donne les signaux obtenus avec les différentes
concentrations de HFIP
testées. Pour des concentrations supérieures à 2%, le HFIP diminue de plus de
75% le
signal de détection du TDP-43 NAFB. Son effet éventuel sur les agrégats sera
donc
évalué dans ce format avec une concentration de 2%.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
28
[0178]
Exemple 6 : Test du HFIP comme agent désagrégeant deTDP-43 AFP
1-01791 Le HFIP a été dilué dans du tamp à 2%.
[0180] Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre
suivant:
1) 8 pL d'un échantillon de TDP-43 AFB préparé selon le protocole décrit à
l'exemple 2.
2) 8 pL d'une solution de HFIP à 2% ou de tampon de lyse.
3) Ajout des réactifs de détection FRET :
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0181] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0182] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
[0183] Ratio des signaux = (Signal échantillon traité avec le HFIP 2%) /
(Signal échantillon
traité avec tampon de lyse).
[0184] La Figure 11 donne les résultats obtenus. Le ratio des signaux est
inférieur ou égal à
1 (0.89) ce qui indique que le traitement au HFIP 2% n'augmente pas la
détection du
PNAFB dans l'échantillon contenant TDP-43 AFB. On peut en conclure que le
traitement
au HFIP 2% ne permet pas de désagréger, même partiellement, TDP-43 AFP.
[0185]
Exemple 7 : Test de l'effet de l'Urée sur la capacité de détection
d'une méthode utilisant une paire d'anticorps capable de se lier
spécifiquement au TDP-43 NAF8
[0186] L'urée a été diluée dans du tampon de lyse pour obtenir des solutions à
7M, 3,5M,
1,75 M et 0,88 M.
[0187] Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre
suivant :
1) 8 pL d'un échantillon de TDP-43 NAF13 préparé selon le protocole décrit à
l'Exemple 2.
2) 8 pL des différentes solutions d'Urée à 7M, 3,5M, 1,75M et 0,88M ou de
tampon de
lyse.
3) Ajout des réactifs de détection FRET :
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0188] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques été réalisée sur un appareil
PHERAstar FS Lamp
(BMG Labtech) en utilisant un module de détection HTRF.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
29
[0189] La Figure 12 donne les signaux obtenus avec les différentes
concentrations d'Urée
testées. Pour des concentrations supé plus de 75% le
signal de détection du TDP-43 NAF13. Son effet éventuel sur les agrégats sera
donc
évalué dans ce format avec des concentrations inférieures ou égales à 3,5M.
[0190] Exemple 8 : Test de l'Urée comme agent désagrégeant de TDP-43
AFI3
[0191] L'urée a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
3,5 NI, 1,75 M et 0,88 M.
[0192] Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre
suivant :
1) 8 pL d'un échantillon de TDP-43 AFB préparé selon le protocole décrit à
l'Exemple 2.
2) 8 pL d'une solution d'Urée aux différents concentrations (3,5 M, 1,75 M et
0,88 M) ou
de tampon de lyse.
3) Ajout des réactifs de détection FRET :
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2.
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0193] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0194] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
[0195] Ratio des signaux = (Signal échantillon traité avec l'Urée 3,5M) /
(Signal échantillon
traité avec tampon de lyse supplémenté).
[0196] La Figure 13 donne les résultats obtenus. Le ratio des signaux est
inférieur ou égal à
1 pour toutes les concentrations d'Urée testées ce qui indique que ces
traitements
n'augmentent pas la détection de TDP-43 PNAFB dans l'échantillon agrégat. On
peut en
conclure qu'un traitement avec des concentrations d'Urée inférieures ou égales
à 3,5M
ne permet pas de désagréger, même partiellement, TDP-43 AFB.
[0197] Exemple 9 : Test de l'effet du chlorure de Guanidinium
sur la
capacité de détection d'une méthode utilisant une paire d'anticorps capable
de se lier spécifiquement au TDP-43 NAFI3
[0198] Le Chlorure de Guanidinium a été dilué dans du tampon de lyse
supplémenté pour
obtenir des solutions à 6 M, 3 M et 1,5 M.
[0199] Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre
suivant :
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
1) 8 pL d'un échantillon de TDP-43 NAFB préparé selon le protocole décrit à
l'Exemple 2.
2) 8 pL des différentes solutions de 01 et 1,5 M ou de
tampon de lyse supplémenté.
3) Ajout des réactifs de détection FRET :
5 - 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0200] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
10
[0201] La Figure 14 donne les signaux obtenus avec les différentes
concentrations de
Chlorure de Guanidinium testées. Quelle que soit sa concentration, le Chlorure
de
Guanidinium diminue de plus de 75% le signal de détection de TDP-43 NAFB. Son
effet
éventuel sur les agrégats ne pourra donc pas être évalué dans ce format car ce
composé
empêche la détection de TDP-43 NAFB.
15 [0202]
Exemple 10 : Test de l'effet l'Acide Formique (AF) et l'Acide
Trifluoroacétique (TFA) sur la capacité de détection d'une méthode utilisant
une paire d'anticorps capable de se lier spécifiquement au TDP-43 NAFI3
[0203] L'AF et le TFA ont été dilués dans du tampon de lyse supplémenté pour
obtenir des
solutions à 20%, 10% et 2%.
20
[0204] Les réactifs suivants ont été distribués dans une plaque 384
puits dans l'ordre
suivant:
1) 8pL d'un TDP-43 NAFB préparé selon le protocole décrit à l'Exemple 2.
2) 8pL des différentes solutions de d'AF ou de TFA à 20%, 10% et 2% ou de
tampon de
lyse supplémenté.
25 3) Ajout des réactifs de détection FRET :
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0205] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
30 Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0206] La Figure 15 donne les signaux obtenus avec les différentes
concentrations d'AF ou
de TFA testées. Quelle que soit leurs concentrations, ces réactifs diminuent
de plus de
75% le signal de détection du TDP-43 NAFB. Leur effet éventuel sur les
agrégats ne
pourra donc pas être évalué dans ce format car ils empêchent la détection de
TDP-43
NAFB.
[0207]
Exemple 11 : Test de l'effet de l'acide formique (AF) suivi d'une
neutralisation au NaOH sur la capacité de détection d'une méthode utilisant
une paire d'anticorps capable de se lier spécifiquement au TDP-43 NAM
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
31
[0208] L'AF a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
20%.
[0209] Le NaOH a été dilué dans un tampon HEPES 450mM pour obtenir une
solution 5N
[0210] Les réactifs suivants ont été distribués dans une plaque 96 puits dans
l'ordre suivant:
1) 60 pL d'un échantillon de TDP-43 NAFp préparé selon le protocole décrit à
l'Exemple
2.
2) 8 pL d'une solution d'AF à 20% ou de tampon de lyse supplémenté. Le mélange
a été
incubé 15 minutes à température ambiante. Le pH mesuré à cette étape est égal
à 2,5.
3) 9 pL d'une solution de NaOH 5N ou de tampon de lyse supplémenté. Le pH
mesuré
après ces ajouts est égal à 7,6.
[0211] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Acl Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0212] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0213] La Figure 16 compare le signal de détection de la PNAFp obtenu avec le
traitement
AF puis NaOH avec celui obtenu en absence de traitement. Le traitement
provoque une
disparition quasi-totale du signal de détection de TDP-43 NAFp. Leur effet
éventuel sur
la désagrégation de TDP-43 AFp ne pourra donc pas être évalué.
[0214] Exemple 12 : Test de l'effet de l'Acide Trifluoroacétique
(TFA) suivi
d'une neutralisation au NaOH sur la capacité de détection d'une méthode
utilisant une paire d'anticorps capable de se lier spécifiquement au TDP-43
NAM
[0215] Le TFA a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
20%.
[0216] Le NaOH a été dilué dans un tampon HEPES 450 mM pour obtenir une
solution 5N.
[0217] Les réactifs suivants ont été distribués dans une plaque 96 puits dans
l'ordre suivant:
1) 60 pL d'un échantillon de TDP-43 NAFP préparé selon le protocole décrit à
l'Exemple
2.
2) 8 pL d'une solution de TFA à 20% ou de tampon de lyse supplémenté. Le
mélange a
été incubé 15 minutes à température ambiante. Le pH mesuré à cette étape est
égal à
0,6.
3) 4,5 pL d'une solution de NaOH 5N ou de tampon de lyse supplémenté. Le pH
mesuré
après cet ajout est égal à 7,5.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
32
[0218] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajo avec :
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0219] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0220] La Figure 17 compare le signal de détection de la PNAFp obtenu avec le
traitement
TFA puis NaOH avec celui obtenu en absence de traitement. Même si ce
traitement
affecte significativement le signal de détection de TDP-43 NAFp (-62%), le
signal restant
permet de tester celui-ci sur la désagrégation de la TDP-43 AFp.
[0221] Exemple 13 : Test de l'effet de l'Acide Trifluoroacétique
(TFA) suivi
d'une neutralisation au NaOH comme agent désagrégeant de TDP-43 AF13
[0222] Le TFA a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
20%.
[0223] Le NaOH a été dilué dans un tampon HEPES 450 mM pour obtenir une
solution 5 N.
[0224] Les réactifs suivants ont été distribués dans une plaque 96 puits dans
l'ordre suivant:
1) 60 pl d'un échantillon de TDP-43 AFp préparé selon le protocole décrit à
l'Exemple 2.
2) 8 pL d'une solution de TFA à 20% ou d'un mélange TFA/NaOH (obtenu en
mélangeant 8 volumes d'une solution de TFA 20% avec 4.5 volumes d'une solution
de
NaOH 5N). Le mélange a été incubé 15 minutes à température ambiante.
3) 4,5 pL d'une solution de NaOH 5N ou d'un mélange TFA/NaOH. Le pH mesuré
après
cet ajout est égal à 7,5.
[0225] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0226] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0227] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
[0228] Ratio des signaux = (Signal échantillon traité avec TFA 20% puis NaOH
5N) / (Signal
échantillon traité avec le mélange TFA/NaOH).
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
33
[0229] La Figure 18 donne les résultats obtenus. Le ratio des signaux est
inférieur ou égal à
1 (0,56) ce qui indique que le traiterrde TDP-43 NAFB
dans l'échantillon agrégat. On peut en conclure que le traitement au TFA 20%
suivi
d'une neutralisation au NaOH ne permet pas de désagréger, même partiellement,
TDP-
43 AFB.
[0230] Exemple 14 : Test de l'effet de l'acide formique (AF)
suivi d'une
neutralisation au NH4OH sur la capacité de détection d'une méthode utilisant
une paire d'anticorps capable de se lier spécifiquement au TDP-43 NAFI3
[0231] L'AF a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
20%.
[0232] Le NH4OH a été dilué dans un tampon HEPES 450mM pour obtenir une
solution 5N.
[0233] Les réactifs suivants ont été distribués dans une plaque 96 puits dans
l'ordre suivant:
1) 60 pL d'un échantillon de TDP-43 NAFB préparé selon le protocole décrit à
l'Exemple
2.
2) 8 pL d'une solution d'AF à 20% ou de tampon de lyse supplémenté. Le mélange
a été
incubé 15 minutes à température ambiante. Le pH mesuré à cette étape est égal
à 2,5.
3) 12 pL d'une solution de NH4OH 5N. Le pH mesuré après cet ajout est égal à
7,2.
[0234] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0235] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0236] La Figure 19 compare le signal de détection de TDP-43 NAFB obtenu avec
le
traitement AF puis NH4OH avec celui obtenu en absence de traitement. Même si
ce
traitement affecte significativement le signal de détection de la TDP-43 NAFB
(-68%), le
signal restant permet de tester celui-ci sur la désagrégation de TDP-43 AF.
[0237] Exemple 15 : Test de l'effet de l'acide formique (AF) suivi d'une
neutralisation au NH4OH comme agent désagrégeant de TDP-43 AFI3
[0238] L'AF a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
20%.
[0239] Le NI-140H a été dilué dans un tampon HEPES 450mM pour obtenir une
solution 5N
Les réactifs suivants ont été distribués dans une plaque 96 puits dans l'ordre
suivant:
1) 60 pL d'un échantillon de TDP-43 AFB préparé selon le protocole décrit à
l'Exemple 2
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
34
2) 8 pL d'une solution d'AF à 20% ou d'un mélange AF/ NH4OH (obtenu en
mélangeant
8 volumes d'une solution de TFA 20%e NH4OH 5N). Le
mélange a été incubé 15 minutes à température ambiante.
3) 12 pL d'une solution de NH4OH 5N ou d'un mélange AF/ NH4OH. Le pH mesuré
après
cet ajout est égal à 7,2.
[0240] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0241] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0242] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
[0243] Ratio des signaux = (Signal échantillon traité avec AF 20% puis NH4OH
5N) / (Signal
échantillon traité avec le mélange AF/NH4OH).
[0244] La Figure 20 donne les résultats obtenus. Le ratio des signaux est
inférieur ou égal à
1 (0,78) ce qui indique que le traitement n'augmente pas la détection de TDP-
43 NAFB
dans l'échantillon agrégat. On peut en conclure que le traitement à l'AF 20%
suivi d'une
neutralisation au NH4OH ne permet pas de désagréger, même partiellement, TDP-
43
AFB.
[0245] Exemple 16 : Test de l'effet de l'acide trifluoroacétique
(TFA) suivi
d'une neutralisation au NH4OH sur la capacité de détection d'une méthode
utilisant une paire d'anticorps capable de se lier spécifiquement au TDP-43
NAM
[0246] Le TFA a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
20%.
[0247] Le NH4OH a été dilué dans un tampon HEPES 450mM pour obtenir une
solution 5N.
[0248] Les réactifs suivants ont été distribués dans une plaque 96 puits dans
l'ordre suivant:
1) 60 pL d'un échantillon de TDP-43 NAFB préparé selon le protocole décrit à
l'Exemple
2.
2) 8 pL d'une solution de TFA à 20% ou de tampon de lyse supplémenté. Le
mélange a
été incubé 15 minutes à température ambiante. Le pH mesuré à cette étape est
égal à
0,6.
3) 7 pL d'une solution de NH4OH 5N. Le pH mesuré après cet ajout est égal à
7,5.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
[0249] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajo avec :
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
5 - 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0250] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0251] La Figure 21 compare le signal de détection de la PNAFP obtenu avec le
traitement
10
TFA puis NH4OH avec celui obtenu en absence de traitement. Même si ce
traitement
affecte significativement le signal de détection de TDP-43 NAF13 (-72%), le
signal restant
permet de tester celui-ci sur la désagrégation de TDP-43 AFB.
[0252]
Exemple 17 : Test de l'effet de l'acide trifluoroacétique (TFA) suivi
d'une neutralisation au NH4OH comme agent désagrégeant de TDP-43 AFI3
15
[0253] Le TFA a été dilué dans du tampon de lyse supplémenté pour obtenir des
solutions à
20%.
[0254] Le NH4OH a été dilué dans un tampon HEPES 450mM pour obtenir une
solution 5N.
Les réactifs suivants ont été distribués dans une plaque 96 puits dans l'ordre
suivant:
1) 60 pL d'un échantillon de TDP-43 AFP préparé selon le protocole décrit à
l'Exemple 2
20
2) 8 pL d'une solution de TFA à 20% ou d'un mélange TFA/NH4OH (obtenu en
mélangeant 8 volumes d'une solution de TFA 20% avec 7 volumes d'une solution
de
NH4OH 5N). Le mélange a été incubé 15 minutes à température ambiante.
3) 7 pl d'une solution de NH4OH 5N ou d'un mélange TFA/ NH4OH. Le pH mesuré
après
cet ajout est égal à 7,5.
25
[0255] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
30
[0256] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0257] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
35
[0258] Ratio des signaux = (Signal échantillon traité avec TFA 20% puis NH4OH
5N) /
(Signal échantillon traité avec le mélange TFA/NH4OH).
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
36
[0259] La Figure 22 donne les résultats obtenus. Le ratio des signaux est
inférieur ou égal à
1 (0,42) ce qui indique que le traiterrde TDP-43 NAFI3
dans l'échantillon agrégat. On peut en conclure que le traitement au TFA 20%
suivi
d'une neutralisation au NH4OH ne permet pas de désagréger, même partiellement,
TDP-
43 AF13.
[0260] Exemple 18 : effet de solutions de NaOH donnant des pH
compris
entre 8,2 et 13,3 suivi d'une neutralisation au HCI sur la méthode utilisant
les
réactifs de détection de TDP-43 NAFI3
[0261] Solutions de NaOH testées
[0262] [Table 4]
Condition Solution NaOH pH mesuré après ajout sur
l'échantillon de TDP-43 NAF13
A 0,5N 8,2
0,6N 8,5
0,8N 9,6
D 1,2N 12,8
2,4N 13,2
5N 13,3
[0263] Solutions de HCI testées
[0264] [Table 5]
Condition Solution HCI
A 0,34N
0,34N
0,5N
D 1N
2N
5N
[0265] Mélanges NaOH/HCI testés (obtenus en mélangeant un volume identique
d'une
solution de NaOH et d'une solution de HCI)
[0266] [Table 6]
pH mesuré après ajout sur l'échantillon de
Condition Solution NaOH Solution HCI TDP-43 NAFI3
A 0,5N 0,34N 7,6
0,6N 0,34N 7,4
0,8N 0,5N 7,4
D 1,2N 1N 7,2
2,4N 2N 7,4
5N 5N 7
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
37
[0267] Les réactifs suivants ont été distribués dans une plaque 96 puits:
- 60 pL d'un échantillon de TDP-43 NAit à l'Exemple 2.
- 10 pL des différentes solutions de NaOH (A, B, C, D, E ou F) ou de
tampon. Le
mélange a été incubé 15 minutes à température ambiante.
- 10 pL des différentes solutions de HCI (A, 6, C, D, E ou F) ou de tampon.
[0268] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0269] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0270] La Figure 23 montre les résultats obtenus avec les différentes modes de
traitement.
Le traitement avec une solution de NaOH aboutissant à un pH de 13.3 suivi
d'une
neutralisation à l'HCI ne permet pas de détecter TDP-43 NA93. Le pouvoir
désagrégeant
de toutes les autres solutions a pu être testé sur TDP-43 AF[3.
[0271] Exemple 19 : détermination du pH minimum et maximum pour
désagréger TDP-43 AF13 avec NaOH
[0272] Solutions de NaOH testées
[0273] [Table 7]
Condition Solution NaOH pH mesuré après ajout sur
l'échantillon de TDP-43 AFP
A 0,5N 8,2
0,6N 8,5
0,8N 9,6
D 1,2N 12,8
2,4N 13,2
[0274] Solutions de HCI testées
[0275] [Table 8]
Condition Solution HCI
A 0,34N
0,34N
0,5N
D 1N
2N
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
38
[0276] Mélanges NaOH/HCI testés (obtenus en mélangeant un volume identique
d'une
solution de NaOH et d'une solution de
[0277] [Table 9]
pH mesuré après ajout sur l'échantillon de
Condition Solution NaOH Solution HCI TDP-43 AFf3
A 0,5N 0,34N 7,6
0,6N 0,34N 7,4
0,8N 0,5N 7,4
D 1,2N 1N 7,2
2,4N 2N 7,4
[0278] Les réactifs suivants ont été distribués Dans une plaque 96 puits:
- 60 pL d'un échantillon de TDP-43 AF13 préparé selon le protocole décrit à
l'Exemple 2.
- 10 pL des différentes solutions de NaOH (A, B, C, D ou E) ou des mélanges
NaOH/HCI
correspondants (A, B, C, D ou E). Le mélange a été incubé 15 minutes à
température
ambiante.
- 10 pL des différentes solutions de HCI (A, B, C, D, E) ou des mélanges
NaOH/HCI
correspondants (A, B, C, D, E).
[0279] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0280] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0281] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
[0282] Ratio des signaux = (Signal échantillon traité avec NaOH puis HCI) /
(Signal
échantillon traité avec mélange NaOH/HCI).
[0283] La Figure 24 montre les résultats obtenus en fonction du pH induit par
les différentes
solutions de NaOH testées. La détection de TDP-43 NAF13 est possible lorsque
le pH va
de 8,5 à 13,2 durant l'étape de désagrégation. Toutefois, le pH permettant
d'avoir une
amplitude optimale de détection de TDP-43 NA93 est d'environ pH 12,8.
[0284]
Exemple 20 : détermination du temps nécessaire pour désagréger
TDP-43 AFI3 à un pH de 12,8
[0285] Les réactifs suivants ont été distribués dans une plaque 96 puits dans
l'ordre suivant:
1) 60 pL d'un échantillon de TDP-43 AF113 préparé selon le protocole décrit à
l'exemple 2
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
39
2) 10 pL d'une solution de NaOH à 1,2N (pH de l'échantillon porté à 12,8) ou
d'un
mélange NaOH/HCI (obtenu en mélançolution de NaOH
à 1,2N et d'une solution de HCI à 1N). Le mélange a été incubé entre 30
secondes et 1h
à température ambiante selon les puits.
3) 10 pL d'une solution de HCI à 1N (pH de l'échantillon porté à 7,5) dans les
puits
traités avec NaOH à 1,2N ou 10 pL du mélange NaOH/HCI dans les puits traités
avec le
mélange NaOH/HCI.
[0286] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0287] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0288] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
[0289] Ratio des signaux = (Signal échantillon traité avec NaOH à 1,2N puis
HCI à 1N) /
(Signal échantillon traité avec mélange NaOH/HCI).
[0290] La Figure 25 donne les résultats obtenus en fonction du temps de
contact avec
NaOH à 1,2N. Les résultats montrent que le traitement au NaOH à 1,2N a permis
de
désagréger au moins partiellement TDP-43 AFB indépendamment du temps de
contact
(ratio des signaux toujours supérieur à 1. Toutefois, la meilleure
désagrégation a été
obtenue pour des temps de contact allant de 5 minutes à 30 minutes.
[0291] Exemple 21 : détermination du pH minimum et maximum lors de la
mesure la détection de TDP-43 NAFI3
[0292] Solutions de NaOH testées
[0293] Solution de NaOH à 1,2N (permet de porter le pH de l'échantillon à
12,8)
[0294] Solutions de HCI testées
[0295] [Table 10]
Condition Solution HCI
A 1,4N
B 1,3N
C 1,2N
D 1N
E 0,7N
F 0,6N
G 0,5N
H 0,4N
I 0,3N
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
[0296] Mélanges NaOH/HCI testés (obtenus en mélangeant un volume identique
d'une
solution de NaOH et d'une solution de
[0297] [Table 11]
pH mesuré après ajout sur l'échantillon de
Condition Solution NaOH Solution HCI TDP-43 AFp
A 1,2N 1,4N 5,7
1,2N 1,3N 6
1,2N 1,2N 6,4
D 1,2N 1N 7,2
1,2N 0,7N 8
1,2N 0,6N 8,4
G 1,2N 0,5N 10,4
H 1,2N 0,4N 11,2
1,2N 0,3N 12,8
5 [0298] Les réactifs suivants ont été distribués Dans une plaque 96 puits:
- 60 pL d'un échantillon de TDP-43 AFp préparé selon le protocole décrit à
l'Exemple 2.
- 10 pL des différentes solutions de NaOH à 1,2N ou des mélanges NaOH/HCI
correspondants (A, B, C, D, E, F, G, H ou I). Le mélange a été incubé 15
minutes à
température ambiante.
10 - 10 pL des différentes solutions de HCI (A, B, C, D, E, F, G, H ou I )
ou des mélanges
NaOH/HCI correspondants (A, B, C, D, E, F, G, H ou I).
[0299] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
15 - 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0300] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
20 [0301] Le Ratio des signaux obtenus a été calculé comme suit à partir
des signaux FRET
obtenus sur les échantillons :
[0302] Ratio des signaux = (Signal échantillon traité avec NaOH à 1,2N puis
HCI) / (Signal
échantillon traité avec mélange NaOH/HCI).
[0303] La Figure 26 montre que la TDP-43 NAFp peut être détecté après
traitement à
25 pH=12,8 lorsque le pH est ensuite ramené entre pH=6 et pH=10,5. La
détection est
optimale lorsque le pH est compris entre 6 et 8,5.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
41
[0304] Exemple 22 : mesure du niveau d'agrégation d'un peptide
béta
amyloïde 1-42 en utilisant le Pigeant et l'HCI
comme agent neutralisant
[0305] La méthode décrite ci-dessous est basée sur la technologie HTRF (voir
Exemple 1
pour principe).
[0306] Les solutions de NaOH 1,2N et d'HCI 1N ont été préparées comme décrit
dans les
exemples précédents.
[0307] Préparation d'échantillons contenant du peptide amyloïde beta 1-42
mononnérique
(1-42 NAFB) ou agrégé (1-42 AFB) : le peptide amyloïde beta 1-42 humain
lyophilisé
(ERI275BAS, The ERI Amyloid Laboratory, LLC, Oxford) a été re-suspendu selon
les
recommandations du fournisseur puis dilué en tampon 10 mM Sodium Phosphate pH
7,4
à une concentration de 30 pM (1-42 NAFB). Une solution identique de peptide
amyloïde
beta 1-42 est incubée 188 heures à 25 C pour obtenir du 1-42 AFp. Les 2
échantillons
ont été congelés à -80 C avant utilisation future. Avant utilisation, le
niveau d'agrégation
des 2 échantillons a été contrôlé par la méthode à la Thioflavine T.
[0308] Le jour du test, les échantillons 1-42 NAFp et 1-42 AFB ont été
décongelés puis
dilués en tampon 10 mM Sodium Phosphate pH 7,4 à une concentration de 2,4
ng/mL
avant distribution dans la microplaque.
[0309] Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre
suivant:
1) 12 pL d'un échantillon de 1-42 AFB ou d'un échantillon de 1-42 NAFB.
2) 2 pL d'une solution de NaOH à 1,2N ou d'un mélange NaOH/HCI (obtenu en
mélangeant un volume identique d'une solution de NaOH à 1,2N et d'une solution
de HCI
à 1N). Le mélange a été incubé 15 minutes à température ambiante.
3) 2 pL d'une solution de HCI à 1N ou d'un mélange NaOH/HCI.
4) Ajout des réactifs de détection FRET :
- 2 pL d'anticorps Donneur préparé comme décrit à l'Exemple 4.
- 2 pL d'anticorps Accepteur préparé comme décrit à l'Exemple 4.
[0310] Les plaques ont été incubées une nuit à température comprise entre 2 C
et 8 C.
[0311] La détection du signal HTRF dans les différentes plaques a été réalisée
sur un
appareil PHERAstar FS Lamp (BMG Labtech) en utilisant un module de détection
HTRF.
[0312] Le Ratio d'Agrégation est calculé comme suit à partir des signaux HTRF
obtenus sur
les échantillons :
[0313] Ratio des signaux = (Signal échantillon traité NaOH 1.2N puis HCI 1N) /
(Signal
échantillon traité avec le mélange NaOH/HCI).
[0314] La Figure 27 montre les ratios de signaux obtenus avec les échantillons
1-42 NAFB et
1-42 AFB. Le ratio de signal obtenu sur l'échantillon 1-42 AFB est très
supérieur à celui
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
42
obtenu sur l'échantillon 1-42 NAFP. Ce résultat nous indique que la méthode
est capable
de mesurer le niveau d'agrégation du
[0315] Exemple 23 : Effet d'un traitement au NaOH, à l'hydroxyde
de
potassium (KOH) ou au NH4OH suivi d'une neutralisation à l'HCI sur la
capacité de détection d'une méthode utilisant une paire d'anticorps capable
de se lier spécifiquement au TDP-43 NAF13
[0316] Préparation de solutions de NaOH, de KOH, de NH4OH et de HCI pour
traiter des
lysats de TDP43-AFp
[0317] [Table 12]
Condition Solution de base pH mesuré
après ajout sur
l'échantillon de TDP-43 NAFp
A NaOH 1,2N 12,8
KOH 1,2N 12,5
NH4OH 10N 10,9
D NaOH 1,2N 9,6
NH4OH 1,2N 9,6
[0318] Solutions de HCI testées
[0319] [Table 13]
Condition Solution HCI pH mesuré après ajout sur
l'échantillon de TDP-43 NAFp
A 1N 7,2
0,67N 7,5
6,6N 7,4
D 0,5N 7,4
0,5N 7,6
[0320] Mélanges Bases/HCI testés (obtenus en mélangeant un volume identique
d'une
solution de NaOH et d'une solution de HCI).
[0321] [Table 14]
Condition Solution de base Solution HCI
pH mesuré après ajout sur
l'échantillon de TDP-43 NAFp
A NaOH 1,2N 1N 7,2
KOH 1,2N 0,67N 7,5
NH4OH 10N 6,6N 7,4
D NaOH 1,2N 0,5N 7,4
NI-140H 1,2N 0,5N 7,6
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
43
[0322] Les réactifs suivants ont été distribués Dans une plaque 96 puits:
- 60 pL d'un échantillon de TDP-43 NFrit à l'exemple 2.
- 10 pL des différentes solutions de Bases (A, B, C, D ou E) ou des
mélanges Bases/HCI
correspondants (A, B, C, D ou E). Le mélange a été incubé 15 minutes à
température
ambiante.
- 10 pL des différentes solutions de HCI (A, B, C, D, E) ou des mélanges
Bases/HCI
correspondants (A, B, C, D, E).
[0323] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0324] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0325] La Figure 28 montre les signaux de détection de TDP-NAFB obtenus avec
les
différents traitements. La détection de TDP-43 NAFB est possible quelles que
soient les
bases utilisées lorsqu'une étape de neutralisation au HCI permettant d'avoir
un pH
compris entre 7 et 8 est réalisée. L'effet désagrégeant de ces bases sera donc
testés sur
TDP-43 A193.
[0326] Exemple 24 : Effet d'un traitement au NaOH, à l'hydroxyde
de
potassium (KOH) ou au NH4OH suivi d'une neutralisation à l'HCI sur la
désagrégation de TDP-43 A93
[0327] Préparation de solutions de NaOH, de KOH, de NH4OH et de HCI pour
traiter des
lysats de TDP43-AFB
[0328] [Table 15]
Condition Solution de base pH mesuré après ajout sur
l'échantillon de TDP-43 AFB
A NaOH 1,2N 12,8
KOH 1,2N 12,5
NH4OH 10N 10,9
D NaOH 1,2N 9,6
NH4OH 1,2N 9,6
[0329] Solutions de HCI testées
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
44
[0330] [Table 16]
.1 Condition 1 Solution HCI
sur
l'échantillon de TDP-43 AF8
A 1N 7,2
0,67N 7,5
6,6N 7,4
D 0,5N 7,4
0,5N 7,6
[0331] Mélanges Bases/HCI testés (obtenus en mélangeant un volume identique
d'une
solution de NaOH et d'une solution de HCI)
[0332] [Table 17]
Condition
Solution de base Solution HCI pH mesuré après ajout sur
l'échantillon de TDP-43 AF[3
A NaOH 1,2N 1N 7,2
KOH 1,2N 0,67N 7,5
NH4OH 10N 6,6N 7,4
D NaOH 1,2N 0,5N 7,4
NH4OH 1,2N 0,5N 7,6
[0333] Les réactifs suivants ont été distribués Dans une plaque 96 puits:
- 60 pL d'un échantillon de TDP-43 AFP préparé selon le protocole décrit à
l'Exemple 2.
- 10 pL des différentes solutions de Bases (A, B, C, D ou E) ou des
mélanges Bases/HCI
correspondants (A, B, C, D ou E). Le mélange a été incubé 15 minutes à
température
ambiante.
- 10 pL des différentes solutions de HCI (A, B, C, D, E) ou des mélanges
Bases/HCI
correspondants (A, B, C, D, E).
[0334] Une partie du volume contenu dans les puits de la plaque 96 puits a été
transféré
dans une plaque 384 puits avant d'ajouter les réactifs de détection FRET avec
:
- 16 pL du mélange issu de la plaque 96 puits
- 2 pL d'anticorps Ac1 Donneur préparé comme décrit à l'Exemple 2
- 2 pL d'anticorps Ac2 Accepteur préparé comme décrit à l'Exemple 2.
[0335] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques a été réalisée sur un appareil
PHERAstar FS
Lamp (BMG Labtech) en utilisant un module de détection HTRF.
[0336] Le Ratio des signaux obtenus a été calculé comme suit à partir des
signaux FRET
obtenus sur les échantillons :
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
[0337] Ratio des signaux = (Signal échantillon traité avec Base puis HCI) /
(Signal
échantillon traité avec mélange Base/F
[0338] La Figure 29 montre le ratio des signaux obtenus avec les différents
traitements. Les
deux conditions de traitement au NaOH (1,2N et 0.8N), donnant respectivement
des pH
5 de 12,8 et 9,6, permettent de détecter TDP43-NAFp confirmant leur effet
désagrégeant
sur TDP-43 AFp. Le traitement au KOH 1,2N (pH=12,5) permet une faible
détection de
TDP43-NAF13 montrant un faible effet désagrégeant de TDP-43 AFp. Les 2
traitements au
NH4OH (10N et 1,2N) qui donnent des pH similaires aux traitements au NaOH ne
permettent pas de détecter TDP43-NAFp. Ce résultat montre que le NH4OH n'a
aucun
10 effet désagrégeant de TDP-43 AFp.
[0339] Exemple 25: Méthode permettant d'identifier des paires
d'anticorps
capables de se lier spécifiquement à l'Alpha-Synucléine NAFI3 (Alpha-Syn
NAM)
[0340] La méthode est basée sur la technologie FRET (Technologie HTRF de
Cisbio
15 Bioassays), comme détaillé à l'Exemple 1.
[0341] Paire d'anticorps testée
[0342] Une paire d'anticorps dirigée contre l'Alpha-Synucléine marquée
respectivement au
Donneur et à l'Accepteur est celle contenue dans le kit HTRF Total-Alpha-
Synuclein
commercialisée par Cisbio Bioassays (réf. 6FNSYPEG). Chaque anticorps a été
dilué dans
20 le diluant du kit tel que préconisé par le manuel d'utilisation.
[0343] Préparation d'échantillons dA/pha-Syn NA93 et d'Alpha-Syn N'AFP
L'Alpha-Syn NAFp et l'Alpha-Syn AFp ont été obtenues auprès de la société
StressMarq
(StressMarq Active Human recombinant A53T Mutant Alpha Synuclein Protein
Monomer, ref
SPR-325 et Active Human recombinant A53T Mutant Alpha Synuclein Protein
Preformed
25 Fibrils Type 1 réf. SPR-326). Elles ont été diluées à 15,6ng/mL dans le
tampon de lyse du kit
HTRF Total-A Synuclein.
[0344] Test de /a paire d'anticorps sur A/pha-Syn NAFI3 et Alpha-Syn AFI3
Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre suivant:
1) 12 pL d'Alpha-Syn NAFp ou d'Alpha-Syn AFp à 15,6ng/mL
30 2) 2 pL de tampon de lyse. Le mélange a été incubé 15 minutes à
température
ambiante.
3) 2 pL de tampon de lyse.
4) 2 pL d'anticorps Donneur.
5) 2 pL d'anticorps Accepteur.
35 [0345] La détection du signal FRET dans les différentes plaques été
réalisée sur un appareil
PHERAstar FS Lamp (BMG Labtech) en utilisant un module de détection HTRF.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
46
[0346] Les signaux obtenus en FRET sur l'échantillon Alpha-Syn NA193
(Monomères) et sur
l'échantillon Alpha-Syn AFP (Agrégatt le rapport des
signaux de FRET (Monomères/Agrégats) tel que montré à la Figure 30.
[0347] Le rapport des signaux de FRET (Monomère / Agrégat) de la paire
d'anticorps est
supérieur à 2 (valeur de 6,64). Cela indique que cette paire d'anticorps est
capable de
lier spécifiquement l'Alpha-Syn NAF[3 par rapport à l'Alpha-Syn AF[3.
[0348]
Exemple 26 : effet d'une solution de NaOH 1.2N suivi d'une
neutralisation au HCI 1N sur la capacité de détection d'une méthode utilisant
une paire d'anticorps capable de se lier spécifiquement à l'Alpha-Syn NAF13
[0349] L'Alpha-Syn NAF13 (StressMarq, Active Human recombinant A53T Mutant
Alpha
Synuclein Protein Monomer, réf. SPR-326) a été dilué dans le tampon de lyse du
kit
HTRF Total-Alpha Synuclein (Cisbio Bioassays, réf. 6FNSYPEG) à 15,6ng/mL. Les
anticorps donneur et accepteur du kit HTRF Total-A Synuclein ont été dilués
comme
recommandé par le fournisseur dans le manuel du kit.
[0350] Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre
suivant:
1) 12 pL d'Alpha-Syn NAF13 à 15,6 ng/mL
2) 2 pL d'une solution de NaOH à 1,2N (pH de l'échantillon porté à 12,8) ou
d'un
mélange NaOH/HCI (obtenu en mélangeant un volume identique d'une solution de
NaOH
à 1,2N et d'une solution de HCI à 1N). Le mélange a été incubé 15 minutes à
température ambiante.
3) 2 pL d'une solution de HCI à 1N (pH de l'échantillon porté à 7,5) dans les
puits traités
avec NaOH à 1,2N ou 2pL du mélange NaOH/HCI dans les puits traités avec le
mélange
NaOH/HCI.
4) 2 pL d'anticorps Donneur préparé comme décrit dans l'exemple 25
5) 2 pL d'anticorps Accepteur préparé comme décrit dans l'exemple 25
[0351] Les plaques ont été incubées une nuit à température ambiante. La
détection du
signal HTRF dans les différentes plaques été réalisée sur un appareil
PHERAstar FS Lamp
(BMG Labtech) en utilisant un module de détection HTRF.
[0352] La Figure 31 donne les résultats obtenus. Ils montrent que le
traitement au NaOH à
1,2N suivi d'une neutralisation au HCI 1N affecte peu la détection de l'Alpha-
Syn NAFF3
par les anticorps. L'effet de ce traitement pour désagréger l'Alpha-Syn AFP
pourra donc
être évalué.
[0353]
Exemple 27 : mesure du niveau d'agrégation de l'Alpha-Synucléine
en utilisant le NaOH comme Agent Désagrégeant et l'HCI comme Agent
Neutralisant
[0354] La méthode est basée sur la technologie FRET (Technologie HTRF de
Cisbio
Bioassays), comme détaillé à l'Exemple 1.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
47
[0355] Paire d'anticorps testée
I-03561 Les anticorps dirigés contre l'Alphaent au Donneur
et à l'Accepteur sont ceux contenus dans le kit HTRF Total-Alpha-Synuclein
commercialisé par Cisbio Bioassays (réf. 6FNSYPEG). Ils ont été dilués dans le
diluant du
kit tel que préconisé par le manuel d'utilisation.
[0357] Préparation d'échantillons d'Alpha-Syn NAFI3 et d'Alpha-Syn NAi93
[0358] L'Alpha-Syn NAFp et l'Alpha-Syn AFp ont été obtenues auprès de la
société
StressMarq (StressMarq Active Human recombinant A53T Mutant Alpha Synuclein
Protein
Monomer, ref SPR-325 et Active Human recombinant A53T Mutant Alpha Synuclein
Protein Preformed Fibrils Type 1 ref SPR-326). Elles ont été diluées à 15.6
ng/mL dans le
tampon de lyse du kit HTRF Total-Alpha Synuclein.
[0359] Test de la paire d'anticorps sur Alpha-Syn NAFI3 et Alpha-Syn )4F3
Les réactifs suivants ont été distribués dans une plaque 384 puits dans
l'ordre suivant:
1) 12 pL d'Alpha-Syn NAFp ou d'Alpha-Syn AFp à 15,6 ng/mL
2) 2 pL d'une solution de NaOH à 1,2N (pH de l'échantillon porté à 12,8) ou
d'un
mélange NaOH/HCI (obtenu en mélangeant un volume identique d'une solution de
NaOH
à 1,2N et d'une solution de HCI à 1N). Le mélange a été incubé 15 minutes à
température ambiante.
3) 2 pL d'une solution de HCI à 1N (pH de l'échantillon porté à 7,5) dans les
puits traités
avec NaOH à 1,2N ou 2 pL du mélange NaOH/HCI dans les puits traités avec le
mélange
NaOH/HCI.
4) 2 pL d'anticorps Donneur.
5) 2 pL d'anticorps Accepteur.
[0360] La détection du signal FRET dans les différentes plaques a été réalisée
sur un
appareil PHERAstar FS Lamp (BMG Labtech) en utilisant un module de détection
HTRF.
[0361] La Figure 32 montre les ratios de signaux obtenus avec les échantillons
d'Alpha-Syn
NAFp et d'Alpha-Syn AFp. Le ratio de signal obtenu sur l'échantillon d'Alpha-
Syn AFp est
très supérieur à celui obtenu sur l'échantillon d'Alpha-Syn NAFp. Ce résultat
nous indique
que la méthode selon l'invention permet de mesurer le niveau d'agrégation de
l'Alpha-
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
48
Brève description des dessins
- -
[Fid._1] La Figure 1 illustre le principe dé La comparaison
-
des teneurs en PNAFp (Ratio des signaux) permet donc de savoir si
l'échantillon testé
comprend une PAFp. Le ratio des signaux pour un échantillon ne comprenant pas
de
PAFP sera égal à 1. Le ratio des signaux pour un échantillon comprenant des
PAFp sera
supérieur à 1.
[Fig. 2] La Figure 2 représente le signal ELISA (DØ) obtenu pour différentes
dilutions de
PNAFp. La valeur de D.O. correspondant à 80% du signal maximum permet de
déterminer la dilution de référence à utiliser dans la suite de l'expérience.
[Fig. 3] La Figure 3 représente les résultats obtenus dans un test ELISA
visant à
déterminer si une paire d'anticorps reconnait sélectivement ou non une PNAFP.
A) paire
d'anticorps non sélective d'une PNAFP. B) paire d'anticorps sélective d'une
PNAFP.
[Fig. 4] La Figure 4 représente le principe d'un immunoessai HTRF. Ce type
d'immunoessai
permet de savoir si deux anticorps, respectivement marqués au Donneur et à
l'Accepteur
sont capables de créer une paire d'anticorps capables de reconnaitre
simultanément un
antigène d'intérêt. A) les 2 anticorps testés ne sont pas capables de créer
une paire
d'anticorps capable de reconnaitre l'antigène d'intérêt ; il n'y a pas de
transfert d'énergie
entre le Donneur et l'Accepteur et donc aucun signal de fluorescence émis par
l'Accepteur. B) Les deux anticorps testés sont capables de reconnaitre
simultanément
l'antigène d'intérêt. Un transfert d'énergie se produit alors entre le Donneur
et
l'Accepteur. Il en résulte une émission de fluorescence spécifique à 665 nm
qui est émise
par l'accepteur.
[Fig. 5] La Figure 5 représente le signal HTRF obtenu pour différentes
dilutions de PNAFP.
La valeur de signal HTRF correspondant à 80% du signal maximum permet de
déterminer la dilution de référence à utiliser dans la suite de l'expérience.
[Fig. 6] La Figure 6 représente les résultats obtenus dans un test HTRF visant
à déterminer
si une paire d'anticorps reconnait sélectivement ou non une PNAFp. A) paire
d'anticorps
non sélective d'une PNAFp. B) paire d'anticorps sélective d'une PNAFp.
[Fig. 7] La Figure 7 représente le calcul du rapport des signaux entre un
échantillon
agrégat TDP-43 AFp et un échantillon monomère TDP-43 NAFp obtenu avec une
paire
d'anticorps dirigée contre la protéine TDP-43. Un rapport de signaux supérieur
à 2
indique que la paire testée est sélective de TDP-43 NAFp.
[Fig. 8] La Figure 8 représente le calcul du rapport des signaux entre un
échantillon
agrégat de peptide amyloïde beta 1-40 et un échantillon monomère de ce même
peptide
obtenu avec une paire d'anticorps dirigée contre le peptide amyloïde beta 1-
40. La
valeur du rapport des signaux supérieure à 2 indique que la paire testée est
sélective du
peptide amyloïde 1-40 NAFp (forme monomérique).
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
49
[Fig. 9] La Figure 9 représente le calcul du rapport des signaux entre un
échantillon
agrégat de peptide amyloïde beta 1-4e même peptide
obtenu avec une paire d'anticorps dirigée contre le peptide amyloïde beta 1-
42. La
valeur du rapport des signaux supérieure à 2 indique que la paire testée est
sélective du
peptide amyloïde 1-42 NAFp (forme monomérique).
[Fig. 10] La Figure 10 représente l'effet de l'Hexafluoroisopropanol (HFIP)
sur la capacité
de détection d'une méthode HTRF utilisant une paire d'anticorps capable de se
lier
spécifiquement au TDP-43 NAFp.
[Fig. 11] La Figure 11 représente l'absence d'effet désagrégeant de
l'Hexafluoroisopropanol
(HFIP) sur un échantillon de TDP-43 AFp.
[Fig. 12] La Figure 12 représente l'effet de l'Urée sur la capacité de
détection d'une
méthode HTRF utilisant une paire d'anticorps capable de se lier spécifiquement
au TDP-
43 NAFp.
[Fig. 13] La Figure 13 représente l'absence d'effet désagrégeant de l'Urée sur
un
échantillon de TDP-43 AFp.
[Fig. 14] La Figure 14 représente l'effet du Chlorure de Guanidinium sur la
capacité de
détection d'une méthode HTRF utilisant une paire d'anticorps capable de se
lier
spécifiquement au TDP-43 NAFp.
[Fig. 15] La Figure 15 représente l'effet de l'Acide Formique (A) ou du TFA
(B) sur la
capacité de détection d'une méthode HTRF utilisant une paire d'anticorps
capable de se
lier spécifiquement au TDP-43 NAFP.
[Fig. 16] La Figure 16 représente l'effet de l'Acide Formique suivi d'une
neutralisation au
NaOH sur la capacité de détection d'une méthode HTRF utilisant une paire
d'anticorps
capable de se lier spécifiquement au TDP-43 NAFp.
[Fig. 17] La Figure 17 représente l'effet du TFA suivi d'une neutralisation au
NaOH sur la
capacité de détection d'une méthode HTRF utilisant une paire d'anticorps
capable de se
lier spécifiquement au TDP-43 NAFp.
[Fig. 18] La Figure 18 représente l'absence d'effet désagrégeant du TFA suivi
d'une
neutralisation au NaOH sur un échantillon de TDP-43 AFp.
[Fig. 19] La Figure 19 représente l'effet de l'Acide Formique suivi d'une
neutralisation au
NH4OH sur la capacité de détection d'une méthode HTRF utilisant une paire
d'anticorps
capable de se lier spécifiquement au TDP-43 NAFp.
[Fig. 20] La Figure 20 représente l'absence d'effet désagrégeant de l'Acide
Formique suivi
d'une neutralisation au NH4OH sur un échantillon de TDP-43 AFp.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
[Fig. 21] La Figure 21 représente l'effet du TFA suivi d'une neutralisation au
NH4OH sur la
capacité de détection d'une méthode ps capable de se
lier spécifiquement au TDP-43 NAFp.
[Fig. 22] La Figure 22 représente l'absence d'effet désagrégeant du TFA suivi
d'une
5 neutralisation au NH4OH sur un échantillon de TDP-43 AFp.
[Fig. 23] La Figure 23 représente l'effet de solutions de NaOH donnant des pH
compris
entre 8.2 et 13.3 suivi d'une neutralisation au HCI sur la capacité de
détection d'une
méthode HTRF utilisant une paire d'anticorps capable de se lier spécifiquement
au TDP-
43 NAFp.
10 [Fig. 24] La Figure 24 représente la détermination du pH minimum et
maximum pour
désagréger un échantillon de TDP-43 AFP avec de solutions de NaOH.
[Fig. 25] La Figure 25 représente la détermination du temps nécessaire pour
désagréger
un échantillon de TDP-43 AFp avec une solution de NaOH à pH=12.8.
[Fig. 26] La Figure 26 représente la détermination du pH minimum et maximum
lors de la
15 mesure de la détection de TDP-43 NAFp.
[Fig. 27] La Figure 27 représente la mesure du niveau d'agrégation d'un
peptide béta
amyloïde 1-42 en utilisant le NaOH comme agent désagrégeant suivi d'une
neutralisation
à l'HCI.
[Fig. 28] La Figure 28 représente l'effet de solutions de NaOH, KOH et NH4OH
suivi d'une
20 neutralisation à l'HCI sur la capacité de détection d'une méthode HTRF
utilisant une paire
d'anticorps capable de se lier spécifiquement au TDP-43 NAFp.
[Fig. 29] La Figure 29 représente l'effet de solutions de NaOH, KOH et NH4OH
suivi d'une
neutralisation à l'HCI sur la désagrégation de TDP-43 NAFp.
[Fig. 30] La Figure 30 représente le calcul du rapport des signaux entre un
échantillon
25 agrégat d'Alpha-Synucléine (Alpha-Syn AFp) et un échantillon monomère de
cette même
protéine (Alpha-Syn NAFp) obtenu avec une paire d'anticorps dirigée contre
l'Alpha-
Synucléine. La valeur du rapport des signaux supérieure à 2 indique que la
paire testée
est sélective de l'Alpha-Syn NAFp.
[Fig. 31] La Figure 31 représente l'effet d'une solution de NaOH suivi d'une
neutralisation à
30 l'HCI sur la capacité de détection d'une méthode HTRF utilisant une
paire d'anticorps
capable de se lier spécifiquement à l'Alpha-Syn NAFp.
[Fig. 32] La Figure 32 représente la mesure du niveau d'agrégation de l'Alpha-
Synucléine
en utilisant le NaOH comme agent désagrégeant suivi d'une neutralisation à
l'HCI.
CA 03179103 2022- 11- 16
WO 2021/234261
PCT/FR2021/050854
51
Références bibliographiques
_ _ Fil Harrison et al, RNA -bindinq
protealth and disease
_
(2017) Biochem J. ; 474(8): 1417-1438. doi:10.1042/BC320160499
[2] Chang et al., Detection and quantification of tau aggregation using a
membrane filter
assay, , Analytical Biochemistry 373 (2008) 330-336
[3] Howlett et al, Inhibition of fibril formation in b-arny/oid peptide by a
novel series of
benzofurans, Biochem. J. (1999) 340, 283-289.
[4] Linghagen-Persson et al., Amyloid-b Oligomer Specificity Mediated by the
IgM
Isotype - Implications for a Specific Protective Mechanisrn Exertec/ by
Endogenous Auto-
PLoS ONE, November 2010 I Volume 5 I Issue 11 I e13928
[5] Englund et al., Sensitive ELISA detection of amyloid-b protofibrils in
biological
samples, Journal of Neurochemistry, 2007, 103, 334-345
[6] Van Helmond et al, Higher Soluble Amyloid b Concentration in Frontal
Cortex of
Young Adults than in Normal Elderly or Alzheimer's Disease, Brain Pathology
ISSN 1015-
6305, doi:10.1111/j.1750-3639.2010.00374.x
[7] Selkoe et al., Isolation of Low-Molecular-Weight Proteins from Amyloid
Plaque Fibers
in Alzheimer's Disease, Journal of Neurochemistry, (1986)
[8] Janssen et al., Signal loss due to oligomerization in ELISA ana/ysis of
amyloid-beta
can be recovered by a nove/ sarnple pre-treatrnent rnethod, MethodsX 2 (2015)
112-123
[9] Sun et al., Molecular Determinants and Genetic Modifiers of Aggregation
and Toxicity
for the ALS Disease Protein FUS/TLS, PLoS Biology, April 2011 I Volume 9 l
Issue 4 I
e1000614
[10] Couthuis et al., Evaluating the mie of the FUS/TLS-related gene EWSR1 in
amyotrophie lateral sclerosis, Human Molecular Genetics, 2012, Vol. 21, No. 13
2899-
2911
[11] Ryan et al., Ammonium hydroxide treatment of A13 produces an aggregate
free
solution suitable for biophysical and cell culture characterization, (2013),
PeerJ 1:e73;
DOI 10.7717/peerj.73
[12] Dormann et al., Proteolytic processing of TAR DNA binding protein-43 by
caspases
produces C-terminal fragments with disease defining properties indepen dent of
progranulin, (2009), Journal of Neurochemistry, 110, 1082-1094
[13] Couthuis et al., A yeast functional screen predicts new candidate ALS
disease
genes, PNAS l December 27, 2011 I vol. 108 I no. 52 l 20881-20890
CA 03179103 2022- 11- 16