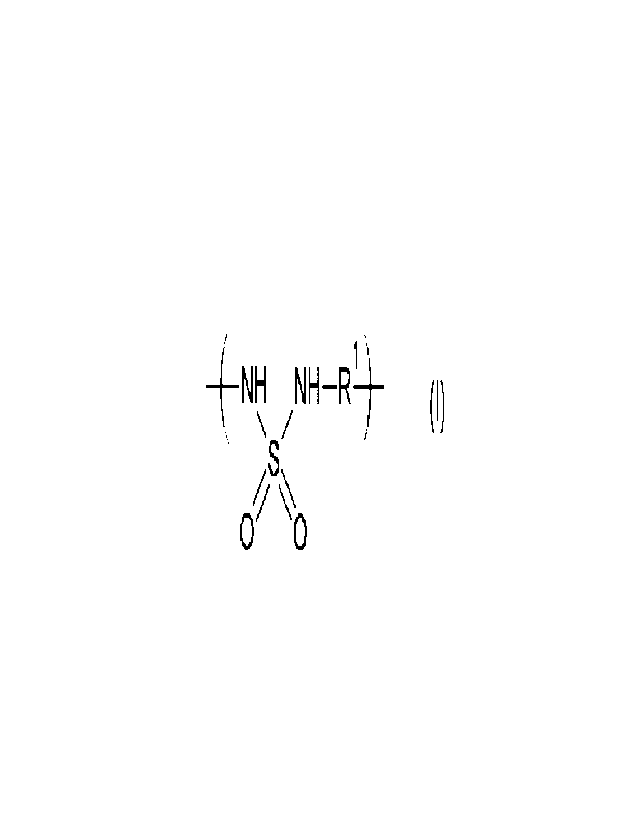Note: Descriptions are shown in the official language in which they were submitted.
WO 2022/126251
PCT/CA2021/051796
1
TITRE DE L'INVENTION
POLYMERES DE SULFAMIDES CONDUCTEURS, LEUR UTILISATION DANS DES BATTERIES ET
PROCÉDÉ
DE FABRICATION DE CEUX-CI
RÉFÉRENCE CROISÉE A DES DEMANDES ASSOCIÉES
Cette application réclame priorité, sous 35 U.S.C. 119(e), de la demande
provisoire américaine n de série
63/126,369, déposée le 16 décembre 2020. Tous les documents ci-dessus sont
intégrés aux présentes dans leur
intégralité par référence.
DOMAINE DE L'INVENTION
pon La présente invention concerne un polymère comprenant des
unités de répétition de sulfamide modifiées
lithiées et/ou non lithiées et son utilisation comme électrolyte de batterie.
CONTEXTE DE L'INVENTION
[0002] Les matériaux à base de poly(oxyde d'éthylène) (POE) sont
largement considérés comme des candidats
prometteurs pour les hôtes polymères dans les électrolytes à l'état solide
pour les batteries secondaires au lithium à
haute densité d'énergie. Ils présentent plusieurs avantages spécifiques tels
qu'une sécurité élevée, une fabrication
facile, un faible coût, une densité énergétique élevée, une bonne stabilité
électrochimique et une excellente
compatibilité avec les sels de lithium. Cependant, le POE linéaire typique ne
répond pas aux exigences de production
en raison de sa conductivité ionique insuffisante en raison de la
cristallinité élevée des chaînes d'oxyde d'éthylène
(0E), qui peuvent restreindre la transition ionique en raison de la structure
rigide, en particulier à basse température.
Les scientifiques ont exploré différentes approches pour réduire la
cristallinité et donc améliorer la conductivité ionique
des électrolytes à base de POE, y compris le mélange, la modification et la
fabrication de dérivés de POE.
RÉSUMÉ DE L'INVENTION
[0003] Conformément à la présente invention, on propose :
1. Un polymère de formule (I) :
+N1,1-,1 r_NH¨R+
0 0 (I),
dans laquelle :
les atomes d'azote sont coordonnés avec un atome de lithium dans 0 % à 100 %
des unités de répétition dans
le polymère, et
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
2
chaque R1 dans chaque unité de répétition individuelle représente
indépendamment un groupe bivalent, dans
lequel les groupes bivalents sont, indépendamment les uns des autres, un
groupe alkylène, arylène ou -CH2-
CH2-(0-CH2-CH2),,, dans lequel :
m est un nombre entier égal à 1 ou plus, et
l'alkylène, l'arylène et le -0H2-0H2-(0-0H2-0H2), sont éventuellement
substitués par un ou
plusieurs atomes d'halogène.
2. Le polymère du point 1, dans lequel les atomes d'azote sont coordonnés
avec un atome de lithium dans plus
de 0 %, de préférence au moins environ 50 %, de manière davantage préférée au
moins environ 60 %, de
manière encore davantage préférée au moins environ 70 %, de manière davantage
préférée encore au moins
environ 80 %, de manière davantage préférée encore au moins environ 90 %, et
de manière préférée entre
toutes dans environ 100 % des unités de répétition dans le polymère.
3. Le polymère selon le point 1 ou 2, dans lequel l'alkylène est un
alkylène linéaire.
4. Le polymère selon l'un quelconque des points 1 à 3, dans lequel
l'alkylène est un alkylène en C3-C12, de
préférence un alkylène en 03-C3, et de manière préférée entre toutes un
butylène (04).
5. Le polymère selon l'un quelconque des points 1 à 4, dans lequel chacun
des cycles de l'arylène comprend 5
ou 6 atomes de cycle.
6. Le polymère selon l'un quelconque des points 1 à 5, dans lequel
l'arylène est un arylène monocyclique, de
préférence le phénylène, de manière davantage préférée le paraphénylène.
7. Le polymère selon l'un quelconque des points 1 à 6, dans lequel
l'alkylène est substitué par un ou plusieurs
atomes d'halogène.
8. Le polymère selon l'un quelconque des points 1 à 7, dans lequel les
atomes d'halogène sont des atomes de
fluor.
9. Le polymère selon l'un quelconque des points 1 à 8, dans lequel
l'alkylène est le 2,2,3,3-tétrafluoro-1,4-
butylène.
10. Le polymère selon l'un quelconque des points 1 à 6, dans lequel
l'alkylène n'est pas substitué.
11. Le polymère selon l'un quelconque des points 1 à 10, dans lequel
l'arylène n'est pas substitué.
12. Le polymère selon l'un quelconque des points 1 à 11, dans lequel m vaut
au moins 2, de préférence au moins
3.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
3
13. Le polymère selon l'un quelconque des points 1 à 12, dans lequel m vaut
au plus 15, de préférence au plus 10,
et de manière davantage préférée au plus 5.
14. Le polymère selon l'un quelconque des points 1 à 13, dans lequel m vaut
1, 2 ou 3; de préférence 2 ou 3, et
de manière davantage préférée 3.
15. Le polymère selon l'un quelconque des points 1 à 14, dans lequel chaque
R1 dans chaque unité de répétition
individuelle représente un même groupe bivalent.
16. Le polymère selon le point 15, dans lequel R1 représente un
alkylène ou -CH2-CH2-(0-CH2-CH2), ; de manière
davantage préférée -CH2-CH2-(0-CH2-CH2),, dans lequel l'alkyléne et m sont
tels que définis dans l'un
quelconque des points 1 à 14.
17. Le polymère selon l'un quelconque des points 1 à 13, dans lequel chaque
R1 dans chaque unité de répétition
individuelle représente indépendamment un total de plus d'un groupe bivalent,
de préférence un total de deux
groupes bivalents.
18. Le polymère selon le point 17, dans lequel les plus d'un
groupe bivalent sont indépendamment des groupes
alkylène et/ou -0H2-0H2-(0-0H2-0H2)m-.
19. Le polymère selon le point 17 ou 18, dans lequel chaque R1 dans chaque
unité de répétition individuelle
représente indépendamment un total de deux groupes bivalents, dans lequel :
= l'un des deux groupes bivalents est un alkylène et l'autre des deux
groupes bivalents est -CH2-CH2-
(0-CH2-CH2),,, ou
= l'un des deux groupes bivalents est -CH2-CH2-(0-CH2-CH2)m-, dans lequel m
a une première valeur,
et l'autre des deux groupes bivalents est -CH2-CH2-(0-CH2-CH2)m-, dans lequel
m a une seconde
valeur différente de la première valeur,
dans lequel l'alkylène et m sont tels que définis dans l'un quelconque des
points 1 à 13.
20. Le polymère selon le point 19, dans lequel la première valeur
et la seconde valeur pour m sont choisies parmi
1, 2 et 3; de préférence parmi 2 et 3.
21. Le polymère selon l'un quelconque des points 1 à 20, dans lequel :
= chaque R1 dans chaque unité de répétition individuelle représente -CH2-
CH2-(0-CH2-CH2)m-, dans
lequel m vaut 2 ou 3, de préférence 3 ;
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
4
= chaque R1 dans chaque unité individuelle représente indépendamment un
total de deux groupes
bivalents, dans lequel l'un des deux groupes bivalents est -0H2-0H2-(0-0H2-
0H2)m-, dans lequel m
vaut 2, et l'autre des deux groupes bivalents est -0H2-0H2-(0-0H2-0H2)n,-,
dans lequel m vaut 3;
= chaque R1 dans chaque unité de répétition individuelle représente
indépendamment un total de deux
groupes bivalents, l'un des deux groupes bivalents étant le 2,2,3,3-
tétrafluoro-1,4-butylène et l'autre
des deux groupes bivalents étant le -CH2-CH2-(0-CH2-CH2)n,-, m valant 2 ou 3,
de préférence 3.
22. Le polymère selon l'un quelconque des points 1 à 21, dans lequel les
unités de répétition sont disposées de
manière aléatoire dans le polymère.
23. Le polymère selon l'un des points 1 à 22, ayant une masse molaire
comprise entre 5 000 et 5 000 000 gmol-1.
24. Le polymère selon l'un quelconque des points 1 à 23, n'ayant aucune
cristallinité.
25. Le polymère selon l'un quelconque des points 1 à 24, ayant une
température de transition vitreuse (Tg)
d'environ -30 C.
26. Un procédé de fabrication du polymère selon l'un quelconque des points
1 à 25, le procédé comprenant une
réaction catalytique oxydante de sulfamide avec un ou plusieurs diols en
présence d'un sel de cuivre et
éventuellement d'une base de lithium.
27. Le procédé selon le point 26, dans lequel les ou les diols sont
utilisés en excès.
28. Le procédé selon le point 27, dans lequel le sulfamide et le ou les
diols sont utilisés dans un rapport molaire
sulfamide:diol total de 1:4.
29. Le procédé selon l'un quelconque des points 26 à 28, dans lequel un
seul diol est utilisé.
30. Le procédé selon l'un quelconque des points 26 à 28, dans lequel plus
d'un diol est utilisé.
31. Le procédé selon l'un quelconque des points 26 à 30, dans lequel le sel
de cuivre est le triflate de cuivre ou
l'acétate de cuivre.
32. Le procédé selon l'un quelconque des points 26 à 31, dans lequel la
base de lithium est présente.
33. Le procédé selon l'un quelconque des points 26 à 32, dans lequel la
base de lithium est le carbonate de lithium.
34. Le procédé selon l'un quelconque des points 26 à 33, dans lequel le sel
de cuivre est l'acétate de cuivre.
35. Le procédé selon l'un quelconque des points 26 à 34,
comprenant en outre l'étape de passage du polymère
dans une résine échangeuse d'ions après la polymérisation pour augmenter un
degré de lithiation du polymère.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
36. Le procédé selon l'un quelconque des points 26 à 31, dans lequel la
base de lithium est absente.
37. Le procédé selon l'un quelconque des points 26 à 31 et 36, dans lequel
le sel de cuivre est le triflate de cuivre.
38. Le procédé selon l'un quelconque des points 26 à 37, dans lequel le
sulfamide, le sel de cuivre et la base de
lithium si elle est utilisée, sont d'abord mélangés ensemble, puis le diol est
ajouté.
5 39. Utilisation du polymère selon l'un quelconque des points 1 à 25
comme électrolyte pour une batterie.
40. Un électrolyte pour une batterie comprenant le polymère selon l'un
quelconque des points 1 à 25.
41. Une batterie comprenant une anode, une cathode et un électrolyte entre
l'anode et la cathode, dans laquelle
l'électrolyte comprend le polymère selon l'un des points 1 à 25.
BREVE DESCRIPTION DES DESSINS
[0004] Dans les dessins en annexe :
La figure 1 montre le spectre de FTIR du polymère de l'exemple 13.
La figure 2 montre le spectre de RMN H1 solide des polymères de l'exemple 2a,
de l'exemple 13 (c'est-à-dire de
l'exemple 2a après traitement avec une résine échangeuse d'ions) et de
l'exemple 2a avec 20 % en poids de LITFSI.
La figure 3 montre les résultats de l'analyse thermogravimétrique (ATG) pour
le polymère de l'exemple lb.
La figure 4 montre les résultats d'ATG pour le polymère de l'exemple 3a.
La figure 5 est une vue éclatée de la pile bouton assemblée dans l'exemple 5.
La figure 6 montre un circuit équivalent utilisé lors du calcul de la
conductivité.
La figure 7 montre un autre circuit équivalent utilisé lors du calcul de la
conductivité.
La figure 8 montre les résultats de conductivité pour le polymère de l'exemple
2a (fabriqué à partir de triéthylène glycol)
avec 0, 20, 30, 40 ou 50 % en poids/poids de LiTFSI.
La figure 9 montre les résultats de conductivité pour le polymère de l'exemple
la (fabriqué à partir de tétraéthylène
glycol) avec 0, 10, 20 ou 30 % en poids/poids de LiTFSI.
La figure 10 compare les conductivités du polymère de l'exemple 2a (fabriqué à
partir de triéthylène glycol) et du
polymère de l'exemple la (fabriqué à partir de tétraéthylène glycol) à
différents niveaux de sel.
La figure 11 montre la conductivité du polymère de l'exemple lb mélangé avec
15% en poids de polymère HQ674.
La figure 12 montre la conductivité des polymères des exemples lb et 7, avec
ou sans sel, avec ou sans polymère
HQ674 et compare la conductivité du polymère HQ674.
La figure 13 montre la conductivité des polymères de l'exemple 6 sel, en
mélange avec du polyfluorure de vinylidène,
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
6
ou en mélange avec à la fois du polyfluorure de vinylidène et du phosphate de
lithium aluminium titane.
DESCRIPTION DÉTAILLÉE DE L'INVENTION
[00051 En ce qui concerne maintenant l'invention plus en détail,
on propose un polymère de formule (I) :
+NHNHR
0 (I),
dans laquelle :
les atomes d'azote sont coordonnés avec un atome de lithium dans 0 A à 100 %
d'unités de répétition dans le
polymère, et
chaque Ri dans chaque unité de répétition individuelle représente
indépendamment un groupe bivalent, dans lequel
les groupes bivalents sont, indépendamment les uns des autres, un groupe
alkylène, arylène ou -CH2-CH2-(0-CH2-
CH2)m- :
m est un nombre entier égal à 1 ou plus, et
l'alkylène, l'arylène et le -0H2-0H2-(0-0H2-0H2), sont éventuellement
substitués par un ou plusieurs atomes
d'halogène.
[0006] Comme le montrent les exemples ci-dessous, les polymères de
l'invention ont une bonne conductivité
même à basse température (par exemple 4,10 x 10-5 Scm-1 à 50 C). Aussi, dans
certains cas, leur conductivité est
maximale en l'absence de sel. Alors que la conductivité globale des polymères
de l'invention est légèrement inférieure
à celle du POE, son indice de transport est beaucoup plus élevé (de 0,2 pour
POE contre par exemple ¨0,9 pour le
polymère de l'invention). Cela est extrêmement important car la conductivité
ionique rapportée est une valeur liée à la
contribution cationique et anionique ; par conséquent, l'indice de transport
(t* + t = 1) est associé au mouvement des
cations et des anions. Comme le t+ de Li dans le POE est faible, le mouvement
du TFSI- est majeur et a davantage
contribué à la conductivité. Dans le polymère de l'invention, les ions Li + se
déplacent plus rapidement que les contre-
anions (squelette du polymère). Le POE n'est qu'un vecteur de mouvement pour
LiTFSI. De plus, on peut voir que
l'énergie d'activation des polymères de l'invention est très différente de
celle typiquement observée pour les polymères
(1,7 eV POE + cristal de Li). Elle est bien meilleure et elle est en fait plus
proche de celle rapportée pour les céramiques
(0,30 eV).
[0007] Comme indiqué ci-dessus, les atomes d'azote sont coordonnés
avec un atome de lithium dans 0 % à
100 % des unités de répétition dans le polymère. Cela signifie que 0 % à 100 %
des unités de répétition sont lithiées,
tandis que les unités de répétition restantes sont non lithiées. En effet,
comme le montrent les exemples ci-dessous,
notamment dans les spectres de RMN et de FTIR, les atomes d'azote dans le
polymère de l'invention peuvent être
coordonnés avec un atome de lithium, formant ainsi un complexe, à hauteur de 1
atome de lithium par unité de
répétition.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
7
[0008] Dans des modes de réalisation, les atomes d'azote sont
coordonnés avec un atome de lithium dans 0 %
des unités de répétition dans le polymère. Dans de tels cas, le polymère est
totalement non lithié.
[0009] Dans des modes de réalisation, les atomes d'azote sont
coordonnés avec un atome de lithium dans 100
% des unités de répétition dans le polymère. Dans de tels cas, le polymère est
totalement lithié.
[0010] Dans des modes de réalisation préférés, les atomes d'azote sont
coordonnés avec un atome de lithium
dans plus de 0 % des unités de répétition dans le polymère, ce qui signifie
que le polymère comprend au moins
certaines unités de répétition lithiées. Dans des modes de réalisation
préférés, les atomes d'azote sont coordonnés
avec un atome de lithium dans au moins environ 50 %, de préférence au moins
environ 60 %, de manière préférée au
moins environ 70 %, de manière davantage préférée encore au moins environ 80
%, et de manière préférée entre
toutes au moins environ 90 % des unités de répétition dans le polymère. Dans
les modes de réalisation préférés entre
tous, les atomes d'azote sont coordonnés avec un atome de lithium dans environ
100 % des unités de répétition dans
le polymère. Dans de tels modes de réalisation, toutes ou presque toutes les
unités de répétition dans le polymère
sont des unités de répétition lithiées.
[0011] Dans des modes de réalisation, l'alkylène est un alkylène
linéaire.
[0012] Dans des modes de réalisation, l'alkylène est un alkylène en 03-012,
de préférence un alkylène en 03-Ce,
et de manière davantage préférée le butylène (04).
[0013] Dans des modes de réalisation, chacun des cycles de
l'arylène comprend 5 ou 6 atomes de cycle.
[0014] Dans des modes de réalisation, l'arylène est un arylène
monocyclique. Dans des modes de réalisation
préférés, l'arylène est un phénylène, de manière davantage préférée le
paraphénylène.
[0015] Comme indiqué ci-dessus, les groupes alkylène, arylène et -0H2-0H2-
(0-0H2-0H2)m- sont éventuellement
substitués par un ou plusieurs atomes d'halogène. Les atomes d'halogène
préférés comportent le fluor. Dans de tels
modes de réalisation, les groupes R1 préférés comportent les groupes alkylène
substitués par un ou plusieurs atomes
d'halogène. Un groupe R1 préféré est le 2,2,3,3-tétrafluoro-1,4-butylène.
[0016] Dans des modes de réalisation préférés, l'alkylène est
substitué, de préférence comme décrit ci-dessus.
Dans d'autres modes de réalisation, l'alkylène est non substitué.
[0017] Dans des modes de réalisation préférés, l'arylène est non
substitué.
[0018] Dans des modes de réalisation préférés, m vaut au moins 2,
de préférence au moins 3.
[0019] Dans des modes de réalisation préférés, m vaut au plus 15,
de préférence au plus 10, et de manière
davantage préférée au plus 5.
[0020] Dans des modes de réalisation préférés, m vaut 1, 2 ou 3 ; de
préférence 2 ou 3, et de manière davantage
préférée 3.
[0021] Comme indiqué ci-dessus, chaque R1, dans chaque unité de
répétition individuelle, représente
indépendamment un groupe bivalent. Cela signifie que différentes unités de
répétition dans le polymère peuvent
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
8
comprendre différents groupes bivalents. Plus précisément, lorsque plus d'un
groupe bivalent est présent, une partie
des unités de répétition dans le polymère comprendra un premier groupe
bivalent, une autre partie des unités de
répétition comprendra un groupe bivalent, s'il existe un troisième groupe
bivalent, alors encore une autre partie des
motifs de répétition comprendra le troisième groupe bivalent, et ainsi de
suite pour chaque groupe bivalent. Par
exemple, un polymère peut comprendre des unités de répétition (lithiées et/ou
non lithiées), dans lequel R1 est un
alkylène ainsi que d'autres unités de répétition (lithiées et/ou non
lithiées), dans lequel R1 est -CH2-CH2-(0-CH2-CH2)n,-
. Comme autre exemple, le polymère peut comprendre des unités de répétition,
dans lequel R1 est -CH2-CH2-(0-CH2-
CH2)m-, dans lequel m vaut 3, et d'autres unités de répétition, dans lequel R1
est également -CH2-CH2-(0-CH2-CH2)m-
, mais dans lequel m vaut 4.
[0022] Dans des
modes de réalisation préférés, chaque R1 dans chaque unité de répétition
individuelle
représente un même groupe bivalent ; en d'autres termes, chaque unité de
répétition dans le polymère comprend le
même groupe bivalent. Dans de tels modes de réalisation préférés, R1
représente de préférence un alkylène ou -CH2-
CH2-(0-CH2-CH2)m- ; de manière davantage préférée -CH2-CH2-(0-CH2-CH2)m-, dans
lequel l'alkylène et m sont tels
que définis ci-dessus, y compris les modes de réalisation préférés de celui-
ci.
[0023] Dans
d'autres modes de réalisation préférés, chaque R1 dans chaque unité de
répétition individuelle
représente indépendamment un total de plus d'un groupe bivalent. En d'autres
termes, différentes unités de répétition
dans le polymère contiennent différents groupes bivalents. Cela signifie que
R1 représente un premier groupe bivalent
dans certaines des unités de répétition lithiées et des unités de répétition
non lithiées, tandis que R1 représente
indépendamment un deuxième, troisième, quatrième (et ainsi de suite) groupe
bivalent (de préférence un deuxième
ou troisième groupe bivalent, et de manière davantage préférée un deuxième
groupe bivalent) dans d'autres unités de
répétition lithiées et d'autres unités de répétition non lithiées, les
deuxième, troisième ou quatrième (et ainsi de suite)
groupes bivalents étant différents les uns des autres et différents du premier
groupe bivalent. Dans de tels modes de
réalisation préférés, chaque R1 dans chaque unité de répétition individuelle
représente indépendamment un total de
deux groupes bivalents. Dans ces modes de réalisation préférés, ces plus d'un
(de préférence deux) groupes bivalents
sont indépendamment un groupe alkylène et/ou -CH2-CH2-(0-CH2-CH2)m-. Dans des
modes de réalisation plus
préférés, chaque R1 dans chaque unité de répétition non lithiée individuelle
représente indépendamment un total de
deux groupes bivalents, dans lequel :
= l'un des deux groupes bivalents est un alkylène et l'autre des deux
groupes bivalents est-CH2-CH2-(0-CH2-
CH2)m-, ou
= l'un des deux groupes bivalents est -CH2-CH2-(0-CH2-CH2)m-, dans lequel m a
une première valeur, et l'autre
des deux groupes bivalents est -CH2-CH2-(0-CH2-CH2)m-, dans lequel m a une
seconde valeur différente de
la première valeur.
Dans tous ces cas, l'alkylène et m sont tels que définis ci-dessus, y compris
les modes de réalisation préférés de ceux-
ci. Dans de tels modes de réalisation préférés, les première et deuxième
valeurs pour m sont choisies parmi 1, 2 et 3;
de préférence de 2 et 3.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
9
[0024] Dans les modes de réalisation préférés entre tous :
= chaque R1 dans chaque unité de répétition individuelle représente -CH2-
CH2-(0-CH2-CH2),, dans lequel m
vaut 2 ou 3, de préférence 3;
= chaque R1 dans chaque unité de répétition individuelle représente
indépendamment un total de deux groupes
bivalents, dans lequel l'un des deux groupes bivalents est -0H2-0H2-(0-0H2-
0H2)m-, dans m vaut 2, et l'autre
des deux bivalents groupes est -0H2-0H2-(0-0H2-0H2)m-, dans lequel m vaut 3 ;
= chaque R1 dans chaque unité de répétition lithiée individuelle représente
indépendamment un total de deux
groupes bivalents, l'un des deux groupes bivalents étant le 2,2,3,3-
tétrafluoro-1,4-butylène et l'autre des deux
groupes bivalents étant le -CH2-CH2-(0-CH2-CH2)m-, m valant 2 ou 3, de
préférence 3.
[0025] Dans des
modes de réalisation préférés, les unités de répétition sont disposées de
manière aléatoire dans
le polymère. Cela signifie que les unités de répétition lithiées et non
lithiées ne sont pas séparées les unes des autres
(comme elles le seraient dans un copolymère bloc), ni placées dans un
quelconque ordre particulier dans le polymère
(par exemple, elles n'ont pas besoin d'être alternées). Cela signifie
également que les unités de répétition contenant
des groupes bivalents différents ne sont pas séparées les unes des autres, ni
placées dans un quelconque ordre
particulier dans le polymère.
[0026]
Les polymères de l'invention peuvent être fabriqués comme décrit dans la
section suivante. Typiquement,
ces polymères ont une masse molaire comprise entre 50 000 et 5 000 000 pie'.
[0027]
De plus, ils n'ont généralement pas de cristallinité avec une
température de transition vitreuse (Tg)
d'environ -30 C.
Procédé de fabrication
[0028]
Dans un aspect apparenté de l'invention, on propose un procédé de
fabrication des polymères ci-dessus.
Le procédé comprend la réaction catalytique oxydante du sulfamide avec un diol
en présence d'un sel de cuivre et
éventuellement d'une base de lithium.
[0029]
Le polymère de l'invention peut en effet être produit par une réaction
catalytique oxydante. Dans cette
réaction, le sulfamide (NH2-S02-N H2) et un diol correspondant au R1 souhaité
sont mis en réaction ensemble. Des
exemples de schémas réactionnels génériques sont fournis ci-dessous :
Sel de cuivre
H2N NH0 OH-R1-OH ____________ --NH NH R1)
\ /
0 0 0 0
, exempt d'unités de
répétition lithiées,
Sel de cuivre
H2N NHn OH-R1-OH ____________ --NH NH R1 )
\ /
0 0 Base de lithium
0 0
, comprenant des
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
unités de répétition lithiées,
Dans lequel R1 est tel que défini dans la section précédente.
[0030] Comme on peut le voir ci-dessus, le diol perd ses deux
groupes hydroxyle dans la réaction, donnant le
groupe R1 dans le polymère de l'invention. Par conséquent, le diol peut être
choisi en fonction du groupe R1 souhaité
5 dans le polymère.
[0031] Pour préparer des polymères de l'invention dans lesquels
chaque R1 dans chaque unité de répétition
individuelle représente indépendamment un total de plus d'un groupe bivalent,
il suffit d'utiliser deux diols différents
dans la réaction ci-dessus. Cela produira ainsi un polymère contenant des
unités de répétition avec des groupes
bivalents R1 provenant d'un diol ainsi que des unités de répétition avec des
groupes bivalents R1 provenant d'un autre
10 diol (et ainsi de suite si plus de deux diols sont utilisés).
[0032] Dans cette réaction, le diol agit également comme solvant
de réaction.
[0033] Le temps de réaction peut aller de 3 heures à 12 heures
selon le diol utilisé.
[0034] Le diol est typiquement utilisé en excès car il joue
également le rôle de solvant de réaction. Dans des
modes de réalisation préférés, le sulfamide et le(s) diol(s) sont utilisés
dans un rapport molaire sulfamide:diol total de
1:4.
[0035] Le système catalytique de cette réaction comprend un sel de
cuivre et éventuellement une base de lithium.
Pour produire un polymère exempt d'unités de répétition lithiées, la base de
lithium est omise. Cependant, pour
produire un polymère comprenant des unités de répétition lithiées, une base de
lithium est utilisée. Cela permet de
produire un polymère comprenant jusqu'à 60 % d'unités de répétition lithiées.
Pour produire des polymères avec des
taux de lithiation plus élevés (jusqu'à 100 % d'unités de répétition), le
procédé comprend en outre l'étape de passage
des polymères dans une résine échangeuse d'ions après la polymérisation du
polymère.
[0036] Des exemples non limitatifs de sels de cuivre comprennent
le triflate de cuivre et l'acétate de cuivre. De
préférence, le sel de cuivre est l'acétate de cuivre car il permet l'obtention
de polymères à unités de répétition lithiées
(contrairement au triflate de cuivre).
[0037] De préférence, la base lithium est le carbonate de lithium.
[0038] Des exemples non limitatifs de résines échangeuses d'ions
comportent les résines de silice, telles que la
résine DowexTM 50X8 H', traitées avec des ions lithium.
[0039] Dans des modes de réalisation, le carbonate de lithium et
l'acétate de cuivre sont utilisés pour la
production de polymères comprenant jusqu'à environ 60 % d'unités de répétition
lithiées. Dans d'autres modes de
réalisation, le triflate de cuivre est utilisé sans base pour produire des
polymères exempts d'unités de répétition lithiées.
[0040] Dans des modes de réalisation, les solides (le sulfamide,
le sel de cuivre et la base de lithium si elle est
utilisée) sont d'abord mélangés ensemble, puis le diol est ajouté.
[0041] Ce procédé est illustré dans les exemples ci-dessous pour
produire des polymères linéaires avec une
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
11
masse molaire comprise entre 5 000 et 5 000 000 gmol-1. De plus, ces polymères
n'ont généralement pas de
cristallinité avec une température de transition vitreuse (Tg) d'environ -30
C.
Utilisations et applications
[0042] Les polymères de l'invention peuvent être utilisés comme
électrolytes de batterie.
[0043] Dans des modes de réalisation, lorsqu'il est utilisé comme
électrolyte de batterie, le polymère de l'invention
est dans une batterie comprenant une anode, une cathode et un électrolyte
entre l'anode et la cathode, dans lequel
l'électrolyte comprend le polymère de l'invention.
Définitions
[0044] L'utilisation des termes un et une et le/la et
des références similaires dans le contexte de la
description de l'invention (en particulier dans le contexte des revendications
suivantes) doit être interprétée comme
couvrant à la fois le singulier et le pluriel, sauf si indiqué autrement ici
ou contredit clairement par le contexte.
[0045] Les termes comprenant , ayant , comportant et
contenant doivent être interprétés comme
des mots ouverts (c'est-à-dire signifiant y compris, mais sans s'y limiter
), sauf indication contraire. En revanche,
l'expression constitué de exclut tout élément, toute étape, tout
ingrédient non spécifié ou analogue. L'expression
constitué essentiellement de limite la portée aux matériaux ou étapes
spécifiés et à ceux qui n'affectent pas
matériellement la ou les caractéristiques de base et nouvelles de l'invention.
[0046] La récitation des plages de valeurs ici est simplement
destinée à servir de procédé abrégé pour se référer
individuellement à chaque valeur distincte entrant dans la plage, sauf
indication contraire ici, et chaque valeur distincte
est incorporée dans la spécification comme si elle était individuellement
citée ici. Tous les sous-ensembles de valeurs
dans les plages sont également incorporés dans la spécification comme s'ils
étaient individuellement cités ici.
[0047] De même, ici, une structure chimique générale, telle que la
formule I, avec divers substituants (Ri, R2,
etc.) et divers radicaux (alkyle, atome d'halogène, etc.) énumérés pour ces
substituants est destinée à servir de
procédé abrégé pour se référer individuellement à chaque molécule obtenue par
la combinaison de l'un quelconque
des radicaux pour l'un quelconque des substituants. Chaque molécule
individuelle est incorporée dans la description
comme si elle était individuellement citée ici. En outre, tous les sous-
ensembles de molécules dans les structures
chimiques générales sont également incorporés dans la description comme s'ils
étaient individuellement cités ici.
[0048] Tous les procédés décrits ici peuvent être exécutés dans
n'importe quel ordre approprié, sauf en cas
d'indication contraire dans la présente invention ou de contradiction claire
par le contexte.
[0049] L'utilisation de tous les exemples ou de tous les termes
appelant des exemples (par exemple, tel que )
fournis ici vise simplement à mieux éclairer l'invention et ne constitue pas
une limitation de la portée de l'invention,
sauf indication contraire.
[0050] Aucun langage dans la description ne doit être interprété
comme indiquant un élément non revendiqué
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
12
comme essentiel à la pratique de l'invention.
[0051] Ici, le terme à propos prend son sens ordinaire. Dans
des modes de réalisation, cela peut signifier plus
ou moins 10 % ou plus ou moins 5 % de la valeur numérique qualifiée.
[0052] Sauf définition contraire, tous les termes techniques et
scientifiques utilisés ici ont la même signification
que celle communément comprise par l'homme du métier auquel appartient cette
invention.
[0053] Ici, les termes alkyle et alkylène ainsi que leurs
dérivés (tels qu'alcoxy, alkylèneoxy, etc.) ont leur
sens ordinaire dans la discipline technique. Pour plus de certitude, voir ci-
dessous :
Terme Définition
Hydrocarbures aliphatiques saturés
alcane hydrocarbure aliphatique de formule générale
C,112,2
alkyle radical alcane monovalent de formule
générale -CnE121-1+1
alkylène radical alcane bivalent de formule générale -
CnH2-
(également appelé alcanediyle)
[0054] Il est à noter que, sauf indication contraire, les chaînes
hydrocarbonées des groupes ci-dessus peuvent
être linéaires ou ramifiées. En outre, sauf indication contraire, ces groupes
peuvent contenir entre 1 et 18 atomes de
carbone, plus précisément entre 1 et 12 atomes de carbone, entre 1 et 6 atomes
de carbone, entre 1 et 3 atomes de
carbone, ou contenir 1 ou 2, de préférence 1, ou de préférence 2 atomes de
carbone.
[0055] Ici, les termes aryle et leurs dérivés prennent leur
sens ordinaire dans la discipline technique. Pour
plus de certitude, voir ci-dessous :
Terme Définition
arène hydrocarbure aromatique présentant des liaisons simples et
doubles alternées entre des atomes de
carbone disposés en un ou plusieurs cycles.
aryle radical arène monovalent
arylène radical arène bivalent
[0056] Il est à noter que, sauf indication contraire, chaque cycle
des groupes ci-dessus peut comprendre entre 4
et 8, de préférence 5 ou 6 atomes de cycle.
[0057] De plus, chacun des composés ci-dessus peut comprendre plus
d'un cycle. En d'autres termes, ils peuvent
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
13
être polycycliques. Les arènes polycycliques sont composés de multiples cycles
aromatiques (cycles organiques dans
lesquels les électrons sont délocalisés). Les arènes polycycliques comprennent
des aromatiques fusionnés. Ce sont
des composés qui comprennent deux cycles aromatiques ou plus fusionnés par le
partage de deux atomes de carbone
voisins. Les composés les plus simples de ce type sont le naphtalène, ayant
deux cycles aromatiques, et les composés
à trois cycles anthracène et phénanthrène. Les arènes polycycliques
comprennent également des composés dans
lesquels des cycles aromatiques sont liés les uns aux autres par une liaison
covalente ou un atome de carbone (portant
0, 1 ou 2 atomes d'hydrogène selon les besoins selon le nombre de noyaux
aromatiques auxquels ils sont liés).
[0058] Ici, un atome du cycle , tel qu'un atome de carbone du
cycle ou un hétéroatome du cycle, fait référence
à un atome qui forme (avec d'autres atomes du cycle) un cycle d'un composé
cyclique, tel qu'un cycloalkyle, un aryle,
etc.
[0059] Ici, un hétéroatome est un atome autre qu'un atome de
carbone ou un atome d'hydrogène. De
préférence, l'hétéroatome est l'oxygène ou l'azote.
[0060] D'autres objets, avantages et caractéristiques de la
présente invention apparaîtront plus clairement à la
lecture de la description non limitative suivante de modes de réalisation
spécifiques de celle-ci, donnée à titre
d'exemple uniquement en référence aux dessins en annexe.
DESCRIPTION DE MODES DE RÉALISATION ILLUSTRATIFS
[0061] La présente invention est illustrée plus en détail par les
exemples non limitatifs suivants.
Synthèse des polymères
[0062] Les polymères de l'invention ont été synthétisés à l'aide
du procédé de fabrication décrit ci-dessus.
[0063] Brièvement, le sulfamide, l'acétate de cuivre, le diol et le
carbonate de lithium ont été ajoutés à un ballon
équipé d'un agitateur et d'un condenseur. Le ballon a été placé dans un bain
de sable chauffé à 170 C de sorte que
la température était d'environ 165 C dans le ballon. On a laissé la réaction
se dérouler pendant 5 à 12 heures en
fonction du diol. Ensuite, le chauffage a été arrêté et 10 à 20 ml de méthanol
ont été ajoutés lentement pour arrêter la
réaction. Le mélange réactionnel a ensuite été laissé à refroidir puis passé à
travers de la CeliteTM prélavée avec du
méthanol. Le mélange réactionnel a été évaporé jusqu'à ce que son volume soit
la moitié de son volume d'origine,
puis précipité dans 10 fois le volume d'acétate d'éthyle refroidi à 4 C pour
purification. On a laissé le polymère coller
aux parois du récipient pendant quelques minutes. Ensuite, le récipient a été
mis au congélateur pendant 15 minutes.
Enfin, le mélange a été décanté et séché dans une étuve sous vide pendant
quelques heures à 60 C. Si des particules
insolubles sont présentes, elles peuvent être détectées visuellement. Le
polymère a été dissous dans un minimum de
méthanol et versé dans cinq volumes de dichlorométhane. Le précipité a été
éliminé par centrifugation et la solution
avec le polymère soluble a été évaporée à sec. Le polymère a été séché dans
une étuve sous vide à 60 C
[0064] Les autres conditions réactionnelles étaient les suivantes
:
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
14
Polymère Diol Sulfamide Sel de cuivre Base
Durée
(rendement)
Exemple la Tétraéthylène 1 éq Acétate de
cuivre Li2003 3 h
glycol (41
%)
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple lb Tétraéthylène 1 éq Acétate de
cuivre Li2CO3 5h
glycol (74
%)
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple lc Tétraéthylène 1 éq Acétate de
cuivre Li2003 12 h
glycol (55
%)
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple Id Tétraéthylène 1 éq Acétate de
cuivre Li2003 5 h
glycol (72,0 ml)
480 mg pour 10,0 g de 1,2 éq (65
%)
sulfamide
Exemple 2a Triéthylène 1 éq Acétate de cuivre Li2CO3 5
h (58 %)
glycol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple 2b Triéthylène 1 éq Acétate de cuivre Li2003
12 h (27 %)
glycol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple 3a Diéthylene 1 éq Acétate de cuivre Li2003 3
h (44 %)
glycol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple 3b Diéthylene 1 éq Acétate de cuivre Li2CO3 5
h (39 %)
glycol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple 3c Diéthylene 1 éq Acétate de cuivre Li2CO3
6,5 h (35 ')/0)
glycol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
Polymère Diol Sulfamide Sel de cuivre Base
Durée
(rendement)
Exemple 3d Diéthylene 1 éq Acétate de cuivre Li2003 12
h (45 %)
glycol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple 3e Diéthylene 1 éq Triflate de cuivre 100 mg pour
Aucun 1 h (62 %)
glycol 2,0 g de sulfamide
1 éq
Exemple 3f Diéthylene 1 éq Triflate de cuivre 150 mg pour
Aucun 22 h (25 %)
glycol 2,0 g de sulfamide
1 éq
Exemple 3g Diéthylene 1 éq Triflate de cuivre 150 mg pour
Aucun 12 h (39 %)
glycol 2,0 g de sulfamide
4 éq
Exemple 4a Éthylène glycol 1 éq Acétate de cuivre Li2CO3 5 h
(comparatif) 4 éci
60 mg pour 1,25 g de 1,2 éq
Aucun
sulfamide
polymère
obtenu
Exemple 4b Éthylène glycol 1 éq Acétate de cuivre Li2003 12
h
(comparatif) 4 ég
60 mg pour 125g de 1,2 éq
Aucun
polymère
sulfamide
obtenu
Exemple 5a 1,3- 1 éq Acétate de cuivre Li2003 5h
(52 %)
propanediol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple 5b 1,3- 1 éq Acétate de cuivre Li2003 12
h (44 %)
propanediol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
Exemple 6 PEG 400 Mn 1 éq Acétate de cuivre Li2003 4
h (60 %)
4 éq 60 mg pour 125g de 1,2 éq
sulfamide
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
16
Polymère Diol Sulfamide Sel de cuivre Base
Durée
(rendement)
Exemple 7 2,2,3,3- 1 éq Acétate de cuivre Li2003 12
h (70 %)
Tétrafluoro-
240 mg pour 5,00 g de 1,2 éq
1,4-butanediol
sulfamide
2,0 g
tétraéthylène
glycol
34,0 ml
Exemple 8 Triéthylène 1 éq Acétate de cuivre Li2CO3 5
h (66 %)
glycol
240 mg pour 5,00 g de 1,2 éq
17,0 ml
sulfamide
tétraéthylène
glycol
18,0 ml
Exemple 9 Benzène-1,4- 1 éq Acétate de cuivre Li2CO3
Aucun
(comparatif) diol
polymère
60 mg pour 1,25 g de 1,2 éq
4 éq obtenu
sulfamide
Exemple 10 cis-2-butène- 1 éq Acétate de cuivre Li2003 12
h
(comparatif) 1,4-diol
Aucun
60 mg pour 1,25 g de 1,2 éq
polymère
4 éq sulfamide
obtenu
Exemple 11 1,6- hexane 1 éq Acétate de cuivre Li2003
5h (50 %)
diol
60 mg pour 1,25 g de 1,2 éq
4 éq sulfamide
[0065] Les inventeurs ont observé que les rendements de la
réaction étaient légèrement supérieurs lorsque les
solides (sulfamide, sel de cuivre et base de lithium si elle est utilisée)
étaient d'abord mélangés avant l'ajout du diol.
Degré de lithiation
[0066] Pour augmenter le niveau de lithiation, certains des polymères ci-
dessus ont été passés à travers une
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
17
résine échangeuse d'ions. En l'occurrence, le polymère a été dissous dans un
minimum de méthanol et agité pendant
12 heures avec 30 % en masse de la résine de Li décrite ci-dessous. La
solution a été filtrée et évaporée à sec.
Sécher sous vide à 60 C pendant 4 heures.
[0067] Résine DoexTM 50X8 H': Une colonne de verre (environ 30 g)
a été remplie de résine et humidifiée avec
une solution aqueuse 2M de Li0H. Une fois que le liquide sortant du robinet de
la colonne était basique, l'éluant a été
changé en eau ultrapure jusqu'à ce qu'un pH neutre soit atteint. Ensuite, la
résine a été lavée avec 300 ml de méthanol.
La résine a été séchée à 60 C pendant 12 heures. Un autre procédé consistait
à mettre la résine dans un bécher
avec 300 ml de LiOH 2M dans de l'eau. Agiter pendant 12 heures puis filtrer et
laver à l'eau ultrapure jusqu'à obtention
d'un pH neutre puis traiter avec du méthanol et sécher.
[0068] Le degré de lithiation des polymères de départ et des polymères
après le traitement avec la résine
échangeuse d'ions a été calculé à partir de leurs spectres de RMN Li7 solides
sur la base de l'étalonnage avec du LiCI.
[0069] Les polymères et leurs degrés de lithiation avant et après
traitement étaient les suivants :
% mol Li
Polymère de Avant résine Après
résine
Polymère Diol
départ échangeuse d'ions
échangeuse d'ions
Exemple Polymère de
Tétraéthylène glycol Non disponible 86 %
12 l'exemple 1d
Exemple Polymère de
Triéthylène glycol 63 % 93 %
13 l'exemple 2a
Exemple Polymère de
Diéthylene glycol Non disponible 60 %
14 l'exemple 3d
2,2,3,3-tétrafluoro-1,4-
Exemple Polymère de
butanediol + tétraéthylène Non disponible 38 %
l'exemple 7
glycol
Exemple Polymère de Tétraéthylène glycol
Non disponible 79 %
16 l'exemple 8 + triéthylène glycol
Caractérisation par RMN et élucidation de la structure
15 [0070] Les spectres de RMN H1 liquides des polymères produits ont été
enregistrés à l'aide de Bruker Ultrashield
300.
[0071] Les pics de RMN pour ces polymères étaient les suivants.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
18
Polymère List of NMR peaks
Polymères de l'exemple 1 1.3 ppm; 2.1 ppm; 3.3 ppm; 3.4 ppm; 3.5 ppm;
3.6 - 3.9 ppm; 4.0 ppm; 4.2 ppm
(D20)
(diol = tétraéthylène glycol)
De l'exemple la 0.97 ppm; 1.46 ppm; 1.81 ppm; 2.33 ppm; 2.58
ppm; 2.71 ppm; 2.99 ppm; 3.2-3.4
(diol = tétraéthylène glycol) ppm; 3.64 ppm; 4.48 ppm; 5.56 ppm (DMSO d-6)
De l'exemple 12 (Exemple la 0.87 ppm; 2.33 ppm; 2.79 ppm; 3.1-3.5 ppm; 3.63
ppm; 3.99 ppm; 4.26 ppm; 4.43
lithiated) ppm (DMSO d-6)
(diol = tétraéthylène glycol)
Polymères de l'exemple 2 2.1 ppm; 2.3 ppm; 3.6 - 3.9 ppm; 4.0 ppm; 4.2
ppm (D20)
(diol = triéthylène glycol)
Polymères de l'exemple 3 3.6- 3.9 ppm; 4.0 ppm, 4,2 ppm (D20)
(diol = diéthylène glycol)
Polymères de l'exemple 5 1.7 - 2.0 ppm; 3.0 - 3.2 ppm; 3.6 - 3.8 ppm;
4.1 ppm (D20)
(diol = 1,3-propanediol)
De l'exemple 6 3.6 - 3.9 ppm; 4.2 ppm (D20)
(diol = PEG 400)
De l'exemple 7 2.43 ppm; 3.13 ppm; 3.3-3.5 ppm; 3.73 ppm;
4.05 ppm; 4.53 ppm (DMSO d-6)
(diol = 2,2,3,3-tétrafluoro-1,4-
butanediol
+ tétraéthylène glycol)
De l'exemple 11 1.2 - 1.8 ppm; 2.0 ppm; 2.5 ppm; 2.8 ppm; 2.9
ppm; 3.2 -3.8 ppm; 4.4 ppm; 7.2
ppm (DMSO d-6)
(diol = 1,6- héxanediol)
[0072] Collectivement, les spectres de FTIR et de RMN du polymère
de l'invention ont montré que, dans les
unités de répétition lithiées, les atomes d'azote ont perdu un de leurs atomes
d'hydrogène et sont coordonnés avec
un atome de lithium, formant ainsi un complexe avec cet ion lithium.
[0073] La figure 1 montre le spectre de FTIR du polymère de l'exemple 13
(c'est-à-dire le polymère de l'exemple
2a après traitement avec la résine échangeuse d'ions). La bande attribuée à la
vibration de l'imine (C=N) (base de
Schiff) et située à 1628 cm-1 est décalée à 1653 cm-1 (décalage de 25 cm-1) et
la bande située à 1712 cm-lest absente
du spectre après traitement. Cela indique que les atomes d'azote forment un
complexe avec l'ion lithium.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
19
Polymère Liste des pics de FTIR (cm-1)
De l'exemple 2a 3382 ; 2931 ; 2875 ; 1712 ; 1628 ; 1456 ; 1351 ;
1215 ; 1082 ; 1057 ; 1018 ; 916 ; 801 ; 769
De l'exemple 13 3345 ; 2931 ; 2872 ; 2293 ; 1653 ; 1456 ; 1350 ;
1211 ; 1086 ; 1055 ; 1017 ; 916 ; 820 ; 769
[0074] Les polymères ont également été caractérisés par la mesure
de récupération d'inversion du temps de
relaxation longitudinale de RMN (Ti) pour les noyaux 1H, 7Li et 19F. Des
expériences de RMN ont été réalisées à
l'aide d'un spectromètre RMN Bruker Avance III à 600 MHz équipé d'une sonde à
large bande de 5 mm à double
résonance. Les mesures de Ti ont été effectuées dans la plage de températures
de 326 à 371 K pour le polymère de
l'exemple 2a et de 330 à 378 K pour le polymère contenant du LiTFSI. Le délai
de récupération variait en 16 étapes
de 100 ps à5 s.
[0075] La caractérisation de la dynamique locale au sein de la
structure du polymère à l'aide de la technique de
relaxation RMN T1 a révélé que Li est principalement situé près de l'azote
dans les polymères.
[0076] La figure 2 montre le spectre NRM 1H solide des polymères
de l'exemple 2a, de l'exemple 13 et de
l'exemple 2a avec 20 % en poids de LITFSI. Le pic de NH est décalé vers la
droite pour le polymère de l'exemple 13
(5,3 ppm) par rapport aux polymères de l'exemple 2a où ce pic était à 5,8 ppm.
La position de ce pic dépend donc du
degré de lithiation. Dans le spectre du polymère de l'exemple 2a avec 20 % en
poids de LITFSI, ce pic se chevauche
probablement à 5,0 ppm avec les signaux de CH2.
Caractérisation supplémentaire
[0077] Il a été démontré que le procédé produit des polymères
linéaires avec des masses molaires différentes.
Ceux-ci n'ont pas de cristallinité avec une température de transition vitreuse
(Tg) d'environ -30 C ou moins.
[0078] La masse molaire des polymères produits a été déterminée
par chromatographie en phase gazeuse
(GPC) dans le DMF à 60 C avec un étalonnage universel basé sur des étalons de
poly(styrène). La masse molaire
des polymères produits (exemples 36 et 3f) a été déterminée par GPC dans de
l'eau à 40 C avec triple détection. La
Tg a été déterminée par DSC, 2 cycles à 10 C/min. Les résultats sont résumés
dans le tableau ci-dessous.
Polymère Masse molaire (Mn) (g/mol) Tg ( C)
Exemple la Non disponible -31
Exemple lb Non disponible -55
Exemple 2a Non disponible
Exemple 3a Non disponible -42
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
Exemple 3e 33 200; 7 700 Non disponible
Exemple 3f 120 000 Non disponible
Exemple 7 8 000; 7 600 ; 3 500 Non disponible
Exemple 8 Non disponible -57
Exemple 11 5 100; 5 800 -68
[0079] Les figures 3 et 4 montrent les résultats de l'analyse
thermogravimétrique (ATG) pour le polymère des
exemples lb et 3a, respectivement. Les polymères sont un profil typiquement de
polymère et présentent une stabilité
à la chaleur relativement bonne.
5 Conductivité des polymères
[0080] La conductivité du polymère a été mesurée comme décrit ci-
dessous.
Préparation des solutions
[0081] Dans une chambre anhydre, un gramme du polymère 2a a été
inséré dans chacun des 6 flacons séparés.
Ensuite, à chaque flacon ont été ajoutés 0, 10, 20, 30, 40 ou 50 % p/p de
bis(trifluorométhanesulfonyl)imide de lithium
10 (LiTFSI). Ces pourcentages sont basés sur le poids total du
mélange polymère/LiTFSI (20 % p/p de LiTFSI = 1 g de
polymère + 0,25 g de LiTFSI). Les échantillons ont été vortexés. Ensuite, un
solvant (Me0H anhydre) a été ajouté et
les échantillons ont été mélangés jusqu'à ce qu'ils présentent une viscosité
semblable à celle du miel. Les échantillons
ont été homogénéisés à l'aide d'un mélangeur à rouleaux pendant la nuit ou
jusqu'à l'obtention de solutions
homogènes
15 Revêtement
[0082] Les matériaux utilisés étaient :
= Table de revêtement Zehntner ZAA 2300,
= Applicateur de film carré (Dr BladeCi) (5 cm),
= Éthanol anhydre,
20 = Collecteur en acier inoxydable prélavé, et
= Ruban en polypropylène.
[0083] La table de revêtement et l'applicateur ont été lavés avec
de l'éthanol. Le collecteur en acier inoxydable
a été placé sur la table de revêtement (sous la barre de support) et une
petite quantité d'éthanol a été ajoutée sous le
collecteur puis lissée avec un Kimwipe pour assurer une bonne adhérence à la
table de revêtement ainsi qu'une
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
21
surface lisse. Des bandes de polypropylène de la largeur de l'applicateur de 5
cm ont été ajoutées (sous la barre de
support). L'applicateur a été placé sur les bandes de polypropylène.
L'épaisseur choisie pour le polysulfonamide était
de 5 mils + 1 mils (ruban de polypropylène). Le mélange de polymères a été
ajouté avec une spatule dans l'applicateur
et le revêtement a commencé (vitesse de revêtement de 8 tr/min).
L'applicateur, l'excès de mélange et les bandes de
polypropylène ont été retirés. Le film a été placé sur une plaque d'acier, qui
a ensuite été placée dans une étuve sous
vide préchauffée à 80 C. Le film est resté dans l'étuve sous vide pendant une
nuit.
Assemblage de pile bouton
[0084] Le polymère étant très collant, l'assemblage est difficile
et pour faciliter la tâche, les films ont été préparés
dans une chambre anhydre. Les batteries ont été assemblées dans une boîte à
gants de laboratoire.
[0085] La figure 5 est une vue éclatée de la pile bouton (10) utilisée pour
ces tests. Tout d'abord, le film polymère
(12) et le collecteur en acier inoxydable (14), tels que préparés à l'étape
précédente, ont été découpés à dimension
(18 mm de diamètre). Ensuite, un espaceur de 0,5 mm d'épaisseur (16) du même
diamètre a été placée sur le film
polymère (12). Si l'espaceur (16) ne collait pas à la surface du film polymère
(12), le film polymère (12) était chauffé à
50 C pendant environ 1 minute, puis l'espaceur (16) était réappliqué.
[0086] L'épaisseur du film polymère (12) a été calculée à partir de
l'épaisseur totale mesurée de l'ensemble
collecteur en acier inoxydable (14), film polymère (12) et espaceur (16), par
la soustraction des épaisseurs du collecteur
en acier inoxydable (14) et l'espaceur (16), 28 pm et 500 pm, respectivement.
[0087] Enfin, l'ensemble collecteur en acier inoxydable (14), film
polymère (12) et espaceur (16) a été placé dans
un boîtier de pile bouton (18). Un second espaceur de 0,5 mm d'épaisseur (20)
puis un joint en plastique (22) ont été
placés sur le dessus de l'ensemble. La pile bouton a été placée sous vide
pendant 1h. Enfin, les piles bouton ont été
fermées avec un couvercle de pile bouton (24), muni d'un sprint soudé (26),
puis scellé avec une pince à sertir.
Mode opératoire d'analyse de conductivité et analyse des données
[0088] Les batteries ont été placées dans un four Espec . Un
cycleur BioLogic VMP3 a été utilisé pour mesurer
la conductivité entre 10 C et 90 C par incréments de 10 C, deux fois.
[0089] A chaque température, deux mesures d'impédance ont été effectuées
pour assurer la stabilité thermique
de l'échantillon. Au total, 36 valeurs d'impédance ont été mesurées. Si les
deux impédances étaient identiques, alors
seule la première valeur d'impédance a été utilisée pour l'analyse.
[0090] L'option ZFit d'EC-Lab a été utilisée pour la détermination
la valeur de la résistance connectée à
l'électrolyte. Si le demi-cercle sur l'impédance était parfaitement
symétrique, le circuit équivalent illustré sur la figure 6
a été utilisé et la valeur R2 a été utilisée pour le calcul de la
conductivité. En revanche, si le demi-cercle n'était pas
symétrique ou s'il y avait deux demi-cercles, le circuit équivalent représenté
sur la figure 7 a été utilisé. Encore une
fois, la valeur R2 a été utilisée pour le calcul de la conductivité.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
22
[0091] Pour calculer la conductivité, on a utilisé l'équation
suivante :
T x 0,0001
Conductivité = __________________________________________
A x R
dans laquelle :
T est l'épaisseur calculée du film polymère (12) en pm,
A est la surface de contact entre le film polymère (12) et l'espaceur (16) en
cm2 - ici cette valeur était de 2,01 cm2,
R est la résistance mesurée à l'aide du circuit équivalent (voir Figures 6 et
7), et
la conductivité calculée est en S/cm.
Résultats de conductivité
[0092] La figure 8 montre les résultats de conductivité pour le
polymère de l'exemple 2a (fabriqué à partir de
triéthylène glycol) avec 0, 20, 30, 40 ou 50 % en poids/poids de LiTFSI.
[0093] La figure 9 montre les résultats de conductivité pour le
polymère de l'exemple la (fabriqué à partir de
tétraéthylène glycol) avec 0, 10, 20 ou 30 % en poids/poids de LiTFSI.
[0094] La figure 10 compare les conductivités à 50 C pour le
polymère de l'exemple 2a (fabriqué à partir de
triéthylène glycol) et le polymère de l'exemple la (fabriqué à partir de
tétraéthylène glycol) à différents niveaux de sel.
[0095] On peut voir, d'après ce qui précède, que le polymère fabriqué à
partir de tétraéthylène glycol présentait
des conductivités plus élevées que le polymère fabriqué à partir de
triéthylène glycol. De plus, ce polymère fabriqué à
partir de tétraéthylène glycol présentait les conductivités les plus élevées
sans sel : la conductivité était de 4,10 x 10
SCM-1 à 50 C.
[0096] La figure 11 montre la conductivité du polymère de
l'exemple lb mélangé à 15 % en poids de polymère
H0674 (une courbe enregistrée lors du chauffage, l'autre enregistrée lors du
refroidissement). Le polymère H0674
est un polymère tel que décrit dans le brevet n US 7 897 674, utilisé pour
augmenter les propriétés mécaniques du
mélange résultant.
[0097] La figure 12 montre la conductivité à 50 C des polymères
des exemples lb et 7, avec ou sans sel, avec
ou sans polymère HQ674, et compare la conductivité du polymère HQ674. Les
résultats sont également résumés ci-
dessous :
Échantillons Conductivité à 50 C Épaisseur
HQ-674 + LiTFSI 20 % en poids 2,13 E-04 50 pm
1,65E-04 20 pm
Exemple 7 - Pas de sel 0,632 E-04 30 pm
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
23
Exemple 1 b + 30 A HQ674, 20 % en poids LiTFSI 0,576 E-04 60 pm
Exemple lb, Pas de sel 0,0342 E-04 50 pm
[0098] La Figure 13 montre les résultats de conductivité pour le
polymère de l'exemple 6 (fabriqué à partir de
PEG 400) seul, mélangé avec du fluorure de polyvinylidène, ou mélangé avec du
fluorure de polyvinylidène et du
phosphate de lithium aluminium titane (LATP).
[0099] L'énergie d'activation peut être extrapolée à partir de la pente de
la courbe de conductivité. L'énergie
d'activation des polymères de l'invention est présentée dans le tableau
suivant :
Polymère Énergie d'activation Énergie
d'activation Énergie d'activation
sans sel (eV) 20 A poids/poids de sel (eV) 50 A
poids/poids de sel (eV)
Exemple la 0,35 0,30 Non disponible
Exemple 2a 0,50 0,46 0,34
[00100] On peut voir que l'énergie d'activation est très différente
de celle typiquement observée pour les polymères
(cristal 1,7 eV POE + Li). Elle est bien meilleure et elle est en fait plus
proche de celle rapportée pour les céramiques
(0,30 eV). Les énergies d'activation sont une indication du mécanisme/mode de
conduction du polymère. On en conclut
donc que ce mécanisme est différent dans le polymère de l'invention par
rapport aux polymères habituels.
[00101] De plus, la RMN solide a montré que l'indice de transport
de Li était de 0,88.
Polymère Indice de transport Indice de transport
sans sel 20 % poids/poids de sel
Exemple la 0,88 0,47
[00102] A savoir, pour déterminer le nombre de transport, les temps
de relaxation de RMN longitudinal (T1) et
transversal (T2) des noyaux de 1H, 'Li et l'F ont été mesurés dans la plage de
température de 323 à 378 K à l'aide
d'un spectromètre RMN Bruker 600 MHz Avance III équipé d'une sonde à large
bande de 5 mm à double résonance.
Les fréquences de résonance de 1H, 'Li et 19F sont respectivement de 599,9,
233,1 et 564,4 MHz. Les données de Ti
ont été collectées à l'aide d'une expérience de récupération d'inversion avec
le délai de récupération variant en
16 étapes de 100 ps à 5 s et le délai de relaxation entre les balayages de 1
s. Une séquence d'impulsions standard
de Carr-Purcell-Meiboom-Gill (CPMG) a été utilisée pour mesurer 12 ; jusqu'à
480 échos ont été collectés avec un
retard d'écho de 200 s.
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
24
[00103]
Les coefficients de diffusion de 'H, 'Li et 19F ont été mesurés à 323 K
à l'aide d'un spectromètre RMN
Bruker 300WB fonctionnant à 300,3 MHz pour 1H, 116,7 MHz pour 7Li et 282,3 MHz
pour 19F, avec une sonde à
gradient Diff50 (force de gradient maximale de 2750 G/cm). Les données de
diffusion ont été recueillies à l'aide de la
séquence d'impulsions à retard de courant de Foucault longitudinal à gradient
bipolaire (BPLED). La force du gradient
de champ (g) a été augmentée en 16 étapes équidistantes jusqu'à 95 % de la
valeur maximale autorisée, tandis que
la longueur de l'impulsion de gradient (5) et le temps de diffusion (A) ont
été ajustés au noyau d'observation en fonction
du coefficient de diffusion attendu. En général, ,5 et A étaient
respectivement de l'ordre de 1 à 2 ms et de 100 à 200 ms.
[00104]
Comme il ressort de ce qui précède, les performances des polymères se
dégradent en présence d'un sel
de lithium, tel que LiTFSi. Une meilleure conductivité et un meilleur indice
de transport sont observés sans sel. Cela
est une preuve supplémentaire que l'on a un autre mode de conduction pour les
polymères de l'invention.
Balayages de CCD
[00105]
Afin d'étudier la performance électrochimique et de comprendre le
mécanisme de défaillance du polymère,
une cellule symétrique Li/Li a été préparée avec le polymère comme séparateur.
La capacité surfacique a été fixée à
1,28 mAh/cm2 et la densité de courant pour 1/nC (n=1, 1h de charge et 1h de
décharge) était de 1,28 mA/cm2. Les
densités de courant incrémentielles de 0,054 (0/24), 0,107 (0/12), 0,214
(0/6), 0,427 (C/3), 0,640 (0/2), 1,28 (10),
2,56 (2C), 3,84 (3C), 5,12 (4C) et 6,4 (5C) mA/cm2 ont été appliquées. La
densité de courant critique du polymère a
été identifiée lorsque la surtension de la cellule est passée au-dessus de 1V.
[00106]
Le polymère de l'Exemple la (15 %) + HQ674 (85 %), sans LiTFSI,
présentait une densité de courant
critique de 2,56 mA/cm2 (définie comme 2C) alors que le polymère HQ-674
n'atteignait qu'une densité de courant de
0,214 mA/cm2 avant défaillance.
[00107]
La surtension du polymère de l'Exemple la (15 %) + HQ674 (85 %), sans
LiTFSI, à 1,28 mA/cm2 (taux
1C) était de 0,07V, alors que cette valeur a été obtenue à une faible densité
de courant de 0,214 mA/cm2 (taux de
0/6) pour le polymère HQ-674.
RÉFÉRENCES
[00108] La
présente description se réfère à un certain nombre de documents dont le
contenu est incorporé ici par
référence dans leur intégralité. Ces documents comprennent, sans s'y limiter,
les éléments suivants :
= Christophe Michot, Contribution à l'étude du transport des ions et des
électrons en milieu polymère solvatant :
applications aux générateurs et aux systèmes électrochromes, thèse de
doctorat, Université de Grenoble,
http://www.theses.fr/1995IN PG0061
= Shi et
al., Copper-Catalysed Alkylation of sulfamides with Alcohol, Angew. Chem. Int.
Ed., 2009, 48, 5912-
5915.
= De Zea Burmudez et al., Chemistry and physical properties of sulfamide
and its derivatives: proton
CA 03196166 2023- 4- 19
WO 2022/126251
PCT/CA2021/051796
conducting, Materials, J. Mater. Chem., 1997, 7 (9), 1677-1692.
= De Zea Burmudez and Sanchez, Sulfamide complexes of polymethacrylates
carrying oligopolyoxyethylene
chains, Solid State lonics, 61(1993) 203-212.
= Choquette et al., Sulfamides and Glymes as Aprotic Solvents for Lithium
Batteries, 1998, J. Electrochem.
5 Soc., 145, 3500.
= Brevet américain n 7 897 674.
= Brevet américain n 6 190 804.
CA 03196166 2023- 4- 19