Note: Descriptions are shown in the official language in which they were submitted.
VO 2023/280708 1
PCT/EP2022/068270
DESCRIPTION
TITRE : Procédé automatique de segmentation d'un
thrombus et d'une lésion dans une image tridimensionnelle
cérébrale
DOMAINE TECHNIQUE DE L'INVENTION
[0001] Le domaine technique de l'invention est celui de l'imagerie
tridimensionnelle
cérébrale, et plus particulièrement celui de la segmentation d'un thrombus et
d'une
lésion dans une image tridimensionnelle cérébrale d'un patient présentant un
accident
vasculaire cérébrale.
[0002] La présente invention concerne un procédé de segmentation d'un
thrombus
et d'une lésion dans une image tridimensionnelle cérébrale et en particulier
un procédé
automatique de segmentation d'un thrombus et d'une lésion dans une image
tridimen-
sionnelle cérébrale. La présente invention concerne également un produit-
programme
d'ordinateur et un support d'enregistrement.
ARRIERE-PLAN TECHNOLOGIQUE DE L'INVENTION
[0003] L'accident vasculaire cérébral ou AVC correspond soit à une
obstruction
d'une artère cérébrale par un caillot sanguin ou thrombus ¨ on parle alors
d'AVC isché-
mique - soit à une rupture d'une artère cérébrale ¨ on parle alors d'AVC
hémorragique.
zo [0004] Pour limiter les séquelles engendrées par un AVC, on estime
qu'il faut que
5 heures maximum se soient écoulées entre le moment où le patient arrive à
l'hôpital
et le moment où il est diagnostiqué et traité, le choix du traitement
dépendant du type
d'AVC diagnostiqué.
[0005] Le diagnostic est classiquement réalisé par un
professionnel de santé ex-
périmenté à partir d'une imagerie cérébrale en localisant le thrombus et la
lésion en-
gendrée par le thrombus. Or les professionnels de santé capables d'analyser
des
images cérébrales d'AVC sont rares et en pratique, les images doivent souvent
être
transmises de l'hôpital qui a accueilli le patient vers un autre hôpital
disposant de per-
sonnel capable d'analyser les images. La durée d'obtention du diagnostic est
alors
considérablement augmentée et souvent incompatible avec la durée de 5 heures
maxi-
mum.
[0006] Pour remédier à ce problème, des méthodes de segmentation
de la lésion
ou du thrombus à partir d'une image tridimensionnelle cérébrale ont été
développées.
CA 03224162 2023- 12- 22
WO 2023/280708 2
PCT/EP2022/068270
Cependant, aucune de ces méthodes n'est capable de détecter à la fois le
thrombus
et la lésion et ceci de manière fiable. c'est-à-dire avec un taux de détection
supérieur
à 90% et un nombre de faux positifs réduit, et entièrement automatique.
RESUME DE L'INVENTION
[0007] L'invention offre une solution aux problèmes évoqués
précédemment, en
proposant une méthode automatique de segmentation du thrombus et de la lésion
dans une image cérébrale, ayant un taux de détection supérieur à 90% et un
taux de
faux positif réduit.
[0008] Un premier aspect de l'invention concerne un procédé
automatique de seg-
mentation d'un thrombus et d'une lésion engendrée par le thrombus dans une
image
tridimensionnelle cérébrale, l'image tridimensionnelle cérébrale étant acquise
selon au
moins une modalité, chaque modalité étant associée à un ensemble d'images com-
portant une pluralité d'images correspondant chacune à une section de l'image
tridi-
mensionnelle acquise selon la modalité, selon un plan de section
perpendiculaire à un
axe donné, le procédé comportant les étapes suivantes :
Entraînement supervisé d'au moins un réseau de neurones artificiels récur-
rents primaire configuré pour fournir une prédiction de lésion à partir d'une
image, chaque réseau de neurones artificiels récurrents primaire étant as-
socié à un jeu de paramètres d'entraînement et entraîné sur une base de
données primaire comportant une pluralité d'images cérébrales chacune
associée à un ensemble d'informations relatives à la segmentation de
chaque lésion dans l'image ;
Entraînement supervisé d'au moins un réseau de neurones artificiels récur-
rents secondaire configuré pour fournir une prédiction de thrombus à partir
d'une image, chaque réseau de neurones artificiels récurrents secondaire
étant associé à un jeu de paramètres d'apprentissage et entraîné sur une
base de données secondaire comportant une pluralité d'images cérébrales
chacune associée à un ensemble d'informations relatives à la segmentation
de chaque thrombus dans l'image ;
Utilisation de chaque réseau de neurones artificiels récurrents primaire en-
traîné, sur chaque image d'un ensemble d'images primaire dépendant d'au
moins un ensemble d'images associé à une modalité, et fusion des
CA 03224162 2023- 12- 22
WO 2023/280708 3
PCT/EP2022/068270
prédictions de lésion obtenues pour obtenir un ensemble de segmentations
de lésion :
o Si l'ensemble de segmentations de lésion comporte au moins une
segmentation, sélection de la segmentation présentant un volume
maximal comme segmentation de la lésion :
Utilisation de chaque réseau de neurones artificiels récurrents secondaire
entraîné, sur chaque image d'un ensemble d'images secondaire dépendant
d'au moins un ensemble d'images associé à une modalité, et fusion des
prédictions de thrombus obtenues pour obtenir un ensemble de segmenta-
tions de thrombus :
Si l'ensemble de segmentations de thrombus comporte au moins
une segmentation, sélection de la segmentation répondant à une
condition de proximité comme segmentation du thrombus, la con-
dition de proximité dépendant de la segmentation de la lésion.
[0009] Grâce à l'invention, au moins un réseau de neurones artificiels
récurrents
primaire est entraîné puis utilisé sur un ensemble d'images primaire obtenu à
partir de
l'image tridimensionnelle pour réaliser une prédiction de lésion par image de
l'en-
semble d'images primaire, et en parallèle au moins un réseau de neurones
artificiels
récurrents secondaire est entraîné puis utilisé sur un ensemble d'images
secondaire
zo obtenu à partir de l'image tridimensionnelle pour réaliser une prédiction
de thrombus
par image de l'ensemble d'images secondaire.
[0010] Le taux de détection obtenu par chaque réseau de neurones
artificiels ré-
currents primaire est proche de 100% mais le nombre de faux positifs est élevé
[0011] Quand plusieurs réseaux de neurones artificiels récurrents
primaires sont
utilisés, les prédictions de lésions obtenues pour l'ensemble des réseaux de
neurones
artificiels récurrents primaires sont alors fusionnées pour obtenir un
ensemble de seg-
mentations de lésion regroupant les segmentations de lésion les plus
susceptibles de
coïncider avec la lésion dans l'image tridimensionnelle, en prenant en compte
les pré-
dictions de lésion de chaque réseau de neurones artificiels récurrents
primaire. Ainsi,
en choisissant des jeux de paramètres d'apprentissage différents et/ou des
images
cérébrales différentes dans la base de données primaire et dans l'ensemble
d'images
primaire pour chaque réseau de neurones artificiels récurrents primaire, les
informa-
tions utilisées par chaque réseau de neurones artificiels récurrents primaire
pour faire
sa prédiction de lésion sont différentes et le choix de l'ensemble de
segmentations de
CA 03224162 2023- 12- 22
WO 2023/280708 4 PCT/EP2022/068270
lésion est donc basé sur un nombre plus important d'informations, ce qui
augmente sa
précision.
[0012] La segmentation de lésion de l'ensemble de segmentations de lésion
pré-
sentant le volume le plus important est ensuite sélectionnée comme
segmentation ef-
fective de la lésion, ce qui permet d'obtenir un nombre de faux positifs
réduit par rap-
port à l'art antérieur tout en maintenant un taux de détection proche de 100%
pour la
segmentation de la lésion.
[0013] Le taux de détection obtenu par chaque réseau de neurones
artificiels ré-
currents secondaire est au moins égal à 89% et le nombre de faux positifs est
élevé.
10 [0014] Quand plusieurs réseaux de neurones artificiels récurrents
secondaires
sont utilisées, les prédictions de thrombus obtenues pour l'ensemble des
réseaux de
neurones artificiels récurrents secondaires sont alors fusionnées pour obtenir
un en-
semble de segmentations de thrombus regroupant les segmentations de thrombus
les
plus susceptibles de coïncider avec le thrombus dans l'image
tridimensionnelle, en
prenant en compte les prédictions de thrombus de chaque réseau de neurones
artifi-
ciels récurrents secondaire. Là encore, en choisissant des jeux de paramètres
d'ap-
prentissage différents et/ou des images cérébrales différentes dans la base de
don-
nées secondaire et dans l'ensemble d'images secondaire pour chaque réseau de
neu-
rones artificiels récurrents secondaires, le choix de l'ensemble de
segmentations de
zo thrombus est basé sur un nombre plus important d'informations, ce qui
augmente sa
précision.
[0015] La segmentation effective de la lésion est ensuite utilisée pour
sélectionner
la segmentation effective du thrombus parmi les segmentations de thrombus de
l'en-
semble de segmentations de thrombus, ce qui permet d'obtenir un taux de
détection
supérieur à 90% et un nombre de faux positifs réduit par rapport à l'art
antérieur pour
la segmentation du thrombus.
[0016] Une fois la segmentation de la lésion et la segmentation du thrombus
ob-
tenu, il est alors possible de caractériser la lésion ou le thrombus de
manière objective
par le calcul de paramètres numériques, tel que le volume, rendant
l'interprétation de
l'image tridimensionnelle homogène, c'est-à-dire non dépendante du praticien.
[0017] Outre les caractéristiques qui viennent d'être évoquées dans le
paragraphe
précédent, le procédé selon l'invention peut présenter une ou plusieurs
CA 03224162 2023- 12- 22
WO 2023/280708 5
PCT/EP2022/068270
caractéristiques complémentaires parmi les suivantes, considérées
individuellement
ou selon toutes les combinaisons techniquement possibles.
[0018] Selon une variante de réalisation, l'image
tridimensionnelle est acquise par
IRM.
[0019] Selon une première sous-variante de réalisation de la
variante de réalisation
précédente, l'image tridimensionnelle est acquise par IRM selon une première
moda-
lité angiographie pondérée en fonction de la susceptibilité SWAN, une deuxième
mo-
dalité phase du signal radiofréquence de l'angiographie pondérée en fonction
de la
susceptibilité phase SWAN, une troisième modalité temps de vol ToF, une
quatrième
modalité pondération en diffusion DVV1 et une cinquième modalité pondération
en dif-
fusion avec application exclusive du champ magnétique principal Bo.
[0020] Selon une deuxième sous-variante de réalisation de la
variante de réalisa-
précédente compatible avec la première sous-variante de réalisation
précédente,
le procédé selon l'invention comporte une étape de prétraitement comprenant
les
sous-étapes suivantes pour chaque modalité de l'image tridimensionnelle :
- Calcul d'un histogramme sur les niveaux de gris des voxels de l'image
tridi-
mensionnelle acquise selon la modalité ;
Calcul d'une approximation polynomiale du logarithme de l'histogramme ;
- Application de la fonction inverse du logarithme à l'approximation polyno-
miale pour obtenir une approximation de l'histogramme ;
- Détermination d'un maximum local de l'approximation de l'histogramme
correspondant au tissu sain cérébral et division des niveaux de gris des
voxels de l'image tridimensionnelle acquise selon la modalité par le niveau
de gris correspondant au maximum local dans l'histogramme.
[0021] Ainsi, chaque image tridimensionnelle acquise par IRM est
normalisée pour
permettre l'obtention de résultats répétables. En effet, les niveaux de gris
des voxels
des images tridimensionnelles acquises par IRM varient entre deux patients ou
encore
entre deux acquisitions réalisées sur un même patient, ce qui ne permet pas un
traite-
ment automatique sans normalisation préalable.
CA 03224162 2023- 12- 22
WO 2023/280708 6
PCT/EP2022/068270
[0022] Selon une alternative de réalisation de la première sous-
variante de réali-
sation ou de la deuxième sous-variante de réalisation, le procédé selon
l'invention
comporte les sous-étapes suivantes :
- Pour chaque image de l'ensemble d'images associé à la quatrième moda-
lité, soustraction à l'image considérée, de l'image correspondante de l'en-
semble d'images associé à la cinquième modalité, pour obtenir un en-
semble d'images améliorées ;
Pour chaque image de l'ensemble d'images associé à la quatrième moda-
lité, concaténation de l'image considérée et de l'image correspondante de
l'ensemble d'images améliorées, pour obtenir un ensemble de premières
images concaténées ;
- Pour chaque image de l'ensemble d'images associé à la première modalité,
concaténation de l'image considérée, de l'image correspondante de l'en-
semble d'images associé à la deuxième modalité et de l'image correspon-
dante de l'ensemble d'images associé à la troisième modalité, pour obtenir
un ensemble de deuxièmes images concaténées.
[0023] Selon un exemple de réalisation de l'alternative de
réalisation précédente :
- l'étape d'entraînement est réalisée pour un premier réseau de neurones ar-
tificiels récurrents primaire et un deuxième réseau de neurones artificiels
récurrents primaire associés à des jeux de paramètres d'entraînement dif-
férents, sur une même base de données primaire comportant une pluralité
de premières images concaténées ;
- l'étape d'utilisation est réalisée sur un même ensemble d'images primaire
pour le premier réseau de neurones artificiels récurrents primaire et le deu-
xième réseau de neurones artificiels récurrents primaire, l'ensemble
d'images primaire correspondant à l'ensemble de premières images conca-
ténées ;
- l'étape d'entraînement est réalisée pour un premier réseau de neurones ar-
tificiels récurrents secondaire et un deuxième réseau de neurones artificiels
récurrents secondaire présentant des jeux de paramètres d'entraînement
identiques, sur une première base de données secondaire pour le premier
réseau de neurones artificiels récurrents secondaire et sur une deuxième
base de données secondaire pour le deuxième réseau de neurones
CA 03224162 2023- 12- 22
WO 2023/280708 7
PCT/EP2022/068270
artificiels récurrents secondaire, la première base de données secondaire
comportant une pluralité d'images acquises selon la première modalité et la
deuxième base de données secondaire comportant une pluralité de deu-
xièmes images concaténées ;
l'étape d'utilisation est réalisée sur un premier ensemble d'images secon-
daire pour le premier réseau de neurones artificiels récurrents secondaire
et sur un deuxième ensemble d'images secondaire pour le deuxième ré-
seau de neurones artificiels récurrents secondaire, le premier ensemble
d'images secondaire correspondant à l'ensemble d'images associé à la pre-
mière modalité et le deuxième ensemble d'images secondaire correspon-
dant à l'ensemble de deuxièmes images concaténées.
[0024]
Ainsi, un taux de détection de 100% et un nombre de faux positifs réduit
par
rapport à l'art antérieur est obtenu pour la segmentation de la lésion et un
taux de
détection de 93% et un nombre de faux positifs réduit par rapport à l'art
antérieur est
obtenu pour la segmentation du thrombus.
[0025]
Selon une variante de réalisation compatible avec les variantes de
réalisa-
tion précédentes, chaque réseau de neurones artificiels récurrents primaire et
chaque
réseau de neurones artificiels récurrents secondaire ont une même architecture
de
zo
type réseau de neurones artificiels récurrents à mémoire court et long terme
convolutif
disposant d'une mémoire, dans lequel chaque convolution est remplacée par un
bloc
logique dans lequel une première partie d'une donnée d'entrée passe par une
couche
convolutive et une seconde partie de la donnée d'entrée passe par un bloc de
transfert
composé d'une couche de transfert entourée de deux couches convolutives, la
couche
de transfert effectuant plusieurs opérations de max-pooling avec différentes
tailles de
fenêtres.
[0026]
Ainsi, chaque réseau de neurones artificiels récurrents est invariant en
tran-
slation et présente un champ récepteur maximal et un nombre d'hyperparamètres
ré-
duit par rapport aux réseaux de neurones artificiels récurrents à mémoire
court et long
terme convolutifs classiques.
[0027]
Selon une sous-variante de réalisation de la variante de réalisation
précé-
dente, l'étape d'entraînement d'un réseau de neurones artificiels récurrents
primaire
CA 03224162 2023- 12- 22
WO 2023/280708 8
PCT/EP2022/068270
comporte les sous-étapes suivantes pour chaque image de la base de données pri-
maire correspondante :
- Première soumission de l'image au réseau de neurones artificiels
récurrents
primaire pour remplir sa mémoire ;
Deuxième soumission de l'image au réseau de neurones artificiels récur-
rents primaire pour fournir une prédiction de lésion à partir de la mémoire
remplie, la deuxième soumission étant immédiatement consécutive à la pre-
mière soumission ;
- Remise à zéro de la mémoire ;
et l'étape d'entraînement d'un réseau de neurones artificiels récurrents
secondaire
comporte les sous-étapes suivantes pour chaque image de la base de données se-
condaire correspondante :
- Première soumission de l'image au réseau de neurones artificiels
récurrents
secondaire pour remplir sa mémoire ;
Deuxième soumission de l'image au réseau de neurones artificiels récur-
rents secondaire pour fournir une prédiction de thrombus à partir de la mé-
moire remplie, la deuxième soumission étant immédiatement consécutive à
la première soumission ;
- Remise à zéro de la mémoire.
[0028] Ainsi, la prédiction fournie par chaque réseau de neurones
artificiels récur-
rents provient d'un réseau de neurones artificiels profond alors que le nombre
d'hyper-
paramètres est réduit par rapport aux réseaux de neurones artificiels
récurrents à mé-
moire court et long terme convolutifs classiques
[0029] Selon une autre variante de réalisation compatible avec les
variantes de
réalisation précédentes, la segmentation du thrombus comprend une pluralité de
voxels identifiés comme appartenant au thrombus, chaque voxel étant associé à
une
étiquette faux-positif ou à une étiquette vrai-positif, l'étiquette faux-
positif ou l'étiquette
vrai-positif étant attribuée par le réseau de neurones artificiels récurrents
secondaire
entraîné, le procédé comprenant une étape de raffinement de la segmentation du
thrombus comprenant les sous-étapes suivantes :
- Calcul de l'enveloppe de la lésion à partir de la segmentation de la
lésion,
- Répartition de la segmentation du thrombus en un premier ensemble de
voxels et un deuxième ensemble de voxels
CA 03224162 2023- 12- 22
WO 2023/280708 9
PCT/EP2022/068270
o le premier ensemble de voxels comporte les voxels de la segmen-
tation du thrombus associés à l'étiquette faux-positif,
O le deuxième ensemble de voxels comporte les voxels de la seg-
mentation de la lésion associés à l'étiquette vrai-positif,
Réduction du premier ensemble de voxels de la segmentation du throm-
bus:
O Pour chaque voxel du premier ensemble de voxels, calcul de la
distance à la lésion, la distance à la lésion étant la distance eucli-
dienne du voxel du premier ensemble de voxels à l'enveloppe de
la lésion,
O Ordonnancement des voxels du premier ensemble de voxels en
fonction de la distance à la lésion calculée,
O Sélection d'un sous-ensemble de voxels à partir de l'ordonnance-
ment des voxels du premier ensemble de voxels,
Sélection de la segmentation répondant à la fusion du deuxième ensemble
de voxels et du sous-ensemble de voxels sélectionné comme segmentation
du thrombus.
[0030]
Selon une sous-variante de la variante de réalisation précédente,
l'étape de
sélection d'un sous-ensemble de voxels est réalisée en sélectionnant les N
voxels du
zo premier ensemble de voxels ayant la distance à la lésion la plus
petite, N étant compris
entre 3 et 5.
[0031]
Selon une autre sous-variante de la variante de réalisation précédente,
l'étape de sélection d'un sous-ensemble de voxels est réalisée en
sélectionnant les
voxels du premier ensemble de voxels ayant une distance à la lésion inférieure
à un
seuil prédéterminé.
[0032]
Ainsi, il est possible d'affiner la segmentation du thrombus en
réduisant le
nombre de faux-positifs.
[0033]
Avantageusement, le procédé peut comprendre une étape de caractérisa-
tion volumétrique du thrombus à partir de la segmentation du thrombus.
[0034]
Avantageusement encore, l'étape de caractérisation volumique du throm-
bus peut comprendre les sous-étapes suivantes :
Extraction des pixels de la segmentation du thrombus à partir de la seg-
mentation du thrombus, les pixels formant un nuage de points contenu dans
CA 03224162 2023- 12- 22
VO 2023/280708 10 PCT/EP2022/068270
un volume, le volume étant l'enveloppe ellipsoïdale maximale contenant le
thrombus,
- Détermination des caractéristiques géométriques du volume de l'enveloppe
ellipsoïdale maximale contenant le thrombus par analyse par composante
principale du nuage de points selon trois axes principaux, les trois axes
principaux étant orthogonaux,
- Calcul du volume de l'enveloppe ellipsoïdale maximale contenant le throm-
bus à partir des paramètres géométriques déterminés.
[0035] Un deuxième aspect de l'invention concerne un produit-programme
d'ordi-
w nateur comprenant des instructions qui, quand le programme est
exécuté sur un ordi-
nateur, conduisent celui-ci à mettre en oeuvre les étapes du procédé selon
l'invention.
[0036] Un troisième aspect de l'invention concerne un support
d'enregistrement
lisible par ordinateur comprenant des instructions qui, lorsqu'elles sont
exécutées par
15 un ordinateur, conduisent celui-ci à mettre en oeuvre les étapes du procédé
selon l'in-
vention.
[0037] L'invention et ses différentes applications seront mieux comprises à
la lec-
ture de la description qui suit et à l'examen des figures qui l'accompagnent.
BREVE DESCRIPTION DES FIGURES
[0038] Les figures sont présentées à titre indicatif et nullement limitatif
de l'inven-
tion.
- La figure 1 est un schéma synoptique illustrant l'enchaînement des étapes
d'un procédé selon l'invention.
- La figure 2 est un schéma synoptique illustrant l'enchaînement des sous-
étapes d'une première étape du procédé selon l'invention.
- La figure 3 représente un histogramme des niveaux de gris d'une image
tridimensionnelle cérébrale.
- La figure 4 est un schéma synoptique illustrant l'enchaînement des sous-
étapes d'une deuxième étape du procédé selon l'invention.
- La figure 5 montre un premier exemple en haut et un deuxième exemple en
bas comportant de la gauche vers la droite, une image cérébrale, une lésion
CA 03224162 2023- 12- 22
WO 2023/280708 11
PCT/EP2022/068270
à identifier dans l'image et une prédiction de lésion fournie par le procédé
selon l'invention à partir de l'image.
- La figure 6 est un schéma synoptique illustrant l'enchaînement des sous-
étapes d'une troisième étape du procédé selon l'invention.
La figure 7 montre un premier exemple en haut et un deuxième exemple en
bas comportant de la gauche vers la droite, une image cérébrale, un throm-
bus à identifier dans l'image et une prédiction de thrombus fournie par le
procédé selon l'invention à partir de l'image.
- La figure 8 est un schéma synoptique illustrant l'enchaînement des sous-
étapes d'une quatrième étape du procédé selon l'invention.
- La figure 9 est un schéma synoptique illustrant l'enchainement d'une hui-
tième et d'une neuvième étape au procédé selon l'invention.
- La figure 10 est un schéma synoptique illustrant l'enchainement des sous-
étapes de la huitième étape du procédé selon l'invention.
La figure 11 est un schéma synoptique illustrant l'enchainement des sous-
étapes de la troisième sous-étape de la huitième étape du procédé selon
l'invention.
- La figure 12 est un schéma synoptique illustrant l'enchainement des sous-
étapes de la neuvième étape du procédé selon l'invention.
DESCRIPTION DETAILLEE
[0039] Sauf précision contraire, un même élément apparaissant sur
des figures
différentes présente une référence unique
[0040] L'invention concerne un procédé automatique de segmentation d'un
throm-
bus et d'une lésion dans une image tridimensionnelle cérébrale d'un patient,
le throm-
bus ayant engendré une lésion cérébrale entraînant un accident vasculaire
cérébral
ou AVC chez le patient.
[0041] On entend par segmentation d'un élément dans une image
tridimension-
nelle , l'identification de chaque voxel de l'image appartenant à l'élément,
un voxel se
définissant comme un pixel tridimensionnel.
CA 03224162 2023- 12- 22
WO 2023/280708 12
PCT/EP2022/068270
[0042] L'image tridimensionnelle est acquise par un système
d'imagerie selon une
ou plusieurs modalités, autrement appelées séquences, ayant chacune des para-
mètres d'acquisition différents.
[0043] L'image tridimensionnelle est par exemple acquise par
scanner à rayons X
ou par imagerie par résonance magnétique ou IRM.
[0044] Si l'image tridimensionnelle est acquise par une séquence
ou une combi-
naison de séquences IRM, elle peut par exemple être acquise selon au moins une
des
modalités suivantes : une séquence par image écho planaire ou image EPI (pour
Echo Planar Image en anglais), une séquence par pondération en diffusion ou
DVVI
(pour Diffusion Weighted Images en anglais), une séquence en inversion-
récupé-
ration atténuée par un fluide ou FLAIR (pour Fluid Attenuated Inversion
Recovery
en anglais), une séquence temps de vol ou ToF (pour Time of Flight en
anglais),
une séquence par angiographie pondérée en fonction de la susceptibilité ou
SWAN
(pour Susceptibility VVeighted ANgiography en anglais), une séquence par
ponde-
ration de la susceptibilité ou SVVI (pour Susceptibility-VVeighted Images
en anglais),
une séquence en pondération en diffusion DVVI avec application uniquement du
champ
magnétique principal Bo, c'est-à-dire avec un degré de pondération de
diffusion égal à
0, ou encore une séquence phase du signal radiofréquence de l'angiographie
pondé-
rée en fonction la susceptibilité phase SVVAN.
[0045] Pour chaque modalité, un ensemble d'images est obtenu à
partir de l'image
tridimensionnelle acquise selon la modalité, l'ensemble d'images comportant
une plu-
ralité d'images correspondant chacune à une section de l'image
tridimensionnelle ac-
quise selon la modalité, selon un plan de section perpendiculaire à un axe
donné.
[0046] Les plans de section des images d'un ensemble d'images sont
parallèles
entre eux et non confondus, c'est-à-dire que les plans de section sont espacés
entre
eux selon l'axe auquel ils sont perpendiculaires, et peuvent être chacun
associé à une
position sur l'axe.
[0047] L'axe est par exemple transversal.
[0048] Les plans de section sont identiques pour chaque modalité, c'est-à-
dire que
chaque ensemble d'images présente le même nombre d'images et chaque image d'un
ensemble d'images a une image correspondante dans chaque autre ensemble
d'images.
CA 03224162 2023- 12- 22
VO 2023/280708 13
PCT/EP2022/068270
[0049] Chaque image de l'ensemble d'images peut ensuite être
partitionnée en
imagettes de dimensions réduites. La taille des imagettes est par exemple
choisie de
manière que chaque imagette présente une zone de recouvrement avec au moins
une
autre imagette.
[0050] Chaque image est par exemple partitionnée en un nombre d'imagettes
com-
pris entre une dizaine et une centaine d'imagettes.
[0051] [Fig. 1] La figure 1 est un schéma synoptique illustrant
l'enchaînement des
étapes du procédé 100 selon l'invention.
113
[0052] Le procédé 100 selon l'invention peut comporter une
première étape 101
de prétraitement si l'image tridimensionnelle cérébrale a été acquise par IRM.
[0053] La première étape 101 est alors réalisée pour chaque
modalité de l'image
tridimensionnelle IRM.
[0054] [Fig. 2] La figure 2 est un schéma synoptique illustrant
l'enchaînement de
sous-étapes de la première étape 101 du procédé 100.
[0055] Une première sous-étape 1011 de la première étape 101
consiste à calculer
[0056] un histogramme sur les niveaux de gris ou intensités des voxels de
l'image
tridimensionnelle IRM acquise selon la modalité.
[0057] [Fig. 3] La figure 3 est un exemple d'histogramme des
niveaux de gris d'une
image tridimensionnelle cérébrale.
[0058] Sur la figure 3, l'histogramme présente un maximum global à
proximité du
niveau de gris 0 et un maximum local aux alentours du niveau de gris 25.
[0059] Le maximum local dont le nombre d'occurrences est 400 000
correspond
au tissu sain cérébral dans l'image tridimensionnelle IRM.
[0060] Une deuxième sous-étape 1012 de la première étape 101 consiste à
calcu-
ler une approximation polynomiale du logarithme de l'histogramme calculée à la
pre-
mière sous-étape 1011.
CA 03224162 2023- 12- 22
VO 2023/280708 14
PCT/EP2022/068270
[0061] Une troisième sous-étape 1013 de la première étape 101
consiste à appli-
quer la fonction inverse du logarithme à l'approximation polynomiale obtenue à
la deu-
xième sous-étape 1012 pour obtenir une approximation de l'histogramme.
[0062] Sur la figure 3 est également représentée l'approximation
de l'histogramme.
[0063] Une quatrième sous-étape 1014 de la première étape 101
consiste à déter-
miner le maximum local de l'approximation de l'histogramme correspondant au
tissu
sain cérébral.
[0064] Le maximum local est par exemple déterminé par seuillage
sur le nombre
d'occurrences.
[0065] La quatrième sous-étape 1014 de la première étape 101
consiste ensuite à
diviser le niveau de gris de chaque voxel de l'image tridimensionnelle IRM
acquise
selon la modalité, par le niveau de gris correspondant au maximum local dans
l'histo-
gramme.
[0066] Sur la figure 3, la quatrième sous-étape 1014 revient à
diviser le niveau de
gris de chaque voxel de l'image tridimensionnelle IRM acquise selon la
modalité par
environ 25.
[0067] Le procédé 100 selon l'invention peut comporter une deuxième étape
102
de traitement si l'image tridimensionnelle cérébrale a été acquise par IRM
selon une
première modalité angiographie pondérée en fonction de la susceptibilité SWAN,
une
deuxième modalité phase du signal radiofréquence de l'angiographie pondérée en
fonction de la susceptibilité phase SWAN, une troisième modalité temps de vol
ToF,
une quatrième modalité pondération en diffusion DWI et une cinquième modalité
pon-
dération en diffusion DWI avec application exclusive du champ magnétique
principal
Bo.
[0068] La première étape 101 a par exemple été préalablement
réalisée sur cha-
cune des cinq modalités précédentes.
[0069] [Fig. 4] La figure 4 est un schéma synoptique illustrant
l'enchaînement de
sous-étapes de la deuxième étape 102 du procédé 100.
CA 03224162 2023-12-22
WO 2023/280708 15 PCT/EP2022/068270
[0070] Une première sous-étape 1021 de la deuxième étape 102 consiste à
obtenir
un ensemble d'images améliorées en soustrayant à chaque image I de l'ensemble
d'images associé à la quatrième modalité, l'image I correspondante de
l'ensemble
d'images associé à la cinquième modalité.
5 [0071] L'ensemble d'images améliorées contient donc autant d'images que
chaque ensemble d'images.
[0072] On entend par soustraire une première image à une deuxième image
,
la soustraction pour chaque pixel, du niveau de gris du pixel de la première
image au
niveau de gris du pixel de la deuxième image correspondant.
[0073] Une deuxième sous-étape 1022 de la deuxième étape 102 consiste à
obte-
nir un ensemble de premières images concaténées en concaténant chaque image I
de l'ensemble d'images associé à la quatrième modalité avec l'image I
correspondante
de l'ensemble d'images améliorées obtenu à la première sous-étape 1021.
15 [0074] L'ensemble de premières images concaténées contient donc autant
d'images que chaque ensemble d'images.
[0075] On entend par image issue de la concaténation d'une première image
et
d'une deuxième image , une unique image regroupant la première image et la
deu-
xième image.
[0076] Une troisième sous-étape 1023 de la deuxième étape 102 consiste à
obtenir
un ensemble de deuxièmes images concaténées en concaténant chaque image I de
l'ensemble d'images associé à la première modalité, avec l'image I
correspondante de
l'ensemble d'images associé à la deuxième modalité et avec l'image I
correspondante
de l'ensemble d'images associé à la troisième modalité.
[0077] L'ensemble de deuxièmes images concaténées contient donc autant
d'images que chaque ensemble d'images.
[0078] Une troisième étape 103 du procédé 100 consiste à entraîner de
manière
supervisée au moins un réseau de neurones artificiels récurrents primaire sur
une
base de données primaire pour obtenir un réseau de neurones artificiels
récurrents
primaire entraîné capable de fournir à partir d'une image, une prédiction de
lésion
coïncidant avec la lésion effectivement présente dans l'image.
CA 03224162 2023- 12- 22
WO 2023/280708 16
PCT/EP2022/068270
[0079] Une prédiction de lésion correspond à une carte de
probabilités associant
à chaque pixel de l'image une probabilité que le pixel soit compris dans une
lésion.
Seuls les pixels associés à une probabilité supérieure à un seuil sont
considérés
comme appartenant effectivement à une lésion.
[0080] Le seuil est par exemple de 0.5.
[0081] Chaque réseau de neurones artificiels récurrents primaire
peut être entraîné
sur une même base de données primaire ou sur une base de données primaire
diffé-
rente par rapport aux autres réseaux de neurones artificiels récurrents
primaires.
[0082] L'entraînement supervisé, autrement appelé apprentissage supervisé,
per-
met d'entraîner un réseau de neurones artificiels à une tâche prédéfinie, en
mettant à
jour ses hyperparamètres de manière à minimiser une fonction de coût
correspondant
à l'erreur entre la donnée de sortie fournie par le réseau de neurones
artificiels et la
vraie donnée de sortie, c'est-à-dire ce que le réseau de neurones artificiels
devrait
fournir en sortie pour remplir la tâche prédéfinie sur une certaine donnée
d'entrée.
[0083] Une base de données d'entraînement comporte donc des
données d'en-
trée, chacune associée à une vraie donnée de sortie.
[0084] Chaque base de données primaire comporte une pluralité
d'images céré-
chacune associée à un ensemble d'informations relatives à la segmentation de
chaque lésion dans l'image.
[0085] Ainsi, les données d'entrée sont les images cérébrales et
les vraies don-
nées de sortie sont les informations relatives à la segmentation de chaque
lésion dans
l'image.
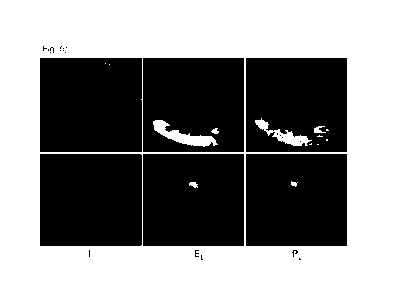
[0086] [Fig. 5] La figure 5 montre un premier exemple en haut et
un deuxième
exemple en bas, d'une image I cérébrale, d'informations EL relatives à la
segmentation
d'une lésion dans l'image I et d'une prédiction de lésion PL fournie par le
réseau de
neurones artificiels récurrents primaire.
[0087] L'entraînement supervisé de chaque réseau de neurones
artificiels récur-
rents primaire consiste donc à mettre à jour les hyperparamètres de manière à
mini-
miser une fonction de coût correspondant à l'erreur entre la prédiction de
lésion fournie
par le réseau de neurones artificiels récurrents primaire à partir d'une image
I cérébrale
CA 03224162 2023- 12- 22
WO 2023/280708 17
PCT/EP2022/068270
de la base de données primaire et les informations relatives à la segmentation
de
chaque lésion dans l'image I associées à l'image I dans la base de données
primaire.
[0088] La fonction de coût est par exemple la fonction d'entropie
croisée.
[0089] Chaque réseau de neurones artificiels récurrents primaire
est associé à un
jeu de paramètres d'entraînement qui peut être identique ou différent des jeux
de pa-
ramètres des autres réseaux de neurones artificiels récurrents primaires.
[0090] Le jeu de paramètres d'entraînement comporte par exemple le
nombre
d'images par itération et les dimensions des images utilisées lors de
l'entraînement.
[0091] Chaque réseau de neurones artificiels récurrents primaire
est par exemple
un réseau de neurones artificiels récurrents à mémoire court et long terme ou
LSTM
(pour Long-Short Term Memory en anglais) et dispose alors d'une mémoire,
ou un
réseau LSTM convolutif, ou encore un réseau LSTM convolutif à champ récepteur
maximal.
[0092] On entend par champ récepteur d'un réseau de neurones
artificiels , la
part de la donnée d'entrée accessible par la dernière couche du réseau de
neurones
artificiels pour faire sa prédiction.
[0093] Un réseau LSTM convolutif à champ récepteur maximal est par exemple
un
réseau de neurones artificiels LSTM convolutif dans lequel chaque convolution
est
remplacée par un bloc logique dont le champ récepteur est aussi large que la
donnée
d'entrée Dans le bloc logique, une première partie de la donnée d'entrée passe
par
une couche convolutive et une seconde partie de la donnée d'entrée passe par
un bloc
de transfert composé d'une couche de transfert entourée de deux couches
convolu-
tives, la couche de transfert effectuant plusieurs opérations de max-pooling
avec dif-
férentes tailles de fenêtres.
[0094] Chaque réseau de neurones artificiels récurrents primaire
peut présenter
une architecture identique ou différente de l'architecture des autres réseaux
de neu-
rones artificiels récurrents primaires.
[0095] La troisième étape 103 du procédé 100 est par exemple
réalisée pour un
premier réseau de neurones artificiels récurrents primaire et un deuxième
réseau de
CA 03224162 2023- 12- 22
WO 2023/280708 18
PCT/EP2022/068270
neurones artificiels récurrents primaire présentant une même architecture de
type
LSTM convolutif à champ percepteur maximal et des jeux de paramètres
d'entraîne-
ment différents, sur une même base de données primaire comportant une
pluralité de
premières images I concaténées comme images I cérébrales.
[0096] [Fig. 6] La figure 6 est un schéma synoptique illustrant
l'enchaînement de
sous-étapes de la troisième étape 103 du procédé 100.
[0097] La troisième étape 103 peut comporter une première sous-
étape 1031, une
lo deuxième sous-étape 1032 et une troisième sous-étape 1033 pour chaque
image I de
la base de données primaire.
[0098] La première sous-étape 1031 consiste à soumettre l'image I
une première
fois au réseau de neurones artificiels récurrents primaire qui va ainsi
remplir sa mé-
15 moire.
[0099] La deuxième sous-étape 1032 consiste à soumettre l'image I
une deuxième
fois au réseau de neurones artificiels récurrents primaire qui va ainsi
fournir une pré-
diction de lésion PL en utilisant les informations enregistrées dans sa
mémoire à la
première sous-étape 1031.
20 [00100] La deuxième soumission est immédiatement consécutive à la
première sou-
mission, c'est-à-dire qu'aucune autre image I n'est soumise au réseau de
neurones
artificiels récurrents primaire entre la première sous-étape 1031 et la
deuxième sous-
étape 1032
[00101] La troisième sous-étape 1033 consiste à effacer la mémoire du réseau
de
25 neurones artificiels récurrents primaire.
[00102] Une quatrième étape 104 du procédé 100 consiste à entraîner de manière
supervisée au moins un réseau de neurones artificiels récurrents secondaire
sur une
base de données secondaire pour obtenir un réseau de neurones artificiels
récurrents
30 secondaire entraîné capable de fournir à partir d'une image I, une
prédiction de throm-
bus coïncidant avec le thrombus effectivement présent dans l'image.
[00103] Chaque réseau de neurones artificiels récurrents secondaire peut être
en-
traîné sur une même base de données secondaire ou sur une base de données
CA 03224162 2023- 12- 22
WO 2023/280708 19
PCT/EP2022/068270
secondaire différente par rapport aux autres réseaux de neurones artificiels
récurrents
secondaires.
[00104] Chaque base de données secondaire comporte une pluralité d'images I cé-
rébrales chacune associée à un ensemble d'informations relatives à la
segmentation
de chaque thrombus dans l'image.
[00105] Ainsi, les données d'entrée sont les images I cérébrales et les vraies
don-
nées de sortie sont les informations relatives à la segmentation de chaque
thrombus
dans l'image.
[00106] [Fig. 7] La figure 7 montre un premier exemple en haut et un deuxième
exemple en bas, d'une image I cérébrale, d'informations ET relatives à la
segmentation
d'un thrombus dans l'image I et d'une prédiction de thrombus PT fournie par le
réseau
de neurones artificiels récurrents secondaire.
[00107] L'entraînement supervisé de chaque réseau de neurones artificiels
récur-
rents secondaire consiste donc à mettre à jour les hyperparamètres de manière
à mi-
nimiser une fonction de coût correspondant à l'erreur entre la prédiction de
thrombus
fournie par le réseau de neurones artificiels récurrents secondaire à partir
d'une image
zo I cérébrale de la base de données secondaire et les informations relatives
à la seg-
mentation de chaque thrombus dans l'image I associées à l'image I dans la base
de
données secondaire.
[00108] La fonction de coût est par exemple la fonction d'entropie croisée.
[00109] Chaque réseau de neurones artificiels récurrents secondaire est
associé à
un jeu de paramètres d'entraînement qui peut être identique ou différent des
jeux de
paramètres des autres réseaux de neurones artificiels récurrents secondaires.
[00110] Les dimensions des images utilisées lors de l'entraînement du jeu de
para-
mètres d'entraînement de chaque réseau de neurones artificiels récurrents
primaire
sont par exemple plus grandes que les dimensions des images utilisées lors de
l'en-
traînement du jeu de paramètres d'entraînement de chaque réseau de neurones
arti-
ficiels récurrents secondaire.
CA 03224162 2023- 12- 22
WO 2023/280708 20
PCT/EP2022/068270
[00111] Chaque réseau de neurones artificiels récurrents secondaire est par
exemple un réseau LSTM, ou un réseau LSTM convolutif, ou encore un réseau LSTM
convolutif à champ récepteur maximal.
[00112] Chaque réseau de neurones artificiels récurrents secondaire peut
présenter
une architecture identique ou différente de l'architecture des autres réseaux
de neu-
rones artificiels récurrents secondaires.
[00113] Chaque réseau de neurones artificiels récurrents secondaire peut
présenter
une architecture identique ou différente de l'architecture des réseaux de
neurones ar-
récurrents primaires.
[00114] Par exemple, chaque réseau de neurones artificiels récurrents primaire
et
chaque réseau de neurones artificiels récurrents secondaire présentent une
même
architecture de type réseau LSTM convolutif à champ récepteur maximal.
[00115] La quatrième étape 104 du procédé 100 est par exemple réalisée pour un
premier réseau de neurones artificiels récurrents secondaire et un deuxième
réseau
de neurones artificiels récurrents secondaire présentant une même architecture
de
type LSTM convolutif à champ percepteur maximal et des jeux de paramètres d'en-
traînement identiques, sur une première base de données secondaire pour le
premier
réseau de neurones artificiels récurrents secondaire et sur une deuxième base
de don-
nées secondaire différente de la première base de données secondaire pour le
deu-
xième réseau de neurones artificiels récurrents secondaire, la première base
de don-
nées secondaire comportant une pluralité d'images I acquises selon la première
mo-
dalité comme images I cérébrales et la deuxième base de données secondaire com-
portant une pluralité de deuxièmes images I concaténées comme images I
cérébrales.
[00116] [Fig. 8] La figure 8 est un schéma synoptique illustrant
l'enchaînement de
sous-étapes de la quatrième étape 104 du procédé 100.
[00 1 17] La quatrième étape 104 peut comporter une première sous-étape 1041,
une
deuxième sous-étape 1042 et une troisième sous-étape 1043 pour chaque image I
de
la base de données secondaire.
CA 03224162 2023- 12- 22
WO 2023/280708 21
PCT/EP2022/068270
[00118] La première sous-étape 1041 consiste à soumettre l'image I une
première
fois au réseau de neurones artificiels récurrents secondaire qui va ainsi
remplir sa
mémoire.
[00119] La deuxième sous-étape 1042 consiste à soumettre l'image I une
deuxième
fois au réseau de neurones artificiels récurrents secondaire qui va ainsi
fournir une
prédiction de thrombus PT en utilisant les informations enregistrées dans sa
mémoire
à la première sous-étape 1041.
[00120] La deuxième soumission est immédiatement consécutive à la première sou-
mission, c'est-à-dire qu'aucune autre image I n'est soumise au réseau de
neurones
artificiels récurrents secondaire entre la première sous-étape 1041 et la
deuxième
sous-étape 1042.
[00121] La troisième sous-étape 1043 consiste à effacer la mémoire du réseau
de
neurones artificiels récurrents secondaire.
[00122] La quatrième étape 104 pourrait également être réalisée antérieurement
ou
parallèlement à la troisième étape 103.
[00123] Une cinquième étape 105 du procédé 100 selon l'invention comporte une
première sous-étape 1051 et une deuxième sous-étape 1052 qui peuvent être
réali-
sées en parallèle comme illustré sur la figure 1 ou l'une après l'autre.
[00124] La première sous-étape 1051 consiste à utiliser chaque réseau de
neurones
artificiels récurrents primaire entraîné à la troisième étape 103, sur chaque
image I
d'un ensemble d'images primaire, chaque réseau de neurones artificiels
récurrents
primaire fournissant alors une prédiction de lésion PL pour chaque image I de
l'en-
semble d'images primaire.
[00125] Chaque réseau de neurones artificiels récurrents primaire
peut être utilisé
sur un ensemble d'images primaire identique ou différent par rapport aux
autres ré-
seaux de neurones artificiels récurrents primaires.
[00126] Chaque ensemble d'images primaire dépend d'au moins un ensemble
d'images associé à une modalité, c'est-à-dire que chaque ensemble d'images
primaire
peut correspondre à un ensemble d'images ou à une combinaison d'ensembles
d'images.
CA 03224162 2023-12-22
WO 2023/280708 22
PCT/EP2022/068270
[00127] La première sous-étape 1051 est par exemple réalisée sur un même en-
semble d'images primaires pour le premier réseau de neurones artificiels
récurrents
primaire et le deuxième réseau de neurones artificiels récurrents primaire
précédem-
ment décrits, et l'ensemble d'images primaire correspond à l'ensemble de
premières
s images concaténées obtenu à la deuxième étape 102.
[00128] La première sous-étape 1051 consiste ensuite à obtenir un ensemble de
segmentations de lésion en fusionnant les prédictions de lésion PL obtenues
pour l'en-
semble des réseaux de neurones artificiels récurrents primaires.
[00129] Ainsi, si deux réseaux de neurones artificiels récurrents primaires
sont utili-
sées, les prédictions de lésion PL par le premier réseau de neurones
artificiels récur-
rents primaire sont fusionnées avec les prédictions de lésion PL par le
deuxième ré-
seau de neurones artificiels récurrents primaire.
[00130] La fusion est par exemple réalisée en multipliant chaque prédiction de
lé-
sion PL obtenue pour une image I d'un premier ensemble d'images primaire
fournie
par un premier réseau de neurones artificiels récurrents primaire avec la
prédiction de
lésion PL obtenue pour une image I correspondante d'un autre ensemble d'images
primaire pour chaque autre réseau de neurones artificiels récurrents primaire.
[00131] Une carte de probabilités de fusion est alors obtenue pour chaque
image
du premier ensemble d'images primaire, dans laquelle chaque pixel est associé
au
produit des probabilités associées au pixel correspondant dans chaque
prédiction de
lésion PL fournie pour l'image I.
[00132] La fusion consiste ensuite à appliquer un seuil sur chaque carte de
proba-
bilités de fusion pour ne conserver que les pixels associés à une probabilité
supérieure
au seuil dans la carte de probabilités de fusion.
[00133] Le seuil est par exemple égal à 0.25.
[00134] En comparant les groupes de pixels voisins dans chaque carte de
probabi-
lité de fusion seuillée en prenant en compte la position de l'image I
correspondante
selon l'axe perpendiculaire au plan de section correspondant, des groupes de
voxels
voisins peuvent être déterminés, chaque groupe de voxels voisins constituant
alors
une segmentation de lésion qui est placée dans l'ensemble de segmentations de
lé-
sion.
CA 03224162 2023- 12- 22
WO 2023/280708 23
PCT/EP2022/068270
[00135] Si à l'issue de la première sous-étape 1051 de la cinquième étape 105,
l'ensemble de segmentations est vide, on considère que l'image ne contenait
aucune
lésion.
[00136] Sinon, c'est-à-dire si à l'issue de la première sous-étape
1051 de la cm-
quième étape 105 l'ensemble de segmentations comporte au moins une
segmentation
de lésion, une sixième étape 106 du procédé 100 est réalisée.
[00137] La deuxième sous-étape 1052 consiste à utiliser chaque réseau de neu-
rones artificiels récurrents secondaire entraîné à la quatrième étape 104, sur
chaque
image I d'un ensemble d'images secondaire, chaque réseau de neurones
artificiels
récurrents secondaire fournissant alors une prédiction de thrombus PT pour
chaque
image de l'ensemble d'images secondaire.
[00138] Chaque réseau de neurones artificiels récurrents secondaire peut être
uti-
lisé sur un ensemble d'images secondaire identique ou différent par rapport
aux autres
réseaux de neurones artificiels récurrents secondaires.
[00139] Chaque ensemble d'images secondaire dépend d'au moins un ensemble
d'images associé à une modalité.
[00140] La deuxième sous-étape 1052 est par exemple réalisée sur un premier en-
semble d'images secondaire pour le premier réseau de neurones artificiels
récurrents
secondaire précédemment décrit et sur un deuxième ensemble d'images secondaire
pour le deuxième réseau de neurones artificiels récurrents secondaire
précédemment
décrit, le premier ensemble d'images secondaire correspondant à l'ensemble
d'images
associé à la première modalité et le deuxième ensemble d'images secondaire
corres-
pondant à l'ensemble de deuxièmes images concaténées obtenu à la deuxième
étape
102.
[00141] La deuxième sous-étape 1052 consiste ensuite à obtenir un ensemble de
segmentations de thrombus en fusionnant les prédictions de thrombus PT
obtenues
pour l'ensemble des réseaux de neurones artificiels récurrents secondaires.
[00142] Ainsi, si deux réseaux de neurones artificiels récurrents secondaires
sont
utilisés, les prédictions de thrombus PT par le premier réseau de neurones
artificiels
récurrents secondaire sont fusionnées avec les prédictions de thrombus PT par
le deu-
xième réseau de neurones artificiels récurrents secondaire.
CA 03224162 2023-12-22
WO 2023/280708 24
PCT/EP2022/068270
[00143] La fusion est par exemple réalisée en multipliant chaque prédiction de
thrombus PT obtenue pour une image I d'un premier ensemble d'images secondaire
fournie par un premier réseau de neurones artificiels récurrents secondaire
avec la
prédiction de thrombus PT obtenue pour une image I correspondante d'un autre
en-
semble d'images secondaire pour chaque autre réseau de neurones artificiels
récur-
rents secondaire.
[00144] Une carte de probabilités de fusion est alors obtenue pour chaque
image
du premier ensemble d'images secondaire, dans laquelle chaque pixel est
associé au
produit des probabilités associées au pixel correspondant dans chaque
prédiction de
thrombus PT fournie pour l'image I.
[00145] La fusion consiste ensuite à appliquer un seuil sur chaque carte de
proba-
bilités de fusion pour ne conserver que les pixels associés à une probabilité
supérieure
au seuil dans la carte de probabilités de fusion.
[00146] Le seuil est par exemple égal à 0.25.
[00147] En comparant les groupes de pixels voisins dans chaque carte de
probabi-
lité de fusion seuillée en fonction de la position de l'image I correspondante
selon l'axe
perpendiculaire au plan de section correspondant, des groupes de voxels
voisins peu-
vent être déterminés, chaque groupe de voxels voisins constituant alors une
segmen-
tation de thrombus qui est placée dans l'ensemble de segmentations de
thrombus.
[00148] La sixième étape 106 du procédé 100 selon l'invention consiste à
sélection-
ner comme segmentation de la lésion dans l'image tridimensionnelle, la
segmentation
de l'ensemble de segmentations de lésion de volume maximal, c'est-à-dire
compre-
nant le plus grand nombre de voxels.
[00149] Une septième étape 107 du procédé 100 selon l'invention consiste à
sélec-
tionner comme segmentation du thrombus dans l'image tridimensionnelle, la
segmen-
tation de l'ensemble de segmentations de thrombus répondant à une condition de
proximité dépendant de la segmentation de la lésion obtenue à la sixième étape
106.
[00150] Une segmentation de thrombus répond par exemple à une condition de
proximité si sa position dans l'image I est comprise entre la position de la
lésion dans
l'image I et le bas de la tête du patient.
CA 03224162 2023- 12- 22
WO 2023/280708 25
PCT/EP2022/068270
[00151] En réalisant toutes les étapes de la méthode 100 décrites sur la
figure 1 en
utilisant le premier réseau de neurones artificiels récurrents primaire, le
deuxième ré-
seau de neurones artificiels récurrents primaire, le premier réseau de
neurones artifi-
ciels récurrents secondaire et le deuxième réseau de neurones artificiels
récurrents
secondaire précédemment décrits, un taux de détection de 100% et un nombre de
faux positifs réduit est obtenu pour la segmentation de la lésion et la
segmentation du
thrombus.
[00152] Il est possible de réduire encore le nombre de faux
positifs en réalisant une
lo huitième étape 108 de post-traitement de la segmentation du thrombus
obtenue à l'is-
sue du procédé 100. Cette étape 108 est illustrée sur les figures 10 à 11.
[00153] On entend par faux-positifs les voxels de la segmentation du thrombus
qui
sont associés à une forte probabilité de ne pas appartenir au thrombus. A
l'inverse, les
vrai-positifs sont les voxels de la segmentation du thrombus associés à une
forte pro-
babilité d'appartenir au thrombus. Ces probabilités sont déterminées pendant
l'entraî-
nement du réseau de neurones artificiels récurrents secondaire. Ainsi, à
l'étape 107
du procédé 100, l'utilisation de chaque réseau de neurones artificiels
récurrents se-
condaire permet d'associer à chaque voxel de la segmentation du thrombus une
éti-
guette faux-positif ou vrai-positif.
[00154] L'étape 108 consiste à exclure de la segmentation du thrombus un
certain
nombre de faux positifs en fonction de leur distance à la lésion déjà
segmentée 106.
[00155] Pour cela, une première sous-étape 1081 consiste à calculer
l'enveloppe
de la lésion à partir de la segmentation de la lésion déterminée à l'étape
106.
[00156] Une deuxième sous-étape 1082 consiste à répartir la segmentation du
thrombus 107 en deux ensembles de voxels: le premier ensemble de voxels FP COM-
porte tous les voxels de la segmentation du thrombus associés à l'étiquette
faux-positif
et le deuxième ensemble de voxels VP comporte tous les voxels associés à
l'étiquette
vrai-positif, c'est-à-dire que le deuxième ensemble comporte tous les voxels
de la seg-
mentation du thrombus qui n'appartiennent pas au premier ensemble de voxels
FP.
CA 03224162 2023- 12- 22
WO 2023/280708 26
PCT/EP2022/068270
[00157] A partir du premier ensemble de voxels FP, on réalise une troisième
sous-
étape 1083 de réduction du nombre de faux-positifs.
[00158] Une première sous-sous étape 1083a consiste à calculer, pour chaque
voxel du premier ensemble de voxels FP, la distance euclidienne du voxel à
l'enve-
loppe de la lésion. Ainsi, chaque voxel du premier ensemble de voxels FP est
associé
à un paramètre donnant sa distance à la lésion.
[00159] Une deuxième sous sous-étape 1083b consiste à ordonnancer, par ordre
croissant par exemple, les voxels du premier ensemble de voxels FP en fonction
de la
distance à la lésion calculée précédemment. On obtient ainsi une liste de
voxels or-
donnés en fonction de leur distance à la lésion.
[00160] Dans une troisième sous-sous étape 1083c, seuls un certain nombre de
voxels du premier ensemble de voxels FP sont sélectionnés à partir de la liste
de
voxels ordonnés pour former un sous-ensemble de voxels FPR du premier ensemble
de voxels FP. Les voxels du sous-ensemble de voxels FPR sont donc un ensemble
réduit de voxels faux-positifs.
[00161] La sélection des voxels de la liste de voxels ordonnés peut être
réalisée de
plusieurs manières. Dans une première manière, on peut sélectionner les 3 à 5
voxels
de la liste de voxels ordonnés ayant la distance à la lésion la plus petite.
Dans une
autre manière, on peut sélectionner les voxels de la liste de voxels ordonnés
qui sont
associés à une distance à la lésion inférieure à un seuil prédéterminé. Ce
seuil peut
être de 1 à 2 unités.
[00162] Enfin, l'étape 108 comprend une quatrième sous-étape 1084 consistant
en
la réunion du sous-ensemble de voxels FPR et du deuxième ensemble de voxels VP
pour former la segmentation du thrombus, celle-ci étant une segmentation du
throm-
bus raffinée par rapport à la segmentation du thrombus déterminée à l'étape
107. Le
taux de faux-positifs est en effet réduit.
[00163] Une fois la segmentation de la lésion et la segmentation du thrombus
obte-
nus, il est alors possible de caractériser la lésion ou le thrombus de manière
objective
CA 03224162 2023- 12- 22
WO 2023/280708 27
PCT/EP2022/068270
par le calcul de paramètres numériques, tel que le volume, de manière à
fournir au
praticien une image interprétable, cela de façon homogène, c'est-à-dire peu
dépen-
dante du praticien.
[00164] Le volume et la forme du thrombus donnent en particulier au praticien
des
informations complémentaires capitales en ce qu'elles aident le praticien à
poser un
diagnostic et à orienter le traitement à donner. En effet, selon que le
thrombus occupe
un grand ou petit volume, ou/et que sa forme soit elliptique ou sensiblement
sphérique,
le protocole de traitement à appliquer sera différent.
[00165] Pour cela, le procédé 100 peut être suivi d'une neuvième étape 109 de
ca-
ractérisation volumétrique du thrombus déjà segmenté. Comme illustré sur la
figure 9
qui est un schéma synoptique illustrant l'enchainement d'une huitième et d'une
neu-
vième étape 108, 109 au procédé 100, l'étape 109 peut être réalisée soit à
partir de la
segmentation du thrombus obtenue à l'issue du procédé 100, soit à partir de la
seg-
mentation raffinée du thrombus obtenue à l'étape 108.
[00166] Par caractérisation volumétrique du thrombus, on entend le calcul du
vo-
lume de l'enveloppe ellipsoïdale maximale contenant le thrombus et le calcul
des pa-
ramètres géométriques caractérisant ce volume. Ainsi, considérant un volume
simple
de forme ellipsoïde, les paramètres géométriques déterminés à l'étape 109
seront les
longueurs, respectivement, du demi grand axe, du demi-moyen axe et du demi-
petit
axe Ces valeurs permettent de caractériser la forme du volume de manière
objective
[00167] En référence à la figure 12, la caractérisation volumétrique du
thrombus
(109) est réalisée en au moins trois sous-étapes 1091, 1092 et 1093.
[00168] La première sous-étape 1091 consiste à extraire de la segmentation du
thrombus 107 ou 108 les n pixels qui forment le thrombus, n étant supérieur à
3. Plus
précisément, la sous-étape 1091 consiste à extraire, pour tous les voxels de
la seg-
mentation du thrombus, les 3 pixels correspondant aux trois directions
spatiales de
chaque voxel, et à organiser les n pixels extraits dans une liste. Cette liste
prend par
exemple la forme d'une matrice M ayant les coordonnées spatiales de chaque
pixel
arrangées en ligne.
CA 03224162 2023- 12- 22
WO 2023/280708 28
PCT/EP2022/068270
[00169] Les n pixels extraits forment un nuage de points 3D contenu dans un vo-
lume, par exemple dans un volume de forme ellipsoïde. Ce volume représente le
vo-
lume de l'enveloppe ellipsoïdale maximale contenant le thrombus.
[00170] La deuxième sous-étape 1092 de l'étape 109 consiste à calculer les
para-
mètres géométriques caractérisant le volume de l'enveloppe ellipsoïdale
maximale
contenant le thrombus. Considérant un volume de forme ellipsoïde, les
paramètres
géométriques caractérisant le volume de l'enveloppe ellipsoïdale maximale
contenant
lo le thrombus sont les longueurs du grand, moyen et petit demi-axe de
l'ellipsoïde.
[00171] Pour cela, à la sous-étape 1092, le nuage de points 3D formé par les n
pixels extraits est analysé par composantes principales en prenant comme axes
prin-
cipaux 3 axes orthogonaux, ces axes orthogonaux définissant les axes de
l'ellipsoïde.
ts En d'autres termes, l'analyse par composantes principales permet de
déterminer les
trois axes orthogonaux qui représentent le mieux le nuage de points 3D, c'est-
à-dire
le volume de l'enveloppe ellipsoïdale maximale contenant le thrombus.
[00172] Plus précisément, le théorème de Karhunen-Loeve comprenant des étapes
zo de diagonalisation de matrice, transformation de vecteur propre et analyse
en compo-
santes principales, peut être utilisé sur la matrice M déterminée à la sous-
étape 1091.
[00173] On détermine ainsi la matrice M', cette matrice étant la transposée de
la
matrice M
[00174] On décompose ensuite le produit de matrice M x mi en la somme de trois
zs matrices M1, M2 et M3 de même dimension que M:
[00175] M x M' = x Mi + x M2 + 13 X M3, OU :
O Mi = u X u ,avec i = 1,2,3 et et j = 1,2,3,
o et (ui, /i) forme le couple de vecteur/valeur propre,
o et /1. > /2 > /3.
30 [00176] Géométriquement, I est un demi-axe de l'ellipsoïde.
[00177] La troisième sous-étape 1093 de l'étape 109 consiste à calculer le
volume
V de l'enveloppe ellipsoïdale maximale contenant le thrombus à partir des demi-
axes
CA 03224162 2023- 12- 22
VO 2023/280708 29
PCT/EP2022/068270
/I déterminés à la sous-étape 1092. Le volume V est donné par la formule
suivante :
4
V = -31/Cii X 12 X 13).
[00178] En résumé, on obtient à l'issue de l'étape 109 les paramètres
géométriques
de plus grande longueur I, de moyenne longueur /2 et de petite longueur /3
caracté-
s risant le volume de l'enveloppe ellipsoïdale maximale contenant le
thrombus, ainsi que
le volume de l'enveloppe ellipsoïdale maximale contenant le thrombus.
CA 03224162 2023- 12- 22