Note: Descriptions are shown in the official language in which they were submitted.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
1
DISPOSITIF MICROFLUIDIQUE POUR LA CRISTALLISATION ET
L'ANALYSE CRISTALLOGRAPHIQUE DE MOLÉCULES
La présente invention se rapporte au domaine de la
cristallisation. Elle concerne tout particulièrement un
dispositif microfluidique pour la cristallisation et
l'analyse cristallographique de molécules, notamment
biologiques.
La mise au point de dispositifs permettant l'obtention
de cristaux de qualité est un enjeu majeur, notamment dans
les domaines de la biologie, en particulier en génomique
structurale, de la chimie, de la pharmacie et de la
médecine, notamment pour la recherche de nouveaux principes
actifs.
La cristallisation de molécules, notamment biologiques,
est un processus multi-paramétrique complexe qui fait
intervenir un grand nombre de variables physiqo-chimiques et
biochimiques. Ainsi, la recherche et l'optimisation de
conditions permettant l'obtention de cristaux de qualité,
peut nécessiter une quantité importante de substances à
cristalliser telles que des biomolécules ou des composés
synthétiques, matériel pouvant être très coûteux.
Actuellement, la recherche de dispositifs visant à
obtenir des cristaux de qualité avec une faible quantité
d'échantillon à cristalliser est en pleine expansion.
Ainsi, depuis 2003, la société Californienne Fluidigm
propose une puce microfluidique permettant de préparer des
cristaux de qualité à partir d'une faible quantité
d'échantillon. Toutefois, ce système doit être rempli à la
main et fonctionne avec un système de vannes activées par
pressurisation qui rend complexe son utilisation et qui peut
être une source de panne. En outre, ce dispositif est
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
2
onéreux et permet difficilement une analyse des cristaux in
situ.
Bien que certains dispositifs miniaturisés soient déjà
utilisés pour la cristallisation de molécules, ils peuvent
être coûteux, insuffisamment fiables, difficiles
d'utilisation, ne pas être adaptés à la fois au criblage et
à l'optimisation des conditions de cristallisation, ou
encore ne pas permettre une analyse des cristaux in situ,
notamment par diffraction des rayons X.
Il subsiste donc un besoin pour des dispositifs
présentant des propriétés améliorées pour la cristallisation
de molécules.
Les inventeurs ont maintenant mis au point un dispositif
permettant de résoudre tout ou partie des problèmes évoqués
ci-dessus.
Selon un premier aspect, l'invention a pour objet un
dispositif microfluidique comprenant au moins une chambre de
cristallisation susceptible de comprendre une solution dans
laquelle au moins un composé est présent selon un gradient
de concentration et dans lequel la géométrie de ladite
chambre de cristallisation permet de limiter les phénomènes
de convection.
Ainsi, l'invention se rapporte aussi à une chambre de
cristallisation destinée à recevoir une solution comprenant
un agent de cristallisation. Par conséquence, l'invention se
rapporte également à une chambre de cristallisation
comprenant ou non cette solution, ainsi qu'à un dispositif
microfluidique comprenant au moins une chambre avec ou sans
ladite solution.
On entend par dispositif microfluidique au sens de
la présente invention un appareil miniaturisé utilisant de
très faibles quantités d'échantillon liquide, de l'ordre du
microlitre, voire inférieures au microlitre. Au sein du
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
3
dispositif, la géométrie et les dimensions réduites de
ladite chambre de cristallisation minimisent les mouvements
de convection dans les solutions, tels qu'observés par
exemple en interférométrie. L'environnement microfluidique
favorise ainsi une croissance cristalline plus homogène dans
un milieu limitant les phénomènes de convection, voire
exempt de phénomènes de convection.
On entend par chambre de cristallisation au sens de
la présente invention une chambre adaptée à la
cristallisation de molécules, en particulier un espace
étanche aux liquides et aux gaz, et tout particulièrement à
l'eau, aux solvants volatiles tels que les alcools, à la
vapeur d'eau et/ou à l'air.
En particulier, la chambre de cristallisation est reliée
à au moins un réservoir (R1).
On entend par réservoir au sens de la présente
invention, une enceinte étanche permettant de contenir un
fluide dont le volume peut être supérieur à celui de la
chambre de cristallisation.
La chambre de cristallisation selon l'invention peut
être agencée de manière à permettre une cristallisation par
batch, par contre-diffusion, de préférence par contre-
diffusion.
La technique de cristallisation par contre-diffusion a
été développée par Garcia-Ruiz en 1994 (Garcia Ruiz &
Moreno, 1994, Acta. Cryst. D50, 484-490), cette technique
est bien connue de l'Homme du Métier.
En particulier, la chambre de cristallisation selon
l'invention présente une section ou un diamètre, inférieur
ou égal à 400 m, notamment inférieur ou égal à 300 Eim, en
particulier inférieur ou égal à 200 m, voire inférieur ou
égal à 100 m.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
4
La chambre de cristallisation selon l'invention peut
présenter une longueur supérieure ou égale à 10 mm,
notamment supérieure ou égale à 30 mm.
La chambre de cristallisation selon l'invention peut
présenter un rapport longueur / largeur supérieur ou égal à
10, en particulier supérieur ou égal à 100, et tout
particulièrement supérieur ou égal à 1000.
La chambre de cristallisation selon l'invention peut
présenter une section carrée, rectangulaire, hémisphérique,
triangulaire ou tubulaire, notamment carré ou rectangulaire.
En particulier, la géométrie de la chambre de
cristallisation selon l'invention comprend des moyens
permettant d'améliorer la cristallisation notamment
d'augmenter le nombre de cristaux formés, en particulier par
greffage de fonctions chimiques, de charges, de substrats
d'enzymes et/ou de ligands, ou encore par des arrangements
géométriques particuliers, comme des chicanes, des aspérités
ou des irrégularités de surface.
Les techniques de greffage de fonctions chimiques, de
charges, de substrats d'enzymes ou de ligands sont des
techniques bien connues de l'Homme du Métier (Ulman, 1991,
Introduction to thin organic films : From Langmuir-Blodgett
to self Assembly ; Academic Press, Boston).
Ainsi, le dispositif selon l'invention peut notamment
permettre la cristallisation de macromolécules telles que
les enzymes, les acides nucléiques ou les protéines
membranaires.
La chambre de cristallisation selon l'invention peut
être réalisée par au moins un procédé de lithographie, de
micro-usinage, de moulage par injection, de moulage par
compression, de compression à chaud ou à froid par coulage
et/ou d'impression.
On entend par procédé de lithographie une méthode
dérivée de l'industrie des semi-conducteurs dont le principe
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
général consiste à créer une image sur un substrat recouvert
d'une couche de matériau sensible telle que décrite par
Chang et Sze (1996, ULSI technology, Mac Graw-Hill
International Editions) et par Xia et Whitesides (1998,
Annu. Rev. Mater. Sci., 28, 153-184).
A titre d'exemple de procédé de lithographie, on peut
citer la photolithographie, la lithographie X, la
lithographie EUV, la lithographie électronique, la
lithographie ionique et la lithographie de nano-impression.
De telles techniques peuvent être facilement identifiées par
l'Homme du Métier à l'aide de ses connaissances générales.
Des procédés de micro-usinage par enlèvement de matière
peuvent être basés sur l'utilisation d'un outil coupant ou
d'un laser.
Le (ou les) matériau(x) constituant la chambre de
cristallisation selon l'invention et son entourage peu(ven)t
être transparent(s) , notamment laisse(nt) passer le
spectre visiblg, les rayons X incidents et/ou le signal
diffracté par le cristal. Le(s) matériau(x) peu(ven)t
notamment être choisi(s) dans le groupe comprenant le
polydiméthyl-siloxane (PDMS), le polyméthyl-méthacrylate
(PMMA), le polycarbonate, le copolymère de cyclo-oléfine
(COC) et la résine SU8, de préférence le polyméthyl-
méthacrylate.
Ainsi, le dispositif selon l'invention peut permettre le
suivi cinétique de la croissance des cristaux, par exemple
par vidéomicroscopie, de la formation d'un gradient de
concentration, notamment par interférométrie.
En particulier, au moins une partie du volume défini par
la chambre de cristallisation selon l'invention comprend un
gel.
On entend par gel un milieu diphasique constitué
d'un réseau tridimensionnel de polymère réticulé imprégné
d'un liquide tel qu'une solution moléculaire à cristalliser.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
6
La réticulation peut être d'origine physique dans le cas par
exemple d'un gel d'agarose, de cellulose et leurs dérivés,
ou chimique dans le cas par exemple d'un gel de silice ou
d'acrylamide-bisacrylamide.
Ledit gel selon l'invention peut être choisi dans le
groupe comprenant les gels d'agarose, de cellulose et/ou
leurs dérivés, de silice et/ou d'acrylamide-bisacryamide.
En particulier, au moins une partie du volume défini par
une extrémité de la chambre de cristallisation selon
l'invention comprend un gel.
En particulier, l'ensemble du volume défini par la
chambre de cristallisation selon l'invention comprend un
gel.
La chambre de cristallisation selon l'invention peut
présenter sur au moins une partie de sa surface interne des
moyens permettant d'en augmenter la mouillabilité.
On entend par mouillabilité au sens de l'invention
l'aptitude d'une,surface à être mouillée par une solution
aqueuse, ce qui se traduit par l'observation d'un angle de
contact inférieur à 90 .
Ainsi, l'invention est remarquable en ce que dans le cas
où la chambre de cristallisation présente une surface
hydrophobe, ce qui est le cas avec les élastomères ou
plastiques, l'ajout d'agent mouillant comme des tensioactifs
permet de faire pénétrer spontanément les solutions
aqueuses, y compris celles comprenant des protéines, dans la
chambre de cristallisation, notamment lorsque celle-ci se
présente sous la forme de canaux. Ainsi, l'ajout de ces
tensioactifs permet d'augmenter le pouvoir mouillant des
échantillons et de s'affranchir des systèmes de vannes et de
pompes puisque les échantillons pénètrent par capillarité.
Une alternative selon l'invention consiste à modifier
chimiquement la surface de la chambre de façon à la rendre
plus hydrophile.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
7
Ainsi, à titre d'exemples de moyens permettant
d'augmenter la mouillabilité, on peut citer :
- i) les modifications de surface par des
traitements physiques, chimiques ou une combinaison des
deux, par exemple des traitements plasmas, notamment
oxygène, ozone, ultraviolets, par des ions, l'adsorption de
tensioactifs, le greffage de groupements hydrophiles ;
- ii) l'ajout de molécules tensioactives à une
solution aqueuse.
Selon un mode de réalisation particulier, la chambre de
cristallisation est susceptible d'être remplie par
capillarité.
On entend par capillarité selon l'invention un
phénomène se traduisant par la montée d'un fluide dans un
tube de faible diamètre.
On entend par solution au sens de la présente
invention, un liquide homogène comprenant au moins un
9 = = solvant et un soluté, ledit soluté étant dissous dans le
solvant.
On entend par composé au sens de la présente
invention, une substance chimique.
En particulier, ledit composé est un agent de
cristallisation.
On entend par agent de cristallisation au sens de la
présente invention un composé organique ou inorganique,
naturel ou de synthèse, favorisant la cristallisation de
molécules.
A titre d'exemples d'agent de cristallisation, on peut
citer des sels tels que le chlorure de sodium, le sulfate
d'ammonium, des alcools tel que le méthyl-2,4-pentanediol,.
l'éthanol, des polymères tels que les polyéthylène-glycols
et leurs dérivés et les polyamines.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
8
On entend par gradient de concentration au sens de
la présente invention, la variation de la concentration d'un
composé du milieu le plus concentré vers le milieu le moins
concentré.
En particulier, le dispositif microfluidique permet
d'obtenir un gradient de concentration en composé, et en
notamment en agent de cristallisation, allant d'une
concentration inférieure ou égale à 25 %, notamment 20
voire 15 %, en particulier 10 %, tout particulièrement 5$,
voire 0%, à une concentration supérieure ou égale à 50 $,
voire 75 %, notamment 85 %, en particulier 95 % et tout
particulièrement 100 % de la concentration de saturation en
composé et notamment en agent de cristallisation.
En particulier, ledit gradient de concentration
s'établit sur au moins 20 % de la longueur, notamment sur au
moins 40 % de la longueur, en particulier sur au moins 60 %
de la longueur, tout particulièrement sur au moins 80 % de
-0 . . . ,
la longuéur, voire sur toute la longueur de la chambre de
cristallisation.
Ainsi, le dispositif selon l'invention permet d'obtenir
une très grande variété, un continuum, de conditions de
cristallisation. Ce dispositif permet tout particulièrement
d'obtenir une variation continue ou quasi continue des
conditions.
En particulier, lorsque le dispositif selon l'invention
comprend plusieurs chambres de cristallisation, ledit
composé, notamment l'agent de cristallisation est présent à
une concentration différente dans chaque chambre de
cristallisation.
Ainsi, lorsqu'une condition de cristallisation est
identifiée, ce dispositif peut être utilisé pour
l'optimiser.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
9
Le dispositif selon l'invention, en limitant les
phénomènes de convection, peut permettre l'obtention de
cristaux de qualité avec de très faibles quantités de
matériels à cristalliser.
On entend par phénomène de convection au sens de la
présente invention, les mouvements au sein d'un fluide dus,
par exemple, à une variation de température ou de densité.
On entend par géométrie au sens de la présente
invention, la disposition dans l'espace des éléments, en
particulier l'arrangement de ladite chambre de
cristallisation.
En particulier, le dispositif selon l'invention peut
permettre la cristallisation de molécules dans un milieu
dépourvu d'air et/ou de gaz entraînant la dégradation de
composés, et en particulier de molécules à cristalliser.
Ceci peut ainsi permettre la cristallisation de molécules
sensibles,,notamment à l'oxydation.
Le dispositif selon l'invention peut comprendre au moins
une solution comprenant une substance tensioactive,
notamment choisie dans le groupe comprenant des tensioactifs
non-ioniques et zwitterioniques, notamment permettant de
solubiliser les molécules à cristalliser.
On entend par substance tensioactive au sens de la
présente invention un composé chimique présentant des
propriétés tensioactives.
A titre d'exemples de substance tensioactive, on peut
citer l'octylglucoside, l'octylthioglucoside, le
nonylgiucoside, le LDAO (lauryl-diamine oxide), le Triton X-
100 (polyoxyethylène octyl phenyl ether), le CHAPS (acide
3((3-cholamidopropyl) dimethylammonio)-propanesulfonique) et
leurs dérivés, en particulier l'octylglucoside.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
La concentration en substance tensioactive peut varier
en fonction du produit choisi, notamment de 1 à 100, % ou
plus de la concentration micellaire critique (CMC).
A titre d'exemples, la CMC dans l'eau de
l'octylglucoside est de 20 mM, celle de
l'octylthioglucoside est de 6,5 mM, du nonylgiucoside est de
9,5 mM, du LDAO est de 2 mM, du Triton X-100 est de 0,9 mM,
du CHAPS est de 8 mM.
En particulier, le dispositif selon l'invention est
dépourvu :
- de moyens de remplissage mécanique, notamment de la
chambre de cristallisation, comme des vannes et des moyens
de pression, et/ou
- de partie mobile,
en particulier pour permettre l'utilisation dudit
dispositif, tout particulièrement lors du remplissage de la
chambre de cristallisation.
Ainsi, le dispositif selon r'invention peut être d'uné
utilisation facile, présenter une fiabilité améliorée et/ou
avoir un coût de production réduit.
Avantageusement, le dispositif selon l'invention peut
permettre une analyse in situ des cristaux présents dans la
chambre de cristallisation par diffraction de rayons X.
Le dispositif selon l'invention peut être transparent ou
translucide à la lumière, en particulier pour permettre
l'observation des cristaux à l'aeil nu, en grossissement
optique, notamment en grossissement optique.
En particulier, ladite solution selon l'invention
comprend en outre au moins une molécule d'intérêt, d'origine
chimique, biologique, médicale et/ou pharmaceutique,
notamment une molécule inorganique ou organique, une
macromolécule naturelle ou de synthèse, notamment choisie
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
11
dans le groupe comprenant les acides nucléiques, les
protéines, les complexes supramoléculaires et les virus.
Le dispositif microfluidique selon l'invention peut
comprendre des moyens permettant d'obtenir une température
donnée dans tout le dispositif ou dans au moins une chambre
de cristallisation.
Le dispositif microfluidique selon l'invention peut
comprendre des moyens permettant d'obtenir gradient de
température dans au moins une partie d'au moins une chambre
de cristallisation, en particulier sur toute la longueur
d'au moins une chambre de cristallisation et tout
particulièrement dans l'ensemble du dispositif selon
l'invention.
De tels moyens peuvent être facilement identifiés par
l'Homme du Métier à l'aide de ses connaissances générales.
A titre d'exemples de moyens permettant d'obtenir une
température donnée dans tout le dispositif ou dans au moins
une chambre de cristallisation, oli peut citer l'utilisation.
d'éléments Peltier. Par effet Peltier , on entend un =
effet de déplacement de chaleur en présence de courant
électrique dans des matériaux conducteurs de natures
différentes liés par des jonctions. Une des jonctions se
refroidit alors légèrement pendant que l'autre jonction se
réchauffe.
En particulier, le dispositif microfluidique selon
l'invention peut comprendre des moyens permettant d'obtenir
un gradient de température dans au moins une partie d'au
moins une chambre de cristallisation, voire sur toute la
longueur d'au moins une chambre de cristallisation.
De tels moyens peuvent être facilement identifiés par
l'Homme du Métier à l'aide de ses connaissances générales.
A titre d'exemples de moyen permettant d'obtenir un
gradient de température dans au moins une partie d'au moins
une chambre de cristallisation, voire sur toute la longueur
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
12
d'au moins une chambre de cristallisation, on peut citer les
éléments Peltier.
Selon un autre aspect, l'invention a également pour
objet l'utilisation du dispositif selon l'invention pour
l'une des applications suivantes :
- cristallisation par contre-diffusion,
- recherche de nouveaux principes actifs et/ou de
nouvelles formes de principes actifs, notamment de nouvelles
formes cristallines,
- recherche par criblage et optimisation des conditions
de cristallisation,
notamment dans le cas de molécules d'intérêt, telles que des
sels ou des molécules organiques ou inorganiques, des
macromolécules biologiques, des virus ou des principes
actifs de médicaments.
Ainsi, le dispositif selon l'invention peut être utilisé
pour cribler et optimiser les conditions de cristallisation
de molecules.
Selon un autre aspect, l'invention a également pour
objet l'utilisation du dispositif selon l'invention au sein
d'un dispositif permettant une analyse par diffraction des
rayons X des cristaux présents dans la chambre de
cristallisation.
Ainsi, le dispositif selon l'invention peut être utilisé
pour analyser des cristaux in situ sans manipulation pouvant
détériorer leur qualité.
Selon un autre aspect, l'invention a également pour
objet un procédé de cristallisation comprenant au moins les
étapes consistant à :
(i) déposer à une extrémité d'une chambre de
cristallisation une solution comprenant au moins une
molécule d'intérêt, notamment une macromolécule,
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
13
(ii) déposer à une autre extrémité de la chambre de
cristallisation une solution comprenant au moins un agent de
cristallisation, puis
laisser des cristaux se former.
En particulier, dans le procédé selon l'invention,
ladite chambre de cristallisation est comprise dans un
dispositif selon l'invention.
En particulier, le procédé de cristallisation selon
l'invention comprend en outre l'étape consistant à :
(iv) déposer à une extrémité d'une chambre de
cristallisation une solution comprenant un composé choisi
dans le groupe comprenant des substrats d'enzymes, des
ligands, des cryoprotectants, des composés facilitant la
détermination de structure tridimensionnelle tels que des
atomes lourds.
D'autres avantages et caractéristiques de l'invention
apparaîtront au regard des figures et des exemples qui
a = .
suivent.
Les figures et les exemples qui suivent sont donnés à
titre illustratif et non limitatif :
- La Figure 1 (A et B) illustre des dispositifs en
PDMS selon l'invention. La Figure lA illustre sous la forme
d'un dessin un masque présentant 3 types de géométries de
chambres de cristallisations sous forme de canaux isolés, de
peigne et en arborescence. La Figure 1B représente un
substrat de PDMS comportant quatre dispositifs à géométrie
arborescence moulés par la méthode de coulage.
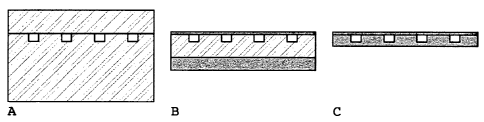
- La Figure 2 (A, B et C) illustre sous la forme de
schémas trois types de dispositifs selon l'invention. La
Figure 2A illustre un dispositif d'épaisseur totale de 4-5
mm, formé par une couche de PDMS ( f igurée par des rayures)
dans laquelle sont moulées les chambres de cristallisation
sous forme de canaux et qui sont fermées par collage d'une
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
14
seconde couche de PDMS. La Figure 2B illustre un dispositif
formé par une couche de PDMS de 0,5-1 mm d'épaisseur, dans
laquelle sont moulées les chambres de cristallisation sous
forme de canaux et qui sont fermées par un film plastique
transparent (figuré en gris foncé). La couche de PDMS est
rigidifiée par une couche-support en PMMA (figurée en gris
clair). La Figure 2C illustre un dispositif d'épaisseur de
0,25 mm, formé par une couche de PMMA dans laquelle sont
moulées les chambres de cristallisation sous forme de canaux
et qui sont fermées par un film plastique transparent.
- La Figure 3 illustre le remplissage d'un
dispositif selon l'invention en PDMS.
- La Figure 4 (A, B, C, D et E) illustre sous la
forme de photos la formation de cristaux du virus de la
mosaïque jaune du navet (VMJN), de la thaumatine, de
lysozymes de poule et de dinde dans des dispositifs selon
l'invention.
, . .
- La Figure 5 illustre = le positionnement du
dispositif selon l'invention sur une ligne de lumière
synchrotron en vue d'une analyse aux rayons X. Le dispositif
a été fixé sur une microplaque standard (plaque NUNC 96
puits à rangées amovibles), l'ensemble étant placé dans le
faisceau de rayons X à 200 mm du détecteur MAR CCD et
maintenu par la pince du bras manipulateur d'un robot
(Stàubli, France).
- La Figure 6 (A à D) illustre l'analyse in situ de
cristaux de lysozyme de poule par diffraction des rayons X.
La Figure 6A représente un dispositif selon l'invention en
PMMA dont les chambres de cristallisation sont disposées en
arborescence. Le dispositif est fixé sur une microplaque et
maintenu par une pince. La Figure 6B représente un cristal
de lysozyme de poule observé via une caméra à visée axiale.
La Figure 6C est un cliché de diffraction dont les plages de
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
résolution sont indiqués par les cercles à 2,1 Å, 2,8 Å, 4,3
Å et 8,5 Å. La Figure 6D représente une carte de densité
électronique (à 2,15 Å de résolution) avec le modèle
atomique de la protéine.
EXEMPLES
I. Exemple 1 : Fabrication de dispositifs
I.1 Fabrication de dispositifs en polydiméthyl-siloxane
(PDMS)
Des dispositifs microfluidiques ont été réalisés en
polydiméthyl-siloxane (PDMS) en quatre étapes successives :
Un masque sur film transparent a été obtenu par
impression laser.
Un moule en résine SU8 épaisse a ensuite été réalisé
par photolitographie à partir dudit masque (Figure 1B).
Les dispositifs ont ensuite été obtenus par moulâgé.
Les chambres de cristallisation sont ensuite
scellées par collage d'une seconde couche de PDMS ou d'un
film plastique transparent tel que ViewSeal , C1earSeal ,
Mylar .
Des dispositifs comprenant des chambres de
cristallisation présentant diverses géométries ont été
fabriqués tels que représentés sur la Figure lA : des
chambres de cristallisations sous forme de canaux soit
isolés, soit en forme de peigne ou en arborescence.
La Figure 1B représente le moulage de quatre dispositifs
en PDMS dont les chambres de cristallisation présentent une
géométrie arborescente.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
16
1.2 Fabrication de dispositifs en polyméthyl-
méthacrylate (PMMA)
Des dispositifs selon l'invention ont été fabriqués en
polyméthyl-méthacrylate (PMMA) par ablation laser (gravure
de chambres de cristallisation dans une couche de 250 m de
PMMA). Les chambres de cristallisation ont ensuite été
fermées par un film plastique transparent (Figure 2 C).
Les dispositifs selon l'invention fabriqués en PMMA se
sont révélés particulièrement bien adaptés à l'analyse
cristallographique, notamment par diffraction des rayons X,
et offrent de nombreux avantages par rapport aux dispositifs
en PDMS.
II. Remplissage des dispositifs
II.1 Deux techniques principales de remplissage des
dispositifs
-0 a
Les chambres de cristal~.isation du dispositif selon
l'invention ont été remplies par capillarité, notamment
selon deux techniques :
1) Une goutte de solution comprenant une molécule à
cristalliser, un agent gélifiant tel que l'agarose (0,2%-
0,5% m/v) et une substance tensioactive telle que
l'octylglucoside (0,5% m/v) a été déposée à l'extrémité
d'une chambre de cristallisation qui s'est remplie par
capillarité.
Une solution comprenant un agent de cristallisation a
ensuite été déposée à une autre extrémité de la chambre de
cristallisation.
2) Une goutte de solution comprenant une molécule à
cristalliser et une substance tensioactive telle que
l'octylglucoside (0,5% m/v) a été déposée à l'extrémité
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
17
d'une chambre de cristallisation qui s'est remplie par
capillarité.
Une solution comprenant un agent gélifiant tel que
l'agarose (2% m/v) a ensuite été déposée à une autre
extrémité de ladite chambre de cristallisation.
Enfin, une solution comprenant un agent de
cristallisation a ensuite été déposée sur le gel à cette
autre extrémité de la chambre de cristallisation.
La substance tensioactive a permis de stabiliser les
molécules, notamment les macromolécules.
L'agent gélifiant a permis d'immobiliser les solutions
et les cristaux dans les chambres de cristallisation. En
outre, il a permis de réduire encore davantage le phénomène
de convection et ainsi de favoriser la croissance de
cristaux de qualité.
. . - o . . =
11.2 Remplissage de dispositifs en PDMS
Le remplissage d'un dispositif en PDMS est illustré sur
la Figure 3.
Une couche de PDMS comprenant les chambres de
cristallisation sous forme de canaux a été déposée sur une
fine plaque de PMMA (C) placée du côté opposé aux canaux.
Ces derniers sont fermés par un film plastique transparent
(D) tel que ViewSeal , C1earSeal et Mylar . Cet ensemble a
ensuite été vissé sur un support de PMMA épais de 5 mm (B').
Une goutte de solution comprenant une molécule à
cristalliser, un agent gélifiant tel que l'agarose (0,2%-
0,5% m/v) et un détergent tel que l'octylglucoside (0,5%
m/v) a été déposée à l'extrémité de l'arborescence des
canaux qui se sont remplis par capillarité (F).
L'ensemble (A) a ensuite été pris en sandwich entre les
deux plaques vissables de PMMA (B et B') et une solution
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
18
comprenant un agent de cristallisation a ensuite été déposée
dans des réservoirs reliés aux chambres de cristallisation.
L'ensemble a ensuite été scellé par un film transparent
pour en assurer l'étanchéité.
III. Cristallisation du virus VMJN, de la thaumatine, de
lysozyme de poule et de dinde dans les dispositifs selon
l'invention
En utilisant les protocoles décrits précédemment, des
cristaux de trois protéines différentes et d'un virus ont
été obtenus par contre-diffusion.
Des cristaux de thaumatine (22kDa) sont représentés sur
les Figures 4A et 4C. Le gradient de concentration de
l'agent cristallisant s'est établi par diffusion de la
droite vers la gauche. La taille des cristaux augmente et
leur nombre diminue à mesure que la concentration d'agent
Q ,
cristallisant diminue' 'le long de la chambre, de
cristallisation sous forme de canal. La Figure 4C est une
vue rapprochée des cristaux de thaumatine sous forme de
bipyramides obtenues en 3 jours dans une chambre de
cristallisation selon l'invention, sous forme de canal
présentant une section de 100 m.
Des cristaux de virus VMJN, virus de la mosaïque jaune
du navet (5.106 kDa) sont représentés sur la Figure 4B.
Des cristaux quadratiques de lysozyme de poule obtenus
dans un dispositif en PDMS comprenant des chambres de
cristallisation sous forme de canaux isolés sont représentés
sur la Figure 4D. Les cristaux sont bien visibles en lumière
polarisée.
Des cristaux hexagonaux de lysozyme de dinde obtenus
dans un dispositif en PDMS comprenant des chambres de
cristallisation sous forme de canaux en arborescence sont
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
19
représentés sur la Figure 4E. Les cristaux sont bien
visibles lorsque polariseur et analyseur sont croisés (photo
dans l'encart).
Ces résultats montrent que le dispositif selon
l'invention permet la cristallisation de protéines par
contre-diffusion.
De plus, les dispositifs selon l'invention en PDMS et
PMMA sont suffisamment transparents pour permettre une
observation des cristaux à l'oeil nu ou au microscope, y
compris en lumière polarisée.
En outre, les cristaux obtenus dans les dispositifs
selon l'invention présentent des tailles supérieures à 50 m
et donc compatibles avec une analyse directe par diffraction
des rayons X.
IV. Analyse directe des cristaux par diffraction des rayons
dg
Des cristaux de lysozyme de poule ont été analysés in
situ par diffraction des rayons X (Figure 6). Cette analyse
a été effectuée sous rayonnement X synchrotron à l'ESRF à
Grenoble.
Ces cristaux ont été obtenus par la technique de batch
dans des dispositifs selon l'invention en PMMA de 250 m, et
fermés par un film plastique (Figure 2C).
Les dispositifs ont ainsi été remplis avec 3 l du
mélange de cristallisation de composition suivante :
- 5 l de lysozyme à 80 mg/ml dans 100 mM acétate-Na
pH 4,6
- 3 l d'agent X : 100 mM acétate-Na pH 4,6, 1 M
NaCl, 30 % PEG 3350)
- 0,3 l d'octyl-glucoside 10% (m/v) soit 0,3% (m/v)
- 1,7 l de tampon 100 mM acétate-Na pH 4,6.
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
Le dispositif a ensuite été fixé sur une microplaque
standard (plaque NUNC 96 puits à rangées amovibles),
l'ensemble étant placé dans le faisceau de rayons X à 200 mm
du détecteur MAR CCD et maintenu par un bras manipulateur
robotisé (Stâubli, France) (Figure 5).
Un jeu de trente images successives collecté sur l'un
des cristaux (conditions d'exposition : 20 secondes,
distance de 200 mm, longueur d'onde de 0,800 Å) a permis de
calculer une carte de densité électronique à une résolution
de 2,15 Å et de déterminer la structure tridimensionnelle de
la protéine (Figure 6D).
Les données cristallographiques sont résumées ci-après :
Longueur d'onde 0,799 Å
Distance 200 mm
Exposition 15 sec
Oscillation 10
Nombre d'images 30
.Groupe d'espace P43212
Maille cristalline a=79,1 Å, c=38,8 ~
Résolution 2,15 - 20 Å
Nombre de réflexions (uniques) 12115 (5040)
Complétude 72,4 % (72,7 ~)*
Rsym 7,4 % (20,1 ~)*
*données à haute résolution : 2,15-2,21 Å
L'ensemble de ces expériences montrent que le dispositif
selon l'invention permet d'obtenir des cristaux de qualité
avec une faible quantité d'échantillon à cristalliser. En
outre le dispositif selon l'invention permet à la fois le
criblage et l'optimisation des conditions de
cristallisation, le suivi par vidéo-microscopie et l'analyse
in situ des cristaux par diffraction des rayons X. La
simplicité de fonctionnement et la géométrie des dispositifs
CA 02658403 2009-01-16
WO 2008/009823 PCT/FR2007/001243
21
devraient faciliter l'automatisation de l'ensemble des
étapes, notamment dans le cadre d'applications à haut débit
pour la génomique structurale.