Note: Descriptions are shown in the official language in which they were submitted.
~2633~
-- 1 --
La présente invention a pour objet de nouveaux
dérivés N-carboxyalcoyl-2 oxo-l diaryl 5,6 as triazines,
leur procédé de synthèse et leur application thérapeu-
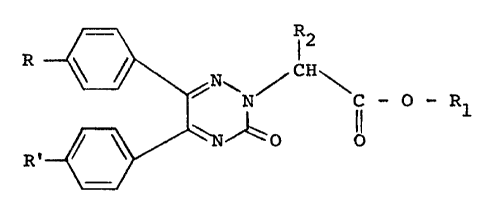
tique. Les nouveaux composés chimiques répondent a la
formule générale I:
~ l2
R ~\,~N~ /
R~\N~o C -- O -- R
(I)
dans laquelle:
R et R', identiques ou différents représentent un
hydrogene, un alcoxy ayant 1 a 5 atomes de carbone, un
alcoyle ayant 1 a 5 atomes de carbone, un hydroxy, un
dialcoylamino dans lequel le groupe alcoyle a de 1 à 5
atomes de carbone ou un halogane;
Rl représente un hydrogene, un alcoyle ayant 1 à 5
atomes de carbone;
R2 représente un hydrogane ou un groupe alcoyle ayant
1 à 5 atomes de carbone.
Des travaux antérieurs, effectu~s sur des
dérives triaziniques comportant sur l'atome d'azote en
position 2 divers groupes fonctionnels, sont illustres
20 par les brevets français n 2,383,176, n 2,478,095 et
n 2,500,830. Plus recemment, le brevet francais n
2,544,313, relatif aux N-cycloalcoylméthyl-2 oxo-3 5,6 as
,~ ~
~J633
-- 2 ~
triazines, a montre l'importance de certains substi-
tuants particuliers. La poursuite des investigations
sur cette structure as triazinique a conduit aux
nouveaux derives, objet de la presente invention, de
formule I, dans lesquels le groupe fonctionnel en
position 2 est un alcoyl carboxyalcoyle. De maniere
tout-à-fait inattendue, ces derives ne possèdent que
peu ou pas de proprietes anti-inflammatoires. Par
contre, leur activité antalgique est très puissante.
Certains composes presentent un effet sur le test des
contorsions à la phenyl benzoquinone:
Exemples 6 et 7 = activite 100 mg/kg ~ - 75~).
A titre d'exemples non limitatifs, il est
decrit ci-apres quelques composés chimiques et leur
mode d'obtention.
Schéma de synthese:
R ~ ~N~ HNa lR2
I N-H ~ X - CH - C02 - R
R~ ~ ~ N'~O
~ ~ ~,N~ /
R~ ~ ~ N ~ O C - O - R
X = halogène, plus particulièrement Br.
3;3 ~L
-- 3 --
Les intermédiaires triaziniques non substitues
en 2 peuvent être preparés à partir d'~-dicetones:
~ + NH - C - ~H - NH2 ~ Ar ~ N~
Ar O 2 O Ar N ~ O
Ar = groupes aryles substitues ou non.
Mode operatoire:
1 mole de triazine en solution dans le
dimethyl formamide est traitee par une mole d'agent
sodant, preferablement l'hydrure de sodium puis par la
quantite stoechiometrique de réactif halogéne:
l2
X - CH - CO2 - Rl
X = halogène, plus particulièrement Br.
EXEMPLE 1
Ethoxycarbonylmethyl-2 oxo-3 di(paramethoxyphenyl) 5,6
as triazine
CH20 ~ N
~ N -CH2 - C ~ C2H5
C 3 ~ ~I ~ O
Cristaux jaunes
Soluble dans le chlorure de methylène, le chloroforme,
l'ether; les alcools et le benzène à chaud.
Insoluble dans l'eau, les acides et les bases dilues.
Point de fusion : 153C + 1C
;33~
CCM : benzène - acetate d'ethyle (7/3) - Rf : 0.23
IR : v C=O : 1745 cm
EXEMPLE 2
Di(ethoxycarbonyl)methyl-2 oxo-3 di(paramethoxyphenyl)
5,6 as triazine _ _
C 3O ~ ~ ~N ~ ~C0 C2H5
CH30~ J~ \COOC2H5
Cristaux jaunes
Soluble dans le benzène, chlorure de methylène, chloro-
forme, ether; les alcools à chaud.
Insoluble dans l'eau, les acides et les bases dilues.
Point de fusion : 99C
CCM : toluène - acetate d'ethyle (7/3) - Rf : 0.37
IR : v C=O : 1700 cm 1.
EXEMPLE 3
(Ethoxycarbonyl-l ethyl-1)-2 oxo-3 di(parahydroxyphenyl)
5,6 as triazine
/=~\
H0-- ~ ~N~
CH - lCI - OC2H5
~N~0 0
Cristaux jaunes
Soluble dans les alcools à chaud.
~633~3~
-- 5 --
Insoluble dans l'eau, acides et bases dilués, le benzene,
chloroforme, chlorure de méthylène, éther.
Point de fusion : 276C
CCM : chloroforme - acétone (7/3) - Rf : 0.37
IR : v C=O : 1745 cm 1.
EXEMPLE 4
(Ethoxycarbonyl-l éthyl-1)-2 oxo-3 di(paraméthoxyphényl)
5,6 as triazine
C 3 ~ fH3 O
~ N- CH - C - OC2H5
3 y \N ~ O
Cristaux jaunes
Soluble dans les alcools à chaud, benzène, chloroforme,
chlorure de méthylène, éther.
Insoluble dans l'eau, les acides et bases dilués
Point de fusion : 132C
CCM : éther isopropylique -dioxanne -triéthylamine
(85/12.5/2.5).
EXEMPLE 5
(Hydroxycarbonyl-l éthyl-1)-2 oxo-3 di(paraméthoxy-
phénvl) 5,6 as triazine
CH3 ~ CH3 O
~ N- CH - C - OH
C~3O ~ \ y ~?N ~ O
~ii3~
Ce dérivé est obtenu par traitement alealin
(potasse en quantité stoechiométrique) dans l'éthanol
absolu du dérivé ST 1107 décrit ci-dessus.
Cristaux jaunes
Soluble dans les alcools a chaud, chlorure de méthylène,
ehloroforme, éther.
Insoluble dans l'eau, aeides et bases dilués
Point de fusion : 200C
CCM : éther isopropylique -dioxanne -acide aeétique
(85/12.5/1).
EXEMPLE 6
(Ethoxyearbonyl-l propyl-1)-2 oxo-3 di(paraméthoxy-
phényl) 5,6 as triazine
C 3O ~N~ I 2 3 O
CH8O ~/~N~O ~ OC2H5
Cristaux jaunes
Soluble dans les aleools à ehaud, benzène, ehlorure de
méthylene, chloroforme.
Insoluble dans l'eau, aeides et bases dilués, éther
Point de fusion : 110C.
EXEMPLE 7
(Ethoxyearbonyl-l butyl-1)-2 oxo~3 di(paraméthoxyphényl)
5,6 as triazine
3~
3 ~ ~ \ fH2-CH2-CH3
~ N- CH - C - OC2H5
CH30 ~ ~ N ~ O O
Cristaux jaunes
Soluble dans les alcools à chaud, benzene, chlorure de
méthylène, chloroforme, éther.
Insoluble dans l'eau, acides et bases dilués
Point de fusion : 110C.
EXEMPLE 8
(Méthoxycarbonyl-l éthyl)-2 oxo-3 di(paramethoxyphényl)
5,6 as triazine
C 3 ~ CH3
~ N - CH - C - OCH
CH30 ~N ~ O O
Cristaux jaunes
Soluble dans les alcools à chaud
Insoluble : eau, éther
Point de fusion : 137C.
EXEMPLE 9
(Ethoxycarbonyl-l éthyl-1)-2 oxo-3 di~phényl~ 5,6 as
triazine
-- 8 --
\~` ~ N f H3 O
N- CH - C - O - Et
N ~ O
EXEMPLE 10
(Ethoxycarbonyl-l éthyl-1)-2 oxo-3 di(p-méthylph~nyl)
5,6 as triazine
C 3 ~ fH3 0
~ N -CH - C - O - Et
CH3 ~ ~ ~
EXEMPLE ll
(Ethoxycarbonyl-l éthyl-1)-2 oxo-3 di(p chloroph~nyl)
5,6 as triazine
Cl ~ ~N~N IH - 11 - OEt
Cl ~ N ~ O
EXEMPLE 12
(Ethoxycarbonyl-l éthyl-1)-2 oxo-3 (p-chloro p-méthoxy)
5,6 as triazine
-
N~ f ll
~ N - OEI - C - OEt
Cl ~ ~ ~ O
~6~3~L
g
EXPERIMENTATIONS PHARMAC LOGIQUES
A) Toxicologie
L'etude de toxicite a ete effectuee chez la
souris conventionnelle pesant environ 20 grammes. Les
substances ont ete administrees par voie orale et les
doses letales 50 exprimees en mg/kg et calculées selon
la methode de MILLER et TAINTER - Proc. Soc. Exper. Biol.
Med. 1944, 57, 261.
Resultats: Tous les produits testes et decrits dans les
exemples ci-dessus ont une DL50 superieure à 1000 mg/kg.
B) Proprietes antalgiques
L'activite sur le test des contorsions à la
phenyl benzoquinone (PBQ) selon SIEGMUNG et coll.,
J. Pharm. Exptl. Ther. 1957, 119, 453, a été déterminée
par administration du produit per os. La dose exprimee
en mg/kg chez la souris, 30 mn avant l'injection intra-
peritonéale de l'agent algogène. Les résultats sont
exprimés en pourcentage de variation du nombre de con-
torsions.
-- 10 --
Pour les molécules les plus actives, le pour-
centage d'inhibition a été déterminé et apparait a la
Table I.
TABLE I
ACTIVITE
COMPOSES 100 mg/kg
Exemple 3 - 8%
Exemple 1 - 45%
Exemple 7 - 75%
Exemple 6 - 83%
Aspirine~ - 50%
APPLICATIONS THERAPEUTIQUES
Compte tenu de leur parfaite tol~rance et de
leurs propriétés pharmacologiques, les produits et plus
particulierement ceux décrits aux Exemples 4, 6 et 7
peuvent être utilisés dans le traitement des algies
d'origines diverses (dentaire, musculaire, rhumatis-
male). Les préparations pharmaceutiques contenant les
principes actifs peuvent être administrees par voie
orale, parent~rale ou rectale. Ces compositions pharma-
ceuti~ues peuvent également contenir, en association,
d'autres principes actifs pharmaceutiquement et théra-
peutiquement acceptables. La dose par unité de prise
sera par exemple comprise entre environ 10 et environ
100 mg.
., .