Note: Descriptions are shown in the official language in which they were submitted.
F ~,1f,
' jl i3(~4943
Mai 87 - 1 -
PROCEDE POUR LA PRODUCTION DE METAU~
P~R ~EDU~TION DE SELS METALLIQUES
La présente invention concerne la préparation de
métaux par réduction de leurs sels, suivant un procédé qui
fait intervenir une réaction d'échange chimique avec un
métal réducteur pour le métal réductible à produire, dans un
milieu réactionnel assurant le contact entre les métaux et
les sels correspondants. Elle permet d'obtenir des métaux
réduits à l'état liquide ou solide, aisément séparables du
milieu réactionnel, mais son intéret industriel est surtout
sensible pour la production de métaux réfractaires en
poudre.
10Le titane est un exemple d'un tel métal réfrac-
taire.
Actuellement, les procédés les plus couramment
utilisés pour fabriquer le titane sont le procédé Kroll, et
le procédé Hunter, qui consistent à utiliser à titre d'agent
réducteur du magnésium ou du sodium respectivement, que l'on
fait agir à haute température et en atmosphère neutre, sur
des vapeurs de chlorure de titane.
Ces procédés conduisent à du titane sous une forme
poreuse, que l'on qualifie fréquemment pour cette raison
d'éponge. Or ces éponges ne sont généralement pas
utilisables sous cette forme directement. Elles nécessitent
des traitements de purification ultérieurs qui sont très
énergivores. Et si elles sont transformées en lingots, on
doit déplorer, lors de l'usinage des lingots, les pertes de
matière importantes, qui peuvent varier de 30 % à 90 % du
poids suivant la forme des produits visés.
Toutefois, le brevet US 2 839 385 a propose de
réaliser la réduction du titane par le magnésium dans un
bain de chlorure de magnésium. Mais la réaction s'effectue
dans ce cas à partir du dichlorure TiCl2, qu'il est
nécessaire de préparer au préalable par réduction du
t , ~l 1304943
Mai 87
tétrachlorure par le titane métal. Le contrôle de la
production intermédiaire du dichlorure rend ce procédé mal
commode et peu apte à une mise en oeuvre à l'échelle
industrielle.
La présente invention apporte une solution à ces
difficultés, grâce à un procédé permettant de fabriquer de
la poudre de titane qui est utilisable directement par les
techniques de la métallurgie des poudres. Son intérêt,
particulièrement évident pour le titane, existe également à
l'égard d'autres métaux, à l'égard notamment du tantale, qui
est utilisé en poudre pour la fabrication de condensateurs,
et à l'égard du niobium. De plus, le même procédé peut
également se révéler fort utile pour produire d'autres
métaux obtenus à l'état liquide, tels que le magnésium.
L'invention propose un procédé de production d'un
métal par réduction d'un sel de ce métal, caractérisé en ce
que l'on réalise un échange entre un métal réducteur et un
métal réductible au sein d'un bain d'halogénures métalliques
fondus, dans des conditions où le métal réductible à l'état
de métal réduit est non miscible dans ce bain en présence du
métal réducteur, celui-ci étant préalablement dissous dans
ledit bain.
Il doit être entendu que chacun des métaux inter-
venant dans la réaction peut être aussi bien un métal pur
qu'un mélange de métaux ou un alliage, de même que les sels
métalliques correspondants peuvent être des mélanges de
sels. On peut en particulier trouver intérêt à opérer la
réaction sur des mélanges de sels fondus formant entre eux
des eutectiques fondant à une température plus faible que
les sels individuels, ceci soit pour le métal réductible,
soit de préférence pour le métal réducteur, soit encore pour
chacun d'eux. De ce fait, tous les sels intervenant dans le
procédé sont généralement des halogénures.
Dans la mise en oeuvre du procédé, il est avanta-
geux de choisir comme métal réducteur le calciu~ et dans unepremière étape, de dissoudre intégralement ce calcium dans
F-~,61~ ~304943
,~ j1
Mai 87
le bain de sels fondus constituant le milieu réactionnel.
Cette condition permet en seconde étape de partir de
produits à réduire très divers, à l'état de solides finement
divisés, de liquides ou de gaz, qui alors ne seront pas
nécessairement dissous mais seulement dispersés dans le
bain. Toutefois, des conditions préférentielles pour la mise
en oeuvre du procédé impliquent la mise en solution du métal
réducteur, généralement grâce à sa transformation en un
composé soluble dans le bain, tandis que le métal à produire
est initialement sous forme d'un composé également soluble
et qu'il est obtenu à l'état de métal réduit non soluble, et
plus particulièrement de poudre solide.
Selon une caractéristique secondaire du procédé
objet de l'invention, le métal réducteur est produit dans le
même bain à partir de son sel et d'un composé métallique
plus réducteur que lui, constitué par du chlorure de calcium
C2Ca. Cette étape de réduction préalable produit le métal
réducteur in situ dans le bain, ce qui est apparu hautement
favorable à l'obtention d'une poudre finale de bonne
qualité. Le carbone est facile à recueillir à l'état solide
et à séparer du bain, avant l'introduction du métal à
réduire, généralement sous forme d'halogénure.
Cette procédure procédure permet de régénérer le
bain réactionnel en produisant le métal réducteur in situ.
Elle est alors applicable non seulement au calcium ou au
sodium, mais surtout au magnésium. Elle permet de rendre le
magnésium efficace dans le procédé de l'invention, malgré sa
faible solubilité.
La température du bain est naturellement-choisie à
une température égale ou supérieure à la température de
fusion de ses constituants essentiels, et ~pécialement
notamment à celle du chlorure de calcium ou de ses
eutectiques qui peuvent ainsi constituer ledit sel fondu
dissolvant le calcium réducteur. Par exemple, dans un
réacteur vertical, le calcium peut être introduit à la
partie supérieure du réacteur, à l'état d'un solide finement
E 6616
. .'jl 1304943
Mai 87
divisé, par exemp1e de granulométrie de l'ordre de 0,5 à 2
millimètres. ~appelons qulil peut également être produit in
situ dans le bain à partir de carbure de calcium, notamment
par ~change avec du magnésium présent à l'état de chlorure
dissous dans le bain. Dans le cas où le métal réduit est
obtenu à l'état solide, la température du bain agit
généralement sur la granulométrie du métal qui se forme, une
temperature plus élevée conduisant à des particules
métalliques plus grosses et réciproquement.
Quant à l'halogénure du métal à réduire, il peut
être introduit dans le réacteur, par exemple en partie basse
d'un réacteur vertical, à l'état d'un halogénure en phase
liquide ou en phase gazeuse. S'il est en phase liquide, la
température du bain de sel fondu, qui est généralement
élevée (supérieure à 500 ~C dans la plupart des cas), peut
provoquer une vaporisation de l'halogénure qui peut suffire
à entrainer sa dispersion, et éventuellement sa dissolution
dans le bain. Il est également possible, pour retrouver des
conditions analogues, de procéder directement à une
injection d'halogénure dans le sel fondu sous forme gazeuse.
Les injections de l'halogénure de métal à réduire
d'une part~ et du métal réducteur d'autre part, peuvent être
effectuées simultanément si toutefois la distance des points
d'injection est telle que l'halogénure à réduire d'une part,
et le métal réducteur d'autre part, soient dissous dans le
sel avant qu'ils ne puissent réagir l'un sur l'autre.
Le métal réduit à produire peut être choisi
notamment parmi ceux du groupe constitué par : Al, Si, Cr,
Co, Fe, Ni, Ti, Zr, V, Nb, Ta, Mo et W.
3~ Pour des raisons qui seront expliquées dans la
suite de la présente description, l'invention, sans y être
limitée, est plus particulièrement appropriée pour les
métaux dits réfractaires, c'est-à-dire ceux qui ont des
points de fusion extrêmement élevés et qui sont obtenus à
l'état de solides pulvérulents. Parmi ces métaux, on citera
notamment le titane, le niobium et le tantale.
F 6616 1~04943
Mai 87
Daris le cas le plus fréquent, l'halogénure de ces
métaux qui est utilisé dans le cadre du procédé selon
l'invention est un chlorure.
A titre de métal réducteur, on peut utiliser non
seulement le calcium, mais aussi notamment le lithium (Li),
le sodium (Na), le potassium (K), le bérylium (Be) ou le
strontium (Sr), ou dans certains cas le mélange Mg/Ca, qui a
permis d'obtenir des résultats particulièrement intéressants
dans le cas de la production de titane. Dans ce cas, le bain
de sel fondu est constitué avantageusement par un mélange
MgC12/CaC12 -
Parmi les eutectiques utilisables pour constituer
le milieu réactionnel, on peut donc citer les mélanges
MgCl2/CaCl2, mais aussi les mélanges MgCl2/NaCl et
CaCl2/NaCl qui, dans les proportions appropriées, forment
des eutectiques à point de fusion relativement bas.
Un autre avantage de l'invention réside dans la
possibilité de former des alliages dans le cadre de la
production du métal réduit. Pour ce faire, il suffit d'in-
jecter non pas un halogénure métallique Mehn, mais unmélange de plusieurs halogénures de différents métaux. En
choisissant de façon appropriée les halogénures, plus
particulièrement les chlorures des métaux en cause, et en
les introduisant dans des proportions choisies, on peut
aboutir à des alliages dont la constitution reflètera les
proportions des métaux introduits. Lorsque la production
directe des alliages en poudre n'apparalt pas possible, on
peut cependant réaliser l'alliage ultérieurement, par
frittage à partir du mélange métallique par les techniques
classiques de la métallurgie des poudres.
Aux fins d'illustration, l'invention sera mainte-
nant décrite en référence au dessin annexé qui représente un
mode de réalisation d'un dispositif pour la mise en oeuvre
du procédé selon l'invention.
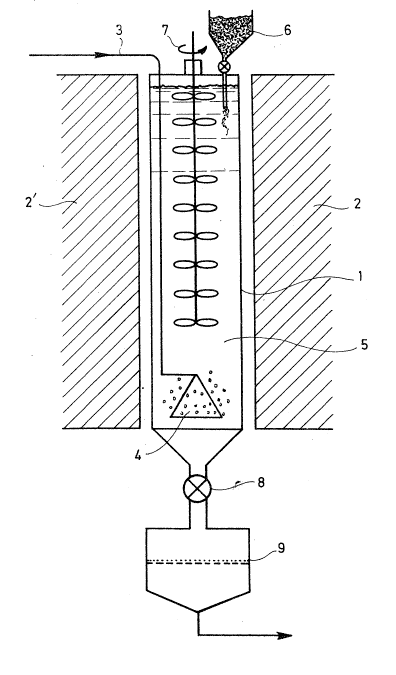
Ce dispositif comprend un réacteur 1 dont la
~ 6616 1304~43
~i~i 87 - 6 -
hauteur es~ grande par rapport à la largeur pour les raisons
qui seront expliquées ci-après. Des moyens de chauffage
2,2', de type connu en soi, sont disposés autour du réacteur
1, afin de per~ettre à celui-ci d'atteindre et de se
maintenir à la température requise.
L'halogénure du métal à produire, qui peut par
exemple etre du TiCl4, est introduit par un tube 3 qui
débouche à la partie inférieure du réacteur 1, dans un
diffuseur 4 qui permet d'assurer la dispersion de
l'halogénure métallique au sein du liquide contenu dans le
réacteur 1~
Ce liquide 5 est constitué par un mélange d'halo-
génures métalliques en fusion, dans lequel se produit
l'échange d'oxydo-réduction entre le métal à réduire et le
métal réducteur.
Le métal réducteur, supposé constitué de calcium à
l'état solide, est introduit en 6 dans le réacteur 1, à la
partie la plus éloignée par rapport au diffuseur 4. Dans le
cas de la figure, le diffuseur 4 se situe au fond du
réacteur, la trémie d'alimentation en métal réducteur 6
étant à la partie supérieure dudit réacteur.
Le processus conduit dans le bain fondu 5 implique
la dissolution du métal réducteur dans son halogénure dans
ce bain d'une part, la dispersion ou la dissolution de
l'halogénure à réduire d'autre part.
Afin d'assurer cette dispersion dans le milieu
réactionnel, des moyens d'agitation 7 sont prévus dans le
réacteur 1.
Dans la partie supérieure du réacteur 1, le métal
ou les métaux introduits en 6 sont tout d'abord entraînés
mécaniquement, puis dissous ; ils migrent par diffusion ou
par convection au sein du milieu réactionnel. Dans la
solution homogène de calcium en sel fondu obtenue, on opère
ensuite la réduction des halogénures introduits en fond du
réacteur. La réaction donne naissance, par exemple dans le
E 66l6
Mai ~
cas du titane, à une poudre qui décante facilement.
Pour récupérer cette poudre, on peut procéder de
diverses manières après avoir vidé le reacteur 1 par une
vanne thermique 8, équipée de moyens de chauffage permettant
de liquéfier les sels métalliques solidifiés. On peut
notamment envoyer la partie de bain concernée sur un filtre
9 où l'on recueille un "gâteau" que l'on peut reprendre
après broyage à l'alcool, à l'eau, ou encore à l'eau
acidulée pour en extraire le métal pulvérulent. Il est
également possible de séparer le métal de son sel par
distillation de ce dernier.
Dans l'état physique dans lequel il se trouve, le
métal peut être aisément travaillé par des moyens connus en
soi compte tenu de son degré de pureté élevé. Il peut
notamment être utilisé dans la métallurgie des poudres, par
des techniques aisément mises en oeuvre, par opposition aux
éponges difficiles à broyer qui étaient obtenues par les
techniques antérieurement appliquées aux métaux, tels que le
titane.
Afin de régénérer le bain de sel, on peut mettre
celui-ci en contact avec un composé plus réducteur, par
exemple du carbure de calcium. En supposant que la
regénération s'effectue dans un réacteur séparé plutôt que
directement dans le bain d'halogénures, on peut prévoir que
le sel résiduel contenant le carbone et les impuretés du
carbure soit retraité par insufflation d'air pour le
purifier et générer de la chaleur.
Les exemples ci-après sont donnés à titre de
complément d'illustration du procédé selon l'invention.
3~ Exemple 1
Dans cet exemple 9 l'halogénure de métal à réduire
était le tétrachlorure de titane TiC14, et le métal
reducteur était le calcium.
Le réacteur utilisé était de forme cylindrique et
avait un diarnètre de 8 cm. On a versé dans ce réacteur, 3 kg
E 66 G 1304943
7 - 8 -
de CaCl2, le bain de sel fondu ayant une hauteur de l'ordre
de 30 cm environ. On a opéré à la température du chlorure de
calcium fondu, à savoir 830~C.
On a d'abord envoyé du calcium au sommet du
réacteur après mise en route de l'agitation du bain. Le
calcium était injecté sous forme de billes dont le diamètre
moyen était de l'ordre de 1 mm. Elles se sont facilement
dissoutes dans le bain de CaCl2 fondu.
On a ensuite envoyé du tétrachlorure de titane à
l'état liquide à l'aide d'un injecteur au fond d'un réacteur
tubulaire qui était placé verticalement. Le tétrachlorure de
titane s'est volatilisé et les bulles de gaz s'échappaient à
la base de l'injecteur où elles étaient finement dispersées
par agitation.
Afin d'éviter la corrosion des parois du réacteur,
on a prévu un léger excédent de calcium par rapport aux
proportions stoechiométriques correspondant à la réaction de
réduction du TiC14 par Ca.
Après la réaction on a laissé l'agitation se
poursuivre pendant environ 15 minutes, puis on l'a arrêtée
de manière à laisser décanter la poudre de titane. Cette
décantation a duré environ 10 minutes.
On a alors soutiré la moitié inférieure du bain par
l'intermédiaire d'une vanne thermique et cette moitié a été
envoyée sur un filtre de type connu en soi.
On a analysé, du point de vue chimique, la poudre
de titane ainsi obtenue ; cette analyse a donné les
résultats suivants, dans lesquels les pourcentages, comme
d'ailleurs dans tout le présent texte, sont indiqués en
poids.
Ti : 99,80 %
O : 0,05 % (500 ppm)
Fe : 0,05 % (500 ppm)
Ni : 0,004 % (40 ppm)
Cr : 0,007 % (70 ppm)
E 5616 13049~3
,' j l
Mai 87
N : 0,005 % (50 ppm)
H : 0,015 % (150 ppm)
S : 0,025 ~ (250 ppm)
La granulométrie de la poudre de titane était
5 comprise entre 1 et 10 microns.
Pour une quantité de 1,o8 kg de Ca injectée et 2,55
kg de TiC14, on a récupéré entre 600 et 640 g de poudre de
titane, ce qui correspondait à un rendement compris entre
92,5 % et 99 %.
Exemple 2
Afin d'abaisser la température du milieu réac-
tionnel, et par voie de conséquence la consommation énergé-
tique, on a opéré dans un melange eutectique CaCl2~NaCl dont
le point de fusion est de l'ordre de 500~C, pour une
composition pondérale correspondant à environ 34,5 % en
poids de NaCl.
Afin de maintenir la composition eutectique, on a
prévu l'addition simultanée de chlorure de sodium pulvé-
rulent, en même temps que de calcium, à raison de 146,3 g de
NaCl pour 100 g de Ca.
Les autres conditions opératoires étaient identi-
ques à celles de l'exemple 1.
Dans le réacteur contenant au départ 3 kg de
mélange eutectique CaCl2/NaCl, on a ajouté 0,5 kg de Ca,
0,73 kg de NaC1, puis 1,18 kg de TiCl4 à une température
égale approximativement à 580~C.
Après décantation et filtration, on a récupéré 292
g de titane en poudre, d'une granulométrie comprise entre
0,3 et 5 microns, ce qui correspondait à un rendement de
l'ordre de 97 % en poids.
La pureté de la poudre de titane, après analyse,
était de l'ordre de 99,85 %.
Les teneurs des impuretés décelées étaient
sensiblement plus basses que dans l'exemple précédent, à
~ 6616 130~9~3
jl
.ai 87
-- 10 _
savoir :
Fe 300 ppm
0 250 ppm
H 100 ppm
Exemple 3
De la même façon que pour le titane, on peut
produire du tantale à partir du pentachlorure TaCl5 qui ~ond
à 220 ~C et bout à 234 ~C.
Dans 2 kg d'un bain de sel constitué par
l'eutectique CaCl2/NaCl contenant environ 34,5 % en poids de
NaCl, on a injecté du calcium métallique en billes de 0,5 à
1 mm de diamètre en même temps que du chlorure de sodium en
haut du réacteur. Puis on a introduit la vapeur de TaCl5 à
la base du réacteur, le pentachlorure de tantal étant porté
préalablement à l'ébullition dans une cellule séparée.
On a injecté 1692 g de TaCl5, 472 g de Ca et 690 g
de NaCl.
Le niveau du bain a pratiquement doublé dans la
cellule et après filtration du bain de sels fondus et lavage
à l'eau et à l'alcool, on a recueilli 830 g de poudre ayant
une granulométrie comprise entre 0,5 et 3 microns.
La température de travail était de 600 ~C. Le
rendement mesuré était de 97 %.
Exemple 4
Pour obtenir des particules de tantale plus
volumineuses que dans l'exemple précédent, on a opéré à plus
haute température (850 ~C) dans 2 kg de bain con~titué par
CaCl2 pur. On a ajouté 505 g de calcium et 1800 g de TaCl5.
On a recueilli 898 g de tantale en poudre ayant une
granulométrie comprise entre 5 et 10 microns.
Le rendement était pratiquement égal à l'unité
(environ 99 %).
Exemple 5
On a procédé comme dans l'exemple 4 mais avec
F 6~16
Mal 87 13049~3
NbCl5, préchauffé à 370 ~C dans une cellule annexe pour
l'injecter so~s forme de vapeur.
On a injecté 400 g de Ca et 1080 g de NbCl5.
On a obtenu 370 g de poudre de niobium d'une granu-
lométrie de 1 à 6 microns, soit un rendement pratiquementunitaire.
Exemple 6
On a produit de la poudre de zirconium en se
plaçant dans des conditions identiques à celles prévalant
pour la production de titane, à savoir :
- bain de sel constitué par CaCl2 pur (3 kg) à
850 ~C
- ZrCl4 porté au-dessus de son point de sublimation
dans une cellule annexe (350 ~C).
L'injection de 400 g de Ca et 1166 g de ZrCl4 a
permis de récupérer 446 g de poudre de zirconium de granulo-
métrie comprise entre 0,3 et 10 microns, soit un rendement
de 98 %.
Exemple 7
Le procédé utilisé pour la préparation de titane en
poudre conformément aux exemples 1 et 2, a été appliqué dans
des conditions analogues à la production de magnésium métal
par réduction du chlorure MgCl2.
Dans ce cas, le métal produit est liquide à la
température du bain de sels fondus, mais alors que les
chlorures et le métal réducteur ~Ca ou Ca et Na) se dissol-
vent dans ce bain aux concentrations utilisées, le magnésium
liquide est peu soluble dans le bain. Il se décante à la
surface supérieure, où il est facile à recueillir à l'état
pratiquement pur.
Exemple 8
Le bain de sel étant constitué à base de chlorure
de calcium CaCl2, on y a ajouté du chlorure de magnésium
13049~3
Mai 87 - 12 -
MgCl2, puis du carbure de calcium C2Ca en petits morceaux.
Dans ce cas, on utilise peu le chlorure de sodium, le
carbure de calcium étant déjà peu soluble dans le chlorure
de magnésium.
La réaction est effectuée à 800 ~C. On obtient
alors le magnésium à l'état liquide, du carbone à l'état
solide et du sel de base (CaCl2). La séparation du carbone
permet d1obtenir un bain réducteur à base de magnésium
produit in situ dans le bain de sels fondus.
Du tétrachlorure de titane était ajouté dans un
réacteur contenant un tel bain de chlorure de calcium,
additionné de magnésium. La réaction était alors effectuée
conformément à la procédure de l'exemple 1.
Cette réaction conduit à la formation de titane
métal et de chlorure de magnésium. Le titane était alors
séparé du mélange de sel Cl2Mg/Cl2Ca.
Ce mélange de sels métalliques était régénéré par
réduction par du carbure de calcium selon la procédure ci-
dessus et séparation du carbone par filtration ou brûlage,
pour être ensuite réutilisé dans le réacteur précédent,
assurant la réduction du titane par le magnésium.
La même procédure de régénération du bain par le
carbure de calcium peut être appliquée quand le métal
réducteur est le calcium.
Il va de soi que l'invention ne saurait être
limitée aux modes spécifiques de mise en oeuvre qui ont été
décrits dans les exemples précédents. En effet, l'homme de
l'art pourra dans chaque cas adapter les conditions
opératoires au problème particulier qui lui est soumis.