Note: Descriptions are shown in the official language in which they were submitted.
~3~5~7~
L.a présente invention a pour objet de nouvelles
compositions pharmaceuti.ques contenant des composés aromati-
ques bicycliques,e-t leur utilisation en médecine humaine et
vétérinaire.
Les compositions selon l'invention, de par leur
activité inhibitrice de la synthèse des lipides, sont d'un
grand intérêt pour le traitement du cuir chevelu et de la
peau présentant un aspect gras.
Ces compositions présenten-t en outre une activité
dans le traitement topique et systémique d'affections derma-
tologiques à composante inflammatoire.
Les compositions selon l'invention consistent en
l'association d'un excipient pharmaceutiquement acceptable
avec au moins un principe actif choisi dans le groupe
constitué par les composés aromatiques bicycliques répondant
à la formule générale (I)
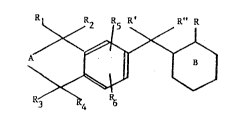
R R~ R~ R' R" R
3 4
dans laquelle:
Rl, R2, R3 et R4 représentent, indépendamment l'un de
l'autre, un atome d'hydrogène ou un radical alkyle
inférieur, au moins deux des radicaux Rl à R4 étant
différents d'un atome d'hydrogène,
A représente un radical méthylène ou diméthylène substitué
ou non par un radical alkyle inférieur, et lorsque A
représente un radical diméthylène, Rl et R3 peuvent former
9~
131~7~
ensemble un rad:ical méthyLène ou diméthy].ène,
R5 et ~6 représentent un atome d'hydroyène, un atome
d'halogene, un radical alkyle inferieu.r, un radical alkoxy
inférieur ou un radical. hydroxyle,
R' représente un atome d'hydrogène, un radical hydroxyle, un
radical alkoxy inférieur, un radical acyloxy en Cl-C4 ou un
radical amino,
R" représente un atome d'hydrogène ou un radical alkoxy
inEérieur,
ou R' et R" pris ensembl.e forment un radical oxo (=0),
méthano (=CH2) ou hydroxyimino (=N-OH),
B représente un noyau cyclohexyle, cyclohexényle, cyclo-
hexadiényle ou phényle non-substitué ou subs-titué,
R représente -CH2OH ou le radical -COR7, / r'
R7 étant un atome d'hydrogène, le radical -OR~ ou -N \ r",
R~ représentan-t un atome d'hydrogène, un radical alkyle
ayant de 1 à 20 atomes de carbone, un radical monohydroxy-
alkyle, polyhydroxyalkyle, aryle ou aralkyle non-
substitué(s) ou substitué(s) ou un reste de sucre,
r' et r" représentant un atome d'hydrogène, un radical
alkyle inférieur, un radical monohydroxyalkyle non-
interrompu ou interrompu par un hé-téroatome, un radical
polyhydroxyal]cyle, un radical aryle ou benzyle non-
substitué(s) ou substi-tué(s), un reste cl'amilloacide ou de sucre am:Lné
ou pris ensernble Eormen-t un hé-térocyc:le non-subst:i.tué ou substitué,
et les sels pharmaceutiquement acceptables desd:its composés
de formule (I) et leurs isomères optiques ainsi que les
formes tautomères des composés de formule (I), à l'exclusi.on
de l'acide ~(méthano-5,8 tétrahydro-5,6,7,8 naphtyl-2)carbo-
nyl~-2 benzoique.
Par radical alkyle inférieur, on doit notamment
entendre un radical ayan-t de 1 à 6 atomes de carbone.
Par radical alkyle inférieur ou ayant jusqu'à 20
131~7~
atornes de carbone, on peut entendre notamment les radicaux
rnéthyle, éthyle, propyle, isopropyle, butyle, tertiobutyle,
éthyl-2 hexyle, octyle, dodécyle, hexadécyle et octadecyle.
Par radical monohydroxyalkyle, on peut entendre un
S radical ayant de 2 à 6 atomes de carbone, notamment un
radical hydroxy-2 éthyle, hydroxy-2 propyle ou hydroxy-2
éthoxyéthyle.
Par radical polyhydroxyalkyle, on peut entendre un
radical contenant de 3 à 6 atomes de carbone et de 2 à 5
groupes hydroxyles tels que les radicaux dihydroxy-2,3
propyle, dihydroxy-1,3 propyl-2 ou le reste du
pentaérythritol.
Parmi les radicaux alkoxy inférieurs, on peut
notamment citer les radicaux méthoxy, isopropoxy, butoxy, et
tert-butoxy.
Par reste d'un sucre, on peut entendre un reste
dérivant par exemple du glucose, du mannose, de l'érythrose
ou du galactose.
Parmi les restes de sucres aminés, on peut citer
ceux dérivant de glucosamine, de galactosamine, de
mannosamine ou de la méglumine.
- Lorsque le radical B est un noyau phényle
substitué, les substituants peuvent être un alkyle
inférieur, un halogène ou un alkoxy, en position 3,4,5 ou 6.
Lorsque les radicaux r' et r" pris ensemble
forment, avec l'atome d'azote auquel ils sont reliés, un
hétérocycle, celui-ci est de préférence un radical
pipéridino, pipérazino, morpholino, pyrrolidino ou (hydroxy-
2 ethyl)-4 pipérazino.
Quand les composés de formule (I) se présenten-t
sous forme de sels, il peut s'agir soit de sels de zinc,
d'un métal alcalin ou alcalino-terreux ou d'une amine orga-
nique lorsqu'ils comportent au moins une fonction acide
libre, soit de sels d'un acide minéral ou organique,
13~7~
- 4 -
notamment de cl~lorhydrate, de bromhydrate ou de citrate
l.orsqu'ils comportent au moins une fonction ami.ne.
I.es composés de formule (I) des compositions selon
l'invention, peuvent se présenter sous forme tautomère
lorsque R' et R" pris ensemble forment un radical oxo et que
R représente une fonction acide carboxylique ou une fonction
amide.
Ainsi, les composés de formule (II) ci-dessous
peuvent se présenter sous forme cyclique lactone (III).
A
De même, les composés de formule (IV) peuvent se
présenter sous forme tautomère lactame de formule (V).
~R
R3 R4 (IV) R3 R4 ~V)
1 3 ~
- 4a -
Les compositions seloll 1.'invention peuver-t
renferme~ à titre de principe actif préférentiels, au moins
un des composés aromatiques bicycliques répondant à la
formule générale (I):
~ (I)
R3 4
dans laquelle:
Rl, R2, R3 et R4 représentent, indépendamment l'un de
l'autre, un atome d'hydrogène ou un radical alkyle
renfermant de 1 à 6 atomes de carbone, au moins deux des
radicaux Rl à R4 étant différents d'un atome d'hydrogène,
A représente un radical méthylène ou diméthylène non-
substitue ou substitué par un radical alkyle inférieur, et
lorsque A représente un radical diméthylène, Rl et R3
peuvent former ensemble un radical méthylène ou diméthylène,
R5 et R6 représentent un atome d'hydrogène, un atome
d'halogène, un radical alkyle renfermant de 1 a 6 atomes de
carbone, un radical alkoxy choisi dans le groupe constitué
par les radicaux méthoxy, isopropoxy, butoxy et tert-butoxy,
ou un radical hydroxyLe,
R' représente un atome d'hydrogène, un radical hydroxyle, un
radical alkoxy choisi dans le groupe constitué par les
radicaux méthoxy, isopropoxy, butoxy et tert-butoxy, un
radical acyloxy renfermant de 1 à 4 atomes de carbone ou un
radical amino,
R" représente un atome d'hydrogène ou R' et R" pris ensemble
131~674
-- 4b -
forment un raclical oxo (=O), méthanc) (=C1l2) ou hydroxyimino
( =N-OII ),
B représente un noyau cyclohexyLe, cyclohexényle,
cyclohexadiényle ou un noyau phényle non-subs-titué ou
substi-tué par un radical alkyle renfermant de 1 à 6 atomes
de carbone, un radi.cal alkoxy renfermant de l à 6 atomes de
carbone ou un atome d'halogène, en position 3,4,5 ou 6,
R représente le radical -CH2OH ou le radical de formule:
~ COR7
. R7 représentant un atome d'hydrogène, ou
. R7 représentant un radical de formule -OR8 dans
laquelle R8 représente un atome d'hydrogène, un
radical alkyle renfermant de 1 à 20 atomes de
carbone, un radical hydroxy-2 éthyle, hydroxy-2
propyle, hydroxy-2 hydroxyéthyle, dihydroxy-2,3
propyle, dihydroxy-1,3 propyl-2, le reste de
pentaérythritol ou un reste d'un sucre choisi dans le
groupe constitué par le glucose, le mannose,
l'érythrose et le galactose, ou
. R7 représentant un radical de formule -N dans
laquelle r' et r" représentent soit un atome
d'hydrogène, un radical alkyle renfermant de l à 8
atomes de carbone, hydroxy-2 éthyle, hydroxy-2
propyle, hydroxy-2 hydroxyéthyle, dihydroxy-2,3
propyle, dihydroxy-1,3 propyl-2, phényle, benzyle ou
un reste d'un sucre aminé choisi dans le groupe
constitue par la glucosamine, la galactosamine, la
mannosamine et la méglumine, soit pris ensemble for-
ment, avec l'atome d'azote auquel ils sont reliés, un
hétérocycle choisi dans le groupe constitué par les
131~7~
- 4c -
radicaux p:Lperidillo, pipérazino, rnorpholino, pyrroli-
dino et (hydroxy-2 éthyl) 4 pipéra~ino,
et les seLs minéraux ou organiques pharmaceutiquement
acceptables desdits composés de formule (I) et leurs
isomères optiques ainsi que les formes tautomères des
composés de formule (I), à l'exclusion de l'acide ¦(méthano-
5,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 benzoique.
Les compositions particulièrement préférés selon
l'invention, renferment notamment à titre de principe actif,
au moins un des composés de formule (VI):
C ~ C~ COR7
~ ~ (VI)
C~ F3
dans laquelle:
R' et R" pris ensemble forment un radical oxo (=O) ou R'
représente un radical hydroxyle et R" un atome d'hydrogène,
A représente un radical -(CH2 ~ ou le radical -CH-
H3
8 est un noyau phényle ou cyclohexyle,R7 représente le radical OR8 ou le radical -N = r'~
R8 représentant un atome d'hydrogène ou un radical alkyle
ayant de 1 à 12 atomes de carbone,
r' représentant un atome d'hydrogène ou un radical mono-
hydroxyalkyle (notamment l'hydroxy-2 éthyl, l'hydroxy-2
propyle),
et r" représentant un radical alkyle ayant de 1 à 8 atomes
de carbone, un radical monohydroxyalkyle, éventuellement
interrompu par un hétéroatome (notamment l'hydroxy-2 éthyle,
~31~674
- 4d -
i'hydroxy-2 propyle et l'hydroxy--2 hydroxyéthyle), ou un
radical polyhydroxalkyle (notarm~ent le di.hydroxy-2,3 propyle, le
dihydroxy-l,3 propyl-2 et Ull reste du pentaérythritol) ou r'
et r", pris ensemble, forment avec l'atome d'azote un
radical (hydroxy-2 éthyl)-4 pipérazinyle et les sels
pharmaceutiquement acceptables desdits composés de formule
(VI).
De préférence, les compositions selon l'invention
ren~erme, à titre de principe actif, au moins un des
10 composés de formule (I) choisis dans le groupe constitué
par:
1) l'acide ~ttétraméthyl~5,5,8,8, tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 benzoique,
2) le N-éthyl [(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 benzamide,
3) le L(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-
2)carbonyll-2 benzoate de méthyle,
4) le ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-
2)carbonyl~-2 benzoate d'éthyl-2' hexyle,
5) le ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-
2)carbonyl~-2 benzoate de sodium,
6) le r(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-
2)carbonyl¦-2 benzoate de zinc,
7) le ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-
2)hydroxyméthyl~-2 benzaldéhyde,
8) le L(té-traméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-
2)hydroxyméthyl~-2 phényl carbinol,
9) l'acide C(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)hydroxyméthyl~-2 benzoique,
10) le N-(hydroxy-2 éthyl)-4' pipérazino ~(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2) carbonyl¦-2
benzamide,
-5- 13~67~
11) L'acide ~tétraméthyl-5,5,8,8 tétrahydro-S,6,7,8 naphtyl-2) éthoxy
méthyl~-2 benzo~que,
12) L'aclde ~(pentaméthyl-1,1,2,3,3 indanyl-S)hydroxyméthyl3-2 benzo~que,
13) L'acide ~(pentaméthyl-1,1,Z,3,3 inda1lyl-5)-2 éthényl-?~-2 benzoIque,
14) L'acide ~(pentaméthyl-1,1,2,3,3 indanyl-5) carbonyl]-2 benzoique,
15) Le N-éthyl ~(pentaméthyl-1,1,2,3,3 inda~yl-5) carbonyl~-2 benzamide,
16) Le Epentaméthyl-1,1,2,3,3 indanyl-5) carbonyl3-2 benzoate d'éthyle,
17) Le ~(pentaméthyl-1,1,2,3,3 indanyl-S) carbonyl~-2 benzoate d'éthyl-2'
hexyle,
18) Le EpentaméthyL-1,1,2,3,3 indanyl-5) carbony1 -2 benzoate de sodium,
19) Le N-(hydroxy-2 éthyl)-4' pipérazino [(pentaméthyl-1,1,2,3,3
indanyl-5) carbonyl]-2 benzamide,
20) L'acide L~ tétraméthyl-1~1~3 3 indanyl-5) hydroxyméthyl~-2 benzoIque,
21) L'acide ~(tétraméthyl-1,1,3,3 indanyl-5) carbonyl]-2 benzoIque,
22) Le N-éthyl Etétraméthyl-1,1,3,3 indanyl-5) carbonyl] ~2 benzamide,
23) Le N-(hydroxy-2 éthyl)-4' pipérazino [(tétraméthyl-1,1,3,3 indanyl 5)
carbonyl~-2 benzamide,
24) Le ~tétraméthyl-1,1,3,3 indanyl-5) carbonyl]-2 benzoate de zinc,
25) Le ~(méthano-5,8 tétrahydro-5,6,7,8 naphtyl-2) carbonyl~ -2 benzoate
d'éthyle,
26) Le N-éthyl ~(méthano-5.8 tétrahydro-5.6,7,8 naphtyl-2) carbonyl~ -2
benzamide,
27) L'acide [(méthano-5,8 tétrahydro-5,6,7,8 naphtyl-2) hydroxyméthyl~-2
benzoIque,
131~7~
--6--
28) L'acide ~(dlmethoxy-1,4 méthano-S,8 tétrahydro-5,6,7,8 naphtyl-2)
hydroxyméthy~ -2 benzoIque,
29) L'scide ~dlméthoxy-1.4 methano-5,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl]-2 benzoIque,
30) Le N-éthyl [(dlméthoxy-1,4 méthano-5,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl]-2 benzamide,
31~ Le N,N-di n-butyl [(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl3-2 ben~amide,
32) L'acide ~tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl]-2 cyclohexane carboxylique,
33) L'aclde L(pentaméthyl-1,1,2,3,3 indanyl-5) carbonyl~-2 cyclohexène-l
carboxylique-1,
34) Le N,N-di(hydroxy-2 éthyl) [(tétraméthyl-5,5,8,8 tétrahydro-5~6,7,8
naphtyl-2)carbonyl~-2 benzamide,
35) Le ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~ -2
cyclohexane carboxylate de sodium,
36) L'acide Epentaméthyl-1,1,2,3,3 indanyl-5) carbonylJ -2
cyclohexane carboxylique,
37) Le ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~ -2
cyclohexane carboxylate d'éthyle,
38) L'acide ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
hydroxyméthyl] -2 cyclohexane carboxylique,
39) Le ~tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
hydroxyméthyl] -2 cyclohexane carboxylate de sodium,
40) Le [(tétraméthyl-S,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl] -2
benzoate d'éthyle,
_7_ 131567~
41) L'acide [(tetraméthyl-5,5,8,8 tétrahydro-5,6,7,o naphtyl-Z)
méthyl~-2 benzo~que,
42) Le [(tetraméthyl-5,5,~,~ tétrahydro-5,6,7,8 naphtyl-2)carbonyl~ -2
benzoate de zinc, et
43) Le ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~ -2
cyclohexane carboxylate de zinc.
Les composés aromatiques bicycliques de formule (I)
peuvent être préparés selon le schéma réactionnel
suivant:
~ A`
~<~/ R b 6 (4)
X ~ Cl ou Br
Ces composés résultent dans un premier stade d'une condensation
dans les conditions de la réaction de Friedel-Crafts soit d'un halogénure
d'acide substitué (1), soit d'un anhydride de structure (2) sur un
composé aromatique bicyclique de formule (3).
De préférence, la réac~ion de condensation est effectuée à l'aide
d'un anhydride interne de struc~ure ~2) en présence d'un acide de Lewis
tel que le chlorure dlaluminium ou le chlorure d'étain dans un solvan~
chloré tel que le dichloro-1,2 éthane.
~31 ~67~
--8--
Parmi les composés aromatlques bicycliques de départ de formuLe
(3~, on peut citer le tétraméthyl-1,1,4,4 tétrahydro-1,2,3,4 naphtalène
(décrit dans J.A.C.S., 62, 36-44, (1'340)), le méthano-1,4 tétrahydro-
1,2,3,4 naphtalène ou benzonorbornène (décrit dans J.O.C., 32, 893-901,
(1967)), le dihydro~y-5,8 méthano-1.4 tétrahydro-1,2,3,4 naphtalène (pro-
duit commercial~, le tétraméthyl-1,1,3,3 indane et le pentaméthyl-1,1,2,3,3
indane (décrits dans le brevet fransais 1.392.804).
A partlr des composés de formule3 (4~ et (5), notamment à
partir des céto-acides de formule (5), on peut accéder, selon le schéma
réactlonnel suivant, aux autre~ formes des composés de formule (I):
` -9~ 131~74
Rl R2 R5 ICO2H Rl R2 R5 OH CO2H
><'~,'J ~ ~
10 A ~ ~ u X~ ~J
R3 R4 Æn/~iaOH R6
(5) (6)
lS Rl / f 2
- (5) Zn/1~3 ~ICI~
R3 4 (7)
(S) L~
~31~7~
-- 10 --
Ainsi, par réduction par le borohydrure de sodium,
dans un sol.vant tel que le tétrahydrofuranne ou bien par le
zinc en milieu alcalin, on peut accéder aux alcools
secondaires de formule (6).
Par réduction de Clemmensen à l'aide d'amalgame de
zinc en présence d'acide chlorhydrique, on peut accéder aux
composés de formule (7). ~
Par réduction par l'hydrure de lithium aluminium
dans le tétrahydrofurane, on peut accéder aux diols de
formule (8).
A partir de ces diols, on peut, par oxydation au
chlorochromate de pyridinium (P.C.C.), obtenir les céto-
aldéhydes de formule (9).
Les dérivés acyloxy des composés de formule (I),
(R' = acyloxy et R" = H) sont obtenus en faisant réagir une
forme activée d'acide, tel qu'un anhydride ou un chlorure
d'acide, sur un composé selon l'invention dans lequel R' =
OH et R" = H.
Les dérivés alkoxy des composés de formule (I),
(R' = alkoxy et R" = H) sont de même obtenus à partir des
composés de formule (I) (R' = OH et R" = H) selon les
méthodes connues.
Les composés de formule (I~ dans laquelle R' et R"
forment ensemble un radical méthano (CH2 =) sont obtenus par
action du bromure de méthyl triphényl phosphonium, en milieu
basique, sur les composés carbonylés de formule (I) dans
laquelle R' et R" pris ensemble forment un radical oxo.
Les composés de formule (I) dans laquelle R' et R"
forment ensemble un radical hydroxyimino sont obtenus par
réaction du chlorhydrate d'hydroxylamine sur les composés
carbonylés correspondants, dans un solvant organique tel que
l'éthanol, en présence d'une base minérale telle que le
bicarbonate de sodium ou d'une base organique telle que la
triéthylamine.
13~7~
- 11 -
Ces d~rives hydroxyimino conduisent, par reduction
au ZillC en milieu acétique, aux amines correspondantes (R' =
N1l2 et R~ = il)
Les compositions selon l'invention qui renferment,
à titre de principe actif, au moins un des composés de
formule (I) précédemment définis, présentent une excellente
activité dans le test décrit par J. GIRARD et A. BARBIER,
Int. Journal of Cosmetic Science 2, 315-329 (1980) et M.
GAUCI et J. OUSTRIN, Int. Journal of Cosmetic Science 3,
227-232 (1982). Ces auteurs ont en effet montré que le test
"in vitro" d'incorporation de glucose marqué pouvait etre
retenu comme test d'orientation pour les antiséborrhéiques
non hormonaux puisque ce test rend compte de l'activité
inhibitrice de la synthèse des lipides.
On sait par ailleurs qu'un accroissement de
sécrétion du sébum produit des états dermatologiques tels
que la séborrhée, les pellicules, la peau grasse, les
cheveux gras, les points blancs et les points noirs. Ces
phénomènes chroniques des unités pilo-sébacées concernent
surtout le visage, la poitrine et le dos.
En outre, les compositions pharmaceutiques
renfermant comme principe actif, au moins un des acides de
formule (I) dans laquelle (R =- CO2H), présentent une
activité bactéricide sur les germes de l'acné.
Ces compositions conviennent donc particulièrement
bien pour traiter les affections dermatologiques liées à un
désordre de production ou de sécrétion excessive de sébum
ainsi que pour les affections dermatologiques, ou autres à
composante inflammatoirej notamment les acnés vulgaire,
comédoniennes ou polymorphes, les acnés séniles, solaires et
les acnés médicamenteuses ou professionnelles.
Comme excipient (ou support) utilisable pour la
réalisation des compositions selon l'invention, on peut
utiliser tout excipient (ou support) conventionnel pharma-
~567~
ceutiq-lelllellt ace-eE)table, Le prirlclpe acti~- se trouvant soit
à L'etat dissous, soit à l'etat dispersé dans l'exc:ipient.
L'administratiorl de la composi-tion selon
l'invention peut être effectuée par voie entérale,
parentérale, topique ou oculaire. Par voie entérale, les
compositions médicamenteuses peuvent se présenter sous forme
de comprimés, de gélules, de dragées, de sirops, de
suspensions, de solutions, de poudres, de granulés,
d'émulsions. Par voie parentérale, les compositions peuvent
se présenter sous forme de solutions ou suspensions pour
perfusions ou pour injections.
I,es compositions selon llinvention sont
généralement telles qu'elles permettent d'administrer à un
sujet une dose journalière de composés de formule lI)
d'environ 0,1 mg/kg à 10 mg/kg de poids corporel.
Par voie topique, les compositions pharmaceutiques
à base des composés de formule (I) se présentent sous forme
d'onguents, de teintures, de crèmes, de pommades, de
poudres, de timbres, de tampons imbibés, de solutions,
d'émulsions, de lotions, de gels, de sprays ou encore de
suspensions.
Ces compositions par voie topique peuvent se
présenter soit sous forme anhydre, soit sous forme aqueuse
selon l'indication clinique.
Lorsque les compositions selon l'invention sont
formulées pour être utilisées par voie topique, on observe
une bonne activité; on peut utiliser, notamment, des concen-
trations en produit actif allant de 0,01 à 10% en poids. Il
est, bien entendu, possible d'utiliser des concentrations
supérieures lorsque ceci est rendu nécessaire pour une
application thérapeutique particulière; toutefois, les con-
centrations préférées en produit actif sont comprises entre
0,1 et 5% en poids.
Lescornpositions selon l'invention trouvent également
6 7 4
- 12a -
une applicat ion pour le traitemerl-t des pe~ux a tendance
acnéique, pour la xepousse des cheveux, l'an-ti-chute, ou le
traltement des effets néfas-tes du soleil.
I,a présente invention vise donc également une com-
position pharmaceutique contenant, dans un support pharma-
ceutiquement acceptable, au moins un composé de formule (I)
ou un de ses sels, se présentant notamment sous forme de
lotion, gel, savon ou ~hampooing. La concentration en
composés de formule (I), dans les compositions, est comprise
entre 0,005 et 5% en poids et de préférence entre 0,01 et 1%
en poids.
Les compositions médicamenteuses, selon l'inven-
tion, peuvent contenir des additifs inertes ou même pharma-
codynamiquement actifs et notamment : des agents hydratants
comme la thiamorpholinone et ses dérivés ou l'urée; des
agents antiséborrhéiques, tels que la S-carboxyméthyl-
cystéine, la S-benzylcystéamine et leurs dérivés, la
tioxolone; des agents anti-acnéiques comme le peroxyde de
benzoyle; des antibiotiques comme l'érythromycine et ses
esters, la néomycine, les tétracyclines ou les polyméthylè-
ne-4,5 isothiazolinones-3; des agents favorisant la repousse
des cheveux, comme le "Minoxidil" (diamino-2,4-pipéridino-6-
pyrimidine oxyde-3) et ses dérivés, le Diazoxide (chloro-7
méthyl-3 benzothiadiazine-1,2,4 dioxyde-1,1) et le Phénytoin
(diphényl-5,S imidazolinedione-2,4) ou encore l'iodure
d'oxapropanium; des agents anti-inflammatoires stéroidiens
et non stéroidiens; des carotèno;des et, notamment le B -
carotène; des agents anti-psoriasiques tels que l'anthraline
et ses dérivés et les acides eicosatétraynoique-5,8,11,14 et
triyno;que-5,8,11, leurs esters et amides.
Les compositions selon l'invention peuvent
également contenir des agents d'amélioration de la saveur,
des agents conservateurs, des agents stabilisants, des
agents régulateurs d'humidité, des agents régulateurs de pH,
131~67~
- 12b -
des agents modificateurs de pression osmotique, des agents
émulsionnants, des fi.ltres IJV-A et UV-~, des antioxydants
tels que l'o~-tocophérol, le butylhydroxy-anisole ou le
butylhydroxy-toluène.
S On va maintenant donner, à titre d'illustration et
sans aucun caractère limitatif, plusieurs exemples de
préparation des composés actifs de formule (I) ainsi que des
exemples de compositions pharmaceutiques selon l'invention
les contenant.
-13- 131~674
EXEMPLE I
Préparation de l'acide ~(tétraméthyl-5.5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 benzoIque
(formule I dans laquelle A 8 -(CH2 ~ , Rl= R2~R3=R4=CH3
S R5=R6=H ; R' ,R"=oxo; B=phényle ; R-CO2H)
A une suspensio~ de 9,41 g (O,OS molej de tétraméthyl-1,1,4,4
tétrahydro-1,2,3,4 naphtalène et de 7,46 g (O,OS mole) d'anhydride
phtalique dans 100 cm3 de dichloro-1,2 éthane anhydre, on a~oute par
portions, 13,3 g (0,1 mole) de chlorure d'aluminium anhydre de façon à
maintenir la température en dessous de 30C. Aprè~ lh d'agitation à tempéra-
ture ambiante, le milieu réactionnel est versé dans 100 cm3 d'eau glacée.
La phase organique est décantée. La phase aqueuse est à nouveau extraite
deux fois par 150 cm3 de dichloroéthane. Les phases de dichloroéthane
sont rassemblées, lavées à l'eau, séchées sur sulfate de sodium puis concen-
trées sous pression réduite. Le solide brut obtenu est repris par 250 mld'hexane bouillant, essoré après refroidissement à ~5C et recristallisé
dans 200 cm3 de toluène. Après séchage sous vide à 80C, on obtient
13,5 g de cristaux blancs d'acide~(tétraméthyl-5,S,8,8 tétrahydro-S,6,7,8
naphtyl-2)carbonyl~-2 benzoique dont le point de fusion est de 187C.
Les spectres RMN 1H 250 MHz et I.R. sont conformes à la structure atten-
due.
Analyse élémentaire : C22H2403
C H 0
calculé 78,54 7,l9 L4,27
trouvé 78,82 6,93 14,2S
~31~674
-L4-
_EMPLE II
Préparation de l'acide [(pencaméthyl-1,1,2,3,3 indanyl-5) carbonyl~ -2
benzoIque
(Formule I dans laquelle A - -CH-; R1=R2~R3=R4=CH3 ; R5sR6=~1 ;
S CH3
R',R"=oxo ; B = phényle ; R = C02H)
A une suspension de 13,2 g (0,07 mole) de pentaméthyl-1,1,2,3,3 indane et
de 10,37 g (0,07 mole) d'anhydride phtalique dans 150 cm3 de dichloro-1,2
éthane anhydre, on a~oute par portions 16g (0,12 mole) de chlorure d'alumi-
nium anhydre de ~açon à maintenir la température en dessous de 30C. Après
lh d'agitation à température ambiante, le milieu réactionel est versé dans
100 cm3 d'eau glacée. La phase organique est décantée. La phase aqueuse
est à nouveau extraite deux fols par 100 cm3 de dichloroéthane. Les pha-
ses de dichloroéthane sont rassemblées, lavées à l'eau, séchées sur sulfate
de sodium puis concentrées sous pression réduite. Le solide brut obtenu est
repris par de l'hexane, essoré, puls recristallisé dans l'acétate d'éthyle.
Après séchage, on obtient 15,5 g de crlstaux blancs d'acide ~(pentaméthyl-
1,1,2,3,3 indanyl-5) carbonyl~-2 benzo~que dont le point de fusion est de
205C.
Les spectres RMN H 80 MHz et l.R. correspondent à la structure attendue.
Analyse élémentaire : C22H2403
C H 0
calculé 78,547,19 14,27
trouvé 78,507,20 14,15
EXEMPLE III
Préparation de l'acide~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 cyclohexane carboxylique
(formule I dans laquelle A - -(CH2 ~ ; R~-R2=R3=R4 C 3
R5=R6=H ; R',R"-oxo ; B=cyclohexyle ; R=C02H))
A une suspension de 16,95 g (0,09 mole) de tétraméthyl-1,1,4,4 tétrahydro-
1,2,3,4 naphtalène et de 13,9 g (0,09 mole) d'anhydride cis hexahydro-
phtalique dans 150 cm3 de dichloro-1,2 éthane anhydre, on a~oute par
portions 20 g (0,15 mole) de chlorure d'aluminium anhydre de fa~on à mainte-
nir la température en dessous de 30C. Après lh d'agitation à températureambiante, le milieu réactionnel est versé dans 100 cm3 d'eau glacée. La
phase organique est décantée. La phase aqueuse est à nouveau extraite par
150 cm de dichloroé~hane. Leq phase~ de dichloroéthane sont rassemblées,
lavées à l'eau, séchées sur sulfate de sodium puis concentrées sou~ pres-
sion réduite. Le solide brut obtenu eit repris par de l'hexane tiède, esso-
-15- 1315~7a~
ré puii recristallisé dan~ l'acétate d'éthyle. Aprè3 secnage on obtient
20,7 g de cristaux blancs d'aclde L(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbony1~-2 cyc]ohexane carboxyl~que dont le point de fuslon est
de 173~C.
Les spectres RMN H 80 MHz et I.R. sont conorme~ à la structure attendue.
Analyse élémentaire : C221~3003
C H 0
calculé 77,158,83 14,02
trouvé 76,938,89 13,97
E~EMPLE IV
Préparation de l'acide [~pentaméthyl-1,1,2,3,3 indanyl-5) carbonylJ -2
cyclohexène-1 carboxylique-1
(formule I dans laquelle A -fH-; R1-R2-R3~R4SCH3 ; R5=R~=H;
CH3
R',R"-oxo ; B = cyclohexényle ; R - CO2H)
A une suspension de 5,88 g (0,031 mole) de pentaméthyl-1,1,2.3,3
indane et de 5 g (0,031 mole) d'anhydride tétrahydro-3,4,5,6 phtalique dans
60 cm de dichloro-1,2 éthane anhydre, on a~oute par portions 8,3 g (0,06
mole) de chlorure d'aluminium anhydre de façon à maintenir la température
en dessous de 30C. Après 2 h d'agitation, le milieu réactionnel est versé
dans 40 cm d'eau glacée. La phase organique est décantée. La phase
aqueuse est à nouveau extraite deux fois par 150 cm3 de dichloroéthane.
Les phases de dichloréthane sont rassemblées, lavées à l'eau, séchées sur
sulfate de sodium puis concentrées sous pression réduite. Le solide brut
obtenu est purifié par chromatographie sur gel de silice 60 éluée au
dichlorométhane puis cristallisé dans l'hexane. Après filtration et sé-
chage, on obtient 4,8 g de crlstaux blancs d'acide ~(pentaméthyl-1,1,2,3,3
indanyl-S) carbonyl~-2 cyclohexène-1 carboxylique-l dont le point de fusion
est de 153C.
Les spectres RMN H 250 MHz et C dans le deutérochloroforme ainsi que
les spectres I.R. (KBr et dlchlorométhane) correspondent à la forme
cyclisée lactol.
Analyse élémentalre : C22H2803
C H 0
calculé 77,61 8,29 14,10
trouvé 77,94 8,47 i3,S3
7 ~
-16--
EX~MPLE V
Préparation de l'Acide [(dlméthoxy-1,4 méthano-5,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 ben20~yl1e
(formule I dans laquelle A --(CH2 ~ ; R1 ~t R3 -C~2
S R2=R4=H ; R5=R6=-OCH3 ; R', R"=OXO ; B~phényle ; R~-C02H))
A une suspension de 2,25 g (11 mmoles) de diméthoxy-5,8 méthano-
1,4 tétrahydro-1,2,3,4 naphtalène et de 1,63 g (11 mmolea) d'anhydride
phtalique dan~ 40ml de dichloro-1,2 éthane anhydre, on a~oute par portlons,
en environ 30 mn, 2,93 g (22 mmoles) de chlorure dlaluminium anhydre. Après
une nuit d'agitation à température ambiante, le milieu réactionnel est
versé dans 40 cm3 d'eau glacée. La phase organique est décantée. La phase
aqueuse est à nouveau extraite deux foi3 par 100 cm3 de dichlorométhane.
Le~ phases de dichloroéthane et dichlorométha~e sont rassemblées, lavées à
l'eau, séchées sur sulfate de sodium et évaporées à sec. Le solide obtenu
est purif~é deux fois par chromatographie sur gel de silice 60 dans le
mélange éluant dichlorométhane/tétrahydrofuranne 50/50. Après évaporation
et séchage, le solide isolé est repris à l'éther isopropylique. Après fil-
tration et séchage, on obtient 0,4 g d'acide [(diméthoxy-1,4 méthano-5,o
tetrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 benzoique sous la forme d'une
poudre blanche dont le point de fusion est de 213C.
Le spectre RMN H 80 MHz est conforme à la structure attendue.
Analyse élémentaire : C21H2005
C H O
calculé 71,38 S,72 22,70
trouvé 71,18 5,76 22,67
EXEMPLE VI
Préparation de l'acide rttétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
hydroxyméthylJ-2 phénylcarbinol.
(formule I dans laquelle A =-(CH2 ~ ; Rl=R2=R3=R4=CH3
RS=R6=H ; R'=OH, R"=1l ; B=phényle ; R=CH20H)
A une suspension de 350 mg (9 mmoles) d'hydrure de lithium alumi-
nium dans 10 cm3 de tétrahydrofuranne anhydre, refroidie à 0C, on aJoute
goutte à goutte une solution de 1 g (3 mmoles) d'acide t(tétraméthyl-
S,5,8,8 tétrahydro-5,6,7,8 naphtyl-2) carbonyl] -2 benzolque dans 20 cm
de tétrahydrofuranne anhydre. Après 1 h d'agitation en laissant revenir à
température ambiante, le milleu réactionnel est refroidi à 0C, acidifié
par addition lente d'acide chlorhydrique O,lN et extrait à l'éther
éthylique. La phase organique e~t lavée à l'eau, séchée sur sulfate de
sodium et évaporée à sec. Le diol brut obtenu est purifié par
131~7~
-17-
chromatographie s~lr gel de silice 60 élué par un ~élange dichlorométhane-
acétate d'éthy]e 97-3. On obtient. après évaporatlon, UTIe huile incolore
quf e~t cristallisée dan~ l'hexane. Après filtration et séchage, on obtient
0,8 g de cri3taux blanc~ de ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,ô
S naphtyl-2)hydroxyméthylJ-2 phényl carbinol dont le point de fu~ion est de
95-8C,
Le spectre RMN H 80 MHz correspond à la structure attendue.
Analyse élémentaire : C22H2802
C H O
calculé 81,44 8,70 9,86
trouvé 81,48 8,46 9,82
EXEMPLE VII
Préparation du ~(tétraméthyl-S,S,8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl~-2 benzoate d'éthyl-2' hexyle
(formule I dans laquelle A --(CH2 ~ ; Rl=R2=R3=R4 CH3
R5=R6=H ; R',R"=oxo ; B = phényle ; R =-CO2C8H17~
Une solution de 4,2 g (0,0125 mole) d'acide ~(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2) carbonyl~ -2 benzolque décrit à
l'exemple I et de 3,26 g (0,025 mole) d'éthyl-2 hexanol-1 dans 100 cm3 de
toluène contenant 0,1 cm d'acide sulfurique à 98%, est chauffée 8 h au
reflux avec distillation azéotropique de l'eau formée. Le milieu
réactlonnel est alors refroidi à température ambiante, lavé abondamment à
l'eau et concentré sous presslon réduite. L'huile brute obtenue est puri-
fiée rapidement par chromatographle sur gel de silice 60 éluée par un mé-
lange toluène/dichlorométhane 50/50. Après évaporation et séchage, on ob-
tient 4,1 g de [(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl~-2 benzoate d'éthyl-2' hexyle sous forme d'un liquide incolore.
Les spectres RMN H 80 MH~ et I.R. correspondent à la structure attendue.
Analyse élémentaire : C30~14003
C H 0
calculé 80,318,99 10,70
trouvé 80,468,91 10,75
EXEMPLE VIII
Préparation du [(pentaméthyl-1,1,2,3,3 indanyl-5)carbonyl3 -2 benzoate
d'éthyle
(formule I dans laquelle A =-~H- ; R1=R2=R3=R4=CH3;
CH3
-18- 13~567~
R5~R6=H ; R',R"-oxo; B=phényle ; R=C02C2H5)
Une solu~ion de 2,4 g (7,1 mmoles) d'acide ~pentaméthyl-
1,1,2~3,3 indanyl-5)carbonylJ-2 benzo;que, décrit à l'exemple II, clans
80 cm d'alcool éthylique contenant 0,1 cm d'acide sulfurique à 98~,
9 est chauffée 12 h au reflux. 1a solutlon est alors concentrée sous pression réduite. L'ester brut est dlssous dans 100 cm d'éther éthylique. I,a
solution éthérée est lavée au bicarbonate de sodium pui~ à l'eau, séchée
sur sulfate de sodium et enfin évaporée à sec. Après séchage, on obtient
2,5 g de ~(pentaméthyl-1,1,2,3,3 indanyl-5) carbonyl] -2 benzoate d'éthyle
sous forme d'une huile lncolore qui cristallise lentement à température
ambiante pour donner un solide blanc dont le point de fusion est de 56-57C.
Les spectres RMN H 80 MH2 et I.R. sont conformes à la structure attendue.
Analy8e élémentaire : C24H2803
C ~ O
lS Calculé 79,09 7,74 13,17
Trouvé 79,12 7,ô5 12,98
EXEMPLE IX
Préparation du l(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl~-2 benzoate de méthyle
(for~ule I dans laquelle A =-(C~2 ~ ; Rl=R2=R3 R4 C 3
R5=R6=H ; R', R"-oxo ; B - phényle ; R=-C02CH3)
Une solution de 3,36 g (0,01 mole) d'acide [(tétraméthyl-5,5,8,8
tétrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 benzolque, décrlt à l'exemple I,
dans 125 cm d'alcool méthylique contenant 0,1 cm3 d'acide sulfurique à
98~, est chauffée 24 h au reflux. la solution ese concentrée sous presslon
réduite. L'ester brut est dissous dans 150 cm d'éther éthylique, lavé au
bicarbonate de sodium et à l'eau. Après séchage sur sulfate de sodium, la
phase éthérée est évaporée à sec. le solide obtenu est recristallisé dans
le minimum d'hexane. Après séchage, on obtient 2,2 g de cristaux blancs
de ~(tétraméthyl-S,5,8.8 cétrahydro-5,6,7,8 naphtyl-2)carbonylJ-2 benzoate
de méthyle dont le poinC de fusion esC de 77-78C.
Les spectres RMN lH 80 MHz et I.R. correspondent à la structure attendue.
Analyse élémentaire : C23H2603
C H 0
calculé 78,82 7,48 13,70
trouvé 78,93 7,50 13,79
~31~674
-19-
EX~MPLE X
Préparatlon du N-éthyl ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl--2)cnrbonyl]-2 benzamide
(formule I d~ns Iaquelle A ~ -(C~2 ~ ; R1=R2'R3=R4 CH3
RS=R6=H ; R',R"=oxo ; B ~ phényle ; R~-CONHC2H5)
A une solution de 3,36 g (0,01 mole) d'acide [(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2) carbonyl~-2 benzo~que dans 30 cm3
de dichlorométhane anhydre, on a~oute 0,55 cm (6 mmoles) de trichlorure
de phoaphore et chauffe 3 h au reflux. Le milleu réactionnel est refroidi à
+5C et 2 cm (0,03 mole) d'éthylamine anhydre sont a~outés. L'agitation
est maintenue 30 ~n à +5C pUi8 1 h en laissant revenir à tempéra~ure am-
biante. Le milieu réactionnel est alors dilué à 100 cm3 par additlon de
dichlorométhane et lavé à l'acide chlorhydrique dilué pUi8 à l'eau. La
phase de dichlorométhane est séchée sur sulfate de sodium puis concentrée
lS sous pression réduite. Le produit brut obtenu est purifié par
chromatographie sur gel de silice 60 dans un mélange éluant
toluène/dichlorométhane/acétate d'éthyle 5/3/2 suivie d'une
recristallisation dans l'éther isopropylique. Après séchage, on obtient
1,75 g de cristaux blancs de N-éthyl ~(tétraméthyl-5,5,8,8 tétrahydro-
5,6,7,8 naphtyl-2)carbonyl~ -2 benzamide dont le point de fusion est de
201C.
Les spectres RMN lH 250 MHz et 13C dans le deutérochloroforme ainsi que
les spectres I.R. (RBr et dichlorométhane) correspondent à la forme
cyclisée lactame.
Analyse élémentaire : C24H29NO2
C H N 0
calculé 79,30 8,04 3,85 8,80
trouvé 79,32 8,01 3,80 8,69
EXEMPLE XI
Préparation du N,N-di n-butyl ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl3-2 benzamide
(formule I dans laquelle A =-(CH2 ~ ; Rl=R2=R 3=R4 CH3
R5=R6=H ; R',R"=oxo ; B = phényle ; R=-CON(C4H9)2
A une solution de 1,68 g (S mmoles) d'aclde C(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 benzoique dans 20 cm3 de
dichlorométhane anhydre, on a~oute 0.22 cm3 (2,5 mmoles) de trichlorure
de phosphore et chauffe 3 h au reflux. Après refroidissement à +5C, 2,6
cm (15 ~moles) de dibutylamine sont a~outés. L'agitation est maintenue
30 mn à +5VC puis 1 h supplémentaire en laissant revenir à température
-20- L31567~
ambiante. Le mllieu réact1Onnel est alor9 dilué à environ 80 cm3 par
addition de dichlorométhane pUi9 tran9féré d~ns une ampoule à décanter et
lavé à l'~cide chlorhydrique dilué puis à l'eau. La phase de
dichlorométhane est séchée sur sulfate de sodium puis concentrée sou~ pres-
sion réduite. I.e produit brut obtenu est purifié par chromatographle surgel de silice 60 dans un mélange éluant toluène/dichlorométhane/acétate
d'éthyle 5/3/2. Après évaporation et séchage 90U3 vide à 80C, on obtlent
0,6g de N,N-dl n-butyl ~(tétraméthyl-5,5.8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 benzamide sous la forme d'une huile épaisse incolore.
Les spectres RMN ~ 80 MHz et I~R. correspondent à la structure attendue.
Analyse élémentaire : C30H41NO2 ; 0,25 H20
C H N 0
Calculé 79,699,253,10 7,96
Trouvé 79,489,373,16 7,97
EXEMPLE XII
Préparation du [(tétraméthyl-5,5,8,8 tétrahydro-5,6,7~8 naphtyl-2)
carbonyl]-2 benzaldéhyde
(formule I dans laquelle A =-(CH2 ~ ; Rl=R2=R3 R4 3
R5~R6=H ; R', R" =oxo ; B - phényle ; R=-CH0)
A une solution de 1 g (3 mmoles) de C(tétraméthyl-5,5,8,8
tétrahydro-5,6,7,8 naphtyl-2)hydroxyméthyl~-2 phényl carbinol, décrit à
l'exemple VI, dans 20 cm de dichlorométhane sec, agitée à température
ambiante, on ajoute 2,3 g ~10,6 mmoles) de chlorochromate de pyrldinium et
2S agite lh 30 à température inférieure ou égale à 28C. Après dilution à
environ 200 cm3par du dichlorométhane, on a~oute 50 g de gel de silice 60
et filtre sur célite. Le filtrat est concentré SOU9 pression réduite. Le
solide brut obtenu est purifié par chromatographie sur gel de silice 60
élué au dichlorométhane. Après évaporation et séchage sous vide à 70C, on
obtient 0,3 g de ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 benzaldéhyde sous forme d'un solide blanc dont le
point de fusion est de 145C.
Le spectre RMN H 80 MHz est conforme à la structure attendue.
Analyse élémentaLre : C22H24N02
C H 0
calculé 82,46 7,55 9,99
trouvé 82,887,37 9,82
-21- 1 31~67~
EXT~ LE XIII
Preparatlon de l'acide ~(tétramethyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)hydrvxyméthy1]-2 benzo~que et de sa lactone
(formule I dans laquelle A ~(Cliz ~ ; R1=R2=~3 1~4 C 3
S R5=R6=ll ; R'~OH, R" GH; B ~ phényle ; R ~ -C02H)
A une solution de 2 g (8,12 mmoles) d'acide C(tétramethyl--
S,5,8,8 tetrahydro-5,6,7,8 naphtyl-2)carbony~ 2 benzo~que dans 50 cm3 de
tétrahydrofuranne anhydre, on a~oute par portions 1,82 cm3 (0,048 mm~le)
de horohydrure de sodium et agite 20 h à température amblante. Le milleu
réactionnel est refroldl entre O et 5C9 acidlflé par addition lente
d'acide chlorhydrique 0,1 N et extrait à l'éther éthylique. La phase organi-
que est lavée à l'eau, séchée sur sulfate de sodlum et évaporée à sec. Le
produit brut obtenu est purlflé rapidement par chromatographie sur gel de
silice 60 dans le dichlorométhane suivie d'une recristallisation dans
l'hexane. Après séchage, on obtient 1,1 g de cristaux blanc3 de lactone de
l'acide [(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
hydroxyméthyl~-2 benzolque dont le polnt de ~uslon est de 134C.
Les spectre~ RkiN H 250 MHz et C alnsl que les spectres I.R. corres-
pondent à la structure attendue.
Analyse élémentalre : C22~i24N02
C H O
calculé 82,46 7,55 9,99
trouvé 82,45 7,60 10,11
Une suspension de 0,96 g (3 mmoles) de la lactone décrlte ci-
dessus dans 60 cm de soude normale est chauffée 2 h au reflux. La solu-
tion obtenue est reProidie à +5C puis acidlflée par addition de 3,5 cm3
d'aclde acétique glacial. Le précipité obtenu est filtré, lavé abondamment
à l'eau et séché sous vide sùr potasse à température ambiante. On obtient
ainsl 0,96 g d'acide r(tétramétnyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)hydroxyméthyl~ -2 benzo~que sous la forme d'un solide blanc bien
crlstallisé et très hydrophobe, devenant gommeux dès qu'on le chauffe, puis
à nouveau solide et fondant à 134~C (transformation en lactone).
Les spectres RMN H 250 MHz et I.R. sont conformes à la structure atten-
due.
Analyse élémentaire : C22H26N03
C H O
calculé 78,07 7,74 14,18
trouvé 77,97 7,72 13,89
-22- 131~ ~7 ~
EXEMPLE XIV
Préparation du ~(tétraméthyl-5,5.8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl~-2 benzoate de sodlum
(formule I dans laquelle A ~-(CH2 ~ ; 1 2 3 4 3
S R5=R6=H ; R',R"=oxo ; B 8 phényle ; R ~ C02~ a~
On met en suspension 1,252 g (3,73 mmoles) d'acide [(tétraméthyl-
5,5,ô,8 tétrahydro-5,6,7,8 naphtyl~2)carbonyl~-2 benzoIque dans 300 cm
d'eau bipermutée. a~oute 37,3 cm de soude aqueuse 0,1N (3.73 ~moles) et
agite en tiédissant Jusqu'à dissolution. La solution est filtrée pUi8 évapo-
rée à sec. On a~oute alors 50 cm3 de toluène et évapore à nouveau à sec.On obtient ainsi, après séchage sous vide à 80C, 1,32 g de ~(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 benzoate de sodlum 50U5 la
forme d'une poudre blanche dont le point de fusion est supérieur à 300C.
EXEMPLE XV
Préparation du ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7.8 naphtyl-2)
carbonylJ-2 cyclohexane carboxylate de sodium
(formule I dans laquelle A - (CH2 ~ ; R~-R2=R3=R4=CH3
R5-R6= H ; R', R"=oxo ; B=cyclohexyle ; R-C02eNa~
On met en suspension 342,S mg (1 mmole) d'acide ~(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonylJ-2 cyclohexane carboxylique
dans 150 cm3 d'eau bipermutée, ajoute 10 cm3 de soude aqueuse 0,1N
~1 mmole) et agite en tiédissant jusqu'à dlssolution. La solution obtenue
est alors filtrée puis évaporée à sec. On a~oute 50 cm3 de toluène et
évapore à nouveau à sec. On obtlent ainsi, après séchage sous vide à 80Ct
0,36 g de ~(tétraméthyl-5,5,8,ô tétrahydro-5,6,7,8 naphtyl-2)carbonyl]-2
cyclohexane carboxylate de sodium sous la forme d'un solide blanc devenant
vitreux entre 145 et 150C.
EX~MPL~ XVI
Préparation de l'acide ~(tétraméthyl-1,1,3,3 indanyl-S)carbonyl]-2 benzo~que
(Formule I dans laquelle A - -CH2- ; R1 - R2 R3 = R4 - CH3 ;
R5 8 R6 = H ; Rl ,R~r = oxo ; B - phényle ; R - -C02H).
A une suspension de 2,96g (17 mmoles) de tétraméthyl-1,1,3,3
indane et de 2,52g (17 mmoles) d'anhydride phtalique dans 100cm3 de
dichloro-1,2 éthane anhydre. on aJoute par portions 3,4g (25,5 mmoles) de
chlorure d'aluminium anhydre de fason à maintenir la température en-dessous
de 30C.
Après 3 heures d'agitation, le milieu réactionnel est versé dans
SOcm de d'eau glacée~ La phase organique est décantée~ La phase aqueus~
13~6~
-23-
e~st à nouveal1 extrstte deux fois par 50c~ de dichloroéthane. Les phase3
de dichloroéthane sont rassemblées. lavées à l'eau, séchées sur sulfate de
sodium puis concentrée~q soug presslon réduite. Le résldu est repri~ dans
100 cm d'hexane tlède, es~oré après refroidissement à +5C, Iavé deux
fols par 50cm d'hexane puls recri9talli9é dans le minimum de toluène
boulllant. Après séchage sous vlde à 80C, on obtlent 3,lg de crlstaux
blancs dlacide ~(tétramethyl~1,1,3,3 indanyl-5)carbonyl~ -2 benzo~que dont
le poin~ de fusion est de 194~195C.
Les spectres RMN H 80MHz et I.R. sont conformes à la structure
attendue.
Analyse élémentaire : C21H2203
C ~ O
Calculé 75,49 7~75 16,76
Trouvé 75,47 7,67 16,92
EXEMPLE ~VII
Préparation de l'acide ~(pentaméthyl-1,1,2,3,3 indanyl-5)carbonyl~ -2
cyclohexane carboxyllque
(Formule I dans laquelle A = -1~_ ; R1 - R2 ' R3 = R4 = CH3 ;
CH3
R5 = R6 = H ; R', R" = oxo ; B = cyclohexyle ; R ~ -C02H).
A une suspension de 3,3g (17,5 mmoles) de pentaméthyl-1,1,2,3,3
indane et de 2,7g (17,5 mmoles) d'anhydride cis hexahydrophtalique dans
100 cm de dichloro-1,2 éthane anhydre, on a~oute par portions 4,7g
(35 mmoles) de chlorure d'aluminlum anhydre de façon à maintenir la tempéra-
ture en-dessous de 30C. Après 3 heures d'agitat~on à température ambiante,
le milieu réactionnel est versé dans 50 cm d'eau glacée. La phase organi-
que est décantée. La phase aqueuse est à nouveau extraite deux fois par
100cm de dichloroétllane. Les phases de dichloroéthane sont rassemblées,
lavées à l'eau, séchées sur sulfate de sodium puis évaporées à sec. Le
résidu est repris par 200 cm3 d'hexane tiède, filtré après refroidisse-
ment à +5C, lave trois fois par 100cm d'hexane, refroidi et séché sous
vide à 70C. On obtient ainsi 5,1g d'acide ~(pentaméthyl-1,1,2,3,3
indanyl-5)carbonyl 3 -2 cyclohexane carboxylique sous la forme d'un solide
blanc dont le point de fusion est de 178~C.
Les spectres I.R. et RMN H 80MHz sont conformes à la structure
attendue.
-24- 131~7~
Analyse élémentaire : C22H3003
C H 0
Calculé 77,15 8,83 14,02
Trouvé 77,21 9,00 13,56
EXEMPLE XVIII
Préparatfon du N,N-di(hydroxy-2 éthyl) C(tétraméthyl-5,5,8,8 tétrahydro
S,6,7,8 naphtyl-2)carbonyl~ 2 benzamide
(Formule I dans laquelle : A ~ -(CH2 ~ ; Rl~ R2= R3= R4 C 3;
R5~ R6~ H ; R,R"=oxo, B=phényle; R = -CON(CH2CH20H32)
A une solution de 3,36g (10 m~oles) d'acide ~(tétraméthyl-5,5,8,8
tétrahydro-5,6,7,8 nap~tyl-2)carbonylJ-2 benzoique, décrit à l'exemple I,
dans 30cm de dichlorométhane anhydre, on aJoute 0,44cm3 de trlchlorure
de phosphore et chauffe 3 heures au reflux. Après refroidissement à +5C,
lS on a~oute 5,25g (0,05 mole) de diéthanolamine et agite 30 minutes à +5C
puis 1 heure en laissant revenir à température ambiante. Le milieu
réactionnel est alors dilué à environ 80cm puis transféré dans une a~m-
poule à décanter et lavé à l'acide chlorhydrique dilué puis à l'eau. La
phase de dichlorométhane est séchée sur sulfate de sodium puis concentrée
~0 sous pression réduite. Le solide obtenu est purifié par chromatographie sur
gel de silice 60 dans le mélange éluant acétate d'éthyle/alcool
isopropyllque/dichlorométhane 3/2/5. Après évaporation et séchage, on ob-
tient 3,2g de N,N-di(hydroxy-2 éthyl) [(tétraméthyl-S,5,8,8 tétrahydro-
5,6,7,8 naphtyl-2)carbonyl3-2 benzamide~ sous la forme d'un solide blanc~
dont le point de fusion est de 116C.
Le spectre RMN H 250MHz est conforme à la structure attendue.
Analyse élémentaire : C26H33N 04
C H N 0
Calculé 73,73 7,85 3,31 19,11
Trouvé 73,51 7,88 3,27 19,40
EXE~PLE XIX
N-(hydroxy-2 éthyl)-4' pipérazino ~(tétraméthyl-5,S,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl3 -2 benzamide
(Formule I dans laquelle A = -(CH2 ~ ; Rl= R2= R3= R4= C113;
5 6 r___~ R'. R" = oxo ; B - phényle ;
R = -CON~___~N-CH~CH20H)
Une solution de 1,68g (S mmoles) d'acide ~(tétraméthyl-5,5,8,8
tétrahydro-5,6,7,8 naphtyl-2)carbony ~ -2 benzo~que décrit à l'exemple I et
-25- 13~567~
de 0,28 cm (3 mmoles) de trichlorure de pho~phore dans 15cm de
dlchloromét~ane anhydre est chauffée 3 heure9 au reflux. Après refroidisse-
ment entre 0 et +5C, on a~oute 1,4cm (11,4 mmoles) de N-(hydroxy-2
éthyl)pipérazine et aglte I heure, à l'abrl de la lumlère, en 1alssant
S revenlr à température amblante. Le milieu réactlonnel est alors dllué à
envlron 80cm3 par addltion de dlchlorométhane pu18 transféré dans une
ampoule à décanter et lavé abondamment à l'eau. La phase de dichlorométhane
est alors séchée sur sulfate de sodium pui~ concentrée sous presslon ré- -
duite. Le solide brut obtenu est puriflé par chromatographie sur silice 60
à l'abri de la lumière9 en utilisant d'abord un mélange éluant
tétrahydrofuranne/dichlorométhane 50/50 puis le tétrahydrofuranne seul.
Après évaporation et séchage à l'abri de la lumière, on obtlent 0,9g de N-
(hydroxy-2 éthyl)-4' pipérazino [(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl]-2 benzamide SOU9 la orme d'un solide blanc dont le
point de fusion est de 58-60C.
Le spectre H RMN 250MHz correspond à la structure attendue.
EXE~PLE XX
Préparation du ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl~-2 cyclohexane carboxylate d'éthyle
(Formule I dans laquelle A = -(CHz ~ , R1= R2= R3= R4= CH3;
Rs- R6= H ; R', R"=oxo ; B=cyclohexyle; R - -C02C2H5).
Une solution de 3,42g (10 mmoles) d'acide ~(tétraméthyl-5,5,8,8
tétrahydro-S,6,7,8 naphtyl-2)carbonyl~-2 cyclohexane carboxylique, décrit à
l'exemple III, dans 100cm d'alcool éthylique contenant 0,1cm d'acide
sulfurique à 98%, est chauffée 12 heures au reflux. La solution est concen-
trée sous pression réduite et l'ester brut obtenu est dissous dans 100cm
d'éther éthylique. La solution éthérée est lavée au bicarbonate de sodium
puis à l'eau, séchée sur sulfate de sodium et évaporée à sec. Après se-
chage, on obtient 3,6g de [(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 cyclohexane carboxylate d'éthyle SOllS la forme d'une
huile épaisse incolore.
Les spectres I.R. et RMN H 80MHz correspondent à la structure
attendue.
Analyse élémentaire : C24H3403
C H 0
Calculé 77,80 9,25 12,95
Trouvé 77,65 9,29 12,78
, .
-26- 1 3 ~ 7 4
EXEMPLE ~xr
Préparatlon de 1'acide L(téeraméthyl-5,5,8,8 tétrahydro-5,6,7,8
n~phtyl~2)hydroxyméthyl~ -2 cyclohexane carboxyllque
(Formule I dans laquelle : A n -(CH2 ~ ; U1~ R2~ R3~ R4 CH3;
R5~ R6- ll; R'=OH, R"= H; Bacyclohexyle; R ~ -C02H)
Une suspeniion de 3,42g (10 mmoles) d'acide C(tétraméthyl-5,5,8,8
tétrahydro-S,6,7,8 naphtyl-2)carbonyl ~ -2 cyclohexane carboxylique décrit à
l'exemple III et de 10g de zlnc en poudre (0,15 mole) dans 150cm3 de
solution aqueuse de soude 2,5M est chauffée au reflux pendant 7 heures.
Apres refroidissement à ~5C, le milieu réactionnel est neutralisé par
60cm d'acide chlorhydrique 6N puis acidifié à pH voisin de 3 par addi-
tion de 20cm d'acide acétique glacial. Le mélange est alors extrait à
~ 1'éther éthylique (2xl50cm ). La phase éthérée est lavée abondamment à
lteau, séchée sur sulfate de sodium et évaporée à sec. Le solide obtenu est
lS repris dans 50cm d'hexane, essoré, lavé à nouveau deux fois par 40cm
d'hexane et séché sous vide à 40C. On obtient ainsi 2,9g d'acide
~tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)hydroxyméthyl~ -2~
cyclohexane carboxylique sous la forme d'un solide blanc dont le point de
fusion est de 186C.
les spectres I.R. et RMN H 250MHz sont conformes à la struc-
t~re attendue.
Analyse élémentai~e : C22H3203
C H O
Calculé 76,70 9,36 13,93
Trouvé 76,66 9,26 13,95
EXEMPLE XXII
Préparation du ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)hydroxyméthyl~-2 cyclohexane carboxylate de sodlum
(Formule I dans laquelle : A = -(CH2 ~ ;R1= R2= R~ R4 3;
R5 - R6 ~ H; R' = OH, R" = l~; B - cyclohexyle; R = C02~ a )
On met en suspension 344,48mg (lmmole) d'acide [(tétraméthyl-
5,5,8,8 tétrahydra-5,6,7,8 naphtyl-2)hydroxyméthyl ] -2 cyclohexane
carboxyl~que, décrit à l'exemple XXI dans 100 cm3 d'eau blpermutée,
a~oute 1OCM de soude aqueuse O,lN (1mmole? et aglte 30 minutes dans un
baln à ultra-sons. La solutlon obtenue est évaporée à sec sous presslon
rédulte. On aJoute 50cm de toluène anhydre et évapore à nouveau à sec.
On obtient ainsi, après séchage sous vide à ôOC, 0,36g de ~(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)hydroxyméthyl~ -2 cyclohexane
4Q carboxylate de sodlum sou~ la forme d'un sollde blanc dont le polnt de
-27- ~ 7 ~
fusion esc de Z60C.
EXE~PLE XXIII
Préparation de l'acide ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)méthyl]-2 benzoIque :
(Formule I dans laquelle A ~ -(CH2 ~ ; 1 2 3 4 3
RS-R6=H ; R'~R"=~I ; B=phényle ; R--C02H)
Un mélange de 6g de zinc, 0,6g de ch10rure mercurique, 9cm3
d'eau et 0,3cm d'acide chlorhydrique concentré est agité lOmn à tempéra-
ture ambiante. La solution est décantée et l~amalgame est rincé deux fois
par 25cm d'eau. On a~oute alor3 10cm d'eau, 5cm d'acide chlorhydri-
que concentré, 8cm de toluène, 8,4g (0,02S mole) d'aclde C(tétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 benzo~que, décrit à
l'exemple I, et chauffe 30 heures au reflux sou~ agitation en a~outant
3cm3 d'acide chlorhydrique concentré toutes les 6 heures. On a~oute
20cm3 de toluène, filtre à chaud et lave l'amalgame troi~ fois par
40cm de toluène. Le filtrat est transféré dans une ampoule à décanter et
la phase toluénique est séparée, lavée à l'eau, séchée sur sulfate de ~o-
dium puis concentrée sous pression rédulte. Le produit brut isolé est
recristallisé dans un mélange heptane, éther isopropylique. On obtient,
ap~ès séchage, 6,6g de cristau~ blancs d'acide ~(tétraméthyl-5,5,8,8
tétrahydro-5,6,7,8 naphtyl-2)méthyl~-2 benzo~que dont le point de fusion
est de 136C.
Le spectre RMN H 80M~z est conforme à la structure attendue.
Analyse élémentaire : C22~2602
C ~ O
Calculé 81,95 8,13 9,92
Trouvé 82,14 8,16 9,79
EXEMPL~ XXIV
Préparation du ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 benzoate d'éthyle :
(Formule I dans laquelle A - -(CH2 ~ ; 1 2 3 4 3
R5=R6-~ ; R',R"=oxo ; B-phényle ; R--C02C2H5).
Une solueion de 8,41g (0,02S mole) d'acide ~(tétraméthyl-5.5,8,8
tétrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 benzo~que, décrit à l'exemple I,
dans 300cm d'alcool éthylique contenant 0,4cm3 d'acLde sulfurique à
98~ est chauffée 14 heures au reflux. La solution est alors concentrée sous
pression réduite et l'ester brut obtenu est dissous dans 300cm3 d'éther
éthylique. La solution éthérée est lsvée au b~carbc-.~ate de sodium puis à
l'eau, séchée sur sulfate de sodium et évaporée à sec. Après séchage, on
-28- 13~7~
obtient 7,9g de ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonylJ-2 benzoate d'éthyle sous la forme d'une huile incolore qui cris-
tallise lentement à température ambiante pour donner tm sollde blanc dont
le point de fuslon es~ de 58-59C.
Les spectres I.R. et RMN H 80~1z sont confor~es à la structure
attendue.
Analyse élémentaire : C24H2803
C 11 0
Calculé 79,09 7,74 13,17
Trouvé 79,19 7,75 13,02
EXEMPL~ XXV
Préparation du (tétra~éthyl-5,5,8.8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl -2 benzoaCe de zinc :
(Formule I dans laquelle A = -(CH2 ~ ; R~=R2sR3=R4=CH3
R5sR6-H ; R',R"=oxo ; B=phényle ; R= -C02 1/Z Zn )
On met en suspension 368,5mg (1,lmmoles) d'acide ~tétramét~ l-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~ -2 benzoIque, décrit à
l'exemple I, dans 150cm3 d'eau bipermutée, ajoute llcm3 (l,lmmoles) de
soude O,lN et ag1te dans un bain à ultra-sons ~usqu'à dissolu~ion (30mn). A
la solution de sel de sodium ainsi obtenue, on ajoute 157,Smg (0,548mmole)
de sulfate de zinc, 7H20 , le sel de zinc formé par transalification
précipite. Il est essoré, lavé à l'eau et séché sous vide à 70-80C. On
obtient ainsi 0,4g de ~(tétraméthyl-5,5,8.8 tétrahydro-5,6,7,8
naphtyl-2)carbonyl~-2 benzoate de zinc sous la forme d'un solide blanc
devenant vitreux vers 1S5C,
EXEMP~E XXVI
Préparation du ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2)carbony1-2 cyclohexane carboxylate de zinc :
(Formule I dans laquelle A- -(CH2 ~ ~ R1=Rh~3R3=R4=CH3;
R5-R6=H ; R',R"=oxo ; B=cyclohexyle ; R- -C02 1/2 Zn~
On met en suspension 381,7mg (1,115mmoles) d'acide ~(cétraméthyl-
5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyll-2 cyclohexane carboxylique,
décrit à l'exemple III, dans 150cm3 d'eau bipermutée, on ajoute 11.2cm
(1,12mmoles) de soude O,lN et agite dans un bain à ultra-sons jusqu'à
solubilisation (40mn). On ajoute ensuite 160,4mg (0,558mmole) de sulfate de
zinc, 7H20 puis essore le précipité formé. Après lavage à l'eau et sé-
chage sous vide à 70-80C, on obtient 0,41g de ~(~étraméehyl-5,5,8,8
tétrahydro-5,6,7,8 naphtyl-2)carbonyl~-2 cyclohexane carboxylate de zinc
-29-- ~ 3~7~
~;ou~ la ~orm~ d'un 30l'dc l~lanc d~venant vi~reux ver~ 115C.
E~ Pl.ESl)L ~ORMUI.~TION~-
~xcm~L~ I : 1,otion ~n~lc.cborr~léiquc
Alcoo1 ab30lu. ~.................................................... 59,0g
P~opylène glycol.................................................... 40,0K
Acide ~(tétramé~hyl~5,5.S,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl~-~ benzoIque................................................ I,Og
Exemple 2 : Lotion de soin pour le visage à tendance acné~que.
Alcool absolu....................................................... 42,0g
Propylène glycol........................................... 24.0g
Eau purifiée................................................ ........ 33,0g Acide ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
carbonyl~-2 benzo~que....................................... ......... I,Og
Le composé actif peut être remplacé par 0,S g de l'acide ~(tétraméthyl-
5,5,8,8 tétrahydro-S,6,7,8 naphtyl-2)carbonyl] -2 cyclohexane carboxylique
ou de l~acide C(tétraméthyl-5~5,8,8 tétrahydro-5,6,7,8 naphtyl-2)
hydro~yméthyl~-2 cyclohexane carboxylique.
Exemple3 : Gel pour lutter contre la peau grasse à tendance acnéique
Carbopol 941.............,.......................................... 0,80g
Alcool absolu................................................ ...... 32,15gPropylène glycol............................................. ...... 3S,OOg
Butylhydroxytoluène.......................................... ....... 0,02gButylhydroxyanisole.......................................... ....... 0,03g
Triethanolamine 20Z...... ................. I,OOg
Eau purifiée.............~......................................... 30.00g
Aclde ~(tétraméthyl-5,5,8,8 cétrahydro-5,6,7,8 naphtyl-2)
carbony~ -2 benzoIque............................................... I,OOg
*(marque de commerce)
~ 3~567~
- 30 -
~xemple4 Gel pour lu~tcr contre la pea- gras~e à tendance acnclq-le
Klucel ll ~8cri.ve cellulosi.que)....~..................... I,OOg
~lcool absolu.............................................. 70,00g
Propylene glycol........................................... 28,45g
B~tylhydroxytol.tlènc.................................. 0,02g
Butylhydro~yanlsole...................................... .. 0,03g
Acide ~(tétraméthyl-5,5,8,8 tétrahydro-5,6,7~8 uaphtyl-2)
carbonyl~-2 benzo~que................ ~...................... ~,.,. 0,5 g
Le composé actif peut être remplacé par la même quantlté de l'acide
~pentamethyl-1,1,2,3,3 indanyl-5)carbonyl~ -2 benzoIq~e ou de l'acide
~tétraméthyl-5,5,8,8 tétrahydro-5,6,7,8 naphtyl-2)carbonyl~ -2 cyclohexane
carboxylique ou encore de l'acide ~(tétramethyl-5,5,8,8 tétrahydro-5,6,7,8
naphtyl-2) hydroxyméthyl]-2 cyclohexane carboxyliq~e.
* (marque de commerce)