Note: Descriptions are shown in the official language in which they were submitted.
2 ~
NOUVEAUX COMPOSES (METH)ACRYLI~UES PORTEUR5 DE FONCTION
T~IOCYANATE, LE~R PROCEDE DE PREPARATION ET LEUR
APPLICATION A L'OBTENTION DE NOUVEAUX POL~ERESo
La presente in~ention se rapporte à la synthèse
de nouveaux compo~és acryliques et méthacryliques porteurs
d'au moins une fonction thiocyanate ainsi qu'à l'applica-
tion de ces composés à la préparation da nouveaux polymères
et copol~mères.
On connait dejà dans la litterature scientifique
et industrielle de no~breux composés acryliques at
méthacryllques porteurs de fonction~ telles que halog`ne,
hydroxyle, thiol, époxyde, etc. Chacune de ces familles de
composés a deja trouve dans differentes industries, en
raison de la facilité de polymérisation de la double
liaison acrylique, des applications variées. Jusqu'à ce
jour toutefois, la litterature ~cienti~ique et industrielle
n~a pa~ donne d'exemples de composés acryliques et méth-
acryliques porteurs de fonction t:hiocyanate. En raison des
particularités de comportement chimique que l'on peut
20 attendre de la presence d'une telle fonction dans un
composé acrylique ou méthacrylique, le but visé par la
presente invention consi~;te donc a ~xplorer c~ nouveau
domaine de la chimie et a determiner 1PS conditions de
synthese de tels composes.
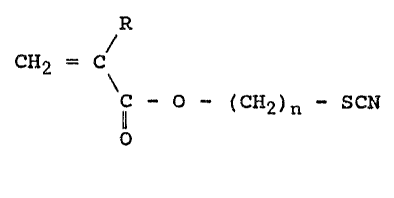
Un premier objet de la presente invention
concerne donc des composés acryliqu~3s et méthacryliques
choisis parmi ceux de formule:
R
CH2 = C (I)
C - O ~ 2) n ~ SCN
o
20~L~46~
et ceux de fo~mul~
C~2
CH2 = ~ C - R
C - O - (CH2)n - S NS ~ ~CH2)n ~ 0 ~C
Il \ // \ / ~
O ~ C O
N N
\\ /
C
S (II)
(C~2) n
o
C
/ \\
CH2 = C O
R
dans lesquelles :
- n est un nombre entier allant de 2 à 20, et
- R est choisi parmi l'atome d'hydrogèn~, le radical
méthyle et les radicaux C~O~R~ dan~ lesquels R~ est
choisi parmi les radicaux alkyl s linéaires ou
ramifiés le cas échéant porteurs de substituants
hydroxyles, alcoxy ou esters, les radicaux alcényles
linéaires, rami~iés ou cycliquas, les radicaux aryles
le cas échéant porteurs de substituants halogén~s,
nitrés ou alcoxy, les radicaux hé~erocycliques
insaturés, les radicaux alkylaryles et arylalkyles,
R ne pouvant représenter méthyle dans la formule (I~ si
simultanément n vaut 2 ou 4.
Comme exemples de radicaux R' dans les composés
de ~ormulP~ et (II~ selon 1'invention, lorsque R est
égal a CHOHR', on peut citer notamment les radicaux
méthyle, éthyle, n~propyle, isopropyle, isobutyle,
tertiobutyle, n~pe~tyle, n-hexyle, n-heptyle, n-nonyle,
:
, ",:
, , . :: ";;,,
.", ,"
4 ~ ~
trichlorométhyle, chloro-3 propyle, propenyl-l, méthyl-2-
propenyl-2, cy~lohexényle, phényle, benzylet phenyl-2-
éthyle, parachlorophenyle~ paratoluyle, paraméthoxyphényle,
paranitrophényle, orthochlorophényle, styryle, méthoxy-
methyle, acétyl-2-ethyle, pyridyl-2, pyridyl-3, pyridyl-4,
quinolyl-4, furyl-~, méthyl-4-fury1-2, (~ury1-2)-2-vinyl-1,
oxo-2-propyl 1, méthane-sulfonate-2 d'~thyl-l, benzyloxy-l-
éthyl 1, benzoyloxy-3~propyl-1, benzoyloxy-3-butyl-1,
benzyloxymethyl, (methyl-~-dioxolann~-1,3) 2-éthyl~l,
(tétrahydropyrannyl oxy-2)-3 propyl-1, acétyloxy-3-
pyvaloyloxy 3-propyl-1, et
O
R10-C-, R1 étant un radical alkyle ayant de 1 à 18 atomes
de carbone~
Un second objet de la presente invention consiste
en un procéde de preparation des composes acryliques et
méthacryliques de formules (I) et; (IIl~ Quoique tous ces
composes aient en commun pour leur préparation une étape
met~ant en jeu un sel de thiocyanate ~t un acrylate ou
methacrylate halogene, l~ur syn~hèse présente tou~efois des
paxticularites s~lon que ~ est choisi par~i l'atome
d'hydrogène et le r~dical m~thyle. ou bien sel~n que ~ est
choisi parmi les radicaux C~OH~' tels que précédemment
d~finis. ~'est pourquoi le proc~dé de préparation selon
l'invention sera maintenant décrit par reference à chacune
des familles de composés selon l'invention.
La prepaxation de~ composés acryliques et
méthacryliques de fo~mule ~I~ dans laquelle R est choisi
3 0 parmi 1 ' atome d'hydrogène et le radical méthyle et n est un
nom~re entier allant de 2 à 20, s'effectue en faisant
réagir un acrylate ou méthacrylate d'halogéno-n-alkyle avec
un sel de thiocya~a~e da~s un solvant organique et en
présence d'une quantité ef~icace d'au moins un agent de
trans~ert de phase. Le (méth)acrylate d~halogeno-n-alkyle
qui est mis à réagir selon ce procede a pour formule
2 ~
générala :
R
C~2 = C (III)
C - O ~ (CH2)n - X
o
dans la~uelle R et n sont tels que definis ci-dessus et X
est un atome d'halogene. X est choisi de préf~renca parmi
: le chlore et le brome, mais peut être aussi l'iode. Les
(meth)acrylates d'halogeno-n-alkyle de foxmule (III)
peuvent être eux-mêmes obtenus par estéri~ication du
chlorure dlacide (meth)acrylique par un halogéno-alcool de
formule HO-(CH~)n-X, cette réaction s'effectuant dans un
solvant organique tel qu8 le ohloroforme, le cas échéant en
presance d'un capteur d~acide chlorhydrique tel qu:une
amine tertiaire.
Co~me sel de thiocyanate pouvant être mis à
reagir avec le (méth)acrylate d'~Lalogéno-n-alkyle de
formule (III) on peu~ citer nota~ent les ~hiocyanates de
métal alcalin tel que le sodium et le potassium et le
thiocyanate d~ammonium. Comme solvant organique pouvant
con~enir à ce~te réactaon, on p~ut iter des cé~ones telles
que l'acétone, la méthylisobutylcétone t la mé~hyléthyl-
cétone, des amides tsls que le dimethyl~ormamide, 1
formamide et le N,N-~iméthylacetamide, des hydrocarbures
cyclaniques ou aromati~ues tels ~ue le cyclohexane, le
; methylcyclohexane, le benzène e~ le toluène, des alcools
tels que 1'ethanol, des nitriles tels ~ue l'acetonitrile et
le benzonitrile, ainsi ~ue de~ solvants chlorés ~els que le
chlorobenz~ne, 1'orthodichlorobenzène, le dichloro-1,2
ethane et le t~trachlorure de carbone.
Le solvant organique est utilisé dans une
proportion qui peut varier en fonction du (meth)acrylate
d'halo~éno-n~alkyle d'une par~, de la na~ure du solvant
d'autr~ par~. Toutefsis l~s plU5 uguelles sont gén~rale-
'' ~ ' ',,
2~6~
ment comprises entre 0,5 et 2,5 moles de (méth~acrylate deformule (III) par litre de solvant organigue.
La température réactionnelle depend évidemment
de la nature du solvant organique choisi, etant donné qu'on
opère le plus souvent à la température de reflux dudit
solvant. Ainsi la température réactionnelle est le plus
souvent choisie entre 50C et 120~ environ. Enfin la
reaction selon l'invention est e~fectuée en présence d'au
moins un agent de transfert de phase qui peut être choisi
notamment parmi
- les sels d'ammonium quaternaires tels que les
chlorure, bromure et iodure de tétra-n~butyl-
ammonium, 1Ihydrogénosulfate de tétra-n-butyl-
ammonium, le bromure de triméthylphénylammonium, le
chlorure de méthyltricaprylylammonium, les chlorures
de triméthylbenzyl- et triethylbe~zylammonium~ les
chlorure et bromure de tétraméthylammonium, l'iodure
de tétraéthylammonium, et
les sels de phosphonium quaternaires tels que le
bromure de methyltriphénylp~losphonium, le bromure de
tetra-n-butylphosphonium et l'iodure de triphényl-
iodophosphonium.
La quantite e~ficace d'agent de transfert de
phase dépend évidemment de la nature de 1'agent de
transfert choisi ainsi que du substrat - (méth)acrylate de
formule (III) - concerné par la réaction. Toutefois elle
est généralement comprise entre 0,04 et 0,4 mole d'agent de
transfert pour 1 mole de substrat.
Dans le procéde selon l'invention, on utilise
généralement une proportion de 1 à 2 moles environ de sel
de thiocyanate pour 1 mole de (méth)acrylate de ~ormule
(III). Enfin le procédé peut être mis en oeuvre en
présence d'un halogenure, de préférence un bromure ou un
iodure, de métal alcalin, de préférence le sodium ou le
potassium. Cet halogénure de métal alcalin, permettant de
réaliser in situ un échange d'halogène pour obtenir un
substrat plus reactif, peu~ être utilise dans une
' '
,: "
2 ~
proportion allant jusqu'à 1 mole pour 1 mole de
(meth~acrylat2 de formule (III).
Quoique la pression atmosphérique soit
géneralement satisfaisante, le procéde selon l'invention
peut egalement être mis en oeuvre sous pression réduite,
par exemple entre 0,05 et 1 bar environ.
Enfin, la réaction selon l' inYention peut être
effectuee en présence d'une quantite e~ficace d'au moins un
inhibiteur de polymerisationO
Cet inhibiteur est u~ilisé par exemple à raison
de 0,05% à 0,5% en poids sur la base de (méth)acrylate.
Comme exemples d'inhibiteurs de polymérisation utilisables,
on peut citer notamment la phénothiazin~, 1'éther
méthylique de l'hydroquinone, la N,N-~iéthylhydxoxylamine,
le nitrobenzène, le di-tertiobutylcatéchol, 1'hydroquinone,
le p anilinophénol, le phosphite de di-(2-ethylhexyl)-
octylphényl et leurs melanges en toute~ proportions.
La préparation des composes acryliques de
formule (I) dans laquelle R est choisi parmi les radicaux
CHOHR' peut sleffectuer en faisant reagir un compose
acrylique de formule (I) dans laquelle R est l'atome
d'hydrogène ~ ce composé ~etant obtenu tel que décrit
précédemment - avec un aldehy~e en prés~nce d'une quan~ité
efficaca d~au moins un catalyseur de fonctionnalisation.
Comme catalyseur de ~onctionnalisation convenant bien à la
reaction avec un aldéhyde on pPut citPr notamment des bases
relativemen~ fortes telles que des amines tertiaires
cycliques ayant au moins un atome d'azote commun à trois
cycles, décrites dans le brevet US-A-3 743 6~9, par exemple
le diazabicyclo-[2,2,2]-octane, la quinuclidine, et
l'a-quinuclidinol. Une quantité efficace de catalyseur de
fonctionnalisation dépend evidemment de la nature de ce
dernier, mais aussi de l'acrylate de formule (I) (R = H) et
de l'aldéhyde. Elle est généralemen~ comprise entre 0,1 et
10% environ, de pré~érence antre 1 et 6% environ en moles
par rapport à la somme des réactants en présence - acrylate
de formule (I) (R = H) et aldehyd~.
2 ~
L'ald~hyde avec lequel est mis à reagir
l'acrylate de f~rmule (I) ~ ) a pour formule gPnérale
R'CH0, dans laquelle R' a la signification dejà mentionnée
ci-dessus. Comme exemple de tels aldehydes on peut citer
notamment 1lacétald~hyde, le n-butyraldéhyde, le phényl-
acetaldehyde, le benzaldéhyde, le crotonaldehyde , le
m-ethylphenyacétaldehyde, le m-chlorobenzaldéhyde, le
p-nitrophenylacétaldéhyde, le m-carbomethoxybenzaldehyde,
le p-méthoxybenzaldehyde, le formaldéhyde, le propion-
aldéhyde, l'isobutyraldéhyde, le tertiobutyraldéhyde, len-pentaldéhyde, le n-hexaldéhyde, le n-heptaldéhyde, le
n-nonaldéhyde, le chloro-4-butyraldéhyde, le p-chloro-
benzaldahyde, l'o-chlorobenzaldehyde, le cyclohexène-4-
aldéhyde, le furfuraldehyde, le méthyl-4-furfuraldehyde,..
Les réactants - aldéhyde et ac~ylate de
formule (I) dans laquelle R est hydrogène - sont genérale-
ment utilisés dans une proportion de 0,5 à 2 moles d'aldé-
hyde pour 1 mole d'acrylate. La température à laquelle est
effectuee la réaction est genéralament comprise entre O~C
et 150C environ. La réaction entre 1'aldehyde et
1'acrylate peut être effectuée en outre en présence d'au
moins un activa~eur electrophile tel qulun sel de lithium,
en par~iculier un halogenure de lithium comme le chlorure
de lithium. Celui-ci peut être utilise à raiso~ de jusqu'à
0,1 ~ en moles par rapport à la somme des réactants.
Enfin, cette réactio~ selon l'invention peut
être ef~ectuée en présence d'une quantite ~fficace d'au
moins un inhibiteur de polymérisation.
Cet inhibiteur est utilisé par exempl~ ~ raison
de 0,05% à 0,5% en poids sur la base de (meth)acrylate.
Comme exemples d'inhibiteurs de polymerisation utilisables,
on peut citer notamm~nt la phenothiazine, l'éther
méthylique de llhydro~inone, la N,N-diéthylhydroxylamine,
le nitrobenzène, la di-tertiobutylcatéchol, l'hydroquinone,
le p-anilinophenol, le phosphite de di-(2 ethylhexyl~-
octylphényl et leurs mélanges en toutes proportions.
La préparation des composes acryliques de
fo~mule (I) dans laquelle R est choisl parmi les radicaux
: ' ,
6 ~
CHOHR' peut aussi s'effectuer en faisant d'abord réagir un
acrylate d'halogéno-n-alkyle de formule (III~ avec un
aldéhyde de formule R'CHO en présence d'une quantité
ef~icace d'au moins un catalyssur de ~onctionnalisation
pour obtenir un intermédiaire de formule :
CHOHR'
/
CH2 = C (IV)
C - O ~ H2) n~X
puis dans une seconde etape a faire réagir ledit
intermediaire avec un sel de thiocyanate dans un solvant
organique et en présence d'une quantite efficace d'au moins
un agent de transfert de phase. Les conditions opératoires
de la première etape de ce procéde, notamment la nature du
catalyseur de fonctionnalisation, la température
reactionnelle et les proportions des divers réactants, sont
analogues à celles décrites ci-dessus à propos du premier
procédé de preparation~ Les conditions opératoixes de la
second~ étape du procéde, notamment la nature du solvant
organique, la nature de l'agent de trans~ert de phase, la
temperature réactionnelle et les proportions des divers
réactants, sont analogues à celles decrites précedemment à
propos des composes acryliques et methacryliques de formule
(I) dans laquelle R est chuisi parmi l~a~ome d'hydrogbne et
le radical methyle. ~es composés acryliques de formule
(IV) ci-dessus constituant de nouveaux inte~mediaires de
synthèse. La premiere etape de ce procede pourra le cas
échéant être e~fectuee ~n présence d'une quanti~é efficace
d'au moins un activateur electrophile tel qu'un sel de
lithium, la notion de quantité efficace e~ant analogue à
celle indiqu~e précédemment pour l'emploi de ces composés.
Cette seconde methsde de préparation est plus particuliPre-
ment applicable aux composés dans lesquels n est un nombre
entier allant de 2 a 4.
2 ~ 6
La preparation de~ composês acryliques et méth-
acryliques de formul~ (II), c'est-à-dir~ les trimères des
composes acryliques et mé~hacryli~ues de formule (I), peut
etre ef~ectuée par réaction desdi~s composés de formule (I)
avec au moins un hydrure de metal alcalin comme le lithium
ou le sodium, en presence d'u~ solvant organique. Co~me
solvant oryanique on peut utiliser notamment un hydro
carbure aromatique tel ~ue le benzène, le toluene, les
xylènes ou bien aliphatique tel que llheptane. Cette
reaction es~ effectuée ~ une température gén~ralement
comprise entre 50~C et ~20-C environ, selon la nature du
solvant choisiO La durée de la réaction est relativement
longue et genér~lement comprise sntre 2 et 80 heures en~i-
ron, selon la température réactionnelle. Cette réaction
est géneralement incomplète et conduit, a l'issue dP- la
durée mentionnee précedemment, à un mélange du compose de
formule ~I) et de son trimère de for~ule (II), melange à
partir duquel il est possible d'isoler, puis de purifier,
1~ compose ac~ylique ou methacrylique de fo~mule ~II).
Enfin un troisième et dernier objet de la
présente invention consiste en l'application des nouveaux
composés acryliques et methacryliques décxits precédemment
a la constitution de nouveaux polymères et copolymères.
Plus precisément la pr~sente invention cnncerne des
polymeres e~ copolymères comprenant au moins un motif
derive d'au moins un compose acrylique ou methacryli~ue de
formule ~I) et/ou (II), R, R' et n etank ~els ~ue dé~inis
ci-dessus, R ne pouvant representer méthyle dans la ~ormule
(I3 si simul~anémen~ n vaut 2. De tels (co)polymeres
pPuvent en outre comprendre au moins un moti~ dérlvé d'au
moins un comonomere copolym0risable a~ec ledit composé
acrylique ou methacrylique de formule (I~ et~ou (II), tel
que par exemple :
- un acrylate ou methac~ylate d'alkyle dont le groupe
alkyle linéaire ou ramifié, le cas echéant substitué,
par exemple par au moins un atome d'halogène comme le
chlora ou le fluor et/ou par au moins un groupe
hydroxyle, poss~de de 1 ~ 20 atomes de carbone,
2 ~
un acrylate ou méthac~ylate d'aryle tel que le
méthacrylate de benzyle,
un hydrocarbuxe vinylaromatique tel que le styrène,
le vinyltoluène, l 7 alphaméthylstyrene, le methyl-4
styrène, le méthyl-3 styrène, le méthoxy-4 styrène,
l'hydroxyméthyl-2 styrène, l'éthyl-4 styrene,
1'éthoxy-4 styrène, le diméthyl-3,4 styrène, le
chloro-2 styrène, le chloro-3 styrène, le chloro-4
méthyl-3 styrene, le tert.-butyl-3 ~tyrène, l
dichloro-2,~ styrène, le d~chloro-2,6 styrène et le
vinyl-1 naphtalène,
- un nitrile insaturé ~el que l'acrylonitrile ou le
méthacrylonitrile,
- une maleimide N-substituee telle que la N-éthyl-
maleimide, la N-isopropylmaleimide, la N-n-butyl-
maléimide, la N-isobutylmaléimide, la N-terbutyl-
maleimide, la N-n-octylmaléimide, la N-cyclohexyl-
maléimide, la N-benzylmaleimide et la N-phényl-
maléimide,
'- un anhydride d'acide dicarboxylique insaturé tel que
1'anhydride maleique, l'anhydride itaconique,
1'anhydride citraconique ou l'anhydride
tétrahydruphtalique,
- 1'acide acrylique ou méthacrylique,
- un acrylate ou mé~hacrylate de polyol comme les
diacrylatas et dimethacrylates de l'é hylèneglycol,
du propylèneglycol, du 1,3-butanediol, du
1,4-butanediol, du 1,6-hexane diol, du néopentyl-
glycol, du 1,4-cyclohexane-diol, du 1,4-cyclo-
hexanediméthanol, ~u 2,2,4-trimé~hyl-1,3-pentanP-
diol, du 2-éthyl-2-méthyl-1,3~propanediol, du
2,2-diéthyl-1,3-propanediol, du diéthylèneglycol, du
dipropyleneglycol, du triethyleneglycol, du
tripropylèneglycol, du tetraéthylèneglycol, du
tétrapropylèneylycol, du triméthylolethane, du
triméthylolpropane, du glycérol, du pentaerythritol,
les triacryla~es et ~riméthacrylates du triméthylol-
,~ ;
%0~6B
éthane, du trimethylolpropane, du glycerol, du
pentaé~ythritol, les tbtraacrylates et tetramétha-
crylates du pentaéxythritol, les di(méth)acrylates à
hexa(méth)acrylates du dipentaérythritol, les
poly(méth~acrylates de polyols mono- ou polyéthoxy-
le5 OU mono- ou polypropoxyles tels le triacrylate
et le triméthacrylate du triméthylolpropane triétho-
xyle, du trimethylolpropane tripropoxyle ; le
triacrylate et le trimethacrylate du glycerol
tripropoxylé ; le ~riacrylate, le triméthacrylate,
le tetraacrylate et le tétramet~acrylate du
pentaerythritol tetraéthoxylé,
- un acrylate ou méthacrylate époxydé choisi parmi le
2-époxyethylbicyclo[202.1]hept-5(6)-yl (méth)-
acrylate, l'acrylate d'epoxydicyclopentyloxyéthyle
ainsi que ceux de formule :
o
Il
Rl C ( CH2 ) n C H2
\ / \ / \ /
C O CH
Il \
CH2 o
dans laquell R1 est choisi parmî 1'atome d'hydrogène
et le radical méthyle, et n est un nombre entier
allant de 1 à 16, ceux de formule :
o
Il .
R1 C CH2 CXR2
~ / \ / \/
C O CH
CHz o
dans laquelle R1 est choisi parmi l'atome dlhydxogène
et le radical methyle, et ~ est choisi parmi les
radicaux alkyle ayant de 1 à 12 atomes de carbone et
le~ radicaux aryle ayant de 6 à 12 atomes de
2 ~
carbone, et ceux de formules :
O , ..
Il
CH;
et
o
Il
Rl C O
C O ~~ CH
ll `\~/ 3
C~I2
dans lesquelles R1 est choisi parmi l'atome
d'hydrogène et le radical methyle,
- un acrylamide ou methacrylamide, un acrylate ou
methacrylate de dialkylaminoalkyle et leurs sels
quaternaires,
- l'acrylate et le methacrylate de (norbornyloxy-2)-2
éthyle et de (dimethanodécahydronaphtyloxy-2)-2
éthyle, et
2s - des oxazolidon~s acryliques et méthacryliques
choisies parmi celles de formule :
Rl o
\ ~ . -
C - C
H2C ~ ( CH2) n ~ CH - C\ 2
C - R2
1l m
" .
: , . . . . ;,: . ~
2~6~
et celles de formule :
~ R1 0
\ //
/ - C
H2C O
( I H2 ) n R2
CH - N
\/\\
O O
m
formules dan~ lesqu~lles :
- R1 est choisi parmi l'atome d'hydrogène et le
radical méthyle,
- n est un nombre entier allant de 1 à 12,
- m est un nombre entier allant de 1 à 3, et
_ R2 est un radical hydrocarbone, alkyle linéaire,
ramifié ou cyclique ou bien aromatique,
possedant de 5 à 12 atomes de carbone,
lesdites oxazolidones pouvant ~tre obtenues par
réaction, entre 30~C e~ 90C, d'un compose portant
une ~onction (méth)acrylique avec un compose portant
au moins une fonction isocyanate,
- des composes acxyliques et methacryliques choisis
parmi ceux de formule :
R1
/
H2C = C 0 - A - Y - P(OR)2 (X)
C X
11
o
dans laquelle :
- R1 est choisi parmi l'atome d'hydrogène et le
radical méthyle,
- A est choisi parmi les radicaux (CH2) n pour
lesquels n est un nombre entier de 2 à 12 et le
.:
14
radical -(OEI2CH20)d-CH2CH2-, d etant un nombre
entier allant de 1 à ~0,
- X est choisi parmi les atomes de soufre et
d'oxygène,
- Y est choisi parmi les atomes de soufre et
d'oxygène,
avec la condition ~ue X est un atome de soufre et Y
est un atome d'oxygène lorsque A est le radical
-(CH2CH20)d-CH2CH2 , et
: 10 - R est choisi parmi les radicaux alkyle ayant de
1 à 20 atomes de carbone et les groupes
- (CH2) pS~3 dans lesquels p est un nombre entier
allant de 3 à 12 et R3 est un radical alkyle
ayant de 1 a 20 atomes de carbone r
ceux de formule :
Rl
H2C = C 0 - A ~ ! P D X
\C/
_ ll 3
O
dans laquelle :
- R1 est choisi parmi 1~atome d'hydrogène et le
radical methyle,
: - A est choisi parmi les radi~aux (CH2) n pour
lesquels n est un nombre en~ier de 2 à 12 et le
radical -(CH2CH20)d-CH2CH2-, d étant un nombre
entier allant de 1 à 20, et
- X est choisi parmi les atomes de soufre et
d'oxygène,
: et ceux de formule :
~C=C/ O~ 0~11-51 Z
~ : .. , :., .
,. ~,., , :., ~ ,
- ' :. ;. ,
.: - :
.
2~6~
dans laquelle :
- R1 est choisi parmi 1'atome d'hydrogèn~ et le
radical methyle,
- A est choisi parmi les radicaux (C~I2) n pour
lesquels n est un nombre entier de 2 à 12,
- m est un nombre entier allant de 1 a 3, et
- Z est choisi parmi l'atome d'hydrogène, les
radicaux R2QH, RZ etant un radical alkyle ayant
de 2 à 12 atomes de carbone et Q etant choisi
parmi les atom~s dloxyyène et de sou~re, et les
atomes des métaux des groupes IA, IIA, IIIA,
IB, IIB, VIB, VIIB et VIII de la Classification
Periodique,
avec 1~ condition qu2 Z est choisi parmi
l/atome dlhydrogène et les radicaux RZOH lorsque
m - 1 et que m est la valence de Z lorsque Z
est un metal.
De tels composes peuvent êt.re preparés par réaction
d'un composé acrylique ou methac~ylique de formule :
R1
H2C = c o - A - YH
C
ll
o
dans laquelle R1, A et Y ont les memes significations
que dans la formule (X), avec un composé pentavalent
du phosphore, celui-ci pouvant être par exemple un
composé de foxmule PXT3 dans laquelle X a la même
signification ~ue dans la formule (X) e~ T designe
un atome d'halogène, ou bien un compose phosphoré de
formule .
T - P(OR)2
X
. . .
2~4~6~
16
dans laquelle R et X ont les mêmes significations
que dans la formule (I3 et T désigne un atome
d'halogène, ou bien le pentasulfure P2S5,
- des composes acryliques et méthacryliques choisis
parmi ceux de formule :
R1
HzC = C 0 ~ R2 _ f~ CHR6 s P (-oR3)2 (XI)
C X~ S
et ceux de formule :
R1
H2c = c o R2 fH - s - p - (-oR3) 2
C CHXH S
ll l6
formules dans lesquelles :
- R1 est choisi parmi l'atome d'hydrogène et le
radical méthyle,
- X est un héteroatome choisi pa~mi l'axygène et
le soufre,
- R est choisi parmi les groupes alkylènes
lineaires ou rami~iés, cycloalkylènes et
hétérocycloalkylènes mono- ou polycycliques,
alkylarylènes et arylalkylènes comprenant dP 1
à 12 atomes de carbone,
- R6 est choisi parmi l'atome d'hydrogène et les
radicaux alkyles et a~yle5 ayant de 1 à
12 atomes de carbone, et
- R3 est choisi parmi les radicaux alkyles et
aryles ayant de 1 à 20 atomes de carbone, les
groupes -(C~2)pSRb dans lesquels p est un nombre
entier allant de ~ a 12 et R4 est un radical
:,
,
2 ~
alkyle ayant de 1 à 20 atomes de c~rbone ou bien
~n gYOUpe cycloalkyle mono ou polycyclique ayant
de ~ à 10 atomes de carbone, chaque cycle dudit
groupe comprenant de 4 ~ 6 chainons, et les
groupeS ~ 2 ~ 0 - C C - CH2 dans le~quels
q est un nombre entier allant de 2 à 12 et R5 est
choisi parmi l'at~m~ d~hydrogene et le radical
me~yle. De tels composés peuvent être preparés
par réaction d'un époxyde ou épisulfure acryli~ue
ou méthacrylique de formule :
Rl
~I2C = C o - R2 _ CH- CHR6
\/ \/
C X
O
dans laquelle Rl, R2, R6 et X ont les memes
signific tions que dans la formule (XI),
aYec un composé thiophosphore de formule :
(R30`)2- P - SH -
s
De tels poly~ères et copolymères sont obt~nus en
tco)polymérisant au moins un composé acrylique ou méth~
acrylique de formule (I) et~ou (I~) e~ le cas échéant au
moins un comonomere copolymérisable, tel que défini préce-
demment, en presence d~au moins un ini~iateur de radicauxlibres tel ~u'un peroxyde, un hydropero~y~e ou un compos~
diazo. La (co)polymérisation est géneralement ef~ectuee a
une température comprise en~re 50-C et 120-C environ et en
utilisant l'un des monomères co~me solvant. Elle peut
également s'e~fectuer en emulsion dan~ 1'eau, à un~
. ~. ., .:
. .
18
température comprise entre ~0C et 100C, en présence d'au
moins un agent tensio~actif.
Les ~xemples suivants illustrent la presente
invention sans intention limitative.
EXEMPLES l_à 5
On fait réagir à 65C dans la méthyléthylcétone
le thiocyanate de potassium (2 moles) avec l'acrylate de
chloro-2-ethyle ~1 mol ? en présence d'iodure de tétra-
n-~utylammonium comme agent de trans~er~ de phase et le cas
écheant en presence d'iodure de potassium. Le nom~re de
moles de chacun des deux derniers composés cites est
indiqué dans le Tableau I ci-après, ainsi que la durée de
la reaction t texprimée en heures) et le rendement R en
acrylate de thiocyanato~2-éthyle, exprimé en pourcentage et
obtenu après isolement et purification sur gel de silice.
L'acrylate de thiocyanato-2-éthyle a par ailleurs été
identifie par les techniques suivantes :
- résonance magnétique nucléaire du proton, utilisant
un spectromètre JEOL PMX60SI : le spectre obtenu
comporte deux triplets à 3,25 ppm (2H) et 4,40 ppm
~2~) et un m~lltiplet à 6,2 ppm (3H~ (Figure 1 en
annexe).
- spectrophotomé~rie infrarouge, utilisant un
sp~ctrsmètrP PERKIN ELMER 841 : le spectre obtenu
comporte des bandes caractéristiques à 2957, 2157,
1727, 1638, 1620, 1409 et 1183 cm1 (Figur~ 2 en
annexe).
- résonance ~agnétique nucléaire du carbone 13,
utilisant un spectromè~re BRUKER AC 200 : le spectre
obtenu est reproduit sur la figura 37 Qn annexe.
. .
,
19
TABLEAU I
Exemple 1 2 3 4 5
__ .
5(C4Hs~4NI 0,10,2 0,2 0,2 0,3
KI 0,1 0 0,1 0,5 0,1
t 72 120 63 63 ~
R 52 81 79 78 76
. . ___
EXEMPLES 6 à 11
On reproduit la procédure opératoir~ de
- 1'Exemple 3 en remplaçant l'iodure de tétra-n-butylammonium
par un autre agent de transfert de phase dont la nature est
precisee dans le Tableau II ci-après, ainsi que la durée t
de la ré~ction et le rendement R(%).
TABLEAU XI
Exemple Agent de transfert de phase t R
2 0 6 ~ C4H9) 4NHsO4 75 55
7 (C4H~)~NBr 75 71
8 (c~H9)hNcl 72 72
9 ~c6Hs)3c~3pBr84 90
(~H3)3c6HsNBr120 73
2511 CH3N[(cH2)7~H3]~cl 144 52
~I~ .
On reproduit la procédure opératoire de
l'Exemple 7, en remplaçant l'iodure de potassium par une
quantite equivalente de bromure de potassium. Aprè~
113 heures de réaction a 65C, l'acrylate de thiocyanato-2-
éthyle est obtenu avec un rendement 78%.
On reproduit la procéduxe opératoire de
l'Exemple 9, e~ xemplaçan~ la méthyléthylcetone par un
..
.
.
, ;
2~4~
autre solvant dont la nature est precisée au Tableau III
ci-après et en modifiant correlativement la temperature
reactionnelle T (exprimée en degré Celsius). Le
Tableau III ci-après indique en outre la durée de la
réaction et le rendement R (expr?mé en pourcentage) en
acrylate de thiocyanato-2-éthyle dans chaque cas.
TABLEAU III
Exemple Solvant T t R
10 ~
13 diméthyl~ormamide 65 48 68
14 ethanol 65 120 52
acetonitrile 65 72 76
16 benzonitrile 65 120 16
17 N-N'-dimethyl-
acétamide 65 42 90
18 toluène 90 72 73
19 méthylisohutyl-
cetone 69 96 70
acétone 56 168 64
~ ,
EXEMPLES_21 à 35
on reproduit la procédure opératoirP de
1'Exemple 9 en remplaçant l'acrylate de chloro-2-~thyle par
un acrylate ou méthacrylate d'halogeno n-alkyle de formule
(III) en quantité aquivalente. On obtient ainsi un
acrylate ou méthacrylate de thiocyanato~n-alkyle de
formule (I) qui est identifié par les mêmes techniques que
celles mentionnées aux Exemples 1 à 5 au sujet de
llacrylate de thiocyanato-2-éthyle. Le Tableau IV ci-
après rassemble, en fonction de la valeur de n, de la
signification de R et X dans la formule (III), et de la
duree t de la réaction (exprimee en heures), le rendement R
avec lequel ledit produit est ob~enu ainsi que les numeros .. -~
des ~igures - en annexe - reproduisant les spectres de
resonance magnétique nucleaire du proton (RMN 1H~ et du
carbone 13 (RMN 13C) et infrarouge (IR) du produit obtenu.
'
2 ~ 6 ~ ~
Ces spectres présentent des caractères communs et peuvent
être décri-ts comme suit :
- resonance maanétique nucléaire du proton :
signal (~) m, lH m, lH t, 2H t, 2H m, 3H (2n-4)H
~=CH3, n=2 6,20 5,65 4,45 3,3 2,0
R-CH~, n>2 6,05 5,35 4,15 3,0 1,9 1,0-2,0
R=H, n>2 : 5,7~6,7 ppm (m, 3~), 4,15 ppm (t, 2H),
2,95 ppm (t, 2H~ et 1,5-2,2 ppm (m, (2n-4)H).
~ spectrophotomét-r-le infrarouqe : ~ en cm
R=CH3 2158-2154, 1723-1716, 1640-1638
R=H 2157-2154, 1727-1724, 1638-1637, 1622-161g
TABLEAU IV
Exemple n R X t R RMN1H IR RMN 13C
_ ~ _
21 2 CH3 Cl 84 76 3 4 38
22 3 H Cl 45 92 5 6 39
23 3 CH3 Cl 26 79 7 8 40
24 4 H Cl 31 75 9 10 41
20 25 4 CH3 Cl 55 81 11 12 42
26 5 H Br 2 89 13 14 43
27 5 CH3 Br 2 82 15 16 44
28 6 H Br 2 82 17 18 45
29 6 CH3 Br 2 90 19 20 46
25 30 8 H Br 2 85 21 22 47
31 8 CH3 Br 2 81 23 24 48
32 10 H Br 2 84 25 26 49
33 10 CH3 Br 2 75 27 ~8 50
34 12 H Br 2 95 2g 30 51
30 35 12 CH3 Br 2 91 31 32 52
~6~
EXEMP,LE 36
On fait réagir pendant 24 heures a la
température de 20~C 1 msle d'acrylate de chloro-2-éthyle et
0,7 mole de benzaldéhyde en présence de 0,1 mole de
diazabicyclo-[2,2,2]-octane et de 0,1 mole de chlorure de
lithium. On obtient alors 0,45 mole d'acrylate de
formule :
CHOH-C6~s
CH2 = C
CO2-(C~2)2 C~
(rendement par rapport au henzaldéhyde = 64~).
Cet acrylate, identifié par les mêmes
techniques que celles mentionnees aux Exemples 1 à 5 au
sujet de 1'acrylate de thiocyanato-2-éthyle, présente les
caracteristiques spectrale~ suivantes :
- resonance m~agnét q~e du proton (~igure 33 en annexe) :
7,25 ppm (m, 5H) ; 6,3 ppm (m, lH) ;
5,9 ppm (m, lH); 5,45 ppm (s, lH) ;
4,25 ppm (t, 2H) ; 3,55 ppm (t, 2H) ;
3 ppm (s, 1~),
- spectr,oEIhotométrie ln_rarouae (~igura 34 en annexe) :
3472 cm1 ; 1721 cm'~ ; 1630 cm~1,
- résonance maqnétiq~Le du carbone 13 (~igure 53 en
annexe) : `
165,60 ppm ; 141,73 ppm ; 141,16 ppm ; 128,61 ppm ;
128,37 ppm ; 127~81 ppm ; 126,56 ppm ; 72,92 ppm ;
64,21 ppm ; ~1,22 ppm.
EXEMPLE~37
0~ fait reagir 0,2 mole de l'acrylate pr~parP a
l'Exemple 36 avec 0,4 mole de thiocyanate de potassium,
23
pendant 168 heures à 65C dans 200 ml de méthyléthylcétone,
en présence de 0,04 mole de bromure de m~thyltriphenyl-
phosphonium et de 0,02 mole d'iodure de potassium. On
obtient alors 0,148 mole d'acrylate de formule :
C~OH-C6Hs
CH2 = C
CO2 (~H2)2 SCN
(rendement par rapport à l'acrylate = 74%).
Cet acrylate, identifié par les mêmes ~
techniques que celles mentionnées aux Exemples 1 à 5 au
sujet de l'acrylate de thiocyanato-2-éthyle, présente les
caractéristiques spectrales suivantes :
5 - résonance magnetique du protQn (figure 35 en annexe) :
7,25 ppm (m, 5H~ ; 6,35 ppm (m, lH) ;
5,9 ppm (m, lH); 5,5 ppm (m, lH~ ;
4,35 ppm (t, 2H) ; 3,05 ppm (t, 2H) ;
3 ppm (s, 1~),
~ D~9~ 9~ D~i~5~ y~ (figure 36 en annexe) :
3~84 cm~1 ; 2157 cm~1 ; 1721 cm1 ; 1630 cm~1,
- résonance maqnetique du carbone 13 (figure 54 en
annexe) :
165,48 ppm ; 141,44 ppm ; 141,15 ppm : 128,44 ppm ;
127,92 ppm ; 127,16 ppm ; 126,63 ppm ; 111,24 ppm ;
72,77 ppm ; 62,29 ppm ; 32,50 ppm.
EXEMPLE 38
On fait réagir 0,5 mole de l'acrylate de
thîocyanato-2-ethyle obtenu conformément a 1~Exemple 9 avec
0,35 mole de benzaldehyde, pendant 48 heures a la
tempéra~ure de 20C , en présence de 0,05 mole de
diazabicyclo-[2l2l2]-oc~ane et de 0,05 mole de chlorure de
2 i~
2~
lithium. On obtient alors 0,231 mole du même produit,
identifie par ses caractéristiques spectrales infrarouge et
de résonance magnétique nucléaire, que celui obtenu à
l'Exemple 37. (Rendement par rapport au ~enzaldéhyde :
6~
EXEMPLE 39
On fait réagir 0,3 mole du méthacrylate de
thiocyanato-2-éthyle obtenu conformément à l'Exemple 21
avec 0,1 mole d'hydrure de sodium, à 55C pendant 24 heures
dans 400 ml de toluène. En suivant l'avancement de la
réaction par chromatographie en phase gazeuse, on~observe
alors l'obtention d'un melange constitué à 75% de
méthacrylate de thiocyanato-2-éthyle et a 25% de son
trimère de formule (II), celui-ci étant identifié de la
manière suivante :
a) Resonance maqnetique nucleaire du ~roton :
A l'exception des pics à 6,2 ppm ~m, lH), à 5,65 ppm
(m, lH~, à 4,5 ppm (t, 2~) et à 2 ppm (m, 3~) dont
les déplacements chimiques sont conservés, le
spectre (figure 55 en annexe) indique la présence
d'un triplet à 3,05 ppm (2H).
- b) Spectro~hotométrie infrarou~ (figure 56 en annexe~ :
Le spectre indique la pre~ence d'une nouvelle bande
caractéristique à 2096 cm1.
EXEMPLE 40
On reproduit la procédure opératoire de
l'Exemple 39 à l'exoeption de la quantité d'hydrure de
sodium, portée a 0,3 mole, et de la duree de la réaction,
portée a 72 heures. On obtient alors un mélange de 47% du
méthacrylate de thiocyanato-2-éthyle et de 53% de son
trimere de formule (II), iden~ifie comme prec~demment.
EXEMPLE 4~
On reproduit la procédure opératoire de
l'Exemple 39 à l'exception de la quantité d'hydrure de
sodium, portée à 0,9 mole, et de la duree de la réaction,
portee à 72 heures. On obtient alors un mélange de 80~ du
methacrylate de thiocyanato-2-éthyle et de 20% de son
trimère de formule (II), identifié co~me précédemment.
, . .. . . .