Note: Descriptions are shown in the official language in which they were submitted.
~091/139'77 PCT/FR91/00200
PROCEDE DE STlMULATlON ARTIFlClELLE DE CELLULES ET
~5rrrF DE CUL~URE D'O~OCYTE~
__ __.__
La présente invention concerne un procédé de stimulation
- artificielle des cellules en particulier d'ovocytes, ladite stimulation étant
modulab~e dans le temps, et un dispositif de culture de cellules perme~tan~
la m Ise en oeuvre du procédé.
La présente invention se rapporte à la stimulation de cellules,
en particulier d'ovocytes ou d'oeufs fécondés, par un mécanisme bio-
chirnique régulé dans les conditions physiolo~iques par un oscillateur
i nterne.
11 s'agit notamment d'une procédure de clonage des embrvons
d'animaux et, en particulier d'obtention d'ovocytes receveurs cornpétents
pour la greffe d'un noyau cellulaire dans un état homogène.
Le clonage d'embryons d'animaux domestiques est la voie
perme~tant de remédier à la variabilité génétique induite par la
fécondation et de standardiser les améliorations généIiques d'une race.
Lors de la fécondation, I'entrée du spermatozolde va avoir
deux grandes fonctions:
- apport du génome haplolde mâle,
- activation du développement qui restructure le noyau mâle par le
cytoplasme de l'ovocyte et favorise les intéractions noyau-cytoplasme.
11 s'écoule en moyenne 12 à 20 heures entre la fécondation et
la première division cellulaire, pendant lesquelles un ensemble de
phénomènes ont lieu, les deux ~énomes paternel e~ maternel ayant des
rôles complementaires pour un développement ultérieur de l'embryon
(Surani et al. 1984, Nature 308, 54~-550), rnais on n'en connait pas le
mécanisme exact.
e clonage d'un embryon est une mé~hode qui vise ~ obtenir le
plus d'animaux vivants à la suite du transfert des noyaux cellulaires de cet
embryon ~qui contient plusieurs cellules~ dans des ovocytes enuclées et
activés. Les deux fonc~ions de la fécondation son~ dissociées. Afin d'obtenir
un développement ulterieur de l'oeuf, il faut procéder à une activation de
I'ovocyte receveur avant la greffe nucléaire. L'activation peut aussi
s'appliquer aux premières heures du développement de l'oeuf fécondé.
On sait que les oeufs de mammifères peuvent être ac~ivés
artificiellement par difforents stimulis physiques ou chimiques, qu'il s'a~isse
.,;
'.'
:~ ;
. :
- . . .
,
.
:: ~ .:, : . : .
2 ~
tlVO ~1/13977 PCI/FR91/00200
de chocs électriques, ~hermiques ou osmotiques, d'enzymes ou d'agen~s
anesthésiques (Kaufman ~lH 1983 - Early mammalian development -
parthenogene~ic studies - Cambridge University Press). Cependant,
I'activation est toujours identifiée à un stimulus unique, limité dans le
5 temps, supposé mimer la pénétration du spermatozolde dans I'oeuf. Aucun
de ces traitements ne reproduit la série de chan~ements physiolog~ques se
produisant dans l'oeuf après la pénétration du spermatozolde.
On ne connait que quelques cas d'activation parthénogenéti~ue
de l'ovocyte de vache (Menezo et al. 1976 - Commission of the European
10 Coimmuni~ies, Agricultural research seminar, Egg transfer in Cattle. Eur
5491); aucune méthode vraiment fiable et précise d'activation des ovocytes
de bovins n'est disponible. L'activation expérimentale par Iréthanol
présente de nombreux inconvénients: grande variabilité des résultats en
fonction de l'âge des ovocytes (Cuthbertson, 1983 ; J. Exp. Zool. 226,
31 1-314).
En ce qui concerne le clonage d'embryons, les premiers
résultats incontestés ont été obtenus par S. Willadsen en 1986 chez la
brebis. Ils ont été suivis par ceux de Prather et al en 1987 chez la vache, et
en 1989 chez la truie. Chez la lapine, les premiers individus issus de
20 clonage ont été obtenus par Stice et Robl en 1988. Les ~aux de succès de
ces expériences rapportés dans les publications ne dépassent généralemen~
pas 4 %. Toutefois, des sociétés américaines (Granada Genetics, Houston,
Texas) ou Canadienne (Alta Genetics, Callgary, Alberta), semblent
rnaîtriser la procéJure de clonage chez les bovins. Il est dit qu'une centaine
25 de veaux aurait déjà été obtenue sur le continent nord-américain. Cette
prise en main industrielle reflète l'intérêt que susci~e le clonage d'embryon
chez les bovins. kAais les techniques ont-elles vraiment progressé ?
Les procédures décrites dans les publications se ressemblent.
Les ovocytes utilisés ont subi une période de vieillissement de 6 à 10
30 heures. Ce veillissement es~ rendu nécessaire pour favoriser l'activation
(aucune technique classique d'activation ne permet d'activer des ovocytes
fraîchement ovulés même chez les bovins (Ware et al. 1989). Les
chromosomes or~anisés sur 13 métaph.se 11 sont prélevés en "aveugle" dans
' ' ,
.~
-~ 2~ 138
~0 91/13977 PCl`/FR91/00200
la region du premier globule polaire, mais des techniques de visualisation
des chromosomes par fluorescence sont mises en oeuvre. Une cellule
embryonnaire provenant d'une morula est introduite sous la zone pellucide
et la fusion est obtenue par des impulsions de champs électriques.
L'activation de l'ovocyte est généralement provoquée par la procédure de
fusion cellulaire; dans certains cas, elle n'est pas décrite. Deux chercheurs
ont pu obtenir un agneau à la suite du transfert dans un ovocyte d'un noyau
provenant d'une cellule du bouton embryonnaire (Smith a~ Wilmut, L989).
Toutefois, le niveau des resultats et la complexité des
mécanismes en jeu tels que le stade de différenciation du noyau, la phase
du cycle cellulaire, l'état de l'ovocyte receveur~ son âge! la procédure
dIactivation ne permettent pas de comprendre pou~quoi certains embryons
se développent et d'autres non. De nombreuses théories pour expliquer les
échecs comme celle fondée sur l'ac~ivité de transcription du noyau
l 5 transplanté ont été contredites par quelques résultats expérimentaux.
Des données nouvelles sont apparues sur les mécanismes
physiologiques déclenchés par la fécondation et notamment en ce qui
concerne les rythmes des variations de niveau du calcium libre et des
seconds messagers comme l'lnositol (1,6,5)-tri-phosphate (InsP3)
(Cuthbertson et al. l981; Cuthbertson ~ Cobbold, 1985; Miyazaki et al.
1986; Miyazaki, 1988). L'activité périodique de ces seconds messagers
pourrait régul~er les synthèses des acides nucléiques (ADN et ARNs) et des
protéines (Basset et al. 1968; Rodan et al. 1978).
Le processus est déclenché par le spermatozolde dans les
secondes qui suivent la fécondation~ La chaîne de réactions qui aboutit à la
production d'lnsP3 semble dépendre d'un influx d'ions calcium. L'lnsP3 se
lie à un récepteur spécifique qui contrôle l'activité d'un canal calcique situe
sur la membrane intracellulaire d'un réservoir intracellulaire de calcium.
Le calcium ainsi libéré active des protéines spécifiques, qui elles-mêmes
activent des processus spécifiques, par exemple la complexation calcium-
` calmoduline, I'activation de kinase etc. Le calcium est considéré comme
I'activateur principal du métabolisme. Ce cycle de réactions se reprodui~ à
(
:
20rl~ 3~
r~O 91tl3977 PCI`/FR91/00200
une fréquence de l'ordre de la minute durant plusleurs heures ~1cCulloh et
al. 1983; Igusa ~c Miyazaki, 1983-1986 ~ liyazaki et al. 1986; .~/liyazaki;
1 9~S).
Cette activité rythmique, due a un système de si~nau~
5 intracellulaires émis à une fréquence propre, semble dépendre de la
presence de pronuclei male et femelle car elle n'a pu etre observée sur des
oeufs parthénogénétiques activés par des méthodes classiques ~Cuthberston
et al. 1981; Cuthbertson d( cobbold, 1985; Miyazaki, 1988). `
L'injection dans des ovocytes d'une protéine G ~guanosine
10 -5'-0-(3-thiotriphosphate) (GTP [S]) induit plusieurs cycles de liberation decalcium, mais ne permet pas de maintenir cette activité au-delà du
quatrième (Swann, Igusa ~c Miyazaki, 1989).
Les contributions génétiques respectives de l'ovocyte et du
spermatozolde sont très documentées chez la souris. Ces études montrent
15 que le développement normal à terme d'un embryon dépend de la présence
permanente durant tout le prernier cycle cellulaire des deux pronuclei
parentaux (PN) ~Surani ~ Barton 1983; Mc(;rath ~ Solter, 1984; Surani et
al. 1986; Mann ~ Lovell - Badge, 1986, 1988).
La production de jeunes par clona~e ne peut être réalisée dans
20 la pratique que si l'on dispose de procedés fiables et reproductibles. La
qualité de l'activation de I'oeuf joue dans le développement un rôle
important jusque là ignoré.
La maîtrise de l'activation comprise comme phénomène
rythmique s'etendant sur tout le premier cycle cellulaire es~ essentielle,
25 non seulement pour produire en routine des ovocytes activés et synchrones
mais aussi pour faire bénéficier des oeufs "clonés" de ce type d'activation
imposee pour se développer normalement.
La présente invention concerne donc un procédé de stimula-
tion artifieiel, notamment à long terme, d'un ensemble de cellules
30 reproduisant l'effet d'un mecanisme de régulation biochimique, contrôlé
dans les conditions physiologiques naturelles par un oscillateur interne,
caractérisé en ce qu'il comprend les étapes suiv~ntes:
,
~ .
~"" .
. . - ,: :
2~7~
~0 91/13977 PCT/FR91/00200
a) les cellules sont placées en culture in vitro, pendant un temps
détermine,
b) les cellules sont placées dans le milieu d'impulsion, après élimination du
milieu de culture,
5 c) on soumet les cellules a une impulsion générée par un champ électrique,
d) les cellules sont à nouveau placées dans le milieu de culture, `
e) on répète les étapes précédentes un certain nombre de fois, et
f) on ob~ient les cellules dans un état activé homogène.
L'élimination du milieu de culture sera de préférence
10 complétée par un lavage des cellules par le milieu d'impulsion.
Ce procédé de stimulation bien qu'il puisse être utilisé dans
un grand nombre de procédés, a été mis au point dans le cadre de
l'activation des ovocytes en vue du clonage d'embryons. Des études récentes
ont en effet montré que dans les oeufs de mammifères, la fécondation est
15 accompagnée d'une augmentation transitoire de la concentralion intracel-
lulaire de calcium libre ([Ca2 ]i]' suivie d'une série d'oscillations de cette
concentration, qui dure au moins 4 heures.
On ignore encore par quel moyen le spermatozoïde déclenche
ces variations de [Ca2 ]i~ ainsi que les fonc~ions biologiques exactes de ces
20 oscillations de Ca2 de longue durée. Cependant, elles semblent caracté-
ristiques des oeufs fécondés et niont jamais été observées quand les
ovocytes sont artiiiciellement activés (Miyazaki 1988 - J. Cell. Biol. 106,
; 345-353).
Le procédé développé dans la présente invention va donc
25 permettre de stimuler périodiquement les ovocytes par des influx de
calcium au niveau de la membrane plasmique.
En effet, en introduisant dans le milieu d'impulsion des ions
Ca2t, ceux-ci vont pouvoir péné~rer dans la cellule par l'électroporation,
c'est-à-dire la création de "pores" générées par l'impulsion électrique.
Au-delà des phénomènes immédiats provoqués dans l'ovocyte
comme l'expulsion du globule polaire, les effets de cette stimulation se
; ~manifesteront sur les stades ultérieurs du développement de i'embryon,
alors meme que le ~raitement a cessé. C'est ainsi que les phénomènes de
compaction et de cavitation poùrront être affectés.
. :
'
.,
`:
.: ., '
:
.
,
2 ~
~-'0 91/13977 PCl/FR91/00200
Ce procédé peut s'appliquer au~ ovocytes fraich~ment ovulés,
obtenus par stimulation hormonale de la femelle. L'activation des oYocy~es
dans les condi~ions définies de fréquence, d'intensi~é et de durée provoque
l'expulsion du deuxième globule polaire. On peut alors prélever les
5 chromosomes qui se ~rouvent en fin de télophase juste sous le deuxième
globule polaire. On dispose d'ovocytes dans le même état physiologique
possédant un pronucleus.
On introduit alors un blastomère sous la zone pellucide et on
procède à la fusion cellulaire par action d'un champ électrique.
Le procédé peut alors s'appliquer aux embryons clones ainsi
obtenus, af in d'améliorer leur développement, c'est-à-dire de régulariser
les divisions cellulaires et d'obtenir la compaction.
La stimulation par ce procédé peut s'appliquer à des ovocytes
fraichement ovulés placés en présence d'un inhibiteur. de l'expulsion du
15 deuxième ~lobule polaire, comme la cytochalasine a, qui maintient un état
diploîde. On obtient ainsi une population d'embryons parthenogénétiques,
qui pourront être implantés dans des femelles receveuses et présenteront un
développement synchrone du foetus et des annexes embryonnaires.
Ces expériences d'abord menées sur des ovocytes de lapine ont
20 été confirmées sur des ovocytes de souris, réputés réfractaires à l'activation
juste après l'ovulation. Les performances du procédé sont donc reproduc-
tibles d'une espèce à l'autre. La méthode d'activation pourra certainement
s'appliquer à des ovocytes fraichemen~ ovulés de bovin ou d'ovin.
Si l'on soustrait les ovocytes en cours de traitement, ils
25 régressent et on obtient certains artefacts, comme des ovocytes en
métaphase 111 reproductibles à volonté, et qui offrent de nouvelles
possibilités d'études, notamment sur la dynamique du cytosquelette et
I'activation du génome.
Le procédé a é~é conçu sur la base des effets des~champs
30 électriques sur les membranes plasmiques.
Il a été montré (Zimrnermann, 1982) que des impulsions de
champs électriques de l'ordre de 1 à 3 kVcm-l et d'une durée de quelques ys
peuvent créer des micropores dans la ~membrane plasmique et é~ablir une
. ,
... . . .
~ .. , . ... . . .:
2~7~1~g
~1VO 91/13977 PCl/FR91/00200
communication directe entre les milieux inlra et extra cellulaire. Il a été
ainsi possible par exemple de faire pénétrer du calcium dans des ovocytes
d'oursin en les exposant à des impulsions de champs électriques en presence
d'ions calcium (Rossignol et al 1983). L'amplitude de ces influx peut être
S modulée par la durée de l'impulsion de ch~mp électriqu~.
I.e procédé implique la conlugaison d'une méthode de culture
in vitro d'un lot d'ovocytes (ou ernbryons) par perfusion entre deux
électrodes et d'une méthode de lavage avec une solution non conductrice,
contenant du calcium 0 à 30 ~M, dans laquelle sont délivrées les impulsions.
10La présence d'une solution très faiblemenl conductrice, par exemple une ~-
solution isotomique de glucose contenant les ions Ca, au moment d'une
impulsion permet de faire apparaître un champ électrique en~re les
électrodes. Une présence excessive d'ions diminue l'effet "champ élec-
trique".
15De manière préférée, la concentration en ions Ca2~ est
comprise entre 8 et 20 ~M. De bons résulta~s sont obtenus par exemple
pour une concentration en ions Ca2~ valant 10 ~ ou bien 16 IIM.
L'alternance d'une période de culture et d'une période de lavage permet de
soumettre fréquemment les ovocytes à des stimula~ions ~dans un milieu
20 ionique très bien déf ini.
Ce procédé peut s'étendre à la stimulation des cellules par
tou~e une gamme de signaux simples ou complexes ioniques ou molécu-
laires ~ des concentrations variables qui seront déterminés par la
composition du milieu d'impulsion.
Ce procédé permet de moduler la fréquence du signal par la
durée entre deux lavages, et son amplitude par la durée de l'impulsion
électrique.
11 es~ impératif de rernplacer totalement le milieu de culture
par Ia solution d'impulsion, car l'intensité du courant due à des excès d'ions
30 provenant du milieu de culture détruirait les ovocytes. Juste après
I'impulsion, la solution d'impulsion est remplacée par le milieu de culture,
les ovocytes ne pouvant pas survivre dans la solu~ion d'impulsion.
,' '
'
,
'
..
. . .
- : .
'. . : . , ' . :,
'
~ ~7~38 :
n'O 91/13977 PC~/FP~91/00200
Ce procédé peut être piloté par l'intermédiaire d'un lo~iciel
qui permettra de créer des traitement de stimulation selon des équationS
spécifiques. exporentielles, sinusoldales, suites de Fourier ou autres.
L'un des aspects de la présente invention est le trailement
5 simultané d'un ensemble d'ovocytes~ qui seront ainsi obtenus, activés dans
le même état physiolo~ique. Les ~reffes de noyau pourront ainsi être
réalisées sur des ovocytes physiologiquement identiques.
Lors du clonage, la séquence et les phases du cycle cellulaire
durant lesquelles sont enchaînées les opérations ont des conséquences très
10 importantes sur le remodelage des noyaux et sur le développement
ultér ieur.
Il est extrêmement intéressant de pouvoir s~andardiser les
différentes phases du traitement des ovocytes~ afin d'obtenir une bonne
reproductibilité du procédé.
La présente invention concerne donc un systeme dynamique,
fonctionnant en continu et pouvant être automatisé, réalisé par un
dispositif permettant la succession automatique des étapes de lavage, de
stimulation et l'acquisition des paramètres de stimulation.
Ce disposi~if est caractérisé par le fait qu~il assure llimmobi-
20 lisation des cellules pendant les différen~es phases du traitement.
Différents modes de réalisation de ce dispositif apparaissent
. ~ .
sur les figures 1 et 3.
Il est constitué d'une enceinte comportant au moins unearrivée de fluide (10, Il) et une sortie de fluide (6) et, est caractérisé en
25 ce qu'à la partie inférieure de llenceinte se trouvent un ou plusieurs
orifices (4) don~ la géométrie est telle qulelle sloppose au passage des
cellules et en ce que le liquide entrant dans llenceinte est prélevé, au
moins en partie, à travers les orifices, en créant une dépression telle
qulelle assure sensiblement le blocage des cellules sur le ou les orifices,
30 une partie du fluide étant évacuée par débordement.
Ce dispositif permet de retenir les cellules sans les abimer ni
in~roduire une con~rain~e mécanique parasi~e. En ou~re, il perme~ à ~o~
~.
,~
~ .
.
~. ' ` , ' , , . :.
.
2 ~ 7 ~
,, ~
~0 91/13977 Pa~/FR91/00200
moment de replacer, prélever ou déplacer des cellules. Ce dispositif
permet donc de placer successivement les cellules dans des milieux de
composltion chimique de différentes natures, durant des périodes et selon
une fréquence variables.
L'enceinte comporte sur ses parois internes deux élec~rodes,
de préférence parallèles, et le ou les orifices sont alignés à égale distance
des électrodes, baignant dans le milieu correspondant à la phase du
trai ~ement en cours.
Grâce à ce dispositif, on peut à volonté cultiver les cellules
ou bien dans le milieu d'impulsion faire pénétrer dans la cellule traitée7 un
ion, une molécule, une substance chimique ou biologique complexe.
Ce dispositif permet en particulier le traitement dans une
même enceinte d'un ensemble d'ovocytes, en grand nombre, sans qu'il soit
nécessaire de les placer dans des compartiments séparés.
En particulier, le dispositif comporte au moins deux arrivées
de f luide, qui peuvent être superposées.
L'évacuation des fluides pourra egalement se faire latéra-
lement.
A chaque milieu arrivant successivement dans la chambre,
20 correspond une tubulure d'injection distincte.
Au mornent de l'injection du milieu d'impulsion, un système
d'aspiration adapté sur le dispositif d'arrivée du milieu de culture permet
la succion d'une petite quantite du milieu d'impulsion qui pénètre dans la
canalisation d'arrivée du milieu de culture; on évite ainsi que les ions du
25 milieu de culture pénètrent dans la chambre durant les lavages. La
circulation des flux de milieu est représentée par des flèches sur la
f i gure 3.
Ces milieux, aussi bien le milieu de culture que le milieu
d'impulsion, sont en circulation continue, et c'est ce flux de liquide qui par
30 effet de succion assure le maintien des ovocytes entre les électrodes
pendant les renouvellements du milieu.
Les compositions des m.lieux de culture sont connues et
dépendent des cellules en culture. Le milieu d'impulsion est généralement
-
.
2~7~3~ ~
-'0 91~13977 PS:~/FR91/{)0200
cons~itue d'un milieu non ionique pour assurer un effet de champ. Il s'agira
d'une solution isotonique par exemple de glucose.
La présence d'une grande quantité d'ions peut gravement nuire
aux cellules lors de l'impulsion. Il est donc nécessaire de laver les cellules
avec le milieu d'impulsion pour éliminer les ions contenus dans le milieu de
cult lre.
Ce dispositif peut être conçu comme une chambre d'activation,
dont la capacité peut être adaptée au nombre de cellules que l'on souhaite
traiter simultanément.
Les caractéristiques du procédé mettant en oeuvre le
dispositif, peuven~ varier largement et ne sont en général limitées que par ?
des conditions telles que les durées de lavage. Ainsi, la fréquence des
irnpulsions est limitée par la durée de lavage rninimum par le milieu
d'impulsion.
Les paramètres du procédé et du dispositif clest-à-dire les
arrivées et les sorties de fluide, de même que la fréquence, la durée et
l'intensité des impulsions électriques arrivant dans les électrodes sont
gérées par un système électronique.
Les caractéristiques des impulsions électriques en elles-mêmes
peuvent varier et dépendre des cellules et des buts recherchés.
En général, les champs électriques varient de 1 à 3 Kv. cm 1
et l'impulsion électrique aube durée de 10 lls à 2 000 ~s.
La fréquence et la durée des impulsions peuvent varier au
cours des différentes étapes d'un même processus de s~imulation.
L'organisation des tubulures qui débouchent dans la chambre
permet d'injecter des milieux sans que les ovocytes soient décrochés par les
bulles de gaz qui finissent par se former dans les canalisations. De plus, la
structure de distribution des milieux permet de limiter considérablement la
contamination ionique du milieu de stimula~ion par les ions du milieu de
culture. ;`
:, . .
:. . . . .: . :, :
: .
,. : . . .
.: : . . .
: : :
2~7~
.....
~0 91/t3977 PCl/FR91/00200
I l .
Les pompes d'injection des milieux peuven~ être commandées
par un microordinateur qui déterminera les séquences de lavage répétables
tout en maintenant les cellules entre les électrodes.
Ce dispositif pourra s'appliquer au traitement des cellules par
toute substance que l'on souhaite faire pénétrer dans l'espace intracellu-
laire. La composition du milieu d'impulsion determinera la pénétration de
cette substance selon un gradient de concentration.
Lors d'une culture cellulaire, on pourra provoquer, à un
moment déterminé, qui peut être unique, I'entrée dans l'ensemble des
cellules de la substance souhaitée. Pour cela on remplacera le milieu de
culture par le milieu d'impulsion et on déclenchera l'impulsion de champ
- électrique, la durée de l'impulsion déterminant la quantité de substance qui
pénètre. Ce milieu d'impulsion pourra alors etre évacué et les cellules
remises en culture dans un milieu approprié. L'avantage de ce système est
qu'il permet de traiter simultanément un ensemble de cellules qui sont
ainsi synchronisées. Il fonctionne en continu e~ évite toute manipulation
des cellules, assurznt ainsi une meilleure reproductibilité et une plus
grande rapidité d'exécution. Ceci permet une standardisation des conditions
et facilite le transfert de technologies.
On peut envisager de faire pénétrer dans les cellules un ion ou
une molécule simple. Ce disposi~if peu~ aussi s'appliquer à la stimulation
des cellules par une molécule plus complexe, ou à la pénétration de
; fragments d'ADN, ou d'épisome.
Ce dispositif sera utilisé pour réaliser une stimulation
cyclique des cellules, plusieurs séquences de base étant réalisées
~i successivement, l'intensité, la durée et la fréquence des impulsions pilotées
par l'intermédiaire d'un microordinateur.
.
' ~ '
~ ~0
,. .
. .
,
~: , ' : ,"
,
2 ~ ;7 ~
~0 91/13977 PCr/lFR91/002~0
Ce disposi~if perme~ la réalisation du procédé d'activation et
de svnchronisation d'ovocytes, par des stimulations répétees par Ca2, en
vue du clonage d'embryons d'animaux domestiques.
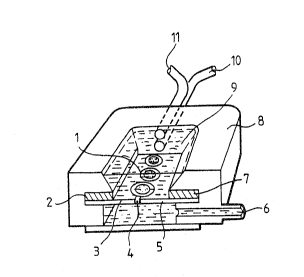
5Un mode de réalisation de la chambre est représenté en figure
1.
Les ovocytes I sont placés sur une fente rectiligne 4, réalisée
par la juxtaposition de deux plaques de verre 3 et 5, dont l'ecartement est
inférieur au diamètre des ovocytes. Les milieux, milieu de culture et milieu
10d'impulsion, arrivent dans la parti~ supérieure de la chambre chacun par
une tubulure distincte, respectivement 10 et 11, évitant une con~amination
réci proque.
Le milieu 9 correspondant a la phase de traitement en cours
arrive en c~ntinu et est évacué par une tubulure 6 située à un niveau plus
15bas que celui des ovocytes. Ce courant de liquide maintient par succion les
ovocytes plaqués sur le fond de la chambre.
Sur les parois internes de la chambre se trouvent deux
électrodes de platine 2 et 7, parallèles, de 1 cm de long.
L'enceinte 8 est thermostatée à 38C.
20Chaque milieu arrive dans la chambre après passage par un
système retenant les bulles de gaz de taille importante.
Ce système est constitué d'un ballon de verre dans lequel le
liquide arrive. De ce ballon part une tige d'or per~orée de trous de petit
diamètre; après passage à travers cette tige, les bulles de gaz de taille
25importante sont retenues et le liquide arrive dans la chambre par une
tubulure courte.
Des lapines ont été superovulées par injection de FSH et de
LH, et les ovocytes prélevés dans les oviductes. Après traitement 5 mn par
la hyaluronidase, les ovocytes sont placés dans la chambre d'activation,
30dans le milieu B2 (Menezo, 1976 - C. Hebd. Seanc. Acad. Sci. Paris 282,
1967-1970) à 38C, dans une atmosphère à 5 % de CO~
Les ovocytes peuvent immédiatement être soumis au
traitement d'activation, au~une période de ~ viellissement n'es~ nécessaire.
1 . ~ ~ '
2 ~ 7 ~
.. ..
~O 91~13977 PCr/FlR91/03)2û0
13
lls sont soumis pendant 90 minutes à une série d'impulsions de
champ électrique. à un rythme d'une i~npulsion toutes les 4 minutes, soit 22
impulslons de durée decroissante dissipant une éner~ie totale 1250 ujoules,
d~une duree totale de 14 868 ~Is, le champ électrique a une valeur de 1,8
Kv. cm~ 1.
Avant chaque impulsion, le milieu de culture est remplacé par
un milieu d'impulsion constitué d'une solution isotonique de glucose
contenant CaC12 1 0~M.
A la fin du traitement d'activation, tous les ovocytes ont deux
globules polaires bien formés. On obtient donc au même moment, à
quelques minutes près, une population homogène d'ovocytes activés dans le
meme état physiologique. Cela présen~e deux atouts: le premier est de
pouvoir ~oujours réaliser les greffes de noyau dans des oeufs physiologi-
quement identiques, le second, plus pratique, est de pouvoir opérer au
moment où les chromosomes (haploldes) se trouvent tous en fin de
télophase jus~e sous le deuxième globule polaire. Ce repérage naturel de
I'endroit où se trouvent les chromosornes facilite leur retr~it en "aveugle"
et permet, sans avoir recours à des techniques de marquage fluorescent,
d'enchaîner rapidement les étapes de manipulations.
On peut alors effectuer le prélèvement des chromosomes. On
remarque que les deux globules polaires ne sont pas toujours accolés
~certains sont à l'opposé l'un de l'autre, c'est pourquoi le premier ~lobule
polaire n'est pas un bon rnarqueur de l'endroit où se trouven~ les chromo-
somes maternels). L'efficacité de cette opération, vérifiée par la présence
ultérieure d'un pronucleus, est supérieure à 80 %. Un blastomère est
ensuite introduit sous la zone pellucide. Quinze à 20 ovocytes peuvent être
manipulés en 1 heure.
On procède ensuite à la fusion cellulaire. La méthode de
fusion cellulaire dérive des travaux de Zimmerman sur les champs
électriques. La procédure a été affinée. (Ozil et Modlinski 1986, J. Embryol.
Exp. Morph. 96, 211-228).
On obtient 100 % de fusion. Il sera possible ~e réaliser
automatiquernent, sous le contrôle d'un logiciel, I'alignement et la fusion
cellulaire dans la charnbre de stimulation. Cette procédure permettra de
limiter la durée des manipulations e~ de standardiser les conditions
expérimentales.
'-. ' ~ ~ ... ..
~/0 91/13977 PCT/FR91/00200
14
EXEMPLE I
MATERIELS ET METHODES
On a induit une superovulation chez les femelles de lapin
sexuellement matures d'espèces variées par injection sous-cutanée
d'hormone stimulant le follicule ~FSH) et d'hormone lutéinisante (LH) en
accord avec la technique décrite par Kennely et Foote (1965) et modifée
par Thibault (communication personnelle). Les femelles ont reçu 2 mg de
FSH en cinq injections à 12 heures d'intervalle: 0,250, 0,250, 0.650, 0,650
et 0!250 mg. 12 heures plus tard? avant la saillie par un mâle vasectomisé,
on leur a injecté 0,33 mg de LH.
Les ovocytes ont éte récupérés à partir des oviductes 12-l5 h
après la saillie par lavage par une solution saline de phosphate tamponné
l 5 (PBS). Ils ont été incubés pendant 5 mimJtes dans l'hyaluronidase t300
i.u.rnl- I dans du PBS) pour éliminer les cellules folliculaires. Après le
traitement, les ovocytes ont été cultivés à 38 dans du milieu B2 (Ménézo
1976) dans une atmosphère à 5 % de C02.
Méthode et proccdure expérimentaie
La perméabilité membranaire des ovocytes de lapin fraiche-
ment ovulées a été transitoirement augmentée par ouverture des pores par
une impulsion induite par un champ électrique en présence de Ca2 10 IIM
contenu dans une solution de glucose 0,3 M - 1~ MOhm H20 ~milieu
d'impulsion). Il est admis que, pendant que les pores sont ouverts, un fl-lx
d'ions circule selon les gradients de concentration à travers la membrane
cellulaire vers l'in~érieur du cytosol comme cela a déja été montré dans des
ovc~cytes d'oursin (Rossignol et al, 1983). Ainsi, I'influx ioni~e peut être
ajusté dans ces conditions soit par la différence de concentration ionique
entre l'interieur et lIextérieur de la cellule soit par la durée des
impulsions.
La procédure expérimentale pour un flux ionique induit
électriquement était similaire à celle précédemment décrite pour la fusion
par champ électrique d'embryons de lapin à deux cellules (Ozil et Modlinski
1986). Les ovocytes sont cultivés avec du milieu Ml6 (Whittingham, 1971) à
38C dans une charnbre spécialement conSue. Avant chaque impulsion, le
,
~7~3~
~O 91/13977 PCr/FR91/0020û
1 5
milieu de culture est automatiquement remplacé par le milieu d'impulsion.
Les détails de la chambre sont décrits dans la figure 1. Chaque impulsion
é~alt composée de deux impulsions alternatives afin d'éviter " une
électrophorèse latérale " (~affe 1977) des protéines de membrane qui
5 pourrai~ intervenir après plusieurs impulsions de la meme polarité ~Poo,
1981). L'amplitude du signal ionique etait modulé à travers la durée de
l'impulsion. Le processus en entier était contrôlé par un mlcro-ordinateur
IBM PC-AT 286 par l'in~ermédiaire d'une interface Tektronix Ml 5010 avec
un pro~ramme écrit en MS-BASIC. Le Yoltage réel et le courant entre les
électrodes étaient mesurés par un oscilloscope Tektronix 77041 monté avec
un convertisseur numérique programrnable 7D20 et un amplificateur 7A22.
Le rythme des impulsions électriques et la durée totale du
traitement étaient les mêmes pour tous les traitements, c'est-à-dire
appliquer une impulsion toutes les quatres minutes pendant 90 minutes.
15 Ces valeurs ont été choisies parce qu'elles s'accordent bien avec la
fréquence et la durée moyenne de l'hyperpolarisation du potentiel de
membrane des ovocytes de lapin pendant la fécondation (22 oscillations
biphasiques du potentiel membranaire pendant les premières 90 minutes
suivant la fusion sperme-oeuf, une impulsion toute les 4 minutes -McCulloh
20 et al., 1983). On sait que la variation du potentiel de membrane reflète le
passa~e de 1< basé sur des canaux activés par le calcium et qu'elles
corstituent donc un indicateur fiable de [Ca2~]i (Miyazaki et Igusa 1982).
L'amplitude de champs électriques tl.8 kVcm-l) etait constante pour tout
les groupes expérimentaux.
Traitement des o~cytes
Les effets des différents paramètres du traitement sur
- liactivation des ovocytes ont été étudiés dans quatre groupes expérimen-30 taux.
~, ~, . . .
,
'
', ~ ' ' '
,~ ~ 7 ,~, ~ s~
.
.~0 91/13977 PCT/FRgl/00200
16
Groupe A - Environnement expéFimental
: .
Afin de tester l'effet des conditions expérimentales (perfusion
continue. remplacement du milieu de culture et impulsions électriques), des
5 ovocytes fraichement ovules et des oeufs fecondés soumis à 22 doubles
impulsions de 900 ~s dans le milieu d'impulsion dépourvu de Ca2 ~la
première impulsion est donnée 13 à 15 heures après la saillie). Après le
traitement, les oeufs fécondés ont été transférés dans des receveuses pour
déterminer la survie à terme. Les ovocytes non fécondés ont été cultivés in
10 vitro et le taux d'activation parthenogénétique a été noté.
Groupe B - ions calcium et durée des impulsions
_ _ _ _ _ _ _ _ _ _ ;
L'effet de la durée des impulsions a été ét~dié dans le milieu
d'impulsion contenant du CaC12 10 ~M. Le traitemen~ pour lequel les
ovocytes ne sont pas activés a été considéré comme étan~ la durée
minimum et celui résulta nt dans la Iyse des ovocytes a été considéré
comrne étant la durée maximum. Un jeu de six traitements avec 22 doubles
impulsions constantes a été choisi arbitrairement. Ces traitements on~ une
durée d'impulsions égale à 200, 300, 600, 900, 1200 et 1500 lls respective-
ment. L'effet de la présence d'ions Na+ et Mg2+ à une concentration de 10
M dans le milieu d'impulsion a été testé avec 22 doubles impulsions
constantes d'une durée de 900 IJs
Groupe C - modulation des impulsions et type d'activation parthéno-
______________ ___ __ :
~énétique
____.__---- -- ~
Le traitement avec 22 doubles impulsions de durée constante
révèle la valeur de la durée de l'impulsion pour laquelle les effets
maximum et minimum sont enregistrés. Ces traitements constants ne
produisent pas un taux élevé d'activation avec un type uniforme d'oeufs
parthéno~énétiques. Afin de vérifier si une réduction progressive des
."~
,: :
... .
~''''.
,~,
' ~
, , ' ' ~ '
. ' ~ , ~ ~',
.
~ 2~7~3g
` ~
WO 91/13977 PC~/FR9ltO0200
17
stimuli calcium dans un trai~ement donné a un effet sur ie type de réac~ion
parthénogénétique, les ovocytes ont été soumis à des trai~ements dans
lesquels la durée des impulsions décroissait peu à peu selon une relation
exponentielle négative. Quatre traitements ont été testés en accord avec la
durée maximum de la première impulsion. La figure 2 donne la courbe des
durées d'impulsions pour ces traitements.
Une relation exponen~ielle négative (D~u)-e (axutb)~c) en~re
I'indice de l'impulsion (I à 22) et la durée d'impulsion (1500 ~s à 200 us) a
été choisie arbitrairement pour trouver la valeur de chaque impulsion au
cours du traitement.
~vec D(u): durée d'impulsion du cycle (u).
Le coefficient a détermine la pente de décroissance de cette
relation.
Le coefficient b détermine la durée de la première impulsion.
Le coefficient c détermine la durée de la dernière impulsion.
Les coefficients a et c sont constants et égaux respectivement
à -0,4 et 200.
b = 5,9920 pour le traitement I
= 6,5 510 pour le traitement 11
6,9080 pour le traitement 111
= 7,1700 pour le traitement IV.
Groupe D - Modulation du champ électrique et développement in vitro
_ _ __~_~_________._________ __ ________________ ______ __ ____ _ _ _ ___ ____ .
Les oeufs sont traités en présence de 8 ~gml- I de cytocha-
lasine ~ dans le milieu de cùlture pour bloquer l'expulsion du second
globule polaire et obtenir une population uniforme d'oeufs parthéno-
génétiques diploides. Deux traitements ont é~é appliqués au groupe C, le
traitement I qui est le traitement faible avec une durée totale d'impulsion
égale à l l 228 ~JS et le traitement 111 qui est le traitement fort avec une
durée de 14 868~s. Les oeufs parthénogéné~iques ont été cultivés in vitro
jusqu'au stade blastocyste et l'influence des deux traitements a été évalué
par le taux de formation de blastocyste~
. .
.;
'
~7~
" . .
~VO 91/13977 PCI/FR91/00200
1~ .
Viabili~é au delà de l'implantation des embryons parthénogénétiques
d i plo i des
Les embryons au stade 4-cellules ont été transplantés dans les
oviductes de receveuses. Les oeufs fécondés ont également été transplantés
dans la corne opposée de quelques receveus~es afin de comparer le
développement parthénogénétique au développement normal. Les receveu-
ses ont été autopsiées entre le Jour 8.5 et le jour 13 de la gestation et le
nombre de sites d'implantation de foetus vivants a été noté.
RESULTATS
Groupe A - Effet de l'environnement expérimental (contrôles)
1 5 __ ____ __________ _____ __ .
Quant le milieu dlimpulsion ne contient pas d'électrolytes,
aucun des ovocytes ~105) n'est activé. L'environnement expérimental et les
conditions de cul~ure c'est-à-dire le remplacemen~ du milieu de culture
avant chaque impulsion par un milieu d'impulsion ne contenant pas
d'électrolytes et le traitement par des impulsions électriques relativement
fortes (2 x 1.8 kVcm-lx900l1s x 22 fois, c'est-à-dire une durée totale
d'impulsions de 30 600 lls) n'a pas d'effet visible sur les ovocytes
fraîchement ovulés mais les condi~ions ne permettent pas de déclencher le
développernent. Par contre 41 % t9/22j des oeufs fécondés traités de la
2 5 même manière se sont développés à terme démontrant ainsi que le
traitement par des impulsions électriques de haut voltage n'a pas d'effet
contraire sur la capacité de développement des ovocytes fécondés. Il n'était
pas possible de remplacer totalement le milieu de culture par le milieu
d'impulsion avant chaque impulsion. Le courant mesure pendant l'impulsion
révèle que la conductivité du milieu d'irnpulsion est au moins de 15 %
supérieure à celle du milieu d'impulsions mesurée entre les électrodes
avant expérience et avant la premiere injection de milieu de culture.
Pendant l'experimentation, des ions provenant du milieu de culture sont
encore présents pendant les impulsions et ceci modifie le signal ionique.
Ces variations du micro-environnement n'apparaissent pas comme ayant un
quelconque effet significatif sur l'activation ou le développement
embryonnaire. Dans ce~te série d'expérimentations, les oeufs sont lavés par
:,
. . , :.
J ~
~0 91/13977 PCT/FR91/002ûO
19
le milieu d'impulsion pendant 45 secondes toutes les quatre minutes. Cette
p~riode pendant laquelle les oeufs ne sont pas dans le milieu de culture n~a
pas d'effe~ significatif sur l'activation ou sur la survie à terme.
5 Groupe ~ - ions calcium et durée de l'impulsion
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Le tableau I résume les résultats de l'expérimentation dans
lequel le taux d'activation a été testé en relation avec la durée d'impulsion
en présence de CaC12 lO ,uM.
I0 L'apparition de pronuclei après 3 ou 4 heures de culture sert
de marqueur pour l'activation parthénogénétique. Ces résultats mon~rent
clairement que l'activation parthénogénétique est déclenchée qaand le
milieu d'impulsion contient Ca~ lO IIM.
De plus, le taux d'activation est directement relié à la durée
15 de l'impulsion qui contrôle indirectement la stimulation par le calcium. La
durée des stimuli ioniques n'influence pas seulement le taux d'activation
mais aussi la configuration nucléaire des ovocytes parthénogénétiquement
activés d'age postovulatoire semblables.
Plus la durée d'impulsion est longue, plus la proportion d'oeufs
20 activés est élevée mais plus la proportion d'ovocytes contenant des
micronuclei est importante.
Groupe C - modulation des impulsions et type d'activation parthéno-
~; _ __ ______ _ __ __ ___ _ _ ,,
génétique.
Les résultats sont résumés dans le tableau 11. La relation entre
le type d'activation parthénogénétique et chaque traitement est égalernent
montrée dans le tableau 111. Quand la durée de l'impulsion est réduite, tous
les ovocytes sont activés et la majorité (91 %~ d'entre eux ont un
30 pronucleus unique et deux globules polaires quand la rnéiose est terminée.
Ainsi, la modulation des stimuli de calcium à travers la durée
de l'impulsion semble être effective et influence les premières étapes du
développement.
Dans cette étude, I'â~e des ovocytes était sirnilaire et ne peut
donc pas affec~er les résultats.
.
.~0 91/13977 PCr/FR91/00200
2~
Groupe D - Effet de la modulation de champ électrique sur le
..
5 développement in vitro d'ovocytes activés par parthénogénèse.
_ _ _ _ _ _, _ _ _ _ _ ,
Les résulta~s sont résumés dans le tableau 111. Aucune
différence visible dans le développemenl de chaque groupe n'a pu ê~re
notée jusqu'à la Iroisièrne division.
Dans les embryons parthénagénétiques produits par le
traitement 1, une proportion plus faible d'embryons présente une
compaction et ceux qui se compactent sont irréguliers. Par eontre, la
majorilé des embryons produits par le traitement 111 se compacte e~ se
développe jusqu'au stade de blastocyste.
Ces résultats montrent que la forme du stimulus d'activation a
un effet profond sur la capacité des embryons parthéno~énétiques à se
développer jusqu'au stade de blastocyste in vitro.
Viabilité post-implantation des oeufs parthénogénetiques diploldes.
2~
13 receveuses sont devenues gravides et ont été autopsiées -
entre le jour 8.5 et le jour 13. Les résultats sont résumés dans le tableau IV.
Bien que les embryons parthénogénétiques soient plus peti~s que les
embryons de contrôle, ils appa!aissent morphologiquement normaux selon
les critères définis pour le lapin. Le rapport entre la tail!e des annexes
embryonnaires et celle du foetus est grossièrement équivalent pour les
embryons obtenus par fécondation ou par parthéno~énèse.
Ainsi, il semble que le développement ~éneral des embryons
parthénogénétiques, le foetus et ses tissus trophoblastiques soit ralenti.
Les foetus morts ont plusieurs anomalies et il n'était pas
possible de les classifier.
~` :
.:
~ ~ 7 ~
.
~O ~1/13977 P~/FR91/00200
21
Tableau I -
Effet de la présence d'ions calcium et durée de l'impulsion électrique sur
l'activation des ovocytes de lapin
Durée Nomb-e Nombre % % d'ovocytes activés avec
d'impulsion d'ovocytes Iyses (%) activés I PN+PBI 2PN 2PN#
(~s) ~PB2 ~PB I -PB I
200 ~s 47 0 (0) 13 83 17 0
300 ~s 99 0 (0) 62 68 25 7
60011s 85 0 (0) 98 71 19~ 10
900 ~s 63 0 (0) 100 62 14 24
1 200 lls 97 5 ~5) 100 57.29 14
l 5 1 500 ~s 50 3 ~6) 100 30 l ~ 53
Tableau 2 - Effet de la modulation du champ électrique sur l'activation
TraitementNornbre % % ovocytes activés avec . i
d'ovocvtesactivation I PN+PBl 2PN 2PN#
~PB2 ~ PBI -PBl : :
1 86 88 83 9 8
11 15l 99 89 9
111 l 18 lO0 91 9 0
IV 96 lO0 70 25 5
# Pronuclei anormaux, petits micronuclei
i ~
,:
~VO 91/13977 2 a ~ /FR9l/002oo
22
Tableau 3 -
Effet de la modulation de champ électrique sur le développement d'oeufs
parthénogénétiques in vitro
Traitement Nombre ,6 Nombre Nombre Nombre
d'ovocytes activa_on cultivés !norulae blastocystes
compact (/0) (6)
98 91 69 25(36) 23 (33)
111 352 100 244 244(100) 216 (88)
Tableau 4 -
15 Developpement post-implantal:ion d'oeuis parthénogénétiques soumis au
traitement 111.
Jour de l'autopsie J 8-9 J 9-10 J10-11 J 12-13 Total
Nombre d'oeufs
~: transférés 21 26 50 68 165
,~
, Nombre d'implan-
tations 9 3 15 23 50
,
% cumulé (42,8) ~21,2) (27,8) (30,3)
.',
Nombre de foetus
- vivants 8 3 7 0 18
.
. ~ % cumulé (88,8) (91,6) (66,6) (36)
' : "
~;
.
.
'
: ' , ' ~ '' ~:
: .
3 8
,
/0 91/13977 PCr/FR91/00200
23
EXEMPLE 11
DEVELOPPEMENT PARTHENOGETIQUE
Des ovocytes fraIchement collectés (13 h après la saillie avec
un mâle vasectomisé) son; soumis à un traitement standard comprenant 22
impulsions tune tou~es les 4 minutes) et dont leur durée totale est égale à
22 47511s (référence de travail: lex 1370).
La concentration en calcium dans la solution dtimpulsion est
I'unique variable. Cinq valeurs ont été choisies: 10, 12, 14, 16, 18, 25l1M de
calcium. Le tableau ci-dessous récapitule les résultats. ;
'
__ Nb d~ N~ N~ Nb de ~ T~ Nb Nb ~au!~ Nb T~us Ta~
c~ um tr~nstor~ o-uh oouf~ r-c~ d~ d'oeuh d'im~ d'im- ~o~ to~ h~
1 5 par vw~ ~ sur 10~ plan- pl~n~ v~v~n~
~ 9~ t~on r~c~u ta~ian~ t~on
vau~o d~L$ s~
_ , _ _ __ q~d~ ~. .
1 011M 2 61 31 1 50~C 31 2 6% 1 3~/. 3Y.
1 2IJM 3 79 26 3 100~ 79 29 37Y~, 16 ~% 0%
1 4uM _ 4 90 23 4 1~% 90 28 31% 19 21% 7%
2 0 1 ~uM 7 89 13 ~ 86% 81 31 3~% 21 26YI, 23Yo
. . 1 8L~M 4 85 21 1 25Yo 3C'7 3 1 OY9 3 1 0Q~O 1 0Y,
20~YM 3 80 20 2 67% 49 9 18% 5 t 0!-~ o~
totat 2:~ ~ 4% 381~ 102 29% 6S 64Y~ ~3-S -
',
Sur un total de 23 transplantation, le taux de gestation global,
;~ 30 tous traitements confondus, est de 74 %. Parmi les receveuses qui sont
devenues gravides, le taux d'implantation enregistre au 1,5e jour de .-~
gestation (la durée de gestation chez la lapine est de 29 jours) est de 28 %.
-,
: .
- .,
78~
~0 91/13977 PCI /FIR91/00200
2l~
~; La présence de foetus a pu être observée dans 64 % des cas e~ 28 %
d'entre eux étaient encore vivants au moment cle l'autopsie. Ces résultats
globau~ sont nettement au-dessus des résultats obtenus par les méthodes
classiques: chez les souris, I'obtention de foetus à ~ll est très rare,
5Toutefois, le resultat le plus important réside dans l'effet de
la concentra~ion en calcium au moment des impulsions sur le dévelop-
~;~ pement post-implantatoire. La figure 2 montre clairement que les taux
d'implantation et de survie à Jll dépendent directement de ce paramètre.
Le développement optimum a été obtenu avec une concentration de 1611M.
lODans ce cas, nous avons obtenu un taux d'implantation record de 38 % (31
implantations sur 81 oeufs transplantés), dont 26 % de foetus. La
comparaison morphologique des différents foetus obtenus révèle que c'est
avec 16~M de calcium que les foetus ont la taille la plus grande.
Par ailleurs, nous avons observé que la presence de milieu de
ISculture résiduel dans la proportion de ItlOOOO en plus des 1611M de calcium
est capable de modifier considérablement le développement car les annexes
embryonnaires se développent mais les foe~us sont pratiquement inexis-
tants.
Les paramètres de lavage doivent donc permettre de limiter la
20présence de milieu de culture résiduel au moment des impulsions. La
présence de milieu résiduel augmente le nombre d'espèces ioniques
susceptibles de pénétrer dans l'ovocyte au moment de l'électroperméabi-
.Iisa~ion de la membrane.
''; ~'
2 5 EXEMPLE 111
ACTIV~TION DE L'OVOCYTE DE~ SC)URIS FRAICHEMENT OVULE
: ~Des ovocytes de souris fraîchement ovulés (l2 h post HCG)
30 sont soumis à des traitements comprenant 33 impulsions, une toutes les 4
minutes durant 2 heures i2 minutes.
~: '
' ::~
'~
~, .,
:
`-j 2~78138
,~Cl3 91~13977 25 PCr~FR91~00200
Les ~raitements sont menés pour des concen~ra~ions en
calcium dans la solution d'impulsion valant successivement 4~3M, 8~3M, 12~3.~,t,et 1 6u~1 et pour des durées d'impulsions ~ariables.
Les dvnamiql.3es de formation du pronucleus peuvent ê~re
5 contrôlées en fonction de la concentra~ion en calcium dans la solution
d'impulsion et la durée tota'3e des impulsions électriques (Vitullo, Ozil.
-: 1991) .
: , ~ .
," , , .
~"1
~ :
~.;" , ~, ~',~ '~ ,
~: , ~ ~ ` _
,i,~. ~ ~
~'~-' ~ ,
~ : ::
';.':.': ~ ", :' ` ~
',:, ~ ' ~ ''
~.~i ~ ~ ,
.~ < : ~ ~
': ' ' . : . .: , '
2~7~3~ ~
. .
~0~1~13977 PCr/FlR9~/û0200 .
26
REFERENCES
Basset, C.~. and Hermann~ 196~). The effec~ of electros~a~ic flelds on
macromolecular synthesis by fibroblast in vitro. J. Cell Biol. 39.9A.
Cuthbertson, K.S.R. Whittingham, D.G. ~ Cobbold, P.H. (1981). Free Ca2^
increases in exponential phases during mouse oocyte activation. Nature 294,
754-757.
Cuthbertson, K.S.R. ~ Cobbold, P.H. (1985). Phorbol ester and sperm
activate mouse oocytes by inducing sustained oscillations in cell Ca2,
Nature 316, 541-542.
Cuthbertson, K.S.R. ~1983). Parthenogenetic activaTion o$ mouse oocytes in
vitro with ethanol and benzyl alcohol. J. Exp. Zool. 226, 311-314.
Igusa.Y. ~c Miyazaki, S.l. (1983). Effect of alterated extracellular and
intracellular calcium concentration on hyperpolarizing responses of the
hamster egg. J. Physiol. 340 611-632.
Igusa.Y. ~ Miyazaki. S.l. (1986) Periodic increase of cytoplasmic free
calcium in fertilized hamster eggs measured with calcium-sensitive
electrodes. ~. Physiol. 377, 193-205.
Jaffe, F.L. (1977). Electrophoresis along ceil membranes. Nature 265,600-
602.
Kaufman, M.H., Barton, S.C. ~ Surani, M.A.H. (1977). Normal postirnplanta-
tion development of mouse ~parthenogenetic embryos to the foreliab bud
stage. Nature 265, 53-55.
Kaufman, M.H. (1983). Early mammalian development: parthenogenetic
studies. Cambridge Unlversity Press.
,
. . . . .
:~ . .
, . - : :.
.
2 0 ~ g
~VO 9t/13977 PC~/FR91/00200
27
Kennelly, J.J. ~i Foote, R.H. (1965). ~uperovulatory response of pre- and
post-puberal rabbits to commercially available gonadotrophins. J. Reprod.
Fer~. 9il77-1~8.
~lann, J.R. ~ I ovell-badge, R. (1986). Inviability of par~henogenones is
determined by pronuclei, not egg cytoplasm. Na~ure 310, 66 67.
,~lcCulloh, D.H., Rexroad. C.E. Jr ~ Levitan H. (1983). Insemination of
rabbit eg8 is associated with slow depolarization and repetilive diphasic
membrane potentials. Devi. ~iol. 95 372-377.
~'
~lcGrath, J. ~c Solter, D. (1984). Completion of mouse embryogenesis
requires bo~h maternal and paternal genomes. Cell 37, 179-163.
Ménézo.Y. (1976). Mise au point d'un rnilieu artificiel défini pour la survie
et la matura~ion des gamètes et pour la culture de l'oeuf fécondé. C.r.
hebd. Séanc. Acad. Sci. Paris, 282, 1967-1970.
" .
Miyazaki, S.l. Igusa, Y. ~ 1982). Ca-mediated activa~ion of a K current at
f ertilization of golden hamster eggs.
Proc. natn. Acad. Sci. USA. 79, 931-935.
: `:
Miyazaki, S.l. Hashimoto, N. Yoshirnoto, Y. Kishimoto, T., igusa9 Y., dc
Miramoto, Y. (1986). Temporall and spatial dynamics of the periodic
25 increase in intracellular free calcium at fertilization of golden hamster
eggs. Devl. Biol. 118, 259-267.
Miyazaki, S.l. (1988). Inositol 1,4,5. Triphosphate-induced calcium release ~i
and nucleotide-binding protein-media~ed periodic calcium rises in golden ~ ;
harnster eggs. J. Cell. Biol. 106, 345-353.
.,
`~ Ozil J.P. ~c Modlinsky, J. (1986). Effects of elec~ric field on fusion ans
survival of 2-cell rabbit embryos. J. Embryol. exp. Morph. 96, 211-228.
,' :
, ~ ,, .
~ :
0 7 8 ~
,VO 91/13977 PCT/FR91/0~201)
Rodan. G.A., Bourret. L.A. ~ ,~lorton, L.A. (1978). DNA Synthesis in cartilage
cells is stimulated by oscillating electric fields. Science 199, 690-692.
Rossignol, D.P., Decker, G.L, Lennarz. \X.J., Isong, T.Y., ~ Teissié, J. (19~3).5 Induction of calcium-dependant, localized cortical granule breakdown in
sea-urchin eggs by voltage pulsation Biochim. biophys. Acta. 763, 346-355.
Smi~h, L.C. ~ Wilmut, 1. (1989). Influence of nuclear and cytoplasmic
activity on the developement in vivo of sheep embryos after nuclear
transplantation. Biol. Reprod. 40, 1027-1035.
Stice S.L. ~ Robl. J.M. (1988). Nuclear reprogramming in nuclear transplant
rabbit embryos. Biol. reprod. 39,657-664.
15 Surani, M.A.H. ~ Barton, S.C. (1983). Developement of gynogenetic eggs in
the mouse. Implication for pa rthenogenetic embryos. Science 222,
1 034- 1 036.
Surani, M.A.H., E~arton S.C. ~ Norris, M.L. ~1984). Developmenr of
20 reconstituted mouse eggs suggests imprinting of the genome during
gametogenesis. Nature 308, 548-550.
Swann, K., Igusa, Y. ~ Myayazaki9 S.l. (1989). Evidence for an inhibitory
effect of proteine kinase C on G-protcin-mediated repetitive calcium
2 5 transients in hamster eggs. The EMBO journal vol. 8, N 12 in press.
Vitullo A, Ozil J.P. ( 1991). Publication en préparation.
Ware, C.B.7 ~arnes, F.L.Maiki-Laurila, M., ~c First, N.L. ( l 989). Age
30 dependance of bovine oocyte activation. Gamete. res. 22, 265-275.
~' .
,'
- .
-
2~7~
" .
~0 91/13977 P(~/FR91/00200
Whittingham, D.G. (1971). Culture of mouse Ova. J. reprod. Fert. Suppl. 14.
7-21.
5 Willadsen9 S.M. (1986). Nuclear transplantation in sheep embryons. ,~lature
320, 63-65.
'immermann, U. (1982)~ Electric field-media~ed fusion and rela~ed
electrical phenomena. Biochim. Biophys. Acta. 694 227-277.
I O ~ . -
Il
~'
o
, ~' , ' ' ' '.
~ ~ .
.~ :-.
.
, : -
-, : , .. :
. .
' . . ' :