Note: Descriptions are shown in the official language in which they were submitted.
2~3~
Nouveau~ dérivés triazole et imidazole fongicides.
I.a présente invention concerne de nouveaux
composés à groupement triazole ou imidazole à usage
phytosanitaire. Elle concerne également les procédés de
préparation de ces composés et les composés éventuellement
utilisables comme intermédiaire dans les procédés de
préparation. Elle concerne enfin l'utilisation ~ongicide de
ces composés, les compositions fongicides à base de ces
composés et les procédés, pour lutter contre les maladies
fongiques des cultures, utilisant ces composés. Elle
concerne également un produit de multiplication des plantes
cultivées qui a subi un traitement de protection par un
produit de l'invention.
Un des buts de la présente invention est de
proposer des composés présentant une activité améliorée dans
le traitement des maladies fongiques.
Un autre but est de proposer des composés
présentant un spectre d'utilisation également amalioré dans
le domaine des maladies fongiques.
De nombreux produits à groupes triazole, notamment
des fongicides, sont déjà connus. En particulier, par les
demandes de brevets publiées EP 151084, EP 246982, EP
121979, EP 89100 on connait des fongicides triazoles à cycle
tétrahydrofuranne. Par les demandes de brevets publiées EP
272895, EP 267778, EP 378953, DE 3630840, BE 867245 on
2~ connait des fongicides triazoles à cycle cyclopentane. Par
la demande de brevet publiée EP 324646 et les brevet US
4684396, on connaît dPs ~ongicides triazo]es à groupe
cycloalcane.
D'autres composés triazole ou imidazole fongicides
sont décrits dans la littérature brevets. Cartain triazoles
ou imidazoles à groupe cyclopropyl sont connus par les
demandes de brevets publiées BE 886128, EP 40345, EP 47594,
EP 52424, EP 143384, EP 180136, EP 180B38, EP 212605 et DE
3909862,
2~3~
Certains triazoles oll imidazoles à groupe oxirane sont décrits dans les demandes
de brevets publiées EP 251086 et DE 3819053 .
Ainsi compte tenu de cet état de la technique, on but de la présente
invention est de proposer d'autres composés tria~oles ou imidazoles fongicides alarge spectre utiles hotamment dans le traitement des maladies du pied comme
le piétin verse ou de la feuille comme l'oidium, la septoriose, la piriculariose, les
fusarioses, la rhynchosporiose, le rhizoctone, des maladies provoquées par les
champignons pathogènes tels que E~otrytis, Phoma, Aschochyta, dans les
cultures aussi diverses que les céréales, la vigne, le riz, le mais et le soja par
exemple.
n a été maintenant trouvé que les buts précités pouvaient être atteints
grâce aux composés selon l'invention, qui sont de nouveaux dérivés à groupe
triazole ou imidazole et à groupe oxirane ou cyclopropyl, éventuellement
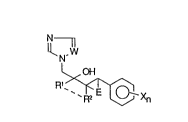
substitué. Ces composés ont pour formule générale VII:
N 1
N ( VII
- ' R1~
dans laquelle:
Rl représente un radical alkyle de 1 à 4 atomes de carbone, linéaire ou
ramifié; cycloalkyle de 3 à 6 atomes de carbone; alkylidène, hydroxyalkyle,
carboxyalkyle de l à 4 atomes de carbone, ces radicaux étant éventuellement
substitués par un ou plusieurs atomes d'halogène; aryle, choisi dans le groupe
comprenant phényle, naphtyle, éventuellement substitué par un ou plusieurs
groupes choisis panru halog~ne, nitro, cyano, amino, alkyle ou alkoxy de l à
atomes de carbone éventuellement substitués par un ou plusieurs atomes
k~ ~
. ,
d'halogène, alkylamino, la partie alkyle ayant de 1 à 4 atomes de carbone
éventuellement substitués par un ou plusieurs atomes d'halogène; aralkyle, dont
la partie alkyle possède de 1 à 4 atomes de carbone, linéaire ou ramifié et dontla partie aryle est dé~lnie comme ci-dessus;
S
R2 représente un radical alkyle ou perhalogénoalkyle de 1 à 4 atomes
de carbone, linéaire Oll ramifié, ou un atome d'halogène, de préférence chlore ou
fluor, lorsque E est autre qu'un atome d'oxygène;
R1 et R2, ensemble, peuvent former un radical - (cH2)3 -, - ~CH2)4 -,
- (CH2)s -, conduisant ainsi à un cycle à S, 6 ou 7 atomes de carbone, cycle
dont chaqlle hydrogène peut éventuellement être substitué par un radical choisi
dans le groupe comprenant les atomes d'halogène, les radicaux alkyle, de 1 à 4
atomes de carbone, linéaire ou ramifié, éventuellement substitués par un ou
plusieurs atomes d'halogène;
-W est un radical CH ou l'atome d'azote;
-E représente un atome d'oxygène ou un radical CH2;
-X représente un atorne d'halogène F, Cl, Br; un radical alkyle, de 1 à 4
atomes de carbone, linéaire ou ramifié, éventuellement substitués par un ou
plusieurs atomes d'halogène; alkylamino, la partie alkyl ayant de 1 à 4 atomes
de carbone éventuellement substitués par un ou plusieurs atomes d'halogène;
alcoxy de 1 à 4 atomes de carbone éventuellement substitués par un ou plusieurs
atomes d'halogène; phénoxy ou benzyloxy éventuellement substitué par un ou
plusieurs halogènes; nitro; cyano;
2s -n est un entier égal à 1, 2, 3, 4 ou 5, avec, quand cet entier est
supérieur ou égal à 2, la possibilité que les groupements X ne soient pas
identiques.
L'invention concerne également les formes salifiées des composés ci-
dessus dé~lnis.Les formes salifiées sont les fonnes acceptables en agriculture
panni les~uelles on pellt citer les chlorhydrates, les sulfa~es, les oxalates, les
ni~ates ou les alkyl- ou aryl-sulfonates ainsi que les complexes d'addition de ces
composés avec des sels métalliques, et notamment des sels de fer, chrome,
cuivre, manganèse, zinc, cobalt, étain, magnésium et aluminium.
Les composés de l'invention et les composés éventuellement utilisables
à titre d'intermédiaires dans les procédés de préparation, et qui seront définis à
I'occasion de la description de ces procédés, peuvent exister sous une ou
plusieurs formes d'isomères selon le nombre de centres asymétriques de la
molécule. L'invention concerne donc aussi bien tous les isomères optiques que
leur mélanges racémiques et les diastéréoisomères correspondants, séparés ou en
mélange. La séparation des isomères optiques et/ou des diastéréoisomères peut
s'effectuer selon des méthodes connues en soi.
Parmi les composés de l'invention, on préfèrera en vue des applications
fongicides ceux pour lesquels W est l'atome d'azote, donc les composés
triazoles.
De façon encore plus avantageuse, on choisira des composés ~iazoles
ayant un groupe oxirane ou cyclopropane.
Finalement, les composés avec ~ qui représente un halogène, de
préférence le chlore, Rl qui est un groupe propyle ou butyle, linéaire ou
ramifié, et R2 qui est un radical méthyl ou éthyl, ou avec Rlet R2 formant
ensemble un cycle à 5 ou 6 atomes de carbone, constituent un groupe de
composés préférés parmi les composés de l'invention à groupements triazoles et
oxirane ou cyclopropane.
L'invention concerne également i'utilisation préventive ou curative des
composés ci-dessus définis comme fongicides ainsi que les compositions
fongicides. Les composés de l'invention peuvent être utilisés en traitement
foliaire, en traitement de sol ou, vu l'absence de phytotoxicité, en traitement de
semences.
L'invention concerne également un procédé de traitement des cultures
atteintes ou susceptibles d'etre atteintes par les maladies fongiques caractérisé en
ce l'on applique sur les feuilles une dose efficace d'un composé de l'invention.Les composés s'appliquent avantageusement à des doses de 0,002 à 5
kg/ha, et plus spécifiquement de 0,005 à 1 kg/ha.
2 ~ 3
L'invention concerne en outre un produit de multiplication des plantes
cultivées qui a subi un traitement de protection avec un composé ~le l'invention.
S On désigne par produit de multiplication toutes les parties génératives
de la plante que l'on peut utiliser powr la multiplication de celle-ci.On citera par
exemple les graines (semence au sens étroit), les racines, les fruits, les
tubercules, les bulbes, les rhizomes, les parties de tige, les plants, pousses et
autres parties de plantes.On mentionnera également les plantes germées et les
jeunes plants qui doivent être transplantés après ~ermination ou après sortie deterre.Ces jeunes plants peuvent être protégés avant la transplantation par un
traitement total ou partiel par immersion.
En général, les composés seront appliqués à raison de 0,1 à 500 g par
quintal de graines.Les graines subiront alors un traitement avec les composés
selon l'invention par pelliculage ou enrobage.Les brevets US 3989501 et FR
2588442 décrivent de telles forrnes d'application.
La pr~sente invention a également pour objet des procédés de
préparation des composés selon l'invention ainsi que les composés
éventuellement utilisables à titre d'intermédiaires dans les procédés de
préparation.
Un premier ensemble de proc~dés, dont on donne le schérna A ci-après,
fait intervenir les composés intermédiaires de forrnules II, III, rv, v, VI, VIII,
I~, dans lesquelles les swbstituants W, E, R1, R2, X et n ont la même
2s signification que dans la formule générale V~I ci-dessus.
2~
SCHEMA REACTIONNEL A
o O
R'~ HO J~
I X,~CHO I (IIr)
O O
R~ ~ Xn ~ CI
1S a~
R' '~ R
~5 ~-~i N -~
I 1'
r N
(IX)
~` N ~//
~ OH
R~ (Vll)
s~
Le procédé consiste à condenser une cétone de formule générale (I)
R'~
(1)
avec un aldéhyde de formule:
.
Xn~ CHO
en présence d'une base telle que les hydroxydes de métaux alcalins ou
alcalino-terreux, alcoolates de métaux alcalins, hydrure de sodium, amidures de
Iithium, ou d'un acide tel que l'acide sulfurique, acétique, chlorhydrique,
bromhydrique, p-toluènesulfonique, méthanesulfonique dans un solvant comme
un alcool C1 à Cs ou un éther ou un hydrocarbure aromatique, au moyen de la
réaction bien connue d'aldolisation-crotonisation de façon à obtenir le composé
de formule (II)
o
F~l'
(II)
de façon générale, les cétones de forrnule (II), dans lesquellesR1 et R2
forment ensemble un cycle, peuvent être obtenues selon les mé~hodes décrites
danslademande publiée EP 378 953. Elles peuvent etre
en particulier obtenues par reaction d'un aldéhyde
de formule:
,.
2~3~2~
avec un anhydride de formule (R2C~-12CO)20 et le sel de sodium ou
potassium de l'acide carboxylique correspondant R2CH2CO2H selon la réaction
S de Perkin décrite dans Org. React. 1, 251 (1942) pour obtenir un dérivé de
l'acide cinnamique de formule (III)
O
(III)
Le composé (III) est transformé en chlorure d'acide (IV)
O
C
(IV)
à l'aide de chlorure de thionyle, trichlorure de phosphore, pentachlorure
de phosphore, chlorure d'oxalyle ou du complexe triphénylphosphine - -
tétrachlomre de carbone.
La cétone (II) est ensuite obtenue par:
- couplage du chlorure d'acide (IV) avec un organomagnésien R1MgCI
ou un organozincique R12Zn dans un solvant tel que l'éther ou le
tétrahydrofurane avec un intervalle de température de -78 à -~25C en l'absenceou en présence de cuivre et de chlorure cuivreux selon la méthode décrite dans
la littérature (J. E. Dubois, M. Boussu, Tetrahedron Lett. 1970, 2523).
- couplage du chlorure d'acide (IV~ avec l'énolate de lithium, de sodium
2s ou de potassium de la butyrolactone dans le THF, suivi d'une extrusion de
dioxyde de carbone en présence de LiCI, LiBr, NaCI ou NaBr dans un solvant
tel que le dimethylsulfoxyde, N,N-dimethylformamide ou N-méthyl-2-
pyrrolidinone à une température comprise entre l'ambiante et le reflux du
solvant selon la méthode décrite dans la littérature (S. Takei, Y. Kawano,
Tetrahedron Lett.1975, 4389).
S - couplage du chlorure d'acide (IV) avec le dianion lithié de l'acide
carboxyliqlle RlCOOH (à condition que Rl possède au moins un atome
d'hydrogène) dans un solvant tel que le tetrahydrofurane ou l'éther suivi d'un
traitement acide décarboxylant. selon la méthode décrite dans la littérature (P.E. Pfeffer, L. S Silbert, J. M. Chirinko, J. Org. Chem. 1972, 37, 451)
- couplage de l'amide de manière en soi connue à partir du chlorure
d'acide par réaction avec une amine, de préférence secondaire, avec un
organomagnésien ou organolithien, come décrit par S.M.Weinreb et al,
Tetrahedron Letters, 1981, vol 22, pp 3815-3818.
Le composé de formule (II) est mis à réagir avec un ylure de
sulfoxonium, de formule (CH3)2S(O)=CH2, obtenu par action d'une base telle
qu'un alcoolate de métal alcalin, NaH, ou les hydroxydes de métaux alcalins sur
un halogénure, par exemple de l'iodure de trimethylsulfoxonium ((CH3)3SO+,
I-) dans un solvant tel q,ue le dimethylsulfoxyde, la N,N-dimethylformamide, la
N-methyl-2-pyrrolidinone, l'acétonitrile, ou un mélange de ces solvants avec de
I'alcool tert-butylique ou de l'alcool tert-amylique dans un rappo~t 50:50 à
90:10. à une température comprise entre 20 e~ 100C pour obtenir le composé
de formule (V). Le composé de formule (TI) peut être également mis à réagir
avec du peroxyde d'hydrogène ou de l'hydroperoxyde de tert-butyle en présence
d'une base telle qu'un hydroxyde de métal alcalin dans un mélange eau-alcool
Cl-Cs dans un intervalle de température compns entre 0C et le reflux du
solvant pour obtenir le composé de formule (V)
lo
2~3~3
R~
tv)
s Ledit composé (V) est mis à réagir avec un ylure de sulfonium, de
formule (CH3)2S=CH2, obtenu par action d'une base telle que les hydroxydes
de métaux alcalins, NaH, les alcoolates de métaux alcalins sur ((CH3)3S+,X-)
(X = Cl, Br, I, CH3SO4) dans un solvant tel que le dimethylsulfoxyde, la N,N-
dimethylformamide, la N-methyl-2-pyrrolidinone, l'acétonitrile ou un mélange
dichlorométhane-eau ou toluène-eau à une température comprise entre -10c et
~S0C pour obtenir un oxirane de formule (VI)
~,0
Rt~ `~`Xn
(VI)
Cet oxirane peut également être obtenu en faisant réagir un halométhyl-
lithien sur le composé de formule ~V) comme décrit dans Bull. Soc. Chim. de
France 1986, vol 3, pp 470-477.
L'oxirane (Vl) est mis à réagir avec un hétérocycle azoté de ~ormule
générale
~0
f~ N~N
N 11
en présence de bases telles que NaH, les hydroxydes de métaux
alcalins, les alcoolates de métaux alcalins, les carbonates de sodium ou de
2s potassium dans un solvant comme la N-méthyl-~-pyrrolidinone, la N,N-
dimethylformamide, le diméthylsulfoxyde, les alcools en C1-Cs, les nitriles
dans un intervalle de température compris entre +25C et le reflux du solvant,
your obtenir un composé de formule (VII):
r-l
~N'
n
(VII)
Les composés de formule (VII) peuvent également être obtenus à partir
du composé (II) comme décrit dans le brevet EP-378953-A par réaction avec un
ylure de sulfonium, de formule (CH3)2S=CH2, obtenu par action d'une base
telle que ]es hydroxydes de métaux alcalins, NaH, les alcoolates de métaux
alcalins sur ((CH3)3S+,X-) (X = Cl, Br, I, CH3SO4) dans un solvant tel que le
dimethylsulfoxyde, la N,N-dimethylformamide, la N-methyl-2-pyrrolidinone,
l'acétonitrile ou un mélange dichlorométhane-eau ou toluène-eau à une
ternpérature comprise entre -10c et +50C pour obtenir un oxirane de formule
~VIII)
~0
R~
(VIII)
~o Ledit oxirane est mis à réagir avec un hétérocycle azoté de formule
générale
Nll
.
2 ~ 3
en présence de bases telles que NaH, les hydroxydes de métaux
alcalins, les alcoolates de mé~aux alcalins, les carbonates de sodium ou de
potassium dans un solvant comme la N-méthyl-2-pyrroli(linone, la N,N-
dimethylforrnamkle, le diméthylsulfoxyde, les alcools en C1-Cs, les nitriles
S dans un intervalle de température compris entre +25C et le reflux du solvant,
pour obtenir un composé de forrnule (IX)
N l
l~N.W
R ~''C` X
(~)
Dans le cas où E est CH2, le composé de formule (IX) est soumis à une
réaction de cyclopropanation du type Simmons Smith (cf Organic Reactions,
1973, vol 20, p 1-131) avec un dihalogénométhane, de préférence diiodo ou
dibromo. Une variante consiste à réaliser la réaction sous ultra-sons comme
décrit dans Tetrahedron Letters, 1982, vol 23, pp 2729-2732 ou selon la
demande br;tannique 2 191 774.
Dans le cas où E est un atome d'oxygène; le composé de fonnule (IX)
est soumis à une oxydation avec de l'acide méta-chloro perbenzoique ou de
l'hydroperoxyde de tert-butyle dans un solvant tel que les solvants halogénés, les
hydrocarbures pour obtenir le composé selon l'invention de formule (VII).
Un second ensemble de procédés, dont on donne le schéma B ci-après,
fait intervenir les composés intermédiaires de forrnules X, XI, XII et XIII, dans
lesquelles les substituants W, E, Rl, R2, X et n ont la même signification que
2s dans la formule générale VII ci-dessus et:
- R3 représente un atome d'halogène, de pré~érence de chlore ou de
brome, ou un groupe Y-R4, d~ns lequel Y représente un atome de d'oxygène, de
13
- 2~3~3
soufre ou d'azote et R4 représente un atome d'hydrogène, un radical alkyle
linéaire ou ramifié de 1 à 4 atomes de carbone, cycloalkyle de 3 à 6 atomes de
carbone, phényle ou napthyle, éventuellement substitué par 1 à 5 substituants
choisi dans le groupe comprenant un atome d'halogène, amino, alkyle ou alkoxy
S de 1 à 4 atomes de carbone, ou encore phénylalkyle ou naphthylalkyle, dont la
partie alkyle comprend de I à 4 atomes de carbone. Dans le cas où Y est un
atome d'azote, il porte en plus de R4 un second substituant, identique ou
différent de R4 et pouvant ~voir les mêmes significations.
- R'3 représente un atome d'halogène(identique à R3, quand R3 est un
atomed'halogène), ou
-un sel de sulfonium ou de sulfoxonium, de préférence C1-C4
alkylsulfonium ou C1-C4 alkyl sulfoxonium, lorsque Y est un atome de soufre,
- un sel d'ammonium(de préférence Cl-C4 alkylammonium ),
lorsque Y est Ull atome d'azote ou
- un groupe alkyl(de préférence méthyl)sulPonate, phényl(de
préférence tolyl)sulfonate ou naphthylsulfonate, halogénoalkylcarbonyloxy(de
préférence trifluoromethylcarbonyloxy), lorsque Y est un atome d'oxygène.
IJes composés de formule X, dans laquelle R3 est un a~ome d'halogène
peuvent être préparés par réaction d'un composé de formule II et d'un
halomethyllithien selon la méthode décrite dans Bull. Soc. Chim. Fr.19~6, pp
470-477.
Les composés de formule X, dans laquelle R3 est le grollpe YR4
2s peuvent ê~re préparés par réaction d'un composé de formule II et d'un composé
HYR4, selon la snéthode décrite par Advanced Organic Chemistry Mc Graw
Hill Inc. J. March.
Les composés de formule X, dans laquelle R3 est le groupe YR4, dans
lequel Y est un atome de soufre, peu~ent être préparés par réaction d'un
composé de forrnule II et d'un alkyl(ou aryl) thiomethyllithien selon la méthodedécrite dans J. Or~,. Chem., 1985, vol 95, pp 3429-3431.
2 ~ 3
Les composés de ~orrnule X, dans laquelle R3 est le groupe hydroxyle,
peuvent être préparés par réaction d'un composé de formule II avec le
paraformaldéhyde selon la méthodc décrite dans Tetrahedron Letters, 1992, vol
48, pp 2069-2080.
Les composés de formule XI peuvent être préparés par réaction selon
une réac~ion de cyclopropanation du type Simmons Smith tcf Organic
Reactions, 1973, vol 20, p 1-131) avec un dihalogénométhane, de préférence
diiodo Oll dibromo. Une variante consiste à réaliser la réaction sous ultra-sonscomme décrit dans Tetrahedron Letters, 1982, vol 23, pp 2729-2732 ou selon la
demande britannique 2 191 774. Dans le cas où ~3 est un groupe SR4, dans
lequel R4 est un radical alkyle linéaire ou ramifié de 1 a 4 atomes de carbone ou
cycloalkyle de 3 à 6 atomes de carbone, on obtient directement à partir des
composés de formule X, des composés de formule XII, dans laquelle ~'3
représente un halogénure (de pré~érence un iodure) de méthylsulfonium
Les composés de fonnule ~II, dans laquelle R'3 est un groupe
alkylsulfonate, phénylsulfonate ou naphthylsulfonate, ou
halogénoalkylcarbonyloxy peuvent être obtenus à partir d'un composé de
formule XI, dans laquelle R3 est le groupe hydroxyle, selon la méthode décrite
par Advanced Organic Chemistry Mc Graw Hill Inc. J. March.
Les composés de formule XI peuYent être obtenus directement à partir
d'un composé de formule X, dans laquelle R3 est le groupe hydroxyle, ou à
partir d'un composé de forrnule XI, dans laquelle ~3 est un groupe alkoxy ou
aryloxy selon les mé~hodes connues, en particulier par action de l'iodure de
trimethylsilyle comme décrit dans Silicon Reagents for Organic Synthesis, W.P.
2s Weber, 19~3, Springer Yerlag.
Les composés de forrnule XIII peuYent être obtenus des composés de
formule XII, par action d'une base telle qu'un hydroxyde alcalin, l'hydrure de
sodium ou un alcoolate alcalin dans un sol~lant tel que le dimethylsulfoxyde, leN,N-dimethylformamide, la N- methyl-2-pyrrolidone, l'acetonotrile, à une
température de -10C à ~ 60~C.
2, ~
SC~IEMA REACTIONNEL B(en configuration relative)
~,,OH
R ~ (X)
R~
I~,IOH
R~ .
~R2 ~n
~, IOH
Rl.~n (X~l)
,
~ O
R ~
~n
i~,N
OH
Rl~ (VII)
R~ n
16 "~ 3~
Les composés de formule VII, dans laquelle E est le groupe méthylene,
peuvent etre obtenus a partir des composés de ~ormule XIII selon la même
méthode que celle décrite précédemment à partir des composés de formule VI.
Les exemples ci-après sont donnés ~ titre d'illustration des composés
S selon l'invention, de leurs procédés de préparation et de leurs propriété
antifongiques.
Exemple 1_: Préparation dll 1-(4-chloro~vl)-2~4-dimethvl-3-one-pent-1-ène
Du chlorure d'hydro~ène est mis à barbotter dans un mélange de 100ml
de 2-méthyl-3-pentanone, 113g de 4-chlorobenzaldéhyde et 400ml d'éthanol
~jusqu'a saturation. La température de la solution est maintenue à 60C pendant
8h. Le mélange est ensuite versé dans 11 d'eau et extrait avec 500ml d'éther
diisopropylique. La phase organique est lavée avec 250ml de soude à 10%, puis
avec 250ml de solution saturée de chlorure de sodium et séchée sur sulfate de
sodium. Après évaporation, 167g de liquide brun sont obtenus.
1S Rdt = 93%.
Exemple 2: Préparation du 1-(4-chlorophenvl)-2-methvl-2-(2-methvl-1-one-1-
propyl!-cyclopropane
A une suspension de 61,3g d'hydmre de sodium dans 200ml de NMP
chauffée à 50C, sont ajoutés 185ml d'alcool tert-amylique de manière à avoir
un dégagement d'hydrogène régulier. La solution obtenue est refroidie à 25C et
176g d'iodure de trimethylsulfoxonium solide sont ajoutés, suivis d'une solutionde 162g de 1-(4-chlorophenyl)-2,4-dimethyl-3-one-pent-1-ène dans 250ml de
NMP. Le mélange résultant est chauffé ~ 60C pendant 30mn. Le produit
obtenu est laissé dans le milieu réactionnel pour l'étape suivante.
2s
Exçmp]e ~: Préparation du t-(4-chlorophenyl)-2-methvl-2-(2-methvl-1-
oxirane- I -propvl!-cyclopropane
A la solution précédemment obtenue ss)nt ajoutés lSlg de
méthylsulfate de trimethylsulfonium dans 200ml de NMP à 25C. Après 30mn,
la réaction est finie. Le composé obtenu est laissé dans le milieu réactionnel
pour l'étape suivante.
';'
17
~3~3
Exemple 4: Préparation du 1-(4-chlorophenyl)-2-methyl-2-(2-methyl-1-
hydroxy-1-(1,2,4-triazol-1-ylmethyl)-1-propyl)-cyclopropane (composés n 3 et
4).
A la solution précédemment obtenue, est ajoutée une solution de
triazolyl sodiurn obtenue en mélangeant 60,5g de 1,2,4-triazole et 70g de soude
à 50% dans 500ml de NMP. Le mélange réactionnel est chauffé à 130C
pendant 8h. Le mélange est ensuite versé dans 21 d'eau et extrait avec 2 X 750mld'éther. La phase organique est lavée avec 21 d'eau puis avec 500ml de solution
aqueuse saturée de chlorure de sodium et séchée sur sulfate de sodium. Le brut
est purifié par chromatographie sur silice avec heptane 60-acétate d'éthyle 37-
éthanol 5. 14,Sg de diastéréoisomère A (F = 121-composé 4) et 16,3g de
diastéréoisomère B (F = 141-composé 3) sont obtenus.
Exemple 5: Pré~aration du 2-(4-chlorophenyl!-4-(1.2.4-triazol-1-vlmethvl)-4-
ol-(2~5!-oxa-spirQQ-ç~ m-~2Qs-~n~a
IS Un mélange de ~g de 2-(4-chlorobenzylidène)-1-(1,2,4-triazol-1-
ylmethyl)-cyclopentan-1-ol et 14,8g d'acide m-chloroperbenzoique dans 50ml
de dichloromethane est agité pendant 3h à température ambiante. 200rnl d'eau
sont ensuite ajoutés et extraits avec 3 X 100ml de dichloromethane. La phase
organique est lavée avec une solution de carbonate de potassium. La phase
organique est séchée sur sulfate de sodium et évaporée. Le résidu est cristallisé
dans de l'éther diisopropylique pour obtenir 6g de solide blanc (F = 150,5C)
Rdt = 63%
. _ _ __ ~
. R1 R2 W E ~ F (C)
Composé n
_ r _ ~ _. __
1- (dia ~) iPr Me N C~122,4-diCI 147
. _
2- (dia A) iPr Me N CH22,4-diCI 145
3- (dia B) iPr Me N CH2 4-CI 141
4- (dia A) iPr Me N CH2 4-Cl 121
_
5- (dia B) iPr Me N O 4-CI 152
.
~ 18
~X~
:
6- (dia A)iPr ¦ M e N O 4-CI 175
7 -(CH2)4- N O 4-CI 150
8 -(CMe2CH2-CH2)- N O 4-CI 143
9- (dia B) 'tB u Et N C H 2 4-CI 117
10- (dia A?tB u Et N CH2 4-CI 100
. 11- (dia B)iPr Et N CH2 4-CI 131
12- (dia A)iPr Et N CH2 4-CI 109
13- t2 dia)-(CMe2CH2-CH2)- N CH2 4-CI 113
1 4 (dia A)(C H M eC H 2-C H 2-C H 2) N C H 2 4-C1 183
. _
15- (dia A)-(~H2)4- N CH2 4-CI 165
16- (dia B)-(CH2)4- N CH2 4-CI 150
_ _ . _
: 17- (dia A) -(~H 2)5- N CH2 4-Cl 119
_ _ _ .
18- (dia B) -(C H 2)5- N CH2 4-Cl 124
_
19- (dia A)-(C H M eC H 2-C H 2)- N C H 2 4-CI 128
., . .
20- (dia B)-(CHMeCH2-CH2)- N CH2 4-Cl 155
21- (diaC)-(CHMeCH2-CH2)- N CH2 4-CI 157
.
22- (diaB)-(CHMeCH2-CE~2)- N CH2 4-CI 114
23- (dia C)-(C H M eC H 2-C H 2)- N C H 2 4-CI 161
. _._ _ .
24- (diaD) -(CHMeCH2-CE~2)- N CH2 4-CI 179
-(CH2)3- N CH2 4-Cl 123
~, . _ ._. . . . .
. . S
l()
2 ~
Exemple 6: Pré~aration d~l 2-(-4-chlorobenzvlidene)-5-methyl-1-
tmehtylthiome~yl~çyçlopentanol;
Dans un ballon de 500ml équipé d'une ampoule de coulée isobare de
100ml et d'une agitation magnétique, on introduit sous argon 69ml (0,011 mole)
de n-butyllithium 1,6M. On refroidit le balon dans un bain de glace avant de
couler successiYernent 16,6 ml(0,11 mole) de tetramethylethylene diamine puis,
après lS mn, 8,1 ml (0,11 mole) de dimethylsulfure.
Après 3 heures d'agitation à température ambiante, le ballon est refroidi
10 à -70C, avant de couler 20g (0,09 mole) de 2-(4-chlorobenzylidene)-5-
methylcyclopentanone dissoute dans 100 ml de tetrahydrofurane sec.
.
Après une demi-heure, à -70,C, on introduit dans le ballon Sg de
chlorure d'ammonium puis 80 ml d'éther éthylique. La solution est alors
15 hydrolysée avec 200 ml d'eau saturée en chlorure d'ammonium, extraite avec 2
~ois 60 ml d'éther. Les phases organiques sont lavées, avec 3 fois 80 ml d'eau
saturée en chlorure de sodium puis séchées sur sulfate de magnésium.
On recueille, après élimination des solvants,2S g( rendement brut
20 :98%) de 2-(4chlorobenzylidene) S-methyl-l-(methylthiomethyl) cyclopentanol,
sous la forme d'une huile visqueuse jaune clair présentant 2 diastéréoisomères
dans les proportions 70/30.
Exemplç ?; Préparation de l'io~lure de (1-(4 chlorophenyl)-~-methyl
spiro(2~0,,hçpl,a~-4-ol)-4-Yl dimethy.l sulfQn ~lm!.
2s Dans un ballon de 250 ml équipé d'un réfrigérant, d'une ampoule de
coulée ;sobare et d'une agitation mécanique, on introduit sous azote 1 lg (0,168at.g) de zinc en poudre dans 60 ml de glyme sec. Le ballon est alors introduit
dans une cuve sous ultrasons(modèle Branson*2200) pendant lh 30mn avant
d'introduire rapidement 13,5g(0,048 mole) du composé préparé à l'exemple 6,
30 dilué dans 10 ml de glyme. Ensuite, sous ultrasons, on coule gout~e à goutte à
45C, 13,7 ml~0,170 mole) de diiodomethane dilué avec 10ml de glyme. On
* mar~ue de commerce
2i~3~2~
note une exothermie import~mte de 10 à 15C pendant l'introduction du
diiodométhane. Le mélange est maintenu 5 h, sous ultrasons, à 55C.
Après avoir laissé la température revenir à l'ambiante, on ajoute 100ml
d'acétate d'ethyle avant d'hydrolyser avec 150 ml d'une solution d'eau saturée en
S chlorure (I'ammonium. La phase aqueuse est extraite avec 3 fois 70 ml d'acétate
d'ethyle. Les phases organiques rassemblées sont lavées, avec 3 fois 80 ml d'eausaturée en chlorure de sodium, séchées sur sulfate de magnésium et concentrées.
On recueille 35g d'une huile visqueuse jaune clair, qui est triturée avec
un mélange 50/50 d'ether éthyliquetéther diisopropylique et conduit à un
précipité beige très hygroscopique. Apr~s séchage à 40C on obtient 18g
(rendement: 87%)d'une masse sous forme d'une meringue blanche fondant à
78C.
- Exemple 8: Préparation (lu (1-(4-chlorophenyl)-4~ -1.2.4-triazolvl-
I-ylmethvl)-5-methvl spiro(2~4! heptan-4-ol)(composé 19 et 21):
Dans un ballon de 500 ml équipé d'un réfrigérant, d'une ampoule de
coulée de 100 ml et d'une agitation mécanique, on introduitl60 ml de
dimethylformamide sec puis 1,64 g(0,04 mole) d'hydrure de sodium à 60% dans
I'huile. On ajoute 7,64 g(0,084 mole) de triazolyl-sodium préparé et dilué dans
40 ml de climethylformamide.
Le milieu est alors chauffé à 85C pendant 3 heures. Après avoir laissé
la température revenir à l'ambiante, le milieu est hydrolysé et traité comrne à
l'exemple 4~
On obtient ainsi, après élimination des solvants, 10,5g d'un résidu
visqueux brun, qui, par chromatographie sur colonne de silice(éluant:chlorure
de methylene/methanol 98/2), conduit à 5,9g d'un mélange des composés 19 et
21 dans les proportions 30n0(rendement global: 41%)
Le composé 21 est obtenu par recristallisation du mélange précédent
avec le binaire acétate d'éthyle/éther diisopropylique. Point de fusion: 157C.
Les composés 2, 4, 10, 12, 16, 17, 22, 24, et 25 peuvent être également
21
2 ~
obtenus selon ce procédé.
Ex~mple 9: Test in vivo sur Botrvtis cinerea(pourritllre grise) sur
feuille excisée cle tomate(souches sçnsible5 e~ r~si~"n~_~nux bçnz!mi~azolç~
On préparç, par broyage fin, une suspension aquellse de la matière
active à tester ayant 1~ composition suivante:
- matière active: 60 mg
- a~ent tensioactif Tween 80, (oléate de dérivé polyoxyéthyléné du
sorbitan) dilué à 10% dans l'eau: 0,3 ml
- on complète à 60 ml d'eau pour obtenir une suspension/solution à 1
g/l
Cette suspension aqueuse est ensuite éventuellement diluée par de l'eau
pour obtenir la concentration désirée en matière active.
Des tomates culitvées en serre~variété Marmande agées de 30 jours
sont traitées par pulvérisation avec des suspensions aqueuses telles que définies
ci-dessus et à diverses concentrations du composé à tester.
Des plants, utilisés comme témoins sont traités par une solution
aqueuse ne contenant pas la matière active.
Au bout de 24 heures les feuilles sont coupées et mises dans une boîte
de Pétri (dia~mètre 14 cm), dont le fond a été préalablement garni d'un disque de
papier filtre humide (10 folioles par boîte).
L'inoculum est ensuite apporté à l'aide d'une seringue par dépôt de
gouttes (3 par foliole) d'une suspension de spores de Bot~ytis cinçrea., sensibles
aux benzimidazoles ou résistantes aux benzimidazoles, obtenue à partir de
cultures de 15 jours, mises ensuite en suspension à raison de 1~0 000 unités parcm3
Le contrôle est fait S jours après la contamination en comparaison avec
un témoin non traité.
13ans ces condi~ions, on observe, à la dose de 1 g/l, une protection
bonne ( au moins 75%) ou totale avec les composés 1, 3, 4, 5, 6, 7, 8, 10, 12,
13, 16, 17, 19, 22 et23 contre les souches de Botrytis sensibles aux
benzimidazoles.
2~3~3
xemple 10: Test in yiv~-s~-r-pxr-~c~ r~ orvzae re~onsable de la piriclllariose
du riz :
On prépare, par broyage fin, une suspension aqueuse de la matière
S active à tester ayant la composition suivante:
- matière active: 60 mg
- agent tensioactif Tween 8û, (oléate de dérivé polyoxyéthyléné du
sorbitan) dilué à 10% dans l'eau: 0,3 ml
- on complète à 60 ml d'eau pour obtenir une suspension/solution à 1
g/l.
Cette suspension aqueuse est ensuite éventuellement diluée par de l'eau
pour obtenir la concentration désirée en matière active.
Du riz, semé en godets dans un mélange 50/50 de tourbe enrichie et de
pouzzolane, est traité au stade 10 cm de hauteur par pulvérisation de la
suspension aqueuse ci dessus.
Des plants, uLilisés con~ne témoins sont traités par une solution
aqueuse ne contenant pas la matière active.
Au bout de 24 heures, on applique sur les feuilles une suspension
aqueuse de spores de Pvricularia Qrvzae, obtenues à p~rtir d' une culture de 15
jours, mises ensuite en suspension à raison de 100 000 unités par cm3.
- Les plants de riz sont placés pendant 24 heures en incubation (25C,
100% d'humidité relative), puis mis en cellule d'observation, dans les mêmes
conditions, pendant 5 jours.
2s La lecture se fait 6 jours après la contamination.
Dans ces conditions, on observe, a la dose de 1 g/l, une protection
bonne (au moins 75%) ou totale avec les composés 2, 3, 4, 5, 6, 8, 10, 11, 12,
- 13,14,16,17, 19,21,22,23et24.
~3~
Exemple 11: Tçst in vivo sur Ervsi~he graminis sllr or~e (o-idium de l'orge~: -
On prépare, par broyage fin, une suspension aqueuse de la matière
active à tester ayant la composition suivante:
- matière active: 60 mg
s - agent tensioactif Tween* 80, (oléate de dérivé polyoxyéthyléné du
sorbitan) dilllé à 10% dans l'eau: 0,3 ml
- on complète à 60 ml d'eau pour obtenir une suspension/solution à 1
g/l.
Cette suspension aqueuse est ensuite éventuellement diluée par de l'eau
pour obtenir la concentration désirée en matière active. :
De l'orge, en godets, semée sur un substrat tourbe terre pouzzolane
50/50, est traitée au stade 10 cm de hauteur par pulvérisation de la suspension
aqueuse ci dessus.
Des plants, utilisés comme témoins sont traités par une solution
aqueuse ne contenant pas la matière active.
Au bout de 24 heures, on saupoudre les plants d'orge avec des spores
d'Ervsiphe graminls, le saupoudrage étant effectué à l'aide de plants malades.
La lecture se fait 7 à 14 jours aprés la contamination, en comparaison
avec les plants témoins.
Dans ces conditions, on observe, à la dose de 1 gJI, une protec~ion
bonne (au moins 75%) ou totale avec les composés 1, 2, 4, S, 6, 8,10, 12, 13,
16, 19, 20, 21, 22, 23 et 24.
Exemple 12: Test in vivo sur Puccinia recondita (rouille du blé):
On prépare, par broyage fin, une suspension aqueuse de la matière
2s active ~ tester ayant la composition suivante:
- matière active: 60 mg
- agent tensioactif Tween*~0, (oléate de dérivé polyoxyéthyléné du
sorbitan) dilué à 10% dans l'eau: 0,3 ml
- on complète à 60 ml d'eau pour obtenir une suspension/solution à 1
g/l.
* margue de commerce
24
2~93~3
Cette suspension aqueuse est ensuite éventuellement diluée par de l'eau
pour obtenir la concentration désirée en matière active.
Du blé, en godets, semé sur un substrat tourbe terre pouzzolane 50/50,
S est traité au stade 10 cm de hauteur par pulvérisation de la suspension aqueuse
ci dessus.
Des plants, utilisés comme témoins sont traités par une solution
aqueuse ne contenant pas la matière active.
Au bout de 24 heures, une suspension aqueuse de spores (100000
sp/cm3~ est pulvérisée sur le blé; cette suspension a été obtenue à partir de plants
contaminés. On place ensuite le blé pendant 24 heures en cellule d'incubation à
environ 20C et à 100% d'humidité relative, puis pendant 7 à 14 jours à 60%
d'humidité relative.
Le contrôle de l'état des plants se fait entre le 8ème et le lSème jour
après la contamination, par comparaison avec un témoin non traité.
Dans ces conditions, on observe, à la dose de 1 g/l, une protection
bonne (au moins 75%) ou totale avec les composés suivants 1, 3, 4, 6, 7, 8, 9,
10,11,12 13, 16, 22, 23, et 24.
Ces résultats montrent clairement les bonnes propriétés fongicides des
dérivés selon l'invention contre les maladies des plantes dues à des champignonsappartenant aux familles les plus diverses telles que les Phycomycètes, les
Basidiomycètes, les ascomycètes, les adelomycètes ou fungi imperfecti, en
particulier les Botrytis sp., Piricularia oryzae, les oidium(Erysiphe sp.) les
rouilles( Puccinia sp.), le mildiou de la vigne.
2s Pour leur emploi pratique, les composés selon l'invention sont rarement
utilisés seuls. Le plus souvent ces composés font partie de compositions. Ces
compositions, utilisables comme agents fongicides, contiennent comme matière
active un composé selon l'invention ~el que décrit précédemment en mélange
avec les supports solides ou liquides, acceptables en agriculture et les agents
tensio-actifs également acceptables en agriculture. En particulier sont utilisables
les supports inertes et usuels et les agents tensio-actifs usuels. Ces compositions
2s
2 3 ~
.
font également partie de l'invention.
Ces compositions peuvent contenir aussi toute sorte d'autres ingrédients
tels que, par exemple, des colloides protecteurs, des adhésifs, des épaississants,
des agents thixotropes, des agents de pénétration, des stabilisants, des
séquestrants, etc.. Plus généralement les composés utilisés dans l'invention
peuvent être combinés à tous les additifs solides ou liquides correspondant aux
techniques habituelles de la mise en formulation.
D'une façon générale, les compositions selon l'invention
contiennent habituellement de 0,~5 à 95 % environ (en poids) d'un composé
selon l'invention (appelé par la suite matière active), un ou plusieurs supportssolides ou liquides et, éventuellement, un ou plusieurs agents tensioactifs.
Par le terme "support", dans le présent exposé, on désigne une
matière organique ou minérale, naturelle ou synthétique, avec laquelle le
composé est combiné pour faciliter son application sur la plante, sur des graines
ou sur le sol. Ce support est donc généralement inerte et il doit être acceptable
en agriculture, notamment sur la plante traitée. Le support peut être solide
(argiles, silicates naturels ou synthétiques, silice, résines, cires, engrais solides,
etc...) ou liquide (eau, alcools, notamment le butanol etc...).
L'agent tensioactif peut être un agent émulsionnant, dispersant ou
mouillant de type ionique ou non ionique ou un mélange de tels agents
tensioactifs. On peut citer par exemple des sels d'acides polyacryliques, des sels
d'acides lignosulfoniques, des sels d'acides phénolsulfoniques ou
naphtalènesulfoniques, des polycondensats d'oxyde d'éthylène sur des alcools
gras ou sur des acides gras ou sur des amines grasses, des phénols substitués
2s (notamment des alkylphénols ou des arylphénols~, des sels d'esters d'acidessulfosucciniques, des dérivés de la taurine (notamment des alkyltaurates), des
esters phosphoriques d'alcools ou de phénols polyoxyéthylés, des esters d'acidesgras et de polyols, les dérivés à fonction sulfates, sulfonates et phosphates des
composés précédents. La présence d'au moins un agent tensioactif est
généralement indispensable lorsque le composé et/ou le support inerte ne sont
pas solubles dans l'eau et que l'agent vecteur de l'application est l'eau.
~3~
Ainsi donc, les compositions à usage agricole selon l'invention
peuvent contenir les matières actives selon l'invention dans de très larges
limites, allant de 0,05 % à 95 % (en poids). Leur teneur en agent tensio-actif est
avantageusement coMprise entre 5 % et 40 % en poids.
s Ces compositions selon l'invention sont elles-mêmes sous des
formes assez diverses, solides ou liquides.
Comme formes de compositions solides, on peut citer les poudres
pour poudrage (à teneur en composé pouvant aller jusqu'à 100 %) et les
granulés, notamment ceux obtenus par extrusion, par compactage, par
imprégnation d'un support granulé, par granulation à partir d'une poudre (la
teneur en cornposé dans ces granulés étant entre 0,S et 80 % pour ces derniers
cas), les comprimés ou tablettes effervescents.
Les composés de formule (I) peuvent encore être utilisés sous
forme de poudres pour poudrage; on peut aussi utiliser une composition
i5 comprenant 50 g de matière active et 950 g de talc; on peut aussi utiliser une
composition comprenant 20 g de malière active, 10 g de silice finement divisée
et 970 g de talc; on mélange et broie ces constituants et on applique le mélangepar poudrage.
Comme formes de compositions liquides ou destinées à
constituer des compositions liquides lors de l'application, on peut citer les
solutions, en particulier les concentrés solubles dans l'eau, les concentrés
émulsionnables, les émulsions, les suspensions concentrées, les aérosols, les
poudres mouillables (ou poudre à pulvériser), les pâtes, les gels.
Les concen~és émulsionnables ou solubles comprennent le plus
souvent 10 à 80 % de matière active, les émulsions ou solutions prêtes à
l'application contenant, quant ~ elles7 0,001 à 20 % de matière active.
~n plus du solvant, les concentrés émulsionnables peuvent
contenir qu~nd c'est nécessaire, 2 à 20 % d'additifs appropriés comme les
stabilisants, les agents tensio-actifs, les agents de pénétration, les inhibiteurs de
corrosion, les colorants ou les adhésifs précédemrnent cités.
:
2~3~2~
A partir de ces concentrés, on peut obtenir par dilution avec de
l'eau des émulsions de toute concentration désirée, qui conviennent
particulièrement à l'application sur les cultures.
A titre d'exemple, voici la composition de quelques concentrés
émulsionnables:
Ex~mple CE l:
- matière active 400 g/l
- dodécylbenzène sulfonate alcalin 24 g/l
- nonylphénol oxyéthylé à 10 molécules
d'oxyde d'éthylène 16 gtl
- cyclohexanone 200 g/l
- solvant aromatique q.s.p.1 Iitre
- Selon une autre formule de concentré émulsionnable, on utilise:
Exemple CE 2
- matière active 250 g
- huile végétale époxydée 25 g
- mélange de sulfonate d'alcoylaryle et
d'éther de polyglycol et d'alcools gras 100 g
- dimé~hylformamide 50 g
- xylène 575 g
.
Les suspensions concentrées, également applicables en
pulvérisation, sont préparées de manière à obtenir un produit fluide stable ne se
déposant pas et elles contiennent habituellement de 10 à 75 % de matière active,2s de 0,5 à 15 % d'agents tensioactifs, de 0,1 à 10 % d'agents thixotropes, de 0 à 10
% d'additifs appropriés, comme des anti-mousses, des inhibiteurs de corrosion,
des stabilisants, des agents de pénétration et des adhésifs et, comme support, de
I'eau ou un liquide organique dans lequel la matière active est peu ou pas soluble
: certaines matières solides organiques ou des sels mineraux peuvent ê~e dissousdans le support pour aider à ermpêcher la sédimentation ou comme antigels pour
l'eau.
2~3~23
A titre d'exemple, voici une composition de suspension
concentrée:
Exem~le SC 1:
S - matière active 500 g
- phosphate de tristyrylphénol polyéthoxylé 50 g
- alkylphénol polyéthoxylé 50 g
- polycarboxylate de sodium 20 g
- éthylène glycol 50 g
- huile organopolysiloxanique (antimousse~ 1 g
- polysaccharide 1,5 g
- eau 316,5 g
Les poudres mouillables (ou pouclre à pulvériser) sont
habituellement préparées de manière qu'elles contiennent 20 à 95 % de matière
active, et elles contiennent habituellement, en plus du support solide, de 0 à 30
% d'un agent mouillant, de 3 à 20 % d'un agent dispersant, et, qu~nd c'est
nécessaire, de 0,1 à 10 % d'un ou plusieurs stabilisants etlou autres additifs,
comme des agents de pénétration, des adhésifs, ou des agents antimottants,
colorants, etc
- Pour obtenir les poudres à pulvériser ou poudres mouillables, on
mélange intimement les matières actives dans les mélangeurs appropriés avec
Ies substances additionnelles et on broie avec des moulins ou autres broyeurs
appropriés. On obtient par là des poudres à pulvériser dont la mouillabilité et la
mise en suspension sont avantageuses; on peut les mettre en suspension avec de
l'eau à toute concentration désirée et ces suspensions sont utilisables trés
avantageusement en particulier pour l'application sur les feuilles des végétaux.A la place des poudres mouillables, on peul réaliser des pâtes.
Les conditions et modalités de réalisation et d'utilisation de ces pâtes sont
semblables à celles ~les poudres mouillables ou poudres à pulvériser.
A titre d'exemple, voici diverses compositions de poudres
2 ~ 2 3
mouillables (ou poudres à pulvériser):
Exem~le PM I
- matière active 50%
- alcool gras éthoxylé (agent mouillant) 2,5%
- phényléthylphénol éthoxylé (agent dispersant) 5%
- craie (support inerte) 42,5%
Exemple PM 2:
- matière active 10%
- alcool synthetiqlle oxo de type ramifié, en
C13 éthoxylé par 8 à 10 oxyde d'éthylène
(agent mouillant) 0,75%
- lignosulfonate de calcium neutre (agent
dispersant) 12~o
- carbonate de calcium (charge inerte) q.s.p. 100 %
Exem~le PM 3:
Cette poudre mouillable contient les mêmes ingrédients que dans
l'exemple précédent, dans les proportions ci-après:
- matière active 75%
- agent mouillant 1,50%
- agent dispersant 8%
- carbonate de calcium (charge inerte) q.s.p. 100%
Exemple PM 4:
- matière active 90%
- alcool gras éthoxylé (agent mouillant) 4%
- phényléthylphénol éthoxylé (agent dispersant) 6%
~me~k~:
- matière active 50%
- mélange de tensio-actifs anioniques et
non ioniques (agent mouillant) 2,5%
- lignosulfonate de sodium (agent dispersant) 5%
- argile kaolinique (support inerte) 42,5%
30 2~3~2~
Les dispersions et émulsions aqueuses, par exemple les
composilions obtenues en diluant à l'aide d'eau une poudre mouillable ou un
concentré émulsionnable selon l'invention, sont comprises dans le cadre général
S de la présente invention. Les émulsions peuvent être du type eau-dans-l'huile ou
huile-dans-l'eau et elles peuvent avoir une consistance épaisse comme celle
d'une "mayonnaise".
Les composés selon l'invention peuvent être forrnulés sous la
forme de granulés dispersibles dans l'eau également compris dans le cadre de
I'invention.
Ces granulés dispersibles, de densité apparente généralement
comprise entre environ 0,3 et 0,6 ont une dimension de particules généralement
comprise entre environ 150 et 2000 et de préférence entre 300 et 1500 microns.
l,a teneur en matière active de ces granulés est généralement
comprise entre environ 1 % et 90 %, et de préférence entre 25 % et 90 %.
Le reste du granulé est essentiellement composé d'une charge
solide et éventuellement d'adjuvants tensio-actifs conférant au granulé des
propriétés de dispersibilité dans l'eau. Ces granulés peuvent être essentiellement
de deux types distincts selon que la charge retenue est soluble ou non dans l'eau.
Lorsque la charge est hydrosoluble, elle peut être minérale ou, de préférence,
organique. On a obtenu d'excellents résultats avec l'urée. Dans le cas d'une
charge insoluble, celle-ci est de préférence minérale, comrne par exemple le
kaolin ou la bentonite. Elle est alors avantageusement accompagnée d'agents
tensio-actifs (à }aison de 2 à 20 % en poids du granulé) dont plus de la moitié
2s est, par exemple, constituée par au moins un agent dispersant, essentiellemen~
anionique, tel qu'un polynaphtalène sulfonate alcalin ou alcalino terreux ou un
lignosulfonate alcalin ou alcalino-terreux, le reste étant constitué par des
mouillants non ioniques ou anioniques tel qu'un alcoyl naphtal~ne sulfonate
alcalin ou alcalino-terreux.
Par ailleurs, bien que cela ne soit pas indispensable, on peut
ajouter d'autres adjuvants lels que des agents anti-mousse.
3, ,~ 3
Le granulé selon l'invention peut être préparé par mélange des
ingrédients nécessaires puis granulation selon plusieurs techniques en soi
connues (drageoir, lit fluide, atomiseur, extrusion, etc...). On termine
généralement par un concassage suivi d'un tamisage à ln d;mension de particule
S choisie clans les limites mentionnées ci-dessus. On peut encore utilisé desgranulés obtenus comme précédemment puis imprégnés avec une composition
contenant la matière active.
De préférence, il est obtenu par extrusion, en opérant comme indiqué
dans les exemples ci-après.
Exemple G~l: C1ranul~s ~lispersibles
Dans Ull melangeur, on mélange 90 % en poids de matière active
et l0 % d'orée en perles. Le mélange est ensuite broyé dans un broyeur à
broches. On obtient une poudre que l'on humidifie avec environ 8 % en poids
d'eau. La poudre humide est extrudée dans une extrudeuse à rouleau perforé. On
obtient un granulé qui est séché, puis concassé et tamisé, de façon à ne garder
respectivement que les granulés d'une dimension comprise entre 150 et 2000
microns.
Exemple GD2: Granulés dispersibles
Dans un mélangeur, on mélange les constituants suivants:
- matière active 75%
- agent mouillant (alkylnaphtalène sulfonate de sodium) 2%
- agent dispersant (polynaphtalène sulfonate de sodiom) 8%
- charge inerte insoluble dans l'eau (kaolin) 15%
2s Ce mélange est granulé en lit fluide, en presence d'eau, puis
séché, concassé et tamisé de manière ~ obtenir des granulés de dimension
comprise entre 0, lS et 0,80 mm.
Ces granulés peuvent être utilisés seuls, en solution ou dispersion
dans de l'eau de m;mière a obtenir la dose cherchée. Ils peuvent aussi être
utilisés pour préparer des associations avec cl'autres matières actives, notamrnent
fongicides, ces dernières étant sous la forme de poudres mouillables, ou de
~3~23
granulés ou suspensions aqueuses.
En ce qui concerne les compositions adaptées au stockage et au
transport, elles contiennent plus avantageusement de 0,5 à 95 % (en poids) de
substance active.
I,'invention a également pour objet l'utilisation des composés selon
l'invention pour la lutte contre les maladies fongiques des plantes par traitement
préven~if ou curatif de ces dernières ou de leur lieu de croissance.