Note: Descriptions are shown in the official language in which they were submitted.
W O 93/02095 2 1 ~ 3 ~ 7 5 PCT/FR92/00697
NCUVEWUX STSgDIDES sussTITuEs EN PosITqoN 6
IEURS PFCCEDES D~cET9NTIoN ET
DES ooMpo6ITqoos EHuRr~cEunIQuEs EN FEN}E~aNT
La présente invention se rapporte au domaine de la chimie et pluspartic~lièrement à celui de la chimie thérapeutique.
Elle a plus précisément pour objet de nouveaux dérivés stéro'~diens,
substitués en position 6 ainsi que leurs procédés d~obtention.
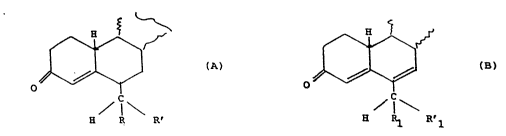
Elle a spécifique~ent pour objet des 19-nor pregnanes substitués enposition 6 choisis dans le groupe constitué par :
- les 3-céto ~4- l9-nor pregnènes substitués en position 6 répondant àla formNle partielle A
(A)
o4~\~
H Rl R'
dans laguelle R représente un radical hydroxy, un acyloxy, un alcoxy,
un hal~gène ou un alcoyle inférieur
R' représente un hydrogène, un halogène
ou bien R et R' fonment ensemble l'oxygène d'une fonction carbonylée
et
- les 3-ceto 19-nor ~4,6-pregnadiènes substitués en position 6
répondant à la formule partielle B
~ C ~
H ~ R'1
FEUILLE DE REMPLACEMENT
W O 93/02095 ~ 3 4~ 5 PCT/FR92/00697
-- 2 --
dans laquelle Rl représente un hydrogène, un halogène, un hydroxyle, un
alcoxy, un acyloxy ou un alcoyle inférieur
R'1 représente de l'hydrogène ou un halogène
ou bien Rl et R'l forment ensemble l'oxygene d'une fonction carbonylee
avec la restriction que R1 et R'l ne sont pas en même temps de
l'hydrogène ou un atome d'halogène.
Dans les deux formwles partielles A et B, les autres cycles du noyau
stéroidien ne sont pas figurés. Ils sont ceux d'un pregnane et peuvent
porter une chaine latérale en 17~_du type oxoalcoyle ayant de 2 à 8
atomes de carbone ou hydroxyalcoyle ayant de 2 à 8 atomes de carbone ou
acyloxyalcoyle ayant de 2 a 8 atomes de carbone. La position 17o-peut
comporter un hydrogène, un hydroxyle libre, estérifié ou alcoylé ayant
de 1 à 3 atomes de carhone, un halogène ou un radical alcoyle inférieur
saturé ou non saturé.
La position 16 peut également porter un méthyle, un éthyle, un
methylène ou être engagée dans une double liaison carbone-carbone avec
le carbone 17 ou le carbone 15.
La position 11 peut porter un hydroxyle, l'oxygène d'une fonction
cétone ou un radical méthylène.
Parmi les composés de formule partielle A, on citera tout
particulièrement les composés pour lesquels
" " R
CH
~ R'
représentent un groupe formyle, un groupe hydroxyméthyle, un groupe
acyloxy méthyle, un groupe dihalogénométhyle ou un groupe
alcoxyméthyle.
Parmu les composés de formule partielle s, on citera ceux pour lesquels
le groupe
R'
--R
représente un hydroxy méthyle, un méthoxy méthyle, un halogénométhyle,
un formyle, un alcoyle inférieur ou un dialcoxymethyle.
FEUILLE DE REMPLACEMENT
W O 93/0209~ 2 1 1 3 4 7 5 PCT/FR92/0069/
On citera tout particulierement parmi ces composés, les 19-nor pregna
4-ène 6-hydroxy methylés qui sont les composés actuellement préferé~
répcndant à la fonm~le parti~lle C
~ (C)
C~
dans laquelle le trait pointillé symbolise une double liaison
évent~elle en 6-7.
En l'absence de double liaison, le groupe hydroxyméthyle peut être
Qrienté QU ~.
Ces pregnanes peuvent comporter un hydroxyle ou un alcoyle en 17a et
une chaine oxoalcoyle ou hydroxyalcoyle, linéaire ou ramifiée, en
positiQn 17~.
L'invention comprend aussi le~ dérivés 6-methyléniques de formule
partielle D
~ (D)
qui ont é~é jusqu'ici décrits comme intermédiaires de synthèse pour des
lg-nor pregnanes 6-méthylés (cf. brevet britannique 1.515.441)
L'invention se rapporte specifiquement en tant que nouveaux composes
aux dérivés suivants :
FEUILLE DE REMPLACEMENT
W O 93/0209~ PCT/FR92/00697
~ 4 -- -
- le 3,20-dioxo 6-formyl 17a-acetoxy 19-nor pregna 4-ène
- le 3,20-dioxo 6-difluorométhyle 17o-acetoxy 19-nor pregna 4-ène
- le 3,20-dioxo 6-acetoxyméthyl 17o-acetoxy 19-nor pregna 4,6-diène
- le 3,20-dioxo 6-methoxyméthyl 17o-acetoxy 19-nor pregna 4,6-diène
- le 3,20-dioxo 6-hydroxymethyl 17o-hydroxy 19-nor pregna 4,6-diene et
son acétate en 17
- le 3,20-dioxo 6-difluoromethyl 17o-acetoxy 19-nor pregna 4,6-diène
- le 3,20-dioxo 17o-aceloxy 6-chloro~éthyl l9-nor pregna 4,6-diene
- le 3,20-dioxo 6-tosyloxymethyl 17o-acetoxy l9-nor pregna 4,6-diène
- le 3,20 dioxo 6-fonmyl 17o~actoxy 19-nor pregna 4,6-diène
- le 3,20-dioxo 6-hydroxymethyl 17o-méthyl 19-nor pregna 4,6-diène
- le 3,20-dioxo 6-éthyl 17o~hydroxy 19-nor pregna 4,6-diène et son
acétate
- le 3,20-dioxo 6-propyl 17o-hydroxy l9-nor pregna 4,6-diène et son
acétate
Les composes selon 1'invention manifestent des propriétés
pharmacologiques interessantes et notamment des propriétés
progestromimetiques puissantes. Ils trouvent de ce fait, un emploi
comme medicament progestatif dans le traitement ou la prévention des
syndromes liés à la menopause tels que bouffées de chaleur,
perturbations cutanées, troubles circulatoires.
A cette fin, ils sont utilisés sous forme de eQmpositions
pharmaceutiques destinées à l'administration par voie parentérale,
digestive, rectale, penmuqueuse ou percutanée. Ils seront donc
présentés sous forme de solutés ou de suspensions injectables
conditionnés en ampoules, seringues auto-injectables ou flacons
mLlti-doses ; sous forme de comprimes nus ou enrob~s, de dragées, de
capsules, de gélules, de pilules, de cachets, de poudres, de
suppositoires ou de capsules rectales ; de solutions ou de suspensions
pour l'usage percutané dans un solvant polaire ; de crèmes, de gels ou
de pommades ; et enfin, de suppositoires.
Pour l'usage thérapeutique, les composés selon l'invention sont
administres à une dose variant de 20 à 50 mg et de préférence de 5 à
25 mg par dose unitaire. ~a posolo~ie journalière s'échelonne de 5 à
200 mg par jour en fonction de l'indication thérapeutique et de la voie
d'administration.
FEUILLE DE REMPLACEMENT
W O 93/0209~ 21 i 3 ~ 7 5 PCT/FR92/00697
L'invention concerne également un procedé pour produire les composés de
formLle ~
,~7
~ (A)
o
/ l\
H ~ R'
d~ns laquelle R et R' sont définis comme précédemment
qui consiste en ce que l'on soumet un ether d'énol de formNle générale
II
~o ~f
dans laquelle ~ est un radical alcoyle inférieur
à l'action d'un agent de fonmylation du type Vislmeier-Hack pour former
le dérivé Ç-formylé correspondbnt (III)
l ¦ (III)
R~/ ~i/
CHO
dans laquelle ~ a la signification antérieure
. que l'on peut réduire par action d'un hydrure mixte de metal alcalin
FEUILLE DE REMPLACEMENT
, , . . ~ ~ . .... .. ~ . . . .. .
W O 93/0209~ A ~ PCT/FRg2/00697
-- 6 --
pour former le dérivé hydroxyméthyle correspondant ~IV)
~ ( (IV)
R2 '
dans laquelle R2 est defini com~e précédemment
puis soumet celui-ci à une alcoylation suivie d'une hydrolyse acide
pour obtenir un dérivé alcoxyméthylé de formule V
(V)
0~\~/
tans laquelle R3 est un radical alcoyle inférieur éventuellement
substitué
ou à une acylation suivie d'une hydrolyse acide pour obtenir le dérivé
acyloxyméthylé de formule générale VI
a~c
dans laquelle Ac représente le reste acyle d'un acide organique
carboxylique aliphatique, aromatique, hétérocyclique ou cycloalcoyl
carboxyli~ue ayant de 1 à 10 atomes de carbone
ou à une acylation par un dérivé fonctionnel d'un acide facilement
labile, puis soumet celui-ci à une mono ou dihalogénation par action
d'un fluorure de métal alcalin pour former un dérivé halogéné de
structure
FEUILLE DE REMPLACEMENT
W O 93/0209~ PCT/FR~2/00697
`. 21i3/17~
~lf r
ou a une dé~hydratation en milieu acide pour former un dérivé
methylidinique de formule VIII
~ . ¦ (VIII)
0//\~ \1~
Pour former les ~ osés pcur lesquels ~' représente de l'hydr~gène et
R représente un radical alcoyle in~érieur
on fait réagir le dérivé formylé III avec un sel d'alcoylm~tal comme un
halogenure d'alccyl magnésium, un halogenure d'alcoyl. zinc ou un
halogénure d'alcoyl cadmium pour former le carbinol correspondant que
lton traite en milieu agueux acide pour obtenir le dérive
alcoylidénique correspondant puis isomerise à l~aide d'un metal noble
ccmme le palladium, en dérive 6-a1coy1é.
LsinventiQn co~eerne égal~ment un proc~de d~obtention des composés de
formule partielle B qui consiste en ce que l~on soumet un éther
énolique de fonmule partielle rv
(IV)
CH2 OH
FEUILLE DE REMPLACEMENT
W O 93/0209~ PCT/FR92/00697
3 ~ ~
dans laguelle R2 est un radical alcoyle in~érieur
à l'action d'un agent de déshydroqenation quinonique dans un solvant
inerte miscible à l'eau pour former après destruction de l'excès de
reactif, un derivé hydroxy m~thyle de formule partielle c
~ (C)
~ OH
que l'on peut alcoyler par action d'un agent d'alcoylation, en dérivé
alcoyloxy methyle
ou estérifier par action d'un derivé fonctionnel d'acide organique
carboxylique pour former un dérive acyloxylé
ou convertir en dérivé halogéné par conversion en premier lieu en ester
reactif du dérivé hydroxy méthylé puis transfor~ation de cet ester en
dérivé halogené par action d'un halogenure de metal alcalin dans un
solvant polaire.
Dans le procede selon l'invention, l'agent déshydrogénant quinonique
est de preférence la dibromcdicyanobenzoquinone, le choranil, la
dichloronaphtoquinone ou la dichlorodicyano benzoquinone.
L'ester reactif est de préference un methane sulfonate, un p.toluène
~ulfonate ou un trifluoramethylsulfonate. L'halogénure de metal alcalin
est de préférence le fluorure de sodium ou de potassium, ou le chlorure
de sodium en présence d'un acétate de metal alcalin. Le solvant polaire
est la pyridine, le dimethylform2mide ou le diethyl acétamide.
Les derivés dihalogenomethyles sont obtenus par un procédé qui consiste
à faire réagir le derivé formylé de formule partielle III avec un
halogénure de dihalogénosulfonium comme le DAST (diéthylAminosulfur
trifluoride).
Les exemple suivants illustrent l'invention sans toutefois la limiter.
FEUILLE DE REMPLACEMENT
~VO 93/0209~ 2 ~ 1 3 ~ ~ ~ PCT/FR92/00697
EXEMPLE I
ALETo~Y-17~ DIoWD-3,20 Elopyla~6 NOR-l9 PREGNADIENE-4,6
Dans un ballon on introduit sous azote 24 g (57,9 mM) d'acétoxy-17a
éthoxy-3 formyl-6 oxo-20 nor-l9 pregnadiène-3,5 et 240 ml de
tétrahydrofurane (THF). Sous agitation, on ajoute a température
ambiante et lentement 48 ml d'une solution de chlorure d'éthylmagnesium
dans le TffF titre à 25% ~soit 134,4 mM). On agite encore une heure. On
ajoute 48 ml d'HCl aqueux 5N en refroidissant. ~n coule ensuite dans un
litre d'eau. Le produit precipité. On le reprend par du chlorure de
methylène et evapore à sec. On obtient 28 g de residu que l'on
chromatographie sur silice en éluant par un melange toluène 9,S/acetate
d'éthyle 0,5. On recristallise dans le méthanol et obtient 2,3 g
d'acetoxy-17~ propylidène-6 dioxo-3,20 nor-l9 pregnène-4.
Le prodult ci-dessus est introduit dans une suspension agitee de l,S g
de charbon palladié à 5% de palladium dans 220 ml de methanol
preal~blement porte au reflux. Après maintien du reflux pendant
2 heure~, on refroidit et filtre. Le produit d'évaporation à sec est
chromatographie sur silice et élue par le melange toluène 95/acetate
d'ethyle S. On obtient 1,6 g de produit brut que l'on recristallise
dbns l'ether isopropylique. On sépare 0,9 g de cristaux blancs.
PF. - 161-162
W : (acétonitrile) ~ max : 285 nm E ~ 24.218
IR (KBr) carbonyle 1705, 1648 cm 1
acétate 1727 cm~
C~C 1614, 1574 cm~
1 ~1 RMN ~CDC13, 250 NHz)
0,70 (s, 3, CH3-18),
O,908 (t, 3, CH3-6-propyle)
2,07 (s, 3, CH3-acétate)
2,11 (s, 3, CH3-2)
6,01 (s, 2, H4 avec H7)
E2EMPLE II
;
A~El~Y--17a DIaX~3,20 E1~6 N~R--19 PREX;t~DIEN1~4,6
on introduit dans un ballon, sous azote, S g (12,07 mM) d'acetoxy-17
ethoxy-3 fonmyl-6 oxo-20 nor-l9 pregnadiène-3,5 et 50 ml de
,~
`~ FEUILLE DE REMPLACEMENT
WO 93/0209~ PCI /FR92/00697
'1~ 10-
tetrahydrofuran (TffF). A la suspension on ajoute, sous agitation, à
température ambiante, 5 ml d'une solution de chlorure de
mæthylmagnésium dans le THF titrée à 3mMVml de magnésien. Après une
heure on ajoute 15 ml de HCl aqueux SN en refroidissant, puis on coule
le mélange dans 500 ml d'eau. Le produit précipite. On filtre et ~n
lave à l'eau : 4,5 9, Rdt : 97~. Le produit e~t chromatographié sur
silice et élué par un mélange toluène/acétate d~éthyle (90/10). On
recristallise dans 14 volumes de mæthanol et sépare 1,S g d~acétoxy-17a
éthylidène-6 dioxo-3,20 nor-l9 pregnène-4.
Le produit ci-dessus est ajouté à une suspension agitee de 1,2 9 de
charbon palladié ~ 5% de Pd dans 200 ml de methanol prealablement
; porté au reflux. On maintient le reflux pendant 45 mn, on refroidit à
te~pérature a~biante, on filtre et évapore à sec. Le residu est
chromatographié sur silice et élué par un mélange de toluène et
d'acetate d'éthyle (90/10). On obtient 1 9 de produit que l'on
recri~tallise dans le méthanol : 0,5 9, cristaux blanc-crème
PF - IS4-156 (Kofler)
U.V : (acétonitrile) ~ max : 284 nm - 22.337
I.R (~Br) : carbonyles à 1705-1715, 1670 cm 1
acétate 1739 cm~l
C-C 1614, 1580 cm 1
tl~ RMN : (CDC13 250 MH2)
0,71 (S, 3, CH3-18~
1,08 (t, 3 CH3-6-ethyle)
2,07 (S, 3 Q 3-acétate)
2,10 (S, 3 CH3-21)
6,01 (S, 2H, H4 avec H7)
E~EMPLE III
ACESOXY--17a roFrYLr6 DIoXD-3,20 NOR--19PREGN~DIENE-4,6
On introduit sous azote et sous agitation, 2,8 9 de dichloro-2,3
dicyano-5,6 p-benzoquinone dans une solution de 5 g d'acétoxy-17a
éthoxy-3 formyl-6 oxo-20 nor-l9 pregnadiène-3,5 dans 135 ml d'acétone
et 7,1 ml d'eau. La temperature s'élève de 19 à 21 et le milieu
réactionnel se colore.
':~
:
: FEUILLE DE REMPLACEMENT
W O 93/0209~ PCT/FR92/00697
21~7~
-- 11
Après 45 minutes, on reprend par de l'eau et de l'acétate d~éthyle, on
lave par de la soude N puis à l'eau à neutralité. On amène à sec. Le
résidu est chromatographié sur silice et élué à l'acétate d'éthyle. On
recristallise dans l'éther éthylique par chaud et froid (-18). Les
cristaux sont lavés à l'éther. On obtient 500 mg de produit blanc-crème
fondant vers 190-200C.
U.V : (acétonitrile) ~ max : 272 nm ~ ~ 20.000
I.R ~KBr) : carbonyles à 1711, 1688, 1653 cm 1
acétates 1733 cm~
H] RMN (CDC13, 250 MHZ)
0,70 (S, 3, CH3-18)
2,00 (S, 3, CH3-acétate)
2,06 (S, 3, Q3-21)
7,01 (d, 1) ~H4, H7)
7,12 (d, 1) (H4, H7)
9,59 (S, 1, aldéhyde)
,EXEMPIE IV ,
PREPARPlIoN DE L'ACEToXY--17~ =::--o~YMET=7:,6 DICXD-3,20 NOR-l9 PREGN~D1ENE-4,6 (A) ET DE L'~YDRoXY-17~ ~ r~ 6 DICXD-3,20
NOR--19 PREGN~DIENE-4,6 (B)
Dan~ un tricol de 2 litres muni d'une agitation ma~nétique, on
introduit sous azote, acétoxy-17 ethoxy-3 hydroxyméthyl-6 oxo-20
nor-19 pregnadiène-3,5 20 g, acétone 200 ml (20 Vol), eau 40 ml
(2 Vol), dichloro-2,3 dicyano-5,6 p-benzoquinone i8,2 g ~0,93 p).
La reaction est suivie par chromatographie en couche mince. La réaction
est totale au bout de 45 mn. On précipite dans 1 1 d'eau. On observe un
précipite qui est filtré. Les eaux mères sont extraites deux fois par
500 ml de dichlorométhane.
Les phases organiques sont lavées par de l'eau jusqu'à pH neutre. On
obtient 7,8 g d'une huile marron Rt ~ 41,9 %
La purification est effectuée sur une colonne de silice, on separe dans
l'ordre un premier produit (A) 5.5 9 et un second produit (s) 1.2 9.
FEUILLE DE REMPLACEMENT
W O 93/0209~ PCl`/FR92/00697
~ 3 ~ '' 12 -
Le produit A est recristallisé dans le méthanol et fournit 3 g
d'acétoxy-17a hydroxyméthyl-6 dioxo-3,20 nor-19 pregnadiène-4,6.
Pfk : 202.4C
RMN : H4 S 6.37 ppm 1 proton
H7 S 6~01 ppm 1 "
hydroxyméthyl-6 S 4.34 ppm 2 "
H C21 S 2.10 ppm 3 "
A~état~ S 2.07 ppm 3
H-O S 1.63 ppm 1 "
H C18 S 0~73 ppm 3 "
Le produit E est lui aussi cristallisé dans le methanol et fourni 0,3 g
d'hydroxy-17a hydroxyméthyl-6 dioxo-3,20 pregnadiène-4,6.
Point de fusion (Metler) : 251C
RMN : H4 S 6.38 ppm 1 proton
H7 S 6.01 ppm 1 "
hydroxyméthyl-6 S 4.33 ppm 2 n
H C21 S 2.3 ppm 3 n
H-0 6 S 1.63 ppm 1 n
H C18 S 0.81 ppm 3 n
l~E V
PREP~RA~IoN DE L~A~EToxx-17 A~ ~ D~6 MoXD-3,20 NCR--l9
PgEGNNDIENE-4,6
Dans un tricol de 100 ml muni d'une agitation magnétique et d'un
réfrig~rant on introduit s~ccessivement 1 g de produit A de l'exemple
rv, 20 ml de pyridine (20 Vol), 2 ml d'anhydride acétique ~2 Vol).
La 801~tion est chauffée à 60C pendant 35 mn. On precipite dans un
bain eau/glace. Le produit est filtré puis purifié sur colonne de
silice. On obtient 0.7 g d'un produit blanc.
RMN : H4 S 6.32 ppm 1 proton
H7 S 6.01 ppm 1 "
acétQxyméthyl-6 S 4.72 ppm 2 " (proton du CH2)
H C21 S 2.11 ppm 3 "
Me des acétoxy S 2.07 ppm 6 n (acétoxy-17 et 6)
H C18 S 0.72 ppm 3 "
FEUILLE DE REMPLACEMENT
PCl /FR92100697
WO 9310?09~
r
2 1 1 3 7 !,~
-- 13 --
0~E VI
.
~RE:eARA~ICN DE L'A~f--17a ~ HYD~l~, HEMISIK:CIN~S )--6
DIa~3,20 N~ PEU~1Et~4,6
Dans un tricol de 100 ml muni d'une agitation magnétique et d'un
refrigérant, on introduit successivement 1 g de produit (A) précédent,
pyridine 20 ml (20 Vol) et anhydride succinique O,6 9.
La solution est chauffée à 60C durant 4 h. On décompose 1'excès
d'anhydride par de l'eau. On extrait le produit par du toluène et on
lave par de l'eau. Le prcduit est purifié sur colonne de silice. On
obtient O.25 g d'un produit blanc.
RMN : H4 S 6.38 ppm 1 proton
H7 S 6.01 ppm 1 "
2 protons du méthylène en 6 S 4.75 ppm 2 "
4 protons hémissuccinate en 6 S ~.66 ppm 4 '`
H C21 S 2.11 ppm 3
Me acétoxy-17a S 2.02 ppm 3 "
H C18 S 0.72 ppm 3 "
E~EMPLE VII
PREPP~A~IoN DE L'A~ETCXY-17~ ET~YNYL,17a MEI~Y1~DENE,6 CXO-3 ESTREN~4
~ans un tricol de 50 ml on introduit sous agitation et azote, 2,8 g
d'acétoxy-17~ éthoxy-3 éthynyl-17a formyl-6 estradiène-3,5, éthanol
(abs) 8,S ml (3,03 V), diméthylformamide 7 ml (2,5 ~), borohydrure de
sodium 0,13 9 (0,046 p). La réaction est terminée après 22 h
d'agitation, Le milie~ réactionnel e~t hydrolyse en introduisant en
10 mn ~ne solution composée d'acide sulfuri~ue 2N 2,~ ml (1 Vol), DMF
6 ml (2,1 Vol), éthanol (abs) ~ ml ~2,1 Vol). On obtient 2,1 9
(Rt = 84 %) d'un produit blanc-crème.
PFk : 157~
Ce composé a déjà été décrit dans la demande de brevet franc,aise
n 89.06790 déposée le 24 Mai 1989 au nom de la demanderesse.
FEUILLE DE RE~JIPLACE~/IEN~