Note: Descriptions are shown in the official language in which they were submitted.
NOUVEAUX DERIVES DE L.A BACCA~INE III ET DE LA D~SACETYL,-Io
BACCATINE III. LEUR PREPARAl~ON ET LES COMPOSITIONS
PHARMACEUTIOUES OUI LES CONTIENNENT
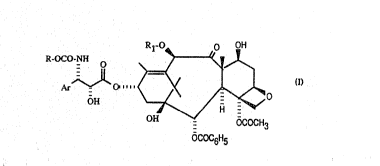
La présente invention concerne de nouveaux derivés du taxane de formule
5 générale:
Rl-O~ o OH
R-O~
OH '7~ / H
OH - OCOCH3
~ : CC6H5
leur préparation ee les compositions pharmaceutiqu~s qui les contiennent.
Dans la formule générale (I), Ar représente un radical aryle, R1 représente
un atome d'hydrogène ou un radical acétyle et R représente
10 - un radical alcoyle droit ou ramifié contenant 1 à 8 atomes de carbone, alcényle
contenant 3 à 8 atomes de carbone, alcynyle contenant 3 à 8 atornes de carbone,
:cycloalcoyle contenant 3 à 6 atomes de carbone, cycloalcényle contenant 4 a 6
atomes de carbone ou bicycloalcoyle contenant 7:à 10 atomes de carbone, ces
radica~x étant éventuellement substitués par un ou plusieurs substituants ~hoisis
15 :parmi~les atomes d'halogène e~ les radica~Y hydroxy, alcoyloxy contenant 1 à 4
atomes~de carbone, dlalcoylam~no dont chaque panie alcoyle contlent 1 à 4 atomesde~ carbone, pipendino,::morpholino, pipérazinyl-l (éveMuellernent substitue en -4
par~un:radical alcoyle~:contenant 1 à 4 atomes de carbone ou par un radical
p~lalcoyle dont la :partie aicoyie contient 1 à 4 a$omes de carbone~, cycloalcoyle
20 ~ contenant 3 à 6: a~omes d~ carbone, cycloalcényle contenant 4 à 6 atomes de carbone,
phényle, cyano, e~ ou alcoyloxycarbonyle dont la partie alcoyle contient 1 à 4
atomes de car~nst ~
- ou un radical phényle éventuellement substitue par un ou plusieurs atomes ou
radicawc choisis parmi les~atomes~d'halogène et les:~dicaux~alcoyles contenant 1 à 4
25 atomçs de carbone, alcoyloxy eontenant 1 à 4 atomes de carbone,
ou tm radical hétérocyclyle azoté saturé QU non sature :contenant 5 ou 6 chaînons et
éventuellement substitué par un ou plusieurs radicaux alc~les contenant 1 à 4
atomes de carbone,
UILLE ~A0D~
~,
:
étant entendu que les radicaux cycloaicoyles, cycloalcényles ou bicycloalcoyles
peuvent être éventuellement substitués par un ou plusieurs radicaux alcoyles
contenant 1 a ~ atomes de carbone, et étant entendu que, lorsque Ar représente un
radical phényle non substitué, Rl représente un atome d'hydrogène ou un radical
5 acétyle, R ne peut pas représenter un radical éthyle ou tert-butyle, et étant entendu
que, lorsque Ar représente un radical phényle substitué ou a- ou ~napht~le
éventuellement substitué, R1 représente un atome d'hydrogène ou un radical acétyle,
R ne peut pas représenter un radical tert-butyle.
De préférence Ar représente un radical phényle ou cc- ou ~naphtyle éven-
10 tuellement substitué par un ou plusieurs atomes ou radicaux choisis parmi les atomesd'halogène (fluor, chlore, brome, iode) et les radicaux alcoyles, alcényles, alcynyles,
aryles, arylalcoyles, alcoxy, alcoylthio, aryloxy, arylthio, hydroxy, hydroxyalcoyle,
mercapto, formyle, acyle, acylamino, aroylamino, alcoxycarbonylamino, amino,
alkylamino, dialkylamino, carboxy, alcoxycarbonyle, carbamoyle, dialcoylcarba-
15 rnoyle, cyano, nitro et trifluorométhyle, étant entendu que les radicaux alcoyles et lesportions alcoyles des autres radicaux contienne~t 1 à 4 atomes de carbone, que les
radicaux alcényles et alcynyles contiennent 3 à 8 atomes de carbone et que les
radlcaux aryles sont des radicaux phényles ou a- ou ~naphtyles.
Plus particulièrement, Ar repr&sente un radical phé~yle éventuellernent
20 substitué par un ou plusieurs atomes ou radicaux, identiques ou différents, choisis
parmi les atomes dlhalogène et les radicaux alcoyles, alcoxy, amino, alcoylamino,
dialcoylamino, acylamino, alcoxycarbonylamino et trifluorométhyle.
: : ~
Plus par~lculièrement encore, Ar représente un radical phényle éventuelle-
ment substitué par un atome de chlore ou de fluor, ou par un radical alcoyle
25 (méthyle), alcoxy (méthoxy~, dialcoylamino (diméthylamino), acylamino (acétyl-
amino) ou alcoxycarbonylamino (tert-butoxycarbonylamino).
Dans C.R. Aca~l. Sci., ~_, séne II, n 15, 1039-1043 ~1984) sont décrits les
produits de fo~rnule ~génerale (l~ dans laquelle R1 représente un atome d'hydrogène
ou un radical acétyle, R represente un radical éthyle et Ar r~présente un radical
30 ~ phényle non substitué.
Dans EP-0 253 738 sont décrits les prod~$ts de formule générale (I) dans
laquelle R1 représente un a~ome d'hydrogène ou un radical acétyle, R représente ur
radical tert-butyle et Ar représente un radical phenyle non substitué.
Dans WO 92/0~589 ~snt decrits les produits de forrnule généraIe ~I~ clans
35 la~uelle Rl rep~sente un atome d'hydrogène ou un radical acétyle, R représente un
o~
r~dical tert-but,vle et Ar représente un radical phényle substitué ou un radical a- ou
~naphtyle é~Jentuellement substitué. . :
Les produits selon l'invention se distinguent des produits antérieurement
connus par Ull spectre d'activité différent.
Selon la présente invention, les nouveaux dérivés du taxane de fonnule
générale (I) peuvent etre obtenus par action d'un dérivé réactif de formule générale:
R-O-(: O-X (II)
dans laquelle R est défini comme précédemment et X représente un atome
d'halogène (fluor, chlore~ ou un reste -O-R, -O-CO-OR, -O-Ph dans lequel Ph
représente un radical phényle substitué par un radical électro-at~acteur, de
préférence le radical nitro, en para ou en ortho, ou un reste tétrachloro- 1,2,2,~ éthoxy ~ ~:
sur un dérivé de la baccatine III ou de la désacét,vl-10 baccatine III de formule -
générale ~
H N OH H
OH OCOCH3
OCOC6H5 ~ `
15~ ~ dans laquelle :Ar esl défini~ comme précédemment, G1 représente un groupement ~;
: protecteur de la fonction hydroxy tel qu'un radical trichloro-2,2,2 éthoxycarbonyle ~ ~ ~
ou: t*alkylsilyle, dialkylarylsilyle, alk,vldiarylsilyle ou triarylsilyle clans lequel ~:
chaque~ partie~ alkylè~ contlent l à 4 atomes de car~one et chaque ~p~tie aryle ::
represénte:de préférence un:radical phényle et G2 représeIlte un radical acétyle ou un
; 20 gr~up~mént pn~ ur de là fonction hydroxy tel qu'un radicai trichloro-2,2,2
é~ox:ycarbonyle, pour donner un produit de formllle générale :: :
R-O-CO-NH ~OH - -
OH _ OCGCH3
3~0C6H5
,
`
dans laquelle Ar, R, G1 et G2 sont définis comme précédemment, suivie du rempla-cement des groupements Gl et G2 par des a~omes d'hydrogène pour donner le ::.
produit de formule générale (I).
Généralement, l'action du dérivé réactif de formule générale ~II) sur le
dérivé de la baccatine III ou de la désacétyl-10 baccatine III de formule générale (III) -:~
lorsque X représente un atome d'halogène ou un radical -OR ou -O-CO-OR, est
effectuée dans un solvant organique tel qu'un ester comme l'acétate d'éthyle en
présence d'une base minérale ou organique telle que le bicar~onate de sodium. .
Généralemen~ la réaction est effectuée à une température comprise ent~e 0 et ~ ~ -
50C, de préférence voisine de 20C. ~ :
Généralement, l'action du dérivé réactif de forrnule génér~le (II) sur le
dérivé de la baccatine III ou de la désacétyl-10 baccatine III de formule générale :~
(III), lorsque X ~présente un radical -O-Ph, est effectuée dans un solvant organique
choisi p~mi les éthers tels que le tétrahydrofuranne, les niteiles tels que l'acétonitrile, : ~
I5 les amides tels que le dirnéthylfonnamide et les hydrocarbures aliphatiques ::
halogénés tels que le dichlorométhane à une temperature comprise entre 50 et 100C.
Généralement, l'action du dérivé réactif de formule générale (II) sur le ~:~
.
: dérivé de la baccatine III ou de la désacétyl-10 baccatine III de formule générale
tIII)~ lorsque X représente un radical tétrachloro-1,2,2,2 éthoxy, est effectuée dans
2 0 ~ solvar~t or~anique inerte choisi parmi les éthers tels que le tétrahydrofuranne, les
r~itriles teIs que l'acétonitnle, les amides tels que le diméthylformamide et les amines
aromatiques telles que~ La pyridine à une température voisine de 0C.
Généralement~le~remplacement des groupements protecteurs G1 et G2 du
produit~de fo~mule ~générale ~IV~ par des atomes d'hydrogène est ef~ectué par traite-
25~ ; ment par~le~zmc en pYésence d'ælde acétique à une temperature comprise entre 30 es6Q~C~ :ou au~moyen d'un acide minéral ou o~anique tel que l'acide chlorhyd~ique ou
l'acide acétique en~ solu~ion: :dans un alcool aliphatique co~tenant 1 à 3 atomes de
:carbone en p~esence de z:Lnc lorsque G1 et /ou G2 représentent un ~adical trichloro~
,2,2 éthoxycarbonyle, ou par~trai~ement en milieu acide tel ~e par exemple l'acide
3 0l chlorhy~rique en solution~ d~ns un alcool aliphatique c~t~nant 1 à 3` atornes de
c arbone méthanol, éthanol, propanol, isopropanol) ~ l'acide ~luorhydnque aqueux ~
une température comprise entre 0 et 40C lorsque G1 et/ou G2 représentent un
radical silylé.
L~ dérivé de la baccatine III ou de la désac~ 10 bacca~ine III de fo~mule
: 35 générale (III~ peut être obtenu pa~ acti~ d'un acide minéral ou organique
: ,`
r ?
',-
éventuellement dans un alcool dans des conditions qui sont sans effet sur les
groupements protecteurs G1 et ~2 sur un pro~uit de formule générale:
O"",~O (V)
Boc-N~O H
R ~ R OH _ OCOCH3
OC0~;:6H5
dans la~elle Ar, Gl et G~ sont définis comme précédemment, Boc représente le
5 radical tert-butoxycarb~nyle et R2 et R3, identiques ou dif~érents, représentent
atome d'hydrog~ne ou un radical alcoyle contenant 1 à 4 atomes de carbone, :
eventllellemen~ substitué par un ou plusieurs radicaux aryles (phényle) ou aryle ~i
~phényle) ou bien R2 et R3 forment ~nsemble a~ec l'atome de carbone auquel ils sont
: ~ ~ liés un cycle ayant de 4 à 7 chaînons.
Le produit de formule genérale (V) peut être obtenu par ac~ion d'lan dérive
de l'oxazolidine de formule générale:
COOH ;
N><O ~ (Vl)
R2 R3 :
dans laquelle Ar,~Boc,~R2 et R3~sor~it définls comme précédemment, éventuellemeMsous:forrne d'anhydride, sur~url~déri~é du taxane de:~omlule générale
dO~ ~o
OH ~- OCocl;t3 ~
lS~ OC0C6H5 i ~
dans laquelle G1 et C~2 50nt defin~s comme précédemment.
Généralement::l'esten~ication est effectuée en présence d'un agent de
condensation tel qu'un car~iimide comme le dicyclohexylcarbodiimide ou ~
carbonate ré~ctif com~ne le dipyridyl-2 carbonate et d'un agent d'activation tel qu'une
: ` :
dialkylaminopyridine comme la diméthylamino-4 pyridine en opérant dans un
solvant organique tel qu'un hydrocarbure aromatique (benzène, -~o1uène, xvlène,
éthylb,enzène, isopropylb,enzène, chlorobenzène), un éther (tétrahydrofuranne~, un
nitrile (acétonitrile), un ester (acétate d'éthyle) à une temp,érature comprise entre 0 et
5 90C
Le dérivé de l'oxazolidine de formule générale (VI) peut être obtenu par
sapon~fication en milieu basique d'un ester de forrnule générale: ~
COOR4 . 1.
N o (VIII)
,>< ' ,:
dans laquelle Ar, R2 et R3 sont définis comme précédemrnent et R4 représente un
10 radical alcoyle contenant 1 à 4 atomes de carbone éventuellement substitué par ur
radical phényle.
C}énéralement, la saponi'rication est effectuée au moyen d'une base minérale ~
telle que la lithine en opérant dans un alcool contenant l à 4 atomes de car~one tel A,
que réthanol.
15L'ester de 'ro~nule générale;(VIII) peut être obtenu par ac~ion d'un méthoxy-
alcène éventuellement substitué par un ou plusieurs radicaux aryles ~méthox~,--2propène), d'un gem-diméthoxyalcane ;éventuellernent subslitué par un ou plusieurs
radicaux ~ aryles (dlméthoxy-2,2 propane) ou un gem~-diméthoxycycloalcane
contenant 4 à 7 atomes de carbone (diméthoxy-1,1 cyclohexane) sur un dérivé de la
2 0 ~phénylisosérine de formulegénérale
Ar ~COO
(CH3~3CO-CO-NH 011
dans laquelle Ar et R4 sont dé~inis comme précédemment sous forme ~acémique ou, `~
de préferen, ce, sous fo~me 2R,3S.
(3érléralementj la réaction du méthoxyalcène ou du gem-diméthoxyalcane ~;
25 ou du gem-diméthoxycycloalcane avec le produit de fonnule générale (IX) est
e~fectuee en operant dans un solvant organique inerte en présence d'un acide fort tel
que`l'acide p.toluènesulfonique éventuellement sous ror~0 de sel de pyrid~ium a
une tempérahlre compnse entre 0C et la temperature d'ebullition du melange
~.~
FEUlL~ lf~E
:..
réactionnel. L,es solvants qui conviennent particulièrement bien sont choisis parmi
les hydrocarbures aromatiques ~benzène, toluçne, xylène).
Le produit de fo~nule générale (IX) peut être obtenu par acylation d'un ~:
dérivé de la ~phénylisosérine de formule générale:
Ar ~COOR4
~ (X) ~:
H2N OH
dans laquelle Ar et R4 SOIIt définis comme précédemment.
La réaction est généralement mise en oeuvre en faisant réagir le dicarbonate
de di-tert.butyle en opérant dans un solvant organique inerte tel qu'un ester comme
; l'acétate de méthyle~ ou d'éthyle à une température comprise entre 0 et 40C, de
10~ p~éférence voisine de 20C
Le dérivé de la ~phénylisosérine de formule générale (X) peut ;être obtenu
par réduction d'un hydroxy-azoture de formule générale:
Ar ~COOR4
N3 ;~ ~ OH~
dans laquelle Ar et R4 sont définis comme précédemment. ~;
15 ;~Généralement~la~réduction~est effectuée au moyen d'hydrogène en présence
d'un~catal~yssur~ ~el que~ le ~palladium sur char~on en opérant dans un solvant :~
organique ~inerte ~1 ~que l'æétate~ d'éthyle. On opère de préférence à une température
comprise~entre 0~et 50C.~ est~avantageux d'effectuer l'hydrogénation sous une
pressio~n comp~ise~entre 1 :et~S bars.~
0 ;~prod:uit~de for~nule~ générale~ (XI) peut etre ob~enu par action d'un azoture
d~ métal ~ ~ alcalin. ~ ~tel. ~que l!azoture de sodium sur ~ un ester de l'acide phënyl~lycldique~ de fofmule générale ~
Ar COOR4
dans laquelle Ar et R4 sont définis comme pr~édelnment.
2~Généralement, on op~re~dans un mélange hydroo~anique tel qu'un mélange ~
eau-tétrahydrofuranne à la temperanLre~ de ~eflux du mélange réactionne L ~ -
.
: ~ : : :.
F~U~
8 i~
.:
L'ester de forrnule génerale (XII) peut être obtenu par déhydrohalogénation
d'un produit de formule générale
OH O O
Ar ~ N~O (XIII) ,
Hal ,~ "
R~ ~6
dans laquelle Ar est défini comme précédemment, Hal représente un atome d'halo-
5 gène~ de préférence un atome de brome e~ Rs et 1~6, identiques ou différents, repré-
sentent un radical alcoyle contenant 1 à 4 atomes de carbone ou phényle. `
-Généralement, on opère en présence d'un excès d'~m alcoolate de mé$al
alca1in, éventuellement préparé in situ, dans un solvant organique inerte tel que le
~: ~ tétrahydrofurrnne à une température comprise entre -80C et +25C. ~:
Le produit de formule générale (XIII) peut être obtenu par action d'un aldé- :
hyde de~ fonnule générale
CHO (XIV~
dans laquelle Ar est; défini comme precédemment sur un halogénure d'acide de ~ormule~générale
o (Xv~
lS ~ R5 R6
dans~ laquelle~ Hal, Rs~et;~R6 sont~définis comme précédemment, préalablentent
Généralement, on opère :dans un solvant organi~que inerte choisi p~i les
éthers~(éther éthylique),~et~les hydrocarbures ~al1phatiques halo~énés (chlor~e de ;~
20~ m~lène1 à une têmperah~e~:~comprise entre~-80C et 25C~ en présence d'une
amine~ terfiaire~ iéthyl`amine) et d'un agent d'ani~isation ~tnflate de di-n~
Le produit d~ formule générale~(X~) peutjet~e:obtenu par action :~'un hal~
gérlure~d'un acide haIogénoacétique,~de préférence, le bromure de l'acide bromoacé- ~ 5
25 ~ : :tic~ue~ sur le sel de lithium de l'oxazolidinone corresponda~te.
Selon l'invention, les nouYeaux derives du~ ~axane de fo~nule générale a) ;~
::
peuvent:aussi ê~re obtenus par acdon d'u~} acide:de fo~nule génerale ~
. ..
~ . ~
Ar COOH~
.. .
~; (,YVI~
RO-CO-NH O-G3
dans laquelle Ar et R sont définis comme précédemment et G3 représente un grou-
pement protecteur de la fonction hydroxy tel qu'un radical méthoxyméthyle,
~étho~-13 éthyle, benzyloxyméthyle, (~triméthylsilyléthoxy) méthyle, tétrahydro~pyrannyle, trichloro-2,2,2 éthoxyméthyle ou trichloro-2,2,2 éthoxycarbonyle,
éventuellement sous forme d'anhydride, sur un dérivé du taxane de fonnule générale
(VII), suivi du remplacement des groupements protecteurs Gl, G2 et G3 par des
atomes d'hydrogène.
Généralement l'estérification est effectuée en présence d'un agent de
condensation tel qu'un carbodiimide comme le dicyclohe~lcarbodiimide o~ un
carbonate réactif comme le pyridyl-2 carbonate et d'un agent d'activation tel qu'une
aminopyridine comme la diméthylamino-4 pyridine ou la pyrrolidino-4 pyri~e en
opérant dans un solvant organique tel qu'un hydrocarbure aromatique (b~nzène,
toluène, xylènes, éthylb~nzèn~, isopropyl~enzène, chlorobenzène), un éther
(tétrahydrofuranne~, un nitrile (acétonitrile), un ester (acérate d'éthyle) à une
:température comprise entre O et 90C.
Le remplacement des g~oupements protecte~us G1, G2 et G3 par des atomes
d'hydrogène est effectué généraIement par traitement par le zinc en présence d'acide
acétlque à une temperature compnse entre 30 et 60C ou au moyen d'un acide miné-ra~ou organique tel ~ue l'acide chlorhydrique ou l'acide acétique en solution dans un
alcool aliphatique contenant~ 1 à 3 atomes de car~one ~n présence de zinc lorsque l'~n
:des:groupements protee~eurs représente un radical trichloro-2,2,2 éthoxycar~onyle
ou: par tral~ement en miileu: acide lorsque liun des groupements protecteurs représente
radical ::silyl:é.
25~ L'acide de fo~ule générale (XVl) peu~ etre obtenu par saponif;eation d'un
ester de formule générale ~
RO-CO-NH O^G3
~ . ~
dans~ laquelle R, Ar et G3 son~ definis comme p~écédemment et :R7 represente un ~ ` -
:radical aIcoyle contenan~ I à 4 atomes ~e carbone:eventuel~ement substitué par un ;:
radical phényle, au moyen d'une base minérale telle ~qu'un hydroxycle d~ m~tal
:
~:
-:~
~`:
alcalin (lithine, soude), un carbonate ou bicarbonate de métal alcalin (bicarbonate de
sodium, carbonate de potassium) en milie~i hydro-alcoolique tel qu'un mélange
méthanol-eau en operant à une temperature comprise entre 10 et 40C, de préférence
voisine de 25C.
Le produit de forrnule générale (XVII) peut être obtenu dans les conditions
habituelles de préparation des éthers, et plus particulièrement selon les p~océdés
décrits par J-N. Der~is et coll., J. Org. Chem., ~1, 46-50 ~1986), à partir du produit de
formule générale:
Ar ~COOR7
~ (XViII)
RO-CO-NH OH
dans taquelle R, Ar et R7 sont définis comme précédemment.
Le produit de formule générale (XVIII) peut être obtenu par action d'un
produit de formule générale (II) sur un produit de formule générale
COOR
~\ (XI~
H2N OH
dans laquelle Ar et R7 sont définis comme précédemment. Généralement, on opere -'
~ dans un solvant organique tel que le chlorure de rnéthylène en présence'd'une base
minérale telle que le bicarbonate de sodium. '~
Le produit de fonnule générale (XIX)~ peut~ être obtenu par réduction d'un
azide~de fo~nule générale ~
COOR7
N3 OH
20~ dans~laquelle A~ et~R7 ~ont définis~comme précedemment, qui est obtenu selon les ~ -
méthodes connues diouYerture d7un époxyde de~formule générale: '
dans laquelle Ar et ~7 sont définis comme précédemment, au moyen d'azoture de ~'
sodium dans l'eéhanol à chaud.
: L'ép~cyde de ~o~rnule générale (X~) peut être obtenu dans les conditions
decrites par F.W. Bachelor et R.K. Bansal, J. Org. Chem., ~, 3600^04 (1969).
:
"~ 'r ~ r~r~
: ::
:: :
Les exemples suivants illustrent l'invention.
XEMPLE 1
A tme solution de 0,5 g d'amino-3 hydroxy-2 phényl-3 propionate-(2R,3S)
d'acétoxy-4 benzoyloxy-Za époxy-5~,20 hydroxy-1 oxo-~ bis- (trichloro-2,2,2
S éthoxyl carbonyloxy-7~,10~ taxene-11 yle-13a dans 12,5 cm3 d'acétate d'éthyle,
maintenue sous atmosphère d'argon, on ajoute 12,5 cm3 d'une solution saturée
d'hydrogénocarbonate de sodium et lZ,5 cm3 d'eau distillée puis en une seule fois
93 mg de fluoroformiate d'adamantyle. Le mélange réactionnel est agité pendant
7heures à une température ~voisine de 20C. La phase aqueuse est séparée par
décantation puis extraite par 3 fois 15 cm3 d'acétate d'éthyle. Les phases organiques
sont ~éunies, sechées sur sulfate de rnagnésium, filtrées puis concentrées à sec sous
pression réduite (2,7 kPa) à 40C. On obtient 0,57 g d'une meringue blanche que l'on
purifie par chromatographie su~ 12 g de silice (0,04-0,063 mm~ contenus dans unecolonne de 1,5 crn de diamètre [éluant: dichlorométhane-méthanol (98-2 en
volumes)] en recueillant des frætions de 5 cm3. Les fractions 22 à 34 sont réunies et
:
co~centrées à~ sec sous presslon réduite (0,27 kPa) à 40C. On obtient ainsi 0,52 g
; d'adaman~yloxycarbonylamino-3 phényl-3 hydroxy-2 propionate-(2R,3S)
d'acétoxy-4 benzoyloxy-2a ~ époxy-5~,20 hydroxy-1 oxo-9 bis-(trichloro-2,2,2
éthoxy) ca~bonyloxy-7~,10~ taxène-ll;yle-13a sous forme d'une meringue blanche
20 ~ Une~ solution de 0,52 g d'adamantyloxycarbonylamino-3 phényl-3
hydroxy-2 propionate-(2R,3S) d'acétoxy-4 benzoyloxy-2a époxy-5~,20 h~droxy-1
oxo-9~bis-(tnchloro-2,2,2 éthoxy)carbonyloxy-7~,10~ taxène-11 yle-13~x dans un
melange~de lQ cm3 de~mé~anQI et de 10 cm3~d'acide acétique est chauffée sous
agit~ion :et~sous atmosphère d'argon jusqu'à une température voisine de 60Ci puis on
25~ ajouté 1 g de zinc en~ poudre.~Le ;mélange réactionnel est ensuite agité` pendant
30 minutes~à 60C~;puis~re~roidi~à~une température voisine de 20C et filtré sur verre
té~ga~ de célite. Le verre fdtte est lavé par 3 fois 5 cm3 de diehlorom~hane et
les~filtr~ts sont reunis puis concentrés à æc sous pression réduite (2,7 kPa) à une
temperature voisine de 40C~
3 0~ Au résidu, on a~oute 20 cm3 de dichloromè~ane. Le sol;de forrné est separé
par filtration et le filtrat~ est concentré à sec sous p~ession r~duite g2,7 kPa) à une
temperature ~isine de 40C.~On obhent 0,48 g ~d'une me~ingue blanche que l'on
ie par ~hromatographie sur 12 g de silice (0,04-0,063 mm) contenus da~ une
colo~e de 2,5 cm de diamètre ~éluant: dichlo~méthane-methanol ~97-3 en
"
. .
~ ...
~';
12
volumes~ en recueillant des fractions de ~ cm3. Les fractions 17 à 37 sont réunies et
concentrées à sec sous pression réduite (0;~7 kPa) à 40C pendant 5 heures. On
obtient ainsi û,2 g d'adamantyloxycarbonylamino-3 phényl-3 hydroxy-2 propionate-(2R,3S) d'acétoxy-4 benzoyloxy-2a époxy-5~,20 trihydroxy-1,7~,10~ oxo-9
taxène-11 yle-13a sous forme d'une meringue blanche dont les caractéristiques sont
les sui~antes:
- pouvoir rotatoire: [a~20D = -32 (c = t~; méthanol)
- spectre de RMN (400 MHz; CDCl3) ;
~ (ppm) :1,14 (s, 3H: -CH3 16 ou 17); 1,26 Is, 3H: -CH3 16 ou 17); 1,4 à 2,1 (rn,
15H: -CH2- et -C~- de l'adamantyl); 1,7 (s, lH: -OH 1); 1,77 et 1,88 ~2s, 3H
chacun: -CH3 18 et -C~3 19); 1,85 (m, lH: -(CH)-;~ 6); 2,31 (d, 2H, J = 9:
-C~2-14); 2,4 (s, 3H: -COC~3); 2,6 (m, lH: -(CH)-H 6); 3,35 (d, lH, J = 5:
-o~ 2'?; 3,93 (d, lH, J = 7: -H 3); 4j2 et 4,32 ~2d, lH chacun, J = 8: -(CH2)-20);
4,23 (s, lH: -O~ 10); 4,25 (m, lH: -H 7); 4,64 (m lH: -H 2'); 4,96 (d, 1H, J = 9:
-H 5); 5,21 (s, lH: -H 10); 5,27 (d, lH, J = 9: -:~ 3'); 5,44 (d, lH, J = 9: -:
N CO-);5,69(d,1H,J=7:-~52);6,24(t,1H,J=9:-~13);7,3à7,45(m,5H:
-C6~!s); 7,51 [t, 2H, J = 8,5~: -OCOC6Hs(-H 3 et -~ 5)~; 7,62 [t, lH, J = 8,5:
-OCOC6Hs(-~ 4)]; 8,13 [d9 2H, J - 8,5: -OCOC6Hs (-~ 2 et -H 6)~.
Liamirlo-3 hydroxy-2 phényl-3 propionate- (2R,3S) d'acétox-4 benzoyl-
oxy-2a époxy~5~,20 hydroxy-1 oxo-9 bis-(trichloro-2,2,2 éthoxy)carbonyloxy-
7~,10~ taxène-11 yle-13a peut etre~préparé de la manière suivante: ~;
On agite 14 g de tert.butoxycarbonyl-3 diméthyl-2,2 phényl-4 oxazolidine-
carboxylate-5-(AS,5R~3 d'acétoxy-4 benzoyloxy-2a époxy-5~,20 hydroxy-1 oxo-9
bis-~trichloro-2,2,2 éthoxy) ~carbonyloxy-~,10~ taxène-11 yle-13a avec de l'acide
25~ ~ ~rml~ue à une temperature d 20C. Après concentration à sec, reprise du résidu par
~e dichlorométhane et pu~ification par chromatographie flash (éluarlt: dichloro-methane-méthanol [95-~ en volum~es)], on obtient 6,3 " d'amino-3 hydroxy-2
phényl-3 popionate-(2R,3S) d'acétoxy~ benzoyloxy-2a époxy-5~,20 hydroxy~
oxo-9 bis-(trichlor~2,2,2 éthoxy)car~onyloxy-7~,10~ taxène-11 yle-13a sous forme~; 30 d'une meringue blanche dont le pouvoir rotatoire est [a~20~ = -39,7 ~c 3
mét~anol).
: ~ ~
On ob~ient 14 g de tert.butoxycarbonyl-3 diméthyl-2,2 phényl-4 oxazolidi-
necarbo~late-5-(4S,5R~ d'acétoxy~ benzoyloxy-2a époxy-5~,20 hydroxy-1 oxo-9
bis-~trichlor~2,2,2 éthoxy)carb~onyloxy-7fl,1û~ taxène-11 yle-13a sous forme d'une
rne~ingue blallche dont le pouvoir rotato~re est ~]~OD = -37,2~ (c - 1; methanol) ~ -
:
; '.
FEUILLE ~loDlFlEE
:
par ~ction de 10 g d'acide tert.butoxycarbonyl-3 diméthyl-2,2 phényl-4 oxazolidine-
carboxylique-5- (4S,5R) sur l2,6 g d'a~étoxy4 benzoyloxy-2a époxy-5~,20
dihydroxy-1,13a oxo-9 bis-(trichloro-2,2,2 éthoxy)carbonyloxy-7~,10~ taxène-11
dans le toluène à une température voisine de 80C en présence de dicyclo-
5 hexylcarbodiimide et de diméthylamino4 pyridine.
L'acide tert-butoxycarbonyl-3 diméthyl-2,2 phényl4 oxazolidinecarboxy-
lique-5-(4S,5R) peut être préparé de la manière suivante:
A une solution agitée de 12,8 g de tert-butoxycarbonyl-3 diméthyl-2,2
phényl-4 oxazolidinecarboxylate-5-(4S,5R) d'éthyle dans 200 cm3 d'éthanol, on
ajoute en 10 minutes une solution de 4,62 g d'hydrate d'hydroxyde de lithium dans
80 cm3 d'eau. Après 10 minutes d'agitation supplémentaire, le milieu réactionnel est
concentré à sec sous pression réduite t2i7 kPa) à une température voisine de 40C.
Le résidu obtenu e~ dissous dans 7Q cm3 d'eau puis extrait avec 3 fois 20 cm3
d'oxyde d'isopropyle. La phase aqueuse est ensuite acidifiee à un pH voisin de 2,6
15 par addition d'environ 100 cm3 d'une solution aqueuse lN d'acide chlorhydrique,
;; puis extraite 3 ~ois av c 50 cm3 de dichlorométhane. Les phases organi~ues réunies
sont séchées sur du sulfate de magnésium, filtrées puis concentrées à sec sous
pression réduite (Z,7 kPa) à une temperature voisine de 40C. On obtient ainsi 11,3 g
d'acide tert-butoxycarbonyl-3 dimé~hyl-2,2 phényl-4 oxazolidinecarbox~lique-5-
20 ~ ~4S,SR) sous forme d'~ne huile jaune dont le pouvoir rotatoire est [a~ZD = -3~
(c = 0,8; CHCI3).
Le ter~-butoxycarbonyl-3 diméthyl-2,2 phényl-4 oxazolidinecarboxylate-5-
4S,5R) d'éthyle peut etre~préparé~de la~ manière suivante ~
Une solution de~i1,7 g de tert-butoxycarbonylarnino-3 hydroxy-2 phényl-3
25 ~ ; propionate-(2R,3S)~ d'éthyle, de 3,6 cm3 de méthoxy-2 propene et de 0,06 g d'acide
p.toluènesu~fonique da~ns 120~cm3 de toluène est agitee pendant 1 heure à une
tem~ure voisine~ de~ ~0C Le~ milieu réactionnel est porté à ébullition~ puis ona~oute~ 0,06 g d'aclde p.tolu~nes~l~onique. Le distillat est recueilli dans un r~cipient
gradué tandls ~ue l'on additionne, gou~e à goutte, une solution de 18crn3 de
30 ~métho~y-2 propène ~dians 82 cm3 de toluènè de n~ianière ià maintenir constant le
volume du milieu réactionneL ~Après 1 heure 20~ ~inutes de distlllatlon on ajoute
0,06 g d'acide piaratoluènesulfonique, puis la distillation ~st poursuivie pendant 10
mirlutes; le ~tolume~de idistillat recueilli est alors de 100 cm3. Le milieu reactiolmel
est re~roidi ià une tempérahlre ~lroisine de 2QC, on~ ajoute alors 25 cm~ d'un~ sc>l~tion
3S aqueus~ saturée d'hydrogénocarbonate de sodium. La phase aqueuse est déca~tee,
,-
FEUILLE M~OIFIEE
~ ,:
puis extraite avec 2 ~ois 10 cm3 de dichlorométhane; les phases organiques réunies
sont séchées sur du sulfate de rnagnésium, ~trées et concentrees à sec sous pression
réduite ~2,7 kPa) à une température ~oisine de 40C. On obtient ainsi 20,8 g d'une
huile jaune qui est purifiée par chromatographie sur 630 g de gel de silice [diamètre
de la colonne: 5,5 cm, éluant: cyclohexane-acétate d'éthyle ~70-30 en volumes),
fractions de 100 cm3]. Après concentration à sec sous pression réduite ~2,7 kPa) à
une tem~érature voisine de 40C des ~ractions 3 à 9 on obtient 13 g de ~ ;~
~ert-butoxycarbonyl-3 dimé~hyl-2,2 phényl-4 oxazolidinecarboxylate-5-~4S,5R)
d'éthyle sous forme d'une huile jaune dont le pouvoir rotatoire est ~a]20D = -7,3
- 10 (c = 1; CHCl3)
- Le tert-butoxycarbonylamino-3 hy~roxy-2 phényl-3 propionate- (2R,3S)
d'éthyle peut être préparé selon la méthode suivante:
A une solution agitée de 16 g d'amino-3 hydroxy-2 phényl-3 propionate-
(2R,3S) d'ethyle dans ~6~ cm3 de dichlorométhane, on ajoute 7,1 g
d'hydrogénocarbonate de sodium puis on coule en 40 minutes une solution de 22,1 g
de di~arbona~e de di.ter~-butyle dans 40 cm3 de dichlorométhane. Le milieu réaction~
nel est agité 3,25 heures à une ~emperature voisine de 20C, puis on ajoute 150 cm3
d'eau. La phase organique est decantée, la phase aqueuse est extraite aveG 50 cm3 de
dichlorométhane, puis les phases organiques réunies sont séchées sur du sulfate de ;
~nagnésium, filtrées ~t concentrées à sec sous pression réduite (2,7 kPa) a une
tem~ ah~ce vois~ne de 30C. Le résidu obtenu est tnturé dans 50 cm3 d'éther iso~propylique; le solide obtenu est filtré, puis séché sous pression réduite ~2,7 IcPa) à ~`
une température voisine d~ 20C. On obtient ainsi 11,9 g de ter~- butoxycarbonyl^ ;~
amino-3 hydroxy-2 phényl-3 propionate-(2R,3S) d'éthyle sous forme d'une poudre
2 5 blanehe fondant ~ ~124C dont le pouvoir rotatoire est ~a3 0D = 6,3 ~c = l; CHCl
L'amino^3 hydroxy^2 phenyl-3 propionate^ (2R,3S) d'éthyle peut etre
preparé par la méthode ~ecrite par H. Honig et al, Tetrahedron, 46, p. 3841 (1990).
L'ae~toxy-4 1~nzoyloxy^2cc époxy-5~,20 dihydroxy^1,13cc oxo-9 bis-
~trichlo~o-2,2,2 ~thoxy) carbonyloxy-7~,10~ taxène^11 peut etre préparé selon la3Q méthod~ décrite dans le brevet euro~n EP 0 253 738.
EXE~PLE 2
A une solution ~ 0,S g d'amin~3 hy~oxy-Z phényl-3 propionate-~2R,3S)
d'acétoxy4 benzoylox~r-2~ ~-5~,2û hydroxy-1 ox~g bis-ltrichls:)Fo-2,2,2
é~hoxy)carbonyloxy-7~,10~ taxène-11 yle-13a dans 10 cm3 de dichloromé~hane,
, ...
.
F~`~IIL~ E i`ilOGii-i~E
maintenue sous atmosphère d'argon, on ajoute 44 m~, d'hydrogénocarbonate de
sodium et en une seule fois 0,13 g de di-tert-~entyldicar~onate.
Le mélange réactionnel est agité pendant 24 heures à une température voi-
sine de 20C puis on ajoute un mélange de 20 cm3 d'eau distillée et de 20 cm3 dedichlorométhane. La phase aqueuse est séparée par décantation puis extraite par
20 cm3 de dichlorométhane. Les phases organiques sont réunies, séchées sur sulfate
de magnésium, filtrées puis concentrées à sec sous pression réduite ~2,7 kE'a) à 40C.
On obtient 0,66 g d'une meringue blanche que l'on purifie par chromatographie su~
13 g de silice (0,04-0,063 mm) contenus dans une colonne de 1,5 cm de diamètre
[éluant: dichlorométhane-méthanol (98-2 en volumes)] en recueillant des fractions
de 5 cm3. Les ~ractions 10 à 17 sont réunies et concentrées à sec sous pression
réduite (0,27 kPa) à 40C. On obtient ainsi 0,52 g de tert-pentyloxycarbonylamino-3
phényl-3 hydroxy-2 propionate- (2R,3S) d'acétoxy4 benzoyLoxy-2a epoxy-5~,20
hyclroxy-1 oxo-9 bis-(trichloro-2,2,2 éthoxy) carbonyloxy-7~,10~ taxène-11 yle-13a
sous forme d'une meringue blanche.
En operant d'une manière analogue à celle décrite à l'exemple 1, mais à
partir de 0,52 g de tert-pen~rloxycarbonylamino-3 phényl-3 hydroxy-2 propionate-~2~R,3S) ~d'acétoxy-4 benzoyloxy-2a époxy-S~,20 hydroxy-1 oxo-9 bîs-(trichloro-
2,2,2 éthoxy) carbonyloxy-7~,10~ taxène-11 yle-13a, on obtient, 0,18 g de tert-pen-
tyloxycarbonylarnino-3 phér.yl-3 hydroxy-2 propiona~e- (2R,3S~ d'acétoxy-4
benzoyloxy-2a époxy-5~,20 trihydroxy-1,7~,10~ oxo-9 taxène-11 yle-13a sous
forrne d'une meringue blanche~ dont les caractéristiques sont les suivantes:
- pouvoir rotatoire [a]20D = -35 (c = 0j4; méthanol)
sp~ctre~de RMN ~400 MHz; CDCi3)
25 ~ ~ Ippm): 0,~ (t, 3H, J = 7: CH2C~3 du ca~bamatè~; 1,15 (s, 3H: -C 3 16 OU 17);
1,25~s, 3H: -CH3 16 ou 17 ); 1,32 (s, 6H: -C(CH3)2 du carbamate~; 1,69 (qj 2H,
J = 7: -C~2CH3 du carbamate~; 1,73 ~s, lH: -O 1); 1,77 (s, 3H: -CH3 19); 1,85
[m, lH: -(CH)-H 6~; 1987 ~s, 3H: -C~3 18); ~,29 (d, 2H, J - 9: ~CH2- 14); 2,39
~s, 3H~: -CO(:H3); 2,59 ~m, lH: -(CH)-H 6~; 3,4 ~m9 lH -0~5 2'); 3,92 ~d, lH,
30l J - 7 . -~ 3~; 4,19 et 4,32 (2d, lH chacun, J = 8: -(C~2)-20); 4,24 ~n~, 2H: -OEI
10 et -H 7); 4,64 (m, lH: -~ 2'); 4,95 (d, lH, J ' 9: -:~ 5); 5,2~ (s, lH: -H 10);
5,28 (dj lH, J = 9: -H 3'); 5,47 ~d, lH, J = 9: -NH~O-): 5,68 (d, lH, J = 7: -H 2~;
6,22 ~t, 1H, J = 9: -~ 13); 7,3 à 7,45 (m, 5H: -C6~5); 7,51 [t, 2H, 3 = 8~5:
-OCOC6Hs(-H 3 et -~ 5)]; 7,63 ~t, 1HI J - g,5: -OCOC6H~ 5 4)]; 8,11 [d, 2H,
J - 8,5: -OCOC6Hs~H 2 et -H 6)].
'~
16
, - "~
E~EMPLE
A une solution de 0,6 g d'amino-3 hydroxy-2 phényl-3 propionate-(2R,3S)
d'acétoxy-4 benzoyloxy-2cc époxy-5~,20 hydroxy-l oxo-9 bis-(trichloro-2,2,2
éthoxy)carbonyloxy-7~,10f3 taxène-ll yle-13a dans 10 cm3 d'acétate d'éthyle,
main~enue sous atmosphère d'argon, on ajoute 10 cm3 d'une solution saturée
d'hydrogénocarbonate de sodium et 10 cm3 d'eau dis~illée puis goutte à goutte
0,57 cm3 d'une solution lM de chloroformiate d'isopropyle dans le toluène.
Le mélange réactionnel est agité pendant 30 minutes à une température ;
voisine de 20C. La phase aqueuse est séparée par décantation puis extraite par 3 fois
10 cm3 d'acé~ate d'éthyle. Les phases organiques sont réunies, séchées sur sulfate de
magnésium, filtrées puis concentrées à sec sous pression réduite (2,7 kPa) à 40C;
On obtient 0,6 g d'une meringue blanche que l'on purifie par chromatographie sur ;
20 g de silice (0,04-0,0~3 rnm) contenus dans une colonne de 2 cm de diamètre
[éluant: dichlorométhane-méthanol (97-3 en ~olumes)] en recueillant des fractions
; 15 de 5~cm3. Les fractions 2 à 11 sont réun~es et concentrées à sec sous pression réduite ~ ~-
~0,27 kPa) à 40C. On obtient ainsi 0,38 g d'isopropoxycarbonylamino-3 phényl-3
;hydroxy-2 p~opionate-(2R,3S) d'acétoxy4 ~enzoyloxy-2a époxy-5~,20 hydroxy~
oxo-9 bis-(trichloro-2,2,2 éthoxy)carbonyloxy-7~,10~ taxène-11 yle-13cc sous forme -
d'une meringue blanche. ~ ;;
~ En opérant d'une manière analogue à celle décrite à l'exemple 1, mais à
paitir de 0,35 g d'isopropoxycarbonylamino-3 phényl-3 hydroxy-2 propionate~
(2R,3S)~d'acétoxy-~ b~nzoyloxy-2a époxy-5f3,20 hydroxy-1 oxo-9 bis-(tnchloro-
2,2t2~éthox~)carbonyloxy-7~,10~ taxène-ll yle-113a, on obtient 0,11 g d'isopropo- -~ i
xycarbcnylamino-3 phényl-3 hyclroxy-2~propionate-t2R,3S) d'acétoxy4 benzoyl~
as O xy-2~épo~y-5~,20 ~ihy~o~;y-1,7~,10~; ox~9 taxène-1 yle-13a sous forme d'une
` meringue blanche dont~ caractéris~iques sont les suivantes
- pouvoir r~tat~ire: [oc~20D =~-31~(c = 0,5; méthanol~
- spec~e~ de ~M~ (300 MHz~; CDC13)~
~ I S ~pprn) :~1,11 et 1,17 (2d,~3H~chacun, J = 7: -C~(H3?2)~; 1,13 (s, 3~: -(~3 16
30~ ou~17~; 1,26 (s, 3H: -C 3~16~ou 17); 1,7 (s, 1~: -Q~ 1) ;;1,77 e~ 1,85 ~2s, 3H
chacun~ 318et-C~319)~ 1,85(m,lH:-(CH)-~6);2,25(m,2H:-C~2~143;
2,38 (s, 3H ~:-COC~3); 2,58 ~(m, lH~ . -(CH)- 6); 3,S (m, 1H: -O~ 2'); 3,9? ~d,
lH, J ~7 ~ 3); 4,19 ét 4,32~ (2d, lH chac~, J = 8: -(C~2)-20) -; 4,~3 (m, 2H:
-0~ 10 et -~ 7); 4,64 (s, lH ~ 2'); 4,81 (m, lH, J - 7 :~-C (CH3)2); 4,96 (d,
lH, J = g: -~ 5): 5,23 (s, IH: -H ~10); 5,29 (d, lH~ J = 9: -H 3'~; 5,57 ~d, lH, J =
,; ; ~ ~,
.-.,... ~,
17
9: -NHCO-); 5,68 (d, lH, J = 7: -H 2); 6,23 (t, lH, J = 9: -H 13); 7,3 à 7,5 (m,5H: -C6~s); 7,51 [t, 2H, J = 8,5: -OCOC6Hs(-H 3 et -H 5)]; 7,63 [t, lH, J = 8,5:-OCOC6Hs(-H 4)]; 8,12 ~d, 2H, J = 8,5: -OCOC6Hs(-H 2 et -H 6)].
EXEMPLE 4
A~ une solution de 0,794 g d'amino-3 hydroxy-2 phényl-3 propionate-
(2R,3S) d'acétoxy-4 benzoyloxy-2a époxy-5~,20 hydroxy-1 oxo-9 bis-(trichloro
2,2,2 éthoxy)carbonyloxy-7~,10~ taxène-11 yle-13a dans 30 cm3 de diméthyl-
formamide, maintenue SQUS atmosphère dlargon, on ajoute en une seule fois 0,209 g
de carbonate de méthyl-1 cyclohexyle et;de nitro-4 phényle. Le mélange réactionnel
est ensuite agité pendant 9 heures à 80C puis refroicli à une température voisine de
20C et additionné de 300 em3 d'eala distillée et de 100 cm3 dtacéta~e d'éthyle. I,a
phase aqueuse est séparée par déeantation puis extraite par 2 fois 50 cm3 d'acétate
d'éthyle. Les phases organiques sont réunies, séchées sur sulfate de magnésium,
filtrées puis concentrées a sec sous pression réduite (2,7 kPa) à 40C. On obtient une
meringue blanche que l'on purifie par chromatographie sur 2~ g de silice (0,04
0,063 mm) contenus dans une colonne de 2,5 cm de diamètre en éluant avec 1m
méla~lge dichlorométhane-méthanol (99-l en volumes) et en recueillant des fractions
de 15 cm3. Les fraetions ~18 à 32 sont reunies et concen~rées à sec sous pression
réduite (0,27 kPa) a 40C. On obtient ainsi 0,2 g d'hydroxy-2 ~méthyl-1 cyclo~
ZO~ ;hexyl)oxycar~onylamino-3 phényl-3 propionate-(2R,3S) d'acétoxy-~i benzoyloxy-2a
épox}~-5~,~0 hydroxy-l ox~-9 bis-(thchloro-2~2J2 éthoxy)carbonylo~cy-7~,10~
taxène-11 yle-13a sous fo~me d'une menngue blanche.
Une solution de 0,47 g d'hydroxy-2 (méthyl-1 cyclohexyl)oxycarbonyl-
amino-3 ph~nyl-3 propionate-(2R,3S)~ d'acétoxy-4 benzoylox~-2a époxy-5~,20
;~ hydroxy-l oxo-9 bis-(trichloro-2,2,2 éthox )carbonyloxy-7~,10~ taxene-ll yle-13cc
dans un mélange de 10 cm3 de méthanol et de lO cm3 d'acide acétique est chaufféesous~ agitation et sous atmosphère d'argon jusqu'à une température voisine de 60C
puis additio~ de 0,9~ g de zinc en poudre. Le melange réactionnelj est ensuite
a~ité pendant 15 rninutes à 60C puis refroidi à une temperature voisine de 20~ et
; 30~ ~filt~é sur verEe fritté ,~arni de célite.~Le verre friti~ est lavé par 3 ~ois I0 cm3 de
diehlorom~thane~et les flltrats sont réumes puis concentrés à sec sous pression
réduite ~2,7 kPa) à une temperature voisine de 40C.
Le résidu est additionné de 20 cm3 de dichlorome~hane, le solide fo~mé est
sép~é par f;ltration et le filtrat es~ concentré a sec sous pression reduite (2,7 kPa) à
o~F~EE
18 ::
~ne température voisine de 40C. On obtient ~,55 g d'une meringue blanche que l'on
purifie par chromatographie sur 14 g de silice (0,0~0,063 mm) contenus dans une
colonne de 1 cm de diamètre [éluant: dichlorométhane-méthanol (98-2 en volumes)] ::
en recueiIlant des fractions de 5 cm3. Les fractions 23 à 37 sont ré~ies et
concentrées à sec sous p~ssion réduite (0,Z7 kPa) à 40C pendant S heures. On -;
obtient ainsi 0,164 g d'hydroxy-2 ~méthyl-1 cyclohexyl)oxycar~onylamino-3
phényl-3 propionate-(2R,3S) d'acétoxy4 benzoyloxy-2a époxy-5~,20 trihydroxy-
1,7~,10~ oxo-9 taxène-11 yle-13a sous forrne d'une meringue blanche dont les
caracté~istiques sont les sui~antes
- pouvoir rotatoire: [a~20D ~ -36 (c - 0,47; méthanol) -
- spectre de RMN (400 MHz; CDCl3)
. ~ en ppm): 1,10 à 2,10 (mt, 10H: -CH2- du cycl~hexyl); 1,15 (s, 3H: -CH3 16 ou
17); 1,25 (s, 3H: -CH3 16 ou 17); 1,37 (s, 3H: -C~3 en 1 du cyclohexyl); 1,70 (s,
lH: -OH 1); 1,78 (s, 3H: -C~I3 19); 1,86 [mt, 1H: -(CH~-~ 6]; 1,87 (s, 3H: ` -
.. .. . .
1~ -C:~3 18); 2,30 (mt, 2H: -CH2- 14); 2,40 (s, 3H: -COCH3), 2,60 Lmt, lH: -(CH)- : :~
~: H 6]; 3J38 (d, lH, J - 3,5: -OH 2'j; 3,92 (d, lH, J = 7: -H 3); 4,20 [d, lH, J = 8: '~"!.''''~'.'
-(CH-H 20]; 4,23 (mt, l~H: -~ 7); 4,25 (s, 1H: -OH 10); 4,33 [d, lH, J - 8: ~ :
(CH~-H 20]; 4,66 (s large, lH: -H 2'); 4,96 (d large, lH, J = 10: -H 5); 5,22 (s, ;: ~ .
1 H: -H 10); 5,30 (dd, 1H, J = 10 et 2: -H 3'); 5,49 (d, 1H, J - 10: -NH- 3'~; 5,69
(d,: lH, J = 7: -H 2); 6,24 (t, lH, J = 9: -H 13); 7,30 à 7,45 [mt, SH: -C6Hs en 3
: ~ ~ (-H 2 à -H 6)]; 7,51 [t, 2H, J = 7,5: -OCOC6Hs (-H 3 et -H 5)]; 7,&2 [t, H, J = 7,5: .; ~
OCOC6Hs (-H 4)]; 8,11 [d, 2H, J = 7,5~: -OCOC6Hs ~-. 2 et -;~ 6)]. `,;
L'amino-3 hydroxy-2 phényl-3 propionate-(2R,3S~ d'acétoxy~ benzoyloxy-
2cr epoxy-5~,20 hyd~oxy-1 oxo-9 bis-(trichloro-2,2,~ éthoxy)carbonyloxy-7~,10~ :
taxène-11 yle-13c~ peut être préparé ælon la méthode décrite dans la demande . .~
internationale PCT WO 92/08589. : : :
;: Le carbonate de méthyl-1 cyclohexyle et de nitro-4 phényle peut etre ,`
,préparé de la manière suivante ~
A une solution de ~1,14~ g de méthyl-1 cyclohexanol dans 15 cm3 de
30: :dlchlorométhane, maintenue sous atmosphère d'arg~n, on ajoute, à une température
voisine de 20C, 0,79 g de pyridine anhydre puis goutte à goutte, en se maintenant à
: ;~ la: même: ternpérature, une solution de 2,01 g de chlo~ofo~niate de nitro-4 phényle -
dans 15 cm3 de dichlorométhane. Le mélange réactionnel est ensuite agité pendant ~i
24 heures à une température voisine: de 20C puis concentré à sec sous p~ession ~`.
réduite ~2,7 kPa) à 40C. On obtient une meringue blanche que l'on purifie par ~ .
cc~ c~\00\~
.
19
chromatographie sur 60 g de silice (0,0~0,2 mrn) contenus dans une colonne de
3 cm de diamètre [éluant: dichlorométhan~cyclohexane (50-50 en volumes)]. Les
fractions ne contenant que le produit cheirché sont réun~es et concentrées à sec sous
pression réduite (0,27 kPa~ à 4Q9C. On obtient ainsi 1,3 g de carbonate de méthyl~
5 cyclohexyle et de nitro-4 phényle sous forme d'une huile incolore.
EXEMPLE 5
En opérant comme dans l'exemple 4, mais à partir de 0,43 g d'hydroxy-2
(m~thyl-1 trifluorométhyl-1)éthoxycarbonylamino-3 phényl-3 propionate-(2R,3S)
d'acétoxy4 benzoyloxy-2a époxy-5,20 hydroxy-1 oxo-9 bis-(tIichloro-2,2,2 éthoxy)carbonyloxy-7~,10~taxène-11 yle-13a, obtenu par action du carbonate de (méthyl-1trifluorométhyl-1) éthyle e~ de nitro-4 phényle sur l'amino-3 hydroxy-2 phényl-3propionate-(2R,3S3 d'acétoxy4 benzoyloxy-2a époxy-5~,20 hydroxy-1 oXo-9 bis-
(~ichIor~2,2,2 éthoxy)carbony{oxy-7~,10~ taxène-11 yle-13c~, on obtient 0,075 g
d'hydroxy-2 (méthyl-1 trifluoroMéthyl-l)é$hoxycarbonylamino-3 phényl-3 propio-
nate-~2~,3S) d'acétoxy~ benzoyloxy-2a époxy-5~,20 ~rihydroxy-1,7f3,10~ oxo-9
taxène-11 yle-13a sous forme d'une meringue blanche dont les caractéristiques sont
:; ~ }es suivantes ~
pouvoir rotatoire: [a]20D = -28 (c = 0,44; méthanol)
- spectr~ de RMN ~400 MHz; CDC13)
(ppm): 1,15 (s, 3H: -CH3 16 ou 17) :; 1,25 (s, 3H: -CH3 16 ou 17~; 1,54 et 1,60
[2s, 3H chacun: -C(CH3)2~ 1,70 (s, lH: -OH lt; 1,77 ~s, 3H: -CH3 19); 1,84 (s,
~: 3H:: -C~3 1&);; 1,85 [mt, lH: -(C~)-H 6]; 2,25 (d, 2H, J = 9: -CH2- 14); 2,37 (s,
~ ~ 3H ~ OC~:3) ;:2,60 ~mt,~lH: -(CH?-H 6~; 3,36 (d, lH, J = 5 . -O~ 2'); 3,92 (d,
: 25 lH, J = 7~ 3); 4,18 [d9 lH, J = 8: -(CH)-H 20]; 4~211 (s, lH: -OH 10); 4,23
(mt, lH: -H 7); 4,33 [d, lH, J = 8: -(CH)-H 20]; 4,63 (s large, lH: -H 2'); 4,95 (d
large, lH, J = 10:: - 5); 5,21 (s, lH: -H 10); 5,25 (d large, lH, J = 10: -H 3');
5,68 (d, lH, J = 7: -H 2); 5,73 (d, lH, J = 10: -NH- 3'); 6,62 (t, lH, J = 9: -H 13);
7,30 ~ 7~45 [mt, 5H: -C6Hs en 3' (-H 2 à -H 6)~; 7,52 [t, 2H9 J = 7,5: -OCOC6Hs
(-~ 3 et H 5)]; 7,63 [t, lH, J = 7,5: -OCOC6H~' (-H 4)~; 8,12 [d, 2H, J = 7,5
-OCOC6Hs (-~ 2 et ~ 6)~
:
~'; ' "'
. ~
:,:
o~r~
~ ~ p 7 ~:
EXEMPLE 6 ;;
:- ~
A une solution de 0,741 g d'amino-3 hydroxy-2 phényl-3 propionate-
(2R,3S~ d'acétoxy4 benzoyloxy-2c~ époxy-5~,20 hydroxy-1 oxo-9 bis-(trichloro-
2,2,2 éthoxy)carbonyloxy-7~,10~ taxène-11 yle-13a dans 10 cm3 de pyridine
5 anhydre m~ntenue sous atmosphère d'argon, on ajoute, goutte à goutte, une solution
de 0,211 g de carbonate de méthyl-1 cyclopropyle et de tétrachloro-1,2,2,2 éthyle
dans 4 cm3 de pyridine anhydre. Le mélan~e réactionnel est ensuite agité pendant1 heure à une température voisine de 20C puis additionné de 10 cm3 d'eau distillée
et de 10 cm3 de dichlorométhane. La phase aqueuse est séparée par décantation puis
10 extraite par 2 fois 10 cm3 de dichLorométhane. Les phases organiaues sont réunies,
séchées sur sulfate de magnésium, filtré~s p1i~s concentrées a sec sous pressionréduite (2,7 kPa) à 40C. On obtient 0,9 g d'une meringue blanche que l'on purifie
par chromatographie sur 60 g de silice (0,063-0,2 mm) contenus dans une coIonne de
1,5 cm de diamètre en éluant avec un mélange dichlorométhane-méthanol (99-1 en
volumes) en recueillant des fractions de 15 cm3. Les fractions 30 à 37 sont réunies et
concentrées à sec sous pression réduite (0,27 kPa) à 40C. On obtient ainsi 0,578 g
d'hydroxy-2 (méthyl-1 cyclopropyl~oxycarbonylamino-3 phényl-3 propionate-
(2R,3S) d'acétoxy-4 benzoyloxy-2a époxy-513,20 hydroxy^1 oxo-9 bis-(trichloro-
2,2,~ éthoxy)carbonyloxy-7~,10~ taxène-11 yle-13a sous forme d'une meringue
20 blanche.
Une solution de 0,58 g d'hydroxy-2 (méthyl-1 cyclopropyl)carbonylamino-3
phényl-3 propionate-(2R,3S) d'acétoxy~ benzoyloxy-2a époxy-5~,20 hydroxy-1
oxo-9 bls-(trichloro-2,2,2 éthoxy)carbonyloxy-7~,10~!taxène-11 yle-13a dans un
mélange de 25 cm3 de methanol et de 25 cm3 d'acide acétique est chauffée sous
25 agitation et sous atmosphère d'argon jusqu'à une temperature voisine de 60C puis
additionnée de 2,3 g d~ ~inc en pcudre. Le mélange réactionnel est ensuite agitépendant lS minutes a 60C puis refroidi à une température voisine de 20C et filtré
sllr verre fritté garni de célite. Le verre fritte est lavé par 3 fois 15 cm3 de méthano 1
et les fil~ats sont réunis puis concentrés à sec sous pression réduite (2,7 kPa~ à une
30 température voisine de 40C. ;,
Le résidu est additionné de 50 cm~ d'eau distillée et le solide cristallisé est
séparé pa~ filtration, lavé par 4 fois 10 crn3 d'eau distillée et séché sous pression
réduite (2,7 kPa) à 20C pendant 16 heures. On obtient 0,32 g d'une meringue
blanche que l'on purifie par chromatographie sur 30 g de silice (0,063-0,2 mm)
35 contenus dans une colonne de 1 cm de diamè~e [élu~nt dichlorométhane-mé~hanol~.' ' ',''
21
(98-2 en volumes)] en rec~leillant des fractions de 5 crn3. Les fractions ne contenant
que le produit cherché sont réun~es et c~ncentrees à sec sous pression réduite
(0,27 kPa) à 40C pendant 5 heures. On obtient a~nsi 0,11g d'hydroxy-2 (méthyl-1cyclopropyl)oxycarbonylarr~ino-3 phényl-3 propionate-(2R,3S) d'acétoxy4 benzoyl-oxy-2a époxy-5~,20 tlihydroxy-1,7~,10~ oxo-9 taxène-11 yle-13a sous forme d'une
meringue blanche dont les caractéristiques sont les suivantes:
- pouvoir rotatoire: ~al20D = -33 (c = 0,52; methanol)
- spectre cle RMN (400 MHz; CDCl3)
~ (ppm): 0,48 et 0,80 (2mt, 2H chacun: -CH2- du cyclopropyl); 1,13 Is, 3H: -CH3
16 ou 17); 1,25 (s, 3H: -CH3 16 ou 17); 1,42 (s, 3H: -CH3 en 1 du cyclopropyl);
1,76 (s, 3H: -CH3 19); 1,75 à 1,90 [mt, lH: -(CH)-H 6]; 1,83 (s, 3H: -C~3 18);
2,28 (d, 2H, J = 8,5: -CH2- 14); 2,38 (s, 3H: -COCH3); 2,58 [mt, lH: -(CH)-~5
6]; 3,33 (mf, lH: -OH 2'); 3,91 (d, lH, J = 7: -H 3); 4,19 [d, lH, J = 3: -(CH)-EI
201; 4,20 ~s, lH: -OH 10~; 4,23 tmt, lH: -H 7); 4,31 [d, lH, J = 8: -(CH~-H 20];1~ 4,63 (s large, lH: -~ 2'); 4,94 (d large, 1H, J - l0: -H 5); 5,20 (s, lH: -~ 10);
5,28 (d large, lH, J = 10: -H 3'); 5,51 (d, 1H, J = 10: -l~H- 3'); S,68 (cl, 1H, J = 7:
-~ 2); 6,22 (t, lH, J = 8,5: -H 13); 7,25 à 7,45 [mt, 5H: -C6Hs en 3' (-H 2 à
-H 6)]; 7,51 ~t, 2H, J = 7,5: -OCVC6Hs(~ 3 et H 5)3; 7,62 [t, lH, J = 7,5:
OCOC6Hs ~-H 4)]; 8,12 [d, 2H, J = 7,5: -OCOC6Hs (-H 2 et H 6)~
~20 Le carbonate de méthyl-1 cyclopropyle et de tétrachloro-1,2,2,2 éthyle peut
être préparé de la rnaniere suivan~e ~
~. `
A une solution de 0,567 g de méthyl-1 cyclopropanol dans 10 cm3 de
dichlorométhane, maintenue sous atmosphère d'argon, on ajoute, à une températurevoisine de 5C, 0,38 cm3 de pyridine anhydre puis, en maintenant la même
;~; ; 25 température, 0,72 cm3 de chloroformiate de tétrachloro-1,2,2,2 éthyle. Le mélange
reactionnel est ensuite agité pendant 3 heures à une température voisine de 20C puis
additionné de 10~ cm3 d'une solu~ion aqueuse d'acide chlorhydrique lN. La phase
aqueuse est séparée par décantation puis extraite par 10 cm3 de dichlorométhane.LRS phases o~ganiques sont réunies, lavées par 10 crn3 d une solution aqueuse sahlrée
d'hydrogénocarbonate de sodium, séchées sur du ~lfate de magnésium, fil~rées et
concentrees à sec SQUS pression réduite ~2,7 kPaj à 40C. On obtient 1,15 g d'une
,
huile jaune pâle que l'on purifie par chroma~ographie sur 25 g de silice (0,()63~
0,2 mm) contenus dans une colonne de 1 cm de diamètre en éluant avec un mélange
dichlorométhane-cyclohexane (50-50 en volumes) et en recueillant des fractions de ~;
12 cm3. La fraction 3 est concentré~e à sec sous p,ession réduite (0,27 kFa) à 40C'C.
~ ~,
.. .
r ; ,. . ~
22
On obtient ainsi 0,14 g de carbonate de méthyl-1 cyclopropyle et de té~achloro-
1,2,2,2 éthyle sous forme d'une huile incolor~
,.~ .; .~;
EXE~P~E 7
En opérant comme dans l'exemple 6, mais à partir de 0,60 g d'hyd~oxy-2
S (chloro-2 diméthyl-1,1)éthoxycarbonylamino-3 phényl-3 propionate-(2R,3S)
d'acétoxy4 benzoyloxy-2cc époxy-5~,20 hydroxy-l oxo-9 bis-(trichloro-2,2,2
éthoxy)carbonyloxy-7~,10~ taxène-11 yle-13a, obtenu par action du carbonate de
(chloro-2 diméthyl-1,1) éthyle et de tétrachloro-1,2,2,2 éthyle sur l'amino-3
hydroxy-2 phenyl-3 propionate-(2R,3S) d'acétoxy-4 benzoyloxy-2a épo~y-5~,20
hydroxy-1 oxo-9 bis-(trichloro-2,2,2 éthoxy)carbonyloxy-7~,10~3 taxène-11 yle-13cc,
on obtient 0,203 g d'hydroxy-2 (chloro-2 dirnéthyl-1,1)éthoxycarbonyl~nino-3
phényl-3 propionate-~2R,3S) d'acétoxy4 benzoyloxy-2a époxy-5~,20 trihydroxy
1,7~,10~ oxo-9 taxène-11 yle-13a sous forrne d'une meringue blanche dont les
caractéristiques sont les suivantes
- ~uvoi~ rotato~re: [c~]2QD = -34 (c = 0,45; méthanol)
- spect~ede RMN (400 MHz; CDCl3)
~(ppm): 1,16 et 1,28 (2s, 3H chacun: -C~3 16 et -CH3 17); 1,41 et 1,44 ~2s, 3H
chacun: -C(C~3)2}; 1,69 (s, lH: -QH 1); 1,78 (s, 3H: -C~3 19); 1,80 à 1,95 [mt~
1 H: -(CH)-H 6]; 1,87 (s, 3H: -CH3 18); 2,31 tab, 2H, J = 16 et 9: -CH2- 14);
2i3i (s, 3H: -COC~3); 2,60;[mt, lH: -(CH)-H 6]; 3,35 (mf, 1H: -O~ 2'); 3,65 e~
3,76 (2d, 1~I:chacun, J = 11: -CH2Cl); 3,95 (d, 11H, J - 7: -H 3); 4,17 (s large,
lH: -O~ 10); 4,23 et 4,32 (2d, lH chacun, J = 8: -CH2- 20); 4,24 Imt, lH: -~ 7j;4,65 (s large, lH: -~ 2'); 4,95: (d large, lH, J = 10: -H 5); 5,22 (s, 1H: -~ 10);
5,30~ ~d large, 1H, J - 10: -~: :3'); S,58 (d, 1H, J = lQ: -N~- 3'); 5l71 (d, lH, J = 7:
25 ~ -~ 2~; 6,27 (t, lH, J = 9 ::-~13); 7,30:à 7,50 [mt, SH: -C6Hs en 3' (-~ 2 à -~ 6)];
~7,50 ~t, :2H, J = 7,5: -QCOC6Hs (- :3 et -H 5)]:; 7,61 Lt, IH, J = 7,5: -OCOC6Hs
(-~4)]; 8,12 [d, 2H, J = 7,5: ~-OCOC6Hs (-H 2 et -H 6)3.
EXEMPLE 8 :
En opéran~ comme dans l'exemple~ 6, mais a :~partir de 0,35 g d'hydroxy-2
3Q cyclohexylcarbonylamino-3 phényl-3 :propionate-(2R,3S) d'acétoxy-4 benzoyloxy-
2a épo~y-5~,20 hydroxy-1 oxo-9 bis-(~ichloro-2,2,2 étlioxy)carbonyloxy-7~3,10
taxène-1 yle-13a, obtenu par action du carbonate de cyclohexyle et de tétrachloro-
1,2,2,2 éthyle sur l'amino-3 hydroxy-2 phényl-3 p~opionate-(2R,3S) d'acétoxy-4
,' "~
.
,, :'' ,'
..
- ;
r
23
benzoyloxy-2a époxy-5~,20 hydroxy-1 oxo-9 bis-(trichloro-2,2,2 éthoxy)carbonyl-
oxy-7~,10~ taxène 11 yle-13a, on obtient -;~,090 g d'hydroxy-2 cyclohexylcar~o-
nylamino-3 phényl-3 propionate-(2R,3S) d'acétoxy4 ben~oyloxy-2a époxy-5~,20
trihydroxy-1,7~,10~ oxo-9 ~axène-11 yle-13a sous forme d'une meringue blanche
dont les caractéris~ques sont les suivantes:
- spec~e de RMN (400 MHz; CDC13)
(ppm): 1,16 et 1,28 (2s, 3H chacun: -C~3 16 et -C~3 17); 0,95 à 1,95 (mt, 1OH:
-CH2- du cyclohexyl); 1,77 (s, 3H: -CH3 19); 1,80 à 1,95 [mt, 11H: -(CH)-~ 6];
1,87 (s, 3H: -CH3 18); 2,27 (ab, 2H, J = 16 et 9: -CH- 14); 2,42 (s, 3H:
-COCH3); 2,61 [rnt, lH: -(CH)-H 6]; 3,40 (s large, lH: -OH 2'); 3,94 (d, lH, J =7: -H 3); 4,15 à 4,30 (s, 2H: -OH 10 et -~ 7); 4,20 et 4,33 (2d, lH chacun, J - 8:
-CH2- 2~); 4,52 (mt, lH: -CH- du cyclohexyl); 4,6~ (s large, 1H: -H 2'~; 4,96 (dlarge, lH, J = 10: -~ 5~; 5,23 (s, lH: -~ 10); 5,34 (d large, lH, J - 10: -H 3');
S,58 (d, lH, J = 10: -NH- 3'); 5,70 (d, lH, J = 7: -H 2); 6~27 (t, lH, J - 9:
-~113~; 7,25 à 7,50 [mt, 5H: -C6Hs en 3' (-~ 2 à -H 6)]; 7,53 [~, 2H, J = 7,5:
-OCOC6H~; (-H 3 et -~ 5)]; 7,64 [t, lH, J - 7,5: -OCOC6Hs (-H 4)]; 8,13 [d, 2H,
J = 7,5: -OCOC6Hs (-~ 2 et -~ 6)~
EX~IPLE 9
En operant comme dans !'exemple 6, mais à partir de 0,75 g d'hydroxy-2
cyclobutyloxycarbonylamino-3 phényl-3 propionate-(2R,3S) d'acétoxy4 benzoyl-
o~y-2c~ époxy-513,20 hydroxy-1 oxo-9~ bis-(trichloro-2,2,2 éthoxy)car~onyloxy-
7~,10fl taxène-11 yle-13a, obtenu par action du carbonate de cyclobutyle et de
tétrachloro-1,2,2,2 é~yle sur l'arnino-3 hydroxy-2 phényl-3 propionate-~2R,3S)
d'acé~4 benzoyloxy-2c~; épo~xy-5~,20 hydroxy-1 oxo-9 bis-(trichloro-2,2,2
éthoxy)carbonyloxy-7~,10~ taxène-11 yle-13cc, on obtient û,128 g d'hydroxy-2
cy~lobu~rloxycarbonylami~ao-3 phényl-3 propionate-(2R,3S) d'acétoxy4 ben~oyl-
oxy-2a époxy-5~,20 tr~hydroxy-1,7~,10~3 oxo-9 taxène-11 yle-13a sous forme d'unehleringue blanche dont les caractéristiques sont les suivantes:
- pouvoir rotatoire: ~a~20D = -31 ~c - 0,47; méthanol)
- spectre de RMN (400 MHz; CDCl3)
(ppm): 1,13 et 1,23 (2s, 3H chacun: -CH3 16 et -CH3 17); 1,30 à 2,30 (mt, 6H:
-C~2- du cyclob~ rl); 1,75 Is. 3H ~ H3 19); 1,~5 à 1,90 [mt, lH: -(CH)-H 6];
1,82 (s, 3H: -CH3 18); 2,10 à 2l30 (mt, 2H: -CH2- 14); 2,37 (s, 3H: -COCH3);
2,57 [mt, lH: -(CH)-~ 6]; 3,32 (mf étalé-, lH: -OH 2'); 3,90 (d, lH, J = 7: -H 3);
,p.:
0\~\~
~r
'.: ''-'
24
4,1~ et 4r30 (2d, lH chacun, J - 8: -CH2- 20); 4,22 (mt, lH: -H 7); 4,62 (d, lH,J = 2,5 ~ 2'); 4,80 (quintuplet, 1H, J = 7,5: -CH du cyclobutyl); 4,92 (d large,lH, J = 10: -H 5); 5,18 (s, lH: -H 10); 5,27 (d large, lH, J = 10: -H 3'); 5,58 (d,
lH,J=10:-NH-3');5,66(d,11H,J=7:-H2);6,22(t,11H,J-9:-H13);7,25
~ 7,45 ~mt, 5H: -C6Hs en 3' (-H 2 à -H 6)]; 7,50 [t, 2H, J = 7,5: -OCOC6Hs (-H 3et -~15)~; 7,61 ~t, lH, J = 7,5: -OCOC6Hs (-lEI 4)]; ~,11 [d, 2H, J = 7,5
-OCOC6Hs (-~ 2 et -H 6)].
EXEMPLE lO
En opérant comme dans l'exemple 6, mais à partir de 0,71 g d'hydroxy-2
(méthyl-1 cyclopentyl)oxycarbonylarnino-3 phényl-3 propionate-(2R,3S) d'acétoxy-4
benzoyloxy-2a époxy-5~,20 hydroxy-1 oxo-9 bis-(trichloro-2,2,2 éthoxy)car~onyl-
oxy-713,101'3 taxène-11 yle-13c~, obtenu par action du carbonate de méthyl-1
cyclopentyle et de tétrachloro-1,2,2,2 éthyle sur l'amino-3 hy~oxy-2 phényl-3
propionate-(2R,3S) d'acétoxy4 be-Lzoyloxy-2a époxy-513,20 hydroxy-1 oxo-9 bis-
(trichloro-2,2,2 éthoxy)carbonyloxy-7~910~ taxène-11 yle-13a, on obtient 0,103 gd'hydroxy-2 (méthyl-l cyclopentyl)oxycarbonylamino-3 phényl-3 propionate-
(2R,3S) d'acétoxy4 benzoyloxy-2a époxy-5~,20 trihydroxy-1,71'3,101'3 oxo-9
taxène-11 yle-13a sous forme d'une meringue blanche dont les caractéristiques sont
les suivantes
- pouvoi~ rotatoire: [aI20D = -28 (c = 0,50; méthanol~
- spectre de RMN (400 MHz; CDCl3):
(ppm): 1,15 ~et 1,26 (2s, 3H chacun: -CH3 16 et -C~I3 17); 1,45 (s, 3H: -CH3 du
n~éthyl-l cyclopentyi); 1,40 à: 1,75 et 2,03 (2mt, res~ectivement 6H et 2H: -CH2-
du méthyl-1~cyclopentyl) :; 1,76 (s, 3H: -CH3 19); 1,80 à 1,90 [mt, lH: -(CH)-
2 5 ~6]~; 1,85 (s, 3H: -CH3 18); 2,30 (d, 2H, J ~ 9: -C~2- 14~; 2,36 (s, 3H:
COC~3); 2,59 [mt, lH ~ -~CH)-H 6]; 3,30 ~mf étalé, lH: -0~ 2'); 3,94 (d, lH,
J = 7 ~ 3~; 4,10 à 4,30: (mf, lH: -OH 10~; 4,22 et 4,32 (2d, lH chacun, 3 - 8:
-CH2- 20j; 4,22 (mt, 1H ~: - 7); 4,62 (d, lH, J - 1 j5: -H 2'); 4,95 (d large, lH, J,=
10: -H 5~; 5,21 (s, lH: -H 103; ~,26 (d large, lH, J - lQ: -H 3'); 5,43 ~d, 1H, J =
: ~ ~ 30 lO: -~- 3'); 5,70 (d, lH,~J ~ 7: -H 21; 6,23 ~t, lH, J = 9: -H 13); 7,30 à 7,45
~: ~ [mt, SH :~-C6Hs en 3' ~-H 2 à -H 6)]; 7,50 [t, 2H, J - 7,5: -OCOC6Hs ~-~ 3 et -H
~):]; 7,61 [t, :lH, J = 7,5: -OCOC6Hs (-H 4)]; 8,11 [d, 2H, J = 7,5: -OCOC6Hs (-H
2 et -H S)].
. . . ~
E~EI~fPLE 11
En opérant comme dans l'exemple ~, mais à partLr de 0,35 g d'hydroxy-2
(pentyl-3)oxycar~onylamino-3 phényl-3 propionate-(2R,3S) d'acétoxy-4
benzoyloxy-2a époxy-5~,20 hydroxy-1 oxo-9 bis-(trichloro-2,2,2 éthoxy)
car~onyloxy-7~,10~ taxène-11 yle-13cc, obtenu par action du carbonate de pentyl-3
et de tétrachloro-1,2,2,2 éthyle sur l'amino-3 hydroxy-2 phényl-3 propionate-(2R,3S)
d'acétoxy~ be~zoyloxy-2a époxy-5~,20 hydroxy-1 oxo-9 bis-(trichloro-2,Z,2
éthoxy)carbonyl-o~y-7~,10~ taxène-11 yle-13a, on obtient 0,115 g d'hydroxy-2
(pentyl-3)oxycar~onylamino-3 phényl-3 propionate-(2R,3S) d'acétoxy4 be~zoyl-
oxy-2a époxy-5~,20 trihydroxy-1,7~,10~ oxo-9 taxène-11 yle-13cc sous forme d'unemeringue blanche dont les caractéristiques sont les suivantes:
- pouvoir rotatoLre: [a]20D = -31 (c = 0,5Z; méthanol)
- spectre de RMN (400 MHz; CDCl3)
~ (ppm): 0,76 et 0,84 (respectivement t large et t, 3H chacun, J = 7,5: -C~13 dupentyl); 1,15 et 1,26 (2s, 3H chacun: -C 3 16 et -CH3 17); 1,40 à 1,60 (mt, 4H :-CH2 du pentyl); 1,69 (s, 1H: -OH 1); 1,78 (s, 3H: -CH3 19); 1,80 à 1,95 [mt,
lH: -(CH)-~5 6]; 1,87 ~s, 3H: -C~3 18); 2,31 (ab, 2H, J = 16 et 9: -C~I2- 14);
2,3~ (s, 3H: -COC~3); 2,60 [mt, lH: -(CH)-~ 6~; 3,31 (d, lH, J = 3: -OH 2');
3,94 (d, lH, J - 7: -~I 3); 4,17 (s large, lH: -OH 10); 4,22 et 4,32 (2d, lH chacun,
J = 8: -C~2- 203; 4,24 (mt, lH: -H 7); 4,55 [quintuplet, lH, J = 7,5:
-C~(C2Hs)2]; 4,65 (s large, lH: -H 2'); 4,95 (d large, lH, J = 10: -H 5); 5,22 (s,
lH: -H 10~; 5,32 (d large, lH, J - 10 :: -H 3'); 5,54 (d, lH, J - 10: -NH- 3'); 5,70
(d, lH, J ~ 7: -H 2); 6J24 ($, :1H, J = 9: -h 13); 7,30 à 7,45 [mt, 5H: -C6Hs en 3
2 à .~ 6)]; 7.50 It. 2H,::J = 7,5: -OCOC6Hs(-~ 3 et -H 5)]; 7,61 [t, lH, J = 7,5:
-OCOC6Hs (-~ 4)]; 8,12~d, 2H, J = 7,5: -OCOC6Hs (-~ 2 et -H 6)]-
EXEMPLE 12
, .
A une solution de 0,16 g d'hydroxy-2 [(méthoxy-4) benzyloxy-2 ;~
~ ~diméthyl-1,1]i~ éthoxycarbonylamino-3 phényl-3 propionate-(2R,3S) dlacétox:y-4
: ~ benzoyloxy-2a époxy-5~,20 trihydroxy-1,7~,10~ oxo-9 taxène-11 yle-13a dans
3 0 10 cm3 de dichlorom~thane, maintenue sous atmosphère d'argon, on ajoute, à une :
temperature voisine de 20C, 0,115~ g de dichloro-2,3 clicyano-5,6 benzoquinone puis
0,2 cm3 d'eau distillée. Le mélange réactionnel est ensuite agité pendant 1 heure 30 : . -
minutes à une température voisine de 20C puis additionné de 100 crn3 de ~ `
. ,;, ,.
;,'
26
: '' ',,.',.
dichlorométhane. La phase organique est séparée par décantation, lavée par 2 fois
50 cm3 d'une solution aqueuse saturée d'hydrogénocarbonate de sodium puis par
50 cm3 d'eau distillée, séchée sur du sulfate de magnésiurn, filtrée et concentrée a
sec sous pression réduite (2,7 kPa~ à 40C. On obtient 0,171 g d'une meringue
blanche que l'on purifie par chromatographie sur 10 g de silice (0,063-0,2 mm~
contenus dans une colonne de 1 cm de diamètre en éluant avec un mélange
dichlo~ométhane-méthanol (95-5 en volumes) et en recueillant des &actions de
5 cm3. Les fractions ne contenant que le produit cherché sont réunies et concentrées
à sec sous pression réduite (0,~7 kPa) à 40C. On obtient ainsi 0,083 g d'hydroxy-2
(hydroxy-2 diméthyl-1,1)éthoxycarbonylamino-3 phényl-3 propionate-(2R,3S)
d'acétoxy 1 benzoyloxy-2a époxy-5~,20 trihydroxy-1,7~,10~ oxo-9 taxène-11 yle-
13a sous forme d'une meringue blanche don~ les caractéristiques sont les suivantes
- pouvoir rotatoire: [a]20D = ~31 (c = 0,47; méthanol)
- speetre de RMN (400 MHz; CDC13 ~ ~ CD30D)
~ ~ 15~ ~ (ppm): 1,01 et 1,10 (2s, 3H chacun: -CH3 16 et -C~3 17); 1,18 et 1,22 [2s, 3H
;~ ~ chacun: -C~C~3)2]; 1,62 (s, 3H: -C~3 19); 1,70 à 1,85 [mt, lH: -(CH)-~ 6];
1,80 (s, 3H: -C~53 18); 2,04 et 2,17 (2dd, 2H, J = 16 et 9: -CH2- 14); 2,28 (s, 3H ~
-CO~3); 2,39 ~mt, ~lH: -(CH)-~ 6]: 3,26 et 3,46 [2d, 2H, J = 13: -C(CH3)2
CH2OH]; 3,76 (d, 1H. J - 7: -H 3); 4?08 (dd, lH, J - 13 et 7: -~ 7), 4~13 et 4,15
(2d, lH chacun, J = 8: ~CH2- 20); 4,46 (d, lH, J = ?: -H 2'); 4,85 ld large, lH, J ~
10: ~ 5); 5,I0 (s, 1H . -~10) ;:~5,11 (d, lH, J = 2: -H 3'); 5,55 (d, lH, J = 7:2); ~6,12 (t, 1lH, J =~9: -~ 13) ;~ 7,15 à 7,35 ~mt, 5H ~ 6Hs en 3' (-H 2 à -~
6)];; 7~38 ~t, ~2H, J = 7,5: OCOC6Hs (-~E 3 et -h 5)] ;: 7,49 [t, 1H, J = 7,5:
OCOC6Hs (-~ 4)~; 7,97 [d, 2H, J = 7,5: -OCOC6Hs (-~ 2 et -H 6~
25~ ~- L'hydroxy-2 [~(méthoxy-4~ benzoyloxy]-2 diméthyl-1,1] éthoxycarbonyl-amino-3 phényl-3 ~pro~io:nate-(2R,3S) d'acétoxy-4~ benzoyloxy-2a époxy-5~,2û
trihydroxy-1,7~ 0~ oxo-9~ taxène 11~yle-I3a es~ obtenu par a~tion du zinc dan~
~; ~ l'acide ~acéti~ue sur l'hydroxy~2 [[(méthoxy-4) benzoyloxy]-2 diméthyl-1,1] é~hoxy~
carbonyl-`amiIio-3 phényl-3 propionate-(2R,3g) d'acétoxy4 be~oyloxy-2a époxy-
5~,20 ;hydroxy-1 oxo-~ ~bis-(trichloro-2.2,2 étho~jcarbonyloxy-7~,10~ talcène-11yle-13a qui~ est lui-même ~obtenu par action du carbonate de ~[(méthoxy-4
zy1Ox~r~-2 diméthyl-1,1] ~7ylen et~ de tétrachloro-1,2,2J2 éthyle sur 1'amino-3
hyc~o~ 2 phényl-3 propionate-(2Ri3S) d'acétoxy~ be~oylo7~y-2a époxy-5~,20
hyd~oxy-1 oxo-9 bis-(trichl~ro-2,2,2 ~thoxy)carbonyloxy-7~,10~ tax~ne-11 yle-13cc.
~ ~: . ., ", ~ .:
. . 5
.:
'`'.. ''
Le (méthoxy4) benzyloxy-1 méthyl-2 propanol-2 peut être préparé de la
mar~ière suivante ~
A 120 cm3 de diméthylforniamide anhydre maintenu sous atmosphère
d'argon, on ajoute, à une température voisine de 15C, 9,6 g d'une suspension
huileuse (50 ~o en poids) d'hydrure de sodium puis goutte à goutte, en se maintenant
à la même température, une solution de 10,9 g de chloro-l méthyl-2 propanol-2 dans
20 cm3 de diméthylformamide anhydre. Le mélange réactionnel est ensuite agité
pendant 2 heures à une température voisine de 20C puis on ajoute, goutte à goutte
en se maintenant à cette température, une solution de 12,5 cm3 d'alcool méthoxy-4
~enzyli~ue dans 20 cm3 de diméthylfo~amide anhydre et maintient le mélange
réactionnel sous agitation, à une température voisine de 20C, pendant 48 heurespuis chauf~e à 50C pendant 8 heures et refroidi à une température ~oisine de 20C
et maintient 16 heures à cette températ~e. Le mélange réactionnel est ensuite ajouté
à 1200 cm3 cl'eau distillée et acidifié jusqu'à un pH voisin de 5 par addition de
175 cm3 d1une solution aqueuse d'acide chlorhyd~ique lN. Apres avoir ajouté
250cm3 de dichloronnéthane la phase aqueuse est séparée par déc~tation puis
extraite par 2 fois 250 cm3 de dichlorométhane. Les phases organiques sont réunies,
séchées sur sulfate de magnésium, filtrées puis concentrées à sec sous pression
réduite (2,7 kPa) à 40C puis (0,27 kPa) à 60C. L'huile résiduelle est purifiée par
chromatographie sur 500 g de silice (0,063-Q,2 mm) contenus dans une colo~e de
5 cm de diarnètre (éluant: dichlorométhane) en recueillant des frac~ions de 75 cm3
Les Practions 13 à 4$ sont réunies et concentrées à sec sous pression réduite
(0,27 kPa) à 40C. On obtient~ ainsi 13,6 g de (méthoxy4) benzyloxy-l méthyle-2
propanol-2 sous fonne d'une huile jaune.
Le ca~bonate de~ [~iméthoxy-4) benzyloxy]-2 diméthyl-1,1] éthyle et de
tétrachloro-1,2,2,2 éthyle es$ obtenu par action du (méthoxy4) benzyloxy-1
mét~yl-2 propanol sur le chloroformiate de tétrachloro-1,2,2,2 éthyle en présence de
pyri~ine à OC.
~ En operant comme~dans l'exemple 4, mais à partir de 0,26 g d'hydroxy-2
(dime~yl-l,l propyne-2) yloxycarbonylamino-3 phényl-3 propaonate-(2R,3S)
d'acétoxy4 be~oyloxy-2cc époxy-5~,20 hydroxy-l oxo-9 bis-(trichloro-~,2,2
éthoxy3 earbonylQxy-7~,10~ taxène-ll yle-13a, obtenu par action du carbonate de
''''-'''':
-. _.,- , ., -
... . ..
~:.. ' '.
28
'.',',' `
diméthyl-1,1 propyne-2 et de r~itro-4 phényle sur l'amino-3 hydroxy-2 phényl-3
propionate-(2R,3S) d'acétoxy~ benzoyloxy~2a époxy-5~,20 hydroxy-1 oxo 9 bis-
(trichloro-2,2,2 éthoxy)carbonyloxy-7~,10~ ~axène-11 yle-13cc, on obtient û,013 g
d'hydroxy-2 ~dimethyl-1,1 propyne-2) yloxycarbonylamino-3 phényl-3 propionate-
(2R,3S) d'acétoxy~ benzoyloxy-2a époxy-5~,20 trihydroxy-1,7~,10~ oxo-9
t&lcène-11 yle-13a sous forrne d'une meringue blanche dont les caractéristiques sont
lessuivantes:
- spectre de RMN (400 MHz; CDCl3; ~ en ppnl)
1,15 (s, 3H: -C~3 16 ou 17~; 1,26 (s, 3H: -C~:I3 16 ou 17~; 1,60 et 1,64 [2s, 3Hchacun: -C(CH3)2]; 1,67 (s, lH: -0~1); 1,79 (s, 3H: -CH3 19); 1,87 (s, 3H:
-C~53 18); 1,87 [mt, lH: -(CH)-~I 6]; 2,35 (ab limite, J = 16 et 9 Hz, 2H: -CH2-14); 2,38 (s, 3H: -COCH3); 2,43 (s, lH: -C_CO; 2,60 [mt, lH: -(CH)-H 6];
3,27 (d, J = 4, lH: -O~ 2'); 3,95 (d, J - 7, lH: -H 3); 4,17 (s large, lH: -OH 10);
4,23 [d, ~ = 8, lH: -(CH)-~ 20]; 4,23 (mt, lH: -H 7); 4,32 [d, J = 8~ lH: -(CH)-~
20}; 4,64 (mt, lH: -H 2'); 4,95 (dd, J - 10 et 2, lH: -~ 5); 5,21 (s large, lH: ~
10); 5,33 (d la~ge, J = 10, lH: -H 3'); 5,52 (d, J = 10, lH: -N~l- 3'); S,71 (d, J = 7,
lH :~-~ 2); 6,26 ~t, J = 9, lH: -H 13)~; 7,30 à 7,45 [mt, 5H: -C6H~ en 3' (-~ 2 à -~
6)~; ~7,52 Et, J - 7,5, 2H: -OCOC6Hs (-H 3 et -~ 5)]; 7,63 ~t, J = 7,5, lH:
OCOC6Hs (-~ 4)]; 8,12 [d, J - 7,5, 2H: -OCOC6Hs (:-~ 2 et -H 6)].
~ ~ Le carbonate de diméthyl-1,1 propyne-2 et de nitro-4 phényle, sous forme
:: : de cristaux creme fondant à 58~, peut être obtenu par action du diméthyl-1,1
; ~ propyne-2 ol sur le chloroformlate de nitro-4 phényle.
~s nouvealL~c procluits: de formule génerale II) présentent des activités
biologiques particulièrement intéressantes.
25~ ~s ~nouveaux ~produits; de~:formule générale ~I) manifestent une activité
in~ubitcice~s~nificative de la~prolifération cellulaire ano~male et possèdent des
propn~tés~ ~érapeubques pennettant le trai$ement de malades ayant des conditions:pa~ologiques~asso~iees à une proliferation cellulaire anormale. Les conditions
~ pathologiques incluent la prolifération cellulaire ano~nale de cellules malignes ou
non malignes:de divers tissus:et/ou organes compre,nant, de manière non limitative,
les tissus~musculaires, osse x ou conjonctifs, la peau,~ le cerveau, les poumons, les
organes sexuels, les systèmes lymphatiques ou rénaux, les celluIes mammaires ou
sangl~ines, le foie, :l'appareil digestif, le pancréas et les glandes t~yroides ou ad~é~
nales.; Ces condi~ions pa~ologiqucs peuvent inclilre également le psoriasis, lestume~lrs solides,~ les cancers de l'ovaire, du sein, du cerveau, de la prostate, du colon,
.:
29
de l'estomac, du rein ou des testicules, le sar~ome de Kaposi, le cholangiocarcinome,
le choriocarcinome, le neuroblastome, la tuffneur de Wilms, la maladie de Hodgkin,
les mélanomes, les myélomes multiples, les leucémies Iymphocytaires chroniques,
les lymphomes granulocytaires aigus ou chroniques. Les nouveaux produits selon
5 l'in~ention sont particulièrement utiles pour le traitement du cancer de l'ovaire. Les
produits selon l'invèntion peuvent être utilisés pour prévenir ou retarder l'apparition
ou la réapparition des conditions pathologiques ou pour traiter ces conditions
pathologiques.
Les produits selon l'invention peuvent être administrés à un malade selon
10 différentes formes adaptées à la voie d'administration choisie qui, de préférence, est
la voie parentérale. L'administration par voie parentérale comprend les administra-
tions intraveineuse, mtraperitonéale, intramusculaire ou sous-cutanée. Plus par~icu-
lièrement préférée est l'administration intrapéritonéale ou intraveirleuse.
La présente invention comprend également les cornpositions phannaceu-
15 tiques qui contiennent au moins un produit de formule générale (Ia) en une quantitésuffisante adaptée à l'emploi en thérapeutique humaine ou vétérinaire. Les compo-
.
sitions peuvent être préparées selon les méthodes habituelles en utilisant un ouplusieurs adjuvants, supports ou excipients pharmaceutiquernent acceptables. Lessupports convenables incluent les diluants, les milieux aqueux stériles et divers
20; solvants non toxiques. De préférence les compositions se presentent sous forrne de
solutions ou de suspensions aqueuses, ~de~ solutions in~ectables qui peuvent contenir
des agents émusifiants, des colorants, des préservatifs ou des stabilisants.
Le ehoix~des adjuvants ou excipients peut être déterminé par la solubilité et
les p~opnétés chimiques du produit, le mode partlculier d'administration et les
25~ ~ bonnespratiquespha~maceutiques.
Pour l'administration~parenté~ale, on ut-lise des solutions ou des susp~nsions
stériles a~queuses ou non aqueuses. P~ la~préparation de solutions ou de suspensions
non aqueuses peuven~tre~utiIisés des huiles végétales naturelles telle que l'huiIe
d'olive, rhuilq deIsesame ou i'huile de paraffine ou les esters organiques inJectables
30 ~el que~i'oléate d'éthyle. Le~ solutions stériles aqueu~es peuvent être const ituées d'un~
solution d'un sel phannæeutiquemer~t~æceptable en solution dans de l'eau. Les
solutions~ aqueuses conYiennent pour~l'adminis~ation intraveineuse dans la mesure où
le p~I~est conveIlablement aJusté et où risotonicité est realisée, par exemple, par une
quantite suffisante de chlon~re de sodîurn ou de glucose. La stérélisation peut etre
35 réalisée par chauffage ou par tout autre moyen qui n'altère pas la composition.
;,.. ~:
F~ OOlF~E
'-'..
: .,. .:
Il est bien entendu que tOUS les produits entrant dans les compositions selon
l'invention doivent être purs et non toxiques ~our les quantités utilisées.
Les compositions peuvent contenir au moins 0,01 % de produit thérapeuti-
quement actif. La quantité de produit actif dans une composition est telle qu'une
5 posologie convenable puisse etre prescrite. De préférence, les compositions sont
préparées de telle façon qu'une dose unitaire contienne de 0,01 à 1000 mg environ de
produit actif pour l'administration par voie parentérale.
Le traitement thérapeutique peut être effectué concuremment avec d'autres
traitements thérapeutiques incluant des rnédicameMs antinéoplastiques, des anticorps
10 monoclonaux, des thérapies immunologiques ou des radiothérapies ou des
rnodificateurs des réponses biologiques. Les modificateurs des réponses incluent, de
ma~ière non limitative, les Iymphokines et les cytokines telles que les interleuk~es,
les interférons~cc, ~ ou ~) et le TNF. D'autres agents chimiothérapeutiques utiles dans
le traitement des désordres dus à la prolifération anormale des cellules incluent, de
15 manière non limitative, les agents alkylants tels que les moutardes à l'azote comme la
mechloretamirle, le cyclophosphamide, le; melphalan et le chlorambucil, des
sulfonates d'alkyle comme le busulfan, les nitrosourées comme la carmustine, la
lomusine, la sémustine et la streptozocine, les triazenes comme la dacarbazine, les
antimétabolites comme les analogues de l'acide folique tel que le méthotrexate, les
20 analogues de pyrimidine comme Ie fluorouracil et la cytarabine, des analogues de
purines comme la mercaptopurine et la thioguanine, des produits naturels tels que les
alcaloides de vinca comme la ~ vinblastine, la vincristine et la vendésine, des
épi~odophyllotoxines comme l'étoposide et~le teniposide, des antibiotiques comme la
dactinomycine, la daunorublcine, la~doxorubicine, la bléomycine, la plicamycine et
25~ ~- la mitomycine,~ des enzymes comme la l.-asparaginase, des agents divers comme les
complexes de coordinàtion du platine~tei que le cisplatine, les urées substituées tel
que~l'h~xyurée, les dénvés de~ méthylhydr~é comme la procarbazine, les
suppresseurs adréno~otlcoiques comme~ le rnitot~ne et l'aminoglutéthymide, les
~ hormones et les~ antagonistes~ comme les adrénocorticost~oides comme la
3~ ~pred~ison~, le~ progestines ~omme le~caproate d'hydroxyprogestérone, I'acétate de
méthoxyprogestérone ~ et~ l'acétate ~ de megestro~ ~ les oestrogènes comme le
di~thylstilbestrol et l'étilynylest~adiol, les~antioestrogène comme le ~amoxifène, les
androgènes comme le propionate de testostérone et la fluoxymésterone.
Les dvses utilisees pour met~e en oeuvre les méthodes selon l'invention
35 sont celles qui permettent un ~raitement prophylactique ou tlll max~mum de réponse
L~E
thérapeutique. Les doses ~arient selon la forme d'administration, le produit par~icu-
lier sélectionné et les caractéristiques propres du sujet à traiter. En général, les doses
sont celles qui sont thérapeutiquement efficaces pour le traitement des désordres dus
à une prolifération cellulaire anormale. Les produits selon l'invention peuvent être
5 adrninistrés aussi souvent que nécessaire pour obtenir l'effet thérapeutique désiré.
Certains malades peuvent répondre rapidement à des doses relativement fortes ou
faibles puis avoir besoin de doses d'entretien faibles ou nuIles. Généralement, de
faibles doses seront utilisées au début du traitement et, si nécessaire, des doses de
plus en plus fortes seront administrées jusqulà l'obtention d'un effet optimum. Pour ~ ;~
10 d'autres malades il peut être nécessaire d'administrer des doses d'entretien 1 à 8 ~ois
par jour, de préférence 1 à 4 fois, selon les besoins physiologiques du malade ;;
considéré. Il est aussi possible que pour certains malades il soit nécessaire de -
n'utiliser qu'une à delLY adrninistrations journalières. :
Chez l'homme, les doses sont généralement co~nprises entre 0~01 et 200
mg/kg. Par voie intrapéritonéale, les doses seront en général compnses entre 0,1 et ` ' -
100 mg/kg et, de pré~érence entre 0,5 et 50 Mg/k~g et, encore plus spécifiquement
entre 1 et 10 m~/kg. Par voie in~raveineuse, les doses sont généralement comprises ~,
entre 0,1 et ~0 mg/kg et, de préférence entre 0,1 et 5 mg/kg et, encore plus spécifi-
quement entre 1 et 2 mg/kg ~l est entendu que, pour choisir le dosage le plus
approprié, devrom être pris en compte la voie d'administration, le poid~ dw malade, :-
` ~ son état de santé gélléral, son age et tous les ~acteurs qui ~euvent influer sur l'effi-
cacité du traitement. ~ -
L'exemple suivant illustre une composition selon l'in~ention. ~ -
E~I\~PLE ~ ~
On dissout 40 mg du ~produit obtenu à l'exemple 1 dans 1 cm3 d'Emulphor i . i
EL 620 et 1 cm3 d'éthanol puis la solution est diluée par ad~ition de 18 cm3 de
sé~physiologique.
~a comp~sition est administrée par introduction dans une perfusion d'un
soluté physiologique pendant 1 heure. j ~
. ,..~, .
., :.,,
~:
, ~,