Note: Descriptions are shown in the official language in which they were submitted.
Wo 93/17027 ? ~ r PCl /FR93/00173
NOtlVET~LF~ APPLICATIO~I TUF~RAPF~UrIOlJE DE DERIVES nu
PYRII)YT.PYRROLOTHIAZOLF~ CARBOXAMTr)E
La présente invention concerne une nouvelle application
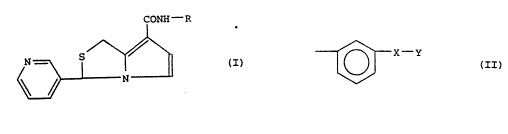
thérapeutique de dérivés du (pyridyl-3)-3 1H,3H-pyrrolo[1,2-c]
5 thiazole carboxamide-7 de formule générale : :
CONH--R
~ '
dans laquelle R représente un radical de formule générale :
~ X ~II)
pour lequel X est un atome d'oxygène, un radical carbonyle,
10 h~droxyméthyl~ne, carboxamido, méthylènecarbonyle, carbonylvinylene :~
ou vinylènecarbonyle, et :
Y est un radical carbocyclique ou hétérocyclique aromatique, ~
sous leurs formes stéréoisom~res ou leurs mélanges ainsi que leurs :
sels
15Des produits de formule générale (I~ ou leurs analogues ainsi
que leur préparation, ont été précédemment décrits dans les brevets
européens EP 115 979, EP 388 309 ~t américains US 4 906 757 et
US 4 783 472 pour leur utilité dans le traitement des allergies, de .
l'inflammation et de l'inhibition de l'agrégation des plaquettes
sanguines, ainsi que dans le traitement des affections dans les-
que}les est impliqué le rôle physiologique du PAF-acéter.
Les dérivés de pyrrolo[1,2-c]thiazole carboxamide de formule
générale lI) sous leurs formes stéréoisomères ou leurs mélanges,
aingi que leurs sels, sont utiles pour l'obtention d'un médicament
destin~ ~ la prophylaxie et/ou au traitement th~rapeutique des
WO93/17027 ~, ~ rj PCI/FR93/00173
, , ,,,, 5,,
:
infections à retrovirus, et plus partlculiere~ent du SIDA (syndrome
d'immuno-déficience acquise) et de syndromes associés [ARC (AIDS
related complex)].
Par prophylaxie nous sous entendons le traitement des sujets
qui ont été exposés aux virus HIVs (human immunodeficiency virus),
en particulier les séropositifs asymptomatiques, qui présentent le
risque de développer la maladie dans les mois et les années a venir
après la primo-infection.
Dans la formule générale (I) le symbole Y représente un radical
aromatique qui peut être avantageusement choisi parmi les radicaux
phényle, thiényle ou pyridyle.
Les produits de formule générale (I) pour lesquels X est un
radical carboxamido ou hydroxyméthylène sont des produits nouveaux.
Ces dérivés du pyrrolo[1,2-c]thiazole carboxamide peuvent etre
1~ préparés par analogie avec les méthodes décrites dans les réfé-
rences citées ci-dessus.
L'activité des produits de formule générale (I) a été mise en
évidence de la manière suivante :
Le Tumour Necrosis Factor (TNF) est responsable de 1'activation
- 20 du virus HIV notamment dans 1es cellules chroniquement infectées.
Les effets des dérivés du pyrrolo[1,2-c]thiazole carboxamide
sur 1'induction du virus HIV-1 ont été étudiés sur des lignées
cellulaires chroniquement infectées.
On utilise des lignées cellulaires U1 obtenues après infection
de la lignée promonocytaire, U937, par le virus HIV-1 et sélection-
née selon la capacité à augmenter la production virale en réponse
au Phorbol Myristate Acétate (PMA), au TNF et à d'autres médiateurs
tFolks et al., Science, 2~, 800 (1987)]. L'activité de la reverse
transcr1ptase est utilisée comme un indicateur de la production
vlrale, On analyse ainsi l'effet de concentrations croissantes du
prodult a étudier sur des li~nées cellulaires stimulées.
W O 93/17027 '~ j PCT/FR93/00173
., ~ ~, i . : .
Etude e~érimentale
Le produit à étudier est mis en solution dans le
diméthylformamide (DMF). Les solutions mères sont préparées le jour
de l'essai et conservées à une temperature de 4C. Les dilutions
S sont réalisées de telle manière que la concentration en DMF soit
constante (0,1%).
Les cultures cellulaires sont prélevées en phase de croissance
exponantielle et remises en culture ~ raison d'une conc~ntration
finale de 2x105 cellules/ml, en présence de différentes concentra-
tions du produit à étudier. 30 minutes après, l'ensemble des cul-
tures est additionné de TNFa ou de PMA.
Chaque essai est fait en triple, excepté les contrôles qui sont
faits en quadruple. Trois jours après, une fraction de surnageant
des cultures est prélevée, et congelée en vue de la mesure de la
reverse transcriptase.
Ta mesure de l'activité de la reverse transcriptase est faite
par les techr.iques connues, en double exemplaire [Strebel et al.,
Nature, 32~, 728 (1987)].
Les dérivés du pyrrolo[1,2-c]thiazole carboxamide sont etudiés
- 20 aux concentrations de 1, 10 et 30 ~M.
Le TNP~ est additionné ~ raison de 100, 10 ou 1 Unit~s/ml.
Certains contrôles ne recoivent pas l'activateur~ D'autres
contrôles ne reçoivent pas le produit à étudier. D'autres ne reçoi-
vent ni le produit ni l'activateur.
~:
t _ -
La diminution de la production virale par les derivés du pyr-
rolo[1,2-c]thlazole carboxamide-7 est significative et dose-dépen-
dante dan~ le ca5 de cellules U1 tralté~s par le TNFa ou par le
PMA, Le ~our 3, on observe une diminution d'au moins 50% de l'acti-
W O 93/17027 PCT/FR93/00173
, " ' i' 4
vité de la reverse transcriptase pour les cellules U1 traitées par10 Unités/ml de TNF~ et addltionnées d'une concentration de 10~M
des produits.
Par ailleurs les dérivés de pyrrolo~l,2-clthiazole carboxamide
de formule générale ~I) sont sans effet sur la viabilité des cel- ;-
lules quelque soit la concentration utilisée.
Les résultats figurent dans le tableau I ci-après.
Tableau I
,. . _
~:
Exemple X Y ~ d'in~ibition
_~_ 10~M ,
l l -CO- ~ 1 23 1 72
2 -CO-CH'CH- ~3 6 7 5
3 _o_~ 33 71
. . ,-~.... . , , .
4 -CO- ~ 1 14 68
.- . . , S , .
-CH2-CO- ~ 14 69
r . . . _
6 -CH5CH-CO- . - 3 2 8 5
¦ 7 l -CHOH- ¦ ~ ¦ l O ¦ 50
WO 93/17027 ~ PCr~FR93/00173
..
Exemple X Y % d'inhibition
1 ~.
8 -CONH- -13 ~4 56
¦ -O~ 30 ¦ 47
La présente invention concerne l'obtention d'une com-~sition
pharmaceutique contenant un dérivé de pyrrolothiazole c joxamide
de formule générale (I) sous ses formes stéréoisom~res ou leur mé-
langes, éventuellement sous forme de sel, a l'état pur ou sous
forme d'association avec un ou plusieurs diluants ou adjuvants
compatibles et pharmaceutiquement acceptables.
. ~. .
Les compositions pharmaceutiques selon 1'invention sont ca- ~-
pables d'inhiber la réplication des rétrovirus et donc de réduire
la progression vers la maladie ou de diminuer sa gravité chez les
1~ sujets infectés -~
Notamment dans le cas des infections par le HIV, en inhibant la
réplication de ce virus, elles sont capables de réduire la progres-
sion vers le SIDA ou de diminuer sa gravité ~hez les sujets infec-
tés.
Les compositions pharmaceutiques selon l'invention sont suscep-
tibles d'empécher ou de ralentir l'évolution des sujets infectés
par rétrovirus vers un stade aggravé de la ~aladie.
~ Elles peuvent être utiliséss à titre prévent~f ou curatif. Par
"préventif" on entend le fait de prévenir l'évolution chez des su-
~ets présentant une immunodéficience et/ou infectés par r~trovirus.
W O 93/17027 ~ ) PCT/FR93/00173
Bien entendu, la constitution de ces compositions sera adaptéeau cas particulier du tractus di~estif des immunodéprimés.
Les compositions peuvent être utilisées par voie orale, paren-
térale ou rectale~
Les compositions stériles pour administration parentérale peu-
vent être de préfér~nce des solutions aqueuses ou non aqueuses, des
suspensions ou des emulsions. Comme solvant ou véhicule, on peut
employer l'eau, le propylèneglycol, un polyéthylèneglycol, des
huiles végétales, en particulier l'huile d'olive, des esters orga-
niques injectables, par exemple l'oléate d'éthyle ou d'autres sol-
vants organiques convenables. Ces compositions peuvent également
contenir des adjuvants, en particulier des agents mouillants,
isotonisants, émulsifiants, dispersants et stabilisants. La
stérilisation peut se faire de plusieurs façons, par exemple par
filtration aseptisante, en incorporant à la composition des agents
stérilisants, par irradiation ou par chauffage. Elles peuvent
également etre prépar~es sous forme de compositions solides sté-
riles qui peuvent etre dissoutes au moment de l'emploi dans un mi-
lieu stérile injectable.
Comme compositions solides pour 1'administration orale peuvent
- être utilisés des comprimés~ des pilules, des poudres ou des granu-
lés Dans ces compositions, le produit actif selon l'invention
(éventuellement associé à un autre produit pharmaceutiquement
compatible) est mélangé a un ou plusieurs diluants ou adjuvants
inertes, tels que saccharose, lactose ou amidon. Ces compositions
peuvent également comprendre des substances autres que des di-
luants, par exemple un lubrifiant tel que le stéarate de magnésium.
- Comme compositions liquides p~ur l'administration orale, on
peut utiliser des émulsions pharmaceutiquement acceptables, des
solutions, des suspensions, des sirops, des ~lixirs contenant des
diluants inertes tels ~ue 1'eau ou 1'huile de paraffine. Ces
co~posltion5 peuvent également comprendre des substances autres que
W O 93/l7027 ' ~ PCT/FR93/00173
les diluants, par exemple des produits mouillants, édulcorants ou ~-
aromatisants.
Les compositions pour administration rectale sont les supposi-
toires ou les capsules rectales, qui contiennent outre le principe
S actif, des excipients tels que le beurre de cacao, des glycérides ~
semi-synthétiques ou des polyéthylèneglycols. ;
D'une manière générale, le médecin déterminera la posologie
qu'il estime la plus appropri~e en fonction de l'~ge, du poids et
des facteurs propres au produit et au sujet à traiter. Généralement
10 chez l'adulte les doses sont comprises entre 25 et 500 mg par jour.
,,,~ .
L'exemple suivant donné à titre non limitatif illustre une
composition selon l'invention. -
- N-(phénoxy-3 phényl) (pyridyl-3)-3 1H,3H-pyrrolo , -;
[1,2-clthiazolecarboxamide-7.. ~........................ 5 mg
- Stéarate de magnésium : 1~........................... 2 mg -~
- ACD~SOL : t%......................................... 2 mg
- - Silice colloïdale : O,5%...... ................ 1 mg
- Lactose ............................................. 190 mg
~es dérivés de pyrrolo[1,2-c]thiazole carboxamide peuvent être
préparés comme décrit dans les références citées préc~demment. A
titre d'exemple les produits des exemples 5 à 8 peuvent être prépa-
rés comme décrit ci après :
~m~
2~ On ajoute, vers 60C, en 10 minutes environ, 2 g de 7-chlorofor-
- - myl-3-l3-pyridyl) 1H,3H-pyrrolo[1,2-c]thiazole-(RS) à une solutionde 1,4 g de 3-benzoylméthylan~line et de 1,9 cm de tr~éthylamine
dans 50 cm de dioxane. ~e m~lange réactionnel est chauffé 5
heures a 100C, refroidl vers 25C et le solvant est ~liminé sous
pres5ion réduite (2,7 kPa) ~ une températurs voisine de 60C. Le
résidu est repris par 200 cm de dichlorométhane et 80 cm d'eau
;:
W O 93/17027 ` PCT/FR93/00173
~ 8
distillée. La phase organique est décantée, lavée par 180 cm au
total de soude 1N puis 300 cm d'eau distillée. Les extraits orga-
niques sont additionnés de 0,5 g de noir décolorant, séchés sur
sulfate de magnésium anhydre, filtrés et le solvant est évaporé
sous pression réduite (2,7 kPa) à une température voisine de 45C.
Les 2,9 g de résine obtenus sont dissous dans 300 cm d'acétate
d'éthyle, filtrés sur une colonne de 3 cm de diamètre contenant 25
g de silice (0,02-0,045 mm). La colonne est lav~e par 75 cm au
total d'acétate d'éthyIe. Les filtrats sont rassemblés et concen-
trés à sec sous pression réduite (2,7 kPa) à une température voi~sine de 50C. Les 2,5 g de solide crème obtenus sont dissous une
première fois dans 25 cm d'acétonitrile bouillant. La solution
obtenue est filtrée à chaud. Le filtrat est refroidi à une
température voisine de 10C pendant 48 heures. Les cristaux obte-
nus sont séparés par filtration, lavés par 10 cm3 au totald'acétonitrile glacé et séchés sous pression réduite (13,5 Pa) à
une température voisine de 50C. On obtient ainsi 1,4 g d'un so-
lide beige qui est redissous à chaud dans 200 cm d'acétate
d'éthyle, et traité en présence de 0,5 g de noir décolorant, fil-
tré à chaud. Après évaporation du solvant sous pression réduite(2,7 kPa), à une température voisine de 50~C, les 1,2 g obtenus
sont dissous une dernière fois dans 25 cm d'acétonitrile bouil-
- lant La solution est filtrée à chau~. Le filtrat est refroidivers 20C pendant 48 heures. Les cristaux obtenus sont séparés par
filtration, rincés par 10 cm au total d'acétonitrile et séchés
sous pression réduite (13,5 Pa) à une température voisine de 80C.
On obtient ainsi 0,75 g de N-(3-phénacylphényl)-3-(3-pyridyl)
1H,3H-pyrrolo[1,2-c]thiazole-7-carboxamide-~RS), sous la forme
d'un solide crème fondant vers 165C.
La 3-benzoylméthylanillne est préparee d'après G.G.I. MOORE, J.K.
HARRIN5TON, J. Med. Chem., 18, 386 (1975).
W O 93/17027 ~ PCT/FR93/00173
EmDl~ 6
On ajoute, vers 60C environ, en 10 minutes environ, 8,8 g de
7-chloroformyl-3-(3-pyridyl) 1H,3H-pyrrolo[1,2-clthiazole-(RS) à
une solution de 6,6 g de 3-aminochalcone et de 8,3 cm de
triéthylamine dans 165 cm de dioxane. Le mélange réactionnel est
chauffé 6 heures 30 minutes à 100C, refroidi vers 25C et le sol-
vant est éliminé sous pression réduite (2,7 kPa) à une température
voisine de 50C. Le résidu est repris par 500 cm de dichloromé-
thane et 200 cm d'eau distillée. La phase organique est décantée,
l~ lavée par 450 cm au total d'eau distillée, séchée sur sulfate de
magnésium anhydre et le solvant est évaporé sous pression réduite
(2,7 kPa) à une température voisine de 40C. Les 13,9 g de me-
ringue obtenus sont dissous dans 300 cm d'acétonitrile bouillant.
La solution obtenue est filtr~e à chaud. Le filtrat est refroidi à
une température voisine de 10C pendant 3 heures environ. Les
cristaux obtenus sont séparés par filtration, lavés par 20 cm au
total d'acétonitrile glacé et séchés sous pression réduite ~13,5
Pa) ,~ une température voisine de 50C. On obtient ainsi 6,6 g de
N-[3-~3-phényl-3-oxo-propényl)phényl]-3-(3-pyridyl) 1H,3H-pyrrolo
[1~2-c~thiazole-7-carboxamide-(RS)~ sous la forme d'un solide
crème fondant vers 180C.
La 3-aminochalcone peut être préparée de la manière suivante:
Une solution de 42,5 g de chlorure stanneux dans un mélange de 40
cm d'éthanol absolu et 16 cm d'acide chlorhydrique 12N est ajou-
tée goutte à goutte, en 50 minutes environ, à une suspension de 15
g de 3-nitrochalcone dans 50 cm d'éthanol absolu, en maintenant
la température vers 45~C. Le mélange réactionnel est alors chauffé
2 heures 30 au reflux, puis refroidi vers 20C. Le précipit~ est
séparé par filtratior., lavé par 100 cm environ d'~thanol et mis
30 en solution dans 25 cm d'ammoniaque 10N. On a~oute 200 cm d'eau
di~tillée et 200 cm d'acétate d'éthyle. La phase organique est
d~cantée et la phase aqueuse est extraite par 800 cm au total
d'ac~tate d'éthyle. Les extraits organiques sont rassemblés, lavés
W O 93/17027 ~ PCT/FR93/00173
]O
par 300 cm au total d'eau distillée, séchés sur du sulfate de
magnésium anhydre et concentrés à sec sous pression réduite t2,7
kPa) à une température voisine de 40C. On obtient ainsi 9,5 g de
3-aminochalcone, sous la forme d'un solide jaune, fondant vers
156C.
La 3-nitrochalcone est préparée d'après Le Fevre et Pearson, J.
Chem Soc., 2807 ~1932).
Exemple 7
On ajoute goutte à goutte, à une température voisine de 25C, une
solution de 0,31 g de borohydrure de sodium dans un mélange com-
posé de 0,42 cm de soude 2N et 4 cm d'eau distillée, à une solu-
tion de 8,8 g de N-(3-benzoylphényl)-3-(3-pyridyl) lH,3H-pyrrolo
~1,2-c]thiazole-7-carboxamide~(RS) dans 2~ cm de méthanol. Apr~s
48 heures sous agitation, on a~oute 3 cm d'acide acétique 4N, 250
cm d'eau distillée et 250 cm d'acétate d'éthyle. La phase orga-
nique est décantée, la phase aqueuse est extraite par 250 cm
d'acétate d'éthyle. Les extraits organiques sont réunis, lavés par
200 cm au total d'eau distillée, puis par 100 cm d'une solution
saturée de bicarbonate de sodium et par 100 cm d'eau distillée.
On ajoute 0,5 g de noir décolorant, sèche sur du sulfate de magné-
- sium anhydre, et évapore le solvant sous pressi~n réduite (2,7
kPa) à une température voisine de 40C Les 8,2 g de meringue
orange obtenus sont chromatographiés sur une colonne de 8,5 cm de
diamètre contenant 800 g de silice (0,02-0,045 mm), éluée avec un
mélange de cyclohexane et d'acétate d'éthyle 20-80 (en volumes) en
recueillant des fractions de 80 cm . Les 45 premières fractions
sont éliminées, les 32 suivantes sont rassemblées et le solvant
est évaporé sous pression réduite ~2,7 kPa) à une température voi-
sine de 40C. Les 5,6 g de meringue orange obtenus sont dissous
dans 90 cm d'acétonitrile bouillant. La solution est filtrée à
chaud. Le filtrat est refroidi 12 heures à 10C~ Les cristaux sont
séparés par flltration, lavés par 10 cm au total d'acétonitrile
et séchés sous pression réduite (1~,5 Pa) à une température voi-
W O 93/l7027 .,, ..................... ~,~ ................... PCT/FR93/OOt73 .~
"'ll`; ' ~. ........................... .
sine de 60C. On obtient ainsi 1,4 g de N-[3-(u-hydroxyben-
zyl)phényl]-3-(3-pyridyl) 1H,3H-pyrrolo[1,2-c]thiazole-7-carboxa-
mide-(RS), sous la forme d'un solide blanc, fondant vers 182C.
E~emple 8
On ajoute, vers 60C, en 15 minutes environ, 6 g de
7-chloroformyl-3-(3-pyridyl) 1H,3H-pyrrolo[1,2-c]thiazole-(RS) à
une solution de 4,2 g de 3-aminobenzanilide, 5,6 cm de triéthyla-
mine dans 100 cm de dioxane. Le mélange réactionnel est chauffé 6
heures au reflux, refroidi vers 25C et le solvant est éliminé
sous pression réduite (2,7 kPa) à une température voisine de 60C.
Le résidu est repris par 500 cm de dichlorométhane, l'insoluble
est séparé par filtration, lavé par 60 cm au total de dichloromé- .
thane et 200 cm d'eau distillée. La phase organique est décantée,
lav~e par 100 cm de soude 1N et 500 cm au total d'eau distillée.
On ajoute le solide obtenu précédemment à la phase chlorométhylè-
nique et ajou,.- 100 cm d'un mélange chlorure de méthy- ~
lène/méthanol 90-10 (en volumes) pour avoir une solution limpide. .
La solution est s~chée sur sulfate de magnésium anhyd~e et filtrée
sur 50 g de sil_ce (0,063-0,200 mm). Le solvant est évaporé sous
pression réduite (2,7 kPa) à une température voisine de 50C. Les
8,5 g de solide obtenus sont dissous dans 150 cm de butanol
bouillant. La solution obtenue est filtrée à chaud. Le filtrat est
refroidi à-une température voisine de 10C pendant 24 heures. Les
cristaux obtenus sont séparés par filtration, lavés par 30 cm au
total de butanol et 40 cm d'éther éthylique et séchés sous pres-
sion réduite (13,5 Pa) à une temperature voisine de 100C. On ob-
tient ainsi 5,3 g de N-(3-phénylcarbamoylphényl)-3-(3-pyridyl)
lH,3H-pyrrolo[1,2-c]thiazole-7-carboxamide-(RS), sous la forme
d'un solide crèm~ fondant vers 206C.
.' '
. .