Note: Descriptions are shown in the official language in which they were submitted.
WO 94/08984 2 ~ ~67 6 5 PC~/FR93/01013
NOUVF ~UX DERIVES DU TAXANE. LEUR PREPARATION ET LES
COMPOSIIIONS PHARMACEUTIOUES OUI LES CONTIF.~NENT
,~ La présente invention conr~rne de nouveaux dérivés du taxane de formule
générale:
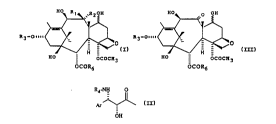
HO~ `R2 ~OH
R3-OIlll~ (I)
HO - OCOCH3
OCOR6
dans laquelle:
- un des symboles Rl ou R2 n~pr~senle un atome d'hydrogène et l'autre représente un
radical 11Y~`U~LY,
- R3 r~p,~ se1,le un atome d'hydrogène ou un radical de formule générale:
R4-NH 8
Ar~ (~)
OH
dans laquelle
Ar représente un radical aryle, et
R4 représente un radical benzoyle ou un radical Rs-O-CO dans lequel Rs
,~pl~senle un radical alcoyle, alcényle, cycloalcoyle, cycloalcényle, bicycloalcoyle,
15 phényle ou hétérocyclyle, et
- R6 l~p~sellL~ un radical alcoyle, alcényle, cycloalcoyle, cycloalcényle, bicyclo-
alcoyle, aryle ev~nll1e11~ment s~hstit~1ç ou hétérocyclyle.
Plus particulièrement la ~l~senle invention c~)nc~ne les produits de formule
générale (I) dans laquelle R, Rl et R2 étant définis comme précéAe.. ~, R3
20 ~pr~senLe un atome d'hydrogène ou un radical de formule générale (II) dans
laquelle:
Ar représente un radical aryle,
R4 représente un radical benzoyle ou un radical Rs-O-CO- dans lequel Rs
représente:
25 - un radical alcoyle droit ou ramifié contçn~nt 1 à 8 atomes de carbone, alcényle
conle1la,lL 2 à 8 atomes de carbone, cycloalcoyle conten~nt 3 à 6 atomes de carbone,
WO 94/089X4 PCr/FR93/01013
cycloalcényle c~ntfnAnt 4 à 6 atomes de carbone ou bicycloalcoyle cont~n~nt 7 à 10
atomes de carbone, ces radicaux étant évent~-ellem~.nt s~stih~e-s par un ou pl1~ie--n$
s~ ;1..Anl~ choisis parmi les atomes de fluor ou de chlore et les rArli~ -x lly~L~.cy,
alcoxy col.lPnAnl 1 à 4 atomes de carbone, dialcoylamino dont chaque partie alcoyle .~t
5 contiPnt 1 à 4 atomes de carbone, pipéridino, morpholino, pipél~.yl-1
(évPntu~PllçmPnt substitué en 4 par un radical alcoyle con~-.lA..I 1 à 4 atome~s de
carbone ou par un radical phénylalcoyle dont la partie alcoyle c~ ntiP-nt 1 à 4 atomes
de carbone), cycloalcoyle co..lP~lAn~ 3 à 6 atomes de carbone, cy~loAl~nyle ~ Pn~n~
4 à 6 atomes de carbone, phényle, cyano, calbO~y ou alc.,~yc~l,ollyle dont la partie
10 alcoyle contipnt 1 à 4 atomes de carbone,
- un radical phényle évçntuelle-ment sl~kshtllé par un ou pl1~ie~rs r~ica-~x choisis
parmi les radicaux alcoyles cfi..l*.1A.-t 1 à 4 atomes de carbone et alcoxy c~ PnAnl. 1 à
4 atomes de carbone,
- ou un radical hétérocyclyle azoté saturé contPnAnt 5 à 6 ~h~înon~ evPnttuPllemPnt
15 st-kstitne par un ou plneiç1-r.e r~r~ica~x alcoyles contP.nAnt 1 à 4 atomes de carbone,
étant çnt~n~lu que les radicaux cycloalcoyles, cy~lo~l~nyles ou bicycloalcoyles
peuvell~ être évçntuellçmf--nt s~hstitués par un ou plusieurs ~ir~llx alcoyles
conlçn~nl 1 à 4 atomes de carbone, et
R6 represenle:
20 - un radical alcoyle droit ou ramifié conlP.nA.~I 1 à 8 atomes de bone, alcémyle
co.~lç~1A.~I 2 à 8 atome~s de carbone, alcynyle co..lP-n~"l 2 à 8 atome,s de carbone,
cycloalcoyle cofilPI~Alll 3 à 6 atomes de carbone, cycloalcényle c~n~ ;lll 4 à 6atome~s de carbone ou bicycloalcoyle c ntenAnt 7 à 11 atomes de carbone, ces
r~A11içAl-x étant évPntl~P-llem~nt suhstit~lP-e par un ou pl1~si~l~r~ 2~ lx choisis
25 parmi les atomes d'halogène et les r~liicAl-x hy~cy, alcoyloxy co..lPnAnl 1 à 4
atomes de carbone, dialcoylamino dont chaque partie alcoyle contiPnt 1 à 4 atomes de
carbone, pipPriflino, morpholino, pip~ yl-l (évçnt~lelle-m~q.nt sll2~ en 4 par un
radical alcoyle contenAnt 1 à 4 atomes de carbone ou par un radical phénylalcoyle
dont la partie alcoyle contient 1 à 4 atomes de carbone), cycloalcoyle co..L~n~ 3 à 6
30 atomes de carbone, phényle éventuellement ~nhstitué, cyano, carboxy ou
alcoyloxycarbonyle dont la partie alcoyle contient 1 à 4 atomes de carbone,
- ou un radical aryle évçnt~ lPment substitué par un ou plusieurs atomes ou radicaux
choisis parmi les atomes d'halogène et les radicaux alcoyles conl~n~.~l 1 à 4 atomes
de carbone et alcoyloxy conten~nt 1 à 4 atomes de carbone,
WO 94/08984 2 ~ 7 ~ ~ PCI /FR93/01013
- ou un radical hétérocyclyle azoté saturé ou non saturé co.,le~ .l 4 à 6 chaînons et
~v~.,l..ellem~nt substittl~ par un ou pll-ciel~rs radicatLx alcoyles cc nten~nt 1 à 4 atomes
de carbone,
étant ~nt~n~ que les rfltiiç~l~x cycloalcoyles, cyçlo~lr~nyles ou bicycloalcoyles
5 peuvelll être ev~ntllellemPnt suhstitt~e-c par un ou plusieurs r~1ic~llx alcoyles
cont~n~nt 1 à 4 atomes de carhone.
De p,i~relellce, les radicaux aryles représentés par Ar et R6 sont des radicaux
phényles ou ~- ou ~naphtyles ev~-.L~ellem~nt su~sti~lés par un ou p~ ie~lrs atomes
ou r~1ic~l1x choisis parmi les atomes d'h~lo~èn~ (fluor, chlore) et les radicaux10 alcoyles, alcényles, alcynyles, aryles, aralcoyles, alcoxy, alcoylthio, aryloxy, arylthio,
hy~oxy, hy~y~lcoyle, mercapto, formyle, acyle, acylamino, aroylamino,
alco~y~;a.L~.lyl~mino~ amino, alcoyl~mino, dialcoylamino, c&.L~cy, alcc,~y~lJonyle~
carbamoyle, dialcoylc&,lJamoyle, cyano, et trifluorométhyle, étant Pnten~ll que les
r~liç~l-x alcoyles et les portions alcoyles des autres radicaux contienn-~nt 1 à 4 atomes
15 de carbone et que les radicaux alcényles et alcynyles contiPnn~nt 2 à 8 atomes de
carbone et que les r~içallx aryles sont des radicaux phényles ou a- ou ~naphtyles.
De pre:r~:re.lce, les r~-li~llx hétérocycliques ~pf~sel~lés par Ar sont des
r~ic~llx hétérocycliques a~l.,aliques ayant 5 ~h~înon.c et Co~ .L 1 OU plusieurs
~torn~s, identiques ou dirri:r~llls, choisis parmi les atomes d'azote, d'c,~y~,èl~e ou de
20 soufre, ~v~n~ -m~nt s~ es par un ou pl~ rs s~ ;L~,Anl.~, identiques ou
dir~.enL~, choisis parmi les atomes d'h~lo~ne (chlore, fluor) et les r~ llx alcoyles
cont~n~nt 1 à 4 atomes de carbone, aryles co..~ A..~ 6 à 10 atomes de carbone,
amino, alcoylamino co..lP-~ 1 à 4 atomes de carbone, dialcoylamino dont chaque
partie alcoyle c nti~nt 1 à 4 atomes de carbone, alcoxyc~l,ollylamino co..~e~A.-~ 1 à 4
25 atomes de carbone, acyle co~ A~1 1 à 4 atomes de carbone, arylc~l,onyle dont la
partie aryle c onti~nt 6 à 10 atomes de carbone, cyano, ca,l,u~y, carbamoyle,
alcoylc~l,~lloyle dont la partie alcoyle contient 1 à 4 atomes de carbone,
dialcoylc~l,~lloyle dont chaque partie alcoyle contient 1 à 4 atomes de carbone ou
alcoyloxy~;&lbollyle dont la partie alcoyle contient 1 à 4 atomes de carbone.
Plus particulièrement encore, la présente invention con~ rne les produits de
formule générale (I) dans laquelle Rl et R2 étant définis comme précéde.-~ t R3
représente un radical de formule générale (II~ dans laquelle Ar représente un radical
phényle ev~nt~ lem~nt sllbstitllé par un atome de fluor ou de chlore ou par un radical
alcoyle (méthyle), alcoxy (méthoxy), dialcoylamino (diméthylamino), acylamino
(acétylamino), alcoxyca~l,onylamino (tert-bllloxyc~bonylamino) ou trifluorométhyle
WO 94/08984 PCr/FR93/01013
2 ~ ~ 6 ~ ! --
ou un radical thiényle-2 ou -3 ou furyle-2 ou -3 R4 représente un radical bel~:>yle ou
un radical Rs-O-CO- pour lequel Rs représente un radical t.butyle et R6 représente
un radical phényle éventuellemPnt slJbstitllé par un atome d'h~lo~ne.
Les produits de formule générale (I) dans laquelle Rl R2 et R6 sont définis
5 comme préc~l~mm~nt et R3 ,~pr~serlL~ un radical de formule générale (II) ~s~
des propriétés n~ n~orales et ~ntilnlr~miques ~ll~a~uables.
Selon la présente invention les nouveau~ produits de formule générale (I)
peuvenl être ob~en~ par r~uction électrolytique d'un produut de fonnule générale:
S ~
R3-O ~ o (
HO - OCOCH3
OCOR6
10 dans laquelle R3 et R6 sont définis comme précé~emmçnt
Selon l'invention la ré~u~tic)n du g,oilpell,ent carbonyle -CO- est effectuée
par voie électrochimique selon la réaction suiv~lle:
HO O OH
~1 +2e~+2H+ ( I)
R3-olll~ ~o (I; Rl = H et R2 = OH) + (I; Rl = OH et R2 = H)
HO _ oCO CH 3
OCOR6
La réduction électrolytique à partir d'un produit de formule générale (III) est
réalisée dans un électrolyseur conl-qn~.l un catholyte con~ d'un électrolyte
support c~ P~ des ions an~.nonilln~ (NH4+) et d'un solvant ou mélange de
solvants dans lequel est dissous le produit de formule générale (III) à une
concentration comprise entre 0 1 g/l et la saturation de la solution.
Lorsque dans le produit de formule générale (III) le radical hy~uxy en -7
est sous la forme 7a il se forme ~eeen~iellement un produit de formule générale (I)
pour lequel R~ sen~ un atome d'hydrogène R2 ~ s~"~e un radical hy~y et
le radical hydroxy en -7 est sous la forme 7a.
WO 94/08984 PCr/FR93/01013
~ 21~76~
Effectuée en milieu acide en présence d'ions calcium, la réduction
électrolytique d'un produit de formule générale (m) conduit e~s~nti~llem~nt à unproduit de formule générale (I) pour lequel Rl ~sente un atome d'hydrogène et
R2 ~pr~sen~e un radical hydroxy indépend~mment de la cc)nfi~-ration de la fonction
5 hydr~cy en -7.
La 4ual.Li~ d'électri~ite théorique n~$~ pour effectuer la ré~lction d'un
produit de formule générale (III) en produit de formule générale a) est de 2 Faradays
(ou 193.000 coulombs) par molécl-le
rr~Çer~..Li~llçment la réAnction s'effectue dans un électrolyseur à
10 diaphragme.
Selon un mode de m-ise en oeuvre du procédé selon l'invention, la réduction
électrolytique est effectuée dans un élec~olyseur comporl~l~ une c~thocle~ un
co~ )alLilllent cathodique, un diaphragme ~p~a~eu~ un co~np~Lin~ent anodique et
une anode dont les car~ctçri.~tiques sont les suiv~lLes:
15 a) la c~thc~le est con.~tit~ée d'un m~téri~u contl~lcteur de l'électricité sur lequel la
réA~-~tiQn a lieu à un potentiel supérieur à celui de la ré~luction du solvant ou de l'un
des cQ~ uA-llx de l'électrol,vte support, ou à un potentiel tel que la réduction du
solvant ou de l'un des C~ AI~ de l'électrolyte su~>o.~ n'est pas sllffis~mment
illl~l L~te pour gêner la réAl~etion du produit,
20 b) le co-n~a~t;-l-ent c~th~illue contil~-nt le catholyte qui est c"n~titt~é d~une sgll~tion
du produit de formule g~n~.~le (III) dans un milieu organique ou hydroorganique et
d'un électrolyte cont~n~nt des ions ~mmonillm (NH4+). Le pH peut être .-~ Ç~
légèrement alcalin, c'est-à-dire coll~pris de prere~ ce entre 7 et 9, par addition
d'ammoniaque. Le catholyte peut aussi être acide et csnt~nir des ions cA~ lm fournis
25 par exçmple par du chlorure de sAlci~m en vue d'obtenir pr~re.ellliellement un
produit de formule générale (I) dans laquelle Rl représente un atome d'hydrogène et
R2 ~epri~senle un radical Lyd~`~cy.
c) le diaphragme sépa.d~e~ est csn-~ é d'un m~tPri~u poreux tel qu'une plaque, un
m~nchQn ou une bougie de verre fritté ou de porcelaine ou par une membrane
30 échangeuse d'ions, de préférence une membrane échangeuse de cations,
d) le ~n~al~illlent anodique contient l'anolyte constitllé de préférence par le même
solvant ou mélange de solvants et le même électrolyte support que celui qui est utilisé
dans le compartiment cathodique. L'anolyte peut aussi être con~titl-é d'une solution
acide qui, par l'intermédiaire d'une membrane échangeuse de cations, permet de
WO 94/08984 PCr/FR93/01013
6~ 6
m~ ,lir le pH dans le catnolyte au cours de l'électrolyse. De prere~nce on utilise de
l'acide chlorhydrique dilué dans du m~,thAn~l
e) l'anode est con~ ,ee d'un ry~ ;A~I co-ul~c~e"~ de l'~lçctricité dont la nature n'est
pæ e-~.~ntielle à la mise en oeuvre du procédé.
G~on~r~lçm~nt, l'anode est co!lxl;l.iée par un .. ,~ l con~ cte~lr de
l'élect~icité inattaquable dans les contlitionX de l'électrolyse, tel que par exemple le
platine poli, massif ou sur support a~n~-~cte~r, le ~pll;le ou le carbone vitreux.
De pl~r~-ellce, la cathode est c~--lxl;l~e par une nappe de mercure.
L'électrolyte support est C~ nx~ d'un sel clh~ , tel que le chlorure
10 d'A.nmon;~....l soluble dans le solvant ou le m~ nge de solvants. Génér~lem~nt on
utilise des solvants protiques qui solt-hili.~P.nt f~cil~m~nt les produits de formule
générale (I) et (III) et qui perm~ttent un ixole-n~nt facile des produits de formule
générale (I; R1 = H et R2 = OH) et (I; R1 = OH et R2 = H). De pr~:réfeilce, les
solvants seront choisis parmi les alcools ~lirh~tiques cc--l~n~--l 1 à 4 atomes de
15 carbone tels que le méth~nol, l'éth~nol, l'iscplopallol ou le t b~lt~nol
Le pH doit être co...~ ;hle avec la st~hilité du s,~b~ l et il peut être
m~int~nu légèrement alcalin au cours de l'électrolyse, c'est-à~ire compri~ de
p-~réL~llce entre 7 et 9, par a(l~lition d'~mm-~ni~que en solutif n ~lleuse ou par
barbotage de gaz ~lllmo~ c lorsque l'électrolyse est ~rr~uée en p~sence d'ions
20 ~mmonillm ou bien il peut être ~ acide par ~ on d'acide chlorhydrique
lorsque l'électrolyse est erre~;~uée en p~sence d'ions c~ m fourni~s par ~x~mple par
du chlorure de c~lc.il-m
La nature du diaphragme sép~n..l l'anolyte du catholyte n'est pas une
caract~ri~tique e-~enti~lle de l'invention. C'est ainsi qu'on peut utiliser tout25 diaphragme de type connu, c~ - par un m~teri~t1 poreux comme le verre fritté, la
porcelaine avec ou sans gel cnnri~cte~r li-n;L~..I la diffusion des réactifs ou par des
m~mh~n~s é~h~nge~es d'ions de p~cfé~lce é.rh~n~ es de r~tion~. Les membr~ne~s
peuvent être de type homogène ou hétérogène et elles peuv~ v~ ellement être
.~nfo~ées par une trame. De p-~ér~nce sont utili~é~s des m~mhranes qui ne gonflent
30 pas, qui ne ~;~ en~ pas et qui sont stables en présence des diver~s con~tit--~nt.~ de
l'anolyte et du catholyte.
Selon un mode de mise en oeuvre préféré de l'invention, l'anode, la cathode
et le diaphragme s~a-a~eur sont disposés selon des plans parallèles de p~fi~lel1ce
ho. ;,.o--l~..x dans le cas d'une cathode con~ituee par tme nappe de mercure.
WO 94/08984 2 I ~ ~ 7 6 5 PCI/FR93/01013
La te111péralule du bain d'électrolyse est généralement co1l~1ise entre 0 et
30C.
L'électrolyse est effectuée à potentiel contrôlé, celui-ci peut être fixé e ~vir~n
entre -1,75 et -1,9 volt par rapport à une électrode de référence au calomel, de5 préférence à -1,85 volt.
La quanlilé théorique d'~1ectrit~-ite mise en oeuvre est de 2 Faradays (ou
193.000 coulombs) par mole d'un produit de formule générale (III). Pratiquement la
qua"Li~é d'filectri~ ité utilisée peut 8tre de 2 à 5 fois la quA~ théorique.
Le catholyte peut être mis en cirC1l1Ation par exemple sous l'action d'une
10 pompe. Le circuit peut en outre co111~ dre des dis~osilirs annexes tels
qu'éçhAn~e -rs de température ou vases de~pAn~icn; un tel vase d'expansion permet
en particulier d'~1imçnter le catholyte en produit de formule générale (III) et permet
é~A1~-mçnt d'effectuer un soutirage pour l'extraction des produits de formule
générale a)-
L'anolyte peut é~lçm~-nt être soumis à une circulation. Selon un mode
p~rére11liel de réAli~Atic n de l'invention, le circuit du catnolyte est ~imi1Aire à celui de
l'anolyte, ce qui permet d'équilibrer les pressions de part et d'autre du diaphragme
sépal~leur.
Selon un autre mode de mise en oeuvre parLiculier de l'invention, on dispose
des intercalaires dans les co-1-pa~lime1~ anodique et r~tho~lique. Ces intercalaires
servent à éviter, d'une part, les dé~uf -~1;on~ de la membrane érhAn~ se d'ions et,
d'autre part, les c~-ntAct~ de cette membrane avec les électrodes. Ils servent également
à améliorer l'homogénéité de concentration du catholyte.
En l'Ahs~n~e d'intercalaire, la vitesse de cira~1Ation du catholyte dans le
compAIlilllent cAtholique est hA~it~1e11~m~nt supérieure à 10 cm/s, de ~ ére1lcesupérieure à 50 crn/s. Lorsque l'on utilise un intercalaire, la vitesse a~ar~n~e du
catholyte (vitesse dans le con~pa-Li,~,e1,L rAth~iq11e supposé sans intercalaire) est
habituellement supérieure à 1 cm/s, de p1~Ç~ ce supérieure à 10 cm/s.
Selon un autre mode de mise en oeuvre de l'invention, la cellule peut être
c~nctitllçe simplement d'un récipient, parallélépipédique ou cylindrique, en unematière inerte vis-à-vis des con~itllAntc des électrolytes. Ce récipient contient
l'électrode de travail dont la nature est la même que celle définie pour le premier
genre de cellule. La forme de cette électrode de travail est adaptée à la forme du
récipient.
WO 94/08984 PCr/FR93/01013
~,~46~ 6~ 8
D'une façon générale, toute cellule électrolytique comportant une anode et
une c~tho(ie séparées par un ou pl1~eiYIns diaphragmes assurant la con~ ctibilité
ionique est s~sce~.l;hle d'être employée, la dis~silion des elemPntc n'étant pasPe.e~Pntielle à la mise en oeuvre du procédé.
Les prodLu~ de formule générale (I) obtenus par la mise en oeuvre du
procédé selon l'invention sont séparés par aprli-~tion des m~th~1es h~bi~PllPe
La mise en oeuvre du procédé selon l'invention con~llie~nt à partir d'un
produit (~ r~ de formule générale (m) dans lequel la cnnfi~lr~tion du radical
hyLo~y en position -7 est sous la forme -713, au mélange des produits correspon~nt.c
de formule ~finfi~le (I) pour laquelle, d'une part, Rl ,e~r~sellle un atome d'hydrogène
et R2 ~pl. s~lle un radical hy~y et, d'autre part, Rl ~pl. sen~ un radical hy~o~cy
et R2 n~pl~sel~le un atome d'hydrogène, la séparation des ph~dLii~ ainsi obtenus peut
être efîe ;luée selon les mP,thoc1Pe c~ nmnP-s telles que }a chr~ S~Io~raphie.
Les produits de formule ~finP~le (III) dans laquelle R6 représente un radical
phényle et R3 l~plt~ un atome d'hydrogène correspondent respectivement à la
désacétyl-10 b~cc~tin-p m qui peut être isolée, selon les methori~Ps connllPs, à partir
des extraits de dirre~ les variétés d'ifs (Tasus sp.).
Les produits de formule générale (m) dans laquelle et R3 représente un
radical de formule générale (II) dans laquelle Ar ~pl~senle un radical aryle et R4
représente un radical l~yle col~spondent au désacétyl-10 taxol et à ses analogues
qui peuv~ être obtP-m~e selon les procedés décrits dans les brevets européens
EP 0 253 739, EP 0 336 840, EP 0 400 971 et EP 0 428 376 ou dans la ~emS n~le
e~ n~lic)n~le PCT WO 9209589.
Les ~lod~ de formule générale (m) dans laquelle R6 ,t;~,~sell,Le un radical
phényle et R3 ~l~sel~le un radical de formule générale (II) dans laquelle Ar
représente un radical aryle et R4 n~p~senle un radical t.bulo~yc~hl~l-yle peuvell~ être
obtenus selon les procédés décrits dans les brevets européens EP 0 253 738 et EP 0
336 841 ou dans la ~lem~n~1e ;.,~ AI;c)n~le PCT WO 9209589.
Les produits de formule générale (III) dans laquelle R6 représente un radical
phényle et R3 l~pn~sellle un radical de formule générale (II) dans laquelle R4
n~pl~se.l~e un radical Rs-O-CO- pellvell~ être obtenus par action d'un dérivé réactif de
formule générale:
Rs-O-CO-X (IV)
WO 94/08984 PCr/FR93/01013
~ 21~765
dans laquelle X représente un atome d'halogène (fluor, chlore) ou un reste -O-Rs ou
-O-CO-Rs sur un dérivé de la désacétyl-10 b~cc~tine III de formule générale:
H2~1 ON ~O
HO - OCOCH3
OCOC6H5
dans laquelle Ar est défini comme précé~lemm~nt, Gl f~pri~senle un atome
d'hydrogène ou un ~ nt protecteur de la fonction hy~O~cy tel qu'un radical
trichloro-2,2,2 e~lo~yc&,l,ollyle ou un radical trialcoylsilyle, dialcoylarylsilyle,
alcoyldiaryl-silyle ou triarylsilyle dans lequel chaque partie alcoyle contient 1 à 4
atomes de carbone et chaque partie aryle r~p,~senLe de pri:~e~nce un radical phényle
et G2 représente un atome d'hydrogène ou un gl~,ul)elllent p~LecLetlr de la fonction
lly~y qui est de prefér~ilce un radical trichoro-2,2,2 étho~yc~boliyle pour donner
un produit de formule générale:
R5-O-CO-NH ~-- i~
HO - OCOCH3
OCOC6H5
dans laquelle Ar, Rs, Gl et G2 sont définis comme précé~lemmçnt, suivie du
rempl~cem~nt des ~u~ nt~ protecteurs Gl et G2 par des atomes d'hydrogène.
Génér~lement l'action du réactif de formule générale (IV) sur le dérivé de la
b~ccatine m ou de la désacétyl-10 bacc~tine m de formule générale (V) est effectuée
dans un solvant organique tel qu'un ester comme l'acétate d'éthyle en p~sence d'une
base minérale ou organique telle que le bicarbonate de sodium à une tempéla
comprise entre 0 et 50C, de ~.leré~ ce voisine de 20C.
Génér~lem~-nt le rempl~ement des groupements protecteurs G1 et G2 du
produit de formule générale (VI) par des atomes d'hydrogène est effectué par
traitement par le zinc en présence d'acide acétique à une telll~laLult: comprise entre
30 et 60C ou au moyen d'un acide minéral ou organique tel que l'acide
WO 94/08984 PCr/FR93/01013
61 6~ lo
chlorhydrique ou l'acide acétique en soll1tion dans un alcool ~lirh~tique cont~n~nt 1 à
3 atomes de carbone en pl~sence de zinc lorsque Gl et/ou G2 repré.s~ntçnt un radical
trichloro-2,2,2 étho~yc~ubollyle ou par l.~ .l en milieu acide tel que par ~x~?mrle
l'acide chlorhydrique en s0ll1tk n dans un alcool ~lirh~ti-lue c~ ..l 1 à 3 atomes de
5 carbone (méth~n( l, eth~nol, isopfopallol) ou l'acide~ fluorhydrique aqueux à une
~e-n~élalufe comprise entre 0 et 40C lorsque Gl et/ou G2 repr~.sçnt~nt un radical
silylé ou alcoxyacétyle.
Les produits de formule ~n~.~ale (m) dans laquelle R3 représente un radical
de formule générale (II) et R6 est défini comme préc~lemm~nt ~)eUV~ être obtenus10 par estenfiç~tion d'un produit de formule générale:
G 2 - O O - G 1
~0 - oco
OH
dans laquelle Ar, R4, Gl et G2 sont définis comme préc~iP~ er-l et ou bien R7
représente un atome d'hydrogène et R8 représente un g.ou~el.lent protecteur de la
fonction hydl`u~y ou bien R7 et R8 fo"l,en~ ~n~emhle un hétérocycle saturé à 5 ou 6
15 ~h~înon~ au moyen d'un acide de formule générale:
R6-COOH (VIII)
dans laquelle R6 est défini comme préc~le-.n.--~.-l, ou bien d'un dérivé de cet acide,
pour obtenir un produit de formule générale:
\ / G2- o 0-G1
O ~ y ~ ~O
HO - OCOCH3
OCOR6
20 dans laquelle Ar, R4, R6, R7, Rg, Gl et G2 sont définis comme précé~l~mmçnt dont
on r~mpl~ce les g,~upements protecteurs Rg, lorsque R7 représente un atome
d'hydrogène, ou bien R7 et Rg, lorsque R7 et R8 forment ensemble un hétérocycle
WO 94/08984 ~ 1 4 6 7 ~ ~ PCI /FR93/01013
~1
11
saturé à 5 ou 6 chaînons, Gl et év~nt~1ellçm~nt G2 par des atomes d'hydrogène pour
obtenir le produit de formule générale (III) en passant év~nt~ m~nt selon les
~ignific~tion~ de R4, R7 et R8 par un produit de formule générale:
G2- O-G~
~¢ ? (X,
HO - OCOCH3
OCOR6
5 dans laquelle Ar, R6, Gl et G2 sont définis comme précé~emm-?nt, qui est acylé au
moyen de chlorure de berwyle ou d'un produit de formule générale (IV avant de
remplacer évçnt~lellçm~nt les ~;~o,,~ Gl et G2 par des atomes d'hydrogène.
Le produit de formule générale (VII) peut être obtenu par ré~ ~ion
électrolyfique d'un produit de formule générale:
R4~ ~R7 G2- : O-G~
¢7 ' ~`
HO - OCOCH3
OCOC6H5
dans laquelle Ar, R4, R7, Rg, Gl r~r~senle un atome d'hydrogène ou un g-~ pe-llent
protecteur de la fonction lly~xy qui est de pr~fé~e,lce un radical silylé et G2
~pnsellLe un atome d'hydrogène ou un g~olipe~ nt ~r~,l~lei~ de la fc-n~tic n Lyd~y
qui est de pri~rel~l~ce un radical alco~y~.ci'-lyle, suivie éventuellement du
rempl~çment des g.~,~pemel-L~ pn~læ.;le~ R7, Rg, Gl et G2 par des atomes
d'hydrogène.
Les produits de formule générale (I) pour lesquels R3 représente un atome
d'hydrogène sont utiles pour p~ép~t;r les produits de formule générale (I) pour
lesquels R3 représente un radical de formule générale (II) selon des procédés
analogues à ceux qui sont décrits dans les brevets européens EP 0 253 738,
EP0253739,EP0336840,EP0336841,EP0400971 ouEP0428376Oudans
la ~m~n~ie int~rn~tionale PCT WO 9209589.
WO 94/08984 , I PCr/FR93/01013
12
Les nol,veaw~ produits de formule générale (I) dans laquelle Rl et R2 étant
définis comme préc~ .n~ .l R3 lepn~sellle un radical de formule générale (II)
ma~ une activité inhihitrice ~ignifir~tive de la prolifération c~llf~ ire
~norm~1e et po.cc~pnt des propriétés thél~uliques permett~nt le ~itemPnt de
5 m~ e~s ayant des contfitinn~ pathologiques ~sociép~s à une prolifération cell~ ire
~norm~lP. Les c~n~.fition~ p~thologiques in-lu~Pnt la prolifération cell~ ire anormale
de cellules m~lignP-s ou non m~li nPs de divers tissus et~ou or~ es, colnpr~l1ant, de
l.l~ièl~ non ~ni~liv~, les tissus ml-~fll~ires, osseux ou conjonctifs, la peau, le
cerveau, les po~..c n~, les organes sPYflPl~, les systèmes lyml)h~l;ques ou rénaux, les
cellules .. ~.. ~;~ ou sanguines, le foie, l'appareil digestif, le pancréas et les
glandes thyroides ou adf~nales. Ces con~fition~ pathologiques ~uven~ inclure
g~1PmPnt le psc)ri~ , les tflmelfr~ solides, les cancers de l'ovaire, du sein, du
celveau~ de la p~le, du colon, de l'estom~c, du rein ou des te~sti~llps~ le sa~me
de Kaposi, le rhc-l~ngioc-~rcinome, le choriocarcinome, le neufoblastome, la tumeur
15 de Wilms, la m~l~-.fie de ~or~gkin, les mel~nc)mpc~ les myélomes multirle,s, les
hPuc~miPs ly~npllocyk~i~s chroniques, les lymphomP.~ ~nlllo~;y~i,~s aigus ou
chroniques. Les nouveaux produits selon l'invention sont particulièrement utiles pour
le l.i.;l.~...~nl du cancer de l'ovaire. Les produits selon l'invention ~uvent être utilisés
pour ple:V~I~ OU retarder l'appaLilion ou la l~a~alilion des cc)n~lition~ pathologiques
20 ou pour traiter ces conf1ition~ p~thologiques.
Les produits selon l'invention peu~ ll être a l...;~ s à un malade selon
dirr~ll~s formes ~ rté~s à la voie d'~i....n;~l.alion choisie qui, de pri:ré.~e.lce, est
la voie paf~.nlhi.le. L'~ .;n;~ Lion par voie pa~nlél~le col~rei1d les ~rlmini.~tra-
tions il~ ve;n~se, il.~ ;lon~le, ;..l.z~....~sc~ ire ou sous~lt~née. Plus particu-
25 lièrement préférée est l'a-1. ..;n;.~ lion intr~rçritc)n~le ou il-1 ~v~ use~
La pl~sellle invention comp-~e ~d é.~l~mf~nt les compo.~ition~ ph~rm~f~u-
tiques qui cc nti~.nn~nt au moins un produit de formule ~ne~lf~ (I) en une qllalllile
sl~rr;~ e ~ e à l'emploi en théla~eulique hi....~ille ou v~lPf;n~;~. Les compo-
sitions peuvellL être préparées selon les metho~les habituelles en lltili~nt un ou plu-
30 sieurs adjuv~-l~, S~ )pO-l:j ou excipients phann~reutiquement acceptables. Les sup-
ports cor.venables in~ .nt les rlihl~nts~ les milieux aqueux stériles et divers solvants
non toxiques. De pr~îé.~ ce les compositions se prés~ntent sous forme de solutions
ou de suspensions aqueuses, de solutions injectables qui peuvenl contenir des agents
em1lcifi~nt.c, des colorants, des préservatifs ou des stabilic~nt.c.
W O 94/08984 2 1 ~ ~ 7 6 5 PC~r/FR93/01013
Le choix des adjllv~ls ou ~x~irient~ peut être déterminé par la solubilité et
les propriétés chimiques du produit le mode particulier d'~A~ d~ion et les
bonnes pratiques pha~ ce~ll;ques.
Pour l'a~ lion pa~ - .le on utilise des soll1ticn.~ ou des s ~pen~i~ n~
5 stériles aqueuses ou non aqueuses. Pour la p~pal~lion de solutions ou de s--~n~inn~
non aquellses peuv~ ~ être utilisés des huiles végetales naturelles telle que l'huile
d'olive l'huile de sésame ou l'huile de p~rine ou les esters organiques injectables
tel que l'oléate d'éthyle. Les solutir n~ stériles ~ue~s peuvel-l être c -.~ J~s d'une
solllticn d'un sel rh~rm~ce~-tiqllen~elll acceptable en solution dans de l'eau. Les
10 sol--tion~ aque~es conviennent pour l'a~l~n;~ alion .llL~v~;ne--~e dans la mesure où
le pH est collvP---ahlçm~nt ajusté et où l'i~olonic;le est réalisée par ~Yemrle par une
quan~ilP S~rri~anlp- de chlorure de sodium ou de glllcose La stérç~ at on peut être
réalisée par hallffa~e ou par tout autre moyen qui n'altère pas la coM~osi~ion.
Il est bien ent~n~ que tous les produits entrant dans les compo~itiC~n~ selon
15 l'invention doivent être purs et non toxiques pour les q~ntites lltili~éçs~
Les colllpo~;l;on~ ~uvPnl conlenir au moins 0 01 % de produit th~.apeu~i-
- quement actif. La q~ é de produit actif dans une co.ll~osilion est telle qu'une
posologie cGllvt:nable puisse être p escliLe. De pç~éf~ilce les coll-po~ n~ sontpréparées de telle façon qu'une dose unitaire conl;Pnne de 0 01 à 1000 mg e -vi~n de
produit actif pour l'~l.. -.~.l.~lion parvoie ~.. L~le.
Le ~...I~....~n~ thé.a~eu~ique peut être er~eclllé conc~---~ nl avec d'autres
I-. ;len~n~ thP~pei~l;ques in~ nt des méAi~m~nt.~ anlinéoplastiques des anti-
corps m~n~lcn~nc des thérapies immtmolQgiques ou des r~io~ )jes ou des
mo lific~tellr~ des ~ponses biolo~iques. Les mo~ifiç~tellr~ des e~nses incluent de
25 manière non li-~ ive les lymphokines et les cytokines telles que les interlel-kin~s
les il~ s(a ~ ou ~) et le TNF. D'autres agents rhimioth~n~l~l;que~s utiles dans
le l.n;~ nt des désor~Les dus à la prolifération ~ncrm~le des c~ s ;nrl.iP..~ demanière non Llli~live les agents aLkylants tels que les moutardes à l'azote comme la
mefhlor~lA.n;ne le cyclophosph~mi-ie. le m~lrh~l~n et le chlorambucil des
30 sulfonates d'aL~cyle comme le busulfan les nitrosourées comme la cafn~me la
lom-îsin.o la sém~ n~ et la ~ o~ cine les tri~7P-nes comme la dac~La~ine les
~ntimet~kolites comme les analogues de l'acide folique tel que le méthc lle~ale les
analogues de pyrimi~ine comme le fluorouracil et la cytarabine des analogues de
purines comme la m~rca~lop~ille et la thioguanine des produits naturels tels que les
35 alcalo;des de vinca comme la vinblastine la vincristine et la vPn~esine des
WO 94/08984 PCr/FR93/01013
~,
6~ ~ 14
épipodophyllotoxines comme l'étoposide et le teniposide, des antibiotiques comme la
~ctinC)mycine~ la daunorubicine, la doxorubicine, la bléomycine, la plican,ycine et
la mi~olllycille~ des enzymes comme la L^aspar~in~e, des agents divers comme lescompl~Yçs de coor~in~tion du platine tel que le cisplatine, les urees substituées tel
5 que l'hy&u~yur~e, les dérivés de méthyll,y-l-~ule comme la proc~ba~ e, les
sl ~p~eu.~ adrénocoticoiques comme le mitotane et l'amino~ Lhyl~ide, les
hnrmt~nes et les antagol~Les comme les adrénocorticc,~Léroides comme la
pre~lni.~ne, les progestines comme le caproate d'hydru~ypr~g~lér~i1e, l'acétate de
m~t~oy~yproge~Lér~ile et l'acétate de megestrol, les oestrogènes comme le
10 diéthyl.~tilhe-strol et l'éthynylestradiol, les antioestrogène comme le tamoxifène, les
androgènes comme le propionate de tçstostérone et la fluoxymesterone.
Les doses utili~ées pour mettre en oeuvre les méthodes selon l'invention
sont celles qui p~rmett~nt un traitement prophylactique ou un ma~u.,l de réponsethél~ell~ique. Les doses varient selon la forme dl~imini~tr~tit~n~ le produit particu-
15 lier s~-lectionnç et les caractéristiques propres du sujet à traiter. En général, les doses
sont celles qui sont thél~peuliquement ~ffic~ces pour le t~ e~ des désordres dusà une prolifération ce~ ire ~norm~le Les produits selon l'invention peuv~nL être~-lminictrés aussi souvent que nece~ e pour obtenir l'effet th~,apeulique dé~siré.
Certains m~ s pe~ vel,L répondre rapi~emçnt à des doses relativement fortes ou
20 faibles puis avoir besoin de doses d'entretien faibles ou nulles. Génér~l~m~-nt, de
faibles doses seront ntili.cé~s au début du tr~it~?m~nt et, si n~5~ , des doses de
plus en plus fortes seront a l~;n;~ees jusqu'à l'obtention d'un effet opLill~um. Pour
d'autres m~l~(les il peut être nécessaire d'a~lmini~trer des doses d'entretien 1 à 8 fois
par jour, de préférence 1 à 4 fois, selon les besoins physiologiques du malade
25 c~n.~i~lçré. Il est aussi possible que pour certains m~ çs il soit nece~ ;le de
n'utiliser qu'une à deux ~ n;~ nt;on~ journalières.
Chez l'homme, les doses sont généralem~nt comrri~-s entre 0,01 et
200 mg/kg. Par voie intrapériton~le, les doses seront en général cornpri.~es entre 0,1
et 100 mg/kg et, de préférence entre 0,5 et 50 mg/kg et, encore plus spécifiquement
30 entre 1 et 10 mg/kg. Par voie intraveineuse, les doses sont généralement comprises
entre 0,1 et 50 mg/kg et, de p,ere-ellce entre 0,1 et 5 mg/kg et, encore plus specifi-
quement entre 1 et 2 mg/kg. Il est ~nten~l1 que, pour choisir le dosage le plus
approp.ié, devront être pris en compte la voie d'~lmini~tration, le poids du m~ e,
son état de santé général, son âge et tous les facteurs qui peuvent influer sur
35 l'efficacité du traitement.
WO 94/08984 PCr/FR93/01013
~ 6 7 ~
Les exemples suivants illustrent la présente invention.
FXF.l~PLE 1
On procède à la réduction électrolytique du t.b~lloxycaLlJonylamino-3
phényl-3 hydroxy--2 propionate-(2R,3S) d'acétoxy4 bel~yloxy-2a époxy-5~,20
trihydio~y-1~3,713,10~ oxo-9 taxène-ll yle-13a (ou Taxotère) dans une cellule
d'électrolyse possé~nt les caractéristiques Sl~iv~l~es:
- la cellule est un vase de verre de 25 cm3 divisé en deux colllpaLLilllell~ par une
membrane échangeuse de cations,
- la cathode est une nappe de mercure dont la s~face utile est d'env~ 12 cm2,
- l'anode est une grille de platine,
- l'électrode de référence est une électrode au calomel saturée.
Dans le colllpal ~illlent c~th~iique, on introduit 25 cm3 d'une solution
cont~n~nt
- t.bu~oxycalbonylamino-3 phényl-3 hydroxy-2 propionate-(2R,3S)
d'acétoxy-4 benzoyloxy-2a époxy-5~,20 trihydn~cy-1~,7~,1013 oxo-9
taxène-ll yle-13a (ou Taxotère) titrant à 73 ~o . .. ..... ... 500 mg
- chlorure d'ammonium .............................. ............. 0,1M
- ammoniaque aqueux à 33 ~o ........................ ..... . 0,5 cm3
- méthanol ......................................... ... q.s.p. 25cm3
Le pourcentage d'eau est de 2 ~o (en volume).
Dans le conlpa.~ ent anodique, on introduit 10 cm3 du même m~l~nge ne
conten~nt pas le substrat.
Après désaération de la solution pendant 10 .l~;nules par barbotage d'un
courant d'argon, qui est m~int~ntl pendant toute la durée de l'électrolyse, le potentiel
de la ~thccle est fixé à -1,85 volt par rapport à l'électrode de li:ri~ ce.
Au cours de l'électrolyte, à deux repri.~e,s, on fait l~sll,oter de l'~mmc~ni~que
gazeux puis de l'argon pendant quelques .~.;nul~c afin de ..~ ir le pH légèrement
alcalin, c'est-à-dire supérieur à 7. On électrolyse la solution pendant 2 heures 20
mint~teS, c'est-à-dire pendant le temps nécP,s.s~;.e au passage de 380 coulombs.A l'électrolysat, on ajoute 1,4 cm3 d'acide actique pour neutraliser
l'ammoniaque jusqu'à pH 6. Après avoir éliminé le solvant sous pression réduite à
une température inférieure à 35C, on reprend l'extrait par 25 cm3 d'eau pelnlu~ée,
on extrait par 3 fois 25 cm3 d'acétate d'éthyle puis on lave la phase organique par
une solution aqueuse saturée en chlorure de sodium. Après séchage de la phase
WO 94/08984 PCr/FR93/01013
1-
6~ ~ 16
organique, séparée par lt~c~nt~tinn~ sur sulfate de m~nçsium, on évapore le solvant
sous pression réduite à une température inférieure à 35C. On obtient ainsi 510 mg
de produit brut dont les con~ S~ sont séparés par chrom~tQgraphie flash sur 50 gde silice (0,04-0,063 mm) Co,,lt~ c dans une colonne de 2 cm de diamètre en éluant
5 avec un mélange dichlorométh~ne-mi~th~nol (93-3 en volumes) sous une pression
d'argon de 4 bars, en recueillant des fractions d'envrion 5 cm3. Les fractions 30 à 41,
réunies et con-~ntrées à sec sous pression réduite (0,27 kE'~) à une températureinférieure à 35C, fo~rni.~-nt 167 mg d'un produit obtenu qui est purifié par
chr,~n,d~ographie ~r,-paL~iv~ en couche mince [gel de silice - ép~ el-~ 0,25 mm -
milieu dichlorornçth~ne-acétate dléthyle-méth~nol (40-55-5 en volumes)]. On obtient
ainsi 118 mg de t.butoxycarbonylamino-3 phényl-3 hy~ y-2 propionate-(2R,3S)
d'acétoxy-4 benzoyloxy-2a époxy-5~,20 tétraliy~u~y-1~,7~,9a,10~ taxène-11 yle-
13a, c'est-à-dire un produit de formule générale (I) pour lequel Rl représente un
atome d'hydrogène et R2 ~ sel,le un radical lly~Lo~y dont les caractéristiques sont
les suivantes:
- spectre de R.M.N.: (400 MHz; CDCl3; llépl~mçnt.~ chimiques en ppm;
con~t~nt.o-~ de couplage J en Hz): 1,30 (s, 3H: -C~3 16 ou 17); 1,40 [1s, 9H:
-C(CH3)3, 1s, 3H: -CH316 ou 17]; 1,70 (1s, 3H: -C~3 18 ou -C~3 19); 1,82 (1s,
3H: -CEI318 ou -CH3 19); 1,90 [m, lH: -(CH)H 6]; 2,09 [m, lH: -(CH)EI 14];
2,28 (bs, 3H: -COCH3); 2,37 [m, lH: -(CH)H 14]; 2,52 [m, lH: -(CH)H 6]; 3,03
(d, lH: -H 3); 4,20 (d, lH: -(CH)H 20); 4,30 (m, 3H: -(CH)~ 20, -E~ 7, -H 9];
4,60 (bs, lH: -H 2'); 4,90 (m, J = 10 Hz, 2H: -~ 5 et -~1 10); 5,28 (bd, lH: -~1 3')
; 5,68 (d, lH: -CONH-); 5,80 (d, lH: -H 2); 6,10 (bt, lH: -E 13); 7,30 à 7,44 (m,
5H: -C6H53'); 7,50 [t, J = 7,5 Hz, 2H: -OCOC6H5(-H 3 et -_ 5)]; 7,60 [t, J = 7,5Hz, lH: -OCOC6H5(-H 4)]; 8,10 [d, J = 7,5 Hz, 2H: -OCOC6H5(-H 2 et -H 6)].
Les fractions 44 à 61, réunies et cl nrPntrées à sec sous pression réduite
(0,27 kPa) à une le~ inférieure à 35C, fo~lrni~sçnt 90 mg de
t.bu~o~yc~l,onylamino-3 phényl-3 lly~o~y-2 propionate-(2R,3S) d'acétoxy-4
benzoyloxy-2a époxy-5~,20 tétrally~Lv~y-1~,7~,9~,10~ taxène 11 yle-13cc, c'est-à-
dire un produit de forrnule générale (I) pour lequel Rl représente un radical hydroxy
et R2 représente un atome d'hydrogène dont les caractéristiques sont les suivantes:
- spectre de R.M.N.: (400 MHz; CDCl3; dépl~çmçnt.~ chimiques en ppm;
const~n~es de couplage J en Hz): 1,30 (s, 3H: -CH3 16 ou 17); 1,40 [1s, 9H:
-C(CH3)3, 1s, 3H: -CH316 ou 17]; 1,70 (1s, 3H: -CH3 18 ou -C~3 19); 1,80 (ls,
3~ 3H: -CH318 ou -C_3 19); 2,00 [m, 2H: -(CH)_ 6 et -(CH)_ 14]; 2,25 (bs, 3H:
WO 94/08984 214 fi ~ 6 S PCr/FR93/01013
17
-COCH3); 2,40 [m, 2H: -(CH)H 6 et-(CH)H 14]; 3,04 (d, lH: -H3); 4,12 [t, lH:
-H 7]; 4,24 à 4,36 (m, 3H: -C--2 20 et -H 9); 4,60 (bs, lH: -~ 2'); 5,00 (bd, lH:
-~1 5); 5,24 (d, J = 6 Hz, lH: -H 10); 5,30 (vbd, lH: -~I 3'); 5,70 (bd, lH:
-CONH-); 6,12 (bt, lH: -H 13); 6,24 (d, lH: -EI 2); 7,30 à 7,43 (m, 5H:
-C6H53'); 7,50 [t, J = 7,5 Hz, 2H: -OCOC6H5(-~l 3 et -~I 5)]; 7,60 [t, J = 7,5 Hz,
lH: -OCOC6H5(-H 4)]; 8,10 [d, J = 7,5 Hz, 2H: -OCOC6H5(-H 2 et -~ 6)].
EXFl\~PLE 2
On procède à la rédtlction électrolytique du t.butoxycarbonylamino-3
phényl-3 hy~roxy-2 propionate-(2R,3S) d'acétoxy-4 ber~yloxy-2a époxy-5~,20
tril,y~Lo~y-1~,7~,10~ oxo-9 taxène-ll yle-13a (ou Taxotère) dans une cellule
d'électrolyse possé(l~nt les caractéristiques suiv~l~es:
- la cellule est un vase de 25 cm3 divisé en deux co,l~p~liments par une membrane
échangeuse de cations,
- la cathode est une nappe de mercure dont la surface utile est d'el-v~on 4 cm2.- l'anode est une grille de platine,
- l'électrode de référence est une électrode au c~lom~l saturée.
Dans le coll.~a"i-l-ent cathodique, on introduit 10 cm3 d'une solution
conten~nt
- t.l)u~o~cyc~lJonylamino-3 phényl-3 hy~`~y-2 propionate-(2R,3S)
d'acétoxy-4 I)el~yloxy-2a époxy-5~,20 tril-y~ y-1~,7~,10~ oxo-9
taxène-ll yle-13c~ (ou Taxotère) ...................... 32,3 mg
- chlorure de c~lcillm .. ,........... ,,.. ,. ...... ............... 0,05 M
- acide chlorhydrique méthanolique q.s.p...... .................. 4.10-3M
- eau ....... .......................... .......................................... 0,5 cm3
- méthanol q.s.p. . ........................ ........ . 10 cm3
Le po~el-~ge en eau est d'environ 5 % (en volumes).
Dans le co-l,p~ ent anodique, on introduit 10 cm3 d'acide chlorhydrique
0,2M dans le méthanol.
Après désaération de la solution pendant 10 minlltes par barbotage d'un
30 courant d'argon, qui est m~int~nll pendant toute la durée de l'électrolyse, le potentiel
de la cathode est fixé à -1,9 volt par rapport à l'électrode de référence.
On électrolyse la solution pendant 43 minl~t~.s, c'est-à-dire pendant le temps
nécessaire au passage de 30,9 coulombs.
WO 94/08984 PCr/FR93/01013
23.~67 ~ 18
Pour neutraliser parti~llem~nt l'acidité de l'électrolysat, on ajoute 400 Illitres
d'une soll-tion meth~nQlique 0,1M d'acétate de sodium.
Le solvant est éliminé par ~ tillAticn sous pression réduite à une
te-l,pé~d~ule inférieure à 35C. Le résidu est repris par 10 cm3 d'acétate d'éthyle et
par 10 cm3 d'eau ~ ~ Après ~léc~nt~tiQn~ la phase aqueuse est extraite par 3
fois 5 cm3 d'acétate d'éthyle.
La phase organique est lavée par 10 cm3 d'une sollltion aqueuse de tampon
phQsph~te de sodium 0,2M à pH = 7.
Après ~léc~ntat --n, la phase organique est séchée sur s-wfate de m~gn~ m
Après filtration et con~ ion à sec sous pression réduite à une
température inférieure à 35C, on obtient 26,2 mg d'un produit brut dont les
con~ sont séparés par cl~r~,l,alographie p~p~ive en couche mince
(0,25 mm) sur 6 plaques de gel de silice (Kieselgel 60 F 254; Merck) en éluant par
un m~l~n~e dichlorométh~ne-méthanol-a~el~.n;l- .le (724-24 en volumes).
On obtient ainsi, avec un rentiçm~nt de 51 ~, 16,7 mg de t.butoxy-
c~l,ollylamino-3 phényl-3 1Iy~Ly-2 propionate-(2R,3S) d'acé~y4 berwyloxy-
2a époxy-5~,20 tétrahy~o~y-1~,7~,9a,10~ taxène-ll yle-13a.
EXFl\IPLE 3
On procède à la récl~ction électrolytique du t.bu~o~yc~bonylamino-3
phényl-3 l-y~xy-2 propionate-(2R,3S) d'acétoxy-4 benzoyloxy-2a époxy-5~,20
trihy~ xy-1~,7a,10~ oxo-9 taxène-ll yle-13a (ou épi-7 Taxotère) dans une celluled'électrolyse posse~nt les caractéristiques swv~es:
- la cellule est un vase de verre de 25 cm3 divisé en deux co",pa.~iments par une
membrane échangeuse de cations,
- la cathode est une nappe de mercure dont la surface utile est d'ellviL~oll 4 cm2,
- l'anode est une grille de platine,
- l'électrode de référence est une électrode au calomel saturée.
On réduit 505 mg d'épi-7 Taxotère en effectuant 2 opérations d'électrolyse
succe~ives:
Première électrolvse
Dans le comp~ linlent cathodique de la cellule décrite ci-dessus, on intr~}duit
10 cm3 d'une solution C~-nten~nt
WO 94/08984 PCT/FR93/01013
7~
19
- épi-7 Taxotère ...................................... 101,6 mg
- chlorure d'~mmonillm ........ ..... .......................... ..... 0,1M
- ~mmo~liPque aqueux à 33 ~o ...... ................ ... . 0,2 cm3
- méthanol q.s.p............................... .............. 10 cm3
Le po~ell~ge d'eau est de 2 ~?o (en volumes)`
Dans le co-"p~Lilllent anodique, on introduit 10 cm3 d'une solution 0,1M de
chlorure d'~mmoni~-m dans le méth~nol
Après désaération de la solution pendant 10 .~.;nule5 par barbotage d'un
courant d'argon, qui est m~int~ml p~n~i~nt toute la durée de l'électrolyse, le potentiel
de la cathode est fixé à -1,8 volt par rapport à l'électrode de référence.
On électrolyse la solution ~ndal,~ 64 minl~tes, c'est-à-dire pendant le temps
neC~ss~ire au passage de 73 coulombs.
Pour neutraliser l'~mmfni~que, on ajoute environ 0,6 cm3 d'acide acétique à
l'électrolysat.
Deuxième électrolvse
Dans le co,~arLllent cathodique de la cellule d'électrolyse décrite
ci~essus, on introduit 20 cm3 d'une solution Co~ lL:
- épi-7 Taxotère ........ ............................. ..... .............. 404,1 mg
- chlorure d'~mmonil~m .. .. .... ...... , . ...... ......... 0,1M
- ammoniaque aqueux à 33 ~ . .. ... ....... .............. 0,4 cm3
- mét~anol q.s.p....................................... 20 cm3
Dans le co-llp~iment anodique, on introduit 10 cm3 de solution 0,1M de
chlorure d'ammonium dans le méth~nol
Après désaération de la soll-tion p~n~1~nt 10 ...;~ les par barbotage d'un
courant d'argon, qui est m~inteml pendant toute la durée de l'électrolyse, le potentiel
de la c~tho ie est fixé à -1,8 volt par rapport à l'électrode de référence.
On électrolyse la solution pendant 2 heures 19 minlltes, c'est-à-dire pendant
le temps nécç~ire au passage de 255 coulombs.
Les deux électrolysats ainsi obtenus sont réunis.
Après élimin~tion du solvant sous pression réduite à une température
inférieure à 35C, le résidu est repris par 30 cm3 d'acétate d'éthyle et 30 cm3 d'eau.
Après ~ nt~tion, la phase aqueuse est extraite par 2 fois 15 cm3 d'acétate
d'éthyle.
WO 94/08984 PCr/FR93/01013
6~ 20
Les phases organiques réunies sont lavées par 30 cm3 d'une solution
aqueuse 0,2M de tampon phosph~te de sodium à pH=7 puis sé~hees sur sulfate de
m~gn~ m.
Après filtration et i~vapoI~Lion du solvant sous pression réduite à une
température inférieure à 35C, on obtient 436 mg de produit brut dont les
con~ sont séparés par chromatographie prepaL~liv~ en couche mince (1 mm)
sur 11 plaques de gel de silice (~i~,l~l 60 F 254, Merck) par un mél~nge
dichlorométh~ne-acé~ ;I. ;le-m~th~nol (72-24-4 en volumes).
On obtient ainsi, avec un renriem~nt de 62,5 ~o, 317 mg de
t.bu~oxyc~boI.ylamino-3 phényl-3 hydlu~r-2 propionate-(2R,3S) d'acétoxy-4
ber~oyloxy-2a époxy-5~,20 tétra~Iy~u~y-1~,7a,9a,10~ taxène-11 yle-13a dont les
caractéristiques sont les s~uv~es:
- spectre de R.M.N.: (400 MHz; CDC13; d en ppm):
1,28 (s, 3H: -CH3 16 ou 17); 1,40 [s, 9H: -C(CH3)3]; 1,54, 1,60, 1,70 (3s, 3H
chacun: -CH3 16 ou 17, -CH3 18, -CH3 19); 2,20 à 2,4 (mt, 7H: -COCH3, -CH2
14, -CH2 6); 2,50 (bs, lH: -O~ 10); 2,94 (bs, lH: -OE 9); 3,40 (d, lH: -~ 3);
3,50 (bs, lH, -OH 2'); 3,70 (d, lH: -O_ 7); 4,24 (dd, lH: -H 9); 4,30 et 4,40 (2d,
lH chacun: -CH2 20); 4,52 (bdd, lH: -~ 7); 4,60 (bs, lH: -H 2'); 4,88 (dd, lH:
-H 5); 5,20 (d, J = 10 Hz, lH: -~ 10); 5,28 (vbd, lH: -~ 3'); 5,52 (bd, lH:
-CON~-); 5,85 (d, lH: -H 2); 6,14 (bt, lH: -H 13); 7,30 à 7,42 (m, 5H: -C6~15
3'); 7,50 [t, J = 7,5 Hz, 2H: -OCOC6H5(-~ 3 et -H 5)]; 7,60 [t, J = 7,5 Hz, lH:
-OCOC6H5(-H 4)]; 8,10 [d, J = 7,5 Hz, 2H: -OCOC6H5(-~ 2 et -~ 6)].
L'épi-7 Taxotère peut être obtenu par action de l'hy~ure de sodium sur le
Taxotère en opérant dans le tétrahy~fu~ e sous atmosphère inerte.
E~Fl\~PLE 4
On dissout 40 mg de t.buto~y~l,ol,ylamino-3 phényl-3 lIy~roxy-2
propionate-(2R,3S) d'acétoxy-4 benzoyloxy-2a époxy-5~,20 tétral,yd~o~y-1~,7~3,
9a,10~ taxène-11 yle-13a dans 1 cm3 d'Fmlllphc)r EL 620 et 1 cm3 d'éthanol puis la
solution est diluée par addition de 18 cm3 de sérum physiologique.
La composition est ~imini~trée par introduction dans une perfusion d'un
soluté physiologique pendant 1 heure.