Note: Descriptions are shown in the official language in which they were submitted.
2l52l8~
WO 94/159~4 PCT/FRg4/00006
nFRlVFS DF PYRROI IDINF FT THIA701 IDINF. I FUR PRFPARATION FT
I FS MFnlcAMENTs I FS CONTENANT
.
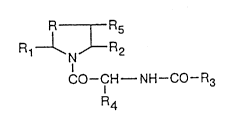
La présente invention concerne des dérivés de formule:
R I R5
1 ~N~ 2 (I)
CO--CH--NH--CO--R
R4
5 leurs sels, leur préparation et les médicaments les contenant.
Dans la formule (I),
-soit R représente un radical méthylène, éthylène, SO, S02, CHOH ou un
atome de soufre, R1 représente un radical pyridyle éventuellement substitué
par un ou plusieurs radicaux alkyle, furyle éventuellement substitué par un ou
10 plusieurs radicaux alkyle, thiènyle éventuellement substitué par un ou
plusieurs radicaux alkyle, quinolyle éventuellement substitué par un ou
plusieurs radicaux alkyle, naphtyle éventuellement substitué par un ou
plusieurs radicaux alkyle, indolyle éventuellement substitué par un ou
plusieurs radicaux alkyle ou phényle éventuellement substitué par un ou
15 plusieurs substituants choisis parmi les atomes d'halogène et les radicaux
alkyle, alcoxy, hydroxy, nitro, amino, monoalkylamino, dialkylamino,
alcoxycarbonyle, -CO-~NR7Rg -NH-CO-CH3, trifluorométhyle ou
trifluorométhoxy et Rs représente un atome d'hydrogène,
-soit R représente un radical méthylène, R1 représente un atome
20 d'hydrogène et Rs représente un radical phényle,
-soit R représente un radical CHR6, R1 et Rs représentent chacun un atome
d'hydrogène,
.
-R2 représente un radical alcoxycarbonyle, cycloalkyloxycarbonyle, cyclo-
alkylalkyloxycarbonyle, -CONRgR1 o ou phényle éventuellement substitué par
WO 94/15954 .~ PCT/FR94/00006
2~S2~3 2
un ou plusieurs substituants choisis parmi les radicaux alkyle, alcoxy ou
hydroxy,
-R3 représente un radical phénylamino dont le noyau phényle est substitué
par un ou plusieurs substituants choisis parrni- les radicaux -alk-SO2H,
5 -SO2-NH-CO-R11. -B(H)2, -SO2-NH-SO2-R1 1. -CO-NH-CO-R1 1,
-CO-NH-SO2-R1 1, -c(NH2)=NoHl -SO2-NH-R~2, -CO-NH-R1 2
N O N--NH
I~N~R13 ~o~LO
HN N HN O
~co R14
HN O
~
OH
et éventuellement par un ou plusieurs substituants choisis parmi les atomes
d'halogène et les radicaux alkyle, alcoxy, alkylthio, trifluorométhyle, carboxy,10 alcoxycarbonyle, hydroxy, nitro, amino, acyle, cyano, sulfamoyle,
carbamoyle, hydroxyiminoalkyle, alcoxyiminoalkyle, hydroxyaminocarbonyle,
alcoxyaminocarbonyle, tétræolyl-5, tétræolyl-5 alkyle,
trifluorométhylsulfonamido, alkylsulfinyle, mono ou polyhydroxyalkyle, sulfo,
-alk-O-CO-alk, -alk-COOX, -alk-O-alk, -alk'-COOX, -O-alk-COOX,
15 -CH=CH-COOX, -CO-COOX, -alk-SO3H (sous forme de sel), -CH=CH-alk',
-C(=NOH)-COOX, -S-alk-COOX, -SO-alk-COOX, -SO2-alk-COOX,
-O-CH2-alk'-COOX, -CX=N-O-alk-COOX, -alk-N(OH)-CO-alk ou diméthyl-2,2
dioxo-4,6 dioxanne-1,3-yl-5,
-R4 représente un atome d'hydrogène ou un radical alkyle,
20 -R6 représente un radical phényle,
WO 94/15954 _ 21 5 2 1 8 3 PCT/FR94/00006
-R7 représente un atome d'hydrogène ou un radical alkyle, phénylalkyle ou
phényle éventuellement substitué par un ou plusieurs substituants choisis
parmi les atomes d'halogène et les radicaux alkyle, alcoxy et alkylthio,
-R8 représente un radical alkyle, phénylalkyle ou phényle éventuellement
5 substitué par un ou plusieurs substituants choisis parmi les atomes
d'halogène et les radicaux alkyle, alcoxy et alkylthio,
ou bien R7 et R8 forment avec l'atome d'azote auquel ils sont rattachés un
hétérocycle mono ou polycyclique saturé ou insaturé contenant 4 à 9 atomes
de carbone et un ou plusieurs hétéroatomes (O, N) et éventuellement
10 substitué par un ou plusieurs radicaux alkyle,
-Rg représente un atome d'hydrogène ou un radical alkyle, cycloalkylalkyle,
cycloalkyle, phénylalkyle ou phényle éventuellement substitué par un ou
plusieurs substituants choisis parmi les atomes d'halogène et les radicaux
alkyle, alcoxy et alkylthio,
15 -R10 représente un radical alkyle, cycloalkylalkyle, cycloalkyle, phénylalkyle
ou phényle éventuellement substitué par un ou plusieurs substituànts choisis
parmi les atomes d'halogène et les radicaux alkyle, alcoxy et alkylthio,
ou bien Rg et R10 forment ensemble avec l'atome d'azote auquel ils sont
rattachés un hétérocycle mono ou polycyclique saturé ou insaturé contenant
20 4 à 9 atomes de carbone et un ou plusieurs hétéroatomes (O, N, S) et
éventuellement substitué par un ou plusieurs r~dic~llx alkyle,
- R11 représente un radical alkyle, cycloalkyle, trifluorométhyle, phényle
éventuellement substitué par un ou plusieurs substituants choisis parmi les
radicaux cyano, alcoxy, nitro, amino et les atomes d'halogène,
25 - R12 représente un radical tétrazolyl-5,
- R13 représente C=O ou S=O,
- R14 représente O ou C=O,
- X représente un atome d'hydrogène, un radical alkyle ou phénylalkyle,
WO 94/15954 S2183 PCT/FR94/00006
- alk représente un radical alkyle ou alkylène,
- alk' représente un radical hydroxyalkyle, hydroxyalkylène, alkoxyalkyle ou
alkoxyalkylène. ~ .
Dans les définitions qui précèdent et celles qui seront citées ci-après,
5 sauf mention contraire, ies radicaux alkyle, alkylène et alcoxy et les portions
alkyle, alkylène et alcoxy contiennent 1 à 4 atomes de carbone en chaîne
droite ou ramifiée, les radicaux ou portions acyle contiennent 2 à 4 atomes
de carbone et les radicaux et portions cycloalkyle contiennent 3 à 6 atomes
de carbone.
Lorsque R7 et R8 forment avec l'atome d'azote auquel ils sont
rattachés un h~térocycle, celui-ci est de préférence un cycle pipéridino
éventuellement substitué par un ou plusieurs radicaux alkyle ou un cycle
tétrahydro-1,2,3,4 quinoléine.
Lorsque Rg et R10 forment avec l'atome d'azote auquel ils sont
15 rattachés un hétérocycle, celui-ci est de préférence un cycle pipéridino,
perhydroazépinyl-1, tétrahydro-1,2,3,6 pyridyl-1, tétrahydro-1,2,3,4
quinolyl-1, pyrrolidinyl-1, tétrahydro-1,2,3,4 isoquinolyl-2, thiomorpholino ou
indolinyl-1, ces cycles pouvant être éventuellement substitués par au moins
un radical alkyle.
Les composés de formule (I) comportant un ou plusieurs centres
asymétriques présentent des formes isomères. Les racémiques et les
énantiomères de ces composés font également partie de l'invention.
Les composés de formule (I) pour lesquels R représente un radical
méthylène, éthylène, CHOH, CHR6 ou un atome de soufre peuvent être
préparés par action d'un dérivé réactif de l'acide carbamique, obtenu
éventuellement in situ par action d'un dérivé réactif de l'acide carbonique
choisi parmi le N,N'-diimidazole carbonyle, le phosgène, le diphosgène, le
triphosgène et le chloroformiate de p-nitrophényle sur un dérivé de formule:
2152183
WO 94/15954 PCT/FR94/00006
R I Rs
R1~N~R2 (Il)
I
CO- ICH--NH2
- R4
dans laquelle R représente un radical méthylène, éthylène, CHOH, CHR6 ou
un atome de soufre et R1, R2 R4 Rs et R6 ont les mêmes significations que
dans la formule (I), sur une aniline dont le noyau phényle est substitué par un
5 ou plusieurs substituants choisis parmi les radicaux -alk-SO2H,
-S02-NH-CO-R1 1, -B(OH)2~ -S02-NH-S02-R1 1, -CO-NH-CO-R1 1,
-CO-NH-S2-R1 1, -C(NH2)=NoH~ -SO2-NH-R1 2, -CO-NH-R12,
N--O N- NH
13 ~o~LO
HN N,CH3 HN O
r
N R~4
HN r
ol~
OH
et éventuellement par un ou plusieurs substituants choisis parmi les atomes
10 d'halogène et les radicaux alkyle, alcoxy, alkylthio, trifluorométhyle, carboxy,
alcoxycarbonyle, hydroxy, nitro, amino, acyle, cyano, sulfamoyle,
carbamoyle, hydroxyiminoalkyle, alcoxyiminoalkyle, hydroxyaminocarbonyle,
alcoxyaminocarbonyle, tétrazolyl-5, tétrazolyl-5 alkyle,
trifluorométhylsulfonamido, alkylsulfinyle, mono ou polyhydroxyalkyle, sulfo,
15 -alk-O-CO-alk, -alk-COOX, -alk-O-alk, -alk'-COOX, -O-alk-COOX,
-CH=CH-COOX, -CO-COOX, -alk-SO3H (sous forme de sel), -CH=CH-alk',
-C(=NOH)-COOX, -S-alk-COOX, -SO-alk-COOX, -SO2-alk-COOX,
-O-CH2-alk'-COOX, -CX=N-O-alk-COOX, -alk-N(OH)-CO-alk ou diméthyl-2,2
dioxo-4,6 dioxanne-1,3-yl-5.
WO 94/15954 215 2183 ~ PCT/F'R94/00006
Cette réaction s'effectue généralement au sein d'un solvant inerte tel
que le tétrahydrofuranne, le diméthylformamideJ un solvant chloré
(chloroforme, dichloro-1,2 éthane par exemple) ou~ un solvant aromatique
(benzène, toluène par exemple) ou un mélange de ces solvants, à une
S température comprise entre 20C et la températ`ùre d'ébullition du solvant.
Le dérivé réactif de l'acide carbamique peut être obtenu dans les
mêmes conditions de solvant et de température.
Les dérivés de formule (Il) peuvent être obtenus par déprotection
d'un dérivé de formule:
R ~R5
IN 2 (Ill)
CO--CI H--NH--COOC(CH3)3
R4
dans laquelle R représente un radical méthylène, éthylène, CHOH, CHR6 ou
un atome de soufre et R1, R2, R4 Rs et R6 ont les mêmes significations que
dans la formule (I).
Cette déprotection s'effectue de préférence au moyen
15 d'iodotriméthylsilane ou d'acide trifluoroacétique, au sein d'un solvant inerte
tel que l'acétonitrile ou un solvant chloré (chloroforme, dichloro-1,2 éthane
par exemple), à une température comprise entre 15 et 40C.
Les dérivés de formule (Ill) peuvent être obtenus par action d'un
dérivé de formule:
R ~R5
N 2 (IV)
H
dans laquelle R représente un radical méthylène, éthylène, CHOH, CHR6 ou
un atome de soufre et R1, R2 Rs et R6 ont les mêmes significations que
dans la formule (I), sur un acide de formule:
WO 94/15954 215 218 3 PCT/FR94/00006
HOOC--CH--NH--COOC(CH3)3 (V)
R4
dans laquelle R4 est défini comme dans la formule (I).
Cette réaction s'effectue au sein d'un solvant inerte tel que
l'acétonitrile, le tétrahydrofuranne ou un solvant chloré, en présence d'un
5 agent de condensation utilisé en chimie peptidique tel qu'un carbodiimide
(N,N'-dicyclohexylcarbodiimide par exemple) ou un chloroformiate d'alkyle, à
une température comprise entre 10 et 40C.
Les dérivés de formule (V) peuvent être obtenus selon les méthodes
habituelles de protection des amino acides.
Les dérivés de formule (IV) peuvent être préparés par application ou
adaptation des méthodes décrites dans la littérature et des méthodes
décrites ci-dessous.
Les dérivés de formule (IV) pour lesquels R2 représente un radical
alcoxycarbonyle, cycloalkyloxycarbonyle ou cycloalkylalkyloxycarbonyle
15 peuvent être obtenus par estérification d'un acide de formule:
R R5
R~N~LCOOH (Vl)
H
dans laquelle R représente un radical méthylène, éthylène, CHOH, CHR6 ou
un atome de soufre et R1 Rs et R6 ont les mêmes significations que dans la
formule (I).
Cette estérification s'effectue généralement au moyen d'un alcool
R1 s-OH dans lequel R1 s représente un radical alkyle, cycloalkyle ou
cycloalkylalkyle, en milieu acide, à la température d'ébullition du mélange
réactionnel. Pour les composés de formule (IV) pour lesquels R2 représente
un radical tert-butoxycarbonyle on fait réagir l'isobutène, sur un produit de
formule (Vl) au sein d'un solvant inerte tel qu'un solvant chloré, en présence
d'un acide tel que l'acide sulfurique, à une température voisine de 20C.
WO 94/15954 ~ PCT/F R94/00006
2ls2l~3 8
Les dérivés de formule (Vl) pour lesquels R représente un radical
méthylène, R1 est défini comme dans la formule (!) e~ Rs représente un
atome d'hydrogène peuvent être préparés par application ou adaptation de la
méthode décrite par H.GERSHON et coll., J. Org. Chem., 26, 2347 (1961).
Les dérivés de formule (Vl) pour lesquels R représente un radical
CHR6 et R1, Rs et R6 sont définis comme dans la formule (I) peuvent être
préparés par application ou adaptation de la méthode décrite par J. K.
THOl~ATHIL et coll., Tetrahedron Letters, 27, 151 (1986) et D.R.
KRONENTHAL et coll., Tetrahedron Letters, 31,1241 (1990)
Les dérivés de formule (Vl) pour lesquels R représente un radical
méthylène, R1 représente un atome d'hydrogène et Rs représente un radical
phényle peuvent être préparés par application ou adaptation de la méthode
décrite par Y.N. BELOKON et coll., J. Chem. Soc. Perkin Trans 1, 2075
(1988) et J. RIVIER et G.R. MARSHALL, Peptides, Chemistry, Structure and
biology, Proceedings of the Eleventh American Peptide Symposium,
July 9-14,1989 - La Jolla California USA - ESCOM Leiden 1990.
Les dérivés de formule (Vl) pour lesquels R représente un atome de
soufre, R1 est défini comme dans la formule (I) et Rs représente un atome
d'hydrogène peuvent être obtenus par action d'un dérivé de formule:
HS--CH--ICH--NH2 (Vll)
R5 COOH
dans laquelle Rs représente un atome d'hydrogène, sur un aldéhyde de
formule:
R1 -CHO (Vlll)
dans laquelle R1 a les mêmes significations que dans la formule (I).
Cette réaction s'effectue de préférence au sein d'un alcool, à la
température d'ébullition du milieu réactionnel.
WO 94/15954 215 2 1 8 3 PCT/FR94/00006
Les dérivés de formule (Vl) pour lesquels R représente un radical
éthylène, R1 est défini comme dans la formule (I) et Rs représente un atome
d'hydrogène, peuvent être préparés par réduction des dérivés de formule:
~ (IX)
R 1 N COOH
5 dans laquelle R1 a les mêmes significations que dans la formule (I).
Cette réduction s'effectue généralement au moyen d'hydrogène, au
sein d'un solvant inerte tel qu'un alcool, en présence d'un catalyseur tel que
l'oxyde de platine, à une température comprise entre 20 et 1 00C,
éventuellement sous pression ou au moyen de borohydrure de sodium et de
10 carbonate de potassium au sein d'un mélange eau-alcool (éthanol, de
préférence), à une température comprise entre 0 et 20C.
Les dérivés de formule (IX) peuvent être obtenus par action d'un
acétamidomalonate d'alkyle sur un dérivé de formule:
o
~Rl (X)
CH2--CH2--CH2CI
15 dans laquelle R1 a les mêmes significations que dans la formule (I) suivi de
l'hydrolyse, de la décarboxylation et de la deshydratation du produit obtenu
en opérant par chauffage dans l'acide chlorhydrique aqueux, I'action de
l'acétamidomalonate d'alkyle sur le produit de formule (X) étant effectuée au
sein d'un alcool, en présence d'une base telle qu'un alcoolate de métal
20 alcalin, à la température d'ébullition du solvant.
Les dérivés de formule (X) peuvent être obtenus par application ou
adaptation de la méthode décrite par M. T. WILLS et coll., J. Org. Chem., 45
(12), 2495 (1980).
Les dérivés de formule (IV) peuvent également être obtenus par
25 déprotection d'un dérivé de formule:
WO 94/15954 PCT/FR94/00006
215Z183 10
R -R5
R~ ~NJ--R2 : . (Xl)
COOZ ~ ~
dans laquelle R représente un radical méthylène, éthylène, CHOH, CHR6 ou
un atome de soufre, R1 R2, Rs et R6 ont les mêmes significations que dans
la formule (I) et Z représente un radical alkyle et de préférence tert-butyle,
5 étant entendu que lorsque R2 représente un radical tert-butoxycarbonyle, Z
ne peut pas être méthyle ou éthyle.
Cette réaction s'effectue au sein d'un solvant inerte tel qu'un solvant
chloré, au moyen d'iodotriméthylsilane, à une température comprise entre
1 5C et la température d'ébullition du milieu réactionnel.
Les dérivés de formule (Xl) pour lesquels R représente un radical
méthylène, R1 représente un radical phényle, thiènyl-2 éventuellement
substitué, furyl-2 éventuellement substitué ou indolyl-3 éventuellement
substitué, R2 représente un radical alcoxycarbonyle, cycloalkyloxycarbonyle,
cycloalkylalkyloxycarbonyle et Rs représente un atome d'hydrogène, peuvent
15 être obtenus par action d'un dérivé de formule:
R 1 H (Xl 1)
dans laquelle R1 représente un radical phényle, thiènyl-2 éventuellement
substitué, furyl-2 éventuellement substitué ou indolyl-3 éventuellement
substitué, sur un dérivé de formule:
R I R5
R16~ NJ--R2 (XIII)
COOZ
dans laquelle R représente un radical méthylène, R2 et Rs ont les mêmes
significations que ci-dessus, R16 représente un radical alcoxy contenant 1 ou
2 atomes de carbone et Z représente un radical alkyle.
2152183
WO 94/15954 PCT/FR94/00006
11 L
Cette réaction s'effectue généralement en présence d'un acide fort
tel que l'acide p-toluènesulfonique ou d'un acide de Lewis tel que le
trichlorure d'aluminium, éventuellement au sein d'un solvant inerte tel qu'un
solvant aromatique, à une température comprise entre 20C et la
5 température d'ébullition du milieu réactionnel.
Les dérivés de formule (Xlll) peuvent être préparés par application
ou adaptation de la méthode décrite par T. SHONO et coll., J. Am. Chem.
Soc., 104, 6697 (1982).
Les dérivés de formule (Xl) pour lesquels R2 représente un radical
10 alcoxycarbonyle, cycloalkyloxycarbonyle ou cycloalkylalkyloxycarbonyle et Z
représente un radical tert-butyle peuvent être préparés par estérification d'un
acide de formule:
R -R5
R1 ~N~COOH (XIV)
COOC(CH3)3
dans laquelle R représente un radical méthylène, éthylène, CHOH, CHR6 ou
15 un atome de soufre, R1 Rs et R6 ont les mêmes significations que dans la
formule (I).
Cette estérification s'effectue dans les conditions décrites
précédemment pour l'estérification des acides de formule (Vl) ou au moyen
d'un alcool, en présence de chlorure de tosyle, au sein de la pyridine.
20Les acides de formule (XIV) peuvent être obtenus par action de
dicarbonate de ditert-butyle sur un acide de formule (Vl).
Cette réaction s'effectue au sein d'un solvant inerte tel que l'eau, le
dioxanne ou un mélange de ces solvants, en présence d'un carbonate de
- métal alcalin, à une température voisine de 20C.
25Les dérivés de formule (Xl) pour lesquels R2 représente un reste
-CONRgR10 et Z représente un radical tert-butyle peuvent être obtenus par
WO 94/15954 PCT/FR94/00006
2~s~83 l2
réaction d'un acide de formule (XIV) ou un dérivé réactif de cet acide sur une
amine de formule:
HNRgR10 '' `` (XV)
dans laquelle Rg et R10 ont les mêmes significations que dans la formule (I).
Lorsque l'on met en oeuvre l'acide, on opère en présence d'un agent
de condensation utilisé en chimie peptidique tel qu'un carbodiimide (par
exemple le N,N'-dicyclohexylcarbodiimide) ou le N,N'-diimidazole carbonyle,
dans un solvant inerte tel qu'un éther (tétrahydrofuranne, dioxanne par
exemple), un amide (diméthylformamide) ou un solvant chloré (chlorure de
méthylène, dichloro-1,2 éthane, chloroforme par exemple) à une température
comprise entre 0C et la température de reflux du mélange réactionnel.
Lorsque l'on met en oeuvre un dérivé réactif de l'acide, il est possible
de faire réagir l'anhydride, un anhydride mixte ou un ester (qui peut être
choisi parmi les esters activés ou non de l'acide).
On opère alors soit en milieu organique, éventuellement èn présence
d'un accepteur d'acide tel qu'une base organique azotée (trialkylamine,
pyridine, diaza-1,8 bicyclo [5.4.0] undécène-7 ou diaza-1,5 bicyclo [4.3.0]
nonène-5 par exemple), dans un solvant tel que cité ci-dessus, ou un
mélange de ces solvants, à une température comprise entre 0C et la
température de reflux du mélange réactionnel, soit en milieu hydroorganique
biphasique en présence d'une base alcaline ou alcalino-terreuse (soude,
potasse) ou d'un carbonate ou bicarbonate d'un métal alcalin ou alGalino-
terreux à une température comprise entre 0 et 40C.
Les dérivés de formule (IV) pour lesquels R représente un radical
méthylène, R1 est défini comme dans la formule générale (I) à l'exception
des radicaux ou des substituants pouvant être altérés lors d'une réduction
(par exemple radical quinolyl ou substituant nitro), R2 représente un radical
phényle éventuellement substitué par un ou plusieurs radicaux choisis parmi
les radicaux alkyles, alcoxy et hydroxy et Rs représente un atome
d'hydrogène peuvent être obtenus par application ou adaptation des
méthodes décrites par C.G. OVERBERGER et Coll., J. Amer. Chem. Soc.,
WO 94/15954 215 2 1 8 3 PCT/FR94/00006
91, 887 (1969). Cette méthode met en jeu des réductions de pyrroles qui
peuvent être obtenus par application ou adaptation des méthodes décrites
dans Synthesis, 613 (1991), Tetrahedron Letters 4407-4410 (1986).
- Les dérivés de formule (IV), pour lesquels R représente un radical
5 méthylène, R1 représente un radical pyridyle éventuellement substitué,
quinolyle éventuellement substitué, naphtyle éventuellement substitué ou
phényle éventuellement substitué par un ou plusieurs substitu~nts choisis
parmi les atomes d'halogène et les radicaux alkyle, alcoxy, hydroxy, amino,
monoalkylamino, dialkylamino, alcoxycarbonyle, -CO-NR7Rg ou
10 -NH-CO-CH3, R2 représente un radical alcoxycarbonyle,
cycloalkyloxycarbonyle ou cycloalkylalkyloxycarbonyle et Rs représente un
atome d'hydrogène peuvent également être obtenus par réduction d'un
dérivé de formule:
(XVI)
R R2
H
15 dans laquelle R1 et R2 ont les mêmes significations que précédemment.
Cette réduction s'effectue généralement au moyen d'un amalgame
mercure-sodium, en présence de dihydrogénophosphate de sodium ou
d'hydrogénophosphate de sodium, au sein d'un solvant tel qu'un alcool
(méthanol par exemple), le tétrahydrofuranne, I'eau ou un mélange de ces
20 solvants, à une température comprise entre -10 et 40C, ou au moyen de
magnésium, au sein d'un solvant inerte tel qu'un alcool (méthanol par
exemple), à une température comprise entre 20C et la température
d'ébullition du milieu réactionnel.
Les dérivés de formule (XVI) peuvent être obtenus par action d'un
25 dérivé de formule:
R 1 -CH=N-CH2-R2 (XVI 1)
WO 94/15954 PCT/FR94/00006
21s218'3 14
dans laquelle R1 et R2 ont ies mêmes significations que précédemment sur
la phényl vinylsulfone.
Cette réaction s'effectue généralement en présence d'un sel
métallique tel que le bromure de lithium ou l'acétate d'argent et d'une
5 trialkylamine telle que la triéthylamine, au sein d'un solvant inerte tel que
l'acétonitrile, à une température voisine de 20C.
Les dérivés de formule (XVII) peuvent être obtenus par action d'un
aldéhyde de formule (Vlll) dans laquelle R1 a les mêmes significations que
précédemment sur une amine de formule:
R2-CH2-NH2 (XVIII)
dans laquelle R2 a les mêmes significations que précédemment.
Cette réaction s'effectue généralement au sein d'un solvant inerte tel
qu'un hydrocarbure (benzène, toluène par exemple), un solvant chloré
(dichlorométhane, chloroforme par exernple), éventuellement en présence
15 d'acide p-toluène sulfonique, à la température d'ébullition du milieu
réactionnel.
Les dérivés de formule (IV) pour lesquels R représente un radical
méthylène, R1 représente un radical phényle éventuellement substitué par
un ou plusieurs radicaux choisis parmi les radicaux alkyle, alcoxy et hydroxy
20 ou naphtyle éventuellement substitué et R2 représente un radical phényle
éventuellement substitué par un ou plusieurs radicaux choisis parmi les
radicaux alkyle, alcoxy et hydroxy et Rs représente un atome d'hydrogène
peuvent également être obtenus par réaction d'éthylène sur un dérivé de
formule (XVII) dans laquelle R1 et R2 ont les mêmes significations que
25 précédemment.
L'éthylène peut être formé in situ par décomposition de
tétrahydrofuranne en présence d'une base telle que le butyllithium, à une
température comprise entre 0 et 25C. On peut également ajouter de
l'éthylène, en présence de diisopropylamidure de lithium, au sein du
30 tétrahydrofuranne, à une température voisine de 20C.
WO 94/15954 21 5 218 3 PCT/FRg4/00006
Les composés de formule (IV) pour lesquels R représente un radical
méthylène ou CHOH, R1 représente un radical pyridyle, naphtyle, quinolyle
ou phényle, R2 représente un radical alcoxycarbonyle,
cycloalkyloxycarbonyle, cyclalkylalkyloxycarbonyle ou phényle
5 éventuellement substitué par un ou plusieurs substituants choisis parmi les
r~dic~u~ alkyle, alcoxy ou hydroxy et Rs représente un atome d'hydrogène
peuvent être obtenus par réduction d'un dérivé de formule:
R
1 ~N 2 (XIX)
dans laquelle R, R1 et R2 ont les mêmes significations que précédemment.
Cette réduction s'effectue de préférence au moyen d'hydrogène, en
présence d'un catalyseur tel que l'oxyde de platine, au sein d'un solvant
inerte tel que l'éthanol, à une température voisine de 20C, ou au moyen de
borohydrure de sodium et de carbonate de potassium au sein d'un mélange
eau-alcool (éthanol de préférence), à une température comprise entre 0 et
15 20 C.
Les dérivés de formule (XIX) peuvent être obtenus par application ou
adaptation des méthodes décrites par A. MKAIRI et J. HAMELIN,
Tetrahedron Letters, 28, 1397 (1987), A. VAN DER WERF et R.M.
KELLOGG, Tetrahedron Letters, 32, 3727 (1991), E. KATO et Coll., Chem.
20 Pharm. Bull., 33,4836 (1985), ~. ACKERMANN et Coll., Helv. Chim. Acta, 73,
122 (1990).
Les dérivés de formule (XIX) peuvent également être obtenus par
déprotection et déshydratation d'un dérivé de formule:
R
=( ~ OU R>~ N~ 2
R1 NH--COOC(CH3)3
COOC(CH3)3
(XX) (XXI)
WO 94/15954 PCT/FR94/00006
2~J s2i83 16
dans lesquelles R, R1 et R2 ont les mêmes significations que
précédemment, ou d'un mélange de ces dérivés.
Ces déprotection et déshydratation s'effectuent généralement au
moyen d'acide trifluoroacétique ou d'iodotriméthylsilane, au sein d'un solvant
5 inerte tel qu'un solvant chloré (dichlorométhane par exemple), à une
température voisine de 20 C.
Les dérivés de formule (XX) et (XXI) peuvent être obtenus par action
d'un dérivé de formule:
R 1 -M (XXI 1)
10 dans laquelle R1 a les mêmes significations que précédemment et R1-M
représente un dérivé organomagnésien, organolithien ou un cuprate, sur un
dérivé carbonylé de formule:
R
~ LR2 (X
COOC(CH3)3
dans laquelle R et R2 ont les mêmes significations que précédemment.
Cette réaction s'effectue au sein d'un solvant inerte tel que le
tétrahydrofuranne, à une température comprise entre -78 et 20C.
Les dérivés de formule (XXIII) peuvent être obtenus par application
ou adaptation des méthodes décrites par J. ACKERMANN et coll., Helv.
Chim. Acta, 73, 122 (1990), T. OHTA et coll., Chem. Lett., 2091 (1987) ou
20 T. OHTA et Coll., Tetrahedron Letters, 29, 329 (1988). De préférence, on fait réagir le dicarbonate de ditert-butyle sur un dérivé de formule:
F~LR2 (XXIV)
dans laquelle R et R2 ont les mêmes significations que précédemment.
2152183
WO 94/15954 PCT/FRg4/00006
17
Cette réaction s'effectue généralement en présence de triéthylamine
et de diméthylamino-4 pyridine, au sein d'un solvant chloré tel que le
dichlorométhane, à une température voisine de 20 C.
Les dérivés de formule (XXIV) peuvent être obtenus par application
5 ou adaptation des méthodes décrites par T. KOLASA et coll., J. Org. Chem.,
55, 1711 (1990), A. L. J O H N S O N et coll., J. Med. Chem., 28, 1596 (1985) etB. RIGO et coll., J. Het. Chem., 25, 49 (1988), R.W. ROSENMUND et
P. ENGELS, Arch. Pharm., 284, 16 (1951), C.F. KOELSCH et
C.H. STRATTON, J. Am. Chem. Soc., 66, 1883 (1944), S. WIDEQUIST, ArK.
10 Kemi, Mineral. Geol., 26, 1 (1948), J. SINNREICH et D. ELAD, Tetrahedron
Letters, 24, 4509 (1968), G.R. BROWN et Coll., J. Chem. Soc, Chem
Commun, 1973 (1984).
Les dérivés de formule (IV) pour lesquels R représente un atome de
soufre, R1 est défini comme dans la formule (I), R2 représente un radical
15 phényle éventuellement substitué par un ou plusieurs substituants choisis
parmi les radicaux alkyle, alcoxy, hydroxy et Rs représente un atome
d'hydrogène peuvent être obtenus par action d'un dérivé de formule (Vlll) sur
un amino-2 phényl-2 éthanethiol dont le noyau phényle est éventuellement
substitué par un ou plusieurs substituants choisis parmi les radicaux alkyle,
20 alcoxy, hydroxy.
Cette réaction s'effectue généralement au sein d'un solvant inerte tel
qu'un alcool, à la température d'ébullition du milieu réactionnel.
Les amino-2 phényl-2 éthanethiols dont le noyau phényle est
éventuellement substitué peuvent être préparés par application ou adaptation
25 de la méthode décrite dans le brevet JP 57 197 447 qui met en oeuvre des
amino-2 phényl-2 éthanols qui sont préparés par application ou adaptation
des méthodes décrites par Z.L. KIS et J. MORLY, EP 258 191, J. PLESS,
CH 590 820, S. MIYAMOTO et Coll. EP 432 661, J. SUZUKI et Coll.
EP 345 775.
Les dérivés de formule (IV) pour lesquels R2 représente un phényle
éventuellement substitué par un ou plusieurs substituants choisis parmi les
radicaux alkyle, alcoxy ou hydroxy, R représente un radical méthylène, R1
2 1 5 218 ~ 1 8 PCT/FR94/00006
représente un atome d'hydrogène et Rs représente un radical phényle
peuvent être préparés par application ou adaptatior~ des méthodes décrites
par W.H. PEARSON et Coll., J. Am. Chem. Soc., 114, 1329 (1992), O.
TSUGE et Coll., Bull. Chem. Soc. Japan, 59, 2537 ~1986).
Ces dérivés peuvent également être préparés par réduction des
pyrroles et des pyrrolines correspondants par application ou adaptation des
méthodes décrites par C.G. OVERBERGER et Coll. J. Am. Chem. Soc., 91,
687 (1969).
Ces pyrroles et ces pyrrolines peuvent être préparés par application
ou adaptation des méthodes décrites par M. OHNO et Coll., Tetrahedron
Letters, 32, 5093 (1991), S.C. CHERKOFSKY, US 4 267 184, S.C.
CHERKOFSKY et G.A. BOSWELL Jr., EP 25884, O. TSUGE et Coll. Bull.
Chem. Soc. Japan, 59, 1809 (1986).
Les dérivés de formule (IV) pour lesquels R représente un radical
éthylène, R2 représente un phényle éventuellement substitué par un ou
plusieurs substituants choisis parmi les radicaux alkyle, alcoxy ou hydroxy,
Rs représente un atome d'hydrogène et R1 a les mêmes significations que
dans la formule (I) peuvent être préparés par application ou adaptation des
méthodes décrites par C.G. OVERBERGER et Coll., J. Am. Chem. Soc., 79,
6430 (1957), J. THESING et H. MEYER, Ann., 609, 46 (1957), D.Y.
JACKSON et P.G. SCHULTZ, J. Am. Chem. Soc., 113, 2319 (1991), C.G.
OVERBERGER et L.P. HERIN, J. Org. Chem., 27, 2423 (1962).
Certaines de ces méthodes mettent en oeuvre des réductions de
pipéridéines qui peuvent aussi être obtenus par application ou adaptation des
méthodes décrites par H. QUAST et B. MUELLER Chem. Ber., 116, 3931
(1983), R. WEIL et N. COLLIGNON, C. Rend. Acad. Sci. Ser. C, 275, 299
(1972) et Bull. Soc. Chim. Fr., 258 (1974).
Les dérivés de formule (IV) pour lesquels R2 représente un phényle
éventuellement substitué par un ou plusieurs substituants choisis parmi les
radicaux alkyle, alcoxy ou hydroxy, R représente un radical CHR6, R1 et Rs
représentent chacun un atome d'hydrogène et R6 représente un radical
phényle peuvent être préparés par application ou adaptation des méthodes
2152183
WO 94/15954 PCT/FR94/00006
19
décrites par M.C. KLOEZEL, J. Am. Chem. Soc., 69, 2271 (1947),
W.H. PEARSON et Coll., J. Am. Chem. Soc., 114, 1329 (1992), O. TSUGE et
Coll., Bull. Soc. Japan, 59, 2537 (1986), M. CARRIOU et Coll., Can. J.
Chem., 61, 2359 (1983), E. BREWER et D. MELUMAD, J. Org. Chem., 37,
5 3949 (1972).
Certaines de ces méthodes mettent en oeuvre des réductions de
pyrroles et de pyrrolines qui peuvent aussi être obtenues par application ou
adaptation des méthodes décrites par C.F.H. ALLEN et C.V. WILSON, Org.
Synth. Coll. Vol. Ill, 358 (1955), W. DAVEY et D.J. TIVEY, J. Chem. Soc.,
10 2276, (1958), W. CHEN et Coll., Chin. Chem. Lett., 2, 439 (1991),
S.M. BLOOM et P.P. GARCIA, US 3 883 555 et US 3 691 161.
Les dérivés de formule (Ill) pour lesquels R2 représente un radical
alcoxycarbonyle, cycloalkyloxycarbonyle ou cycloalkylalkyloxycarbonyle
peuvent également être obtenus par estérification d'un acide de formule:
R I R5
R 1 J` N ~ COOH (XXV)
CO--ICH--NH--COOC(CH3)3
R4
dans laquelle R, R1, R4 Rs et R6 ont les mêmes significations que dans la
formule (I).
Cette réaction s'effectue de préférence dans les mêmes conditions
que celles décrites précédemment pour l'estérification des composés de
20 formule (XIV).
Les acides de formule (XXV) peuvent être obtenus par hydrolyse des
esters méthyliques ou éthyliques correspondants de formule (Ill).
Cette hydrolyse s'effectue généralement au sein d'un solvant inerte
tel que l'eau, le dioxanne ou un mélange de ces solvants, au moyen d'une
25 base telle qu'un hydroxyde de métal alcalin (soude, potasse), à une
température voisine de 20C.
WO 94115954 PCT/FR94100006
'` 2~S2~83 20
Les dérivés de formule (Ill) pour lesquels R représente un radical
méthylène, R1 représente un radical pyridyle éventuellement substitué,
quinolyle éventuellement substitué, naphtyle éventuellement substitué ou
phényle éventuellement substitué par un ou plusieurs substituants choisis
5 parmi les atomes d'halogène et les radicaux alkyle, alcoxy, hydroxy, amino,
monoalkylamino, dialkylamino, alcoxycarbonyle, -CO-NR7Rg ou
-NH-CO-CH3, R2 représente un radical alcoxycarbonyle,
cycloalkyloxycarbonyle ou cycloalkylalkyloxycarbonyle et Rs représente un
atome d'hydrogène peuvent être obtenus par réduction des dérivés de
1 0 formule:
J-- (XXVI)
Zl
dans laquelle Z1 représente un radical -CO-CH(R4)-NH-COOC(CH3)3, R1 et
R2 ont les mêmes significations que précédemment et R4 a les mêmes
significations que dans la formule (I).
Cette réaction s'effectue dans les mêmes conditions que celles
décrites précédemment pour la réduction des dérivés de formule (XVI).
Les dérivés de formule (XXVI) peuvent être obtenus par action d'un
acide de formule (V) sur un dérivé de formule (XVI).
Cette réaction s'effectue au sein d'un solvant inerte tel que
20 I'acétonitrile, le tétrahydrofuranne ou un solvant chloré, en présence d'un
agent de condensation utilisé en chimie peptidique tel qu'un carbodiimide
(N,N'-dicyclohexylcarbodiimide par exemple) ou un chloroformiate d'alkyle, à
une température comprise entre 10 et 40C.
Les dérivés de formule (Xl) pour lesquel R représente un radical
25 méthylène et Z représente un radical tert-butyle peuvent être obtenus par
réduction des dérivés de formule:
- 21~2183
WO 94/15954 ^ PCT/FR94/00006
21
~SO~ XXVII)
R I R2
COOZ
dans laquelle R1 et R2 ont les mêmes significations que dans la formule (I) et
Z représente un radical tert-butyle.
Cette réduction s'effectue dans les mêmes conditions que celle
5 décrites précédemment pour la réduction des dérivés de formule (XVI).
Les dérivés de formule (XXVII) peuvent être obtenus par action d'un
dérivé de formule (XVI) avec le dicarbonate de ditert-butyle.
Cette réaction s'effectue au sein d'un solvant inerte tel qu'un solvant
chloré (dichlorométhane par exemple), en présence d'une base organique
10 telle qu'une trialkylamine (triéthylamine par exemple) ou d'un carbonate ou
bicarbonate de métal alcalin, à une température voisine de 20C.
Les anilines éventuellement substituées sont commercialisées ou
peuvent être obtenues par application ou adaptation des méthodes décrites
par R. SCHROTER, Methoden der organischen Chemie, Houben Weil, Band
15 Xl/1, p 360; G.J. ESSELEN et coll., J. Am. Chem. Soc., 36, 322 (1914); G.
ADRIANT et coll., Bull. Soc. Chim. FR, 1511 (1970); W.A. JACOBS et coll., J.
Am. Chem. Soc., 39, 2438 (1917) et J. Am. Chem. Soc., 39, 1438 (1917) et
dans les exemples.
Les composés de formule (I) pour lesquels R3 représente un radical
20 phénylamino dont le noyau phényle est substitué par un radical carboxy,
-alk-COOH, -O-alk-COOH, -alk'-COOH, -CH=CH-COOH, -CO-COOH,
-S-alk-COOH, -SO-alk-COOH, -SO2-alk-COOH, -C(=NOH)-COOH,
-O-CH2-alk'-COOH ou -CX=N-O-alk-COOH et R1, R2, Rs et R6 sont définis
comme dans la formule (I) peuvent également être préparés par hydrolyse
25 ou, selon le cas, hydrogénolyse des esters correspondants de formule (I).
Lorsque l'on utilise les esters d'alkyle ou de phénylalkyle, il est
avantageux d'effectuer l'hydrolyse au moyen d'une base telle que la soude,
WO 94/15954 PCT/FR94/00006
22
2~ S?.~3
la potasse ou l'hydroxyde de lithium, au sein d'un solvant inerte tel que le
tétrahydrofuranne, le dioxanne, I'eau ou un mélange de ces solvants, à une
température comprise entre 20C et 40C. Lorsque l'on utilise un ester de
triméthylsilyléthyle, il est avantageux d'opérer au sein d'un solvant inerte tel5 que le tétrahydrofuranne, au moyen~ d'un fluorure tel que le fluorure de
tétrabutylammonium, à une température comprise entre 10 et 40C. Lorsque
l'on utilise des esters de phénylalkyle, il est peut être aussi avantageux
d'effectuer une hydrogénolyse au moyen d'hydrogène ou de formiate
d'ammonium en présence d'un catalyseur tel que le palladium sur charbon
10 dans un solvant tel que le méthanol ou l'acétate d'éthyle.
Les esters de triméthylsilyléthyle peuvent être obtenus par
application ou adaptation de la méthode décrite par H. GERLACH, Helv.
Chim. Acta, 60, 3039 (1977).
Les composés de formule (I) pour lesquels R3 représente un radical
15 phénylamino dont le noyau phényle est éventuellement substitué par un
radical hydroxyiminoalkyle ou alcoxyiminoalkyle peuvent également être
préparés par action du dérivé acylé correspondant de formule (I) sur un
dérivé de formule:
H2N-OR 17 (XXVI l l)
20 dans laquelle R17 représente un atome d'hydrogène ou un radical alkyle.
Cette réaction s'effectue généralement au sein d'un solvant inerte tel
qu'un alcool (méthanol, éthanol par exemple), I'eau ou un mélange de ces
solvants, à la température d'ébullition du solvant et éventuellement en
présence d'une base telle que la pyridine.
Les composés de formule (I) pour lesquels R représente un radical
SO ou SO2, R1, R2 et Rs sont définis comme dans la formule générale (I)
peuvent être préparés par oxydation des composés de formule (I)
correspondants pour lesquels R représente un atome de soufre, étant
entendu que les autres radicaux et les autres substituants sont choisis de
telle manière qu'ils soient insensibles aux conditions de la réaction.
2152183
WO 94/15954 PCT/FR94/00006
23
Cette oxydation s'effectue généralement au moyen d'oxoneR
(peroxymonosulfate de potassium) commercialisé par Aldrich, au sein d'un
alcool tel que le méthanol ou un mélange méthanol-eau, à une température
voisine de 25C.
ll est entendu pour l'homme de métier que, pour la mise en oeuvre
des procédés selon l'invention décrits précédemment, il peut être nécessaire
afin d'éviter des réactions secondaires d'introduire des groupes protecteurs
des fonctions amine, alcool, acide et cétone tels que ceux décrits par T. W.
GREENE, Protective groups in organic synthesis, John Wiley and Sons, New
York. Par exemple, les fonctions amine peuvent être bloquées sous forme de
carbamates de tert-butyle ou de méthyle puis régénérées au moyen
d'iodotriméthylsilane ou sous forme de carbamates de benzyle puis
régénérées par hydrogénation après avoir mis en oeuvre le procédé selon
l'invention. Les fonctions alcool peuvent par exemple être bloquées sous
forme de benzoate puis régénérées par hydrolyse en milieu alcalin après
avoir mis en oeuvre le procédé selon l'invention.
Les énantiomères des composés de formule (I) contenant au moins
un site asymétrique peuvent être obtenus par dédoublement des racémiques
par exemple par chromatographie sur colonne chirale ou par synthèse à
partir des précurseurs chiraux.
Comme phase chirale, on utilise de préférence une phase dont le
sélecteur chiral, qui est, de préférence, la dinitro-3,5
benzoyl-D-phénylglycine, est éloigné de la silice par un bras aminoalcanoyle
contenant 3 à 14 atomes de carbone fixé sur les fonctions amines d'une
silice aminopropyle et dont les fonctions silanols libres sont bloquées par des
radicaux trialcoysilyles.
Cette phase chirale peut être définie par la structure suivante:
wo 94/1~954 PCT/FR94/00006
21S2183 24
O-Si(R')3
O\ ,~
~SIi--(CH2)3-NH-CO-(CH2)n-NH-CO-fH-NH-Gl ~XXIX)
O-Si(R")3 ` C6H5
dans laquelle les symboles R', identiques ou différents, et R", identiques ou
différents, représentent des radicaux alcoyles contenant 1 à 10 atomes de
carbone, G1 représente un groupement électro-attracteur et n représente un
5 nombre entier compris entre 3 et 13 inclusivement.
De préférence, I'un des symboles R' représente un radical alcoyle
contenant 7 à 10 atomes de carbone et les deux autres représentent un
radical alcoyle contenant 1 à 2 atomes de carbone et de préférence un
radical méthyle, les symboles R" sont identiques et représentent un radical
10 méthyle ou éthyle, G1 représente un radical benzoyle éventuellement
substitué, de préférence, par un ou plusieurs radicaux nitro tels que le radicaldinitro-3,5 benzoyle et n est égal à 10.
La phase chirale peut être préparée par action sur une silice
aminopropyle de l'anhydride d'un acide aminoalcanoïque contenant 3 à 14
15 atomes de carbone dont la fonction amine est protégée par un groupement
protecteur tel que le radical tert-butoxycarbonyle, suivie du blocage d'une
partie des fonctions silanols par des radicaux Si(R')3 tels que définis
précédemment, puis, après élimination du groupement protecteur de la
fonction amine, de l'amidification au moyen de D-phénylglycine dont la
20 fonction amine est protégée par un groupement électroattracteur G1 tel que
défini précédemment, et enfin du blocage des fonctions silanols résiduelles
par des radicaux Si(R")3 tels que définis précédemment.
Généralement, I'action de l'anhydride d'un acide aminoalcanoïque
protégé sur la silice aminopropyle est effectuée en opérant dans un solvant
25 organique anhydre tel que le diméthylformamide à une température voisine
de 20 C.
2152I83
W O 94/15954 PCT~R94/00006
Le blocage des fonctions silanols par des groupements -Si(R3) tel
que définis précédemment est effectuée par action d'un
halogénotrialkylsilane sur la silice aminopropyle greffée par des restes
aminoalcanoyles en opérant dans un solvant organique tel que le chlorure de
5 méthylène en présence d'un agent basique tel que la pyridine.
L'élimination des groupements protecteurs des restes
aminoalcanoyles s'effectue généralement, lorsque le groupement protecteur
est un radical tert.butoxycarbonyle, par action de l'acide trifluoroacétique
dans un solvant organique tel que le chlorure de méthylène.
L'amidification au moyen de la D-phénylglycine dont la fonction
amine est protégée est effectuée en présence d'un agent de condensation tel
que la N-éthoxycarbonyl éthoxy-2 dihydro-1,2 quinoléine en opérant dans un
solvant organique anhydre tel que le diméthylformamide.
Le blocage des fonctions silanols résiduelles par des radicaux -
15 Si(Rn)3 tels que définis précédemment est généralement effectuée au moyende trialkylsilylimidazole en opérant dans un solvant organique tel que le
chlorure de méthylène.
Les composés de formule (I) peuvent être purifiés par les méthodes
connues habituelles, par exemple par cristallisation, chromatographie ou
20 extractions.
Les composés de formule (I) comportant un reste basique peuvent
être éventuellement transformés en sels d'addition avec un acide minéral ou
organique par action d'un tel acide au sein d'un solvant organique tel qu'un
alcool, une cétone, un éther ou un solvant chloré.
Les composés de formule (I) comportant un reste acide peuvent
éventuellement être transformés en sels métalliques ou en sels d'addition
avec les bases azotées selon des méthodes connues en soi. Ces sels
peuvent être obtenus par action d'une base métallique (alcaline ou
alcalinoterreuse par exemple), de l'ammoniac, d'une amine ou d'un sel d'une
amine sur un composé de formule (I), dans un solvant. Le sel formé est
séparé par les méthodes habituelles.
WO ~ 2~3 PCT/FR94/00006
26
Ces sels font également partie de !'invention.
Comme exemples de sels pharmaceutiquement acceptables,
peuvent être cités les sels d'addition avec les acides minéraux ou organiques
(tels que acétate, propionate, succinate, benzoate, fumarate, maléate,
5 oxalate, méthanesulfonate, iséthionate, théophyllinacétate, salicylate,
méthylène-bis-~oxynaphtoate, chlorhydrate, sulfate, nitrate et phosphate),
les sels avec les métaux alcalins (sodium, potassium, lithium) ou avec les
métaux alcalinoterreux (calcium, magnésium), le sel d'ammonium, les sels de
bases azotées (éthanolamine, triméthylamine, méthylamine, benzylamine,
10 N-benzyl-~-phénéthylamine, choline, arginine, leucine, Iysine, N-méthyl
glucamine).
Les composés de formule (I) présentent des propriétés
pharmacologiques intéressantes. Ces composés possèdent une forte affinité
pour les récepteurs de la cholécystokinine (CCK) et de la gastrine et sont
15 donc utiles dans le traitement et la prévention des désordres liés à la CCK et
à la gastrine au niveau du système nerveux et de l'appareil gastrointestinal.
C'est ainsi que ces composés peuvent être utilisés pour le traitement
ou la prévention des psychoses, des troubles anxieux, de la dépression, de
la neurodégénération, des attaques de panique, de la maladie de Parkinson,
20 de la diskynésie tardive, du syndrôme du colon irritable, de la pancréatite
aiguë, des ulcères, des désordres de la motilité intestinale, de certaines
tumeurs sensibles à la CCK, comme régulateur de l'appétit, dans le sevrage
aux traitements chroniques et abus d'alcool ou de médicaments et comme
constricteur de la pupille de l'oeil.
Ces composés ont également un effet de potentialisation sur l'activité
analgésique des médicaments narcotiques et non narcotiques. En outre, ils
peuvent avoir un effet analgésique propre.
Par ailleurs, les composés ayant une forte affinité pour les récepteurs
CCK modifient les capacités de mémorisation. En conséquence, ces
composés peuvent être efficaces dans les troubles de la mémoire.
2152183
-
WO 94/15954 PCTIFR94/00006
27
L'affinité des composés de formule (I) pour les récepteurs CCK a été
déterminée selon une technique inspirée de celle de A. SAITO et coll . (J.
Neuro. Chem., 37, 483-490 (1981)) au niveau du cortex cérébral et au niveau
du pancréas.
Dans ces tests, la Clso des composés de formule (I) est
généralement inférieure ou égale à 1000 nM.
Par ailleurs, il est connu que les produits qui reconnaissent les
récepteurs centraux de la CCK ont une spécificité similaire pour les
récepteurs de la gastrine dans le tractus gastrointestinal (BOCK et coll., J.
Med. Chem., 32, 16-23 (1989); REYFELD et coll., Am. J. Physiol., 240,
G255-266 (1981); BEINFELD et coll., Neuropetides, 3, 411 -427 (1983).
Les composés de formule (I) présentent une toxicité faible. Leur
DLso est généralement supérieure à 40 mg/kg par voie sous cutanée chez la
souris.
L' exemple suivant illustre l'invention sans la limiter.
EXEMPLE 1
Une solution de 1,6 9 d'{[(imidazolyl-1 carboxamido)-2 acétyl]-3 (fluoro-2
phényl)-2 thiazolidinecarboxylate-4 de tert-butyle-(2R,4R) et de 1,4 9
d'amino-3 phénylméthanesulfinate de sodium dans 55 cm3 d'un mélange
20 toluène-diméthylformamide (90/10 en volumes) est chauffée à reflux pendant
4 heures. Après retour à une température voisine de 25C, le mélange
réactionnel est dilué par 20 cm3 d'une solution aqueuse d'acide
chlorhydrique 0,5 N et extrait par 2 fois 50 cm3 d'acétate d'éthyle. Les
phases organiques réunies sont lavées par 50 cm3 d'eau puis extraites par
25 2 fois 10 cm3 d'une solution aqueuse d'hydroxyde de sodium 1 N. Les phases
aqueuses basiques sont réunies, amenées à un pH voisin de 1 par addition
d'une solution aqueuse d'acide sulfurique 1 N et extraites par 2 fois 25 cm3
d'acétate d'éthyle. Les phases organiques réunies sont lavées par 25 cm3
d'eau, séchées sur sulfate de magnésium et concentrées à sec sous 30 pression réduite à 40C. On obtient ainsi 0,03 9 d'acide
{{[tert-butoxycarbonyl-4 (fluoro-2 phényl)-2 thiazolidinyl-3]-2 oxo-2 éthyl}-3
WO 94/15954 PCT/FR94/00006
28
~o~ 3
urei }-3 phénylméthanesulfinique-(2R,4R) sous forme d'un produit
amorphe.
RMN (~ ppm, DMSO D6 + 2 gouttes de CD3COOD, 393 K): 1,50 (s, 9H,
CO2tBu); 3,20 à 3,60 (mt, 2H, -S-CH2-), 3,85 (s, 2H, Ar-CH2-SO2-), 3,70 à
5 4,20 (mt, 2H, N-CH2-CO-), 5,00 (mt, lH, N-CH-CO-), 6,53 (s, 1H, N-CH-S-),
6,80 à 8,00 (mt, 8H, Aromatiques).
A.- L'{[(imidazolyl-1 carboxamido)-2 acétyl]-3 (fluoro-2 phényl)-2
thiazolidinecarboxylate-4 de tert-butyle-(2R,4R) peut être préparé de la
manière suivante: à une solution de 7,0 9 d'(amino-2 acétyl)-3 (fluoro-2
10 phényl)-2 thiazolidinecarboxylate-4 de tert-butyle-(2R,4R) dans 100 cm3 de
tétrahydrofuranne anhydre, on ajoute lentement, à une température voisine
de 25C, une solution de 4,8 9 de N,N'-diimidazole-carbonyle dans 50 cm3
de tétrahydrofuranne anhydre. Le mélange réactionnel est agité pendant
12 heures à une température voisine de 25C puis concentré à sec sous
15 pression réduite à 35C. Le résidu obtenu est dissous dans 200 cm3
d'acétate d'éthyle et lavé par 2 fois 50 cm3 d'eau. La phase organique est
séchée sur sulfate de magnésium et évaporée à sec sous pression réduite à
40C. On obtient ainsi 8,7 9 d'{[(imidazolyl-1 carboxamido)-2 acétyl]-3
(fluoro-2 phényl)-2 thiazolidinecarboxylate-4 de tert-butyle-(2R,4R) sous
20 forme d'une huile jaune utilisée telle quelle dans les synthèses ultérieures.
B.- L' (amino-2 acétyl)-3 (fluoro-2 phényl)-2 thiazolidinecarboxylate-4 de
tert-butyle-(2R,4R) peut être préparé de la manière suivante: à une solution
de 15,0 9 de (tert-butoxycarbonylamino-2 acétyl)-3 (fluoro-2 phényl)-2
thiazolidinecarboxylate-4 de tert-butyle-(2R,4R) dans 150 cm3 de
25 chloroforme, on ajoute goutte à goutte 5,4 cm3 d'iodotriméthylsilane à une
température voisine de 25C. Le milieu réactionnel est agité pendant
3 heures à une température voisine de 25C, puis on ajoute 50 cm3 d'eau.
La phase aqueuse est séparée par décantation et extraite par 2 fois 50 cm3
de chloroforme. Les phases organiques réunies sont lavées successivement
30 par 50 cm3 d'eau, 50 cm3 d'une solution aqueuse saturée
d'hydrogénocarbonate de sodium et 50 cm3 d'une solution aqueuse saturée
de chlorure de sodium, puis séchées sur sulfate de magnésium et
concentrées à sec sous pression réduite à 40C. On obtient ainsi 10,0 9
WO 94/15954 215 2183 PCT/FR94/00006
29
d'(amino-2 acétyl)-3 (fluoro-2 phényl)-2 thiazolidinecarboxylate-4 de
tert-butyle-(2R,4R) sous forme d'une huile jaune utilisée telle quelle dans les
synthèses ultérieures.
C.- Le (tert-butoxycarbonylamino-2 acétyl)-3 (fluoro-2 phényl)-2
5 thiazolidinecarboxylate-4 de tert-butyle-(2R,4R) peut être préparé de la
manière suivante: à une solution de 25,0 9 de (fluoro-2 phényl)-2
thiazolidinecarboxylate-4 de tert-butyle-(2RS, 4R) et de 15,5 9 d'acide
tert-butoxycarbonylamino-2 acétique dans 150 cm3 d'acétonitrile anhydre
maintenue à une température voisine de 0C, on ajoute en 30 minutes une
10 solution de 18,2 9 de N,N'-dicyclohexylcarbodiimide dans 75 cm3
d'acétonitrile anhydre. Le milieu réactionnel est agité pendant 16 heures à
une température voisine de 25C. Le produit insoluble est séparé par
filtration, lavé par 3 fois 20 cm3 d'acétonitrile et le filtrat est concentré à sec
sous pression réduite à 40C. Le produit brut obtenu est purifié par
15 chromatographie sur silice [éluant: acétate d'éthyle-cyclohexane (30-70 en
volumes)]. Les fractions contenant le produit attendu sont réunies et
concentrées à sec sous pression réduite à 40C. On obtient ainsi 25,0 9 de
(tert-butoxycarbonylamino-2 acétyl)-3 (fluoro-2 phényl)-2
thiazolidinecarboxylate-4 de tert-butyle-(2R,4R) sous forme d'une huile
20 utilisée telle quelle dans les synthèses ultérieures.
D.- Le (fluoro-2 phényl)-2 thiazolidinecarboxylate-4 de tert-butyle-(2RS, 4R)
peut être préparé de la manière suivante: à une suspension refroidie à une
température voisine de 5C de 5,7 9 d'acide (fluoro-2 phényl)-2
thiazolidinecarboxylique-4-(2RS,4R) dans 60 cm3 de chloroforme, on ajoute
25 goutte à goutte 1,5 cm3 d 'acide sulfurique concentré. Le milieu réactionnel
est saturé par de l'isobutène pendant 3 heures en maintenant la température
du milieu réactionnel au voisinage de 5C. Après retour à une température
voisine de 25C, I'agitation est poursuivie pendant 12 heures. Le milieu
réctionnel est traité par 50 cm3 d'une solution aqueuse saturée
30 d'hydrogénocarbonate de sodium. La phase organique est décantée et la
phase aqueuse est extraite par 2 fois 40 cm3 de chloroforme. Les phases
organiques réunies sont lavées par 50 cm3 d'eau et par 50 cm3 d'une
solution aqueuse saturée de chlorure de sodium, séchées sur sulfate de
magnésium et concentrées à sec sous pression réduite à 40C. On obtient
WO 94/15954 PCT/FR94/00006
2~,S2-~83 30
ainsi 5,8 9 de (fluoro-2 phényl)-2 thiazolidinecarboxylate-4 de tert-butyle-
(2RS, 4R) sous forme d'une huile jaune utilisée telle quelle dans les
synthèses ultérieures.
E.- L'acide ffluoro-2 phényl)-2 thiazolidinecarboxylique-4-(2RS,4R) peut être
5 préparé de la manière suivante: à une suspension de 21,2 9 de L-cystéine
dans 150 cm3 d'éthanol, on ajoute, à une température voisine de 50C,
22,7 9 de fluoro-2 benzaldéhyde. Le milieu réactionnel est chauffé à reflux
pendant 3 heures. Après refroidissement à une température voisine de 25C,
le produit insoluble est séparé par filtration et lavé par 2 fois 50 cm3
10 d'éthanol et 2 fois 50 cm3 d'oxyde de diéthyle. On obtient ainsi 28,2 9 d'acide
(fluoro-2 phényl)-2 thiazolidinecarboxylique-4-(2RS,4R) fondant à 147C.
F.- L'amino-3 phénylméthanesulfinate de sodium peut être préparé de la
manière suivante: dans un monocol purgé à l'azote on introduit
successivement une solution de 7 9 de nitro-3 phénylméthanesulfinate de
15 sodium dans 1000 cm3 d'éthanol et 10,0 9 de nickel de Raney. La
suspension est agitée pendant 1 heure sous atmosphère d'hydrogène
(100 kPa) à une température voisine de 25C puis on ajoute du charbon et
on sépare le catalyseur par filtration. Le filtrat est concentré à sec sous
pression réduite à 40C. On obtient ainsi 6,0 9 d'amino-3
20 phénylméthanesulfinate de sodium sous forme d'une meringue blanche
hygroscopique, utilisée telle quelle dans les synthèses ultérieures.
G.- Le nitro-3 phénylméthanesulfinate de sodium peut être préparé de la
manière suivante : à une suspension de 16,6 9 de [(nitro-3 phényl)-
méthylsulfonyl3-2 benzothiazole dans 400 cm3 d'un mélange éthanol-
25 tétrahydrofuranne (10/90 en volumes) on ajoute 3,8 9 de borohydrure desodium. Le milieu réactionnel est agité pendant 16 heures à une température
voisine de 25C. L'insoluble est séparé par filtration et lavé par 2 fois 50 cm3d'éthanol. On obtient ainsi 9,2 9 de nitro-3 phénylméthanesulfinate de sodium
sous forme d'une poudre jaune utilisée telle quelle dans les synthèses
30 ultérieures.
H.- Le [(nitro-3 phényl)-méthylsulfonyl]-2 benzothiazole peut être préparé de
la manière suivante: à une solution de 20,0 9 de [(nitro-3 phényl)-
méthylthio]-2 benzothiazole dans 1000 cm3 d'acide acétique, on additionne
2152183
WO 94/15954 - PCT/FR94/00006
31
en 45 minutes une solution de 12,6 9 de permanganate de potassium dans
750 cm3 d'eau. Le milieu réactionnel est agité pendant 18 heures à une
température voisine de 25C, puis on ajoute goutte à goutte une solution
aqueuse de 6,5 9 de sulfite de sodium dans 50 cm3 d'eau. Le solide, ainsi
5 précipité, est séparé par fiitration et lavé par 20 cm3 d'éthanol et 30 cm3
d'oxyde de diéthyle. On obtient ainsi, 19,2 9 de [(nitro-3 phényl)-
méthylsulfonyl]-2 benzothiazole sous forme d'une poudre blanche fondant à
1 68C.
I.- Le [(nitro-3 phényl)-méthylthio]-2 benzothiazole peut être préparé de la
10 manière suivante: à une suspension de 25,9 9 de mercapto-2 benzothiazole
dans 500 cm3 de méthanol, on ajoute 150 cm3 d'une solution aqueuse
d'hydroxyde de sodium 1 N puis 25,0 9 de chlorure de nitro-3 phénylméthyle.
Le mélange réactionnel est agité pendant 18 heures à une température
voisine de 25C puis concentré à sec sous pression réduite à 40C. Le résidu
15 obtenu est repris dans 500 cm3 d'eau et extrait par 4 fois 250 cm3 de
dichlorométhane. Les phases organiques réunies sont séchées sur sulfate
de magnésium et concentrées à sec sous pression réduite. On obtient ainsi
39,3 9 de [(nitro-3 phényl)-méthylthio]-2 benzothiazole sous forme d'une
poudre jaune fondant à 1 60C.
Les médicaments selon l'invention sont constitués par un composé
de formule (I) sous forme libre ou sous forme d'un sel, à l'état pur ou sous
forme d'une composition dans laquelle il est associé à tout autre produit
pharmaceutiquement compatible, pouvant être inerte ou physiologiquement
actif. Les médicaments selon l'invention peuvent être employés par voie
orale, parentérale, rectale ou topique.
Comme compositions solides pour administration orale, peuvent être
utilisés des comprimés, des pilules, des poudres (capsules de gélatine,
cachets) ou des granulés. Dans ces compositions, le principe actif selon
l'invention est mélangé à un ou plusieurs diluants inertes, tels que amidon,
cellulose, saccharose, lactose ou silice, sous courant d'argon. Ces
compositions peuvent également comprendre des substances autres que les
diluants, par exemple un ou plusieurs lubrifiants tels que le stéarate de
magnésium ou le talc, un colorant, un enrobage (dragées) ou un vernis.
WO 94/15954 PCT/FR94/00006
32
2~s~3
- Comme compositions liquides pour admini~lr~lion orale, on peut
utiliser des solutions, des suspensions, des émulsions, des sirops et des
élixirs pharmaceutiquement acceptables contenant des diluants inertes tels
que l'eau, I'éthanol, le glycérol, les huiles végétales ou l'huile de paraffine.5 Ces compositions peuvent comprendre des substances autres que les
diluants, par exemple des produits mouillants, édulcorants, ép~ississ~nts,
aromatisants ou stabilisants.
Les compositions stériles pour administration parentérale, peuvent
être de préférence des solutions aqueuses ou non aqueuses, des
10 suspensions ou des émulsions. Comme solvant ou véhicule, on peut
employer l'eau, le propylèneglycol, un polyéthylèneglycol, des huiles
végétales, en particulier l'huile d'olive, des esters organiques injectables, par
exemple i'oléate d'éthyle ou d'autres solvants organiques convenables. Ces
compositions peuvent également contenir des adjuvants, en particulier des
15 agents mouillants, isotonisants, émulsifiants, dispersants et stabilisants. La
stérilisation peut se faire de plusieurs facons, par exemple par filtration
aseptisante, en incorporant à la composition des agents stérilisants, par irra-
diation ou par chauffage. Elles peuvent également être préparées sous forme
de compositions solides stériles qui peuvent être dissoutes au moment de
20 I'emploi dans de l'eau stérile ou tout autre milieu stérile injectable.
Les compositions pour administration rectale sont les suppositoires
ou les capsules rectales qui contiennent, outre le produit actif, des excipientstels que le beurre de cacao, des glycérides semi-synthétiques ou des
polyéthylèneglycols.
Les compositions pour administration topique peuvent être par
exemple des crèmes, lotions, collyres, collutoires, gouttes nasales ou
aérosols.
En thérapeutique humaine, les composés selon l'invention sont
particulièrement utiles dans le traitement et la prévention des désordres liés àla CCK et à la gastrine au niveau du système nerveux et de l'appareil
gastrointestinal. Ces composés peuvent donc être utilisés dans le traitement
et la prévention des psychoses, des troubles anxieux, de la dépression, de la
neurodégénération, des attaques de panique, de la maladie de Parkinson, de
2152183
WO 94/15954 PCT/FR94/00006
33
la diskynésie tardive, du syndrôme du colon irritable, de la pancréatite aiguë,
des ulcères, des désordres de la motilité intestinale, de certaines tumeurs
sensibles à la CCK, des troubles de la mémoire, dans le sevrage aux
traitements chroniques et abus d'alcool ou de médicaments, comme
5 constricteurs de la pupille de l'oeil, comme analgésiques, comme
potentialisateurs de l'activité analgésique des médicaments analgésiques
narcotiques et non narcotiques et comme régulateurs de l'appétit.
Les doses dépendent de l'effet recherché, de la durée du traitement
et de la voie d'administration utilisée; elles sont généralement comprises
10 entre 0,05 9 et 1 9 par jour par voie orale pour un adulte avec des doses
unitaires allant de 10 mg à 500 mg de substance active.
D'une façon générale, le médecin déterminera la posologie
appropriée en fonction de l'âge, du poids et de tous les autres facteurs
propres au sujet à traiter.
Les exemples suivants illustrent des compositions selon l'invention:
FXEMPI F A
On prépare, selon la technique habituelle, des gélules dosées à
50 mg de produit actif ayant la composition suivante:
- acide {{[tert-butoxycarbonyl-4 (fluoro-2 phényl)-2
thiæolidinyl-3]-2 oxo-2 éthyl}-3 uréido}-3
phénylméthanesulfinique-(2R,4R)............. 50 mg
- Cellulose.................................18 mg
- Lactose...................................55 mg
- Silice colloldale.........................1 mg
- Carboxyméthylamidon sodique...............10 mg
-Talc.......................................10mg
- Stéarate de magnésium..................... 1 mg
FXFMPI F B
On prépare selon la technique habituelle des comprimés dosés à
30 50 mg de produit actif ayant la composition suivante:
WO 94/15954 PCT/FR94/00006
3 34
~5~8
- - acide {{[tert-butoxycarbonyl-4 (fiuoro-2 phényl)-2
thiazolidinyl-3]-2 oxo-2 éthyl}-3 uréido}-3
phénylméthanesulfinique-(2R,4R)......................... .50 mg
- Lactose............................................... 104 mg
- Cellulose............................................. 40 mg
- Polyvidone............................................ .10 mg
- Carboxyméthylamidon sodique........................... 22 mg
-Talc................................................... .10mg
- Stéarate de magnésium................................. .2 mg
- Silice colloldale..................................... .2 mg
- Mélange d'hydroxyméthylcellulose, glycérine, oxyde de
titane (72-3,5-24,5) q.s.p. 1 comprimé pelliculé terminé à 245 mg
EXEMPI F C
On prépare une solution injectable contenant 10 mg de produit actif
ayant la composition suivante:
- acide {{[tert-butoxycarbonyl-4 (fluoro-2 phényl)-2
thiazolidinyl-3]-2 oxo-2 éthyl}-3 uréido}-3
phénylméthanesulfinique-(2R,4R)......................... 10 mg
- Acide benzoïque....................................... 80 mg
- Alcool benzylique..................................... 0,06 cm3
- Benzoate de sodium.................................... 80 mg
- Ethanol à 95 %........................................ 0,4 cm3
- Hydroxyde de sodium.................................... 24 mg
- Propylène glycol....................................... 1,6 cm3
- Eau................................. q.s.p. 4 cm3