Note: Descriptions are shown in the official language in which they were submitted.
~ WO 9~/13271 2 1 7 5 3 8 4 PCTml94/01283
NOUVEAUX TAXOID~S. LEUR pl?FPARATlON ET L F.~ COMPOSITIONS
PHARMACEUTIOUES OUI T FS CONTIENNENT
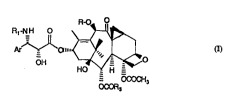
La présente invention concerne de nouveaux taxoldes de formule générale:
R1-N H o ~ ~
- OCOCH
OCOR3
5 leur ~llivll et les ~ . qui les .
Dans la formule générale (1),
Ar représente un radical aryle, alcoyle contenant 1 à 4 atomes de carbone, alcényle
contenant 2 à 4 atomes de carbone, cycloalcoyle contenant 3 à 6 atomes de carbone
ou ~:y~lo~L,é..yl~ contenant 3 à 6 atomes de carbone,
10 R représente un atome d'l.~ u~ ou un radical alcanoyle, ah;v~..~.yle ou alcoyle,
R1 représente un radical benzoyle, thénoyle ou furoyle ou un radical R2-O-CO- dans
lequel R2 représente:
- un radical alcoyle droit ou ramifié contenant 1 à 8 atomes de carbone,
alcényle contenant 2 à 8 atomes de carbone, alcynyle contenant 3 à 8 atomes de
15 carbone, cycloalcoyle contenant 3 à 6 atomes de carbone, cycloalcényle contenant 4 à
6 atomes de carbone ou bi~,lv~l~,vyl~ contenant 7 à 11 atomes de carbone, ces
radicaux étant évpnt~pllpmp~ substitués par ùn ou plusieurs ! ' "' ' choisis
parmi les atomes d'halogène et les radicaux hydroxy, alcoyloxy contenant 1 à 4
atomes de carbone, didl~;uyl~ 0 dont chaque partie alcoyle contient 1 à 4 atomes de
20 carbone, pipéridino, ~ ,l.olino, pipérazinyl-l (éVPntllPll substitué en -4 par un
radical alcoyle conterlant 1 à 4 atomes de carbone ou par un radical 1~ ' .yl~
dont la partie alcoyle contient 1 à 4 atomes de carbone), ~,y~.loaL,uyle contenant 3 à 6
atomes de carbone, ~ y~.lU~L~ yl~ contenant 4 à 6 atomes de carbone, phényle, cyano,
carboxy ou al~,uyl~J~yw~ . dont la partie alcoyle contient 1 à 4 atomes de
2~ carbone,
- ou un radical phényle évPntllpllpmpnt substitué par un ou plusieurs atomes
ou radicaux choisis parmi les atomes d'halogène et les radicaux alcoyles contenant 1 à
4 atomes de carbone, alcoyloxy contenant 1 à 4 atomes de carbone,
WO gS113271 PCTII~Rg4/01283 0
21 75384
-
- ou un radical hétérocyclyle sah~ré ou non sah~ré contenant 4 à 6 chaînons et
év,nh~Pll~m~^nt substitué par un ou plusieurs radicaux alcoyles contenant 1 à 4 atomes
de carbone, et
R3 représente
5 - un radical alcoyle droit ou ramifié contenant 1 à 8 atomes de carbone, slcényle
contenant 2 à 8 atomes de carbone, alcynyle contenant 2 à 8 atomes de carbone,
cycloalcoyle contenant 3 à 6 atomes de carbone, ~ ' ~' ' yl~. contenant 4 à 6
atomes de carbone ou l,i~,ludlcvyle contenant 7 à 11 atomes de carbone, ces
radicaux étant C~ " substihués par un ou plusieurs .^~.~h~l:l..-..l~ choisis
10 parmi les atomes d'halogène et les radicaux hydroxy, alcoyloxy contenant 1 à 4
atomes de carbone, dialcoylamino dont chaque partie alcoyle contient 1 à 4 atomes de
carbone, pipéridino, IIIU~ ' pipérazinyl-l (L' ~. 'l^-n^nt substihué en -4 par un
radical alcoyle contenant 1 à 4 atomes de carbone ou par un radical IJll6.l~1dl~,uyld
dont la partie alcoyle contient 1 à 4 atomes de carbone), L,y, I~ ~ yle contenant 3 à 6
15 atomes de carbone, ~I~AIc~..yle contenant 4 à 6 atomes de carbone, phényle
év nt.l,ll,^m,^t substitué, cyano, carboxy ou alcoylu,.y~,a~l.ollyle dont la pattie
alcoyle contient 1 à 4 atomes de carbone,
- ou un radical aryle éVrnf~ lPm~nt substitué, étant entendu que R3 ne peut pas
l un radical phényle non substitué,
20 - ou un radical l~L~Iu~yl,lyl~ saturé ou non saturé contenant 4 à 6 chainons et
év~nt.~PIlr-mPnt substihué par un ou plusieurs radicaux alcoyles contenant 1 à 4 atomes
de carbone,
étant entendu que les radicaux ~:yL;luàlcuylds, L,y~lodl.,~lyl~ ou bicycloalcoyles
peuvent être éVpnt~lpllpmpnt substihués par um ou plusieurs radicaux alcoyles
25 contenant 1 à 4 atomes de carbone.
De préférence les radicaux aryles l~ par Ar et R3 sont des radicaux
phényles ou - ou ~3-naphtyles L' ~ " r11 "~ 1 substitués par un ou plusieurs atomes
ou radicaux choisis parmi les atomes d'halogène (fluor, chlore, brome, iode) et les
radicaux alcoyles, alcényles, alcynyles, aryles, aly~ ~, alcoxy, alcoylthio, aryloxy,
30 arylthio, hydroxy, llyLu~aluu~/lc~ mercapto, formyle, acyle, acylamino, aluy~âhu~LyLa~ ly' ` ~, amino, r~ ylallllno~ dialcoylamino, carboxy, al~u~yl,~ubullylc,
ballluyl~" dialcoylcarbamoyle, cyano, nitro, azido, L iLluu~u~ Lllu~y et
LLi[1UUIUIII~;IIYI~ étant entendu que les radicaux alcoyles et les portions alcoyles des
autres radicaux cnntipnnpnf 1 à 4 atomes de carbone, que les radicaux alcényles et
35 alcynyles ~:(...I,~.-~.t.ll 2 à 8 atomes de carbone et que les radicaux aryles sont des
~ WO95/13271 ~17~384 pCT~R94/01283
radieaux phényles ou cc- ou ~naphtyles, et que le radical R3 ne peut pas
un radical phényle non substitué.
De préférence les radicaux l~ , par Ar et R3 sont des
radicaux II~Lélu~_y~;l;;L~.. , ayant 5 ehaînons et contenant un ou plusieu~s
5 atomes, identiques ou différents, ehoisis paumi les atomes d'azote, d'oxygène ou de
soufre, C. ~ ." ' substitués par un ou plusieurs ider~iques ou
différents, ehoisis parmi les atomes d'halogène (fluor, chlore, brosne, iode) et les
radicaux alcoyles contenant 1 à 4 stomes de earbone, a~yles eontenant 6 à 10 atomes
de earbone, alcoxy contenant 1 à 4 atomes de earbone, aryloxy eontenant 6 à 10
10 atomes de carbone, amino, ' ylall"~w contenant 1 à 4 atomes de carbone,
" ' ~.r;dl~ U' dont chaque partie alcoyle eontient 1 à 4 atomes de carbone, acylamino
dont la partie acyle contient 1 à 4 atomes de carbone, ' yl,all ull.rlalllilw contenant
1 à 4 atomes de carbone, acyle contenant 1 à 4 atomes de carbone, ~yl~h~u~ C dont
la partie aryle contient 6 à 10 atomes de carbone, cyano, carboxy, wballlu~
15 ' ~yl~ballluyl~ dont la partie alcoyle contient 1 à 4 atomes de earbone,
diàll:uyluaLlJà~luyle dont chaque partie alco~le contient 1 à 4 atomes de w-bone ou
al1uAyl.a.l,ullrle dont la partie alcoxy contient 1 à 4 atomes de carbone,
étant entendu que les radicaux cycloalcoyles, cycloalcényles ou bicycloalcoyles
peuvent être éV~nt~ m~nf sub$itués par um ou plusieurs radicaux alcoyles
20 contenant 1 à 4 atomes de carbone.
Plus ~ Lil~ Ar représente un radical phényle, thiényle-2 ou -3 ou
fusyle-2 ou -3 éV~nt~ nn~nt sub$itué par un ou plusieurs atomes ou radicaux,
identiques ou di~férents, choisis par.mi les atomes d'halogène et les radicaux alcoyles,
alcoxy, amino, ' y' , dial~u,y- :), acylamino, ' ,~,~bUIIJ' -I et
25 L~inuv~U~dalrl~ et R3 représente un radical phényle substitué par un ou plusieurs
atomes ou radicaux, identiques ou différents, ehoisis parmi les atomes d'halogène et les
radicaux alcoyles, alcoxy, amino, ' yl~l.illo, liàl~u,y' ', acylamino, alcoxy-
ylàll~ v et Llinuulul~ Lllyld.
Plus ~ua~liculiè~lll~ eneore, Ar représente un radical phényle éventuel-
30 lement substitué par un atome de chlore ou de fluor, ou par un radical alcoyle(méthyle), alcoxy (méthoxy), didlcuy;al~il~ (dillléLllylaullillu), acylamino (acétyl-
amino) ou al~ y~all~u.,ylà,lliuw (tert-buLu~yuallJullylallliA~) ou thiényle-2 ou -3 ou
furyle-2 ou -3 et R3 représente un radical phényle substitué par un atome d'halogène.
D'un intéret encore plus particulier sont les produits de formule générale (I)
35 dans laquelle Ar rdprésente un radicâl phényle et Rl représente un radical benzoyle ou
WOg5113271 PCTlFRg4/01283 0
2 1 75384
tert.l,u~uAy~,d.bu..yl~ et R3 représente un rddical phényle substitué par un atome
d'halogène.
Selon l'invention les nouvèauA t~txoïdes de formule générale (I) peuvent être
obtenus par ~ctPrifir~t-'rn d'tm produit de formule générale:
O R ~O (Il)
OH OCOa~3
dans laquelle Ar et Rl sont définis comme ~. ~l.~,..,.,~.,~ et, ou bien R4 représente
un atome d'llydLu5b~le et Rs représente un gluu~w~lel~t protecteur de la fonction
hydroxy, ou bien R4 et Rs forment ensemble un hétérocycle saturé à 5 ou 6 chaînons,
Gl représente un radical alcanoyle (acétyle), al~,uAra~lyle (lll611l~JAra~;étyl~) ou
10 alcoyle (méthyle) ou un ~uu~,~,.--~t protecteur de la fonction hydroAy au moyen d'un
acide de formule générale:
R3-CO-OH (III)
dans laquelie R3 est défini comme ~ f ~ . ou d'un dérivé activé de cet acide,
pour obtenir un produit de formule générale:
R,~N,R~ o ~0
- OCOCH3
OCOR3
dans laquelle Ar, Rl, R3, R4, Rs et Gl sont définis comme pL~ ., dont le
F.ll des ~;IUUp6111~ protecteurs Rs, lorsque R4 représente un atome
d'hydrogène, ou bien R4 et Rs, lorsque R4 et Rs forment ensemble un hétérocycle
saturé à 5 ou 6 chaîAons, et évPnf~pllprnpnt Gl par des atomes d'l-y~ucbA~, conduit au
20 produit de formule générale (I) en passant éVpnh~pllf~mF~nt~ selon les gign ~ fi~ nc de
R1, R4 et Rs, pâr un produit de formule générale:
21 75384
WO 95113271 PCT/FR94/01283
" ' ~ (V)
- OCOCH
CORa
dans laquelle Ar et R sont définis comme ~ t, qui est acylé au moyen de
chlorure de benzoyle, thénoyle ou furoyle ou d'un produit de formule générale:
R2-O-CO-X (VI)
5 dans laquelle R2 est défini comme 1~ ' et X représente un atome d'halogène
(auor, chlore) ou un reste -O-R2 ou -O-CO-O-R2
Lorsque R4 représente un atome d'l~r~Lu~ ., Rs représente de préférence
un radical ll.calu~y..l~,ll.yle, éthoxy-l éthyle, benzyl~ lld~lyld~ .é~ ilyld,
triéthylsilyle, (~-t~ yl~;lyl_lllu~y) méthyle ou ~ildlly~Lu}~ yl~.
Lorsque R4 et Rs forment ensemble un hétérocycle, celui-ci est de
préférence un cycle ,~- .1;.1;,). évPnt~PII~n~Pnt mono-substitué ou gem-disubstitué
en position -2.
De préférence, Gl représente un radical acétyle ou alcoyle ou un radical
alcoxyacétyle.
L'.~ ,;r,~;.", du produit de formule générale (II) peut être effectuée en
faisant réagir l'acide de forrnule générale (III) de préférence sous forme ~"' ~, c"
tel que le chlorure, sur le produit de formule générale (II) 1 ' ' ' ' métallé. La
mPt~llsfil~n est ~n~r~lPmPnt effectuée au moyen d'un alcoylure de métal alcalin tel
que le butyllithium en opérant dans un solvant organique inerte tel qu'un éther
20 comme le i' ' yd~u~ , à ume t..ll~Ld~b.C: inférieure à -50C et, de pr~éférence au
voisinage de -78C. L'P~r~ est gPnPrglPmPnt effectuée en opér_nt à la même
: dans le même solvant.
Selon la nature des g.~ protecteurs du produit de formule générale
(IV), leur In,.,~ . .. - par des atomes d'l~ydlut~ peut être effectué de la manière
25 suivante:
1) lorsque R4 représente un atome d'hydrogène, Rs est défini cornme ~ P.~
et Gl représente un radical alcanoyle (acétyle), aL,u~d~yle (~ u~yle),
alcoyle (méthyle), le ,, .1; des ~ par des atomes
WO95/13271 PCT/l;R94/01283~
2 175384
-
d'lly~Lu~.lF peut être effectué en traitant le produit de formule générale (IV~ par un
acide minéral (acide chlu.ll~ique, acide sulfurique, acide rluullly~Liquc) ou
organique (acide acétique, acide mrthAnpclllfonique~ acide L inuulu",6G,ailF
sulfonique, acide r ~ r. . ~ utilisé seul ou en mélange en opérant dans un
5 solvant organique choisi parmi les alcools, les éthers, les esters, les ;~ydluu~lJ~t::~
A1,~ .F ~, les l~y~u~ w A1irhA-tir¦~1r~c halogénés, les ;Iy~A cs ~uu~L
ou les nitriles à une i , ' ~; comprise entre -10 et 60DC.
2) lorsque R4 et Rs forment ensemble un ~.~,t;.uu~ile saturé à 5 ou 6 cha~nons et plus
L~,ul;~ un cycle ~ 1 de formule générale:
R1-N><O (VII)
0 R6 R7
dans laquelle Rl est défiAi comrne ~ l, R6 et R7, identiques ou différents,
Ir,"lc~u~ un atome d'i~r~u~,~ ou un radical alcoyle contenant l à 4 atomes de
carbone, ou un radical aralcoyle dont la partie alcoyle contient l à 4 atomes decarbone et la partie aryle représente, de préférence, un radical phényle ~ n rntsubstitué par un ou plusieurs radicaux alcoxy contenant l à 4 atomes de carbone, ou
un radical aryle Ir~,~,L~, de préférence un radical phényle év-ntl-~llr~m~nt
substitué par un ou plusieurs radicaux alcoxy contenant l à 4 atomes de carbone, ou
bien R6 représente un radical alcoxy contenant 1 à 4 atomes de carbone ou un radical
trih?11~m~thyle tel que ~ , OU un radical phényle substitué par un radical
trih?lf~m~fhyle tel que L i~Llv~u~ ,G~rle et R7 représente un atome dl~.ylllu _.le, ou
bien R6 et R7 forment ensemble avec l'atome de carbone auquel ils sont liés un cycle
ayant 4 à 7 cha~nons, et Gl représente un radical alcanoyle (acétyle), ~ cc~yle
(.lléLl.u~l~,cLyl~)oualcoyle(méthyle),le rI~ r~ I dest.vu~ ~-ul~- ~s
par des atomes d'll~d~ug~ peut être effectué, selon les ci~, ri ~ de Rl, R6 et
R7, de la manière suivante:
a) lorsque Rl représente un radical t.bu~w~y~ LIv~ , R6 et R7, identiques
ou différents~ I~l~..,~,..'~.lL un r_dical alcoyle ou un radical aralcoyle (benzyle) ou
aryle (phényle), ou bien R6 représente un radical trih?l~m~thyle ou un radical
phényle substitué par un radical tr h?l-lm~thyle et R7 représente un atome
30 d'lly~Lu ,~ , ou bien R6 et R7 forment ensemble un cycle ayant de 4 à 7 chaînons, le
traitement d'un produi- de formule générale (IV) par un acide minéral ou organique
WO95/113271 2 1 7 5 3 8 4 PCT/FR94/01283
,--
év. ntl-Pll.-mPnt dans un solvant organique tel qu'un alcool conduit à un produit de
formule générale (V) qui est acylé au moyen d'un produit de formule générale (VI).
~e préférence, le produit de formule générale (IV) est traité par l'acide formique à
une ~cll-pd-~lLuuc voisine de 20C. De préférence, I'acylation du produit de formule
5 genérale (V) au moyen d'un produit de formule générale (VI) est effectuée dans un
solvant organique inerte choisi par~ni les esters tels que l'acétate d'éthyle, I'acétate
d'iDvl!lvlJylc OU l'acétate de n butyle et les hJ~ r~ir~ . halogénés tels
que le ~ hl-~ OU le dichloro-1,2 éthane en présence d'une base minérale
telle que le l~ de sodium ou organique telle que la L i~,a~ . La
10 réaction est effectuée à une ~ comprise entre 0 et 50C, de préférence
voisine de 20C.
b) lorsque Rl représente un radical benzoyle ou un radical R2-O-CO- dans
lequel R2 est défini comme ~ . - R6 représente un atome dhy~u~ . ou
un radical alcoYy contenant 1 à 4 atomes de carbone ou un radical phényle substitué
15 par un ou plusieurs radicauY alcoxy contenant 1 à 4 atomes de carbone et R7
représente un atome d'll~v~ , Ie ll .1~ des ~UU~CIIIWIi.~ ~IVk:C~UID par
des atomes d'l-y~Lv~ c s'effectue en présence d'un acide minéral (acide
chlvllly~hi~uc, acide sulfurique) ou organique (acide acétique, acide méthane-
sulfonique, acide L irluul~ . q P, acide r tr)l~ npculfonique) utiliæ æul
20 ou en mélange, en opérant dans un solvant organique choisi parmi les alcools, les
éthers, les esters, les lly~v~bulcD rl,l.1 -l;.l...; les ll~dlV~ 1b~.1CD Ill l r~l.l ;
halogénés et les IIY~VUOI1JUICD ~vlll~,iq~._, à une ICIIIPCI4lUIC compriæ entre -10 et
60C, de préférence entre 15 et 30C. L'acide peut être utilisé en quantité catalytique
OU ~lv~l 1,;.-,.,~1, ;.1~1~
25 3) lorsque Gl représente un radical alcv~4. é;yle et R4 et Rs sont définis comme au
point 1) ci-dessus, on effectue d'abord le ~ du ~vu~dlll~ll protecteur Rs
par un atome d~IIYdIVg`.US en opérant dans les conditions acides décrites au point 1)
ci-dessus, puis remplace évf~nt~Pll le ~;lU~JCll~ protecteur Gl par un atome
dily~llv~;cl~ par traitement en milieu alcalin ou par action d'un ' '-~, c de zinc
30 dans des conditions qui ne touchent pas au reste de la molécule. G. ' t, le
traitement alcalin est effectué par action de l'~lr..llvll;ac en milieu hydro-alcoolique
ou l'hydrazine en milieu alcoolique à une LCIII~JW4LUUC voisine de 20C. Générale-
ment, le traitement par un halogénure de zinc, de préférence l'iodure de zinc est effec-
tué dans le méthanol à une Lclll~J~LaLuud voisine de 20C.
.. , ..... . . .. . . _ _ _
wo 95/13271 PCT~Rs4/012$3 0
2 1 75~8~
4) lorsque Gl i-eprésente un radical alcoxyacétyle et R4 et Rs sont définis comme au
point 2-a) ci-desslis, on effectue i,~ Pn~Pnt le IPI~ du i~uu~
pi^otecteur GI par traitement en mil;eti alca'iin ou par traitement par un I ' ~æ e de
zinc dans les conditions décrites au point 3) ci-dessus, puis traite le produit de
5 formu'ie générale (V) obtenu dans les eonditions d'acylation décrites au point 2-a) ei-
dessus.
5) lorsque Gl représente un radiea'i ~i'i.,v~ ya~,;.yle et R4 et Rs sont définis eomme au
point 2-b) ei-dessus, on effeetue ~. '1PmPnt le ~ du i~vu~.~
protecteur Gl par traitement en mi'iieu aleaiin ou par t~aitement par un ha'iogénure de
10 zinc dans les conditions décrites au point 3) ci-dessus, puis traite le produit obtenu
dans les conditions décrites au point 2-b) ci-dessus.
Les produits de formule générale (II) peuvent eti-e obtenus par réduction
élec Livly Li iud d'un produit de formu'ie généra'ie:
~0 (Vlll)
oCOCH3
OCOCsHs
15 dans laquelle Ar, Rl et R4 sont défnis comme l,ic 'r~ n~ .l Rs est défni co~nme
p~ PI~ et peut i~l en outre un atome ~ r~iiuc~ilc, G'l repi~ésente un
atome ~ y(hv j~..lc ou un radical a1icanoyle (acétyle), ^' y~i~,dlyld (lI.' IilV Ly~ Lyl~,)
ou a'icoyle (métityle) ou un ~j.VUlJCII..,..~ protecteur de la fonction hydroxy selon le
schéma suivant:
~0 ~ , n.e ~ n.l~ A ~ ~
étant entendu que, lorsque n est égal à 2, le produit de coupure est le 1~1~ llyilid et,
lorsque n est égal à 4, le p~duit de coupure est l'a~icool beitzylique, suivie
WO 95/13271 2 1 7 5 3 8 4 PCT~94/01283
éyPntllpllpnApnf de la protection des fonctions hydroxy définies par -OR5 et -O-G 1
pour obtenir le produit de formule générale (Il).
La réduction électrolytique à partir du produit de formule générale (VIII) est
réalisée dans un éle~hul~Lu contenant un cathAolyte support dans lequel est dissous
le produit de formule générale (VIII) à une r~ comprise entre 0,1 g/l et la
saturation de la solution en produit de formule générale (VIII~.
r~,f~ lPmPnt la réduction s'effectue dans un el~hul~ à
,h A jl~ 1 ~
Selon un mode de mise en oeuYre du procédé selon l'ill~. la réduction
élechulyh~lue est effectuée dj~ns un él~,hul~ u1~pu1ku~ une cathode, un
eulnlJa~ èl~ rAAthrriirl-P, un dia~JIuà~ , séparateur, un ~ )aLiull~,.li anodique et
une anode dont les . A~AI ir~ r~ sont les suivantes:
a) la cathode est constituée d'une nappe de mercure,
b) le eu111~d1~ cathodique contient le catholyte qui est constitué d'une solution
du produit de formule générale (VIII) dans un milieu organique,
c) le rl;A~ séparateur est constitué d'un matériau poreuAY tel qu'une plaque, unmanchon ou une bougie de Yerre fritté ou de porcelâine ou par une membrane
P~ ' d~ions, de préférence par une membrane é. l - .g. ~ de cations,
d) le ~u111~d1 li111e1~ anodique contient l'anolyte constitué de préférence par le même
solvant ou mélange de solvants et le même électrolyte support que celui qui est utilisé
dans le ;Ulllpal iilllC.-~ ~AAth~jiq~e,
e) I'anode est constituée par un matériau co~ducteur de l'électricité dont la nature n'est
pas essentielle à la mise en oeuvre du procédé,
CPnprAlpmpnt~ l'anode est constituée par un matériau wlldul,ie~ de
I'électticité ;~ P dans les conditions de l'électrolyæ tel que par exemple le
platine poli, massif ou sur support ~ ' , le graphite ou le carhJone vitreux.
L'électrolyte support est constitué d'un sel .IA I~ r`~ e tel que
l'acétate de teh~ ;llylA~ ou le biL~l~v1ul~u1ai.~, de b~h~ h~ ou
leurs mélanges soluble dans le solvant ou le mélange de solvants.
CPnPrAlpmr~nt~ on utilise des solvants qui cr ll'hiliAP.`t facilement les produits
de formule générale (II) et (VIII) et qui sont peu résistants tels que les alcools comme
le méthanol, les nittiles comme l'acétonitrile ou les amides comme le diméthyl-
formamide.
WO95/13271 PCT~94/01283 0
2~ 7538~ lo
Le pH doit être compatible avec la stabilité du substrat. Le milieu peut être
tamponné en ajoutant un acide faible tel que l'acide acétique en c~
équimolaire avec l'acétate d'~ 4Uf Lt:lll~ile:.
Selon un mode préféré de mise en oeuvre du procédé, I'anode, la cathode et
5 le f~ séparateur sont dans des plans parallèles h ~ Ia cathode étant
constituée d'une nappe de mercure.
La i , du bairl ~I'.,IU~,L~ ~ est g~ ~~~'~ comprise entre 0 et
30C.
L'électrolyse est effectuée a potentiel contrôlé qui peut être compris entre
-I,90 et -2,10 volt par rapport à une électrode de référence saturée au calomel.Il est nécessaire de désaérer la solution par barbotage d'un gaz inerte tel que
l'argon pendant une dizaine de minutes avant le début de l'électrolyse, I'i ~i' ` "
inerte étant maintenue pendant toute la durée de l'électrolyse
Le produit de formule générale (VIII) peut être obtenu:
15 1) par action d'un halogénure de métal alcalin (chlorure de sodium, fluorure de
potassium) ou d'um azoture de métal alcalin (azoture de sodium) ou d'un sel
d'.",.".~ quaternaire ou d'un phosphate de métal alcalin sur un produit de
formule générale:
~2-CF3
~o ~ IX)
- oCOCH3
oCOc6H6
dans laquelle Ar, Rl, R4 et G'l sont définis cor~lme ~ .. ,.. 1 et Rs est défini
comme ~ f 1~ . ,- -- etpeutrepresenterenoutreunatomedl1y~u~
Généralement, la réaction est effectuee dans un solvant organique choisi
parmi les éthers (~ llufuu~uulf~ d;i~u~ LI-~-, méthyl t.butyléther) et les
nitriles (PA~f~mitrilP) seul ou en mélange à ume ~e-1.~,~Lu.~ comprise entre 20C et la
25 ~.~p~1f.~ule d'ébullition du mélange réactionnel.
Le produit de formule générale (IX) peut être obtenu par action d'un dérivé
de l'acide Llifluol~ ' ''u~hlue tel que l'anhydride ou le N-phényl trifluoro-
m.oth~npsl~lfonimide sur un taxoïde de formule générale:
wo 95113271 2 1 7 5 3 8 4 PCI'IF~94/01283
11
O R5 ~
- oCOCH3
OCOCsHs
dans laquelle Ar, R1, R4 et G'1 sont définis comme I ' et Rs est défini
commel),.S,~P.lf ..",. ~1
GPnp~pmpnf~ la réaction s'effectue dans un solvant organique inerte
5 (l~y~Loc~ 1irhotiq~P~ évPntnf~llPmPni halogénés, llydlu~,al~
en présence d'une base organique telle qu'une amrne tertiaire aliphatique
(L~ ylalliille) OU la pyridine à une ~.IIl~é-d~u.e comprise entre -50 et +20C
Le taxoide de formule générale (X), dans laquelle G'1 représente un atome
d'hr~Lug~lf ou un radical acétyle, al~:u~a.,~yl~, ou alcoyle, peut etre obtenu à partir
10 d'un produit de formule générale:
~ y~O (Xl)
oCOCH3
OCOCsHs
dans laquelle Ar, R1 e~ R4 sont definis comme ~l~cP.i~ Rs est défrni comme
f fl~ et G 1 représente un radical acétyle, al~ yle f~U alcoyle ou un
protecteur de la fonction hydroxy et G'2 représente un "r- r
15 protecteur de la fonction hydroxy par nPmr~ f~n-Pnt des ~,.u~ I ~u~ G 2
et évPntl~PllPmPnt G'l par des atomes cl'lly~u~
Les radicaux G'1 et G'2, lorsqu'ils l~ un ~u.,~ protecteur de
la fonction hydroxy, sont de préférence des radicaux trichloro-2,2,2 ;;llu~r~;a bull~
(trichlorométhyl-2 propoxy)-2 carbonyle ou des radicaux triaL~cylsilyles, diaLIcyl-
20 arylsilyles, alkyldiarylsilyles ou triarylsilyles dans lesquels les parties alkyless~ntiPnnPnt 1 à 4 atomes de carbone et les parties aryles sont de preférence des
radicaux phényles.
Lorsque G'l et G'2 ~ ,.It~ L un radical trichloro-2,2,2 ~,Lllu~y~bul.
ou (trichlorométhyl-2 propoxy)-2 carbonyle, le if ~ r ~ l des ~,r- r- -
WO 95113271 PCT/FR94/01283 1~
21 75384
12
-
protecteurs par des atomes d'hydrogène est effectué par le zinc, éVPntllp~ npnt
associé au cuivre, en présence d'aeide acétique à une Lel~p~la~uue compnse entre 20 et
60C ou au moyen d'un acide minéral ou organique tel que l'acide chlu.l.y~Liy~c ou
l'acide acétique en solution dans un alcool aliphatique contenant 1 à 3 atomes de
5 carbone ou un ester aliphatique tel que l'acétate d'éthyle, I'acétate d~V~JIU~YI~ ou
l'acétate de n.butyle en présence de zinc ~ associé à du cuivre.
Lorsque G'2 représente un radical silylé et G'1 représente un radical
alcanoyle (acétyle), al~u~yae..~yle (~ u~yacé~yle) ou alcoyle (métltyle), le
du s.vu~ .~A protecteur G'2 par un atome d'l-y-llv~,~._ peut
10 s'effectuer au moyen, par exemple, d'acide ~llu~l~ydliy~e, gazeux en solutionk~ ,G à une t~ yéla~Uue voisine de 0C ou par action d'un complexe acide
nuvlllydli~uè-LI;~Lll~a~ e Ou acide ~luu~llydli~lu~ pyridine dans un solvant
organique tel que le dicl-lvlvll-éLlla~-~,, le ~éLlall~l 't ou l'~rPtnnit~ilP à une
~elnpela~uuc voisine de 20C, dans des conditions qui sont sans effet sur le reste de la
15 molécule.
Lorsque R4 et Rs forment ensemble un cycle ..,~ l;.i;..r de formule
générale (VII) dans laquelle R6 représente un atome d'l~y~Luc~.~e et R7 représente trn
radical phényle substitué, le traitement en milieu acide conduit à un produit deformule générale (X) dans laquelle R4 et Rs le~ CllL chacun un atome
20 dl~yd~u~èl.~. ll est alors nécessaire de protéger sélectivement la fonction hydroxy
lè~...,.._..Lce par -O-Rs dans le produit de formule générale (X), de préférence sous
forme d'un radical silylé, avant de préparer le produit de fonmule générale (LX).
Le prvduit de fonmule générale (XI) dans laquelle G~I représente un atome
'I;l.rLU~ Ou un radical acétyle, ~lcu~acO~yle ou alcoyle peut être obtenu dans les
conditions décrites dans les brevets européens EP 0 336 840 et EP 0 336 841 et dans
la demande ;.. A ;n lAlP PCT/WO 9209589 par ~ ; .. de la baccatine III ou
de la désacétyl-10 baccatine III dont les fonctlons hydroxy en-7 et évPnt~PIIP~Pr t -10
sont prvtégées, étant entendu que pour obtenir un produit de fonmule générale (XI)
dans laquelle G'l représente un radical ~lcv~yaeé~yL. ou alcoyle, il est nécessaire de
30 traiter ~ Ia désacétyl-10 baccatine III protégée en -7, de préférence par
un radical silylé, par un halogénure d'acide alCuAya.,c~iquc ou par un halogénure
d'alcoyle.
Généralement l'iu~L~vduc~iu~ d'un g.v~c...~ alcuAya~c~yle s'effectue en
traitant la désacétyl-10 baccatine III prvtégée en -7 par un halogénure d'acide
WO 95/~3271 2 1 7 5 3 8 4 PCTIFR94101283
13
-
alcv~al~eLiqua en opérant dans un solvant organique basique tel que la pyridine à une
k111pc~ uLe Yoisine de 20C.
."1..~ 1" ~iU~,Livl1 d'un radical alcoyle s'effectue en traitant la
désacétyl-10 baccatine m protégée en -7 et méta11ée en -lO, au moyen par exemple5 d'un hydrure alcalin (hydrure de sodium) ou d'un alcoylure métallique (butyllithium),
par un halogénure d'alcoyle.
2) par ~ " r;. A ;1-~ ~ d'un produit de formule générale:
G~
HO ~ I~ (XII )
~
HO ~ -
- OCOCH3
OCOC6Hs
dans laquelle Gl est défini comme ~ -- -1, au moyen d'un acide de formule
10 générale:
R i ~ ,R4
Af~OH (Xlll)
~Rs
dans laquelle Ar, Rl, R4 et Rs sont définis comme IJLfA a~ . 11, OU d'un dérivé de
cet acide.
L'~ ~ . ;r;. A~ l au moyen d'un acide de formule générale (XIII) peut être
15 effectuée en présence d'un agent de .. ~.1~ .1~A1;(111 (. A l,.~l;;.. ~la, carbonate réactifl et
d'un agent Ll'~ aiiv1~ (al11;1lU~yLiLl;llc) dans un solvant organique (éther, ester,
cétones, nitriles, l1~dLvua~bu~c~ LvcalL cs Fl;l-l l;q ~ halogénés,
Il~LLuL`albuues aLvlllaliq~ s) à une tu~ cla~uLe comprise entre -lO et 90C.
L'aetarifiAAti--n peut aussi être réalisée en utilisant racide de formule
20 générale (XIII) sous forme .1' ' ~LLidè en opérant en présence d'un agent d'à1Livaiion
(a111iul~ylL;l;nc) dans un solvant organique (éthers, esters, cétones, nitriles, hydrocar-
bures A1;~ 8~ LL~IuallJuuc~ A1irh ~tiq~ae halogénés, l1~LL~:aLI,u.c~ aroma-
tiques) a une 1c111~c1a~uuc comprise entre 0 et 90C.
L'~ "t~'. ;r;~Al;l.,~ peut aussi être realisée en utilisant l'acide de formule
25 générale (XIII) sous forme d'halogénure ou sous forme .1' ' ~d.ide avec un acide
WO95/13271 l~l/r ~4'012830
2 1 75384
14
aliphatique ou ~uvllla~iq~ éVo~t-~PIlPn~l~nt préparé in situ, en présence d'une base
(amine aliphatique tertiaire) en opérant dans un solvant organique (éthers, esters,
cétones, nitriles, llydLUCaLb~ liph~tl~i . IlydLUUaLl/Ult::~ A1irh~tiq~ s halogénés,
IIYdLVI~aLblLL~ uullLdt~ ) 8 une i Ij ' comprise entre O et 80C.
Le produit de formule générale (XII) peut être obtenu par nction d'un
halogénure de métal alcalin (chlorure de sodium, fluorure de potassium) ou d'ur
azoture de métal alcalin (azoture de sodium) ou d'url sel d'; ~ ou
d'un phosphate de métal alcalin sur un produit de formule générale:
G~02 CF3
~/ `S~ O (XIV)
- OCOCH3
OCOC~Hs
10 dans laquelle Gl est défini comme ~
Cri~n~r~l~mrnt la réaction est effectuée dans un solvant organique choisi
parmi les éthers (Lé~LallydLVrULd~nl~, dii::~ul~v~)yll~Lllel, méthyl t.butyléther) et les
nitriles (~f ~t~nitril~) seul ou en mélange à une ~ lul~ comprise entre 20C et la
Lll~ult~ d'ébullition du mélange ~f tir~nn~
Le produit de formule (XIV) dans laquelle G1 représente un atome
d'l-y~Lv6~l~ Ou un radical alcanoyle (acétyle), alcvAya~é~yl~ ,lLv~ya~ yl~) ou
alcoyle (méthyle) peut être obtenu par action d'un dérivé de l'acide l~ uvlvll~ e-
sulfonique tel que l'anhydride ou le N~ yll~iLluvl~ '' '~ sur la
baccatine III ou la désacétyl- 10 baccatine III, qui peuvent être extraites selon les
20 méthodes connues à partir des feuilles d'ifs (Taxus baccata), suivi évf~nt-~r~ n1~nt de
la protection en position 10, étant entendu que pour obtenir un produit de formule
générale (XIV) dans laquelle Gl représente un radical al1v, ya~yle ou alcoyle, il est
nécessaire de traiter ~ la désacétyl-10 baccatine III protegée en -7, de
préférence par un radical silylé, par un halogénure d'acide al~v.~ya~,éli~l~ ou par un
25 halogénure d'alcoyle.
G~on~5rAlf~m~nt la réaction d'un dérivé de l'acide LLilluull ~
s'effectue dans un solvant organique inerte (llydlu~ dfl~u~ lirh~tiq~
év~nt~ m.ont halogénés, llydlv~lJuu~ ~vllla~ S) en présence d'une base
WO95/13271 2 1 7 5 3 8 4 Pcr~FR94JO1283
organique telle qu'une amine tertiaire aliphatique (L~ dal~lillc) ou la pyridine à une
l~ laiu t; comprise entre -50 et +20C.
CPnPrr~ ulu~iùl~ d'un ~ P- 1 alcoxyacétyle s'effectue en
traitant la désacétyl-10 baccatine m protégée en -7 par un halogénure d'acide
5 alc.~y~.~,é~ , en opérant dans un solvant organique basique tel que la pyridine à une
~LaL~e voisine de 20C.
GPn~l--- I" ~lu~,liu~ d'un radical alcoyle s'effectue en traitant la
désacétyl-10 baccatine m protégée en -7 et métallée en -I0, au moyen par exempled'un hydrure alcalin (hydrure de sodium) ou d'un alcoylure métallique (butyllithium),
10 par un halogénure d'alcoyle.
Selon l'invention les nouveaux produits de formule générale (I) peuvent être
obtenus par ~ d'un produit de formule générale:
Ar~O "~ (XV)
- OCOCH3
01~
dans laquelle Ar, Rl, R4, Rs et Gl sont définis comme ~,~f~ et G2
15 représente un ~ u~ .,..l protecteur de la fonction hydroxy choisi, de préférence
parmi les radicaux lli~yLlyl~, d;dLl~Lybilyl~, " yl liolyl~ilyl~ ou l~;~yl~;
dans lesquels les parties alkyles ~ 1 à 4 atomes de carbone et les parties
aryles sont de préférence des radicaux phényles, au moyen d'un acide de fc~rmulegénérale (Ill), pour obtenir un produit de formule générale:
R,,N,R4 o j~2
Ar~~J~O'' C\~ 1 (XVI)
- OCOCH3
OCOR3
dans laquelle Ar, Rl, R3, R4, Rs, Gl et G2 sont définis comme ~ dont
on remplace ~ le ~ ; protecteur G2 par un atome ~ ylLu~
pour obtenir un produit de formule générale:
Wo 95113271 PcT/~s4/01283 0
2 1 75384
16
Ar~O ~ ~ (XVII)
O-R5 ~O
- OCOCH
OCOR3
dans laquelle Ar, Rl, R3, R4, Rs et Gl sont définis comrne 1~ qui, par
action d'un dérivé de racide; ' ' ~ 1 tel que l'anhydride ou le N-
phényl ,. , . . r I ~ est transformé en prcduit de formule générale:
Ar' ~~Jl~o ~ 2-CF3
O R6 ~H~ G
- OCOCH3
OCOR3
dans laquelle Ar, Rl, R3, R4, Rs et Gl sont définis comme IJ.~ n~ dont les
.n~ u~S ~ Jl~.".L~ par Rs ou par R4 et Rs soffl remplacés par des
atomes d'hydrogène pour donner un produit de formule générale:
Ar ~o " ~ (XIX~
OCOCH3
OCOR3
10 dans laquelle Ar, Rl, R3 et Gl sont définis comme ~ . .. 1 qui, par action d'un
halogénure de métal alcaltn (chlorure de sodium, fluorure de potassium, chlorure de
sodium) ou d'un azoture de métal alcalin (azoture de sodium) ou d'un sel d'
quaternaire ou d'un phosphate de métal alcalin, conduit au produit de formule générale
(I) dans laquelle R représente un radical acétyle, al.,~ tyl~, ou alcoyle qui peut être
15 transformé en produit de formule générale (I) dans laquelle R représente un atome
d'hydrogène.
L~ r.. -~ '.... d'un produit de formule générale (XV) au moyen d'un acide de
formule générale (I11) est effectuée dans les conditions décrites l,~ pour
WO95/13271 2 1 7 5 3 8 ~ Pcr~s4/0l283
17
I~r~1r1;r;. 1;.~.- d~un produit de formule générale (II) au moyen d'un acide de formule
générale (III).
Le ~ du ~JU~.I.~ protecteur G2 par un atome d'il~ydlU~
s'effectue ~onr~r~l ' en traitant le produit de formule genérale (XVI) par racide
5 nuu.l.yd.iq~ ou l'acide i 11 ' . erl présence d'une base organique telle que la
pyridine ou une amine tertiaire aliphatique telle que la i ~- en opérant dans unsolvant organique tel qu'un éther (~llall,~d~ur~ ,) ou un nitrile (,-- ' t. . -1 il-) .
La ~., ..r~ .... ....~ d'un produit de formule générale (XVII) en un produit de
formule générale (XVIII) s'effectue dans les conditions décrites ~ ' pour
10 préparer le produit de formule générale (IX) a partir du produit de formule générale
(X).
Le ~ des t.uu~l..~ plul~t~"lla .~p., par Rs ou par R4
et Rs est effectué dans les ccnditions décrites ~r~ ..1 pour le Ir...
des 2;.~Jup~ La protecteurs du produit de formule générale (IV).
La l.,1,.cr.. ,.. ~;,.. d'un produit de formule générale (XIX) en produit de
formule générale (1), dans laquelle R représente un radical alcanoyle, r1~ ya~Lyle ou
alcoyle, est effectuée dans les conditions décrites ~Ir~ r~ 1 pOUr la
l,r.,~r~., 111,.1;.,.~ d'un produit de formule générale (IX) en produit de formule générale
(VIII) .
Le .~ 1. ' éventuel du radical R du produit de formule générale (I),
dans laquelle R représente un radical alcanoyle, alcu~a~ yl~ ou alcoyle, par un atome
d'l~y~Lu~ peut être effectué dans les conditions décrites ~ ._.,1 pour le
.r"~ r",r.,1 des ,~5.uupw,..,..~ plul~_kula d'un produit de formule générale (IV) par
des atomes d l~Y~IIUc--l~
Le produit de formule générale (XV) peut être obtenu dans les conditions
décrites dans la demande ;..~. -';~ PCT WO 94/20484.
Les nouveaux produits de formule générale (I) obtenus par la mise en oeuvre
des procédés selon l'invention peuvent être puri6és selon les méthodes connues t~lles
que la l rict~llic~tir~n ou la .lu. ,., - ~ .l,;r
Les produits de formule générale (I) presentent des propriétés hi~ giql.
remarquables.
In vitro, la mesure de l'activité biologique est effectuée sur la tubuline
extraite de cerveau de porc par la méthode de M.L Shelanski et coll., Proc. Natl.
Acad. Sci. USA, 70, 765-768 (1973). L'étude de la d~ol~....,.~liol, des microtu-35 bules en tubuline est effectuée selon la méthode de G. Chauvière et coll., C.R. Acad.
..... _ _ . , . , .. , .. ,, .. _ _ . . .. , . . , . . , ., ... ... . ., .. , ,,,, . , , , _ _ _ _ _
_ _ _ _ _,
WO 95/13271 P~.l/r~ t!O12U ~
2 1 753v4
18
Sci., ~2~, série II, 501-503 (1981). Dans cette étude les produits de formule générale
(I) se sont montrés au moins aussi actifs que le taxol et le Taxotère.
In vivo, les produits de formule générale (I) se sont montrés actifs chez la
souris greffée par le mélanome B16 à des doses comprises entre 1 et 10 mglkg par5 voie U~ ' ' 1P, ainsi que sur d'autres tumeurs liquides ou solides.
Les nouveaux produits r ' ' une activité sur les tumeurs qui sont
résistantes au Taxol~) ou au Taxotere~). De telles tumeurs ~ ~ les tumeurs
du colon qui ont une expression élevée du gène mdr 1 (gène de la multi-drug
ésistance). La multi-drug résistance est un terme habituel se rapportant à la résistance
10 d'une tumeur à différents produits de structures et de l.lé.~ d'action différents.
Les taxoides sont g~ - ' -~' connus pour être fortement reconnus par des tumeurs C telles que P388/DOX, une lignée cellulaire ~ ' pour sa
résistance à la dw~ulubic;ll., (DOX) et qui exprime mdr 1.
Les exemples suivants illustrent la présente invention.
15 F:XF.l\IPJ F 1
A une solution de 91,5 mg d'amino-3 hydroxy-2 phényl-3 IJII r- ' -(2R,3S)
de diacétoxy-4a,10~ (fluoro4 ~.~uylo~y)-2a époxy-5~,20 hydroxy-1~ méthylène-
7~,813 oxo-9 nor-19 taxène-11 yle-13a dans 0,2 cm3 de dichlulul~ a,~.~" maintenue
sous ~IL-llv~~ d'argon, on ajoute 12,5 mg d'i,ydlut,~.locarbonate de sodium puis,
20 goutte à goutte, à une u,,l~ voisine de 20C, une solution de 32 mg de
li~,~; de di-t.butyle dans 0,1 cm3 de t1i~`hl ' ' La solution obtenue est
agitée pendant 22 heures à une ~.~é~ voisine de 20C puis: '" d'un
mélange de 0,5 cm3 d'eau dis~llée et de 5 cm3 de ~ hl~ La phase aqueuse
est extraite par 0,5 cm3 de 1' -' '- ' - Les phases organiques réunies sont
25 séchées sur sulfate de m~ n filtrées puis ~:ul~ ~ à sec sous pression réduite(2,7 kPa) à 40C. On obtient ainsi 99,2 mg d'ume meringue jaune que ron purifie par
1-."",. 1"~ ,1".o préparative sur 6 plaques de silice en couche mince (Kieselgel60F254, Merck) de 0,25 mm d'épaisseur en éluant 2 fois avec un mélarlge méthanol-
dichlu,ul.,éa.dl~ (2-98 en volumes). Après élution de la zone UUII~IJUllli~uli au
30 produit recherché par un mélange méthanol-di..l,lulu...éal~.~ (10-90 en volumes) p us
Ul~l~iOll SOUS pression réduite (0,27 kPa) à une il~ el~UI1 voisine de 40C, on
obtient 32,7 mg de t.buLu~y~allJullyldllllllO-3 hydroxy-2 phényl-3 l r' ' (2R,3S)
de diacétoxy-4a,1013 ffluoro-4 l~cl.Lvylu.~y)-2a époxy-5~,20 hydroxy-
~
Wo 95/13271 PCTI~R94/01283
2 ~ 75384
19
-
méthylène-7~,81S~ oxo-9 nor-19 taxène-ll yle-13 sous forme d'une meringue blanche
- dont les . ~ s; sont les suivantes:
- spectre de résonance ~ 1 f nucléaire du proton (400 MHz; CDC13;
~Iripl- ' chimiques en ppm): 1,28 (s, 3H: -C~I3 en 16 ou 17); 1,30 s, 9H: -
C(C~3)3]; 1,37 (mt, lH: -s en 7); 1,58 (s, 3H: -CH3 en 16 ou 17) 1,68 et 2,25 (tet m, lH chacun: C~I2 du ~l~r ~ ~; 1,87 (s, 3H: -C~13 en 18); 2,12 et 2,47 (d
et td, lH chacun: -C_2 en 6); 2,22 (s, 3H: -COC~3 en 10); 2,22 et 2,40 (m, lH
chacun: -CH2 en 14); 2,38 (s, 3H: -COC~ en 4); 3,26 (s large, lH: -O_ en 2');
4,05 et 4,30 (d, lH chacun: -C~2- en 20); 4,10 (d, lH: -_ en 3); 4,64 (s large, lH:
-~ en 2'); 4,75 (d, lH -~ en 5); 5,30 (d, large, lH: -~en 3'); 5,31 (d, lH:
-CON~-); 5,65 (d, lh: -H en 2); 6,29 (t large, lH: -H en 13); 6,32 (s, lH: -_ en10); 7,20 [t, 2H: -OCOC6H4F (-H en 3 et -;t~ en 5)]; de 7,30 à 7,45 (mt, 5H: C6Hs
en 3'); 8,19 [dd, 2H: -OCOC6H4F (-~en 2 et -~ en 6).
L'amino-3 hydroxy-2 phényl-3 1 -s- -(2R,3S) de diacétoxy-4a,10
(fluoro-4 L~.~vyluAy)-2a époxy-5~,20 hydroxy-l~ méthylène-713,8~ oxo-9 nor-19
taxène-ll yle-13a peut être préparé de la manière suivante:
Une solution de 130 mg de tIJU~V~YC~UIIYI 3 diméthyl-2,2 phényl-4
r~ Ju ~ylr~5-(4R~5s) de diacétoxy4a,101S~ (fluoro-4 1~vylu~y)-2a
époxy-5~3,20 hydroxy-113 méthylène-7~,813 oxo-9 nor-19 tAxène-ll yle-13a daiA,s
1,3 cm3 d'acide formique est agitée pendant 2 heures à une ~c~ u~c voisine de
20C puis concentrée à sec sous pression réduite (0,27 k~a) à 30C. La meringue
blanche obtenue est purifiée dh~ par ~ - à pression
Al,.,~î~l.l.f.;.lur~sur40gdesilice(0.063-0.2mm)contenusdansunecolonnede2.5Crn
de diamètre en éluant avec un melange méthanol-dichlu.u...clllanf (gradient d'élution
de 2,5-97,5 à 5-95 en volumes). Ies fractions ne contenant que le produit recherché
sont réunies et ~ à sec sous pression réduite (0,27 kPa) à 40C. On obtient
ainsi 91,5 mg d'amino-3 hydroxy-2 phényl-3 propionate-(2R,3S) de diacétoxy-4a,10(fluoro4 1~,~uylvAy)-2a époxy-5,~,20 hydroxy-113 méthylène-7~,813 oxo-9 nor-19
taxène-l 1 yle-13a sous forme d'une meringue blanche.
Le t.bu~v~yc_~lJullyl-3 diméthyl-2,2 phényl-4 ~ ylA-t~- 5
(4R,5S) de diacétox,Y-4a,10~ (fluoro-4 I~.~vylv1Ly)-2a époxy-5~,20 hydroxy-113
méthylène-7~,813 oxo-9 nor-19 taxène-ll yle-13a peut être préparé de la manière
suiYante:
A une solution de 190 mg de t.bu~u~ycA~bvllyl-3 diméthyl-2,2 phényl-4
rYA7rl,~I;rr Ad)vAylate-5-(4R,5S) de diacétoxy-4a,10~ époxy-5~,20 dihydroxy-1~,2a
wo 95/13271 PCT/F~94/01283 ~
2 ~ 7~384
-
méthylène-713,8~ oxo-9 nor-19 taxène-11 yle-13a dans 4 cm3 de LéLIl~J~vrl
a~hydre, maintenue sous: .'` d'argon, on ajoute Su~u~i~ ellL, à une
Lell~péld~ule voisine de -78C, 0,38 cm3 d'une solution 1,3 M de n l~u~y ' ' dans
l'hexane puis 0,0585 cm3 de chlorure de fluoro4 benzoyle. La solution est agitée5 pendant 45 minutes à ume 1~....~,, voisine de -78C puis on ajoute SU~A~I._..;,
à la même l~ -. 0,38 cm3 d'une solution 1,3 M de n Luly'- dans l'hexane
puis 0,0585 cm3 de chlorure de fluoro4 benzoyle. La solution est agitée pendant 35
minutes à une ~.llpela~ule voisine de -78C puis on sjoute 1 crn3 d'une solutionaqueuæ saturée de chlorure d'; Le mélange réacti~nel est ramené à une
10 Lel~ ule voisine de 20C en 15 minutes. Après ~' la phase aqueuse est
extraite par 2 fois I cm3 d'acétate d'éthyle. Les phases organiques réunies sont séchées
sur sulfate de r.Aa~ m filtrées puis cu..~,ellt~, à sec sous pression réduite
(2,7 kPa) à 40C. On obtient ainsi 245 mg d'une huile jaune qui est purifiée parchromatographie à pression A I I ~ sur 40 g de silice (0,063-0,2 mm) contenus
dans une colonne de 2,5 cm de diamètre en éluant avec un mélange méthanol-
di._llvlulll.,illàl~è (gradient d'élution de 0,5-99,5 à 2,5-97,5 en volurnes). Les fractions
ne contenant que le produit recherché sont réunies et, éeS à sec sous pression
réduite (0,27 kPa) à 40C On obtient ainsi 130 mg de t.butv~yeallJvllyl-3 diméthyl-
2,2 phényl-4 ~ ylaLe-5-(4R~5s) de diacétoxy-4a,10~ (fluorv-4
~.~vyluAy)-2a épvxy-513,20 hydroxy-113 méthylène-7~,8~ oxo-9 nor-19 taxène-11
yle-13a sous forme d'une meringue blanche.
Le t.~u~uAy~ bullyl-3 diméthyl-2,2 phényl4 .. l;.l.. A. 18)~ 5
(4R,5S) de diacétoxy-4a,10~ époxy-513,20 dihydroxy-113,2a méthylène-7~,813 oxo-9nor-19 taxène-11 yle-13a put être préparé de la manière suivante:
On procède à la réduction ~!~11- . du t bulv~eA l~vllyl-3 diméthyl-
2,2 phényl4 ~ yh~ 5-(4R,5S) de diacétox~v-4a,1013 1~.~vyluA.y-2a
époxy-5~,20 hydroxy-1~ méthylène-7j3,8~ oxo-9 nor-19 taxène-11 yle-13a dans une
cellule dléle~ vly~e dont les . A. ~ sont les suivantes:
- la cellule est un vase de verre de 100 cm3 divisée en 2 c~ . par
une membrane ~ de cations,
- la cathode êSt une nappe de mercure dont la surface utile est d'environ
4cm2,
- I'anode est une grille de platine,
- I'électrode de réference est une électrode au calomel saturée.
WO 9~/13271 PCrlPR941012g3
21 75384
21
-
Dans le f ~ f sfh~ iq~F on introduit 10 cm3 d'une solution
contenant:
- t.buLo~aLluullrl-3 diméthyl-2,2 phényl-4 ~ y' 5-(4R,5S)
de diacétoxy-4a,101'~ benzoyloxy-2a époxy-51'~,20 hydroxy~ méthylène-7fl,8'~ oxo-9
nor-l9 taxène-ll yle-13a 27,3 mg
- t~,LG~luulubul,,~ de toha~:Lll.~ ;''''' 1 e r 0,15 M/l
- acétate de ~ Lil~ q e r 0~05 M/l
- acide acétique q c r 0'05 M/l
- méthanol q c r- lo cm3
10 Dans le ~ l anodique, on introduit 10 cm3 d'une solution d'acide
sulfurique aqueux 0,1~.
Après fif~Fr~tif~n de la solution pendant 10 minutes par barbotage d'um
courant d'argon qui est maintenu pendant toute la durée de r~l~.,L.ulysc, le potentiel de
la cathode est fixé à -1,95 volt par rapport à rélectrode de référence.
On électrolyse la solution pendant 54 minutes, c'est-à-dire le temps nécessaire
au passage de 100 coulombs. Après ~ à sec sous pression réduite
(0,27 kPa) à une ~ laluLt: voisine de 35~, le résidu est repris par 10 cm3 d'acétate
d'éthyle et 10 cm3 d'eau distillée. Après extrsction et flPf sntstif)n la phase aqueuse est
extraite 2 fois avec 5 cm3 d'acétate d'éthyle. Les phases organiques sont réunies,
lavées avec 10 cm3 de tampon phosphate aqueux 0,2 m (pH = 7), séchées sur sulfate
de m~nf-~ m, filtrées puis .,U,.~,.,.ILI~s à dec sous pression réduite. On obtient ainsi
24 mg d'une merngue jaune pâle qui est purifiée par ~ l~aLa~ivt: sur 4
plaques de silice en couche mince (Kieselgel 60F254, Merck; épaisseur 0,25 mm) en
éluant avec um mélange méthanol-acétonitrile-.li~llulul~lé1h~, (5-5-90 en volumes).
Après repérage sous U.V. (254 rlm) et élution de la ~one Wll- r ' ' au produit
principal par un mélange méthanol-~' ' ' ' ' (1-1 en volumes) puis e~ lLion
sous preSsion réduite (0,27 kPa) à une ~.IIIJ~alL..~ voisine de 40C,on obtient 9,6 mg
de t.bulu~y~albullyl-3 diméthyl-2,2 phényl4 .~ F - ~ Y' 5-(4R,5S) de
diacétoxy-4a,10,~ époxy-5,i.20 dihydroxy-1~,3,2a méthylène-71'~,81'~ oxo-9 nor-l9
30 taxène-ll yle-13a sous forme d'une meringue blanche.
Le t.buL~yLall>ùllyl-3 diméthyl-2,2 phényl4 .~. ,..1;.I..~F~ r~ 5
(4R,5S) de diacétoxy-4a,101'~ 1~.~vylwy-2a éroxy-51,3,20 hydroxy-ll'i méthylène-71f~,81'~ oxo-9 nor-l9 taxène-ll yle-13a peut être préparé de la manière suivante:
A une solution de 1,8 g de tb.~tu~,aLbull~1-3 diméthyl-2,2 phényl4
~ if~ .l,o~' 5-(4R,5S) de diacétoxy-4a,101'~ ~uyl~y-2a époxy-5,'~,20
Wo 95/13271 PCI /FR94/0 1283 ~
2~ 75384
22
-
hydroxy~ oxo-9 Llillu~ fonateA7l~ taxène-ll yle-13fl dans 20 cm3
d'acétonitrile anhydre et 4 cm3 de ~allydlu~uua~ anhydre, maintenue sous
a~ .f` n d'argon, on ajoute 4 g de chlorure de sodium et 300 mg de tamis
,..olé.,ul~ue 4A activé en poudre. Le mélange réactionnel est chauffé pendant 2 heures
5 sous agitation et sous ,;' ` d'argon, à une L~ ...pf aLu~c: voisine de 80C, puis
refrvidi à une i~ . .,1~. Al~'' n voisine de 20C et filt~é sur verre fritté garni de celite. Le
filtrat est concentré à sec sous pression réduite (2,7 l~a) à une i . voisirle de
40C. On obtient ainsi 4,9 g d'un résidu brun-orangé qui f st punfié par
~.lu~ , à pression . ' i sur 40 g de silice (0,063-0,2 rnm) contenus
10 dans une colonne de 4,5 cm de diamètre en éluant avec un mélange acétate d'éthyle-
(gradient d'élution de 0-100 à 10-90 en volumes). Les fractions ne
contenant que le produit recherché sont réunies et ~ ,..L w~ à sec sous pressionréduite (0,27 kPa) à 40C. On obtient aiiAIsi 1,35 g de t.~uLvA.~bol.~1-3 diméthyl-2,2
phényl4 .,- A~ b~ Y' ' 5-(4R,5S) de diacétoA~y-4fl,101'~ 1~.~ylu~y-2a
époxy-51'~,20 hydroxy-ll'~ méthylène-71'~,81'i oxo-9 nor-19 taxène-ll yle-13a sous
forme d'une meringue blanche.
Le t.bulu~yl,~bvllyl-3 diméthyl-2,2 phényl-4 ~ ' ' L~ -5-
(41'~,5S) de diacétoxy-4a,101'~ benzoyloxy-2a époxy-51'~,20 hydroxy-li'~ oxo-9
trifluv.-,,.. ~ lr~,.l.. 71f~ taxène-ll yle-13a peut être préparé de la manière
20 suivante:
A une solution de 3,85 g de t.burlJ~yu~ulJoll.~l-3 diméthyl-2,2 phényl-4
,..li.l;.lP. .l..,~laL~5-(4R,5S) de diacétoxy-4a,101'~ benzoyloxy-2a époxy-5~,20dihydroxy-11'~,7~ oxo-9 taxène-ll yle-13a daris 40 cm3 de f'--'-' anhydre,
maintenue sous, L...o~pl.;.t: d'argon, on ajoute 1,3 cm3 de pyridine et 100 mg de tamis
25 moléculaire 4A activé en poudre. Le mélange réactiormel est refroidi à une
,é.aLu.~ voisine de -30C. On ajoute lentement 1,2 cm3 d' ' ydlidl triflluoro-
."~Il..;... ~..1~."".~ agite à une ~ell~laLuu~; voisine de 0C pendant 1 heure. On
refroidit à nouveau à une L~-~.pé-aLuid voisine de -30C puis on ajoute 1,2 cm3
d'anhydride Llifluvl.~ - lr~JIli LU~, agite à une L~ JelaL~: voisine de 0C
30 pendant 1 heure et ajoute 10 cm3 d'eau distillée. Le mélange réactiorlnel est ramené à
une L~ él,~Lu.~ voisine de 20C, filtré sur verre fritté garni de célite. Le verre fritté
est rincé avec 50 cm3 d'un mélange acétate d'éthyle-di~,l.lu.u...éLl.~u~f (1-1 en
volumes). La phase aqueuse est séparée par flf~nt~tinn puis extraite par 10 cm3 de
dichlv.~,l.l0.Lalle~ Les phases organiques réunies sont séchées sur sulfate de
35 mslvnf~ei--m filtrées puis ~:or~ t-é~ à sec sous pressiori réduite (2,7 kPa) à 40C On
wo g5,l3271 ~ ~ 7 5 3 8 4 PCT~g4/0l283
23
obtient ainsi 4,39 g d'un solide jaune qui est purifié par ~Iu~ ,, .",1..~ à pression
sur 350 g de silice (0,063-0,2 mm) contenus dans une colonne de
4,5 cm de diamètre en éluant avec un mélange acétate d'éthyle-dichlu ~
(gradient d'élution de 0-100 à 5-95 en volumes). Les fractions ne contenant que le
5 produit recherché sont réurlies et ~~ ~ ~~ c~ à sec sous pression réduite (0,27 kPa) à
40C. On oWent ainsi 4,07 g de t butu~.r~,~l~lyl-3 diméthyl-2,2 phenyl4 oxazoli-d~l~,.,~l~y' 5-(4R,5S) de diacétoxy 4c~,10~ ~.~vrl~,.y-2a époxy-5~,20
hydroxy-1j3 oxo-9 ~ ' ' '' 7~ taxène-ll yle-13cc sous forme d'urLe
meringue blanche.
Ld tbuL~J~Ly~ yl-3 diméthyl-2,2 phényl-4 (~ .. y' 5
(4R,5S) de diacétoxy-4a,10~ beyloxy-2 époxy-5~,20 dihydroxy-113,7~ oxo-9
taxène-ll yle-13 peut être préparé dans les conditions decrites dans la demande, "~ "~lr- PCT WO 9209589.
EXFMPLE 2
A une solution de 500 mg de tert-bu~ y-~ul,o lyl-3 (méthoxy-4 phényl)-2
phényl-4 (.~ -1,3 ~ubu~liLud-5-(2R,4S,5R) d'acétoxy-4c~ dihydroxy-1~,2
époxy-5~,20 métll~,A~ y-10~ oxo-9 triéthylsilyloxy-7~ taxene-ll yle-13 dans
7 cm3 de ~L~ ydloruu~ e maintenue sous agitation et sous ~ os~ d'argon, on
ajoute ~uc~ -L, à une t~ laLuu~ oisine de -78~C, 0,9 cm3 d'une solution
1,4 M de n-butyllithium dans l'hexane et 279 mg de chlorure de L~rlub~ 6a~ y-3
benzoyle. La solution est ainsi maintenue agitée pendant 45 minutes puis on ajoute
10 cm3 d'une solution aqueuse saturée de chlorure ." Le milieu
est ramené à une ~.Il~ voisine de 20C en 1 heure. La solution obtenue est
versée dans un mélange de 50 cm3 d'acétate d'éthyle et 50 cm3 d'une solution aqueuse
saturée de chlorure ~I't~ La phase aqueuse est séparée par ~ nf~tjl~n puis
extraite par 2 fois 50 cm3 d'acétate d'éthyle. Les phases organiques sont réunies,
lavées par 50 cm3 d'eau distillée puis séchées sur sulfate de .. ~ ...., filtrées et
es à sec sous pression réduite (2,7 kPa) à 40C. On obtient 620 mg d'une
meringue blanche que l'on purifie par .,L"" ~t k.~ sur 200 g de silice (0,063-
30 0,2 mm) contenus dans une colonne de 2 cm de diamètre [éluant: acétate d'éthyle-
cyclohexane (10-90 en volumes)] en recueillant des fractions de 30 cm3. Les fractions
ne contenant que le produit cherché sont réunies et ~u~ ..u~S à sec sous pression
réduite (2,7 kPa) à 40C. On obtient 244 mg de tert-buLu,~y~;~ub~Jllyl-3 (méthoxy-4
phényl)-2 phényl4 f-vL~7-7lirlin~1,3 ~.ad~u~yli~ue-5 (2R,4S,5R) d'acétoxy4a
WO 95/13271 PCT/FR94101283 0
21 75384
24
-
époAy-5~,20 hydroxy-1~ ca~uAya~uA~y-10¦3 oxo-9 L iéa~ybilylvAy-7fl
(L inuvl~v~cLlloxy-3 1~.~vyluAy)-2a taxène-ll yle-13a sous forme d'une meringue
blanche et dont les . A Al ~ sont les suivantes:
- spectre de R.M.N. du proton (400 MHz; CDC13; ~ en ppm): 0,59 (q, J = 7,5 Hz, 6H: SiCH2 éthyle); 0,94 (t, J = 7,5 Hz, 9H: CH3 éthyle); 1,08 (s, 9H: (CH3)3);
1,19 (s, 3H: CH3); 1,21 (s, 3H: CH3); 1,62 (s, lH: OH en 1); 1,67 (s, 3H: CH3);
1,70 (s, 3H: CH3); 1,83 (s, 3H: COCH3); 1,85 et 2,50 (2 mts, lH chacun: CH2 en
6); 2,08 et 2,19 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,53 (s, 3H: OCH3);
3,73 (d,J=7Hz,lH:Hen3) ;3,84(s,3H:ArOCH3) ;4,07et4,22(2d,J=8,5
Hz, lH chacun: CH2 en 20); 4,18 (AB limite, J = 16 Hz, 2H: OCOCH2O); 4,43
(dd, J = 11 et 6,5 Hz, lH: H en 7); 4,58 (d, J = 5 Hz, lH: H en 2'); 4,87 (d large, J =
10 Hz, lH: H en 5); 5,43 (mt, lH: H en 3'); 5,62 (d,J = 7 Hz, lH: H en 2); 6,07 (t
large,J=9Hz,lH:Henl3);6,40(mt,1H:Hen5');6,46(s,1H:HenlO);6,93
(d, J = 8 Hz, 2H: H a.u.~.ah.lues en or~ho du OCH3); de 7,30 à 7,50 (mt, 7H: H
alulllali~ues et H alvlYIa~ u~ en méta du OCH3); 7,49 (d large, J = 7,5 Hz, lH: H
en 4 de l'alullla~ en 2); 7,53 (t, J = 7,5 Hz, lH: H en 5 de 1'~, . en 2);
7,90 (s large, lH: H en 2 de l'~uullla~i Lu1 en 2); 7,99 (d, J = 7,5 Hz, lH: H en 6 de
l'alulllali4ue en 2).
A une solution de 240 mg de tert-~uLuAy-,a~l~ alyl-3 (méthoxy-4 phényl)-2
phényl4 (~ ~1,3 ~albuAyli~u~-5-(2R,4S,5R) d'acétoxy~ époxy-513,20
hydroxy-1~ alVA~a.,~LVAy-10~ oxo-9 L ica.yl~ilylu.~y-7l3 (L inuv.ul..ca.vAy-3
1~,~4vylvAy)-2a taxène-ll yle-13a dans 4 cm3 de di.,hlvlvl~.~a~c, on ajoute, à une
L~ .a~u c voisine de 20C, 3,3 cm3 de compleAe L ica..~' acide Lluv~l~ydl;q--.
Le mélange réactionnel est agité pendant 4 heures à une L.ll~la~ voisine de 20Cpuis on ajoute 10 cm3 de ii~,l.lv., ' et 50 cm3 d'une solution aqueuse saturée
d'l~ydlu~ ocarbonate de sodium. La phase organique est décantée, lavée par 2 fois
50 cm3 d'une solution aqueuse saturée de chlorure de sodium puis séchée sur sulfate
de ~ filtrée et concentrée à sec sous pression réduite (2,7 kPa) à 40C. On
obtient 205 mg de tert-bu~vAy.,a.l)v.~yl-3 (méthoxy-4 phényl)-2 phényl4 1 ' '
1,3 ~,alboAyli~u~ 5-(2R,4S,5R) d'acétoxy-4a dihydroxy-1,3,7~ époxy-5~,20 méthoxy-
acétoxy-1013 oxo-9 (~.inuu~.,.c~l.uAy-3 1~vylvAy)-2a taxène-ll yle-13a sous
forme d'une meringue blanche et dont les A A~ ; sont les suivantes:
-spectre de R.M.N du proton (400 MHz, CDC13, o en ppm): 1,06 (s, 9H: (CH3)3);
1,24 (s, 3H: CH3); 1,28 (s, 3H: CH3); 1,56 (s, 3H: CH3); 1,65 (s, 3H: CH3);
1,85 (s, 3H: COCH3); 1,85 et 2,53 (2 mts, lH chacun: CH2 en 6); 2,08 et 2,21 (2
~ WOs~13271 2 1 7 5 3 8 4 Pcr~Rs4Jol2s3
~25
dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 2,35 (mf, lH: OH en 1); 3,53 (s, 3H:
OCH3); 3,72 (d, J = 7 Hz, lH: H en 3); 3,83 (s, 3H: ArOCH3); 4,08 et 4,22 (2 d,
J = 8,5 Hz, lH chacun: CH2 en 20); 4,25 (AB limite, J = 16 Hz, 2H: OCOCH2O);
- 4,37(dd,J=llet8Hz,lH:Hen7);4,58(d,J=5Hz,lH:Hen2');4,90(dlarge,
5 J=lOHz,lH:Hen5) ;5,43 (mt,lH:Hen3') ;5,62(d,J=7Hz,lH:Hen2);
6,13 (t large, J = 9 Hz, lH: H en 13); 6,31 (s, lH: H en 10); 6,39 (mt, lH: H en5'); 6,93 (d, J = 8 Hz, 2H: H ~ en ortho du OCH3); de 7,30 à 7,50 (mt,
7H: H ~ et H , en rr~éta du OCH3); 7,49 (d large, J = 7,5 Hz,
lH: H en 4 de l'ulullluii~l_., en 2); 7,54 (t, J = 7,5 Hz, lH: H en 5 de rblv.l.uLi lue en
2); 7,88 (s large, lH: H en 2 de r~ullluli~ en 2); 7,98 (d, J = 7,5 Hz, lH: H en 6
de l'u vlllu~ uè en 2).
A une solution de 200 mg de tert-bu~u~y~uLlJullyl-3 (méthoxy-4 phényl)-2
phényl-4 (~._,..l;~l;.~r 1,3 uubwylique-5-(2R,4S,5R) d'acétoxy-4a dihydroxy-1~,7époxy-5~,20 ~l~éLllu~u~é~u~y-lo~ oxo-9 (hinuulull~6il~v~y-3 1~.~vyluAy)-2a
taxène-ll yle-13a dans 3 cm3 de ," ' u~éll.~e anhydre et 0,120 cm3 de pyridine,
maintenue sous ~ ? .~ d'argon, à une ~elll~e~ voisine de 0C, on ajoute
goutte à goutte 0,125 cm3 ~ hide hinuv.. Il. ~ fvl iq~. La solution
orangéé obtenue est agitée 20 minutes à une ~.llpéLaLuue voisine de 0C puis on
additiomne 3 cm3 d'eau et 30 cm3 de di~lllv~u~éL~ e~ La phase organique est
20 décantée, lavée par 2 fois 20 cm3 d'une solution aqueuse saturée de chlorure de
sodium puis séchée sur sulfate de .. ~ .., filtrée et concentrée à sec sous pression
réduite (2,7 kPa) à 40C. On obtient 233 mg que l'on purifie par, - ,, , - sur
200 g de silice (0,063-0,2 mm) contenus d~ms une colonrle de 2 cm de diamètre
[éluant: di~llv~u~}~ ~ méthanol (98-2 en volumes)] en recueiLant des fractions de
25 10 cm3. Les fractions ne contenant que le produit cherché sont réunies et
à sec sous pression réduite (2,7 kPa) à 40C. On obtient 192 mg de tert-
bULV~Y~:U.IJU...YI-3 (méthoxy-4 phényl)-2 phényl-4 . .~ ~1,3 ~bv~L~_~, 5-
(2R,4S,5R) d'acétoxy-4a époxy-513,20 hydroxy-l~ ~l.6ill~A~u~v~y-10~ oxo-9
hiiluv~"~ r~"~ylu~y-7l3 ( ullléLllu-y-3 1~.~vylu~y)-2a taxène-ll yle-
13a sous forme d'une mermgue blanche et dont les . - ~. Ir ~ q ~ - sont les suivantes:
- spectre de R.M.N.du proton (400 MHz, CDC13, o en ppm): 1,07 (s, 9H: (CH3)3);
1,18 (s, 3H: CH3); 1,20 (s, 3H: CH3); 1,65 (s, lH: OH en 1); 1,72 (s, 3H: CH3);
1,84 (s, 3H: CH3); 1,92 (s, 3H: COCH3); 2,07 et de 2,10 à 2,25 (le~euLi~ dd
~:1 = 16 et 9 Hz) et mt, lH chacun: CH2 en 14); de 2,10 à 2,25 et 2,83 (2 mts, lH
chacun: CH2 en 6); 3,52 (s, 3H: OCH3); 3,83 (s, 3H: ArOCH3); 3,85 (mt, lH: H
wo 95113271 PCT~R94101283 ~
2 1 75384 26
en 3); 4,08 et 4,26 (2 d, J = 8,5 Hz, lH chacun: CH2 en 20); 4,14 et 4,22 (2 d, J =
16 Hz, 2H: OCOCH2O); 4,56 (d, J = 5 Hz, lH: H en 2'); 4,86 (d large, J = 10 Hz,
lH: H en 5); 5,43 (dd, J = 11 et 8 Hz, lH: H en 7); 5,46 (mt, lH: H en 3'); 5,66(d,J=7Hz,lH:Hen2);6,06(tlarge,J=9Hz,lH:Henl3);6,40(mt,1H:Hen
5'); 6,63 (s, lH: H en 10); 6,93 (d, J = 8 Hz, 2H: H ~ ; I en ortho du
OCH3); de 7,30 à 7,50 (mt, 7H: H r ' ~ et H ~ , en méta du
OCH3); 7,50 (d large, J = 7,5 Hz, lH: H en 4 de 1'blvll au4~ en 2); 7,56 (t, J = 7,5
Hz, lH: H en 5 de ralvl~.a i4u~, en 2); 7,89 (s large, lH: H en 2 de r . en
2); 7,99 (d, J = 7,5 Hz, lH: H en 6 de l'~u, . en 2).
Une solution de 190 mg de tert-l~u,v~y~,~ubvl~yl-3 (méthox,Y-4 phényl)-2 phé-
nyl-4 . .~ ,. .1i.1;,.~-1,3 ~ubw~yli4ue-5-(2R~4s~5R)-dlacétoxy4a épox~Y-513,20 hydrQxy-
1~ méthox~Yacétoxy-10~ oxo-9 llin~ "...~ r ...,~lv~y-7~ (11inuulvlllelllv~y-3
I;~ Lvylu~y)-2a taxène-ll yle-13a dans 3,2 cm3 d'une solution 0,1N d'éthanol chlor-
hydrique est maintenue sous agitation à une lelll~éla~ul~; voisine de 20C pendant 20
15 heures. Le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa) à
40C. Le produit brut obtenu est dissous dans 50 cm3 de di~,llvlvllléllla~., et 50 cm3
d'une solution aqueuse saturée de l~ de sodium. La phase organique est
séparée par ~ nt~tif)n puis extraite par 2 fois 50 cm3 de Lc~.llulvlllé~ . Les
phases organiques sont réunies, laYées par 50 c~n3 d'eau distillée puis séchées sur
20 sulfate de m~ m, filtrées et ~:ullcellLlées à sec sous pression réduite (2,7 kPa) à
40C. On obtient 175 mg d'une ~neringue Wanche que l'on purifie par ~ ' .. / .~,.1.1.;~
préparative sur plaque de silice de 0,5 mm d'épaisseur [éluant: di~hlvlvl~léll~aule-
méthanol (94-6 en volumes)]. On obtient 66 mg de tert- l y~bvllylallLulo-3
hydroxy-2 phényl-3 ~n~i (2R,3S) d'acétoxy4a époxy-5~,20 hydroxy-l~
25 I~ ~a~:é~ y-10~ oxo-9 I"n .,~"". ~ r~.. ,rlu~y-7~ nuululllélllv~y-3
I~.~vylv~y)-2a taxène-ll yle-13a sous forme d'une meringue blanche et dont les
lr~ sont les suivantes:
- Spectre de R.M.N.du proton (400 MHz, CDC13, ô en ppm): 1,22 (s, 3H: CH3);
1,26 (s, 3H: CH3); 1,37 (s, 9H: (CH3)3); 1,72 (s, lH: OH en l); 1,91 (s, 3H:
CH3); 2,07 (s, 3H: CH3); 2,26 et 2,89 (2 mts, lH chacun: CH2 en 6); 2,36 (mt,
2H: CH2 en 14); 2,37 (s, 3H: COCH3); 3,36 (d, J = 5 Hz, lH: OH en 2'); 3,54 (s,
3H:OCH3);3,97(d,J=7,5Hz,lH:Hen3);4,16et4,26(2d,J=16Hz,2H:
OCOCH2O); 4,17 et 4,34 (2 d, J = 8,5 Hz, lH chacun: CH2 en 20); 4,62 (d large,
J=5Hz,lH:Hen2');4,94(dlarge,J=lOHz,lH:Hen5) ;5,24(dlarge,J=10
Hz, lH: H en 3'); 5,36 (d, J = 10 Hz, lH: CONH); 5,49 (dd, J = 11 et 8 Hz, lH: H
WO 95/13271 ~ ~ 7 ~ 3 8 4 r~.,r ~4~01283
.27
en7);5,73(d,J=7Hz,lH:Hen2);6,17(tlarge,J=9Hz,lH:Henl3);6,73(s,
- lH: H en 10); de 7,30 à 7,50 (mt, 5H: H alUIllciiU,U~::I); 7,50 (d large, J = 7,5 Hz,
lH: H en 4 de 1'~ . en 2); 7,57 (t, J = 7,5 Hz, lH: H en 5 de r~u,llc~iuue en
2); 7,99 (s large, lH: H en 2 de l'cuu~l~cLi~ u~, en 2); 8,07 (d, J = 7,5 Hz, lH: H en 6
5 de l'hlv.l,cii~Lua en 2).
A une solutiorl de 66 mg de tert-~uLu. y.,c l.vllyl~u~iu~v-3 hydroxy-2 phényl-3
~ - (2R,3S) d'acétoxy-4a hydroxy-ll'~ époxy-51'~,20 ~ ;liv~.y~Ly-10
OXO-9 i ~ lu~y-71f~ r-3 ~.~vylu.~r)-2a taxène-ll
yle-13a dans 0,855 cm3 d'acétonitrile et 0,085 cm3 de i' ' r.llu~, on ajoute
suc~iv~lll~lL 200 mg de tamis mf " ' 4A en poudre et 100 mg de chlorure de
sodium Le mélange réactiomnel est maintenu sous agitation à une L~ cLuu~ voisinede 75C pendant 5 heures puis, à une L~l..,J~aLuu~ voisine de 20C, additionné de
75 cm3 de flifhl ' et de 50 cm3 d'une solution aqueuse saturée de chlorure
de sodium La phase organique est décantée, lavée par 2 fois 40 cm3 d'une solution
15 aqueuse saturée de chlorure de sodium puis séchée sur sulfate de ~ ' filtrée et
concentrée à sec sous pression réduite (2,7 l~a) à 40C. On obtient 110 mg que l'on
purifie par ~ "l,l ~.I~Li~, sur plaque de silice de 0,5 mm dépaisseur en
éluant avec un mélange cyclohexane-acétate d'éthyle (1-1 en volumes). On obtient30 mg de tert-l,uL~y~bu..yla l.;..o-3 hydroxy-2 phényl-4 ~ , -(2R,3S)
d'acétoxy-4a hydroxy-ll~ époxy-5~'~,20 llléLlluAyc~éLoAy-101f~ méthylène-71~,8 nor-l9
oxo-9 (ilinuulul~Lllu~y-3 1~.~urluAy)-2a taxène-ll yle-13a et dont les caracté-
ristiques sont les suivantes:
- Spectre de R.M.N.du proton (400 MHz, CDC13, ~ en ppm): 1,22 (s, 3H: CH3);
1,25 (s, 3H: CH3); 1,28 (s, 9H: (CH3)3); 1,38 (mt, lH: H en 7); 1,65 et 2,25 (2
mts, lH chacun: CH2 en 19); 1,80 (s, lH: OH en 1); 1,85 (s, 3H: CH3); 2,09 et
2,45 (le~euLiy~ .lL d et dt, J = 16 Hz et J = 16 et 4 Hz, lH chacun: CH2 en 6);
2,32 (mt, 2H: CH2 en 14); 2,32 (s, 3H: COCH3); 3,28 (mf, lH :H en 2'); 3,49 (s,
3H: OCH3); 4,00 et 4,27 (2 d, J = 8,5 Hz, lH chacun: CH2 en 20); 4,08 (d, J = 7,5
Hz, lH: H en 3); 4,13 (AB limite, J = 16 Hz, 2H: OCOCH2O); 4,57 (s large, lH:
Hen2') ;4,72(dlarge,J=4Hz,lH:Hen5) ;5,21 (dlarge,J=lOHz,lH:Hen
3'); 5,30 (d, J = 10, lH: CONH); 5,62 (d, J = 7 Hz, lH: H en 2); 6,19 (t large, J =
9 Hz, lH: H en 13); 6,39 (s, lH: H en 10); de 7,25 à 7,50 (mt, 5H: H aroma-
tiques); 7,44 (d large, J = 7,5 Hz, lH: H en 4 de l'hlUIllaLi.l~ en 2); 7,55 (t, J = 7,5
Hz, lH: H en 5 de l'hlolllaLiuu~, en 2); 7,99 (s large, lH: H en 2 de l'huul~laLi L~ en
2); 8,08 (d, J = 7,5 Hz, lH: H en 6 de l'alu,~,aLique en 2).
WO 9S/13271 PCT/E~94/01283 0
21 7538~
28
-
EXFMPI .F 3
Un mélange de 300 mg de tert-1,uLu,~y.,Gubu..ylGl~ o-3 hydroxy-2 phényl-3
(2R,3S) d'acétoxy-4a (cllloro-3 brc.L~uylu..y)-2a époxy-5~,20 hydroxy-1
~ calu;~yG~fcLu~Ly-10l3 OXO-9 IHnuu~ r~ ylu~y-7~ taxène-11 yle-13a, de
500 mg de chlorure de sodium et de 100 mg de tamis ' ' 4A activé, dans
3 cm3 d'acétonitrile et 0,6 cm3 de Li,~u~y~Lu~uuGul~ est chauffé au reflux pendant 3
heures. Après It r, ~ jusqu'à une i I Yoisine de 20C, le mélange est
filtré sur vere fritté garni de célite. Le filtrat eOt lavé avec 5 cm3 d'eau, puis la phaOe
organique est décantée, séchée sur sulfate de ~ ' Après filtration sur verre
fritté et .~ sous pression réduite (0,27 kPa) à une ~rJ~ fc~G~uurc voisine de
40C, on obtient 410 mg d'une meringue jaune-pâle que l'on purifie par
~,luul~laiu lGlJlLe prépGrative sur couche mince [12 plaques Ulri~JGLGLiV~Co Merck,
Kieselgel 60F254; épaisseur 0,25 mm; dépôt en solution dans le di~,hlulull~ca~G u,;
éluant: mélGnge méthanol-dichlulul,.,ca.G.~ (7-93 en volumes)]. Après élution de la
15 zone ~:UII~O~O~ GIII au produit principal par un mélange méthanol-dichlu.u~,li.~u.~,
(10-90 en volumes), filtration sur verre friKé, puis f~a~ulaLiùll des solvants sous
pression réduite (0,27 kPa) à une Irclll~rcla~uuc voisine de 40C, on obtient 136,8 mg
de tert-l,uLu~y~a-bullylalll;llu-3 hydroxy-2 phényl-3 ~rlu~riullc~ (2R,3S) d'acétoxy-4a
(chloro-3 1~.~uylu~y)-2a époxy-5~,20 hydroxy-1~ lcLllu~ya~;riLu~y-10~ méthylène-7,813 oxo-9 nor-19 taxène-11 yle-13a sous forme d'une meringue blanche dont les
" sont les suivantes :.
- Spectre de R.M.N. du proton (400 MHz; CDC13 ;o en ppm): 1,22 (s, 6H: CH3);
1,26 (s, 9H: (CH3)3); 1,37 (mt, lH: H en 7); 1,67 et 2,34 (2 mts, lH chacun: CH2en 19); 1,78 (s, lH: OH en 1); 1,85 (s, 3H: CH3); 2,10 et 2,44 (Ir,o~Li~ ' d
et dt, J = 16 Hz et J = 16 et 4 Hz, lH chacun: CH2 en 6); 2,23 (mt, 2H: CH2 en
14); 2,34 (s, 3H: COCH3); 3,26 (mt, lH: OH en 2'); 3,49 (s, 3H: OCH3); 3,98 et
4,27(2d,J=8,5Hz,lHchacun:CH2en20);4,07(d,J=7,5Hz,lH:Hen3);
4,15 et 4,22 (2 d, J = 16 Hz, 2H: OCOCH2O); 4,57 (mt, lH: H en 2'); 4,73 (d
large,J=4Hz,lH:Hen5);5,22(dlarge,J=lOHz,lH:Hen3');5,30(d,J=10
Hz,lH:COl~H);5,60(d,J=7Hz,lH:Hen2);6,20(tlarge,J=9Hz,lH:Hen
13); 6,40 (s, lH: H 10); de 7,20 à 7,50 (mt, 5H: H alull.aLiq~); 7,44 (t, J = 7,5
Hz, lH: H en 5 de l'alul..a~ique en 2); 7,57 (d large, J = 7,5 Hz, lH: H en 4 del'alul.l~liqu,c en 2); 8,02 (d, J = 7,5 Hz, lH: H en 6 de l'~uulll~liir~u~ en 2); 8,14 (s
Iarge, lH: H en 2 de l'~uulllaLi~u~c en 2).
WO95/13271 2 ~ 7 5 3 8 4 PCT11;~94/01283
29
Le tert-buLuAyualbu~lyla~llulo-3 h~droxy-2 phényl-3 ~ . (2R,3S)
d'acétoxy-4 (chloro-3 I~VYIUAY)-2 époxy-5~,20 hydroxy-1~ u~a~ uAy-
10~ oxo-9` i ~'' ' ' '' ylUAy-713 taxène-ll yle-13 peut être préparé de la
manière suivante:
Une solutic~n de 770 mg de tert-l~uluAy~bullyl-3 (méthoxy-4 phényl)-2
phényl 1 ...~ ; 1,3 ~,albv~y' -5-(2R,4S,5R) d'acétoxy-4a (chloro-3
b~l~vylu,~y)-2a époxy-513,20 hydroxy-113 oxo-9 i ~ .,,1v~y-7
taxène-11 yle-13a dans 20 cm3 d'une solution d'acide chlullly~' l 0,1N dans
l'éthanol est agitée à une ~.~ .a~ ; voisine de 5C pendant 16 heures. Le mélange
réactionnel est ensuite dilué aYec 50 cm3 de dichlulvllwlLa l~, lavé par 2 fois 10 cm3
d'eau distillée. Après extraction de la phase aqueuse par 10 cm3 de Lu;lv~
Ies phases organiques sont ".~ . ;, séchi es sur sulfate de ~ filtrees sur
verre fritté et ~:u--~,e ,l-é,aO sous pression réduite (0,27 kPa) à une t~,.l.~lal~ vvisine
de 40C. On obtient ainsi 7io mg d'un solide jaune que ron purifie par
cl~. ,.,.-.. ,~, .. l.l. ~ à pression ~ sur 50 g de silice (0,063-0,2 mm)
contenus dans une colonne de 2 cm de diamètre en éluant avec un gradient d'élution:
acétate d'éthyle-ll;l l-l.. ,.. ':l --.. de 10-90 à 20-80 en volumes et en recueillant des
fractions de 10 cm3. Les frdctions ne contenant que le produit cherché sont réunies et
~:UI~.,.ILl~O à sec sous pression réduite (0,~7 kPa) à 40C pendant 2 heures. Onobtient ainsi 594 mg de tert-l,u~u~y.,all,u.lylc.. ulu-3 hydroxy-2 phényl-3 ~
(2R,3S) d'acétoxy-4 (chloro-3 ~.~vylu~y)-2a époxy-513,20 hyd~xy-113 méthoxy-
acétoxy-1013 oxo-9 i~ uu~ r~ lVAy-7~ taxène-ll yle-13a sous forme
d'une meringue jaune pâle dont les ~ sont les suivantes:
- spectre de R.M.N. du proton (400 MHz; CDC13; ~ en ppm): 1,23 (s, 3H: CH3);
1,24 (s, 3H: CH3); 1,38 (s, 9H: (CH3)3); 1,68 (s, lH: OH en 1); 1,90 (s, 3H:
CH3); 2,08 (s, 3H: CH3); 2,26 et 2,88 (2 mts, lH chacun: CH2 en 6); 2,31 (mt,
2H: CH2 en 14); 2,41 (s, 3H: COCH3); 3,35 (mt, lH: OH en 2'); 3,54 (s, 3H:
OCH3); 3,95 (d, J = 7,5 Hz, lH: H en 3); 4,15 et 4,35 (2 d, J = 8,5 Hz, lH chdcun:
CH2 en 20); 4,16 et 4,25 (2 d, J = 16 Hz, 2H: OCOCH2O); 4,64 (mt, lH: H en 2');
4,95 (d large, J = 10 Hz, lH: H en 5); 5,26 (d large, J = 10 Hz, lH: H en 3'); 5,37
(d,J=lOHz,lH:CONH);5,48(dd,J=10,5et8Hz,lH:Hen7);5,70(d,J=7
Hz,lH:Hen2);6,19~tlarge,J=9Hz,lH:Henl3);6,73(s,1H:HenlO);de
7,30 à 7,50 (mt, 5H: H alUllUlli~lU~o); 7,48 (t, J = 7,5 Hz, lH: H en 5 de
l'aromatique en 2); 7,62 (d large, J - 7,5 Hz, lH: H en 4 de l'~ullld~._ en 2); 8,00
WO95/13271 PcrlFR94101283 1~
2 ~ 75384
-
(d, J = 7,5 Hz, lH: H en 6 de l'h..,ll.dtique en 2); 8,11 (s large, lH: H en 2 de
rdl~ dli~lU~ en 2).
Le tert-buLvAyu~l,-u.yl-3 (méthoxy-4 phényl)-2 phényl4 f ~ - 1,3
I,~ lbuAy' -5-(2R,4S,5R) d'acétoxy-4a (chloro-3 1,w~rh,Ay)-2a époxy-5~,20
5 hydroxy-llfj oxo-9 L-in,,~ r~ f~ Ay-7lf~ taxène-ll y~e-13a peut être
préparé de la manière suivante:
A une solution de 680 mg de tert-buh.Ar~ul~.yl-3 (méthoxy-4 phényl)-2
phényl-4 ~ " " ~ 1,3 ~,o.lbUAy- ' 5-(2R,4S,SR) d'acétoxy-4a (chloro-3 benzoyl-
oxy)-2a époxy-51f~,20 dihydroxy-llf~,71f~ oxo-9 taxène-ll yle-13a dans 7 cm3 de
10 ~ f et 0,43 cm3 de pyridine anhydre, on ajoute à une t~ Luue
Yoisine de 20C du tamis ' ' 4A en poudre. A la suspension arnsi obtenue, on
ajoute, à une ~ d~uUe voisine de -30C, sous d~lllU~ C inerte d'argon,
0,445 cm3 d'anhydride triflique. Après avoir laissé la ~t:llllJ~.l~UU~: du mélange
réactionnel remonter jusqu'au VU~,__.fj.,.l~ 20C en environ 1 heure, on ajoute
succ~ivt:"~elll 5 cm3 d'eau distillée et 50 cm3 de tiifhl.. ,.. :l - f~ puis on filtre le
tamis sur verre fritté garlu de célite. Après rl~ ;f n, la phase aqueuse est extraite
par 2 fois 5 cm3 de ~ ll- f Les phases organiques sont .~ f~
séchées sur sulfate de m~ei-- n, filtrées sur verre fritté, et ~ tlW~ SOUS pression
réduite (0,2~ kPa) à une i , c~ voisine de 40C. On obtient ainsi 1,13 g d'une
meringue brune que l'on purifie par, ' ,, , ' à pression , ' ~ - sur
60 g de silice (0,063-0,2 mm) contenus dans une colonne de 2 cm de diamètre en
éluant avec un gradient d'élution acétate d'éthyle-fiirhl ' de 0-100 à 10-90
.en volumes et en recueillant des fractions de 10 cm3. Les fractions ne contenant que
le produit cherché sont réunies et ~:or._~.t~ à sec sous pression réduite (0,27 kPa) à
40C pendant 2 heures. On obtient ainsi 762 mg de tert-~.,vAy~albull.yl-3 (méthoxy4
phényl)-2 phényl4 I -, .l; l:~r~1,3 u~ul~y' 5-(2R,4S,5R) d'acétoxy-4a (chloro-3
lic.~yluAy)-2a époxy-5~,20 hydroxy-ll~ oxo-9 ~in~,., yl,JAy-7,~
taxène-l l yle-13a sous forme d'une meringue jaune-orangée dont les . ... Ir. ;~1;~1....
sont les suivantes:
- spectre de R.M.N. du proton (400 MHz; CDC13; o en ppm): 1,08 (s, 9H:
(CH3)3); 1,20 (s, 6H: CH3); 1,61 (s, lH: OH en 1); 1,71 (s, 3H: CH3); 1,85 (s,
3H: CH3); 1,95 (s, 3H: COCH3); 2,08 et de 2,10 à 2,30 (.. ~e~ ~iv, dd (J = 16
et 9 Hz) et mt, lH chacun: CH2 en 14); de 2,10 à 2,30 et 2,84 (2 mts, lH chacun:CH2 en 6); 3,53 (s, 3H: OCH3); 3,85 (s, 3H: ArOCH3); 3,85 (mt, lH: H en 3);
4,09 et 4,28 (2 d, J = 8,5 Hz, lH chacun: CH2 en 20); 4,15 et 4,23 (2 d, J = 16 Hz,
WO95113271 2 1 75384 I~l/r ~Cl~os
31
2H: OCOCH2O); 4,58 (d, J = 5 Hz, lH: H en 2'); 4,87 (d large, J = 10 Hz, lH: H
en5);5,42(dd,J=lOet7Hz,lH:Hen7);5,45(mt,1H:Hen3');5,65(d,J=
7 Hz, lH: H en 2); 6,06 (t large, J = 9 Hz, lH: H en 13), 6,42 (mt, lH: H en 5');
- 6,61 (s, IH: H en 10); 6,94 (d, J = 8,5 Hz, 2H: H ~uvlllaLi Luci~ en ortho du OCH3);
de 7,30 à 7,50 (mt, 8H: H ~ et H h ~ en méta du OCH3); 7,45
(t, J = 7,5 Hz, lH: H en 5 de r~uu.l.~ Liilu~ en 2); 7,62 (d large, J = 7,5 Hz, lH: H en
4 de 1'alv~Li4~.~ en 2); 7,92 (d, J = 7,5 Hz, lH: H en 6 de r~, , en 2); 8,01
(s large, lH: H en 2 de 1'~ en 2).
Le tert-buLv~y~ Jvll.yl-3 (méthoxy-4 phényl)-2 phényl4 ~ P 1~3
C~ v~y' 5-(2R,4S,5R) d'acétoxy-4a ~chloro-3 1~.~VylVAy)-2~ époxy-5~,20
dihydroxy-113,7~ oxo-g taxène-ll yle-13a peut être préparé de la manière suivante:
A une solution de 800 mg de tert-b~u~y~ vllyl-3 (méthoxy-4 phényl)-2
phényl-4 ~ ,3 i;c~l~v~- -5-(2R,4S,5R) d'acétoxy4a (chloro-3 benzoyl-
oxy)-2a époxy-5~,20 hydroxy-113 oxo-9 Lii~a~yl~ilylvAy-7~ taxène-ll yle-13a dans8cm3 de dichlu.v.l,caloll~, maintenue sous ,.1.. ~.1,"~* d'argon, on ajoute goutte à
goutte, à une i. .l.~él~u~c voisine de 0C, 8,5 cm3 du complexe acide lluvLllyiLiilu*-
L i~a.~ld l.i le (3HF.Et3N). La solution est agitée pendant 4 heures à 0C, puis diluée
par 20 cm3 de dichlvlv...ca.l.~, et versée sur 40 cm3 d'une solution aqueuse saturée
en hydrogénocar'conate de sodium maintenue à une tU~ ' C voisine de 0C.
20 Après ~-IP~ la phase aqueuse est extraite avec 3 fois 30 cm3 de
di~Llu~v~*Ll~dl~. Les phases organiques .,.~ sont séchées sur sulfate de
1..~,~.. ..11 filtrées sur verre fritté, puis i VII~.,llLicc~ sous pression réduite (0,27 kPa)
à une Lc-l-~l~Luic voisine de 40C. On obtient ainsi 781 mg d'une meringue jaune pale
que l'on purifie par ~,l.l~.,.. ~ ~U,~ à pression ~ i- , sur 100 g de silice
(0,063-0,2 mm) contenus dans une colonne de 3,5 cm de diamètre en éluant avec unmélange achate d'éthyle-dichlulv.l.cLlldlie (25-75 en volumes) et en recueillant des
fractions de 15 cm3. Les fractions ne contenant que le produit cherché sont réunies et
i,O.~,.ltli',C~ à sec sous pression réduite (0,27 kPa) à 40C pendant 2 heures. On
obtient ainsi 686 mg de tert-1,uLuAyi;~ul,ullyl-3 (méthoxy-4 phényl)-2 phényl4
~ .. P-1,3 c~ul~u~ yld~c-5-(2R,4S,5R) d'acétoxy-4a (chloro-3 L~vylu~y)-2a
époxy-5~,20 dihydroxy-1~,7~ oxo-9 taxène-ll yle-13a sous forme d'ume meringue
blanche dont les car~r~ri~tiq~P~ sont les sui~antes:
- spectre de R.M.N. du proton (400 MHz; CDC13; o en ppm): 1,08 (s, 9H:
(CH3)3); 1,12 (s, 3H: CH3); 1,25 (s, 3H: CH3); 1,58 (s, 3H: CH3); 1,64 (s, lH:
OH en 1); 1,66 (s, 3H: CH3); 1,86 et 2,54 (2 mts, lH chacun: CH2 en 6); 1,88 (s,
WO95113271 2 1 7 5 ~ 8 4 PCT/FR94101283 0
32
3H: COCH3); 2,08 et 2,21 '~2 dd, J = 16 et 9 Hz, lH chacun: CH2 14); 2,32 (d, J =
4Hz,lH:OHen7);3,54(s,3H:OCH3);3,71(d,J=7Hz,lH:H3);3,83(s,
3H: ArOCH3); 4,08 et 4,24 (2 d;J = 8,5 Hz, lH chacun: CH2 en 20); 4,26 (AB
irnite, J = 16 Hz, 2H: OCOCH2O); 4,37 (mt, lH: H en 7); 4,61 (d, J = 5 Hz, lH:
5 Hen2') ;4,91 (dlarge,J=lOHz, lH:Hen5) ;5,43 (mt, lH:Hen3') ;5,60 (d,J=
7Hz,lH:Hen2);6,14(tlarge,J=9Hz,lH:Henl3);6,30(s,1H:HenlO);
6,40 (mt, lH: H en 5'); 6,94 (d, J = 8,5 Hz, 2H: H ~ en ortho du OCH3);
de 7,30 à 7,50 (mt, 8H: H uv,..aLiq.,w et H ~ er. méta du OCH3); 7,45
(t, J = 7,5 Hz, lH: H 5 de rAromatique en 2); 7,61 (d large, J = 7,5 Hz, lH: H en 4
de l'a,vl.la~ ua en 2); 7,92 (d, J = 7,5 Hz, lH: H en 6 de l'alvlllaii~u~ en 2); 8,03 (s
large, lH: H en 2 de l'alvllla~iu,u~, en 2).
Le tert-buLv~y~all)b~ l-3 (méthoxy-4 phényl)-2 phényl-4 1 ~ ~ - 1,3
~;clbv~ylaL~-5-(2R,4S,5R) d'acétoxy-4a (chloro-3 1~.wylv~y)-2a époxy-51'~,20
hydroxy-ll'~ oxo-9 L~iét~ ilylu~.y-71'~ taxène-ll yle-13a peut être préparé de la
15 manière suivante:
A une solution de 2,5 g de tert-1,uLu,y~bù..yl-3 ~méthoxy-4 phényl)-2
phényl-4 f)~7f)liflinf~1,3 ~bv~y' 5-(2R,4S,5R) d'acétoxy-4a dihydroxy-11'~,2a
époxy-51'~,20 lllelllw~ya~e~u~y-lo!3 oXo-9 Llié~'~y~ilylwy-71~ taxène-ll yle-13a dans
25 cm3 de L~L al~y~vr~ maintenue sous agitation et sous ~ d'argon, on
ajoute ~u~f~i~ , à une Lt,.np. ~a~uuè Yoisine de -78C, 3,90 cm3 d'une solution
1,6M de n-butyllithium dans l'hexane et 0,8 cm3 de chlorure de métachlu,vbel.,vyle.
La solution est ainsi agitée à une ~ a~b.e Yoisine de -78C pendant 45 minutes
puis on ajoute 10 cm3 d'une solution aqueuse saturée de chlorure ,~.' Le
mélange réactionnel est ramené à ume t~ p6~a~ voisine dé 20C en 1 heure et dil.ué
par 20 cm3 d'acétate d'éthyle. La phase aqueuse est separée par f~ puis
extraite par 2 fois 10 cm3 d'acétate d'éthyle. Les phasw organiques sont réunies,
lavées par 10 cm3 d'eau distillée, séchées sur sulfate de ,, Après fil.tration et
fA~ à sec sous pression réduite (2,7.~'a) à 40C, on obtient 3,47 g d'une
meringue jaune pâle que l'on purifie par A'iU- ~ SUr 250 g de silice (0,063-
0,2 mm) contenus dans une colonne de 5 cm de diamètre en éluant avec un gradientd'élution acétate d~éthyle-flirh~ f de 3-97 à 10-90 en volumw et en
recueillant des fractions de 15 cm3. Les fractions ne contenamt que le produit cherché
sont réunies et ~:u..~ es à sec sous pression réduite (2,7.~Pa) à 40~C. On obtient
1.41 g de tert-.,...v,.y.,al~v..yl-3 (méthoxy-4 phényl)-2 phényl4, ' ' -1,3
35 caulJv~y' 5-(2R,4S,5R) d'acétoxy-4a (chloro-3 ~.wylv~y)-2a époxy-51'~,20
WO 9~113271 2 1 7 5 3 ~ 4 PCT/~94~01283
33
-
hyd~oxy~ oxo-9 Llié1Lyl~ily~u~y-7lf~ taxène-ll yle-13a sous forme d'une meringueblanche dont les f ~ sont les suivantes:
- spectre de R.M.N. du proton (400 MHz; CDC13; S en ppm): 0,60 (q, J = 7,5 Hz, 6H: SiCH2 éthyle); 0,95 (t, J = 7,5 Hz, 9H: CH3 éthyle); 1,08 (s, 9H: (CH3)3);
1,19 (s, 3H: CH3); 1,21 (s, 3H: CH3); 1,62 (s, lH: OH en 1); 1,65 (s, 3H: CH3);
1,70 (s, 3H: CH3); 1,85 (s, 3H: COCH3); 1,85 et 2,51 (2 mts, lH chacun: CH2 en
6); 2,08 et 2,19 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,53 (s, 3H:
OCH3); 3,71 (d, J = 7,5 Hz, lH: H en 3); 3,84 (s, 3H: ArOCH3); 4,07 et 4,24 (2
d, J = 8,5 Hz, lH chacun: CH2 en 20); 4,15 et 4,22 (2 d, J = 16 Hz, 2H:
OCOCH2O); 4,42 (dd, J = 10 et 6 Hz, lH: H en 7); 4,60 (d, J = 5 Hz, lH: H en 2');
4,88(dlarge,J=lOHz,lH:Hen5);5,42(mt,1H:Hen3');5,60(d,J=7,5Hz,
lH:Hen2);6,08(tlarge,J=9Hz,lH:Henl3);6,40(mt,1H:Hen5');6,45
(s, lH: H en 10); 6,93 (d, J = 8,5 Hz, 2H: H alulllaLi~u~ en ortho du OCH3); de
7,30 à 7,50 (mt, 8H: H d.u.l.aLi~ues et H a.u...aLiqu~ en meta du OCH3 et H en 5 de
I'alullla~i~uè en 2); 7,61 (d large, J = 7,5 Hz, lH: H en 4 de l'~uulllaiillu~. erl 2); 7,94
(d, J = 7,5 Hz, lH: H en 6 de 1'a.u...aii4ua en 2); 8,03 (s large, lH: H en 2 de l'a-u--.aLi~ua en 2).
Le tert-buLu~y~allJullyl-3 (méthûxy-4 phényl)-2 phényl-4, ~ -1,3
~,albu~laLe-5 (2R,4S,5R) d'acétoxy-4a dihydroxy-1~,2a époxy-51'~,20 méthoxy-
acétoxy-101'~ oxo-9 lliéLil.rl~ilylu~y-7lf~ tdxène-ll yle-13a peut être préparé dans les
conditions décrites dans lâ demande n~slP PCT WO 94/20484.
Les nouveaux produits de formule générale (I) ~ - rr~ une activité
inhibitrice s;~ ricdLiv~ de la ~ r,~ cellulaire anormale et possèdent des
propriétés thf-r.orf-~tif~ permettdnt le trditement de malades ayant des c~ditions
rothfllflgifl~lf-~ associées à une y~uliré~aLiull cellulaire anormale. Les c~mditions
r~th~llogj~ incluent la ~IvlirélaLivll oellulaire anormale de cellules malignes ou
non malignes de divers tissus et/ou organes, ~UIIl~ lal.~, de manière non limitative,
les tissus Illu~uldile~, osseux ou ronjfm~tifc la peau, le cerveau, les poumons, les
organes sexuels, les systèmes Iy~ llau~lue~ ou rénaux, les cellules ou
- 30 sanguines, le foiê, I'appareil digestif, le pancréas et les glandes thyroldes ou
adrénales. Ces conditions pathologiques peuvent inclure également le psoriasis, les
tumeurs solides, les cancers de l'ovaire, du sein, du cerveau, de la prostate, du colon,
de l'estomac, du rein ou des testicules, le sarcome de Kaposi, le .1 .~ u.v."e,
le choriocarcinome, le ,leu ul,la~LvlJle~ la tumeur de WiLms, la maladie de Hodgkin,
35 les m~l~n~mps~ les myélomes multiples, les leuoémies lyllllJllv~,~Lau~ .,1.~ , les
.
Wo 95113271 Pcr~94101283 ~
2 1 753~4
34
l~vmphomes granulocytaires aigus ou chroniques. Les nouveaux produits ælon
rinvention sont palliuuli~ A,. utiles pour le traitement du cancer de l'ovaire. Les
produits selon l'invention peuvent être utilisés pour prévenir ou retarder l'apparition
ou la 1éà~ali1iol- des conditions r thn1n~ C ou pour traiter ces conditiorls
5 r^~hnln~flllf c
Les produits selon l'invention peuvent être ~ ' à un malade ælon
différentes formes adaptées à la voie d'~ f~ choisie qui, de préférence, est
la voie pal~1Lrl~llf. L' ' par voie I ' comprerld les administra-
tions illi~a~ --r ~ r Ou sous-cutanée. Plus particu-
10 lièrementpréféréeest~ r ~ -' ~,1,~... ;..1.,.1~1;~-",'.,l.~ Oumtla~lfu~e.
La présente invention comprend également les ~ ;..f~c pharmaceu-
tiques qui ~ au moins un produit de formule générale (I) en une quantité
suffisante adaptée à l'emploi en 1~ )e~ humaine ou vétérinaire. Les comro-
sitions peuvent être préparées selon les méthodes habituelles en utilisant un ouplusieurs adjuvants, supports ou excipients ~ A~ff~ )lf~ Les
supports ~ lableo incluent les diluants, les milieux aqueux stériles et divers
solvants non toxiques. De préférence les ~ se présentent sous forme de
solutions ou de ~ aqueuses, de solutions mjectables qui peuvent contenir
des agents ~ ;r;- 1 ~, des colorants, des ~ l Va~irO OU des Ct~ tC
Le choix des adjuvants ou excipients peut être déterminé par la solubilité et
les propriétés chimiques du produit, le mode particulier d'~l,.;~ '-,-1;..1 et les
bonnes pratiques 1.1. -- r ~ `r~
Pour ls~l~l ~;~1,,,1;,.,, ~ '`, on utilise des solutions ou des suspen-
sions stériles aqueuses ou non aqueuses. Pour la ~1;pa aliO1l de solutions ou de25 S ~l-r l~ non aqueuses peuvent être utilisés des huiles végétales naturelles telle
que l'huile d'olive, rhuile de sésame ou rhuile de paraffine ou les esters organiques
injectables tel que l'oléate d'éthyle. Les solutions stériles aqueuses peuvent être
constituées d'une solution d'un sel ~ IA r~ f ~ - ~ acceptable en solution dans
de l'eau. Les solutions aqueuses ~".~;.,.,...,..~ pour 1' ' ~ , dans
30 la mesure où le pH est ~11~ ajusté et où risotonicité est réalisée, par
exemple, par une quantité suffisante de chlorure de sodium ou de glucose. La
qtf~riliclltinn peut être réalisée par chauffage ou par tout autre moyen q~u n'altère pas
Il est bien entendu que tous les produits entrant dans les . . selon
35 I'invention doivent être purs et non toxiques pour les quantités utilisées.
WO 95/13271 PCT/F~94/01283
2 1 75384
Les .~ "~ peuvent contenir au moins 0,Ol % de produit thérapeuti-
quement acti La quantité de produit actif dans une ~ ;"" est telle qu'une
posologie convenable puisse être prescrite. De préférence, les ~ sont
- préparées de telle façon qu'une dose unitaire contienne de 0,Ol à lO00 mg environ
5 de produit actif pour l~Y~ I r ~ 1 par voie ~GIC.IICL~
Le traitement Ih' nl~ t~ peut être effectué ~ ~ avec d'autres
traitements 11~, npe~ P~ incluarlt des ' " ~ ~ 1 5, des anticorps
r~ , des tnérapies v. ou des ~ ou des
' ~ des réponses hi~ girll.P~ Les m~iifir^~l~ des réponses incluent, de
10 manière non limitative, les ly~ lluhillci~ et lcs cytokines teDes que les
Ies interférons (a, 13 ou o) et le INF. D'autres agents rh;mi~ utiles
dans le traitement des désordres dus à la luLuli~ld~iu l anormale des cellules incluent,
de manière non limitative, les agents alkylants tels que les moutardes à l'azotecomme la .~P11~ le c:y, ~ , le melphalan et le rhl~lrPm~ril~
15 des sulfonates d'alkyle comme le busulfan, les l iLIusuu cc~ comme la ~ , la
lomustine, la sémustine et la SLL. ~ r, les triazènes comme la ~ ; r, les
hlll, ~ comme les analogues de l'acide folique tel que le I~ uLl~Gh~ les
analogues de pyrimidine comme le rluOIuuldcil et la cytarabine, des analogues de
purines comme la --c ~ r et la l~ g~ ~ ~,1,r~ des produits naturels hls que les20 alcaloides de vinca comme la vinblastine, la vincristine et la vendésine, desé~ipudùl,l,yllotoxines comme l'étoposide et le teniposide, des .~ ~ ;1,;, l1 .q P~ comme la
dG~Li~u~y~ e~ la ~1-- ~. . 1;; lP, la dU~UIUbiL,In~, la l~léu...~ , la I " .rc_._ et la
yuille~ des enzymes comme la ~-'IJ~ - . des agents divers comrne les
complexes de 1 ~ ;, . du platine hl que le cisplatine, les urées substituées hl
25 que I~IIYdLU~UILSCI les dérivés de IllcLll~DlydLG~ul~, comme la ~/IUL~I ' ', les
SUI~I)I'C~CUL:~ aLILP~ -U~ r~ oomme le mitotane et r l "Igl ~t~ ', les
hormones et les ...,l~gl~ oomme les a~iL,~locu,l;-,u~Lcluid~ comme la
prednisone, les ~JlUo_.,Lilici, comme le caproate Llll~LUAy~ f ~, I'acétah de
lllcLllw~yluruoc~Lélull~ et l'acétate de megestrol, les oc~Lluowl~s oomme le
30 diéthyistilbestrol et l'cL~l~llyD,_..ddiul, les antioestrogènes comme le Ld~l~u~if~ " Ies
androgènes comme le propionate de ~ci~Lu~Lc~u~lc et la auu~y...csLclu..~.
Les doses utilisées pour mettre en oeuvre les méthodes selon rinvcntion
sont celles qui permettent un traitement ~u,ul~ylacLi~uc ou un maximum de réponse
r Les doses varient selon la forme d'n~ , le produit particu-
lier sélectiomné et les .;GI ~ propres du sujet à traiter. En g&éral, les doses
wo 95113271 PCT~94/01283~
2 ~ ~5384
36
sont celles qui sont Illé.~ efficaces pour le traitement des désordres dusà une ~ulir~ ;ul- cellulaire anormale. Les produits ælon rinvention peuvent être
administrés aussi souvent que nécessaire pour obtenir l'effet ~ u~ désiré.
Certains malades peuvent répondre .AI~ n 1 à des doses l~laLi~ fortes ou
5 faibles puis avoir besoin de doses d'entretien faibles ou nulles. Gf~ -- t, defaibles doses seront utilisées au début du traitement et, si nécessaire, des doses cle
plus en plus fortes seront ' jusqu'à l'obtention d'un effet optimum. Pour
d`autres malades il peut être nécessaire ~1' ' des doses d'entretien 1 à 8 fois
par jour, de préférence 1 à 4 fois, selon les besoins ~ Cv l du malade
10 considéré. Il est aussi possible que pour certains malades il soit nécessaire de
n`utiliser qu'une à deux ' ILiuns j~ "` ~i.,.
Chez l'homme, les doses sont v ' comprises entre 0,01 et
200 mg/kg. Par voie ;,,I,,.I..'.;I,.l~lr les doses seront en général comprises entre 0,1
et 100 mg/kg et, de préférence entre 0,5 et 50 mg/lcg et, encore plus ~1~ if;,l.,..,...~
entre 1 et 10 mg/kg. Par voie illL~ , les doses sont ePn5r~1rnnPnf comprises
entre 0,1 et 50 mg~g et, de préférence entre 0,1 et 5 mg/kg et, encore plus SpéCifi-
quement entre 1 et 2 mg/kg. Il est entendu que, pour choisir le dosage le plus
approprié, devront être pris en compte la voie ~ le poids du malade,
son état de santé général, son âge et tous les facteurs qui peuvent influer sur refficacité
20 du traitement.
L'exemple suivant illustre une rflm3~citir~n selon l'invention.
.XF~ PLE
On dissout 40 mg du produit obtenu à l'exemple 1 dans 1 cm3 d"' 'j ' EL
620 et 1 cm3 d'éthanol puis la solution est diluee par addition de 18 cm3 de sérum
25 physiologique.
La ~ est ~tlminiefT~c par perrusion pendant 1 heure par intfoduc-
tiûn dans du soluté physiologique.