Note: Descriptions are shown in the official language in which they were submitted.
21 90~5l
wo 95133736 P~llr~
I
NOUVE~UX TAXOIT)E~. LFUR PRF.PARATrON _T I F.~ COMPOSITION.
PHARMACEUTIOUES OUI r.F.~ CONTIFNNF.~T
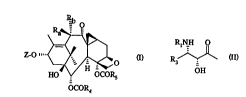
La présente in~ention concerne de nouveaux taxoides de formule générale:
~ .
zo,~ <~ (I)
HO OCORs
OCOR4
5 dans laquelle:
Ra représente tm atome d'~ .LUs~,... ou un radical hydroxy, alcoxy contenant
1 à 4 atomes de cat-bone, acyloxy conterlant 1 à 4 atomes de carbone ou
al~.u~ y dont la partie alcoyle contient 1 à 4 atomes de carbone et Rb
représente un atome d';~y~hu~ ou bien Ra et Rb forment ensemble avec l'atome de
10 carbone auquel ils sont liés une fonction cétone,
Z représente un atome d'hr~u~ c ou un radical de formule générale:
RNH O
~(11)
OH
dans laquelle:
R1 représente un radical berr~oyle C.. " substitué par un ou
15 plusieurs atomes ou radicaux, identiques ou différents, choisis parmi les atomes
d'halogène et les radicaux alcoyles contenant 1 à 4 atomes de carbone, alcoxy
contenant 1 à 4 atomes de carbone ou i ^ u~l.C~le, thénoyle ou furoyle, ou un
radicar R2-O-CO- dams llequel R2 représente:
- um radical alcoyle colltenamt 1 à 8 atomes de carbone, alcényle contenant 2 à 8
20 atomes de carbone, arcynyle contenant 3 à 8 atomes de carbone, ~lual~vyle
contenamt 3 à 6 atomes de carbone, ~.,lu~ r'r, contenant 4 à 6 atomes de carbone,
b;~, ' ' ,yl~, contenamt 7 à 10 atomes de carbone, ces radicaux étant éV~t~ ~pntsubstitués par un ou phlsieurs ' choisis parmi les atomes d'halogène et les
radicaux hydroxy, alcoxy contenant 1 à 4 atomes de carbone, ~ ;uy;~ul~v dont
25 chaque partie alcoyle c,ontient 1 à 4 atomes de carbone, pipéridino""~
pipérazinyl-1 (;.. . ~...11. --- ..; substitué en -4 par un radical alcoyle contenant 1 à 4
2 1 9065 1
WO 95133736 ~ r~
atomes de carbone ou par un ra~lical phénylalcoyle dont la partie alcoyle contient 1 à 4
atomes de carbone), ~, ~ le contenant 3 à 6 atomes de carbone, ey~ le
contenant 4 à 6 atomes de carbone, phényle (;. 'I substitué par un ou
plusieurs atomes ou radicaux choisis parnu les atomes d'halogène et les radicaux5 alcoyles contenant 1 à 4 atomes de carbone ou alcoxy contenant 1 à 4 atomes decarbone), cyano, carboxy ou -' y1~1~...~r1~, dont la partie alcoyle contient 1 à 4
atomes de carbone,
- un radical phényle ou a- ou ~naphtyle ;. ~I substitué par un ou plusieu~s
atomes ou radicaux choisis pammi les atomes d'halogène et les radicaux alcoyles
10 contenant 1 à 4 atomes de carbone ou alcoxy contenant 1 à 4 atomes de carbone ou
um radical }.~,t~ ~ aromatique à 5 chaînons choisi de préférence parmi les
radicaux furyle et thiényle,
- ou un radical llé~é~ lyle saturé contenant 4 à 6 atomes de carbone ;. ~l~t~.~tsubstitué par un ou plusieurs radicaux alcoyles contenant 1 à 4 atomes de carbone,
R3 represente un radical alcoyle droit ou ramifié contenant 1 à 8 atomes de
carbone, alcenyle droit ou rami~ié contenant 2 à 8 atomes de carbone, alcynyle droit
ou ramifié contenant 2 à 8 atomes de carbone, ~ k ' ,~ contenant 3 à 6 atomes decarbone, phényle ou a- ou ~naphtyle ~ substitué par un ou plusieurs
atomes ou radicaux choisis parmi les atomes d'halogène et les radicaux alcoyles,20 alcényles, alcynyles, aryles, aralcoyles, alcoxy, alcoylthio, aryloxy, arylthio, hydroxy,
' .yl~" mercapto, forrnyle, acyle, acylamino, ~' ~ ' y~l~.~l-
amino, amino"' ,y' , ~ J' 1, carboxy, rl~.,~l~..~1~" ~ILb~lllVyl~.,
y ~ l~b~ yle~ cyano, nitro et l,;ll ~,.~ Ih.~ ou un
~t..~.;le aromatique ayant 5 chaînons et contenant un ou plusieurs ~
25 identiques ou différents, choisis parmi les atomes d'azote, d'oxygène ou de soufre et
~" '1--- substitué par un ou plusieurs ' identiques ou différents,
choisis parmi les atomes d'~lalogène et les radicaux alcoyles, aryles, amino,
' ,~' ~, ~' ' ~' , I' ~.,~1~.~' , acyle, ~I~I,u..;l~" cyano,
carboxy, ~ ' ' yle~ Lale~l~ Jyle ou r~ y~,~l~l;l~" étant
30 entendu que, dans les ' des radicaux phényle, a- ou ~naphtyle et
l~t;~ Ies radicaux alcoyles et les portions alcoyles des autres
radicaux, 1 à 4 atomes de carbone et que les radicaux alcényles et
alcynyles 2 à 8 atomes de carbone et que les radicaux aryles sont des
radicaux phényles ou a- ou ~naphtyles, et
R4 et Rs, identiques ou différents, I~,~JI~' '
2 1 9r365 1
WO 9a/33736 P~ . . /sa
- tln radical alcoyle droit ou ramifié contenant 1 à 8 atomes de carbone, alcényle
droit ou ramifié conteltant 2 à 8 atomes de carbone, alcyltyle droit ou ramifié
contenant 2 à 8 atomes ~e carbone, ~.y~,lual~,vyl~ contenant 3 à 6 atomes de carbone,
~,lual~;.Ayl~ contenaltt 4 à 6 atomes de carbone ou L~,y.,loal~;~,y~, contenant 7 à 11 atomes de carbone, ces radicaux étant e.. 'I substitués par tm ou plusieurs
choisis parnti les atomes d'halogène et les radicaux hydroxy, alcoyloxy
contenant 1 à 4 atomes de carbone, ~' ' y' , dont chaque partie alooyle
contient 1 à 4 atomes de carbone, pipéridino, ...ul~l.uli.to, pipérazinyl-l
(évPnt-.Pll substitué en -4 par un radical alcoyle contenant 1 à 4 atomes de
10 carbone ou par un radicsl phénylalcoyle dont la p~trtie alcoyle contient 1 à 4 atomes
de carbone), ~;y~,lu~lcuylt contenant 3 à 6 atomes de carbone, ~;y,' ' ' Jle
contenant 4 à 6 atomes de carbone, phényle .,.. ~lP~pnt substitué, cyano,
carboxy ou a!~yl~J~.yl~l..bullylc dont la pattie alcoyle oontient 1 à 4 atomes de
carbone,
15 - ou un radical aryle i,.. 'lPr~pnt substitué par un ou plusieurs atomes ou radicaux
choisis panmi les atomes d'halogène et les radicaux alcoyles, alcényles, alcyttyles,
aryles, aralcoyles, alco~y, alcoylthio, aryloxy, aryltltio, hydroxy, }~J~itU~y ' ~y~"
mercapto, formyle, ac~le, acylamino, ~uuy' , ' y~ullyl-amino~ amino,
y ~, ~ y ' , carboxy, r~ y~ lyl~
20 dialcuy' ' ~I~., cyalto, nitro, azido, i ~ U...~ Ou l n . ~ y,
ou un radical I u~,y~,lyl~, saturé ou non saturé contenant 4 à 6 chatnons et
'.. " substitulé par un ou plusieurs radicaux alcoyles contenant 1 à 4
atomes de carbone,
étant entendu que Rs ne peut pas représenter un radical méthyle,
25 étant entendu que les radicaux ~;y~,luilc~ ' ' ' jl~ ou b;~y~l~JalC~Jy
peuvent être ~,. 'l- substitués par un ou plusieurs radicaux alcoyles
contenant 1 à 4 atomes dle carbone.
De préférence les radicaux aryles pouvant ~tre représelttés par R3, R4 etlou
Rs sont des radicaux phényles ou a- ou ,~naphtyles ,.. " substitués par un
30 ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène (fluor, chlore,
brome, iode) et les radicaux alcoyles, alcényles, alc~nyles, aryles, ~y' ' ".~ " alcoxy,
alcoylthio, atyloxy, atylthio, hydroxy, IIJ~U~ .YI~" mercapto, fotmyle, acyle,
acylamino, ~uuy' ), -' y.,~l,u..y' . amino, ~' ,y' ), ~"' y- .
carboxy, :' Y~ULbVIIJ~ J1C~ " ~ ,J' ' ~YIt, c~ano, nitro, azido,
35 i " ' ' yl~, et i~irlu.u~v~t.61~Ay, étautt entendu que les radicaux alcvyles et les
21 90~1
wo 95/33736 r--llr~ a
portions alcoyles des autres radicdux ~ 1 à 4 atomes de carbone, que les
radicaux alcényles et alcynyles, 2 à 8 atomes de carbone et que les
radicaux aryles sont des radicaux phényles ou a- ou ~naphtyles, et que le radical Rs
ne peut pas représenter un radical méthyle.
De préférence les radicaux II~L~ ,L~u~ pouvant être .C~I' par R3,
R4 et/ou Rs sont des radica~x h~f,.u~ ,L~ dtiqu~ ayant 5 cha~ons et
contenant un ou plusieurs atomles, identiques ou différents, choisis parmi les atomes
d'azote, d'oxygène ou de soufre, c.. " substitués par un ou plusieurs
identiques ou dif~érents, choisis parmi les atomes d'halogène (fluor,
10 chlore, brome, iode) et les ra~icaux alcoyles contenant 1 à 4 atomes de carbone,
aryles contenant 6 à 10 atomes de carbone, alcoxy contenant 1 à 4 atomes de carbone,
aryloxy contenant 6 à 10 atomes de carbone, amino, ~ o contenant 1 à 4
atomes de carbone, d;AI~YI~ IV dont chaque partie alcoyle contient 1 à 4 atomes de
carbone, acylamino dont la partie dcyle contient 1 à 4 atomes de carbone,
15 -' ~w,l~..~ contenant 1 à 4 atomes de carbone, æyle contenant 1 à 4
atomes de carbone, ~uyl~lvllyl~ dont la partie aryle contient 6 à 10 atomes de
carbone, cyano, carboxy, ~,A bA llvyl~ JI~,A. Ir~ , dont la partie alcoyle contient
1 à 4 atomes de carbone, ~ ~b~IU~1C dont chaque partie alcoyle contient 1 à 4
atomes de carbone ou ' y~ , dont la partie alcoxy contient 1 à 4 atomes de
20 carbone.
Plus ~ ~lt, la présente invention concerne les produits de formule
générale a) dans laquelle Ra représente un radical hydroxy, alcoxy contenant 1 à 4
atomes de carbone, æyloxy contenant 1 à 4 atomes de carbone ou r~ t.,~
dont la partie alcoyle contient 1 à 4 atomes de carbone et Rb représente un atome
25 d'llydluO~.le, Z représente un atome d'l~ o-~ ou un radical de formule générale
(II) dans laquelle R1 représente un radical benzoyle ou un radical R2-O-CO- daiAs
lequel R2 représente un radical tert-butyle et R3 repri~sente un radical alcoylecontenant 1 à 6 atomes de calbone, alcényle contenant 2 à 6 atomes de carbone,
~. ' ' yl~, contenant 3 à 6 atomes de carbone, phényle c~ r.A-~nt substitué par
30 un ou plusieurs atomes ou radicaux, identiques ou différents choisis parmi les atomes
d'halogène (fluor, chlore) et les radicaux alcoyles (méthyle), alcoxy (méthoxy),LI.f,l}lr- 3, æylamino (a~,f.l~- ), r~ bullyldl~ 0 (tert-
) ou l~ill "~,.. ':hyl~ Ou un radical furyle-2 ou -3, thiényle-2 ou
-3 ou thiazolyle-2, -4 ou -5 et R4 représente un radical phényle C.. 'I~r.A.~nt
35 substitué par un ou plusieurs atomes ou radicaux, identiques ou différents, choisis
W09503736 2 1 '?~511 r~l/r~-l ~Ja
parmi les atomes d'halogène et les radicaux alcoyles, alcoxy, amino, ' ~I~.~v,
d;dl~vy' , æylamint, ' r~l,ul.y' azido, ~ VlVII._t~ylt et trifluoro-
méthoxy, ou un radical thiényle-2 ou -3 ou furyle-2 ou -3 et Rs représente un radical
alcoyle ~_.. " substitué contenant 1 à 4 atomes de carbone, étant entendu
5 que Rs ne peut pas représenter un radical méthyle.
Plus ~ ` encore, la présente invention concerne les produits de
formule générale (I) dans laquelle Ra représente un atome d'lly~ut_l.t ou un radical
hydrvxy ou acétyloxy ou Illclllu~fcl~,.,tu~y et Rb représente un atome d'~ue,~ .." Z
représente un atome d'l-~d~u~ ou un radical de formule générale (II) dans laquelle
10 Rl représtnte un radical l~enzoyle ou un radical R2-O-CO- dans lequel R2 représente
un radical tert-butyle et R3 représente un radical isobutyle, i~vl).,.L.l.rlt, butényle,
CIVI.~AYIC~ phényle, furyle-2, fu~yle-3, thiényle-2, thiényle-3, thiazolyle-2,
~u~vl~, 1 ou thiazolyle-5 et R4 représente un radical phényle C.. 'l
substitué par un atome d'llalogène et Rs représente un radical alcoyle contenant 2 à 4
15 atomes de carbone.
Les produits de îormule générale (I) dans laquelle Z représente un radical de
formule générale (II) présentent des propriétés ,...1 ~....,.~,.1. et
udl~lf ~.
Selon la presentt invention, les produits de formule générale (I) dans laquelle
20 Ra represente un atome ~,rhJ~u~,_.l~, ou un radical alcoxy, acyloxy ou alw~c~y,
Rb représente un atome ~rl~y-l-ut_..~" R4, Rs et Z sont définis comme 1
peuvent être obtenus par action d'un halogénure de métal alcalin (chlorure de sodium,
iodure de sodium, fluorure de potassium) ou d'un azoture de métal alcalin (azoture de
sodium) ou d'un sel d' quaternaire ou d'un phosphate de métal alcalin sur
25 un produit de formule générale:
~=b
~2-CF3
<~
HO OCORs
OCOR4
dans laquelle Z, R4 et Rs sont définis comme 1~ f ~ S :. Ra représente un atome
~ ydlu~,;..~, OU un radical alcoxy, acyloxy, ~ ,u~ y~clu~ ou un radical hy~roxy
WO9~D3736 2 1 9 0 ~ ~1 P~llr. r ,~ ~
protégé, et Rb représente un atome (1 }l~dlVL~ suivi, si nécessaire, du
du 6l~ , protecteur porté par Ra par un atome d'llydl~
1~ ~ t, la réaction est effectuée dsns un solvant organique choisi
parnu les éthers (~ally~ dii~~ .ylel~lel, méthyl tert-butyléther) et les
5 nitriles ~7 ~ ) seul ou en mélange a une ~ el~ule comprise entre 20C et la
. ' d'ébullition du mél7Jnge .
Le produit de formule générale lIII) dans laquelle Z représente un radical de
formule générale (II) peut êtr~ obtenu par ~ .~. r~ .. d'un produit de formule
générale:
~ lO-SO2-CF3
HO ~
HO OCOR5
OCOR4
dans laquelle R4, Rs sont défirlis comme 1~l, ' t, et Ra représente un atome
dll~ J6~ ou un radical alcoxy, acyloxy, ' ,~éL~ y ou un radical hydroxyprotégé, et Rb représente un atome dll~ Jr~lle, au moyen d'un acide de formule
générale:
l N 6
R~OH
O-R~ ~
dans laquelle Rl et R3 sont définis comme ~ ' t, ou bien R6 représente un
atome d'll.~L~J~_.. , et R7 représente un v . protecteur de la fonction
hydroxy, et ou bien R6 et R7 forment ensemble un hétérocycle saturé à 5 ou 6
cha3^nons, ou d'un dérivé de cet acide ~our obtenir un ester de formule générale:
n
R~ \ .R6 ~O2-CF3
R/JIO~ ~ (VI)
R~ HO - OCORs
OCOR4
2 1 ~06~ ~
WO 95133736 1 ~ J~
dans laquelle Ra~ Rb, Rl, R3, R4, Rs, R6 et R7 sont définis comme ~ t,
suivi du ., "~ 1 des c vu~.~ L protecteurs reprQsentQ par R7 et/ou R6 et
R7 par dQ atomQs d'l~yu~uc_. ~ et i,~. ..1,.. 11 ., ..1 Ra~ lorsqu'il représente un radical
acyloxy, 31~a.,é~y ou un radical hydroxy protégé, par un radical hydroxy.
L~ ;.;r~ au moyen d'un acide de formule générale (V) peut étre
effectuée en présence d'un agent de .Y~n~ (.,a l~liiu..lde, carbonate réactif) et
d'un agent d'activation ~ .iliinQ) dans un solvant organique (éther, Qter,
cétonQs, nitriles, Il.~Lu~,al'~ Q i.l,~ 1U.,O1I/UIW ~1 I -- . halogénés,
l~dluuall ~ O~ ` à une ~ ' comprise entre -10 et 90C.
L'~ ~ -, r;, ~ ;. ", peut aussi être r~alisée en utilisant l'acide de formule
générale (V) sous forme ~ y~Lide en opérant en présence d'un agent d'~ulivali,an(àl~iu~u~lidil~.,) dans un solvant organique (éthers, Qters, cétones, nitriles,
Lu~ ;IJ -~ ~I . Ily~Lu~,alb, w ~ halogénés, ;I.yJlul,alb
uu....,Liqu~) à ume i . d comprise entre 0 et 90C.
L'~ , ;r,. ~ peut aussi être réalisée en utilisant l'acide de formule
générale (V) sous forme d" 'o,, , ou sous forme cl' ',~idd avec un acide
aliphatique ou aromatique, éVPnt--Pll préparé in situ, en présdnce d'une base
(amine aliphatique tertiaire) en opérant dans un solvant organique (éthers, esters,
cétones, nitriles, II~Lu~,~bul~ -'.' , ;Iy~u~ bu~ ; halogénés,
~u~bu-~s ~uulllaii~ ) à une . ' comprise entre 0 et 80C
Lorsque Ra repr~ésente un c~ . protecteur de la fonction hydroxy. Ra
est de préférence un radi~al trichloro-2,2,2 i:a-u~,~bull~lu~y.
De prdférence, R6 reprdsentd un atome d'h.r~uc`~._ et R7 reprdsente un
c uu~-l~ protecteur de la fonction hydroxy ou bien R6 et R7 forment ensemble un
l~ luu~ule saturé à 5 ou 6 chaînons.
Lorsque R6 représente un atome d'l..~uc~ , R7 représente de préférence
un radical -.Ca-u~ al~le, éthoxy-1 éthyle, l~.~lu,.~ ' ~11" hi.~.sll-yl~il~le~
hi~llyl~ilylc, ~hi~ hybilyL~ yl..~al.rl~, l~,~lu~ ~ubu...~ ou tetrahydro-
pyrannyle.
Lorsque R6 et Rj forment ensemble un 11~: élu.,y.,ll" celui-ci est de
préférence un cycle oxazolidine C,. ~ mono-substitué ou gem-disubstitué en
position -2.
Le l~ . des ~ 1 protecteurs R7 e~lou R6 et R7 par des
atomes d'h.r~uc~l~ et C.. " de Ra par un radical hydroxy peut être
35 effectué, selon leur nature de la manière suivante:
wo 95/~3736 2 1 9 0 6 1 P~ ~/r~ a
1) lorsque R6 représente un atome dl,~Lv~èi.~ et R7 représente un ~ r
protecteur de la fonction hydroxy, Ra représente un radical alcoxy, acyloxy ou
alcv~a~ vi~y~ le . '- des " . IJIvLcl,~.ua par des atomes
y~J~`JL~ s'effectue au mo~en d'un acide minéral (acide ' ' J~' , , acide
5 sulfurique, acide nuvll.J~i~uc) ou organique (acide acétique, acide méthane-
sulfonique, acide ~inu~ , acide p l~ fvniq~) utiliæ æul
ou en mélarlge en opérant dans un solvant organique choisi parmi les alcools, les
éthers, les esters, les hJ~v~ L ~ ' . les lly~Lv~,al~uL~
halogénés, les llydlv~l/~,s ~u, . ou les nitriles à une ~ lawlc: comprise
10 entre -10 et 60C,
2) lorsque R6 représente un atome d'l~y~v~ et R7 représente un ~;.. -.1~.. l
protecteur de la fonction hydroxy, Ra représente un radical trichloro-2,2,2
~L~Iv/~y~auLIvllylv~y, le 1~ du ~VU~ protecteur R7 est effectué dans
les conditions décrites ci-dessus sous 1) et celui de Ra par traitement par le ~inc,
15 C.. " associé à du cuivre, en présence d'acide acétique à une
comprise entre 30 et 60C ou au moyen d'un acide minéral ou organique tel que
racide chlorhydrique ou l'acide acétique en solution dans un alcool aliphatique
contenant 1 à 3 atomes de carbone (méthanol, éthanol, propanol, iaV~ . I) ou
dans un ester aliphatique (acétate d'éthyle, acétate d'iav~lv~yle acétate de n butyle) en
présence de zinc ~.. ~.. Il.. ~ associé à du cuivre,
3) lorsque R6 et R7 forment ensemble un hétérocycle saturé à 5 ou 6 chainons et plus
particuLièrement un cycle, ' ' de formule générale:
R~-N><O (VII)
R~ R9
dans laquelle Rl est défni comme ~nl ' t, R8 et Rg, identiques ou différents,
25 I~l,.. un atome d'~ ~v~ ou' un radical aleoyle eontenant 1 à 4 atomes de
earbone, ou un radical aralcoyle dont la partie alcoyle eontient 1 à 4 atomes deearbone et la partie aryle représente, de préférence, un radieal phényle
C.. 'I~rn~nt substitué par un ou plusieurs radieaux alcoxy eontenant 1 à 4 atomes
de earbone, ou un radieal ar~le . . t, de préférence un radieal phényle
30 C.. 'Ir~m nt substitué par un ou plusieurs radieaux aleoxy eontenant 1 à 4 atomes
de earbone, ou bien R8 reprévente un radieal alcoxy eontenant 1 à 4 atomes de
2 1 q~6~ 1
wo ss~33736 P~ rA,S.. /a~
carbone ou un radical trh~ m~thyle tel que ~ ;hlu~u~ yle ou un radical phényle
substitué par un radical trl~lr)mpthyle tel que ~ l.lu.u...éLllyle et Rg représente un
- atome d'l~ylllu~ , ou bien R8 et Rg forment ensemble avec l'atome de carbone
auquel ils sont liés un cy,cle ayant 4 à 7 chaînons, et Ra représente un radical acyloxy
5 ou ~l~,v~a~tu~y oU trichloro-2,2,2 ~ u~y~ bullylu~y, le, ."~ 1 du
~, , protecteur formé par Ro et R7 par des atomes I'I.~Lu~ , et de Ra par
un radical hydroxy peut être effectué, selon les ~i~ ' de Ra~ Rl, R8 et Rg, de
la manière suivante:
a) lorsque Rl représente un radical tert-buLu,.y.,~ul,ullyL,, R8 et Rg,
10 identiques ou différents, I~l;~.lt~ un radical alcoyle ou un radical aralcoyle
~benzyle) ou aryle (phényle), ou bien R8 représente un radical i ' ' ' yl~. ou un
radical phényle substitué par un radical ~lillalu~ -yle, et Rg représente un atome
d'llyJIut~ , ou bien R8 et Rg forment ensemble un cycle ayant de 4 à 7 ch~ûnons, le
traitement de rester de formule génerale (Vl) par un acide minéral ou organique
15 C. " dans un solvant organique tel qu'un alcool conduit au produit de
formule générale:
3~b
a~O O-SO2-CF3
OH ~O (VIII)
HO OCORs
OCOR4
dans laquelle Ra~ Rb, R3, R4 et Rs sont définis oornme ~ - - qui est acylé
au moyen de ch~orure de benzoyle dans lequel le noyau phényle est ;. "
20 substitué, de chlorure de thénoyle, de chlorure de furoyle ou d'un produit de formule
générale:
R2-O-CO-X (IX)
dans laquelle R2 est c~éfini comme ~., ' et X représente un atome
d'halogène (fluor, chlore) ou un reste -O-R2 ou -O-CO-O-R2, pour obtenir un produit
25 de formule générale:
WO 9S/33736 2 1 9 0 6 5 1 P~T/FR95100735
Rb
a~O ~ O-SO2-CF3
R,-NH O ~/ ~
R3 ~O ~ ,~o (X)
HO . ~ OCORs
OCOR4
dans laquelle Ra~ Rb, Rl, R3, R4 et Rs sont définis comme ~.lf~ f.l..,... ~ dont le
i~, protecteur Ra~ Ic~3qu'il représente un radical hydrvxy prvtégé~ est
remplacé, si nécessaire, p;3r un radical hydroxy.
De préférence, le produit de fvrmule générale (VI) est traité par l'acide
formique à une ~ la~ uG Yoisine de 20C.
De préférence, I'acylativn du prvduit de forrnule générale (VIII~ au moyen
d'un chlorure de benzoyle d~3ns lequel le radical phényle est c.. " substitué,
de chlorure de thénoyle ou de clllorure de furvyle ou d'un prvduit de formule générale
10 (IX) est effectuée dans un sol-~ant organique inerte choisi parmi les esters tels que
l'acétate d'éthyle, I'acétate ~ vi~ivpylG ou l'acétate de n.butyle et les lly~vl,iuiJuuGI~
~ I - i halogénés tels que le ~-'' "' ou le dich'ioro-1,2 éthane en
présence d'une base rninérale tei'ie que le l ' de sodium ou organique tei'ie
que la liiGlh~' - La réaction est effectuée à une ~Gil~ iUG cvmprise entre 0 et
1550C, de préférence voisine de 20C.
De préférence, le ,' du g~v ~ prvtecteur de Ra~ lorsqu'il
représente um radical trichloro-2,2,2 .' r~ bvl~.~lvi~y, est effectué dans les
conditions décrites pll ' ' sous 2),
b) lorsque Rl représente un radicali benzoyle ~ mP~lt substitué,
20 thénoyle ou furoyle ou un ri3dical R2O-CO- dans lequel R2 est défini comme
,.é ' t, R8 représente ~n atome ~li'llyd~vi ~i.., ou un radica'i a!icoxy contenamt
1 à 4 atomes de carbone ou un radical phényle substitué par un ou plusieurs radicaux
alcoxy contenant 1 à 4 atvmes de carbone et Rg représente un atome ~ v"`.l~, Ie
.' du ~VU~G..I~.lL protecteur formé par R6 et R7 par des atomes
25 ~li'llyd~v~ , s'effectue en présence d'un acide minéral (acide ch'ivllly~Liq~, acide
sulfurique) ou orgsnique (acide acétique, scide ll.6LIii~i~ 3 rv~i;q~ scide
i~inuvl~ ' C~ ique, acide r~ . ) utilisé seuli ou en mélsnge en
quantité '~ ' . ou catalytique, en opérant dans un solvant organique
2 ~ 9~
WO 95133736 r~,l/r~ a
11
choisi parmi les alcools, les éthers, les esters, les l~u~ ' GS ~ U~, les
llylLu~ubuuGs ~ halogénés et les ]I.~'d~Ul,allJUlGa uulllaiiqu~ à une
t~ GlaLl..G comprise erltre -10 et 60C, de préférence entre 15 et 30C et le
" "~ du ~-, protecteur de Râ~ lorsqu'il représente un radieal
5 trichloro-2,2,2 ;;h~l~wbu~ylu~y par un atome cll~y~ub~i.c, s'effectue dans les conditions décrites pl~' ' sous 2).
4) lorsque Ra représente un radical alcoxyacétyle et R6 et R7 sont définis comme au
point 1) ci-dessus, on effectue d'abord le l~ du ~IUUp~.l..,.l; protecteur R7
par un atome d'llyLue,~ilc en opérant dans les conditions acides décrites au point 1)
10 ci-dessus, puis remplace évl~ntllpllpmpnt Ra par un radical hydroxy par traitement en
milieu alcalin ou par action d'un halogénure de zinc dans des conditions qui ne
touchent pas au reste de la molécule. GPnP~l t, le traitement alcalin est effectué
par action de l'ammoniac en milieu hydro-alcoolique à une ~GllI~.al~G voisine de20C. é ' t, le traitement par un halogénure de zinc, de pré~férence l'iodure
15 de zinc est effectué dans le méthanol à une ~ a~uue voisine de 20C.
5) lorsque Ra représente un radical al~u~Lya.,é.v,-y et R6 et R7 sont définis comme au
point 2-a) ci-dessus, on effectue le l~--r~ ' du radical Ra par un radical
hydroxy par traitement en milieu alcalin ou par traitement par un halogénure de zinc
dans les conditions décri~es au point 3) ci-dessus, puis traite le produit de formule
20 générale (VI) obtenu dans les conditions de délJlu.~ iull et d'acylation décrites au
point 2-a) ci-dessus.
6) lorsque Ra représente ~un radical ~I.,v~ tv~y et R6 et R7 sont définis comme au
point 2-b) ci-dessus, on effectue le .~ - . l du radical Ra par un radical
hydroxy par traitement en. milieu alcalin ou par traitement par un halogénure de zinc
25 dans les conditions décrites au point 3) ci-dessus, puis traite le produit obtenu dans
les conditions décrites au point 2-b) ci-dessus.
Selon rinvention, les produits de formule genérale (III) dans laquelle R4 et
Rs sont définis oomme l ' t, Ra représente atome dll.~uo~ ou un
radical alcoxy, acyloxy ou -' ~ , v,.y, et Rb représente un atome d'h.~uL~ " ou
30 bien Ra et Rb forment ensemble avec l'atome de carbone auquel ils sont lie;s, une
fonction cétone et Z représente un atome d hyll~ peuvent être obtenus par actiond'un dérivé de l'acide ~linuul. ' lfonique tel que l'anhydride ou le N-phényl
'.' ' ''~ ' sur un produit de formule générale:
wos~l33736 2 1 ~ 0 6 5 1 P_~/r~ /~a
12
=b
~/ ~
HO OCORs
OCOR4
dans laquelle Ra~ Rb, R4 et Rs Sont définis comme ~,.~, .1., . ,.... I
C. ~ 1 t, la réaction s'effectue dans un solvant organique inerte
(Il,ydl~ubulca ~ éVf~t..~ ' halogénés, l~ydlu~,a buul,D alullldti~ucD) en
5 présence d'une base organique telle qu'une arnine tertiaire aliphatique (ui~,~lallull~)
ou la pyridine à une t~ a~ . comprise entre -50 et +20C.
Les produits de formule générale (Xl) dans laquelle R4 et Rs sont définis
comrne ~CA' ' t, Ra représente un atome d'hydrogène ou un radical alcoxy,
dCylOXy ou al~u~a~tu~ ou un radical hydroxy protégé, Rb représente un atome
10 d'~ u~ e, peuvent être obtelllus par action de l'acide lluu~ d~ ~ ou de l'acide
hinuul~ ', dans un solvant organique basique, tel que la pyridine
.. " substituée par un ou plusieurs radicaux alcoyles contenant 1 à 4
atomes de carbone, ou la ~ ' - c~.-.h.. Il. .~ 1 en association avec un solvant
organique inerte tel que le chlorure de méthylène ou l' '~ ou le
15 t;~dlyJIl ' à une ~.ll~.a~ulc compriæ entre 20 et 80C sur un produit de
formule générde:
b
G -O ~
HO OCORs
OCOR,,
dans laquelle R4 et Rs sont définis comme ~ ...."..,l Ra représente um atome
d'h~u~ , ou un radical alcoxy, acyloxv ou dl~,u~ au~u~ ou un radical hydroxy
20 protégé, Rb représente un atome d'}.r~Lut_.l~, et les symboles Gl, qui sont identiques
l~JII un radical triacoylsilyle.
-
21 90~5~
WO 951337361 P~, I /r 1
13
Le produit de formule générale (XII) peut être obtenu par action d'un produitde formule générale:
- R-Y (XIII)
dans laquelle R représente un radical alcoyle, alcanoyle ou -' y~ yle ou un
. UU~~ L protecteur ~e la fonction hydroxy et Y représente un atome d'halogène
sur un produit de formule générale:
G -O l l " ~ (XIV)
HO OCORs
OCOR4
dans laquelle R4, Rs et Gl sont défilus comme l"~
Lorsque R représente un radical alcoyle ou al~u~y~yl~ il est
10 particulièrement aYantageux d'opérer dans un solvant organique basique tel que la
pyridine ou dans un solvant organique inerte tel que le chlorure de méthylène, le
~LIulu~u.. , ou le dichloro-1,2 éthane en présence d'une an~ine tertiaire telle que la
hi~ ou la pyridine à une i , ~ voisine de 0C.
Lorsque R représente un radical alcoyle, il est l l,.. l:~.~^-.. l avantageux15 de métaUer I ' ' la fonction hydruxy en -10 au moyen d'un hydrure alcalin
(hydrure de sodium) vu d'un alcoylure métallique (I,uly'' ' ).
Le produit de fvrmule générale (XIV) et év~nn~ le produit de
formule générale (XII) peuvent être obtenus par action d'un dérivé ~ ;r ... ~ iq~-
de formule générale:
R4-M (XV)
dans laquelle R4 est défini comme 1~ '' et M représente un atome
métallique, de préférenc~^, un atome de lithiur.. ou de O ' sur un produit de
formule générale:
W095/33736 2 1 9 5 ' ~ 1 P~.lrh ,~
Rb
~ O Cl
G - ~ (XVI)
O OCORs
o~o
dans laquelle Ra~ Rb, Rs et Gl sont définis comme I
~ '- t, la réaction est effectuée d3ns un solvant organique tel qu'un
éther (t~ti~l ` à une Ic...~ i inférieure à -503C, de préférence voisine
5de-78C.
Le produit de formule genérale (XVI) peut êke obtenu par ~ d'un
produit de formule générale:
Rb
Gl-O "" ~ ~. ;XVII)
O OH
dans laquelle Ra~ Rb et Gl so~t défirlis comme ~Lé~' t, au moyen d'un acide
10de formule générale:
Rs-COOH (XVIII)
d3ns laquelle Rs est défini comme I ' ' t, ou d'un dérive de cet acide tel
qu'un halogénure ou un anhyd~ide en présence d'un agent de, ' ou d'une
base minérale ou organique.
Le produit de formule générale (XVII) peut être obtenu par action d'un
produit de formule générale (Xm) sur un produit de formule g~nérale:
2190G5~
wo 95133736 r~ rl _ I /.5a
~Gl
G -O ~ (XIX)
o . OH
~_ ~
dans laquelle Gl est cléfini cornme ~ 1 dans les cc~nditic~s décrites
~11' ' . pour l'action d'un produit de fclrmule générale (XIII) sur un produit de
forrnule générale (XIV).
Le produit de formule générale (XIX) peut être préparé par action du
phosgène ou d'un de ses dérivés tel que le ki~ sur un produit de for~nulegénérale:
Gl-O ~ (XX)
HO OH
OH
dans laquelle Gl est défini cornne ~Jll ' en C\pérant dans un solvant
organique basique tel que la pyricline à une i ~ inférieure à -50C, de
préférence voisine de -78C.
Le produit de fc)rmule générale (XX) peut être préparé par action d'ur
h~ g~n~ ' ' y' ' sur un produit de for nule générale:
HoWO O^GI
~ I
HO ~ (XXI)
HO OH
OH
15dans laquelle Gl est cléfni cornme 1,ll' '' en opérant dans un solvant
organique basique.
Le produit de fcrmule-générale (XXI) peut être préparé dans les conditions
décrites par D.G.I. Kings~on et coll., Jourr~al of Nat. Prod., ~, 884 (1993).
21 90651
w095/33736 r~l,r~ a
16
Les produits de formule générale n) dans laquelle Ra et Rb LCIUlt:s~llt~
chacun un atome cl'l-yLu~ peuvent etre obtenus par téduction C~ vly~ u~ d'un
produit de formule générale (I) dans laquelle Ra représente un radical hydroxy ou un
radical acyloxy ou ' ya~ y ou dans les conditions décrites dans la demande
5 '- PCTWO 93/06093.
Les produit de formule générale (I) dans laquelle Ra et Rb forment ensemble
avec l'atome de carbone auquel ils sont liés une fonction cétone peuvent être obtenus
par oxydation d'un produit de formule générale ~I) dans laquelle Ra représente un
radical hydroxy et Rb représente un atome dl~y~v~l~., au moyen, par exemple, de
10 chl~u~.l, de ~ de dichromate de py~idinium, de bichromate de
potassium, de bichromate d' ou de bioxyde de m~ ,,,pn~3eP
Les nouveaux produits de formule générale (I) obtenus par la mise en
oeuvre des procédés selon l'invention peuvent être purifiés selon les méthodes
connues telles que la criet~ ion ou la ~,1.., ,, , ' -
Les produits de formu]le générale (I) dans laquelle Z représente un radical de
formule générale (II) presentent des propriétés l~,nlng;.~ a~4udblcs.
In vitro, la mesure dle l'activité biologique est effectuée sur la tubulineextraite de cerveau de porc par la méthode de M.L. Shelans~ci et coll., Pro~ Natl.
Acad. Sci. USA, 70. 765-768 (1973). L'étude de la d~pvly~ a~ des microtu-
20 bules en tubuline est effectuée selon la méthode de G. Chauvière et coll., C.R. Acad.Sci., ~2~. série n, 501-503 (1981). Dans cette étude les produits de formule générale
(I) dans laquelle Z représente un radical de formule générale (II) se sont montrés au
moins aussi actifs que le taxol et le Taxotère.
In vivo, les produits de formule générale (I) dans laquelle Z représente un
25 radical de formule générale (I10 se sont montrés actifs chez la souris greffée par le
mélanome B16 à des doses comprises entre 1 et 10 mg/lcg par voie
ainsi que sur d'autres tumeurs liquides ou solides.
Les nouveaux produits ont des propriétés anti-tumorales et plus
"` ~ une activité sur les rumeurs qui sont résistantes au Taxol~D ou au
30 Taxotère(E9. De telles tumeurs ~ . les tumeurs du colon qui ont une
expression élevée du gène mdr 1 (gène de la multi-drug resistance). La multi drug
resistance est un terme habituel æ rapportant à la résistance d'une tumeur à différents
produits de structures et de ' d'action différents. Les taxoides sont
g~ ' ' connus pour être fortement reconnus par des tumeurs c,
21 9G~Sl
wo ssl33736 l ~I/r. /~a
17
telles que P388/DOX, une lignée oellulaire s~ pour sa résistance à la
dv~v~ ' (DOX) qui exprime mdr 1.
Les exemples stlivants illustrent la présente invention.
FXFMPIi.F. 1
S A une solutioll de 0,193 g de tert-bulv~y.,~l,v.lyhu.. ~o-3 hydrvxy-2
phényl-4 ~ .~ l (2R,4S) de benzoyloxy-2a époxy-5~,20 hydrvxy-l~ méthoxy-
acétoxy-10~ oxo-9 In" ~ylv~y-4a i ' '' ~ Jlv,.r-7~ taxène-ll
yle-13a dans 2,5 cm3 d'acétonitrile et 0,250 cm3 de i ' ydlu~uu~r" on ajoute
~uccc~ . 0.096 g de tamis ' ' _ 4A en poudre, 0,290 g de chlorure de
10 sodium. Le milieu réactionnel est maintenu sous agitation à une ~.llpel.l~UlC: voisine
de 75C pendant 5 heules ptUS, à une i I ~ voisine de 20C, additionné de
75 cm3 de di~ u~v~ e et 50 cm3 d'une solution aqueuse saturée de chlorure de
sodium. La phase orgaDique est décantée, lavée par 2 fois 40 cm3 d'une solution
aqueuse saturée de chlomre de sodium puis séchée sur sulfate de ~ . filtrée et
concentrée à sec sous pression réduite (2,7kPa) à 40C. On obtient 0,150 g d'un
produit que l'on purifie par ~ sur 80 g de silice (0,063-0,2 mm)
contenus dans une colonne de 1 cm de diamètre (éluant: di~lil..lv...~ -méthanol:98/2 en volumes) en rec1ueillant des fractions de 10 cm3. Les fractions ne contenant
que le produit cherché sont réunies et ~ ,., à sec sous pression réduite
(2,7kPa) à 40C. On obtient 0,080 g de tert-~ y~l,v.. ~' -3 hydrvxy-2
phényl-3 ,~,.., (2R,4S) de benzoyloxy-2a époxy-513,20 hydrvxy-l~ métnoxy-
acétoxy-10j3 méthylène-7~,8 nor-l9 oxo-9 1~' . ylw~y-4a taxène-ll yle-13a dont
les, , sont les suivantes:
- spectre de R.M.N. lH (400 MHz, CDC13, ~ en pprn): 1,24 (t, J = 7.5 Hz, 3H: CH3éthyle); 1,24 (s, 6H: CH3); 1,27 (s, 9H: C(CH3)3); 1,42 (mt, lH: H 7); 1,68 et
2,24 (2 mts, lH chacun: CH2 en 19); 1,86 (s, lH OH en 1); 1,86 (s, 3H: CH3);
2,12 et 2,86 (I~ iVt~ d et dt, J = 16 et J = 16 et 5 Hz, lH chacun: CH2 en 6);
de 2,15 à 2,30 et 2,41 (I~ti~. mt et dd, J = 16 et 9 Hz, lH chacun: CH2 en
14); 2,64 (mt, 2H: CH2 éthyle); 3,26 (mt, lH: OH en 2'); 3,52 (s, 3H: OCH3);
4,07 (d, J = 7 Hz, lH: H en 3); 4,04 et 4,33 (2d, J = 9 Hz, lH chacun: CH2 en 20);
4,22 (AB limite, J = 16 Hz, 2H: OCOCH30); 4,62 (mt, lH: H en 2'); 4,70 (d, J = 4Hz,lH:Hen5);5,28(md,2H:Hen3'etCONH~;5,67(d,J=7Hz,lH:Hen2);
6,26 (t large, J = 9 Hz, lH: H en 13); 6,42 (s, lH: H en 10); de 7,25 à 7,45 (mt,
5H: H ~, , en 3'); 7,52 (t, J = 7,5 Hz, 2H: OCOC6H5 H en méta); 7,62 (t,
21 90651
wo s5n3736 r~ a
18
J = 7,5 Hz, lH: OCOC6H5 H en para); 8,16 (d, J = 7.5 Hz, 2H: OCOC6H5 H en
ortho).
Le tert-~ r~,albu~ 3 hydroxy-2 phényl4 ~,lur (2R,4S) de
benzoyloxy-2a époxy-513,20 hydroxy~ .6,Llw~Lu~y-10fl oxo-9 1~ yl~ y-
5 4a '- , ' '' ~ y-7~ taxène-ll yle-13a peut être préparé de la manière
suivante:
Une solution de 0,760 g de tert-' y~ul~.JI-3 (méthoxy-4 phényl)-2
phényl-4 .~ 1,3 uall~y- 5 (2R,4S,5R) de benzoyloxy-2a époxy-5~,20
hydroxy-l~ ll,; '~J~.u~r-10~ oxo-9 1~ . Yl~J~r4~ LLill..~.. ' .c
7~ taxène-ll yle 13a darls 6,6 cm3 d'une solution 0,1N d'éthanol rLlLi~ue est
maintenue sous agitation à une ~.YI~IdLul~ voisine de 0C pendant 22 heures. Le
milieu réactionnel est concentré à sec sous pression réduite (2,7kPa) à 20C. Le brut
réactionnel est dissous dans 8al cm3 de ~ - et 80 cm3 d'une solution
aqueuse saturée de l;;c~L de sodium. La phase organique est séparée par
d~mt ~ti. n puis ext~aite par 2 fois 50 cm3 de ~' - ' Les phases
organiques sont réunies, lavées par 50 cm3 d'eau distillée puis séchées sur sulfate de
filtrées et . ~ .,w à sec sous pression réduite (2,7 kPa) à 20C. On
oWent 0,9 g d'une meringue blanche que ron purifie par ~ sur 150 g
de silice (0,063-0,2 mrn) contenus dans une colonne de 3 cm de diamètre (éluant:dL~,lilul~ ' - ~': 95-5 en volumes) en recueirlant des fractions de 15 cm3.
Les fractions ne contenant que le produit cherché sont réuniw et . ~,w à sec
sous prwsion réduite (2,7kPa) à 20C. On oWent 0,456 g de tert-
bu~u~r.,~l)ullr --3 hydroxy-2 phényW 1~. (2R,4S) de l~vrl~,Ar-2a
époxy-513,20 hydroxy-l~ .LlW~ Lu~r-10l3 oxo-9 ~L.I ylu~r-4a trifluoro-
~ - r ~1.,.~r-713 taxène-ll yle-13a et dont les, . physiques sont
les suivantew:
- spectre de RM.N. lH (400 ~Hz, CDC13, o en ppm): 1,24 (s, 9H,: CH3 et CH3
éthyle); 1,34 (s, 9H: C(CH3)3); 1,74 (s, lH: OH en 1); 1,88 (s, 3H: CH3); 2,05 (s
large, 3H: CH3); 2,24 et 2,86 (2 mts, lH chacun: CH2 en 6); 2,33 (d, J = 9 H~, 2H:
CHz en 14); 2,68 (mt, 2H: ClH2 éthyle); 3,30 (mt, lH: OH en 2'); 3,52 (s, 3H:
OCH3); 3,93 (mt, lH: H en 3); 4,19 (AB limite, J = 16 Hz, 2~: OCOCH2O); 4,20
et 4,36 (2d, J = 9 Hz, lH chacun: CH2 en 20); 4,64 (d large, J = 5,5 Hz, lH: H en
2');4,86(dlarge,J=lOHz,lH:Hen5);5,22(mt,1H:Hen3');5,30(d,J=10
Hz,lH:CONH);5,51(dd,J=lOet7,5Hz,lH:Hen7);5,75(d,J= 7Hz.lH:
Hen2);6,20(mt,1H:Henl3);6,71(s,1H:HenlO);de7,30à7,45(mt,5H:H
~ woss~33736 2 ~ 9G~S ~ r~llr~ J~
19
Al~l...~l;ll.'~; en 3'); 7,52 (t, J = 7.5 Hz, 2H: OCOC6H5 H en méta); 7,64 (t, J = 7,5
Hz, lH: OCOC6Hs H en para); 8,13 (d, J = 7,5 Hz, 2H: OCOC6Hs H en ortho).
Le tert-l,uLu~y~ 1-3 (méthoxy-4 phényl)-2 phényl4 ~ ' ' 1,3
~l~y' 5 (2R,4S,5R) de benzoyloxy-2a époxy-5~,20 hydroxy-113 méthoxy-
5 acétoxy-1013 oxo-9 ~ lu~Ly4a ~ IYIU~Y-7~ taxène-11
yle-13a peut être préparé de la manière suiYante:
A une solution d~ 0,590 g de benzoyloxy-2a dihydroxy-1~,13a époxy-513,20
Il._Lllu~a~y-1013 oXo-9 ~ . ylu~y4a L inhul ' '' ~lu~y-7
taxène-11 dans 10 cm3 d'acétate d'éthyle anhydre, on ajoute su~c~.,:~, 0,463 g
d'âcide tert-butu~y~ l-3 (méthoxy4 phényl)-2 phényl4, ' ' - 1,3
~l~yL~ue~5 (2R,4S,5R), 0,319 g de dil,y,' ' yl~_.l~l----~;~l et 0,028 g de
44LIléLl.y' -py~idme Le mélange réactionnel est agité pendant 15 heures, sous
~LII-V~ d'argon, à une t~ laLuu~ voisine de 20C, puis additionné de 75 cm3 de
' ' ' , ' ' et 50 cm3 d'une solution aqueuse saturée de chlorure ~'' -
La phase organique est décantée, lavée par 2 fois 40 cm3 d'une solution aqueuse
saturée de chlorure de sodium puis séchée sur sulfate de ~ ' filtrée et
concentrée à sec sous pression réduite (2,7 kPa) à 40C. On obtient 0,980 g que l'on
purifie par ' ~ ~ l' sur 150 g de silice (0,063-0,2 mm) contenus dans une
colonne de 3 cm de diamètre (éluant: !'- ' ' ull,~ ul~-méthanol: 95-5 en volumes)
en recueillant des fractiolls de 15 cm3. Les fractions ne contenant que le produit
cherché sont réunies et: ~ à sec sous pression réduite (2,7kPa) à 40C. On
obtient 0,740 g de tert-1,uh,~r~1,ullyl-3 (méthoxy~ phényl)-2 phényl4, ' '
1,3 ~L~y' 5 (2R,4S"5R) de benzoyloxy-2a époxy-5~3,20 hydroxy-1~ méthoxy-
acétoxy-10~ oxo-9 ~,1,l ,.~lu,.y4a i r' ' 'CVl~ U~y-7~ taxène-11
yle-13a sous forme d'une meringue blanche et dont les . ~ . physiques sont
les suivantes:
- spectre de R.M.N. 1H (400 MHz, CDCI3, o en ppm): 1,06 (s, 12H: CH3 et
C(CH3)3); 1,20 (s, 3H,: CH3); 1,27 (t, J = 7,5 Hz, 3H: CH3 éthyle); 1,67 (s, lH: OH
en 1); 1,71 (s, 3H: CH3); 1,83 (s, 3H: CH3); de 2,00 à 2,30 et 2,83 (2 mt, lH
chaclm: CH2 en 6); de 2,00 à 2,30 (mt, ZH: CH2 éthyle); 2,08 et 2,22 (2 dd, J = 16
et 9 Hz, lH chaclm: CH2 en 14); 3,52 (s, 3H: OCH3); 3,82 (s, 3H: ArOCH3); 3,82
(mt, lH: H en 3); 4,12 et 4,29 (2d, J = 9 Hz, lH chactm: CH2 en 20); 4,18 (AB
Iimite, J = 16 Hz, 2H: OCOCH2O); 4,51 (d, J = 5 ~Iz, lH: H en 2'); 4,80 (d large,
J = 10 Hz, lH: H 5); de 5,35 à 5,45 (mt, lH: H en 3'); 5,43 (dd, J = 10,5 et 7,5 Hz,
lH:Hen7);5,68(d,J -7Hz,lH:Hen2);6,01(mt,1H:Henl3);6,38(mt,
21 qO651
wo 95l33736 r~l,r~7~c /~5
lH: H en 5'); 6,60 (s, lH: H en 10); 6,92 (d, J = 8.5 Hz, 2H: H ~ --; en
or~o du OCH3); 7,39 (d, J = 8,5 Hz, 2H: H <uu...~.Li4~,, en méta du OCH3); de
7,30 à 7,45 (mt, 5H: H ~uV~ , en 3'); 7,50 (t, J = 7,5 Hz, 2H: OCOC6H5 H en
méta); 7,65 (t, J = 7,5 Hz, 1~: OCOC6Hs H en para); 8,03 (d, J = 7,5 Hz, 2H:
5 OCOC6Hs H en ortho).
Le ~e.~v~hJ.~y-2a dihydroxy-1~3,13a époxy-5~,20 ~ ,Lllu~ tv~y-10
OXO-9 ~ lv~y-4a i " ~ ' ' '' JIU~y-7~ taxène-ll peut être préparé
de la manière suivante:
A une solution de 0,660 g de benzoyloxy-2a époxy-5~,20 Il~,L~Iv~ ~tvAy
10,~ oxo-9 1~u~J~.v~lvi~y-4a trihydroxy-1~,713,13a taxène-ll dans 6,6 cm3 de
di~,llvl~ '' anhydre et 0,338 cm3 de pyridine, mamtenue sous ~LIllu~ h.,.e
d'argon, à une i . ' e v~dsdne de 0C, on ajoute goutte à goutte 0,354 cm3
d' ' .~Li~ll, L inw.. ' '' . La solution orangéê obtenue est agitée 10
mdnutes à une i . e voisdne de 0C, 30 mdnutes à une t~,.ll~élQL~le vodsdne de
20C, puis -'' de 3 cm3 d'eau et 50 cm3 de di~.llu.u.r.~ . La phase
organique est décantée, lavée par 2 fods 40 cm3 d'une solution aqueuse .,aturée de
chlorure de sodium p~us séchée sur sulfate de m:lgn.oQ;~m filtrée et concentrée à sec
sous pression réduite (2,7 kPa) à 40C. On obtient 0,800 g que ron purifie par
c ;~ v . sur 100 g de silice (0,063-0,2 mm) contenus dans une colonn~ de
20 2 cm de diamètre (éluant: dielllul~ : 95-5 en volumes) en
recueillant des fractions de 15 cm3. Les fractions ne contenant que le produit cherché
sont réunies et ~- - ~s à sec sous pression réduite (2,7 kPa) à 40C. On obtient0,591 g de l~vylu~ y-2a dlihydroxy-1~,13a époxy-5~,20 I..,L~lu~y~y-10
OXO-9 ~ u~ 4a " ~ 'w~y-713 taxène-ll sous forme d'une
meringue blanche et dont les .,~ ;qu- - physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz, CDC13, o en ppm): 1,05 (s, 3H: CH3); 1,19 (s,
3H: CH3); 1,23 (t, J = 7,5 Hz, 3H: CH3 éthyle); 1,62 (s, lH: OH en 11; 1,89 (s,
3H: CH3); 2,12 (d, J = 5 Hz, l]H: OH en 13); 2,24 et 2,90 (2 mts, l]H chaclm: CH2
en 6); 2,25 (s, 3H: CH3); 2,30 (AB limite, 2H: CH2 en 14); 2,64 (mt, 2H: CH2
éthyle); 3,52 (s, 3H: OCH3); 4,02 (d, J,= 7 Hz, lH: H en 3); 4,15 êt 4,35 (2d, J = 9
Hz, lH chacun: CH2 en 20); 4,20 (AB limite, J = 16 Hz, 2H: OCOCH2O); 4,85
(mt,lH:Henl3);4,91(dlarge,J=lOHz,lH:Hen5);5,57(dd,J=lOet7Hz,
lH:Hen7);5,69(d,J=7Hz,lH:Hen2);6,73(s,1H:HenlO);7,50(t,J=
7.5 Hz, 2H: OCOC6H5 H en m~ta); 7,63 (t, J = 7,5 Hz, lH: OCOC6Hs H en para);
8,11 (d, J = 7,5 Hz, 2H: OCOC6Hs H en ortho).
~ wo ssa3736 1 9 0 ~ 5 1 P~l/~ L ,~
Le benzoyloxy-2a époxy-513,20 ~ u~ya~tu~y-101~ oxo-9 ~. ylV~r-
4a trihydroxy-113,713,13a taxène-ll peut être préparé de la manière suivante:
A une solution de 1,21 g de benzoyloxy-2a ' ' .~ily'u~y-713,13a époxy-
5~3,20 hydroxy-1~ I..6~lu~ya~,élv~y 10~ oxo-9 ~,." ,ylu~a taxène-11 dans
15 cm3 de rfirh1 "' ~, on ajoute, à une i . ~: voisine de 20C, 23 cm3 de
complexe lli~ y- ~cide nuv~llyl- . Le mélange réactionnel est agité pendant
20 heures à une; . è voisine de 20C puis on ajoute 50 cm3 de
" ' , ' et 100 cm3 d'une solution aqueuse saturée d~y~u~ de
sodium. La phase organique est décantée, lavée par 2 fois 50 cm3 d'une solution
aqueuse saturée de chlorure de sodium puis séchée sur sulfate de v filtrée et
concentrée à sec sous l~ression réduite (2,7 kPa) à 40C. On obtient 1,04 g de
l~.~ylu~y-2a époxy-5~,20 I~ ya~yl-lOfl oxo-9 ~u~ lvylu,~y-4a trihydroxy-
1~,7~,13a taxène-ll SOIlS forme d'une meringue blanche et dont les,
physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz, CDCI3, v en ppm): 1,11 (s, 6H: CH3); 1,25 (t,
J = 7,5 Hz, 3H: CH3 éthyle); 1,65 (s, lH: OH er~ 1); 1,70 (s, 3H: CH3); 1,88 et
2,60 (2 mts, lH chacun: CH2 en 6); 2,08 (s, 3H: CH3); 2,30 (AB limite, 2H: CH2
en 14); 2,39 (d, J = 4 Hz, lH: OH en 7); 2,63 (mt, 2H: CH2 ethyle); 3,55 (s, 3H:OCH3); 3,90 (d, J = 7 Hz, lH: H en 3); 4,17 et 4,32 (2d, J = 9 Hz, lH chacun: CH2
en 20); 4,25 (A13 limite, J = 16 Hz, 2H: OCOCH2O); 4,51 (mt, lH: H en 7); 4,89
(mt, lH: H en 13); 4,95 (d large, J = 10 Hz, lH: H en 5); 5,64 (d, J = 7 Hz, lH: H
en 2~; 6,43 (s, lH: H en 10); 7,48 (t, J = 8 Hz, 2H: OCOC6Hs H en méta); 7,61 (t,
J = 8 Hz, lH: OCOC6Hs H en para); 8,13 (d, J = 8 Hz, 2H: OCOC6H5 H en ortho).
Le benzoyloxy-2a ~" ' ybilylu..y-7~,13a époxy-5~,20 hydroxy-113
~ y.l~;e~yl-10~ oxo-9 ~ ylu~-r~a taxène-11 peut être préparé de la
manière suivante:
A une solution de 0,900 g de benzoyloxy-2a dihydrvxy-1l3,10
(ili;;hybilrlu~r)-7~,13a époxy-5~,20 oxo-9 ~I~. ,Jlu,.y~a taxène-11 dans
15cm3 de pyridine, on ajoute 0,520 cm3 de chlorure de ya.,~,yle à une
~.I.~el~lule voisine de 0''C. Le mélange réactionnel est agité pendant 2 heures à une
. 5. ' t~ voisine de 20C puis on ajoute 100 cm3 de ~' ' ' et 50 cm3
d'une solution aqueuse .saturée de c-hlorure d'; La phase organique est
décantée, lavée par 2 fois 40 cm3 d'une solutivn aqueuse saturée de chlorure
d'; puis séchée sur sulfate de v filtrée et concentrée à sec sous
35 pression réduite (2,7 I~Pa) à 40C. On obtient 1,3 g que ron purifie par
21 90651
WO gs/33736 P~,l/r~ _ 'L l~a
22
v . sur 150 g de silice (0,063-0,2 mm) contenus dans une colonne de
2,5 cm de diamètre (éluant: acétate d'éthyle-cyclohexane: 25-75 en volumes) en
recueillant des fractions de 10 cm3. Les fractions ne contenant que le produit cherché
sont réunies et ~ , à sec sous pression réduite (2,7 kPa) à 40C. On obtient
0,780 g de benzoyloxy-2a b;D(' ''' yl~ilylu~y)-713,13a époxy-5~,20 hydr~vxy-l~
v~a~ y-10~ oxo-9 ln, ~ ylu~y~a taxène-ll sous forme d'une meringue
blanche et dont les, ~ , physiques sont les suivantes:
- spectre de R.M.N. lH (400 ]\~Hz, CDCI3, ~ en ppm): de 0,50 à 0,70 (mt, 12 H:
CH2 éthyle); 0,92 (t, J = 7,5 ]~z, 9H: CH3 éthyle); 1,00 (t, J = 7.5 Hz, 9H: CH3éthyle); 1,10 (s, 3H: CH3); 1,17 (s, 3H: CH3); 1,29 (t, J = 7,5 Hz, 3H: CHl éthyle
en 4); 1,61 (s, lH: OH en 1); 1,68 (s, 3H: CH3); 1,84 et 2,51 (2 mts, lH chacun:CH2 en 6); 2,09 et 2,21 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 2,10 (s, 3H:
CH3); 2,60 (mt, 2H: CH2 éthy~e en 4); 3,50 (s, 3H: OCH3); 3,78 (d, J = 7 Hz, lH:H en 3); 4,12 et 4,30 (2d, J = 9 Hz, lH chacun: CH2 en 20); 4,15 (AB limite, J = 16
Hz, 2H: OCOCH2O); 4,49 (dd,J = 11 et 7 Hz, lH: H en 7); 4,90 (mt, 2H: H en 5
et H en 13); 5,62 (d, J = 7 Hz, lH: H en 2); 6,52 (s, lH H en 10); 7,45 (t, J = 7,5
Hz, 2H: OCOC6H5 H en méta); 7,58 (t, J = 7.5 Hz, lH: OCOC6Hs H en para); 8,09
(d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho).
Le benzoyloxy-2a dihydroxy-1~,10~ (dihi~lrb;lrlu~y)-713,13a époxy-
513,20 oxo-9 ~,.u~Jal.vylu~,y-4a taxène-ll peut être préparé de la manière suivante:
A une solution de 1,105 g de carbonate-113,2a 1 ' ybilrlu~r)-7l3~l3a
époxy-513,20 ~ J~u~a~étu~y-l 0~ oxo-9 ~ yk/~y-4a taxene-l 1 dans 50 cm3 de
t6h~ir~L~)ru~ , anhyd~ide, on ajoute 1.8 cm3 d'ume solution lM de 1' ," '
dans le t~hallr~urlllal~ à une i . c: voisine de -78C Le mélange réactionnel
est agité pendant 15 minutes à une ~IIl~la~ voisine de -78C pL~iS on ajoute
10 cm3 d'une solution aqueuse saturée de chlorure d'~ A une t~_lYI~
voisine de 20C, on ajoute 20 cm3 d'une solution aqueuse saturée de chlorure
~' et 50 cm3 de d;~Llulu~ ;llall~. La phase organique est décantée, lavée
par 2 fois 10 cm3 d'une solution aqueuse saturée de chlorure de sodium puis séchée
sur sulfate de ~ filtrée et concentrée à sec sous pression réduite (2,7 kPa) à
40C On oWent 1,3 g que l'on purifie par ,' ~ .' sur 150 g de silice
(0,063-0,2 mm) contenus dans une colonne de 5 cm de diamètre (éluant: acétate
d'éthyle-~-r~ ~ : 10-90 erl volumes) en recueillant des fractions de 18 cm3 Les
fractions ne contenant que le produit cherché sont réunies et I ~s à sec sous
pression réduite (2,7 l~a) ~ 40C. On oWent 0,840 g de ~.~vylu~y-2a dihydroxy-
WO 95133~36 2 ~ 9 ~ 6 5 ~ r . ,~
23
~ ,10~ (IH~ ybilyl~ .y)-71f~,13~ époxy-51'~,20 oxo-9 IJlulJall~Jyl~y 4 taxène-ll
sous forme d'une meringue blanche et dont les ~ physif~ues sont les
- suivantes:
- spectre de R.M.N. lH (400 MHz, CDC13, ~ en ppm): 0,53 (mt, 6 H: CH2 éthyle);
5 0,65 (mt, 6 H: CH2 éthyle); 0,92 (t, J = 7,5 Hz, 9H: CH3 éthyle); 1,00 (t, J = 7,5
Hz, 9H: CH3 éthyle); 1,07 (s, 3H: CH3); 1,14 (s, 3H: CH3); 1,26 (t, J = 7,5 Hz,
3H: CH3 éthyle en 4); 1,40 (s, lH: OH en l); I,71 (s, 3H: CH3); 1,88 et 2,45 (2
mts, lH chacun: CH2 en 6); 2,00 (s, 3H: CH3); 2,06 et 2,18 (2 dd, J = 16 et 9 Hz,
lH chacun: CH2 en 14); 2,60 (q, J = 7.5 Hz, 2H: CH2 éthyle en 4); 3,84 (d, J = 7Hz, lH: H en 3); 4,14 et 4,30 (2d, J = 8,5 Hz, lH chacun: CH2 en 20); 4,26 (d, J =
0,5 Hz, lH: OH en 10); 4,40 (dd,J = 11 et 7Hz, lH: H en 7); 4,90 (d large,J = 10Hz,lH:Hen5);4,94(tlarge,J=9Hz,lH:Henl3);5,12(d,J=0,5Hz,lH:H
enlO);5,58(d,J=7H[z,lH:Hen2);7,45(t,J=7,5Hz,2H:OCOC6HsHen
méta); 7,60 (t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,09 (d, J = 7,5 Hz, 2H:
OCOC6Hs H en ortho).
Le carbonate-]13,2a bi~ bil.~ y)-713,13a époxy-51'~,20 méthoxy-
acétoxy-1013 oxo-9 1~ ylv..y 1a taxène-ll peut être préparé de la manière
suivante:
A une solution de 2,0 g de carbonate-11'~,2f~ 1,.,~ ' ybilylo~y)-7~13
époxy-51'i,20 hydroxy4~ ,I.é~ ~a~,~tu~y 10~3 oxo-9 taxène-ll dans 90 cm3 de
dil,lllu~ ' on ajoute 3,37 g de 4~ .r' ,,-' et 3,64 cm3
d'anhydride ~IV~;UII;~ ,. Le milieu réactionnel est chauffé à une I , voisine
de 42C pendant 8 heures. On ajoute 50 cm3 d'une soluti~n aqueuse saturée de
chlorure de s~Jdium et 50 f m3 de ~ ' ' ' ' La phase organique est décantée,
lavée par 2 fois 40 cm3 d'une soluti~Jn aqueuse saturée de chlorure de sodium puis
sechée sur sulfate de ~ filt~ée et concentrée à sec sous pression réduite
(2,7 kPa) à 40C. On obtient 2,6 g que ron purifie par ~hl ~ . ' ~ sur 100 g de
silice (0,063-0,2 mm) contenus dans une colomne de 3 cm de diamètre (éluant:
acétate d'éthyle-~,' ' : 5-95 en volumes) en recueillant des fractions de
I2 cm3. Les fractions ne contenant que le produit cherché sont réunies et I
à sec sous pression réduite (2,7 kPa) à 40C. On obtient 1,97 g de carbonate-1~3,2
b~(~ ll.rbilyloxy)-7;'~,13 époxy-51'~,20 méthoxyacétoxy 10~ oxo-9 propanoyl-
oxy4 taxene-ll sous ~orme d'une meringue blanche et dont les
physiques sont les suivantes:
wo ss/33736 Z 1 (~ O 6 5 1 . ~l~rh~ a
24
- spectre de R.M.N lH (400 MHz, CDCI3, ~ en ppm): de 0,50 à 0,75 (mt, 12H:
CH2 éthyl); 0,94 (t, J = 7,5 Hz, 9H: CH3 éthyl); 1,03 (t, J = 7,5 Hz, 9H . CH3 éthyl);
1,21 (mt, 6H: CH3 et CH3 éthyl); 1,28 (s, 3H: CH3) ;1,75 (s, 3H: CH3); 1,90 et
2,60 (2 mts, lH chacun CH2 er 6); 2,13 (s, 3H: CH3); 2,15 et 2,38 (2 dd, J = 16 et
9 Hz, lH chacun: CH2 en 14); 2,43 (mt, 2H: CH2 éthyl); 3,43 (d, J = 5,5 Hz, lH:
H en 3); 3,51 (s, 3H: OCH3); 4,18 (s, 2H: OCOCH2O); 4,46 (dd, J =11 et 7 Hz,
lH: H en 7); 4,48 et 4,65 (2d, J = 9Hz, 2H: CH2 en 20); 4,51 (d, J = 5,5 Hz, lH:Hen2);4,93(dlarge,J=lOllz,lH:Hen5);5,02(t,J=9Hz,lH:Henl3);
6,51 (s, lH: H en 10).
Le cdrbonate-1~,2 bi,(l-i;~l~ lu~)-7~,13a époxy-5~,20 hyd~oxy-4a
;a~u~ ~-10~ oxo-9 taxène-ll peut être prépa~é de la manière suivante:
A une solution de 4,12 g de carbonate-1~,2a dihydroxy~a,l0
b.D(l.i;;~ lu~)-713,13a époxy-5~,20 ûxo-9 taxène-ll dans 80 cm3 de pyridine,
on ajoute, sous agitation et à une t~ dtul~ voisine de 0C, 2 g de tamis
'~ ' c 4A en poudre et 2,86 cm3 de chlorure de ~ a-u~a~ ,. Le mélange
réactionnel est agité pendant 15 minutes à une t~,.ll~h,.a~ voisine de 0C puis on
laisse remonter doucement la i , ' t, du maieu réactionnel à une tc~ ~alu~e
voisine de 20C. Après 4 heures d'agitdtion à une l~lllpéla~ voisine de 20C, onajoute 50 cm3 d'une solution aqueuse saturée de chlorure ''I et 100 cm3 de
~' La phase organique est décantée, lavée par 2 fois 40 cm3 d'une
solution aqueusc saturée de chlorure d' 2 fois 25 cm3 d'une solution
aqueuse saturée de sulfate de cuivre et 2 fois 25 cm3 d'une solution aqueuse saturée
de chlorure de sodium puis séchée sur sulfate de v ' filtrée et concentrée à
sec sous pression réduite (2,7 kPa) à 40C. On obtient 5,3 g que l'on purifie par
' ,, sur 200 g de silice (0,063-0,2 mmj contenus dans une colonne de
4cm de diamètre (éluant: acétate d'éthyle-~ - ' : 25-75 en volumes) en
recueillant des fractions de 12 cm3. Les fractions ne contenant que le produit cherché
sont réurlies et, ~ a sec sous pression réduite (2,7 kPa) à 40C. On obtient
4,21 g de carbonate-1~,2a l,i;,( - ~ 1u~)-7~,13a époxy-5~,20 hydroxy-4a
' ' .~ a~-10~ oxo-9 taxène-ll sous forme d'ume meringue blanche et dont les
physiques sont les suivantes:
- spectre de RM.N. lH (400 ~Hz, CDCI3, ~ en ppm): 0,59 (mt, 6H: CH2 éthyl);
0,73 (mt, 6H: CH2 éthyl); 0,91 (t, J = 7,5 Hz, 9H: CH3 éthy; 1,02 (t, J = 7,5 Hz,
9H: CH3 éthyl); 1,15 (s, 3H: CH3); 1,18 (s, 3H: CH3) ;1,65 (s, 3H: CH3); 1,98 et2,51 (2 mts, lH chacun: CH[2 en 6); 2,15 (s, 3H: CH3); 2,54 et 2,72 (2 dd,
2 1 9~65
WO 95~33736 r ~ ~ Ir S
.~o"e~L~. J = 16 et 9 Hz et J = 16 et 3 Hz, lH chacun: CH2 en 14); 2,93 (s,
lH: OH en 4); 3,03 (d, J = 5 Hz, lH: H en 3); 3,51 (s, 3H: OCH,); 4,16 (mt, lH:
H en 7); 4,17 (AB,J = :18 Hz, 2H: OCOCH20); 4,37 (d, J = 5 Hz, lH: H en 2);
4,54 (AB, J = 9 Hz, 2H: CH2 en 20); 4,76 (d large, J = 10 Hz, lH: H en 5); 4,81
(dd,J=9et3Hz,lH:Henl3) ;6,51 (s,1H:HenlO).
Le carbonate-1~,2a dihydroxy-4a,101A~ b~(kié11~ 1vAy)-7lA~,13a époxy-
51A~,20 oxo-9 taxène-l 1 peut être préparé de la manière suivante:
A urle solution de 0,400 g de IJ;o(kiél;~.ybilyl~vAy)-7~l3a epoxy-51A~,20 oxo-9
' ~ vAy-llA~,2a,4a,10~ taxène-ll dans 10 cm3 de dL~l lv-- ' , on ajoute,
sous agitation et à une i . 6 voisine de -78C, 1 cm3 de pyridine et 0,560 g de
l.il,l..,.v:..r Le mélange réactionnel est agité pendant 2 heures à une t~,..llJél~
voisine de -78C puis on laisse remonter doucement le milieu réactionnel à une
. ' t, voisine de 20C. On ajoute 30 cm3 d'une solution aqueuse saturée de
chlorure .1'_ et 20 cm3 de dL~I~.. La phase or~anique est
15 décantée, lavée par 2 fois 40 cm3 d'une solution aqueuse saturée de chlorure de
sodium puis séchée sur sulfate de lv , filtrée et concentrée à sec sous pression
réduite (2,7 k~a) à 40C. On obtient 0,400 g d'une m6ringue jaune que l'on purifie par
~ v . sur 25 g de silice (0,063-0,2 mm) contenus dans une colonne de
2cm de diamètre (éluant: acétate d'éthyle-~,' ' : 20-80 en volumes) en
20 lecueillant des fractions dle 10 cm3. L~w fractions ne contenant que le produit cherché
sont réunies et, 6w à sec sous Fession reduite (2,7 k~Aa) à 40C. On obtient
0,330 g ae carbonate-llA~,2a dihydrvxy-4a,10lA~ biO(IIi6,ilyb;1~1uAy)-7lA~,13a époxy-
513,20 oxo-9 taAène-ll sous forme d'une merinvue blanche et dont les . - ... ~.. ;~I ,.l....
physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz, CDC13, ~ en ppm): 0,54 (mt, 6H: CH2 éthyl);
0,63 (mt, 6H: CH2 éthyl); 0,92 (t, J = 7,5 Hz, 9H: CH3 éthyV; 1,03 (t, J = 7,5 Hz,
9H: CH3 éthyl); 1,11 (s, 3H: CH3); 1,19 (s, 3H: CH3); 1,72 (s, 3H: CH3); 1,98 et2,46 (2 mts, lH chacun: CH2 en 6); 2,06 (s, 3H: CH3); 2,55 et 2,66 (2 dd,
.w~li~. J = 16 et 9 Hz et J = 16 et 3 Hz, lH chacun: CH2 en 14); 3,00 (s,
lH:OHen4);3,13(d,J=5Hz,lH:Hen3);4,06(dd,J=llet7Hz,lH:Hen
7);4,20(d,J=2,5Hz,lH:OHenlO);4,33(d,J=5Hz,lH:Hen2);4,55(AB,
J=9Hz,2H:CH2en20);4,76(dlarge,J=lOHz,lH:Hen5);4,82(dd,J=9et
3Hz,lH:Henl3);5,19(d,J=2,5Hz,lH:HenlO).
Le 1~(~ ,Ay)-7~,13a époxy-5~,20 oxo-9 i~ vAy-1~,2a,4a,
1013 taxène-ll peut être préparé de la manière suivante:
2 ~ 906J 1
wo 95~33736 P~llr~l .
26
A une solution de 3,,~30 g de époxy-5~,20 oxo-9 1 ' y~Lw~y-113,2a,4a,
1013,13a ilic~ ilylu~y-7~ taxène-11 dans 100 cm3 de dichlul~ ' ~, on ajoute,
sous agitation et à une i , ' ~; voisine de 0C, 1,20 cm3 de pyridine et 2,48 cm3
de ~,LIuluhié~ ' Le mélange réactiannel est agité pendant 3 heures à une
5 i . ~ voisine de 0C. On ajoute 100 cm3 d'une solution aqueuse saturée de
chlorure de sodium. La phase organique est décantée, lavée par 2 fois 100 cm3 d'une
solution aqueuse saturée de chlorure de sodium puis séchée sur sulfate de
fltrée et concentrée à sec sous pression réduite (2,7 kPa) à 40C. On ûbtient 5,34 g
d'une huile orangée que l'on purifie par .,}~ sur 300 g de silice (0,063-
10 0,2 rnm) contenus dans une colonne de 3 cm de diamètre (éluant: acétate d'éthyle-
~ yl ' ' ~: 25-75 en volumes) en recueillant des fractions de 40 cm3. Les fractions
ne contenant que le produit ch.erché sont réunies et ~.:Ul~c6.1~5 à sec sous pression
réduite (2,7 ~Pa) à 40C. On obtient 4,18 g de 1~( ' yl~;lyl~ y)-7~i,13a époxy-
5~,20 oxo-9 i '.~dlu~.y-l~2a~4a~lo~ taxène-11 sous forme d'une meringue
15 blanche et dont les . ,,~s~ physiques sont les suivantes:
- spectre de R.M.N. 1H (400 r~Hz, CDCI3, o en ppm): 0,53 (mt, 6H: CH2 éthyl);
0,75 (mt, 6H: CH2 éthyl); 0,91 (t, J = 7,5 Hz, 9H: CH3 éthyl); 1,01 (s, 3H: CH3);
1,03 (t, J = 7,5 Hz, 9H: CH3 éthyl); 1,09 (s, 3H: CH3); 1,63 (s, 3H: CH3); 1,97 (s,
3H: CH3); de 1,95 à 2,10 et 2,40 (2 mts, 2H chacun: CH2 en 14 et CH2 en 6); 3,17(s,lH:OH);3,18(d,J=5,5Hz,lH:Hen3);3,43(d,J=lOHz,lH:OHerl2);
3,76(dd,J=lOet5,5Hz,lH:Hen2);3,96(dd,J=llet6Hz,lH:Hen7);4,10
(s, lH: OH); 4,18 (d, J = 3 ~z, lH . OH en 10); 4,44 et 4,73 (2d, J = 9 Hz, lH
chacun: CH2 en 20); 4,64 (d large, J = 10Hz, lH: H en 5); 4,74 (mt, lH: H en 13);
5,14(d,J=3Hz,lH:HenlO).
FXF.MPJ F 2
A une solution de ~0,5 mg de tert-l,u~y.,~l,ullylal~ lu-3 hydroxy-2
pbényl-3 ~ -r- (2R,3S) dlépoxy-5~3,20 hydroxy-1~ u~y~ u~.y-10~ oxo-9
~ . ylu~y-4a (~l6r.uylu~y-2)-2a i-~l '' .~lu~y-7~ taxène-11
yle 13a dans 0,2 cm3 d' ' ~' et 0,025 cm3 de i ' y~ , on ajûute
45 mg de chlorure de sodium et une spatule de tamis ~llul~uL8u~ activé 4A. Le
mélange obtenu est port~ au reflux, sous . ' ` ~i d'argon, pendant 2 heures. Après
l.,r., ' à une , ' ~ voisirle de 20C, les solvar~ts sont évaporés sous
pression réduite (0,27 ~Pa) à lme i , ~i voisine de 40C, le résidu solide est
repris avec 5 cm3 de ~'-'~' ' ~, filtré sur coton et rincé par 5 cm3 d'un
2 1 9065 ~
~ W<~95/33736 P~,l/r~ .fa
27
mélange acétate d'éthyle-dichlol. ' (50-50 en Yolumes). Les phases organiques
sont ~ .w sous pression réduite (0,27 kPa) à une t~ é~ uu~ voisine de 40C.
- On oWent ainsi 17,1 mg d'une meringue jaune que l'on pu~ifie par ~Iu,préparative sur couche mince [2 plaques 1,.6~ Merck, Kieselgel 60F254,
épaisseur 0,25 mm, dépôt en solution dans le diclllu., ' éluint mélange
méthanol-dichloro-méth~ine (6-94 en volumes)]. Après élution de la zone
Wll~ r ' ' au produit principal par un mélange méthanol~ (10-90
en volumw), filtration sur verre fritté, puis ,./.~ulo.liull des solvants sous prwsion
réduite (0,27 kPa) à une i . e voisine de ~0C, on obtient 10,0 mg de tert-
butu~r~ ull~ 3 hydroxy-2 phényl-3 ~ . (2R,3S) d'époY~y-5~,20
hydroxy-1~ ;h.~A~a~,é~u~y-10~ méthylène-7,8~ oxo-9 ~.,, ylu~Ly4a
6.lvylu~y-2)-2a nor-19 taxène-ll yle-13a sous forme d'une laque blanche dont les sont les suivantes:
- spectre de R.M.N. lH (400 MHz, CDC13, o en ppm): 1,18 (t, J = 7,5 Hz, 3H: CH3
éthyle); 1,22 (s, 6H: C~13); 1,32 (s, 9H: C(CH3)3); 1,41 (mt, lH: H en 7); 1,69 et
2,23 (2 mts, l~chacun: CH2 en 19); 1,81 (s, lH: OH en 1); 1,85 (s, 3H: CH3);
2,12 et 2,50 (Iw~.,li~. d et dt, J = 16 et J = 16 et 4,5 Hz, lH chacun: CH2 en
6); 2,25 et 2,39 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 2,63 (mt, 2H: CH2éthyle); 3,23 (mt, lH: OH en 2'); 3,52 (s, 3H: ()CH3); 4,03 (d, J = 7 Hz, lH: H
en 3); 4,12 et 4,44 (2d, J = 9 Hz, lH chacun: CH2 en 20); 4,20 (AB limite, J = 16
Hz, 2H: OCOCH2O); 4,62 (mt, lH: H en 2'); 4,70 (d, J= 4 Hz, lH: H en 5); 5,22
(mt,lH:Hen3');5,28(d,J=lOHz,lH:CONH);5,58(d,J=7Hz,lH:Hen2);
6,23(tlarge,J=9Hz,lH:Henl3);6,41(s,1H:HenlO);7,18(dd,J=5et3,5
Hz, lH: H en 4 du thénoyle-2); de 7,30 à 7,50 (mt, 5H: H ~UVlll~ en 3'); 7,67
(d large, J = 5 Hz, lH: ~ en 5 du thénoyle-2); 7,96 (d large, J = 3,5 Hz, lH: H en 5
du thénoyle-2).
Le tert-l ye~l~ull~ -3 hydroxy-2 phényl-3 ~I~. -(2R,3S)
d'époxy-5~,20 hydroYy-113 lll~alu~,6tv~y-10~ oxo-9 ~lv~OIlvylu~y4a
(al;..uylu,.y-2)-2a; " ~ ' '' Jlu~y-7~ taxène-ll yle-13a peut être
30 préparé de la manière suivante:
- Une solution de 75 mg de tert-~u.v~bvll~1-3 (méthoxy-4 phényl)-2
phényl4 I-Y~7rlliriinr 1,3 ~,~ul u~y' 5 (2R,4S,5R) d'époYy-5~,20 hydroxy-l~
,lllv~ y-1013 OXO-9 ~ l ,ylu,-y-4a (al6LvyluAy-2)-2a (Hnuululllé
v~y-713 taxène-ll yle-13a dans 0,77 cm3 d'une solution d'acide ~LIvlll~ u~
35 0,1N dans l'éthanol est agitée à une h,..~la~l~le voisine de 5C pendant 2 heurw. Le
21 9~65 1
wo 95/33736 . ~llr~
28
mélange réactionnel est ensuite dilué avec 10 cm3 de di~;~lu~ull~6a~-c, lavé par 2 fois
1 cm3 d'eau distiaée. Après extraction de la phase aqueuse par 1 c~n3 de
dichl~.u,r,~a.~le, les phases organiques sont ".~,..1.1~., séchées sur sulfate de
mrt~P~ m fltrées sur verre fritté et ws sous pression réduite (0,27 kPa) à
S une ~ la~u~:: voisine de 40C. On obtient ainsi 74,4 mg d'une laque jaune que l'on
purifie par ,1... ~ à Fession r ,'', sur 8 g de silice (0,063-
0,2mm) contenus dans une colonne de 1,5 cm de diamètre (g;~dient d'élution:
acétate d'éthyle-~l - ' ' de 5-95 à 20-80 en volumes) en recueiaant des
fractions de 8 cm3. Les fractions ne contenant que le produit cherché sont réunies et
~u.. ~ ~ à sec sous pression réduite (0,27 kPa) à 40C pendant 2 heures. On
oWent ainsi 56,3 mg de tert-' y~ u,"~' -,-3 hydroxy-2 phényl-3 propionate-
(2R,3S) d'époxy-5~,20 hydroxy-113 IlI~,alUAy~ UAy-10~ oxo-9 propanoyloxy-4a
~ ..uyluAy-2)-2a i-~l ' '' y~uAy-7~ taxène-ll yle-13a sous forme
d'une meringue jaune pâle dont les, sont les suivantes:
- spectre de R M.N. lH (400 ]\~Hz, CDC13, o en ppm): 1,20 (s, 6H: CH3); 1,22 (t,J = 7.5 Hz, 3H: CH3 éthyle); 1,36 (s, 9H: C(CH3)3); 1,71 (s, lH,: OH en 1); 1,89(s, 3H: CH3); 2,05 (s, 3H: CH3); 2,25 et 2,86 (2 mts, lH chacun: CH2 en 6);
2,33 (d, J = 9 Hz, 2H: CH2 en 14); 2,66 (mt, 2H: CH2 éthyle); 3,28 (d, J = 5 Hz,lH:OHen2');3,52(s,3H:OCH3);3,90(d,J=7Hz,lH:Hen3);4,20(AB
limite, J = 16 Hz, 2H: OCOCH2O); 4,27 et 4,50 (2d, J= 9 Hz, lH chacun: CH2 en
20); 4,61 (mt, lH: H en 2'); 4,88 (d large, J = 10 Hz, lH: H en 5); 5,20 (d large,
J=lOHz,lH:Hen3');5,30(d,J=lOHz,lH:CONH);5,50(dd,J=lOet7Hz,
lH:Hen";5,65(d,J=7Hz,lH:Hen2);6,18(tlarge,J=9Hz,lH:Henl3);
6,70 (s, lH: H en 10); 7,18 (dd, J = 5 et 3,5 Hz, lH: H en 4 du thénoyle-2); de
7,30 à 7,50 (mt, 5H: H ~. , en 3'); 7,69 (dd, J= 5 et 1,5 Hz, lH: H en 5 du
thénoyle-2); 7,92 (dd, J = 3,5 et 1,5 Hz, lH: ~ en 5 du thénoyle-2).
Le tert-l. yu~bu~yl-3 (méthoxy-4 phényl)-2 phényl-4 ~
~1~UAY' 5 (2R,4~i,5R) d'époxy-5~,20 hydroxy-113 ' y~ Ay-10~ oxo-9
~, u~!~u-uyluAy-4a (~ uylu.~y-2)-2a h;n~l~tl - ~ r ylUAy-713 taxene-ll
yle-13a peut être préparé de la manière suivante:
A une solution de 55,2 mg d'époxy^5~,20 dihydroxy-1~,13a
Ill~aluAy~l~..,tuAy-10~ OXO-9 lJ~ yluAy-4a (thénoyloxy-2)-2a iHnuu.u.l.~a.~.c
SUIIUII~IUAY-7~ taxène-ll dans 0,1 cm3 de toluène anhydre, on ajoute au~:C6~ ~ '41 mg d'acide tert-1,uluAy.,a.l u..yl-3 (méthoxy4 phényl)-2 phényl-4, ' ' ~ 1,3
35 ~L,UAYIi~U~ 5 (2R,4S,5R), 26 mg de di~ul.. ,Ayl- _.l~l:.",:.i~. et 3 mg de
~ W09Sf3373G 2 ~ 9065 ~ r--llr~ a
29
N,N-di...c~.y' ~4 pyndine. Le mélange réactionnel est agité pendant 2 heures,
SOUS I ~ ` e d'argon, à une t~ Jél~f~u e voisine de 20C, puis déposé sur une
colonne de ~,Iu~ ~ . ' à pression ~ .. . ;.l (15 g de silice (0,063-0,2 mm)
contenus dans une colonne de 1,5 cm de diamètre (gradient d'élution: acétate
d'éthyle~ hluL. ' de 5-95 à 10-90 en volumes) en recueillant des fractions de
10 cm3). Les fractions ne contenant que le produit cherché sont réunies et
f ~,~ à sec sous l~ression réduite (0,27 kPa) à 40C pendant 2 heures. On
obtient ainsi 75,3 mg de tert-bu~uAy~ bull,rl-3 (méthoxy4 phényl)-2 phényl4
,..-,.,1,.1.,.~1,3 ~o~bui~y- 5 (2R,4S,5R) d'époxy-51'~,20 hydroxy-113 méthoxy-
acétoxy-101'~ oxo-9 ~1u~ lvylu~y4a (~ vylu~y-2)-2a ,.inuu~
oxy-71'~ taxène-ll yle-13a sous forme d'une meringue blanche dont les caracté-
ristiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz, CDC13, ~S en ppm): 1,04 (s, 9H: C(CH3)3);
1,04 (t, J = 7.5 Hz, 3H: CH3 éthyle); 1,14 (s, 3H: CH3); 1,16 (s, 3H: CH3); 1,61(s, lH: OH en 1); 1,68 (s, 3H: CH3); 1,81 (s, 3H: CH3); de 2,00 à 2,30 (mt, 4H:
CH2 éthyle et CH2 en 14); 2,03 et 2,80 (2 mts, lH chacun: CH2 en 6); 3,50 (s, 3H:
OCH3); 3,77 (d, J = 7 Hz, lH: H en 3); 3,81 (s, 3H: ArOCH3); 4,13 (AB limite,
J = 16 Hz, 2H: OCOCH20); 4,18 et 4,39 (2d, J = 9 Hz, lH chacun: CH2 en 20);
4,48(d,J=4Hz,lH:H[en2');4,78(dlarge,J=lOHz,lH:Hen5);de5,35à
5SO(mt,2H:Hen3'etllen7);5,55(d,J=7Hz,lH:Hen2) ;5,96(tlarge,J=9
Hz,lH:Henl3);6,34(mt,1H:Hen5');6,56(s,1H:HenlO);6,88(d,J=8
Hz, 2H: H .u, , en ortho du OCH3); 7,13 (dd, J = 5 et 3,5 Hz, lH: H en 4
du thenoyle-2); de 7,30 à 7,45 (mt, 5H: H ~u.~ i4u~,~ en 3'); 7,36 (d, J = 8 Hz, 2H:
H alulll~.li4,,~., en méta dtl OCH3); 7,62 (d large, J = 5 Hz, lH: H en 5 du thénoyle-
2); 7,80 (d large, J = 3,5 ]Hz, lH: H en 5 du thénoyl~2).
L'époxy-51~,20 dihydroxy-113,13f~ ,a~u~y~ tv~ y-lOlfi oxo-9 ~ ylu~y-
4a (11~ vylu~.y-2)-2f~ .rlu~y-71fi taxène-ll peut être préparé de
la manière suivante:
A une solution de 50 mg d'époxy-5~,20 ~ ,tl~u~y~ w~y-lOIf~ oxo-9
I,.u~, Jylu,.y-4a (thénoyloxy-2)-2ft trihydroxy-11~,7l~,13a taxène-ll dans 0,5 cm3
de di~,llv........... anhydre et 0,0255 cm3 de py~idine, maintenue sous ~ v~.`.c~
d'argon, à une i . ~ voisine de 0C, on ajoute goutte à goutte 0,0265 cm3
d'arlhydride i.inuo.. I~ r.. ;~ La solution orangée obtenue est agitée 10
minutes à une t~ . ~ voisine de 0C, 45 minutes à une .c...l c. c vûisine de
20C, p~us: " de 0,1 cm3 d'un mélange méthanol/di~l.lu.. ' (5/95 en
Wo 95n3736 2 1 ~ 0 6 5 1 1~I/rl ~
olumes). La solution est déposée sur une colonne de ~:lu~ ~ ,' à pression
i ~ (10 g de 5ilice (3,063-0,2 rnm) contenus dans une colonne de 1,5 cm
de diamètre (gradient d'élution: méthanol-di.,LIu.. ' de 2-g8 à 5-95 en
Yolumes) en recueillant des fra~tions de 8 cm3). Les fractions ne contenant que le
produit cherché sont réunies et ~ ~_O à sec sous pression réduite (0,27 kPa) à
40C pendant 2 heures. On obtient ainsi 55,2 mg d'époxy-513,20 dihydroxy-1~,13a
ll._;llu~ ~Ay-10~ oxo-9 ~ IwLy~a (~ vylu~y-2)-2a
sullull~lu~y-7i3 taxène-l 1 sous forme d'une meringue blanche.
L'époxy-513,20 trihydroxy-1~,7~,13a If.~ u~y~l~,Glu~y-10~ oxo-9 propanoyl-
oxy-4a (~i~_.luylu~y-2)-2a taxène-ll peut être préparé de la manière suivante:
A une solution de 0,302 g d'époxy-513,20 hydroxy-l~ ll.611lu~ ,tuAy-10
oxo-9 ~,.,. ylu,.y-4a (thénoyloxy-2)-2a b;O(~ ;llyl~ lu~.y)-7~,13a taxène-ll
dans 5 cm3 de ~' ' ' u~l._;L~, on ajoute, à une i , ~ voisine de 20C, 6 cm3
de complexe i ' ~' acide nuull~yl' , (Et3N.3HF). Le mélange réactionnel
est agité pendant 24 heufes à une ~ Iuu~ voisine de 20C puis on ajoute 50 cm3
de dichlulul.._;h~ul., et 100 crn3 d'une solution aqueuse satufée en hydrogéno-
carfbonate de sodium. La phase organique est décantée, lavée pa~f 2 fois 40 cm3 d'une
solution aqueuse saturée de chlorure de sodium puis séchée sur sulfate de ~ .
filtrée et concentrée à sec sous pression réduite (2,7kPs) à 40C. On oWent ainOi
0,24 g d'époxy-5~,20 trihydfoxy-113,713,13a Ir._~lu~u~Ly-1013 oxo-9 propanoyl-
oxy-4a (Ih_~.uyluAy-2)-2a tOxène-ll sous forme d'une meringue blanche dont les
' , sont les suivantes:
- spectre de RM.N. lH (400 MHz, CDC13, o en ppm): 1,07 (s, 3H: CH3); 1,10 (s,
3H: CH3); 1,22 (t, J = 7,5 Hz, 3H: CH3 éthyle); 1,62 (s, lH: OH en 1); 1,69 (s,
3H: CH3); 1,89 et 2,63 (2 mts, lH chacun: CH2 en 6); 2,03 (d, J = 5,5 Hz, lH:
OHenl3);2,07(s,3H:CH3);2,27(d,J=9Hz,2H:CH2enl4);2,35(d,J=4,5
Hz, lH: OH en 7); 2,59 (mt, 2H: CH2 éthyle); 3,52 (s, 3H: OCH3); 3,84 (d, J = 7
Hz, lH: H en 3); 4,23 et 4,43 (2d, J = 9 Hz, lH chacun: CH2 en 20); 4,25 (AB
limite, J = 16 Hz, 2H: OCOCH2O); 4,49 (mt, lH: H en 7); 4,87 (mt, lH: H en
13); 4,95 (d large, J = 10Hz, l]H: H en 5); 5,53 (d, J = 7 Hz, lH: H en 2); 6,42 (s,
lH:HenlO) ;7,14(dd,J=4,5et3,5Hz,lH:Hen4duthénoyle-2) ;7,61 (dd,J=
4,5 et 1,5 Hz, lH: H en 5 du thénoyle-2); 7,83 (dd, J = 3,5 et 1,5 Hz, lH: H en 3 du
thénoyle-2).
2 1 9~65 ~
w0 95~33736 r~~ I.sa
31
L'époxy-513,20 llydroxy-l~ u~y~.tv~y-10l3 oxo-9 ~ ylu~y-4
(lrl.,r.vylu~y-2)-2 I i .(~ bilylu~y)-713,13 taxène-l l peut être préparé de la
manière suivante:
A une solutic,n de 0,5 g d'époxy-513,20 dihydroxy-1~,10~ oxo-9 propanoyl-
oxy4 (~ v.~lu.~y-2)-2a bi~ ybilrlu~.y)-7~,~3 taxène-11 dans 10cm3 de
py-ridine~ on ajoute 0,286 cm3 de chlorure de l~0;1~u~y~ylu à une i
voisine de 0C. Le mélan~e réactionnel est agité pendant 10 heures à une t~
voisine de 20C puis on ajoute 100 cm3 de di~,llu~ et 50 cm3 d'une solution
aqueuse saturée en chlorure d'hl...~ "'.. La phase organique est décantée, lavée par
2 fois 40 cm3 d'une solution aqueuse saturée en chlorure d' puis séchée sulr
sulfate de ~ ' filtrée et concentrée à sec sous pressiûn réduite (2,7 kPa) à
40C. Le résidu obtenu (0,6 g) est purifié par ', ~ ,' sur 50 g de silice
(0,063-0,2 mm) contenu~s dans une cûlonne de 2 cm de diamètre (éluant: acétate
d'éthyle-~;y~ ' ' : 5-95 en volumes) en recueillant des fractions de 10 cm3. Lesfractions ne contenant que le produit cherché sont réunies et ,: ~,~ à sec sous
pression réduite (0,27kP~) à 40C. On obtient 0,320 g d'époxy-513,20 hydroxy-l~
lllu~Lyl~;.,tv~y-1013 oxo-9 ~ ylu~y-4 (~ ylu.~y-2)-2 1~ ~ylu~y)-
713,13 taxène-l 1 sous forme d'une meringue blanche dont les ~ ,
physiques sont les suivantes:
- spectre de R.M.N. lH 1400 MHz, CDC13, ~ en ppm): de 0,50 à 0,70 (mt, 12 H,:
CH2 éthyle): 0,92 (t, J = 7,5 Hz, 9H: CH3 éthyle); 0,98 (t, J = 7,5 Hz, 9H: CH3
éthyle); 1,09 (s, 3H: CH3); 1,15 (s, 3H: CH3); 1,27 (t, J = 7,5 Hz, 3H: CH3 éthyle
en 4); 1,59 (s, lH: OH en 1); 1,65 (s, 3H: CH3); 1,85 et 2,52 (2 mts, lH chacun:CH2 en 6); 2,07 et 2,18 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 2,08 (s, 3H:
CH3); 2,58 (mt, 2H: CH2éthyle en 4); 3,50 (s, 3H: OCH3); 3,73 (d, J = 7 Hz, lH:
H en 3): 4,13 (AB limite, J = 16 Hz, 2H: OCOCH2O); 4,20 et 4,41 (2d, J = 9 Hz,
lH chacun: CH2 en 20); 4,49 (dd, J = 11 et 7 Hz, lH: H en 7); 4,89 (t large, J = 9
Hz,lH:Henl3);4,91(dlarge,J=lOHz,lH:Hen5);5,53(d,J=7Hz,lH:H
en 2); 6,51 (s, lH: H en 10); 7,12 (dd, J = 4,5 et 3 Hz, lH: H en 4 du thiénoyle-2);
7,61 (d, J = 4,5 Hz, lH: H en 5 du tl3iénoyle-2); 7,83 (d, J = 3 Hz, lH: H en 3
- thiénoyle-2).
L'époxy-5~,20 dihydroxy-113,10~ oxo-9 ~JIu~ lvylv~r 4c4 (thénoyloxy-2)-2
Li ~ i.,;llyLlylu~y)-713,13~ taxène-ll peut être prépLré de la manière suivante:A une solution de 0,5 g de ~bull.~ldiuAy-1~,2 époxy-5~,20 méthoxy-
35 acétoxy-1013 oxo-9 ~l~I ylu~y-4 bb(l~ yb;lylv~y)-713,13 taxène-11 dans
21 ~0051
wo sst33736 r- l~r
32
20 cm3 de t;t~ y~Luf~ulc, sous I ' ` ~ d'argon, à ume ~ luue voisine de
-78C, on ajoute 1,5 cm3 d'une solution lM de 2~ ' ' dans le
t;~dllt~Ur, Le mélange réactionnel est agité pendant 35 minutes à une
~: voisine de -78C p~us on ajoute 1 cm3 d'une solution aqueuse saturée en
5 chlorure cl'~ A une t~,.ll~alul~: voisine de 20C, on ajoute 10 crn3 d'une
solution aqueuse saturée en chlorure d'i et 50 cm3 de di~,llvlulll~ lc. La
phase organique est decantée, lavée par 2 fois 10 cm3 d'une solution aqueuse saturée
de chlorure de sodium puis s~chée sur sulfate de l filtrée et conoentrée à
sec sous pression réduite (2,7 kPa) à 40C. On obtient 0,65 g d'un solide que l'on
purifie par ~,u, ~ ur 90 g de silioe (0,063-0,2 mm) contenus dans une
colonne de 1 cm de diamèb~e (éluant: acétate d'ethyle-~:y.' ' ~: 10-90 en
volumes) en recueillant des fractions de 10 cm3. Les fractions ne contenant que le
produit cherché sont réunies ~t ~< w~ à sec sous pression réduite (0,27 kPa) à
40C. On obtient 0,511 g d'él~oxy-5~,20 &ydroxy-113,10~ oxo-9 ~,lu,~,~u.oylu~y4a(~,.. vylu~y-2)-2a bb(~ bil~lu~y)-713,13a taxène-ll sous forme d'une meringue
Wanche dont les ~u,-- t'. ;~ u - physiques sont les suivantes:
- specbre de R.M.N. lH (600 I~Hz, CDCI3, o en ppm): 0,57 (mt, 6 H: CH2 ethyle);
0,68 (mt, 6 H: CH2 éb~yle); 1~,95 (t, J = 7,5 Hz, 9H: CH3 éthyle); 1,01 (t, J = 7.5
Hz, 9H: CH3 éthyle); 1,07 (s, 3H: CH3); 1,17 (s, 3H: CH3); 1,27 (t, J = 7,5 Hz,
3H: CH3 éthyle en 4); 1,73 (s, 3H: CH3); 1,90 et 2,47 (2 mbs, lH chacun: CH2 en
6); 2,02 (s, 3H: CH3); 2,09 et 2,18 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14);
2,60 (mt, 2H: CH2 ebllyle en 4); 3,82 (d, J = 7 Hz, lH: H en 3); 4,24 et 4,44 (2d,
J = 9 Hz, lH chacun: CH2 en 20); 4,26 (d, J = 0,5 Hz, lH: OH en 10); 4,42 (dd,
J=llet7Hz,lH:Hen7);4,93(dlarge,J=lOHz,lH:Hen5);4,97(tlarge,J=
9Hz,lH:Henl3);5,13(d,J=0,5Hz,lH:HenlO);5,53(d,J=7Hz,lH:H
en 2); 7,15 (dd, J = 4,5 et 3 Hz, lH: H en 4 du b~iénoyle-2); 7,63 (d, J = 4,5 Hz,
lH: H en 5 du thénoyle-2); 7,85 (d, J = 3 Hz, lH: H en 3 du thiénoyle-2).
E~F.MPLF. 3
A une solution de 154 mg de tert-l~utv,.y1aLbu.lyl~ iu~0-3 hydroxy-2 phényl-3
~ (2R,3S) de benz~yloxy-2a 1 ,ylu~-4a époxy-513,20 hydroxy-l~
J~ y-1013 OXO-9 i 1~ 1u~y-713 taxène-ll yle-13a dans
2 cm3 d'; ' '- et 200 ~ e toh~ url . on ajoute succ.~ . 96 mg de
tamis ' ' ~, 4A en poudre, 225 mg de chlorure de sodium. Le mélange
réactionnel est maintenu sous agitation à une . c voisine de 75C pendant
2lsa6sl
WO 9S133736 r ~ r 5'~ ~Ja
33
5 heures p us, à une ~ <,Lu e voisine de 20C, additionné de 15 cm3 de
d;~,l-lu-- et 10 crl3 d'une solution aqueuse saturée de chlorure de sodium. La
- phase organique est décantée, lavée par 2 fois 20 crn3 d'une solutif n aqueuse saturée
de chlorure de sodium puis séchée sur sulfate de ~ ~ ~ r~ . l, filtrée et concentrée a sec
sous pression réduite (2,7 kPa) a 40C. On obtient 133 mg que l'on purifie par
u}~. ,, .' sur 80 g de silice (0,063-0,2 mm) contenus dans une colonne de
1 cm de diamètre en éluant avec un mélange di~ ~. ' ' méthanol (98-2 en
volumes) et en recueillant des fractifns de 10 cm3. Les fractions ne contenant que le
produit cherché sont réunies et ~ ~s à sec sous pression réduite (2,7 kPa) à
40C. On obtient 63 mg de tert-bu~w y~ ~ul,u~ .. ulo-3 hydroxy-2 phényl-3
~ul (2R,3S) de benzoyloxy-2a buLuluylu~y~a époxy-51'i,20 hydroxy-ll'i
~-0Ll~u~y~éLu~y-101'i méthylène-71'i,8 nor-l9 oxo-9=taxène-11 yle-13a sous formed'une meringue blanche elt dont les f - - - ' , physiques sont les suivantes:
- spectre de R.M.N. IH (~00 MHz; CDC13; o en ppm): 0,92 (t, J = 7,5 Hz, 3H: CH3
du propyle); 1,26 (s, 6H: CH3); 1,31 (s, 9H: C(CH3)3); 1,42 (mt, lH: H en 7);
1,71 et 2,26 ~2 mts, lH chacun: CH2 en 19); de 1,60 à 1,85 (mt, 2H: CH2 du
propyle); 1,86 (s, 3H: CH3); 1,88 (s, lH: OH en 1); 2,12 et 2,50 (Ica~.,Li~. d
large et mt, J = 16 Hz, lH chacun: CH2 en 6); 2,23 et 2,39 (le~Li~. mt et dd,
J = 16 et 9 Hz, 2H: C~2 en 14); 2,49 et 2,65 (2 mts, lH chacun: OCOCH2 du
propyle); 3,25 (mt, lH: ~H en 2'); 3,51 (s, 3H: OCH3); 4,05 et 4,32 (2 d, J = 9 Hz,
lHchacun:CH2en20);4,10(d,J=7Hz,lH:Hen3);4,16et4,22(2d,J=16
Hz, lH chacun: OCOCH2O); 4,62 (mt, lH: H en 2'); 4,68 (d large, J = 4,5 Hz, lH:
Hen5);5,25(dlarge,J=lOHz,lH:Hen3');5,30(d,J=lOHz,lH:CONH);
5,65(d,J=7Hz,lH:Hen2);6,23(tlarge,J=9Hz,lH:Henl3);6,42(s,1H:
H en 10); de 7,25 à 7,45 (mt, 5H: H lUullldti4uw en 3'); 7,51 (t, J = 7,5 Hz, 2H:
OCOC6Hs H en méta); 7,62 (t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,16 (d, J =
7,5 Hz, 2H: OCOC6Hs H en ortho).
Le tert-buLu~.y~ bully -3 hydroxy-2 phényl-3 ~ r (2R,3S) de
~.~ylu~y-2a 1 yl~ y4a époxy-51'i,20 hydro~y-ll'i lll~llu~dury-101fi oxo-9
30 L~inuu'' ~furlu~y-7~ taxène-ll yle-13a peut être preparé de la manière
suivante:
Une solution de 400 mg de tert-~ y~bullyl-3 (méthoxy-4 phényl)-2
phényl-4 ..~ ,"1..1~ 1,3 ~ubu~.y' 5 (2R,4S,5R) cle benzoyloxy-2a ~uuu~vylu~y4a
époxy-51'i,20 hydroxy-ll'i ~ .L~lu~,.,.u~y-10~ oxo-9 L in~ ylu~y-713
taxène-ll yle-13a dans 6,4 cm3 d'une solution 0,1N d'éthanol chlu.;.y,' . est
2 1 9/~65 1
wo 95/33736 P~~
~ .
34
maintenue sous agitation à une le-~.aLul~ Yoisine de 0~C pendant 6 heures puis àurle l~,.ll~.~-Lu-c voisine de 20C pendant 15 heures. Le milieu réactionnel estconcentré à sec sous pression réduite (2,7 kPa) à 20C. Le produit brut de la réaction
est dissous dans 20 cm3 de di~,Llo~ ' et 10 cm3 d'une solution aqueuse saturée
5 de i ' de sodium. La phase aqueuse est séparée par ~ puis extraite
par 2 fois 20 cm3 de di~Llu~u~ ,. Les phases orgaluques sont réunies, lavées par30 cm3 d'eau distillée p us séchées sur sulfate de ~ ' filtrées et, ~ à
sec sous pression réduite (2,7 I;Pa) à 20C. On obtient 410 mg d'un prcduit que l'on
purifie par .,1... ~ .-- s~tr 60 g de silice (0,063-0,2 mm) contenus dans une
10 colonne de 1 cm de diamètre en éluant avec un mélange (d;~,llu,, ' méthanol
98,5-1,5 en volumes) et en recueillant des fractiûns de 10 cm3. Les fractions necontenant que le Foduit cherché sont réunies et rt~ à sec sous FeSSion
réduite (2,7 kPa) à 20C. On obtient 307 mg de tert-~ u.. yl.llllill~3
hydroxy-2 phényl-3 P~l (2R,3S) de benzoyloxy-2a ' ~lu~.y-4a épox,Y-
5~,20 hydrox,Y-1~ u~ y-10~ oxo-9 Lliiluul~ '' '' .ylw~y-7
taxène-ll yle-13a sous forme d'une meringue blanche et dont les . .
physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDC13; ~ en ppm): 0,93 (t, J = 7,5 Hz, 3H: CH3
du prcpyle); 1,22 (s, 3H: CH3); 1,24 (s, 3H: CH3); 1,35 (s, 9H: C(CH3)3); de 1,65
à 1,85 (mt, 2H: CH2 du propyle); 1,74 (s, lH: OH en 1); 1,88 (s, 3H: CH3); 2,04
(s, 3H: CH3); 2,25 et 2,86 (2 mts, lH chacun: CH2 en 6); 2,33 (d, J = 9 Hz, 2H:
CH2 en 14); 2,52 et 2,66 (2 mts, J = 14,5 et 6,5 Hz, lH chacun: OCOCH2 du
propyle); 3,33 (d, J = 4 Hz, lH: OH en 2'); 3,52 (s, 3H: OCH3); 3,94 (d, J = 7 Hz,
lH: H en 3); 4,16 et 4,21 (2 d, J = 16 Hz, lH chacun: OCOCH2O); 4,19 et 4,35 (2
d, J = 9 Hz, lH chacun: CH2 en 20); 4,62 (mt, lH: H en 2'); 4,86 (d large, J = 10
Hz,lH:Hen5);5,22(dlarge,J=lOHz,lH:Hen3');5,33(d,J=lOHz,lH:
CONH);5,50(dd,J=llet8Hz,lH:Hen7);5,73(d,J=7Hz,lH:Hen2);
6,16 (t large, J = 9 Hz, lH: H en 13); 6,71 (s, lH: H en 10); de 7,25 à 7,45 (mt, 5H:
H ~ en 3'); 7,51 (t, J = 7,5 Hz, 2H: OCOC6Hs H en méta); 7,63 (t, J = 7,5
Hz, lH: OCOC6Hs H en para); 8,12 (d, J = 7,5 Hz, 2H: OCOC6Hs H en ortho).
Le tert-' .r~lnJ~l.rl-3 (méthoxy4 phényl)-2 phényl4 "~ 1,3
w~l~y' -5 (2R,4S,5R) de b~nzoyloxy-2a 1~ .ylu~4c~ épox~Y-5~,20 hydrox~Y-
,Lh~ u~-10fl oxo-9 ~ Jlu,~r-713 taxène-ll yle-13a
peut être préparé de la manière suivante:
~ woss~33736 2 1 9~ t ~ r~ ~ a
A une solution de 400 mg de benzoyloxy-2c~ l ylv~y4a dihydrvxy-
1~,13c~ époxy-5~,20 II~;;-V IYA~ V~Y-1O~ oxo-9 Llinuv~ vllYlvAr-7l3
- taxène-ll dans 10 cm3 d'acétate d'éthyle anhydre, on ajoute succ~ .lL 247 mg
d'acide tert-b..~Ay~lJvll.~l-3 (méthoxy4 phényl)-2 phényl4 ~ r 1,3
5 ~;~ul~yLqu~ 5 (2R,4S,5R~, 186 mg de d;~, ' ' yl~; " ' et 12,5 mg de
4~ ' Le mélange réactionnel est agité pendant 15 heures, sous
allllv~l,h~e d'argon, à ulle t~ ~., voisine de 20C, puis concentré à sec sous
pression rédlute (2,7 l~a) à 40C. On obtient 1 g d'um produit que l'on purifie par
,- O ,- sur 100 g de silice (0,063-0,2 mm) contenus dans une colonne de
3 cm de dl-amètre en élllant avec un mélange ~- v~ll;.~.~æ-méthanol (95-5 envolumes) et en recueillamt des fractions de 12 cm3. Les fractions ne contenant que le
produit cherché sont réunies et ~ à sec sous pression réduite (2,7 kPa) à
40C. On obtient 410 mg de tert-l,."v,~y.,A l~llyl-3 (méthoxy-4 phényl)-2 phényl4
-1,3 ~,lbv~y -5 (2R,4S,5R) de benzoyloxy-2a ~uL~ulvylv~.y4a époxy-
513,20 hydroxy-1~ u~y~ y-10~ oxo-9 L inuvl~ - - r ~IV~Y-7l3
taxène-ll yle-13a sous forme d'une meringue blanche et dont les . A~
physiques sont les suiYantes:
- spectre de R.M.N. lH (~00 MHz; CDCl3; o en ppm): 0,92 (t, J = 7,5 Hz, 3H: CH3
du propyle); 1,07 (s, 9H: C(CH3)3); 1,17 (s, 6H: CH3); de 1,55 à 1,70 (mt, 3H:
CH2 du propyle et OH en 1); 1,64 (s, 3H: CH3); 1,84 (s, 3H: CH3); 2,08 et de 2,15
à 2,30 (I~Li~. dd et mt, J = 16 et 9 Hz, lH chacun: CH2 en 14); de 2,15 à
2,30 et 2,82 ~2 mts, lH chacun: CH2 en 6); de 2,15 à 2,30 (mt, 2H: OCOCH2 du
propyle); 3,51 (s, 3H: OCH3); 3,82 (s, 3H: ArOCH3); 3,83 (d, J = 7 Hz, lH: H en
3); 4,12 et 4,28 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,14 et 4,22 (2 d, J = 16 Hz,
lH chacun: OCOCH2O); 4,52 (d large, J = 4,5 Hz, lH: H en 2'); 4,79 (d large, J =10Hz,lH:Hen5);de5,35à5,50(mt,1H:Hen3');5,44(dd,J=9et7Hz,lH:
Hen7);5,67(d,J=7Hz,lH:Hen2);5,99(tlarge,J=9Hz,lH:Henl3) ;6,40
(mf, lH: H en 5'); 6,59 (s, lH: H en 10); 6,92 (d, J = 8,5 Hz, 2H: H _~,IlI. Li~u.,,, en
ortho du OCH3); de 7,25 à 7,45 (mt, 5H: H ~v~lldti4u~ en 3'); 7,37 (d, J = 8,5 Hz,
2H: H ~. . en méta du OCH3); 7,48 (t, J = 7,5 Hz, 2H: OCOC6Hs H en
méta); 7,63 (t, J = 7,5 ~z, lH: OCOC6Hs H en para); 8,11 (d, J = 7,5 Hz, 2H:
OCOC6Hs H en ortho).
Le benzoylox~Y-2a 1 ylo~.y4a dihydroxy-1~,13a époxy-513,20
~ Lllu~ Lv~y-loll3l OXO-9 i ~..~ '- r ~Iv~y-7~ taxène-ll peut etre
35 préparé de la man3ère suiYan~:
WO95/33736 2l~a65~ r~_'C
36
A une solution de 389 mg de benzoyloxy-2a bu~-uylu~y-4a époxy-
5~,20 1llclllw~ya~u~yl-l0l3 0~0-9 trihydroxy-1~,7j3,13a taxène-ll dans 6 cm3 de
" ' ' Ulll., '-lal~ anhydre et 390 ,ul de pyridine, maintenue sous a~lllu~ h ~i d'argon, à
une i .' ~ voisine de aloc, on ajoute goutte à goutte 410 111 d'anhydride
5 hirl.lul. ' '~ , La solution orangée obtenue est agitée 15 minutes à une
~ la~ul~ voisine de 0C puis -'" de 3 crn3 d'eau et 50 cm3 de
di~,llulull~,hlall~. La phase organique est décantée, lavée par 2 fois 40 crn3 d'une
solution aqueuse saturée de chlorure de sodium puis séchée sur sulfate de
filtrée et concentrée à sec sous pression réduite (2,7 kPa) à 40C. On obtient 510 mg
que ron purifie par ~,}.. , " . ' sur 70 g de silioe (0,063-0,2 mm) contenus dars
une colonne de 1 cm de diamètre en éluant avec un mélange di~ lu~u~ thane-
méthanol (95-5 en volumes) et en recueillant des fractions de 10 crn3. Les fractions ne
contenant que le produit cher~hé sont réunies et, ~ à sec sous pression
réduite (2,7 kPa) à 40C. On obtient 410 mg de 1~.~uylu~y-2a ~ yluAy4a
dihydroxy-113,13a époxy-5~,20 IY~6~lu~aoetvr.y-10l3 oxo-9 h~ u.
sulfonyloxy-7~ taxène-ll sous forme d'une meringue blanche et dont le~
' lu ~ physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDC13; o en ppm): 1,06 (t, J = 7,5 Hz, 3H: CH3
du propyle); 1,06 (s, 3H: CH3); 1,20 (s, 3H: CH3); 1,63 (s, lH: OH en 1); 1,77
(mt, 2H: CH2 du propyle); 1,87 (s, 3H: CH3); 2,18 (d, J = 5 Hz, lH: OH en 13);
de 2,15 à 2,40 (AB limite, 2H: CH2 14); de 2,15 à 2,40 et 2,89 (2 mts, lH chacun:
CH2 6); 2,25(s, 3H: CH3); 2,59 (AB lirnite, J = 16 et 7,5 Hz, 2H: OCOCH2 du
propyle); 3,51 (s, 3H: OCH3); 4,03 (d, J = 7 Hz, lH: H 3); 4,16 et 4,24 (2 d, J = 16
Hz, lH chacun: OCOCH2O); 4,18 et 4,35 (2 d, J = 9 Hz, lH chacun: CH2 20); 4,85
(mt, lH: H 13); 4,92 (d large, J = 10 Hz, lH: H 5); 5,57 (dd, J = 10,5 et 7 Hz, lH:
H7);5,68(d,J=7Hz,lH:H2);6,73(s,1H:H10);7,51 (t,J=7,5Hz,2H:
OCOC6H5 H méta); 7,63 (t, J = 7,5 Hz, lH: OCOC6Hs H para); 8,10 (d, J = 7,5 Hz,
2H: OCOC6Hs H ortho).
Le ~.~uyluA.~-2a 1 ,ylu~y-4a époxy-5~,20 Ill.,illu~a~,c~u~y-10l3 oxo-9
trihydroxy-1~,713,13c~ taxène-ll peut être préparé de la manière suivante:
A une solution de 580 mg de benzoyloxy-2cI bulul~ylu~y 4a
bii~(hical~lsilylu~y)-7;3,13a époxy-5~,20 hydroxy-l~ ll.;;~lu~.~a.,.,tu~ y-10l3 oxo-9
taxène-ll dans 5 crn3 de f" ' " ' ~, on ajoute, à une i r' ' t~ voisine de
20C, 5,5 cm3 de complexe hi;;h~' acide r~ hiq~. Le mélange réactionnel
35 est agité pendant 23 heures à u~e i . ~i voisine de 20C puis on ajoute 50 cm3
2 1 ~5 t
~ WO 95133736 r~l~r~ J:~
37
de di, Ll~,.~,.~.c,ll.dlle et 100 cm3 d'une solution aqueuse saturée cl'~y~LvO_..ou~L
de sodium. La phase organique est décantée, lavée par 2 fois 20 cm3 d'une solution
aqueuse saturée de chlorure de sodium puis séchée sur sulfate de rr~Pei..m filtrée et
concentrée à sec sous pression réduite (2,7 kPa) à 40C. On obtient 520 mg que l'on
- 5 purifie par ~1.. , O .' - sur 70 g de silice (0,063-0,2 rnm) contenus dans une
colonne de 2 cm de diamètre en éluant avec un mélange méthanol-~ ;L~ul~
(5-95 en volumes) et en L!ecueillant des fractions de 10 cm3. Les fractions ne contenant
que le produit cherché sont réunies et ~ ~., à sec sous pression réduite
(2,7 kPa) à 40C. On obtient 389 mg de benzoyloxy-2a L~ul u~vylv~ y-4a époxy-5~,20
~ .y~ tv~y-10~ oxo-9 trihydroxy-1~,7~,13a taxène-ll sous forme d'une
meringue blanche et don~ les ~ physiques sont les sui~antes:
- spectre de R.M.N. lH ~(400 MHz; CDCI3; ~3 en ppm): 1,05 (t, J = 7,5 Hz, 3H: CH3
du propyle); 1,11 (s, 6l~: CH3); 1,67 (s, 3H: CH3); 1,71 (s, lH OH en 1); 1,75
(mt, 2H: CH2 du propyle); 1,85 et de 2,45 à 2,65 (2 mts, lH chacun: CH2 en 6);
2,05 (s, 3H: CH3); 2,24 (d, J = 5 Hz, lH: OH); 2,28 (AB limite, J = 16 et 9 Hz, 2H:
CH2 en 14); 2,40 (d, J = 4 Hz, lH: OH); 2,56 (AB limite, 2H: OCOCH2 du
FPYIe) ;3,51 (s,3H:OCH3) ;3,88(d,J=7Hz,lH:Hen3) ;4,15et4,32(2d,J=
9 Hz, lH chacun: CH2 en 20); 4,23 (AB Limite, J = 16 Hz, 2H: OCOCH2O); 4,48
(mt,lH:Hen7);4,86(mt,1H:Henl3);4,94(dlarge,J=lOHz,lH:Hen5);
5,62(d,J=7Hz,lH:Hen2);6,43(s,1H:HenlO);7,49(t,J=7,5Hz,2H:
OCOC6H5 H en méta); 7,62 (t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,12 (d, J =
7,5 Hz, 2H: OCOC6H5 ll en ortho).
Le benzoyloxy-2a L~uku~oylu~y-4a L,~ lvi~y)-7~,13a époxy-5~,20
hydroxy-l~ ."~ u.~yl.~é~u~y-10~ oxo-9 taxène-ll peut être préparé de la manière
suivante:
A une solution de 906 mg de benzoyloxy-2a L~uku.~)ylo~y-4a dihydroxy-
1~,10j3 Li~(lli0~1~ 1v.~y)-7~,13a epoxy-5~,20 oxo-9 taxène-ll dans 18 cm3 de
pyridine, on ajoute 1,03 cm3 de chlorLlre de ~ Iv~ yl~, à une . , ~ voisine
de 0C Le mélange réactionnel est agité pendant 14 heures à une t~ UI~ voisine
de 20C puis on ajoute 20 cm3 de ~ , et 20 cm3 d'une solution aqueuse
saturée de chlorure d' La phase organique est décantée, lavée par 4 fois
20 cm3 d'une solutiorl aqueuse saturée de sulfate de cuivre, 2 fois 40 cm3 d'unesolution aqueuse saturée de chlorure d' puis séchée sur sulfate de
filtrée et concentrée à sec sous pression réduite (2,7 kPa) à 40C. On
obtient 800 mg d'un produit que l'on purifie par ~,Iu. O . - - sur 100 g de silice
w0 95133736 2 ~ 9 3 6 ~ 1 P~l/r~ 5 ~
38
(0,063-0,2 mm) contenus dans une colonne de 2,5 cm de diamètre en éluant avec unmélange méthanol-dichlu.~ .al~ (2-98 en volumes) et en recueillant des fractionsde 15 cm3. Les fractions ne contenant que le produit cherché sont réunies et
Wl-~ ~ à sec sous pression réduite (2,7 kPa) à 40C. On obtient 580 mg de
benzoyloxy-2a ~uk~ yl~Ay4a 1,;~ ,b;lyloxy)-7'13,13a époAy-5t3,20 hydroxy-
lt3 lll6;1l~A~ra~vAy-1013 oxo-9 taxène-11 sous forme d'une meringue blanche et dont
les ~ physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3 o en ppm): 0,60 et 0,68 (2 mts, 6H
chacun: CH2 de l'éthyle); 0,95 et 1,04 (2 t, J = 7,5 Hz, 9H chacun: CH3 de l'éthyle);
1,09 (t, J = 7,5 Hz, 3H: CH3 du propyle); 1,13 (s, 3H: CH3); 1,18 (s, 3H CH3);1,64 (s, lH: OH enl); 1,68 (s, 3H: CH3); 1,84 (mt, 2H: CH2 du propyle); 1,89 et
2,50 (2 mts, lH chacun: CH2 en 6); 2,11 et 2,23 (2 dd, J = 16 et 9 Hz, lH chacun:
CH2 en 14); 2,13 (s, 3H: CH3); 2,55 (mt, 2H: OCOCH2 du propyle); 3,53 (s, 3H:
O CH3); 3,82 (d,J = 7 Hz, lH: H en 3); 4,13 et 4,31 (2 d, J = 9 Hz, lH chacun:
CH2 en 20); 4,16 (AB limite, .J = 16 Hz, 2H: OCOCH2Ol; 4,52 (dd, J = 11 et 7 Hz,lH:Hen7);4,91(mt,1H:lHenl3);4,93(dlarge,J=lOHz,lH:Hen5);5,64
(d, J = 7 Hz, lH: H en 2); 6,54 (s, lH: H en 10); 7,47 (t, J = 7,5 Hz, 2H:
OCOC6H5 H en méta); 7,61 (t, J = 7,5 Hz, lH: OCOC6Hs H en para); 8,11 (d, J =
7,5 Hz, 2H: OCOC6Hs H en crtho).
Le benzoyloxy-2a ~ yl,JAy-4a dihydroxy-113,1013 L- ' ' ;I~;IYIrJAY)-
713,13a épo~y-513,20 oxo-9 ta~.ène-11 peut étre prepare de la manière suivante:
A une solution de 907 mg de buLarl~ylrJA~r~lCc carbonate-113,2a
b~(Lr;6~b;l~,lvAy)-7t3~l3a époAy-513,20 l~ JA~a~,~t~lAy-1013 oxo-9 taxène-11 dans
50 cn3 de ~ v~,,..~ anhydre, on ajoute 2,34 cm3 d'une solution lM de
25 ~,}i.,..~" ' dans le i ' "J.~,r, à une ~ alr~ voisine de -78C Le
mélange réactionnel est agité pendant 1 heure à une i , ~, voisine de -78C puison ajoute 10 cm3 d'une solution aqueuse saturée de chlorure ," A une
~ ll~laLur.~ voisine de 20C, on a30ute 20 cm3 d'une solution aqueuse saturee dechlorure rl'i ' et 50 cm3 de d;-,l~.. '' La phase organique est
30 décantée, lavée par 2 fois 10 cm3 d'une solution aqueuse saturée de chlorure de
sodium puis séchée sur sulfate de ~ filtrée et concentrée à sec sous pression
réduite (2,7 kPa) à 40C On obtient 1,3 g que l'on purifie par ,~ ,' sur
150 g de silice (0,063 0,2 mm) contenus dans une colonne de 5 cm de diamètre en
éluant avec un mélange acétate d'éthyle-,~y,' ' (10-90 en volumes) et en
35 recueillant des fractions de 18 cm3. Les fractions ne contenant que le produit cherché
2 1 ~0~5
W095133736 r~ /J~
39
svnt réunies et f- - ~a à sec sous pression réduite (2,7 kPa) à 40C. On obtient906 mg de benzoyloxy-2a buLu.vylv~r-4a dihydroxy-l~,lOfl ' rlbilrlv~-
713,13a épvxy-5~,20 oxo-9 taxène-ll sous fotme d'une meringue blanche et dont les
.,~u~i , physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3; o en ppm): 0,56 et 0,67 (2 mts, 6H
chacun: CH2 de réthyle); 0,95 et 1,03 (2 t, J = 7,5 Hz, 9H chacun: CH3 de l'éthyle);
1,08 (s, 3H: CH3); 1,10 (t, J = 7,5 Hz, 3H: CH3 du propyle); 1,18 ~s, 3H: CH3);
1,60 (s, lH: OH en 1); 1,73 (s, 3H: CH3); 1,84 (mt, 2H: CH2 du prvpyle); 1,91 et2,48 (2 mts, lH chacun: CH2 en 6); 2,03 (s. 3H: CH3); 2,11 et 2,22 (2 dd, J = 16 et
9 Hz, lH chacun: CH2 en 14); 2,58 (mt, 2H: OCOCH2 du prvpyle); 3,87 (d, J = 7
Hz,lH:Hen3);4,18et4,32(2d,J=9Hz,lHchacun:CH2en20);4,28(d,J=2
Hz, lH: OH en 10); 4,42 (dd, J = 10,5 et 6,5 Hz, lH: H en 7); 4,93 (d large, J = 10
Hz,lH:Hen5);4,98(1:~J=9Hz~lH:Henl3);5~l7(d~J=2Hz~lH:Henlo);
5,62 (d, J = 7 Hz, lH: H en 2); 7,49 (t, J = 7,5 Hz, 2H: OCOC6H5 H en méta); 7,61
(t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,12 (d, J = 7,5 Hz, 2H: OCOC6H5 en
ortho).
Le buL~vrlvA~/-4a carbonate-1~3,2a b;a(~ rlailylu~r)-7~,13a épvxy-
5~,20 I~ lv~ tv,.r-lO~ oxo-9 taxène-ll peut être préparé de la manière suivante:A une solution de 870 mg de carbonate-1j3,2a ~;a(hi6~lrlailyloxy)-7~,13a
époxy-513,20 hydrvxy~la ~ 1lu~ tu~r-10~ oxo-9 taxène-ll dans 15 cm3 de
dichlO~u~ tl~ .,, on ajoute 1,46 g de 4~ Ulv~r " et 3,90 cm3
d'anhydride butyrique. Le milieu réactionnel est chauffé à ume; , c: voisine de
42C pendant 45 heures. On ajoute 50 cm3 d'une solution aqueuse saturée de chlorure
de sodium et 50 cm3 de dichlu.u.l.~ . La phase organique est décantée, lavée par2 fois 40 cm3 d'une solution aqueuse saturée de chlorute de sodium puis séchée sur
sulfate de v filtrée et concentrée à sec sous pression réduite (2,7 kPa) à
40C. On oWent 2,0 g qule l'on putifie par ~ O . ' sur 170 g de silice (0,063-
0,2 mm) contenus dans cme colonne de 3 cm de diamètre en éluant avec un mélange
acétate d'éthyle-~.' ' - (5-95 en volumes) et en recueillant des fractions de
15 cm3. Les fractions ne contenant que le produit cherché sont réunies et rr ~
à sec sous pression réduite (2,7 kPa) à 40C. On obtient 1,00 g de 1,uLu.vrlu~r-4a
carbonate-1~,2a dil~;61.~1~;1rlu~r-7~,13a ép~xy-513,20 ~ u~lu~,tv~r-10j3 oxo-9
taxène-11 sous forme d'une meringue blanche et dont les . ~ physiques
sont les suivantes:
2T ~a~l
woss/33736 r~.,~ ,c /~a
- spectre de R.M.N. lH (400 MHz; CDCI3: o en ppm): de 0,50 à 0,70 (mt, 12H:
CH2 de l'éthyle); de 0,90 à 1,10 (mt, 21H: CH3 de l'éthyle et CH3 du propyle); 1,18
(s, 3H: CH3); 1,28 (s, 3H: CH3); 1,73 (mt, 2H: CH2 du propyle); 1,75 (s, 3H:
CH3); 1,92 et 2,59 (2 mts, lH chacun: CHz en 6); 2,13 (s, 3H: CH3); 2,14 et de
2,35 à 2,45 (~ lcll~ dd et mt, J = 16 et 9 Hz, lH chacun: CH2 en 14); de
2,35 à 2,45 (mt, 2H: OCOCH2 du propyle); 3,42 (d, J = 6,5 Hz, lH: H en 3); 3,51
(s, 3H: OCH3); 4,18 (s, 2H: OCOCH2O); 4,46 (dd, J = 10 et 6,5 Hz, lH: H en 7);
4,50 et 4,63 (2 d, J = 9 Hz, lH[ chacun: CH2 en 20); 4,51 (d, J = 6,5 Hz, lH: H en
2); 4,93 (d large, J = 10 Hz, IH: H en 5); 5,02 (t large, J = 9 Hz, lH: H en 13);
6,51 (s,lH:HenlO).
FX~ pLF 4
En opérant comme dans l'exemple 3, et à partir de tert-butu~yucu~u~.rl-
anqino-3 hydroxy-2 phényl-3 ~UpiO~ , (2R,3S) de b~.~v~lu~y-2a ~h_.~.yL~c6.u~.y-4a
6poxy-5~,20 hydroxy~ 6;1lw~ vcLu~y-10~ oxo-9 Llln~.ul.~ r ~ luAy-7
taxène-ll yle-13, on obtient le tert-l y~olbullyl~llillu-3 hydroxy-2 ph6~nyl-3
(2R,3S) de benzoyloxy-2a époxy-5j3,20 hydroxy-113 ...~LIIU~ LUJC~-1O~
m6~thylène-713,8 nor-l9 oxo-9 1' ~lLl~Lu~y4a taxène-ll yle-13a dont lw
". ~ sont lw suivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3; ô en ppm): 1,24 (s, 15H: CH3 - CH3 et
C(CH3)3); 1,40 (mt, lH: H en 7); 1,66 et 2,24 (2 dd, J = 6 et 5 Hz et J = 10 et 6 Hz,
lH chacun: CH2 en 19); 1,92 (s, lH: OH en 1); 1,96 (s, 3H: CH3); 2,07 et 2,46
(.~,~,li~. d large et dt, J = 16 Hz et J = 16 et 4,5 Hz, lH chacun: CH2 en 6);
2,32 et 2,54 (~ . dd et dd large, J = 16 et 9 Hz, lH chacun: CH2 en 14);
3,24 (mt, lH: OH en 2'); 3,53 (s, 3H: OCH3); 3,90 et 4,14 (2 d, J = 15 Hz, lH
chacun: OCOCH2Ar); 4,00 et 4,16 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,20 et
4,26 (2 d, J = 16 Hz, lH chacun: OCOCH2O); 4,23 (d, J = 7 Hz, lH: H en 3); 4,55
(dlarge,J=4,5Hz,lH:Hen5);4,63(mt,1H:Hen2');5,31(ABlimite,2H:H
en3'etCONH);5,71(d,J=7Hz,lH:Hen2);6,34(tlarge,J=9Hz,lH:Hen
13); 6,44 (s, lH: H en 10); de 7,10 à 7,45 (mt, 10H: H ~u. . et H
~uulll~:l;quw en 3'); 7,51 (t, J = 7,5 Hz, 2H: OCOC6Hs H en méta); 7,63 (t, J = 7,5
Hz, lH: OCOC6Hs H en para); 8,16 (d, J = 7,5 Hz, 2H: OCOC6Hs H en ortho).
En operant dans dw conditions analogues à celles d6crites dans l'exemple 3, on
prépare le tert-l ~ubull~ '-3 hydroxy-2 phényl-3 ~ r- ' (2R,3S) de
21 ~0~5 t
~WO 95133736 r~,l/r~ a
41
~.~uyl~ y-2a époxy-5~,20 hydroxy-l~ lu~yd~ u~y-1013 oxo-9 ~ ,.lyl~tv~y-
4a; .A ~ lu~y-7~ taxène-ll yle-13a dont les ~ sont
les suivnateS:
- rpectre de R.M.N. lH (400 MHz; CDCI3; ~ en ppm): 1,24 (s, 6H: CH3); 1,36 (s,
5 9H: C(CH3)3); 1,74 (s, lH: OH en 1); 1,87 (s, 3H: CH3); 2,14 (s, 3H: CH3); 2,19
et 2,83 (2 mts, lH chacun: CH2 en 6); 2,39 et 2,48 (2 dd larges, J = 16 et 9 Hz, lH
chacun: CH2 en 14); 3,38 (d, J = 4,5 Hz, lH: OH en 2'); 3,53 (s, 3H: OCH3); 3,90et 4,14 (2 d, J = 15 Hz, lH chacun: OCOCH2Ar); 4,01 (d, J = 7 Hz, lH: H en 3);
4,11 et 4,20 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,17 et 4,25 (2 d, J = 16 Hz, lH
chacun: OCOCH2O); 4,65 (mt, lH: H en 2'); 4,68 (d large, J = 10 Hz, lH: H en
5); 5,28 (d large, J = 10 Hz, lH: H en 3'); 5,35 (d, J = 10 Hz, lH: CONH); 5,50
(dd, J = 10 et 7 Hz, lH: ]~ en 7): 5,77 (d, J = 7 Hz, lH: H en 2); 6,28 (t large, J = 9
Hz, lH: H en 13); 6,74 (s, lH: H en 10); de 7,15 à 7,45 (mt, 10H: H ~llUllld~ u~et H <UUIna~iqU~ en 3'); '7,51 (t, J = 7,5 Hz, 2H: OCOC6Hs H en méta); 7,66 (t, J =
7,5 Hz, lH: OCOC6H5 H en para); 8,08 (d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho).
En opérant dans des conditions analogues à celles décrites dans l'exemple 3,
on prépare le tert-l,utu~y~a~lJu~ -3 (méthoxy-4 phényl)-2 phényl-4 I..,.,.l~ 1,3ul~yld~-5 (2R,4S,5R) de benzoyloxy-2a époxy-51A~,20 hydroxy-113 méthoxy-
acétoxy-1013 oxo-9 ~ 1~é~u~y4a l-illUu -~ lfonyloxy-7~ taxène-ll
yle-13a dont les, , sont les suivantes:
- spectre de R.M.N. lH (~00 MHz; CDCI3; une ~elll~ ld~UUC: de 333K, ~ en ppm):
1,06 (s, 9H: C(CH3)3); 1,12 (s, 3H: CH3); 1,24 (s, 3H: CH3); 1,66 (s, lH: OH en
1); 1,83 (s, 3H: CH3); 1,86 (s, 3H: CH3); 2,14 et 2,79 (2 mts, lH chacun: CH2 en6); 2,24 et 2,30 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,45 et 3,58 (2 d, J =
15 Hz, lH chacun: OCOCH2Ar); 3,54 (s, 3H: OCH3); 3,85 (s, 3H: ArOCH3);
3,94(d,J=7Hz,lH:Hen3);4,08et4,17(2d,J=9Hz,lHchacun:CH2en20);
4,14 et 4,22 (2 d, J = 16 H[z, lH chacun: OCOCH,O); 4,59 (d large, J = 10 Hz, lH:
Hen5);4,63(d,J=5,5Hz,lH:Hen2');5,45(d,J=5,5Hz,lH:Hen3') ;5,47
(mt,lH:Hen7);5,72(d,J=7Hz,lH:Hen2);6,14(tlarge,J=9Hz,lH:Hen
13); 6,34 (s, lH: H en '3'); 6,65 (s, lH: H en 10); 6,94 (d, J = 8,5 Hz, 2H: H
~uulllaliq~c~ en ortho du OCH3); de 7,20 à 7,45 (mt, 12H: H ~UUIllaiiqu~ et H
aLUl~ldti~lUe~i en méta du OCH3 et H ~U~I~IIa~i~UC~ en 3'); 7,48 (t, J = 7,5 Hz, 2H:
OCOC6H5 H en méta); 7,64 (t, J = 7,5 Hz, lH: OCOC6H5 H en para); 7,98 (d, J =
7,5 Hz, 2H: OCOC6H5 H ~en ortho)
21 9065 l
wo 95/33736 ~ r~ 5
42
En opérant dans des conditions analogues à celles décrites dal3s l'exemple 3,
on prépare le l~.~uylu~y-2a dihydroxy-1~,13a époxy-5~,20 ~.01~u~au;.uAy-10
OXO-9 ~h~ y-4a l~inuu~ lu~y-713 taxène-ll dont les
,.. r~ sont les suivantes:
- spectre de R.M.N. lH (400 ~IHz; CDCI3; ~ en ppm): 1,07 (s, 3H: CH3); 1,21 (s,
3H: CH3); 1,64 (s, lH: OH en 1); 1,87 (s, 3H: CH3); 2,18 (d, J = 4,5 Hlz, lH: OHenl3); 2,20 et 2,88 (2 mts, lH chacun: CH2 en 6); 2,30 (s, 3H: CH3); de 2,25 à
2,35 (mt, 2H: CH2 en 14); 3,52 (s, 3H: OCH3); 3,90 et 3,97 (2 d, J = 15 Hz, lH
chacun: OCOCH2Ar); 4,08 (d, J = 7 Hz, lH: H en 3); 4,12 et 4,27 (2 d, J = 9 Hz,
lH chacun: CH2 en 20); 4,16 et 4,24 (2 d, J = 16 Hz, lH chacun: OCOCH2O); 4,80
(d large, J = 10 Hz, lH: H en 5); 4,92 (mt, lH: H en 13); 5,55 (dd, J = 10 et 6,5
Hz,lH:Hen7);5,71(d,J=7Hz,lH:Hen2);6,74(s,1H:Henl0);de7,25à
7,45 (mt, 5H: H ~uulllaliyuw); 7,48 (t, J = 7,5 Hz, 2H: OCOC6H5 H en méta); 7,64(t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,03 (d, J = 7,5 Hz, 2H: OCOC6H5 H en
ortho).
En opérant dans des conditions analogues à celles décritw dans l'exemple 3,
on prépare le ~..Luylo~y-2a époxy-5~,20 1l~6l~lu~a~é~u~y-lol3 OXO-9 ~/I~.,..,~I~.,.~y-
4a trihydroxy-1~3,7~,13a taxène-l 1 dont lew, I sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3 o en ppm) 1,12 (s, 3H: CH3); 1,14 (s,
3H: CH3); 1,66 (s, lH: OHI en 1); 1,67 (s, 3H: CH3); 1,84 et 2,56 (2 mts, lH
chacun: CH2 en 6); 2,11 (s, 3H: CH3); de 2,20 à 2,45 (2 mts, lH chacun: OH);
2,35 et 2,42 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,54 (s, 3H: OCH3);
3.94 (AB limite, J = 15 Hz, 2H: OCOCH2Ar); 3,94 (d, J = 7 Hz, lH: H en 3); 4,12
et 4,25 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,26 (AB limite, J = 16 Hz, 2H:
OCOCH2O); 4,50 (mt, lH: H en 7); 4,87 (d large, J = 10 Hz, lH: H en 5); 4,96
(mt,lH:Henl3);5,66(d,J=7Hz,lH:Hen2);6,44(s,1H:HenlO);de7,25
à 7,45 (mt, 5H: H ~uullla~iyUw); 7,47 (t, J = 7,5 Hz, 2H: OCOC6H5 H en méta);
7,62 (t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,04 (d, J = 7,5 Hz, 2H: OCOC6H5 H
en ortho)
En opérant dans des conditions analogues à celles décrites dans l'exemple 3,
on prépare le benzoyloxy-2a l~i~( ' yl~ilylu~y)-713,13a époxy-513,20 hydroxy-l~
Ill'~lu~a~ y-10l3OXO-9~' ylac~y-4ataxène-lldontles, .. r ;~ sont
les suivantes:
21 ~065 1
WO 95133736 1 ._lrr~
43
- spectre de R.M.N. lH (400 MHz; CDCI3; iS en ppm): 0,60 et 0,72 (2 mts, 6H
chacun: CH2 de l'éthyle); 0,94 et 1,05 (2 t, J = 7,5 Hz, 9H chacun: CH3 de l'éthyle~;
1,15 (s, 3H: CH3); 1,22 (s, 3H: CH3); 1,66 (s, 3H: CH3); 1,69 (s large, lH: OH en
1); 1,84 et 2,51 (2 mts, lH chacun: CH2 en 6); 2,20 (s, 3H: CH3); 2,24 et 2,36 (2
dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,54 (s, 3H: OCH3); 3,82 et 3,96 (2 d, J
= 15 Hz, lH chacun: OCOCH2Ar); 3,89 (d, J = 7 Hz, lH: H en 3); 4,06 et 4,16 (2
d, J = 9 Hz, lH chacun: CH2 en 20); 4,20 (AB limite, J = 16 Hz, 2H: OCOCH2O);
4,52(dd,J=lOet6Hz,lH:Hen7);4,79(dlarge,J=lOHz,lH:Hen5);4,96(t
large,J=9Hz,lH:Henl3);5,66(d,J=7Hz,lH:Hen2);6,58(s,1H:Hen
10); de 7,25 à 7,45 (mt, 7H: H a l " . et OCOC6HsH en méta); 7,61 (t, J = 7,5
Hz, lH: OCOC6H5 H en para); 8,00 (d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho) .
En opérant dans des conditions analogues à ceUes décrites dans l'exemple 3, on
prépare le berlzoyloxy-2 dihydroxy-1~,1013 b;~(hi~ ylsil~lu~y)-7l3,13a époxy-5~,20
Ox[}9; ' ' yla~ vAy4a ~xène-l l dont les ~ ~ ,.. t~ sont les suivantes:
- spectre de R.M.N. lH (600 MHz; CDC13; ~ en ppm): 0,53 et 0,72 (2 mts, 6H
chacun: CH2 de l'éthyle); 0,94 et 1,05 (2 t, J = 7,5 Hz, 9H chacun: CH3 de l'éthyle);
1,10 (s, 3H: CH3); 1,20 (s, 3H: CH3); 1,64 (s, lH: OH en 1); 1,70 (s, 3H: CH3);
1,86 et 2,45 (2 mts, lH chacun: CH2 en 6); 2,10 (s, 3H: CH3); 2,20 et 2,32 (2 dd,
J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,80 et 3,96 (2 d, J = 16 Hz. lH chacun:
OCOCH2~r); 3,95 (d, J = 7 Hz, lH: H en 3); 4,07 et 4,17 (2 d, J = 9 Hz, lH
chacun: CH2 en 20); 4,29 (s large, lH: OH en 10); 4,43 (dd, J = 11 et 7 Hz, lH: H
en 7); 4,79 (d large, J = 10 Hz, lH: H en 5); 5,03 (t large, J = 9 Hz, lH: H en 13);
5,19 (s large, lH: H en 1l1)); 5,63 (d, J = 7 Hz, lH: H en 2); de 7,25 à 7,45 (mt, 7H:
H ~ ; et OCOC6H5 H en méta); 7,60 (t, J = 7,5 Hz, lH: OCOC6H5 H en
para); 8,00 (d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho).
En opérant dans des conditions analogues à celles décrites dans l'exemple 3,
on prépare le carbonate-113,2a b;~(hi~ ;lylo~y)-7~,13a époxy-5~,20
l~a~ y-1013oxo9~,}1~ la~ y-4ataxène-l1dontles~ , sont
les suivantes:
- spectre de R.M.N. lH ~(400 MHz; CDCI3; ~ en ppm): 0,61 et 0,74 (2 mts, 6H
chacun: CH2 de l'éthyle); 0,92 et 1,05 (2 t, J = 7,5 Hz, 9H chacun: CH3 de l'éthyle);
1,20 (s, 3H: CH3); 1,30 ~s, 3H: CH3); 1,73 (s, 3H: CH3); 1,83 et 2,54 (2 mts, lHchacun: CH2 en 6); 2,18 (s, 3H: CH3); 2,27 et 2,48 (2 dd, J = 16 et 9 Hz, lH
chacun: CH2 en 14); 3,50 (d, J = 6,5 Hz, lH: H en 3); 3,53 (s, 3H: OCH3); 3,65
(AB limite,J = 14 Hz, 2H: OCOCH2Ar); 4,18 (AB limite, 2H: OCOCH2O); 4,45 et
21 qG65 l
WO 9'iD3736 ~ /r
44
4,53 (2 d, J = 9 Hz, lH chacurl: CHz en 20); 4,46 (mt, lH: H en 7); 4,53 (d, J = 6,5
Hz,lH:Hen2);4,68(dlarge,J=lOHz,lH:Hen5) ;5,06(tlarge,J=9Hz,lH:
H en 13); 6,53 (s, lH: H en 10); de 7,25 à 7,45 (mt, 5H: H ,
PXP.I\~IPI P. 5
En operant comme dans l'exemple 3, et a pattir de tert-l.utv~.,~
amino-3 hydroxy-2 phényl-3 ~.,. (2R,3S) de ~.~yhJ~-2a lli;~(ll._;ilu;~y-
acétoxy)-4a,1013 époxy-5~3,20 hydroxy-l~ oxo-9 I~inuvl~ - 'fvllrlw~-7
taxene-ll yle-13a, on pre~pare le teAt-l;utvAy.Aul,~ o-3 hydroxy-2 phényl-3
~, I (2R,3S) de benzoyloxy-2a l,;~ .v~ v~)-4a,10~ époxy-5~,20
hydroxy-113 méthylène-7Fi,8 nor-l9 oxo-9 taxène-ll yle-13a dont les l A A~
sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3 ~ é.~uu~ de 333K, o en ppm): 1,26
(s, 3H: CH3); 1,29 (s, 3H: CH3); 1,35 (s, 9H: C(CH3)3); 1,42 (mt, lH: H en 7);
1,71 et 2,29 (l~i ~. dd et mt, J = 6,5 et 5 Hz, lH chacun: CH2 en 19); 1,81
(s, lH: OH en l); 1,91 (s, 3H: CH3); 2,15 et 2,54 (It:D~Li~. d large et dt, J =
16 Hz et J = 16 et 4,5 Hz, lH chacun: CH2 en 6); 2,32 (AB li nite, 2H: CH2 en 14);
3,50 et 3,53 (2 s, 3H chacun: OCH3); 3,60 (mf, lH: OH en 2'); 4,11 et 4,56 (2 d,J = 16 Hz, lH chacun: OCOCH2O); 4,12 et 4,31 (2 d, J = 9 Hz, lH chacun: CH2 en
20); 4,17 (d, J = 7 Hz, lH: H en 3); 4,19 et 4,24 (2 d, J = 16 Hz, lH chacun:
OCOCH2O); 4,67 (mt, lH: H en 2'); 4,78 (d, J = 4,5 Hz, lH: H en 5); 5,29 (d
large,J=10~z,lH:Hen3');5,47(d,J=lOHz,lH:CONH);5,70(d,J=7Hz,
lH:Hen2);6,21(tlarge,J=9Hz,lH:Henl3);6,44(s,1H:HenlO);7,30(t,
J = 7,5 Hz, lH . H en para de r~, i en 3'); 7,39 (t, J = 7,5 Hz, 2H: H en méta
de l'~ul . en 3'); 7,45 (d, J = 7,5 Hz, 2H: H en ortho de r . en 3~);
7,51 (t, J= 7,5 Hz, 2H: OCOC6Hs H en méta); 7,61 (t, J = 7,5 Hz, lH: OCOC6Hs H
en para); 8,12 (d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho).
En opérant dans des conditions analogues à cerles décrites dans l'exemple 3,
on prépate le tert-l,u.vAy~ ' -3 hydroxy-2 phényl-3 ~JII, ' (2R,3S) de
~.~ylo~ y-2a L~(l..6;h~_~tv~y)-4a,1013 époxy-5~i,20 hydroxy-l~ oxo-9
30 ; ~ r Jl,",y 7~ taxène-ll yle-13a dont les A r ~ ; sont les
suivantes:
- r,pectre de R M.N. lH (400 MHz; CDCI3; t~ Ult~ de 333K, ~ en ppm): 1,22
(s, 3H: CH3); 1,27 (s, 3H: CH3); 1,38 (s, 9H: C(CH3)3); 1,64 (s, lH: OH en l);
2 1 90~ 1
~ WO95133736 P~l/r~ /Ja
1,92 (s, 3H: CH3); 2,11 (s, 3H: CH3); Z,25 et 2,~2 (2 mts, lH chacun: CH2 en 6);2,26 et 2,36 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,47 et 3,52 (2 s, 3Hchacun: OCH3); 3,66 (s large, lH: OH en 2'); 3,99 (d, J = 7 Hz, lH: H en 3); 4,15
et 4,57 (2 d, J = 16 Hz, lH chacun: OCOCHaO); 4,19 (AB limite, J = 16 Hz, 2H:
5 OCOCH2O); 4,24 et 4,35 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,70 (mt, lH: H
2'); 4,95 (d large, J = 10 Hz, lH: H en 5); 5,29 (d large, J = 10 Hz, lH: H en 3');
5,49 (d, J = 10 Hz, lH: CONH); 5,53 (dd, J = 11 et 8 Hz, lH: H en 7); 5,76 (d, J =
7Hz,lH:Hen2);6,1~(tlarge,J=9Hz,lH:Henl3);6,74(s,1H:HenlO);
7,30 (t, J = 7,5 Hz, lH: H en para de 1'~ LVI~d~iqUe en 3'); 7,38 (t, J = 7,5 Hz, 2H: H
en méta de l'~UUl~lad~ , en 3'); 7,45 (d, J = 7,5 Hz, 2H: H en ûrtho de l'dLVllla,LiqU~
en 3'); 7,49 (t, J= 7,5 ~Iz, 2H: OCOC6Hs H en méta); 7,63 (t, J = 7,5 Hz, lH:
OCOC6H5 H en para); 8,09 (d, J = 7,5 Hz, 2H: OCOC6Hs H en ortho).
En operant dans des conditions analogues à celles décrites dans l'exemple 3,
on prépare le tert-L ~bvllv1-3 (méthoxy4 phényl)-2 phényl-4 v~a4vlidiu~c-1,3
~,~uL~y' 5 (2R,4S,5R) de benzoyloxy-2a bis(méthv;~cl~ v~y)4a,10l3 époxy-
5~,20 hydroxy-113 oxo-9 L in~.J~ ,. lfrlnyloxy-7l3 taxène-ll yle-13a dont les
sont les suivantes:
- spectre de RM.N. lH ('l00 MHz; CDC13; ~,n~. ~ de 333K, o en ppm): 1,10
(s, 9H: C(CH3)3); 1,18 (s, 3H: CH3); 1,20 (s, 3H: CH3) ;1,64 (s, lH: OH en l);
1,75 (s, 3H: CH3); 1,86 (s, 3H: CH3); 2,12 et 2,26 (2 dd, J = 16 et 9 Hz, lH
chacun: CH2 en 14); 2,24 et 2,86 (2 mts, lH chacun: CH2 en 6); 3,33 et 3,53 (2 s,
3H: OCH3); 3,65 et 4,10 (2 d, J = 16 Hz, lH chacun: OCOCH2O); 3,83 (s, 3H:
ArOCH3); 3,86 (d, J = 7 Hz, lH: H en 3); 4,14 et 4,20 (2 d, J = 16 Hz, lH chacun:
OCOCH2O); 4,19 et 4,32 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,72 (d large, J =4,5Hz,lH:Hen2');4,89(dlarge,J=lOHz,lH:Hen5) ;5,46(mt,1H:Hen
3'); 5,45 (dd, J = 11 et 8 Hz, lH: H en 7); 5,69 (d, J = 7 Hz, lH: H en 2); 5,94 (t
large,J=9Hz,lH:Henl3) ;6,40(slarge,1H:Hen5') ;6,63 (s, lH:HenlO);
6,93 (d, J = 8,5 Hz, 2H: }I ILI . en ortho du OCH3); de 7,30 à 7,45 (mt, 5H:
H aLVll~dtillU~ en 3'); 7,38 (d, J = 8,5 Hz, 2H: H uv~ lLiqu~ en méta du OCH3);
7,48 (t, J= 7,5 Hz, 2H: OCOC6H5 H en méta); 7,63 (t, J = 7,5 Hz, lH: OCOC6H5 H
en para); 8,08 (d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho) .
En opérant dans des conditions analogues à celles décrites dans l'exemple 3,
on prépare le benzoyloxy-2a 1 ~ dc~,tv~y)4a,10~ dihydroxy-1~,13a époxy-
wo s~/33736 2 1 9 0 6 5 1 ~ c _ lva ~
46
5~,20 oxo-9 v~rlu~ ul~lu~-713 taxène-ll dont les ~ ; sont
les suivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3; o en ppm) 1,06 (s, 3H: CH3); 1,20 (s,
3H:CH3);1,61(s,1H:OHenl);1,89(s,3H:CH3);2,23(d,J=5Hz,lH:OH
en 13); de 2,20 à 2,35 et 2,92 (2 mts, lH chacun: CH2 en 6); 2,26 (s, 3H: CH3);
2,32 (d, J = 9 Hz, 2H: CH2 en 14); 3,52 et 3,58 (2 s, 3H chaclm: OCH3); 4,04 (d,J = 7 Hz, lH: H en 3); 4,19 et 4,32 (2 AB limite, J = 16 Hz, 2H chacun:
OCOCH2O); 4,20 et 4,38 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,82 (mt, lH: H
enl3);4,99(dlarge,J=10]~z,lH:Hen5);5,55(dd,J=lOet7Hz,lH:Hen
7);5,69(d,J=7Hz,lH:Hen2);6,73(s,lH:Hen10);7,51(t,J=7,5Hz,2H:
OCOC6H5 H en méta); 7,64 (~, J = 7,5 Hz, lH: OCOC6Hs H en para); 8,13 ~d, J =
7,5 Hz, 2H: OCOC6Hs H en ortho).
En opérant dans des conditions analogues à celles décrites dans l'exemple 3,
on prépare le benzoyloxy-2a Lv(~ y)-4a,10~ epoxy-5~,20 oxo-9
trihydroxy-lr3,7~,13a taxène-ll dont les . ~ sont les suiYantes:
- spectre de R.M.N. lH (400 MHz; CDCI3 o en ppm): 1,11 (s, 6H: CH3); 1,63 (s,
lH: OH en 1); 1,70 (s, 3H: CH3); 1,92 et 2,63 (2 mts, lH chacun: CH2 en 6); 2,08(s, 3H: CH3); de 2,20 à 2,30 (mt, 3H: CH2 en 14 et OH); 2,40 (d, J = 4 Hz, lH:
OH); 3,54 et 3,59 (2 s, 3H chacun OCH3); 3,92 (d, J = 7 Hz, lH: H en 3); 4,20 et4,35 (2 d, J = 9 Hz, lH chaclm: CH2 en 20); 4,24 et 4,28 (2 AB limite, J = 16 Hz, 2H
chacun: OCOCH2O); 4,50 (mt, lH: H en 7); 4,86 (mt, lH: H en 13); 5,03 (d large,
J=lOHz,lH:Hen5);5,65(d,J=7Hz,lH:Hen2);6,44(s,1H:HenlO);
7,49 (t, J = 7,5 Hz, 2H OCOC6H5 H en méta); 7,63 (t, J = 7,5 Hz, lH: OCOC6H5 H
en para); 8,14 (d, J = 7,5 Hz, 2H: OCOC6Hs H en ortho).
En opérant dans des conditions analogues à oeUes décrites dans rexemple 3,
on prépare le hvenzoyloxy-2a L;v(..,;~.u~ y)-4a,10~ L ' ' ' jlv'ylu~)-
713,13 époxy-5~,20 hydroxy-l~ oxo-9 taxène-ll dont les ~v~U~U~I '' . sv~nt les
suivantes:
- spectre de R.M.N. lH (40~ MHz; CDC13 ~ en ppm): 0,60 et 0,70 (2 mts, 6H
chacun: CH2 de réthyle); 0,94 et 1,02 (2 t, J = 7,5 Hz, 9H chacun: CH3 de l'éthyle);
1,12 (s, 3H: CH3); 1,20 (s, 3H: CH3); 1,64 (s, lH: OH en 1); 1,70 (s, 3H: CH3);
l,91 et2,57 (2 mts, lH chac~n: CH2 en 6); 2,12 (s, 3H: CH3); 2,13 et 2,23 (2 dd,J = 16 et 9 Hz, lH chacun CH2 en 14); 3,53 et 3,57 (2 s, 3H chacum: OCH3); 3,83
(d, J = 7 Hz, lH: H en 3); 4,15 et 4,40 (2 d, J = 16 Hz, 2H: OCOCH2O); 4,19 (AB
21 90651
~ WO95133736 1~ r. 1.55
47
limite, J = 16 Hz, 2H: OCOCH2O); 4,21 et 4,37 (2 d, J = 9 Hz, lH chacun: CH2 en
20); 4,51 (dd, J = 11 et 7 Hz, lH: H en 7); 4,93 (t, J = 9 Hz, lH: H en 13); 5,02 (d
large,J=lOHz,lH:~len5) ;5,64(d,J=7Hz,lH:Hen2) ;6,56(s,1H:Hen
10); 7,48 (t, J = 7,5 ~z, 2H: OCOC6H5 H en méta); 7,63 (t, J = 7,5 Hz, lH:
OCOC6HsH en para); 8,19 (d, J = 7,5 Hz, 2H: OCOC6HsH en ortho).
Erl opérant dans des conditions analogues à celles décrites dams rexemple 3,
on prépare le benzoylcxy-2a &ydroxy-113,10~ 1 -( ' yl~ilyl~.y)-7~l3 époxy-
5j3,20 ~ u~c~ y 4a oxo-9 taxène-ll dont les ~ , sont les
suiYantes:
- spectre de R.M.N. lH (400 MHz; CDCI3; ~ en ppm): 0,57 et 0,69 (2 mts, 6H
chacun: CH2 de l'éthyle); 0,94 et 1,03 (2 t, J = 7,5 Hz, 9H chaclm: CH3 de réthyle);
1,09 (s, 3H: CH3); 1,1,~ (s, 3H: CH3); 1,58 (s, lH: OH en 1); 1,75 (s, 3H: CH3);1,93 et 2,49 (2 mts, lH chacun: CH2 en 6); 2,03 (s, 3H: CH3); 2,09 et 2,18 (2 dd,
J = 16 et 9 Hz, lH chac~n: CH2 en 14); 3,57 (s, 3H: OCH3); 3,88 (d, J = 7 Hz, lH:
H en 3); 4,16 et 4,40 (2 d, J = 16 Hz, lH chacun: OCOCH2O); 4,20 et 4,36 (2 d,
J = 9 Hz, lH chacun: CH2 en 20); 4,23 (s large, lH: OH en 10); 4,42 (mt, lH: H
en7);4,97(t,J=9Hz,lH:Henl3);5,01 (dlarge,J=lOHz,lH:Hen5);5,17
(slarge,lH:HenlO),5,62(d,J=7Hz,lH:Hen2);7,47(t,J=7,5Hz,2H:
OCOC6Hs H en méta); '7,61 (t, J = 7,5 Hz, lH: OCOC6Hs H en para); 8,18 (d, J =
7,5 Hz, 2H: OCOC6Hs ~1 en ortho).
En opérant darL~3 des conditions analogues à celles décrites dams l'exemple 3,
on prépare le b~(lll;,~ .y~ y)-4a,1013 carbonate-1~,2a IJ;~ L.Jl~ilylOxy)
7~3,13a époxy-5~,20 oxc~9 taxène-ll dont les . ~ sont les suiYamtes:
- spectre de R.M.N. lH (400 MHz; CDC13; o en ppm): 0,60 et 0,68 (2 mts, 6H
chacun: CH2 de l'éthyle); 0,92 et 1,01 (2 t, J = 7,5 Hz, 9H chacun: CH3 de l'éthyle);
1,19 (s, 3H: CH3); 1,27 (s, 3H: CH3); 1,75 (s, 3H: CH3); 1,91 et 2,63 (2 mts, lHchacun: CH2 en 6); 2,0~ et 2,41 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 2,12
(s, 3H: CH3); 3,44 (d, J = 6,5 Hz, lH: H en 3); 3,46 et 3,50 (2 s, 3H chacun:
OCH3); 4,06 et 4,14 (~ d, J = 16 Hz, lH chacun: OCOCH2O); 4,16 (s, 2H:
OCOCH2O); 4,46 (dd, J = 10 et 7 Hz, lH: H en 7); 4,50 et 4,66 (2 d, J = 9 Hz, lHchacun: CH2 en 20); 4,51 (d, J = 6,5 Hz, lH: H en 2); 4,99 (mt, lH: H en 13);
5,00(dlarge,J=lOHz,lH:Hen5);6,51(s,1H:HenlO).
O~' 1
woss/33736 21 9 ~) r~llr~ 5.
48
EXF.MPI .F. 6
En opérant comme dans l'exemple 3, et à partir de tert-b~u~w~ul.rl-
amino-3 hydroxy-2 phényl-3 ~, (2R,3S) de ~.~uyl~y-2a ~;y~,luyl~ulvylu~y-
4a époxy-5~,20 hydroxy-l~ o:~o-9 I.l6~u~ya~ y-10~ llinuu~, ' 'fo~.yloxy-
7~ taxène-ll yle-13a, on prépare le tert-hu~u,.y~allJullylLullulu-3 hydroxy-2 phényl-3
(2R,3S) de benzoyloxy-2a ~,1u~luparluylu~y-4a époxy-5~,20 hydroxy-
1~ Il.;;llu~.~a~,~;'u~y-10~ méthylène-7~,8 nor-l9 oxo-9 taxène-ll yle-13a dont les
. r. 1~ 1 . sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDC13; h r' ' ~ voisine de 333K, o en
ppm): de 0,80 81,40 (mt, 4H: CH2CH2 du ~ ,lU~JlVU,y~); 1,30 (s, 6H: CH3); 1,35
(s, 9H: C(CH3)3); de 1,30 à 1,40 (me~ lH: H en 7); 1,70 et 2,23 (2 dd,
,,s~ . J = 6 et 5,5 Hz etJ =10 et 5,5 Hz, lH chdcun: CH2 en 19); 1,80 (mt,
lH: CH du ~,y~,lu~lu~l~.); 1,735 (s, lH: OH en 1); 1,86 (s, 3H: CH3); 2,11 et 2,44
(l~li~. d large et dt, J = 16 Hz et J = 16 et 4,5 Hz, lH chacun: CH2 en 6);
2,34 et 2,50 (2 dd, J = 16 et 5 Hz, lH chacun: CH2 en 14); 3,22 (d, J = 4 Hz, lH:
OH en 2'); 3,52 (s, 3H: OC~13); 4,08 et 4,28 (2 d, J = 9 Hz, lH chacun: CH2 en
20); 4,13 (d, J = 7 Hz, lH: H en 3); 4,16 et 4,24 (2 d, J= 16 Hz, lH chacun:
OCOCH2O); 4,62 (d, J = 4,5 Hz, lH: H en 5); 4,70 (d la~e, J = 4 Hz, lH: H en
2'); 5,2~3 (AB limite, 2H: H3' et CONH); 5,70 (d, J = 7 Hz, lH: H en 2); 6,23 (tlarge, J = 9 Hz, lH: H en 13); 6,42 (s, lH: H en 10); de 7,20 à 7,45 (mt, 5H: H
auullldti~u~,~ en 3'); 7,52 (t, J = 7,5 Hz, 2H: OCOC6Hs H en méta); 7,61 (t, J = 7,5
Hz, lH: OCOC6Hs H en para); 8,14 (d, J= 7,5 Hz, 2H: OCOC6Hs H en ortho) .
En opérant dans des conditions analogues à oelles décrites dans l'exemple 3,
on prépare le tert-~ y~,allJul~ 3 hydroxy-2 phényl-3 1"', (2R,3S) de
benzoyloxy-2a c~lu~,l. . ,~loxy4a époxy-513,20 hyd7~0xy-l~ n.;~lluA~a~ y-10~
oxo-9 1~ illuul~ lu~y-7l3 taxèlle-l l yle-l3a do;lt les ~ - - sollt
les suivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3; o en ppm): de 0,85 à 1,40 (mt, 4H:
CH2CH2 du ~,lu~llulJyl~); 1,22 (s, 3H: CH3); 1,24(s, 3H: CH3); 1,39 (s, 9H:
C(CH3)3); 1,70 (s, lH OH ell 1); 1,83 (mt, lH: CH du ~ ,lu~J~u~yl~); 1,88 (s, 3H:
CH3); 2,05 (s, 3H: CH3); 2,23 et 2,84 (2 mts, lH chacun: CH2 en 6); 2,34 et 2,42(2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 3,35 (d, J = 5,5 Hz, lH: OH en 2');
3,52 (s, 3H: OCH3); 3,96 (d, J = 7 Hz, lH: H en 3); 4,16 et 4,25 (2 d, J = 16 Hz,
lH chacun: OCOCH2O); 4,17 et 4,28 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,72
2~ q~5 1
~ WO95133736 P~rA,~
49
(mt, lH: H en 2'); 4,81 (d large, J = 10 Hz, lH: H en 5); 5,28 (d large, J = 10 Hz,
lH:Hen3');5,36(d,J=lOHz,lH:CONH);5,48(dd,J=10,5et7Hz,lH:Hen
7);5,72(d,J=7Hz,lH:Hen2);6,11(mt,1H:Henl3);6,71(s,1H:HenlO);
de 7,25 à 7,45 (mt, 5H: H cuUIllo.Li4u~ en 3'); 7,52 (t, J = 7,5 Hz, 2H: OCOC6H5 H
en méta); 7,65 (t, J = 7"5 Hz, lH: OCOC6H5 H en para); 8,08 (d, J= 7,5 Hz, 2H:
OCOC6H5 H en ortho).
En opérarlt dans des conditions arlalogues a ceaes décrites dans l'exemple 3,
on prépare le tert-l,u~u~y~culJullyl-3 (méthoxy-4 phényl)-2 phényl4 .,~ -1,3
u~y' 5 (2R,4S,5R) de benzoyloxy-2 ~:yclu~Jl~ollvyloxy4 époxy-5~,20
hydroxy~ ilu~a~elui~y-10~ oxo-9 IHnuu~ .rlu~lcy-7l3 taxène-ll
yle-13dontles. ", I~ I;,I..F;sontlessuivantes:
- spectre de R.M.N. lH (400 MHz; CDCI3: â en ppm): de 0,50 à 1,50 (mt, 5H: CH
et CH2 du cyclo~lu~yle); 1,04 (s, 9H: C(CH3)3); 1,17 (s, 3H: CH3); 1,19 (s, 3H:
CH3); 1,65 (s, lH: OH en 1); 1,72 (s, 3H: CH3); 1,84 (s, 3H: CH3); 2,14 et 2,32
(2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 2,16 et 2,79 (2 mts, lH chacun: CHz
en 6); 3,52 (s, 3H: OCH3); 3,82 (s, 3H: ArOCH3); 3,86 (d, J = 7Hz, lH: H en 3);
4,11 et 4,24 (2 d,J = 9 Hz, lH chacun: CH2 en 20); 4,15 et 4,22 (2 d, J = 16 Hz, lH
chacun: OCOCH2O); 4,60 (d, J = 4,5 Hz, lH: H en 2'); 4,74 (d large, J = 10 Hz,
lH:Hen5);5,44(dd,J=10,5et8Hz,lH:Hen7);5,50(mt,1H:Hen3');5,67
(d, J = 7 Hz, lH: H en 2JI; 5,88 (mt, lH: H en 13); 6,41 (m~F, lH: H en 5'); 6,61 (s,
lH: H en 10); 6,92 (d, J = 8,5 Hz, 2H: H ~ 1 en ortho du OCH3); 7,38 (d,
J = 8,5 Hz, 2H: H ~u.. Li.~ en méta du OOEli3); de 7,25 à 7,45 (mt, 5H: H
, . en 3'); 7,49 (t, J = 7,5 Hz, 2H: OCOC6Hs H en méta); 7,63 (t, J = 7,5
Hz, lH: OCOC6H5 H en para); 8,02 (d, J = 7,5 Hz, 2H: OCOC6Hs H en ortho).
En opérant dans des conditions analogues à ceaes décrites dans rexemple 3,
on prépare le benzoyloxy-2 ~,IUIJII I ylu~ y4 dihydroxy-1~,13 époxy-5~,20
~ucal~ ~t~y-10~ oxo-9 llinu~u, ~ ~1u~y-713 taxène-lldont les
r~ t~F- ~ sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDC13; i , ' ~, de 333K, ~ en ppm): de
0,90 à 1,40 (mt, 4H: Cll2CH2 du ~,y~,lu~JIu~.rld); 1,10 (s, 3H: CH3); 1,22 (s, 3H:
CH3); 1,61 (s, lH: OH en l); de 1,70 à 1,85 (mt, 2H: CH du cy~.lol)lu~ . et OH
en 13); 1,90 (s, 3H: CH3); 2,22 et 2,86 (2 mts, lH chacun: CH2 en 6); 2,26 (s, 3H:
CH3); 2,36 (d, J = 9 Hz, 2H: CH2 en 14); 3,52 (s, 3H: OCH3); 4,05 (d, J = 7 Hz,
lH: H en 3); 4,14 et 4,22 (2 d, J = 16 Hz, lH chacun: OCOCH2O); 4,20 et 4,36 (2
wo ssn3736 2 1 ~ 3 6 5 l ~ ~l/r~7~ .sa ~
d, J = 9 Hz, lH chacun: CH2 en 20); 4,84 (mt, lH: H en 13); 4,85 (d large, J = 10
Hz,lH:Hen5);5,54(dd,J=llet8Hz,lH:Hen7);5,72(d,J=7Hz,lH:H
en 2); 6,73 (s, lH: H en 10); 7,51 (t, J = 7,5 Hz, 2H: OCOC6H5 H en méta); 7,63
(t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,12 (d, J = 7,5 Hz, 2H: OCOC6H5 H en
5 ortho)
En operant dans des conditions analogues à oelles décrites dans l'exemple 3,
on prépare le Ih.k~ylu~y-2a ~ ,yl~y 4 dihydroxy-1~,13a époxy-5~,20
~ h~ y-1013 oxo-9 hinuu., ' ' ~lo,.y-7~ taxène-ll dont les
.,,u, , sont les suivantes:
- spectre de R.M.N lH (400 MHz; CDCI3; 1 , ~, de 333K, ô en ppm): de
0,90 à 1,40 (mt, 4H: CH2CH2 du .;~lu~yl~); 1,10 (s, 3H: CH3); 1,22 (s, 3H:
CH3); 1,61 (s, lH: OH en l); de 1,70 à 1,85 (mt, 2H: CH du ~y~;lO~ Jyl~ et OH
en 13); 1,90 (s, 3H: CH3~; 2,22 et 2,86 (2 mts, lH chacun: CH2 en 6); 2,26 (s, 3H:
CH3); 2,36 (d, J = 9 Hz, 2H: CH2 en 14); 3,52 (s, 3H: OCH3); 4,05 (d, J = 7 Hz,
lH: H en 3); 4,14 et 4,22 (2 ~1, J = 16 Hz, lH chacun: OCOCH2O); 4,20 et 4,36 (2d, J = 9 Hz, lH chacun: CH2 en 20); 4,84 (mt, lH: H en 13); 4,85 (d large, J = 10
Hz,lH:Hen5);5,54(dd,J=llet8Hz,lH:Hen7);5,72(d,J=7Hz,lH:H
en 2); 6,73 (s, lH: H en 10); 7,51 (t, J = 7,5 Hz, 2H: OCOC6H~ H en méta); 7,63
(t, J = 7,5 Hz, lH: OCOC6H5 H en para); 8,12 (d, J = 7,5 Hz, 2H: OCOC6H5 H en
ortho)
En opérant dans des Iconditions analogues à celleS décrites dans l'exemple 3,
on prépare le ~.~ y-2a ~.lvl, . ,.~lv~y~ IY~(hi;~h~lsiurlv~y)-7~13a
époxy-5~,20 hydroxy~ ~é.w.y-10~ oxo-9 taxène-ll dont les
sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDC13 ~ en ppm): 0,60 et 0,68 (2 mts, 6H
chacun: CH2 de l'éthyle); de 0,90 à 1,35 (mt, 4H: CH2CH2 du .,~ ,.u~l~,); 0,94 et
1,03 (2 t, J = 7,5 Hz, 9H chac~n: CH3 de l'éthyle); 1,14 (s, 3H: CH3); 1,20 (s, 3H:
CH3); 1,64 (s, lH: OH en 1); 1,71 (s, 3H: CH3); 1,73 (mt, lH CH du
~ ); 1,87 et 2,50 (.~li~ dd large et mt, J = 14 et 11 Hz, lH
chacun: CH2 en 6); 2,11 et 2,29 (2 dd, J = 16 et 9 Hz, lH chacun: CH2 en 14); 2,15
(s, 3H: CH3); 3,53 (s, 3H: C~CH3); 3,86 (d, J = 7 Hz, lH: H en 3); 4,14 et 4,26 (2
d, J = 9 Hz, lH chacun: CH2 en 20); 4,19 (AB iimite, J = 16 Hz, 2H: OCOCH2O);
4,52(dd,J=llet7Hz,lH:Hen7);4,84(dlarge,J=lOHz,lH:Hen5);4,95(t
large,J=9Hz,lH:Henl3);5,65(d,J=7Hz,lH-Hen2);6,56(s,1H:Hen
~ wossl33736 21 ~165 ~ r~llr ~ ~a~
51
10); 7,50 (t, J = i,5 l~z, 2H: OCOC6Hs H en méta); 7,62 (t, J = 7,5 Hz, lH:
OCOC6Hs H en para); 8,09 (d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho).
E;n opérant dans des conditions analogues à celles décrites dans l'exemple 3,
on prépare le benzoyloxy-2a ~ ,lv~ uAr-4a dihydroxy-113,1013 bis(triéthyl-
silyloxy)-713,13a époxy-513,20 oxo-9 taxène-ll dont l~.~ . sont les
suivantes:
- spectre de RM.N. lH (400 MHz; CDCI3: S en ppm): 0,58 et 0,68 (2 mts, 6H
chacun: CH2 de l'éthyle); de 0,90 à 1,35 (mt, 4H: CH2CH2 du l;.r.,lv~ rle); 0,94 et
1,03 (2 t, J = 7,5 Hz, 9H[ chacun: CH3 de l'éthyle); 1,12 (s, 3H: CH3); 1,22 (s, 3H:
CH3); 1,59 (s, lH: OH en 1); 1,67 (mt, lH: CH du ~r~,lv~lu~yle); 1,73 (s, 3H:
CH3); 1,90 et 2,44 (2 mts, lH chacun: CH2 en 6); 2,06 (s, 3H: CH3); 2,10 et 2,25
(2dd,J=16et9Hz,l~lchacun:CH2enl4);3,91(d,J=7Hz,lH:Hen3);4,16
et 4,26 (2 d, J = 9 Hz, lH chacun: CH2 en 20); 4,28 (d, J = 1,5 Hz, lH: OH en en
10);4,42(dd,J=llet6Hz,lH:Hen7);4,841(dlarge,J=lOHz,lH:Hen5);
5,00(t,J=9Hz,lH:E~lenl3);5,16(d,J=1,5Hz,lH:HenlO);5,62(d,J=7
Hz, lH: H en 2); 7,50 (t, J = 7,5 Hz, 2H: OCOC6H5 H en méta); 7,62 (t, J = 7,5 Hz,
lH: OCOC6H5 H en para); 8,09 (d, J = 7,5 Hz, 2H: OCOC6H5 H en ortho).
Le carbonate-1~,2t~ ~.,lol,.v~ vylv~y-4a bi~(L i;, .ybil~ r)-7~,13
époxy-5~,20 llléLll~ac~Lu~r-lofl oxo-9 taxène-ll peut être préparé de la manièresuivante:
A une solution tle 100 mg de carbonate-1~,2a L,i~(L i~llrl~ilyloxy)-7~,13a
époxy-5~,20 hydroxy4c~ ;llw~y~C~LIJ~r-10~ o~o-9 taxene-ll dans 7 cm3 de
L.I~l~Lurl . on ajoute, goutte à goutte, 345 ,ul d'une solution lM de
,~ ' ' de lithium dans l'hexane, à une ~ a~ voisine de -30C. Le
mélange réactionnel est agité pendant 15 minutes à cette t~ c.L~ p us on ajoute,goutte à goutte, 39 ~I de chlorure de ~ u~ vyle. Le mélange réactionnel est
agité pendant 30 minutes à une L.-~ L.--~ voisnne de 0C puis hydrolysé par addition
de 1 cm3 d'une solu~:ion saturée de chlorure d'i et 50 cm3 de
dichlu.. La phase organique est décantée, lavée par 2 fois 40 cm3 d'une
30 solution aqueuse saturée de chlorure de sodium p us séchée sur sulfate de O '
filtrée et concentrée à sec sous pression réduite (2,7 kPa) à 40C. On obtient 120 mg
d'un produit que ron purifie par ~}.. ~ sur 70 g de silice (0,063-0,2 mm)
contenus dans une coloMe de 2 cm de diamètre en éluant avec un mélange acétate
d'éthyle-~, ' ' (20-30 en volumes) et en recueillant des fractions de 10 cm3. Les
2 l qo6~ l
wo ss/33736 ~ Is~
52
fractions ne contenant que le produit cherché sont réunies et ~ ~,~ à sec sous
pression réduite (2,7 kPa) à 40C. On obtient 31 mg de carbonate-1~,2a
u~a Ivylu~ 4a bia(L~ bilylu~)-7~13a époxy-5~,20 ~ LlluA~a~,~tv~y-10
oxo-9 taxène-11 s^vus forme d'une meringue blanche dont les, ^ ,..
physiques sont les suivantes:
- spectre de R.M.N. lH (400 MHz; CDC13: v en ppm): 0,60 et 0,66 (2 mts, 6H
chacun: CH2 de l'éthyle); de 0,90 à 1,35 (mt, 4H: CH2CH2 du ~ ); 0,92 et
1,02 (2 t, J = 7,5 Hz, 9H chac un: CH3 de l'éthyle) ;1,19 (s, 3H: CH3); 1,29 (s, 3H:
CH3); 1,60 (s, lH: OH en 1); 1,62 (mt, lH: CH du ~,lu~lu~ ); 1,73 (s, 3H:
CH3); 1,88 et 2,57 (.~L;~. dd large et mt, J = 15 et 10 Hz, lH chacun: CH2
en 6); 2,15 (s, 3H: CH3); 2,19 et 2,37 (2 dd, J - 16 et 9 Hz, lH chacun: CH2 en
14); 3,48 (d, J = 7 Hz, lH: H en 3); 3,51 (s, 3H: OCH3); 4,16 (s, 2H:
OCOCH2O); 4,44 (mt, lH: H en n; 4,45 et 4,54 (2 d, J = 9 Hz, lH chacun: CH2 en
20); 4,49 (d,J = 7 Hz, lH: H en 2); 4,85 (d large,J = 10 Hz, lH: H en 5); 5,02 (t
large, J = 9 Hz, lH: H en 13); 6,52 (s, lH: H en 10).
Les nouveaux produits de formule générale (I) dans laquelle Z représente un
radical de formule générale (II) r ' ' une activité inhibitrice s.~LricaLv~ de la
;r;l~LLu~ cellulaire anormale et possèdent des propriétés ~ permettant
le traitement de malades ayant des conditions ~ v. assvciées à une
20 ~vl;r;laLu~ cellulaire anormale. Les conditions I - ' ~ i incluent la ~ulire~.sliu
cellulaire anormale de c,ellules malignes ou non malignes de divers tissus et/ouorganes, . ~ t, de manière non limitative, les tissus ' ca, osseux ou
~^~^,~j.^,n~ la peau, le cerveau, les poumons, les organes sexueb, les systèmes
1~ ,' . ou rénaux, les cellules marnmaires ou sanguines, le foie, I'appareil
25 digestif, le pancréas et les glandes thyroides ou adrénales. Ces conditions
'~ . peuvent inclure également le psoriasis, les tumeurs solides, les cancers
de rovaire, du sein, du cerveau, de la prostate, du colon, de l'estomac, du rein ou des
testicules, le sarcome de Kaposi, le ^hr~ ,uwll~, Ie ~llu~;ul,al~.ulv~, le
~I~,~ublaaAJl.~ la tumeur de Wilms, la maladie de Hodgkin, les " les
30 myélomes multiples, les le~c,émies 1.~ I .y Ll~ ~ i . Ies Iymphomes
granulocytaires aigus ou chrcniques. Les nouveaux produits selon l'invention sont
' ` . utiles pour le t~aitement du cancer de l'ovaire. Les produits selon
rinvention peuvent être utilisés pour prévenir ou retarder l'apparition ou la
'~1'~' ;1;'''~ des conditions I ' I~,l ou pour traiter ces conditions
35 1 ~1û~, .
~ WO 9~1~3736 2 1 9 ~ 6 5 1 r~l~rl ,~
53
Les produits selon l'invention peuvent être administrés à un malade selon
différentes formes adaptées à la voie ~ choisie qui, de préférence, est la
voie 1~ L'. ' par voie parentérale comprend les ~ "U;~
.. - . I . - ' ~ ou sous-cutanée. Plus ~ iC.
- 5 préférée est l'Arl~ t .-~ ou il~L~
La présente invention comprend également les ~ phatmaceu-
tiques qui, au moins un produit de formule générale (I) en une quantité
suffisante adaptée à remploi en ~ A ;.~ humaine ou vétérin~ure. Les
e~ p. ~ peuvent être préparées selon les méthodes habituelles en utilisant un ouplusieurs adjuvants, suppotts ou excipients ~ ,, . qr.-qpfqhl~ Les
supports wll~n~u~ incluent les diluants, les milieux aqueux stériles et divers
solvants non toxiques. De préférence les r~ se présentent sous forme de
solutions ou de s ~i~ ..c;.~ aqueuses, de solutions injectables qui peuvent contenir
des agents ,~ - ', des colorants, des ~l~l vaLi~ ou des -~tqhi~iCq-f-~
Le choix des adjuvants ou excipients peut etre déterminé par la solubilité et
les propriétés chimiques du produit, le mode particulier d' ' et les bonnes
pratiques ~l., ,
Pour l' ' parentérale, on utilise des solutions ou des ! 1~ "`;"
stériles aqueuses ou non ,~queuS-es. Pour la preparation de solutions ou de ~
20 non aqueuses peuvent être utilisés des huiles végétales neturelles telle que l'huile
d'olive, l'huile de sésame ou l'huile de paraffune ou les esterS organiques injectables tel
que l'oléate d'éthyle. Les solutions stériles aqueuses peuvent être constituées d'une
solution d'un sel ~ aoceptable en solution dans de l'eau. Les
solutions aqueuses WIIV' ' pour l- ' i it. ~ ~ dans la mesure où
25 le pII est w.... ' ' ajusté et où risotonicité est réalisée, par exemple, par une
quantité suffisante de chlorure de sodium ou de glucose. La cfrrjlicq~rn peut être
réalisée par chauffage ou par tout autre moyen qui n~altère pas la r, ~ ~ '1~ '';1 ;' " '
Il est bien entendu que touS les produits entrant dans les ~ selon
rinvention doivent être purs et non toxiques pour les quantités utilisées.
Les ~ ;l;.. nc peuvent contenir au moins 0,01 % de produit thérapeuti-
quement actif. La quantité de produit actif dans une ~ est telle qu'une
posologie wnvenable p~isse être prescrite. De préférence, les ~.Y~ sont
préparées de terle façon qu'une dose unitaire contienne de 0,01 à 1000 mg environ de
produit actif pour l' ' par voie p--~ ' -
woss/33736 2 1 ~ Q 6 5 1 p~l/rlv~. ,~s ~,
Le traitement ~ peut etre effectué ~:UII~.UI~ ' avec d'autres
traitements i , , incl~ant des A.A~ ;.l.'U~ CI;q. ~. des anticorps
des thérapies ;~ OU des .",1: ,l1,~ .; ou des
"~ des réponses ~ O . Les mo~' r des réponses incluent, de
'i m~uuère non limitative, les 1~ ~ ' et les cytokines ter~es que les Uli~ ' ' ' , les
interférons (a, ~ ou o) et le TNF. D'autres agents Ahimiulll ~ u~ utiles dans letraitement des désordres dus à la ~nulir~_Lv~l anormale des oer~ules incluent, de
manière non limitative, les agents arkylants tels que les moutardes à l'azote comme la
ll.~Llv~ le ~. ', ' . ' ' le melphalan et le . ' 1 ,. A ~ 1, des sulfonates
10 d'arkyle comme le busulfan, les rUUU~ comme la ,AAr~m~tjn~ la lomustine, la
sémustine et la ~L~ ;.. . Ies triazènes comme la ~- ' les hnlit~q
comme les analogues de l'acide folique tel que le Ill;;llv~ les analogues de
pyrimidine comme le fluorouracil et la cjAtarabine, des analogues de purines comme la
Il..,~. -1~l~ 'IJ ; ~ et la tl O des produits naturels tels que les alcaloldes de vinca
15 comme la vinWastine, la vincristine et la vendésirle, des C~ vdv~}.rr~uluAu.~ comme
l'étoposide et le teniposide, des A..::l.;.ll;.l ~ comme la ~.LIIv~ ,ulc. la
~urv., ' la dUA~VlULl;~ la l,l~o".~. la PI;~ U~ et la X y~,UI~ des
enzymes comme la k., ,, , des agents divers comme les complexes de
du platine tel que le cisplatine, les urées substituées tel que
20 rl-~vA-.~...~, les dérivés de Y-' r~u* comme la yllJr~ les
- . 1 u~,..~ _n~ . comme le mitotane et l'~minn~ ' 'r y ' les
hormones et les . - ~ -g....: .~ ~ comme les a~l..,..~vl ~;~v~.~"v;des comme la ~JI~ ' .
Ies ~IVo_~t;ll~., comme le caproate d~ dIVA~JIVO~ VII~ l'acétate de
~ ,, . ~ et l'acétate de megestrol, les 1- vO~.~S comme le
25 diéthylstilbestrol et I~L~llyl~ iol~ les Aull;v~ LvO_..~ cotnme le t~moYif~n~ les
vO .._~ comme le propionate de L~tU~.. et la auvA~
Les doses utilisées pour mettre en oeuvre les méthodes selon l'invention sont
cer~es qui permettent un traitement ~,lu~ u~ ou un maximum de réponse
li , Les doses varient selon la forme d~ le produit particulier
30 sélectionné et les . . propres du sujet à traiter. En général, les doses sontcerles qui sont i' . . efficaces pour le traitement des désordres dus à une
uliri~ liul~ oerlulaire anormale. Les produits selon rinvention peuvent etre
administrés aussi souvent que nécessaire pour obtenir l'effet III~ désiré.
Certains malades peuvent répondre rapidement à des doses ' ~_.I.~.; fortes ou
35 faibles p us avoir besoin de doses d'entretien faibles ou nulles. C~. ' t, de
21 9065 1 ~
WO95133736 1 ~ 5
faibles doses seront utilisées au début du traitement et, si nécessaire, des doses de plus
en plus fortes seront a' jusqu'à l'obtention d'un effet optimum. Pour d'autresmalades il peut être nécessaire d' ' ~,. des doses d'entretien 1 à 8 fois par jour,
de préférence 1 à 4 fois, selon les besoins l,..,~,i~Jlogi~ du malade considéré. Il est
- 5 aussi possible que pour certains malades il soit nécessaire de n'utiliser qu'une à deux
Chez l'homme, les doses sont g, . ..~. AI.~ t comprises entre 0,01 et
200 mg/lcg. Par voie , ', les doses seront en général comprises entre 0,1
et 100 mg~g et, de préférence entre 0,5 et 50 mg/kg et, encote plus, ~,
10 entre 1 et 10 mglkg. Par voie i~ o~ les doses sont L~ .. "I~ comprises
entre 0,1 et 50 mg~cg et, de préférence entre 0,1 et 5mg~cg et, encore plus
- entre 1 el: 2 mg~g. Il est entendu que, pour choisir le dosage le plus
approprié, devront être pris en compte la voie d' ~ ,a;.~.., le poids du malade,son état de santé général, son âge et tous les facteurs qui peuvent influer sur l'efflca^
15 cité du traitement.
L'exemple suivant illustre une .~ selon l'invention.
F.XEl~Pr .F.
On dissout 40 rrlg du produit obtenu à l'exemple 1 dans 1 cm3 d'EIl~ul~
EL 620 et 1 cm3 d'éthanol puis la solution est diluée par addition de 18 cm3 de sérum
20 ~ 'o~,
La ~ li est administrée par perfusion pendant 1 heure par introduc-
h~darlsdusolutepùydol~