Note: Descriptions are shown in the official language in which they were submitted.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/nO088
]
CELLULES PC)UR LA l'RODUCTIQN DlADENOVIRIJS RECOMBINANTS
La presente invention concerne de nouvelles lignees cellulaires utilisables pour la
production d'adénovirus recombinants défectifs. Elle concerne également les préparations
virales purifiées produites dans ces lignées, ainsi gue les plasmides permettant leur
5 construction. Plus particulierement, les nouvelles lignées cellulaires selon l'invention
permettent la transcomplémentation de la ré~ion E4 et une production clonale avec des
titres élevés d'adénovirus recombinants défectifs notamment pour tout ou partie de la région
E4.
Les adénovirus presentent certaines propriétés particulièrement avantageuses pour
I 0 une utilisation comme vecteur de transfert de gènes en thérapie génique. Notamment, ils ont
un spectre d'hôte assez large, sont capables d'infecter des cellules quiescentes, ne s'intègrent
pas au génome de la cellule infectée, et n'ont pas été associés à ce jour à des patholo(ries
importantes chez l'homme. Les adénovirus ont ainsi été utilisés pour transférer des gènes
d'intérêt dans le muscle (Raaot et al., Nature 361 (1993) 647)l le foie (Jaffe et al., Nature
1 ~ genetics I (1992) 372), le systèllle nerveu~; (Akli et al., Nature genetics 3 (I 993) 224)~ etc.
Les adenovirus sont des virus à ADN double brin linéaire d'une taille de 36 kb
environ. Leur génome comprend notamment une séquence inversée répétée (ITR) à chaque
extrémité, une séquence d'encapsidation (Psi), des gènes précoces et des gènes tardifs (Cf
figure 1). Les principaux gènes précoces sont contenus dans les régions El, E2, E3 et E~.
20 Parmi ceu~-ci~ les genes contellus dans la région E I notamlllent sont necessaires à la
propaaation virale. Les principaux gènes tardifs sont contenus dans les régions L I à L5. Les
génome de l'adénovirus AdS a été entièrement séquencé et est accessible sur base de
données (voir notamment Genebank M73260). De meme des parties, voire la totalitéd'autres genomes adénoviraux (Ad2, Ad7, Adl2, etc) ont également été séquencées.
Pour leur utilisation en thérapie génique, différents vecteurs dérivés des adénovirus
ont été préparés, incorporant différents gènes (13-gal, OTC, ct-lAT, cytokines, etc). Dans
chacune de ces constructions, l'adénovirus a été modifié de manière à le rendre incapable de
réplication dans la cellule infectée. Ainsi, les constructions décrites dans l'art antérieur sont
des adénovirus délétés de la région El, essentielle à la réplication virale, au niveau de
laquelle sont insérées les sequences d'ADN hétérologue (Levrero et al., Gene 101 (1991)
195; Gosh-Clloudhury et al., Gene 50 (19~6) 161). Ces adénovirus sont produits dans une
lignée de complémentation (lignée 293) dans laquelle une partie du génome de l'adénovirus
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
a el~ intégrée. Plus précisément, la lignée 293 contient l'extrémite gaucl1e (environ 11-12%)
du ~énome de l'adénovirus sérotype 5 (Ad5), comprenant l'ITR gauche, la région
d'encapsidation. la région E1~ incluant Ela, Elb, la région codant pour la protéine pIX et
une partie de la région codant pour la protéine pIVa2 Cette lignée est capable de trans-
S complémenter des adénovirus recombinants défectifs pour la région E I, c'est-a-dire
dépourvus de tout ou partie de la région E1, et de produire des stoclis viraux ayant des
titres élevés. Cependant, les vecteurs déficients pour la région E1 (vecteurs El-, dits de
première génération) présentent certains inconvénients pour une utilisation thérapeutique.
En particulier, ils pourraient ne pas être totalement défectifs pour la réplication in vivo, en
10 raison notamment de l'existence de certaines fonctions cellulaires transcomplémentantes.
Ainsi, une activité de transcomplémentation de El a été mise en évidence dans les cellules
de carcinome embryonnaire F9 (Imperiale et al., Mol. Cell. Biol. 4, 1984, 867-874). Une
activité de même type, régulée par l'interleukine-6, a également été mise en évidence
(Spergel et al., J. Virol. 66, 1992, 1021-1030). D'autres inconvénients liés à ces vecteurs
15 sont la présence de nombreux gènes viraux, susceptibles d'être exprimés in vivo apres
transfert de gènes, et d'induire une réponse immllnit~ire et/ou infl;~mm~toire.
Pour pallier à ces inconvénients, il a été proposé de créer d'autres délétions ou
modifications dans le génome de l'adenovirus. Ainsi, une mutation ponctuelle
tllermosensible a eté introduite dans le mutant ts175, permettant d'inactiver la protéine de
2() liaison à l'ADN (DBP) de 72kDa (Van der Vliet et Sussenbach, Virology 67, 1975~ 415-
426). Ces vecteurs peuvent également être produits avec des titres élevés dans les cellules
de la lignée 293 à la température permissive (32~C). Toutefois, ce type de vecteur présente
aussi un certain nombre d'inconvénients tels qu'une surexpression in vivo de la region E4; la
présence d'une mutation ponctuelle, donc sujette à réversion, un risque d'activité partielle à
25 3 7t'C, etc.
Une autre approche pour remédier a ces problèmes réside dans la déletion d'une
autre région essentielle à la réplication et/ou à la propagation virale. A cet égard, la
demanderesse s'est intéressée plus particulièrement à la région E4. La région E4 est en effet
impliquée dans la régulation de l'expression des gènes tardifs, dans la stabilité des ARN
30 nucléaires tardifs, dans l'extinction de l'expression des protéines de la cellule hôte et dans
l'efficacité de la réplication de l'ADN viral. Des vecteurs adénoviraux dans lesquels les
ré~ions El et E4 sont délétées possèdent donc un bruit de fond de transcription et une
expression de gènes viraux très réduits (voir notamment la demande PCT/FR94/00~51).
Toutefois, la construction et l'exploitation industrielle et thérapeutique de tels vecteurs
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
implique la mise à disposition d'un s~stème ef~icace de trallscolllplélllentation de ces deu!;
fonctions pour la production des stocks viraux
La présente invention apporte une solution à ce probleme. La présente invention
fournit en effet des lignées cellulaires permettant la transcomplémentation de la region E4 et
5 une production clonale et avec des titres élevés d'adénovirus recombinants défectifs pour
cette région. Les lignées selon l'invention sont avantageusement capables de
transcomplémenter les deux fonctions El et E4, et permettent donc de produire des virus
déficients pour ces deux fonctions. La présente invention fournit également des plasmides
permettant la construction de ces lignées; un procédé de préparation d'adénovirus
0 recombinants défectifs et des stocks viraux purifiés. Plus particulièrement, la demanderesse
a maintenant montre que des lignées de production capables de transcomplementer
efficacement la région E4 sont obtenues par introduction d'une partie seulement de la ré_ion
E4. Ainsi, des lignées ayant des propriétés particulièrement avantageuses sont obtenues
lorsque seulement une unité fonctionnelle réduite de la région E4, correspondant à la phase
15 de lecture ORF6 ou aux phases de lecture ORF6 et ORF6/7, sont présentes.
Un premier objet de l'invention réside donc dans un cellule utilisable pour la
production d'adénovirus recombinants défectifs comprenant, insérée dans son génome, une
partie de la région E4 d'un génome d'adénovirus comportant la phase de lecture ORF6 sous
contrôle d'un promoteur fonctionnel. Selon un mode préféré, les cellules de l'invention
20 comprennent une partie de la région E4 d'un génome d'adénovirus comportant les phases de
lecture ORF6 et ORF6/7 sous contrôle d'un promoteur fonctionnel.
Comme indiqué ci-avant, les lignées cellulaires selon la présente invention présentent
des propriétés particulièrement avantageuses: Elles permettent tout d'abord la
transcomplémentation des fonctions E I et E4 . Mais, de manière particulièrement25 avantageuse, elles sont capables d'induire la formation de plages de virus déficients dans ces
fonctions, ce qui est indispensable au clonage des virus recombinants, puis à leur
amplification et à leur purification. A cet égard, la demanderesse a en effet montré que des
lignées possédant l'ensemble de la région E4 ou des unités fonctionnelles plus grandes,
incluant par exemple la phase de lecture ORF4, sont incapables de former des plages de
30 virus déficients pour la région E4. L'identification d'unités fonctionnelles spécifiques de la
région E4 permet la réalisation d'un système très efficace de transcomplémentation et de
production de virus défectifs pour les fonctions El et E4. D'autres avantages des lignées
selon l'invention sont notamment leur aptitude pour l'amplification en milieu liquide de tels
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/(lnU88
virus déficients pOUI les re(~ions E1 et E4, les titres élevés de tels vinls gu'elles produisent
et l'absence de production de particule virale réplicative contaminante.
La région E4 du génome adénoviral est constituée de 7 phases ouvertes de lecture,
désignees ORFl, 0RF2, ORF3, ORF4, ORF3/4, ORF6 et ORF6/7 (fi(Jures 7 et 3). Comme
indiqué ci-avant, les cellules de l'invention sont caractérisées particulièrement par la
présence d'une partie seulement de cette région, comprenant la phase de lecture ORF6
éventuellement associée à la phase de lecture ORF6/7. Il est particulièrement important que
la partie de la région E4 présente dans les cellules de l'invention ne contiennent pas la phase
de lecture ORF4 fonctionnelle. Avantageusement, la région E4 présente dans les cellules de
l'invention ne contient pas les phases de lecture ORF1-ORF4 fonctionnelles. De manière
particulièrement préférée, la région E4 présente dans les cellules de l'invention est délétée
d'une partie au moins des phases de lecture ORFI-ORF4. Ces difI'erentes parties de la
région E4 peuvent être obtenues par coupures enzymatiques ou modifiées selon lesméthodes connues de l'homme du métier. Selon un mode de réalisation préféré, les lignées
cellulaires de l'invention comprennent un fragment inséré contenant moins de 2 kb de la
région E4 d'un génome d'adénovirus contenant la totalité des phases de lecture ORF6 et
éventuellement 0RF6/7. A titre d'exemples préféres, la phase de lecture ORF6 peut être
isolée de la région E4 sous forme d'un fragment BglII-PvuII, correspondant au~ nucléotides
34115-33126, et les phases de lecture ORF6-ORF6/7 peuvent être isolées de la région E4
sous forme d'un fragment BglII-BglII correspondant aux nucléotides 34115-32490 du
génome de l'Ad5. Selon un mode particulier de l'invention, la phase de lecture ORF6 est
fusionnée en phase traductionnelle avec le domaine d'un récepteul- nucleaire qui est
responsable de la reconnaissance de son ligand spécifique. Le domaine de fixation à
l'hormone (HBD: Hormone Binding Domain) du récepteur aux glucocorticoïdes (GCR:
Hollenberg et al. 1985, Nature, 318, 635-341) est avantageusement choisi car il permet de
retenir, dans le compartiment cytoplasmique de la cellule, la protéine de fusion en absence
d'hormone (T. MATTIONI et al., 1994, Methods in Cell Biology, Chapter 16, 335-352)
grâce à l'interaction stable du HBD (GCR) avec la protéine cytoplasmique hsp90 et d'autres
cofacteurs (S.P. BOHEN et al., 1995, Science, 268, 1303-1304). La présence de l'hormone
provoque alors la translocation de la protéine de fusion du cytoplasme dans le noyau, ce qui
permet la fonctionnalité de l'activité ORF6 de E4 dans le compartiment nucléaire. Il est
également possible que l'ajout d'hormone provoque un "démasquage" des domaines
fonctionnels de l'activité ORF6 par un changement transconformationnel de la protéine
hybride.
CA 02210168 1997-07-17
WO 96/22378 PCT/F~96/OOQ88
A cet égard, un mode de réalisation particulièrement préféré de l'invention est
constitué par une cellule comprenant, inséré dans son génome, un fragment BglII-BglII
correspondant aux nucléotides 34115-32490 du génome de l'Ad5. Ce fragment est présent
notamment dans le plasmide pORF6Gen décrit dans les exemples, utilisé pour la
~ 5 construction de la lignee cellulaire clone#2. Un autre mode de réalisation particulièrement
préféré de l'invention est constitué par une cellule comprenant, inséré dans son génome, un
fragment BglII-PvuII correspondant aux nucléotides 34115-33126 du génome de l'AdS.
Dans un autre mode de l'invention, la région 0RF6 au moins, est couplée au HBD du GCR,
soit à son extrémité C-terminale (fusion GCR-0RF6), soit à son extrémité N-terminale
(fusion 0RF6-GCR). Dans le cas de la fusion C-terminale, la séquence du virus codant pour
0RF6 et ORF7 est avantageusement insérée en phase traductionnelle en aval de la séquence
spécifiant le HBD du GCR. Dans cette réalisation particulière, l'expression du gène
chimérique génère alors un ARN primaire dont le produit de traduction est la protéine
GCR-0R~6 (SEQ ID N~7). L'épissage alternatif de ce transcript génère quant à lui un ARN
] 5 messager qui code pour la protéine fusion GCR-ORF6/7 (cf. Exemple 1.5).
La partie de la région E4 présente dans les cellules selon l'invention peut être issue
d'adénovirus de différentes origines ou sérotypes. Il existe en effet différents sérotypes
d'adénovirus, dont la structure et les propriétés varient quelque peu, mais qui présentent une
organisation génétique comparable. Plus particulièrement, la région E4 présente dans les
2û cellules selon l'invention peut être issue d'un adénovirus d'origine humaine ou animale.
Concernant les adénovirus d'origine humaine, on peut citer préférentiellement ceux
classés dans le groupe C. Plus préférentiellement encore, parmi les différents sérotypes
d'adénovirus humain, on préfère utiliser dans le cadre de la présente invention les adénovirus
de type 2 ou 5 (Ad 2 ou Ad 5). Parmi les dirrélell~s adénovirus d'origine animale, on préfère
utiliser dans le cadre de l'invention des adénovirus d'origine canine, et notamment toutes les
souches des adénovirus CAV2 [souche manhattan ou A26/61 (ATCC VR-800) par
exemple]. D'autres adénovirus d'origine animale sont cités notamment dans la demande
W094/26914 incorporée à la présente par référence.
Dans un mode préféré de mise en oeuvre de l'invention; la partie de la région E4 est
issue d'un genome d'adénovirus humain du groupe C. De manière plus préférentielle, elle est
issue du génome d'un adénovirus Ad2 ou Ad5.
Comme indiqué précédemment, la partie de la région E4 présente dans les cellulesde l'invention est placée sous le contrôle d'un promoteur fonctionnel dans lesdites cellules.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
Avantageusement~ il s'a~rit d'un promoteur inductible, permettant de contrôler les nive2u~;
et/ou les périodes d'expression de ces gènes. De manière particulièrement avantageuse. il
s'agit du promoteur du LTR de MMTV (Pharmacia), qui est induit par la déxamethasone ou
d'un promoteur régulé par la tétracycline (W094/29442; W094/04672). Il est entendu que
5 d'autres promoteurs peuvent être utilisés, et notamment des variants du LTR de M~ITV
portant par exemple des régions hétérologues de régulation (régions "enhancer"
notamment).
Dans un mode de réalisation particulier, l'expression des gènes hybrides est sous le
contrôle de promoteurs régulés afin d'éviter une accl~mlll~tion constitutive de la protéine de
10 fusion dans le cytoplasme, ou pour minimiser la "fuite" vers le compartiment nucléaire et
une certaine cytotoxicité. Dans un mode de réalisation encore plus particulier, le géne
chimérique est sous le contrôle d'un promoteur inductible qui répond aux glucocorticoides
tel que le promoteur GRE5 (S. Mader and J. White, 1993, PNAS, 90, 5603-5607; cf.Exemple I .5) .
Les cellules selon l'invention peuvent être préparées à partir de différentes cellules
pharmaceutiquement utilisables, c'est-à-dire cultivables dans des conditions industriellement
acceptables et n'ayant pas de caractère pathogène reconnu. Il peut s'agir de lignées
cellulaires établies ou de cultures primaires et notamment de cellules de rétine embryonaire
humaine. Il s'agit avantageusement de cellules d'origine humaine, infectables par un
20 adénovirus. A cet égard, on peut citer les cellules KB, Hela, 293, Vero, gmDBP6, etc.
Les cellules de la lignée KB sont issues d'un carcinome épidermique humain. Elles
sont accessibles à l'ATCC (ref. CCL17) ainsi que les conditions permettant leur culture. La
lignée de cellules humaines Hela est issue d'un carcinome de l'épithelium hllm~in Elle est
également accessible à l'ATCC (ref. CCL2) ainsi que les conditions permettant sa culture.
25 Les cellules de la lignée '~93 sont des cellules de rein embryonnaire humain (Graham et al.,
J . Gen. Virol . 36 (1977) 59) . Cette lignée contient notamment, intégrée dans son génome, la
partie gauche du génome de l'adénovirus humain Ad5 (12 %). La lignée de cellules gm
DBP6 (Brough et al., Virology 190 (1992) 624) est constituée de cellules Hela portant le
gène E2 d'adénovirus sous le controle du LTR de MMTV.
Il peut s'agir egalement de cellules d'origine canine (BHK, MDCK, etc). A cet égard,
les cellules de la lignée canines MDCK sont préférées. Les conditions de culture des cellules
MDCK ont eté décrites notamment par Macatney et al., Science 44 (1988) 9.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96M0088
Les lig~llees cellulaires selon l'invention peuvent etre construites de dif~'erentes
manieres. De façon générale, elles sont préparées par transformation d'une culture cellulaire
avec un plasmide portant le fragment sélectionné de la région E4 sous contrôle d'un
promoteur fonctionnel. La transfection des cellules peut être réalisée par toute technique
connue de l'homme du métier, et notamment en présence de phosphate de calcium, par
électroporation, etc. Selon un mode particulier de réalisation, le plasmide utilisé porte
également un gène marqueur permettant d'identifier et de sélectionner les cellules
transformées. Il peut s'agir notamment de tout gène de résistance à un antibiotique
(généticine, hygromycine, etc). Le gène marqueur peut également être porté par une
construction séparée, co-transfectée avec le plasmide. Après transfection et sélection pour
le gène marqueur, les cellules obtenues peuvent être sélectionnées pour leur capacité à
transcomplémenter des adénovirus dépourvus de la région E4. Pour cela, différents
adénovirus mutants défectifs pour différentes parties de la région E4 peuvent être utilisés,
tels que notamment les adénovirus Ad2dl808 (Weinberg et Ketner, J. Virol. 57 (1986) 833),
] 5 Ad5dl 1004~ dl 1007 ou dl 1014 (Bridge et Ketner, J. Virol. 63 (1989) 631), dl 1011 (Bridge
et al., Virology 193 (1993) 794), comme indiqué dans les exemples.
Avantageusement, les cellules selon l'invention sont également capables de
transcomplémenter pour la région El. Celles-ci peuvent être construites comme décrit ci-
avant à partir de cellules qui transcomplémentent déjà la région El (exemple: cellules 293),
ou par introduction séquentielle d'une construction apportant la région E l et d'une
construction apportant la partie de la région E4 selon l'invention, par exemple dans des
rétinoblastes d'origine humaine.
Selon un mode particulièrement préféré, les cellules selon l'invention dérivent de la
lignée cellulaire 293. A cet égard, des résultats particulièrement avantageux ont été obtenus
avec des cellules de la lignée 293 transformées par le plasmide pORF6Gen ou le plasmide
pGGO qui code pour les protéines HBD-ORF6 et ~D-ORF6/7.
La présente invention décrit également la construction de plasmides comprenant une
partie de la région E4 d'un génome d'adénovirus portant la phase de lecture ORF6 ou 0R~6
et ORF6/7 sous contrôle d'un promoteur inductible (voir notamment les plasmides
3Q pORF6Gell et pGGO). Ces plasmides peuvent être utilisés directement pour transfecter une
population cellulaire choisie, puis, par sélection, pour l'identification de cellules ayant acquis
stablement la fonction E4.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/OU()88
~n autre objet de l'invention réside dans l'utilisation des cellules décrites ci-aval1t
pour la production d'adénovirus recombinants défectifs au moins pour la région E4.
L'invention fournit en effet un procédé de production d'adénovirus recombinants défectifs
au moins pour la région E4 particulierement avantageux, mettant en oeuvre les cellules ci-
avant. Selon ce procédé, on transforme une culture de cellules telles que décrites ci-avant
avec un ou plusieurs plasmides apportant les differentes régJions du oenome dudit
adénovirus recombinant défectif puis on récolte les virus produits. Ce procédé est
particulièrement avantageux pour la production d'adénovirus possédant des régions El et
E4 non fonctionnelles. Il s'agit notamment de vecteurs dans lesquels les régions E1 et E4
ont eté inactivées ou rendues non fonctionnelles par délétion totale ou partielle. De telles
modifications peuvent être obtenues in vitro (sur de l'ADN isolé) ou in situ, par exemple, au
moyen des techniques du genie génétique, ou encore par traitement au moyen d'agents
mutagènes. La ou lesdites modifications génétiques peuvent être localisées dans une partie
codante de la re~iol1, ou en dehors d'une ré-rion codante~ et par e~;eml)le dans les re~ions
responsables de l'expression et/ou de la régulation transcriptionelle desdits gènes. La
délétion peut être effectuée par digestion au moyen d'enzymes de restriction appropriées,
puis ligature, selon les techniques classiques de biologie moléculaire.
Selon un mode particulièrement avantageux, le procédé de l'invention est utilisé pour
la production d'adénovirus recombinants dans lesquels la région E I est inactivée par
délétion d'un fragment PvuII-BglII allant du nucléotide 4~4 au nucléotide 3378, sur la
sequence de l'adenovirus Ad5. Cette séquence est accessible dans la litterature el egalemel1t
sur base de donnees (voir notamment Geneban}; n~ M7326(~). Dans Ull autre mode de
réalisation préféré, la région E1 est inactivée par délétion d'un fragment HinflI-Sau3A allant
du nucléotide 382 au nucléotide 3446. Dans un mode particulier, le procédé permet l~
production de vecteurs comprenant une délétion de la totalité de la région E4. Ceci peut
être réalisé par excision d'un fragment MaeII-MscI correspondant aux nucléotides 35835-
32720. Les lignées cellulaires selon l'invention sont en effet capables de transcomplémenter
et d'amplifier des adénovirus portant tout type de délétion ou inactivation de la région E4.
Dans un autre mode particulier, seule une partie fonctionnelle de E4 est délétée. Cette partie
comprend au moins les phases ORF3 et 0RF6. A titre d'exemple, ces phases codantes
peuvent être délétées du génome sous forme de fragments PvuII-Alul et BglII-PvuII
respectivement, correspondant aux nucléotides 34801-343 9 et 34115-33126
respectivement. Les délétions de la région E4 du virus Ad2 dl808 ou des virus AdS dllO04,
Ad5 dl 1007, Ad5 dl 1011 ou Ad5 dl 1014 peuvent également être utilisées dans le cadre de
l'invention. A cet egard, les cellules de l'invention sont particulièrement avantageuses pour
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
la pro(luction de virus comprenant une ré~ion El inaGtive et ul1e deletiol1 dans la ré~ ion E4
du tyye de celle présente dans le génome de AdS dl 1014. c'est-à-dire de virus E4-
conservant la phase de lecture ORF4.
La présente invention décrit donc également des adénovirus recombinants défectifs
dont le génome comprend une délétion dans la région E1 et une délétion dans la région E4.
Plus particulièrement, elle décrit des adénovirus recombinants defectifs dont le genome
comprend une deletion dans la re~ion E 1 et une déletion dans la re~ion E~ correspondant au
moins aux phases de lectures ORF3 et 0RF6. Ainsi, les adénovirus selon l'invention
comportent préférentiellement les délétions suivantes affectant tout ou partie des régions El
et E4:
- Adénovirus ~E1,0RF3-,0RF6-: délétion de tout ou partie de la région E1 et des
nucléotides 34~01-34329 et 34115-33126 de la région E4;
- Adénovirus ~EI,~E4,0RFI~: délétion de tout ou partie de la re(~ion E1 et de larégion E4 à l'exception de la phase de lecture ORF]. Cette délétion dans la région E4
couvre préférentiellement les nucléotides 33093 (SmaI) à 35053 (AccIII). Elle est obtenue
par exemple à partir du mutant Ad5 dllO04. D'autres délétions peuvent être utilisées pour la
réalisation d'adénovirus ~E1,~E4,0RF1+ de l'invention, sur la base des informations
données dans le présente demande et de la séquence nucléotidique SEQ ID n~ 4. Cette
séquence double brin représente la partie droite du génome adénoviral, incluant la région E4
et l'TTR droite du nucléotide 32749 (1 sur SEQ ID n~4) à 35935 (31 ~6 sur SEQ ID n~4). Il
~ s'agit d'une séguence purement illustrative et d'autres sequel1ces pul~liees sont é~,alement
utilisables. Les différentes phases de lecture de la région E4 sont representées, notamment
ORF7, 0RF6, ORF4, ORF3, 0RF2 et ORF1. Un adénovirus ~EI,AE4,0RFI+ de
l'invention comprend avantageusement une délétion dans la région El et une délétion d'un
fragment dont l'e~LléllliLé 5' est comprise dans la phase de lecture ORF7 et dont l'extrémité
3' est située dans la phase de lecture 0RF2. Encore plus préférentiellement, la délétion
concerne un fragment dont l'extrémité 5' est comprise entre les nucléotides 32920 à 33190
du génome de l'adenovirus et dont l'extrémité 3' est comprise entre les nucléotides 34710 à
35090 du ~,énon1e adénoviral. Cette déletion correspond en~ on au~; nucléotides 170 a
(extrémité 5') et 1960 à 2340 (extrémité 3') sur la séquence SEQ ID n~4.
- Adénovirus ~EI,~E4,0RF4+: délétion de tout ou partie de la région El et de la
région E4 à l'exception de la phase de lecture ORF4. Un adénovirus ~El,~E4,0RF4+ de
l'invention comprend avantageusement une délétion dans la ré(ion E1, une délétion d'un
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/O(\O88
fra~ ment dont l'extl-el-lite S est conlplise dan~ la phas~ de le~lul~e ()1~1-7 et dOIlt l ex~remit~
3' est située dans la phase de lecture 0RF6 (à l'exception de la partie chevauchant la phase
de lecture ORF4), et une délétion d'un fragment dont l'extrémité 5' est comprise dans la
phase de lecture ORF3 et dont l'extrémité 3' est située dans la phase de lecture ORF1 ou
5 dans la région promotrice de E4. Plus pr~félellliellement, ces adénovirus selon l'invention
comprennent:
(i) une délétion de tout ou partie de E1,
(ii) une délétion d'un fragment dont l'extrémité 5' est comprise entre les nucléotides
32920 à 33190 du génome de l'adénovirus et dont l'extrémité 3' est comprise entre les
nucléotides 33200 à 34000 du génome adénoviral, et,
(iii) une délétion d'un fragment dont l'extrémité 5' est comprise entre les nucléotides
34360 à 34700 du génome de l'adénovirus et dont l'extrémité 3' est comprise entre les
nucléotides 35150 à 35530 du génome adénoviral.
Les positions correspondantes de la délétion ~ii) sur la sequence SEQ ID n~ 4 sont
180 à 445 (extrémité 5') et 450 à 1250 (extrémité 3'). Les positions correspondantes de la
délétion (iii) sur la séquence SEQ ID n~ 4 sont 1610 à 1950 ~extrémité 5') et 2410 à 2870
(extrémité 3').
Ces délétions dans la région E4 couvrent preférentiellement les nucléotides
33093(SmaI)-33695 et 34634 (Sspl)-35355(Smal) Elles peuvent être obtenues par
20 exemple à partir du mutant Ad5 dllO14.
- Adénovirus ~EI ,~E4 . déletion de tout ou partie de la re~,ion E I et des nucléotides
32720-35835, ou 33466-35355 ~cette délétion peut être obtenue par exemple à partir du
mutant Ad5 dllO07) ou 33093-35355 (cette délétion peut être obtenue par exemple a partir
du mutant Ad5 dll 01 1). Ces 3 délétions couvrent la totalité de la région E4
Comme indiqué ci-avant, la délétion dans la région El couvre avantageusement tout
ou partie des régions EIA et ElB. Cette délétion doit être suffisante pour rendre le virus
incapable de réplication autonome dans une cellule. La partie de la région El délétée dans
les adénovirus selon l'invention couvre avantageusement les nucléotides 454-3328 ou 382-
3446.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
Les positions données ci-dessus f'ont rél'érence à la sequel1ce de l'adenovirus Ad~
sauva~ge telle que publiée et accessibie sur base de donnée. Bien que des variations mineures
puissent exister entre les différents sérotypes d'adénovirus, ces positions sont généralement
applicables à la construction d'adénovirus recombinants selon l'invention a partir de tout
sérotype, et notamment des adénovirus Ad2 et Ad7.
Par ailleurs, les adénovirus de l'invention peuvent posséder d'autres altérations au
niveau de leur ~;énome. En particulier, d'autres région peuvent être délétées pour augmenter
la capacité du virus et réduire ces effets secondaires liés à l'expression de gènes viraux.
Ainsi, tout ou partie de la région E3 ou IVa2 notamment peut être délétée. Concernant la
région E3, il peut cependant être particulièrement avantageux de conserver la partie codant
pour la protéine gpl9K Cette protéine permet en effet d'éviter que le vecteur adénovirus
fasse l'objet d'une réaction immunitaire qui (i) limiterait son action et (ii) pourrait avoir des
effets secondaires indésirables. Selon un mode particulier, la région E3 est délétée et la
séquence codant pour la protéine gpl9k est réintroduite sous controle d'un promoteur
1 5 hétérologue.
Les adénovirus recombinants selon l'invention possédent des propriétés
particulièrement attractives pour une utilisation en thérapie génique. Ces vecteurs
combinent en effet des propriétés d'infection, de sécurité (les risques de réaction
immunitaire et/ou inflamlllatoire sont fortement réduits) et de capacité de transfert de ~Jènes
très élevées De plus les lignées de l'invention permettent la production de stocks viraux
totalement dépourvus dc particules réplicatives contaminantes (RCA). Ainsi~ les résultats
présentés montrent la construction et la production par les lignées de l'invention
d'adénovirus défectifs pour les régions E1 et E4, dépourvus de RCA. En particulier,
l'apparition de particules contaminantes réplicatives E4+ lors de la production des virus
~E1,~E4,0RF1+, ~E1,~E4,0RF4+ ou ~E1,~E4 selon l'invention n'est pas possible avec
les lignées de l'invention puisque (i) ces virus ne contiennent pas de séquences recouvrantes
de part et d'autres de la région integree dans le ~énome de la cellule (Figure 3) et (ii) un
événement de recombinaison homologue simple entre les régions cellulaires et virales
génèrerait un virus non viable dépourvu d'ITR droite. Un autre avantage des virus selon
l'invention réside dans leur capacité de clonage accrue, permettant l'insertion de transgènes
de grande taille (supérieure à lOkb). Ceci permet en particulier l'utilisation de séquences
régulatrices de la transcription permettant d'améliorer l'efficacité, la régulation et la durée
d'expression. Ceci permet en outre d'utiliser des doses plus faibles de virus et d'obtenir un
effet thérapeutique comparable avec des effets secondaires cytopathiques très réduits.
CA 02210168 1997-07-17
WO 96/22378 PCT/~R96/00088
Comn1e in(li(l-lé avant, les adénovirus constituent des vecteurs de transfert de gènes
très efl~lcaces pc ur des applications de thérapie génique et cellulaire. Pour cela une
sequence d'acides nucléiques hetérolo~ue dont le transfert et/ou l'e:;pression dans une
cellule, un organe ou un organisme est recherché peut être inséree dans leur genome. Cette
séquence peut comporter un ou plusieurs ;,ènes thérapeutiques tels qu'un ~ene dont la
transcription et éventuellement la traduction dans la cellule cible generent des produits ayant
un effet therapeutique. Parmi les produits thérapeutiques, on peut citer plus particulièrement
les enzymes, les dérivés sanguins, les hormones, les Iymphokines: interleukines, interférons,
TN~, etc (FR 9203120), les facteurs de croissance, les neurotransmetteurs ou leurs
précurseurs ou enzymes de synthèse, les facteurs trophiques: BDN~, CNTF, NGF, IGF,
GMF, aFGF, bFGF, ~;'T3 NT5, etc; les apolipoprotéines ApoAI ApoA1~' ApoE etc
(WO94/25073), la dystrophine ou une minidystrophine (W093/06223), les gènes
suppresseurs de tumeurs: p53, Rb, RaplA, DCC, k-rev, etc (W094/24297), les gènescodant pour des facteurs impliqués dans la coagulation: Facteurs VII, VIII, IX, etc, les
I 5 SJènes suicides Thymidine kinase, cytosine désaminase, etc; ou encore tout ou partie d'une
immunoglobuline naturelle ou artificielle (Fab, ScFv, etc, W094/~9446), etc. Le gène
thérapeutique peut également être un gène ou une séquence antisens, dont l'expression dans
la cellule cible permet de contrôler l'expression de gènes ou la transcription d'ARNm
cellulaires. De telles séguences peuvent par exemple être transcrites. dans la cellule cible, en
~() ARN complementaires d'ARNm cellulaires et bloquer ainsi leur traduction en protéine.
selon la techni(llle decrite dans le brevet EP 140 308 Le gene therapeutique peut peut aussi
être un ~ene codant pour un peptide antigénique, capable de generer chez l'homn1e une
réponse immunitaire, en vue de la réalisation de vaccins Il peut s'agir notamment de
peptides antigéniques spécifiques du virus d'epstein barr, du virus HIV, du virus de l'hépatite
B (EP 185 573), du virus de la pseudo-rage, ou encore spécifiques de tumeurs (EP 259
212).
Généralement, la sequence d'acides nucléiques hétérolo~,ue comprend également une
région promotrice de la transcription fonctionnelle dans la cellule infectée, ainsi qu'une
région située en 3' du gene d'intérêt, et qui spécifie un signal de fin transcriptionnelle et un
site de polyadénylation. L'ensemble de ces élements constitue la cassette d'expression.
Concernant la région promotrice, il peut s'agir d'une région promotrice naturellement
responsable de l'expression du gène considéré lorsque celle-ci est susceptible de fonctionner
dans la cellule infectée. Il peut éc alement s'agir de régions d'origine différente (responsables
de l'expression d'autres protéines, ou même synthétiques). Notamment~ il peut s'agir de
séquences prol11otrices de genes eucaryotes ou viraux ou de toute sequence promotrice ou
CA 02210168 1997-07-17
WO 96/22378 PCT/FR9610(1O88
13
dérivée, stimulallt ou rél)rilllallt la transcription d'un gène de façoll spécifique ou noll et de
façon inductible ou non. A titre d'exemple, il peut s'agir de séquences promotrices issues du
génome de la cellule que l'on désire infecter, ou du génome d'un virus, et notamment, les
promoteurs des gènes ElA, Ml,P d'adénovirus, le promoteur CMV, LTR-RSV, etc. Parmi
S les promoteurs eucarvotes on peut citer également les promoteurs ubiquitaires (HPRT.
vimentine. ~-actine tubuline. etc), les promoteurs des filaments intermédiaires (desmine.
neurofilaments, kératine, GFAP, etc) les promoteurs de gènes thérapeutiques (type ~IDR
CFTR, facteur VIII, etc) les promoteurs spécifiques de tissus (pyruvate kinase, villine,
promoteur de la proteine intestinale de liaison des acides gras, promoteur de l'actine c~ des
1 0 cellules du muscle lisse, promoteurs spécifiques pour le foie; Apo AI, Apo AII, Albumine
humaine etc) ou encore les promoteurs répondant à un stimulus (récepteur des hormones
stéroides, récepteur de l'acide rétinoïque, etc,). En outre, ces séquences d'expression
peuvent être modifiées par addition de séquences d'activation. de régulation. ou permettant
une e:;pressioll tissu-speciiique ou majoritaire. Par ailleurs~ lorsque l'acide nucléique insere
15 ne comporte pas de séquences d'expression, il peut être inséré dans le génome du virus
défectif en aval d'une telle séquence.
Par ailleurs, la séquence d'acides nucléiques hétérologue peut également comporter,
en particulier en amont du gène thérapeutique, une séquence signal dirigeant le produit
thérapeutique synthétisé dans les voies de sécrétion de la cellule cible. Cette séquence signal
~0 peut être la séquence signal naturelle du produit thérapeutique, mais il peut également s'agir
de toute autre séquence si~mal follctiollnelle, ou d'une séguence si(mal altificielle
La cassette d'e~pression du gène thérapeutique peut etre inseree en dif'férents sites
du génome de l'adénovirus recombinant, selon les techniques decrites dans l'art antérieur.
Elle peut tout d'abord être insérée au niveau de la délétion El. Elle peut également être
25 insérée au niveau de la région E3, en addition ou en substitution de séquences. Elle peut
également être localisée au niveau de la région E4 délétée.
Les cellules selon l'invention peuvent également être utilisées pour la production de
virus adéno-associés (AA\;) recombinants. Ceci constitue une autre application
particulièrement avantageuse des cellules de l'invention. Ces cellules permettent en effet
30 d'obtenir des titres élevés d'AAVr, totalement dépourvus de virus réplicatifs contaminants.
A cet effet, la présente invention concerne également l'utilisation d'une cellule comprenant,
inséree dans son genome, tout ou une partie de la region E4 du génome d'un adénovirus
CA 022l0l68 lgg7-o7-l7
wo 96/22378 PCT/FR96/00088
1~
comportant au moins la phase de lecture 0RF6 pour la production d'AA~ recolnbinants.
Les cellules sont avantageusement telles que definies ci-avant
L'AAV est un virus à ADN de la famille des parvovirus humains, de taille
relativement réduite, qui s'intègre dans le génome des cellules qu'il infecte, de manière stable
et site-spécifique. Les AAV sont capables d'infecter un large spectre de cellules. sans induire
d'effet sur la croissance, la morphologie ou la différenciation cellulaires. Par ailleurs, ils ne
semblent pas impliqués dans des pathologies chez l'homme. Le génome des AAV a été
cloné, séquence et caractérisé. Il comprend environ 4700 bases, et contient à chaque
extrémité une région répétée inversée (ITR) de 145 bases environ, servant d'origine de
I 0 réplication pour le virus. Le reste du génome est divisé en 7 regions essentielles portant les
fonctions d'encapsidation: la partie gauche du génome, qui contient le gène rep implique
dans la réplication virale et l'expression des gènes viraux; la partie droite du génome, qui
contient le gène cap codant pour les protéines de capside du virus. L'utilisation de vecteurs
derivés des AAV pour le transfert de gènes in vitro et in vivo a été décrite dans la littérature
I ~ (voir notamment WO 91/18088; WO 93/09239; US 4,797,368, US5,139,941, EP 488 528).
Dans les AAV recombinants, les gènes rep et cap sont généralement délétés et remplacés
par un gène d'intérêt.
L une des difficultés limitant 1'utilisation des AA\/ comme vecteur de therapie
génique provient du fait que l'AAV ne se réplique efficacement que dans les cellules co-
20 infectées par un virus helper comme par exemple l'adénovirus ou le virus de l'herpès. Lapréparation d'AAV recombinants défectifs implique donc la présence de 3 composants qui
doivent être cotransfectés et co-infectés dans la cellule de production: un virus auxiliaire
(par exemple un adénovirus), un plasmide contenant une séquence nucléique d'intérêt
bordée de deux régions répétées inversées (ITR) d'AAV, et un plasmide portant les gènes
d'encapsidation (gènes rep et cap) d'AA~'.
L'inconvénient majeur de ce système est qu'il utilise un virus helper ~elui-ci est
généralement réplicatif et présent en mélange avec les AAVr produits. Les stocl~s viraux
sont donc potentiellement contaminés par un virus helper ce qui rend ces stoc~s
incompatibles avec une utilisation thérapeutique. En outre, en raison du nombre élevé de
30~ composants impliques dans ce procédé, les titres de virus obtenus sont assez faibles, de
l'ordre de 10~.
CA 02210168 1997-07-17
Wo 96/22378 PCT/FR96/00088
La présente invention permet de remédier à ces inconvénients. La présente invention
fournit en effet un procèdé efficace de production d'AAVr, permettant d'obtenir des stocl;s
de virus à titres très élevés (supérieurs à 10'~), non contaminés par un virus replicatif
Cinq gènes de l'adénovirus sont nécessaires à la réplication de l'AAV EIA, EIB.
5 E2A, VA et E4. Ces gènes doivent être présents et s'exprimer dans la cellule productrice
pour une production optimale de particule infectieuses. Selon le procédé de l'invention, on
utilise maintenant une lignée cellulaire de production contenant déjà dans son génome
certains de ces gènes, et notamment tout ou partie de la résrion E4, préférentiellement
combinée à la région El. L'intérêt d'utiliser ce type de lignée cellulaire est que cela permet
10 d'utiliser un adénovirus helper défectif, c'est-à-dire non capable de genérer de maniere
autonome des particules infectieuses. Ainsi, les stocks d'AAVr produits sont noncontaminés.
En effet, les fonctions intégrées dans la lignée peuvent être délétées du génome de
l'adénovirus helper.
1~ Ceci est particulièrement avantageux pOUI I'utilisation d'un adenovirus helper
d'origine humaine. Ainsi, dans une lignée cellulaire telle que décrite ci-dessus capable de
transcomplementer les fonctions El et E4 de l'adénovirus, il est possible d'utiliser un
adénovirus helper d'origine humaine (ad5 ou ad2 par exemple) défectif pour ces fonctions.
Un tel adénovirus helper ne pouvait être utilisé efficacement dans les procédes de l'art
~0 antérieur car l'absence de régions essentielles à la production d'AAVr (El et E4) limitait
considérablement l'efficacité du procédé. Or, un tel adénovirus est totalement incapable de
générer de manière autonome des particules infectieuses De ce fait, sa présence éventuelle
dans un stock d'AAVr n'affecte pas la qualité pharmaceutique de cette préparation.
Ceci permet également l'utilisation plus efficace d'un adénovirus helper d'origine
25 animale, de préférence canine.
En plus des considération de qualité du stock viral produit, de manière tout à fait
avantageuse, le procédé selon l'invention perrnet d'obtenir des titres de virus
particulièrement élevés. Ceci est une autre propriété tout à fait remarquable du procédé
selon l'invention. Ainsi, les titres produits, pouvant depasser ~o~l genomes virau!; par ml.
3Q sont jusqu'à 1000 fois supérieurs aux titres observes dans l'art antérieur. Ces résultats sont
tout à fait inattendus et d'une importance capitale en terme d'exploitation industrielle. Les
résultats sont particulièrement remarquables avec les lignées cellulaires dérivées de la lignée
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
16
293 et qui expriment ORF6, éventuellement associée à ORF6/7, ou la totalité de E4, sous le
contrôle du promoteur MMTV (elles contiennent donc E1 exprimé constitutivement et E4
ou une partie de E4 comprenant au moins ORF6 exprimé conditionnellement en présence de
dexaméthasone).
Même en l'absence de tout virus helper, ces lignées cellulaires sont capables derépliquer des virus AAV Ainsi, quand on infecte ces lignées avec un AA~' sauvage ou
quand on transfecte ces lignées par un plasmide infectieux pAV2 (Mac T allghlin, Gene, 23,
67-73, 19~3), on peut faire répliquer l'ADN de l'AAV. L'efficacité de la réplication reste
certes inférieure à celle obtenue en présence d'un adénovirus helper, mais démontre les
propriétés particulièrement remarquables des cellules selon l'invention.
Une lignée cellulaire particulièrement avantageuse pour la mise en oeuvre du
procédé selon l'invention est représentée par une cellule de la lignée 293 comprenant
insérée dans son génome, un fragment BglII-BglII correspondant aux nucléotides 34115-
32490 du génome de l'Ad5. Il s'agit par exemple d'une cellule de la lignée 293 transformée
par le plasmide pORF6Gen (Cf exemples).
En coinfectant une cellule de ce type avec un adénovirus helper (par exemple humain
au phénotype sauvage, ou délété pour E1, ou un double délétant pour E1 et E4, ou de
l'adénovirus canin), et en cotransfectant deux plasmides: un plasmide-AA~', portant les
ITRs de l'AAV encadrant un acide nucléique d'intérêt, et un plasmide portant les fonctions
O rep et cap, on peut produire en presence de dexaméthasone des particules de virus AAV
infectieuses à des titres éleves. Comme indique dans les exemples, des titres en génomes de
10l ] genomes /ml peuvent être obtenus lorsque l'on opere sur des quantites faibles de
cellules. En opérant sur des quantités de cellules plus importantes, des titres plus élevés
peuvent être obtenus, jusqu'à 1012 De plus en utilisant de l'adénovirus canin comme virus
helper, le procédé de l'invention permet d'avoir des stocks d'AAV à des titres élevés sans
contamination par de l'Ad humain.
Ainsi, un autre objet de l'invention réside dans un procédé de production d'AA~
recombinants caractérisé en ce que l'on introduit dans une culture de cellules comprenant~
insérées dans leur génome, une partie de la région E4 du génome d'un adénovirus
comportant au moins la phase de lecture ORF6:
- un plasmide AAV portant un acide nucléique d'intérêt bordé d'ITRs d'AAV,
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96M0088
- un adénovirus helper~ et,
- les fonctions Rep et Cap de l'AAV,
puis on récolte les virus produits.
Selon un mode de réalisation particulier, la cellule productrice est une cellule5 comportant l'intégralité de la région E4. Selon un autre mode de réalisation particulièrement
avantageux, la cellule productrice est une cellule comportant une partie de la région E4
comportant au moins la phase de lecture ORF6 et éventuellement la phase de lecture
0RF6/7. Il s?agit de maniere particulierement préféree d'une cellule telle que définie
précédemment pour la production d'adénovirus. En particulier, il s'agit avantageusement
10 d'une cellule capable de transcomplementer les fonctions El et E4 de l'adénovirus. Un
exemple préféré est représenté par une cellule de la lignée ~93 contenant inséré dans son
génome, toute la région E4 ou une partie de la région E4 comportant au moins la phase de
lecture ORF6 et éventuellement la phase de lecture ORF6/7. A titre d'exemple on peut citer
les cellules Clone#2 (IGRP2) et Clone#4 (IGRP4).
I S Comme indiqué précedemme]lt, I adenovirus helper peut être un adénovirus humain
au phénotype sauvage, ou défectif pour la région El, ou un double délétant pour El et E4,
ou encore de l'adénovirus canin. L'avanta~,e du procédé selon l'invention réside d'une part
dans les titres tres élevés en AA~;r, et egTalement dans le caractère sécuritaire des stocl~s
qu'il permet de produire. Ainsi, il est particulièrement avantageux d'utiliser un adénovirus
20 helper défectif, c'est-à-dire incapable de générer de manière autonome des particules
infectieuses. L'adénovirus helper selon le procédé de l'invention est avantageusement un
adénovirus humain possédant une délétion dans la région E4. Plus préférentiellement
encore, il s'agit d'un adénovirus humain défectif pour les régions E] et E4. Selon un autre
mode de réalisation avantageux, il s'agit d'un adénovirus canin, de préférence choisi pamli
25 les souches CAV~.
Dans le procédé selon l'invention, les fonctions rep et cap de l'AAV sont
préférentiellement apportées par co-transfection des cellules avec un plasmide portant les
régions rep et cap de l'AAV. Ces régions peuvent être sous contrôle du promoteur P5
homologue ou d'un promoteur constitutif comme LTR-RSV. Ces fonctions peuvent
30 également être apportées directement par le virus helper utilise. Il est en effet possible
d'insérer dans l'adenovirus helper une cassette contenant les régions rep et cap de l'AAV.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
1~
Dans le procédé de l'invention, la transfection du ou des plasmides (plasmide-AA~'
et plasmide-RepCap le cas échéant) peut être réalisée par toute technique connue de
l'homme du métier. Cependant, plus le taux de transfection est bon, plus les niveaux de
production peuvent etre ameliores. A cet e~ard, la demanderesse a maintenant mis au point
5 une méthode particulièrement efficace pour la transfection des plasmides dans les cellules de
production. Cette méthode repose sur l'utilisation d'un lipide polycationique et d'un agent
compactant les acides nucléiques. L'un des avantages de cette méthode réside en outre dans
le fait qu'elle ne semble pas altérer la morphologie ou l'état physiologique des cellules.
Différents types de lipides cationiques peuvent etre utilisés, tels que la lipofectamine, le
10 Transfectam, etc. Parmi les agents compactant l'ADN, on peut citer de manière avantageuse
des peptides dérivés de protéines nucléaires telles que les histones, la nucléoline, etc
Les différents plasmides et virus helper peuvent etre introduits dans la celluleproductive de manière concomitante ou séparée. Dans le cas dune introduction séparée,
I'ordre dans lequel les différents composants sont introduits ne semble pas être essentiel
15 pour obtenir des titres élevés. Comme illustré dans les exemples, des titres importants ont
été obtenus lorsque, dans un premier temps, les plasmides sont co-transfectés dans les
cellules puis, dans un deuxième temps, les cellules sont infectées par le virus helper.
Un mode de réalisation spécifique de l'invention réside dans un procédé de
production d' AA~ recombinants caractérisé en ce que, dans une culture de cellules
20 transcomplementant les fonctions El et E4 de l'adénovirus, on cotransfecte, en présence
d'un lipide pol~cationique et d'un agent compactant, un plasmide AAV portant un acide
nucléique d'intérêt borde d'ITRs d'AAV et un plasmide portant les régions rep et cap de
l'AAV; on co-infecte ladite culture avec un adénovirus helper choisi parmi les adénovirus
humains d'origine Ad2 ou Ad5 défectifs pour les régions El et E4 et les adénovirus canins
25 d'origine CAV2, puis on récolte les virus produits.
Ce mode de realisation permet d'obtenir des titres de virus élevés et des stocl;s de
qualité pharmaceutique.
La présente invention concerne également les préparations virales purifiées
(adénovirus et AAV) obtenues selon le procédé de l'invention, ainsi que toute composition
30 pharmaceutique comprenant un ou plusieurs adénovirus ou AAV recombinants défectifs
préparés selon ce procédé. Les compositions pharmaceutiques de l'invention peuvent être
formulees en vue d'une administration par voie topique, orale~ parentérale. intranasale.
intraveineuse, intramusculaire, sous-cutanée, intraoculaire, transdermique, etc.
CA 02210168 1997-07-17
WO 96/22378 PCT/li'R96/00088
19
Prél'érentiellelllellt, la composition pharmaceutique contient des véllicules
pharmaceutiquement acceptables pour une formulation injectable. Il peut s'agir en particulier
de solutions salines (phosphate monosodique, disodique, chlorure de sodium potassium.
calcium ou magnésium, etc, ou des mélanges de tels sels), stériles. isotoniques, ou de
- 5 compositions sèches, notamment Iyophilisées, qui, par addition selon le cas d'eau stérilisée
ou de sérum physiologique, permettent la constitution de solutés injectables. D'autres
excipients peuvent être utilisés tels que par exemple un hydrogel. Cet hydrogel peut être
préparé à partir de tout polymère (homo ou hétéro) bio-compatible et non cytotoxique. De
tels polymères ont par exemple été décrits dans la demande W093/08845. Certains d'entre
eux, comme notamment ceux obtenus à partir d'oxyde d'éthylène et/ou de propylène sont
commerciaux. Les doses de virus utilisées pour l'injection peuvent être adaptées en fonction
de dif~erenls parametres, et nolamnlent en tonction du mode d'administratioll utilise, de la
pathologie concernée, du gJène a exprimer, ou encore de la durée du traitement recherchee.
D'une manière générale, les adénovirus recombinants selon l'invention SOllt formulés et
administrés sous forme de doses comprises entre 10 et 10 pfu, et de préférence 106 a
101~ pfu et les AAV, entre 10 et 10 particules. Le terme pfu ("plaque forming unit")
correspond au pouvoir infectieux d'une solution d'adénovirus, et est déterminé par infection
d'une culture cellulaire appropriée, et mesure, généralement après 15 jours, du nombre de
plages de cellules infectées Les tecllniques de détermination du titre pfu d'une solution
2() virale sont bien documentees dans la littérature.
Selon le ~Jène thérapeutique, les virus ainsi produits peuvent être utilises pour le
traitement ou la prévention de nombreuses pathologies, incluant les maladies génétiques
(dystrophie, fibrose cystique, etc), les maladies neurodégénératives (Alzheimer, Parkinson,
ALS, etc), les cancers, les pathologies liées aux désordres de la coagulation ou au~;
dyslipoprotéinémies, les pathologies liées aux infections virales (hépatites, SIDA, etc), etc.
La présente invention sera pllls complètement décrite a l'aide des e~emples gui
suivent, qui doivent être considérés comme illustratifs et non limitatifs.
Lé~ende des ~l~ures
Figure 1: Organisation génétique de l'adénovirus AdS. La séquence complete de
I'Ad5 est disponible sur base de données et permet à l'homme du métier de sélectionner ou
de créer tout site de restriction, et ainsi d'isoler toute région du génome.
ure ~ Or2anisation génétique de la région E~
CA 02210168 1997-07-17
WO 96122378 PCT/~i:R96/00088
l~i'JUI-e 3 . Or~anisation gel1étique de la ré~ion E~ dans les adenovil~us sauvage et E~
dé~ectifs. La taille de la délétion est représentée par une barre épaisse.
Figure 4: (A) Représentation schématique de la cassette MMT~' LTR/(ORF6 +
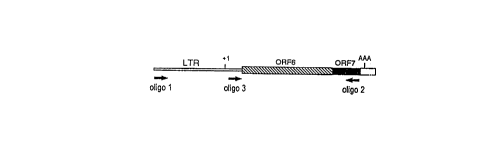
ORF7). Les oli .os 1, 2 et 3 utilisés pour l'amplification ou la RT-PCR sont localisés. ~
5 Site d'initiation de la transcription AAA = Site de polyadénylation (B) Structure des
produits obtenus par RT-PCR. SD = Site 5' donneur d'épissage. SA - Site 3' accepteur
d'épissage.
Fi~ure 5: Analyse de la production de la fibre adénovirale par détection
immunologique à l'aide d'un sérum polyclonal contre la fibre (Boulanger et al.). Les extraits
10 cellulaires sont préparés après 72h d'infection virale, la déxaméthazone est ajoutée en même
temps que le virus (concentration finale 600 nM). (A) Infection par le virus dllO14 (MOI =
10); (B) Infection par le virus dllO01 (MOI = 1); Infection par le virus dllO04 (MOI = 10);
(wt) Infection par le virus Ad5 (MOI = 10).
~ ,ure ~: Inductibilité de E4 dans les cellules du clone ~ ' Analyse des e.~;traits
l~ cellulaires non infectés (contrôle inférieur à 0) ou infectés par le virus dllO07, 72 après
inièction. DM = déxaméthazone (600 nM).
Fi ure 7: Stratégie de construction clonale des virus ~E1, ~E4.
Techniqlles génér:lles de biologie moléc~ ire
Les méthodes classiquement utilisées en biologie molécul~ire telles que les
20 extractions préparatives d'ADN plasmidique, la centrifugation d ' ADN plasmidique en
gradient de chlorure de césium, I'électrophorèse sur gels d'agarose ou d'acrylamide, la
purification de fragments d'ADN par électroélution, les extraction de protéines au phénol ou
au phénol-chloroforme, la précipitation d'ADN en milieu salin par de l'éthanol ou de
l'isopropanol, la transformation dans Escherichia coli, etc ... sont bien connues de l'homme
25 de métier et sont abondamment décrites dans la littérature [Maniatis T. et al., "Molecular
Cloning, a Laboratory Manual", Cold Spring Harbor Laboratory, Cold Spring Harbor,
N.Y.~ 19~2; Ausubel F.M. et al. (eds), "Current Protocols in Molecular Biolog~". John
~ile~ ~ Sl)tl~ ~\e\~ ~'011~ 19S7].
Les plasmides de type pBR322, pUC et les phages de la série M13 sont d'origine
30 commerciale (Bethesda Research Laboratories). Pour les ligatures, les fragments d'ADN
peuvent être séparés selon leur taille par électrophorèse en gels d'agarose ou d'acrylamide,
CA 02210168 1997-07-17
WO 96t22378 PCT/FR96/00088
extraits au phénol ou par un mélange phénol/chloroforme, précipités à l'éthanol puis incubes
en présence de l'ADN ligase du phage T4 (Biolabs) selon les recommandations du
fournisseur. Le remplissage des extrémités 5' proéminentes peut être effectué par le
fragment de Klenow de l'ADN Polymérase I d'E. coli (Biolabs) selon les spécifications du
- 5 fournisseur. La destruction des e~LIélllilés 3' proéminentes est effectuée en présence de
l'ADN Polymérase du phage T4 (Biolabs) utilisée selon les recommandations du fabricant.
La destruction des ~LIélllités 5' proéminentes est effectuée par un traitement ménagé par la
nucléase S1.
La mutagénèse dirigée in vitro par oligodéoxynucléotides synthétiques peut être
effectuée selon la méthode développée par Taylor et al. [Nucleic Acids Res. 13 (1985)
~749-8764] en utilisant le kit distribué par Amersham L'amplification enz~ matique de
fragments d'ADN par la technique dite de PCR [Polymérase-cata]yzed Chaill Reaction.
Sail~i R.K. et al., Science 230 (1985) 1350-1354; Mullis K.B. et Faloona F.A., Metll.
Enzym. 155 (1987) 335-350] peut être effectuée en utilisant un "DNA thermal cycler"
(Perkin Elmer Cetus) selon les spécifications du fabricant. La vérification des séquences
nucléotidiques peut être effectuée par la méthode développée par Sanger et al. [Proc. Natl.
Acad. Sci. USA, 74 (1977) 5463-5467] en utilis,.nt le kit distribué par Amersham.
E~emple 1. Construction de plasmides port:~nt diff~rentes unit~s fonctio~ elles
de l~ ré~ion E4 solls contrôle d'un promotellr
~ O ]; I . Construction du plasmide pE4Gen
Le plasmide pPY2 correspond au clonage du fragment Avr7-Sall (environ 1.3 lib
incluant le promoteur du MMTV) du plasmide pMSG (Pharmacia) entre les sites Xbal et
Sall du plasmide pIC20H préparé à partir d'un contexte E. coli dam+. Le plasmide pPY4
dérive du plasmide pPY2 par délétion d'un fragment de 35 pb après coupure par BamHl et
~5 Bgl ' puis religature Le plasmide pPY5 correspond au plaslllide plC20H dans lequel le
fragment Taq 1 -Bgl2 incluant la region E4 de l'adeno~irus de type 5 situee entre les
positions 3557G (Taql) et 32490 (Bgl2), a été cloné entre les sites Clal et BamHI. La
région E4 du plasmide pPY5 est donc incluse dans un fragment EcoRV-Sphl que l'on peut
cloner après digestion partielle entre les sites Smal et Sphl du plasmide pPY4, ce qui
30 génère le plasmide pPY6. L'insertion du fragment Xhol du plasmide pKIXX (Pharmacia),
qui porte un gène conférant la résistance à la généticine chez les cellules 293, dans le
plasmide pPY6 génère le plasmide pE4Gen. Ce plasmide porte donc un gène sélectionnable
et la totalité de la région E4 de l'adénovirus exprimée à partir du promoteur du ~IT~'.
CA 02210168 1997-07-17
WO 96t22378 PCT/FR96/00088
'~
Dans ce plasmide particulier ces deu~ ~ènes se sui~ent et les se(luel1ces c~(lante~ respecli~ es
sont portées par le même brin d'ADN. Dans Ge plasmide, le site principal S' donneur pour
l'épissage localisé en amont de la phase de lecture ORF1 (vers la position 35548) est donc
conservé pour assurer un épissage alternatif correct, permettant de génerer les différents
5 produits d'expression de toutes les phases codantes de la ré~ ion E4 et de manière
comparable à l'épissage alternatif observé lors du cycle viral.
1.2. Construction du plasmide pORF6Gen
Le plasmide pPY13 correspond au clonage du fra~,ment Bgl''-:Xbal du plasmide
pPY6 entre les sites correspondants du plasmide pIC20H. Ce fragment de 1.6 l~b inclus
donc la séquence de l'adénovirus de type 5 de la position 34115 (Bgl2) à la position 32490
(Bgl2, suivi du site Xbal provenant du multisite de clonage du plasmide pIC20H). Le
plasmide pPY13 contient donc la totalité des phases ouvertes de lecture ORF6 et ORF7 de
l'adenovirus, maintenant incluses dans un fragmel1t Xho 1 -Spl1 l . Le clona~,e de ce fra(~ment
entre les sites Sall et Sphl du plasmide pPY4 ~enère le plasmide pP~ 15. L'insertion du
15 fragment Xho 1 du plasmide pKIXX, qui porte un gène conférant la résistance à la
généticine chez les cellules 293, dans le plasmide pPY15 génère le plasmide pORF6Gen. Ce
plasmide porte donc un gene sélectionnable et les phases ouvertes de lecture ORF6 et ORF7
de la région E4 de l'adénovirus exprimée à partir du promoteur du MMTV. Dans ce
plasmide particulier ces deux gènes se suivent et les séquences codantes respectives sont
~0 portées par le même brin d'ADN. Le premier codon d'initiation de l~ traduction est celui de
la phase ouverte ORF6 (position 34077 dans le génome de l'AdS) et il est sépare du site
CAP du promoteur du MMTV par 235 nucléotides. Dans la mesure ou l'épissage alternatif
est séquentiel et implique en premier lieu la reconnaissance du site 5' donneur, le site
principal 5' donneur localisé en amont de la phase de lecture ORFI (vers la position 35548)
25 n'a donc pas été inclus dans la construction du plasmide pORF6Gen pour permettre
ultérieurement une expression efficace des produits des phases de lecture ORF6 et ORF6/7
(figure 4A).
1 3. Constructiol1 du plasmide pORF4Gen
Le plasmide pPY14 correspond au clonage du *agment Bgl2-Xbal de 1,9 kb
30 (obtenu apres digestion partielle par l'enzyme Bgl2), du plasmide pPY6 entre les sites
correspondants du plasmide pIC20H. Ce fragment de 1.9 l~b inclus donc la séquence de
l'adénovirus de t~pe 5 de la position 34387 (Bgl2) à la position 32490 (Bgl2, suivi du site
Xbal provenant du multisite de clonage du plasmide pIC20H). Le plasmide pPY14 est donc
CA 02210168 1997-07-17
WO 96122378 PCT/FR96/O()O88
isogénique au plasmide pPY 13 à l'exception qu'il inclus en plus un fragment Bgl2
correspondant à la quasi totalité de la phase ouverte de lecture ORF4. Ce plasmide contient
donc la totalité des phases ouvertes de lecture ORF4, 0RF6 et ORF7 de l'adénovirus,
maintenant incluses dans un fragment Xhol-Sphl. Le clonage de ce fragment entre les sites
5 Sall et Sphl du plasmide pPY4 génère le plasmide pPY16. L'insertion du fragment Xhol
du plasmide pKIXX, qui pôrte un gène conférant la résistance à la généticine chez les
cellules 293, dans le plasmide pPY16 génère le plasmide pORF4Gen. Ce plasmide porte
donc un gène sélectionnable et les phases ouvertes de lecture ORF4, 0RF6 et ORF7 de la
région E4 de l'adénovirus exprimée à partir du promoteur du MMTV. Dans ce plasmide
10 particulier ces deux gènes se suivent et les séquences codantes respectives sont portées par
le même brin d'ADN. Comme pour le plasmide pORF6Gen, le site principal 5' donneur
localisé en amont de la phase de lecture ORFl (vers la position 35548) n'a pas été inclus
dans la construction du plasmide pORF4Gen pour permettre ultérieurement une expression
efficace des produits des phases de lecture ORF4, 0RF6 et 0RF6/7.
1.4. Construction des plasmides pJYI et pJY2
Cet exemple décrit la construction d'un plasmide comportant une unité fonctionnelle
de E4 (Cf exemple 1.2.) sous contrôle d'un promoteur dérivé du MMTV. Plus
particulièrement, ce promoteur est un dérivé du MMTV comprenant 5 éléments de réponse
aux glucocorticoïdes, c'est à dire un dérivé hautement inductible par les glucocorticoïdes.
Ce plasmide a été construit de la manière suivante.
Le fragment Bglll de l'Ad5 (pOSitiOl1 3~115 a 32490) inclus les sequences
(0RF6+0RF7) de la région E4. Ce fragment a d'abord été cloné entre les sites BglII et
BamHI du plasmide pIC20H (Marsh et al., Gene 32 (1984) 481), ce qui génère le plasmide
pPY13 dans lequel le site BglII situé en amont de 0RF6 est conservé. Le fragment BglII-
SalI du plasmide pPY13 inclus donc la totalité des séquences (0RF6+0RF7) de la région
E4 de 1'Ad5. Ce fragment a été cloné entre les sites BamHI et SalI du plasmide pIC20H, ce
qui génère le plasmide pPY45.
Le fragment XbaI (environ I kb) du plasmide pGRE5-1 (Mader et White, PNAS 90
(1993) 5603) correspond à un promoteur dérivé du MMTV, hautement inductible par les
glucocorticoïdes. Ce fragment a été isolé et cloné entre les sites XbaI du plasmide pIC20H
isolé à partir d'un contexte dam-. Le plasmide obtenu a été désigné pPY21. Dans ce
plasmide, le site BglII provenant du multisite de clonage du plasmide pIC20H est localisé
immédiatement en amont des 5 éléments du promoteur capables de lier le récepteur
CA 02210168 1997-07-17
wo 96/22378 PCT/FR96/00088
24
nucléaire aux glucocorticoïdes. Le fragment BglII-EcoRI du plasmide pPY21 contenant le
promoteur hautement inductible par les glucocorticoïdes, a ensuite été cloné entre les sites
BglII et EcoRI du plasmide pIC20H, ce qui génère le plasmide pPY26.
Le clonage du fragment EcoRI-SphI du plasmide pPY45 entre les sites
5 correspondants du plasmide pPY26 génère le plasmide pJ~rl qui contient les séquences
(ORF6+0RF7) de l'Ad5 sous contrôle du promoteur hautement inductible par les
glucocorticoïdes (cassette pGRE5/(ORF6+0RF7)).
Un dérivé de pJY1 a également été construit contenant un gène de résistance à lagénéticine. Le fragment XhoI-SalI du plasmide pMSCV contient un gène bactérien
10 conférant la résistance aux cellules eucaryotes à la généticine (APH), exprimé à partir d'un
promoteur fort et ubiquitaire (PGK) chez les cellules. Ce fragment a été cloné dans le
plasmide pJYI, au site sall Le plasmide obtenu a eté désigné pJY2 Ce plasmide contient
les cassettes d'expression pGRE5/(ORF6+0RF7) et PGK/APH transcrites dans la mêmedirection.
1.5. Construction du plasmide pGGO
L'assemblage des parties GCR (HBD) et ORF6+0RF7 de la région E4 de l'Ad5 est
réalisé après amplification PCR en utilisant le plasmide pSG5HGR comme matrice et les
déoxyoligonucléotides SEQ ID N~5
5'-(~ 'GCCGCCACCATGGATATTGAACCTGAAGTGTTATATGCAGGA-3':
(le site Smal est en italique; la séquence consensus Koza}i d'initiation de la
traduction est en gras; le codon spécifiant le résidu 539 du GCR est souligné) et SEQ rD
N~6
5'-CTCGAGAACGCCGGACGTAGTCTTTTGATGAAACAGAAG-3 '
(le site Xhol est en italique; le site Tthl 111 est en gras; le codon spécifiant le residu
777 du GCR est souligné). L'oligonucléotide SEQ ID N~5 permet donc de positionner un
ATG spécifiant l'initiation de la traduction en amont du domaine HBD du GCR allant des
acides aminés 539 à 777 du GCR. L'oligonucléotide SEQ rD N~6 permet de positionner un
site de restriction Tthl 1 lI en aval du HBD. Le fragment d'amplification PCR a d'abord été
cloné dans le plasmide commercial pCRlI et le criblage blanc-bleu a permis de sélectionner
un clone dont l'identité a été vérifiée par séquençage (plasmide pCRII/GCR). Ce plasmide
CA 02210168 1997-07-17
WO 96122378 PCT/FR96/00088
est donc la source d'un fragment Smal-Xhol qui porte le domaine HBD du GCR ayant subi
l'amplification PCR avec les oligos SEQ ID N~5 et SEQ ID N~6.
Le plasmide pMEL3 est une construction intermédiaire qui contient le "polylinker"
EcoRI-Pstl du plasmide pSLl 180 inséré entre les sites EcoRI et PstI d'un dérivé du
plasmide pIC20H dans lequel le site Hind3 situé à proximité immédiate du site Nrul sur le
"polylinker" a été traité par le fragment Klenow de la Polymérase I d'E. coli puis religaturé
sur lui-même, ce qui transforme le site Hind3 en un site Nhel. Le plasmide pMEL3 contient
également un fragment BamHI correspondant au signal de polyadénylation de SV40,
préalablement inséré dans le site Bgl2 du "polylinker" de pIC20H. Le fragment Smal-Xhol
du plasmide pCRII/GCR qui contient le domaine HBD du GCR a alors été inséré entre les
sites correspondants du plasmide pMEL3, ce qui ~énere le plasmide pMEL3/GCR
Après digestion totale du plasmide pPY13 par Hinc2, digestion partielle par SspIpuis religature du plasmide sur lui-même, on génère le plasmide pPY13 (~ Hinc2-Sspl) qui
contient un fragment Hind3 d'environ 1.4 kb contenant la totalité de la séquenceORF6+0RF7 de la région E4 de 1'Ad5, incluant son site de polyadénylation.
Le plasmide pPY13 (~ Hinc2-Sspl) a été digéré par Hind3 et ses e~Ll~éll-iLés ont été
remplies à l'aide de la Polymérase Klenow Ce plasmide est ensuite digéré par XhoI, et les
séquences ORF6tORF7 (environ 1 ~ kb) sont alors clonees entre les sites Xhol et Nrul du
plasmide pMEL3/GCR, ce qui génère le plasmide pMEL3/GCR-Tthl 1 lI-(ORF6+0RF7).
Le couplage du site Tthl 1 lI introduit à l'aide de l'oligonucléotide SEQ ID N~6 avec
le site TthlllI situé immédiatement en aval de l'ATG traductionnel de ORF6 sur la
séquence de l'AdS (position 34070) permet de réaliser un couplage traductionnel entre le
domaine HBD du GCR et la protéine ORF6. Le plasmide pMEL3/GCR-Tthl 1 lI-
(ORF6+0RF7) est donc digéré par Tthl I II puis religaturé sur lui-même, ce qui génère le
2~ plasmide pMEL3/GCR-(ORF6+0RF7). Cette construction a été séquencée pour s'assurer
du couplage traductionnel entre le domaine HBD du GCR et ORF6. La séquence du gène
chimérique obtenue est présentée séquence SEQ ID N~7. Celle de la protéine résultante
GCR-ORF6 est présentée séquence SEQ ID N~8
Le traitement du plasmide pPY26 par EcoR1 et le fragment Klenow de la
Polymérase I d'E. coli, puis par Bgl2 génère un fragment incluant le promoteur inductible
GRE5, dont le clonage entre les sites Apal traité par le fragment Klenow et BamH1 du
plasmide pl\!fEL3/GCR-(ORF6+0RF7) génère le plasmide pMEL3/GRE-(GCR-
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
26
ORF6+0RF7). Ce plasmide est la source d'un fragment B~12-Nhel correspondant à lacassette d'expression codant pour la fusion GCR-(0RF~+0RF7) exprimée à partir dupromoteur GRE5 et dont le clonage entre les sites Bgl2 et Xbal du plasmide pCI-Neo
(Promega) génère le plasmide pGGO.
Exemple 2 - Construction des lignées cellulaires
Cet exemple décrit la construction de lignées cellulaires complémentantes pour les
régions El et E4 des adénovirus selon l'invention. Ces lignées permettent la construction et
la propagation d'adénovirus recombinants délétés pour ces régions, sans avoir recours à un
virus helper.
Les lignées de l'invention ont été construites par co-transfection des cellules choisies
en présence de phosphate de calcium, par les plasmides décrits dans l'exemple 1 et une
construction codant pour le récepteur aux glucocorticoïdes (Hollenberg et al., Nature, 318,
(1985) 635-641). Plus précisément, les cellules de la lignée 293 en boites de 5cm de
diamètre ont été transfectées par I à S ~Lg de plasmide E4 (pE4Gen, pORF6Gen,
pORF4Gen, pGGO ou pJY2) et éventuellement 5 llg d'un plasmide d'expression du
récepteur humain aux glucocorticoïdes exprimé à partir du promoteur précoce du virus
SV40 (plasmide pSGSHGR), en présence de phosphate de calcium, selon le protocole décrit
par Graham et Van der Eb (Virology 52 (1973) 456).
2.1. Selection des clones résistants à la généticine
Après transfection des cellules, celles ci sont lavées, puis le milieu de culture (MEM,
Sigma) supplémenté en sérum de voeu foetal (7% final) est ajouté et les cellules sont mises
à incuber pendant 20 heures. Le lendemain, on sélectionne les cellules en présence de
généticine à la concentration effective de 350 mg/l. La généticine est changée tous les trois
jours et les clones sélectionnables apparaissent après environ 3 semaines. Quand toutes les
cellules non transfectées sont mortes, seules les cellules ayant inséré le gène de résistance
subsistent et se di~isent pour générer des clones cellulaires Quand les clones cellulaires sont
suffisamment _ros pour être visibles à l'oeil nu, ils sont individuellement transférer dans les
puits de culture d'une plaque de culture "24 trous". Chaque clone est ensuite
progressivement amplifié en présence de généticine d'abord dans les puits d'une plaque de
culture "12 trous", puis "6 trous" pour être ensuite amplifié en boites de culture cellulaires.
Chaque clone cellulaire est alors conservé par congélation dans l'azote liquide.
-
CA 02210168 1997-07-17
WO 96122378 PCT/FR96/OnO88
27
2.2 Selection des clones capables de produire des VilUS déficients pour E4.
Les adénovirus Ad2dl808 (Weinberg et Ketner, J. Virol. 57 (1986) 833).
AdSdllO04, dllO07 ou dllO14 (Bridge et Ketner, J. Virol. 63 (1989) 631), dllOll (Bridge
et al., Virology 193 (1993) 794) sont des ml~t~nt.~ de délétion portant des délétions
S importantes au niveau de la région E4. Ces mutants sont incapables de se répliquer dans les
cellules 293, mais peuvent être produits dans les cellules W162 (Weinberg et Ketner, PNAS
80 (1983) 5383). Dans une seconde étape, les 50 clones resistants à la genéticine ont été
testés pour leur capacité à produire ces virus E4- et donc à transcomplémenter la région E4.
60 clones transfectés par le plasmide pJY2, résistant à la généticine, ont également été
criblés pour cette capacité à transcomplémenter la région E4.
Pour cela, chaque clone est infecté en milieu liquide par le virus dl808 à une
multiplicité d'infection d'environ 0,1 PFU/cellule (le titre viral est obtenu sur la lignée
W162). L'infection a été réalisée à une moi de 0,5 pfu/cellule pour les clones pJY~, dans un
milieu supplémenté en déxaméthazone ( l ,uM). L'apparition d'un effet cvtopathique
I 5 amplifiable par réinfection successive des cellules par le Iysat cellulaire obtenu est indicateur
d'une certaine propagation virale de dl808 par les cellules du clone considéré. Cette
transcomplémentation est ensuite objectivée à la fois par analyse du niveau de réplication
virale et la faculté des cellules à former des plages virales (un protocole possible est décrit
par ~itt, M.; Bett, A.J.; Prevec, L. et Graham, F.L. "Construction and propagation of
human adénovirus vectors" in: Cell Biology; a Laboratory Handbook. Volume 1. J.E. Celis
(Ed); Academic Press Inc. (San Diego, CA, USA). p479-490) apres infection par dl808
Cette étape a permis de mettre en évidence plusieurs clones particuliers présentan~
des propriétés efficaces de transcompl~ment~tion de la région E4. Le premier, désigné
Clone#2, résulte de la transfection du plasmide pORF6Gen; le second, désigné Clone#4, a
été isolé après transfection du plasmide pE4Gen. Des clones stables, capables detranscomplémenter pour la région E4, et hautement inductibles par les glucocorticoïdes ont
également été obtenus après transfection des cellules 293 par le plasmide pJY2. Par ailleurs,
d'autres clones stables, capables de propager efficacement des virus défectifs pour la région
E4, et hautement inductibles par un composé non stéroïde ont encore été préparés. Ces
- 30 clones ont été obtenus par co-transfection des cellules 293 par le plasmide pJ'r'~ et par un
plasmide exprimant un transactivateur artificiel composé d'une région transactivatrice
(VP16), de la région qui lie l'ADN provenant du récepteur aux glucocorticoïdes, et d'une
partie tronquée en C-terminal du récepteur à la progestérone, de telle sorte que ce récepteur
-
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
28
hybride soit capable de transactiver le promoteur GRE5 en présence de RU406 et non de
stéroïdes. Les clones obtenus sont effectivement capables de propager efficacement des
virus E4-défectifs en présence de RU486.
Le plasmide pGGO seul, ou une combinaison équimoléculaire des plasmides pGGO et
5 pSGSHGR sont trarisfectés dans des cellules permissives pour l'adénovirus de type 2 ou 5,
et les clones stables sont sélectionnés en présence de 400 mg/l de généticine. Par exemple,
la transfection du plasmide pGGO dans les cellules 293 génère le clone IGRP 1 ~ qui permet
la propagation des virus doublement défectifs pour El et E4 en présence de dexaméthasone
M), ce qui n'est pas le cas en l'absence d'addition.
2.3. Gapacité à propager des adénovirus déficients pour El .
La capacité des lignées préparées à complémenter la région El a été vérifiée après
infection par l'adénovirus Ad-RSV13Gal. Cet adénovirus de première génération (déficient
dans E1 seulement), comprend le gène LacZ de E.coli sous contrôle du promoteur du LTR
du virus RSV (Stratford-Perricaudet et al., J. Clin. Invest. 90 (1992) 626~. Les cellules des
15 clones #2, #4 et des cellules obtenues avec pJY2 ont été infectées par le virus Ad-RSVBGal
et une propagation virale a été observée pour chaque clone.
Ces résultats montrent que la capacité des cellules à transcomplémenter la région El
n'a pas été affectée par l'introduction supplémentaire de la partie distale de la région E4
(clone #2, cellules pJY'') ou de la région E4 complète (clone #4).
2 4. Analvse en Southern~ Northern blot et RT-PCR pour vérifier l'intégration d'une
unité E4 fonctionnelle dans le génome.
Les cellules des clones #2 et #4 ont été analysées en Southern blot pour vérifier
l'expression des protéines virales. Plus particulièrement, I'analyse en Southern Blot (analyse
du DNA génomique hybridant avec une sonde radioactive provenant de la région E4
adénovirale) a été réalisée selon le protocole décrit par Maniatis et al. A cet effet, I'ADN
génomique des cellules 293 et #2 a été préparé. 2 ~g de cet ADN ont été utilisés comme
matrice dans une réaction de PCR réalisée en présence de Polymérase Taq~ de l'oligo l de
séquence SEQ ID n~l (correspondant aux nucléotides 52 à 71 du promo~eur MMTV) et de
l'oligo 2 de séquence SEQ ID n~2 (correspondant aux positions 32921-32940 du génome de
l'AdS). Ces oligo amplifient un fragment de 2617 pb du plasmide pORF6Gen.
L'amplification a été réalisée dans les conditions suivantes: dénaturation à 94~C pendant 5
CA 02210168 1997-07-17
Wo 96/22378 PCT/FR96/00088
29
min, 30 cycles d'amplification par dénaturation à 94~C pendant 1 min, hybridation à 60~C
pendant 2 min, et extension à 70~C pendant 3 min, I'extension lors du dernier cycle étant
prolongée pendant 10 min. Les produits d'amplification ont ensuite été analysés par
électrophorèse SDS I % d'agarose et identifiés en Southern Blot et hybridation avec une
S sonde marquée couvrant la région (0RF6 + ORF7) de l'adénovirus ou la région MMTV.
L'analyse en Northern Blot et RT-PCR (analyse des ARNs cellulaires des clones 2 et
4 hybridant avec une sonde radioactive provenant de la région E4 adénovirale) a été réalisée
selon le protocole décrit par Maniatis et al., les ARNs cellulaires polyadénylés ayant été
préparés selon le protocole décrit par R.E. Farrell Jr. "RNA isolation strategies". in: RNA
Methodologies; a Laboratory Guide for Isolation and Characterization. Academic Press Inc.
(San Diego, CA, USA). p46-92). Pour la RT-PCR, 500 ng des ARN polyA+ ont été traités
avec 0,5 unité de DNAse I puis soumis à une transcription inverse avec une amorce
oligo(dT). Un dixième de la préparation d'ADNc simple brin ainsi obtenue a été utilisé
comme matrice dans une réaction de PCR réalisée au moyen de l'oligo 2 (SEQ ID n~2) et de
l'oligo 3 (SED ID n~3), correspondant aux nucléotides 227-246 par rapport au site cap du
promoteur MMTV (voir figure 4). Ces oligo ont été construits pour amplifier un fragment
de 1255 pb de l'AR~m non epissé 0RF6 et un fragment de 545 pb de l'ARNm épissé
ORF6/7. Les produits d'amplification ont été analysés en gel SDS I % d'agarose et identifiés
en Southern Blot et Hybridation à la sonde (ORF6+0RF7) marquée.
Ces analyses ont permis de montrer que ces 2 clones possèdent leur unité
fonctionnelle E4 respective intégrée à raison de quelques copies par cellules. De plus, ces
études démontrent que ces deux clones expriment la protéine de la fibre de l'adénovirus
après infection avec les mllt~n~ de délétion Ad5dllO04, Ad5dllO11 et Ad5dllO14 (Figure
5). Cette protéine est une protéine tardive du cycle réplicatif et infectieux de l'adénovirus,
dont la synthèse implique l'expression de E4. La présence de cette protéine dans les cellules
infectées par les mutants E4- confirme que ces cellules expriment bien une activité E4
fonctionnelle.
Les analyses en Southern Blot indiquent plus particulièrement que le clone ~2
contient une copie de la cassette MMTV-(ORF6+0RF7) intégrée dans son génome.
L'intégrité de cette cassette a en outre été démontrée par l'amplification au moyen des oligos
I et 2 qui génère un fragment de 2,6 Kb ~ttendll, qui peut être spécifiquement détecté par
une sonde radiomarquée correspondant à l'unité (ORF6+0RF7) ou au promoteur MMTV
(figure 4). L'occurrence d'un épissage alternatif correct dans les cellules de l'invention a
CA 02210168 1997-07-17
wo 96/22378 PCT~96/00088
également été démontrée par RT-PCR. Ainsi 2 signaux principaux ont été détectés
spécifiquement avec la sonde radiomarquée (ORF6+0RF7) dans le clone #2 non infecté,
cultivé en présence de dexaméthazone (conditions inductrices). Le signal le plus important
est un fragment de 1,3 kb environ, taille qui correspond parfaitement à un produit non
S épissé dérivé de 0RF6/ORF7. L'autre signal est un fragment de 0,6 kb environ, taille en
accord avec l'excision (lors de l'épissage) de l'intron de 712 nucléotides générant le
messager 0RF6/7. Ces résultats montrent clairement qu'un épissage altematif correct se
produit dans les cellules de l'invention, et que les deux produits 0RF6 et 0R~6/7 de la
région E4 sont bien exprimés dans ces cellules.
La capacité des cellules de l'invention à exprimer un produit fonctionnel de la région
0RF6 a par ailleurs été démontrée par immunodétection de la protéine de la fibre. Les
résultats obtenus montrent que les cellules 293 infectées par l'adénovirus AdS dllO07 ne
produisent pas de fibres. Au contraire, un signal fibre-spécifique est détecté dans les cellules
de l'invention (clone #2 notamment) après infection par ce mutant, et pas dans les autres
l S cellules non infectées. La présence de la fibre a également été démontrée dans les cellules de
l'invention infectées par les mutants dl808, dllO04 (ORFl+), dllOl l ou dl 1014 (ORF4+) en
présence de déxaméthazone.
2.5. Formation de plages
Cette analyse montre clairement les propriétés particulièrement avantageuses des20 lignées selon l'invention. En effet, alors que les deux clones (clone#2 et clone#4) sont
capables de transcomplémenter la région E4 et de propager avec une efficacité comparable
les mutants Ad2dl80~ ou AdSdllO04 par exemple, ils présentent une différence très
si~nificative en ce qui concerne la formation de plages de virus apres infection par les
m~lt~nt~ Ad2dl808, Ad5dllO04, AdSdllO07, AdSdllO11 ou AdSdllO14.
La capacité de former des plages de virus est une propriété essentielle des lignées de
production. C'est en effet sous cette condition que des clones de virus recombinants peuvent
être isolés, puis amplifiés et purifiés. Les résultats obtenus montrent clairement que la
formation de plages de virus est toujours observée avec le clone#2, alors que cela ne se
produit que rarement avec le clone#4. Ces résultats démontrent clairement les propriétés
~0 très supérieures des li~nées de l'invention dans lesquelles seulement une unité fonctionnelle
particulière de la région E4 est intégrée.
CA 02210168 1997-07-17
wo 96/22378 PCT/FR96/00088
2.6~ E~pression ré~ulée de l'activité E4
Une autres propriéte avantageuse du clone#2 selon l'invention réside le caractère
régulé et inductible de l'expression de l'activité E4. Ainsi, les résultats obtenus montrent que
la formation de plages de virus n'est observée qu'en présence de déxaméthazone. De même,
S dans le clone#2, I'expression de la protéine de fibre de l'adénovirus après infection par le
mutant Ad5dllO07 est significativement augmentée dans les conditions d'induction (figure
6). Les mêmes résultats ont été obtenus avec les mllt~nt~ Ad5dl808, Ad5dllO04, Ad5dllO11
et Ad5dllO14. En revanche, I'expression de l'activité E4 dans le clone#4 est constitutive.
L'ensemble de ces résultats démontre clairement les avantages des lignées cellulaires
10 de l'invention dans lesquelles seulement une unité fonctionnelle particulière de la region E4
est intégrée. Ces avantages résident en particulier dans la capacite à former des plages de
virus et à permettre l'amplification des virus défectifs en milieu liquide. Ces avantages sont
également dans le caractère régulé de l'expression de l'activité E4, contrairement aux lignées
dans lesquelles des unités fonctionnelles plus grandes de E4 sont présentes.
Exemple 3 - Production de virus défectifs pour les fonctions El et E4
Cet exemple décrit l'utilisation des lignées cellulaires selon l'invention pour la
production de virus recombinants déficients dans les régions El et E4. Ces adénovirus ont
été produits par recombinaison homologue, après co-transfection, dans les cellules de
l'invention, de deux fragments d'ADN, I'un apportant la partie gauche du génome du virus
20 recombinant (possédant une délétion dans la région El), I'autre apportant la partie droite du
génome du virus recombinant (possédant une délétion dans la région E4).
Plus précisément, les cellules 293E4 (clone#2 et #4) ont été cotransfectées par 10
mg de l'ADN du virus Ad-RSV13Gal (Stratford-Perricaudet et al.) digéré par Srfl (ou 5 mg
d'ADN du plasmide ayant servi à la construction de ce virus et digéré par Xmnl )7 et 10 mg
25 de l'ADN du virus apportant la délétion fonctionnelle de la région E4 (par exemple
Ad2dl808, Ad5dllO04, Ad5dllO07 ou Ad5dllO14) digéré par l'enzyme Clal. Après
apparition de l'effet cytopathique, les virus sont purifiés par au moins deux cycles
consécutifs d'étalement en solide pour la formation de plages sur clone 2. Les plages
correspondant à l'infection du virus recherché (analyse de l'ADN démontrant la double
30 délétion El et E4) sont alors amplifiées par des cycles d'infection consécutives. Des stocks à
titre élevés sont préparés par purification sur gradient de chlorure de césium. Les virus sont
conservés à -80~C selon les techniques classiques de l'homme de l'art.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
Outre la faculte du clone à faire des plages virales, il permet une propaga~ion en
milieu liquide particulièrement efficace pour le virus ADSdl]014 (El~E4- mais ORF4T) ou
pour le virus E1-E4- construit a partir du virus dllO14.
Par contre le clone 4 obtenu après transfection du plasmide pE4Gen n'est pas très
5 performant pour faire des plages car il a du mal à tenir la confluence cellulaire pendant un
temps sllffi~mment long pour que les plages de Iyse virale soient facilement repérables (et
surtout si le virus recombinant recherché ne code pas pour la ~-galactosidase).
Une méthode alternative de production repose sur la construction clonale des virus
selon l'invention. Plus particulièrement, selon cette méthode, les adénovirus ~E1~E4 sont
10 produits par double-recombinaison homologue in vivo après co-transfection de 3 fragments
d'ADN recouvrants, apportant chacun une partie du génome du virus.
Plus particulièrement, les 3 fragments recouvrants suivants, dérivés des génomesAdRSV~gal et Ad dllO14, ont été purifiés par électroélution (Figure 7)
i) Fragment I Ce fragment est un fragment Narl de 6,8 l~b codant pour la ~gal
15 correspondant à la partie gauche (AEI) du génome de AdRSV,~gal. Sa contamination par
un génome AdRSV,~gal non coupé (et donc réplicatif) est fortement improbable car la
digestion complète par NarI génère ce fragment parmi 25 autres allant de ''6 nucléotides à
3,8 kb.
ii) Fragment II: Ce fragment est un fragment DraI de 9,4 kb également dérivé du
20 génome de AdRSV~gal, et qui se chevauche avec le fragment I sur 1509 nucléotides (cf
Figure 7). La cont~min~tion de ce fragment par un génome infectieux est également
impossible dans la mesure où ce fragment a été purifié à partir de l O fragmentssupplémentaires de taille comprise entre 494 nucléotides et 4,8 kb, après digestion totale par
DraI et Afi II.
iii) Fragment III: Ce fragment est un fragment NsiI de 21,3 kb dérivé du génome de
Ad5 dllOl4. Il chevauche le fragment II sur 1652 nucléotides (Figure 7). Ce fragment
apporte la partie droite du génome du virus recombinant, contenant la région E4 modifiée
(~E4,0RF4+). Sa cont~min~tion est encore une fois plus qu'improbable puisqu'il a été
purifié après digestion complète par NsiI générant 7 fragments de taille comprise entre 17S
nucléotides et 4 kb.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
Les fragments purifiés ont été co-transfectés dans les cellules clone "2 selon le
protocole décrit pour les cellules ~93, en présence de 1 ~IM de dexaméthazone dans le
milieu (ajouté tous les 4 jours pendant 3 semaines). Au terme de cette culture, les cellules
ont été récoltées, congelées et décongelées 3 fois dans un bain glace/éthanol, puis
~ 5 centrifugees à 3000 g pendant 20 min. Le Iysat cellulaire a ensuite été ajouté à une culture
frâîche de cellules clone #2 (également désignées IGRP2) en présence de déxaméthazone (1
~LM). Après S jours, un effet cytopathique a été observé, démontrant la production des
virus. Un stock de ce virus recombinant Ad~E 1, ~E4, ORF4+ a été obtenu après
amplification progressive du mélange induisant l'effet cytopathique sur 100 boites de 10 cm
contenant des cellules clone #2 à sous-confluence, en présence de 1,uM déxaméthazone.
Après purification sur gradient de chlorure de césium et dialyse à 4~C, le stocli viral a été
titré sur monocouches de cellules clone #2 supplémentées de dexaméthazone ( l~lM), avant
coloration in vitro avec du X-Gal. Dans la mesure où toutes les plaques sont positives, le
titre peut-être exprimé soit en pfu / ml soit en plaque virale exprimant la ~-gal. Selon cette
procédure, un stock de 101~ pfu a été préparé. L'absence de RCA dans ce stock a ensuite
été contrôlée par analyses de restriction et en southern. Pour cela l'ADN viral d'un
recombinant du stock a été préparé selon la technique de Challberg (Virology 114 (1981)
196). 2~g de cet ADN ont été soumis à une analyse de restriction et gel d'agarose 1 %. Les
fragments ont eté transférés sur membrane Hybond-N (Amersham) et hybridés avec une
sonde radioactive correspondant aux ITRs de l'adénovirus pour détecter spécifiquement les
fragments localisés aux extrémités du génome viral.
L'analyse de restriction par les enzymes SmaI, AflII ou StuI a donné les profilsattendus, pour des préparations non contaminées par des fra;,ments E1+ ou E4 + comme en
témoigne la stoechiométrie relative des différents fragments de restriction.
L'analyse en Southern après transfert sur membranes montre que la digestion par
StuI génère seulement 2 fragments hybridant avec la sonde ITR: Un de ces fragments
présente une mobilité correspondant à celle du fragment de 1125 pb de AdRSV~gal codant
pour la ~gal, l'autre migre comme le fragment StuI de 2673 pb de AdSdllO14 portant la
délétion E4. Une exposition prolongée de l'autoradiogramme ne fait apparaître aucune
bande supplémentaire ayant une taille correspondant au fragment E1+ (3158 bp) ou E4~
(3980 pb). De même, un fragment correspondant en taille (3267 pb) à l'introduction de
l'unité E4 fonctionnelle (ORF4 + ORF6 + ORF7) dans le génome du recombinant n'a pas
été détecté, démontrant qu'il n'y a pas eu d'événement de double recombinaison pendant la
production entre le génome viral et l'unité E4 intégrée dans la cellule. Ces résultats
CA 02210168 1997-07-17
wo 96122378 PCT/FR96/00088
34
démontrent donc que les cellules de l'invention peuvent être utilisées pour produire
efficacement des lots de virus ~E1, ~E4 dépourvus de RCA.
Exemple 4 - Prodllction d'AA~ recombinants
Cet exemple décrit l'utilisation des lignées cellulaires contenant tout ou une partie de
5 la région E4 d'un génome adénoviral pour la production d'AAV. Ces AAV ont été produits
par co-transfection, dans lesdites cellules, d'un plasmide ITR-AAV et d'un plasmide
Rep/Cap, et par co-infection avec un adénovirus helper.
Plasmides et virus utilises
- Plasmide ITR-AAV, désigne pMA10: Ce plasmide comporte un acide nucléique
10 d'intérêt (cassette d'expression du gène ~-gal d'E.coli composée du promoteur du LTR-
RVS, du gène LacZ précédé d'un signal de localisation nucléaire, et du site de
polyadénylation du virus SV40) borde de 2 ITR d'AAV. Le plasmide pMA10 a été obtenu
en digérant le plasmide pXL2582 par SpeI et en refermant par traitement à l'ADN ligase du
bactériophage T4. Ce traitement permet de supprimer les séquences palindromiques en aval
15 de l'ITR gauche de l'AAV. Le plasmide pXL2582 a été obtenu en ligaturant les fragments
suivants dans les sites EcoRI-KpnI de pXL2359 (décrit dans la demande FR94 02445) .
a) EcoRI-XbaI (contenant l'ITR gauche de l'AAV jusqu'au nucléotide 155, site
HinfI sur la séquence publiée de l'AAV) de pXL2580, et,
b) XbaI-KpnI de pXL2359 (contenant la cassette d'expression du gène LacZ)
Le plasmide pXL2580 a été obtenu à partir de pXL2359 de la manière suivante:
pXL2359 a été digéré par EcoRI-XbaI et déposé sur gel d'agarose 1%, d'ou un fragment
de 650 pb a été purifié. Ce fragment a été redigéré par HinfI et traité à l'ADN Polymérase
du bacteriopha~e T4, recoupe par Pstl puis dépose sur ~el d'agarose 2~~o, d'ou un fragment
de 200 pb a été purifié. Ce fragment, contenant l'ITR gauche de l'AAV jusqu'au nucléotide
155 a été introduit entre les sites PstI-SmaI de pBSKS+ (Stratagene).
- Plasmide Rep/Cap: Le plasmide utilise, désigne p~Bal, a été décrit par Lebkowski
et al (Mol. Cel. Biol. 8 (1988) 3988). Ce plasmide contient les régions rep et cap de l'AAV
sous contrôle du promoteur endogene PS. D'autres promoteurs peuvent être substitues au
promoteur PS, tels que notamment le promoteur constitutif du LTR-RVS.
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/UOQ88
- L'adénovirus helper utilise est un adénovirus sauvage AdS. Il est entendu que
d'autres virus helper peuvent être utilises, et notamment un AdS défectif pour la région E1
et/ou E4, ou un adénovirus canin. L'intérêt d'utiliser un adénovirus canin réside dans leur
capacité à supporter la réplication des AAV tout en étant des virus défectifs chez l'homme.
5 De ce fait, les préparations d'AAVr obtenues sont totalement dépourvues de RCA et
d'adénovirus humain cont~min~nl.
Protocole
La production a été réalisée par transfection de 20 boites de 5cm de diamètre decellules Clone#2 (IGRP2), à la densité de 3.106 cellules par boite environ, préalablement
inoculées 24 à 48 heures dans du milieu MEM 10%SVF. Dans chaque boite ont été co-
transfectés 1 ~Lg de plasmide pMA10 et 5 llg de plasmide p~Bal en présence de 16 lag de
peptide H1, de 16,5 ~I de lipofectamine (Gibco-BRL, Life Technologies) et de OPTIME~I
lipofectamine (Gibco-BRL, Life Technologies) selon les recommandations du fournisseur.
Apres 4 à 16 heures de contact du mélange sur les cellules, le mélange de transfection a été
retire et les cellules ont eté infectées pendant une heure avec l'adénovirus helper, avec un
infectivité de 10 pfu de virus par cellule dans un volume final de 500 ~ll. Du milieu
MEM10%SV~ + dexaméthasone 106 M a ensuite été ajoute. Les cellules ont été récoltées 5
jours après, reprises dans un tampon Tris HCI 10 mM, pH ~, lysées par 3 congélations
décongélations, puis traitées avec du déoxycholate de sodium et à la trypsine aux
concentrations respectives de 0.25% et de 1% pendant 30 min à 37C. Les AAV
recombinants produits ont ensuite été purifies sur gradient de chlorure de césium à la
densité de 1.4, dans un rotor SW55.1 à 35000rpm pendant 20 heures.
Ces expériences ont permis d'obtenir des titres élevés de virus recombinants: 10"
génomes par ml. Ce procédé permet donc de produire des quantités très élevées d'AAV
recombinants (les procédés décrits dans l'art antérieur conduisent à des titres 10 à 100 fois
inférieurs), ayant des qualités propres à un usage thérapeutique chez l'homme. En outre, il
est très facile d'utiliser des quantités de cellules 10 fois plus importantes, et donc d'obtenir
un titre en virus plus élevé.
CA 02210168 1997-07-17
WO 96/22378 PCT/~R96/00088
36
LISTE DE SEQUENCES
(1) INFORMATIONS GENERALES:
(i) DEPOSANT:
(A) NOM: RHONE POULENC RORER
(B) RUE: 20 AVENUE RAYMOND ARON
(C) VILLE: ANTONY CEDEX
(E) PAYS: FR~NCE
(F) CODE POSTAL: 92165
(G) TELEPHONE: 40.91.69.22
S (H) TELECOPIE: 40.91.72.91
(ii) TITRE DE L'INVENTION: CELLULES POUR LA PRODUCTION D'ADENOVIRUS
RECOMBINANTS
~iii) NOMBRE DE SEQUENCES:8
(iv) FORME DECHIFFRABLE PAR ORDINATEUR:
(A) TYPE DE SUPPORT: Tape
(B) ORDINATEUR: IBM PC compatible
(C) SYSTEME D' EXPLOITATION: PC-DOS/MS-DOS
(DJ LOGICIEL: PatentIn Release #1.0, Version #1.30 (OEB)
(2) INFORMATIONS POUR LA SEQ ID NO: 1:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 20 paires de bases
(B) TYPE: nucléotide
(C) r~oMBRE DE BRINS: simple
(Dj CONFIGURATION: linéaire
~ii) TYPE DE MOLECULE: ADNc
(Yi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 1
AAGCAGCCAA GGGGTTGTTT 2
4~
(2) INFORMATIONS POUR LA SEQ ID NO: 2:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 20 paires de bases
(B) TYPE: nucléotide
(C) NOMBRE DE BRINS: simple
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
CA 022l0l68 l997-07-l7
W 096/22378 PCT~R96/00088
(Xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NC: ~:
ACCCTAGTAT TCAACCTGCC 20
(2) INFORMATIONS POUR LA SEQ ID NO: 3:
~i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 20 paires de bases
(B) TYPE: nucléotide
(C) NOMBRE DE BRINS: simple
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
(i:iJ DESCRIPTION DE LA SEQUENCE: SEQ ID N': 3:
ATCATCACAA GAGCGGAACG 20
(2) INFORMATIONS POUR LA SEQ ID NO: 4:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 3189 paires de bases
(B) TYPE: nucléotide
(C) NOMBRE DE BRINS: double
(D) CONFIGURATION: linéaire
~ll TYPE DE MOLECULE: ADNc
(iiil HYPOTHETIQUE: NON
3~ ~
(iv) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 4:
CATCCTCTTA CACTTTTTCA TACATTGCCC AAGAATAAAG AATCGTTTGT GTTATGTTTC 60
AACGTGTTTA TTTTTCAATT GCAGAAAATT TCAAGTCATT TTTCATTCAG TAGTATAGCC 120
4~
CCACCACCAC ATAGCTTATA CAGATCACCG TACCTTAATC AAACTCACAG AACCCTAGTA 180
TTCAACCTGC CACCTCCCTC CCAACACACA GAGTACACAG TCCTTTCTCC CCGGCTGGCC 240
TTAAAAAGCA TCATATCATG GGTAACAGAC ATATTCTTAG GTGTTATATT CCACACGGTT 300
TCCTGTCGAG CCAAACGCTC ATCAGTGATA TTAATAAACT CCCCGGGCAG CTCACTTAAG 360
TTCATGTCGC TGTCCAGCTG CTGAGCCACA GGCTGCTGTC CAACTTGCGG TTGCTTAACG 420
GGCGGCGAAG GAGAAGTCCA CGCCTACATG GGGGTAGAGT CATAATCGTG CATCAGGATA 480
GGGCGGTGGT GCTGCAGCAG CGCGCGAATA AACTGCTGCC G-CGCCGrTC CGTCCTGCAG 540
CA 02210168 1997-07-17
W O 96/22378 PCTA~R96/00088
GAATACAACA TGGCAGTGGT CTCCTCAGCG ATGATTCGCA CCGCCCGCAG CATAAGGCG_ 60~
CTTGTCCTCC GGGCACAGCA GCGCACCCTG ATCTCACTTA AATCAGCACA GTAACTGCA-- 660
CACAGCACCA CAATATTGTT CAAAATCCCA CAGTGCAAGG CGCTGTATCC AAAGCTCATG 720
GCGGGGACCA CAGAACCCAC GTGGCCATCA TACCACAAGC GCAGGTAGAT TAAGTGGCG.' 780
CCCCTCATAA ACACGCTGGA CATAAACATT ACCTCTTTTG GCATGTTGTA ATTCACCACC 840
TCCCGGTACC ATATAAACCT CTGATTAAAC ATGGCGCCAT CCACCACCAT CCTAAACCAG 900
CTGGCCAAAA CCTGCCCGCC GGCTATACAC TGCAGGGAAC CGGGACTGGA ACAATGACAG 960
TGGAGAGCCC AGGACTCGTA ACCATGGATC ATCATGCTCG TCATGATATC AATGTTGGCA 1020
CAACACAGGC ACACGTGCAT ACACTTCCTC AGGATTACAA GCTCCTCCCG CGTTAGAACC 1080
ATATCCCAGG GAACAACCCA TTCCTGAATC AGCGTAAATC CCACACTGCA GGGAAGACCT 1140
CGCACGTAAC TCACGTTGTG CATTGTCAAA GTGTTACATT CGGGCAGCAG CGGATGATCC 1200
TCCAGTATGG TAGCGCGGGT TTCTGTCTCA AAAGGAGGTA GACGATCCCT ACTGTACGGA 1260
GTGCGCCGAG ACAACCGAGA TCGTGTTGGT CGTAGTGTCA TGCCAAATGG AACGCCGGAC 1320
GTAGTCATAT TTCCTGAAGC AAAACCAGGT GCGGGCGTGA CAAACAGATC TGCGTCTCCG 1380
GTCTCGCCGC TTAGATCGCT CTGTGTAGTA GTTGTAGTAT ATCCACTCTC TCAAAGCATC 1440
CAGGCGCCCC CTGGCTTCGG GTTCTATGTA AACTCCTTCA TGCGCCGCTG CCCTGATA~C 1500
ATCCACCACC GCAGAATAAG CCACACCCAG CCAACCTACA CATTCGTTCT GCGAGTCAC.-. 1560
CACGGGAGGA GCGGGAAGAG CTGGAAGAAC CAT~llll"l"l TTTTTATTCC .~AAGATTAT 1620
CCAAAACCTC AAAATGAAGA TCTATTAAGT GAACGCGCTC CCCTCCGGTG GCGTGGTC~A 1680
ACTCTACAGC CAAAGAACAG ATAATGGCAT TTGTAAGATG TTGCACAATG GCTTCCAAAA 1740
GGCAAACGGC CCTCACGTCC AAGTGGACGT AAAGGCTAAA CCCTTCAGGG TGAATCTCCT 1800
CTATAAACAT TCCAGCACCT TCAACCATGC CCAAATAATT CTCATCTCGC CACCTTCTCA 1860
ATATATCTCT AAGCAAATCC CGAATATTAA GTCCGGCCAT TGTAAAAATC TGCTCCAGAG 1920
CGCCCTCCAC CTTCAGCCTC AAGCAGCGAA TCATGATTGC AAAAATTCAG GTTCCTCACA 1980
50 GACCTGTATA AGATTCAAAA GCGGAACATT AACAAAAATA CCGCGATCCC GTAGGTCCCT 2040
TCGCAGGGCC AGCTGAACAT AATCGTGCAG GTCTGCACGG ACCAGCGCGG CCACTTCCCC 210Q
GCCAGGAACC ATGACAAAAG AACCCACACT GATTATGACA CGCATACTCG GAGCTATGCT 2160
AACCAGCGTA GCCCCGATGT AAGCTTGTTG CATGGGCGGC GATATAAAAT GCAAGGTGCT 2220
GCTCAAAAAA TCAGGCAAAG CCTCGCGCAA AAAAGAAAGC ACATCGTAGT CATGCTCATG 2280
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
39
CAGATAAAGG CAGGTAAGCT CCGGAACCAC CACAGAA.~ ACCATTT TTCTCTCAAA 231C!
CATGTCTGCG GGTTTCTGCA TAAACACAAA ATAAAATAAC AAAAAAACAT TTAAACATTA 2400
V 5 GAAGCCTGTC TTACAACAGG AAAAACAACC CTTATAAGCA TAAGACGGAC TACGGCCATG 2460
CCGGCGTGAC CGTAAAAAAA CTGGTCACCG TGATTAAAAA GCACCACCGA CAGCTCCTCG 2520
GTCATGTCCG GAGTCATAAT GTAAGACTCG GTAAACACAT CAGGTTGATT CACATCGGTC 2580
AGTGCTAAAA AGCGACCGAA ATAGCCCGGG GGAATACATA CCCGCAGGCG TAGAGACAAC 2640
ATTACAGCCC CCATAGGAGG TATAACAAAA TTAATAGGAG AGAAAAACAC ATAAACACCT 2700
15 GAAAAACCCT CCTGCCTAGG CAAAATAGCA CCCTCCCGCT CCAGAACAAC ATACAGCGCT 2760
TCCACAGCGG CAGCCATAAC AGTCAGCCTT ACCAGTAAAA AAGAAAACCT ATTAAAAAAA 2820
CACCACTCGA CACGGCACCA GCTCAATCAG TCACAGTGTA AAAAAGGGCC AAGTGCAGAG 2880
CGAGTATATA TAGGACTAAA AAATGACGTA ACGGTTAAAG TCCACAAAAA ACACCCAGAA 2940
AACCGCACGC GAACCTACGC CCAGAAACGA AAGCCAAAAA ACCCACAACT TCCTCAAATC 3000
25 GTCACTTCCG TTTTCCCACG TTACGTCACT TCCCATTTTA AGAAAACTAC AATTCCCAAC 3060
ACATACAAGT TACTCCGCCC TAAAACCTAC GTCACCCGCC CCGTTCCCAC GCCCCGCGCC 3120
ACGTCACAAA CTCCACCCCC TCATTATCAT ATTGGCTTCA ATCCAAAATA AGGTATATTA 3180
TTGATGATG 3189
(2) INFORMATIONS POUR LA SEQ ID NO: 5:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 48 paires de bases
(B) TYPE: nucléotide
(C) NOMBRE DE BRINS: double
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
(iii) HYPOTHETIQUE: NON
iv) ANTI-SENS: NON
(Y.i) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 5:
GGGCCCGCCG CCACCATGGA TATTGAACCT GAAGTGTTAT ATGCAGGA 48
.
55 (2) INFORMATIONS POUR LA SEQ ID NO: 6:
CA 02210168 1997-07-17
W 096/22378 PCT~R96/00088
i) CAR~.CTERIST_QUES DE LA SEQUENCE:
(A LONGUEUR: 39 pai~es ~e ~ases .
(B) TYPE: nucléotide
(C) NOMBRE DE BRINS: double
(D) CONFIGURATION: linéaire r
(ii) TYPE DE MOLECULE: ADNC
lo
(Y.i) DESCRIPTIOI'J DE LA SEQUENCE: SEQ ID NO: 6:
CTCGAGAACG CCGGACGTAG TCTTTTGATG AAACAGAAG 39
ls
(2) INFORMATIONS POUR LA SEQ ID NO: 7:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 1884 paires de bases
(B) TYPE: nucléotide
(C; NOMBRE DE BRINS: double
(D CONFIGURATION: linéaire
(ii) TYP_ DE MOLECULE: ADNC
(iii) HYPOTHETIQUE: NON
(iV) ANT--SENS: NON
~ ) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 7:
ATGGATATTG A~CCTGAAGT GTTATATGCA GGATATGATA GCTCTGTTCC AGACTCAACT 60
TGGAGGATCA TJ.~CTACGCT CAACATGTTA GGAGG5CGGC ~AGTGATTGC AGCAGTGA.~ 120
TGGGCAAAGG CAATACCAGG TTTCAGGAAC TTACACCTGG ATGACCAAAT GACCCTACTG 180
CAGTACTCCT GGATGTTTCT TATGGCATTT GCTCTGGGGT GGAGATCATA TAGACAATCA 240
AGTGCAAACC TGCTGTGTTT TGCTCCTGAT CTGATTATTA ATGAGCAGAG AATGACTCTA 300
CCCTGCATGT ACGACCAATG TAAACACATG CTGTATGTTT CCTCTGAGTT ACACAGGCTT 360
CAGGTATCTT ATGAAGAGTA TCTCTGTATG AAAACCTTAC TGCTTCTCTC TTCAGTTCCT 420
AAGGACGGTC TC-AAGAGCCA AGAGCTATTT GATGAAATTA GAATGACCTA CATCAAAGAG 480
5~ CTAGGA~G CCATTGTCAA GAGGGAAGGA AACTCCAGCC AGAACTGGCA GCGGTTTTAT 540
CAACTGACAA A-.CTCTTGGA TTCTATGCAT GAAGTGGTTG AAAATCTCCT TAACTATTGC 600
TTCCAAACAT TTTTGGATAA GACCATGAGT ATTGAATTCC CCGAGATGTT AGCTGAAATC 660
ATCACCAATC AGATACCAAA ATATTCAAAT GGAAATATCA AAAAACTTCT GTTTCATCAA 720
AAGACTACGT CCGGCGTTCC ATTTGGCATG ACACTACGAC CAACACGATC TCGGTTGTCT 780
CA 022l0l68 l997-07-l7
W 096/22378 PCT~R96/00088
CGGCGCACTC CGTACAGTAÇ GGATCGTCTA CCTCCTTTTG AGACAGAA~C CCGCGCTACC &4,
ATACTGGAGG ATCATCCGCT GCTGCCCGAA TGTAACACTT TGACAATGCA CAACGTGAGT 900
TACGTGCGAG GTCTTCCCTG CAGTGTGGGA TTTACGCTGA TTCAGGAATG GGTTGTTCCC 960
TGGGATATGG TTCTAACGCG GGAGGAGCTT GTAATCCTGA GGAAGTGTAT GCACGTGTGC 1020
CTGTGTTGTG CCAACATTGA TATCATGACG AGCATGATGA TCCATGGTTA CGAGTCCTGG 1080
GCTCTCCACT GTCATTGTTC CAGTCCCGGT TCCCTGCAGT GTATAGCCGG CGGGCAGGTT 1140
TTGGCCAGCT GGTTTAGGAT GGTGGTGGAT GGCGCCATGT TTAATCAGAG GTTTATATGG 1200
]5 TACCGGGAGG TGGTGAATTA CAACATGCCA AAAGAGGTAA TGTTTATGTC CAGCGTGTTT 1260
ATGAGGGGTC GCCACTTAAT CTACCTGCGC TTGTGGTATG ATGGCCACGT GGGTTCTGTG 1320
GTCCCCGCCA TGAGCTTTGG ATACAGCGCC TTGCACTGTG GGATTTTGAA CAATATTGTG 1380
GTGCTGTGCT GCAGTTACTG TGCTGATTTA AGTGAGATCA GGGTGCGCTG CTGTGCCCGG 1440
AGGACAAGGC GCCTTATGCT GCGGGCGGTG CGAATCATCG CTGAGGAGAC CACTGCCATG 1500
TTGTATTCCT GCAGGACGGA GCGGCGGCGG CAGCAGTTTA TTCGCGCGCT GCTGCAGCAC 1560
CACCGCCCTA TCCTGATGCA CGATTATGAC TCTACCCCCA TGTAGGCGTG GACTTCTCCT 1620
TCGCCGCCCG TTAAGCAACC GCAAGTTGGA CAGCAGCCTG TGGCTCAGCA GCTGGACAGC 1680
GACATGAACT TAAGTGAGCT GCCCGGGGAG TTTATTAATA TCACTGATGA GCGTTTGGCT 1740
CGACAGGAAA CCGTGTGGAA TATAACACCT AAGAATATGT CTGTTACCCA TGATATGATG 1800
CTTTTTAAGG CCAGCCGGGG AGAAAGGACT GTGTACTCTG TGTGTTGGGA GGGAGGTGGC 1860
AGGTTGAATA CTAGGGTTCT GTGA 188
(2) INFOR~ATIONS POUR LA SEQ ID NO: 8:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 534 acides aminés
tB) TYPE: acide aminé
(C) NOMBRE DE BRINS: simple
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: PROTEINe
(~.i) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 8:
Met Asp Ile Glu Pro Glu Val Leu Tyr Ala Gly Tyr Asp Ser Ser Val
1 5 10 15
Pro Asp Ser Thr Trp Arg Ile Met Thr Thr Leu Asn Met Leu Gly Gly
25 30
CA 02210168 1997-07-17
WO 96/22378 PCT/FR96/00088
4'~
Arg Gln Va' Iie Ala Ala Val Lys Trp Aia Lyc .~. a ~ ' e Prs C-; ~ Phe
gO ~
Arg Asn Leu His Leu Asp Asp Gln Met Thr Leu Leu Gln Tyr Ser Trp
5a 55 60
Met Phe Leu Met Ala Phe Ala Leu Gly Trp Arg Ser Tyr Arg Gln Ser
Ser Ala Asn Leu Leu Cys Phe Ala Pro Asp Leu Ile Ile Asn Glu Gln
85 90 C5
Arg Met Thr Leu Pro Cys Met Tyr Asp Gln Cys Lys Hls Met Leu Tyr
100 105 110
Val Ser Ser Glu Leu His Arg Leu Gln Val Ser Tyr Glu Glu Tyr Leu
115 120 125
Cys Met Lys Thr Leu Leu Leu Leu Ser Ser Val Pro Lys Asp Gly Leu
130 135 140
Lys Ser Gln Glu Leu Phe Asp Glu Ile Arg Met Thr Tyr Ile Lys Glu
145 150 155 160
Leu Gly Lys Ala Ile Val Lys Arg Glu Gly Asn Se=r Ser Gln T sn Trp
165 17~ ;75
Gln Arg Phe Tyr Gln Leu Thr Lys Leu Leu Asp Ser Met His Glu Val
180 185 . 190
Val Glu Asn Leu Leu Asn Tyr Cys Phe Gln Thr Phe Leu Asp Lys Thr
195 200 205
Met Ser Ile Glu Phe Pro Glu Met Leu Ala Glu Ile Ile Thr Asn Gln
210 215 220
Ile Pro Lys Tyr Ser Asn Gly Asn Ile Lys Lys Leu Leu Phe Hi s Gln
225 230 ~5 24C~
Lys Thr Thr Ser Gly Val Pro Phe Gly Met Thr Leu Arg Pro Thr Arg
245 250 255
Ser Arg Leu Ser Arg Arg Thr Pro Tyr Ser Arg Asp Arg Leu Pro Pro
260 265 270
Phe Glu Thr Glu Thr Arg Ala Thr Ile Leu Glu Asp His Pro Leu Leu
275 280 285
Pro Glu Cys Asn Thr Leu Thr Met His Asn Val Ser Tyr Val Arg Gly
290 295 300
Leu Pro Cys Ser Val Gly Phe Thr Leu Ile Gln G.-u Trp Val Vc'. PrG
305 310 315 320
Trp Asp Met Val Leu Thr Arg Glu Glu Leu Val IIe Leu Arg Lys Cys
325 330 335
Met His Val Cys Leu Cys Cys Ala Asn Ile Asp Ile Met Thr Ser Met
340 345 350
CA 02210168 1997-07-17
WO 96/22378 PCTtFR96tO0088
43
Met ' ie His Gly Tyr Glu Ser Trp Ala Leu His Cys E'.. _ '-ys S~=- âer
355 360 - 3~'
S Pro Gly Ser Leu Gln Cys Ile Ala Gly Gly Gln Val Leu Ala Ser Trp
370 375 380
Phe Arg Met Val Val Asp Gly Ala Met Phe Asn Gln Arg Phe Ile Trp
385 390 395 400
Tyr Arg Glu Val Val Asn Tyr Asn Met Pro Lys Glu Val Met Phe Met
405 410 415
Ser Ser Val Phe Met Arg Gly Arg His Leu Ile Tyr Leu Arg Leu Trp
420 425 430
Tyr Asp Gly His Val Gly Ser Val Val Pro Ala Met Ser Phe Gly Tyr
435 440 445
Ser Ala Leu His Cys Gly Ile Leu Asn Asn Ile Val Val Leu Cys Cys
450 455 460
Ser Tyr Cys Ala Asp Leu Ser Glu Ile Arg Val Arg Cys Cys Ala Arg
465 470 475 480
Arg Thr Arg Arg Leu Met Leu Arg Ala Val Arg Ile Ile Ala Glu Glu
485 49U 4~-
Thr Thr Ala Met Leu Tyr Ser Cys Arg Thr Glu Arg Arg Arg Gln Gln
500 505 510
Phe Ile Arg Ala Leu Leu Gln His His Arg Pro Ile Leu Met His Asp
515 520 52
Tyr Asp Ser Thr Pro Met
530
.