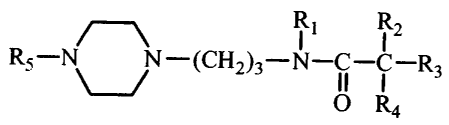Note: Descriptions are shown in the official language in which they were submitted.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
ANTAGONISTES DU RÉCEPTEUR al-ADRÉNERGIOUE
Les neurorécepteurs sont considérés comme des entités dynamiques qui
constituent un moyen
de manipulation clinique accessible. Le neurotransmetteur sympathique
norépinéphrine et
l'hormone surrénale épinéphrine régulent de nombreuses activités
physiologiques au travers
d'interactions avec les récepteurs a- et (i-adrénergiques. Les récepteurs al-
adrénergiques sont
les médiateurs de nombre des effets physiologiques des catécholamines,
notamment la
glycogénolyse, la contraction du muscle lisse vasculaire et génito-urinaire,
l'hyperpolarisation
du muscle lisse intestinal, la force contractile et l'arythmie cardiaques.
Dans l'un de ses aspects, l'invention concerne un composé de formule I:
Ri R2
R5-N % -(CH2)3-N-C- u-R3 (I)
O R4
dans laquelle :
Rl représente un hydrogène, un alkyle inférieur, ou un aryl-alkyle inférieur ;
R2 représente un hydrogène, un alkyle inférieur, OR6, S(O)II,R6 (dans lequel m
vaut 0, 1, ou
2), NHS(O)õR6 (dans lequel n vaut 1 ou 2), OC(O)R6, CONR6R7, NR6R7, ou
N(R7)C(O)R6;
R3 et R4, de façon indépendante l'un de l'autre, représentent l'hydrogène, ou
l'un des
composés suivants substitués (c'est-à-dire, une à quatre fois sur les atomes
de carbone ou
d'azote) ou non-substitués : un alkyle inférieur, un cycoalkyle, un aryle, un
aryl-alkyle
inférieur, un hétérocycle, ou un hétérocycle-alkyle inférieur, dans lequel
ledit substituant est un
alkyle inférieur, un halogène, OR6, SR6, NR6R7, CN, NO2, CF3, un hétérocycle,
ou un aryle,
ou R3 et R4 constituent, ensemble avec l'atome de carbone auquel ils sont
conjointement liés,
un aryle ou un hétérocycle substitué (c'est-à-dire en un à quatre endroits) ou
non-substitué,
dans lequel ledit substituant est un alkyle inférieur, OH, ou un hydroxyl-
alkyle inférieur ;
R5 est un aryle substitué (c'est-à-dire, sur un à quatre atomes de carbone) ou
non-substitué,
dans lequel ledit substituant est un alkyle inférieur, un cycloalkyle, un
hydroxyl-alkyle
inférieur, un hydroxyl-cycloalkyle, un alcoxy-alkyle inférieur, un alcoxy-
cycloalkyle, un
halogène, OR6, SR6, NR6R7, ou CN ; et
CA 02251016 2006-12-19
-2-
R6 et R7, de façon indépendante l'un de l'autre, représentent un hydrogène ou
l'un des
composés suivants substitués (c'est-à-dire, sur un à quatre atomes de carbone)
ou non-
substitués : alkyle inférieur, aryle ou aryl-alkyle inférieur, dans lequel
ledit substituant est un
alkyle inférieur, un halogène, ou un alcoxy inférieur; dans lequel si R3 ou R4
représente un
hydrogène, R2 ne représente pas OH, sauf si le composé de formule I est ( )-a-
hydroxy-N-[3-
{4-(2-méthoxyphényl)-1-pypérazinyl}-propyl]-benzèneacétamide; ou l'un de ses
sels
pharmaceutiquement acceptables.
Dans un autre de ses aspects, l'invention concerne un composé soit de formule
I
~-~ Ri R2
R5-N N-(CH2)3-N- C- C-R3
O R4
dans laquelle
RI représente un hydrogène ou un alkyle inférieur
R2 représente un hydrogène, un alkyle inférieur, OR6, S(O),,,R6 dans lequel m
vaut 0, 1 ou 2,
NHS(O)õR6 dans lequel n vaut 1 ou 2, C(O)NR6R7, NR6R7 ou N(R7)C(O)R6;
chacun des R3 et R4, de façon indépendante l'un de l'autre, représente l'un
des groupements
suivants substitués par un ou plusieurs substituants ou non-substitués :
alkyle inférieur,
cyclohexyle, phényle, napthyle ou benzyle dans lequel ledit substituant est un
alkyle
inférieur, un halogène, OR6, SR6, NR6R7, CN, NO2, CF3 ou phényle, ou R3 et R4,
ensemble
avec l'atome de carbone auquel ils sont conjointement liés, forment le radical
9-xanthényle
ou 9-fluorényle ;
R5 représente un phényle substitué par un ou plusieurs substituants choisi
parmi alkyle
inférieur, CN, un halogène, un hydroxy-alkyle inférieur,
cyclopropylhydroxyméthyle, un
alkoxy inférieur-alkyle inférieur, ou OR6 dans lequel R6 est un alkyle
inférieur ; et
chacun des R6 et R7, de façon indépendante l'un de l'autre, représente un
hydrogène ou l'un
des groupements suivants substitués par un ou plusieurs substituants ou non-
substitués : un
alkyle inférieur, phényle ou benzyle dans lequel ledit substituant est un
alkyle inférieur, un
halogène, ou un alcoxy inférieur ;
étant entendu que
si R2 représente OR6 et R6 représente un alkyle inférieur, alors R4 ne
représente pas le radical
halophényl ou alcoxy inférieur-phényl ;et
CA 02251016 2006-01-09
2a)
RZ, R3 et R4 ne peuvent représenter simultanément un alkyle inférieur" ; et
si R2 représente OR6 et R6 représente l'hydrogène, alors R3 et R4, de façon
indépendante l'un
de l'autre, ne représentent pas l'un des groupements substitués ou non-
substitués suivants
phényle, napthyle ou benzyle ;
soit répondant à l'une des formules suivantes:
a-hydroxy-N-[3-{4-(3-methylphenyl)-1-piperazinyl}-propyl]-a-phenyl-
benzeneacetamide ;
a-hydroxy-N-[3-{4-(2-methylphenyl)-1-piperazinyl}-propyl]-a-phenyl-
benzeneacetamide ;
a-hydroxy-N-[3-{4-(4-methylphenyl)-1-piperazinyl}-propyl]-a-phenyl-
benzeneacetamide ;
N-[3- {4-(2,3-dimethylphenyl)-1-piperazinyl} -propyl]-a-hydroxy-a-phenyl-
benzeneacetamide ;
N-[3-{4-(2,4-dimethylphenyl)-1-piperazinyl}-propyl]- a-hydroxy-a-phenyl-
benzeneacetamide ;
N-[3-{4-(2,6-dimethylphenyl)-1-piperazinyl}-propyl]- a-hydroxy-a-phenyl-
benzeneacetamide;
N-[3- {4-(2,5-dimethylphenyl)-1-piperazinyl } -propyl]-a-hydroxy-a-phenyl-
benzeneacetamide ;
N-[3-{4-(2-ethoxyphenyl)-1-piperazinyl}-propyl]- a-hydroxy-a-phenyl-
benzeneacetamide ;
N-[3-{4-(2-chlorophenyl)-1-piperazinyl}-propyl]- a-hydroxy-a-phenyl-
benzeneacetamide;
N-[3- {4-(2-cyanophenyl)-1-piperazinyl} -propyl]- a-hydroxy-a-phenyl-
benzeneacetamide,
hydrochloride ;
a-hydroxy-N-[3-{4-(2-methoxyphenyl)-1-piperazinyl}-propyl]- a-phenyl-
benzeneacetamide ;
2-chloro-a-(2-chlorophenyl)- a-hydroxy-N-[3-{4-(2-methoxyphenyl)-1-
piperazinyl}-propyl]-
benzeneacetamide ;
a-hydroxy-N-[3- {4-(2-méthoxyphényl)-1-pipérazinyl} -propyl]-benzèneacétamide
;
N-[3- {4-(2,5-dimethylphenyl)-1-piperazinyl}-propyl]-a-hydroxy-4-methoxy-a-(4-
methoxyphenyl)-benzeneacetamide ;
CA 02251016 2006-01-09
2b)
a-amino-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-benzèneacétamide ;
N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]- a-(méthylsulfonylamino)-
benzèneacétamide ;
N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]- a-benzylaminocarbonyl-
benzèneacétamide ;
N-[3- {4-(2,5-diméthylphényl)-lpipérazinyl}-propyl]- a-(4-méthylphényl)-
sulfonylamino-
benzèneacétamide ;
N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]- a-benzylcarbonylamino-
benzèneacétamide
(f)-N-[3-{4-(2-(propyl)-phenyl)-1-piperazinyl}-propyl]- a-hydroxy-a-phenyl-
benzeneacetamide ;
ou un de ses sels pharmaceutiquement acceptables.
Dans l'un des modes de réalisation, R1 représente l'hydrogène ou un allcyle
inférieur, R2
représente un hydrogène, un allcyle inférieur, OR6 (dans lequel R6 représente
un hydrogène ou
un aryl-alkyle inférieur), SR6 (dans lequel R6 est un alkyle inférieur), NH2,
NHSO2R6 (dans
lequel R6 est un alkyle inférieur ou un aryl-alkyle inférieur), OC(O)R6 (dans
lequel R6 est un
aryl-aikyle inférieur) ou CONR6R7 ou N(R7)C(O)R6 (dans lequel R7 représente un
hydrogène
et R6 représente un aryl-alkyle inférieur) ; R5 représente un phényle
substitué ou non-substitué,
dans lequel ledit substituant est un alkyle inférieur, CN, un halogène, un
hydroxy-alkyle
inférieur, un hydroxy-cycloalkyle, un alcoxy inférieur-alkyle inférieur, ou
OR6 (dans lequel Rb
est un alkyle inférieur) ; et R3 et R4, de façon indépendante l'un de l'autre,
représentent un
hydrogène ou l'un des composés suivants substitués ou non-substitués : un
alkyle inférieur, un
cycloalkyle, ou un aryle, dans lequel ledit substituant est un halogène, OR6
(dans lequel R6 est
un allcyle inférieur), ou un aryle.
Dans un autre mode de réalisation, R 1 représente. un hydrogène et R5
représente le
2,5-d.iméthyl-phényle ; R2 représente OR6 (dans lequel R6 représente un
hydrogène, un alkyle
inférieur, ou un aryl-aikyle inférieur) ; et R3 oeprésente un alkyle inférieur
et R4 représente un
phényle.
CA 02251016 2006-01-09
2c)
Dans un autre mode de réalisation, R3 et Rq, ensemble avec l'atome de carbone
auquel ils sont
conjointement liés, constituent un aryle ou un hétérocycle ; Ri représente un
hydrogène et R5
représente le 2-méthoxy-phényle ou le 2,5-diméthyl-phényle; et R2 représente
OR6 (dam
lequel R6 représente un hydrogène, un allcyle inférieur, ou un aryl-alkyle
inférieur).
Dans encore un autre mode de réalisation, R3 et R4, ensemble avec l'atome de
carbone auquel
ils sont conjointement liés, constituent le 9-xanthényle ou le 9-fluorényle.
L,es exemples suivants sont des exemples de composés selon la présente
invention :
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-3-
Composé n
~
Q
NN
h{3C~ ~.N
~~
eo
cl ~
~~
~N ~ 3
HN,/~,NJ
000
H,C
HO'
~
~' O
~ ~~
os
HsCQ
rHO N 6
~
t O
.
CH3
e'
o
7
0 N/,.NJ CH3
O
HõC..O
N NJ '' 8
. ~/~.
p
eo
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-4-
N
HO~~ N 10
N.i~.N
CHs
N
o ~ 11
N.~~NJ CI-s
O
c>~
12
C N,~,N,! C1~13
O
I H31CO
.I N ' 13
N.~.N
~ O
I Hi~ t
0 N....N/N ' 14
yv- Nv~N1 15
O ',,N ~
FI
= t 3Co
= I
HO
O NN 16
',N I
~~ .
e Ci O
N N
HO ' CI ~N ~ 17
t~ H3~ 'i
O
N~N1 18
',N
I~c-0
CA 02251016 1998-10-01
WO 97/37983 PCTIFR97/00615
-5-
Hi C 0
OH ~N
19
N.~~.N..%
~
.
I I
rN 20
3
. N~/~.N/ CH3
0O
a aH,
21
O NN J ~
22
HO N,,.,,-~ NJ Ci-~
~ O
CH3
H C N..,-~N/ CH3 23
cF~
}{~C~S N~tiNJ CH~ 24
0
O~ CH,
HO N.,-., J CK, 25
ÇH2
26
cr~,s NN ~
Fi3C
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-6-
CHI .
N/~.N.JN CH3 27
H3C O ,
HO N,~NJ cH, 28
H3C O
cH,
=~
a N 29
Mo N~~~~N J CH,
M,C O
q
~
a
~ r'N 31
HO N~~~N J CH.
H1C
O
cx,
32
o~lyo
NH N~ ~N ~ 33
&YO
CH,
34
HO N~, N J CH~
H3C 0
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-7-
cli3
CH, 35
N ,~- (V i (~
~
OH
HIC
N 36
O
H1C
rN 37
~ N.~.N..i
. O
H3C ~N ~a
. 38
N.~.N.J
~
s
~ NJ c&l, 39
O
Hi CH
HO N~~NJ CHI
H3C O
H3 CH3
HO N,,,,NJ CH3 41
H3C O
42
n N,,-,N,i Cii~
0
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-8-
CH2
43
HO N~~~NJ CH
H3C O
1 CH3
.
.
-i
HO N~~N~i Ct11 44
H3C 0
CH~
i ~~
H3C~ N CH~ 45
HO Q
.
H0. N~N ~s
~ 46
~C o
C 1 47
"t ~2 C*4
00
CH~
i
O.Ç.O ,~ 48
NH
N
O CH3
O
4 CO ~ 49
N
O
~
00
CA 02251016 2006-01-09
WO 97l37983 PCT/FR97 615
-9-
CH'i
H C ' ~N S1
CH,
O 0
CH~
M~
Ni O ZN,.,,N/ CH3 52
330
Ci CI ~
53
HO N/ Ciis
~C O
rN 54
e
No~N.,=~,N~i ~+,
N....N.J
o
rj 56
~
~ eO
ou un de ses sels acceptables pharmaceutiquement.
CA 02251016 2005-02-21
-10-
Selon un autre aspect, la présente invention concerne l'application à titre de
médicaments des
produits de formule générale I telle que décrite ci-dessus, ainsi qu'une
composition
pharmaceutique comprenant un composé de formule I:
R1 Rz
R5- N-(CH2)3-N-Cl
CI --R3 (n
I
a
dans laquelle :
RI représente un hydrogène, un alkyle inférieur, ou un aryl-alkyle inférieur ;
R2 représente un hydrogène, un alkyle inférieur, OR6, S(O),õR6 (dans lequel m
vaut 0, 1, ou 2),
NHS(O)õR6 (dans lequel n vaut 1 ou 2), CONR6R7, NR6R7, ou N(R7)C(O)R6;
R3 et R4, de façon indépendante l'un de l'autre, représentent l'hydrogène ou
l'un des composés
suivants substitués ou non-substitués : un alkyle inférieur, un cycoalkyle, un
aryle, un aryl-alkyle
inférieur, un hétérocycle, ou un hétérocycle-alkyle inférieur, dans lequel
ledit substituant est un
alkyle inférieur, un halogène, OR6i SR6, NR6R7, CN, NO2, CF3, un hétérocycle,
ou un aryle, ou R3
et R4 constituent, ensemble avec l'atome de carbone auquel ils sont
conjointement liés, un
hétérocycle tel que le radical 9-xanthényle ou 9-fluorényle ; ou un de ses
sels
pharmaceutiquement acceptable.
R5 est un aryle substitué ou non-substitué, dans lequel ledit substituant est
un alkyle inférieur, un
hydroxyl-alkyle inférieur, un alcoxy-alkyle inférieur, un halogène, OR6, SR6,
NR6R7 ou CN; et
R6 et R7, de façon indépendante l'un de l'autre représentent un hydrogène ou
l'un des composés
suivants substitués ou non-substitués : alkyle inférieur, aryle ou aryl-alkyle
inférieur, dans lequel
ledit substituant est un alkyle inférieur, un halogène, ou un alcoxy inférieur
; ou l'un de ses sels
pharmaceutiquement acceptables.
Selon un mode de réalisation, RI représente un hydrogène, R5 représente le 2,5-
diméth lphényle ;
R2 représente OR6 (dans lequel R6 représente un hydrogène, un alkyle
inférieur, ou un aryl-alkyle
inférieur) ; R3 représente un alkyle inférieur ; et R4 représente un phényle.
Tel qu'utilisé ici, un "alkyle inférieur" inclut les groupes hydrocarbonés
aliphatiques saturés à la fois
linéaires, ramifiés, ou à chaîne droite, ayant de 1 à 6 atomes de carbone. Des
exemples de groupes
alkyles inférieurs incluent le méthyle, l'éthyle, le propyle, l'isopropyle, le
butyle, le t-butyle, et
similaires.
Tel qu'utilisé ici, un "cyclo-alkyle" inclut tout fragment hydrocarboné
cyclique non-aromatique ayant
de 3 à 10 atomes de carbone dans lequel de 3 à 8 des atomes de carbone
constituent un
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-11-
cycle. Des exemples de tels fragments incluent, mais ne sont pas limités à, le
cyclopropyle, le
méthyl-cyclopropyle, l'éthyl-cyclopropyle, le cyclobutyle, le cyclopentyle, le
cyclohexyle, le
cyclopropyl-méthyle, le cyclopropyl-éthyle, et le cyclohexyl-éthyle.
Tel qu'utilisé ici, un "aryle" inclut tout noyau(x) ou cycle(s) carboné stable
monocyclique,
bicyclique, ou tricyclique comprenant jusqu'à 7 membres dans chaque cycle,
dans lequel au
moins un cycle est aromatique. Des exemples de tels groupes aryles incluent le
phényle, le
naphtyle, l'anthracényle, le biphényle, le tétrahydronaphthyle, l'indanyle, le
phénanthrényle, et
similaires.
Tel qu'utilisé ici, un "alcoxy inférieur" inclut les groupes hydrocarbonés
aliphatiques saturés à
la fois linéaires, ramifiés, et à chaîne droite, ayant de 1 à 6 atomes de
carbone et un atome
d'oxygène. Des exemples d'alcoxy inférieurs incluent le méthoxy, l'éthoxy, le
propoxy,
l'isopropoxy, le butoxy, et similaires.
Le terme hétérocycle, tel qu'utilisé ici, représente un noyau ou cycle
hétérocyclique comportant
un monocycle stable de 5 à 7 membres ou un bicycle stable de 8 à 11 membres ou
un tricycle
stable de 11 à 15 membres, qui est soit saturé soit insaturé, et qui consiste
en des atomes de
carbone et de 1 à 4 hétéroatomes sélectionnés parmi le groupe consistant en N,
O, et S, et
incluant tout groupe bicyclique dans lequel l'un quelconque des cycles
hétérocycliques définis
ci-dessus est lié à un noyau benzénique. Le cycle hétérocyclique peut être lié
à tout hétéroatome
ou atome de carbone qui a pour résultat la création d'une structure stable.
Des exemples de tels
éléments hétérocycliques incluent, mais ne sont pas limités à, l'azépinyle, le
benzimidazolyle, le
benzisoxazolyle, le bensofurazanyle, le benzopyranyle, le benzothiopyranyle,
le benzofuryle, le
benzothiazolyle, le benzothiényle, le benzoxazolyle, le chromanyle, le
cinnolinyle, le
dihydrobenzofuryle, le dihydrobenzothiényle, le dihydrobenzothiopyranyle, la
dihydrobenzothio-pyranyl sulfone, le furyle, l'imidazolidinyle,
l'imidazolinyle, l'imidazolyle,
l'indolinyle, l'indolyle, l'isochromanyle, l'isoindolinyle, l'isoquinolinyle,
l'isothiazolidinyle,
l'isothiazolyle, l'isothiazolidinyle, le morpholinyle, le naphthyridinyle,
l'oxadiazolyle, le
2-oxoazépinyle, le 2-oxopipérazinyle, le 2-oxopipéridinyle, le 2-
oxopyrrolidinyle, le
pipéridyle, le pipérazinyle, le pyridyle, le pyridyle N-oxyde, le
quinoxalinyle, le
tétrahydrofuryle, le tétrahydroisoquinolinyle, le tétrahydro-quinolinyle, le
thiamorpholinyle, le
thiamorpholinyl-sulfoxide, le thiazolyle, le thiazolinyle, le thiénofuryle, le
thiénothiényle, le
thiényle, le 9-xanthényle, et similaires.
Tel qu'utilisé ici, un halogène représente un chloryle, fluoryle, brominyle,
ou iodo.
Les composés de la présente invention peuvent comporter un centre asymétrique
et se présenter
comme des racémates, des mélanges racémiques, ou des diastéréomères
individuels, avec tous
les isomères possibles, y compris les isomères optiques, l'ensemble étant
inclus dans la
CA 02251016 2005-02-21
- 12 -
présente invention. Pour simplifier, lorsqu'aucune configuration spécifique
n'est décrite dans
les formules structurales, on comprend que toutes les formes énantiomèriques
et leurs mélanges
sont représentées. Dans un mode de réalisation, l'atome de carbone lié à R2,
R3, et R4 est dans la
configuration "S".
Les composés de cette invention peuvent être fournis sous forme de sels
acceptables
pharmaceutiquement. Des sels acceptables incluent, mais ne sont pas limités à,
les sels acides
d'addition d'acides inorganiques tels que le chlorhydrate, le sulfate, le
phosphate, le diphosphate,
l'hydrobromide, et le nitrate ou d'acides organiques tels que l'acétate, le
maléate, le fumarate, le
tartrate, le succinate, le citrate, le lactate, le méthanesulfonate, le p-
toluène-sulfonate, le
pamoate, le salicylate, l'oxalate, et le stéarate. Sont également compris dans
la présente invention,
lorsque cela est possible, les sels formés à partir de bases comme l'hydroxyde
de sodium ou de
potassium. Pour d'autres exemples de sels acceptables pharmaceutiquement, voir
"Pharmaceutical Salts", J. Pharm. Sci. 66:1 (1977).
Dans un mode de réalisation, l'invention porte sur un composé selon la formule
I, dans lequel
ledit composé répond à la formule :
CH3
(\ ~I
H3C H N
HO N~/N CHs
O
ou un de ses sels acceptables pharmaceutiquement.
La présente invention concerne également une méthode de traitement de troubles
dont le
récepteur ai-adrénergique constitue un médiateur. Des exemples de tels
troubles incluent
l'hypertension, les troubles de l'appareil urinaire inférieur (par exemple
l'hyperplasie bénigne de la
prostate), l'arythmie, l'ischémie myocardique, les concentrations lipidiques
sériques élevées, le
glaucome, les troubles de la motilité de l'appareil gastro-intestinal, la
synthèse du cholestérol, le
dysfonctionnement érectile, la maladie de Raynaud, les pathologies congestives
cardiaques,
l'hypertension portale, et la résistance pluri-médicamenteuse, la cirrhose.
L'invention concerne également une composition pharmaceutique comprenant un
composé de
formule générale I telle que décrite ci-dessus, en association avec un support
pharmaceutiquement
acceptable.
CA 02251016 2006-06-20
12a)
L'invention concerne également l'utilisation des produits de formule générale
I telle que décrite ci-
dessus, pour la préparation d'un médicament destiné à traiter l'hyperplasie
bénigne de la prostate,
l'hypertension portale et la cirrhose.
Un autre aspect de cette invention concerne l'utilisation d'un composé de
formule I'
R'
R'
R'5 N N-(CH2)3 N R~3
Ra
O I~
dans laquelle
R', représente un hydrogène ou un alkyle inférieur
R'2 représente un hydrogène, un alkyle inférieur, OR6, S(O),,,R6 dans lequel m
vaut 0, 1 ou 2,
NHS(O)õR6 dans lequel n vaut 1 ou 2, C(O)NR6R7, NR6R7 ou N(R7)C(O)R6 ;
chacun des R'3 et R'4, de façon indépendante l'un de l'autre, représente l'un
des groupements
suivants substitués par un ou plusieurs substituants ou non-substitués :
alkyle inférieur,
cyclohexyle, phényle, napthyle ou benzyle dans lequel ledit substituant est un
alkyle
inférieur, un halogène, OR6, SR6, NR6R7, CN, NOz, CF3 ou phényle, ou R'3 et
R'4, ensemble
avec l'atome de carbone auquel ils sont conjointement liés, forment le radical
9-xanthényle
ou 9-fluorényle ;
R'5 représente un phényle substitué par un ou plusieurs substituants choisi
parmi alkyle
inférieur, CN, un halogène, un hydroxy-alkyle inférieur,
cyclopropylhydroxyméthyle, un
alkoxy inférieur-alkyle inférieur, ou OR6 dans lequel R6 est un alkyle
inférieur ; et
chacun des R6 et R7, de façon indépendante l'un de l'autre, représente un
hydrogène ou l'un
des groupements suivants substitués par un ou plusieurs substituants ou non-
substitués : un
alkyle inférieur, phényle ou benzyle dans lequel ledit substituant est un
alkyle inférieur, un
halogène, ou un alcoxy inférieur ;
étant entendu que si R'2 représente OR6 et R6 représente un alkyle inférieur,
alors R'4 ne
représente pas le radical halophényl ou lower alkoxy-phényl; ou un de ses sels
pharmaceutiquement acceptables, pour la préparation d'un médicament destiné à
traiter
l'hypertension portale ou la cirrhose.
CA 02251016 2006-06-20
12 b)
Dans un autre mode de réalisation, l'invention concerne une méthode de
traitement de
l'hypertension portale, la méthode comprenant l'administration d'une quantité
thérapeutique
efficace d'un composé ayant un Kb d'inhibition de la contraction de la veine
portale de rat qui est au
moins cinq fois (par exemple, au moins dix ou vingt fois) inférieur au Kb
dudit composé pour
l'inhibition de la contraction de l'aorte de rat, dans laquelle ledit composé
se lie au récepteur ai-
adrénergique avec un Ki d'au moins 1 M (par exemple, au moins 10 nM ou 1 nM),
c'est-à-dire
tel que décrit dans les essais décrits ici. Dans un autre mode de réalisation,
ledit composé a un Kb
d'inhibition de la contraction de la veine portale de lapin qui est au moins
cinq fois (par exemple, au
moins dix ou vingt fois) inférieur au Kb dudit composé pour l'inhibition de la
contraction de
l'aorte de lapin, c'est-à-dire tel que décrit dans l'essai décrit ici. Dans
encore un autre mode de
réalisation, ledit composé a un Kb d'inhibition de la contraction de la veine
portale de lapin qui est
au moins deux fois (par exemple, au moins cinq ou
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-13
neuf fois) inférieur au Kb dudit composé pour l'inhibition de la contraction
de la veine saphène
de lapin, c'est-à-dire tel que décrit dans les essais décrits ici.
L'invention a également pour objet l'utilisation de composés ayant un Kb
d'inhibition de la
contraction de la veine portale de rat qui est au moins cinq fois (par
exemple, au moins dix ou
vingt fois) inférieur au Kb dudit composé pour l'inhibition de la contraction
de l'aorte de rat,
dans laquelle ledit composé se lie au récepteur ocl-adrénergique avec un Ki
d'au moins 1 M
(par exemple, au moins 10 nM ou 1 nM), pour la préparation d'un médicament
destiné à traiter
l'hypertension portale ou la cirrhose.
L'invention a également pour objet une méthode de traitement de l'hypertension
portale, ladite
méthode comprenant l'administration d'une quantité thérapeutiquement efficace
d'un composé
de formule IM :
R15
Rg\ ~ Rio R'2
)-V_(CH2)P_N_c_c_R3
R's
R11 q R1 X R'4 IM
dans laquelle
W représente un atome d'azote ou de carbone ;
R 1 représente un hydrogène, un alkyle inférieur, un aryl-alkyle inférieur,
CN, C02R9,
CON(R9)2, un cycloalkyle ou (CH2)pCO2R9 ;
R'2 représente un hydrogène, un alkyle inférieur, OR6, S(O)mR6 dans lequel m
vaut 0, 1 ou 2,
NHS(O)nR6 dans lequel n vaut 1 ou 2, OC(O)R6, C(O)NR6R7, NR6R7, N(R7)C(O)R6,
C02R10, (CH2)p-CO2R10, OR12, N-R12-R13, (CH2)pCN(R10)2 ou CR'2 forme un cycle
cyclopropyle et l'un de R'3 et R'4 n'existe pas.
chacun des R'3 et R'4, de façon indépendante l'un de l'autre, représente un
hydrogène ou l'un
des composés suivants substitués ou non-substitués : alkyle ou alkoxy
inférieur, un
cycloalkyle, un aryle, un aryl-alkyle inférieur, un hétérocycle, un
hétérocycle-alkyle inférieur
ou NR'IOR" 10, dans lequel ledit substituant est un alkyle inférieur
éventuellement substitué par
un ou plusieurs atomes d'halogène, un halogène, OR6, SR6, NR6R7, CN, NO2, un
hétérocycle, un aryle ou un méthylènedioxy sur deux carbones adjacents, ou R'3
et R'4,
ensemble avec l'atome de carbone auquel ils sont conjointement liés, forment
un aryle ou un
hétérocycle substitué ou non-substitué, dans lequel ledit substituant est un
alkyle inférieur, OH,
ou un hydroxy-alkyle inférieur ;
CA 02251016 1998-10-01
WO 97/37983 PCT/P1t97/00615
-14-
R'S est un radical alkyle inférieur, aryle ou hétérocycle substitué ou non-
substitué, dans lequel
ledit substituant est un alkyle inférieur, éventuellement substitué par un ou
plusieurs atomes
d'halogène, un cyclo-alkyle, un hydroxy-alkyle inférieur, un hydroxy-
cycloalkyle, un alcoxy-
alkyle inférieur, un alcoxy-cycloalkyle, un halogène, un méthylènedioxy sur
deux carbones
adjacents, OR6, SR6, NR6R7, CN, C02Rlo, (CH2)pCON(RIO)2 ou (CH2)pCO2Rlo ;
chacun des R6 et R7, de façon indépendante l'un de l'autre, représente un
hydrogène ou l'un
des composés suivants substitués ou non-substitués : un aikyle inférieur, un
aryle ou un
aryl-alkyle inférieur, dans lequel ledit substituant est un alkyle inférieur,
un halogène, ou un
alcoxy inférieur ;
R8 est choisi parmi les hydrogène, cyano, C02R9, CON(R9)2 ou aryle, étant
entendu que
lorsque W est un atome d'azote, R8 n'existe pas ;
chacun de R9, RIO, R'10, R"10 et R11, de façon indépendante l'un de l'autre,
est un hydrogène,
un alkyle inférieur ou un cycloalkyle, les radicaux alkyle et cycloalkyle
étant éventuellement
substitués par un ou plusieurs halogènes ;
chacun de R12 et R13, de façon indépendante l'un de l'autre, représente
l'hydrogène, un radical
alkyle inférieur ou un cycloalkyle substitué ou non substitué, CHO, COR10-
CONR10R1 i ou
(CH2)pOR10 ;
V est choisi parmi
-CH2- CHORIO, CHF, CHRto, CR1oRit, CF ,~ ~
~ 2 ~CH-CHF2, /C=CF2 ou CO ;
q est un entier de 0 à 3
p est un entier de 0 à 3;
X est choisi parmi l'oxygène, le soufre ou NR14, dans lequel R14 est
hydrogène, cyano ou
SO2R10 ;
RI$ est hydrogène ou hydroxy ;
étant entendu que lorsque n = p = 0, V ne représente pas CH20R10=
ou un de ses sels pharmaceutiquement acceptables.
L'invention a également pour objet l'utilisation des produits de formule IM
pour la préparation
d'un médicament destiné à traiter l'hypertension portale ou la cirrhose.
CA 02251016 2005-02-21
WO 97/37983 PCT/FR97/00615
-15-
Les produits de formule IM dont la préparation n'est pas décrite dans la
présente demande, .
peuvent être préparés par le procédé décrit dans la demande WO 96J40136 .
L'invention a également pour objet
l'utilisation des composés tels que décrits dans la demande WO 96/40136, pour
la préparation
d'un médicament destiné à traiter l'hypertension portale ou la cirrhose.
L'invention a également pour objet une méthode de traitement de l'hypertension
portale ou de la
cirrhose, ladite méthode comprenant l'administration dbne quantité
thérapeutiquement ef6cace
d'un composé de formule IN :
R16
R17 J_z
R'S -RX IN
lo dans laquelle R'5, R9 et RIO ont la signification indiquée à la
revendication 38 ;
Z représente un radical CHRig ou NHR9 ;
Rx est choisi parmi les radicaux
O
R19
-(CHZ)3-N ou II T
O.-Sp O
dans lesquels R19 représente un atome d'hydrogène ou un atome de chlore ;
T représente un radical -NH-(CH2)3 ou -N ;
R16, R17 et R18 sont choisis parmi l'hydrogène et les radicaux cyano, aryle,
hétérocycle,
CONR9R10= C02R9 ou S02R9, ainsi que l'utilisation des produits de formule IN
pour la
préparation d'un médicament destiné à traiter l'hypertension portale ou la
cirrhose.
Les produits de formule IN peuvent être préparés par le procédé décrit dans la
demande WO 96140135 .
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-16-
L'invention a également pour objet l'utilisation des composés tels que décrits
dans la demande
WO 96/40135, pour la préparation d'un médicament destiné à traiter
l'hypertension portale ou
la cirrhose.
L'invention a également pour objet une méthode de traitement de l'hypertension
portale, ladite
méthode comprenant l'administration d'une quantité thérapeutiquement efficace
d'un composé
de formule IR :
R20
~ ~ ~--- ~ R22
N N-CH2- i -CH2-R24
R21 / R23 IR
dans laquelle :
R20 représente acétylamino, amino, cyano, trifluoroacétylamino, un halogène,
un hydrogène,
hydroxy, nitro, méthylsulfonylamino, 2-propynyloxy ou l'un des radicaux
substitués une à
trois fois par des atomes d'halogène ou non-substitués suivants : un alkyle
inférieur, un
cycloalkyle inférieur, un cycloalkyl-alkyle inférieur, un alcoxy inférieur, un
cycloalkyloxy, un
cycloalkyl-alcoxy inférieur ou un alkylthio inférieur ; ou bien un des
radicaux suivants : un
aryle, un aryl-alkyle, un hétérocycle, un hétéroc ycle- alkyle inférieur, un
aryloxy, un
aryl-alcoxy inférieur, un hétérocycle-oxy ou un hétérocycle-alcoxy inférieur,
dans lesquels le
radical aryle ou l'hétérocycle sont éventuellement substitués par un ou deux
radicaux
indépendants choisis parmi un atome d'halogène et le radical cyano ;
R21 représente CN, un halogène, un hydrogène, hydroxy ou l'un des radicaux
suivants
éventuellement substitués par un à trois atomes d'halogène : un alkyle
inférieur ou un alcoxy
inférieur ;
R22 et R23 représentent, de façon indépendante, hydrogène ou méthyle ou,
ensemble,
l'éthylène ;
R24 représente un des composés de formule IRa, IRb. IRc et IRd suivantes :
O ,R25 O ,R25 O ,R25 O ; Z25
~_N \~-N ~-N ~_N
-N ~ Zl -N O -N X 1 -N O
R Z1 R Yt R27
26 R26 O R 27 R
28 28
IRa IRb IRc IRd
CA 021251016 2005-02-21
WO 97/37983 PCT/FR97/00615
-17-
dans lesquelles :
X1 représente C(O), CH2 ou CH(OH) ;
Yl représente CH2 ou CH(OH) ;
Z1 représente N ou C(R29), dans lequel R29 représente hydrogène, un alkyle
inférieur ou
hydroxy ;
R25 représente un hydrogène, un des radicaux suivants éventuellement substitué
par un à
trois atomes d'halogène : un alkyle inférieur, un cycloalkyle, un cycloalkyl-
alkyle inférieur ;
ou un des radicaux suivants : un aryle, un hétérocycle, un aryl-alkyle
inférieur ou un
hétérocycle-alkyle inférieur, dans lesquels le radical aryle ou l'hétérocycle
sont éventuellement
lo substitués par un à trois radicaux choisis parmi l'atome d'halogène, cyano,
un alcoxy inférieur,
un alkyle inférieur ou un aryle ;
R26 représente R30C(O)-, carbamoyle, cyano, di(alkyle inférieur)amino, un
halogène, un
hydrogène, hydroxy, hydroxyiminométhyle, R30S, R30SO2 ; un des radicaux
substitués par
un à trois radicaux choisis parmi un halogène, hydroxy ou un alcoxy inférieur,
ou
non-substitués suivants : un alkyle inférieur, un cycloallryle,-un alcoxy
inférieur ou un alcoxy
inférieur-alkyle inférieur ; ou un des radicaux suivants :.un. .aryle, un -
hétérocycle, un aryl-
alkyle inférieur ou un hétérocycle-alkyle inférieur, dans lesquels le radical
aryle ou l'hétérocycle .
sont éventuellement substitués par un à trois radicaux choisis parmi un
halogène, cyano, un
alcoxy inférieur, un alkyle inférieur ou un aryle ; ou R26 et R29 forment
ensemble le radical
-CH2-(CH2)2-CH2- ;
R27 et R28 représentent, de façon indépendante, un hydrogène, hydroxy, méthyle
ou éthyle ;
R30 représente un alkyle inférieur ;
ou un de ses sels pharmaceutiquement acceptable ou un de ses N-oxydes ; et
plus
particulièrement, dans le cas où le composé IR représente la 3-[3-[4-[4-fluoro-
2-(2,2,2-trifluoroéthoxy)phényl]-1-pipérazinyle]propyl]-dihydro-2,4-(1H, 3H)
pyrimidine
dione.
L'invention a également pour objet l'utilisation d'un produit de formule IR
telle que définie
ci-dessus, pour la préparation d'un médicament destiné à traiter
l'hypertension portale ou la
cirrhose.
Les produits de formule IR peuvent être préparés par le procédé décrit dans la
demande EP 748 800, .
CA 02251016 2005-02-21
WO 97/37983 -18 - PGT/FR97/b0615
L'invention a également pour objet l'utilisation des composés tels que décrits
dans la demande.
EP 748 800, pour la préparation d'un médicament destiné à traiter
l'hypertension portale ou la
cirrhose.
Une quantité thérapeutique efficace d'un composé de ladite invention et une
substance support
pharmaceutiquement acceptable (par exemple, le carbonate de magnésium, le
lactose, ou un
phospholipide avec lequel le composé thérapeutique peut former une micelle)
fonnent ensemble
une composition pharmaceutique (par exemple, une pilule, un comprimé, une
capsule, ou un
liquide) pour l'administration (par exemple, par voie orale, intraveineuse,
transdermique, ou
sous-cutanée) à un sujet ayant besoin du composé. La pilule, le comprimé, ou
la capsule peut
être recouvert d'une substance capable de protéger la composition des acides
gastriques ou des
enzymes intestinales dans l'estomac du sujet pendant une période de temps
suffisante pour
permettre à la composition de passer à l'état non digéré dans l'intestin grêle
du sujet
La dose d'un composé de la présente invention pour le traitement des maladies
ou troubles
mentionnés ci-dessus varie en fonction du mode d'administration, de l'âge et
du poids corporel
du sujet, et de la condition du sujet à traiter, et en définitive elle sera
décidée par le médecin ou
vétérinaire traitant. Une telle quantité du composé telle que déterminée par
le médecin ou le
vétérinaire traitant sera appelée ici une "quantité thérapeutique efficace".
Est également considérée comme faisant partie de l'invention une méthode de
préparation du
composé de formule (I) ou de formule (Il) et les intermédiaires chimiques
nouveaux utilisés
dans ces synthèses telles que décrits ici.
D'autres caractéristiques et avantages de la présente invention seront
apparents à partir de la
description détaillée de l'invention et à partir des revendications.
On considère qu'un homme de l'art peut, en se basant sur la description donnée
ici, utiliser la
présente invention dans toute son étendue. Les modes de réalisation
spécifiques suivants ne
sont ainsi mentionnés qu'à titre simplement illustratif, et ne limitent pas la
portée de la
divulgation de quelque façon que ce soit.
A moins qu'ils ne soient définis autrement, tous les termes techniques et
scientifiques utilisés ici
ont la même signification que celle couramment comprise par l'homme de l'art
ordinaire auquel
cette invention s'applique. -- -
Synthèse
Comme cela est représenté sur le Schéma I, les composés de l'invention peuvent
généralement
être préparés par condensation de dérivés du 3-amino-l-propanol de formule
générale (II)
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-19-
(Kim, J.K. et al., J. Org. Chem. 54:1714 (1989) et Koepke, S.R. et al., J.
Org. Chem.
44:2718 (1979)) avec les dérivés acides appropriés de formule générale (III).
Schéma I
RI 0 RZ
(II~O-(CHZ)3-NH + i~-R3 (III)
HO R4
Ij1 R2
HO-(CH2)3-N-~-~R3 (IV)
0 Ra
R1 R2 ~-~ Ri
X-(CH2)3-N-C~R3 (V) R5- N % -(CH2)3-NH (VII)
R
4
0 R2
(VI) R5-- N \ J -H >--R3 (III)
HO R4
RI R
R5-N N-(CH2)3-N-~ --~--R3 (I)
~-/ O Ra
Dans le Schéma I, R1-R5 sont définis ci-dessus et X représente un groupement
éliminable, par
exemple, le méthane-sulfonyloxy, le p-toluène-sulfonyloxy, le chlore, le brome
ou l'iode. Des
dérivés de l'acide benzylique (III), dans lesquels R3 et R4 représentent des
aromatiques et R2
représente OH, sont obtenus soit en chauffant à 80 C des dérivés benzyles et
un hydroxyde de
métal alcalin (par exemple, KOH) à l'état solide (Toda, F. et al., Chem.
Letts. pp. 373-376,
The Chemistry Society of Japan (1990)), tel qu'illustré par l'exemple 25, soit
en chauffant à
CA 02251016 1998-10-01
WO 97/37983 PCT/FTt97/00615
-20-
95 C dans des solvants organiques aqueux (Rzeszotarski, W.J. et al., J. Med.
Chem. 27:156
(1984)).
Des dérivés acides (III), dans lesquels R3 représente une chaîne alkyle, R4
représente un
aromatique, et R2 représente OH, peuvent être obtenus à partir d'autres
méthodes. Une
méthode implique la réaction de dérivés de l'acétophénone avec le
triméthylsilyl-cyanure en
présence d'une quantité catalytique de Zn12 à température ambiante pour
obtenir des
cyanohydrines après hydrolyse acide (Gassman, P.G. et al., Tetrahedron Lett.
40:3773
(1978)). Ces cyanohydrines sont ensuite transformées en acides a-hydroxy en
les faisant
refluer dans de l'HCl concentré (Org. Synth. Coll. Vol. 1:289 (1941)). Une
autre méthode
implique l'alkylation de trianions d'acides a-hydroxycarboxyliques à-78 C
avec des
chlorures d'alkyle (Newcomb M., et al., J. Org. Chem. 43:3963 (1978)) ce qui
conduit
également aux acides alkylés souhaités tel qu'illustré par l'exemple 28.
Encore une autre
méthode est la synthèse d'esters a-aryl-alcanoïques à partir d'a-cétoesters,
par exemple
l'éthyl-pyruvate, et de nucléophiles aryles tels que les bromures d'aryle
magnésium (Salomon,
R.G. et al., J. Org. Chem. 47:4692 (1982)). Les dérivés d'aryle magnésium sont
de façon
pratique préparés en faisant refluer du bromure d'aryle et de la poudre de
magnésium dans du
THF ou du diéthyl-éther sec ou anhydre ("dry"). L'étape de condensation a lieu
en faisant
passer par l'intermédiaire de tubulures ("cannulating") le dérivé froid
d'aryle magnésium sur
l'a-cétoester préalablement refroidi (-78 C) tel qu'illustré par l'exemple
40. La saponification
est facilement effectuée en agitant ces esters en présence de KOH dans du
méthanol pendant
plusieurs heures. Des esters a-aryl-a-hydroxy alcanoïques chiraux sont
accessibles
principalement par l'intermédiaire de l'addition de réactifs organométalliques
sur des
a-cétoesters chiraux (Basavaiah, D. and Bharathi, T.K., Tetrahedron Lett.
32:3417 (1991)) en
utilisant, par exemple, le trans-2-phénylcyclohexanol comme auxiliaire chiral.
Les dérivés acides (III) dans lesquels R3 représente un hydrogène ou une
chaîne alkyle, R4
représente un aromatique, et R2 représente un aminocarbonyle sont préparés de
façon pratique à
partir de diesters phénylmaloniques. L'étape optionnelle d'alkylation a lieu,
dans des conditions
anhydres, en présence d'une base forte telle que NaH et d'un agent
d'alkylation R6-X, tel que
défini ci-dessus, dans un solvant polaire sec, par exemple le DMF ou le THF.
La saponification
avec un équivalent de KOH éthanolique à température ambiante permet l'accès à
des dérivés
mono-acides qui sont facilement transformés en dérivés carboxamides par
réaction avec une
amine NR6R7, telle que définie ci-dessus, dans des conditions peptidiques
classiques. Cette
étape de condensation a lieu en présence de dicyclohexylcarbodiimide et
d'hydroxybenzotriazole comme réactifs de couplage dans un solvant inerte de
préférence le
dichlorométhane ou le DMF (Bodanszky, M. et Bodanszky, A., The Practice of
Peptide
Synthesis, 145 (Springer-Verlag, 1984)). De façon alternative, ces dérivés
carboxamides sont
accessibles par la condensation directe d'une amine NR6R7, telle que décrite
ci-dessus, avec
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-21-
des diesters phénylmaloniques en les chauffant dans un mélange de solvants tel
que
THF/Toluène en présence de sodiumdiéthyldihydroaluminate (Sim, T.B. et Yoon,
N.M.,
Synlett 827 (1994)). La déprotection de la seconde fonction acide est
effectuée exactement tel
que décrit précédemment.
La réaction de couplage peptidique de composés de formules générales (II) et
(III) est bien
connue dans l'art antérieur (Bodanszky, M. et Bodanszky, A., The Practice of
Peptide
Synthesis, 145 (Springer-Verlag, 1984)). Le groupe hydroxyle primaire de
composés de
formule générale (IV) peut être facilement converti en un groupe éliminable,
par exemple un
groupe sulfonyloxy, par réaction avec un chlorure de méthanesulfonyle en
présence de
lo triéthylamine dans du dichlorométhane ou du chlorure de p-toluènesulfonyle
dans de la
pyridine. Lorsque R2 représente OH,1'activation sélective de l'alcool primaire
sera effectuée
seulement grâce à des réactions de type halogénation, par exemple avec des
iodures de formule
générale (V), dans laquelle X représente I, qui sont préparés de façon
pratique par réaction avec
de l'iode, triphénylphosphine, et imidazole (Garegg, P.J. et al., J. Chem.
Soc. Perkin 1, 681
(1982)) tel qu'illustré par l'intermédiaire synthétisé dans l'exemple 1.2. La
réaction de
condensation d'un composé de formule générale (V) avec un composé de formule
générale (VI)
(voir schéma I) peut être réalisée en chauffant le mélange à 80 C dans un
solvant polaire, par
exemple l'acétonitrile, pendant plusieurs heures.
De façon alternative, des composés de formule générale (I) peuvent être
préparés par une
condensation peptidique classique d'un dérivé d'amine primaire de formule
générale (VII)
(pour une préparation pratique voir Wu, Y.H. et al., J. Med. Chem. 12:876
(1969)) avec un
dérivé d'acide de formule générale (III).
Comme cela est représenté dans le Schéma II, des composés de formule générale
(VI), par
exemple les formules (VIa), (VIb) et (VIc), avec un alkyle inférieur, un
hydroxyalkyle, ou un
alcoxyalkyle comme substituants, peuvent généralement être préparés.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-22-
Schéma II
O
H
Subst
ekNT
O
N (VIII)
R-MgX R-X, PPh3
OH
R R
(IX) Subst Subst
N~ (XI)
N O N~
~ N O
~
R6-X
OH R6 R
R Subst R Subst (VIc)
Subst N
N~i 1N O H
(VIa) N (X)
OR6
R
(VI
Subst o
b) HDans le Schéma II, R6 tel que défini ci-dessus, représente un groupe
alkyle, Subst représente
un substituant tel que défini dans R5, et X représente un groupe éliminable,
par exemple le
méthanesulfonyloxy, le p-toluènesulfonyloxy, un chlore, un brome ou un iode.
La
condensation entre des dérivés benzaldéhydes de formule générale (VIII)
(Walter, H.N. et al.,
Synthesis, pp. 641-645 (1987)) et des réactifs de Grignard alkyles dans du
diéthyléther ou
THF permet d'obtenir l'alcool secondaire correspondant de formule générale
(IX), tel
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-23-
qu'illustré par l'intermédiaire 36.2. Les composés de formule générale (VIa)
sont obtenus par
déprotection de composés de formule générale (IX) selon des méthodes générales
connues de
débenzylation, par exemple l'hydrogénation catalytique ou la réaction avec un
chloroformate, tel
que le vinylchloroformate ou l'a-chloroéthylchloroformate, suivie d'une
hydrolyse ou
méthanolyse. D'autres méthodes de débenzylation telles que celles trouvées
dans Green, T.W.
et Wuts, P.G.M., Protective Groups in Organic Synthesis, 2d ed., 364, (John
Wiley & Sons
Inc., 1991) peuvent également être utilisées à condition qu'elles soient
compatibles avec les
substituants du cycle aryle du composé de formule générale (IX). Les composés
de formule
générale (IX) peuvent être O-alkylés dans des conditions anhydres à
température ambiante en
présence d'une base forte, par exemple NaH, et d'un agent d'alkylation R6-X,
tel que défini
ci-dessus, dans un solvant polaire sec, par exemple DMF ou THF. La
débenzylation des
composés de formule générale (X) suivant la procédure déjà décrite permet
l'obtention de
composés de formule générale (VIb).
De façon alternative, les composés de formule générale (VIII) peuvent être
transformés en un
composé de formule générale (XI) par l' intermédiaire d'une réaction de type
réaction de Wittig
impliquant un réactif alkylphosphorane généré à partir d'un sel
d'alkylphosphonium et d'une
base forte, par exemple nBuLi ou phényllithium, dans du THF ou du diéthyléther
sec. Les
composés de formule générale (VIc) sont obtenus par l'intermédiaire d'une
réduction de la
double liaison et d'une débenzylation concommittantes dans des conditions
d'hydrogénation
catalytique.
Les composés de formule générale (I), dans laquelle R2 représente OH, peuvent
être O-alkylés
dans des conditions anhydres en présence d'une base forte telle que NaH et
d'un agent
d'alkylation R6-X dans un solvant polaire sec, par exemple le DMF ou le THF.
Les composés
de formule générale (I), dans laquelle R2 représente une amine modifiée (par
exemple un
sulfonyle amide ou un carboxamide), sont synthésisés par réaction d'un
chlorosulfonyle ou
d'un dérivé acide halogéné sur un amino-acide libre dans des conditions
analogues à celles de la
procédure Schotten-Baumann (Bodanszky, M. et Bodanszky, A., The Practice of
Peptide
Synthesis, 9 (Springer-Verlag, 1984)).
Ce qui suit décrit la synthèse chimique spécifique des composés 1 à 56.
D'autres composés
selon l'invention peuvent être préparés de manière analogue par un homme de
l'art ordinaire.
Exemple 1 : cc-hydroxy-N-[3-{4-(3-méthylphényl)-1-pipérazinyl}-propyl]-
a-phényl-benzèneacétamide, dichlorhydrate (Composé 1) :
1.1) a-hydroxy-N-(3-hydroxypropyl)-a-phényl-benzèneacétamide :
11,34 g (55 mmol) de dicyclohexylcarbodiimide sont ajoutés en une fois à une
solution froide
(0-5 C) de 3,82 ml (50 mmol) de 3-amino-1-propanol, 7,43 g (55 mmol)
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-24-
d'hydroxybenzotriazole et 11,4 g (50 mmol) d'acide benzylique dans 60 ml de
DMF. La
solution est laissée à réchauffer jusqu'à température ambiante et est agitée
pendant 15 heures.
La filtration de la dicyclohexylurée précipitée suivie de l'évaporation de la
liqueur mère permet
l'obtention d'un résidu huileux qui est dissous dans 150 ml d'acétate
d'éthyle. Cette solution
est rincée successivement avec de l'eau (2 x 100 ml), NaOH 1N (2 x 100 ml) et
une
solution saturée de NaCI (100 ml). La phase organique est séchée sur du
sulfate de sodium et
le solvant est évaporé sous pression réduite pour produire 12,8 g (89 %) du
composé titre
sous forme d'un solide blanc ; p.f. : 126-127 C.
RMN-1H (100 MHz, CDC13, S) : 7,40 (m, 10H, 2 x Ph) ; 6,95 (m, 1H, CO-NH) ;
3,98 (s, 1H, OH) ; 3,45 (m, 4H, Ç~,.iI-NH, ÇJJZ-OH) ; 2,88 (m, 1H, CH2-Q,$)
1,63 (m, 2H, CH2).
1.2) a-hydroxy-N-(3-iodopropyl)-a-phényl-benzèneacétamide
14,26 g (56 mmol) d'iode sont ajoutés en plusieurs fois à une solution froide
(0-5 C) de
14,7 g (56 mmol) de triphénylphosphine et 3,82 g (56 mmol) d'imidazole dans un
mélange
de 90 ml de diéthyléther et 30 ml d'acétonitrile. Un précipité jaune se forme
rapidement
pendant l'agitation à température ambiante pendant une heure. A cette
suspension jaune, on
ajoute goutte à goutte une solution de 8 g (28 mmol) de a-hydroxy-N-(3-
hydroxypropyl)-
a-phényl-benzèneacétamide dans 90 ml de diéthyléther et 30 ml d'acétonitrile,
et l'agitation
est poursuivie pendant 15 heures. Le mélange résultant est filtré et concentré
de façon à obtenir
un résidu huileux marron qui est purifié par chromatographie flash (éluent :
pétrole léger
(bp. 40-65 C) / acétate d'éthyle : 8/2 puis 6/4). L'évaporation des phases
appropriées sous
pression réduite permet l'obtention de 8,86 g (80 %) du composé titre sous
forme d'un solide
jaune pâle ; p.f. : 105-106 C.
RMN-1H (100 MHz, CDCI3, S) : 7,35 (m, 10H, 2 x Ph) ; 6,57 (m, 1H, CO-NH) ;
3,81 (s, 1H, OH) ; 3,40 (m, 2H, -ÇH2-NH) ; 3,09 (t, 2H, CH2-I) ; 2,00 (m, 2H,
CH2).
1.3) a-hydroxy-N-[3-{4-(3-méthylphényl)-1-pipérazinyl}-propyl]-a-phényl-
benzèneacétamide, dichlorhydrate :
Un mélange de 0,6 g (3,4 mmol) de 1-(3-méthylphényl)-pipérazine et 1,34 g (3,4
mmol) de
a-hydroxy-N-(3-iodopropyl)-a-phényl-benzèneacétamide dans 20 ml d'acétonitrile
est
chauffé au reflux pendant 3 heures. Après refroidissement jusqu'à température
ambiante, le
mélange réactionnel est concentré sous pression réduite. Le résidu huileux est
dissous dans
50 ml d'acétate d'éthyle et rincé avec NaOH 1N (2 x 50 ml) et de l'eau (2 x 50
ml). Après
le traitement habituel, le produit brut est purifié par chromatographie flash
(éluent : acétate
d'éthyle). L'évaporation du solvant sous pression réduite donne 0,78 g (52 %)
de la base du
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-25-
Composé 1 qui est transformée en son sel de chlorhydrate par une solution
éthérée de chlorure
d'hydrogène ; p.f. : 195-196 C.
RMN-1H (400 MHz, DMSO d6, 8) : 11,04 (bs, 1H, +NH) ; 8,42 (t, 1H, NH-CO) ;
7,35 (m, 10H, 2 x Ph) ; 7,14 (m, 1H, ph-CH3) ; 6,80 (m, 2H, pjl-CH3) ; 6,70
(m, 1H,
Eh-CH3) ; 6,34 (bs, 1H, OH) ; 3,75 (d, 2H, +NH-fj:12) ; 3,45 (d, 2H, ÇJJ7-NH-
CO) ;
3,10 (m, 8H, pipérazine) ; 2,27 (s, 3H, CH3) ; 1,91 (m, 2H, CH2).
Analyse élémentaire pour C28H33N302, 2 HCl :% Calc : C, 65,11 ; H, 6,83 ; N,
8,14 ;
% obtenus : C, 65,02 ; H, 6,80 ; N, 8,10.
Exemple 2 : a-hydroxy-N-[3-{4-(2-méthylphényl)-1-pipérazinyl}-propyl]-
a-phényl-benzèneacétamide, dichlorhydrate. 0,5 H20
(Composé 2) :
Le composé 2 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2-méthylphényl)-pipérazine est utilisée à la place de la 1-(3-méthylphényl)-
pipérazine.
RMN-1H (400 MHz, DMSO d6, S) : 10,97 (bs, 1H, +NH) ; 8,43 (t, 1H, NH-CO) ;
7,34 (m, 10H, 2 x Ph) ; 7,18 (m, 2H, Ph-CH3) ; 7,00 (m, 2H, ph-CH3) ; 4,49
(bs, 1H,
OH) ; 3,44 (d, 2H, +NH-Çâ_Z) ; 3,23 (m, 2H, Ç.H2-NHCO) ; 3,09 (m, 8H,
pipérazine) ;
2,26 (s, 3H, CH3) ; 1,94 (m, 2H, CH2).
Analyse élémentaire pour C28H33N302, 2 HCI, 0,5 H20 :% Calc : C, 64,00 ; H,
6,90 ;
N, 8,00 ; % obtenus : C, 63,89 ; H, 6,87 ; N, 7,92 ; p.f. : 191-192 C.
Exe;p ln e 3: a-hydroxy-N-[3-{4-(4-méthylphényl)-1-pipérazinyl}-propyl]-
a.-phényl-benzèneacétamide, dichlorhydrate (Composé 3) :
Le composé 3 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(4-méthylphényl)-pipérazine est utilisée à la place de la 1-(3-méthylphényl)-
pipérazine;
p.f. : 204,5 C.
RMN-1H (400 MHz, DMSO d6, S) : 11,00 (bs, 1H, +NH) ; 8,42 (t, 1H, NH-CO) ;
7,33 (m, 10H, 2 x Ph) ; 7,00 (m, 4H, a-CH3) ; 6,78 (bs, 1H, OH) ; 3,68 (d, 2H,
+NH-ÇH2,) ; 3,45 (d, 2H, ÇU?-NH-CO) ; 3,15 (m, 8H, pipêrazine) ; 2,22 (s, 3H,
CH3) ;
1,93 (m, 2H, CH2).
Analyse élémentaire pour C28H33N302 , 2 HCl : % Calc : C, 65,11 ; H, 6,83 ; N,
8,14 ;
% obtenus : C, 64,91 ; H, 6,89 ; N, 8,11.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-26-
Exem lg e 4 : N-[3-{4-(2,3-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-phényl-benzèneacétamide, chlorhydrate, 0,25 H20
(Composé 4) :
Le composé 4 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2,3-diméthylphényl)-pipérazine est utilisée à la place de la 1-(3-
méthylphényl)-pipérazine ;
p.f. : 125-126 C.
RMN-1H (400 MHz, DMSO d6, S) : 11,05 (bs, 1H, +NH) ; 8,43 (t, 1H, NH-CO) ;
7,39 (m, lOH, 2 x Ph) ; 7,07 (m, 1H, Ph-CH3) ; 6,93 (m, 1H, Ph-CH3) ; 6,89 (m,
1H,
ph-CH3) ; 4,34 (bs, 1H, OH) ; 3,43 (d, 2H, +NH-ÇJJ2) ; 3,23 (m, 2H, ÇU2 -NH-
CO) ;
1o 3,06 (m, 8H, pipérazine) ; 2,22 (s, 3H, CH3) ; 2,17 (s, 3H, CH3) ; 1,95 (m,
2H, CH2).
Analyse élémentaire pour C29H35N302, HC1, 0,25 H20 :% Calc : C, 69,86 ; H,
7,38
N, 8,43 ; 0, 7,22 ; % obtenus : C, 69,93 ; H, 7,63 ; N, 8,53 ; 0, 7,41.
Exemple 5 : N-[3-{4-(2,4-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-phényl-benzèneacétamide, fumarate, monohydrate
(Composé 5) :
Le composé 5 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2,4-diméthylphényl)-pipérazine est utilisée à la place de la 1-(3-
méthylphényl)-pipérazine ;
p.f. : 177 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,35 (t, 1H, NH-CO) ; 7,35 (m, 1oH, 2 x Ph) ;
6,93 (m, 3H, Ph-CH3) ; 6,75 (bs, OH, COOH) ; 6,62 (s, 2H, CH=CH) ; 3,39 (m,
2H,
Ç,H2-NH-CO) ; 2,87 (bs, 4H, pipérazine) ; 2,71 (bs, 4H, pipérazine) ; 2,56 (m,
2H,
N-CH2) ; 2,20 (s, 6H, 2 x CH3) ; 1,71 (m, 2H, CH2).
Analyse élémentaire pour C29H35N302, fumarate, monohydrate : % Calc : C, 66,99
;
H, 6,98 ; N, 7,10 ; 0, 18,93 ; % obtenus : C, 67,21 ; H, 6,72 ; N, 6,87 ; 0,
18,80.
Exemple 6 : N-[3-{4-(2,6-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-phényl-benzèneacétamide, chlorhydrate, 0,5 H20
(Composé 6) :
Le composé 6 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2,6-diméthylphényl)-pipérazine est utilisée à la place de la 1-(3-
méthylphényl)-pipérazine;
p.f. : 183-184 C.
RMN-iH (400 MHz, DMSO d6, S) : 10,69 (bs, 1H, +NH) ; 8,44 (t, 1H, NH-CO) ;
7,35 (m, 10H, 2 x Ph) ; 7,04 (m, 1H, Eh-CH3) ; 6,97 (m, 2H, Eh-CH3) ; 3,65 (t,
2H,
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-27-
+NH-~2 ) ; 3,34 (bs, 1H, OH) ; 3,71-2,93 (m, 8H, pipérazine) ; 3,22 (m, 2H,
Ç,Hz-NHCO) ; 2,29 (s, 3H, CH3) ; 2,27 (s, 3H, CH3) ; 1,93 (m, 2H, CH2).
Analyse élémentaire pour C29H35N302, HCI, 0,5 H20 :% Calc : C, 69,24 ; H, 7,41
N, 8,35 ; 0, 7,95 ;% obtenus : C, 69,59 ; H, 7,72 ; N, 8,42 ; 0, 7,65.
Exemple 7 : N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-phényl-benzèneacétamide, 1,5 HCI, 0,25 H20
(Composé 7) :
Le composé 7 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2,5-diméthylphényl)-pipérazine est utilisée à la place de la 1-(3-
méthylphényl)-pipérazine ;
t0 p.f. : 171-172 C.
RMN-1H (400 MHz, DMSO d6, S) : 11,01 (bs, 1H, +NH) ; 8,43 (t, 1H, NH-CO) ;
7,34 (m, 10H, 2 x Ph) ; 7,06 (d, 1H, Ph-CH3, J = 7,5 Hz) ; 6,82 (d, 2H, Ph-
CH3) ;
6,90 (bs, 1H, OH) ; 3,43 (m, 2H, +NH-Ça2) ; 3,22 (m, 2H, Çej-NHCO) ; 3,10 (m,
8H, pipérazine) ; 2,26 (s, 3H, CH3) ; 2,20 (s, 3H, CH3) ; 1,93 (m, 2H, CH2).
Analyse élémentaire pour C30H37N302, 1,5 HC1, 0,25 H20 :% Calc : C, 67,40;
H, 7,22 ; N, 8,13 ; 0, 6,97 ; % obtenus : C, 67,10 ; H, 7,17 ; N, 8,22 ; 0,
7,25.
Exemple 8 : N-[3-{4-(2-éthoxyphényl)-1-pipérazinyi}-propyl]-a-hydroxy-
a-phényl-benzèneacétamide, 2 HCI, 0,25 H20 (Composé 8) :
Le composé 8 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2-éthoxyphényl)-pipérazine est utilisée à la place de la 1-(3-méthylphényl)-
pipérazine ;
p.f. : 189 C.
RMN-1H (400 MHz, DMSO d6, 8): 11,01 (bs, 1H, +NH) ; 8,43 (t, 1H, NH-CO) ;
7,34 (m, 10H, 2 x Ph) ; 6,96 (m, 4H, Eà-N) ; 5,36 (bs, 1 H, OH) ; 4,04 (q, 2H,
OCH2,
J = 6,95 Hz) ; 3,48 (m, 4H, +NH-ÇUZ + pipérazine) ; 3,22 (m, 2H, ~HZ-NHCO) ;
3,05 (m, 6H, pipérazine) ; 1,93 (m, 2H, CH2) ; 1,37 (t, 3H, CH3).
Analyse élémentaire pour C29H35N303, 2 HCI, 0,25 H20 :% Calc : C, 63,21 ; H,
6,86 ;
N, 7,63 ; 0, 9,44 ; % obtenus : C, 63,16 ; H, 6,85 ; N, 7,60 ; 0, 9,64.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-28-
Exemple 9 : N-[3-{4-(2-chlorophényl)-1-pipérazinyl}-propyl]-a-hydroxy-
a-phényl-benzèneacétamide, fumarate (Composé 9) :
Le composé 9 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2-chlorophényl))-pipérazine est utilisée à la place de la 1-(3-
méthylphényl)-pipérazine ;
p.f. : 190 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,38 (t, 1H, NH-CO) ; 7,34 (m, 12H, 2 x Ph +
Ph-Cl) ; 7,16 (m, 1H, Ph-Cl) ; 7,03 (m, 1H, Ph-Cl) ; 6,68 (bs, 1H, OH) ; 6,61
(s, 2H,
CH=CH) ; 3,20 (m, 2H, Çâz-NHCO) ; 3,00 (bs, 4H, pipérazine) ; 2,58 (bs, 4H,
pipérazine) ; 2,43 (m, 2H, CH2-N) ; 1,66 (m, 2H, CH2).
Analyse élémentaire pour C27H30C1N302, fumarate :% Calc : C, 64,19; H, 5,91
N, 7,24 ; % obtenus : C, 64,13 ; H, 5,90 ; N, 7,27.
Exemple 10 : N-[3-{4-(2-cyanophényl)-1-pipérazinyl}-propyl]-a-hydroxy-
a-phényl-benzèneacétamide, chlorhydrate, monohydrate
(Composé 10) :
Le composé 10 est préparé d'une manière analogue à celle de l'exemple 1, sauf
que la
1-(2-cyanophényl)-pipérazine est utilisée à la place de la 1-(3-méthylphényl)-
pipérazine ;
p.f. : 168 C.
RMN-1H (400 MHz, DMSO d6, S) : 10,91 (bs, 1H, +NH) ; 8,43 (t, 1H, NH-CO) ;
7,78 (m, 1H, Ph-CN) ; 7,66 (m, 1H, Ph-CN) ; 7,34 (m, 12H, 2 x Ph + Ph-CN) ;
3,57 (m, 4H, +NH-Ç.[_-12 + pipérazine) ; 3,35 (m, OH + pipérazine) ; 3,18 (m,
2H,
ÇU2-NHCO) ; 3,10 (m, 4H, pipérazine) ; 1,93 (m, 2H, CH2).
Analyse élémentaire pour C28H30N402, HCI, H20 :% Calc : C, 66,07 ; H, 6,53
N, 11,01 ;% obtenus : C, 65,91 ; H, 6,50 ; N, 11,01.
Exem lp e 11 : N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-méthoxy-a-phényl-benzèneacétamide, chlorhydrate,
monohydrate (Composé 11) :
0,51 g (1 mmol) de N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-a-
hydroxy-
a-phényl-benzéneacétamide (Exemple 7) est introduit dans un ballon tricol
anhydre équipé
d'une arrivée d'azote et de bouchons de type "septa". Du DMF sec (10 ml) est
ajouté et la
solution est refroidie à 0-5 C à l'aide d'un bain de glace. De l'hydrure de
sodium (0,08 g,
2 mmol) est ensuite ajouté en une fois et le mélange est laissé à réchauffer
jusqu'à température
ambiante. Après une heure, 0,06 ml (1 mmol) d'iodure de méthyle est introduit
goutte à goutte
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-29-
à l'aide d'une seringue dans le ballon. Après avoir mélangé pendant deux
autres heures, le
mélange est concentré et le résidu dissous dans 25 ml d'acétate d'éthyle.
Cette solution est
rincée successivement avec de l'eau (2 x 20 ml) et une solution saturée de
NaCI (20 ml). La
phase organique est séchée sur du sulfate de sodium et évaporée sous pression
réduite de façon
à obtenir une huile qui est purifiée par chromatographie flash (éluent
dichlorométhane / méthanol : 95/5). L'évaporation des phases collectées sous
pression réduite
donne 0,18 g(38 %) de la base du Composé 11. Celle-ci est transformée en son
sel de
chlorhydrate tel que décrit ci-dessus ; p.f. : 125-126 C.
RMN-1H (400 MHz, DMSO d6, S) : 10,82 (bs, 1H, +NH) ; 8,57 (t, 1H, NH-CO) ;
1o 7,36 (m, 10H, 2 x Ph) ; 7,07 (d, 1H, M-CH3) ; 6,82 (m, 2H, P-h-CH3) ; 3,38
(m, 2H,
+NH-Cli2) ; 3,21 (m, 2H, _~2-NHCO) ; 3,17-2,80 (m, 8H, pipérazine) ; 2,98 (s,
3H,
OCH3) ; 2,26 (s, 3H, CH3) ; 2,21 (s, 3H, CH3) ; 1,90 (m, 2H, CH2).
Analyse élémentaire pour C30H37N302, HCl , H20 :% Calc : C, 68,49 ; H, 7,66 ;
N, 7,99 ; % obtenus : C, 68,24 ; H, 7,52 ; N, 7,99.
Exemple 12 : a-benzyloxy-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-
propyl]-oc-phényl-benzèneacétamide (Composé 12) :
Le composé 12 est préparé d'une manière analogue à celle de l'exemple 11 sauf
que du
bromure de benzyle est utilisé à la place de l'iodure de méthyle dans l'étape
d'O-alkylation ;
p.f. : 171 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,53 (m, 1H, NH-CO) ; 7,32 (m, 10H, 2 x Ph) ;
7,07 (d, 1 H, P h- C H 3, J= 7,5 Hz) ; 6,82 (d, 2H, F_h-- C H 3 ) ; 3,54 (m,
2H,
ÇU2-NHCO) ; 3,28-3,10 (m, 8H, pipérazine) ; 2,27 (s, 3H, CH3) ; 2,18 (s, 3H,
CH3)
2,10 (m, 2H, CH2).
Exemple 13 : N-[3-{4-(2-méthoxyphényl)-1-pipérazinyl}-propyl]-a-phényl-
benzèneacétamide, dichlorhydrate (Composé 13) :
0,424 g (2 mmol) d'acide diphénylacétique, 0,498 g (2 mmol) de 3-[4-(2-
méthoxyphényl)-
1-pipérazinyl]-propyl-1-amine (Wu, Y.H. et al., J. Med. Chem., 12:876 (1969))
et 0,297 g
(2,2 mmol) d'hydroxybenzotriazole sont dissous dans 15 ml de THF. La solution
est refroidie
jusqu'à 0-5 C avant addition de 0,453 g (2,2 mmol) de
dicyclohexylcarbodiimide. On
continue à agiter à température ambiante pendant 15 heures. Le mélange
résultant est filtré, les
matières insolubles sont rincées avec le minimum de THF et le filtrat est
évaporé sous pression
réduite. Le résidu huileux est dissous dans 50 ml d'acétate d'éthyle et rincé
successivement
avec H20 (2 x 25 ml), NaOH 0,1 N (25 ml) et une solution saturée de chlorure
de sodium.
La phase organique est séchée sur du sulfate de sodium et évaporée jusqu'à
siccité. Le résidu
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-30-
est soumis à une chromatographie flash sur gel de silice (éluent
dichlorométhane / méthanol : 95/5). L'évaporation des phases collectées sous
pression réduite
donne 0,505 g (55 %) du composé titre qui est mis sous forme de sel par
l'utilisation d'une
solution anhydre de chlorure d'hydrogène dans le diéthyléther ; p.f. : 198-199
C.
RMN-iH (100 MHz, CDC13, S[base libre]) : 7,30 (m, 11H, 2 x Ph + NH-CO) ;
6,90 (m, 4H, Ph-OCH3) ; 4,88 (s, 1H, CH) ; 3,90 (s, 3H, OCH3) ; 3,40 (m, 2H,
ÇJ:lz-NH-CO) ; 3,15-2,50 (m, 8H, pipérazine) ; 2,50 (m, 2H, NH-Cjjz) ; 1,70 (
m, 2H,
CH2).
Analyse élémentaire pour C28H33N302, 2 HCl : % Calc : C, 65,11 ; H, 6,83 ; N,
8,14 ;
% obtenus : C, 64,82 ; H, 6,90 ; N, 8,01.
Exem lp e 14 : a-hydroxy-N-[3-{4-(2-méthoxyphényl)-1-pipérazinyl}-propy{]-
a-phényl-benzèneacétamide, dichlorhydrate, 0,25 H20
(Composé 14) :
Le composé 14 est préparé d'une manière analogue à celle de l'exemple 13 sauf
que l'acide
benzylique est utilisé à la place de l'acide diphénylacétique ; p.f. : 191-192
C.
RMN-1H (400 MHz, DMSO d6, S) : 10,93 (bs, 1H, +NH) ; 8,43 (t, 1H, NH-CO) ;
7,36 (m, 10H, 2 x Ph) ; 6,95 (m, 4H, a-OCH3) ; 4,85 (bs, 1H, OH) ; 3,80 (s,
3H,
OCH3) ; 3,45 (m, 2H, +NH-çH, ; 3,21 (m, 2H, Ç~-11-NHCO) ; 3,40-2,95 (m, 8H,
pipérazine) ; 1,92 (m, 2H, CH2).
Analyse élémentaire pour C28H33N303, 2 HCI, 0,25 H20 :% Calc : C, 62,63 ; H,
6,66 ;
N, 7,82 ; 0, 9,68 ; % obtenus : C, 62,59 ; H, 6,88 ; N, 7,93 ; 0, 9,59.
Exemple 15 : N-[3-{4-(2-méthoxyphényl)-1-pipérazinyl}-propyl]-9H-
xanthène-9-carboxamide, dichlorhydrate (Composé 15) :
Le composé 15 est préparé d'une manière analogue à celle de l'exemple 13 sauf
que l'acide
9H-xanthène-9-carboxylique est utilisé à la place de l'acide diphénylacétique
;
p.f. : 257-258 C.
RMN-1H (l00 MHz, CDC13, S[base libre]) : 7,50-6,80 (m, 12H, xanthène + Ph-
OCH3) ;
6,27 (m, 1H, NH-CO) ; 4,92 (s, 1H, CH) ; 3,85 (s, 3H, OCH3) ; 3,25 (m, 2H,
ÇJ12-NH-CO) ; 3,00-2,30 (m, 8H, pipérazine) ; 2,25 (m, 2H, NH-m2) ; 1,60 (m,
2H,
CH2).
Analyse élémentaire pour C28H31N303 , 2 HCl :% Calc : C, 63,40; H, 6,27 ; N,
7,92;
% obtenus : C, 63,22 ; H, 6,30 ; N, 7,74.
CA 02251016 2006-01-09
WO 97/37983 PGT/FR9M615
-31
ExemRie 16 : 9-hydroxy-N-[3-{4-(2-méthoxyphényi)-1-pipérazinyl}-propylJ-
9H-fluorène-9-carboxamide, dichlorhydrate, monohydrate
(Composé 16) :
Le composé 16 est préparé d'une manière analogue à celle de l'exemple 13 saûf
que l'acide
9-hydroxy-9-fluorène carboxylique est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 186-187 C.
RMN-IH (100 MHz, CDC13, S[base libre]) : 7,70-7,25 (in, 8H, fluorène) ; 6,97
(m, 4H,
pjl OCH3) ; 6,30 (m, 1H, NH-CO) ; 3,85 (s, 3H, OCH3) ; 3,30 (m, 2H, CH2-NH-CO)
;
2,90-2,30 (m, 8H, pipérazine) ; 2,20 (m, 2H, NH-Çjâ2) ; 1,65 (m, 3H, OH +
CH2).
Analyse élémentaire pour C28H31N3O3, 2 HCI, H20 : % Caic : C, 61,31 ; H, 6,43
;
N, 7,66 ; % obtenus : C, 61,32 ; H, 6,25 ; N. 7,64.
ExempJe 17 : 2-chioro-a-(2-chlorophényl)-a-hydroxy-N-
[3-{4-(2-méthoxyphényl)-1=pipérazinyl }-propyl]-
benzèneacétamide, monochlorhydrate, monohydrate
(Composé 17) :
Le composé 17 est préparé d'une manière analogue à celle de l'exémple 13 sauf
que l'acide
2,2'-dichlorobenzylique est utilisé à la place de l'acide diphénylacétique ;
p.f. : 185-186 C.
RMN-1 H (100 MHz, CDC13, S[base libre]) : 7,75 (m, 1 H, NH-CO) ; 7,30 (m, 8H,
2 x Ph-Cl) ; 6,90 (m, 4H, Ph-OCH3) ; 3,88 (s, 3H, OCH3) ; 3,52 (m, 2H, ~,RI-NH-
CO) ; 3,10 - 2,40 (m, 8H, pipérazine) ; 2,50 (m, 2H, NH-ÇJJZ) ; 1,80 (m, 2H,
CH2).
Analyse élémentaire pour C28H31C12N303, HCl , H20 :% Calc : C. 57,69 ; H, 5,88
;
N, 7,21 ; % obtenus : C, 57,42 ; H, 5,84 ; N, 6,67.
Exemple 18 : (t)-a-cyclohexyl-N-[3-{4-(2-méthoxyphényl)-1-pipérazinyl}-
propylJ-benzèneacétamide, dichlorhydrate, monohydrate
(Composé 18) :
Le composé 18 est préparé d'une manière analogue à celle de l'exemple 13 sauf
que l'acide
( )-cyclohexylphényle acétique est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 160-161 C.
RMN-iH (400 MHz, DMSO d6, S) : 10,94 (bs, 1H, +NH) ; 8,32 (m, 1H, NH-CO) ;
7,28 (m, 5H, Ph) ; 6,95 (m, 4H, Ph-OCH3) ; 3,80 (s, 3H, OCH3) ; 3,42 (m, 2H,
+NH-~Hz) ; 3,42-2,90 (m, 8H, pipérazine) ; 3,05 (m, 2H, ÇHI-NH-CO) ; 2,00-0,68
(m,
13H, cyclohexyle + CH2).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-32-
Analyse élémentaire pour C28H39N302, 2 HCI, H20 :% Calc : C, 62,21 ; H, 7,83 ;
N, 7,77 ; % obtenus : C, 62,09 ; H, 7,89 ; N, 7,60.
Exemple 19 : (t)-oc-hydroxy-N-[3-{4-(2-méthoxyphényl)-1-pipérazinyl}-
propyl]-benzèneacétamide, dichlorhydrate, monohydrate
(Composé 19) :
Le composé 19 est préparé d'une manière analogue à celle de l'exemple 13 sauf
que l'acide
( )-mandélique est utilisé à la place de l'acide diphénylacétique ; p.f. : 169
C.
RMN-1H (400 MHz, DMSO d6, S) : 10,94 (bs, 1H, +NH) ; 8,27 (m, 1H, NH-CO) ;
7,35 (m, 5H, Ph) ; 6,95 (m, 4H, Ph-OCH3) ; 5,70 (bs, OH) ; 4,95 (s, 1H, CH) ;
3,80 (s, 3H, OCH3) ; 3,42 (m, 2H, +NH--Ç,,-H-2) ; 3,25-3,02 (m, 10H,
pipérazine +cu2-
NH-CO) ; 1,90 (m, 2H, CH2).
Analyse élémentaire pour C22H29N303, 2 HCl , H20 :% Calc : C, 55,70 ; H, 7,01
N, 8,86 ;% obtenus : C, 55,23 ; H, 6,90; N, 8,84.
Exemple 20 : N-[3-{4-(2,5-diméthyiphényl)-1-pipérazinyl}-propyl]-
oc-phényl-benzèneacétamide, 1,5 HCI, H20 (Composé 20) :
20.1) 3-[4-(2,5-diméthylphényl)-1-pipérazinyl]-propyl-1-amine :
Cet intermédiaire est synthétisé en utilisant la même procédure que celle
décrite par Wu, Y.H.
et al., J. Med. Chem., 12:876 (1969) ; p.f. : 102 C.
RMN-1H (100 MHz, CDC13, S) : 7,10 (d, 1H, Eh-CH3, J = 7,5 Hz) ; 6,80 (m, 2H,
a-CH3) ; 3,10 (m, 12H, CH2-N +CH2-NH2 + pipérazine) ; 2,30 (s, 3H, CH3)
2,26 (s, 3H, CH3) ; 1,70 (m, 2H, CH2) ; 1,62 (s, NH2).
20.2) N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-a-phényl-
benzèneacétamide, 1,5 HC1, H20 :
Le composé 20 est préparé d'une manière analogue à celle de l'exemple 13 sauf
que la
3-[4-(2,5-diméthylphényl)-1-pipérazinyl]-propyl-1-amine est utilisée à la
place de la
3-[4-(2-méthoxyphényl)-1-pipérazinyl]-propyl-1-amine ; p.f.: 151 C.
RMN-1H (400 MHz, DMSO d6, S) : 10,96 (bs, 1H, +NH) ; 8,62 (m, 1H, NH-CO) ;
7,27 (m, 10H, 2 x Ph) ; 7,06 (d, 1H, Ph-CH3, J = 7,5 Hz) ; 6,82 (d, 1H, Ph-
CH3)
4,99 (s, 1 H, CH) ; 3,44 (m, 2H, +NH-ÇUZ) ; 3,18 (m, 2H, ÇEZ-NH-CO) ; 3,12 (m,
8H, pipérazine) ; 2,26 (s, 3H, CH3) ; 2,19 (s, 3H, CH3) ; 1,91 (m, 2H, CH2).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-33-
Analyse élémentaire pour C29H35N30, 1,5 HC1 , H20 :% Calc : C, 67,72 ; H, 7,55
N, 8,17 ; 0, 6,22 ; % obtenus : C, 67,56 ; H, 7,51 ; N, 8,17 ; 0, 6,48.
Exemple 21 : 4-chloro-a-(4-chlorophényl)-N-[3-{4-(2,5-diméthylphényl)-
1-pipérazinyl}-propyl]-benzèneacétamide, fumarate
(Composé 21)
Le composé 21 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
4,4'-dichloro-diphénylacétique est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 139 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,36 (m, 1H, NH-CO) ; 7,34 (m, 8H, 2 x Ph-Cl) ;
7,01 (d, 1H, Ph-CH3, J= 8 Hz) ; 6,79 (s, 1H, a-CH3) ; 6,75 (d, 1H, ph-CH3)
6,61 (s, 2H, CH=CH) ; 4,95 (s, 1H, CH) ; 3,13 (m, 2H, ÇJJZ-NH-CO) ; 2,81 (bs,
4H,
pipérazine) ; 2,52 (bs, 4H, pipérazine) ; 2,38 (m, 2H, CH2-N) ; 2,23 (s, 3H,
CH3)
2,17 (s, 3H, CH3) ; 1,62 (m, 2H, CH2).
Analyse élémentaire pour C29H33C12N3O, fumarate :% Calc : C, 63,26 ; H, 5,95
N, 6,71 ; % obtenus : C, 63,60 ; H, 6,03 ; N, 6,78.
Exemple 22 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-méthyl-benzèneacétamide, 1,25 HCI, 0,75 H20
(Composé 22) :
Le composé 22 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-atrolactique est utilisé à la place de l'acide diphénylacétique ; p.f. :
155 C.
RMN-1H (400 MHz, DMSO d6, S) : 10,82 (bs, 1H, +NH) ; 8,16 (m, 1H, NH-CO) ;
7,56 (m, 2H, Ph) ; 7,34 (m, 2H, Ph) ; 7,24 (m, 1H, Ph) ; 7,06 (d, 1H, a-CH3,
J = 8 Hz) ; 6,82 (m, 2H, P-h -CH3) ; 4,87 (bs, OH) ; 3,39 (m, 2H, +NH-c'Ill) ;
3,17-2,97 (m, 10H, pipérazine +ÇU-Z-NH-CO) ; 2,26 (s, 3H, Ph-_~3) ; 2,20 (s,
3H,
Ph-Ç.B3) ; 1,86 (m, 2H, CH2) ; 1,64 (s, 3H, CH3).
Analyse élémentaire pour C24H33N302, 1,25 HCI, 0,75 H20 : % Calc : C, 63,41
H, 7,93 ; N, 9,24 ; 0, 9,68 ; % obtenus : C, 63,56 ; H, 7,83 ; N, 9,15 ; 0,
9,46.
Exem In e 23 : N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-méthyl-a-phényl-benzèneacétamide, 1,5 HC1, 1,25 H20
(Composé 23) :
Le composé 23 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
2,2-diphénylpropionique est utilisé à la place de l'acide diphénylacétique ;
p.f. : 90 C.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-34-
RMN-1H (400 MHz, DMSO d6, S) : 7,67 (m, 1H, NH-CO) ; 7,26 (m, 10H, 2 x Ph) ;
7,07 (d, 1H, Là-CH3, J = 8 Hz) ; 6,82 (m, 2H, M-CH3) ; 6,56 (bs, 1H, +NH)
3,39 (m, 2H, +NH-LUZ) ; 3,20-2,97 (m, 10H, pipérazine + ÇH2-NH-CO) ; 2,26 (s,
3H,
Ph-Ç.~-Ig) ; 2,21 (s, 3H, Ph-ÇH3.) ; 1,88 (m, 5H, CH2 + CH3).
Analyse élémentaire pour C30H37N30, 1,5 HCI, 1,25 H20 : % Calc : C, 67,62
H, 7,76 ; N, 7,89; 0, 6,76 ; % obtenus : C, 67,82 ; H, 7,80 ; N, 7,51 ; 0,
6,57.
Fxem lp e 24 : N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-éthylthio-a-phényl-benzèneacétamide, 0,5 fumarate
(Composé 24) :
Le composé 24 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
2-éthylthio-2,2-diphénylacétique est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 157 C.
RMN-1H (400 MHz, DMSO d6, S) : 7,94 (m, 1H, NH-CO) ; 7,32 (m, 10H, 2 x Ph) ;
7,01 (d, 1H, P h- C H 3, J = 7,4 Hz) ; 6,75 (m, 2H, Pj-- C H 3); 6,60 (s, 1H,
1/2 CH=CH) ; 3,60 (bs, COOH) ; 3,19 (m, 2H, ÇBZ-NH-CO) ; 2,77 (bs, 4H,
pipérazine) ; 2,50 (m, 4H, pipérazine) ; 2,33 (m, 2H, CII2-N) ; 2,24 (s, 3H,
Ph-çâ3.)
2,16 (m, 5H, Ph-~3 + S-!:Hl) ; 1,62 (m, 2H, CH2) ; 0,99 (t, 3H, ÇlI-CH2-S,
J = 7,5 Hz).
Analyse élémentaire pour C31H39N30S, 0,5 fumarate : % Calc : C, 70,81 ; H,
7,38
N, 7,51 ; S, 5,73 ; % obtenus : C, 70,69 ; H, 7,33 ; N, 7,11 ; S, 5,96.
Exemple 25 : N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-4-méthoxy-a-(4-méthoxyphényl)-
benzèneacétamide, HCI, 0,5 H20 (Composé 25) :
Le composé 25 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
4,4'-diméthoxybenzylique (Toda, F. et al. Chem. Letts., pp. 373-376 (1990))
est utilisé à la
place de l'acide diphénylacétique ; p.f. : 173 C.
RMN-1H (400 MHz, DMSO d6, S) : 11,19 (bs, 1H, +NH) ; 8,37 (m, 1H, NH-CO) ;
7,70 (bs, OH) ; 7,29 (d, 4H, 2 xP-h-OCH3, J = 8,6 Hz) ; 7,05 (d, 1H, n-CH3,
J= 7,7 Hz) ; 6,87 (d, 4H, 2 xP h -OCH3) ; 6,83 (m, 2H, n-CH3) ; 3,73 (s, 6H,
2 x OCH3) ; 3,42 (m, 2H, +NH-Çâ2) ; 3,30-2,95 (m, 10H, pipérazine +~Hj-NH-
CO) ; 2,26 (s, 3H, Ph-Çâ.1) ; 2,20 (s, 3H, Ph-Çâ3.) ; 1,94 (m, 2H, CH2).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-35-
Exem lp .e 26 : N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
2-éthyl-2-phényl-butyramide, dichlorhydrate, monohydrate
(Composé 26) :
Le composé 26 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
2-éthyl-2-phénylbutyrique est utilisé à la place de l'acide diphénylacétique ;
p.f. : 195 C.
RMN-1H (400 MHz, DMSO d6, S) : 11,12 (bs, 1H, +NH) ; 7,65 (m, 1H, NH-CO) ;
7,28 (m, 10H, 2 x Ph) ; 7,06 (d, 1H, Ph-CH3, J = 8 Hz) ; 6,82 (m, 2H, a-CH3) ;
3,40 (m, 2H, +NH--I2) ; 3,05 (m, 8H, pipérazine) ; 2,92 (m, 2H, ÇJJI-NH-CO) ;
2,26 (s, 3H, Ph-Ç-I-3) ; 2,20 (s, 3H, Ph-Çâ3) ; 1,91 (m, 6H, 3 x CH2) ; 0,63
(t, 6H,
2 x Ç~-13-CH2, J = 7,2 Hz).
Analyse élémentaire pour C27H39N30, 2 HC1, H20 : % Calc : C, 63,27 ; H, 8,46 ;
N, 8,20 ; 0, 6,24 ; % obtenus : C, 63,67 ; H, 8,57 ; N, 8,19 ; 0, 6,43.
Exem lp e 27 : (f)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
2-hydroxy-2-phényl-butyramide, fumarate (Composé 27) :
Le composé 27 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
a-hydroxy-cc-phényl-butyrique est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 179 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,03 (m, 1H, NH-CO) ; 7,55 (d, 2H, Ph,
J= 7,5 Hz) ; 7,30 (m, 2H, Ph) ; 7,22 (m, 1H, Ph) ; 7,02 (d, 1H, ph-CH3,
J = 7,5 Hz) ; 6,81 (s, 1H, P i-CH3) ; 6,76 (d, 1H, a-CH3) ; 6,60 (s, 2H,
CH=CH)
3,10 (m, 2H, ç iI 2-NHCO) ; 2,86 (bs, 4H, pipérazine) ; 2,58 (bs, 4H,
pipérazine)
2,41 (m, 2H, CH2-N) ; 2,24 (s, 3H, CH3) ; 2,21 (m, 1H, ÇH2-CH3) ; 2,17 (s, 3H,
CH3) ; 1,86 (m, 1H, Çji7-CH3) ; 1,60 (m, 2H, CH2) ; 0,79 (t, 3H, CH2-Clil,
J = 7,2 Hz).
Analyse élémentaire pour C25H35N302, fumarate : % Calc : C, 66,27 ; H, 7,48
N, 7,99 ; % obtenus : C, 66,28 ; H, 7,35 ; N, 7,98.
Exem in e 28 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
2-hydroxy-2-phényl-hexanamide, fumarate (Composé 28) :
28.1) Acide ( )-2-hydroxy-2-phényl-hexanoïque :
Cet intermédiaire est décrit par Newcomb M., et al. (J. Org. Chem., 43:3963
(1978)) ;
p.f. : 102 C.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-36-
RMN-iH (100 MHz, CDC13, 8) : 7,52 (m, 5H, Ph) ; 5,75 (bs, OH + COOH) ; 2,10
(m,
2H, CH2-C-OH) ; 1,33 (m, 4H, CH2-CH2) ; 0,90 (m, 3H, CH3).
28.2) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-2-hydroxy-
2-phényl-hexanamide, fumarate :
Le composé 28 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
(t)-2-hydroxy-2-phényl-hexanoïque est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 147 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,01 (m, 1H, NH-CO) ; 7,55 (d, 2H, Ph,
J = 7,5 Hz) ; 7,25 (m, 3H, Ph) ; 7,02 (d, 1H, Ph-CH3, J = 7,5 Hz) ; 6,81 (s,
1H,
Pji-CH3) ; 6,76 (d, 1H, a-CH3) ; 6,60 (s, 2H, CH=CH) ; 5,85 (bs, OH + COOH) ;
3,10 (m, 2H, -I2-NHCO) ; 2,85 (bs, 4H, pipérazine) ; 2,57 (bs, 4H, pipérazine)
;
2,39 (m, 2H, CH2-N) ; 2,24 (s, 3H, Ph-Çâ3) ; 2,17 (s, 3H, Ph-ÇH-3.) ; 2,14 (m,
1H,
1/2 ÇIi2-C-OH) ; 1,84 (m, 1H, 1/2 Ç.B2-C-OH) ; 1,59 (m, 2H, CH2) ; 1,25 (m,
4H,
CE.2-Ç,U2,-CH3) ; 1,18 (t, 3H, CH2-Çl-i-3, J = 6,9 Hz).
Analyse élémentaire pour C27H39N302, fumarate : % Calc : C, 67,25 ; H, 7,83 ;
N, 7,59 ; % obtenus : C, 66,76 ; H, 7,69 ; N, 7,58.
Exemple 29 : ( )-2-chloro-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-
propyl]-a-hydroxy-(x-méthyl-benzèneacétamide, fumarate,
monohydrate (Composé 29) :
29.1) ( )-2-chloro-a-hydroxy-oc-méthyl-benzèneacétonitrile
Ce composé est synthétisé en utilisant la même procédure que celle décrite par
Gassman, P.G.
et al., Tetrahedron Lett., 40:3773 (1978).
RMN-1H (100 MHz, CDC13, S) : 7,50 (m, 4H, Ph) ; 3,78 (bs, 1H, OH) ; 2,06 (s,
3H,
CH3).
29.2) Acide ( )-2-chloro-a-hydroxy-a-méthyl-benzèneacétique
Un mélange de 2,3 g (12,7 mmol) de (t)-2-chloro-a-hydroxy-a-méthyl-
benzèneacétrônitrile
et 20 ml de HCl concentré est chauffé à 60 C pendant 3 heures puis est mis au
reflux pendant
2 heures. Après refroidissement, le mélange réactionnel est concentré sous
pression réduite et
le résidu est séparé entre diéthyléther (50 ml) et NaOH 1N (50 ml). La phase
organique est
extraite deux fois avec 25 ml de NaOH 1N, et toutes les phases basiques sont
réunies
ensemble avant acidification avec HCl concentré. Le produit est extrait avec 2
x 50 ml de
CA 02251016 1998-10-01
WO 97/37983 PCTIFR97/00615
-37-
diéthyléther, puis la solution est séchée sur sulphate de sodium et évaporée
sous vide pour
donner 930 mg (36 %) d'une poudre blanche ; p.f. : 110-111 C.
RMN-1H (100 MHz, CDC13, S) : 7,50 (m, 4H, Ph) ; 6,47 (bs, 2H, OH + COOH) ;
1,90 (s, 3H, CH3).
29.3) (t)-2-chloro-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-méthyl-benzèneacétamide, fumarate, monohydrate :
Le composé 29 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
(t)-2-chloro-a-hydroxy-a-méthyl-benzèneacétique est utilisé à la place de
l'acide
diphénylacétique ; p.f. : 84 C.
RMN-1H (400 MHz, DMSO d6, S) : 7,90 (m, 1H, NU-CO) ; 7,62 (m, 1H, pjl-C1)
7,34 (m, 3H, pli-CI) ; 7,03 (d, 1H, Eh-CH3, J= 7,5 Hz) ; 6,78 (m, 2H, n-CH3)
6,61 (s, 2H, CH=CH) ; 6,02 (bs, OH + COOH) ; 3,19 (m, 2H, ÇH 9 -NHCO) ; 2,90
(bs,
4H, pipérazine) ; 2,76 (bs, 4H, pipérazine) ; 2,62 (m, 2H, CH2-N) ; 2,24 (s,
3H, CH3)
2,18 (s, 3H, CH3) ; 1,72 (m, 5H, CH2 + CH3).
Analyse élémentaire pour C24H32C1N3O2, fumarate, H20 :% Calc : C, 59,62 ; H,
6,79 ;
N, 7,45 ; % obtenus : C, 59,54 ; H, 6,47 ; N, 7,10.
Exemple 30 : ( )-4-chloro-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-
propyl]-(x-hydroxy-a-méthyl-benzèneacétamide, 1,25 HCI,
0,5 H20 (Composé 30) :
30.1) Acide ( )-4-chloro-a-hydroxy-a-méthyl-benzèneacétique :
Ce composé est préparé d'une manière analogue à celle de l'intermédiaire 29.2
sauf que le
( )-4-chloro-a-hydroxy-a-méthyl-benzèneacétonitrile (Gassman, P.G. et al.,
Tetrahedron
Lett., 40:3773 (1978)) est utilisé à la place du ( )-2-chloro-a-hydroxy-a-
méthyl
benzèneacétonitrile.
RMN-1H (100 MHz, CDC13, S) : 7,45 (m, 4H, Ph) ; 6,80 (bs, 2H, OH + COOH) ;
1,80 (s,. 3H, CH3).
30.2) ( )-4-chloro-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-méthyl-benzèneacétamide, 1,25 HCI, 0,5 H20 Le composé 30 est
préparé d'une manière analogue à celle de l'exemple 20 sauf que l'acide
(f)-4-chloro-a-hydroxy-a-méthyl-benzèneacétique est utilisé à la place de
l'acide
diphénylacétique ; p.f. : 161,5 C.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-38-
RMN-1H (400 MHz, DMSO d6, S) : 10,95 (bs, 1H, +NH) ; 8,20 (m, iH, NH-CO) ;
7,56 (m, 2H, Ph-Cl) ; 7,39 (m, 2H, Ph-Cl) ; 7,06 (d, 1H, Eh-CH3, J = 8 Hz) ;
6,82 (m,
2H, ]'jj.-CH3) ; 5,70 (bs, OH) ; 3,44 (m, 2H, +NH-Câl) ; 3,16- 2,99 (m, 10H,
pipérazine +~H2-NH-CO) ; 2,26 (s, 3H, Ph-ÇH-3_) ; 2,20 (s, 3H, Ph-Çâ3.) ; 1,87
(m,
2H, CH2) ; 1,62 (s, 3H, CH3).
Analyse élémentaire pour C24H32C1N302, 1,25 HCI, 0,5 H20 :% Calc : C, 59,49 ;
H, 7,12 ; N, 8,67 ; % obtenus : C, 59,46 ; H, 7,01 ; N, 8,51.
Exemple 31 : ( )-3-chloro-N-[3{4-(2,5-diméthylphényl)-1-pipérazinyl}-
propyl]-a-hydroxy-a-méthyl-benzèneacétamide, fumarate
(Composé 31)
31.1) Ethyl-ester de l'acide ( )-3-chloro-a-hydroxy-a-méthyl-
benzèneacétique :
Dans un ballon tricol anhydre équipé d'une arrivée d'azote, d'un entonnoir, et
d'un
condensateur à reflux sont introduits 400 mg (0,016 a.g.) de poudre de
magnésium, quelques
gouttes d'une solution de 3-bromochlorobenzène (1,94 ml, 16,5 mmol) dans 10 ml
de
diéthyléther sec, et un crystal d'iode. Le mélange est doucement chauffé
jusqu'à ce que la
réaction commence, puis le reliquat de 3-bromochlorobenzène est ajouté goutte
à goutte à un
débit qui maintient le reflux. L'agitation est poursuivie jusqu'à disparition
complète du
magnésium (environ 1 heure). Le bromure de 3-chlorophénylmagnésium ainsi formé
est
ensuite amené via une tubulure dans une solution préalablement refroidie (-78
C) de 1,64 ml
(15 mmol) de pyruvate d'éthyle dans 15 ml de diéthyléther sec. Après que cette
addition soit
complète, on laisse la température de réaction lentement augmenter jusqu'à 20
C et le mélange
est agité toute la nuit. Le mélange réactionnel est refroidi brutalement à 0
C par l'addition de
3N HCl (10 ml) et extrait avec 2 x 20 ml de diéthyléther. L'extrait organique
est ensuite
rincé avec de l'eau (2 x 20 ml), une solution saturée de chlorure de sodium
(20 ml), et séché
sur du sulphate de sodium. L'évaporation du solvant sous pression réduite
permet l'obtention
d'une huile jaune qui est purifiée sur colonne de chromatographie (éluent :
pétrole léger
(bp. 40-65 C) / acétate d'éthyle : 95/5). 2,16 g (57 %) d'une huile pure
incolore sont
obtenus.
RM N - 1 H (100 MHz, CDC13, 8) : 7,60 - 7,25 (m, 4H, Ph) ; 4,23 (q, 2H, CH2,
J= 7,0 Hz) ; 3,89 (s, 1H, OH) ; 1,75 (s, 3H, CH3) ; 1,29 (t, 3H, CH2-M 3
.).
31.2) Acide ( )-3-chloro-a-hydroxy-a-méthyl-benzèneacétique :
A une solution de 2,16 g (9,44 mmol) d'éthyl-ester d'acide ( )-3-chloro-a-
hydroxy-
a-méthyl-benzèneacétique dans 20 ml d'éthanol refroidi (0-5 C) est ajoutée
goutte à goutte
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97100615
-39-
une solution de 1,24 g (18,8 mmol) de KOH dans 10 ml de H20. L'agitation est
poursuivie
pendant 3 heures à 25 C, et le solvant est évaporé. Le résidu est séparé
entre H20 et
diéthyléther. Après décantation, la couche aqueuse est acidifiée à 0 C avec
3N HC1 et extraite
avec 2 x 50 ml de diéthyléther. L'extrait diéthyléther est séché sur sodium de
sulphate et le
solvant est évaporé sous pression réduite de façon à obtenir 1,76 g (93 %)
d'une poudre
blanche p.f. : 110-111 C.
RMN-1H (100 MHz, CD3OD, S) : 7,80-7,42 (m, 4H, Ph) ; 1,89 (s, 3H, CH3).
31.3) ( )-3-chloro-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-méthyl-benzèneacétamide, fumarate :
Le composé 31 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
(t)-3-chloro-a-hydroxy-a-méthyl-benzèneacétique est utilisé à la place de
l'acide
diphénylacétique : p.f. : 80-81 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,17 (m, 1H, NH-CO) ; 7,57 (s, 1H, Ph-Cl) ;
7,49 (d, 1H, Ph-Cl, J = 7,63 Hz) ; 7,34 (m, 2H, Ph-Cl) ; 6,61 (s, 2H, -CH=CH-)
;
3,10 (m, 2H, CI-i2-NHCO) ; 2,86 (bs, 4H, pipérazine) ; 2,58 (bs, 4H,
pipérazine) ;
2,40 (m, 2H, CH2-N) ; 2,24 (s, 3H, Ph-Ç~-II) ; 2,18 (s, 3H, Ph-Çâ3) ; 1,59 (m,
5H,
CH2 + CH3).
Analyse élémentaire pour C24H32CIN302, fumarate :% Calc : C, 61,59 ; H, 6,65
N, 7,70 ;% obtenus : C, 61,18 ; H, 6,60; N, 7,60.
Exemple 32 : ( )-a-amino-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-
propyl]-benzèneacétamide, difumarate (Composé 32) :
32.1) (f)-a-tert-butoxycarbonylamino-N-[3-{4-(2,5-diméthylphényl)-
1-pipérazinyl}-propyl]-benzèneacétamide :
Ce composé est préparé d'une manière analogue à celle de l'exemple 20 sauf que
la
( )-Boc-phénylglycine est utilisée à la place de l'acide diphénylacétique.
RMN-iH (100 MHz, CDC13, S) : 7,35 (m, 6H, Ph + NH-CO) ; 7,01 (d, 1H, Eh-CH3,
J = 7,5 Hz) ; 6,85 (s, 1H, a-CH3) ; 6,79 (d, 1H, ph-CH3) ; 5,90 (m, 1H, NU-
Boc) ;
5,10 (d, 1H, CH) ; 3,38 (m, 2H, Ç,-tL2-NHCO) ; 3,00-2,30 (m, 10H,
pipérazine + CH2-N) ; 2,35 (s, 3H, CH3) ; 2,25 (s, 3H, CH3) ; 1,65 (m, 2H,
CH2)
1,40 (s, 9H, tBu).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-40-
32.2) { )-oc-amino-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
benzèneacétamide, difumarate :
Une solution de 1,47 g (3 mmol) de ( )-a-tert-butoxycarbonylamino-N-
[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-benzèneacétamide dans 20 ml
de
1,4-dioxane est refroidie à 0 C avant addition de 7,5 ml (30 mmol) d'une
solution de
4N HCl dans 1,4-dioxane. Après agitation toute la nuit à la température
ambiante, le mélange
réactionnel est concentré sous vide. Le résidu est mis en suspension dans 50
ml d'acétate
d'éthyle et rincé avec 2 x 50 ml de NaOH 1N. Après séchage sur sulphate de
sodium
anhydre, la phase organique est concentrée pour donner 1,10 g (95 %) d'une
huile incolore.
Celle-ci est convertie en son sel de fumarate tel que décrit ci-dessus ; p.f.
: 122-123 C.
RMN-1H (400 MHz, DMSO d6, S) : 9,90 (bs, NH3+) ; 8,52 (m, 1H, NH-CO) ; 7,47
(m,
5H, Ph) ; 7,03 (d, 1H, Ph.-CH3, 3= 7,5 Hz) ; 6,79 (s, 1H, Ph-CH3) ; 6,75 (d,
1H,
a-CH3) ; 6,55 (s, 4H, 2 x -CH=CH-) ; 4,82 (s, 1H, CH) ; 3,12 (m, 2H, ÇI:12-
NHCO) ;
2,80 (bs, 4H, pipérazine) ; 2,50 (bs, 4H, pipérazine) ; 2,32 (m, 2H, CH2-N) ;
2,23 (s,
3H, CH3) ; 2,17 (s, 3H, CH3) ; 1,59 (m, 2H, CH2).
Analyse élémentaire pour C23H32N40, difumarate : % Calc : C, 60,77 ; H, 6,58
N, 9,14 ; % obtenus : C, 60,61 ; H, 6,51 ; N, 8,87.
Exem lF e 33 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-(méthylsulfonylamino)-benzèneacétamide, HCI, 0,5 H20
(Composé 33) :
33.1) Acide ( )-a-(méthylsulfonylamino)-benzèneacétique
A une suspension agitée de 3,78 g (25 mmol) de ( )-phénylglycine dans 10 ml
H20 est
ajoutée goutte à goutte une solution de NaOH 1N (25 ml) jusqu'à dissolution
complète. Sous
agitation forte, 2,7 ml (35 mmol) de chlorure de méthanesulfonyle sont ajoutés
suivis par
NaOH 1N en petite quantité pour maintenir l'alcalinité du mélange à environ pH
9. Après
stabilisation du pH, l'agitation est poursuivie à température ambiante pendant
une heure. Le
mélange réactionnel est ensuite acidifié avec HCl 4N et extrait avec 2 x 50 ml
d'acétate
d'éthyle. La phase organique est rincée avec 50 ml HCl 1N suivi par 2 x 25 ml
d'une
solutation saturée de chlorure de sodium et finalement séchée sur sulfate de
sodium. La
filtration et l'évaporation du solvant permettent l'obtention d'une huile
jaune qui cristallise
lentement lorsqu'elle est laissée toute la nuit à température ambiante. Les
cristaux jaunes sont
filtrés et rincés avec un mélange de pétrole léger (bp, 40-65 C) et de
diéthyléther pour donner
1,87 g (32 %) d'une poudre blanche ; p.f. =117 C.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-41 -
RMN-1H (100 MHz, CDC13, 6) : 9,79 (bs, 1H, COOH) ; 7,40 (bs, 5H, Ph) ; 5,93
(d,
1H, SO2NH, J = 7,0 Hz) ; 5,25 (d, 1H, CH) ; 2,74 (s, 3H, CH3).
33.2) ( )-N-[3-{4-(2,5-diméthylphényi)-1-pipérazinyl}-propyl]-
a-(méthylsulfonylamino)-benzèneacétamide, HCI, 0,5 H20
Le composé 33 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-a-(méthylsulfonylamino)-benzèneacétique est utilisé à la place de l'acide
diphénylacétique ; p.f. : 151-152 C.
RMN-1H (400 MHz, DMSO d6, S) : 11,05 (bs, 1H, +NH) ; 8,64 (m, 1H, NH-CO) ;
7,98 (m, 1H, NHSO2) ; 7,50 (d, 2H, Ph, J= 7,55 Hz) ; 7,36 (m, 3H, Ph) ; 7,06
(d,
lo 1H, Ph-CH3, J= 7,5 Hz) ; 6,82 (m, 2H, tà-CH3) ; 5,03 (d, 1H,CH, J= 6,8 Hz)
;
3,48 (m, 2H, +NH-CE2) ; 3,09 (m, 10H, pipérazine +CUZ-NH-CO) ; 2,76 (s, 3H,
CH3-S02) ; 2,26 (s, 3H, P h -CH3) ; 2,20 (s, 3H, plj.-CH3) ; 1,90 (m, 2H, CH2)
;
1,62 (s, 3H, CH3).
Analyse élémentaire pour C24H34C1N403S, HCI, 0,5 H20 :% Calc : C, 57,19 ; H,
7,20 ;
N, 11,11 ; S, 6,36 ; % obtenus : C, 57,27 ; H, 7,09 ; N, 11,04 ; S, 6,09.
Exemple 34 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
2-hydroxy-2-méthyl-4-méthoxy-benzènepropionamide, fumarate
(Composé 34) :
34.1) ( )-2-hydroxy-2-méthyl-4-méthoxy-benzènepropionitrile
Ce composé est synthétisé en utilisant la même procédure que celle décrite par
Gassman, P.G.
et al., Tetrahedron Lett., 40:3773 (1978).
RMN-1H (100 MHz, CDC13, S) : 7,10 (m, 4H, Ph) ; 3,81 (s, 3H, OCH3) ; 2,98 (AB,
2H, CH2, JAB = 14 Hz) ; 2,70 (bs, 1H, OH) ; 1,64 (s, 3H, CH3).
34.2) Acide ( )-2-hydroxy-2-méthyl-4-méthoxy-benzènepropionique :
Ce composé est préparé d'une manière analogue à celle de l'intermédiaire 29.2
sauf que le
( )-2-hydroxy-2-méthyl-4-méthoxy-benzènepropionitrile est utilisé à la place
du (f)-2-chloro-
a-hydroxy-a-méthyl-benzéneacétronitrile.
RMN-1H (100 MHz, CDC13, 8) : 7,00 (m, 4H, Ph) ; 5,66 (bs, 2H, OH + COOH) ;
3,79 (s, 3H, OCH3) ; 3,00 (AB, 2H, CH2, JAB = 13,7 Hz) ; 1,51 (s, 3H, CH3).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
- 42 -
34.3) (t)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-2-hydroxy-
2-méthyi-4-méthoxy-benzènepropionamide, fumarate :
Le composé 34 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-2-hydroxy-2-méthyl-4-méthoxy-benzènepropionique est utilisé à la place de
l'acide
diphénylacétique ; p.f. : 142 C.
RMN-iH (400 MHz, DMSO d6, S) : 7,66 (m, 1H, NH-CO) ; 7,08-6,73 (m, 7H,
Eh-CH3 + Ph-OCH3) ; 6,61 (s, 2H, CH=CH) ; 5,30 (bs, OH + COOH) ; 3,69 (s, 3H,
OCH3) ; 3,16 (m, 1H, 1/2 ÇH2,-NHCO) ; 2,95 (m, 1H, 1/2 ÇJJ2-NHCO) ; 2,82 (bs,
4H,
pipérazine) ; 2,78 (AB, 2H, CH2-PhOCH3, JAB = 13,35 Hz) ; 2,50 (bs, 4H,
pipérazine) ;
i0 2,32 (m, 2H, CH2-N) ; 2,25 (s, 3H, CH3) ; 2,17 (s, 3H, CH3) ; 1,47 (m, 2H,
CH2) ;
1,26 (s, 3H, CH3).
Analyse élémentaire pour C26H37N303, fumarate : % Calc : C, 64,85 ; H, 7,44 ;
N, 7,56 ;% obtenus : C, 64,59 ; H, 7,42 ; N, 7,49.
Exemple 35 : N-[3-{4-(2,5-diméthylphényl)-lpipérazinyi}-propyl]-N-
méthyl-oc-phényl-benzèneacétamide, 0,75 fumarate
(Composé 35) :
35.1) N-(3-hydroxypropyl)-N-méthyl-a-phényl-benzèneacétamide
Le composé titre est préparé d'une manière analogue à celle de l'intermédiaire
1.1 sauf que la
N-méthyl-3-hydroxypropylamine (Koepke, S.R. et al., J. Org. Chem. 44:2718
(1979)) est
utilisée à la place du 3-amino-1-propanol.
RMN- 1H (400 MHz, CDC13, S) : 7,29 (m, 10H, 2 x Ph) ; 5,24 (s, 1H, CH) ; 3,58
(m,
2H, CH2-NCO) ; 3,48 (m, 2H, CH2OH) ; 3,00 (s, 3H, CH3) ; 1,71 (m, 2H, CH2).
35.2) N-(3-iodopropyl)-N-méthyl-a-phényl-benzèneacétamide :
Le composé titre est préparé d'une manière analogue à celle de l'intermédiaire
1.2 sauf que le
N-(3-hydroxypropyl)-N-méthyl-a-phényl-benzèneacétamide est utilisé à la place
du
a-hydroxy-N-(3-hydroxypropyl)-a-phényl-benzèneacétamide.
RMN-iH (400 MHz, CDC13, S) : 7,32 (m, 10H, 2 x Ph) ; 5,18 (s, 1H, CH) ; 3,50
(m,
2H, CH2-NCO) ; 3,12 (m, 2H, CH2-I) ; 3,00 (s, 3H, CH3) ; 2,10 (m, 2H, CH2).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-43-
35.3) N-[3-(4-(2,5-diméthylphényl)-1-pipérazinyl)-propyl]-N-méthyl-
cc-phényl-benzèneacétamide, 0,75 fumarate :
Un mélange de 2 g (5 mmol) de N-(3-iodopropyl)-N-méthyl-a-phényl-
benzèneacétamide et
970 mg (5 mmol) de 1-(2,5-diméthylphényl)-pipérazine dans 15 ml d'acétonitrile
est chauffé
sous reflux pendant 4 heures. Après refroidissement, le solvant est évaporé
sous pression
réduite, et le résidu est traité tel que décrit dans l'exemple 1 excepté pour
la colonne de
chromatographie (éluent : acétate d'éthyle / éthanol : 90/10). La mise sous
forme de sel est
effectuée en présence d'un équivalent de l'acide fumarique dans de l'éthanol
au reflux pour
donner le composé titre sous forme de solide blanc ; p.f. : 192 C.
RMN-1H (400 MHz, DMSO d6, S) : 7,25 (m, 10H, 2 x Ph) ; 7,02 (d, 1H, Ph-CH3,
7= 7,5 Hz) ; 6,77 (m, 2H, Ph-CH3) ; 6,61 (s, 1,5H, 0,75 CH=CH) ; 5,52 (s,
0,5H,
CH) ; 5,45 (s, 0,5H, CH) ; 3,37 (m, 2H, Ç~-12-N(CH3)-CO) ; 2,98 (s, 1,5H,
NCH3)
2,86 (s, 1,5H, NCH3) ; 2,82 (bs, 4H, pipérazine) ; 2,60 (bs, 4H, pipérazine) ;
2,40 (m,
1H, CH2-N) ; 2,34 (m, 1H, CH2-N) ; 2,23 (s, 3H, Ph-Ç.U3) ; 2,17 (s, 3H, Ph-
ÇIla)
1,67 (m, 2H, CH2).
Analyse élémentaire pour C30H37N30, 0,75 fumarate : % Calc : C, 73,04 ; H,
7,43
N, 7,74 ; % obtenus : C, 72,54 ; H, 7,30 ; N, 7,29.
Exemple 36 : ( )-N-[3-{4-(2-(1-hydroxypropyl)-phényl)-1-pipérazinyl}-
propyl]-(x-phényl-benzèneacétamide, fumarate (Composé 36) :
36.1) 2-(4-benzyl-1-pipérazinyl)-benzaldéhyde :
4,24 ml (40 mmol) de 2-fluorobenzaldéhyde, 8,34 ml (48 mmol) de N-
benzylpipérazine et
6,62 g (48 mmol) de K2C03 dans 60 ml de DMF sont chauffés à 150 C pendant 7
heures.
Après refroidissement, le mélange est couvert avec 200 ml d'acétate d'éthyle,
et la phase
organique est rincée successivement avec 2 x 50 ml de H20 et 2 x 50 ml d'une
solution
saturée de NaC1. Après séchage sur Na2SO4, l'acétate d'éthyle est évaporé pour
obtenir une
huile marron qui est purifiée par chromatographie sur gel de silice (éluent :
pétrole léger
(bp. 40-65 C) / acétate d'éthyle : 9/1 puis 8/2). L'évaporation des fractions
appropriées
sous pression réduite donne 10,91 g (91 %) d'un solide blanc ; p.f. : 60 C.
RMN-1H (100 MHz, CDC13, S) : 10,32 (s, 1H, CHO) ; 7,78 (m, 1H, pjl-CHO)
7,47 (m, 1H, Eâ-CHO) ; 7,32 (s, 5H, Ph) ; 7,10 (m, 2H, n-CHO) ; 3,60 (s, 2H,
,~-Ph) ; 3,12 (m, 4H, pipérazine) ; 2,68 (m, 4H, pipérazine).
~L,
CA 02251016 2006-01-09
WO 97/37983 PCT/FR971'00615
-44-
36.2) (t)-2-(4-benzyl-1-pipérazinyl)-a-éthyl-benzèneméthanol :
Dans un ballon tricol anhydre équipé d'une arrivée d'azote est introduite une
solution de 1,8 ml
( 5,3 mmol, solution 3M dans le diéthyléther) de bromure d'éthylmagnésium dans
10 ml de
diéthyléther sec. A cette solution préalablement refroidie (0 à 5 C) est
ajouté goutte à goutte
1 g (3,5 mmol) de 2-(4-benzyl-l-pipérazinyl)-benzaldéhyde dilué dans 5 ml de
diéthyléther
sec, et 1'agitation est poursuivie 30 minutes à température ambiante. Le
mélange n;ractionnel est
ensuite hydrolysé à 0 C par une solution concentrée de chlorure d'ammonium et
finalement
dilué avec 50 ml d'acétate d'éthyle. Après décantation, la phase organique est
rincée
successivement avec 2 x 20 ml d'eau et 20 ml d'une solution concentrée de
NaCI. Après
séchage sur Na2SO4, l'acétate d'éthyle est évaporé sous vide pour donner 880
mg (81 %)
d'une huile incolore qui cristallise lentement à température ambiante ; p.f. :
97 C.
RMN-1H (100 MHz, CDC13, S) : 7,25 (m, 9H, 2 x Ph) ; 6,55 (bs, OH) ; 4,70 (t,
1H,
CH, J = 7 Hz) ; 3,55 (s, 2H, ÇJJI-Ph) ; 2,98 (m, 4H, pipérazine) ; 2,60 (m,
4H,
pipérazine) ; 1,78 (m, 2H, CEZ-CH3) ; 1,00 (t, 3H, CH2-f~l, J = 7 Hz).
36.3) (t)-2-(1-pipérazinyl)-a-éthyl-benzèneméthanol :
456 mg (1,5 mmol) de 2-(4-benzyl-1-pipérazinyl)-a-éthyl-benzèneméthanol sont
dissous
dans 30 ml d'éthanol et hydrogénés sur Pd/C 10 % à 40 PSI 40 = C dans un
:appareil Parr.Mc
MC
Après 4 heures, le mélange réactionnel est filtré au travers de Celite, et le
filtrat est concentré
sous pression réduite pour donner 330 mg (100 %) de composé titre sous forme
de solide
blanc ; p.f. : 95 C.
RMN-1H (100 MHz, CDC13, S) : 7,21 (m, 4H, Ph) ; 4,72 (t, 1H, CH, J= 7 Hz) ;
3,00 (m, 8H, pipérazine) ; 2,30 (bs, OH) ; 1,80 (m, 2H, fjil-CH3) ; 1,05 (t,
3H,
CH2-Ç~}, J = 7 Hz).
36.4) N-(3-hydroxypropyl)-a-phényl-benzèaeacétamide :
Le composé titre est préparé d'une manière analogue à celle de l'intermédiaire
1.1 sauf que
l'acide diphénylacétique est utilisé à la place de l'acide benzylique ; p.f. :
85 C.
RMN-IH (400 MHz, CDC13, 8) : 7,26 (m, 10H, 2 x Ph) ; 6,18 (m, iH, NH-CO) ;
4,92 (s, 1H, CH) ; 3,55 (m, 2H, Ç~Z-NHCO) ; 3,41 (rn, 2H, CHIOH) ; 3,18 (bs,
OH) ;
1,60 (m, 2H, CH2).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
- 45 -
36.5 ) N-(3-iodopropyl)-a-phényl-benzèneacétamide
Le composé titre est préparé d'une manière analogue à celle de l'intermédiaire
1.2 sauf que le
N-(3-hydroxypropyl)-a-phényl-benzèneacétamide est utilisé à la place du cc-
hydroxy-N-
(3-hydroxypropyl)-a-phényl-benzèneacétamide ; p.f. : 114 C.
RMN-1H (400 MHz, CDC13, S) : 7,30 (m, 10H, 2 x Ph) ; 5,75 (m, 1H, NH-CO) ;
4,92 (s, 1H, CH) ; 3,38 (q, 2H, Çill-NHCO, J= 6,53 Hz) ; 3,09 (t, 2H, CH2I,
J= 6,75 Hz) ; 2,02 (m, 2H, CH2).
36.6) ( )-N-[3-{4-(2-(1-hydroxypropyl)-phényl)-1-pipérazinyl}-propylJ-
a-phényl-benzèneacétamide, fumarate :
710 mg (3,22 mmol) de ( )-2-(1-pipérazinyl)-a-éthyl-benzèneméthanol et 1,21 g
(3,22 mmol) de N-(3-iodopropyl)-a-phényl-benzèneacétamide sont mis au reflux
dans 20 ml
d'acétonitrile pendant 4 heures. Après refroidissement, le solvant est éliminé
sous pression
réduite, et le résidu est traité tel que décrit dans l'exemple 1 sauf pour la
colonne de
chromatographie (éluent : acétate d'éthyle/méthanol : 98/2). L'évaporation des
fractions
collectées sous pression réduite donne 0,74 g (49 %) de la base du composé
titre qui est
convertie en son sel de fumarate en chauffant avec un équivalent d'acide
fumarique dans
l'éthanol absolu ; p.f. : 76 C.
RMN-1H (400 MHz, DMSO d6, 8) : 8,29 (m, 1H, NH-CO) ; 7,41-7,09 (m, 14H,
2 x Ph + Ph-N) ; 6,61 (s, 2H, CH=CH) ; 4,92 (s, 1H, CH) ; 4,85 (m, 1H, ÇU(OH))
3,13 (m, 2H, ÇUI-NHCO) ; 2,95 (m, 2H, pipérazine) ; 2,69 (m, 2H, pipérazine)
2,50 (bs, 4H, pipérazine) ; 2,37 (m, 2H, CH2N) ; 1,55 (m, 4H, ÇHZ + CH2-CH3)
0,86 (t, 3H, CH2-Ç~,â_l, J 7,4 Hz).
Analyse élémentaire pour C30H37N302, fumarate : % Calc : C, 69,49 ; H, 7,03
N, 7,15 ; % obtenus : C, 69,31 ; H, 7,22 ; N, 7,33.
Exemple 37 : ( )-N-[3-{4-(2-(1-méthoxypropyl)-phényl)-1-pipérazinyl}-
propyl]-a-phényl-benzèneacétamide, fumarate (Composé 37) :
37.1) ( )-1-benzyl-4-[2-(1-méthoxypropyl)-phényl]-pipérazine :
Dans un ballon tricol anhydre équipé d'une arrivée d'azote sont dissous 1,55 g
(5 mmol)
d'intermédiaire 36.1 dans 50 ml de DMF sec. 220 mg (5,5 mmol) d'hydrure de
sodium (une
dispersion 60 % dans l'huile) sont ajoutés en une fois et le mélange
réactionnel est agité toute la
nuit à température ambiante avant addition de 0,22 ml (5,5 mmol) de iodure de
méthyle dilué
avec 2 ml de DMF sec. L'agitation est poursuivie pendant 2 autres heures, le
mélange est
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-46-
concentré sous pression réduite et le résidu fractionné entre 50 ml d'acétate
d'éthyle et 25 ml
de NaOH 1N. Après décantation, la phase organique est rincée successivement
avec 25 ml de
NaOH 1N et 25 ml d'une solution concentrée de chlorure de sodium. La
filtration et
l'évaporation du solvent donnent une huile qui est purifiée par
chromatographie flash (éluent :
pétrole léger (bp. 40-65 C) / acétate d'éthyle : 80/20). Les fractions pures
sont collectées et
concentrées pour donner 0,71 g (68 %) d'une huile incolore.
RMN-1H (100 MHz, CDC13, S) : 7,30 (m, 9H, 2 x Ph) ; 4,70 (m, 1H, CH) ; 3,60
(s,
2H, ÇHZ-Ph) ; 3,19 (s, 3H, OCH3) ; 3,10-2,40 (m, 8H, pipérazine) ; 1,70 (m,
2H,
ÇJJZ-CH3) ; 0,92 (t, 3H, CH2-LH3, J 7,0 Hz).
37.2) ( )-1-[2-~1-méthoxypropyl)-phényl]-pipérazine
L'hydrogénation est effectuée telle que décrite pour l'intermédiaire 36.3.
RMN-1H (100 MHz, CDC13, S) : 7,28 (m, 4H, Ph) ; 4,70 (m, 1H, CH) ; 3,18 (s,
3H,
OCH3) ; 3,12-2,70 (m, 8H, pipérazine) ; 1,70 (m, 2H, CH2-CH3) ; 0,92 (t, 3H,
CH2-ÇH~3, J = 7,0 Hz).
37.3) (t)-N-[3-{4-(2-(1-méthoxypropyl)-phényl)-1-pipérazinyl}-propyl]-
a-phényl-benzèneacétamide, fumarate :
Le composé 37 est préparé d'une manière analogue à celle de l'exemple 36 sauf
que la
( )-1-[2-(1-méthoxypropyl)-phényl]-pipérazine est utilisée à la place du ( )-2-
(1-pipérazinyl)-
a-éthyl-benzèneméthanol.
RMN-1H (400 MHz, DMSO d6, S) : 8,31 (m, 1H, NH-CO) ; 7,22 (m, 14H,
2 x Ph + Ph-N) ; 6,61 (s, 2H, CH=CH) ; 4,93 (s, 1H, CH) ; 4,59 (m, 1H,
CH(OCH3)) ; 3,14 (m, 2H, CH2-NHCO) ; 3,07 (s, 3H, OCH3) ; 2,95-2,50 (m, 8H,
pipérazine) ; 2,43 (m, 2H, CH2N) ; 1,60 (m, 4H, CH2 + CH2-CH3) ; 0,86 (t, 3H,
CH2-Ç,â_3, J = 7,33 Hz).
Exemple 38 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyi}-propyl]-
a-méthyl-benzèneacétamide, fumarate (Composé 38) :
Le composé titre est préparé d'une manière analogue à celle de l'exemple 20
sauf que l'acide
( )-2-phénylpropionique est utilisé à la place de l'acide diphénylacétique ;
p.f. : 136 C.
RMN-1H (400 MHz, DMSO d6, S) : 7,97 (m, 1H, NH-CO) ; 7,25 (m, 5H, Ph) ; 7,02
(d,
1H, Ph-CH3, J= 7,5 Hz) ; 6,80 (s, 1H, Ph-CH3) ; 6,78 (d, 1H, Ph-CH3) ; 6,60
(s, 2H,
CH=CH) ; 3,58 (m, 1H, CH) ; 3,07 (m, 2H, Çâ?-NHCO) ; 2,82 (bs, 4H, pipérazine)
;
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-47-
2,57 (bs, 4H, pipérazine) ; 2,39 (m, 2H, CH2-N) ; 2,23 (s, 3H, Ph-Çâ3) ; 2,17
(s, 3H,
Ph-Ç,H-3) ; 1,59 (m, 2H, CH2) ; 1,32 (d, 3H, CH3, J = 7 Hz).
Analyse élémentaire pour C24H33N30, fumarate :% Calc : C, 67,86 ; H, 7,52 ; N,
8,48
% obtenus : C, 67,51 ; H, 7,44 ; N, 8,19.
Exemple 39 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxyméthyl-benzèneacétamide, monochlorhydrate,
0,5 H20 (Composé 39) :
Le composé 39 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-tropique est utilisé à la place de l'acide diphénylacétique ; p.f. : 168-
169 C.
RMN-1H (400 MHz, DMSO d6, S) : 10,77 (bs, 1H, +NH) ; 8,34 (m, 1H, NH-CO) ;
7,28 (m, 5H, Ph) ; 7,06 (d, 1H, M-CH3, J= 7,6 Hz) ; 6,82 (m, 2H, M-CH3) ;
4,48 (bs, 1H, OH) ; 3,96 (m, 1H, CH) ; 3,61 (m, 1H, 1/2 Ç~-i2-OH) ; 3,53 (m,
1H,
1/2 ÇH?-OH) ; 3,45 (m, 2H, +NH-ÇLIZ) ; 3,17 (m, 2H, ÇU2-NH-CO) 3,10 (m, 10H,
pipérazine) ; 2,26 (s, 3H, Ph-Çâ3) ; 2,20 (s, 3H, Ph-ÇH3) ; 1,87 (m, 2H, CH2).
Analyse élémentaire pour C24H33N3O2, HC1, 0,5 H20 :% Calc : C, 65,36 ; H, 8,00
;
N, 9,53 ;% obtenus : C, 65,72 ; H, 7,85 ; N, 9,31.
Exem 1F e 40 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-(x-méthyl-4-méthoxy-benzèneacétamide,
1,25 fumarate, 0,6 H20 (Composé 40) :
40.1) Ethyl-ester de l'acide ( )-a-hydroxy-a-méthyl-4-méthoxy-
benzèneacétique :
L'intermédiaire 40.1 est préparé d'une manière analogue à celle de
l'intermédiaire 31.1 sauf
que la 4-bromoanisole est utilisée à la place du 3-bromochlorobenzène.
RMN-1H (100 MHz, CDC13, 8) : 7,51-6,82 (m, 4H, Ph) ; 4,25 (q, 2H, CH2,
J = 7,0 Hz) ; 3,81 (s, 3H, OCH3) ; 3,65 (s, 1H, OH) ; 1,82 (s, 3H, CH3) ; 1,30
(t, 3H,
CH2-Ç,H3).
40.2) Acide ( )-a-hydroxy-a-méthyl-4-méthoxy-benzèneacétique
L'intermédiaire 40.2 est préparé d'une manière analogue à celle de
l'intermédiaire 31.2 sauf
que l'éthyl-ester de l'acide ( )-a-hydroxy-a-méthyl-4-méthoxy-benzèneacétique
est utilisé à
la place de l'éthyl-ester de l'acide ( )-3-chloro-a-hydroxy-a-méthyl-
benzèneacétique ;
p.f. : 129-130 C.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
- 48
RMN-1H (100 MHz, CDC13, S) : 7,52-6,85 (m, 4H, Ph) ; 4,70 (bs, 2H, OH + CO2H)
3,81 (s, 3H, OCH3) ; 1,75 (s, 3H, CH3).
40.3) (t)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propylJ-a-hydroxy-
a-méthyl-4-méthoxy-benzèneacétamide, 1,25 fumarate, 0,6 H20 :
Le composé 40 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-a-hydroxy-a-méthyl-4-méthoxy-benzèneacétique est utilisé à la place de
l'acide
diphénylacétique ; p.f. : 90-91 C.
RMN-1H (400 MHz, DMSO d6, 8): 8,12 (m, 1H, NH-CO) ; 7,45 (d, 2H, Ph-OCH3,
J= 8,7 Hz) ; 7,06 (d, 1H, Ph-CH3, J 7,57 Hz) ; 6,86 (d, 2H, Pjl-OCH3) ; 6,81
(s,
1o 1H, Ph-CH3) ; 6,76 (d, 1H, Ph-CH3) ; 6,60 (s, 2,5H, 1,25 -CH=CH-) ; 3,71
(s, 3H,
OCH3) ; 3,10 (m, 2H, Ç_HZ-NHCO) ; 2,86 (bs, 4H, pipérazine) ; 2,59 (bs, 4H,
pipérazine) ; 2,41 (m, 2H, CH2-N) ; 2,24 (s, 3H, Ph-.ÇU3) ; 2,17 (s, 3H, Ph-
CH3) ;
1,59 (m, 5H, CH2, CH3).
Analyse élémentaire pour C25H35N303, 1,25 fumarate, 0,6 H20 :% Calc : C, 61,97
;
H, 7,14 ; N, 7,23 ; % obtenus : C, 62,41 ; H, 7,02 ; N, 7,22.
Exemple 41 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-a-hydroxy-
(x-méthyl-4-méthyl-benzèneacétamide, dichlorhydrate
(Composé 41) :
41.1) Ethyl-ester de l'acide ( )-a-hydroxy-a-méthyl-4-méthyl-
benzèneacétique :
L'intermédiaire 41.1 est préparé d'une manière analogue à celle de
l'intermédiaire 31.1 sauf
que le 4-bromotoluène est utilisé à la place du 3-bromochlorobenzène.
RMN-1H (100 MHz, CDC13, 8) : 7,51-7,11 (m, 4H, Ph) ; 4,24 (q, 2H, ÇH2-CH3,
J= 7,0 Hz) ; 3,78 (s, 1H, OH) ; 2,40 (s, 3H, Ph-ÇH.1) ; 1,75 (s, 3H, CH3) ;
1,30 (t,
3H, CH2-CE3).
41.2) - Acide ( )-a-hydroxy-a-méthyl-4-méthyl-benzèneacétique :
L'intermédiaire 41.2 est préparé d'une manière analogue à celle de
l'intermédiaire 31.2 sauf
que l'éthyl-ester de l'acide ( )-a-hydroxy-a-méthyl-4-méthyl-benzèneacétique
est utilisé à la
place de l'éthyl-ester de l'acide (t)-3-chloro-a-hydroxy-a-méthyl-
benzèneacétique
p.f. : 105-106 C.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-49-
RMN-1H (100 MHz, CDC13, 8): 7,55-7,15 (m, 4H, Ph) ; 4,80 (bs, 2H, OH + CO2H)
2,41 (s, 3H, Ph-çH~j) ; 1,81 (s, 3H, CH3).
41.3) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-a-hydroxy-
a-méthyl-4-méthyl-benzèneacétamide, dichlorhydrate :
Le composé 41 est préparé de manière analogue à celle de l'exemple 20 sauf que
l'acide
(t)-a-hydroxy-a-méthyl-4-méthyl-benzèneacétique est utilisé à la place de
l'acide
diphénylacétique ; p.f. : 145-147 C.
RMN-1H (400 MHz, DMSO d6, S) : 10,93 (bs, 1H, +NH) ; 8,12 (m, 1H, NH-CO) ;
7,42 (d, 2H, Ph-C(OH), J = 8 Hz) ; 7,20 (d, 2H, Lâ-C(OH)) ; 7,06 (d, 1H, a-
CH3,
J = 7,9 Hz) ; 6,82 (m, 2H, Ph-CH3) ; 5,23 (bs, OH) ; 3,41 (m, 2H, +NH-ç_Hz)
3,10 (m, 10H, pipérazine + ÇU2-HNCO) ; 2,26 (s, 6H, 2 x Ph-,ÇU.1) ; 2,20 (s,
3H,
Ph-CH~j) ; 1,86 (m, 2H, CH2) ; 1,61 (s, 3H, CH3).
Analyse élémentaire pour C25H35N302, 2 HCl : % Calc : C, 62,23 ; H, 7,73 ; N,
8,71
% obtenus : C, 62,24 ; H, 7,94 ; N, 8,76.
Exemple 42 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-(x-méthyl-1-naphtalèneacétamide, fumarate
(Composé 42) :
42.1) Ethyl-ester de l'acide (t)-a-hydroxy-a-méthyl-1-naphtalèneacétique
L'intermédiaire 42.1 est préparé d'une manière analogue celle de à
l'intermédiaire 31.1 sauf
que le 1 -bromonaphtalène est utilisé à la place du 3-bromochlorobenzène.
RMN-1H (100 MHz, CDC13, 8) : 8,30-7,35 (m, 7H, naphtalène) ; 4,19 (q, 2H, CH2,
J = 7 Hz) ; 3,69 (s, 1H, OH) ; 2,01 (s, 3H, CH3) ; 1,09 (t, 3H, CH2-ç.i3,3.).
42.2) Acide ( )-a-hydroxy-a-méthyl-1-naphtalèneacétique :
L'intennédiaire 42.2 est préparé d'une manière analogue à celle de
l'intermédiaire 31.2 sauf
que l'éthyl-ester de l'acide ( )-a-hydroxy-a-méthyl-1-naphtalèneacétique est
utilisé à la place
de l'éthyl-ester de l'acide ( )-3-chloro-a-hydroxy-a-méthyl-benzèneacétique
p.f. : 152-153 C.
RMN-1H (100 MHz, CD3OD, S) : 8.54 (m, 1H, naphtalène) ; 8.10-7.50 (m, 6H,
naphtalène) ; 2.18 (s, 3H, CH3).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR.97/00615
-50-
42.3) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-a-hydroxy-
a-méthyl-l-naphtalèneacétamide, fumarate :
Le composé 42 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-a-hydroxy-a-méthyl-l-naphtalèneacétique est utilisé à la place de l'acide
diphénylacétique ; p.f. : 136-137 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,41 (d, 1H, naphtalène) ; 8,29 (m, 1H, NH-CO)
;
7,89 (d, 1H, naphtalène, J = 7,39 Hz) ; 7,84 (d, 1H, naphtalène, J = 8,10 Hz)
;
7,63 (d, 1H, naphtalène, J = 7,21 Hz) ; 7,45 (m, 3H, naphtalène) ; 7,01 (d,
1H, pà-CH3,
J = 7,52 Hz) ; 6,79 (s, 1H, P--h- C H 3); 6,74 (d, 1 H, M- C H 3); 6,60 (s,
2H,
-CH=CH-) ; 6,25 (bs, 1H, OH) ; 3,19 (m, 2H, ÇH2-NHCO) ; 2,84 (bs, 4H,
pipérazine) ;
2,56 (bs, 4H, pipérazine) ; 2,43 (m, 2H, CH2-N) ; 2,22 (s, 3H, Ph-ÇH3) ; 2,17
(s, 3H,
Ph- 3) ; 1,83 (s, 3H, CH3) ; 1,66 (m, 2H, CH2).
Analyse élémentaire pour C28H35N302, fumarate :% Calc : C, 68,43 ; H, 7,00
N, 7,48 ; % obtenus : C, 68,58 ; H, 7,16 ; N, 7,53.
Exemple 43 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-(x-méthyl-2-naphtalèneacétamide, 0,75 fumarate
(Composé 43) :
43.1) Ethyl-ester de l'acide ( )-a-hydroxy-a-méthyl-2-naphtalèneacétique :
L'intermédiaire 43.1 est préparé d'une manière analogue à celle de
l'intermédiaire 31.1 sauf
que le 2-bromonaphtalène est utilisé à la place du 3-bromochlorobenzène.
RMN-1H (100 MHz, CDC13, S) : 8,10-7,40 (m, 7H, naphtalène) ; 4,25 (q, 2H, CH2,
J = 7 Hz) ; 3,95 (s, 1H, OH) ; 1,90 (s, 3H, CH3) ; 1,29 (t, 3H, CH2-Çjlâ).
43.2) Acide ( )-a-hydroxy-a-méthyl-2-naphtalèneacétique :
L'intermédiaire 43.2 est préparé d'une manière analogue à celle de
l'intermédiaire 31.2 sauf
que l'éthyl-ester de l'acide ( )-a-hydroxy-a-méthyl-2-naphtalèneacétique est
utilisé à la place
de l'éthyl-ester de l'acide ( )-3-chloro-a-hydroxy-a-méthyl-benzèneacétique
p.f. : 169-170 C.
RMN-1H (100 MHz, CD3OD, S) : 8,75-7,56 (m, 7H, naphtalène) ; 2,05 (s, 3H,
CH3).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
51
43.3) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-a-hydroxy-
a-méthyl-2-naphtalèneacétamide, 0,75 fumarate :
Le composé 43 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-a-hydroxy-a-méthyl-2-naphtalèneacétique est utilisé à la place de l'acide
diphénylacétique ; p.f. : 132-133 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,17 (m, 1H, NH-CO) ; 8,03 (s, 1H, naphtalène)
;
7,89 (m, 3H, naphtalène) ; 7,71 (dd, 1H, naphtalène, J12 = 8,60 Hz, J13 = 1,42
Hz)
7,47 (m, 2H, naphtalène) ; 7,02 (d, 1H, P-h-CH3, J= 7,57 Hz) ; 6,80 (s, 3H, ~h-
-CH3)
6,76 (d, 1H, Ph-CH3) ; 6,61 (s, 1,5H, 0,75 x -CH=CH-) ; 3,12 (m, 2H, Çâ2-NHCO)
lo 2,82 (bs, 4H, pipérazine) ; 2,54 (bs, 4H, pipérazine) ; 2,39 (m, 2H, CH2-N)
; 2,24 (s,
3H, Ph-CH3.) ; 2,16 (s, 3H, Ph-ÇH3) ; 1,73 (s, 3H, CH3) ; 1,16 (m, 2H, CH2).
Analyse élémentaire pour C28H35N302, 0,75 fumarate :% Calc : C, 69,90 ; H,
7,19 ;
N, 7,89 ; % obtenus : C, 69,64 ; H, 7,12 ; N, 7,56.
Exem lR e 44 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-méthyl-1,1'-biphényl-3-acétamide, fumarate
(Composé 44) :
44.1) Ethyl-ester de l'acide ( )-a-hydroxy-a-méthyl-1,1'-biphényl-
3-acétique :
L'intermédiaire 44.1 est préparé d'une manière analogue à celle de
l'intermédiaire 31.1 sauf
que le 3-bromobiphényle est utilisé à la place du 3-bromochlorobenzène.
RMN-1H (100 MHz, CDC13, 8) : 7,80-7,35 (m, 9H, biphényl) ; 4,25 (q, 2H, CH2,
J = 7,0 Hz) ; 3,83 (s, 1H, OH) ; 1,81 (s, 3H, CH3) ; 1,29 (t, 3H, CH2-m3).
44.2) Acide ( )-a-hydroxy-a-méthyl-1,1'-biphényl-3-acétique :
L'intermédiaire 44.2 est préparé d'une manière analogue à celle de
l'intermédiaire 31.2 sauf
que l'éthyl-ester de l'acide ( )-a-hydroxy-a-méthyl-1,1'-biphényl-3-acétique
est utilisé à la
place de l'éthyl-ester de l'acide ( )3-chloro-a-hydroxy-a-méthyl-
benzèneacétique
p.f. : 118-119 C.
RMN-1H (100 MHz, CDC13, 8) : 7,82-7,35 (m, 9H, biphényl) ; 6,20 (bs, 2H, OH,
CO2H) ; 1,90 (s, 3H, CH3).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-52-
44.3) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-a-hydroxy-
a-méthyl-1,1'-biphényl-3-acétamide, fumarate :
Le composé 44 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
(t)-a-hydroxy-a-méthyl-1,1'-biphényl-3-acétique est utilisé à la place de
l'acide
diphénylacétique ; p.f. : 90-91 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,19 (m, 1H, NH-CO) ; 7,83 (s, 1H, biphényl) ;
7,63-7,34 (m, 8H, biphényl) ; 7,02 (d, 1H, n-CH3, J = 7,54 Hz) ; 6,79 (s, 1H,
Eh-CH3) ; 6,75 (d, 1H, Eh-CH3) ; 6,61 (s, 2H, -CH=CH-) ; 3,12 (m, 2H, Çj:jz-
NHCO) ;
2,89 (bs, 4H, pipérazine) ; 2,50 (bs, 4H, pipérazine) ; 2,39 (m, 2H, CH2-N) ;
2,23 (s,
3H, Ph-ÇJJ3.) ; 2,15 (s, 3H, Ph--~_i) ; 1,68 (s, 3H, CH3) ; 1,16 (m, 2H, CH2).
Analyse élémentaire pour C30H37N302, fumarate :% Calc : C, 69,49 ; H, 7,03 ;
N, 7,15 ;
% obtenus : C, 69,65 ; H, 6,94; N, 7,38.
Exemple 45 : S-(+)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-méthyl-benzèneacétamide, fumarate
(Composé 45) :
Le composé 45 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
S-(+)-atrolactique est utilisé à la place de l'acide diphénylacétique ; p.f. :
190-191 C
([a]D = + 10,75 (c = 0,12, EtOH ; temp = 20 C)).
RMN-1H (400 MHz, DMSO d6, S) : 8,09 (m, 1H, NH-CO) ; 7,53 (m, 2H, Ph) ;
7,31 (m, 2H, Ph) ; 7,22 (m, IH, Ph) ; 7,02 (d, 1H, a-CH3, J = 7,57 Hz) ; 6,81
(s,
1H, gh-CH3) ; 6,76 (d, 1H, Ph-CH3) ; 6,60 (s, 2H, -CH=CH-) ; 3,10 (m, 2H,
Ç,HZ-NHCO) ; 2,86 (bs, 4H, pipérazine) ; 2,58 (bs, 4H, pipérazine) ; 2,41 (m,
2H,
CH2-N) ; 2,24 (s, 3H, Ph-CH~i) ; 2,17 (s, 3H, Ph-Çâ_3) ; 1,61 (s, 3H, CH3) ;
1,59 (m,
2H, CH2).
Analyse élémentaire pour C24H33N302, fumarate : % Calc : C, 65,73 ; H, 7,29 ;
N, 8,21 ;% obtenus : C, 65,78 ; H, 7,51 ; N, 8,07.
Exemple 46 : R-(-)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-hydroxy-a-méthyl-benzèneacétamide, 0,8 fumarate
(Composé 46) :
Le composé 46 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
R-(-)-atrolactique est utilisé à la place de l'acide diphénylacétique ; p.f. :
190-191 C
([a]D = -7,25 (c = 0,10, EtOH ; temp = 20 C)).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-53-
Analyse élémentaire pour C24H33N302, 0,8 fumarate :% Calc : C, 66,89 ; H, 7,47
N, 8,60 ;% obtenus : C, 66,43 ; H, 7,25 ; N, 8,56.
Exemple 47 : (f)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-benzylaminocarbonyl-benzèneacétamide, fumarate
(Composé 47)
47.1) Benzyl-ester de l'acide ( )-a-benzylaminocarbonyl-benzèneacétique
4,05 g (15 mmol) du monobenzyl-ester de l'acide phénylmalonique, 1,64 ml (15
mmol) de
benzylamine et 2,23 g (16,5 mmol) d'hydroxybenzotriazole sont dissous dans 40
ml de
dichlorométhane. Après refroidissement jusqu'à 0-5 C, 3,4 g (16,5 mmol) de
dicyclohexylcarbodiimide sont ajoutés en une fois, et l'agitation est
poursuivie à 20 C pendant
4 heures. Le précipité blanc formé durant la réaction est filtré, et le
filtrat est successivement
rincé avec NaOH 1N (2 x 50 ml) et une solution saturée de chlorure de sodium
(50 ml).
Après séchage sur du sulphate de sodium, le solvant est évaporé, et le résidu
est précipité en
présence de dichlorométhane. Une filtration donne 3,19 g (59 %) d'une poudre
blanche ;
p.f. : 150-151 C.
RMN-1H (100 MHz, CD3OD, S) : 7,70-7,35 (m, 15H, Ph) ; 5,35 (s, 2H, CH2-O) ;
5,05 (s, 1H, CH) ; 4,51 (d, 2H, CH2-N).
47.2) Acide ( )-cc-benzylaminocarbonyl-benzèneacétique :
Dans une bouteille Parr sont introduits 1 g (2,78 mmol) de benzyl-ester de
l'acide
( )-a-benzylaminocarbonyl-benzèneacétique dissous dans un mélange de 40 ml
d'éthanol et
ml d'acide acétique et 200 mg de Pd/C 10 %. L'hydrogénation est effectuée sous
15 PSI
H2 à 30 C. Après 15 heures d'agitation, le mélange est filtré au travers de
Celite, et le filtrat
est concentré sous pression réduite. Le résidu est fractionné entre 30 ml de
diéthyléther et
30 ml d'une solution saturée de NaHCO3. L'extrait aqueux est décanté et rincé
avec 30 ml de
25 diéthyléther. Après acidification avec HCI 3N à 0 C, la phase aqueuse est
extraite avec
2 x 30 ml de diéthyléther. La solution éthérée est séchée sur du sulfate de
sodium, filtrée, et le
solvant évaporé pour donner 451 mg (60 %) d'une poudre blanche ; p.f. : 132-
133 C.
RMN-iH (100 MHz, CD3OD, S) : 7,70-7,35 (m, 10H, Ph) ; 4,80 (s, 1H, CH) ; 4,57
(m,
2H, CH2-N).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97100615
54
47.3) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-benzylaminocarbonyl-benzèneacétamide, fumarate :
Le composé 47 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-a-benzylaminocarbonyl-benzèneacétique est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 90-91 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,69 (m, 1H, NH-CH2Ph) ; 8,26 (m, 1H, NH-CO) ;
7,32 (m, 10H, 2 x Ph) ; 7,02 (d, 1H, n-CH3, J 7,51 Hz) ; 6,80 (s 1H, pjl-CH3)
6,76 (d, 1H, a-CH3) ; 6,61 (s, 2H, -CH=CH-) ; 4,47 (s, 1H, CH) ; 4,31 (m, 2H,
NH-Ç,H,-Ph) ; 3,15 (m, 2H, Ç-I2-NHCO) ; 2,83 (bs, 4H, pipérazine) ; 2,58 (bs,
4H,
pipérazine) ; 2,42 (m, 2H, CH2-N) ; 2,23 (s, 3H, Ph-Lâ3) ; 2,17 (s, 3H, Ph-
Ç.â3)
1,63 (m, 2H, CH2).
Analyse élémentaire pour C31H38N402, fumarate : % Calc : C, 68,38 ; H, 6,89
N, 9,11 ; % obtenus : C, 68,70 ; H, 7,06 ; N, 8,81.
Exemple 48 : ( )-N-[3-{4-(2,5-diméthylphényl)-lpipérazinyl}-propyl]-
a-(4-méthylphényl)-sulfonylamino-benzèneacétamide,
1,5 HCI, 0,5 H20 (Composé 48) :
48.1) Acide ( )-(4-méthylphényl)-sulfonylamino-benzèneacétique :
L'intermédiaire 48.1 est préparé d'une manière analogue à celle de
l'intermédiaire 33.1 sauf
que le chlorure de p-toluènesulfonyle est utilisé à la place du chlorure de
méthanesulfonyle ;
p.f. : 188-189 C.
RMN-1H (100 MHz, CD3OD, S) : 7,65 (m, 4H, p-toluène) ; 7,42 (s, 5H, Ph) ; 5,09
(d,
1H, CH) ; 2,55 (s, 3H, CH3).
48.2) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-(4-méthylphényl)-sulfonylamino-benzèneacétamide, 1,5 HCI,
0,5 H20
Le composé 48 est préparé d'une manière analogue à l'exemple 20 sauf que
l'acide
( )-(4-méthylphényl)-sulfonylamino-benzèneacétique est utilisé à la place de
l'acide
diphénylacétique ; p.f. : 180-181 C.
RMN-1H (400 MHz, DMSO d6, S) : 11,19 (bs, 1H, +NH) ; 8,54 (m, 2H, NH-CO,
NH-S02) ; 7,63 (m, 2H, Ph-S02) ; 7,26 (m, 7H, Ph-S02, Ph) ; 7,06 (d, 1H, Eh-
CH3,
J= 7,05 Hz) ; 6,83 (bs, 2H, Ph-CH3) ; 4,92 (d, 1H, CH, J= 8,80 Hz) ; 3,37 (m,
2H,
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-55-
+NH-Ç,H2) ; 3,12 (bs, 4H, pipérazine) ; 2,97 (m, 6H, pipérazine, ÇUZ-NHCO) ;
2,35 (s,
3H, LIII-PhSO2) ; 2,26 (s, 3H, Ph-L-H-3) ; 2,20 (s, 3H, Ph-~Ç-H-.j) ; 1,77 (m,
2H, CH2).
Analyse élémentaire pour C30H38N403S, 1,5 HCI, 0,5 H20 :% Calc : C, 60,21
H, 6,82 ; N, 9,36 ; S, 5,36 ; % obtenus : C, 60,59 ; H, 6,81 ; N, 9,21 ; S,
5,69.
Exemple 49 : (t)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-benzylcarbonylamino-benzèneacétamide, fumarate, 0,5 H20
(Composé 49) :
49.1) Acide ( )-a-benzylcarbonylamino-benzèneacétique :
L'intermédiaire 49.1 est préparé d'une manière analogue à celle de
l'intermédiaire 33.1 sauf
que le chlorure de phénylacétyle est utilisé à la place du chlorure du
méthanesulfonyle.
RMN-1H (100 MHz, CDC13, S) : 8,80 (bs, 1H, CO2H) ; 7,30 (bs, 10H, 2 x Ph) ;
5,52 (d, 1H, NHCO, J = 7,0 Hz) ; 3,60 (m, 3H, CH + CH2).
49.2) (t)-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-benzylcarbonylamino-benzèneacétamide, fumarate, 0,5 H20
Le composé 49 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
( )-a-benzylcarbonylamino-benzèneacétique est utilisé à la place de l'acide
diphénylacétique ;
p.f. : 158-159 C.
RMN-1H (400 MHz, DMSO d6, 8). 8,73 (d, 1H, CH-EH-CO, J = 8,0 Hz) ; 8,32 (m,
1H, NH-CO) ; 7,42-7,20 (m, 10H, 2 x Ph) ; 7,02 (d, 1H, Ph-CH3, J = 7,52 Hz) ;
6,80 (s, 1H, Ph-CH3) ; 6,75 (d, 1H, Ph-CH3) ; 6,61 (s, 2H, -CH=CH-) ; 5,43 (d,
1H,
CH) ; 3,56 (s, 2H, ~?-Ph) ; 3,10 (m, 2H, ÇHI-NHCO) ; 2,80 (bs, 4H, pipérazine)
;
2,50 (bs, 4H, pipérazine) ; 2,34 (m, 2H, CH2-N) ; 2,23 (s, 3H, Ph-Çu3) ; 2,17
(s, 3H,
Ph-Ç-I ~,â) ; 1,58 (m, 2H, CH2).
Analyse élémentaire pour C31H38N402, fumarate, 0,5 H20 :% Calc : C, 67,40 ;
H, 6,95 ; N, 8,98 ; % obtenus : C, 67,57 ; H, 6,86 ; N, 8,98.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-56-
Exemple 50 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-benzylaminocarbonyl-a-méthyl-benzèneacétamide, fumarate,
0,5 H20 (Composé 50) :
50.1) Diéthyl-ester de l'acide ( )-a-méthyl-phénylmalonique
L'intermédiaire 50.1 est préparé d'une manière analogue à celle de l'exemple
11 sauf que le
diéthyl-ester de l'acide phénylmalonique est utilisé à la place du (t)-N-
[3- { 4-(2,5-diméthylphényl)-1-pipérazinyl }-propyl]-a-hydroxy-a-phényl-
benzèneacétamide.
RMN-1H (100 MHz, CDC13, S) : 7,39 (bs, 5H, Ph) ; 4,28 (q, 4H, OCH2, J = 7,0
Hz) ;
1,88 (s, 3H, CH3) ; 1,26 (t, 3H, CH2-~3-).
50.2) Monoéthyl-ester de l'acide ( )-a-méthyl-phénylmalonique :
L'intermédiaire 50.2 est préparé d'une manière analogue à l'intermédiaire 31.2
sauf que le
diéthyl-ester de l'acide ( )-a-méthyl-phénylmalonique est utilisé à la place
de l'éthyl-ester de
l'acide ( )-3-chloro-a-hydroxy-a-méthyl-benzèneacétique.
RMN-1H (100 MHz, CDC13, S) : 9,38 (bs, 1H, CO2H) ; 7,38 (m, 5H, Ph) ; 4,25 (q,
2H,
OCH2, J= 7,0 Hz) ; 1,90 (s, 3H, CH3) ; 1,28 (t, 3H, CH2-Câ3).
50.3) Ethyl-ester de l'acide ( )-a-benzylaminocarbonyl-a-méthyl-
benzèneacétique :
L'intermédiaire 50.3 est préparé d'une manière analogue à celle de
l'intermédiaire 47.1 sauf
que le monoéthyl-ester de l'acide ( )-a-méthyl-phénylmalonique est utilisé à
la place du
monobenzyl-ester de l'acide phénylmalonique.
RMN-1H (100 MHz, CDC13, S) : 7,30 (m, 10H, 2 x Ph) ; 6,82 (m, 1H, NH-CO) ;
4,48 (m, 2H, CH2) ; 4,27 (q, 2H, OCH2, J= 7,0 Hz) ; 1,87 (s, 3H, CH3) ; 1,26
(t,
3H, CH2-Ç,âl).
50.4) Acide( )-a-benzylaminocarbonyl-a-méthyl-benzèneacétique :
L'intermédiaire 50.4 est préparé d'une manière analogue à celle de
l'intermédiaire 31.2 sauf
que l'éthyl-ester de l'acide (f)-a-benzylaminocarbonyl-a-méthyl-
benzèneacétique est utilisé à
la place de l'éthyl-ester de l'acide (f)-3-chloro-a-hydroxy-a-méthyl-
benzèneacétique.
RMN-1H (100 MHz, CDC13, S) : 7,25 (m, 10H, 2 x Ph) ; 6,26 (m, 1H, NH-CO) ;
4,45 (m, 2H, CH2) ; 1,95 (s, 3H, CH3).
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-57-
50.5) ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-benzylaminocarbonyl-a-méthyl-benzèneacétamide, fumarate,
0,5 H2C? :
Le composé 50 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
(t)-a-benzylaminocarbonyl-a-méthyl-benzèneacétique est utilisé à la place de
l'acide
diphénylacétique p.f. : 159-160 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,40 (m, 1H, PhCH2-nâ-CO) ; 7,93 (m, 1H,
NH-CO) ; 7,26 (m, 10H, 2 x Ph) ; 7,02 (d, 1H, Ph-CH3, J 7,52 Hz) ; 6,79 (s,
1H,
Ph.-CH3) ; 6,75 (d, 1H, Eh-CH3) ; 6,61 (s, 2H, -CH=CH-) ; 4,33 (d, 2H, Çâj-Ph,
J= 5,85 Hz) ; 3,19 (m, 2H, ÇJ3.2-NHCO) ; 2,79 (bs, 4H, pipérazine) ; 2,54 (bs,
4H,
pipérazine) ; 2,39 (m, 2H, CH2-N) ; 2,24 (s, 3H, Ph-ÇU3) ; 2,17 (s, 3H, Ph-
Çji3-)
1,71 (s, 3H, CH3) ; 1,63 (m, 2H, CH2).
Analyse élémentaire pour C32H40N402, fumarate, 0,5 H20 :% Calc : C, 67,80;
H, 7,11 ; N, 8,78 ; % obtenus : C, 68,20 ; H, 7,08 ; N, 8,91.
Exem lp e 51 :( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-méthoxy-a-méthyl-benzèneacétamide, 0,5 fumarate
(Composé 51) :
Le composé 51 est préparé d'une manière analogue à celle de l'exemple 11 sauf
que la (t)-N-
[3- { 4-(2,5-diméthylphényl)-1-pipérazinyl } -propyl]-a-hydroxy-a-méthyl-
benzèneacétamide
est utilisée à la place de la ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-
propyl]-
a-hydroxy-a-phényl-benzèneacétamide ; p.f. : 172,5-173,5 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,16 (m, 1H, NH-CO) ; 7,35 (m, 5H, pH) ; 7,02
(d,
1H, n-CH3, J= 7,54 Hz) ; 6,80 (s, 1H, a-CH3) ; 6,75 (d, 1H, Ejl,-CH3) ; 6,60
(s,
1H, 0,5 x-CH=CH-) ; 3,13 (m, 5H, ~Il2-NHCO + OCH3) ; 2,84 (bs, 4H, pipérazine)
;
2,54 (bs, 4H, pipérazine) ; 2,37 (m, 2H, CH2-N) ; 2,23 (s, 3H, Ph- 3) ; 2,18
(s, 3H,
Ph- 3) ; 1,64 (s, 3H, CH3) ; 1,61 (m, 2H, CH2).
Analyse élémentaire pour C25H35N302, 0,5 fumarate : % Calc : C, 69,35 ; H,
7,98
N, 8,99 ;% obtenus : C, 69,34 ; H, 7,99 ; N, 8,69.
Exem in e 52 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
a-benzyloxy-a-méthyl-benzèneacétamide, 0,5 fumarate
(Composé 52) :
Le composé 52 est préparé d'une manière analogue à celle de l'exemple 11 sauf
que la (t)-N-
[3-{4-(2,5-diméthylphényl)-1-pipérazinyl }-propyl]-a-hydroxy-a-méthyl-
benzèneacétamide et
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-58-
le bromure de benzyle sont utilisés à la place de la (t)-N-[3-{4-(2,5-
diméthylphényl)-
1-pipérazinyl}-propyl]-a-hydroxy-a-phényl-benzèneacétamide et de l'iodure de
méthyle ;
p.f. : 153-154 C.
RMN-iH (400 MHz, DMSO d6, S) : 7,94 (m, 1H, NH-CO) ; 7,50-7,26 (m, 10H,
2 x Ph) ; 7,00 (d, 1H, ph-CH3, J = 7,46 Hz) ; 6,74 (d, 1H, pj1-CH3) ; 6,71 (s,
1H,
p11-CH3) ; 6,61 (s, 1H, 0,5 x -CH=CH-) ; 4,35 (AB, 2H, -~Z-Ph, JAB = 12,25 Hz)
;
3,17 (m, 2H, ÇH--Z-NHCO) ; 2,73 (bs, 4H, pipérazine) ; 2,50 (bs, 4H,
pipérazine) ;
2,34 (m, 2H, CH2-N) ; 2,22 (s, 3H, Ph-~3) ; 2,15 (s, 3H, Ph-ç.â3_) ; 1,74 (s,
3H,
CH3) ; 1,61 (m, 2H, CH2).
i0 Analyse élémentaire pour C31H39N3O2, 0,5 fumarate : % Calc : C, 72,90 ; H,
7,60 ;
N, 7,73 ; % obtenus : C, 73,01 ; H, 7,46 ; N, 7,27.
Exemple 53 : ( )-3,4-dichloro-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-
propyl]-a-hydroxy-a-méthyl-benzèneacétamide, fumarate
(Composé 53) :
Le composé 53 est préparé d'une manière analogue à celle de l'exemple 31 sauf
que le
1-bromo-3,4-dichlorobenzène est utilisé à la place du 3-bromochlorobenzène ;
p.f. : 174-175 C.
RMN-iH (400 MHz, DMSO d6, S) : 8,19 (m, 1H, NH-CO) ; 7,73 (d, 1H, Ph-Cl,
J = 1,17 Hz) ; 7,59 (d, 1H, PhCI, J = 8,44 Hz) ; 7,50 (dd, 1H, PhCI) ; 7,02
(d, 1H,
Eh-CH3, J 7,52 Hz) ; 6,81 (s, 1H, Ph-CH3) ; 6,76 (d, 1H, Ph.-CH3) ; 6,60 (s,
2H,
-CH=CH-) ; 3,10 (m, 2H, ÇH2-NHCO) ; 2,85 (bs, 4H, pipérazine) ; 2,56 (bs, 4H,
pipérazine) ; 2,38 (m, 2H, CH2-N) ; 2,24 (s, 3H, Ph-ÇU3) ; 2,17 (s, 3H, Ph-
ÇJJ3) ;
1,59 (m, 5H, CH3 + CH2).
Analyse élémentaire pour C24H31C12N3O2, fumarate : % Calc : C, 57,93 ; H, 6,08
;
N, 7,24 ; % obtenus : C, 57,99 ; H, 6,24 ; N, 7,03.
Exemple 54 : ( )-N-[3-{4-(2,5-diméthylphényl)-1-pipérazinyl}-propyl]-
2-hydroxy-2-méthyl-propionamide, fumarate (Composé 54) :
Le composé 54 est préparé d'une manière analogue à celle de l'exemple 20 sauf
que l'acide
2-hydroxyisobutyrique est utilisé à la place de l'acide diphénylacétique ;
p.f. : 150-151 C.
RMN-iH (400 MHz, DMSO d6, S) : 7,85 (m, 1H, NH-CO) ; 7,02 (d, 1H, pjZ-CH3,
J = 7,52 Hz) ; 6,81 (s, 1H, P_h-CH3) ; 6,76 (d, 1H, ~i] -CH3) ; 6,60 (s, 2H, -
CH=CH-) ;
3,13 (m, 2H, CH2-NHCO) ; 2,88 (bs, 4H, pipérazine) ; 2,67 (bs, 4H, pipérazine)
;
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-59-
2;38 (m, 2H, CH2-N) ; 2,24 (s, 3H, Ph-Ç-U3) ; 2,18 (s, 3H, Ph-ÇUI) ; 1,66 (m,
2H,
CH2) ; 1,24 (s, 6H, 2 x CH3).
Analyse élémentaire pour C19H31N3O2, fumarate : % Calc : C, 61,45 ; H, 7,85
N, 9,35 ; % obtenus : C, 61,00 ; H, 7,89 ; N, 9,22.
Exemple 55 : ( )-N-[3-{4-(2-(cyclopropylhydroxyméthyl)-phényl)-
1-pipérazinyl}-propyl]-a-phényl-benzèneacétamide,
1,25 fumarate, 0,5 H20 (Composé 55) :
Le composé 55 est préparé d'une manière analogue à celle de l'exemple 36 sauf
que le
bromure de cyclopropylmagnésium est utilisé à la place du bromure
d'éthylmagnésium ;
lo p.f. : 151-152 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,31 (m, 1H, NH-CO) ; 7,49-7,09 (m, 14H,
3 x Ph) ; 6,61 (s, 2,5H, 1,25 x-CH=CH-) ; 4,92 (s, 1H, Ph-ÇW ; 4,51 (d, 1H,
ÇU-(OH), J = 6,71 Hz) ; 3,13 (m, 2H, Cj3.Z-NHCO) ; 3,00 (bs, 2H, pipérazine) ;
2,72 (bs, 2H, pipérazine) ; 2,58 (bs, 4H, pipérazine) ; 2,41 (m, 2H, CH2-N) ;
1,63 (m,
2H, CH2) ; 1,05 (m, 1H, CH) ; 0,36 (m, 4H, cyclopropane).
Analyse élémentaire pour C31H37N302, 1,25 fumarate, 0,5 H20 :% Calc : C,
67,80; H,
6,80; N, 6,59 ;% obtenus : C, 68,21 ; H, 6,82; N, 6,12.
Exemple 56 : (t)-N-[3-{4-(2-(propyl)-phényl)-1-pipérazinyl)-propyl]-
a-hydroxy-a-phényl-benzèneacétamide, 0,75 fumarate
(Composé 56) :
56.1) (Z,E)-1-benzyl-4-[2-(1-propényl)-phényl]-pipérazine
Dans un ballon tricol anhydre pourvu d'une arrivée d'azote contenant 80 ml de
THF sec sont
introduits 5,7 g (15,3 mmol) de bromure d'éthyltriphénylphosphonium. A ce
mélange sont
ajoutés goutte à goutte, à 20 C, 8,45 ml (16,9 mmol) d'une solution de
phényllithium (2 M
dans cyclohexane/diéthyléther : 7,3). L'agitation est poursuivie pendant une
heure et à ce
mélange d'un rouge foncé, refroidi à 0 C, est ajoutée goutte à goutte une
solution de 4,3 g
(15,3 mmol) de l'intermédiaire 36.1 dans 30 ml de THF sec. Après agitation
toute la nuit, le
précipité est filtré et rincé avec de l'acétate d'éthyle. Le filtrat est
concentré sous vide, et le
résidu huileux marron est soumis à chromatographie sur gel de silice (éluent :
pétrole léger
(bp. 40-65 C) / acétate d'éthyle : 90/10) pour donner 2,71 g (60 %) d'une
huile pure jaune
pâle.
CA 02251016 2006-01-09
WO 97/37983 PGT/FR97/00615
-60-
RMN-1H (100 MHz, CDCI3, S) : 7,45-6,90 (m, 9H, 2 x Ph) ; 6,60 (m, 1H,
Ph-CH=fJL-) ; 6,20 (m, 1/2 CH, 1/2 x Ph-CH=-CU-) ; 5,79 (m, 1/2 CH,
1/2 x Ph-CH=M-) ; 3,60 (m, 2H, LU2-Ph) ; 3,00 (m, 4H, pipérazine) ; 2,60 (m,
4H,
pipérazine) ; 1,90 (m, 3H CH3).
56.2) 1-[2-(1-propényl)-phényl]-pipérazine :
Un mélange de 2,71 g (9,3 mmol) de (Z,E)-1-benzyl-4-[2-(1-propényl)-phényl]-
pipérazine et
100 mg de Pd/C 10 % dans 30 ml d'éthanol sont hydrogénés sous 40 PSI H2 à 40
C
pendant 15 heures dans un appareil Parr. Puis le mélange réactionnel est
filtré sur une couche
MC
de Celite, et le solvant est évaporé sous pression réduite pour donner 1,78 g
(94 %) d'une
poudre blanche ; p.f. : 145-146 C.
RMN-IH (100 MHz, CDC13, S) : 7,18 (m, 4H, Ph) ; 4,55 (bs, NH) ; 3,30-2,90 (m,
8H,
pipérazine) ; 2,60 (m, 2H, ÇJjj-Ph) ; 1,68 (m, 2H, CH2) ; 1,00 (t, 3H, CH3,
J = 7,0 Hz).
56.3) (t)-N-[3-{4-(2-(propyl)-phényl)-1-pipérazinyl}-propyl]-a-hydroxy-
a-phényl-benzèneacétamide, 0,75 fumarate :
Le composé 56 est préparé d'une manière analogue à celle de l'exemple 1 sauf
que la
(t)-1-[2-(1-propényl)-phényl]-pipérazine est utilisée à la place de la 1-(3-
méthylphényl)-
pipérazine ; p.f. : 152-153 C.
RMN-1H (400 MHz, DMSO d6, S) : 8,37 (m, IH, NH-CO) ; 7,40-6,99 (m, 14H,
3 x Ph) ; 6,60 (s, 1,5H, 0,75 x -CH=CH-) ; 3,20 (m, 2H, ÇJJLZ-NHCO) ; 2,84 (m,
4H,
pipérazine) ; 2,59 (m, 6H, pipérazine + Ph-fJj2) ; 2,44 (m, 2H, CH2-N) ; 1,67
(m, 2H,
CH2) ; 1,60 (m, 2H, CIIZ-CH3) ; 0,92 (t, 3H, CH3, J = 7,46 Hz).
Analyse élémentaire pour C30H37N302, 0,75 fumarate : 96 Calc : C, 70,94 ; H,
7,22 ;
N, 7,52 ; b obtenus : C, 70,71 ; H, 7,28 ; N, 7,07.
Essai de liaison au récepteur al-adrénergique :
L'affinité de composés variés de l'invention pour les récepteur al-
adrénergiques est déterminée
en mesurant l'inhibition de la liaison de la [3H]prazosine (DuPont NEN, Les
Ulis, France) au
cortex cérébral de rat selon une méthode dérivée de celle de Morrow et Creese,
Mol.
Pharmacol. 29:321 (1986). Les cortex cérébraux de rats mâles Sprague Dawley
sont
homogénéisés à 4 C dans Tris-HCI 50 mM pH = 7,7 et centrifugés à 50 000 g
pendant
30 minutes à 4 C. Les culots sont à nouveau mis en suspension dans le même
tampon et
centrifugés à nouveau à 50 000 g pendant 30 minutes à 4 C.
i
CA 02251016 2005-02-21
WO 97/37983 PCT/FR971b0615
-61-
L'inhibition compétitive de la liaison de 0,2 nM [3H]prazosine est effectuée
en triple avec des
composés tests non étiquetés de l'invention dans des concentrations variant de
10-i1M à 10-21VI.
Des membranes de cortex cérébral de rat (5 mg (humide) / ml) sont incubées
pendant
30 minutes à 25 C dans Tris-HC150 mM, pH = V. La [3H)prazosine liée est
séparée de la
[3H]prazosine libre par filtration immédiate au travers de Fltres en fibres de
verre
Whatman GFB en utilisant des récupérateurs de cellules Brandel ~Les filtres
sont rincks trois
fois avec le même tampon à 0-4 C et on teste leur radioactivité par
spectrométrie liquide à
scintiUation.
Les liaisons spécifiques sont obtenues en soustrayant les liaisons non-
spécifiques (déterminées
i0 en présence de 10 M de phentolamine (Sigma Chemical Co., St. Louis MO))
des liaisons
totales. Les données relatives aux liaisons sont analysées par analyse par
régression
non-linéaire itérative assistée par ordinateur, en utilisant le programme
Ligand (Munson, PJ.,
Rodbard, D. Anal. Biochem. 107:220 (1980)).
L'ICgO (concentration nécessaire pour inhiber 50 % des liaisons spécifiques)
de chacun des
composés tests est donnée en Tableau L
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-62-
TABLEAU I
AFFINITÉ DE LIAISON DU RÉCEPTEUR a1.ADRÉNERGIQUE
Composé No. Ki (nM) Composé No. Ki (nM)
1 51 29 67
2 30 30 44
3 60 31 43
4 66 32 51
60 33 40
6 480 34 45
7 30 35 90
8 16 36 170
9 28 38 30
27 39 27
11 38 40 38
13 30 41 27
14 27 42 22
27 43 29
16 41 44 73
17 54 45 13
18 55 46 48
19 60 47 14
27 48 29
21 64 49 50
22 25 50 50
23 98 51 110
24 69 52 51
29 54 280
26 74 55 300
27 31 56 25
28 36
CA 02251016 2005-02-21
WO 97137983 -63 PCT/FR97I~0061s
-
Essai de contraction de l'urètre :
Les urètres sont extraites de lapins mâles New Zealand, et nettoyées des
tissus connexes
environnants. Des bandes d'urètres de la prostate (3 mm de large, 10-15 mm de
long) sont
suspendues (1 g de tension) dans des bains pour organes contenant 10 ml de
solution
physiologique (pH 7,4) à 37 C sous une atmosphère de 95 % 02 / 5 % CO2 ; NaC1
(118 mM) ; KC1 (4,7 mM) ; CaC12 (2,5 mM) ; KH2PO4 (1,2 mM) ; MgSO4 (1,2 mM) ;
NaHCO3 (25 mM) ; glucose (11 mM). Des réponses contractiles sont mesurées en
utilisant
des transducteurs à déplacement de force ("force displacement transducers")
couplés à un
polygraphe Gould 8000S. Une période d'équilibration ou équilibrage d'une heure
est prévue
i0 avant l'expérimentation. Après l'équilibrage, les préparations sont
sensibilisées par une
concentration submaximale de phényléphrine. Quarante cinq minutes après la
sensibilisation,
une courbe concentration-effet pour la phényléphrine est établie. Afin de
déterminer l'effet des
composés tests, différentes préparations provenant du même animal sont
utilisées en parallèle.
Une préparation sert de conts8le alors que les autres recoivent une
concentration d'un composé
test introduit dans le bain 30 minutes avant la phényléphrine (Auguet, M., et
al., European
J. Pharmacol. 217:153 (1995)).
l.es constantes de dissociation (Kb) des composés -tests sont déternzinées en
utilisant l'équation
suivante : Kb =[B] 1(rapport dosique - 1) ; dans iaqirelle [B] est la
concentration du
composé test et (rapport dosique) est l'EC50 de la phényléphrine en présence
du composé test
divisée par l'EC50 de la préparation de contrôle. Ces résultats sont ensuite
exprimés comme le
logarithme négatif du Kt,. Les valeurs d'ECgp sont calculées à partir de la
réponse contractile
maximum à la phényléphrine par analyse par ordinateur en utilisant une
régression linéaire sur
les valeurs de tension moyennes. La réponse contractile maximale de chaque
préparation qui a
été soumise au composé test est déterminée en comparant la réponse provoquée
par l'application
de la concentration sensibilisante de phényléphrine avec la réponse provoquée
dans la
pnsparation de contrôle (qui n'a pas reçu les composés tests).
Les résultats obtenus pour les composés test sont donnés en Tableau II.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-64-
TABLEAU II
INHIBITION DE LA CONTRACTION DE L'URETRE
Composé N -log Kb
2 8
7 8,1
8 8,2
9 8,1
8,2
11 6,9
13 8,2
14 7,8
7,9
16 7,8
17 7,7
7,5
22 8,3
7,6
27 7,6
38 7,5
39 7,3
42 7,68
45 8,3
46 7,5
47 7,07
48 7,02
50 6,92
Essai de contraction de la veine portale et de l'aorte de rat :
L'aorte et la veine portale sont extraites de rats mâles Sprague Dawley (275 -
350 g,
5 Charles River, France) après dislocation cervicale et nettoyées des tissus
connexes
environnants. Des bandes longitudinales (une par animal) de la veine portale
(3 mm de large,
10 - 15 mm de long) et des anneaux dénudés de l'endothélium (= 2 mm de large)
de l'aorte
sont suspendus (tension : veine portale = 0,5 g; aorte = 2 g) dans des bains
pour organes
contenant 10 ml de solution physiologique (composée de NaCI (118 mM), KC1 (4,7
mM),
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-65-
CaC12 (2,5 mM), KH2PO4 (1,2 mM), MgSO4 (1,2 mM), NaHCO3 (25 mM), glucose
(11 mM)) à 37 C et gazée avec 95 % 02 / 5 % C02. Des réponses contractiles
sont
mesurées en utilisant des transducteurs à déplacement de force soit couplés à
un polygraphe
Gould 8000S, soit connectés à un système de récupération de données (IOS, Dei
Lierre,
Mitry-Mory, France). Une période d'équilibrage ou équilibration d'une heure
est prévue avant
l'expérimentation. Après l'équilibration, les préparations sont sensibilisées
avec une
concentration submaximale de phényléphrine (1 M pour l'aorte ; 3 M pour la
veine
portale). Lorsque la contraction provoquée par la phényléphrine est stable, un
défaut de
relaxation après addition de carbachol (10 M) indique une désorganisation
réussie de
l'endothélium de l'aorte. Soixante-quinze minutes après la sensibilisation,
une courbe
concentration-effet pour la phényléphrine est établie. Pour déterminer l'effet
des composés
tests, différentes préparations sont utilisées en parallèle. L'une sert de
contrôle, alors que les
autres reçoivent les diffférents composés tests introduits dans le bain 60
minutes avant
l'administration de phényléphrine.
Les résultats sont exprimés comme des moyennes S.E.M. ou pourcentage de
contraction. La
réponse contractile maximum de chaque préparation qui a été soumise à un
composé test est
déterminée en comparant la réponse provoquée par l'application de la
concentration
sensibilisante de phényléphrine avec la réponse provoquée dans la préparation
contrôle (qui n'a
reçu que la phényléphrine). Les valeurs d'EC50 sont calculées à partir de la
réponse contractile
maximum par analyse par ordinateur en utilisant une régression linéaire sur
les valeurs de
tension moyennes. Les constantes de dissociation (Kb) des composés tests sont
déterminées
pour chaque composé test selon l'équation suivante : Kb =[B] / (rapport
dosique - 1) ;
dans laquelle [B] est la concentration du composé test et (rapport dosique)
est 1'EC50 de
l'agoniste en présence du composé test divisée par l'EC50 contrôle. Le tableau
III donne le Kb
du composé 45 et de l'ai-antagoniste, la Prazosine (Sigma, Clery en Vescin,
France).
TABLEAU III
Composé 45 Prazosine
Kb (Aorte) 45 nM 5 M
K(Veine portale) 1,4 nM 400 pM
Sélectivité 32 0,01
Kb (Aorte) / Kb (Veine)
Essai de contraction de l'aorte et de la veine portale du lapin
L'aorte et la veine portale sont extraites de lapins mâles New Zealand (2,5 -
3,5 kg, Dombes
Romans, France) après dislocation cervicale, et nettoyées des tissus connexes
environnants.
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-66-
Des bandes longitudinales (4 par animal - 3 mm de largeur, 10 à 15 mm de long)
ou des
anneaux dénudés de l'endothélium (1 mm de large) de l'aorte sont suspendus
(tension : veine
portale = 0,5 g; aorte = 2 g) dans des bains pour organes contenant 10 ml de
solution
physiologique (composée de NaCI (118 mM), KCl (4,7 mM), CaC12 (2,5 mM), KH2PO4
(1,2 mM), MgSO4 (1,2 mM), NaHCO3 (25 mM), glucose (11 mM)) à 37 C et gazés
avec
95 % 02 / 5 % C02. Des réponses contractiles sont mesurées en utilisant des
transducteurs à
déplacement de force couplés à un polygraphe Gould RS3400. Une période
d'équilibration ou
équilibrage de une heure est prévue avant expérimentation. Après équilibrage,
les préparations
sont sensibilisées avec une concentration submaximale de phényléphrine (1 gM
pour la veine
portale ; 3 M pour l'aorte). Lorsque la contraction provoquée par la
phényléphrine est
stabilisée, du carbachol (10 M) est administré dans le but de contrôler la
désorganisation de
l'endothélium dans les vaisseaux. Soixante-quinze minutes après la
sensibilisation, une courbe
concentration-effet pour la phényléphrine est établie. Afin de déterminer
l'effet des composés
tests, différentes préparations sont utilisées en parallèle. L'une sert de
contrôle, alors que les
autres recoivent différentes concentrations de composé test introduit dans le
bain 60 minutes
avant la phényléphrine.
Les résultats sont exprimés comme des moyennes S.E.M. ou pourcentage de la
contraction.
La réponse contractile maximale de chaque préparation ayant été soumise à un
composé test est
déterminée en comparant la réponse déclenchée par l'application de la
concentration
sensibilisante de phényléphrine avec la réponse déclenchée dans la préparation
contrôle (qui n'a
reçu que de la phényléphrine). Les valeurs d'EC50 sont calculées à partir de
la réponse
contractile maximum par analyse par ordinateur en utilisant une régression
linéaire sur les
valeurs de tension moyennes. Les constantes de dissociation des composés tests
(Kb) sont
déterminées pour chaque antagoniste selon l'équation suivante : Kb = [B] /
(rapport
dosique - 1) ; dans laquelle [B] est la concentration du composé test et
(rapport dosique) est
l'EC50 de l'agoniste en présence du composé test divisée par l'EC50 contrôle.
Le tableau IV
donne le Kb du composé 45 et de la Prazosine.
TABLEAU IV
Composé 45 Prazosine
Kb (Aorte) 63 nM 2 nM
Kb (Veine portale) 1,6 nM 4 nM
Sélectivité 40 0,5
Kh (Aorte) / Kh (Veine)
CA 02251016 1998-10-01
WO 97/37983 PCT/FR97/00615
-67-
Escai de contraction de la veine saphène de lapin
La veine saphène caudale est extraite de lapins mâles New Zealand (2,5 à 3 kg,
Dombes
Romans, France) après dislocation cervicale et nettoyée des tissus connexes
environnants. Des
anneaux de 2-3 mm de largeur sont découpés sous une lentille de dissection.
Les anneaux sont
suspendus sous une tension de 1 g à 37 C dans des bains pour organes
contenant 10 ml de
solution physiologique (composée de NaCI (118 mM), KCl (4,7 mM), CaC12 (2,5
mM),
KH2PO4 (1,2 mM), MgSO4 (1,2 mM), NaHCO3 (25 mM), glucose (11 mM)) à 37 C et
gazés avec 95 % 02 / 5 % C02. Les réponses contractiles sont mesurées en
utilisant des
transducteurs à déplacement de force couplés à un polygraphe Gould RS3400.
L'endothélium
1o est enlevé en faisant rouler doucement de petits forceps sur la surface
luminale des anneaux
artériels et en perfusant un flux doux de carbogène pendant 5 minutes au
travers de la veine.
Une période d'équilibration ou équilibrage d'une heure est prévue avant
l'expérimentation.
Pendant cette période d'équilibrage, on laisse la tension des anneaux veineux
se relâcher et la
tension finale est maintenue à 0,5 g. Après équilibrage, les préparations sont
sensibilisées par
une concentration submaximale (3 M) de phényléphrine. Lorsque la contraction
déclenchée
par la phényléphrine est stabilisée, du carbachol (10 M) est administré afin
de contrôler la
désorganisation de l'endothélium dans les vaisseaux. Soixante-quinze minutes
après la
sensibilisation, une courbe concentration-effet pour la phényléphrine est
établie. Afin de
déterminer l'effet des composés tests, différentes préparations sont utilisées
en parallèle. L'une
sert de contrôle alors que les autres reçoivent les différents composés tests
introduits dans le
bain 60 minutes avant l'administration de phényléphrine.
Les résultats sont exprimés comme des moyennes S.E.M. ou pourcentage de la
contraction.
La réponse contractile maximale de chaque préparation ayant été soumise au
composé test est
déterminée en comparant la réponse déclenchée par l'application de la
concentration
sensibilisante de phényléphrine avec la réponse déclenchée dans la préparation
contrôle (qui n'a
reçu que la phényléphrine). Les valeurs d'EC50 sont calculées à partir de la
réponse contractile
maximum par analyse par ordinateur en utilisant une régression linéaire sur
les valeurs de
tension moyennes. Les constantes de dissociation du composé test (Kb) sont
déterminés pour
chaque composé test selon l'équation suivante : Kb =[B] / (rapport dosique -
1) ; dans
laquelle [B] est la concentration du composé test et (rapport dosique) est
l'EC50 de l'agoniste en
présence du composé test divisée par l'EC50 contrôle. Le tableau V donne le Kb
du
composé 45 et de la Prazosine.
CA 02251016 2005-02-21
WO 97/37983 -68 PGT/P'R971'00615
-
TABLEAU V
Composé 45 Prazosine
K}~ (Veine saphène) 15 nM 13 nM
Sélectivité 9,4 3,3
ICb (Veine saphène) / Kb (Veine portale)
Autres modes de réaiisation :
On comprend que, alors que l'invention a été décrite en liaison avec sa
description détaillée,
S cette description est prévue pour illustrer et non pas limiter la portée de
l'invention, qui est
définie par la portée des revendications annexées.