Note: Descriptions are shown in the official language in which they were submitted.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
COMPOSES BIAROMATIQUES, COMPOSmONS LES CONTENANT ET UTILISATIONS
5 L'invention concerne, à titre de produits industriels nouveaux et utiles, des
composés biaromatiques. Elle concerne également l'utilisation de ces nouveaux
composés dans des compositions pharmaceutiques destinees à un usage en
médecine hurnaine ou vétérinaire, ou bien encore dans des compositions
cosmetiques.
Les composés selon l'invention ont une activité marquée dans les domaines de la
différenciation et de la prolifération cellulaire, et trouvent des applications plus
particulièrement dans le traitement topique et systémique des affections
dermatologiques liées à un desordre de la kératinisation, des affections
15 dermatologiques (ou autres) à composante inflammatoire et/ou
immunoallergique, et des proliférations dermiques ou épidermiques qu'elles
soient benignes ou malignes. Ces composés peuvent en outre être utilisés dans
le traitement des maladies de dégénérescence du tissu conjonctif, pour lutter
contre le vieillissement de la peau, qu'il soit photoinduit ou chronologique, et20 traiter les troubles de la cicatrisation. Ils trouvent par ailleurs une application dans
le domaine ophtalmologique, notamment dans le traitement des corneopathies.
On peut également utiliser les composés selon l'invention dans des compositions
cosmétiques pour l'hygiène corporelle et capillaire.
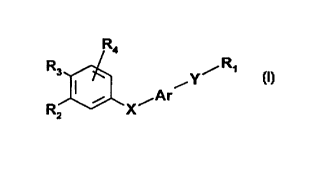
Les composés selon l'invention peuvent être représentés par la formule générale
(I) suivante:
R4
R3,~ ,
R x~Ar
(I)
30dans laquelle:
R1 représente (i) le radical -CH3
(ii) le radical -CH2-O-R5
(iii) le radical -O-R5
(iv) le radical -CO-R6
Rs et R6 ayant les significations données ci-après,
CA 02253221 1998-10-05
WO 98/34909 2 PCTtFR98tO0248
Y représente un radical choisi parmi les radicaux de formules (a) à (c)
suivantes:
-(CH2)n- ~ j~
(a) (b) R'7 (c)
R7 et n ayant les significations données ci-après,
Ar représente un radical choisi parmi les radicaux de formules (d) à (g)
suivantes:
(d) ~ (e) P (f) ~ (g)
R8 ayant la signification donnée ci-après,
X représente un radical choisi parmi les radicaux de formules (h) à (p)
suivantes pouvant être lues de gauche à droite ou inversement,
CA 02253221 1998-10-05
WO 98/34909 3 PCT/FR98/00248
o
)~o~ /~N' j~
h) R'7 (j) R 7 Rs (j)
O O ~
R ~~ ~ ' --J' N
(k) (I) (m)
J~ ~ ~
Rg (n) (o) Rs (P)
etant entendu que lorsque X représente le radical de formule (n) alors
5 Y ne peut pas représenter le radical de formule (a),
R7 et Rg ayant les significations données ci-apres,
R2 et R3, identiques ou différents, représentent un atome ou un radical
choisi parmi:
(i) un atome d'hydrogène,
(ii) un radical alkyle linéaire ou ramifié ayant de1
15 à 20 atomes de carbone,
(iii) un radical-ORs
(iv) un radical -SRs,
Rs ayant la signification donnée ci-après,
avec la condition qu'au moins un des radicaux R2 et R3 représente un
radical de signification (ii),
étant entendu que R2 et R3 pris ensemble peuvent former avec le cycle
aromatique adjacent un cycle à 5 ou 6 chainons éventuellement substitué par des
gro,upes méthyle etlou éventuellement interrompu par ùn atome d'oxygène ou de
soufre,
CA 022~3221 1998-10-0~
WO 98/34gO9 4 PCT/FR98/W248
avec la condition que R2 et R3 pris ensemble forment avec le cycle
aromatique adjacent un cycle à 5 ou 6 chainons éventuellement substitué par des
groupes méthyle et / ou éventuellement interrompu par un atome d'oxygène ou
de soufre, quand X représente le radical de formule (m) ou (i), Y représente le
radical de formule (a) avec n-0, Ar représente le radical de formule (d), R1
représente le radical -CO-R6 avec R6=-O-R1 1, et R8 et Rg représentent
l'hydrogène,
R4 et Rg, identiques ou différents, représentent un atorne d'hydrogène, un
10 atome d'halogène, un radical alkyle linéaire ou ramifié ayant de 1 à 20 atomes de
carbone, ou un radical-ORs,
Rs, identique ou différent, représente un atome d'hydrogène, un radical
alkyle inferieur ou un radical -COR10,
R10 ayant la signification donnée ci-après,
R6 représente un atome ou un radical choisi parmi:
(a) un atome d'hydrogène,
(b) un radical alkyle inférieur,
(c) un radical de formule:
R"
N
R'
R' et R" ayant les significations données ci-après,
(d) un radical -OR11
R11 ayant la signification donnée ci-après,
R7, R'7 et Rg, identiques ou différents, représentent un atome d'hydrogène
35 ou un radical alkyle inférieur,
n est égal à 0, 1 ou 2,
R10 représente un radical alkyle inférieur,
R11 représente un atome d'hydrogène, un radical alkyle linéaire ou rami~ié,
ayant de 1 à 20 atomes de carbone, un radical alkényl, un radicai mono ou
polyhydroxyalkyle, un radical aryle ou aralkyle, éventuellement substitué, ou unreste de sucre ou un reste d'amino acide ou de peptide.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
R' et R", identiques ou différents, représentent un atome d'hydrogene, un
radical alkyl inferieur, un radical mono ou polyhydroxyalkyle, un radical aryle
éventuellement substitué ou un reste d'amino acide ou de peptide ou de sucre ou
encore pris ensemble forment un hétérocycle,
et les isomères optiques et géométriques desdits composés de formule (I) ainsi
que leurs sels.
Lorsque les composés selon l'invention se présentent sous forme de sels, par
10 addition d'un acide, il s'agit de sels pharmaceutiquement ou cosmétiquement
acceptables obtenus par addition d'un acide minéral ou organique, en particulierl'acide chlorhydrique, sulfurique, acétique, citrique, fumarique, hemisuccinique~
maléique et mandélique. Lorsque les composés selon l'invention se présentent
sous forme de sels par addition d'une base, il s'agit préférentiellement de sels15 d'un métal alcalin ou alcalino-terreux ou encore de zinc ou d'une amine
organique.
Selon la présente invention, parmi les radicaux alkyle linéaire ou ramifié ayant de
1 à 20 atomes de carbone, on peut citer avantageusement les radicaux méthyle,
20 éthyle, isopropyle, butyle, tertiobutyle, hexyle, octyle, nonyle, 2-éthyl-hexyl et
dodécyle. De préférence, ces radicaux présentent de 1 à 12 atomes de carbone.
Losqu'il est inférieur, le radical alkyl comprend géneralement de 1 à 10 atomes de
carbone, de préférence de 1 à 6 atomes de carbone. On peut citer, comme
radical alkyle inférieur, les radicaux méthyle, éthyle, propyle, isopropyle,
25 tertiobutyle, hexyle.
Parmi les radicaux alkyle linéaire ayant de 1 à 20 atomes de carbone, on peut
citer notamment les radicaux méthyle, éthyle, propyle, 2-éthyl-hexyle, octyle,
dodécyle, hexadécyle et octadécyl.
Parmi les radicaux alkyle ramifié ayant de 1 à 20 atomes de carbone, on peut
citer notamment les radicaux 2-méthylbutyle, 2-méthylpentyle, 1-méthylhexyle, 3-méthylheptyle, isopropyle ou tertiobutyle.
35 Par radical alkényle, on entend un radical ayant de 2 à 20 atomes de carbone
linéaire ou ramifié comportant une ou plusieurs doubles liaisons.
Parmi les radicaux alkényle, on préfère un radical contenant de 2 a ~ atomes de
carbone et présentant une ou plusieurs insaturations éthyléniques, tel que plus
40 particulièrement le radical allyle.
Par radical monohydroxyalkyle ou polyhydroxyalkyle, on doit entendre un radical
contenant de 1 à 6 atomes de carbone et de 1 à 5 groupes hydroxyles.
45 Parmi les radicaux monohydroxyalkyle, on préfère un radical contenant de
préférence 1 ou 3 atomes de carbone, notamment les radicaux hydroxyméthyl, 2-
hydroxyéthyl, 2 ou 3-hydroxypropyle.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
Parmi les radicaux polyhydroxyalkyle, on préfère un radical présentant de 3 à 6
atomes de carbone et de 2 à 5 groupes hydroxyles, tels que les radicaux 2,3-
dihydroxypropyle, 2,3,4-trihydroxybutyle, 2,3,4,5-tétrahydroxypentyle ou le reste
5 du pentaérythritol.
Parmi les radicaux aryle, on préfère un radical phenyle, thiophène ou pyridine,
éventuellement substitué par au moins un atome d'halogène, un radical
hydroxyle, un radical alkyle, une fonction nitro, un groupe méthoxy ou une
10 fonction amine éventuellement substituée. On préfère le radical phényle
éventuellement substitue.
Parmi les radicaux aralkyle, on préfère le radical benzyle ou phénéthyle
éventuellement substitué par au moins un atome d'halogène, un radical
15 hydroxyle, une fonction nitro ou un groupe méthoxy.
Par reste de sucre, on entend un reste dérivant notamment de glucose, de
galactose ou de mannose, ou bien encore de l'acide glucuronique.
20 Par reste d'aminoacide, on entend notamment un reste dérivant de l'un des
acides aminés tels que la Iysine, la glycine ou l'acide aspartique, et par reste de
peptide, on entend plus particulièrement un reste de dipeptide ou de tripeptide
résultant de la combinaison d'acides aminés.
25 Par hétérocycle, on entend de préférence un radical pipéridino, morpholino,
pyrrolidino ou pipérazino, éventuellement substitué en position 4 par un radicalalkyle en C1-C6 ou polyhydroxyalkyle tels que définis ci-dessus.
Lorsque les radicaux R4 et R8 représentent un atome d'halogène, celui-ci est de
30 préférence un atome de fluor, de brome ou de chlore.
Parmi les composés de formule (I) ci-dessus rentrant dans le cadre de la
présente invention, on peut citer les suivants:
- Acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]
benzoïque.
-Acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloylamino]
40 benzolque.
-Acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propanoyloxy]
benzoïque.
-Acide 4-~N-méthyl-3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)
acryloylamino] benzolque.
. .
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
-Acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-
butenoyloxy] benzolque.
- Acide 3-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]
5 benzoïque.
-Acide 4-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyloxycarbonylvinyl)
benzoïque.
10-Acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propynoyloxy]
benzoïque.
-4-[3-(5,6,7,8-tetrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]
benzaldehyde .
-4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]
benzenemethanol .
-3-{2-[(5,5,8,8-Tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-carbonyl
20 )amino] phenyl}acrylate de méthyle.
-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-l)acryloylamino]-
benzoate de méthyle.
-Acide 2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
acryloylamino] benzoique.
- Acide (E)-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)but-
2-enoylamino]benzoique.
-(E)-2-[3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl)acryloyloxy] benzoate d'allyle.
- Acide (E)-2-[3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl)acryloyloxy] benzoique.
-(E)-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-
acryloyloxy]benzoate d'allyle
-3-{3-[(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino]phenyl} acrylate de méthyle.
-Acide 3-{2-[(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino] phenyl}acrylique.
-Acide 2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
acryloyloxy] benzoique.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
- Acide 2-[3-(5,5,8,8-tetramethyl-~,6,7,8-tetrahydro-naphthalen-2-yl)but-2-
enoyloxy] benzoique.
-Acide 3-{3-[(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-
5 carbonyl)amino] phenyl}acrylique.
-Acide 3-{2-[(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)aminoj phenyl}acrylique.
-Acide 3-{3-[(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino] phenyl}acrylique.
-Acide 4-[2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
cyclopropane carbonyloxy]benzoique.
-Acide 4-{[2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-
cyclopropane carbonyl]amino}benzoique.
Selon la présente invention, les composés de formule (I) plus particulièrement
20 préférés sont ceux pour lesquels l'une au moins et de préférence toutes les
conditions ci-dessous sont respectées:
R1 représente le radical-CO-R6,
2~ Ar represente le radical de formule (d) ou (fl,
X représente le radical de formule (h), (j), (n) ou (o)
R2 et R3 ont pour signification:
- au moins un des deux substituents R2 et R3 représente un radical
ramifié ayant de 1 à 20 atomes de carbone, ou
- R2 et R3 pris ensemble forment avec le cycle aromatique adjacent un
35 cycle à 5 ou 6 chainons éventuellement substitué par des groupes méthyle eVou éventuellement interrompu par un atome d'oxygène ou de soufre,
De manière encore plus préférentielle, les composés présentent la formule (I)
dans laquelle R2 et R3 pris ensemble forment avec le cycle aromatique adjacent
40 un cycle à ~ ou 6 chainons éventuellement substitué par des groupes méthyle
etlou éventuellement interrompu par un atome d'oxygène ou de soufre,
La présente invention a également pour objet les procédés de préparation des
composés de formule (I), en particulier selon les schémas réactionnels donnés à
4~ la figure 1.~
Les dérivés bromés (1) peuvent être transformés:
CA 022~3221 1998-10-0~
WO 98/34909 9 PCI/F1~98/00248
- en dérivés aldéhydiques (4) par formation de dérivés lithiens puis réaction
avec le DMF.
- en dérives cétoniques (2) par formation de dérivés lithiens puis réaction
avec CO2 pour former des dérivés acide carboxylique et réaction avec le
méthyllithium .
- en dérivés acétyléniques (6) par réaction avec le trimethylsilylacétylène en
présene d'acétate de palladium et de triphénylphosphine dans un solvant tel la
triéthylamine puis désilylation en présence de carbonate de potassium ou de
fluorure de tétrabutylammonium.
- en dérivés d'acide acrylique (5) par une réaction de type Heck avec un
ester de l'acide acrylique en présence de triéthyamine ou de carbonate de
potassium et d'acétate de palladium et de triphénylphosphine puis saponificationde la fonction ester avec la soude ou la potasse dans un solvant alcoolique.
Les dérives (3) et (5) peuvent être obtenus respectivement à partir des dérivés
(2) et (4) par une réaction de type Horner-Emmons avec le
triéthylphosphonoacétate en présence d'une base telle l'hydrure de sodium puis
saponification de la fonction ester avec la soude ou la potasse dans un solvant
alcoolique.
Les dérivés (7) peuvent être obtenus à partir des dérivés acetyléniques (6) par
lithiation puis réaction avec CO2.
Les dérivés cyclopropanecarboxylique (8) peuvent être obtenus par une suite de
réactions à partir des dérivés (7): estérification de la fonction acide puis réaction
avec le diazométhane en présence d'acétate de palladium (J. Vallgarda J. Med.
Chem. 1996, 39, 1485-1493 et U. Appelberg Bioorg.& Med. Chem. Letters 1996,
Vol 6, N~4) et saponification en présence de soude ou de potasse. Il peuvent être
aussi obtenus par une suite de réactions comprenant la réduction de la fonction
acide en alcool puis protection de cette fonction avec par exemple le
tétrahydropyran, réaction ensuite avec le chloroforme en presence de soude,
déprotection de la fonction alcool et oxydation par exemple avec le réactif de
Jones (Y. Tanabe Synthesis 1996, 388-92).
Les composés de formule (I) peuvent être ainsi obtenues à partir des dérivés (3),
(5), (7), (8) par réation avec des composés (9) dans lesquels W peut représenterun radical amino ou hydroxy soit par l'intermédiaire du chlorure d'acide ou en
présence de dicyclohexylcarbodiimide et de diméthylaminopyridine dans un
solvant, tel que le THF ou le dichlorométhane.
Lorsque R1 représente le radical -COOH, les composés sont préférentiellement
préparés en protégeant R1 par un groupe protecteur de type allylique, benzyliqueou tert-butylique.
Le passage à la forme libre peut être éffectué:
CA 022~322l l998-lO-0~
WO 98/34909 PCT/FR98/00248
- dans le cas d'un groupe protecteur allylique, au moyen d'un catalyseur, tel
que certains complexes de métaux de transition en présence d'une amine
secondaire .
- dans le cas d'un groupe protecteur benzylique, par débenzylation en
5 présence d'hydrogène, au moyen d'un catalyseur, tel que le palladium sur
charbon .
- dans le cas d'un groupe protecteur tert-butylique au moyen d'iodure de
triméthylsilane.
10 Lorsque R1 représente une fonction alcool les composés peuvent être obtenus àpartir des dérives aldéhydiques correspondants par action d'un hydrure alcalin, tel
que le borohydrure de sodium, dans un solvant alcoolique (par exemple le
méthanol) .
15 Lorsque R1 représente une fonction amide les composés peuvent être obtenus à
partir des dérivés carboxyliques correspondants par réaction avec des amines
aliphatiques, aromatiques, hétérocycliques soit par l'intermédiaire d'un chlorure
d'acide ou en presence de dicyclohexylcarbodiimide ou de carbonyldiimidazole.
20 Les produits de formule générale (I) ainsi obtenus peuvent servir de produits de
départ pour la fabrication d'autres composés de formule (I) selon l'invention. Ces
composés sont obtenus selon les méthodes classiques de synthèse employées
en chimie, telles que celles décrites dans "Advanced Organic Chemistry" de J.
March; John Willey and Sons, 1985.
Par exemple, on peut procéder aux modifications fonctionnelles du groupe R1
comme indiqué ci-dessous:
acide carboxylique -> ester
ester -> acide carboxylique
acide -> chlorure d' acide
chlorure d' acide -> amide
acide -> amide
acide -> alcool
alcool -> aldéhyde
amide -> amine
30 Les composés selon l'invention présentent une activité dans le test de
différenciation des cellules (F9) de tératocarcinome embryonnaire de souris
(Cancer Research 43, p. 5268, 1983) eVou dans le test d'inhibition de l'ornithine
décarboxylase après induction par le TPA chez la souris (Cancer Research 38, p.
793-801, 1978). Ces tests montrent les activités de ces composés
35 respectivement dans les domaines de la différenciation et de la proliférationcellulaire. Dans le test de différenciation des cellules (F9), il est possible d'évaluer
une activité agoniste, comme une activité antagoniste aux récepteurs de l'acide
rétinoïque. En effet, un antagoniste est inactif lorsqu'il est seul dans ce test, mais
inhibe partiellement ou totalement l'effet produit par un rétinoïde agoniste sur la
40 morphologie et sur la sécrétion de l'activateur plasminogène. Certains de ces
CA 022~322l l998-lO-0~
WO 98134909 11 PCT/FR98/00248
composés présentent donc également une activite dans un test qui consiste à
identifier des molecules antagonistes des RARs, tel que décrit dans la demande
de brevet français n~ 9~-07302 déposée le 19 juin 1995 par la Demanderesse.
Ce test comprend les étapes suivantes: (i) on applique topiquement sur une
5 partie de la peau d'un mammifère une quantité suffisante d'une molécule
agoniste des RARs, (ii) on administre par voie systémique ou topique sur ce
même mammifère ou sur cette même partie de la peau du mammifère, avant,
pendant ou après l'étape (i), une molécule susceptible de presenter une activiteantagoniste des RARs et (iii) on évalue la réponse sur la partie de la peau ainsi
10 traitée du mammifère. Ainsi, la réponse à une application topique sur l'oreille d'un
mammifère d'une molécule agoniste des RARs qui correspond à une
augmentation de l'épaisseur de cette oreille peut être inhibee par l'administration
par voie systémique ou topique d'une molécule antagoniste des RARs. En outre,
certains de ces composés peuvent apporter une synergie à l'activité biologique
15 de produits se liant aux récepteurs nucleaires.
La présente invention a également pour objet à titre de médicament les
composés de formule (I) telle que définie ci-dessus.
20 Les composés selon l'invention conviennent particulièrement bien dans les
domaines de traitement suivants:
1) pour traiter les affections dermatologiques liées à un désordre de la
kératinisation portant sur la différenciation et sur la prolifération notamment pour
25 traiter les acnées vulgaires, comédoniennes, polymorphes, rosacées, les acnees
nodulokystiques, conglobata, les acnées séniles, les acnées secondaires telles
que l'acnee solaire, médicamenteuse ou professionnelle,
2) pour traiter d'autres types de troubles de la kératinisation, notamment les
30 ichtyoses, les états ichtyosiformes, la maladie de Darrier, les kératodermiespalmoplantaires, les leucoplasies et les états leucoplasiformes, le lichen cutané
ou muqueux (buccal),
3) pour traiter d'autres affections dermatologiques liées à un trouble de la
35 kératinisation avec une composante inflammatoire eVou immuno-allergique et
notamment toutes les formes de psoriasis qu'il soit cutané, muqueux ou unguéal,
et même le rhumatisme psoriatique, ou encore l'atopie cutanée, telle que
l'eczéma ou l'atopie respiratoire ou encore l'hypertrophie gingivale; les composés
peuvent également être utilisés dans certaines affections inflammatoires ne
40 présentant pas de trouble de la kératinisation,
4) pour traiter toutes les proliférations dermiques ou épidermiques qu'elles
soient bénignes ou malignes~ qu'elles soient ou non d'origine virale telles que
verrues vulgaires, les verrues planes et l'épidermodysplasie verruciforme, les
45 papillomatoses orales ou florides et les proliférations pouvant être induites par les
ultra-violets notamment dans le cas des épithélioma baso et spinocellulaires,
CA 022~322l l998-lO-0~
WO 98t34909 12 PCTI~ ,/QV248
5) pour traiter d'autres désordres dermatologiques tels que les dermatoses
bulleuses et les maladies du collagène,
6) pour traiter certains troubles ophtalmologiques, notamment les
5 cornéopathies,
7) pour réparer ou lutter contre le vieillissement de la peau, qu'il soit photo-induit ou chronologique ou pour réduire les pigmentations et les kératoses
actiniques, ou toutes pathologies associées au vieillissement chronologique ou
1 0 actinique,
8) pour prévenir ou guérir les stigmates de l'atrophie épidermique eVou
dermique induite par les corticostéroïdes locaux ou systémiques, ou toute autre
forme d'atrophie cutanée,
9) pour prévenir ou traiter les troubles de la cicatrisation ou pour prévenir oupour réparer les vergetures,
10) pour lutter contre les troubles de la fonction sébacée tels que
20 I'hyperséborrhée de l'acné ou la séborrhée simple,
11 ) dans le traitement ou la prévention des états cancéreux ou
précancéreux, plus particulièrement les leucémies promyélocytaires;
12) dans le traitement d'affections inflammatoires telles que l'arthrite,
13) dans le traitement de toute affection d'origine virale au niveau cutané,
telle que le syndrome de Kaposis, ou général,
14) dans la prévention ou le traitement de l'alopécie,
15) dans le traitement d'affections dermatologiques ou générales à
composante immunologique,
16) dans le traitement d'affections du système cardiovasculaire telles que
l'artériosclerose ou l'hypertension ainsi que le diabète non-insulino dépendant,
17) dans le traitement de désordres cutanés dus à une exposition aux
rayonnements lJ.V
Dans les domaines thérapeutiques mentionnés ci-dessus, les composés selon
l'invention peuvent être avantageusement employés en combinaison avec
d'autres composés à activité de type rétinoïde, avec les vitamines D ou leurs
derivés, avec des corticostéroïdes, avec des anti-radicaux libres, des o~-hydroxy
ou o~-céto acides ou leurs dérivés, ou bien encore avec des bloqueurs de canaux
ioniques. Par vitamines D ou leurs dérivés, on entend par exemple les dérivés dela vitamine D2 ou D3 et en particulier la 1,25-dihydroxyvitamine D3. Par anti-
radicaux libres, on entend par exemple l'c~-tocophérol, la Super Oxyde Dismutate,
CA 022~322l l998-lO-0~
WO 98/34909 1 3 PCT/F R98/00248
I'Ubiquinol ou certains chélatants de métaux. Par a-hydroxy ou (x-céto acides ouleurs dérivés, on entend par exemple les acides lactique, malique, citrique,
glycolique, mandélique, tartrique, glycérique ou ascorbique ou leurs sels, amides
ou esters. Enfin, par bloqueurs de canaux ioniques, on entend par exemple le
Minoxidil (2,4-diamino-6-pipéridino-pyrimidine-3-oxyde) et ses dérivés.
La présente invention a également pour objet des compositions
médicamenteuses contenant au moins un composé de formule (I) telle que
définie ci-dessus, I'un de ses isomères optiques ou géométriques ou un de ses
1 0 sels.
La présente invention a donc ainsi pour objet une nouvelle composition
médicamenteuse destinée notamment au traitement des affections
susmentionnées, et qui est caractérisée par le fait qu'elle comprend, dans un
support pharmaceutiquement acceptable et compatible avec le mode
d'administration retenu pour cette dernière, au moins un composé de formule (I),I'un de ses isomeres optiques ou géométriques ou un de ses sels.
L'administration des composés selon l'invention peut être effectuée par voie
entérale, parentérale, topique ou oculaire.
Par voie entérale, les médicaments peuvent se présenter sous forme de
comprimés, de gélules, de dragées, de sirops, de suspensions, de solutions, de
poudres, de granulés, d'émulsions, de microsphères ou de nanosphères ou de
vésicules lipidiques ou polymériques permettant une libération contrôlée. Par voie
parentérale, les compositions peuvent se présenter sous forme de solutions ou
de suspensions pour perfusion ou pour injection.
Les composés selon l'invention sont généralement administrés à une dose
journalière d'environ 0,01 mg/kg à 100 mg/Kg en poids corporel, et ceci à raisonde 1 à 3 prises.
Par voie topique, les compositions pharmaceutiques à base de composés selon
l'invention sont plus particulièrement destinees au traitement de la peau et desmuqueuses et peuvent alors se présenter sous forme d'onguents, de crêmes, de
laits, de pommades, de poudres, de tampons imbibés, de solutions, de gels, de
sprays, de lotions ou de suspensions. Elles peuvent également se présenter sous
forme de microsphères ou nanosphères ou vésicules lipidiques ou polymériques
ou de patches polymériques et d'hydrogels permettant une libération contrôlée.
Ces compositions par voie topique peuvent par ailleurs se présenter soit sous
forme anhydre, soit sous une forme aqueuse, selon l'indication clinique.
Par voie oculaire, ce sont principalement des collyres.
Ces compositions à usage topique ou oculaire contiennent au moins un composé
de formule (I) telle que définie ci-dessus, ou l'un de ses isomères optiques ou
géométriques ou encore l'un de ses sels, à une concentration de préférence
CA 022~322l l998-lO-0~
WO 98/34909 PCT/FR98/00248
14
comprise entre 0,001% et 5% en poids par rapport au poids total de la
composition.
Les composés de formuie (I) selon l'invention trouvent également une applicationdans le domaine cosmétique, en particulier dans l'hygiène corporelle et capillaire
et notamment pour le traitement des peaux à tendance acneique, pour la
repousse des cheveux, I'anti-chute, pour lutter contre l'aspect gras de la peau ou
des cheveux, dans la protection contre les aspects néfastes du soleil ou dans letraitement des peaux physiologiquement sèches, pour prévenir eVou pour lutter
contre le vieillissement photo-induit ou chronologique.
Dans le domaine cosmétique, les composés selon l'invention peuvent par ailleurs
être avantageusement employés en combinaison avec d'autres composés à
activité de type rétinoïde, avec les vitamines D ou leurs dérivés, avec des
corticostéroldes, avec des anti-radicaux libres, des ~-hydroxy ou a-céto acides
ou leurs dérivés, ou bien encore avec des bloqueurs de canaux ioniques, tous
ces différents produits étant tels que définis ci-avant.
La présente invention vise donc également une composition cosmétique qui est
caractérisée par le fait qu'elle comprend, dans un support cosmétiquement
acceptable et convenant à une application topique, au moins un composé de
formule (I) telJe que définie ci-dessus ou l'un de ses isomères optiques ou
géométriques ou l'un de ses sels, cette composition cosmétique pouvant
notamment se présenter sous la forme d'une crème, d'un lait, d'une lotion, d'un
gel, de microsphères ou nanosphères ou vesicules lipidiques ou polymériques,
d'un savon ou d'un shampooing.
La concentration en composé de formule (I) dans les compositions cosmétiques
selon l'invention est avantageusement comprise entre 0,001% et 3% en poids par
rapport à l'ensemble de la composition.
Les compositions médicamenteuses et cosmétiques selon l'invention peuvent en
outre contenir des additifs inertes ou même pharmacodynamiquement ou
cosmétiquement actifs ou des combinaisons de ces additifs, et notamment: des
agents mouillants; des agents dépigmentants tels que l'hydroquinone, I'acide
azélalque, I'acide caféïque ou l'acide kojique; des émollients; des agents
hydratants comme le glycérol, le PEG 400, la thiamorpholinone, et ses dérivés oubien encore l'urée; des agents antiséborrhéiques ou antiacnéiques, tels que la S-
carboxyméthylcystéine1 la S-benzyl-cystéamine, leurs sels ou leurs dérivés, ou le
péroxyde de benzoyle; des antibiotiques comme l'érythromycine et ses esters, la
néomycine, la clindamycine et ses esters, les tétracyclines; des agents
antifongiques tels que le kétokonazole ou les polyméthylène-4,5 isothiazolidones-
3; des agents favorisant la repousse des cheveux, comme le Minoxidil (2,4-
diamino-6-pipéridino-pyrimidine-3-oxyde) et ses dérivés, le Diazoxide (7-chloro 3-
méthyl 1,2,4-benzothiadiazine 1,1-dioxyde) et le Phénytoïn (5,4-diphényl-
imidazolidine 2,4-dione); des agents anti-inflammatoires non stéroïdiens; des
caroténoldes et, notamment, le ~-carotène; des agents anti-psoriatiques tels que
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
I'anthraline et ses dérivés; et enfin les acides eicosa-5,8,11,14-tétraynoïque et
eicosa-5,8,11-trynoique, leurs esters et amides.
Les compositions selon l'invention peuvent également contenir des agents
d'amélioration de la saveur, des agents conservateurs tels que les esters de
l'acide parahydroxybenzoïque, les agents stabilisants, des agents régulateurs
d'humidité, des agents régulateurs de pH, des agents modificateurs de pression
osmotique, des agents emulsionnants, des filtres UV-A et UV-B, des
antioxydants, tels que l'(x-tocophérol, le butylhydroxyanisole ou le
10 butylhydroxytoluène.
On va maintenant donner, à titre d'illustration et sans aucun caractère limitatif,
plusieurs exemples d'obtention de composés actifs de formule (I) selon
l'invention, ainsi que diverses formulations concrètes à base de tels composés.
A. EXEMPLES DE COMPOSES
20 EXEMPLE 1
Acide 4-~3-~5, 6, 7, 8-tétrahvdro-5, 5, 8, 8-tétraméthyl-2-naphtyl) acryloyloxy1benzoique.
(a) 3-(5,6,7,8-tétrahydro-5,5,8,8-tetraméthyl-2-naphtyl)acrylate d'éthyle.
Dans un tricol et sous courant d'azote, on introduit 1,8 g (60 mmoles)
d'hydrure de sodium (80% dans l'huile) et 50 ml de DMF. On ajoute goutte à
30 goutte une solution de 11,9 ml (60 mmoles) de triéthylphosphonoacétate dans
50 ml de DMF et agite jusqu'à cessation du dégagement gazeux. On ajoute
ensuite 10,8 g (50 mmoles) de 5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-
naphtalènecarboxaldéhyde dans 70 ml de DMF et agite à température ambiante
quatre heures. On verse le milieu réactionnel dans l'eau, extrait avec de l'éther
35 éthylique, décante la phase organique, sèche sur sulfate de magnésium,
évapore. On recueille 14,1 9 (98%) de l'esteréthylique attendu sous forme d'une
huile jaune.
(b) acide 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acrylique.
Dans un ballon, on introduit 14,1 g (49,3 mmoles) de l'ester éthylique
précédent et 200 ml d'une solution de soude 2N. On agite à température
ambiante pendant six heures, évapore à sec le milieu réactionnel. On reprend le
résidu dans l'eau, acidifie à pH 1 avec de l'acide chlorhydrique, extrait avec de
45 I'éther éthylique, décante la phase organique, lave à l'eau, sèche sur sulfate de
magnésium, évapore. Le résidu obtenu est purifié par chromatographie sur
colonne de silice élué avec un mélange d'éther éthylique et d'hexane (35-65).
CA 022~322l l998-lO-0~
WO 98134909 PCT/FR98/00248
16
Après évaporation des solvants, on recueille 9 g (71 %) d'acide 3-(5,6,7,8-
tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl) acrylique de point de fusion 220-1~C.
(c) chlorure de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyle.
Dans un ballon, on introduit une solution de 2,6 g (10 mmoles) d' acide 3-
(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acrylique dans 50 ml de
dichlorométhane anhydre et ajoute 2 ml (10 mmoles) de dicyclohexylamine et
agite pendant une heure. On ajoute ensuite 800 ~l (10 mmoles) de chlorure de
10 thionyle et agite une heure. On évapore à sec, reprend par l'éther éthylique
anhydre, filtre le sel de dicyclohexylamine et évapore le filtrat. On recueille 2,8 g
(100%) du chlorure d'acide brut qui sera utilisé tel quel pour la suite de la
synthèse.
(d) 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]benzoate
de tert-butyle.
Dans un ballon, on introduit 1,94 g (10 mmoles) de 4-hydroxybenzoate de
tert-butyle 50 ml de THF et 1,4 ml (11 mmoles) de triéthylamine. On ajoute
20 goutte à goutte une solution de 2,8 g (10 mmoles) du chlorure d'acide préparéprécédemment et agite à température ambiante pendant deux heures. On verse
le milieu réactionnel dans l'eau, extrait avec de l'éther éthylique, décante la
phase organique, sèche sur sulfate de magnésium, évapore. Le résidu obtenu
est purifié par chromatographie sur colonne de silice élué avec du
25 dichlorométhane. Après évaporation des solvants, on recueille 4 g (92%) de
l'ester tert-butylique attendu de point de fusion 125-6~C.
(e) acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy3
benzolque.
Dans un ballon et sous courant d'azote, on introduit 2,8 g (6,4 mmoles) de
l'ester tert-butylique précédent 50 ml de tétrachlorure de carbone et ajoute
goutte à goutte tout en refroidissant à 0~C 920 lul (6,4 mmoles) d'iodure de
triméthylsilane. On laisse remonter à température ambiante, verse le milieu
3~ réactionnel dans l'eau, extrait avec de l'éther éthylique, décante la phase
organique, sèche sur sulfate de magnésium, évapore. Le résidu obtenu est
purifié par chromatographie sur colonne de silice élué avec de l'éther éthylique.
Après évaporation des solvants, on recueille 2,3 g (96%) d'acide 4-~3-(5,6,7,8-
tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyl oxy]benzoïque de point de
40 fusion 200-1 ~C.
EXEMPLE 2
Acide 4-~3-(5, 6 7, 8-tétrahydro-5 5, 8, 8-tétraméth yl-2-naphtyl)
acryloylamino1benzoique
CA 022~322l l998-lO-0~
WO 98/34909 17 PCT/FR98/00248
(a)4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloylamino]benzoatede méthyle.
De manière analogue à l'exemple 1(d) par réaction de 1,5 g (10 mmoles)
de 4-aminobenzoate de méthyle avec 2,8 g (10 mmoles) de chlorure de 3
(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyle, on obtient 3,2 g
(82%) de l'ester méthylique attendu.
(b) acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl) acryloylamino]1 o benzoïque.
De manière analogue à l'exemple 1(b) à partir de 3,2 g (8 mmoles) de
l'ester éthylique preparé précédemment, on obtient 2,8 g (91%) d'acide 4-[3
(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloylamino]benzoïque de
point de fusion 268-9~C.
EXEMPLE 3
Acide 4-~3-(5, 6, 7, 8-tétrahydro-5, 5, 8, 8-tétraméthyl-2-naphtyl)propanoyloxy1benzoique.
(a) 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]benzoate
2~ de benzyle.
De manière analogue à l'exemple 1(d) par réaction de 2,3 g (10 mmoles)
de 4-hydroxybenzoate de benzyle avec 2,8 g (10 mmoles) de chlorure de 3-
(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyle, on obtient 1,7 g
(37%) de l'ester benzylique attendu de point de fusion 97-9~C.
(b) acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétramethyl-2-naphtyl)propanoyloxy]
benzoïque.
Dans un réacteur, on introduit 1,7 g (3,7 mmoles) de 4-[3-(5,6,7,8-
tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxylbenzoate de benzyle 40 ml
de dioxanne et 340 mg de palladium sur charbon (10%). On hydrogène à 40~C
et sous une pression de 7 bars pendant trois heures. On filtre le catalyseur,
évapore à sec. On triture le solide obtenu dans l'hexane, filtre, seche. On
recueille 1,2 g (85%) d'acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tetraméthyl-2-
naphtyl)propanoyloxy]benzolque de point de fusion 1 83-4~C.
EXEMPEE 4
Acide 4-/N-méthyl-3-(5, 6, 7, 8-tétrah ydro-~, 5, 8, 8-tétraméthyl-2-naphtyl)
acryloylamino1 benzo~que.
CA 022~322l l998-lO-0~
WO 98/34909 PCT/FR98/00248
18
(a) 4-[N-méthyl-3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2naphtyl)acryloylamino]
benzoate de méthyle.
Dans un tricol et sous courant d'azote, on introduit 300 mg (10 mmoles)
5 d'hydrure de sodium (80% dans l'huile) et 30 ml de DMF. On ajoute goutte à
goutte une solution de 1,8 g (4,8 mmoles) de 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-
tétraméthyl-2-naphtyl)acryloylamino]benzoate de méthyle (préparé à l'exemple
2(a)) dans 50 ml de DMF et agite jusqu'à cessation du dégagement gazeux. On
ajoute ensuite 750 ~ul (12 mmoles) d'iodométhane et agite à température
10 ambiante quatre heures. On verse le milieu réactionnel dans l'eau, extrait avec
de l'éther éthylique, décante la phase organique, sèche sur sulfate de
magnésium, évapore. On triture le solide obtenu dans l'hexane, filtre, sèche. Onrecueille 1,6 9 (83%) de l'ester méthylique attendu de point de fusion 167-8~C.
(b) acide4-[N-méthyl-3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)
acryloyiamino] benzoïque.
De manière analogue à l'exemple 1(b) à partir de1,6 9 (4 mmoles) de l'ester
méthylique préparé précédemment, on obtient 600 mg (39%) d'acide 4-[N-
méthyl-3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-
naphtyl)acryloylamino]benzoïque de point de fusion 252-3~C.
EXEMPLE 5
Acide 4-f3-(~, 6, 7, 8-tétrahydro-5, 5. 8 8-tétraméthyl-2-naphtyl)-2-butenovloxy1
benzoique.
(a) 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoate d'éthyle.
De manière analogue à l'exemple 1(a) par réaction de 10,9 g (50 mmoles)
de (5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-acetylnaphtalène avec 11,9 ml (60
mmoles) triéthylphosphonoacétate, on obtient 10,2 9 (68%) de l'ester éthylique
attendu sous forme d'une huile incolore.
(b) acide 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoïque.
De manière analogue à l'exemple 1(b) à partir de 10,3 g (34 mmoles) de
l'ester éthylique précédent, on obtient 6,1 g (65%) de l'acide attendu de point de
fusion 173-4~C.
(c) chlorure de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoyle.
De manière analogue à l'exemple 1(c) par réaction de 2,7 g (10 mmoles) de
I'acide 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoïque avec
800 ,ul de chlorure de thionyle, on obtient 2,9 g (100%) du chlorure d'acide
attendu qui sera utilisé tel quel pour la suite de la synthèse.
CA 022~322l l998-lO-0~
WO 98/34909 PCT/FR98/002A8
19
(d) 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoyloxy]
benzoate de tert-butyle.
De maniere analogue à l'exemple 1(d) par réaction de 1,9 g (10 mmoles)
de 4-hydroxybenzoate de tert-butyle avec 2,9 9 (10 mmoles) du chlorure d'acide
préparé précédemment, on obtient 3,5 9 (80%) de l'ester tert-butylique attendu
sous forme d'une huile jaune.
(e) acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoyloxy]benzoïque.
De maniére analogue à l'exemple 1(e) par réaction de 3,5 9 (7,8 mmoles)
de 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoyloxy]
benzoate de tert-butyle avec 1,1 ml (10 mmoles) d'iodure de triméthylsilane, on
obtient 2,3 9 (75%) d'acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-
naphtyl)-2-butenoyloxy]benzoïque de point de fusion 170-2~C.
EXEMPLE 6
Acide 3-f3-(5, 6, 7, 8-tétrahydro-5 ~, 8, 8-tétraméthyl-2-naphtyl)acryloyloxy1
benzoiqLle.
(a) 3-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]benzoate
d'allyle.
De manière analogue à l'exemple 1(d) par réaction de 2,8 g (10 mmoles)
de chlorure de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétrambthyl-2-naphtyl)acryloyle avec
1,8 g (10 mmoles) de 3-hydroxybenzoated'allyle, on obtient 2,6 g (62%) de
I'ester allylique attendu sous forme d'une huile incolore.
(b) acide 3-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétramethyl-2-naphtyl)acryloyloxy]
benzo'l'que.
Dans un ballon et sous courant d'azote, on introduit 210 mg (6,8 mmoles)
d'hydrure de sodium (80% dans l'huile) et 15 ml de THF. On ajoute ensuite
goutte à goutte 1 ml (6,8 mmoles) de malonate de diéthyle et agite jusqu'à
cessation du dégagement gazeux. Cette solution est introduite goutte à goutte
dans un mélange de 2,6 g (6,2 mmoles) de 3-[3-(5,6,7,8-tétrahydro-5,5,8,8-
tétraméthyl-2-naphtyl) acryloyloxy]benzoate d'allyle 50 ml de THF et 400 mg de
tétrakis(triphénylphosphine)paliadium(0) et agite à température ambiante
pendant trois heures. On verse le milieu réactionnel dans l'eau, extrait avec del'éther éthylique, décante la phase organique, sèche sur sulfate de magnésium,
évapore. Le résidu obtenu est purifié par chromatographie sur colonne de silice
élué avec un mélange d'éther éthylique et d'hexane (50-50). Après évaporation
des solvants, on recueille 1,5 g (64%) d'acide 3-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]benzolque de point de fusion 134-5~C.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
EXEMPLE 7
Acide 4-~5, 6, 7. 8-tétrahydro-5, 5, 8, 8-tétraméthyl-2-naphty/oxycarbonylvinyl)benzoique.
(a) 4-formylbenzoate d'allyle.
Dans un tricol et sous courant d'azote, on introduit 3,8 9 (12 mmoles)
d'hydrure de sodium (80% dans l'huile) et 100 ml de DMF. On ajoute goutte à
goutte une solution de 15 9 (10 mmoles) d'acide 4-formylbenzoïque dans 100 ml
de DMF et agite jusqu'à cessation du dégagement gazeux. On ajoute ensuite 10
ml (12 mmoles) de bromure d'allyle et agite à température ambiante quatre
heures. On verse le milieu réactionnel dans l'eau, extrait avec de l'éther
éthylique, décante la phase organique, sèche sur sulfate de magnésium,
évapore. On recueille 17,2 g (90%) de l'ester allylique attendu sous forme d'unehuile jaune.
(b) acide 4-allyloxycarbonylbenzoïque.
Dans un ballon on introduit 17,2 g (90,5 mmoles) de 4-formylbenzoate
d'allyle 24 g (230 mmoles) d'acide malonique 8 ml de pipéridione et 100 ml de
pyridine. On chauffe a 1 00~C pendant six heures, évapore à sec le milieu
réactionnel. On reprend par l'eau et le dichlorométhane, acidifie à pH1, décantela phase organique, sèche sur sulfate de magnésium, évapore. On triture le
solide obtenu dans l'hexane, filtre, sèche. On recueille 16,7 9 (80%) d'acide 4-allyloxycarbonylbenzoïque de point de fusion 205-6~C.
(c) chlorure de 4-allyloxycarbonylbenzoyle.
De manière analogue à l'exemple 1(c) à partir de 2,3 g (10 mmoles) d'acide
4-allyloxycarbonylbenzoïque, on obtient 2,5 g (100%~ du chlorure d'acide
attendu qui sera utilisé tel quel pour la suite de la synthèse.
(d) 4-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyloxycarbonylvinyl)benzoated'allyle.
De manière analogue à l'exemple 1(d) par réaction de 2,5 9 (10 mmoles)
de chlorure de 4-allyloxycarbonylbenzoyle avec 2 9 (10 mmoles) de 5,6,7,8-
tétrahydro-5,5,8,8-tétraméthyl-2-naphtol, on obtient 3,2 g (78%) de l'ester
allylique attendu de point de fusion 114-5~C.
(e) acide 4-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyloxycarbonylvinyl)
benzoïque.
De manière analogue à l'exemple 6(b) à partir de 3,2 g (7,6 mmoles) de
l'ester allylique précédent, on obtient 1,8 g (62%) d'acide 4-(5,6,7,8-tétrahydro-
CA 022~322l l998-lO-0~
WO 98/34909 21 PCT/FR98/00248
5,5,8,8-tetramethyl-2-naphtyloxycarbonylvinyl)benzoïque de point de fusion 226-
7~C.
5 EXEMPLE 8
Acide 4-~3-~5, 6, 7. 8-tétrahydro-5, 5, 8, 8-tétraméthyl-2-naphtyl)propynoyloxy
benzoique.
(a) 5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-triméthylsilylethynylnaphtalène.
Dans un tricol et sous courant d'azote, on introduit 26,7 g (0,1 mole) de 2-
bromo-5,6,7,8-tétrahydro-5,5,8,8-tétraméthylnaphtalène, 200 ml de triéthylamine
et un melange de 200 mg d'acétate de palladium et de 400 mg de
triphénylphosphine. On ajoute ensuite 20 g (0,204 mole)de
triméthylsilylacétylène, chauffe progressivement à 90~C durant 1 heure et laisseà cette temperature pendant 5 heures. On refroidit le milieu réactionnel, filtre le
sel et évapore. On reprend le résidu avec 200 ml d'acide chlorhydrique (5%) et
400 ml d'éther éthylique. On décante la phase éthèrée, lave à l'eau, sèche sur
sulfate de magnésium, evapore. Le résidu obtenu est purifié par
chromatographie sur colonne de silice, élué avec de l'hexane. Après évaporation
des solvants, on recueille 18,8 9 (66%) du produit attendu sous forme d'une
huile incolore.
(b) 5,6,7,8-tetrahydro-5,5,8,8-tétraméthyl-6-ethynylnaphtalène.
Dans un ballon, on introduit 5,7 g (0,02 mole) du produit précédent, 75 ml
de méthanol et ajoute 100 mg de carbonate de potassium. On agite à
température ambiante pendant 3 heures, évapore à sec, reprend le résidu par
30 I'eau et l'éther éthylique, décante la phase organique, sèche sur sulfate de
magnésium et évapore. On recueille 4,1 9 (100%) du dérivé acétylènique
attendu sous forme d'une huile jaune.
(c) acide 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propargylique.
Dans un tricol et sous courant d'azote, on introduit une solution de 4,1 9 (19
mmoles) de 5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-6-ethynylnaphtalene dans 75
ml de THF et à -78~C on ajoute goutte à goutte 13,3 ml (21 mmoles) de n-
butyllithium (2,5M) et laisse remonter à température ambiante. A -78~C on
40 introduit un courant de C02 pendant 30' et laisse remonter à température
ambiante. On verse le milieu réactionnel dans une solution saturée de chlorure
d'ammonium, extrait avec de l'éther éthylique, décante la phase organique,
sèche sur sulfate de magnésium, évapore. Le résidu obtenu est trituré dans
l'hexane, filtré, séché. On recueille 3,5 9 (73%) de l'acide propargylique attendu
45 de point de fusion 175-7~C.
(d) chlorure de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propynoyle.
. .
CA 022~3221 1998-10-0~
WO 98/34909 22 PCT/FR98/00248
De manière analogue à l'exemple 1(c) à partir de 1,28 9 (5 mmoles) de
l'acide précédent, on obtient 1,4 g (100%) du chlorure d'acide attendu qui sera
utilisé tel quel pour la suite de la synthèse.
(e) 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propynoyloxy]benzoatede tert-butyle.
De manière analogue à l'exemple 1(d) par réaction de 1,4 g (5 mmoles) de
chlorure de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propynoyle avec
950 mg (4,9 mmoles) de 4-hydroxybenzoate de tert-butyle, on obtient 1,75 g
(83%) de l'ester tert-butylique attendu sous forme d'une huile jaune.
(f) acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propynoyloxy]
benzoïque.
De maniére analogue à l'exemple 1(e) par réaction de 1,7 9 ( 4 mmoles) de
4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)propynoyloxy]benzoate de
tert-butyle avec 580 ,ul (4 mmoles) d'iodure de triméthylsilane, on obtient 510 mg
(34%) d'acide 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-
naphtyl)propynoyloxy]benzoïque de point de fusion 200-1~C.
EXEMPLE 9
4-f3-(5 6, 7, 8-tétrahYdro-~. 5, 8, 8-tétraméthyl-2-na phtyl)acry/oyloxy~
benzaldehyde.
De manière analogue a l'exemple 1(d) par réaction de 2,5 g (20 mmoles)
de 4-hydroxybenzaldéhyde avec 5,5 g (20 mmoles) de chlorure de 3-(5,6,7,8-
tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyle, on obtient 5,6 g (75%) de 4-[3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]benzaldéhyde depoint de fusion 109-1 0~C.
EXEMPLE 10
4-~3-(5, 6, 7, 8-tétrahydro-5, ~, 8, 8-tétraméthyl-2-na phtyl)acryloyloxy1
ber7zenemethanol.
Dans un ballon, on introduit 3,1 g (8,5 mmoles) de 4-[3-(5,6,7,8-tétrahydro-
5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]benzaldehyde 50 ml d'un mélange de
THF et de méthanol (50-50). On ajoute par petites portions 163 mg (4,25
mmoles) de borohydrure de sodium et agite à température pendant trois heures.
On verse le milieu réactionnel dans l'eau, extrait avec de l'éther éthylique,
4~ décante la phase organique, sèche sur sulfate de magnésium, filtre, evapore. On
recristallise le solide obtenu dans un mélange d'éther diisopropylique et
d'hexane. On recueille après filtration et séchage 1,6 g (53%) de 4-[3-(5,6,7,8-
CA 022~3221 1998-10-0~
WO 98/34909 23 PCT/1i~98/00248
tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyloxy]benzenemethanol de point
de fusion 1 40-50~C .
EXEMPLE 1 1
3-~2-f(5, 5, 8, 8-TetramethYI-5, 6, 7, 8-tetrahydro-naphthalene-2carbonyl)
amino1phenyl~ acrylate de méthyle.
(a) 2-aminophenylacrylate de méthyle.
Dans un tricol et sous courant d'azote, on introduit 5 g (22,8 mmoles) de 2-
iodoaniline 2 ml (22,8 mmoles) d'acrylate de méthyle et 50 ml de triéthylamine.
On ajoute successivement 1,28 g (1,82 mmole) de chlorure de
bis(triphénylphosphine)palladium(ll) ~21 mg (2,7 mmoles) de Cul et chauffe à
65~C pendant 24 heures. On verse le milieu reactionnel dans l'eau, extrait avec
de l'acétate d'éthyle, décante la phase organique, lave a l'eau, sèche sur sulfate
de magnésium, évapore. Le résidu obtenu est purifié par chromatographie sur
colonne de silice élué avec un mélange de dichlorométhane et de méthanol (95-
5). Après évaporation des solvants, on recueille 3 g (75%) de l'ester méthyliqueattendu .
(b) 3-{2-[(5,5,8,8-Tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-carbonyl
)amino]phenyl} acrylate de méthyle.
Dans un ballon, on introduit 1,13 g (6,38 mmoles) de 2-
aminophenylacrylate de méthyle 30 ml de THF et 1 ml (7 mmoles) de
triéthylamine. On ajoute goutte à goutte une solution de 1,6 g (6,38 mmoles) de
chlorure de 5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-2-naphthoyle et agite à
température ambiante pendant trois heures. On verse le milieu réactionnel dans
l'eau, extrait avec de l'acétate d'éthyle, décante la phase organique, lave à l'eau,
sèche sur sulfate de magnésium, évapore. Le résidu obtenu est purifié par
chromatographie sur colonne de silice élué avec un mélange d'heptane et
d'acétate d'éthyle (95-5). Après évaporation des solvants, on recueille 2,3 g
(92%) de 3-{2-[(5,5,8,8-Tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-carbonyl
)amino]phenyl}acrylate de méthyle de point de fusion 95-6~C.
EXEMPLE 12
2-~3-(5, 5, 8, 8-tetramethy/-5, 6, 7, 8-tetrahydro-na~hthalen-2-yl)-acryloylamino1
benzoate de méthyle.
4~
(a) 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acrylate d'éthyle.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
24
Dans un tricol et sous courant d'azote, on introduit 1,8 g (60 mmoles)
d'hydrure de sodium (80% dans l'huile) et 50 ml de DMF. On ajoute goutte à
goutte une solution de 11,9 ml (60 mmoles) de triéthylphosphonoacétate dans
50 ml de DMF et agite jusqu'à cessation du dégagement gazeux. On ajoute
ensuite 10,8 g (50 mmoles) de 5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-
naphtalènecarboxaldéhyde dans 70 ml de DMF et agite à température ambiante
quatre heures. On verse le milieu réactionnel dans l'eau, extrait avec de l'éther
éthylique, décante la phase organique, sèche sur sulfate de magnésium,
évapore. On recueille 14,1 g (98%) de l'ester éthylique attendu sous forme d'unehuile jaune.
(b) acide 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acrylique.
Dans un ballon, on introduit 14,1 g (49,3 mmoles) de l'ester éthylique
précédent et 200 ml d'une solution de soude 2N. On agite à température
ambiante pendant six heures, évapore à sec le milieu réactionnel. On reprend le
résidu dans l'eau, acidifie à pH 1 avec de l'acide chlorhydrique, extrait avec de
l'éther éthylique, décante la phase organique, lave à i'eau, sèche sur sulfate de
magnésium, évapore. Le résidu obtenu est purifié par chromatographie sur
colonne de silice élué avec un mélange d'éther éthylique et d'hexane (35-65).
Après évaporation des solvants, on recueille 9 g (71 %) d'acide 3-(5,6,7,8-
tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl) acrylique de point de fusion 220-1~C.
(c) chlorure de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyle.
Dans un ballon, on introduit une solution de 2,6 g (10 mmoles) d' acide 3-
(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acrylique dans 50 ml de
dichlorométhane anhydre et ajoute 2 ml (10 mmoles) de dicyclohexylamine et
agite pendant une heure. On ajoute ensuite 800 ,ul (10 mmoles) de chlorure de
thionyle et agite une heure. On évapore à sec, reprend par l'éther éthylique
anhydre, filtre le sel de dicyclohexylamine et évapore le filtrat. On recueille 2,8 g
(100%) du chlorure d'acide brut qui sera utilisé tel quel pour la suite de la
synthèse.
(d) 2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-acryloylamino]benzoate de methyle.
Dans un ballon, on introduit 1,18 g (7,8 mmoles) de 2-aminobenzoate de
méthyle et 10 ml de THF. On ajoute goutte à goutte une solution de 1,08 g (3,9
mmoles) du chlorure d'acide préparé précédemment dans 10 ml de THF et agite
à temperature ambiante pendant deux heures. On verse le milieu réactionnel
dans l'eau, extrait avec de l'éther éthylique, décante la phase organique, sèchesur sulfate de magnésiurn, évapore. Le résidu obtenu est purifié par
chromatographie sur colonne de silice élué avec de l'acétate d'ethyle. Après
évaporation des solvants, on recueille 750 mg (49%) de 2-[3-(5,5,8,8-
tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)acryloylamino]benzoate de
méthyle de point de fusion 1 32-3~C.
CA 022~3221 1998-10-0~
WO 98134909 PCT/FR98/00248
EXEMPLE 13
Acide 2-~3-(5, 5, 8, 8-tetramethyl-5, 6, 7, 8-tetrahydro-naphthalen-2-yl)
acryloylamino1 benzoique.
Dans un ballon, on introduit 540 mg (1,38 mmole) de 2-[3-(5,5,8,8-
tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)acryloylamino]benzoate de
méthyle 5 ml de THF et 5 ml de méthanol. On ajoute 5,5 ml d'une solution de
soude méthanolique (2N) et agite à température ambiante pendant quatre
heures. On verse le milieu réactionnel dans l'eau, acidifie à pH 1 avec de l'acide
chlorhydrique, extrait avec de l'acétate d'éthyle, décante la phase organique,
lave à l'eau, sèche sur sulfate de magnésium, évapore. Le résidu obtenu est
purifié par chromatographie sur colonne de silice élué avec un mélange
d'heptane et d'acétate d'éthyle (95-5). On recueille après évaporation des
solvants 400 mg (77%) de l'acide attendu de point de fusion 1 85-6~C.
EXEMPLE 14
Acide (E)-2-~3-(~, 5, 8, 8-tetramethyl-5, 6. 7, 8-tetrahydro-naphthalen-2-vl)-but-
2-enoylamino1benzoique.
(a) 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoate d'éthyle.
De manière analogue à l'exemple 1(a) par réaction de 10,9 g (50 mmoles)
de (5,6,7,8-tétrahydro-5,5,8,8-tétramethyl-2-acetylnaphtalène avec 11,9 ml (60
mmoles) triéthylphosphonoacétate, on obtient 10,2 g (68%) de l'ester éthylique
30 attendu sous forme d'une huile incolore.
(b) acide 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoïque.
De manière analogue à l'exemple 1(b) à partir de 10,3 9 (34 mmoles) de
35 I'ester éthylique précédent, on obtient 6,1 g (65%) de l'acide attendu de point de
fusion 173-4~C.
(c) chlorure de 3-(5,6,7,8-tetrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoyle.
De manière analogue à l'exemple 1 (c) par réaction de 2,7 g (10 mmoles) de
l'acide 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoïque avec
800 ,ul de chlorure de thionyle, on obtient 2,9 g (100%) du chlorure d'acide
attendu qui sera utilisé tel quel pour la suite de la synthèse.
(d) (E)-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-but-2-
enoylamino] benzoate de méthyle.
CA 022~3221 1998-10-0~
WO 98134909 26 PCT/FR98/00248
De maniere analogue à l'exemple 11(b) par réaction de 400 1~1 (3,1
mmoles) de 2-aminobenzoate de méthyle avec 900 mg (3,1 mmoles) du chlorure
d'acide préparé précédemment, on obtient 350 mg (30%) de l'ester méthylique
attendu sous forme d'une huile jaune.
(e) acide (E)-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-but-2-
enoylamino] benzoique.
De maniére analogue à l'exemple 13 à partir de 170 mg (4,2 mmoles) de
I'ester méthylique précédent, on obtient 140 mg (85%) d'acide (E)-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-but-2-enoylamino]benzoique de
point de fusion 1 75-6~C.
EXEMPLE 1~
(E)-2-~3-(3, ~, 5, 8, 8-pentamethyl-5, 6, 7, 8-tetrahydro-na~hthalen-2-yl)
acryloyloxy] benzoate d'allyle.
(a) 3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphtyl)acrylate d'éthyle.
De manière analogue à l'exemple 12(a) par réaction de 4 g (17,4 mmoles)
de 3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphtylcarboxaldéhyde avec 4,15
ml (20,9 mmoles) de triéthylphosphonoacétate, on obtient 4,91 g (94%) de 3-
(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphtyl)acrylate d'éthyle.
(b) acide 3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphtyl)acrylique.
De manière analogue à l'exemple 12(b) à partir de 4,7_ g (15,9 mmoles) de
I'ester éthylique précédent, on obtient 3,66 g (84%) d'acide 3-(3,5,5,8,8-
pentamethyl-5,6,7,8-tetrahydro-2-naphtyl)acrylique.
(c) chlorure de 3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphtyl)acryloyle.
De manière analogue à l'exemple 12(c) à partir de 2 g (7,3 mmoles) de
l'acide précédent, on obtient 2,2 g (100%) de chlorure d'acide qui est utilisé tel
quel pour la suite de la synthèse.
(d) (E)-2-[3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl)acryloyloxy]benzoate d'allyle.
De manière analogue à l'exemple 11 (b) par réaction de 1,15 g (6,44
mmoles) de 4-hydroxybenzoate d'allyle avec 1,7 g (5,85 mmoles) de chlorure de
3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphtyl)acryloyle, on obtient 1,8 g
4~ (71 %) d'ester allylique attendu de point de fusion 86-7~C.
EXEMPLE 16
CA 022~3221 1998-10-0~
WO 98/34909 27 PCT/FR98/00248
Acide ~E)-2-~3-(3, 5, 5, 8, 8-pentamethyl-~, 6, 7, 8-tetrahydro-naphthalen-2-yl)acr~loyloxy1 benzoique.
Dans un ballon et sous courant d'azote, on introduit 117 mg (4,9
mmoles) d'hydrure de sodium (80% dans l'huile) et 15 ml de THF. On ajoute
ensuite goutte à goutte 540,ul (3,6 mmoles) de malonate de diéthyle et agite
jusqu'à cessation du dégagement gazeux. Cette solution est introduite goutte à
goutte dans un mélange de 1,4 g (3,24 mmoles) de (E)-2-[3-(3,5,5,8,8-
pentamethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)acryloyloxy]benzoate d'allyle 20
ml de THF et 187 mg de tétrakis(triphénylphosphine)palladium(0) et agite à
température ambiante pendant trois heures. On verse le milieu réactionnel dans
l'eau, extrait avec de l'éther éthylique, décante la phase organique, sèche sur
sulfate de magnésium, évapore. Le résidu obtenu est purifié par
15 chromatographie sur colonne de silice elué avec un mélange d'heptane et
d'acétate d'éthyle (95-5). Après evaporation des solvants, on recueille 800 mg
(63%) d'acide (E)-2-[3-(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl)-acryloyloxy]benzoique de point de fusion 1 37-8~C.
EXEMPLE 17
(E)-2-~3-f5, ~, 8, 8-fetramethyl-5, 6, 7, 8-tetrahydro-naphthalen-2-yl~
acryloyloxy1benzoate d'allyle
De manière analogue à l'exemple 11(b) par réaction de 710 mg (4 mmoles)
de 4-hydroxybenzoate d'allyle avec 1 g (3,62 mmoles) de chlorure de 3-(5,6,7,8-
tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)acryloyle obtenu à l'exemple 1 (c), on
obtient 500 mg (33%) de E)-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-
30 naphthalen-2-yl)acryloyloxy]benzoate d'allyle de point de fusion 92-3~C.
EXEMPLE 18
3-~3-~5, 5, 8, 8-tetramethYI-5, 6, 7, 8-tetrahydro-naphthalene-2-carbonyl)
amino~phenyl~ acrylate de méthyle.
(a) 3-aminophenylacrylate de méthyle.
Dans un tricol et sous courant d'azote, on introduit 8 g (36,5 mmoles) de 3-
iodoaniline 3,3 ml (36,5 mmoles) d'acryiate de méthyle et 50 ml de triéthylamine.
On dégaze le milieu réactionnel et ajoute 410 mg (1,82 mmole) d'acétate de
palladium et chauffe à 65~C pendant 2 heures. On verse le milieu réactionnel
dans l'eau, extrait avec de l'acétate d'éthyle, décante la phase organique, lave à
4~ I'eau, sèche sur sulfate de magnésium, évapore. Le résidu obtenu est purifié par
chromatographie sur colonne de silice élué avec du dichlorométhane. Après
évaporation des solvants, on recueille 4 g (62%) de l'ester méthylique attendu.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
28
(b) 3-{3-[(5,5,8,8-Tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-carbonyl)
(c) amino]phenyl} acrylate de méthyle.
Dans un ballon, on introduit 2,07 g (11,7 mmoles) de 3-(3-
aminophenyl)acrylate de methyle 30 ml de THF et 1,8 ml (12,g mmoles) de
triéthylamine. On ajoute goutte à goutte une solution de 2,93 g (11,7 mmoles) dechlorure de 5,5,8,8-tetramethyl-5,6,7,8-tetrahydro naphthoyle et agite a
température ambiante pendant trois heures. On verse le milieu réactionnel dans
l'eau, extrait avec de l'acétate d'éthyle, décante la phase organique, lave à l'eau,
sèche sur sulfate de magnésium, évapore. Le résidu obtenu est purifie par
chromatographie sur colonne de silice élué avec un mélange d'heptane et de
dichlorométhane (10-90). Après évaporation des solvants, on recueille 3,8 g
(83%) de 3-{3-[(5,5,8,8-Tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino3phenyl}acrylate de méthyle de point de fusion 21 2-3~C.
EXEMPLE 19
Acide 3-f2~ 8, 8-tetramethyl-5, 6. 7. 8-tetrahydro-naphthalene-2-carbonyl)
amino1 phenyl~acrylique.
De manière analogue à l'exemple 13 à partir de 650 mg (1,66 mmole) de 3-
{2-[(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino]phenyl}acrylate de méthyle, on obtient 350 mg (56%) d'acide 3-
{2-[(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino]phenyl}acrylique de point de fusion 205-6~C.
EXEMPLE 20
Acide 2-~3-(5, 5, 8, 8-tetramethyl-5, 6, 7, 8-tetrahydronaphthalen-2-yl)
acryloyloxy1 benzoique.
De manière analogue à l'exemple 16 à partir de 400 mg (0,96 mmole) de
E)-2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)acryloyloxy]-
benzoate d'allyle obtenu à l'exemple 17, on obtient 200 mg (55%) d'acide 2-[3-
(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-acryloyloxy3-benzoique
de point de fusion 1 35-6~C.
EXEMPLE 21
Acide 2-~3-(5, 5, 8, 8-tetramethv/-5, 6, 7, 8-tetrahydro-naphthalen-2-yl)-but-2-enoyloxy1-benzoiqve.
(a) 2-[3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)but-2-
enoyloxy]benzoate d'allyle.
CA 022~3221 1998-10-0~
WO 98134909 PCTIFR98/00248
29
De manière analogue à l'exemple 1 1 (b) par réaction de 607 mg (3,4
mmoles) de 4-hydroxybenzoate d'allyle avec 900 mg (3,1 mmoles) de chlorure
de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétraméthyl-2-naphtyl)-2-butenoyle préparé à
l'exemple 5(c), on obtient 420 mg (31%) de l'ester allylique attendu.
(b) acide 2-[3-(5,5,8,8-tetramethyl~5,6,7,8-tetrahydro-naphthalen-2-yl)but-2-
enoyloxy] benzoique.
De manière analogue à l'exemple 16 à partir de 120 mg (0,28 mmole) de 2-
1 o [3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)but-2-
enoyloxy]benzoate d'allyle, on obtient 70 mg (64%) d'acide 2-[3-(5,5,8,8-
tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)but-2-enoyloxy] benzoique de
point de fusion 128-9~C.
EXEMPLE 22
Acide 3-~3-~5, 5 8, 8-tetramethyl-5, 6, 7, 8-tetrahydro-naphthalene-2-carbonyl)
-amino1phenyl~acrylique.
Dans un ballon, on introduit 2,9 g (7,4 mmoles) de 3-{3-~(5,5,8,8-
tetramethyl-5,6,7,8-tetrahydro-naphthalene-2-carbonyl)amino]phenyl}acrylate de
méthyle obtenu à l'exemple 18 50 ml de THF et 3,1 g (74 mmoles) d'hydroxyde
de lithium. On chauffe à reflux pendant 24 heures, verse le milieu réactionnel
dans l'eau, acidifie à pH 1 avec de l'acide chlorhydrique concentré, extrait avec
de l'acétate d'éthyle, décante la phase organique, lave à l'eau, sèche sur sulfate
de magnésium, évapore. On triture le résidu obtenu avec de l'heptane, filtre,
sèche. On recueille 2,8 g (1 00%) d'acide 3-{3-[(5,5,8,8-tetramethyl-5,6,7,8-
tetrahydro-naphthalene-2-carbonyl)-amino]phenyl}acrylique de point de fusion
2 1 5-6~C.
EXEMPLE 23
Acide 3-~2-~3, 5. 5. 8, 8-pentameth yl-5, 6, 7, 8-tetrah vdro-naphthalene-2 -
carbonyl) amino1phenyt~acrylique.
(a) chlorure de 3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphthoyle.
De manière analogue à l'exemple 12(c) à partir de 3,84 g (15,6 mmoles)
d'acide 3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphthoique, on obtient 4,12
g (1 00%) de chlorure d'acide qui est utilisé tel quel pour la suite de la synthese.
(b) 3-{2-[(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino] phenyl}acrylate de méthyle.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
De manière analogue à l'exemple 1 8(b) par réaction de 983 mg (5,6
mmoles) de 3-(2-aminophenyl)acrylate de méthyle avec 1,47 g (5,6 mmoles) du
chlorure d'acide précédent, on obtient 270 mg (12%) de 3-{2-[(3,5,5,8,8-
pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-carbonyl)-amino]phenyl}acrylate
5 de méthyle.
(c) acide 3-{2-[(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)-amino]phenyl}acrylique.
De manière analogue à l'exemple 13 à partir de 240 mg (0,59 mmole) de
l'ester méthylique prtécedent, on obtient 180 mg (81%) d' acide 3-{2-[(3,5,5,8,8-
pentamethyl-5 ,6,7,8-tetrahydro-naphthalene-2-carbonyl)-amino]phenyl}acrylique
de point de fusion 218-9~C.
EXEMPLE 24
Acide 3-~3-~(3,5, 5. 8, 8-pentamefhyl-5 6 7, 8-tetrahydro-naphthalene-2-
carbonyl)amino1 phenyl~acrvlique.
(a) 3-{3-[(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino]phenyl} acrylate de méthyle.
De manière analogue à l'exemple 18(b) par réaction de 940 mg (5,3
mmoles) de 3-(3-aminophenyl)acrylate de méthyle avec 1,4 g (5,3 mmoles) du
chlorure de 3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-2-naphthoyle préparé à
l'exemple 23(a), on obtient 330 mg (15%) de 3-{3-[(3,5,5,8,8-pentamethyl-
5,6,7,8-tetrahydro-naphthalene-2-carbonyl)amino] phenyl}acrylate de méthyle.
(b) acide 3-{3-[(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino] phenyl}acrylique.
De manière analogue a l'exemple 13 à partir de 300 mg (0,74 mmole) de 3-
{3-~(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino]phenyl}acrylate de méthyle, on obtient 220 mg (79%) d'acide 3-
{3-[(3,5,5,8,8-pentamethyl-5,6,7,8-tetrahydro-naphthalene-2-
carbonyl)amino]phenyl}acrylique de point de fusion 205-6~C.
EXEMPLE 25
Acide 4-~2-(5,5.8,8-tetramethyl-5 6, 7 8-tetrahydro-naphthalen-2-yl~
cyclopropane carbonvloxy1benzoique.
(a) (E)-N-Methoxy-N-methyl-3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-
naphthalen-2-yl) acrylamide.
CA 022~322l l998-lO-0~
W098/34909 31 PCTIP'R98/00248
Dans un tricol et sous courant d'azote, on introduit 727 mg (7,45 mmoles)
de chlorhydrate de N,O-diméthylhydroxylamine 10 ml de THF et 2,3 ml (16,4
mmoles) de triéthylamine. On ajoute goutte à goutte une solution de 2,06 g (7,45mmoles) de chlorure de 3-(5,6,7,8-tétrahydro-5,5,8,8-tétramethyl-2-
5 naphtyl)acryloyle préparé à l'exemple 1 (c) dans 20 ml de THF et agite àtempérature ambiante pendant six heures. On verse le milieu réactionnel dans
I'eau, extrait avec de l'acétate d'éthyle, décante la phase organique, sèche sursulfate de magnésium, evapore. Le résidu obtenu est purifié par
chromatographie sur colonne de silice élué avec un melange d'heptane et
d'acétate d'éthyle (80-20). Après évaporation des solvants, on recueille 1 g
(45%) de (E)-N-Methoxy-N-methyl-3-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-
naphthalen-2-yl)acrylamide sous forme d'une huile.
(b) N-methoxy-N-méthyl-2-(5,5,8,8-Tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl) cyclopropanecarboxamide.
Dans un tricol et sous courant d'azote, on introduit 660 mg (3,3 mmoles) de
iodure de triméthylsulfoxonium et 3 ml de DMSO. On ajoute par petites quantités
100 mg (4,12 mmoles) d'hydrure de sodium (80% dans l'huile) et agite jusqu'à
cessation du dégagement gazeux. On ajoute ensuite goutte à goutte une
solution de 900 mg (3 mmoles) de (E)-N-Methoxy-N-methyl-3-(5,5,8,8-
tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)acrylamide dans 15 ml de DMSO
et agite à température ambiante pendant deux heures. On verse le milieu
réactionnel dans l'eau, extrait avec de l'acétate d'éthyle, décante la phase
organique, sèche sur sulfate de magnésium, évapore. Le résidu obtenu est
purifié par chromatographie sur colonne de silice élué avec un mélange
d'heptane et d'acétate d'éthyle (80-20). Après évaporation des solvants, on
recueille 400 mg (43%) de N-méthoxy-N-méthyl-2-(5,5,8,8-tetramethyl-5,6,7,8-
tetrahydro-naphthalen-2-yl)cyclopropanecarboxamide sous forme d'une huile.
(c) acide 2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
(d) cyclopropanecarboxylique.
Dans un ballon, on introduit 360 mg (1,14 mmole) de N-méthoxy-N-méthyl-
2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl)cyclopropanecarboxamide 15 ml d'éther éthylique 842 mg (7,5 mmoles) de
tert-butylate de potassium et 68,4 ,ul d'eau. On agite à température ambiante
pendant trois heures, verse le milieu réactionnel dans l'eau, acidifie à pH 3 avec
de l'acide chlorhydrique, extrait avec de l'éther éthylique, décante la phase
organique, sèche sur sulfate de magnésium, évapore. On recueille 280 mg
(90%) d' acide 2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl)cyclopropanecarboxyliq ue .
(d) chlorure de 1' acide 2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
cyclopropanecarboxylique.
De manière analogue à l'exemple 1(c) à partir de 190 mg (0,7 mmole) d'
acide 2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
CA 022~3221 1998-10-0~
WO 98/34909 32 PCT/FR98/00248
cyclopropanecarboxylique, on obtient 124 mg (61%) du chlorure d'acide attendu.
(e) 4-[2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
(f) cyclopropanecarbonyloxy] benzoate d'allyle.
De manière analogue à l'exemple 18(b) par réaction de 76,2 mg (0,43
mmole) de 4-hydroxybenzoate d'allyle avec 124 mg (0,43 mmole) du chlorure
d'acide précédent, on obtient 120 mg (65%) de 4-[2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)cyclopropane carbonyloxy]benzoate d'allyle.
(fl acide 4-[2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)cyclopropane carbonyloxy]benzoique.
De manière analogue à l'exemple 16 à partir de 1 10 mg (0,25 mmole) de 4-
1 5 [2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-
cyclopropanecarbonyloxy]benzoate d'allyle, on obtient 75 mg (75%) d' acide 4-
[2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)-
cyclopropanecarbonyloxy]benzoique de point de fusion 191-2~C.
EXEMPLE 26
Acide 4-~2-(5, 5, 8 8-tetramethyl-5, 6. 7, 8-tetrahydro-naphthalen-2-yl)
cyclopropane carbonyl1amino~benzoique.
(a) 4-{[2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
(b) cyclopropanecarbonyl] amino}benzoate d'allyle.
De manière analogue à l'exemple 1 8(b) par réaction de 96 mg (0,54
mmole) de 4-aminobenzoate d'allyle avec 155 mg (0,54 mmole) du chlorure
d'acide préparé à l'exemple 25 (d), on obtient 165 mg (71%) de 4-{[2-(5,5,8,8-
tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
cyclopropanecarbonyl]amino}benzoate d'allyle.
(b) acide 4-{[2-(5,5, 8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-yl)
(c) cyclopropanecarbonyl] amino}benzoique.
De manière analogue à l'exemple 16 à partir de 200 mg (0,3 mmole) de 4-
{~2-(5,5,8,8-tetramethyl-5,6,7,8-tetrahydro-naphthalen-2-
yl)cyclopropanecarbonyl]amino}benzoate d'allyle, on obtient 100 mg (85%) d'acide 4-{[2-(5,~,8,8-tetramethyl-5,6 j7,8-tetrahydro-naphthalen-2-yl)
cyclopropanecarbonyl]amino}benzoique de point de fusion 230-1~C
B. EXEMPLES [~E FORMULATION
1) VOIE ORALE
CA 022~3221 1998-10-0~
WO 98134909 PCT/FR98100248
(a) On prépare la composition suivante sous la forme d'un comprimé de 0,8 g
Composé de l'exemple 1................. 0,005 g
Amidon prégélatinisé .................. 0,265 g
Cellulose microcristalline............. 0,300 g
Lactose ............................... 0,200 g
Stéarate de magnésium ................. 0,030 g
Pour le traitement de l'acné, on administrera à un individu adulte 1 à 3 comprimés
10 par jour pendant 3 à 6 mois selon la gravité du cas traité.
(b) On prépare une suspension buvable, destinée à être conditionnée en
ampoules de 5 ml
Composé de l'exemple 2................. 0,050 g
1~ Glycérine.............................. 0,500 g
Sorbitol à 70 %........................ 0,500 g
Saccharinate de sodium ................ 0,010 g
Parahydroxybenzoate de méthyle ........ 0,040 g
Arôme q.s.
Eau purifiée q.s.p..................... 5 ml
Pour le traitement de l'acné, on administrera à un individu adulte 1 ampoule parjour pendant 3 mois selon la gravité du cas traité.
25 (c) On prépare la formulation suivante destinée à être conditionnée en gélules:
Composé de l'exemple 3................. 0,025 g
Amidon de mais ......................... 0,060 g
Lactose q.s.p.......................... 0,300 g
Les gélules utilisées sont constituées de gélatine, d'oxyde de titane et d'un
30 conservateur.
Dans le traitement du psoriasis, on administrera à un individu adulte, 1 gélule par
jour pendant 30 jours.
2) VOIE TOPIQUE
(a) On prépare la crème Eau-dans l'Huile non ionique suivante:
CA 022~3221 1998-10-0~
WO 98134909 P(,l/r~9B/00248
34
Composé de l'exemple 6.......,..................................... 0,100 g
Mélange d'alcools de lanoline émulsifs, de cires et d'huiles
raffinés, vendu par la Société BDF sous la dénomination
"Eucérine anhydre" .......... ,.,.................................. 39,900 gParahydroxybenzoate de méthyle ............................ 0,075 g
Parahydroxybenzoate de propyle ............................ 0,075 g
Eau déminéralisée stérile q.s.p..........................100,000 g
Cette crème sera appliquee sur une peau psoriatique 1 à 2 fois par jour pendant
30 jours.
(b) On prépare un gel en réalisant la formulation suivante:
Composé de l'exemple 8..................................... 0,050 g
Erythromycine base ........................................ 4,000 g
Butylhydroxytoluène........................................ 0,050 g
Hydroxypropylcellulose vendue par la
société Hercules sous le nom de "KLUCEL HF"................ 2,000 g
Ethanol (à 95~) q.s.p....................................100,000 g
20 Ce gel sera appliqué sur une peau atteinte de dermatose ou une peau acneique
1 à 3 fois par jour pendant 6 à 12 semaines selon la gravité du cas traité.
(c) On prépare une lotion antiséborrhéique en procédant au mélange des
ingrédients suivants:
Composé de l'exemple 5..................................... 0,030 g
Propylène glycol........................................... 5,000 g
Butylhydroxytoluène........................................ 0,100 g
Ethanol (à 95~) q.s.p....................................100,000 g
30 Cette lotion sera appliquée deux fois par jour sur un cuir chevelu séborrhéique et
on constate une amélioration significative dans un délai compris entre 2 et 6
semaines.
(d) On prépare une composition cosmétique contre les effets néfastes du soleil
en procédant au mélange des ingrédients suivants:
Composé de l'exemple 7..................................... 1,000 g
Benzylidène camphre ....................................... 4,000 g
Triglycérides d'acides gras.. ,.. ,.. ,.. ,........................... 31,000 g
CA 022~3221 1998-10-0~
WO 98134909 PCTIFR98/00248
Monostéarate de glycerol..................................... 6,000 g
Acide stéarique ............................................. 2,000 g
Alcool cétylique..........~.................................. 1,200 g
~anoline .................................................... 4,000 g
Conservateurs................................................ 0,300 g
Propylène glycol............................................. 2,000 g
Triéthanolamine ............................................. 0,500 9
Parfum ...................................................... 0,400 9
Eau déminéralisée q.s.p.................................... 100,000 g
Cette composition sera appliquée quotidiennement, elle permet de lutter contre le
vieillissement photoinduit.
(e) On prépare la crème Huile dans l'Eau non ionique suivante:
Composé de l'exemple 10...................................... 0,500 9
Vitamine D3 ................................................. 0,020 g
Alcool cétylique............................................. 4,000 9
Monostearate de glycérol..................................... 2,500 g
Stéarate de PEG 50........................................... 2,500 9
Beurre de Karité............................................. 9,200 g
Propylène glycol............................................. 2,000 g
Parahydroxybenzoate de methyle .......................... 0,075 g
Parahydroxybenzoate de propyle .......................... 0,075 g
Eau déminéralisée stérile q.s.p........................ 100,000 g
Cette crème sera appliquée sur une peau psoriatique 1 à 2 fois par jour pendant
30 Jours.
(f) On prépare un gel topique en procédant au mélange des ingrédients
suivants:
Composé de l'exemple 9................................... 0,050 g
Ethanol ............................................... 43, 000 g
a -tocophérol ........................................... 0,050 g
Polymère carboxyvinylique vendu sous la denomination
3~ "Carbopol 941" par la société "Goodrich" ................ 0,500 g
~riéthanolamine en solution aqueuse à 20 % en poids ..... 3,800 g
Eau ..................................................... 9,300 g
Propylène glycol qsp................................... 100,000 9
CA 022~3221 1998-10-0~
WO 98/34909 36 PCT/I;R98/00248
Ce gel sera appliqué dans le traitement de l'acné 1 à 3 fois par jour pendant 6 à
12 semaines selon la gravite du cas traité.
5 (g) On prépare une lotion capillaire anti-chute et pour la repousse des
cheveux en procédant au mélange des ingrédients suivants:
Composé de l'exemple 1................................... 0,05 g
Composé vendu sous la dénomination "Minoxidil" .......... 1,00 g
Propylène glycol......................................... 20,00g
Ethanol................................................. 34,92 g
Polyéthylèneglycol (masse moléculaire = 400) ...........40,00 g
Butylhydroxyanisole...................................... 0,01 g
Butylhydroxytoluène...................................... 0,02 g
Eau qsp................................................ 100,00 g
On appliquera cette lotion 2 fois par jour pendant 3 mois sur un cuir chevelu
ayant subi une chute de cheveu importante.
(h) On prépare une crème anti-acnéique en procédant au mélange des
ingrédients suivants:
Composé de l'exemple 3........................................ 0,050 g
Acide rétinolque............................................... 0,010 g
Mélange de stéarates de glycerol et de polyéthylene glycol
(75 moles) vendu sous le nom de "Gelot 64" ..par la société
"GATTEFOSSE" ................................................. 15,000 g
Huile de noyau polyoxyéthylénée à 6 moles d'oxyde d'éthylène
vendue sous le nom de "Labrafil M2130. CS" par la société
"GATTEFOSSE" ................................................. 8, 000 g
Perhydrosqualène.............................................. 10,000 g
Conservateurs................................................. qs
Polyéthylèneglycol (masse moléculaire = 400) ................. 8,000 g
Sel disodique de l'acide ethylène-diamine tétracétique ....... 0,0~0 g
Eau purifiée qsp ............................................. 1 00,000g
3~ Cette crème sera appliquée sur une peau atteinte de dermatose ou une peau
acnéique 1 à 3 fois par jour pendant 6 à 12 semaines.
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
(i) On prépare une crème huile dans l'eau en réalisant la formulation suivante:
Composé de l'exemple 7.,,...... ,,.. ,,,............. ,.. , 0,020 g
17~valerate de bétamethasone .. ,.,,.,.... ,.. ,,.. ,,.... , 0,050 g
S-carboxyméthyl cystéine ...... ,.,,, .,.. ,,,.,,.,.. ,.,.... 3, 000 g
Stéarate de polyoxyéthylène (40 moles d'oxyde d'éthylène)
vendu sous le nom de "Myrj 52" par la société "ATLAS" ....... 4,000 g
Monolaurate de sorbitan, polyoxyéthylène à 20 moles d'oxyde
d'éthylène vendu sous le nom de "Tween 20" par la société
"ATLAS" .................................. , ., 1 ,800 g
Mélange de mono et distéarate de glycérol vendu sous la
dénomination de "Géléol" par la societé "GATTEFOSSE".. 4,200 g
Propylène glycol...... ,,,.,.. ,.. ,... ,.. ,,,,... ,.. ,....... 10,000 g
Butylhydroxyanisole .. ,.. ,,,.. ,..... ,, ,,.. ,.......... 0,010 g
Butylhydroxytoluène...... .,... ,......................... 0,020 g
Alcool cétostéarylique........................................ 6,200 g
Conservateurs................................................. q.s.
Perhydrosqualène...... ,,.... ,.. ,.................. ,. 18,000 g
Mélange de triglycérides caprylique-caprique vendu sous la
dénomination de "Miglyol 812" par la société "DYNAMIT NOBEL" 4,000 g
Triéthanolamine (99 % en poids)............................... 2,500 g
Eau q.s.p..................................................... 1 00,000g
Cette crème sera appliquée 2 fois par jour sur une peau atteinte de dermatose
pendant 30 jours.
(j) On prépare la crème de type huile dans l'eau suivante:
Acide lactique.......... ,..... ,,,.. ,........... ,.. ,. 5,000 g
Composé de l'exemple 2.. ,,............. 0,020 g
Stéarate de polyoxyéthylène (40 moles d'oxyde d'éthylène)
vendu sous le nom de "Myrj ~2" par la société "ATLAS" ....... 4,000 g
Monolaurate de sorbitan, polyoxyéthylène a 20 moles d'oxyde
d'éthylène vendu sous le nom de Tween 20" par la société
"ATLAS" ..................................................... 1, 800 g
Mélange de mono et distéarate de glycérol vendu sous la
dénomination de "Geleol" par la société"GATTEFOSSE".......... 4,200 g
Propylène glycol........ ,.. ,...... 10,000 g
Butylhydroxyanisole..... ,.,,,.. ,..... ,,.. ,,................ 0,010 g
Butylhydroxytoluène..... ,.,.,....................... 0,020 g
CA 022~3221 1998-10-0~
WO 98/34909 PCT/FR98/00248
38
Alcool cétostéarylique................................... ..6,200 g
Conservateurs............................................ ..q.s.
Perhydrosqualène......................................... ..18,000 g
Mélange de triglycérides caprylique-caprique vendu sous
la dénomination de "Miglyol 812" . par la société "DYNAMIT
NOBEL" .................................................. ..4,000 g
Eau q.s.p................................................ 100,000 g
Cette crème sera appliquée 1 fois par jour, elle aide à lutter contre le
10 vieillissement qu'il soit photoinduit ou chronologique.