Note: Descriptions are shown in the official language in which they were submitted.
CA 022~7678 1998-12-09
Wo 97t47628 PCT/Fl~97/01050
OrsJanoboranes chiraux
L'invention concerne des organoboranes chiraux, des procédés pour leur préparation et
leur utilisation notamment en tant qu'agent de réduction asymétrique.
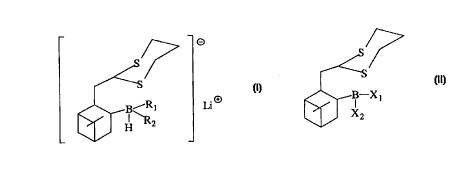
L'invention a ainsi pour objet des composés de forrnules générales I et II
B X
5 dans lesquelles
soit Rl et R2 représentent, indépen(~mmPnt, un atome d'hydrogène ou un radical alkyle
ou cycloalkyle,
soit Rl et R2 représentent ensemble un groupement hydrocarboné divalent saturé;
Xl représente un atome d'halogène; et
o X2 représente un atome d'hydrogène ou d'halogène.
Dans les définitions indiquées ci-dessus, l'expression halogène représente un atome de
fluor, de chlore, de brome ou d'iode, de préférence fluore, chlore, et brome.
L'expression alkyle représente de préférence un radical alkyle ayant de 1 à 6 atomes de
carbone, linéaire ou ramifié, et en particulier un radical alkyle ayant de 1 à 4 atomes de
carbone tels que les radicaux méthyle, éthyle, propyle, isopropyle, butyle, isobutyle,
sec-butyle et tert-butyle.
Les radicaux cycloalkyles saturés peuvent être choisis parmi les radicaux ayant de 3 à
7 atomes de carbone tels que les radicaux cyclopropyle, cyclobutyle, cyclopentyle,
cyclohexyle, cycloheptyle ou cyclooctyl, optionellement substitué par un groupement
20 alkyl inférieur.
CA 022~7678 1998-12-09
W O g7/47628 PCT~R97/OlOSO
-2-
L'expression groupement hydrocarboné divalent saturé comprend de 6 à 8 atomes decarbone et peut être représenté par un groupement de type bicyclo [5,1,1], [4,1,2],
[3,1,3], [4,1,1], [3,1,2], L3,1,1] ou [2,1,2], et de préférence de type [3,1,3].
L'invention a également pour objet un procédé de préparation des composés de formule
s générale I telle que définie ci-desssus, caractérisé en ce que l'on faire réagir un composé
de formule générale III
~ BH2
~ III
avec un composé hydrogéné insaturé applol~ é, pour obtenir un composé de formule IV
~5~
B--Rl
R2 lV
o dans lequel Rl et R2 sont tels que définis ci-dessus,
produit de formule IV que l'on fait réagir avec un organolithien de formule R'Li dans
laquelle R' représente un groupe organique, pour obtenir le composé de formule I.
L'expression composé hydrogéné insaturé approprié représente un composé
hydrocarboné comprenant une ou deux double(s) liaison(s).
5 L'expression groupe organique représente un radical alkyle ou aryl, et de préférence un
radical alkyle tel que tertiobutyle.
, . . , . . . .. . , . ~. .. .
CA 022~7678 1998-12-09
wo 97/47628 PCT/FRg7/01050
- 3 -
Ainsi, la réaction d'un cycloalkyldiène comprenant de 6 à 8 atomes de carbone avec le
~ composé de formule III, permet d'obtenir un composé de formule I dans laquelle Rl et
R2 représentent ensemble un groupement hydrocarboné divalent saturé de 6 à 8 atomes
respectivement. De même, I'obtention d'un radical alkyle et/ou cycloalkyle sur l'atome de
s bore du composé de formule I, est obtenu en faisant réagir l'alkène et/ou le cycloalkène
correspondant(s) respectivement, avec le composé de formule III. Cela signifie qu'un
composé de formule I dans laquelle Rl représente un radical alkyle et R2 un cycloalkyle,
est obtenu en faisant réagir le composé de formule III avec un alkène ayant le même
nombre d'atomes de carbone que la radical alkyle souhaité et un cycloalkène ayant le
o meme nombre d'atomes de carbone que le radical cycloalkyle souhaité. Bien entendu, R
et R2 peuvent représenter le même radical.
L'invention a également pour objet un procédé de préparation des composés de formule
générale II telle que définie ci-desssus. Le procédé de préparation d'un composé de
formule II dans laquelle Xl a la signification indiquée ci-dessus et X2 représente
l'hydrogène, est caractérisé en ce que l'on faire réagir un composé de formule
générale III telle que définie ci-dessus, avec une mole d'un halogénure d'hydrogène de
formule HXl, dans laquelle Xl a la signification indiquée ci-dessus. Le procédé de
préparation d'un composé de formule II dans laquelle Xl a la signification indiquée
ci-dessus et X2 représente un halogène, est caractérisé en ce que l'on faire réagir Ull
composé de formule générale III telle que définie ci-dessus, avec une mole d'un
halogénure d'hydrogène HXI et une mole de l'halogénure d'hydrogène HX2. Bien
entendu, Xl et X2 peuvent représenter le même atome d'halogène.
Le composé de départ III est connu; il peut être préparé par hydroboration du 2-myrtényl
1,3-dithiane par le diborane ou par un complexe du diborane avec un acide de Lewis
(brevet EP 61408).
Les composés de formule I et II peuvent ainsi être préparés sous forme optiquement
active, à partir du composé m sous forme optiquement active.
Les composés de la présente invention sont intéressants en tant qu'agent de réduction
asymétrique. L'invention a donc également pour objet l'utilisation des composés de
30 formule I et II pour des réductions asymétriques. De préférence, les composés de la
présente invention sont utilisés pour la réduction stéréospécifique de(s) fonction(s) cétone
ou imine. La réduction stéréospécifique de cétone ou d'imine, consiste à faire réagir la
cétone ou l'imine avec un énantiomère d'un composé de formule générale I ou II.
CA 022~7678 1998-12-09
W O 97/47628 PCTIFR97/01050
-4-
Les exemples suivants sont présenter pour illustrer l'invention et ne doivent en aucun cas
être considérés comme une limite à la portée de l'invention.
Exemple 1
Préparation du composé (-)-II dans lequel Xl = X2 = Cl
Dans un ballon de 100 ml sous atmosphère d'azote, 3 g (11 mmol) du composé (-)-III
sont mis en suspension dans 60 ml d'éther éthylique anhydre. La suspension est
refroidie dans un bain réfrigérant jusqu'à -60~ C et 5,6 ml (25 mmol) d'éther
chlorhydrique 4,5N sont introduits rapidement . Le bain est retiré, puis la température est
maintenue à -10~ C pendant 2 heures et demie. Le produit précipite sous forme de0 poudre blanche. Le solvant est éliminé sous vide. Le rendement global est de 83,7 %,
calculé sur la base du 2-myrtényl-1,3-(l;thi~n~ borane.
Le solide blanc est recueilli dans 20 ml de tétrahydlorù~ e anhydre et utilisé tel quel
dans les réductions.
Exemple 2
Préparation du composé de fonnule 1, dans laquelle B~ représente B~
On verse 37 g du composé (-)-III dans 140 ml de tétrahydrofuranne anhydre. La
température est ramenée à 0~ C et on additionne, en 30 minutes, 20 ml de
cyclooctadiène dans 20 ml de tétrahydrofuranne. Le mélange réactionnel est alors porté
au reflux toute une nuit. Après refroidissement à -70+ 5~ C, on additionne, en
45 minutes, 81 ml d'une solution 1,7M de t-butyllithium dans du pentane. Le mélange
réactionnel est maintenu à -70 + 5~ C pendant deux heures supplémentaires, puis on
élimine, sous pression réduite et à lelllpGr~lu-~ ambiante, les dirrércnts solvants ainsi que
l'excès de cyclooctadiène. Le résidu obtenu est repris avec 100 ml de MTBE. Après
deux heures d'agitation à telllp~l~ture ambiante puis dec~ntation à -20~ C, on sépare la
phase liquide. Le résidu solide blanc est lavé par 100 ml d'heptane à température
ambiante qui sont ensuite éliminés par filtration. Après un dernier lavage supplémentaire à
température ambiante par 100 ml de MTBE et séchage sous pression réduite, on obtient
45,9 g de cristaux blancs (rendement 86,4 %). Ces cristaux sont conservés à 4~ C sous
argon et à l'abri de la lumière.
CA 022~7678 1998-12-09
wo 97/47628 PCT/FR97/01050
Exemple 3
Utilisation du composé II obtenu à l'exemple 1, pour la réduction ci-dessous:
C~ Cl ~/
S (+) 2
s 1 g (3,15 mmol) du composé 1 solubilisé dans 10 ml de tétrahydrofuranne anhydre
sont ajoutés, à 0 ~C sous atmosphère d'azote, à une solution de 3,7 g (11 mmol) du
composé (-)-II tel qu'obtenu à l'exemple 1, solubilisé dans 20 ml de tétrahydrofuranne
anhydre. La solution est agitée pendant 48 heures à 25~ C. Le solvant est ensuite éliminé
sous pression réduite. Le résidu est repris dans 60 ml d'éther éthylique et 2,6 g
0 (25 mmol) de diéthanolamine sont ajoutés. L'insoluble est éliminé par filtration et le
filtrat est concentré à sec.
Le résidu représente 0,6 g du composé 2 de composition énantiomérique 75 % (+):
25 ~o (-).
Exemple 4
Utilisation du composé I obtenu à l'exemple 2, pour la réduction 1 -> 2 telle que définie
ci-dessus
On dissout 10 g du composé I tel qu'obtenu ci-dessus, dans 45 ml de tétrahydrofuranne
anhydre sous atmosphère inerte. Le mélange réactionnel est alors thermostaté à une
température d'environ -78~ C, et on additionne, en 30 minutes, 0,5 équivalent ducomposé 1 dilué dans 10 ml de tétrahydrofuranne. On laisse la réaction se poursuivre
pendant 2 heures à environ -78~ C. L'excès de borohydrure est neutralisé par de
l'alcool. Le mélange réactionnel est séché sous vide. Le résidu obtenu est redissous dans
25 ml d'éther éthylique et on lave la phase organique par de l'eau, jusqu'à pH neutre.
Après déhydration avec du sulfate de sodium, filtration et séchage sous vide, on récupère
8,9 g d'un mélange que l'on séparé par chromatographie sur colonne de silice. Lerapport des énantiomères du composé 2 est de 96 % (+): 4 % (-).
CA 022~7678 1998-12-09
W O 97/47628 PCTAFR97/OlOSO
-6-
Exemple 5
U~ilis~tion du composé de lormule l, dans laquelle B~ repri~sente B~
préparé in situ, pour la réduction 1 -> 2 telle que définie ci-dessus.
a) ~l~pal~lion du ~Qm~2osé (+) 2:
214,2 g de (-) myrtényle dithiane dissous dans du THF (1280 ml), sont ajoutés à du
s 9-bora bicyclo [3,3,1] nonane. Après dissolution, le mélange réactionnel est chauffé au
reflux pendant toute une nuit, pour l'achèvement de la réaction, puis refroidi à -80~ C.
Puis, le tertio butyl lithium est ajouté en moins d'une heure, en maintenant la température
entre -60 et -80~ C.
On ajoute ensuite, par fractions, le composé 1 (100 g), en moins de 15 minutes. Le
0 mélange est maintenu deux heures à -60~ C. A ce moment précis, le composé 1 est
entièrement transformé.
Après un traitement comme dans l'exemple précédent, le composé (+) 2 est cristallisé à
partir d'hexane (530 ml), pour donner 52,1 g avec une composition 98,2 % (-) /
1,8 % (+).
5 b) Préparation du çQmposé O 2:
On dissout 39,5 g du composé (+) III dans du THF (240 ml). La solution est refroidie
à 0~ C et incorporée à une solution de 1,5 cyclo octadiene (15,9 g) dans du THF
(45 ml).
La solution résultante est chauffée à reflux pendant toute une nuit, puis traitée comme
20 ci-dessus avec du tBuLi pour réduire le composé 1 (21 g) et donner, après traitement
usuel, le composé (-) 2 (10 g - ee 100 %).