Note: Descriptions are shown in the official language in which they were submitted.
CA 02262814 1999-01-13
- WO 98/02~;29 rCT/F:R97/012S0
LIGNEES D'ENCAPSIDATION HAUTEMENT PRODUCTRICES
L'invention a pour objet de nouvelles lignées cellulaires dites
lignees d'encapsida~ion (1i3nées de packagin3) productrices de retrovirus
5 reco",~inants à haut titre et ~tiii~le~ chez l'~lo,n"~e en thérapie génique.
Le l~dnsfe,l de gènes par rétrovirus recGi"binants est
actuellement largement utilisé aussi bien pour des travalD~ expé-i",enlaux
que dans le cadre d'essais thérapeutiques.
Les vecteurs rétroviraux utilisés dans ces différentes
o situations sont habituellement produits par des lignées dites ~ de
- packaging ~ ou d'en~r~ et~ge ou de tra"scoi"plémentation ces trois
termes ayant ta meme signification; ces lignées sont des cellules ayant éte
transduites avec des constructions génétiques perrnettant l'exp,ession
constitutive des cJirrérentes protéines nécessAires à la ~abrication d'une
particule rétrovirale contenant les protéines de structures et les enzymes
nécessaires à leur infectiosité. L'objet de lignée d'encapsidation est de
fournir par transcomplémentation des fonctions ~ helper ~ en particulier
les gènes codant pour les protéines qaa Pol et env qui ont été enlevées
du vecteur génomique porteur d'un transgène dont on recherche
I'expression par utilisation - d'un virus infectieux défectif. Ces fonctions
~ helper ~ dépourvues de la séquence ~ sont exprimées de façon stable
dans les cellules de transcomplémentation après transfection d'un ou
plusieurs plasmides les contenant el dont les transcrits RNA ne sont pas
encapsidés dans les particules virales suite à la délétion de la séquence
d'encapsidation ~. Quand ces cellules d'encapsidation sont ensuite
transfectées par des vecteurs porteurs du Iransgene les protéines virales
aaa produites par la cellule de packaging peuvent enr~pci~er le vecteur
rétroviral porteur du transgène dans des particules virales qui sont ensuite
relarguées dans l'environnement. (pour une revue voir Miller AD Gene
Ther. 19901: 5-~4).
CA 02262814 1999-01-13
WO 3~/0~5~5 P~ 97/01250
Sur ce ,c ri,~eipe genéral difr~:renl~ types de lignees de
packaging ont été réalisés et sont largement utilises aujourd'hui.
Cependant ces lignées sont loin d'être optimisées notaln",ent en fonction
de leur utilisation pour un transgène spécifique ou des modalités
5 particulières. En particulier il n'existe aucun moyen de faire disparaître les cellules transduites a.JI~inist~ées aux patients si le transgène ou son
produit d'expression induit des effets indésirables (par une ex~ression
inadéquate ou une insertion inappro~riée). Un autre aspect pour lequel il
est important de disposer de cellules d'emp~ etage susceptibles d'être
o détruites en cas de besoin sont des problèmes strictement de securité
sachant que des recombinaisons pourraient conduire à la formation de
virus infectieux à partir des lignées d'empaquetage.
Le choix des cellutes de départ dans lesquelles peuvent être
réalisées des lignées de packaging est e,~lrên,e",ent ir"po,lanl au regard
des propriétés attendues et de leur utilisation clinique potentielle. A ce
jour la plupart des lignées cellulaires utilisees en clinique sont toutes
derivées de fibroblastes d'origine murine les cellules NIH-3T3. L'intérêt de
ces cellules est qu'elles sont parfaitement caractérisees qu'elles ne sont
pas transformees (elles ne donnent pas de tumeur lorsqu'elles sont
20 reinjectées in vivo) qu'elles proviennent d'animaux élevés depuis de
nombreuses genérations et dont on sait qu'ils ne présentent pas de
pathologies particulières (de type neurodégenératif par exemple) qui
permettraient de suspecter la présence d'un agent infectieux transmissible
chez ces animaux et donc potentiellement dans les cellules utilisées. De
25 plus I'utilisation de cellules murines offre un degré de sécurité
supplémentaire en cas de conla",ination par un agent infectieux
Il ans,~issible inconnu du fait de la restriction d'espèces fréquemment
observée en pathologie infectieuse. Cependa,)t I'un des défauts dont
souffrent les cellules murines est du au fait que les virus produits par ces
30 cellules et les cellules elles-memes sont la plupart du temps rapidement
neutralisees par le complément humain. Un moyen simple de palier ce
CA 02262814 1999-01-13
WO ~J~LS~9 r~ s7/0l2so
défaut est de produire des ~ell~les de packaging à partir de cellules
humaines ou d'une autre espèçe mais r&sislante au complément humain.
Cependa"t dans le cas des cellules humaines elles sont
souvent trans~o",)ees et ont donc un potentiel tumoral. De plus on ne
s connaît évidemment pas de façon détaillée l'origine des cellules et leur
contamination possible par des agents in~ectie~n~ d'origine inconnue et
capables d'in~ler l'homme.
Les cellules simiennes pourraient être utilisees comme les
cellules humaines pour leur propriété de faire des particules virales qui ne
o seraient pas détruites par le complément mais elles ont de fait les
mêmes défauts que les cellules humaines co"ce",ant la possible prbsence
d'agents infectieux.
Ce peut être des cellules murines dans lesquelles ont été
transférés des gènes leur conferant une plus grande resistance au
complement eVou au sérum humain.
Ces gènes peuvent être notamment le CD46 le CD55 le C,
inhibiteur (C,INH) la protéine H le CR, soluble et notam",ent une forme
multimérique telle que celle décrite dans le brevet FR 9~08901.
L'objet de la présente invention est de fournir des moyëns
pour la préparation de nouvelles lignées d'encapsidation remédiant au
moins en partie à un ou plusieurs des problèmes précedemment décrits et
S nscel,libles:
- de produire des rétrovirus recombinants à des titres éleves;
- d'être bien tolérées;
-d'être résistantes au complément tout en restant
acceptables quant à leur sécurité;
- d'être faciles à produire dans des conditions de bonne
pratique de fabrication et ayant une stabilité dans leur expression au moins
égale à 3 mois;
CA 02262814 1999-01-13
WO 98/02~;29 rCI~ V7/01250
- de disposer d'un gène de sélection pe"netla"t une sélection
positive de celles des cellules de sang qui ont incorpore le vecteur porteur
du t,ar,sge"e;
- de disposer d'un systeme de sécurité permettant de détruire
s les cellules en tant que de besoin.
Pour aboutir à ces dirrerents prérequis, il est néGess~ire
d'optimiser, d'une part, le choix des lignées cellulaires de départ, ainsi que
le choix de chacun des constil.lants nécessaires à l'obtention de la
particule rétrovirale recoi"binante infectieuse defective, en particulier, le
o choix des vecteurs permettant de rendre la cellule de packaging
productrice des proteines Ç~ et env du rétrovirus.
En ce qui concerne la production de ces cellules dans des
cultures en masse ré~iisées en condition de bonne pratique de fabrication
(GMP) pour la production de cellules ou de virus à usage clinique, il est
nécessaire d'avoir des cellules dont les caractéristiques de croissance
soient parfaitement connues, avec des temps de division brefs, poussant à
haute densité, le cas échéant, en suspension.
Enfin, il est nécess~ire de pouvoir sélectionner à partir des
cellules utilisées des transfectants stables exprimant les différents
20 transgènes d'intéret. Actuellement, on utilise la transduction des cellules
de packaging par un vecteur unique portant le gène d'interêt et un gène dit
de sélection, ou par deux vecteurs séparés. Lors de la culture ultérieure
des cellules transduites, il est en général nécess~ire de maintenir la
sélection pour ne pas perdre le transgène d'intérêt. Cependant, il est
25 connu que différents types de modification peuvent aboutir à la perte
d'expression du gène thérapeutique, meme en presence de cette sélection.
Ceci est particulièrement vrai lorsque le transgène à une certaine toxicité
conférant alors un avantage sélectif aux rares cellules l'ayant perdu.
L'utilisation possible de cellules déficientes en certains enzymes
30 permettant leur sélection sur ce critère serait donc un avantaye
supplémentaire, surtout lorsque le gène d'intérêt thérapeutique
CA 02262814 1999-01-13
WO 98/02S29 PCI~/FR97/01250
complémente la déficience. En d'autres termes, I'utilisation comme gène
de sélection, au lieu d'un gène de résistance à un toxique (un sntibiotique
en genéral), d'un gène supplé",entant une déficience genétique de la
cellule présente de no,nbreux avantages dont l'un est la possibilite de
s cultiver lesdites cellules en l'abse"ce du toxique. De plus, si ce gène est
aussi le gène d'intérêt, il n'est plus possible de le perdre au cours de la
sélection même lorsqu'il conrèr~ un désavantage sélectif Ce gène peut
aussi être un gène dit ~ de sécurité ~ ou a gène suicide ~ ce qui signifie
que le produit d'expression de ce gène en presence d'une s~hstAnce
o exogène conduit à la destruction spécifique de la cellule.
L'invention a donc pour objet des cellules eucaryotes
d'empaquetage pour la production de virus infectieux défectifs porteurs
d'un transgene caractérisée en ce qu'elles sont déficientes èn une fonction
cellulaire essentielle à leur croissance, notamment en présence d'un milieu
de culture de selection, ladite fonction étant susceptible d'être restaurée
par l'expression d'une séquence exogène introduite dans la cellule:
- soit avec un vecteur porteur des fonctions
transcomplémentantes des cellules d'empaquetage;
- soit avec un vecteur porteur du transgène;
- I'expression de la séquence exogène ainsi introduite dans la
cellule permettant la selection en milieu selectif des cellules porteuses de
ladite séquence.
La cellule eucaryote d'empaquetage selon l'invention est
caractérisée par le fait qu'elle vérifie l'un ou plusieurs des propriétés
2S suivantes:
- - elle est susceptible de produire des particules virales à un
taux supérieur à ~ o5 particules par ml;
- elle est résistante au complément ou elle produit des
particules virales resistantes au complement;
- elle a un temps de division inférieur à 30 heures;
CA 02262814 1999-01-13
WO 98/02S29 PCIIFR97/01250
- elle est stable au moins 3 mois dans un mi~ieu de culture
non sélectif;
- elle est dépourvue de retrovirus e"dogè,~es.
L'invention porte également sur des lignées d'empaquetage
- 5 productrices de virus infectieux ~lé~eclirs, porteurs d'un gène d'intéret
thérapeutique dans le~uel le gène d'intérêt lui-même porté par un vecteur
approprié est utilisé comme gène de sélection de la lign~ee d'empag~ let~ge
susce~lil)le de produire les virus recombinants défectifs.
Sur cette base, plusieurs types de cellules peuvent être
o utilisés:
des cellules NIH-3T3 T~,
a) les cellules murines NIH-3T3 qui sont actuellement
largement utilisées comme cellules de packaging productrices de
rétrovirus recor"binants utilisés en clinique (Takahara et al. dans Journal
of Virology, (1992 juin) 66 (6) 372~-32).
b) des lignées T~ ont déJà été décrites dont des cellules
NIH-3T3 T~ (F. Wagner et al., EM80 Journal ~198~), Vol. 4 n~ 3,
pages 663~66); ces cellules peuvent être tuées lorsqu'elles sont cultivées
dans des milieux de culture sélectifs comme le HAT. Alors que si elles sont
complémentées pour la fonction thymidine kinase, par exemple celles
provenant du virus HSV1-TK, elles peuvent alors pousser en milieu
sélectif; de telles lignées offrent donc la possibilité d'utiliser le gène
~ISV1-TK comme gène de sélection. Le gène codant pour la thymidine
kinase de HSV1 ou un de ses dérivés fonctionnels est aussi largement
utilisé comme transgène à titre de prodrogue transformant le gdnciclovir ou
l'acyclovir en drogue cytotoxique pour la cellule, trouvant ainsi son
application dans la destruction sélective de cellules, par exemple de
cellules cancéreuses (voir par exemple W0 8~122617).
De manière plus genérale, des cellules T~ peuvent être
dérivées par mutation de toute cellule susceptible d'être utilisée comme
cellule d'e"~pa~,Jetage, par exemple les cellules Vero.
~ , ,
CA 02262814 1999-01-13
WO 98/02529 1~ rl~97/ol2so
Ainsi, lorsque le gène thérapeutique porté par un vecteur
d'expression est introduit dans une cellule de packaging déficiente pour la
thymidine kinase, la séle~tion de la cellule de packaging ayant intégré le
vecteur porteur du l,a,.s~ene se fait sur le gène thérapeutique lui-même,
per",etl~nt ainsi d'auy"lenler la productivite de la culture en virus
recombinants defectifs, les cellules de packaging n'ayant pas integre le
vecteur recombinant étant ipso facto éliminées en milieu sélectif.
De maniere plus générale, I'invention porte sur des cellules
d'errl~a~l~et~ge déficientes en une fonction cellulaire essentielle à leur
o croissance et dans laquelle le transgène est susceptible de restaurer la fonction cellulaire déficiente.
Il est important que les vecteurs défectifs infectieux
recombinants porteurs d'un transgène soient résistants au complément
ainsi qu'aux autres facteurs potentiellement destructeurs de virus ou de
cellules dans le sang ou dans les fluides in~ersliciels; pour ce faire, les
lignées cellulaires de l'invention peuvent avantageusement être elles-
mêmes résistantes au complement et donc préférentiellement être issues
de cellules humaines ou simiennes et plus particulièrement de singes de
l'Ancien Monde ou cellules humaines modifiées.
Dans le cas de cellules humaines ou simiennes, il est
important de disposer de cellules dont l'origine est claire, à savoir non
porteuses d'agents infectieux d'origine incGi")ue et capables d'infecter
l'homme. La lignée ~43 B TK est une lignee d'origine humaine connue
(Manservigi R. et al dans Virology, (1988 Novembre) 167 (1 ) 284-8); elle a
2~ un temps de division bref c'est-à-dire d'environ dix-huit heures et elle
- produit des particules virales résistantes au complément. Elle peut donc
avantageusement être ùtilisée comme cellule de packaging de l'invention.
Les cellules Vero sont également largement utilisées notamment pour la
production de vaccins; ce sont des cellules simiennes qui produisent
également des particules virales résistantes a la neutralisation par le
~ complément; les conditions de culture de ces lignées sont parfaitement
CA 02262814 1999-01-13
WO ~Uû25~5 . I ~,lirAg7/0~250
connues et une lignée déficiente en thymidine kinase pourra etre obtenue
par les techniques classi!lues et etre avant~ge!~sement utilisée apres
l~nsfoi"~ation par les vecteurs pe"netlant la construction de packaging
co""ne lignée d'empaquetage ayant les caractéristiques des lignees de
I'invention.
La fonction d'une lignée cellu~ire d'empaquetage de
rétrovirus est de foumir les fonctions transcomplémentantes qui ont été
délétées du vecteur recombinant porteur du transgène ces fonctions étant
essentiellement les genes codant pour les protéines qaa, ~ et env. Ces
o fonctions sont exprimées de façon stable dans les cellules de packaging à
partir d'un ou de préférence deux moins deux plasmides distincts afin de
reduire très fo(l~n,e"l la possibilité de générer des particules
recombinantes compétentes pour la réplication. Des lignées de packaging
existantes ont été realisées à partir de protéines rétrovirales murines ou
aviaires et sont decrites dans Miller AD Hum Gene Ther 1990 1: ~-14.
Les gènes qaa et E~ des rétrovirus murins sont synthétisés
habituellement par le meme ARN qui donne naissance à des précurseurs
4aq ou des précurseurs Q~Q/~ par décalage du cadre de lecture. Ces
processus sont bien optimises dans la particule rétrovirale de type
Moloney et les constructions destinées à faire la cellule d'empaquetage de
l'invention ne toucl)eront pas à la structure LTR qaal~, a l'exception de la
délétion de ~. Le choix des gènes qa~~ ainsi que des LTR sera fait en
fo"ction de l'objectif qui est d'avoir un taux élevé de particules virales
recombinantes déf~ctives produites élevé et par consé~Jent l'expression
la plus forte possible de ces gènes qaq/~ est recherchée.
Selon un mode de réalisation de l'invention les cellules
d'encapsidation sont caractérisées en ce qu'elles compre"nent:
- un vecteur porteur d'un LTR lui-même caractérisé par une
bonne eKicacité de transcription par exemple le LTR du virus de Friend
FB29 ~voir WO 96/17071 );
CA 02262814 1999-01-13
WO 3~ ,25~5 r~ n97/012S0
- une region aaalE~ issue, soit du virus de Moloney, soit du
virus de Friend ou de tout autre rétrovirus à partir du moment où la
structure et l'expression de cette fo"ction sont ~Jti,).isées;
c) un gène de sélection qua"tilative c'est-à~ire tel que
s lorsque l'on augmente la pression de s~lection, on augmente a priori le
nombre de lldnsui~ synthétisés.
Si le gène de sélection de type qua,)li~atir est situé sur le
même plasmide que le plasmide codant pour ~aq et E~, I'augmentation du
nombre de transcrits codant pour le gène de selection augmente de la
o meme manière que le nombre de transcrits codant pour aaa et ~.
L'optimisation sera encore améliorée si l'on fait en sorte que la traduction
du gène de sélection soit plus faible que celle de ~/~.
Pour ce faire, le gène de sélection est situé soit à environ une
centaine de paires de bases du codon stop de ~!, soit sous le contrôle
d'une séquence IRES normale ou mutée (pour Internal Ribosome ~ntry
Sites) de telle façon que l'initiation de la traduction soit moins efficace que
celle des gènes gaq et e~ La mutation peut consister à supprimer l'ATG
principal, I'initiation se faisant alors sur un ATG moins performant
préexistant ou généré par mutation.
Les séquences JRES sont des séquences qui ont éte utilisées
dans des constructions rétroviraJes pour maîtriser la traduction des
t~2nsc~ it5 d'ARN polycystroniques. Les séquences IRES peuvent initier
directement une tr~duction dans un codon d'initiation. Ainsi, I'inclusion
d'une telle séquence peut permettre d'exprimer plusieurs gènes a partir du
meme promoteur.
L'autre altemative qui est de situer le gène de sélection à
environ une centaine de bases du codon stop de ~ permet également
d'atténuer la traduction du gène de sélection par rappo,l à la traduction
des gènes Q~/~.
Le gène de sélection peut egalement être situe sur le vecteur
porteur du gène env quand celui-ci est distin~t de celui portant aaa/~!;
CA 02262814 1999-01-13
WO g8/02529 PCI'/~971012S0
enfin les deux vecteurs de construction de la cellule de packaging peuvent
l'un et l'autre porter un gene de sélection.
Les gènes de sélection peuvent par exemple être des gènes
de type BSR c'est-à~ire de résistance à la bl~-sticidine S ou un gène de
s résistance à la zéomicine. Le gène de résislc")ce à la blastici~ine est un
gène de sélection pour les cellules animales qui a été décrit notamment
par IZUMI M. et al dans Ex~eri~e"tal Cell Research (1991), 197: 229-233.
Ce gène semble particulièrement efficace puisqu'il a été nota~ "enl utilise
comme marqueur de sélection pour produire des hybridomes producteurs
d'anticorps monoclonaux humains avec un bon rendement (Journal of
Immunological methods, 1994, 177: 17-22).
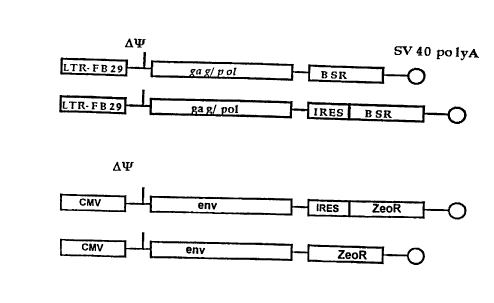
Un exemple de vecteur particulièrement app~c,prie à la
construction des lignées de packaging de l'invention est representé dans
la figure 1 a.
Le deuxieme vecteur utilisable pour la construction de la
cellule d'empaquetage est porteur de gènes codants pour les enveloppes
de rétrovirus. La plupart des gènes codant pour les enveloppes de
rétrovirus pourraient avoir un certain degré de toxicité pour la cellule; or, ilest nécess~ire d'avoir des quantités suffisante de protéines d'enveloppe
qui soient synthétisées pour que les particules rétrovirales recombinantes
défectives soient bien infectieuses.
Les séquences env codant pour les peptides dérivés d'une
enveloppe, par exemple enphotrope peuvent être par exemple l'enveloppe
4070a du virus de la leucémie murine de Moloney (MoMuLV). Mais, tout
2~ type de gène codant pour une proteine d'enveloppe s~sceptible d'être
integrée dans la n,er"bra,1e cellulaire au moment du bourgeonnement du
rétrovirus est utilisable; le choix de la protéine env peut être guidé par la
nature du recepteur de la cellule cible que l'on souhaite t,a"srecler par le
virus rétroviral recombinant défectif. Le gène env porte par le plasmide de
construction de la cellule d'empaquetage est sous la dépendance de
séquences regulatrices de transcription virales ou non virales. Il peut s'agir
CA 02262814 1999-01-13
WO 98/02529 P~,lir~7/01250
de pr~,noteurs forts comme le ~,r~",oteur du cytomégalovirus (CMV) dans
le cadre de constructions génétiques telles que la présélection oblige la
cellule à synthétiser des quantités i, npol lanles d'enveloppes. Par
~ prc""oteur fort ~ on entend toute sequence d'acide nucleique
- 5 coi"po,lant le site de fi~alion de l'ARN polymèrase ainsi que les sites de
fixation des protéines régulatrices et permettant un taux élevé de
transcription de la séquence située sous le controle dudit pron,oteur.
Il peut s'agir également de p,-o",oteurs inductibles qui
permettraient une absence ou une expression faible d'enveloppes qui
o pourraient être ensuite induites de façon transitoire lors du recueil des
particules virales. Par ~ promoteur inductible ~ on entend une séquence
promotrice activable à volonte par une molécule donnée; ce type de
pro",oteur est utilisé chaque fois que l'on désire déclencher à la demande
l'expression d'un gène donné.
Des exemples de promoteurs inductibles susceptibles d'etre
utilisés dans la construction des cellules d'empaquetage de l'invention sont
les promoteurs inductibles par la tétracycline décrit par Bujard et al. dans
Mol. and Gen. Genetics (1977 Dec9) 157 (3):301-11 ou les promoteurs
inductibles conditionnels tel le pron,oteur RAR-~ (~)apanese ~ournal of
Genetics (1993 juin) 68 (3) 175-84); les a promoteurs conditionnels ~ sont
cGnsli~ués d'une séquence pro"~ol,ice activée par un ou des facteurs
trans-regulateurs spécifiquement produits par un tissu donné mais non
nécessairement identifies comme par exemple le promoteur de l'insuline
sensible à des facteurs strictement pancréatiques.
Ces constructions peuvent s'appliquer a tous les gènes env
classiques de type 4070A du virus de la leucémie murine de Moloney
(MoMuLV) ou à des enveloppes qui pourraient être utilisees en fonction de
leurs propriétés particulières nota""nent la résistance au complément de
type RD114. Des enveloppes de type HTLV1 ou dérivés de lentivirus tels
que foamy virus peuvent également etre utilisées.
CA 02262814 1999-01-13
WO 3~ 5)5 I C,l/r~97/01250
Des gènes d'enveloppe ayant un tropisme particulier pour
des cellules cibles s~ ~-sceplibles d'etre transfectees par des virus
~co",binants defec~ produits par les cell~les d'empaquQt~ge peuvent
être avantageusement utilisés, par exemple des sequences d'enveloppe
- 5 de spumavirus ayant un l,opis",e particulier pour les cellules
hei"alopoïétiques humaines.
Enfin, dsns le cadre d'un système ind~ctihle tel que décrit
plus haut, il serait alors possible d'utiliser des enveloppes de type VSV-G.
Le vecteur porteur du gène env con,po, le en 3' une sequence
o de polyadénylation telle celle issue du virus SV40. Un exemple de vecteur
porteur du gène env est montré dans la figure lb, dans laquelle ZeoR est
le gène de résistance à la zéomycine.
Les deux vecteurs pe-llletldllt de constituer la cellule de
packaging sont bien évidemment dépourvus de séquences
IS d'encapsidation.
Les cellules d'empaquetage recombinantes telles que
décrites ci-dessus avec leurs différents modes de réalisation sont
susceptibles d'être transfectées par un vecteur rétroviral recombinant pour
l'expression eUou l'intégration au sein du génome d'une cellule cible d'une
20 séquence de nucléotides choisis (transgene) pour un intérêt thérapeutique.
Ce transgène peut être, soit une séquence codant pour une fonction
déficiente dans la cellule cible et dans laquelle on souhaite restaurer ladite
fonction, ou pour introduire une fonction complémentaire eVou régulatrice
dans la cellule cible, ou encore et sans être limitatif une séquence
25 permettant d'activer des prodrogues comme dans le cas du gène de la
thymidine kinase du virus de HSV1 tran~ror,nant le ganciclovir ou
l'acyclovir en drogue toxique et destructrice des cellules, ou le gene de la
cytosine desaminase transformant un précurseur 5 fluorouracile en drogue
active; cela peut être enfin un transgene permettant d'induire ou de
30 stimuler le système immunitaire, soit par manipulation des cellules
tumorales, soit par manipulation des cellules du système immunitaire lui-
CA 02262814 1999-01-13
WO 98t02529 - PCI~/FR97/01250
même ou au contr~ire un l~ns~e"e permettant de spécifiQuement inhiber
une réponse immunitaire dans le cas par exemple du rejet de greffe ou
dans le cas de maladies auto-immunes.
La structure ye,)erale d'un vecteur rétroviral porteur du
s transgène nécessite la présence de deux LTR encad~nt le ou les gènes
d'interêt ou transgènes et porte la région pel",ell~nt l'enc~-si~tion du
L~nsc, il dans la particule pseud~rétrovirale dont les protéines de
structure sont codées par la cellule d'empaquetage de l'invention.
En ce qui concerne les LTR utilisés, seront préférés, soit ceux
o dérivés des souches de Moloney, tels que ceux dérivés des souches Mov
(réf. Jaenish) pour leur plus grande capacité à s'exprimer dans des cellules
peu ou non différenciées que sont entre autres les cellules tumorales et,
décrits dans la demancle de brevet EP n~ 0674716 où les LTR dérivés des
virus de Friend pour leur haut taux d'expression comme cela a éte décrit
15 ci-dessus.
L'invention porte également sur des vecteurs rétroviraux
recombinants porteurs d'un gène héterologue dont l'expression est
recherchée dans une cellule cible, caractérisée en ce qu'ils comportent:
- un gène d'intérêt thérapeutique X, sous le contrôle d'un
20 promoteur,
- une séquence nucléotidique Y dont l'expression
complémente la fonction déficiente dans la cellule d'empaquetage,
- une séquence d'encapsidation ~,
- le cas écheant un gène de sécurité Z dont l'ex~ression en
25 présence d'une substance exogène conduit a la destruction de la cellule
t~ a, Isrectée ou infectée.
Quand le transgène d'intérêt thérapeutique est un gène
suicide par exemple celui codant pour HSV1-TK ou l'un de ses derivés
fonctionnels, les séquences X et Y ou Y et Z ne forment qu'un seul et
30 même gène, et l'utilisation d'un tel vecteur permet de sélectionner lesdites
cellules d'empaquetage qui ont été transfectées par ledit vecteur
CA 02262814 1999-01-13
WO g8102529 PCT/FR9~/01250
Un bon titre viral depend du "o" ,bre de transuits
encapsidables produits par la cellule d'empaquetage.
L'invention porte également sur le procédé d'obtention de
virus reco,nbinants infectieux dé~ecti~s a haut titre dans les cellules telles
que décrites ci-r~essus et coi"prenant:
a) I'infection ou la transfection desdites cellules par un
vecteur reco",L,i"ant p~rteur au moins d'un gène d'interet thérapeutique X;
- une séquence nucléotidique Y dont l'expression
complémente la foncliGn déficisnte de la cellule d'empaquetage si cette
o déficiente s!~siste après construction de ladite cellule d'empaquetage par les vecteurs porteurs des gènes aal E~Let env;
- une séquence d'encapsidation ~;
- et le cas échéant un gène de sécurité Z dont l'expression en
présence d'une substance exogène conduit à la destruction de la cellule
transfectée ou infectée;
b) la sélection desdites cellules dans un milieu de culture de
selection dans le cas où la cellule d'empaquetage est déficiente pour une
fonction donnée et que le vecteur porteur du transgène supplée cette
déficience.
Quand les lignées d'empaquetage sont déficientes en
thymidine kinase le vecteur porteur du transgène sera un vecteur
bicistronique pe""ellant la sélection en présence d'un gène thymidine
kinase de HSV1 ou un dérive fonctionnel de celui-ci. Une propriété
su,~re"a"le du gène HSV1-TK est que un taux d'expression éleve peut
entralner une toxicite pour la cellule empechant d'obtenir un r,o",bre élevé
de transcrits. Dans ce cas de toxicité du gène la sélection des cellules
productrices aboutit à l'obtention de clones dans lesquels l'expression du
gène est faible et donc le titre infectieux très bas. Le vecteur de l'invention
susceptible d'infecter ou de transfecter les cellules d'empaquetage décrites
ci-~ess!)sl sera donc construit de telle façon que la production des
trar,sc,ils encapsidables du transgène soit élevée en comparaison avec la
CA 02262814 1999-01-13
WO 98/02S29 PCT/FR97/01250
production des protéines HSV1-TK. Ainsi, une cellule d'empaquetage T~
transfectée par un vecteur bicistronique porteur, d'une part, d'un transgène
et, d'autre part, de HSV1-TK ou l'un de ses derivés peut à la fois être
sélectionnée dans le milieu sélectif HAT et être productrice de particules
virales à haut titre, tout en évitant une contre-sélection due a l'activité
toxique du HSV1-TK lorsque le gène est traduit activement. Ceci permet
donc la ré~lis~tion de cellules d'~",pa4uetage disposant d'un titre élevé et
qui produisent des rétrovirus ~Jéfe~l,rs codant, soit pour HSV1-TK seul, soit
pour un gène d'intérêt et HSV1-TK.
o Cette différence dans la production de transcrits du
transgèneX, d'une part, et de Y, d'autre part, est réalisée par la
construction de vecteurs recombinants dans laquelle la séquence
nucléotidique Y dont l'expression complémente la fonction déficiente de la
cellule d'e",pa~ etage, par exemple HSV1-TK, est située soit à environ
une centaine de paire de bases du codon stop du transgene, soit sous le
contrôle d'une séquence de type IRES normale ou mutée telle que décrite
ci-dessus de telle façon que l'initiation de la traduction de la sequence Y
soit moins efficace que celle de la séquence X.
Dans le cas où le transgène est lui-même le gène permettant
la selection des cellules d'empaquetage, c'est-à-dire dans le cas où X et Y
sont un seul et même gène (par exemple HSV1-TK), le gene d'intérêt lui-
même est utilisé comme gène de sélection. Au contraire, quand le gène X
et le gène Y sont clirrérenls, le gène Y peut alors assurer également une
fonction de gène de sécurité Z car il permet le cas échéant de détruire les
cellules t~ans~ectées avec le gène thérapeutique par lr~ile",er,l du malade
avec une substance transformant la prodrogue en drogue toxique.
Dans le cas où la séquence Y et le cas échéant la séquence
Z codent pour HSV1-TK, un exemple de réalisation du vecteur recombinant
de l'invention est representé sur la figure 2.
Dans cette figure, les deux vecteurs représentés montre"t la
difference entre les deux modes de réalisation pen"etlant une moindre
CA 02262814 1999-01-13
WO 98/02529 PCI'/FR97/01250
16
expression du gène HSV1-TK (séquences Y et Z réunies), soit par une
certaine distance du codon stop du gène X, soit par l'introduction d'une
séquence IRES. La séquence rspréser,~ée par gag~ signifie que la
séquence d'en~psi~tion peut cG,nprendre non seulement la région
s génétique nécess~ire à l'enc~rsi~tion mais également la partie du gène
gag mute qui ne permet pas la reconstitution de la protéine gag mais qui
peut augmenter l'efficacité d'encapsidation.
Les propriétés de HSV1-TK sont compatibles avec cette
conception. En effet, de très faibles quantités de TK sont suffisantes pour
pouvoir selectionner en présence d'un milieu sélectif HAT des clones
cellulaires derivés de cellules TK négatives; de la même manière, une très
faible expression de TK est suffisante pour obtenir une bonne sensibilité
au ganciclovir.
Dans certains cas, les trois gènes X, Y et Z ne peuvent
représenter qu'un seul gène comme, par exemple, il s'agit du gène HSV1-
TK qui joue à la fois le rôle de transgène, de gène de sélection, et de gène
de sécurité. Une construction comme celle-ci presente l'avantage de
pouvoir ajouter dans le vecteur un deuxième gène thérapeutique, par
exemple un gène qui code pour des cytokines lorsque l'on souhaite
eliminer des cellules cancéreuses.
Un autre mode de realisation de l'invention, lorsque le gène
TK est le gene thérapeutique lui-même, peut être caractérisé par le fait que
le gène Y peut être un gène codant pour un autre marqueur de sélection
par exemple le gène BSR cité plus haut ou un autre gene d'intérêt
2S thérapeutique cGr"rne par exemple un gene de cytokine.
- Pour une expression optimisee du gène Y, ce dernier peut
être placé sous le contrôle d'un promoteur interne faible qui peut être lui-
même atténué par un ~ read through ~ par le LTR du vecteur rétroviral.
Dans cette condition le LTR 3' du vecteur peut également contenir une
délétion de l'amplificateur de sorte que ce ~ read through ~ n'empêche pas
CA 02262814 1999-01-13
WO 98/02529 ~ irl~g7/012SO
l'expression après infection de la cellule cible par les particules virales
, eoombin~ntes.
De manière générale, le procédé d'obtention de virus
recombinants défectifs à haut titre peut porter sur tout transgène dont
I'absence induit une pression de sélection négative pour la cellule
d'empaquetage; une cellule ainsi delétée du gène codant pour ce
transgène serait alors ~ sauvée ~ par le vecteur rétroviral qui ~ouerait en
meme temps le role de vecteur de sélection. Ceci s'appliquerait ainsi à tout
gène celiulaire dont la sure~,, ession induit une pression de sélection
o négative pour la cellule puisque seules les cellules d'empaquetage
porteuses et productrices de rétrovirus recombinants seront sélectionnées
positivement même dans le cas où l'expression du gène d'intérêt aurait
tendance à contre-sélectionner ces cellules.
L'invention porte sur l'tltilis~tion des cellules d'empaquetage
et des vecteurs decrits ci-dess~s dans la préparation d'un médicament de
thérapie génique possédant les qualités de securité, et d'efficacite
requises pour ce type de médicament, à savoir résistants au complement
et ayant la possibilité d'être detruits in situ en tant que de besoin.
L'invention porte sur l'utilisation des cellules d'empaquetage
selon l'invention et des vecteur recombinants porteurs d'un gene d'intérêt
tel que décrit ci-dessus à la transformation de cellules cibles du système
immunitaire telles les cellules souches hématopoïétiques, des cellules
Iymphocytaires ou des cellules cancéreuses.
L'invention porte également sur l'utilisation des cellules
d'empaquetage telle que décrite plus haut dans un procédé de coculture
de cellules cibles d'un retrovirus infectieux défectif porteur d'un gène
d'intérêt en thérapie génique et produit par les cellules d'empaquetage,
ces dernières devant être impérativement détruites avant utilisation
desdites cellules cibles ainsi llansror"~ées en médicaments. Il est connu en
effet que certaines indications nécessitent cette coculture in vitro de la
~ cellule cible et de la cellule d'empaquetage, par exemple quand la cellule
CA 02262814 1999-01-13
WO g8/02~;29 PCI~/FR97/012~;0
cible est une cellule du système Iymphocytaire ou des cellules souches
hematopolétiques. La cellule d'empaquetage doit impérativement être
éliminée avant la r~ial~c,dLIction de la cellule cible ainsi tr~l1sro""ee.
Quand la cellule d'en~r~guePge est porteuse du gène HSV1-TK comme
gène de sélection par exemple, I'utilisation d'un milieu de culture contenant
du HAT en présence de ganciclovir et d'acyclovir peut permettre de
détruire sélectivement les cellules po,la,1t le gène HSV1-TK et donc la
cellule d'empaquetage au profit des seules cellules cibles Ital ,srectées par
le virus rétroviral produit par lesdites cellules d'empaquetage.
o Un autre mode de réAlisAtion dans le cas de coculture peut
être réalisé avec des cellules d'empaquetage directement dépourvues du
gène HSV1-TK et la sélection du mélange cellulaire en présence du milieu
sélectif HAT en maintenant une concentratiol- cellulaire adéquate fait
egalement disparaltre les cellules d'empaquetage sans altérer les cellules
cibles.