Note: Descriptions are shown in the official language in which they were submitted.
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
"Dérivés de Carboxamidothiazoles, leur préparation,
les compositions pharmaceutiques en contenant".
presente invention a pour o )et des denvës de t azole agonistes de la
cholécystokinine (ÇCK) et plus particulièrement agonistes des récepteurs de
type A de
la cholécystokinine (CCK-A), leur procédé de préparation et les médicaments
les
contenant.
` La CCK est un peptide qui, en réponse à une ingestion d'aliment, est sécrété
au
niveau périphérique et participe à la régulation de nombreux processus
digestifs
(Crawley JN. et al., Peptides, 1994, 15 (4), 731-735).
La CCK a été identifiée également dans le cerveau, et pourrait ètre le
neuropeptide
le plus abondant aaissant comme neuromodulateur des fonctions cérébrales par
stimulation des récepteurs de type CCK-B (Crawley J.N. et al., Peptides. 1994,
15 (4),
731-735). Dans le système nerveux central, la CCK interagit avec la
transmission
neuronale médiée par la dopamine (Crawley J.N. et al., ISIS Atlas of Sci.,
Pharmac,
1988, 84-90). Elle intervient également dans des mécanismes imoiiquant
l'acétylcholine,
le GABA (acide y-aminobutyrique), la sérotonine, les opioides. la
sornatostatine, la
substance P et dans les canaux ioniques.
Son administration provoque des modifications physioiogiques ptose palpébrale,
hypothennie, hyperglycémie, catalepsie; et des modifications comportementales
hypolocomotricité, diminution de l'exploration, analgésie, modification de la
faculté
d'apprentissage, modification du comportement sexuel et satiété.
La CCK exerce son activité biologique par l'intermédiaire d'au moins deux
types de
récepteurs . les récepteurs CCK-A localisés principalement en périphérie, et
les
récepteurs CCK-B présents essentiellement dans le cortex cérébral. Les
récepteurs
CCK-A de type périphérique sont aussi présents dans certaines zones du systeme
nerveux central incluant l'area postretna, le noyau du tractus solitaire et le
noyau
interpédonculaire (Moran T.H. et al., Brain Research, 1986, 362, 175-179 ;
Hill D.R.
et al., J. Neurosci, 1990, 10, 1070-1081) , avec cependant des différences
d'espèce
(Hill D.R. et al., J. Neurosci, 1990, 10, 1070-1081 , Mailleux P. et al.,
Neuro=sci Lett.,
1990, 117, 243-247 ; Barrett R.W. et al., Mol. Phannacol., 1989, 36, 285-290 ;
Mercer J.G. et al., Neurosci Lett., 1992, 137, 229-231 ; Moran T.H. et al.,
Trends in
"0 Phatmacol. Sci., 1991, 12, 232-236).
A la périphérie, par l'intermédiaire des récepteurs CCK-A (Moran T.H. et al.,
Brain Research, 1986, 362, 175-179), la CCK retarde la vidange gastrique,
module la
motilité intestinale, stimule la contraction vésicuiaire, augmente la
sécrétion biliaire et
contrôle la sécrétion pancréatique (McHugh P.R. et al., Fed. Proc., 1986, 45,
1384-
1390 ; Pendleton R.G. et al., J. Pharmacol. Exp. Ther., 1987, 241, 110-116).
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
Le rôle de la CCK dans le signal de satiété est supporté par le fait que les
concentrations plasmatiques de CCK, dépendantes de la composition des repas
(fortes
concentrations de protéines ou de lipides) sont, après les repas, supérieures
à celles
observées avant les repas (Izzo R.S. et al., Regui. Pept., 1984. 9, 21-34 ;
Pfeiffer A. et
al., Eur J. Clin. Invest., 1993, 23, 57-62 ; Lieverse R.J., Gut, 1994, 3.5,
501). Chez les
boulimiques, il y a une diminution de la sécrétion de la CCK induite par un
repas,
(Geraciotti T.D. Jr. et al., N. Engl. J. Med., 1988, 319, 683-688 ; Deviin
M.J. et al.,
Am. J. Clin. Nutr., 1997, 65, 114-120) et une baisse des concentrations de CCK
dans
le liquide cérébrospinal (Lydiard R.B. et al., Am. J. Psychiatry, 1993, 150,
1099-1101).
Dans les lymphocytes T, un compartiment cellulaire pouvant refléter les
sécrétions
neuronales centrales, les concentrations basales de CCK sont significativement
inférieures chez les patients atteints de Bulimia nervosa (Brambilla F. et
al., Psychiatry
Research. 1995, 37, 51-56). Les traitements (par exemple par la L-
phénylalanine, ou
les inhibiteurs de trypsine) qui augmentent la sécrétion de la CCK endogène
provoquent une réduction de la prise alimentaire chez plusieurs espèces dont
l'homme
(Hill A.J. et al., Physiol. Behav., 1990, 48, 241-246 ; Ballinger A.B. et al.,
Metabolism,
1994, 43, 735-738). De même, l'administration de CCK exogène réduit la prise
de
nourriture chez de nombreuses espèces dont l'homme (Crawley J.N. et al.,
Peptides,
1994, 15, 731-755).
L'inhibition de la prise de nourriture par la CCK est médiée par le récepteur
CCK-
A. En effet le devazepide, un antagoniste sélectif des récepteurs CCK-A,
inhibe l'effet
anorexigène de la CCK alors que les agonistes sélectifs de ces récepteurs
inhibent la
prise de nourriture. (Asin K.E. et al.. Pharmacol. Biochem. Behav., 1992, 42,
699-704
Elliott R.L. et al., J. Med. Chem., 1994, 37, 309-313 ; Elliott R.L. et al.,
J. Med.
Chem., 1994, 37, 1562-1568). De pius, les rats OLEFT, n'exprimant pas le
récepteur
CCK-A sont insensibles à l'effet anorexigène de la CCK (Miyasaka K. et al.,
1994, 180,
143-146).
Basée sur ces évidences du rôle clé de la CCK dans le signal de satiété
périphérique, l'utiIité des agonistes et des antagonistes de la CCK comme
médicaments
dans le traitement de certains troubles du comportement alimentaire, de
l'obésité et du
diabète est indiscutable. Un agoniste des récepteurs de la CCK peut aussi être
utilisé en
thérapeutique dans le traitement des troubles du comportement émotionnel,
sexuel et
mnésique (Itoh S. et al., Drug. Develop. Res., 1990, 21, 257-276), de la
schizophrénie,
des psychoses (Crawley J.N. et al., Isis Atlas of Sci., Pharmac., 1988, 84-90
et
Crawley J.N., Trends in Pharmacol. Sci., 1991, 12, 232-265), de la maladie de
Parkinson (Bednar I. et al., Biogenic amine, 1996, 12 (4), 275-284), des
dyskinésies
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
tardives (Nishikawa T et al.. Prosz Neuropsvchopharmacol. Biol. Psych., 1988.
11-,
803-812 . Kampen J V et al., Eur J Pharmacol., 1996, 298, 7- i5) et de divers
troubles de la sphère Qastrointestinale (Drues of the Future, 1992, 17(3), 197-
206)
Des aQonistes des récepteurs CCK-A de ::: CCK sont décrits dans la
littérature.
` Par exemple. certains produits ayant de telles propriétés sont décrits dans
EP-383690
et W09010693 7, W095/28419, W096/ 1 1 70 1 ou encore W096/ 1 i 940
La plupart des asonistes des récepteurs CCK-A décrits â ce jour sont de nature
peptidique. Ainsi, le FPL 14294 dérivé de la CCK-7 est un puissant agoniste
des
récepteurs CCK-A non sélectif vis-à-vis des récepteurs CCK-B Il possède une
puissante activité inhibitrice de la prise de nourriture chez le rat et chez
le chien après
administration intranasale (Simmons R.D et al, Pharmacol. Biochem. Behav..
1994,
-l' (3), '0 l-708 . Kaiser E.F. et al. Faseb, 1991, .i, A864). De méme. il a
été montré
que le A-71623. un tétrapeptide a¾oniste sélectif des récepteurs CCK-A, est
efEcace
dans des modèles d'anorexie sur une période de 11 jours et entraine une
réduction
1~ sisnificative de la prise de poids par rapport au contrôle. chez les
ronQeurs et les singes
cynomologues (Asin K.E. et al., Pharmacol. Biochem. Behav., 1992, t?. 699-704)
De
la mème façon, des analo¾ues structuraux du A 71623, possédant une bonne
efficacité
et une sélectivité pour les récepteurs CCK-A sont dotés d'une puissante
activité
anorexiséne chez le rat (Elliott R.L. et al., J. Med. Chem., 1994, 3:, 309-313
, Elliott
R.L. et al, J. Med. Chem., 1994, 37, 1562-1568). Le GW 5823 (Henke B.R. et
al., J.
Med. Chem., 1996, 39, 2655-2658 , Henke B.R. et al., J Med Chem., 1997, 40,
2706-
2725) une benzodiazépine-1,5, est un agoniste des recepteurs CCK-A in vitro
Cette
molécule est également active par voie orale sur la contraction de la vésicule
biiiaire
chez la souris et sur la prise de nourriture chez le rat.
=5
Des dérivés du thiazole antagonistes de la cholécystokinine sont décrits dans
le
brevet européen EP-432040 et la demande de brevet européen EP-518731
La demande de brevet européen EP-518731 décrit des composés qui interasissent
avec les récepteurs de la izastrine et de la cholécystokinine de formule
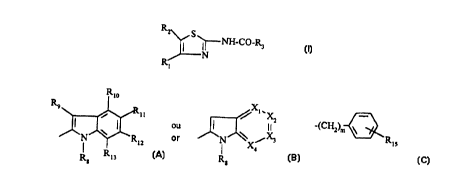
Rm
Rn S 1
-N CO -Z!
N
R
dans laquelle :
Z 1 peut notamment représenter un groupe indolvle de formule :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
4
(Xi)n
Rz
dans laquelle Xi a différentes significations et RZ peut représenter
l'hydrogène ; un
groupe (C 1-C4)aikyle ; un groupe carboxyalkylène éventuellement estérifié de
formule
Z2COOR dans laquelle Z2 représente un (C 1-C4)alkylène et R représente H, un
benzyle, un (C 1-C6)alkyie ; un groupe carbamoylalkylène de formule ZiCONRIVRV
dans laquelle RIV et RV représentent chacun indépendamment l'hydrogène, un (Cl-
C6)alkyle ou forment avec l'azote un hétérocycle saturé ; un groupe acyle de
formule
CORVI dans laquelle RVI représente un (C 1-C4)alkvle ou un phénvle ; un ¾roupe
alcoxvcarbonvle de formule COORVII dans laquelle RV-II représente un tert-
butyle ou
un benzyle.
Toutefois, parmi les composés de formule 1 décrits dans cette demande, aucun
ne
comporte un groupement indolvle comportant simultanément des groupements Xi et
Rz, différents de l'hydrogène. Les composés de fortnule 1 et leurs sels sont
décrits dans
EP 518 731 comme inhibant la fixation de la cholécystokinine à ses récepteurs.
Ils sont
plus ou moins sélectifs des récepteurs de type A et B et des antagonistes de
la gastrine
plus ou moins puissants.
A titre représentatif de ces composés, on peut notamment citer, le sel de
potassium
de l'acide 2-[4-(2-chlorophényl)thiaz-2-ylcarbamoyi]indole-l-acétique ou SR
27897 B,
connu comme un anta¾oniste puissant des récepteurs CCK-A (Eur. J. Pharmacol.,
1993, 1, 13-19).
Dans la demande de brevet européen EP-611766, sont décrits des agonistes des
récepteurs de la cholécystokine sur le test de l'amylase pancréatique. Ces
composés
répondent à la formule :
RLx S YNHCOZ3
2
D~iN d
ans laquelle :
- RVIII est un radical (hétéro)aryle choisi parmi les groupes 4-chloro-2,6-
diméthoxyphényle, 2,6-diméthoxy-4-méthylphényle, 2,4,5-triméthoxyphényle, 4-
méthyl-2,3,6-triméthoxyphényle, 2,6-diméthoxy-4-éthylphényle, 2,4,6-triméthoxy-
5-
chloro-phényle, 2,4,6-triméthoxy-3-pyridinyle, 2,4-diméthoxy-6-méthyl-3-
pyridinvle, 6-chloro-2,4-diméthoxy-5-pyrimidinyle, 2,4,6-triméthoxy-5-
pyrimidinyle,
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
~
5-chloro-2,4-diméthoxyphénvle. 5-chloro-2-méthoxy-4-méthvl phényle, 2.5-
diméthoxy-4-méthylphényle, 4-trifluorométhyl-2,6-diméthoxy phényle. ',4-
diméthoxy-5-méthylphénvle, 5-éthyl-2,4-diméthoxyphényle, 2,4-dimétoxyphénvle ;
R1S{ représente un hydro¾ène. un (C I-C4)alkvle ou un benzvie , avec la
limitation
que RIX est obligatoirement l'hydrogène lorsque R,~ZII est un phényle
substitué
simultanément aux positions 2 et 6 ou lorsque RVIII est un radical 3-
pyridinyle
substitué simultanément aux positions 2 et 4 ou RVIII est un radical 5-
pyrinzidinyle
substitué simultanément aux positions 4 et 6;
- Z; représente un Qroupe 3-quinoléinvle ou un groupe 2-indolvie de formule
R
dans laquelle R est l'hydrogène. un groupe acétyle ou un groupe CH-)COOR', R'
étant
l'hydroeène ou un (C I-C4)alkyle,
ainsi que leurs sels pharmaceutiquement acceptables.
La présente invention a précisément pour objet de proposer une nouvelle
fanvlle
de dérivés de thiazole particulièrement intéressants pour leur activité
agoniste des
récepteurs CCK-A.
Les composés selon l'invention ont fait l'objet d'études systématiques pour
caractériser:
- leur potentialité à déplacer la ["SI]-CCK de ses sites de liaison présents
sur des
membranes pancréatiques de rat (récepteurs CCK-A) ou de cellules 3T3 exprimant
le récepteur recombinant CCK-A humain ;
'-5 - leur propriété agoniste des récepteurs CCK-A à travers leur capacité à
induire in
vitro une mobilisation du calcium intracellulaire dans les cellules 3T3
exprimant le
récepteur CCK-A humain.
Avantageusement, les dérivés du thiazole, selon la présente invention
manifestent
une capacité à se lier aux récepteurs CCK-A et à stimuler comme la CCK, la
)0 mobilisation du caicium intracellulaire dans une lignée cellulaire
exprimant le récepteur
recombinant CCK-A humain. Ils s'avèrent être des agonistes des récepteurs CCK-
A.
Les composés de la présente invention ont en outre été étudiés in vivo, en
évaluant
leur capacité à bloquer la vidange gastrique chez la souris. Comme la CCK, ces
composés bloquent chez la souris la vidange gastrique et se comportent donc in
vivo
'5 comme des agonistes des récepteurs CCK-A.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
6
De manière surprenante. ils s'avèrent des agonistes plus puissants que les
dérivés du
thiazole décrits dans.la demande de brevet EP-611766. Ces meilleures
performances ont
été appréciées d'une part in vitro sur la mobilisation du calcium
intracellulaire, et d'autre
part, in vivo, via leur administration par la voie intrapéritonéale, par leur
capacité à
bloquer la vidange gastrique chez la souris.
En conséquence, la présente invention a pour premier objet des composés de
formule (I) :
~ S
-CO-R3
~ ~cn
R
I
dans laquelle :
- R1 représente un eroupement phényle substitué de formule :
R Me
R5
R6
- R2 représente un groupement choisi partni :
CH2-R7,
. (CH2)2'R7,
S-CH2-R7,
CHi-S-R7,
(C5-C8)alkyle ;
- R3 représente :
i) un indol-2-yle de formule :
Rio
Rg 4
~ ~ 6 R12
.. ~ R
13
ou
ii) un pyrrolo-pyridyle de formule :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCTIFR98/02007
7
~N~
x
Rs
dans laquelle l'un des Xl, Xi, X3, X4 est N. les autres représentent CR14,
- R4 représente l'hydrogène ou un 2roupement métho~, ,
- R; représente l'hydro¾ène, ou un -roupement méthyle, éthvle, isoproovle,
métho?cv,
éthoxv ou un haloQène ;
- R6 représente l'hydrogène, un groupement méthvle, éthyle, méthoxy ou un
halogéne.
- ou Rç et R6, considérés ensemble, représentent un groupe méthylèneâioxy ;
â la condition que les substituants R.4, R5. R6 ne soient pas simultanément
l'hydrogene ,
- R7 représente un ¾roupement (C5-C7)cycloalkyle non substitué ou substitué
par un
ou deux méthyles.
- Rg représente un groupe (CH-)nR15 ou un groupe .
-(CH2)m R15
- Rq représente l'hydroizène ou un groupement méthvle ;
- R 10, R 11, R 12= R 13 représentent chacun indépendamment l'un de l'autre
l'hvdrogène. un groupement méthvle, éthvle, hvdroxv, acétvloxv. méthoxv.
éthoxy,
méthvlthio, trifluorométhvle, amino ou un halo¾ène ,
- R l 4 représente l'hvdrogène ou un groupement méthoxv,
?5 - R15 représente un ¾roupement COOH ou un groupement COOR16,
- R16 représente un groupement (C 1-C4)allcyle ;
- n=1,2,3,4ou5;
- m=0, 1 ,
ainsi que leurs sels ou leurs solvates.
Par (C 1-C4)alkvle, on entend désigner un groupement alkyle linéaire ou
ranlifié et
plus particulièrement les groupements méthyle, éthyle, isopropyle, isobutyle
et tert-
butyle.
Par (C5-C8)alkvle, on entend désigner un alkyle linéaire ou ramifié et plus
particulièrement les groupements n-penryle, n-hexyle, n-octyle et 5, 5-
diméthylhexvle.
Par halogène, on entend un atome de chlore, de fluor ou de brome, le chlore
étant
préféré.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
8
Les sels d'addition de ces composés sont ceux obtenus avec des bases minérales
ou
organiques - les sels non toxiques pharmaceutiquement acceptables sont
préférés mais
d'autres sels utilisables pour isoler ou purifier les composés de formule (I)
sont aussi un
objet de l'invention.
Les sels des composés de formule (I) comprennent les sels avec des bases
organiques ou minérales, par exemple les sels des métaux alcalins ou alcalino-
terreux,
comme les sels de sodium, de potassium, de calcium, les sels de sodium et de
potassium étant préférés, ou avec une amine, telle que le trométamol. ou bien
les sels
d'arginine. de lysine. de N-méthyl-D-Qlucamine ou de toute amine
physiologiquement
acceptable.
La présente invention s'étend également aux solvates formés par les composés
de
formule I avec l'eau ou des acides minéraux ou organiques tels que l'acide
chlorhydrique, l'acide bromhydrique, l'acide trifluoroacétique, l'acide
sulfurique, l'acide
suifonique. l'acide phosphorique, l'acide naphtalène -2 -sulfonique, l'acide p-
to luènesulfo nique.
Tout particulièrement, la présente invention est relative aux composés de
formule
(I)
dans laquelle
- RI représente un sroupement phényle substitué de formule :
R
Me
~
R5
R6
- R3 représente
i) un indol-2-vle de formule :
Rio
Ri 4
( Is
N 7 6 Ru
..
R
~ 13
ou
ii) un pyrrolo-pyridyle de formule :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
9
X X.,
~ II
LI ~XX3
R8
dans laquelle Xl, X-), X;, X4 sont tels que définis ci-dessus,
- R4 représente l'hvdrogène ou un ¾roupement méthoxy ;
- R5 représente l'hydrogène, ou un groupement méthyle. éthyle, méthoxy, éthoxy
ou
un haloaène :
-R.6 représente l'hydrouène, un groupement méthvle, éthyle, méthoxy ou un
halogène;
- ou R; et R6, considérés ensemble, représentent un ¾roupe méthylènedioxv ;
à la condition que les substituants R4, R5, R6 ne soient pas simultanément
l'hydrogène ,
- R 10, R 11 , R 12, R13 représentent chacun indépendamment l'un de l'autre
l'hydrosène, un groupement méthyle, éthyle, rnéthoxv, éthoxy, méthvlthio,
trifluorométhyle, amino ou un halogène ;
- Ri, R8, Rq sont tels que définis ci-dessus ;
ainsi que leurs sels ou leurs solvates.
La présente invention a plus particulièrement pour objet des composés de
formule
(I) dans laquelle R2 représente un groupe choisi parmi
(CHi)2-R7 et
S-CHi-R7 ,
avec Rl, R3 et R7 étant tels que définis ci-dessus pour (I), ainsi que leurs
sels et
solvates.
De préférence, R7 représente un cyclopentyle, un cyclohexyle, un 4,4-
diméthylcyclohexyle ou un cycloheptyle.
Selon la présente invention, on préfère les composés de formule (I) dans
laquelle
R2 est un cyclohexyléthylène et les substituants RI et R3 ont les valeurs
définies ci-
'0 dessus pour (I), ainsi que leurs sels ou solvates.
Les composés de fotmule (I) dans laquelle R1 représente un 4-méthyl-2,5-
diméthoxyphényle ou un 4-chloro-2,5-diméthoxyphényle et les substituants R2 et
R3
ont les valeurs définies ci-dessus pour (I) ainsi que leurs sels et solvates
sont également
des composés préférés , la valeur R1 = 4-chloro-2,5-diméthoxyphényle étant
particulièrement préférée.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
Un groupe particulier de composés est constitué par les composés de formule
(I)
dans laquelle R3 représente un pyrrolo-pyridvle de formule
% t`Xz
' I ~ il
Ra
dans laquelle X1, X2, X;, X4 et Rg sont tels que définis ci-dessus pour (I),
ainsi que
10 leurs sels et solvates.
Un autre groupe particulier de composés est constitué par les composés de
formule (I) dans laquelle R3 représente un groupe indol-2-vle de formule :
Rto
Rg tt
Rtz
R13
avec Rg, R9, R10, R1 l, R12> R13 étant tels que définis pour (1), ainsi que
ses sels
et solvates.
On préfère aussi les composés de formule (I) dans laquelle R1 et R-) sont tels
que
définis ci-dessus pour (I) et R3 est un groupe indol-2-vle dans lequel l'un
des
substituants R I 0, R 11, R12 ou R l;, est différent de l'hydrogène.
Particulièrement,
lorsque R3 est un groupe indoi-2-yle, on préfère les composés dans lesquels F-
représente un groupe carboxyalkylène de formule (CHA-COOH, pius
particufièrement, un groupe carboxyméthylène. On préfère de manière plus
particulière
encore les composés de formule (I) dans laquelle un ou deux des substituants
R10,
R11, R13 représentent un groupement méthyle, méthoxy, trifluorométhyle, un
chlore
ou un fluor, le troisième ainsi que R12 et Rg représentant l'hydrogène, ainsi
que leurs
sels et solvates.
Ainsi les groupes de composés particulièrement préférés selon l'invention sont
représentés par
- les composés de formule :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
ll
Rto
R;i
_,
R
I S ~----~HCO--~ ~ I
~1e0 ,V
~
r Ri3
Ks fI)a
R6 j 0 Me
dans laquelle
- R2)a représente un groupe choisi parmi
(CH-)2R7
S-CHiR7 ;
- Rba représente un chlore ou un méthyle .
- R7, Rg, R9, R 10, R 11. R 12, R 13 étant tels que définis ci-dessus pour (I)
avec la
limitation qu'au moins un des substituants R 10, R I I, R12, R 13 soit
différent de
1 ~ l'hydrogéne :
ainsi que leurs sels et solvates.
- les composés de formule .
Ria
it
(D-(CH2)1-
MeO ~T I
R13 (Db
CH_COOH
OMe
7 S 6a
V dans laquelle :
- R6a est tel que défini ci-dessus pour (I)a ;
- R10, R11, R13 sont tels que définis ci-dessus pour (I) avec la limitation
qu'un ou
deux des substituants R 10, R 11, R 13 soient différents de l'hvdrogène ;
ainsi que leurs sels et solvates.
- les composés de formule
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
12
RIoI
Rl i,
H L (CHz)2 S I / I
Me0 N i I
13s
~ (I)c
ci OMe COOH
dans laquelle
- un ou deux des substituants R l Oa= R 11 a, R 13 a représentent un méthyle,
un
méthoxy. un chlore, un fluor ou un t ritluorom éthyle, les autres ou l'autre
représentant l'hcdrogéne.
ainsi que ieurs sels et solvates.
Tout particulièrement, les composés suivants sont préférés
. l'acide 2-(4-(4-chloro-2.5-diméthoxvphénvl)-5-(2-cvclohexyléthvl)-thiazol-2-
yicarbamoyl)-5-méthylindole-1-acétique
l'acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-(2-cyclohexyléthyl)-thiazal-2-
vicarbamovl)-5, 7-diméthylindole-1-acétique ;
. l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvl)-5-(2-cyclohexyléthyl)-thiazol-2-
vlcarbamoyl)-4-méthoxyindole-1-acétique ;
10 l'acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-(2-cyclohexyléthyl)-thiazol-2-
vlcarbamovl )--t-méthylindole-1-acétique ;
l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvl)-5-(2-cyclohexyléthvl)-thiazol-2-
vlcarbamovl)-4, 5-diméthvlindole-1-acétique ;
l'acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-(2-cyclohexyléthyl)-thiazol-2-
vicarbamoyl)-5-méthoxvindole-1-acétique ;
. l'acide 2-(4-(4-chloro-2,5-diméthoxyphényi)-5-(2-cyciohexyléthyl)-thiazol-2-
ylcarbamoyl)-5-chloroindole-1-acétique ;
. l'acide 2-(4-(4-chloro-2,5-diméthoxyphényi)-5-(2-cyciohexyléthyl)-thiazol-2-
ylcarbamoyl)-4, 5-dichloroindole-1-acétique ;
. . l'acide 2-(4-(4-chioro-2,5-diméthoxyphényl)-5-(2-cyciohexyléthyi)-thiazol-
2-
ylcarbamoy!)-4, 7-diméthylindole-1-acétique ;
l'acide 2-(4-(4-chloro-2, 5-diméthoxyphényl)-5-(2-cyclohexyléthyl)-thiazol-2-
vlcarbamoyl)-4, 5-diméthoxyindole-1-acétique ;
l'acide 2-(4-(4-chloro-2, 5-diméthoxyphényl)-5-(2-cyclohexyléthyl)-thiazol-2-
'5 ylcarbamoyl)-7-méthoxyindole-1-acétique ;
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
13
l'acide 2-(4-(4-chloro-2,5-diméthoxvphénvi)-5-(2-cyciohen=léth,,=i)-thiazol-2-
ylcarbamovl)-7-méthylindole-1-acétique
l'acide 2-(4-(4-chloro-2,5-diméthoxvphénvl)-5-(2-cyciohe~,léthvi)-thiazol-3-
%=lcarbamoyl)-5,7-dichloroindole- t-acétique
l'acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-(2-cvcloheri-léthvi)-thiazol-2-
vlcarbamovl)-4.7-diméthoxvindole-I-acétique ;
l'acide 2-(-4-(4-chloro-2,5-diméthoxyphényl)-5-(2-cyclohexyléthvl)-thiazoi-2-
yicarbamovl )-5-méthoxy- 7 -méthylindole-1-acétique ;
l'acide 2-(4-(4-chloro-2,5-diméthoxryphénvl)-5-(2-cyclohexvléth`,=i)-thiazol-_-
ylcarbamoyl)-5-méthvl-7-chloroindole-l-acétique ;
l'acide 2-(4-(4-chloro-2.5-diméthoxyphénvl)-5-(2-cvciohen=léth~=i)-thiazol-2-
ylcarbamovl)-5-chloro- 7-méthylindole-1-acétique
l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvl)-5-(2-cyclohex~,léthv1)-thiazol-_-
ylcarbamoyi)-5-chloro-7-fluoroindole-l-acétique ;
l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvi)-5-(2-cvclohexyiéth%,l)-thiazol-2-
ylcarbamoyl)-4-méthyl-7-chloroindole-1-acétique ;
l'acide 2-(4-(4-chioro-2,5-diméthoxyphénvl)-5-(2-cyclohexvléthvl)-thiazol-2-
ylcarbamoyi)-4-méthyl-5-chloroindole-l-acétique ;
l'acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-(2-cyclohexvléthyl)-thiazol-2-
vicarbamovi)-5-chloro-7-trifluorométhylindole-1-acétique ;
l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvi)-5-(2-cyclohexyiéthvl)-thiazol-2-
ylcarbamovl)-4-méthoxv- 7 -méthviindoie- l -acétique ;
ainsi que leurs sels et solvates.
Sont plus particulièrement préférés
15 l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvl)-5-(2-cyclohexvléthyl)-thiazol-2-
ylcarbamovi)-5-méthylindole-1-acétique;
l'acide 2-(4-(4-chloro-2, 5-diméthoxyphényl)-5-(2-cyclohexvléthvl)-thiazol-2-
ylcarbamoyl)-5, 7-diméthylindole-1-acétique ;
ainsi que leurs sels et soivates notamment les sels de sodium et de potassium
et leurs
'0
solvates.
La présente invention a pour second objet un procédé de préparation des
composés (I) selon l'invention. Ce procédé est caractérisé en ce qu'il
comprend les
étapes suivantes :
a) condenser un dérivé 2-aminothiazole de formule :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
14
S ~~-N-H_
R ` (II)
dans laquelle R1 et R,) sont tels que définis ci-dessus pour (I), sur un acide
de formule
' R';COOH (III) ou bien sur un dérivé fonctionnel dudit acide, dans laquelle
R'3
représente R3 ou un dérivé de R. tel que défini ci-dessus pour (I), et dans
lequel la
fonction acide de R: est protégée .
b) le cas échéant, transformer le composé obtenu de formule (I')
R, s
I -'N-H-CO-R'3 (I')
R ti
en un composé de formule (I) par la déprotection de la fonction acide protégée
du
substituant de R'; et
c) le composé de formule (I) ainsi obtenu est isolé tel quel ou sous forme
d'un de
ses sels ou solvates.
L'étape a) du procédé est généralement effectuée en milieu basique. Comme
dérivé
fonctionnel de l'acide (III) on peut utiliser un acide activé, un anhydride,
un anhydride
mixte ou un ester activé dudit acide carboxylique.
Comme groupe protecteur de la fonction acide on utilise un ester tel que par
exemple un ester de (C 1-C4)alkvle.
Les anhvdrides mixtes peuvent être préparés par action d'un chloroforniiate
d'alkyle sur l'acide, en présence d'une base, généralement une amine tertiaire
telle que la
triéthylamine , cette réaction est le plus souvent effectuée dans un solvant
tel que le
dichlorométhane. le dichloroéthane ou le chloroforme.
La condensation de l'aminothiazole (II) avec l'acide (III) sous forme d'ester
activé,
préparé par exemple par action du 1-hydroxybenzotriazole sur l'acide en
présence de
dicyclohexylcarbodiimide selon le mode opératoire décrit dans J. Am. Chem.
Soc.
1971, 93, 6318-6319, ou par action de l'hexafluorophosphate de 1-
benzotriazolyloxytris(diméthylamino)phosphonium (BOP) selon le mode opératoire
'0 décrit dans Synthesis, 1976, 751-752, peut ëtre effectuée dans un solvant
dont la nature
est choisie selon la solubilité des composés et le type d'activation de la
fonction acide,
de préférence en présence d'une base, par exemple une amine tertiaire telle
que la
triéthylamine ; la réaction est en général effectuée à une température
comprise entre
0 C et 30 C.
Les composés de formule (I) dans lesquels un (ou plusieurs) substituant R 10,
R 11 ,
R 12, R13 représente un hydroxy sont obtenus à partir des composés de formule
(I)
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
dans lequels le (ou lesdits) substituant représente un acétvlon., les autres
substituants
étant identiques, par hydrolyse en milieu basique.
Dans la présente description et dans les revendications. :es svmboles et
abréviations suivants sont utilisés.
représente un cyclohexvie.
DCM dichlorornéthane
EtiO : Ether : éther diéthvlique
Ether iso : éther diisopropylique
10 Ether chlorhvdrique éther saturé en gaz chlorhydrique
MeOH : méthanol
EtOH éthanol
iPrOH : isopropanol : propan-2-ul
AcOEt : acétate d'éthyle
15 DMF ciiméthvlformamide
THF tétrahvdrofurane
DME : diméthoxyéthane
DIPEA diisopropyléthylamine
DMAP 4-diméthvlaminopyridine
DBU 1.8-diazabicyclo[5.4.0]undec-7-zne
PTT Phénvltriméthvlammonium tribromure
TMEDA : Tétraméthyléth,vlènediamine
VBS : N-bromosuccinimide
CDI : carbonvldiimidazole
~S .
Triton B : N-benzyltriméthylammonium hydroxyde
AcOH acide acétique
TFA : acide trifluoroacétique
Pd/C palladium sur charbon
Ms mésyle
Ts tosvie
Acide triflique : acide trifluorométhanesulfonique
Boc : tert-butoxycarbonyle
Me, MeO : méthyle, méthoxy
Et : éthyle
'5 Pr, iPr propyle, isopropyle
Bu. iBu. tBu : butyle, isobutyle, tert-butyle
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
16
Bz : benzvle
NEt3 triéthylamine
BOP hexatluorophosphate de benzotriazol-1-vloxv-tris(diméthviamino)
phospnonium
` DCI : dicyclohexylcarbodiimide
tampon pH2 : tampon sulfate
Silice H : gel de silice 60 H commercialisé par E. Merck (DAR~ISTAD)
F : point de fusion
TA : température ambiante
l a Les aminothiazoles de formule (II) sont préparés par des méthodes connues
telles
que celles décrites dans le brevet EP-518731 et la demande de brevet EP-611766
De taçon générale. on fait réasir la thiourée avec une cétone haloséZée de
r'ormule
(IV) selon ie schema réactionnel suivant
Schéma 1
RZCHHaI
S = C + C = O ---- (II)
Ri (IV)
Les substituants RI, Ri, du composé (IV) ont les mèmes significations que pour
le
composé (I), Hal représente un halogéne. de préférence le brome ou le chlore.
Les cetones halogénées de formule (IV) peuvent être préparées par des procédés
dont les principes sont décrits dans des ouvrages Qénéraux. Par exemple. les
bromocétones peuvent étre obtenues par action du brome en milieu acide, du
bromure
cuivrique ou du phényltriméthylammoniumtribromure (PTT) sur un composé de
formule :
1ZiCH->COR I (V)
dans laquelle RI, R,>, ont les significations indiquées ci-dessus pour (I),
dans un
solvant organique tel que l'acétate d'éthyle, un solvant chloré ou leur
mélange.
"0 Les cétones (V) sont préparées en général par réaction de Friedel et Crafts
en
présence d'un acide de Lewis tel que A1C13 ou TiCIq4 par exemple. On peut
également
préparer des halogénocétones de formule (IV) par réaction de Friedel et Crafts
avec un
halogénure d'acide convenable Ha1COCHHaIR2 (VI) sur un benzène convenablement
substitué (RIH = C6H2(OMe)R4R5R,6), par exemple selon Chem. Pharm. Bull.,
1991,
"5
39 (9), 2400-2407.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
17
Un aminothiazole de formule (II) peut également ètre préparé en une seule
étape à
partir d'une acétophénone substituée de formule (V) en faisant agir
successivement le
brome ou le PTT dans un soivant tel que le dichlorométhane ou le tétrachlorure
de
carbone, puis la thiourèe, dans un alcool tel que l'éthanol ou le méthanol par
exemple.
On peut également préparer les aminothiazoles de formule (II) en utilisant la
réaction de Hoesch. (selon Dubois, Organic Reactions. 1945. 5, 387 ou selon
Satchell
et al., The Chernistrv of the Carbonvl Group, ed. S. Patai, Interscience,
1966. 1 (5),
233-302) suivie de la condensation avec la thiourée.
Les halogénures d'acide de formule (VI) sont préparés à partir de l'acide
correspondant de formule R->CHiCOOH (VII) par des méthodes classiques, par
exemple par action du chlorure de thionvle ou du chlorure d'oxalyle
Les acides de formule (VII) sont connus ou préparés par des méthodes connues.
De façon particuiière, on peut utiliser le triéthylphosphonocrotonate et
procéder
selon le schéma réactionnel ci-dessous pour préparer des composés de formule
R'i-
(CHi);-CO2H dans laquelle R'2 représente un (C5-C7)cycloallc~,le
Schéma 2
p (EtO),P-CH,-CH = CH-CO,Et
(c HZ)p
--- R'=CH-CH=CH-CO,Et R'z-(CH.)3-CO,Et
_ ` Pd/C
OHC
--+- Et'z(CH`)3CO,H
(VM
p=1,2ou3.
On peut préparer un acide de formule R'2-S-(CH2)2-COOH dans laquelle R'i
représente un (C5-C7)cycloalkyle à partir d'un composé de formule R'iSH par
action
de l'hydroxyde de césium puis d'un ester d'acide halo¾énoalcanoique selon le
schéma
réactionnel ci-après :
Schéma 3
RtSH 1) CsOH R'ZS(CH2)ZCO2R
Z 2) Hal(CHZ)2COzR
OH E) R'2S(CHr)~CO2H
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
18
avec R = (C 1 -C4)alkyle.
Dans certains cas, par exemple pour préparer un aminothiazole de formule (II)
dans laquelle R-) représente un groupe -S-CH2R'i on peut utiliser la méthode
citée
dans S.P. Bruekelman et coll., J Chem. Soc. Perkin Trans 1, 1984, 2801-2807,
décrite
dans le schéma ci-après
Schéma 4
CH3 CH3
~_
1) nBuLi
S N I 2) >
R'zCHz S s ~ II ~ , II ;I
) R,-C~X
V ' V
~ C Rr- ~
R~- ~ C H
i (VM) (IX)
NH2OH. HCI R'.CH22-S SNH2
--~ f ~
o v
Rt
(II)
avec X y représentant un halogène, un méthanesulfonate, un benzénesulfonate,
un p-
toluènesulfonate ou un trifluorométhanesulfonate.
Les composés de formule
Rio
R9 Rt1
HOOC N R 12
R~8 Rts
dans laquelle R9, R 10, R 11, R 12 et R 13 sont tels que définis ci-dessus
pour (I), et R'8
représente Rg tel que défini pour (I) ou un précurseur de Rg dans lequel la
fonction
J0 acide carboxytique est estérifiée, sont connus ou préparés selon les
méthodes décrites
dans EP-518731 ou EP-611766 selon le schéma ci-après :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
l9
Schéma 5
R Rin R
~ R ~ io
" C6HsCH_Br R
I ~ (
HOOCN Rt: DBU
- C6HSCH`O-CN
Il R-2
H R~3 O H I~13
(X) 1H'8Hal (a)
Rg R-o Rg Rio
R R;:
H~, Pd/C -C R f------ CSHSCH_O-C -.-
.,-
HO `
I l 1 ~ z ou AcOH/HBr R2
O R8 Ri3 R'g R13
(ïII) 1 (KM
avec Hal y représentant un halogène.
A la dernière étape pour débenzyler, on utilise soit l'hydroeénation
catalytique
lorsque aucun des substituants R10, R11, R12, Rl3 n'est un halogène, soit une
solution
saturée d'acide bromhydrique dans l'acide acétique lorsque R'8 est protégé par
un
alkyle autre que tert-butyle.
Plus particulièrement, les composés de formule
Rio
Rg R, l
(111)2
HOOC R12
R15
(CH,)m
dans laquelle m, Rg, R 10, R 11, R 12, R 13, et R 15 sont tels que définis ci-
dessus pour
(1) sont obtenus à partir d'un ester, par exemple l'ester benzylique d'acide
indole-2-
carboxylique substitué selon le schéma suivant :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
Schéma 6
Rio Rto
Rg R11 l ) Cu ou NaH Rg Ri1
I ~ I 2 ) Hal(CHz)mC6HsR':s ~( R
CbHSCH,OOC ti R12 ; ) Hz Pd/C HOOC R 12
ts
H Rt3 I t R'
(CH1)~
(III)',
10 R'15 représente R15 ou un groupe dont la fonction acide carboxviique est
estérifiée.
On fait aQir l'hydrure de sodium pour obtenir un composé de formule (III)'-)
dans
lequel m= 1. ou le cuivre pour obtenir un composé de formule (III)'i dans
lequel
m= 0; puis un ester d'acide halogénobenzoique (ou un ester d'acide
15 halogénométhylbenzoique) et enfin on effectue une hvdrogénation
catalytique.
Les indoles de départ sont commerciaux ou préparés selon une adaptation des
procédés décrits dans la littérature, par exemple selon L. Henn et al., J.
Chem. Soc.
Perkin Trans. 1, 1984, 2189 selon le Schéma 7 ci-après
Schéma 7
R13 Rl3
;
R_ 11 O EtOH R
~ -- ~
EtOC-CHZN3 EtONa CO,C_Hs
R1 CHO Rt, CH =C ~
Rlo Rio N3
toluène/à
Rio Rto
R1 t Saponification Rt t
~
R12 i( COOH R 12 ~NCOOC2H5
R13 H R13 H
(Ys R~9 =H)
3 S ou encore, par exemple, selon la synthèse de Fischer (V. Prelog et al.,
Helv. Chim.
Acta, 1948, 31, 1178) selon le Schéma 8 ci-après :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
21
Schéma 8
Rif) 1) ~râ.ti'O, Rto
I
R ~ HÇ1Ril
~2) SnCI:
R~l HCI R12 HCI
R
R 13
EtOH
reflux R'~COCOOC,H,
l0
Rio Rto
R; i R
li
p
acide
paratoluène i
R~~`,^COOC_H< sulfonique R~-HC\COOC,HS
i
R13 H toluène R'
15 R13
9
vaOH 2N
EtOH
=
R~o
20 R., )~ avec
R
'9 = CH~ lorsque R, H
7~~
R\~ï COOH ou R'9 = CHõCH lorsque = CH
3 9 3
R13 H (Y)
ou encore selon la synthèse de Japp-I{lingemann (H. Ishii et al., J. Chem.
Soc. Perkin.
Trans. l, 1989, 2407) selon le Schéma 9 ci-après
35
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
22
Schéma 9
Rto R Rto
R~/~ I) NaNO<<T3C1 aqueux ~ t
i^~ 2) KOH/CHCOCHR't4COZC2Hs i i N
R, R1Z
~Z ~
R13 R13 H CO2CZHS
ZnC12'AcOH
I 0 Rt Rto Ri Rt t Rto
Saponiftcatton ~
R.î ti COOH Rt= v COOCHs
R13 H (X) Rt3 H
Selon la présente invention, on a trouvé un nouveau procédé utile pour la
préparation des acides indole-2-carboxyliques ou 1-H-pyrrolopyridine-2-
carboxylique.
Ainsi la présente invention a également pour objet un procédé de synthèse des
composés de formule :
,
( I (XVIII)
XI 3
~~X 1 ~~1 COOH
' i
H
dans laquelle X'I, X'2, X'3 et X'4 représentent un groupement CH
éventuellement
substitué par un groupement méthyle ou l'un des X'I, X'2, X'3, X'4 est N, et
les autres
représentent CR14 avec R14 représentant l'hydrogène ou un méthoxy, utiles
comme
intermédiaires pour la préparation de composés de formule (I).
Ce procédé est caractérisé en ce qu'il comprend les étapes consistant à:
a) protéger la fonction amine d'un composé de forrnule :
Xz,~X CH3
- I (XM
x3 \ . Nl-12
4
en traitant par le ditert-butyldicarbonate ((Boc)20) ;
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
2~
~
b) traiter le composé ainsi obtenu de formule
X 1, CH3
l (}ox)
1
X3
tiHiBoc
X4.
par un all.-yllithium tel que n-BuLi ou sec-BuLi
c) condenser le dérivé lit,aé ainsi formé avec un ester oxalique tel que
l'oxalate
d'éthyle ou l'oxalate de benzvle ;
d) cycliser en milieu acide
e) saponifier l'ester ainsi obtenu de formule
leX
X; i-COOA {XXI)
X;
H
dans laquelle A représente un éthyle ou hydrogénolvser l'ester ainsi obtenu de
formule (=) dans laquelle A représente un benzyle.
.10 A l'étape b), la lithiation est effectuée selon D. Hands et coll.,
Synthesis, 1996,
877-882 ou R.D. Clark et coll., Synthesis, 1991, 871-878.
La variante consistant à utiliser à l'étape c) l'oxalate de benzyle au lieu de
l'oxalate
d'éthyle. évite les étapes intermédiaires de saponification et
d'estérification.
L'étape d) peut ètre effectuée en présence d'acide tnrluoroacétique ou, en
chauffant en présence d'HCI 6N.
Le procédé revendiqué peut ëtre appliqué efficacement à la préparation des
acides
indoles-2-carboxyliques de formule Xb.
Rtob
Ritb
R12b N COOH
I (X)b
R13b H
dans laquelle R l Ob, R 11 b= R12b, R13b représentent chacun indépendamment
l'un
de l'autre l'hydrogène ou le méthyle, à partir d'une ortho-méthylaniline.
3 5 Dans ce cas particulier, le procédé revendiqué comprend les étapes
consistant à
a) protéger la fonction amine d'une ortho-méthylaniline de formule :
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
24
R Riqb
"b ~ CH}
I
~ ~~
R12b I ""2
Rl3b (}Q) b
en traitant par le ditert-butvldicarbonate (Boc)20 ;
b) traiter le composé ainsi obtenu de formule
Rlot
Rl ib CH3
1
Rl 2b ~ :vI-IBoc
R13b (XM b
par un alkyllithium tel que n-BuLi ou sec-BuLi ;
c) condenser le dérivé lithié ainsi formé avec un ester oxalique tel que
l'oxalate
d'éthyle ou l'oxalate de benzyie ;
d) cycliser en milieu acide ;
e) saponifier l'ester ainsi obtenu de formule :
Rlob
Rlib
~ I I
RiZb N COOA
R13b H (XM)b
dans laquelle A représente un éthyle ou hydrogénolyser l'ester ainsi obtenu de
formule
(XIII)b dans laquelle A représente un benzyle.
Dans les cas particuliers où :
soitRl3b-R12b-CH3 etR10b= R11b- H,
soitR13b-R10b-CH3 et R11b-R12b-~
on obtient à l'étape e) 2 esters de formule :
CH3
i
et
~
~ N COOA CH3 N COOA
C"3 H C~ H
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
Ces composés peuvent ètre séparés par des méthodes connues de la chirnie
organique, par exemple par chromatographie.
Le procédé revendiqué est észalement particulièrement avantasteux pour obtenir
les
composés de formule
X X
COOH
X4 10 H
et les dérivés d'acides pyrrolopyridine-2-carboxylique de formule (III)3
.K
L'COOH (IM3
R'8
dans lesquelles Xl, X2, X;, X4 ont les définitions dann&~- ci-dessus pour (I)
et
R'8 représente R8 tel que défini ci-dessus pour (I) ou un précurseur de R8, à
partir
d'une ortho-méthylaminopyridine.
Par exemple, on peut préparer un dérivé d'acide 1-H-pyrrolo[3,2-b]pyridine -2-
carboxylique selon le schéma réactionnel ci-après:
30
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
26
Schéma 10
Cii, 1) n-BuLi
CNI 2)(COOEt)2 ~ ~
~IHBoc 3) H+ t
1
H
(~)
1) NaOH 1) Ha1R'
-~ i
2)C6HtCH,Br 2)HZ, PdJC \ i I
N `I COOCH,C6H3 N :I ~COOH
H (XVII) R8 (III),
Schéma 11
C~N~ 1) n-BuLi ~NHBoc 2)(COOCHZC6H5)2 N N COOCH2C6HS
H (XVII)
1) HaIR'S
N ~
2) H~, Pd/C COOH
1
R'g
Lorsque les pyridines de départ possèdent un ou plusieurs substituants
méthoxy,
les réactions décrites dans les schémas 10 et 11 permettent d'obtenir des
composés de
formule (111)3 substitués sur le noyau pyridine par un ou plusieurs groupes
méthoxy.
Les dérivés d'acides pyrrolopyridine carboxyliques de formule :
XiXl
3:N 1 3\\ COOH (~3
X4 1
R'
s
dans laquelle X I, X2, X;, X4 ont les définitions données ci-dessus pour (I)
et R'g
représente Rg tel que défini ci-dessus pour (I) ou un précurseur de R8 dans
lequel la
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
27
fonction acide carboxylique est estérifiée peuvent è-Qalement ètre préparés
par des
méthodes connues..
Les dérivés d'acides 1 H-pyrrolo[2,3-c]pyridine-2-carboxvliques, et d'acides
1H-
pyrrolo[3, 2-c]pyridine-2-carboxyliques peuvent être préparés à partir des
~ methylpyridines nitrées en position orrho du méthyle correspondantes. selon
une
modification de la méthode de Reissert. comme décrit par exemple dans B
Frvdman et
coll., J Org. Chem. 1968. 3762-3766 ou M.H. Fisher et coll., J. Het. Chem..
1969,
775-776.
Par exemple, on peut préparer un dérivé d'acide 1H-pyrrolo[3.2-b]pyridine-2-
carboxylique en procédant selon le Schéma réactionnel ci-après
Schéma 12
No. ~o~
~ ~ - (COOEt)= ï CIN , ~ -
CH, KOEt CH~' COOEt
0
H2 NaOHi I I
-. ~
Pd/C COOEt i COOH
H H
(XIV)
DBli N 1) Ha1R'9 /ti
C CH H Br ~ ! I I 2)H`, /dP C
6 5 _ N/~ ``~~~V COOH
~ COOCHIC6Hs
H (XV) R 8
Selon l'invention, les composés de formule (I) comprennent également ceux dans
lesquels un ou plusieurs atomes d'hydrogène, de carbone ou d'halogène,
notamment de
chlore ou de fluor ont été remplacés par leur isotope radioactif par exemple
le tritium
30 ou. le carbone- 14. De tels composés marqués sont utiles dans des travaux
de recherche,
de métabolisme ou de pharmacocinétique, dans des essais biochimiques en tant
que
ligands marqués de récepteurs,
Les composés de formule (I) ont fait l'objet d'études de liaison in vitro aux
récepteurs CCK-A et CCK-B, en utilisant la méthode décrite dans Eur. J.
Pharmacol.,
35 1993, 232,. 13-19.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
28
Ils présentent une forte affinité pour les récepteurs CCK-A (Concentration
inhibitrice CI50 de l'ordre de 10-9M) et une affinité nettement plus faible
sur les
récepteurs CCK-B, avec parfois un rapport au moins égal â 100 entre les 2
affinités. A
titre d'exemple, le composé de l'exemple 5 se lie au récepteur CCK-A humain
avec une
forie afiinité (CIsa = 0,56 nM), supérieure à celle de la CCK (CI5o = 1,17 nM)
et
l'affnité de ce composé pour le récepteur CCK-B humain est faible (Clso -
162nM).
L'activité agoniste des composés vis-à-vis des récepteurs CCK-A a été évaluée
in
vitro dans les cellules 3T3 exprimant le récepteur CCK-A humain, par la mesure
de la
mobilisation du calcium intracellulaire ([Ca++]i), selon une technique dérivée
de celle
de Lignon MF et al., Eur. J. Pharmacol., 1993, Z45, 241-245. La concentration
en
calcium [Ca+_~_ ]i est évaluée avec le Fura-2 comme sonde fluorescente, par la
méthode
de la double longueur d'onde d'excitation. Le rapport de la fluorescence émise
à deux
longueurs d'onde donne la concentration en [Ca++ ]i après un étalonnage
(Grynkiewicz
G. et al., J. Biol. Chem., 1985, 260, 3440-3450).
Comme la CCK, les composés selon l'invention augmentent la concentration en
calcium intracellulaire ([Ca++ ]i) avec une CE50 (concentration efficace
induisant 50 %
de l'effet de la CCK) inférieure ou égale à 100 nM. Ils se comportent donc
comme des
agonistes des récepteurs CCK-A . A ce titre, ils sont plus performants que les
composés décrits dans EP-611766 qui ne montrent aucune propriété agoniste vis-
à-vis
de [Ca ]i à cette concentration de 100 nM. A titre d'exemple, le composé de
l'exemple 5 stimule l'augmentation de la concentration en calcium
intracellulaire au
même niveau que le CCK elle-même, il se comporte donc comme un agoniste total.
Son effet intervient à très faible dose (CEso = 1,27 nM), comme pour la CCK
elle-
mème (CE50 = 1,28 nM)
Une étude de l'effet agoniste des composés sur la vidange gastrique a été
réalisée
comme suit. Les souris femelles Swiss albino CDI (20-25g) sont mises à jeun
solide
pendant 18 heures. Le jour de l'expérience, les produits (en suspension dans
une
solution de carboxyméthylcellulose à 1% ou de méthylcellulose à 0,6 %) ou le
véhicule
correspondant sont administrés par voie intrapéritonéale, 30 minutes avant
l'administration d'un repas de charbon (0,3 ml par souris d'une suspension
dans l'eau de
10 % de poudre de charbon, 5 % de gomme arabique et 1 % de
carboxyméthylcellulose
ou 0,6 % de méthylcellulose). Les souris sont sacrifiées 5 minutes plus tard
par
dislocation cervicale, et la vidange gastrique est évaluée par la présence de
charbon
dans l'intestin au-delà du sphincter pylorique (Eur. J. Phatmacol., 1993, 232,
13-19).
Les composés de formule (I) bloquent la vidange gastrique comme la CCK elle-
même, et se comportent donc comme des agonistes des récepteurs CCK-A. Certains
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
29
composés selon l'invention présentent des DE<,; (dose efficace induisant 50 %
de l'effet
de la CCK) inférieures ou égales à 0, 1 mg/kg par la voie intrapéritonéale.
Dans ces mêmes conditions, les composés décrits dans EP-611766 ne montrent
pas de propriété aaoniste significative vis-à-vis de la vidanee gastrique à la
dose de 0, 1
` mgikg et ont des DEso supérieures à 1 mgikg par la voie intrapéritonéale. A
titre
d'exemple, le composé de l'exemple 5 est très actif in vitro ou il inhibe
complètement la
vidange Qastrique avec une DE3o de 1.9 g/kg par la voie intrapéritonéaie.
Par conséquent, les composés de formule (I) sont particulièrement performants,
en
tant qu'agonistes des récepteurs CCK-A de la CCK, pour la préparation de
médicaments destinés à combattre les maladies dont le traitement nécessite une
stimulation des récepteurs CCK-A de la cholécyst%âcinine.
Plus particuliérement, les composés de formule (1) sont utilisés pour la
fabrication
de médicaments destinés au traitement de certains troubles de la sphère
¾astrointestinale (prévention des calculs biliaires, syndrome du colon
irritable...), du
comportement alimentaire, de l'obésité, ou des pathologies associées telles
que le
diabète et l'hypertension. Les composés de formule (I) induisent un état de
satiété, et
peuvent ainsi être utilisés pour réduire la prise alimentaire, traiter la
boulimie, l'obésité
et provoquer une perte de poids.
Les composés (I) sont également utiles pour la fabrication de médicaments
destinés au traitement des troubles du système nerveux central, notamment les
troubles
du comportement émotionnel, sexuel et mnésique, les psychoses et, en
particulier, la
schizophrénie. la maladie de Parkinson. la dyskinésie comme la dvskinésie
tardive ou la
dvskinésie faciale après traitement prolongé par des neuroleptiques. Ils
peuvent
égaiement être mis en oeuvre pour traiter des troubles de l'appétence, c'est à
dire pour
réguler les désirs de consommation, en particulier la consommation de sucres,
de
graisse, d'alcool ou de dro¾ues et plus généralement d'ingrédients
appétissants.
Aucun signe de toxicité n'est observé avec ces composés aux doses
pharmacologiquement actives, et leur innocuité est donc compatible avec leur
utilisation comme médicaments pour le traitement des troubles et des maladies
'0
énoncés ci-dessus.
La présente invention a également pour objet des compositions pharmaceutiques
contenant une dose efficace d'au moins un composé selon l'invention ou d'un
sel ou
solvate pharmaceutiquement acceptable de celui-ci, et en mélan¾e le cas
échéant avec
des excipients convenables.
,5 Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale, sublinttuale, sous-cutanée, intramusculaire, intra-
veineuse,
topique, intratrachéale, intranasale, transdermique, rectale ou
intraocculaire. les
principes actifs de formule (I) ci-dessus, ou leurs sels éventuels, peuvent
être
5 administrés sous formes unitaires d'administration, en mélange avec des
supports
pharmaceutiques classiques, aux animaux et aux êtres humains pour la
prophylaxie ou
le traitement des troubles ou des maladies évoqués ci-dessus. Les formes
unitaires
d'administration appropriées comprennent les formes par voie orale telles que
les
comprimés, les gélules, les poudres, les granules et les solutions ou
suspensions orales,
l0 les formes d'administration sublinguale, buccale, intratrachéale,
intranasale, les formes
d'administration sous-cutanée, intramusculaire ou intraveineuse et les formes
d'administration rectale. Pour l'application topique, on peut utiliser les
composés selon
l'invention dans des crèmes, pommades, lotions ou collyres.
Afin d'obtenir l'effet prophylactique ou thérapeutique désiré, la dose de
principe
15 actif peut varier entre 0,01 et 50 mg par kg de poids corporel et par jour.
Chaque dose unitaire peut contenir de 0,5 à 1000 mg, de préférence de 1 à 500
mg, d'inarédients actifs en combinaison avec un support pharmaceutique. Cette
dose
unitaire peut être administrée I à 5 fois par jour de façon à administrer un
dosage
journalier de 0,5 à 5000 mg, de préférence de 1 à 2500 mg.
20 Lorsqu'on prépare une composition solide sous forme de comprimés, on
mélange
l'ingrédient actif principal avec un véhicule pharmaceutique, tel que la
gélatine,
l'amidon, le lactose, le stéarate de magnésium, le talc, la gomme arabique ou
analogues.
On peut enrober les comprimés de saccharose, d'un dérivé cellulosique, ou
d'autres
matières appropriées ou encore on peut les traiter de telle sorte qu'ils aient
une activité
25 prolongée ou retardée et qu'ils libèrent d'une façon continue une quantité
prédéterminée
de principe actif.
On obtient une formulation en gélules en mélangeant l'ingrédient actif avec un
diluant et en versant le mélange obtenu dans des gélules molles ou dures.
Une composition sous forme de sirop ou d'élixir ou pour l'administration sous
30 forme de gouttes peut contenir l'ingrédient actif conjointement à un
édulcorant,
acalorique de préférence, du méthylparaben et du propylparaben comme
antiseptique,
ainsi qu'un agent donnant du goût et un colorant approprié.
Les poudres ou les granules dispersibles dans l'eau peuvent contenir
l'ingrédient
actif en mélange avec des agents de dispersion ou des agents mouillants, ou
des agents
de mise en suspension, comme la polyvinylpyrrolidone, de même qu'avec des
édulcorants ou des correcteurs du goût.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
31
Pour une administration rectale, on recourt à des suppositoires qui sont
préparés
avec des liants fondant à la température rectale, par exemple du beurre de
cacao ou des
polyéthylèneslycols.
Pour une administration parentérale, on utilise des suspensions aqueuses. des
` solutions salines isotoniques ou des solutions stériles et injectables qui
contiennent des
aeents de dispersion etiou des mouillants pharmacolo¾iquement compatibles. par
exemple le propylèneglycol ou le butyléneglycol.
Le principe actif peut être formulé également sous forme de microcapsules,
éventuellement avec un ou plusieurs supports ou additifs. ou bien avec des
matrices
telles qu'un polymère ou une cyclodextrine (patch, formes à libération
prolongée).
Les compositions selon l'invention peuvent ètre utilisées dans le traitement
ou la
prévention de différentes affections où la CCK est d'un intérét thérapeutique
Les compositions de la présente invention peuvent contenir, à côté des
produits de
formule (I) ci-dessus ou de leurs sels pharmaceutiquement acceptables,
d'autres
principes actifs qui peuvent étre utiles dans le traitement des troubles ou
maladies
indiquées ci-dessus.
De façon avantageuse, les compositions pharmaceutiques de la présente
invention
contiennent à titre de principe actif au moins un composé de formule (I) ci-
dessus ou
un de ses sels, solvates ou hydrates pharmaceutiquement acceptables.
Les exemples figurant ci-après sont présentés à titre illustratif et non
limitatif de
la présente invention.
A - PREPARATION DES 2-A~1~ILNOTHIAZOLES DE FOILtiIL'LE :
R- S~
~ II (II)
Rt
dans laquelle RI et Ri sont tels que définis ci-dessus pour (I).
PR.EPAR.ATION 1.1.
90 2-Amino-5-cyclohexyléthyl-4-(2,5-diméthoxy-4-rnéthylphényi)thiazole.
A) Chlorure de 4-cyclohexylbutyryle.
On chauffe à reflux pendant 4 heures, 50 g d'acide 4-cyclohexanebutyrique dans
160 ml de chlorure de thionyfe. Après évaporation du chlorure de thionyle en
excès, on
' 5 distille le produit attendu. Eb = 70-80 C sous 400 Pa.
B) 4-Cyclohexyl- 1-(2,5-diméthoxy-4-méthylphényi)butan-1-one.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
32
On mélange 9,4 g du composé obtenu à l'étape précédente et 6,66 g de A1CI3
dans
150 ml de CC14 et l'on ajoute goutte à goutte à 4 C 7,6 g de 2,5-diméthoxy-4-
méthylbenzène puis on maintient la température entre 5 C et 10 C pendant 3
heures.
On hydrolyse le milieu réactionnel par une solution diluée et glacée d'HCI
puis on
décante la phase organique et on sèche sur MgSO4 On évapore le solvant pour
obtenir
le produit attendu, F = 53,5-54,5 C.
C) 2-Amino-5-cyclohexyléthyi-4-(2,5-diméthoxy-4-méthylphényl)thiazole.
On brome la totalité du composé obtenu à l'étape précédente par 2.5 ml de
brome
dans CCI4 à TA. On lave à l'eau, sèche sur MgSO4, évapore le solvant puis on
reprend
par 100 ml d'éthanol et 8 g de thiourée. Après 3 heures à reflux, on évapore
puis on
reprend le milieu réactionnel par une solution saturée de NaIC03. On extrait
par
AcOEt. sèche sur MgSO4, évapore le solvant puis on chromatographie sur colonne
de
Silice en éluant par DCvTIAcOEt (70/30 ; v/v), pour obtenir 9,3 g du composé
attendu F = 112 C.
PREPARATION 1.2.
2-Amino-4-( 5-chloro-2. 4-diméthoxyphényl)-5-cyclohexyléthylthiazole.
A) 4-Cyciohexyl-1-(5-chloro-2,4-diméthoxyphényl)butan-1-one.
On méian¾e 10 g de 2.4-diméthoxychlorobenzène et 10,93 g de chlorure d'acide 4-
cyclohexanebutyrique obtenu à l'étape 1 de la PREPARATION 1.1 dans 100 mi de
CC14 à 0 C et l'on ajoute 6.35 ml de TiC14. Après 2 heures sous agitation à 0
C, on
verse sur une solution d'HCI 1 ti stlacée puis on sépare la phase organique
par
décantation et on lave car VaOH 0,5N. Après séchage sur IvigSO4, et
évaporation du
solvant, on obtient 20 g du produit attendu.
B) 2-Amino-4-(5-chloro-2,4-diméthoxyphényl)-5-cyclohexyléthylthiazole.
20 g dans 200 ntl de CC14 du composé obtenu à l'étape précédente sont traités
par
3,15 g de brome dans 20 ml de CC14, on lave à l'eau et sépare la phase
organique que
l'on sèche sur MgSO4, puis évapore. On reprend par de l'éthanol puis on
chauffe à
reflux pendant 3 heures en présence de 7 g de thiourée. Après évaporation du
solvant,
on reprend par AcOEt puis lave par une solution saturée de Na2CO3 et sèche sur
MgSO4. Après évaporation du solvant et trituration dans un mélange heptane-
éther
(50/50 ; v/v), on obtient 12,55 g du composé attendu : F = 113 C.
PREPARATION 1.3
2-Amino-5-cyciohexyléthyl-4-( 2, 4-diméthoxyphényl)thiazole,
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
A) 4-Cyclohexvl-1 -(2,4-diméthoxvphénvl)butan-1 -one.
On méiange 3,53 g d'AIC1; et 5¾ de chlorure d'acide 4-cyclohexar,ebutvrique
dans
100 n-d de CCI4 et l'on ajoute goutte à soutte à 0 C 5 g de 1.3-
diméthoxvbenzène.
Aprés 3 heures sous aeitation à 0 C, on verse l'ensemble sur une solution
d'HCI diluée
glacée. On sépare la phase organique par décantation puis on lave par NaOH
0,5N.
:'~prés séchage sur M$S04 et évaporation du solvant, on chromatoeraphie sur
une
colonne de silice H en éluant par du toluène pour obtenir 4,5 g du composé
attendu
sous forme d'huile.
B) 2-Amino-5-cyclohexyléthvl-4-(2,4-diméthoxvphénvl)thiazole.
4,44 g du produit obtenu à l'étape précédente sont placés dans 50 m1 de THF et
l'on ajoute Qoutte â goutte une solution de 5,75 g de pnénvltriméthyl
ammoniumtribromure (PTT) dans 50 ml de THF. Après 15 minutes sous a¾itation à
0 C, on verse sur un mélange d'eau et de DCM puis on extrait au DCM. Après
séchage
sur MeSO4, la phase organique est évaporée. le résidu est repris par 100 ml
d'éthanol
puis chauffé à reflux pendant 4 heures en présence de 6 g de thiourée. Après
évaporation du solvant. on reprend par AcOEt et lave successivement par une
solution
de Na2C0; puis à l'eau. La phase organique est séchée sur MgSO4 et évaporée.
Le
résidu est trituré avec un mélange éther-heptane (50/50 ; v/v) pour obtenir
4,18 g du
composé attendu ~ F = 122 C
PREPARATION 1.4
2- Amino-4-(4-chloro-2, 5 -diméthoxvphényi)-5-cvclohexvléthvithiazole.
A) 4-Cyclohexyl-1-(2,5-dirnéthoxy-4-chlorophényl)butan-1 -one.
A une suspension de 2,8 ¾ d'AICI3 dans 20 ml de CC14 à-~-4 C et sous azote, on
ajoute 3,77 g de chlorure d'acide 4-cyclohexanebutyrique en solution dans 10
ml de
CCI4. On ajoute goutte à goute 5,2 a de 2,5 -diméthoxychloro benzène dans 10
ml de
CC14 puis on laisse 3 heures sous agitation à TA. On hydrolyse le milieu
réactionnel
par.une solution diluée d'HC1 puis on décante et extrait la phase organique au
DCM.
Après séchage sur MgSO4, on évapore puis on purifie par chromatographie sur
silice
en éluant par le mélange heptane/DCM (60/40 ; v/v) puis DCM pur. On obtient
3,37 g
du composé attendu, F = 80-81 C.
B) 2-Amino-4-(4-chloro-2, 5-diméthoxyphényl)-5-cyclohexyléthyithiazole.
La totalité du produit obtenu à l'étape précédente est solubilisée dans 50 n-d
de
DCM. On ajoute à TA 1,66 g de brome en solution dans 10 ml de DCM puis la
phase
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
34
organique est lavée à l'eau et séchée sur MgSO4. Après évaporation, le résidu
est repris
dans 30 ml d'éthanol et on ajoute 1,6 g de thiourée puis on chauffe une nuit à
reflux.
On évapore l'éthanol puis le résidu est repris par une solution aqueuse de
Na2C03 à 50
% et du DCM. Après 1 heure sous agitation, on décante, extrait au DCM puis on
sèche
~ les phases organiques réunies sur Na2S04 et évapore le solvant. On
additionne de
l'heptane, le produit cristallise par trituration. On filtre et sèche pour
obtenir 3,42 g du
composé attendu, F = 110-111 C.
PREPARATION 1.5
2-Amino-5-cyclohexyléthyl-4-(5-éthoxy-2-méthoxy-4-méthyiphényl)thiazole.
A) 4-Cyclohexyl-1-(2,5-diéthoxy-4-méthylphényl)-butan-1 -one.
A une suspension de 2,9 g d'A1C1; dans 40 ml de CCI4 à T4 C, on ajoute 4 g de
chlorure de l'acide 4-cyclohexylbutyrique en solution dans 10 ml de CC14. On
ajoute
goutte à goutte 4,2 g de 2,5-diéthoxytoluène dans 20 mi de CC14. Après 4
heures à
+4 C, le milieu réactionnel est versé dans une solution glacée d'HCI dilué, On
ajoute du
DCM, décante puis sèche la phase organique sur MgSO4. Après évaporation du
solvant le produit est purifié par chromatographie sur silice H en éluant au
toluène. On
obtient 5,33 g du composé attendu, F = 49-50 C.
B) 4-Cyclohexyi-1-(5-éthoxy-2-hydroxy-4-méthylphényl)butan-1-one.
Une solution de 5,33 g du produit de l'étape précédente dans 80 ml de DCM
anhydre refroidie à-50C est traitée par 16 ml d'une solution 1M de trichlorure
de bore.
On agite D nûnutes à-5'C et le milieu réactionnel est versé sur une solution
glacée
d'HCI dilué. Après 30 minutes sous agitation, on décante. La phase organique
est
séchée sur MgSO4 et évaporée. Le produit est purifié par chromatographie sur
silice en
éluant par DCM-heptane (50/50 ; v/v). On obtient 3,88 g du composé attendu
sous
forme d'un solide jaune pâle, F = 48-49 C.
C) 4-Cyclohexyl-1 -(5-éthoxy-2-méthoxy-4-méthylphényl)butan-1-one.
On mélange dans 50 ml de MeOH, 2 g du produit de l'étape prédédente et 2 g
d'uae solution à 50 % dans l'eau d'hydroxyde de césium. Après évaporation le
résidu
est repris dans de l'isopropanol et évaporé à siccité. Le solide jaune obtenu
est
solubilisé dans 10 ml de DMF et 5 m1 d'iodure de méthyle sont ajoutés. Après
chauffage 2 heures à 80 C, le DMF est évaporé et le résidu est repris par de
l'eau. Le
composé est extrait au DCM. La phase organique est séchée sur MgSO4 et
évaporée.
"5 Le résidu est purifié par chromatographie sur silice en éluant au DCM; on
obtient 2,12
g du composé attendu, F = 37-38 C.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
D) 2-Amino-5-cyclohexyléthyl-4-(5-éthoxy-2-méthoxy-4-
méthylphényl)thiazole.
A une solution refroidie à-r4 C de 2,12 g du produit de l'étape précédente
dans 30
ml de THF on ajoute goutte à soutte une solution de 2,5 g de PTT dans 20 ntI
de THF.
5 On agite un quart d'heure à+4`ï, puis le milieu réactionnel est versé sur de
l'eau glacée.
La phase aqueuse est extraite 3 fois par 100 ml de DCM. Les phases organiques
sont
réunies et séchées sur MgSO4 puis évaporées. Le résidu est repris par 30 mI
d'éthanol
et on ajoute 1, 1 g de thiourée. Après 3 heures de chauffage à reflux et
refroidissement
l'éthanol est évaporé et l'huile obtenu est repris par une solution à 5 % de
Na2CO3. On
10 extrait deux fois par du DCM. Les phases de DCM sont séchées sur MgSO4 et
évaporées. Le résidu cristallise par trituration dans l'heptane. Après
filtration et séchage
on obtient 2,19 g du composé attendu, F = 96-97 C.
PREPARATION 1.6
15 2-Amino-5-cyclohexylthiométhyl-4-(2, 5-diméthoxy-4-méthyiphénvl)thiazole.
A) 3-cyciohexyithiopropionate d'éthyle.
25 g de cyclohexylmercaptan et 64,66 g d'hydroxyde de césium à 50 % dans l'eau
sont solubilisés dans 200 ml de méthanol. Après évaporation à sec, on effectue
2
20 distillations azéotropiques avec iPrOH puis on reprend le produit sec dans
100 ntl de
DMF, on ajoute 40 g de 3-bromopropionate d'éthyle et on chauffe 2 heures à 80
C.
Après refroidissement, le solide formé est filtré puis lavé avec le minimum de
DMF. On
évapore le DMF, reprend le résidu à l'éther, lave à l'eau, avec une solution
de NaICO3
à 5 /a, puis à l'eau. On sèche sur NaiSO4 puis évapore. Le résidu est
chromatographié
25 sur silice en éluant par un mélange DCM-heptane (50/50 ; v/v) pour obtenir
38,86 g du
composé attendu sous forme liquide.
B) Acide 3-cyclohexylthiopropionique.
La totalité du produit de l'étape précédente est placé dans 200 ml de méthanol
et
l'on ajoute une solution de 17 g de NaOH dans 50 ml d'eau. Après une nuit à TA
on
30 évapore le méthanol, reprend par de l'eau, puis extrait la phase aqueuse à
l'éther. Les
phases éthérées sont éliminées, la phase aqueuse est acidifiée à pH2 par
addition d'HCl
concentré puis on extrait 3 fois au DCM, sèche sur MgSO4 et évapore pour
obtenir
31,1 g du produit attendu sous forme huileuse.
C) Chlorure de l'acide 3-cyclohexylthiopropionique.
35 4 g du composé de l'étape précédente sont mis en solution dans 40 ml de DCM
et
traités par 3,5 g de chlorure d'oxalyle ; on ajoute 3 gouttes de DMF puis on
laisse sous
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
36
agitation 30 rninutes et on évapore à sec. Le produit est utilisé tel quel à
l'étape
suivante.
D) 2-Amino-5-cyclohexylthiométhyl-4-(2,5-diméthoxy-4-méthylphénvl)thiazole.
On procède ensuite selon les modes opératoires décrits précédemment : on
traite
par le 2,5-diméthoxvtoluène en présence de TiCIQ, puis on effectue la
bromation de la
cétone par action du PTT et l'on fait agir la thiourée pour obtenir 4,13 g du
produit
attendu : F = 143-144 C.
PREPAR.ATION 1.7
2-Amino-5-cyclohexylméthylthio-4-(2,5-diméthoxy-4-méthylphénvl)thiazole.
A) 1-(2,5-Diméthoxv-4-méthvlphénvl)éthan-1 -one.
Une suspension de 17,52 g de chlorure d'aluminium dans un mélange de 100 m! de
CCI4 et 100 ml de DCM est refroidie à+4 C sous azote, on ajoute goutte à
goutte
10,4 g de chlorure d'acétyle puis une solution de 20 g de 2,5-diméthoxytoluène
dans 20
ml de DCM. Après 4 heures d'a¾itation à+4 C, le milieu réactionnel est versé
sur de la
glace additionnée de quelques ml d'HCI concentré et on laisse sous agitation
30
minutes. On décante, extrait au DCM, les phases organiques réunies sont lavées
par
une solution aqueuse à 5 % de NaC03, on sèche sur MgSO4 et évapore. Le produit
cristallise, on triture dans 150 ml d'heptane, filtre puis lave à l'heptane
pour obtenir
21,03 g du composé attendu, F= 75-77 C.
B) 2-Amino-4-(2.5-diméthoxy-4-méthylphénvl)thiazole.
Une soiution de 21,03 g du composé de l'étape précédente dans 300 ml de DCM
est traitée goutte à goutte par une solution de 17,35 g de brome dans 70 ml de
DCM.
Après décantation, la phase organique est lavée à l'eau, séchée sur MgSO4 puis
évaporée. On reprend par 200 ml d'éthanol absolu puis ajoute 15,2 g de
thiourée et
chauffe une nuit à reflux. On refroidit au bain de glace, filtre les cristaux
formés, puis
on reprend les cristaux par une solution aqueuse de Na2CO3 à 5 % puis on
extrait à
AcOEt. On décante, sèche la phase organique sur NaiSO4 puis on évapore. On
triture
le.résidu dans l'heptane puis on filtre pour obtenir 17,74 g du composé
attendu sous
forme cristalline, F = 191-192 C.
C) 4-(2,5-Diméthoxy-4-méthylphényl)-2-(2,5-diméthylpyrrol-1 -yl)thiazole.
Dans 300 ml de benzène, on solubilise 17,74 g du composé de l'étape
précédente,
20,3 g de 2,5-hexanedione et 8,51 g d'acide acétique. Après 24 heures de
distillation
azéotropique, le milieu réactionnel est versé sur de l'eau puis on neutralise
par une
solution aqueuse de Na-iCO3 à 5 %. On décante puis on extrait par AcOEt. Les
phases
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
37
organiques réunies sont séchées sur Na2SO4 puis évaporées. Le résidu est
chromatographié sur silice en éluant au DCM pour donner 19,46 g du composé
attendu
qui cristallise dans l'heptane. F= 92-93 C.
D) 5-(Cyclohexylméthvlthio)-4-(2,5-diméthoxy-4-méthylphénvl)-2-(2,5-
~ diméthylpyrrol-l-yl)thiazole.
Une solution de 3,28 g du composé de l'étape précédente dans 80 rril de THF
anhydre est refroidie à-30 C puis traitée par 8 rnl de n-butyllithium 1,6 M
dans
l'hexane. Après 30 minutes à-30 C, on ajoute 650 mg de soufre en tleur. On
laisse
revenir à TA puis on ajoute 3,4 g de tosylate de cyclohexylméthanol en
solution dans
10 ml de TI- anhydre, on laisse sous agitation 2 heures à TA. Le milieu
réactionnel est
versé sur de l'eau puis on extrait à l'éther, sèche sur NaiSO4 et évapore. Le
résidu est
chromatographié sur silice H en éluant au toluène. On obtient 1,1 g du composé
attendu, F = I 17-118 C.
E) 2-Amino-5-cyclohexylméthvlthio-4-(2, 5 -diméthoxy-4-méthylphénvl)thiazole.
On chauffe pendant 36 heures à reflux un mélange contenant 1,1 g du composé de
l'étape précédente, 30 ml d'éthanol, 4,5 mI d'eau et 3,7 g de chlorhydrate
d'hydroxylamine. Après évaporation, on reprend le milieu par une solution
aqueuse de
Na2C0- à~% puis on extrait au DCM, sèche sur MgSO4, et évapore puis le résidu
est chromatographié sur silice en éluant par DCM/AcOEt (70/30 ; viv). On
obtient
0,78 g du composé attendu, F = 111-112 C.
PREPARATION 1.8
2-Amino-5-cvcloheptyléthyl-4-(2, 5-diméthoxy-4-méthylphénvi)thiazole.
A) Ester éthylique de l'acide 4-cycloheptylidènebut-2-énoique.
On solubilise 6,7 ml d'ester éthylique d'acide 4-(diéthoxyphosphoryl)but-2-
énoique
dans 7 mI de diméthoxyéthane puis on verse sur 1,3 g d'hydrure de sodium à 60
% dans
40 ml de diméthoxyéthane. Après 45 minutes sous agitation, on refroidit à 10 C
puis
on ajoute goutte à goutte 3,2 ml de cycloheptanone et on laisse revenir à TA.
Après 4
heures sous agitation, on verse sur de l'eau froide puis extrait à l'éther,
sèche et
évapore. Le résidu est chromatographié sur silice en éluant au DCM. On obtient
1,9 g
du composé attendu.
B) Ester éthylique de l'acide 4-cycloheptylbutanoïque.
La totalité du composé de l'étape précédente est hydrogéné à température
ambiante et à pression atmosphérique dans 20 ml d'EtOH, en présence de 190 mg
de
Pd/C à 10 %. On obtient 1,9 g du composé attendu.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
38
C) Acide 4-cycloheptylbutanoique.
Dans 20 ml de MeOH et 5 ml d'eau, on place 1,9 g du composé de l'étape
précédente et 755 mg de soude et on laisse sous agitation à TA pendant 24
heures. On
séche sous vide pour obtenir 1,5 ¾ du composé attendu.
D) 4-Cycioheptyl-(2, 5-diméthoxy-4-méthylphényl)butan- I-one.
On refroidit à 0 C 1,5 g du composé de l'étape précédente et une goutte de
D?1g
dans 20 ml de DCM, on ajoute 0,71 ml de chlorure d'oxalyle puis on laisse
revenir à
TA. Après 3 heures sous agitation, on ajoute 1,2 g de 2,5-diméthoxvtoluène
refroidi à
4 C puis on ajoute par portions 1,2 g de AIC13. On laisse sous agitation 1
heure et
demie à-4 C puis 2 heures à TA. Le ntilieu réactionnel est versé sur une
solution
d'HCI dilué puis on décante et extrait à l'éther. Les phases organiques sont
réunies,
lavées par NaOH IN puis concentrées. On purifie par chromatographie sur silice
en
éluant par AcOEt/pentane (30/70 ; viv) et on obtient 2,19 g du composé
attendu.
E) 2- Amino-5-cycloheptyléthyl-4-(2, 5-diméthoxy-4-méthylphényl)thiazole.
On solubilise 2,1 g du composé de l'étape précédente dans 25 cnl de THF et on
ajoute 2,47 g de PTT en 5 nvnutes. Après 5 heures sous agitation, on filtre le
précipité,
on lave au THF puis on concentre la phase organique, reprend par 30 ml d'EtOH
puis
ajoute 0,5 g de thiourée et chauffe 48 heures à reflux. On concentre le milieu
réactionnel, reprend par une solution à 10 % de Na2)CO3, extrait à l'éther,
puis on lave
la phase organique, sèche et concentre. Le résidu est chromatographié sur
silice en
éluant par AcOEt/pentane (70/30 ; v/v).
PREPARA.TION 1.9
2-Amino-5 -((4,4-diméthylcyclohexyl)éthyl)-4-(2, 5-diméthoxy-4-méthylphényi )
thiazole.
A) 4,4-Diméthylcyclohexanone.
Dans 65 ml d'AcOEt, on additionne 6,7 g de 4,4-diméthylcyclohex-2-èn-1-one et
2
g de Pd/C à 10 % et on hydrogène à TA sous pression atmosphérique jusqu'à
absorption du volume théorique d'hydrogène. On filtre le catalyseur puis
concentre
pour obtenir 6,3 g du produit attendu.
B) 2-Amino-5-[(4,4-diméthylcyclohexyl)éthyl]-4-(2,5-diméthoxy-4-méthylphényi)
thiazole.
On procéde ensuite selon le mode opératoire décrit à la PREPARATION
précédente en effectuant successivement les étapes A), B), C), D) et E) pour
obtenir le
produit attendu : F = 136-138 C.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
39
PREPARATION 1.10
2-Amino-5-cyclopentyiéthyl-4-(2, 5-diméthoxy-4-méthvlphénvl)thiazoie.
On procède selon le mode opératoire décrit dans les deux PREPARATIONS
précédentes pour obtenir le composé attendu : F = 80 C.
PREPARATION I.11
2-Amino-5-cyclohexyléthyl-4-(2, 5-diméthoxy-4-éthylphénvl)thiazole.
A) 1 -(2, 5-Diméthoxyphényl)éthan-1-one.
On place 19,3 g d'A1C13 dans 200 ml de CC14 à t 5'C sous azote et l'on ajoute
11,36 g de chlorure d'acétyle puis 20 g de 1,4-diméthoxybenzène par petites
fractions.
Après 3 heures sous agitation à + 5 C, on verse sur une solution d'HCI diluée,
glacée.
On sépare la phase organique que l'on sèche sur MgSO4, évapore puis on
chromatographie sur silice en éluant par un mélange DCM-heptane (50/50 ; v/v)
pour
obtenir 24,71 g du produit attendu.
B) 1,4-Diméthoxy-2-éthylbenzène.
On prépare un mélange de 300 g de zinc en poudre et 40 g de chlorure
mercurique
que l'on ajoute à une solution de 24 g du composé de l'étape précédente dans
400 ml de
benzène et 100 ml d'HCI concentré à 80 C. Après 2 heures sous agitation à 80
C, on
filtre puis on sépare la phase organique que l'on sèche sur MgSO4 et évapore,
puis on
chromatographie sur silice en éluant par le mélange DCM-heptane (50/50 ; v/v)
pour
obtenir 8,6 g du produit attendu.
C) 2-Amino-5-cyclohexyléthyl-4-(2,5-diméthoxy-4-éthylphényl)thiazole.
On procède ensuite selon le mode opératoire décrit à la PREPARATION 1.3 pour
obtenir le produit attendu : F = 88 C.
PREPARATION 1.12
.. . 2-Amino-5-cyclopentylméthylthio-4-(2,5-diméthoxy-4-méthylphényl)thiazole.
A). 5-(Cyclopentylméthylthio)-2-(2, 5-diméthylpyrrol-l-yl)-4-(2,5-diméthoxy-4-
rnéthylphényl)thiazole.
On prépare une solution de 3,28 g du 4-(2,5-diméthoxy-4-méthylphényl)-2-(2,5-
diméthylpyrrol- I-yl)thiazole tel qu'obtenu à l'étape C de la PREPARATION 1.7
dans
80 ml de THF, et on refroidit cette solution à-30 C ; on ajoute goutte à
goutte 8 ml de
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
n-butyllithium 1,6 M dans l'hexane, dans 10 ml de THF et on laisse sous
agitation 30
minutes en laissant-la température revenir à 0 C. On refroidit â-30 C et
ajoute 0,65 g
de soufre en fleur. On laisse la température revenir à 0 C et ajoute 3,5 g de
p-
toluènesuifonate de cyclopentylméthyle dans 3 ml de THF. Après 2 heures sous
5 agitation â TA, on verse sur de l'eau glacée, extrait à l'éther puis l'on
sèche sur Na2SO4
et évapore. Le résidu est chromatographié sur silice H en éluant au toluène
pour
obtenir 0,47 g du produit attendu - F = 107,5-108,5- C.
B) 2-Amino-5-cyclopentvlméthylthio-4-(2,5-diméthoxy-4-méthyiphényt)thiazole.
On mélange 0,47 g du composé de l'étape précédente et 2 g de chlorhydrate
10 d'hvdroxylamine dans 20 m1 d'éthanol et 3 ml d'eau et on porte à reflux
pendant 48
heures. Après évaporation du solvant, on reprend par une solution à 5 'a de
Na2C03
puis on extrait au DCM, sèche sur IvigSO4 et évapore. Le résidu est
chromatographié
sur silice en éluant par DCM-AcOEt (80/20 ; v/v). On obtient 0,32 g du composé
attendu : F = 88-89 C.
PREP ARATION 1.13
2-Amino-5-cyclohexyiéthyl-4-(2, 6-diméthoxy-4-méthylphényl)thiazole.
A) 5-Cyclohexyiéthyl-2-(2,5-diméthylpyrrol-1-yl)-4-(2,6-diméthoxy-4-
méthylphényl)thiazole.
A 4.27 g de 2-(2,5-diméthylpyrrol-1-yl)-4-(2,6-diméthoxy-4-méthylphényl)
thiazole, on ajoute à-30 C 10 ml de n-butyllithium 1,6M dans l'hexane et on
laisse 30
minutes sous agitation à-30 C. On ajoute 4,2 g de triflate de
cyclohexyléthanol à-
45 C puis on revient à 0 C, ajoute de l'eau, extrait par Et20, sèche et
évapore. La
gomme formée est chromatographiée sur silice en éluant par cyclohexaneiAcOEt
(1/1 ;
v/v). On obtient 0,52 g du composé attendu sous forme d'une gornme incolore.
B) 2-Amino-5-cyclohexyléthyl-4-(2,6-diméthoxy-4-méthylphényl)thiazole.
On chauffe à reflux pendant une nuit 0,4 g du composé de l'étape précédente
dans
5 ml d'EtOH et 2 ml d'eau en présence de 0,93 g de chlorhydrate
d'hydroxylamine. On
verse sur une solution aqueuse saturée de Na2CO3, extrait par AcOEt, sèche
puis
évapore. La gomme formée est chromatographiée sur silice en éluant par
DCM/MeOH
(100/3 ; v/v). On obtient 0,25 g du composé attendu sous forme d'une huile
brun clair.
PREPARATION 1.14
j' 5 2-Amino-4-(2,5-dirnéthoxy-4-méthylphényi)-5-(5,5-diméthylhexyl)thiazole.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
41
A) (2,5-Diméthoxy-4-méthylphényl)-7,7-diméthyloctan-1-one.
On solubilise 1 g d'acide 7,7-diméthyloctanoïque dans 20 mi de DCM refroidi à
0 C, on ajoute 0,57 ml de chlorure d'oxalyle puis on laisse sous agitation 1
heure à 0 C
et 2 heures à TA. On ajoute 0,93 ml de 2,5-diméthoxytoluène et une goutte de
DMF,
on refroidit à 0 C puis on ajoute 940 mg d'AICI3 et on laisse sous agitation 1
heure à
0 C et une nuit à TA. On verse sur une solution d'HCI à 10 %, extrait à
l'éther, puis on
lave les phases organiques réunies par de la soude 2N, sèche et concentre. Le
résidu est
chromatographié sur silice en éluant par DCM/pentane (85/15 ; v/v) pour
obtenir 1,05
g du composé attendu.
B) 2-Amino-4-(2,5-diméthoxy-4-méthylphényl)-5-(5,5-diméthylhexyl)thiazole.
Dans 15 ml de THF, on solubilise 1,05 g du composé de l'étape précédente puis
on
ajoute 1,29 g de PTT et laisse sous agitation 4 heures à TA. Le précipité
formé est
éliminé et le filtrat est concentré. Le résidu est repris par 15 ml d'éthanol
puis on ajoute
260 mg de thiourée et chauffe une nuit à reflux. Le lendemain on extrait à
l'éther, lave à
l'eau, par une solution de NaOH IN, sèche sur Na2)SO4 et concentre. Le résidu
est
chromatographié sur silice en éluant par AcOEt/pentane (75/25 ; v/v). On
obtient 1,12
g du composé attendu.
En opérant selon les modes opératoires décrits dans les PREPARATIONS 1.1 et
1.2 on prépare les composés décrits dans le tableau 1 ci-après.
25
35
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
42
TABLEAU t
R, s ~~,
`'
R
PREPAR.ALTIONS R Ri F'C
1.15 OMe -(C~ H 120
Me
OMe
OMe
~ 136
1.16 -CH
z H
:vie0
CI
OMe
1.17 ~ n-hexyle 115
Me0
Me
OMe
1.18
-S-C 133
-
Me0
Cl
1.19 Me
` -~C~)z H 151
Me0
Me
1.20 Me -{CHZ)z H 127
MeO
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
4;
1.21 Me
-(CFi..) 133
yteO
~ I
1.22 OMe 121
` I -{CHZ)2 H
MeO
IO Br
OMe
1.23
Br
OMe
1.24 70
-(CHZ)Z H
~ OMe
O
1.25 OMe (CH2)4-CH(CH3 )2 140
M
Me
OMe
1.26 n-heptyie 112
I
M
Me
OMe
1.27
.. ` ~ -(CHz)2
89
OMe
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
44
1.28 OMe
93
-S-Cii~
Me
OMe
PREPAR.ATION 1.29
2-Amino-5-cyclohexyléthyl-4-(2,6-diméthoxy-4-isopropylphényl)thiazole.
A) 1-Isopropènvl-2,4-diméthoxvbenzène.
On dissout 10,57 g de 1-(2,4-diméthoxyphényl)-éthanone dans 100 tnl d'éther et
50 ml de TFiF sous azote. A-50 C on additionne 55 ml de méthyllithum 1,6 M
dans
l'éther et on laisse sous agitation 2 heures entre -60 C et -40 C puis 30
minutes entre
-40 C et 0 C et 3 heures à TA. On refroidit à 0 C et on ajoute 70 ml d'HCI 2
N. Après
décantation, on extrait à l'éther puis on sèche la phase organique sur Na2SO4.
On
concentre puis on reprend par 150 ml de THF et on ajoute 75 ml d'HCl 2 N.
Après 4
heures sous agitation à TA, on ajoute 100 ml d'eau puis on e.,ctrait à
l'éther. La phase
organique est lavée par Na<O3, à l'eau puis séchée sur Na2SO4 et concentrée.
Le
résidu est chromatographié sur silice en éluant par un mélange DC?vi/pentane
(70/30
puis 60/40). On obtient 5 g du composé attendu sous forme d'huile.
B) 1-Isopropyl-2,4-diméthoxybenzène.
On dissout 4,96 g du composé de l'étape précédente dans 100 ml de méthanoi et
on ajoute 0,2 g de Pd/C à 10 % puis on hydrogène à température et pression
ambiantes. On filtre le catalyseur puis on concentre sous vide pour obtenir
4,2 g du
composé attendu sous forme d'huile.
C) 2-Amino-5-cyclohexyléthyl-4-(2,6-diméthoxy-4-isopropylphényl)thiazole.
On procède ensuite selon les modes opératoires décrits précédemment. On traite
le
1-isopropyl-2,4-diméthoxybenzène par le chlorure de 4-cyclohexylbutyryle en
présence
de A1C13, puis on effectue la bromation de la cétone par action du PTT et l'on
fait agir
la thiourée pour obtenir le produit attendu. F = 143 C.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
B - PREPARATION DES DERIVES D'ACIDE LNDOLE-2-
CAR.BOXYLIQUE DE FORMULE R'3COOH:
Rg Rio
Ril
5 i I (~n
HOOC V R1Z
R'8 R13
dans laquelle R'8 est le précurseur de Rg et Rq, R10, R11, R12 et R13 sont
tels que
définis ci-dessus pour (I).
PREPARATION 2.1
Acide 1-(méthoxycarbonylméthyl)indole-2-carboxylique.
A) Ester benzylique de l'acide indole-2-carboxylique.
On place dans un tricol, à TA, 10,32 g d'acide indole-2-carboxylique dans 70
nzl de
THF et on ajoute 10,38 g de carbonyldiimidazole puis, à la fin du dégagement
gazeux,
on ajoute 7,62 g d'alcool benzylique. Après 5 heures de chauffage à reflux, on
verse sur
de l'eau, extrait au DCM, sèche et évapore. Les cristaux formés sont lavés par
iPrOH
pour obtenir 13,62 g du composé attendu : F = 136 C.
B) Ester benzylique de l'acide 1 -(méthoxycarbonylméthyl)indole-2 -
carboxylique.
On place dans un tricol 2,85 g d'hydrure de sodium à 50 % dans l'huile et 10
ml de
DMF et on fait barboter de l'azote. On ajoute 13,58 g du composé de l'étape
précédente dissous dans 50 ml de DMF puis on additionne lentement 9,09 g de
bromoacétate de méthyle. Après une nuit sous agitation à TA, on verse sur de
la glace,
extrait par ACOEt, sèche sur Na2SO4 et évapore ; le résidu est chromatographié
sur
silice en éluant par le mélange toluène-AcOEt (95/5 ; v/v). On obtient 6,84 g
du
composé attendu qui cristallise dans le mélange EtOH/pentane : F = 94 C.
C) Acide 1-(méthoxycarbonylméthyl)indole-2-carboxylique.
On mélange 6,84 g du produit de l'étape précédente avec 80 nil de DMF, 80 ml
î0 d'EtOH et 100 mg de Pd/C à 5 % et on hydrogène sous forte agitation pendant
8
heures. On filtre le catalyseur, évapore à sec puis on cristallise le produit
dans un
mélange EtOH/éther de pétrole. On obtient ainsi 4,30 g du composé attendu, F
190 C.
PREPARATION 2.2
Acide 1-(tert-butoxycarbonylméthyl)indole-2-carboxylique.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
46
A) Ester benzyiique de l'acide 1-(tert-butoxycarbonylméthyl)indole-2-
carboxylique.
On solubilise 50,25 g d'ester benzylique de l'acide indole-2-carboxylique
(PREPARATION 2.1, étape A) dans 140 ml de D11 anhydre, puis on ajoute sous
courant d'azote sec, en 30 minutes, une solution de 6,6 g de NaH à 80 % dans
l'huile
dans 100 ml de Dï1. Le rnilieu réactionnel est agité 90 minutes à TA puis il
est
refroidi dans un bain de glace et on ajoute goutte à goutte 42,91 ml de
bromoacétate
de tert-butyie. Après une nuit sous agitation à TA, on évapore le DMF et on
reprend le
résidu au DCM puis à l'eau. Après agitation, on décante puis la phase aqueuse
est
extraite 2 fois au DCM ; les phases organiques réunies sont lavées par une
solution
saturée de NaCI, puis séchées sur MgSO4 Après filtration et évaporation, le
résidu est
repris par un mélange de 100 ml d'éther éthylique et 100 ml d'heptane. Après 2
heures
d'agitation, les cristaux formés sont filtrés puis lavés par 50 rnl d'un
mélange
heptane/éther éthylique (70/30 ; viv) et séchés à l'étuve. On obtient 58 g du
produit
attendu, F = 95-96 C.
B) Acide 1-(tert-butoxycarbonyiméthyl)indole-2-carboxylique.
58 g de l'ester benzylique de l'étape précédente sont solubilisés dans 150 ml
d'éthanol et 150 mi de DMF ; on ajoute 3 g de Pd/C à 5 %, sous un courant
d'azote et
on hydro¾ène le milieu réactionnel à pression atmosphérique. On filtre sur
Célite R puis
on évapore les solvants et reprend le résidu par de l'eau. Après trituration,
on lave le
solide formé à l'eau puis on le dissout dans 1 litre d'AcOEt. Cette phase
organique est
lavée 2 fois à l'eau puis séchée sur NaiSO4. On filtre et évapore , le solide
formé est
trituré en présence de 100 ml d'un mélange heptane/éther éthylique (50/50 ;
vfv). On
filtre à nouveau et sèche à l'étuve pour obtenir 39,6 g du composé attendu
sous forme
d'un solide blanc, F = 156-157 C.
PREPARATION 2.3
Acide 5-méthyl-1 -(tert-butyloxycarbonylméthyl)indole-2-carboxy:ique.
A).. . Ester benzylique de l'acide 5-méthylindole-2-carboxylique.
On dissout 2,43 g d'acide 5-méthylindole-2-carboxylique dans 15 ml de DMF ; on
ajoute 2,11 g de DBU puis on laisse 1 heure sous agitation à TA. On ajoute
goutte à
goutte 2,61 g de bromure de benzyle puis on laisse 6 heures sous agitation à
TA. On
concentre sous vide, reprend le résidu par AcOEt, lave à l'eau, par une
solution saturée
de Na2CO3, au tampon sulfate puis à l'eau saturée en NaCI. On sèche sur Na2SO4
puis
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
47
on concentre. Le résidu cristallise au pentane, on obtient 3,3 g du composé
attendu,
F = 150-152 C
B) Ester benzylique de l'acide 5-méthyl- l-(tert-butyloxyçarbonyiméthyl)indole-
2-
carboxylique.
On dissout 3,26 g du composé de l'étape précédente dans 30 ml de DMF et l'on
ajoute par portions, sous azote, 0,65 g de NaH à 50 % dans l'huile. Après 2
heures et
demie sous agitation à TA, on ajoute goutte à goutte, à 80 C, 2,64 g de
bromoacétate
de tert butyle et laisse sous agitation 4 heures à TA. On concentre sous vide,
reprend le
résidu par -150 ml de tampon sulfate puis on extrait par AcOEt, sèche sur
Na2SO4 et
concentre. On obtient 3,53 g du composé attendu qui cristallise dans le
pentane, F
80-82 C
C) Acide 5 -méthyl-1-(tert-butyloxycarbonylrnéthyl)indole-2-carboxylique.
3,47 g du composé de l'étape précédente sont dissous dans 30 ml d'éthanol
absolu
et 15 ntl de DV1F et on ajoute sous azote 0,3 g de Pd/C à 10 % puis on
hydrogène à
TA sous pression atmosphérique. On filtre le catalyseur puis on concentre sous
vide
pour obtenir 2,86 g du composé attendu qui cristallise dans le pentane, F =
174-176 C.
PREPARATION 2.4
Acide 4-méthoxy- 1 -(tert butyloxycarbonylméthyl)indole-2-carboxylique.
A) Ester benzylique de l'acide 4-rnéthoxyindole-2-carboxylique.
On dissout 2,65 g d'acide 4-méthoxyindole-2-carboxylique dans 15 rnl de DMF et
on ajoute 2,11 g de DBU puis on agite I heure à TA. On additionne goutte à
goutte à
TA 2,61 Q de bromure de benzyle et on agite 5 heures à TA. On concentre sous
vide,
reprend le résidu par AcOEt, lave à l'eau, par une solution saturée de Na2CO3,
au
tampon sulfate puis à l'eau saturée en NaCI. On sèche sur Na2SO4 et concentre.
On
obtient 3,57 g du composé attendu qui cristallise dans le pentane, F = 162-164
C.
B) Ester benzylique de l'acide 4-méthoxy-l-(tert butyloxycarbonyiméthyl)indole-
2-
carboxylique.
..On dissout 3,3 g du composé de l'étape précédente dans 30 mt de DMF, on
ajoute
par portions, sous azote, 0,62 g de NaH à 50 % dans I'hufle et on laisse sous
agitation 2
heures et demie à TA. On ajoute goutte à goutte à TA 2,52 g de bromoacétate de
tert
butyle et agite 5 heures à TA. On concentre sous vide, reprend le résidu par
150 ml de
tampon sulfate puis extrait par AcOEt, sèche sur Na2SO4 et concentre. On
obtient 4,2
g du composé attendu qui cristallise dans le pentane, F = 96-98 C,
C) Acide 4-méthoxy-l-(tert butyloxycarbonylméthyl)indole-2-carboxylique.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
48
On dissout 4,13 g du composé de l'étape précédente dans 30 ml d'éthanol absolu
et
30 ml de DM'F et 'on ajoute 0.4 g de Pd/C à 10 % puis on hydrogène à TA sous
pression atmosphérique. On filtre le catalyseur et concentre pour obtenir 2,36
g du
composé attendu qui cristallise dans le mélange DCM/pentane, F = 222-224 C.
PREP ARATION 2.5
Acide 5-chloro-1 -(éthoxycarbonvlméthyl)indole-2-carboxylique.
A) Ester tert-butyiique de l'acide 5-chloroindole-2-carboxylique.
On dissout 5,52 g d'acide 5-chloroindole-2-carboxvlique dans 40 n-J de DNIF,
on ajoute
4,57 g de carbonvldiimidazole sous azote à TA puis on chauffe à 40 C et
additionne
4,3 g de DBU et 4,17 g de tert-butanoi. On maintient le chauffage à 40 C
pendant 3
heures puis on filtre le précipité formé et concentre sous vide. On reprend le
résidu par
AcOEt, lave par une solution de Na2CO3 à 10 %, de l'eau saturée en NaCI, un
tampon
sulfate puis on sèche sur Na2>SO4 et concentre. Le résidu est chromatographié
sur
silice en éluant au DCM pour obtenir 0,45 g du composé attendu, F = 140-142 C.
B) Ester tert-butylique de l'acide 5-chloro-l-(éthoxycarbonylméthyl)indole-2-
carboxylique.
On dissout 0,45 g du composé de l'étape précédente dans 15 ml de DMF puis on
ajoute par portions, à TA, sous azote, 94 mg de NaH à 50 % dans l'huile. Après
4
heures sous agitation à TA, on additionne goutte à goutte à TA 0,33 g de
bromoacétate d'éthyle et on laisse sous agitation 4 heures à TA. On concentre
sous
vide, reprend le résidu par AcOEt, lave au tampon sulfate, sèche sur Na2SO4 et
concentre pour obtenir 0,6 g du composé attendu sous forme d'huile.
C) Acide 5-chloro-l-(éthoxycarbonviméthyl)indole-2-carboxylique.
On dissout 0,6 g du composé de l'étape précédente dans 10 tnl de DCM, on place
dans un bain de glace et on ajoute 10 ml de TFA puis on agite pendant 4 heures
dans le
bain de glace. Après une nuit à 4 C, on concentre sous vide. Le résidu
cristallise dans
le pentane. Après séchage on obtient 0,37 g du composé attendu : F = 198-200
C.
PREPARATION 2.6
Acide 1-(2-éthoxycarbonylbenzyi)indole-2-carboxylique.
A) Ester benzyiique de l'acide indole-2-carboxylique.
Cet ester peut être préparé selon un procédé alternatif à celui décrit à la
PREPARATION 2.1.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
49
100 g d'acide indole-2-carboxyiique sont solubilisés dans 500 ml de D;W, on
ajoute goutte à goutte 93 mi de DBU puis 89,7 rnl de bromure de benzyle. Après
une
nuit sous agitation à TA, on évapore le DMF puis on verse sur de l'eau. Le
précipité
formé est filtré, lavé à l'eau, repris par AcOEt. La phase organique est lavée
par une
solution à 5 % de Na2CO3, au tampon sulfate, puis séchée sur Na2SO4. Après
filtration, on évapore les solvants, triture dans l'éther, filtre et sèche. On
obtient 133 g
du composé attendu, F = 136 C.
B) 2-Bromométhylbenzoate d'éthyle.
On chauffe à reflux dans 50 ml de CC14 un mélange contenant 8,2 g de 2-
méthylbenzoate d'éthyle, 10,7 g de NBS et 0,2 g de péroxyde de benzovle, sous
irradiation. Après 45 minutes, la solution est refroidie et le succinimide
formé est filtré.
La phase organique est lavée par une solution à 5 % de NaHCO3 puis séchée sur
MgSO4 et évaporée. Le produit est utilisé tel quel à l'étape suivante.
C) Ester benzylique de l'acide 1-(2-éthoxycarbonylbenzyl)indole-2-
carboxylique.
On solubilise sous azote, dans 50 ml de DMF, 12,56 g du composé préparé à
l'étape A , on ajoute par petites fractions 1,81 g de NaH à 80 % dans l'huile
en
maintenant la température inférieure à 20 C par un bain de glace. Après 1
heure sous
agitation à TA, on refroidit à- 4 C par un bain de glace et ajoute goutte à
goutte le
produit obtenu à l'étape précédente en solution dans 20 ml de DMF puis on
laisse une
nuit sous agitation à TA. On évapore le DMF, reprend par un mélange eau-glace,
extrait 3 fois à l'éther puis on réunit les phases organiques, lave par une
solution saturée
de NaCI, sèche sur Na,)SO4 et évapore. On dissout le produit dans le toluène,
on filtre
et chromatographie le filtrat sur silice H en éluant par du toluène. On
obtient 9¾ du
composé attendu sous forme d'huile.
D) Acide I-(2-éthoxycarbonylbenzyl)indole-2-carboxylique.
La totalité du produit obtenu à l'étape précédente est hydrogénée en présence
de
Pd/C selon la technique habituelle. On obtient 6,13 g du composé attendu, F =
191-
192 C.
PREPARATION 2.7
Acide I -(méthoxycarbonyléthyl)indole-2-carboxylique.
A) Ester benzylique de l'acide 1-(2-cyanoéthyl)indole-2-carboxylique.
Dans 40 ml de dioxane, on mélange 1,6 ml de Triton B à 40 % dans l'eau et 4 ml
d'acryfonitrile puis on ajoute sous agitation 9,44 g d'ester benzylique de
l'acide indole-
2-carboxylique. On chauffe à 80 C pendant 24 heures puis on verse dans 500 ml
d'eau
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
glacée. Le précipité formé est filtré, repris par AcOEt puis on sèche sur
NaIS04 et
concentre pour obtenir 10,1 g du composé attendu qui cristallise. F= 98-100 C.
B) Ester benzylique de l'acide 1-(méthoxycarbonviéthyl)indole-2-carboxylique.
On dissout 10,1 g du composé de l'étape précédente dans 60 ml de DCM et on
5 ajoute 12 ml de MeOH et 120 ml d'éther chlorhydrique. Après 72 heures à 0 C,
on
filtre l'imidate formé puis on reprend le précipité par 30 rnl d'eau et
d'acide acétique. La
solution formée est agitée 2 heures à TA puis on ajoute 50 ml d'HCI N et on
extrait par
AcOEt, sèche sur Na2SO4 et concentre pour obtenir 9 g du composé attendu sous
forme d'huile.
10 C) Acide 1 -(méthoxycarbonyléthvl)indole-2 -carboxylique.
Les 9 g du composé de l'étape précédente sont hvdrogénés dans l'éthanol en
presence de Pd/C pour donner 3,95 g du composé attendu, F 118-12G C.
PREP ARATION 2.8
15 Acide 1-(terr-butoxycarbonvlméthyl)-5-éthylindole-2-carboxylique.
A) Acide 2-[(4-éthylphénvl)hydrazono]propionique.
Ce composé est préparé selon V. Prelog et al., Helv. Chem. Acta, 1948, 31,
1178.
On solubilise 13,2 g de 4-éthylaniline dans 150 ml d'HCl concentré. On
refroidit à
20 0 C puis on ajoute à une température inférieure ou égale à 5 C 10,6 g de
NaNO2 en
solution dans 40 mi d'eau. Après 5 minutes, on ajoute une solution â5 C de
SnCl2,
2HiO dans 75 ml d'HC1 concentré puis on laisse 2 heures et demie a 0 C. On
filtre,
iave le précipité formé avec le mininum d'eau à 5 C puis on le solubilise dans
500 mI
d'eau à 5 C. On ajoute à 10 C, 9,5 ml d'acide pyruvique dans 50 nÉ d'eau.
Après une
25 nuit au réfrigérateur, le précipité formé est filtré puis repris dans 120
ml de benzène.
On sèche sur Na2SO4 puis concentre pour obtenir 11 g de composé attendu.
B) Ester éthylique de l'acide 2-[(4-éthylphényl)hydrazono]propionique.
On chauffe à reflux pendant 2 heures 11 g du composé de l'étape précédente,
dans
100 ml d'éthanol absolu et 6 ml d'H->S04. On concentre au tiers, puis on verse
sur de
30 l'eau glacée, extrait à l'éther, lave par Na2CO3, sèche sur Na2SO4 et
concentre. Le
précipité formé est repris au pentane puis filtré pour donner 7,9 g du composé
attendu.
C) Ester éthylique de l'acide 5-éthylindole-2-carboxylique.
On chauffe 9,6 g d'acide p-toluènesuifonique dans 100 ml de benzène au reflux
puis on ajoute avec précaution 7,9 g du composé de l'étape précédente et on
chauffe
35 une heure et demie à reflux. On filtre l'insoluble, puis la solution
benzènique est lavée
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCTIFR98/02007
51
par NaHCO3 en solution saturée, séchée puis concentrée. Le résidu précipite
dans le
pentane. On obtient 5,4 g du produit attendu.
D) Acide 5-éthylindole-2-carboxylique.
On chauffe pendant 3 heures à reflux 5,4 g du composé de l'étape précédente
dans
50 ml d'éthanol et 4 mi d'eau contenant 3,4 g de KOH. On concentre le milieu,
reprend
le résidu à l'eau, lave à l'éther, acidifie la phase aqueuse par addition
d'HCl concentré
puis on filtre le précipité formé pour obtenir 3,95 g du composé attendu.
E) Ester benzylique de l'acide 5-éthyiindole-2-carboxylique.
Dans 30 ml de D11 on mélange 4 g du composé de l'étape précédente, 3,14 ml de
DBU et 2,75 ml de bromure de benzyie et on laisse 48 heures sous agitation à
TA. On
verse le milieu sur 300 ml d'eau à 5 C, filtre le précipité tormé puis on le
lave à l'eau à
5 C puis au pentane. On reprend ce précipité par 300 ntl d'acétate d'éthrle,
sèche sur
NaiSO4 et concentre pour obtenir 4,93 g du composé attendu.
F) Ester benzylique de l'acide 5-éthyl-1 -(tert-butoxycarbonylméthyl)indole-2-
carboxylique.
On dissout 4,93 g du composé de l'étape précédente dans 40 mi de DMF, on
ajoute par portions 0,78 g d'hydrure de sodium à 60 % dans l'huile puis on
chauffe 30
minutes à 60 C. On laisse refroidir et l'on ajoute goutte à goutte 3,1 mi
d'ester tert-
butylique d'acide bromoacétique. Après une nuit à TA, on évapore le DMF, on
extrait à
l'éther, lave à l'eau, sèche sur Na2S04, puis on chromatographie le résidu sur
silice en
éluant par DCVUpentane (60/40 ; v/v) pour obtenir 5,2 g du composé attendu.
G) Acide 5-éthyl-1-(tert-butoxycarbonylméthyl)indole-2-carboxylique.
On hydrogène à température et pression ambiantes 5,2 g du composé de l'étape
précédente dans 100 nil d'éthanol et 120 ml d'acétate d'éthyle en présence de
520 mg
de Pd/C à 10 %. On filtre le catalyseur, lave à l'acétate d'éthyle puis
concentre à sec
pour obtenir 4 g du composé attendu.
PREPARATION 2.9
Acide 1-(tert-butoxycarbonylméthyl)-5-trifluorométhylindole-2-carboxylique.
A) Ester éthylique de l'acide 2-[(4-
trifluorométhyl)phénylhydrazono]propionique.
On ajoute goutte à goutte 19,3 g de 4-trifluorométhylaniline sur un mélange de
200 ml d'eau et 32 ml d'HC1 concentré, on refroidit à-5 C et on ajoute 8,3 g
de
NaNO2 dans 20 ml d'eau. Par ailleurs, on prépare une solution de 98 g
d'acétate de
sodium hydraté (CH3CO2Na, 3H2O) et 29 ml d'ester éthylique d'acide 2-méthyl-3-
oxobutyrique dans 125 ml d'éthanol et 90 g de glace pilée ; on refroidit à-10
C, on
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
52
ajoute le mélange réactionnel préparé ci-dessus et on maintient 5 minutes à-10
C puis
on laisse revenir à TA. On filtre le précipité que l'on lave à l'eau puis au
pentane pour
obtenir 22.5 g du composé attendu.
B) Acide 1-(rert-butoxycarbonyiméthyl)-5-trifluorométhvlindole-2-carboxylique.
On procède ensuite selon le mode opératoire décrit dans les étapes C à G de la
PREPARATION précédente pour obtenir le produit attendu.
PREP:aR.ATION 2.10
Acide l -(tert-butoxycarbonyiméthyl)-4-trifluorométhvlindole-2-carboxylique.
Ce composé est préparé à partir de la 3-trifluorométhvfaniline en utilisant le
mode
opératoire âécrit à la PREP ARATION précédente.
PREP A.RATION 2.11
Acide 5-méthvl-l-(éthoxycarbonvipropyl)indole-2-carboxylique.
A) Ester éthylique de l'acide 5-méthylindole-2-carboxylique.
A 23,5 î g de p-toluidine dans 50 ml d'HCI et 100 ml d'eau, on ajoute à 0 C,
15,4 g
de NaNO-> dans 4 ml d'eau ; après 20 minutes sous agitation, on additionne
18,2 g
d'acétate de sodium. Par ailleurs, on prépare à 0 C un mélange de 28,8 g
d'ester
éthvlique d'acide 2-méthyl-3-oxo butvrique dans 100 mI d'éthanol que l'on
traite par
11.22 g de potasse dans 20 ml d'eau et 200 g de ¾lace pilée. On ajoute la
solution du
sel de diaaonium préparée ci-dessus et on laisse 3 heures sous agitation à 0
C. Après
une nuit au réfrigérateur, on verse sur une solution saturée de NaC1 puis on
extrait par
AcOEt et sèche sur MgSO4 et concentre. Le résidu est repris dans du toluène,
on
ajoute 16 g d'acide para-toluènesulfonique et on chauffe à reflux pendant une
nuit en
éliminant l'eau à l'aide d'un appareil de Dean Stark. On chromatographie le
nûlieu
réactionnel sur silice en éluant par du toluène pour obtenir 12 g du produit
attendu, F
133 C.
B). . Acide 5-méthylindole-2-carboxylique.
12 g de l'ester obtenu à l'étape précédente sont placés dans 50 ml d'éthanol
et on
ajoute une solution de 3 g de soude dans 30 ml d'eau. Après 30 niinutes sous
agitation,
on évapore le solvant, reprend par de l'eau, lave par AcOEt puis acidifie les
phases
aqueuses à pH = 2 par addition d'HCl concentré, on extrait par AcOEt, sèche
sur
MgSO4 et concentre pour obtenir 8,83 g du composé attendu, F = 218 C.
C) Ester benzylique de l'acide 5-méthylindole-2-carboxylique.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/25525 PCTIFR98/02007
53
Cet ester est préparé par action du bromure de benzyle en présence de DBU.
selon
les méthodes habituelles, F= 141 C.
D) Ester benzylique de l'acide 5-méthvl-l-(éthoxrycarbonvlpropyl)indole-2-
carboxylique.
On place 0,6 g d'hydrure de sodium à 60 io dans l'huile dans 5 mi de DN sous
azote. on ajoute 3 g du composé de l'étape précédente et on laisse ' heures
sous
agitation. On ajoute au milieu réactionnel 3,8 g d'iodobutyrate d'éthyle à 0 C
dans 10
ml de DMF Après 30 minutes d'asitation, on évapore le solvant puis on reprend
le
résidu par AcOEt. On lave par une solution de Na2CO;, puis on sèche sur MgSO4
et
concentre pour obtenir 2.75 g du composé attendu sous forme d'huile.
E) Acide 5-méthyl-1-(éthoxycarbonvlpropyl)indole-2-carboxylique.
La totalité du composé obtenu à l'étape précédente est hydrogéné pendant 2
heures à température et pression ambiantes en présence de 1 g de Pd/C à 10 %
dans 80
ml de MeOH et 20 ml de DMF. On filtre le catalyseur sur Célite. Après
évaporation
des solvants, on triture le produit obtenu dans de l'heptane et obtient 1,54 g
du
composé attendu, F = 142 C.
PREPARATION 2.12
Acide I -(éthoxycarbonylpentyl)indole-2-carboxvlique.
A) Ester benzylique de l'acide 1-(éthoxycarbonylpentyl)indole-2-carboxylique.
On laisse sous agitation sous atmosphère d'azote une heure un mélange
contenant
3¾ d'ester benzylique d'acide indole-2-carboxylique dans 30 ml de DNNiF
anhydre et
500 mg d'hydrure de sodium à 60 % dans l'huile. A 0 C, on ajoute 3 g de 6-
bromohexanoate d'éthyle dans 10 mI de DMF et on laisse sous agitation une nuit
à TA.
On évapore les solvants, reprend par AcOEt, lave à l'eau, sèche sur MgSO4 et
concentre. Le résidu est chromatographié sur colonne de silice H en éluant par
un
mélange heptane/toluène (50/50 ; v/v), on obtient 4,17 g du composé attendu.
B) Acide 1-(éthoxycarbonylpentyl)indole-2-carboxylique.
La totalité du composé de l'étape précédente est hydrogéné pendant 2 heures à
température et pression ambiantes en présence de 1 g de Pd/C à 5%. On filtre
le
catalyseur sur Célite puis on chromatographie sur silice H en éluant par le
mélange
DCM/'vieOH (100/3 ; v/v). On obtient 2,14 g du composé attendu, F = 62 C.
PREPARATION 2.13
Acide 5. 7-diméthyl-l-(tert-butoxycarbonylméthyl)indole-2-carboxylique.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
54
A) Ester éthylique de l'acide 5.7-diméthylindole-2-carboxylique.
Cet ester peut être préparé par 3 voies différentes.
Voie 1
a) Ester éthylique de l'acide 2-(2,4-diméthylphényl)hydrazonojpropionique.
On dissout 17,11 g de 2,4-diméthyianiline dans 36 ml d'HCI concentré dilué
avec
280 ml d'eau. On additionne à 0 C une solution de 10,13 g de nitrite de sodium
dans 30
ml d'eau. On agite 15 minutes à 0 C puis on verse à 0 C la solution obtenue
sur une
solution de 20,5 g d'ester éthylique d'acide 2-méthyl-3-oxobutyrique dans 150
ml
d'éthanol. On additionne en même temps 31,7 g de potasse en solution dans 32
ml
d'eau puis on agite 15 minutes à 0 C. On neutralise le milieu avec 70,6 ml
d'HCl 2N.
On filtre le précipité formé, le lave à l'eau puis on dissout le précipité
dans AcOEt. On
sèche sur Na2SO4 et concentre. Le résidu cristallisé est repris avec de
l'éther
isopropylique puis on filtre pour obtenir 25,49 g du composé attendu, F = 146
C.
b) Ester éthylique de l'acide 5,7-diméthylindole-2-carboxylique
On chauffe à 75 C pendant 3 heures 19 g du produit de l'étape précédente dans
190 ml d'acide formique. On verse le milieu réactionnel dans 2,5 litres d'eau
froide, on
filtre le précipité formé et le lave à l'eau. On dissout le précipité dans
AcOEt, sèche sur
NaiSO4 et concentre. On lave le résidu cristallisé à l'heptane puis on
recristallise le
produit obtenu de l'éther isopropylique pour obtenir 8,9 g du composé attendu,
F
141-143 C.
Voie 2
a) Ester éthylique de l'acide 3-(3,5-diméthylphényi)-2-azido-prop-2-énoique.
On additionne à-10 C sous azote sec un mélange de 5 g de 3,5-
diméthylbenzaldehyde et de 19,3 g d'azidoacétate d'éthyle à un mélange de 25
m1
d'éthanol et de 50 nil d'une solution à 21 % d'éthylate de sodium dans
l'éthanol. On
laisse sous agitation I heure à-10 C et 14 heures et demie à+5 C. On verse sur
100
ml d'eau, filtre le précipité formé et le lave à l'eau. On dissout le
précipité dans l'éther,
sèche sur MgSO4 puis évapore pour utiliser le produit tel quel à l'étape
ultérieure.
b) Ester éthylique de l'acide 5,7-diméthylindole-2-carboxylique
Dans 100 ml de xylène chauffés à reflux, on additionne goutte à goutte une
solution du produit de l'étape précédente dans 100 ml de xylène. Après deux
heures, on
évapore le milieu réactionnel et lave le résidu cristatlisé au pentane pour
obtenir 4,2 g
du composé attendu, F = 146 C.
Voie 3
a) N-(Boc)-2,4,6-triméthyianiline.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
On chauffe à reflux une solution de 36 g de Boc2O dans 60 ml d'heptane. (Dn
additionne goutte à goutte 20,28 g de 2,4,6-triméthylaniline et chauffe 3
heures à
reflux. On refroidit et filtre sur silice en éluant au DCM. On évapore pour
obtenir 33,5
g du composé attendu sous forme d'un produit blanc cristallisé, F = 73-7;,5 C.
5 b) Ester éthylique de l'acide 5, 7-diméthylindole-2-carboxylique.
On refroidit à-40 C sous azote sec une solution de 4,7 g du produit de l'étape
précédente dans 70 ml de THF anhydre. On additionne goutte à uoutte 34 mi
d'une
solution 1,3M de sec-BuLi dans le cyclohexane. On laisse revenir à-20 C en 30
minutes. On refroidit à-40 C et ajoute rapidement cette solution jaune à une
solution
10 de 5,9 g d'oxalate d'éthyle dans 70 ml de THF anhydre puis laisse revenir à
T?. sous
azote. Deux heures après. on refroidit à-~-4 C et additionne lentement 200 ml
de
tampon pH = 2. On extrait deux fois à l'éther, sèche sur MgSO4 et évapore. On
reprend le résidu huileux dans 100 rnl de THF et 160 nù d'HC1 6N On chauffe à
60 C
pendant 1 heure et demie puis on re&oidit. On extrait à l'éther, sèche sur
MgS04 et
15 évapore. On filtre le produit sur silice en éluant par du toluène pour
obtenir 1,6 g du
composé attendu. F = 140-141 C.
B) Acide 5,7-diméthylindole-2-carboxylique.
On agite 8.7 g du produit de l'étape précédente dans 100 ml d'éthanol absolu
avec
100 ml de soude 2N pendant 6 jours, puis on chauffe à reflux pendant 1 heure.
On
20 refroidit à TA et on additionne 20 ml d'HCl concentré. On filtre le
précipité formé, le
lave à l'eau. On dissout le précipité dans AcOEt, sèche sur Na-)S04 et
concentre pour
obtenir 7,15 g du composé attendu, F = 254-256 C.
C) Ester benzylique de l'acide 5,7-diméthylindo le-2 -carboxylique.
Cet ester peut être préparé par deux voies différentes.
25 . Voie 1
On dissout 8,3 g du produit de l'étape précédente dans 60 ml de DMF. On
additionne 6,68 g du DBU et agite 15 minutes à TA puis on additionne 8,25 g de
bromure de benzyle et agite 48 heures à TA. On concentre sous vide puis
reprend le
résidu par 500 nil d'eau. On filtre le précipité formé, dissout le précipité
dans l'AcOEt
30 puis on lave la solution organique avec de l'eau saturée de Na2C03, du
tampon sulfate,
de l'eau saturée de NaCI. On sèche sur Na2SO4, concentre puis lave le résidu
qui
cristallise à l'heptane. On obtient 11,15 g du composé attendu, F = 130-131 C.
Voie 2
On refroidit à-40 C sous azote sec une solution de 4,7 g de N-Boc-2,4,6-
35 triméthylaniline obtenu à l'étape a) de la Voie 3 ci-dessus dans 70 ml de
THF. On
additionne ¾outte à goutte 34 ml d'une solution 1,3 M de sec-BuLi dans le
cyclohexane
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
56
et laisse revenir â-20 C en 30 minutes. On refroidit à-40 C et on ajoute
rapidement
cette solution jaune à une solution de 9,53 g d'oxalate de benzyle dans 70 mi
de TI-iF
anhydre. On laisse revenir à TA sous azote. Deux heures après, on refroidit à-
4 C et
additionne 200 ml de tampon pH = 2. On extrait 2 fois à l'éther, sèche sur
MgSO4 et
évapore. On refroidit le résidu à+4 C et ajoute un mélange de 5 ml d'anisole,
20 m1 de
DCM et 20 ml de TFA. On laisse revenir à TA. Après 3 heures, on évapore et
reprend
le résidu â l'eau. On extrait à l'AcOEt, décante et lave la phase oraanique
par une
solution de Na-)CO3 à 5 %. On sèche sur MeSO4, évapore puis filtre sur silice
en
éluant au toluène. On obtient 1,24 g du composé attendu, F = 132,5-133,5 C.
D) Ester benzylique de l'acide 5,7-diméthyl-l-(tert-
butoxycarbonylméthyl)indole-2-
.arboxylique
Sous azote, on place I67 mg de NaH à 60 % dans l'huile dans 10 ml de DMF et on
ajoute par portions 1 a du composé de l'étape précédente. Après 3 heures sous
a¾itation à TA, on ajoute 0,7 mi de bromoacétate de tert-butyle en solution
dans 1 m!
de DMF et laisse sous agitation pendant 12 heures. On hydrolyse l'hydrure de
sodium
en excès puis on concentre le milieu réactionnel, reprend par AcOEt, lave à
l'eau puis
par une solution de NaiCO3. On évapore puis sèche sur Na2SO4 et on
chromatographie le résidu sur silice en éluant par pentane/DCM (60/40 ; viv)
On
obtient 940 mg du composé attendu, F = 115 C.
E) Acide 5, 7-diméthyl-l-(tert-butoxycarbonyiméthyl)indole-2-carboxylique.
La totalité du composé de l'étape précédente est hydrogéné à température et
pression ambiantes en présence de 100 mg de Pd/C à 5 %, dans 5 ml d'éthanol et
20 ml
d'AcOEt. On filtre le catalyseur sur Célite puis on évapore pour obtenir 596
mg du
composé attendu, F = 210 C.
PREPARATION 2.13 bis
Acide 5,7-diméthyl-l-(méthoxycarbonylméthyi)indole-2-carboxylique.
A) Ester benzylique de l'acide 5,7-diméthyl-l-(méthoxycarbonylméthyl)indole-2-
carboxylique.
On dissout 11,03 g du produit de l'étape C de la PREPARATION 2.13 dans 50 ml
de CH3CN. On additionne 1,35 g de chlorure de benzyltriéthylammonium, 12,39 g
de
carbonate de potassium et 7,55 g de bromoacétate de méthyle. On chauffe 3
heures à
reflux puis on rajoute 1,64 g de carbonate de potassium et 1,81 g de
bromoacétate de
3 5 méthyle. On chauffe à nouveau 3 heures à reflux puis on filtre les
minéraux. On
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
57
concentre le filtrat puis on chromatographie le résidu sur silice H en éluant
par du
toluène. On obtient 9.7 g du composé attendu, F= 91-93 C.
B) Acide 5.7-diméthvl-l-(méthonrcarbonylméthvl)indole-3-carboxvlique.
On dissout 9,6 g du produit de l'étape précédente dans 100 mi de DNiF et 100
mi
d'éthanol absolu. On additionne 900 m¾ de Pd/C à 10 % et hydrogene à
température
ambiante et à pression atmosphérique. On filtre sur hyflo, concentre sous vide
puis on
reprend le résidu par 300 ml d'eau. On filtre le précipité puis on dissout le
précipité
dans AcOEt. On sèche sur Na2SO4, concentre puis lave le résidu qui cristallise
avec
l'éther isopropylique. On obtient 6.11 g du composé attendu. F = 221-223 C.
PREP.-J,,F~TION 2.14
Acide 5,6-diméthvl-l-(terr-butoxycarbonvlméthvi)indole-?-carboxvlique.
A) 2,4.5-trirnéthylaniline.
On dissout 19,70 g de 2,4,5-triméthylnitrobenaène dans 500 ml d'éthanol puis
on
hvdrogène à température et pression ambiantes en présence de 1 g de Pd/C à 5
%. On
filtre le catalyseur sur Célite puis on évapore le milieu pour obtenir 15,67
g du
composé attendu.
B) (,v'-Boc)-2,4,5-triméthylaniline.
On porte à reflux 41 g de (Boc)2O en solution dans 60 ml d'heptane puis on
ajoute
goutte à eoutte 15,67 g du composé obtenu à l'étape précédente dans 20 ml
d'AcOEt et
on maintient le reflux pendant 3 heures. Après refroidissement le produit
cristallise, on
filtre les cristaux formés pour obtenir 13,68 g du composé attendu. On évapore
le
filtrat, reprend dans l'heptane et agite ; on filtre à nouveau 8,35 g de
cristaux du produit
attendu. On a ainsi obtenu 22,03 g, F = 109-110 C.
C) Ester éthylique de l'acide 5,6-diméthylindole-2-carboxylique.
On refroidit à-40 C sous azote 4,70 g du composé de l'étape précédente en
solution dans 70 ml de THF et on ajoute goutte à goutte 34 ml de sec-
butyllithium
1,3M dans le cyclohexane puis on laisse sous agitation 30 minutes à-40 C. On
verse le
milieu réactionnel dans une solution agitée à-40 C de 5,9 g d'oxalate d'éthyle
dans 70
ml de THF et on laisse revenir à TA. On refroidit à 0 C puis on ajoute 100 ml
d'eau.
On extrait par Et20 (3 fois), sèche sur Na2SO4 et évapore puis on
chromatographie
sur silice en éluant au DCM. Le solide obtenu est repris par un mélange de 60
ml d'eau,
3 5 60 ml d'HCl 12N et 60 ml de THF puis on chauffe 3 heures à 60 C. Après
refroidissement, on extrait par EtiO (3 fois), sèche sur Na2SO4 et évapore
puis on
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
58
chromatographie le résidu sur silice H en éluant par du toluène. On obtient
1,37 g du
composé attendu, F = 163,5-164,5 C.
D) Acide 5,6-diméthylindole-2-carboxvlique.
L'ester obtenu à l'étape précédente est hydrolysé par action de la soude dans
le
méthanol puis acidification par HCI concentré, F= 266-266,5 C.
E) Ester benzylique de l'acide 5,6-diméthylindole-2-carboxylique.
Cet ester est préparé par action du bromure de benzyle en présence de DBU
selon
les méthodes habituelles, F = 172,5-173,5 C.
F) Ester benzylique de l'acide 5,6-diméthvl-l-(tert-
butoxycarbonvlméthvl)indole-2-
carboxvlique.
1,67 g du composé de l'étape précédente sont refroidis à-4 C sous azote et on
ajoute par portions 150 mg de NaH à 60 % dans l'huile. Après 30 minutes sous
agitation à-4 C, on ajoute goutte à goutte 0,7 g de bromoacétate de tert-
butyle en
solution dans 5 ml de DMF On laisse revenir à TA, et, après une nuit, on
évapore le
DMF, reprend par de l'eau, filtre le solide, lave à l'eau, puis reprend par
AcOEt. On
lave la phase organique par H-)O (2 fois), sèche sur Na2SO4 et évapore puis on
triture
dans 70 ml d'heptane/éther (50/20 ; viv), filtre et sèche pour obtenir 2 g du
composé
attendu sous forme d'un solide blanc, F = 133-134 C.
G) Acide 5,6-diméthvl-l-(tert-butoxycarbonviméthyl)indole-2-carboxylique.
Le produit attendu est obtenu par hvdrouénation catalvtique en présence de
Pd/C à
5 %. F = 240-241 C.
PREPARATION 2.15
Acide 4, 5-diméthoxy-1-(terr-butoxycarbonylméthyl)indole-2-carboxylique.
A) Ester éthylique de l'acide 2-azido-3-(2,3-diméthoxyphényl)-acryiique.
On refroidit à-30 C, sous azote, une solution d'éthylate de sodium préparée à
partir de 80 ml d'éthanol absolu et 2,76 g de sodium. On ajoute 4,99 g de 2,3-
diméthoxybenzaldehyde et 15,5 g d'azidoacétate d'éthyle puis on laisse sous
agitation
entre -20 C et -10 C pendant 2 heures. On verse le miiieu réactionnel dans 250
ml
d'eau contenant 25 ml d'HCI concentré. On filtre le précipité formé, on le
lave à l'eau
puis on dissout ce précipité dans l'éther. On sèche sur Na2SO4 et concentre
pour
obtenir 5,86 g du composé attendu, F < 50 C.
B) Ester éthylique de l'acide 4,5-diméthoxyindole-2-carboxylique.
On dissout 5,85 g du composé obtenu à l'étape précédente dans 200 ml de
toluène
et on chauffe à reflux pendant 7 heures. On abandonne 2 jours à TA puis on
concentre
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
59
sous vide. Le résidu est chromatoeraphié sur silice H en éluant par '" -
1.L1,te0H
(100/0,6 . v;'v) Après cristallisation dans le pentane. on obtient 2,32 g au
composé
attendu. F = 129-131 C
On procede ensuite selon les étapes habituelles pour préparer les cornposés
~ suivants
C) Acide 4. 5 -diméthoxvindole-2 -carboxylique, F = 258-260 C
D) Ester benzylique de l'acide 4,5-diméthoxvindole-2-carboxvlique, F = 109-111
C
E) Ester benzylique de l'acide 4, 5-diméthoxv- I-(rert-butoxycarbonvlméthvI
)indole-2-
carboxylique, F = 70-72 C
F) Acide 4, 5-diméthoxy- I-(tert-butoxycarbonylméthyl)indole-2-carboxylique,
F = 206-208 C
PREP:UR.-~TION 2.16
Acide 4. S-dichloro-l-(éthoxycarbonylméthyl)indole-2-acétique.
Ce composé est préparé à partir du 2,3-dichlorobenzaldehvde en procédant selon
la Préparation décrite ci-dessus, F = 205-207 C.
PREP ARATION 2.17
Acide 3.5-diméthvl-l-(méthoxycarbonyléthyl)indole-2-carboxylique.
A) Ester éthylique de l'acide 3.5-diméthylindole-2-carboxyiique.
Dans un mélange de 120 tnl d'eau et 50 ml d'HCI concentré, on place 23. 57 g
de p-
toluidine puis on ajoute goutte à goutte à 0 C 15,4 g de NaNO2 dans 40 ml
d'eau et on
laisse sous agitation 20 minutes à 0 C. A la solution de chlorure de p-
toluènediazonium
ainsi formée, on ajoute à-10 C une solution de 32 g d'ester éthylique de
l'acide 2-éthyl-
3-oxobutyrique dans 150 ml d'EtOH et 150 ml de solution de NaOH à 20 %. Après
30
minutes sous agitation -5 C, on acidifie à pH = 4 par addition d'HC1 dilué et
d'un litre
d'eau. Par trituration, il se forme un solide rouge que l'on filtre puis sèche
à l'étuve à
40 C. Ce solide est repris dans 200 ml d'EtOH absolu et 20 m1 d'H2SO4
concentré puis
on chauffe à reflux pendant 45 minutes. On verse le milieu réactionnel sur un
mélange
eau-glace, filtre puis reprend le précipité par AcOEt, lave à l'eau et sèche
sur MgSO4.
Le résidu est chromatographié sur silice en éluant par un mélange DC1vheptane,
F
118 C.
"5 B) Acide 3,5-diméthylindole-2-carboxylique.
Ce composé est obtenu par hydrolyse de l'ester précédent, F = 177 C.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
C) Ester benzylique de l'acide 3,5-diméthylindole-2-carboxyiique.
Ce composé est obtenu à partir de l'acide précédent par action du bromure de
benzyle en présence de DBtJ, F = 91 C.
D) Ester benzylique de l'acide 3,5-diméthyl-1-(2-cyanoéthyl)indole-2-
carboxylique.
5 La réaction est effectuée selon un mode opératoire analo¾ue à celui décrit
dans J.
Chem. Soc. (C), 1967, 2599-2601 pour la N-cyanoéthylation d'indoles.
Dans 20 ml de dioxane, on place 0,5 ml de triton B en solution aqueuse à 40 %
et
2,2 ml d'acrvlonitrile puis on ajoute à la spatule 3 g du composé de l'étape
précédente
et. apres solubilisation totale, on chauffe à 80 C pendant 24 heures. On
évapore le
10 milieu réactionnel. reprend par AcOEt puis lave par une solution de
tia')CO3 et sèche
sur MgSO4. Le résidu est chromatographié sur silice en éluant par
heptaneitoiuéne
(50/50 ,%=rv) On obtient 3.2 g du composé attendu, F = 71 C.
E) Ester benzylique de l'acide 3,5-diméthyl-l-(méthoxycarbonvléthyl)indole-2-
carboxvlïque.
15 On place 3,2 ~ du composé de l'étape précédente dans 30 ml de DCM et 3,8 ml
de
MeOH et l'on ajoute 45 ml d'éther chlorhydrique. Après 2 jours à-4 C, on
filtre le
solide blanc formé, le lave par un mélange EtiO/heptane (50/50 ; v/v) puis
reprend par
15 ml d'eau et 15 ml d'acide acétique et chauffe à 100 C pendant 30 minutes.
On ajoute
50 ml d'eau, extrait au DCM puis sèche sur MgSO4 pour obtenir 1,72 g du
composé
20 attendu sous forme d'huile.
F) Acide 3, 5-diméthvl-l-(méthoxycarbonvléthvi)indole-2-carboxylique.
La totalité du composé obtenu à l'étape précédente est hydrogéné à température
ambiante et à pression atmosphérique dans 200 rni d'EtOH à 90 % en présence de
300
mg de Pd/C à 5 %. On filtre le catalyseur sur CéliteS puis on triture le
filtrat avec de
25 l'heptane contenant un peu d'Et20. On obtient 0,8 g du composé attendu, F =
169 C.
PREPARATION 2.18
Acide 5-(N-tert-butoxycarbonylamino)-1-(tert-butoxycarbonylméthyl)indole-2-
carboxylique.
A) Acide 5-nitroindole-2-carboxylique.
On place 13 g d'ester éthylique d'acide 5-nitroindoie-2-carboxylique dans 200
ml
d'EtOH et on traite pendant 12 heures par 15 g d'une solution de NaOH à 30 %.
Après
évaporation du solvant, on acidifie par HCI concentré puis on filtre pour
obtenir 10,8 g
3 5 du composé attendu.
B) Ester benzylique de l'acide 5-nitroindole-2-carboxylique.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
61
Ce composé est préparé par action du bromure de benzvle en présence de DBU,
F = 192 C
C) Ester benzylique de l'acide 5 -nitro- t-(terr-butoxycarbonylméthvl)indole-,-
carbox-viique.
Ce composé est obtenu par action de \'aH puis du brornoacétate de tert-butrie,
F = 1 12 C
D) Acide : -arnino-1-(tert-butoxycarbonvlméthvl)indole-2-carboxylique.
On hvdroQene 16 Q du composé obtenu à l'étape précédente da::s 200 rnl de
D.NiF,
à pression et température ambiantes en présence de 200 mg de Pd/C à5 % On
filtre Ie
catalyseur sur CéIite-~'. évapore le solvant puis on triture dans le minimum
de DCM
pour obtenir 10.1 g du composé attendu, F = 128 C.
E) Acide '-~-(N-tert-butoxycarbonvlamino)-1-(tert-butoxycarbonvlméthvl)indole-
_-
carboxyiioue
On place 2 Q du composé obtenu a l'étape précédente dans une solution
contenant
30 ml de dioxane. 30 ml d'eau et 1 ml de NEt; et on ajoute goutte à goutte a
SO C, _ g
de BociO dans 10 rnl de dioxane. Après la fin du dégagement de gaz carbonique.
on
évapore le solvant puis on reprend par AcOEt. On lave par une solution tampon
à pH 2
puis on sèche sur vIsSO4 pour obtenir 2,44 g du composé attendu F> 300 C
En procédant selon les modes opératoires décrits ci-dessus, on prépare les
dérivés
d'acide indole-2-carboxylique décrits dans le tableau ci-dessous.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
62
TABLEAU 2
Ria
R~i P-9
R 12 N COOH
R13
R's
PREP.a. R1p R1.1 R12 R13 R9 R'8 F C
RaTiO\ S
2.19 H H -OMe H H -CH2COOtBu 203
2.20
H H H H H -CH`-
172
tBuOCO
2.21 H H H H H
-(CH2)3COOEt 152
/ \
2.22 H H H H H 162
~
OCOMe
2.23 H H H H H 206
Q
EtOCO
Q
2.24 H Cl H H H -CHI 199-200
COZEt
2.25 / \
H Me H H H -C~ 203-204
COZtBu
-2.26 -OMe H -OMe H H -CH CO tBu 210
2.27 Me H H H H -(CH2)4CO2Et 108
2.28 Me H H H H -CH2C02tBu 178-180
2.29 H OMe OMe H H -CH2CO2tBu 209-211
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
63
2.30 H E H H H H -(CH2)4C02Et i 79
2.31 Me H H H H -(CH2)SCO
iEt 85
2.32 Me Me H ~ H ~ H -CH,CO-)tBu 198
?.33 H CI H H H -(CHi)-)CO=,Me 1?1
? 34 H Ci H H H -(CHi);CO-iEt 152
135 C1 H H H-(CH- :1COiEt 99
2.36 H Me H H H~-(CHi)iCO-iMe [66
2.37 ' OMe Me OMe H H-CHiCOitBu 228
_ 38 H OMe H H H -CH-)COitBu 170
? 39 H OMe H H~ H-(CHi),)CO-)-"vie 157
=4 0 Me H i H H H ~-(CH- iCO,l~Ie 131
?.41 Me H H H H -(CHi);CO-)Et 132
:.42 H Me H H H -(CH2)4COiEt 96
~0 ?.43 ~ Me H Me H H -CHiCOitBu 189
3.44 H Br H H H -CH-)CO-iEt 190
?.4 5 H OMe OMe Oy1 H -CHiCOitBu I 170
e
2.46 Me H H Me H -CH2CO2tBu 191 2.47 Cl H H H H -CH2COitBu 165
2.48 H Me H H H -(CH2)5CO2Et 88
2.49 OMe H H H H (CH2)2CO2Me 172
2.50 H F H Me H -CH?C02tBu 251
2.51 H H H F H -CH2CO2tBu 186
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
64
2.52 H C1 Me H -CH2C0-+Et 215
2.53 H Me H CI H -CH2C0Et } 191
2.54 H OMe H Me H -CH2CO,)tBu 192 2.55 OMe H H JOM H -CH-)CO-itBu f 207
+ e 2.56 H H H Me H-CH2COI_tBu ! 176
I ( ! (
2.57 F H H H H -CH2C0_tBu I 1 î2
~ 158 H Me H H Me -CH2CO-)tBu 190
i 2.59 H Me H H Me (CHZ)3C02Et 159 2.60 H H -SMe H H ~-CH-YCO-)Et somme
2.61 H Cl H CI H -CH2COiEt 181
2.62 ~ H Cl H H Me -CHZCO2Vle 216
, I
------------
2.63 Me H Me H H i-(CHi COiEt Qotnme
2.64 H H H OM H -(CH2)3C02Et 115
e
2.65 H H H OM H -CH2COI-tBu 192
e
2.66 H H H H Me -CH2CO,)tBu 175
2.67 H F H H H -CHZCOZtBu 173
2.68 H Me H H H -CH2CO2Et 197
2.69 H OCOMe H H H -CH2COZtBu 185
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
2 70 Me Cl H H H -CHiCOiEt 174
2.71 Me H H Cl H -CH2CO2Et 150
------------
D 2.72 H Ci H F H -CH,)CO2Et 167
2.73 MeO H H Me H -CH,)CO2Et 220
2.74 H Me H F H -CHiCOiMe 187
2.75 H CI H CF3 H -CH2CO,-Et 165
2.76 OCOMe H H H H -CH2CO2tBu 179
C PREPARATION DES DERWES D'ACIDE PYRROLO-PYRIDINES
CARBOXYLIQUE DE FOR.~VIULE R'3COOH:
X
/ X2
ii2 cIII)
HOOC i X4
a
R'8
dans laquelle R'g est le précurseur de R8 et les groupes XI,Xi, X3, X4 sont
tels que
définis ci-dessus pour (I).
PREPARATION 3.1
Acide 1-tert-butoxycarbonylméthyl-1H-pyrrolo[3,2-c]pyridine-2-carboxylique.
A). _Ester benzylique de l'acide 1H-pyrroio[3,2-c]pyridine-2-carboxylique.
A 5 g de 4-(N-Boc-amino)-3-méthylpyridine, on ajoute à-40 C, sous azote, 40
tnl
de tert-butyllithium 1, 7M dans le pentane. Après une heure sous agitation à-
40 C, on
ajoute le dérivé lithié ainsi formé à 12,9 g d'ester benzylique d'acide
oxalique dans 100
ml de THF à-40 C. Laissant la température revenir à 0 C, on laisse sous
agitation
pendant 2 heures puis on ajoute 25 ml d'HC16N et on chauffe 1 heure et demie à
50 C.
On porte à pH = 9 par addition de NaOH iN puis on extrait par AcOEt, sèche et
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
66
évapore. Le résidu est chromatographié sur silice en éluant par DCW:1~feOH
(100/3
v/v) pour donner 2,7 g du composé attendu.
B) Ester benzylique de l'acide 1-tert-butoxycarbonylméthyi-lH-pyrrolo[3,2-c]
pyridine-2 -carboxylique.
Sous azote, on ajoute 0,29 g d'hvdrure de sodium à 60 % dans l'huile dans 20
ml
de DMF puis on ajoute à 10 C 1,7 g du composé obtenu à l'étape précédente.
Après 45
minutes d'agitation, on additionne 1,43 g d'ester rert-butylique d'acide
bromoacétique.
On laisse revenir à TA, agite pendant 5 heures puis on verse le milieu
réactionnel sur de
l'eau, extrait à l'éther, sèche puis évapore. L'huile jaune obtenue est
chromato¾raphiée
l0 sur silice en éluant par DCM/MeOH (100/3 ; viv) puis on réunit les
fractions contenant
le produit et chromatographie à nouveau sur silice en éluant par cvclohexaner
AcOEt
(1/1 , viv). On obtient 1 g de cristaux jaunes. F= 94 C.
C) Acide 1-tert-butoxycarbonylméthyl-1H-pyrrolo[3,2-c]pyridine-2-carboxylique.
On effectue une hydrogénation catalytique en présence de 170 mg de Pd/C à
10 %, à pression et température ambiantes pendant 4 heures, de 1 g du composé
obte- ., à l'étape précédente. Le précipité formé est dissous dans du DMF puis
on filtre
le Pd/C sur Célite(5, on évapore à sec puis lave les cristaux par Et20 pour
obtenir
0,39 g du composé attendu, F = 265 C.
PREPARATION 3.2
Acide 1-tert-butoxycarbonvlméthyl-5-méthoxy-lH-pyrrolo[2,3-c]pyridine-2-
carboxylique.
A) 5-(N-Boc-amino)-2-méthoxy-4-méthylpyridine.
A 5 g de 5-(,\1-Boc-amino)-2-méthoxypyridine on ajoute sous azote, 41,7 ml de
n-
butyllithium 1,6M dans l'hexane et 7,7 g de TMEDA à-60 C. Le milieu se colore
en
jaune. On laisse sous agitation pendant 4 heures, en laissant la température
atteindre -
10 C, il se forme un précipité jaune clair. On refroidit à-40 C puis on ajoute
4,7 g
d'iodure de méthyle. On laisse revenir à TA puis on verse le milieu sur de
l'eau, extrait
par AcOEt, sèche et évapore. Le résidu est chromatographié sur silice en
éluant par
cyclohexane/AcOEt (85/15 ; v/v).
B) Ester benzylique de l'acide 5-méthoxy-lH-pyrrolo[2,3-c]pyridine-2-
carboxylique.
A-60 C, on ajoute sous azote, 13,8 ml de n-butyllithium 1,6M dans l'hexane sur
2,4 g du composé de l'étape précédente. On laisse revenir à-20 C et agite
pendant 30
minutes. On additionne le dérivé lithié ainsi formé sur 5,4 g d'oxalate de
benzyle et on
laisse sous agitation 2 heures à TA. On verse sur de l'eau, extrait par AcOEt,
séche
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
67
puis évapore. On reprend par 100 ml de THF puis on ajoute 30 m1 d'HCI 6N et on
chauffe à 50 C pendant 1 heure et deniie. On porte à pH = 6 par addition de
HCI IN,
extrait au DCM, sèche puis évapore. Le résidu est chromatographié sur silice
en éluant
par DCVLNteOH (100/2,5 ; v/v). On obtient 0,9 g du composé attendu, F = 182 C.
C) Ester benzylique de l'acide 1-tert-butoxycarbonylméthyl-5-méthoxy-lH-
pyrrolo
[2,3-c]pyridine-2-carboxylique
A 0,14 g de NaH à 60 % dans l'huile dans 10 ml de DMF, on ajoute à 5 C 0,9 g
du
composé de l'étape précédente, on laisse 15 minutes sous agitation puis on
ajoute à TA
0,68 g d'ester tert-butylique de l'acide bromoacétique. Après 5 heures sous
agitation à
TA, on verse sur de l'eau, extrait par Et2O, sèche puis évapore. Le résidu est
chromatographié sur silice en éluant par DCivUAcOEt (100/1 ; v/v). On obtient
1,2 g
du composé attendu, F= 110 C.
D) Acide 1-tert-butoxycarbonylméthyl-5-méthoxy-1H-pyrrolo[2, 3-c]pyridine-2-
carboxylique.
On hydrogène pendant 3 heures, à pression et température ambiantes, en
présence
de 120 mg de Pd/C à 10 %, 1,2 g du composé de l'étape précédente, dissout dans
un
mélange EtOH/DMF. On filtre le Pd/C sur Célite , évapore à sec, puis le résidu
est
chromatographié sur silice en éluant par DCM/MeOH (100/3 ; v/v). On obtient
0,41 g
du composé attendu sous forme d'une mousse blanche.
PREPAR.A.TION 3.3
Acide 1-tert-butoxycarbonylméthyi-1H-pyrrolo[2,3-b]pyridine-2-carboxyiique.
A) Ester éthylique de l'acide 1-H-pyrrolo[2,3-b]pyridine-2-carboxylique.
A une température inférieure à 5 C, sous azote, on ajoute 30 mI de n-
butyllithium
à 5 g de 2-(N-Boc)amino-3-méthylpyridine dans 100 ml de THF. Après 1 heure
sous
agitation à 0 C, on ajoute le dérivé lithié ainsi formé à une solution de 7 g
d'oxalate
d'éthyle dans 50 ni] de THF à-3 C. On laisse revenir à TA puis on verse
lentement le
niilieu réactionnel sur 25 ml d'HCI 6N à 0 C, en maintenant la température
inférieure à
10 C. On chauffe 2 heures à 50 C puis on amène à pH = 3 par addition de NaOH
1N.
On extrait par Et20, reprend la phase organique par une solution de K2C03 puis
on
sèche et évapore pour obtenir 1,8 g du composé attendu sous forme de cristaux
blancs,
F = 162 C.
B) Acide IH-pyrrolo[2,3-b]pyridine-2-carboxylique.
On laisse sous agitation pendant 3 heures un mélange contenant 2,4 g du
composé
obtenu à l'étape précédente et 2,5 g de soude dans un mélange éthanol-eau
(20/20
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
68
v/v). Le précipité formé est filtré puis dissous dans l'eau. En acidifiant à
pH = 4 par
AcOH, il se forme un précipité blanc qui est lavé à l'eau puis séché pour
obtenir 1,3 g
du composé attendu, F > 2600C.
C) Ester benzylique de l'acide 1H-pyrrolo[2,3-b]pyridine-2-carboxvlique.
On laisse sous agitation à TA pendant 2 heures un mélange contenant 1,3 g du
composé obtenu à l'étape précédente, 1,22 g de DBU et 1,37 g de bromure de
benzyle
dans 30 ml de D1VIF. Après évaporation du solvant, on reprend par DCM et de
l'eau
puis on extrait par une solution tampon à pH = 2. On sèche puis évapore, les
cristaux
formés sont lavés à l'heptane pour donner 1,5 g du composé attendu. F = 176 C
D) Ester benzylique de l'acide 1-tert-butoxvcarbonvlméthvl-lH-pyrrolo[2,3-b]
pyridine-2-carboxyiique.
Ce composé est obtenu en procédant comme à l'étape C de la Préparation
précédente.
E) Acide l-tert-butoxycarbonylméthyl-lH-pyrrolo[2,3-b]pyridine-2-carboxylique.
Ce composé est obtenu par hydrogénation en présence de Pd/C, F = 104 C.
EXEWLE 1
Acide 2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-méthylphényl)thiazol-2-
ylcarbamoyl)-5-méthylindole-l-acétique, acide trifluoroacétique.
Me Me
I, CF3COOH : R1 R, = -(CH,), R3 =-~N
MeO
Me CH2COOH
A) Ester tert-butylique de l'acide 2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-
méthyl
phényl)thiazol-2-ylcarbamoyl)-5-méthylindole- 1 -acétique.
Dans 2 ml de DMF, on mélange 0,505 g du composé de la PREPARATION 1.1
0,45 g du composé de la PREPARATION 2.3, 0,75 g de BOP et 0,17 g de
triéthylamine. Après 11 jours sous agitation à TA, on verse sur 150 ml de
tampon
sulfate.Le précipité formé est filtré puis lavé à l'eau, puis on le dissout
dans DCM,
sèche sur Na2SO4 et concentre. Le résidu est chromatographié sur silice H en
éluant
par un mélange DCM/AcOEt (100/1 ; v/v) pour donner 0,41 g du composé attendu.
B) Acide 2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-méthyiphényl)thiazol-2-
ylcarbamoyl)-5-méthylindole-l-acétique, acide trifluoroacétique.
On dissout 0,41 g du composé de l'étape précédente dans 15 ml de TFA. Après 4
heures sous agitation à 10 C, on concentre sous vide. Le résidu est repris par
250 ml
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
69
d'eau, puis on laisse sous auitation 1 heure à TA. Le précipité blanc tormé
est filtré puis
séché pour donner 0,37 s du produit attendu, F = 140 C.
E~."vIPLE 1 bis
Sel de sodium de l'acide 2-(5-cyclohexyiéthyl-4-(2,5-diméthoxy-4-méthyl
phénvl)thiazol-2-ylcarbamoyl)-5-méthylindole-1-acétique, trifluoroacétate de
sodium.
On chauffe à reflux une suspension de 0,47 g du composé obtenu a l'EXEMPLE 1
dans 200 ml d'EtOH absolu, ajoute 0,68 ml d'une solution de NaOH 2N et laisse
10
minutes sous agitation à reflux. On concentre sous vide, reprend le résidu à
l'éther,
essore le produit cristallisé formé et le lave à l'éther. On obtient 0.1336 g
du produit
attendu. F = 170 C.
E.XEMPLE 2
Acide 2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-méthylphénvl)thiazol-2-
~-lcarbarnovl)-4-méthoxvindole-1-acétique, acide chlorhydrique.
OMe
Me
~ I I
L CF3COOH . Ri Rr = -(CH2)2 R3
N
Me0
Me CH,COOH
A) Ester rert-butyiique de l'acide 2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-
méthylphényl)thiazol-2-ylcarbamoyl)-4-méthoxyindole-1-acétique.
Dans 2 ml de DMF on mélan¾e 0.505 u du composé de la PREPA.~TION 1.1,
0.47 g du composé de la PREPARATION 2.4, 0,75 g de BOP et 0,17 g de
triéthylamine. Après 5 jours sous aQitation à TA, on ajoute 50 ml de tampon
sulfate. Le
précipité formé est dissout dans DCM puis on sèche sur Na2SO4 et concentre. Le
résidu est chromatographié sur silice en éluant par DCM/AcOEt (100/2 ; vlv),
on
obtient 0,9 g du produit attendu sous forme d'huile.
B) Acide 2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-méthylphényl)thiazol-2-
'0 ylcarbamoyt)-4-méthoxyindole-1-acétique, acide chlorhydrique.
On dissout 0,9 g du composé de l'étape précédente dans 10 ml de DCM puis on
ajoute 10 mi de TFA à 10 C et on laisse 4 heures sous agitation à 10 C. On
concentre
sous vide, reprend le résidu par 100 ml d'éther puis on extrait 2 fois par 25
ml de
NaOH 21v. On acidifie la phase aqueuse par 55 mi de HCI 2N puis on filtre le
précipité
formé. Celui-ci est lavé à l'eau puis séché pour donner 0,68 g du composé
attendu, F
150 C.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WlJ 99/15525 PCT/FR98/02007
EXEMPLE 3
Acide 2-((5-cyclohexyléthyl)-4-(2,5-diméthoxy-4-méthylphényl)thiazol-2-
ylcarbamoyl)indole- l-acétique, sel de sodium.
Me
I : Rt = I ~ -(C~)Z R3
l~ie0 ~
10 Me CHZCOONa
A) Ester methylique de l'acide 2-((5-cyciohexyléthvl)-4-(2,5-diméthoxy-4-
méthyl
phénvl)thiazol-2-ylcarbamovl)indole-1 -acétique.
Dans 30 ml de DCM, on mélange 0,976 g du composé de la PREPARATION 1.
0,7 g d'acide 1-méthoxycarbonylméthylindole-2-carboxylique (PREPA.RATION 2.1),
15 1,44 g de BOP et 0,33 g de triéthylamine. Après 3 jours sous agitation à
TA, on ajoute
30 ml de tampon sulfate, on décante, sèche la phase organique sur Na2SO4 puis
concentre. Le résidu est chromatographié sur silice en éluant par DCWMeOH
(100/0,2 ; viv). On obtient 1,52 g du composé attendu, F = 144-146 C.
B) Acide 2-((5-cyclohexyléthyl)-4-(2,5-diméthoxy-4-méthyiphényl)thiazol-2-
20 vlcarbamovi)indole- l -acétique, sel de sodium.
On dissout 0,5 g du composé de l'étape précédente dans 30 mi de dioxane et on
ajoute 10 ml de propan-2-ol et 0,9 g de soude à 30 %. Après 15 heures sous
agitation à
TA, le solvant est évaporé. On reprend par du iPrOH ; les cristaux formés sont
filtrés ;
lavés par du iPrOH, de l'éther éthylique puis séchés à l'étuve. On obtient
0,46 g du
25 composé attendu. F > 3 50 C. Le sel de sodium cristeise avec une molécule
de NaOH.
EXEWLE 4
Acide 2-((5-cyciohexyléthyl)-4-(2,5-diméthoxy-4-cnéthylphényl)thiazol-2-
ylcarbamoyl)indole- l -acétique.
Me
I : Rt g2 = -(CHz)
z
Me0
Me CH2COOH
Dans 3 ml de DMF, on mélange 0,7 g du composé de la PREPARATION 1.1,
0,53 g d'acide 1-tert-butoxycarbonyiméthylindole-2-carboxylique (PREPARATION
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
71
2.2), 0,85 ? de BOP et 0,25 ml de triéthylamine .aprés une nuit sous agitation
à TA,
on ajoute du tampon sulfate. Les cristaux formés sont filtrés, repris au DCM.
La phase
or¾anique est lavée au tampon sulfate puis par une solution de tialCO; et
séchée sur
lvigSO 4 On chromatographie sur silice en éluant par un mélange DCN1/AcOEt ( I
00/ 1
viv) Le produit pur obtenu est repris dans 10 n-d de TFA et agité pendant 3
heures.
Aprés évaporation, on reprend par de J'eau, une solution de Na,)CO3 puis on
ajoute de
l'acide chlorhydrique concentré jusqu'à pH =5. On extrait au DCM puis sèche
sur
VIgSO4 pour obtenir 0,42 g du composé attendu, F = 198 C.
EXEMPLE 5
Acide 2-(4-(4-chloro-2,5-diméthoxyphényi)-5-(2-cyclohexvléthyl)-thiazol-2-
ylcarbamoyl)-5, 7-diméthylindole-l-acétique, acide trifluoroacétique.
Me Me
1, CF3COOH : Ri RZ =-(CHZ)Z
R3=
Me0 lr
Me
1 CH2COOH
A) Ester tert-butylique de l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvl)-5-
cyclohexvléthvl)thiazol-2-yicarbamoyl)-5,7-diméthylindole-1-acétique.
On mélange 250 mg du composé de la PREPARATION 2.13, 314 mg du composé
de la PREPARATION 1.4, 0,34 mg de triéthylamine et 365 mg de BOP dans 10 rnl
de
DCM et on laisse 3 jours sous aQitation à TA. On extrait à l'éther, lave à
l'eau, par une
solution saturée de KHSO4 puis évapore les solvants et sèche sur NeS04. Le
résidu
est chromatographié sur silice en éluant par DCM/AcOEt (30/20 ; vïv). On
obtient
218 m¾ du composé attendu.
B) Acide 2-(4-(4-chloro-2,5-diméthoxyphény!)-5-cyclohexyléthvlthiazol-2-
ylcarbamoy!)-5, 7-diméthyiindole-1-acétique, acide trifluoroacétique.
On mélange 218 mg du composé de l'étape précédente avec 2,5 ml de TFA dans
6 ml de DCM et on laisse 3 heures sous agitation à TA. On concentre le milieu
'0 réactionnel, reprend à!'éther et filtre le précipité obtenu pour obtenir
160 mg du
composé attendu, F = 173 C.
EXF-MPLE 5 bis
3 5 Sel de potassium de l'acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-
cyclohexyl
éthylthiazol-2-ylcarbamoyl )-5 , 7-diméthylindole-1-acétique, trihydrate.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
72
Me Me
.i ~
1. 3HZ0 R1 = R, _-(CHZ)2
R3_
MeO
Me
1 CH,COOK
A) Ester méthylique de l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvl)-5-
cyclohexyl
éthylthiazol-2-ylcarbamovl)-5, 7-diméthylindole-1-acétique.
On mélange 5,9 g du composé de la PREPARATION 2.13 bis, 7,82 g du composé
de la PREPARATION 1.4, 2,5 g de triéthylamine et 10,9 g de BOP dans 35 ml de
DMF, et on laisse sous agitation 48 heures à TA. On verse sur 2 litres de
tampon
sulfate, nltre le précipité formé, le lave à l'eau. Le précipité est dissout
dans 400 m!
d'AcOEt. lavé successivement 2 fois par 250 ml d'une solution saturée de
NaIC03,
150 ml d'une solution de tampon sulfate et 150 ml d'une solution saturée de
NaCI. La
phase organique est séchée sur Na2SO4 et évaporée. Le résidu est
chromatographié
sur silice en éluant par un mélange chlorure de méthylène, acétate d'éthyle
(98/2 ; v/v).
Les cristaux obtenus sont lavés à l'éther isopropylique. On obtient 11,6 g du
produit
attendu, F = 202 C.
B) Sel de potassium de l'acide 2-(4-(4-chloro-2,5-diméthoxyphényi)-5-
cyclohexyl
éthvlthiazol-2-ylcarbamoyl)-5,7-diméthylindole-l-acétique, trihydrate.
Un mélange de 2 g du produit obtenu à l'étape A, 1,33 g de K,)CO; dans 4,6 ml
d'eau et 8 ml de n-butanoi est chauffé à 90 C pendant 9 heures. Après
refroidissement à
TA, on aioute de l'eau et le précipité formé est filtré, lavé à l'eau (3 X 50
ml) puis à
l'éther éthylique (3 X 200 rnl) et séché sous vide. On obtient 1,2 g du
produit attendu,
F = 250 C.
WEMPLE 5 ter
Acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-cyclohexyiéthylthiazol-2-
yicarbarnoyl)-5, 7-diméthylindole-l-acétique.
Me Me
I : Rt = \ ~ ; R2 _ -(CI'2)2 H ; R~ _ ~ N E i
Me0 Me
1 CH~COOH
Un mélange de 4 g du composé obtenu à l'étape A de l'Exemple 5 bis, 2,65 g de
K2C03 dans 9,2 ml d'eau et 16 ml de n-butanol est chauffé à 90 C pendant 12
heures.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
73
Après refroidissement à TA, on ajoute 19,2 ml d'HCI 2N Le précipité blanc
formé est
lavé par 3 fois 200 ml d'eau puis 3 fois 200 ml d'éther éthvlique On obtient
3,1 g du
produit attendu, F = 241 C.
EXEyfPLE 5 quater
Sei de sodium de l'acide 2-(4-(4-chloro-2,5-diméthoxyphénvl)-5-cyclohexyléthyl
thiazc:-2-ylcarbamoyl)-5,7-diméthylindole-1-acétique, sesquihydrate. F = 200
C.
EXEWLES 6 et 7
Acide 2-(4-(4-chloro-2,5-diméthoxyphényl)-5-cyclohexvléthvlthiazol-2-
vlcarbamoyl)indole-1-acétique, sel de sodium et acide 2-(4-(4-chloro-2,5-
diméthoxy
phénvi)-5-cvclohexviéthvithiazol-2-ylcarbamoyi)indole-1-acétique
Me
I: Ri R, _-(CH,)` R3
Me0
CH2COOH
On procède selon le mode opératoire décrit à l'exemple 3, étape A à partir des
composés des PREPARATIONS 1.4 et 2.1 pour préparer l'ester méthylique de
l'acide 2-(4-(4-chioro-2,5-diméthoxyphény1)-5-(cyclohexy lethvl)thiazol-2-yl
carbamovl)indol-1-ylacétique, F = 145 C (étape A). En procédant comme à
l'étape B,
on prépare le sel de sodium du composé attendu (Exemple 6) qui cristallise
avec une
molécule de NaOH. F= 252 C.
A une suspension de 0, 7 g de l'ester obtenu à l'étape A dans 30 rni de
méthanol, on
ajoute 2 mi de NaOH 2N. La solution formée est laissée au repos pendant 18
heures
puis on évapore le méthanol. Le résidu est repris par de l'eau puis acidifié
par addition
d'HCI concentré jusqu'à pH2. Après 1 ht_re sous agitation, on filtre le
précipité formé,
lave à l'eau et sèche à l'étuve. On obtient 0,63 g de l'acide attendu,
(Exemple 7), F = 213 C.
EXE?ylPLE 8
Acide 2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-chlorophényl)thiazol-2-
ylcarbamoyl)indole-l-hexanoïque.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
74
Me
I- Ri R,
LIe
O
1 I
(CHZ)SCOOH
On place sous agitation pendant une nuit 0,88 g du composé de la
PREPARATION 1.4, 0,7 g du composé de la PREPARATION 2.12, 1,2 g de BOP et
0,32 ml de triéthylamine dans 3 ml de DMF. On ajoute du tampon sulfate ; le
précipité
formé est filtré et repris par AcOEt. On lave au tampon sulfate, par une
solution de
Na2CO3 puis on sèche sur MgSO4. On chromatographie sur silice H en éluant par
un
mélange DCM/AcOEt (100/2 , v/v). Le produit obtenu est saponifié dans 10 rnl
d'éthanol et 2 ml de NaOH 4N. On évapore le solvant, reprend par de l'eau puis
on
acidifie à pH = 2 par addition d'HCl concentré. On filtre le précipité formé
pour obtenir
1,21 g du composé attendu, F = 121 C.
EXEMPLE 9
Acide 2-( 5 -cyclohexyiéthyl-4-(2, 5-diméthoxy-4-méthylphényl)thiazol-2-
ylcarbamoyl )indole-l-butyrique.
Me
Z)Z
I: Rl R~ = -(CH~
{
MeO
Me (CHz)3COOH
On laisse sous agitation pendant 4 heures un mélange de 0,6 g du composé de la
PREPARATION 2.21, 0,75 g du composé de la PREPARATION 1.1, 1 g de BOP et
0,3 ml de triéthylamine dans 3 mI de DMF. On ajoute du tampon sulfate et
filtre le
précipité formé. Celui-ci est repris par AcOEt, lavé au tampon sulfate, par
une solution
de Na2CO3 puis on sèche sur MgSO4 et concentre sous vide. On chromatographie
sur
silice H en éluant par un mélange DCM/AcOEt (100/ i; v/v). Le produit obtenu
est
saponifié dans 10 ml d'éthanol et 2 ml de NaOH 4N. On évapore le solvant puis
on
triture le résidu dans de l'eau et quelques gouttes d'HCI concentré, on filtre
et sèche le
précipité obtenu. On obtient 0,82 g du composé attendu, F = 223 C.
En procédant selon les modes opératoires décrits dans les exemples ci-dessus,
on
prépare les composés selon l'invention rassemblés dans le tableau 3, à partir
des
composés obtenus dans les PREPARATIONS.
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
TABLEAU 3
R9
R!n ~ !l
~ lt_ S NHCD
' I v I ~ 6 R!.
~- ~ '
R ft8 RD (i)
~
10 Exem- R 1 R2 Rg Rg, R 10, It 1t. F C
ples R 12. R13 Sel ou
soivate
~ Utite
M~~ -CH2 H CH2CO2H H 223
ci
1 l /~oMe ~~
-(CH_),-( -CH2C02H H 210
UMe
12 ~UMe _ COZH
-(CH_),-{ D H 190
\ /
~Se
13 oMe
-(CH,), H -(CH2)2C02H H 150
.
Meo
30 Me
14 CO2H
XJOMC -(CHZ)_ H H 170
Me
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
76
15 OMe COONa
H 180
-i tite 16 ~OMe
~ -CH2CO2H H 184
Me0 T
F
17
L,OMC
CH CO H
2 2 H 170
Me
OMe
18 OMe
~ \ -(CHZ)x--~ -CH2CO2H H 215
MeU \_J
Br
19 oMe
-(CH- 5CH3 CH2CO-;H H 242
Mco
Me
20
OMe
-(CFiZ} -CHZCOZH H 250
~-seo
Me
21 OMe
O -(CH_)x-(D -CH2CO2H H 180
`--0 ~
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
77
-- ~~oMC
=(CH_). -CH3CO3Na H 242
~te
?~ ~~)vte
-(CH2 ), =CH2C03H H 236
4te0 i
Me
24 OMe
-(CH,)_-CH2C02H H 234
Ec
25
OMe
-(CH.);-~ -CH2COZH H 197
EcO~ `-1
MC
OMc
-(CH2)2CO-)H H 283
~ (CH,),
~IeO \~
C1
27 OMe
-(CHz)--(../ -(CH2)3C02H H 160
,vZeo H )
ct
3 0 28 oMe
1-(CH)-CH2CO2H H 228
Me
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
78
29 ),OMe
I\ -(CH,)_--~ CH2CO2H 6-OMe 140
:Vic_.
Me
J0 OMe
1 -S-CFi -CH2CO2H H 216
z
MeU
Me
31 UMe
-(CH2) 4CH(CH3)Z -CH2CO2Na H 210
Me0
Me
32 OMe
Me -CH2CO2H H 160
~e
Me0
Me
33 jOMe
-(CH2)6CH3 -CH2CO2H H 206
HCl
Me0
Me
34
OMe
I -CH.-S--( -CH2CO2H H 213
MeO \_J
Me
[35 OMe
I -(CH_)_ -(CH2)4C02H H 232
MeO
C1
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
79
36 I ~OMe
-CH2CO2H 4-CH3 -(CHJ_-~H ~ 2 2 3 140
Me0 CF3CO2H
7 OMe
,(CH_).~ -CH2CO2Na 4-CH3 240
\
Me0
Me
j$ UMe
-(CH2)5C02H H 118
Meo
Me
39 Me0
L OMe -CH2CO2H 4-CF3 200
CI
40 Me0
-CH2C02H 4,6-diOMe 210
L OMe
Me
41 OMe
1 -CH2CO2H 5-Et 220
Mep CF3CO2H
Cl
42 JOMO
1 -CH2CO2H 5,6-diOMe 180
Mep ~.=J CF3CO2H
Me
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
-13 O Vte
H~ -CH2CO2Na 3-Nie 220
-(CH:):--~~,/
CF3C02Va
54
OMe
! -CHZCO2Na 4-OMe 160
CF3C02Na
c!
I
45 OMe
(CH)"--~ -CH2CO2H 4-CF3 210
^
ueo 0,75
m c CF3CO2H
46 OMe
-CH2CO2H 5-CF3 150
;ytCp 3CF;C02H
Me
47 ~ /J~OMe
-(CH_)î -CH2CO2H 5-Et 200
, \ I H
CF3CO2H
Me
48 OMe
! -CH2CO2H 5,6-diOMe 180
Mep CF3CO2H
Ci
49 ome
-(CH_)_--~ 4CH2)3C02H 3-Me 207
Meo
c!
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
81
50 -(CH,),_ -CH2CO2H 185
CF3CO2H
I Ct
51
51 ~UMe
~ -{CH,), K -(CH2)4C02H H 226
me0 HCI
Me
52 I ~ I
~OMG
-(CH-)- H CH2CO2H 5-CF3 190
MeOf 2CF3CO2H
CI
53 oMe
SCH` -CH2CO2H H 213
MeO~
Me
54 ~OMe
-CH2CO2H 5-CI 170
Meo
Me
55
OMe
-(CH-)=_ -CH2CO2H 4,6-üOMe, t60
Me0 5-Me CF3CO2H
Me
56 OMe
1 -(CH2)3C02H 5-Cl 193
MeU HCI
Me
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
82
57 . ~0Me
-(CHI)3COiH 5-C1 188
~~/ = HC1
C1
58 ~UMe
-(CH:),--~~ -(CH2)3C02H 4-Me 163
MeO~~/
Cl
59 UMe
-(CH2)2C02H 5-CI 275
MeU~
Me
60 UMe
7.1 \
-(CH2)2C02H 4-Me 298
MeU
CI
61
"~/ ITT ; =(CH,)__%~ -CH2CO2H 4,3-diMe 185
CF3CO2H
MeU
Me
62
OMe ~--'~
I -(CH.)î--( -CH2CO2H 4,5-diMe 195
Me0 CF3CO2H
CI
63 OMe
\ f -(CH.)'-{ -CH2CO2H 3-0Me 160
Meo CF3CO2H
CI
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
83
64 ~OMe
-CH2CO2H 5.7-diMe 160
meo CF3CO2H
Me
65 'eel-~OMe
SCH, -(CH2)3CO2H 4-Me 140
meo ` HCI
C1
66 ~OMe
~ -(CH,),_-~ -(CH2)2C02H 3,5-diMe 223
meo HC1
Me
67 L,OMe
-(CH.)!-~H, CH2CO2Na 5-Cl 250
A,fep 2 NaOH
C1
68 I
OMe
-CH2CO2H 4,6-diMe 200
meo C1
69
OMe
-(CH)-CH2CO2Na 4,5-diCl 185
mep NaOH
Me
70 pMe
-(CH2)=_% -CH2CO2Na 4,5-diCl 190
Mep NaOH
C1
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
84
71
+ OMe
=CH2C02H 4.7-diMe 190
CF3CO2H
ci
72
(7Me
~ -(CH.),_-~ -CH2COZH 4,7-diMe 184
Me0 CF3CO2H
Me
73 C)Me
I
-(CH_): -CHiCO-7H 5,6-diMe 1 201
HCI
Me
74 OMe
-(CHI)î (CH~2)3CO2H H 168
Me0 `
Me
75 1
~oMe
-(CH:): -CH2CO,)H 4,5-diOMe 145
NI
I H
;vte0 CF3CO2H
cl
76
OMe
-(CH2)4tBu -CH2CO2Na H 228
Me0
Me
77 OMe
-(CH)=--~ -CHZCOZH 4,6-â0Me 175
Mep CF3CO2H
C1
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
78 UMe
_(CH-)-CH?CO2H 4-C1 178
f ~zCo~~ CF3CO2H
Me
OMe
79
_ --~ -CH2CO2H 4-CI 180
! I -(CH,).
;vte0~~ CF3 C02H
C1
80 ~OMe
-CH-~CO2H 4,6-diOMe, 165
!I -(CH_)_
MeO Z*% 5-Me CF3C02H
C1
81 OMe 164
-(CH,)-CH2C02H 3-Me CF3C02H
~J
;viep HCI
Ci
82
OMe
- (CH2)4CO2H 3-Me 248
HCI
Me
83
OMe
-(CH2)--~~ -(CH2)4C02H 5-Me 245
Ma0 ~_,./
Ci.
84 OMe
-(CH2) -(CH2)5C02H 5-Me 139
_ H
1õte0 HCI
Me
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
86
~,OVk
-tCH2)5C02H 5-Me 135
vteU /~~ ~_.1
Cl
5
86 ome .(CH,)ï--~H, -CH2CO2H 6-OMe 170
CF3CO2H
ct
87 ome
\ I) -{CH_>_--~~ -(CH2)4C02H 5-Cl 213
MeoHCI
ct
88 ome
/-~
-(CH_)ï--{ -(CH2)4CO2H 5-Ci 215
HCl
M~
Me
89
Me ome /--~
-(CH.)I-{ H ) -(CH2)3C02H H 130
OMe
90
ome
-(CH,)ï-~H~ -(CH2)3C02H H 131
Cl ~--J HCI
OMe
91 oMe
-(CH2)3C02H 4-Me 270
Me0
Me
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
87
92
~fe0~
-(CH,): -(CH2)5CO2H 4-Me 120
Ome t_../
Cl
93 rl5:~
-(CH_):-( '(CH2)2C02H H 155
OMe
94 OMe
-(CH2)2C02H 5-Cl 278
MeO~/ ~`~
ci
95 OMe
I ~ I -(CH_)_-(CH2)2C02H 5-Me 270
Me0 ` \-/
Me
96 OMe
-(CH_).-~ -(CH2)2C02H 5-Me 273
Me0 \~ ~-/
cl
97 OMe
\ ! _(CH,),-{ -(CH2)4C02H 4-Me 265
Me0
Me
98
OMe /-~
-(CH-)---{ -(CH2)4C02H 4-Me 260
Me0
C1
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
88
99
OMe
ï+ -(CH_):--~~ '{CH2)4C02H H 140
1
U Vte
~
100 -(CH,).-{ (CH2)2C02H 285
Meo T t--.1
\te
101
101 ome
(CH.):--~H ~ -CH2CO2H ~-F 178
~tea~ t..._! CF3CO2H
Me
102 ome -(CH_)ï-~ -CH2C02H 5-F 189
MeV CF3CO-)H
Ct
`0 103
ome
~ I. -(CH.).--~ -(CH2)2C02H 5-OMe 270
C1
i I
104
OMe
` i -(CH)-(CH2)2C02H 4-0Me 298
Me0
C1
105 ome
\ I -CH2C02H 5,6,7-uiOMe 165
Meo ~.1
CI
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
89
106 OMe 176
(CH,)-CH2CO2H 7-OMe CF3CO2H,
vteo I - - ~.J H20
:v1e
107 ~~~Me I
-(CH,).- -CH2CO2H 7-OMe 182
imeo CF3CO2H
cl
lo
108 OMe
~ (CH-)--~ -CH2CO2H 6-SMe I81
Me
109 UMe
-CH2CO2H 6-SMe 190
Me0
C1
110
~OMe
-(CH.)_-l -CH2CO2H 5-Br 220
MeO
ci
111
OMe
-(CH)--~ -CH2CO2H 5-Br 215
MeO
Me
112
OMe
-(CH.)_-~H, -CH2CO2H 7-Me 150
MeO HCl
Me
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
113
UMe I
-CHiCOiH 7-.\1e 47
-(CH.)_--~H~ 1
HCI
Ci
:I
114 U~te
J
I i; -CH2CO2H 4-F 197
Meo~~ HCI
Me
115
OMe
-(CH)-~ -CH2CO2H 4-F 194
i Me0
Cl
116 oMe
-(CH2)3C02H 7-OMe 172
Me0 ~. J
Cl
117 ~OMe
\ II -(CH_)-(CH2)3C02H 7-OMe 175
Mo0
Me
118
OMe
-(CFi.)_--~ -CH2CO2H 3.5-diMe 122
Meo CF3CO,H
Me
119 oMe
-(CH.).--~ CH2CO2H 3,5-diMe 128
Mep CF3CO2H
ct
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
91
130
-(CH2)3C02H =.~-di~fe 13 8
meo HCI
i VIe
121
'(CH:)_ -CHj 200
, vleo CF,C02H
Me COZH
122 ~U:vle _
`-Me 217
titeo CF3CO2H
cl COZH
123 oMe _
5-Cl 187
Meo~ \.._./ \ / HCl
Me COzH
124
OMe
_C j-Cl 197
HCl
COzH
12115 oMe
f / -(CH)_--~ -(CH2)ZC02H 3,5-dLMe 142
Meo HCI
ci
126 OMe
-(CH_)_ -(CH2)3CO2H 3,3-diMe 134
Meo . HCI
ct
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
92
127 OMe
-CH2CO2H 4.6-diMe 160
Mao/~~ - - ~--.,
1,4e
178 ~OMe
-(CH.),--~ -(CH2)3CO2H 4,6-diMe 170
meo
C:l
129 o,v[e
-(CH-)._-{ -(CH2)3C02H 4,6-diMe 160
meo Me
1
130 oMe
-CH2CO2H 3-Me. 157
- -~
ueo~ 5-Cl HCI
Me
131 I
~OMe
-CH2CO2H 3-Me, 172
;~eo5-Cl HCi
ct
1-1 OMe
-(CH)-_f -CH2CO2H 5-NH2 177
tõfeo CF3CO2H
ci
133 OMe
-(CH) -CH2CO2H 5,6-diMe 212
meo
Cl
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
93
i 131 ~
~OMe
-CH-)COiH 5.7-diCl 204
~ ( ~te
135 OMe
-CH2C02H 5,7-diCl 174
vteo^~ HC1
c t
136 ~~o;vue 205
-CH2CO2H 4,7-diOMe gomme
Vtec~~~ CF3CO2H
Ct
1_3 7 OMe
-(CH_):--~H~ -CH2C02H 3-F, 181
7-Me CF3CO2H
Cl
138 ~OMe
-(CH.).-~ -CH2COZH 5-OMe, 194
MepT 7-Me CF3CO2H
ct
139 OMe
\ -(CHï)-CH2CO2H H 164
Et CF3CO2H
OMe
140 OMe
-(CH,)ï--~~ -CH2CO2H 5-Me, 170-172
Me0 7-C1
CI
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
94
141 ~
~ UMe
-CH2CO2H 3-Cl 222
Meo
~! f
142 ome -(CH,)_-{ H > -CH2CO2H 7-F 163
~...J
Me0~ CF3CO2H
ci
!43 ome
-CH2CO2H 4,7-diMe 206
CF3CO,)H
Mz
OMe
144 ~ ome (CH_) -CH2CO2H 5-Me 204
M~ HCl
OMe
145
ome
-CH2CO2H 5-CI 201
Me0 HCI
OMe
146 OMe
-(CH,)_--~ CH2C02H 4,7-diMe 162
Et \_! CF3CO2H
OMe
147
ome
-(CHZ) -CH2CO2H 5-Me 167
Et HCl
OMe
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
148
OMe -CH2Ç02H 5-Cl 188
HCl
5 OMe
149 OMe
~ -(CH,),-~ -CH2CO2H 5-Me 216
~
Me0
10 ~
150
~OMe
-(CH.)-CH2CO2H 5-Me 252
Mec)/\~ \-J
F
151 1 OMe
-(CH-)---~ -CH2CO2H 5-Me 185
Me
ome
152 ~
~OMe
Br -(CH,), H -CH2CO2H H 181
ome
153 ome -(CH_)_-{ H ) ~ H 175
CHz
Ma0
Me CO=H
154
ome
-(CH') C H 174
M~ CO,H
Mt
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
96
I t > > ~ /~ 01~te I
-CHiCOiH 5-Cl 180
~ =(CH:)_~
~.,t
=
UWe
156
ome
-CH2CO2H 5-Cl 161
tviao~~~ 7-CF; '/2 HCI
CI
IO
157 ~ ome -CH2CO2H 5-OCOCH3 211
meo CF3CO2H
C1
158 ome -CH2CO2H 5-OH 186
MaU~
Cl
159 ome
CH CO~H 4-~1de 175
-(CH_)_ Z
'AeU 1/3 HCI
C1
I
160 OMe
-CH2CO2H 4-Me 165
\ -(CH:)ï H
Meo 7-Cl
C1
-10 161
ome
-CH2CO2H 4-OH 181
Me0 --/
C'1
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 97 PCT/FR98/02007
162
-CH2CO?H 5-C1 203
7-F
c 1
163
~,, oMt
-SCH H -CH2CO2H 5.7-di~te ' 130
Mt-
OMr
164 oMC
-SCH, -CHiCO2H 5-Me 227
Me
UMe
165 OMe
-CH2CO2H H 250
iPr Na
oMC 2NaOH
166 ~ oMt
-CH2CO2H 4-OMe 150
OMz 7-Me 1/2
ci CF3CO2H
'S 167 oMe
-(CH_)_-~ -CH2CO2H 5-ime 173
Me0 ` ~--J 7-F
C1
168 OMC
-SCHZ H -CH2CO2H 5-Me 155
Mep '/. HCl
CI
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCTIFR98/02007
98
~ 169
+ ~r G 1~iz
SCH, -CH2CO2H 5,7-diMe 140
Ltz)~ 1/3 HCI
Ct
170
U!vta
_lCH-1,~ -CH2CO2H 4-OCOCH3 196
CF3CO2H
cI
EXEytPLE 171
Acide 5-amino-2-(5-cyclohexyléthyl-4-(2,5-diméthoxy-4-méthyiphényl)thiazol-2-
ylcarbamoyl)-indole-1-carboxylique, acide trifluoroacétique.
Me
I, CFsCO,H : Ri Ri = -(CHr): H ; R. N
Me0 1
1~ie CHZCOOH
Dans 2 ml de DMF, on mélange 0,6 g du composé de la PREPARATION 2.18
avec 0,6 g du composé de la PREPARATION 1. 1, 0,7 g de BOP et 0,21 rnd de NEt3
et
on laisse sous agitation pendant une nuit. On ajoute 5 ml de solution tampon
pH 2,
filtre puis reprend le précipité par AcOEt. On lave par une solution tampon pH
2, par
une solution de Na-iCO3 puis sèche sur MgSO4. Le résidu est chromatographié
sur
silice en éluant par DCM/AcOEt (100/3 ; v/v). Les fractions contenant le
produit sont
réunies puis reprises dans 10 ml de TFA et laissées deux heures sous
agitation. On
évapore les solvants puis triture dans de l'eau à pH 4 pour obtenir 740 mg du
composé
attendu, F = 183 C.
En procédant selon les méthodes habituelles à partir des composés des
PREPAR.ATIONS 3.1, 3.2 et 3.3 du composé de la PREPARATION 1.4 on prépare
les composés selon l'invention décrits dans le Tableau ci-après.
TABLEAU 4
NH-CORz
Rz S \
N
~ (n
Rt
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02304397 2000-03-15
WO 99/15525 PCT/FR98/02007
99
Exemples R 1 R-> R3 F C
el ou solvate
172 i r----
j~ /OMe ~ I ~I~
N210
ct cHco_H CF;CO2H
17"j e
~O!vtn /--~ ~ ~
I! ' (CH:).-{ N ' 212
~.~
~ CH_CO:H CF3CO2H
~l
174 ~OMe ~ ~ ~ I
(cH_)xN 190
é) ; éH.Ca.H CF3CO2H
ci
20
30
FEUILLE DE REMPLACEMENT (REGLE 26)