Note: Descriptions are shown in the official language in which they were submitted.
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
1
NOUVEAUX INHIBTTEURS DE FARNESYLE TRANSFERASE LEUR
PREPARATION LES COMPOSITIONS PHARMACEUTIQUES
QUI LES CONTIENNENT ET LEUR UTILISATION POUR LA PREPARATION
DE MEDICAMENTS
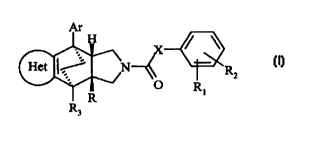
La présente invention concerne de nouveaux dérivés deformule générale (I)
Ar
H
Het I~ N R2 (I)
O R
R i
R3
leur préparation, les compositions pharmaceutiques qui les contiennent et leur
utilisation pour la préparation de médicaments.
La protéine farnésyle transférase est une enzyme qui catalyse le transfert du
groupement farnésyle du pyrophosphate de farnésyle (FPP) au résidue cystéine
terminal de la séquence tétrapeptidique CAAX d'un certain nombre de protéines
et en
particulier de la protéine p2lRas, exprimant l'oncogène ras.
L'oncogène ras (H-, N- ou K-ras) est connu pour jouer un rôle clé dans les
voies de
signalisation cellulaire et les processus de division cellulaire. La mutation
de
foncogène ras ou sa surexpression est souvent associée au cancer humain: la
protéine
p2lRas mutée se retrouve dans de nombreux cancers humains et notamment dans
plus
de 50% des cancers du colon et 90% des cancers du pancréas (Kohl et al.,
Science,
260, 1834-1837, 1993).
L'inhibition de la farnésyie transférase et par conséquent de la farnésylation
de la
protéine p2lRas bloque la capacité de la protéine p2lRas mutée à induire une
prolifération cellulaire et à transformer les cellules normales en cellules
cancéreuses.
D'autre part, il a été démontré que les inhibiteurs de farnésyle transférase
sont
également actifs sur des lignées cellulaires tumorales n'exprimant pas de ras
muté ou
surexprimé, mais présentant la mutation d'un oncogène ou la surexpression
d'une
oncoprotéine dont la voie de signalisation utilise la farnésylation d'une
protéine, telle
- qu'un ras normal (Nagasu et al., Cancer Research 55, 5310-5314, 1995 ; Sepp-
Lorenzino et al., Cancer Research 55, 5302-5309, 1995).
Les inhibiteurs de la farnésyle transférase sont des inhibiteurs de la
prolifération
cellulaire et par conséquent des agents anti-tumoraux et anti-leucémiques.
CA 02315144 2000-06-13
WO 99!33834 PCTIFR98/02804
2
Le brevet FR 95/08296 décrit des inhibiteurs de farnésyle transférase dérivés
benzoperhydroisoinsole, c'est-à-dire, des composés pour lesquels le noyau
isoindole
est condensé à un noyau phényle.
Selon la présente invention, les nouveaux composés de formule générale (I),
possèdent
entre autres modifications, un système hétérocyclique Het condensé à un noyau
isoindole.
Il a maintenant été découvert, et c'est également (objet de cette invention,
que les
nouveaux produits de formule générale (I) de structure originale, présentent
de façon
tout à fait surprenante et inattendue une forte activité inhibitrice de la
farnésyle
transférase et se révèlent être des agents anti-tumoraux et anti-leucémiques
remarquables.
En particulier, (activité biologique des composés selon l'invention est, entre
autres,
nettement améliorée, et ceci contre toute attente, du fait du remplacement du
cycle
benzo du squelette benzoperhydroisoindole par un système hétérocyclique
condensé
au squelette isoindole.
La présente invention concerne les nouveaux composés de formule générale I
Ar
H
Het I~' N I
R ()
a
O R
R 1
R3
dans laquelle:
- Het représente un système monocyclique ou, bi-, ou tri-cyclique condensé,
pour
lequel chaque cycle, saturé ou non, contient de 4 à 7 chaînons, et pour lequel
au moins
un des cycles contient de 1 à 4 hétéroatomes, identiques ou différents,
choisis
indépendamment parmi les atomes d'azote, d'oxygène et de soufre; ce système
hétérocyclique, éventuellement substitué peut être condensé au noyau isoindole
par 2
quelconques de ses atomes adjacents; Het représente préférentiellement un
système
CA 02315144 2000-06-13
WO 99133834 PCTIFR98102804
3
mono- ou bicyclique aromatique de 5 à 9 chainons contenant un atome d'azote ou
de
soufre; Het pouvant être également choisi de façon non limitative parmi les
radicaux
suivants : thiényle, ftzryle, pyrrolyle, pyrazolyie, imidazolyle, pyridyle,
pyrazinyle,
pyrimidinyle, pyridazinyle, benzofuranyle, benzothiényle, chromènyle,
indolyle, ou
quinolyle, ainsi que leurs isomères iso;
préférentiellement, Het représente un radical thiényle, indolyle;
avantageusement selon l'invention, Het représente thiényle;
- Ar représente
- un radical phényle éventuellement substitué par un ou plusieurs atomes ou
radicaux, identiques ou différents, choisis parmi les atomes d'halogène et les
radicaux alcoyles, tel que méthyle, les radicaux alcoyles pouvant être
éventuellement perhalogénés, tel que trifluorométhyle, alcényles, mercapto,
alcoylthio, cyano ou alcoxy, tel que méthoxy, dont la portion alcoyle est
ëventuellement perhalogénée, tel que trifluorométhoxy, ou
- un radical phényle condensé à un hétérocycle de 4 à 7 chaînons contenant
un ou plusieurs hétéroatomes choisis parmi les atomes d'oxygène, d'azote et
de soufre, le système bicyclique ainsi formé pouvant être notamment choisi
parmi les radicaux 2,3-dihydro-1,4-benzodioxin-6-yle ou 2,3-
dihydrobenzofuran-5-yle ou le 2,3-dihydrobenzopyran-6-yle ou
- un radical polycyclique, aromatique ou non aromatique tel que le 1- ou 2-
naphtyle ou le 5-indanyle, ou le 1,2,3,4-tétrahydronapht-6-yle
- un radical hétérocyclique aromatique ou non-aromatique de 5 à 12 chaînons
incorporant un ou plusieurs hétéroatomes choisis parmi les atomes d'oxygène,
d'azote et de soufre, lié au cycle condensé par une liaison carbone-carbone,
ledit radical étant substitué le cas échéant par un ou plusieurs atomes ou
radicaux, identiques ou différents, choisis parmi les atomes d'halogène et les
radicaux alcoyles, alcényles, hydroxy, alcoxy, mercapto, alcoylthio, cyano ou
trifluorométhyle,
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
4
préférentiellement, Ar représente ou un radical phényle éventuellement
substitué, le cas
échéant substitué par un radical alcoyle, de préférence méthyle, alcoxy, de
préférence
méthoxy, ou trifluorométhyle, et ceci de préférence en position 4, ou encore
un radical
phényle condensé à un hétérocycle formant un système bicyclique tel que 2,3-
dihydro
1,4-benzodioxin-6-yle;
avantageusement, Ar représente un radical phényle non substitué ou substitué
par un
radical alcoyle, de préférence méthyle, alcoxy, de préférence méthoxy, de
préférence
en position 4.
- R représente
un radical de formule générale
-CO-Z
dans laquelle Z représente
- un radical hydroxy, ou
- un radical de formule -OR., dans laquelle R~, représente un radical alcoyle,
tel que
méthyle, ou
- un radical de formule -N(RS)(R6) dans lequel
- R5 représente un atome d'hydrogène ou un radical alcoyle et
- R6 représente
- un radical alcoyle, tel que méthyle, éventuellement substitué par un
radical amino, alcoylamino, dialcoylamino, hydroxy, alcoxy,
mercapto, alcoylthio, alcoxycarbonyle, carboxy, cyano, un radical
aromatique mono- ou polycyclique et ayant de 5 à 12 chaînons,
incorporant ou non, un ou plusieurs hétëroatomes choisis parmi les
atomes d'oxygène, d'azote et de soufre éventuellement substitué,
ledit radical aromatique pouvant être notamment le radical 2-, ou 3-,
ou 4- pyridyle, préférentiellement le 3-pyridyle ou le 4-pyridyle, ou le
' radical 2-, ou 4-imidazolyle, ou le radical 2- ou 4-thiazolyle, ou le N-
oxyde de pyridine, ou pouvant être également un radical phényle
éventuellement substitué par un ou plusieurs atomes d'halogène ou
par un ou plusieurs groupements trifluorométhyle, ou par un ou
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
plusieurs radicaux alcoyle ou alcényle, alcoxy, alcoylthio,
alcoylamino, ou encore un radical naphtyle-1 ou -2 ou ,
- un atome d'hydrogène,
- un radical hydroxy,
5 - un radical amino éventuellement substitué, par un ou deux
radicaux, identiques ou différents choisis parmi les radicaux
- alcoyle,
- aryle, tel que phényle, éventuellement substitué par un ou
plusieurs radicaux, identiques ou différents, choisis parmi
les radicaux alcoyle, alcoxy,
- hétérocyclyle de 5 à 7 chaînons et contenant un ou
plusieurs hétéroatomes choisis parmi les atomes d'azote,
d'oxygène et de soufre,
- arylcarbonyle, tel que benzoyle, éventuellement substitué
par un ou plusieurs radicaux, identiques ou différents,
choisis parmi les radicaux alcoyle, alcoxy,
- un radical alcoxy éventuellement substitué par un radical phényle,
préférentiellement, R représente un radical carboxy, ou un radical -COOMe, ou
encore
un radical -CON (RS) (R6) pour lequel lorsque R; représente un atome
d'hydrogène, R6
représente un radical alcoyle, de préférence méthyle, substitué par un radical
aryle, tel
que le radical phényle ou pyridyle, 3- pyridyle de préférence, ou 4- pyridyle
ou 2- ou
4-imidazolyle ou 2- ou 4-thiazolyle;
très avantageusement, R représente un radical carboxy ou un radical -COOMe ou
encore un radical -CON(RS)(R6) pour lequel lorsque RS représente un atome
d'hydrogène, R6 représente un radical alcoyle, tel que méthyle substitué par
un radical
aryle tel que le radical phényle, ou pyridyle; encore plus préférentiellement,
R
reprësente un radical carboxy ou un radical -COOMe;
CA 02315144 2000-06-13
WO 99133834 PCTlFR98102804
6
- R, et R~, identiques ou différents, représentent un atome d'hydrogène, un
atome
d'halogène ou un radical alcoyle, un radical alcoxy, tel que méthoxy, chacun
pouvant
être éventuellement substitué par un radical dialcoylamino, un radical
alcoylthio, un
radical alcoxycarbonyle,
préférentiellement, l'un des symboles R, ou RZ représente un atome d'hydrogène
et
(autre des symboles représente un radical alcoxy tel que méthoxy, et plus
avantageusement fixé en position ortho du cycle phénylique.
- R3 représente un atome d'hydrogène ou un radical alcoyle, un radical
alcoylthio;
préférentiellement, R3 représente un atome d'hydrogène ou un radical méthyle;
très avantageusement, R3 représente un atome d'hydrogène;
- X représente un radical méthylène, ou alcèn-1,1-diyle tel que vinyldiyle ou
cycloalcan-1,1-diyle contenant 3 à 6 atomes de carbone,
préférentiellement, X représente un groupement méthylène ou vinyldiyle,
de façon particulièrement avantageuse, X représente le groupement vinyldiyle,
sous forme racémique ou leurs isomères optiques ou les mélanges de leurs
isomères
optiques, ainsi que les sels du produit de formule générale (I).
Dans les définitions qui précédent et celles qui suivent,
- les radicaux ou portions "alcoyle" définissent les radicaux ou portions
d'hydrocarbures contenant I à 6 atomes de carbone, en chaîne droite ou
ramifiée, et
représentent les radicaux ou portions méthyle, éthyle, propyle, butyle,
pentyle, hexyle
et les isomères iso, sec, tert correspondants, de préfërence les radicaux
méthyle,
éthyle, propyle, butyle, et les isomères iso, sec, tert correspondants
- les radicaux ou portions "alcényle" définissent les radicaux ou portions
d'hydrocarbures insaturés contenant 2 à 4 atomes de carbone et représente les
radicaux
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
7
ou portions vinyle, allyle, propène-2 yle, butène-I ou -2 ou-3 yle, et les
isomères iso,
sec, tert correspondants
- les radicaux ou portions "alcoxy" définissent les radicaux ou portions
contenant 1 à 4
atomes de carbone et représentent les radicaux méthoxy, éthoxy, propoxy,
butoxy, et
les isomères iso, sec, tert correspondants
Préférentiellement, les composés selon (invention présentent une formule
générale (I)
pour laquelle
Het représente un radical thiényle ou indolyle,
Ar représente ou un radical phényle éventuellement substitué, Ie cas échéant
substitué par un radical alcoyle, tel que méthyle, alcoxy tel que méthoxy ou
trifluorornéthyle; de préférence en position 4, ou un radical phényle condensé
à un
hétérocycle formant un système bicyclique tel que 2,3-dihydro-1,4-benzodioxin-
6-yle;
R représente un radical carboxy, ou un radical -COOMe, ou encore un radical
-CON(RS)(R6) pour lequel R$ représente un atome d'hydrogène, et R6 représente
un
radical alcoyle tel que méthyle substitué par le radical phényle ou 3- ou 4-
pyridyle;
fun des symboles R, ou RZ représente un atome d'hydrogène et (autre des
symboles représente un radical alcoxy tel que méthoxy, et plus avantageusement
fixé
en position ortho du cycle phénylique,
R3 représente un atome d'hydrogène,
X représente un groupement vinyldiyle,
sous forme racémique ou leurs isomères optiques ou les mélanges de leurs
isomères
optiques, ainsi que leurs sels.
Préférentiellement, les composés selon (invention présentent une formule
générale (I)
pour laquelle
Het représente un radical thiényle ou indolyle,
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
8
Ar représente ou un radical phényle éventuellement substitué, le cas échéant
substitué par un radical alcoyle tel que méthyle, alcoxy tel que méthoxy, le
radical
trifluorométhyle;
R représente un radical carboxy, ou un radical -COOMe;
fun des symboles R, ou RZ représente un atome d'hydrogène et (autre des
symboles représente un radical méthoxy, et plus avantageusement fixé en
position
ortho du cycle phénylique,
R3 représente un atome d'hydrogène,
X représente un groupement vinyldiyle,
sous forme racémique ou leurs isomères optiques ou les mélanges de leurs
isomères
optiques, ainsi que leurs sels,
Dans ce qui précède et ce qui suit, (expression "isomère optique" ou forme
optiquement active définit la forme pure dudit isomère optique ou
éventuellement le
mélange des isomères optiques "enrichi", c'est-à-dire contenant
majoritairement ledit
isomère optique ou ladite forme.
Selon (invention, les composés de formule générale (I) sous forme dextrogyre
sont
préférés selon l' invention.
A titre illustratif et non limitatif des composés revendiqués on peut plus
particulièrement citer tout composé choisi individuellement parmi les composés
suivants:
acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-phényl-2,3,3a,4,8,8a-
hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS)
CA 02315144 2000-06-13
WO 99!33834 PCT/FR98l02804
acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-méthylphényl)-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylique-
(3aRS,4SR,8SR,8aRS)
acide 4,8-éthano-2-[2-{2-méthoxyphényl)propènoyl]-8-{4-trifluorométhyl-phényl)-
2,3,3a,4,8,8a-hexahydro-1 H-thiéno[2,3-f]isoindole-3a-carboxylique-
(3aRS,4SR,8SR,8aRS)
N-benzyl-4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-trifiuorométhyl-
phényl)-
2,3,3a,4, 8,8a-hexahydro-1 H-thiéno[2,3-f] isoindole-3a-carboxamide-
(3aRS,4SR,8SR,8aRS)
acide 4,9-éthano-2-[2-(2-méthoxyphényl)-2-propèn-1-oyl]-10-(4-méthylphényl)-
2,3,3a,4,10,10a-hexahydro-1H-indolo[2,3-f]isoindole-3a-carboxylique-
(3aRS,4SR,lOSR,lOaRS)
N-(3-pyridxl)méthyl-4 8-éthano-2-[2-(2-méthoxyphényl)pronénovll-8-(4-
méth~phén,Kl)-2 3 3a 4 8 8a-hexahydro-1H-thiénof2 3-flisoindole-3a-carboxamide-
(3aRS-,,4SR.8SR.8aRS).
4,8-éthano-8- (4-méthoxynhén_yl)-2-f 2- (2-méthoxyphényl) pronènoyll-2.3.3
a.4.8 ,8a-
hexahydro-1H-thiénof2 3-flisoindole-3a-carboxylate de méthvle-
(3aRS.4SR,8SR,8aRS).
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
acide 4 8-éthano-8-(4-méthoxyphényl)-2-[2-(2-méthoxyphénvl)pronènoyll-
2 3,3a 4 8 8a-hexahydro-1H-thiéno[2,3-fiisoindole-3a-carboxyliüue-
f 3aRS.4SR.8SR,8aRS).
5 N-(3-pyrid~l)méthyl-8-(benzo-14-dioxan-6-yl)-4.8-éthano-2-[2-(2-
méthoxynhényl)propènoyll-2 3 3a,4 8 8a-hexahydro-1H-thiéno[2.3-flisoindole-3a-
carboxamide-(3aRS,4SR,8SR.8aRS).
sous forme racémique ou leurs isomères optiques ou les mélanges de leurs
isomères
10 optiques, saus forme dextrogyre préférentiellement, ainsi que leurs sels.
Plus préférentiellement selon (invention, on peut notamment citer les produits
suivants
acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-phényl-2,3,3a,4,8,8a-
hexahydro-lH-thiéno[2,3-f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS)
acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-méthylphényl)-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylique-
(3aRS,4SR,8SR,8aRS)
acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-trifluorométhyl-phényl)-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f] isoindole-3a-carboxylique-
(3aRS,4SR,8SR,8aRS)
acide 4,9-éthano-2-[2-(2-méthoxyphényl)-2-propèn-1-oyl]-10-(4-méthylphényl)-
2,3,3a,4,10,10a-hexahydro-1H-indolo[2,3-f]isoindole-3a-carboxylique-
(3aRS,4SR,10SR, lOaRS)
CA 02315144 2000-06-13
WO 99133834 PCT/FR98102804
11
acide 4 8 éthano 8 (4-méthoxxphényl)-2-[2-(2-méthoxyphényl)propènoyll-
2 3,~a 4 8 8a-hexah~-1H-thiéno[2,3-flisoindole-3a-carboxvliaue-
(3aRS,4SR.8SR,8aRS),
et en particulier
acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-méthylphényl)-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylique-
(3aRS,4SR,8SR,8aRS)
sous forme racémique ou ses isomères optiques ou les mélanges de leurs
isomères
optiques, sous forme dextrogyre préférentiellement, ainsi que ses sels.
A titre d'isomère optique des composés de formule générale (I) selon
l'invention tout
particulièrement avantageux, on peut citer notamment
énantiomère dextrogyre de l' acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-
8-
(4-méthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-
carboxylique-
(3aRS,4SR,8SR,8aRS)
ou le mélange d'isomères optiques contenant majoritairement ledit isomére
optique.
La Demanderesse propose en outre ci-après à titre non limitatif de la présente
invention, divers protocoles opératoires ainsi que des intermédiaires
réactionnels
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
12
susceptibles d'être mis en oeuvre pour préparer les composés de formule
générale (I).
Bien entendu, il est à la portée de (homme de fart de s'inspirer de ces
protocoles et ou
produits intermédiaires pour mettre au point des procédés analogues en vue de
conduire à ces mêmes composés.
Selon l'invention, les nouveaux produits de formule générale (I) revendiqués
peuvent être obtenus par action d'un acide de formule générale (II)
X
HO-~ ~ (II)
O Rl
dans laquelle
- Rl, R~ sont définis selon la formule générale I et X défini comme
précédemment,
de son ester méthylique ou d'un dérivé de cet acide tel qu'un halogénure ou
l'anhydride, sur un produit de formule générale (III)
(III)
R3
dans laquelle:
- Het, Ar, R, R3 sont définis selon la formule générale I et
- G ~ représente un atome d'hydrogène, qui peut être obtenu à partir d'un
produit de
formule générale (III) dans laquelle G1 représente un groupement protecteur
d'une
fonction amino tel qu'un radical benzyle, benzyloxycarbonyle, tert-
butoxycarbonyle ou
préférentiellement un radical benzyle ultérieurement transformé en radical
vinyloxycarbonyle lorsque l'hétérocycle Het représente un hétérocycle soufré
tel que le
thiophène, par hydrogénolyse en présence d'un catalyseur tel que le palladium
sur
charbon, lorsque G, représente un radical benzyle ou benzyloxycarbonyle, ou
par
hydrolyse en milieu acide, lorsque G, représente un radical tert-
butoxycarbonyle,
vinyloxycarbonyle ou benzyloxycarbonyle.
CA 02315144 2000-06-13
WO 99133834 PCT/FR98102804
13
Dans ce qui suit, la définition pour laquelle G1 représente un radical benzyle
n'est
donnée qu'à titre illustratif, et il est évident à (homme de fart d'adapter
les divers
protocoles aux autres groupes protecteurs d'une fonction amino tel qu'un
radical
benzyle, benzyloxycarbonyle, tert-butoxycarbonyte ou vinyloxycarbonyle.
Généralement, la réaction du produit de formule générale (II) sous forme
acide sur le produit de formule générale (III) est effectuée en opérant dans
un solvant
organique tel qu'un hydrocarbure aliphatique halogéné tel que le
dichlorométhane en
présence d'un agent de condensation tel que le chlorhydrate de 1-éthyl-3-[3-
(diméthylamino)propyl]carbodiimide, le 1,3-dicyclohexylcarbodümide ou fhexa-
fluorophosphate de benzotriazol-1-yloxytris (diméthylamino)phosphonium et
événtuellement d'un agent d'activation tel que fhydroxybenzotriazole à une
température comprise entre 0°C et la température de reflux du mélange
réactionnel.
Généralement, la réaction du produit de formule générale (II) sous forme
d'ester méthylique sur un produit de formule générale (III) est effectuée en
opérant
dans un solvant organique tel que le dioxane ou un hydrocarbure aliphatique
halogéné
tel que le dichlorométhane à une température comprise entre 0°C et la
température de
reflux du mélange réactionnel.
Généralement, la réaction du produit de formule générale (II) sous forme
d'halogénure sur le produit de formule générale (III) est effectuée en opérant
dans un
solvant organique tel qu'un hydrocarbure aliphatique halogéné tel que le
dichlorométhane en présence d'une base (amine aliphatique tertiaire) à une
température
comprise entre 0°C et la température de reflux du mélange réactionnel.
Généralement, la réaction du produit de formule générale (II) sous forme
d'anhydride sur le produit de formule générale (III) est effectuée en opérant
dans un
Z5 solvant organique tel qu'un hydrocarbure aliphatique halogéné comme le
dichlorométhane en présence d'une base (amine aliphatique tertiaire, pyridine
ou 4-
diméthylaminopyridine) â une température comprise entre 0 et 50°C.
En outre , à (issue de la réaction de II sur III, on peut éventuellement,
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98I02804
14
lorsque R représente un radical -CO-OR:~ avec R4 représentant un radical
alcoyle,
procéder à une saponification du produit obtenu pour obtenir un produit de
formule
générale (I) dans laquelle R représente un radical carboxy.
Généralement la saponification d'un produit de formule générale (I) dans
laquelle R représente un ester de formule générale -CO-OR, en produit de
formule
générale (I) dans laquelle R représente ou contient un radical carboxy est
effectuée au
moyen d'une base minérale telle que la soude ou la potasse ou le carbonate de
sodium
dans un solvant organique tel qû un alcool comme le méthanol ou fëthanol ou
tel
qu'un éther comme le dioxane, à une tempërature comprise entre 20°C et
le reflux du
solvant.
Selon l'invention, les nouveaux produits de formule générale (I) dans
laquelle:
- R représente un radical de formule générale
-CO-Z
avec Z représentant un radical -ORa avec R:, représentant un radical alcoyle,
peuvent être obtenus par estérification d'un produit de formule générale (I)
dans
laquelle Z représente un radical hydroxy.
Généralement, festérification est effectuée au moyen d'un alcool de formule
générale R:,-OH dans laquelle R:, est défini comme précédemment en opérant en
milieu
acide ou au moyen d'un halogénure d'alcoyle de formule générale R.,-Hal dans
laquelle
Hal .représente un atome d'halogène (iode) en opérant en milieu alcalin
(carbonate de
métal alcalin ou alcalino-terreux tel que le carbonate de césium) en opérant
dans un
solvant organique tel que le diméthylformamide à une température comprise
entre 0 et
50°C.
Selon (invention, les nouveaux produits de formule générale (I) dans laquelle:
R représente un radical de formule générale
-CO-Z
dans laquelle:
Z représente un radical -N (RS) (R6)
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
dans lequel R; et R6 sont définis comme en revendication générale (I)
peuvent être obtenus par action d'un produit de formule générale
HN(R;) (Itb)
dans laquelle R; et R6 sont définis comme ci-dessus
5 sur un produit de formule générale (I) dans laquelle R représente un radical
carboxy.
Il est particulièrement avantageux
- soit de faire réagir d'abord le chlorure d'oxalyle avec un composé de
formule générale (I) dans lequel R représente un radical carboxy en solution
dans du
dichlorométhane pour former intermédiairement le chlorure d'acide, puis de
faire
10 réagir le composé de formule générale HN(R;)(R6), éventuellement en
présence d'une
base telle que la triéthylarnine,
- soit de faire réagir directement le composé de formule générale HN(R5)(R6)
avec un composé de formule générale (I) dans lequel R représente un radical
carboxy
dans un solvant organique tel qu'un alcool (éthanal) ou un solvant halogéné
tel que le
15 dichlorométhane en présence d'un agent de condensation tel que le N,N'-
carbonyldiimidazole, le l,ï-dicyclohexylcarbodiimide, le chlorhydrate de 1-
éthyl-3-[3-
(diméthylamino)propyl]carbodiimide, fhexafluorophosphate de benzo-triazol-1-
yloxytris(diméthylamino) phosphonium à une température comprise entre 0 et
50°C.
Lorsque fun au moins des symboles R; et R6 est substitué par un radical
~0 amino, il est particulièrement avantageux de le protéger par un groupement
protecteur
tel qu'un radical tert-butoxycarbonyle, benzyloxycarbonyle ou benzyle
préalablement à
la condensation de famine de formule générale HN(R;) {R6) sur (acide approprié
puis à
remplacer le groupement protecteur par un atome d'hydrogène par exemple par
hydrogénolyse au moyen d'hydrogène en présence d'un catalyseur tel que le
palladium
sur charbon, lorsqu'il représente un radical benzyle ou ~benzyloxycarbonyle,
ou par
hydrolyse en milieu acide, lorsqu'il représente un radical tert-
butoxycarbonyle ou
benzyloxycarbonyle.
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
16
Lorsque fun au moins des symboles R$ et R6 est substitué par un radical
carboxy, il est particulièrement avantageux de le protéger par un groupement
protecteur tel qu'un radical alcoyle éventuellement substitué par un radical
phényle tel
que le radical benzyle préalablement à la condensation de famine de formule
générale
HN(RS)(R6) sur (acide approprié puis de remplacer le groupement protecteur par
un
atome d'hydrogène par exemple par hydrogénolyse au moyen d'hydrogène en
présence
d'un catalyseur tel que le palladium sur charbon ou par saponification dans
les
conditions décrites ci-dessus.
Lorsque, dans le produit de formule générale (I), R~ représente un atome
d'hydrogène ou un radical alcoyle contenant 1 à 6 atomes de carbone et R6
représente
un radical alcoxy substitué par un radical phényle, le remplacement du radical
alcoxy,
substitué par un radical phényle, par un radical hydroxy, effectué
- soit par hydrogénolyse en présence d'un catalyseur tel que Ie palladium sur
charbon,
-soit par traitement avec du chlorure d'aluminium en présence d'anisole dans
un solvant organique tel que le nitrométhane à une température comprise entre -
20°C
et l'ambiante lorsque le radical alcoyle substitué par un radical phényle est
un radical
benzyle,
permet d'obtenir un produit de formule générale (I) dans laquelle R;
représente un
atome d'hydrogène ou un radical alcoyle contenant 1 à 4 atomes de carbone et
R6
représente un radical hydroxy.
Selon (invention, les produits de formule générale (I) dans laquelle l'un des
symboles R, ou R~ représente un radical alcoylcarbonyloxy peuvent être obtenus
par
acylation d'un produit de formule générale (I) dans laquelle fun des symboles
Rl ou RZ
représente un radical hydroxy au moyen d'un acide aliphatique ou d'un dérivé
de cet
acide tel qu'un halogénure ou (anhydride dans les conditions habituelles
d'estérification.
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
17
En ce qui concerne les produits intermédiaires décrits ci-dessus, nous
proposons ci-après également des protocoles opératoires et des composés utiles
pour
les obtenir.
Les produits de formule générale (III)
-G 1 (III)
dans laquelle:
- Het, Ar, R, R3 sont définis selon la formule générale I et
- GI représente un atome d'hydrogène au un groupe protecteur du groupe amino,
tel
que benzyle,
sont d'un intérêt tout particulier selon l'invention.
Classiquement, les produits de formule générale (III) dans laquelle R
représente un radical carboxy au un radical de formule générale COOR4 peuvent
être
obtenus par action de (acide trifluorométhanesulfonique sur un produit de
formule
générale (IV)
~ Q~H
-Gl (IV)
R3 ~~ COOR,~
Het
dans laquelle
Het, Ar, R3 sont définis comme précédemment,
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
18
G, représente un groupe protecteur tel que le radical benzyle,
- R, représente un radical alcoyle contenant 1 à 4 atomes de carbone
suivie du remplacement du groupe G1 par un atome d'hydrogène
- soit par hydrogénolyse dans les conditions décrites ci-dessus puis
éventuellement selon le cas du remplacement de (atome d'hydrogène par un
radical
tert-butoxycarbonyle, par action de (anhydride tert-butoxycarbonyle dans un
solvant
organique, ou par un radical benzyloxycarbonyle, par action du chlorure de
benzyloxycarbonyie dans un solvant organique
- soit, préférentiellement lorsque l'hétérocycle Het représente un noyau
thiophène, par action d'un chloroformiate d'alcoyle, tel que le chloroformiate
de vinyle
ou le chloroformiate d'éthyle ou le chloroformiate de 2-chloroéthyie ou le
chloroformiate de 2,2,2-trichloroéthyle, dans un solvant organique tel que le
dichlorométhane à une température comprise entre 0°C et l'ambiante,
suivie de
l'hydrolyse acide du carbamate intermédiairement formé, généralement à l'aide
d'une
solution aqueuse 1 à 6 M d'acide chlorhydrique, éventuellement dans un solvant
organique tel qu'un alcool, comme le méthanol ou l'éthanol, ou un éther comme
le
tétrahydrofurane ou le dioxane.
Généralement la cyclisation intramoléculaire de type Friedel-Crafts du produit
de formule générale (IV) en produit de formule générale (III) peut être
effectuée par
l'action d'un excès, de 3 à 15 équivalents molaires, d'un acide fort tel que
l'acide
trifluorométhanesulfonique, éventuellement en présence d'anhydride
trifluorométhanesulfonique en quantité catalytique ou éventuellement ajouté en
ajouts
successifs, en opérant dans un solvant organique tel que le dichlorométhane à
une
terripérature comprise entre 0°C et le reflux de quelques minutes à
plusieurs jours. Il
est également possible d'effectuer la cyclisation intramoléculaire de type
Friedel-Crafts
par action d'un acide de Lewis, tel que Ie chlorure d'aluminium ou le
tétrachlorure de
titane ou le trifluorure de bore, éventuellement sous forme de complexe avec
l'oxyde
de diéthyle, dans un solvant organique tel que le dichlorométhane ou le
nitrornéthane
ou le nitrobenzène.
CA 02315144 2000-06-13
WO 99133834 PCTIFR98/02804
19
Cette réaction peut éventuellement être suivie de la saponification du produit
obtenu, et suivie éventuellement selon le cas du remplacement du radical
benzyle par
un atome d'hydrogène.
Le produit de formule générale (IV) peut être obtenu quant à lui de manière
classique par action d'un dérivé organomagnésien de formule générale Ar-Mg-Hal
dans laquelle Ar est défini comme précédemment et Hal représente un atome
d'halogène, ou d'un organolithien de formule générale Ar-Li dans laquelle Ar
est défini
comme précédemment sur un produit de formule générale (V)
H
N-G1 (V)
R3 ~~ COORa
Het
dans laquelle Het, R3, R:, et G1 sont définis comme précédemment, dans les
conditions
habituelles.
Généralement la réaction d'un arylmagnésien, obtenu classiquement et
éventuellement en présence de chlorure de cérium (III) anhydre dans les
conditions
décrites par Imamoto (Tetrahedron Lett., 1985 p.4763), sur le dérivé cétonique
de
formule générale (V) est effectuée dans un solvant organique comme l'oxyde de
diéthyle ou le tétrahydrofurane, en opérant à une température comprise entre
0°C et le
reflux du mélange réactionnel de quelques minutes à 24 heures. Cependant il a
été
trouvé particulièrement avantageux d'opérer dans le toluène, éventuellement en
mélange avec de l'oxyde de diéthyle ou du tétrahydrofurane.
Généralement la réaction d'un aryllithien, obtenu classiquement, sur le dérivé
cétonique de formule générale (V) est effectuée dans un solvant organique
comme
l'oxyde de diéthyle ou le tétrahydrofurane, en opérant à une température
comprise
entre -78° et -20°C de quelques minutes à 4 heures. Cependant il
a été trouvé
CA 02315144 2000-06-13
WO 99133834
PCT/FR98/02804
particulièrement avantageux d'opérer dans le toluène, éventuellement en
mélange avec
de l' oxyde de diéthyle ou du tétrahydrofurane.
Avantageusement, il a été développé dans le cadre de la présente invention,
un procédé de préparation permettant d'obtenir les composés de formule
générale (III)
5 à partir des composés de formule générale (V) via la formation d'un
intermédiaire
stable et caractérisable de formule générale (VI) caractérisé par la présence
d'une
fonction aryléthylénique en position 7.
Plus précisément, les composés de formule générale III
-G1 (III)
R3
1.0 dans laquelle R3, Het, Ar et R sont tels que dêfinis en formule générale I
et G1
représente un radical benzyle peuvent être obtenus à partir de composés de
formule
générale (V)
O
H
-G1 (V)
R3 ~~ COOR4
Het
sous forme racémique ou leurs isomères optiques ou les mélanges de leurs
isomères
15 optiques, ainsi que leurs sels, dans laquelle Het, R3, R., et G~ sont tels
que définis
précédemment via la formation d'un intermédiaire de formule générale (VI)
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
21
(VI)
R's~~~~ COOR4
Het
dans laquelle R3, R:,, Het, Ar et G, sont tels que définis précédemment, dont
la
transformation par cyclisation intramoléculaire de type Friedl-Crafts conduit
au
produit (III) attendu.
Le protocole opératoire mis au point, implique successivement
- soit la condensation, en position 7, d'un dérivé cétonique de formule
générale (V) avec de l'hydrazine, pour conduire à une hydrazone, suivie de
l'action de
l'iode pour conduire, selon la réaction de Barton (J. Chem. Soc. 1962 p.470),
à un
dérivé iodoéthylènique ; puis d'une réaction de couplage au palladium avec un
acide
arylboronique, réaction de Suzuki (Tetrahedron Lett. 1979 p.3437), de formule
générale Ar-B (OH) z, ou éventuellement avec l' anhydride trimérique de l'
acide
arylboronique, dans laquelle Ar est défini comme précédemment, ou avec un
arylstannane, réaction de Stille (Angew. Chem. Int. Ed. Engl., 1986 p.508), de
formule
générale Ar-SnMe3 dans laquelle Ar est défini comme précédemment, pour
conduire à
cet intermédiaire aryléthyléruque de formule générale (VI) dont la
transformation par
cyclisation intramoléculaire de type Friedel-Crafts conduit au produit (III)
attendu,
-soit la réaction d'un dérivé cétonique de formule générale (V) avec de
l'anhydride trifluorométhanesulfonique, pour conduire à un triflate d'énol en
position 7
(Org. Synth., 1990 p.116) ; puis d'une réaction de couplage au palladium avec
un
acide arylboronique, réaction de Suzuki (Tetrahedron Lett. 1979 p.3437), de
formule
générale Ar-B(OH)Z dans laquelle Ar est défini comme précédemment, ou avec un
arylstannane, réaction de Stille (Angew. Chem. Int. Ed. Engl., 1986 p.508), de
formule
générale Ar-SnMe3 dans laquelle Ar est défini comme précédemment, pour
conduire à
CA 02315144 2000-06-13
WO 99133834 PCTIFR98/02804
22
cet intermédiaire aryléthylénique de formule générale (VI) dont la
transformation par
cyclisation intramoléculaire de type Friedel-Crafts conduit au produit (III)
attendu.
Généralement le dérivé cétonique de formule générale (V) est traité par un
excès d'hydrate d'hydrazine, de 3 à 20 équivalents molaires, au reflux dans un
solvant,
tel que l'éthanol, de quelques minutes à quelques heures. L'hydrazone ainsi
obtenue
est alors agitée avec un excès d'iode, en présence d'une amine tertiaire
aliphatique
telle que la triéthylamine, à une température voisine de 20°C pendant
quelques heures
pour conduire à un dérivé iodoéthylénique.
Généralement le dérivé cétonique de formule générale (V) est traité
- soit par de l'anhydride trifluoromëthanesulfonique en présence d'une base
organique,
telle que la 2,6-di-tert-butyl-4-rnéthylpyridine, dans un solvant organique
tel que le
dichlorométhane à une température voisine de l'ambiante pendant quelques
heures ,
selon Stang (Synthesis, 1980 p283),
- soit par un bis(trifluorométhylsulfonyl)amide, comme la N,N-
bis(trifluorométhylsulfonyl)aniline selon Mac Murry (Tetrahedron Lett., 1983
p979)
ou la 2-[N,N-bis(trifluorométhylsulfonyl)amino)pyridine selon Convins
(Tetrahedran
Lett., 1992 p979), en présence d'une base comme le diisoprolylamidure de
lithium
dans un solvant organique comme le dichlorométhane ou le 1,2-diméthoxyéthane,
pour conduire à un triflate d'énol.
Généralement le couplage entre le dérivé iodoéthylènique, ou le triflate
d'énol, obtenu précédemment et un acide arylboronique, obtenu classiquement et
éventuellement isolé sous forme d'anhydride trimérique, est effectué par
agitation dans
un système biphasique constitué d'un solvant organique, préférentiellement un
mélange de toluène et de méthanol, et d'une solution aqueuse basique,
préférentiellement une solution 2N de carbonate de sodium, en présence d'une
quantité catalytique de dérivé de palladium(0), préférentiellement du
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
23
tétralcis(triphénylphosphine)palladium, à une température voisine du reflux
pendant
quelques heures pour conduire au composé aryléthylènique de formule générale
(VI).
Généralement le couplage entre le dérivé iodoéthylènique, ou le triflate
d'énol, obtenu précédemment avec un arylstannane, obtenu classiquement, est
effectué
par agitation dans un solvant organique aprotique polaire, préférentiellement
le
diméthylformamide ou la N-méthyl-pyrrolidone, en présence d'une quantité
catalytique
de dérivé de palladium(0), préférentiellement du tétrakis
(triphénylphosphine)palladium, à une température comprise entre 50° et
100°C
pendant quelques heures pour conduire au composé aryléthylènique de formule
générale (VI).
Généralement la cyclisation intramoléculaire de type Friedel-Crafts du
composé de formule générale {VI) en produit de formule générale (III) est
effectuée
dans les conditions décrites précédemment pour la cyclisation intramoléculaire
des
produits de formule génërale (IV).
Avantageusement, il a en outre été développé, dans le cadre de la présente
invention, un second procédé de préparation permettant d'obtenir les composés
de
formule générale (III) tels que définis précédemment à partir des composés de
formule
générale {V) via la formation de (intermédiaire de formule générale (V1)
éventuellement isolable. Ce second procédé est tout particulièrement
avantageux
lorsque le radical aryle Ar représente un noyau phényle éventuellement
susbtitué, en
positions para ou méta-para ou méta-para-méta' par des groupements donneurs
d'électrons, ou un radical hétérocyclique naturellement riche en électrons ou
un radical
hétérocyclique convenablement substituë par des groupements donneurs
d'électrons,
ce second procédé consiste à faire réagir directement, selon des réactions
tandem de
cyclisations intermoléculaire puis intramoléculaire de type Friedel-Crafts, un
hydrocarbure aromatique ou hétérocyclique Ar-H avec un composé de formule
générale (V) dans un solvant organique en présence d'un excès d'acide fort,
tel que
l'acide trifluorométhanesulforuque, ou éventuellement d'un acide de Lewis, tel
que le
chlorure d' aluminium.
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
24
Le mode opératoire mis au point consiste à condenser le produit de formule
générale (V)(I) avec un excès d'acide trifluorométhanesulfonique (de S à 20
équivalents molaires) dans un solvant organique tel que le dichlorornéthane à
une
température voisine de l' ambiante de quelques heures à plusieurs jours. Selon
le
nombre d'équivalents molaires et la concentration de l'acide
trifluorométhanesulfonique ainsi que la nature du radical Ar et des
substituants qu'il
porte, cette réaction conduit soit directement aux composés de formule
générale (III)
soit intermédiairement aux composés de formule générale (VI) qui sont alors
cyclisés
comme décrit précédemment en composés de formule générale (III).
En outre, les composés de formule générale (I) ou (III) peuvent être obtenus
par
fonctionnalisation des substituants du cycle aromatique Ar des composés de
formule
générale (I) ou (III) correspondants, par application ou adaptation des
méthodes
connues de fonctionnalisations habituelles, telles que, et à titre non
limitatif : les
réactions de substitution fonctionnelle (par exemple le remplacement d'un
atome
d'halogène par un groupement cyano par un couplage au palladium), les
réactions de
déallcylation (par exemple par BBr3), les réactions d'alkylation (notamment
les
réactions d'alkylation-cyclisation par action de BBr2).
Un autre objet de la présente invention se rapporte également à ces composés
de formule générale (VI)
Ar
H
-G1 (VI)
R3 ~~ COOR4
Het
dans laquelle R3 , Het et Ar sont tels que définis en formule générale I, G,
représente
un radical benzyle et R:~ représente un radical alcoyle contenant 1 à 4 atomes
de
CA 02315144 2000-06-13
WO 99!33834 PCTIFR98/02804
carbone sous forme racémique ou leurs isomères optiques ou les mélanges de
leurs
isomères optiques, ainsi que leurs sels.
Le produit de formule générale (V) dans laquelle R3, R.~ , Het et Ar sont tels
que définis en formule générale I, G1 représente un radical benzyle peut être
obtenu
5 par action d'une N-trialcoylsilylméthyl-N-alcoxyméthyl-amine portant un
groupement
protecteur de la fonction amine tel qû un radical benzyle, comme la N-
triméthylsilylméthyl-N-n.butoxyméthyl-benzylamine qui peut être préparée dans
les
conditions décrites dans Chem. Pharm. Bull., 276 (1985), sur un dérivé de
cyclohexënone de formule générale
O
(VII)
~COOR4
R ~~
Het
dans laquelle Het, R3, R, sont définis comme ci-dessus.
Généralement, la réaction est effectuée dans un solvant organique tel qu'un
hydrocarbure aliphatique halogéné comme le dichlorométhane en présence d'un
acide
fort tel que (acide trifluoroacétique à une température comprise entre
0°C et le reflux
du mélange réactionnel.
Lxs produits de formule générale (VII) peuvent être obtenus par estérification
des acides correspondants de formule générale (VIII)
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
26
(VIII)
R3 ~~ 'COOH
Het
dans laquelle R3 et Het sont tels que définis en formule génërale (I), au
moyen d'un
alcool aliphatique de formule générale R40H contenant 1 à 4 atomes de carbone
en
présence d'un acide minéral tel que (acide chlorhydrique ou (acide sulfurique
à une
température comprise entre 0°C et la température de reflux du mélange
réactionnel, ou
au moyen d'un halogénure d'alcoyle (iodure), en présence d'une base organique,
telle
que le 1,8-diazabicyclo[5.4.0]undéc-7-ène, ou minérale, telle que le carbonate
de
césium, en opérant dans un solvant choisi parmi le tétrahydrofurane, le
diméthylformamide, l'acétone ou le dioxane.
Les acides cyclohex-1-ène-1-carboxyliques de formule générale (VIII) dans
laquelle Het et R3 sont définis comme ci-dessus, peuvent être obtenus à partir
des
acides cyclohexane-1-ol-1-carboxyliques de formule générale (IX)
OH (IX)
R3 ~~ "COOH
Het
sous forme racémique ou leurs isomères optiques ou leurs mélanges de leurs
isomères
optiques, dans laquelle Het et R3 sont définis comme ci-dessus, soit par
deshydratation
thermique, par chauffage à une température voisine de 190°C (selon J.
Org. Chem.,
1971 p.3707) ou par chauffage au reflux du toluène en présence d'acide
p.toluènesulforuque, soit par déshydratation en milieu acide, notamment en
présence
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
27
d'acide chlorhydrique, dans un solvant tel que le THF, soit par action d'une
base
minérale telle que la soude à une température comprise entre 0 et 50°C.
Les acides de formule générale (IX) dans laquelle Het et R3 sont définis
comme ci-dessus, peuvent être obtenus par action des acides
hétéroarylpyruviques de
formule générale (X)
R3
COOH
Het
O (X)
dans laquelle Het et R3 sont définis comme précédemment, ou éventuellement des
esters correspondants, sur Ia méthylvinyicétone en opérant généralement en
milieu
hydro-alcoolique tel qu'un mélange méthanol-eau en présence d'une base
minérale telle
que la soude (selon J. Org. Chem., 1971, 3707).
Les acides hétéroarylpyruviques de formule générale (X) dans laquelle R3
représente un atome d'hydrogène peuvent être obtenus soit par hydrolyse des
acides a-
acétamidovinyliques correspondants de formule générale (XI)
H CH3
O
Het COOH
(XI)
dans laquelle Het est défini comme précédemment, par chauffage dans l' acide
chiorhydrique selon Org. Synth. 1943 p.519,
soit par hydrolyse des hydantoines correspondantes de formule générale {XII)
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
28
O
Het '~ \NH
N
'\H
O (XII)
dans laquelle Het est défini comme précédemment, par chauffage dans la soude à
20 %
selon Org. Synth. Coll. Vol. V p.627.
Les acides a-acétamidovinyliques de formule générale (XI) peuvent
être obtenus, à partir des aldéhydes correspondants de formule générale (XIII)
O
H
Het
(XIII)
dans laquelle Het est défini comme précédemment, selon Org. Synth. 1939 pl,
par
action de la N-acétylglycine au reflux de l'anhydride acétique en présence
d'acétate de
sodium. Les azlactones intermédiaires ainsi obtenues sont ensuite hydrolysées
en
acides a-acétarnidovinyliques correspondants par chauffage au reflux dans
l'acétone
aqueux.
Les hydantoines de formule générale (XII) peuvent être obtenues par
chauffage des aldéhydes correspondants de formule générale (XIII), selon Org.
Synth.
Coll. Vol V p.267, avec de l'hydantoine en présence d'une base orgaüique telle
que la
pipéridine à une température voisine de 130°C.
Les esters des acides hétéroarylpyruviques de formule générale (X) dans
laquelle R3 représente un radical alcoyle ou alcoylthio, peuvent être obtenus
par action
des acides carboxyliques correspondants de formule générale {XIV)
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98l02804
29
R3 OH
v,
Het O
(XIV)
dans laquelle Het est défini comme précédemment et R3 représente un radical
alcoyle
ou alcoylthio, sur l'oxalate d'alcoyle, tel que foxalate d'éthyle, en présence
d'une base
organique telle que le n-butyllithium, à une température voisine de -
70°C, suivie de
décarboxylation, en opérant dans les conditions décrites dans Tetrahedron
Lett., 1981,
2439-42.
Les produits de formule générale (III)
-G1 (III)
R3
dans laquelle Het, Ar, R3 et G1 sont dëfinis comme précédemment et R
représente un
radical
-CO-Z
dans lequel
Z représente un radical -OR4 ou -N (Rs) (R6)
peuvent être obtenus à partir d'un produit de formule générale (IV) dans
laquelle R
représente un radical carboxy par estérification et amidification dans les
conditions
décrites ci-dessus, suivie d'une cyclisation par action de l'acide
trifluorométhanesulfonique dans les conditions décrites ci-dessus.
Selon (invention, les produits de formule générale (I) dans laquelle Het, Ar,
Rl, R~, R3, X sant définis comme précédemment et R représente un radical
COOR.~
dans lequel R4 est défini comme précédemment peuvent être également obtenus à
CA 02315144 2000-06-13
PCT/FR98/02804
WO 99/33834
partir d'un produit de formule générale (V) dans laquelle Het, R3, R4 sont
définis
comme précédemment et G1 représente un atome d'hydrogène.
Selon l'invention, le produit de formule générale (V)
O
H
N-G1 (V)
R3~~~ COOR4
Het
5 dans laquelle G, représente un atome d'hydrogène est obtenu à partir du
produit de
formule générale (V) dans laquelle G1 représente un groupement protecteur de
la
fonction amino; dans les conditions décrites précédemment pour la préparation
d'un
produit de formule générale (III) dans laquelle G1 représente un atome
d'hydrogène à
partir du produit de formule générale (III) dans laquelle G1 représente un
groupement
10 protecteur de la fonction amino.
Le produit de formule générale (V) dans laquelle G1 représente un atome
d'hydrogène est transformé en produit de formule générale (XV):
O
H
~X
\\N
(XV)
O R
R3 " , COOR4
Het
15 dans laquelle Het, R~, R2, R3, R4 et X sont définis comme précédemment, en
opérant,
de la manière suivante
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
31
- les produits de formule générale (XV) peuvent être obtenus par action d'un
acide de
formule générale (II), ou de san chlorure, ou de son anhydride sur un produit
de
formule générale (V) dans laquelle G, représente un atome d'hydrogène en
opérant
dans les conditions décrites précédemment pour faction d'un produit de formule
S générale (II) sur un produit de formule générale (III) dans laquelle Gl
représente un
atome d'hydrogène,
Le produit de formule générale (XV) est transformé en produit de formule
générale (XVI):
H
~X
\\N
O Rl ~ (XVi)
COOR,~
Het
dans laquelie Het, Ar, Rl, R~, R3, R.~ et X sont définis comme précédemment,
par
action d'un dérivé métallique de formule générale Ar-Mg-X ou Ar-Lï dans
laquelle X
représente un atome d'halogène sur un produit de formule générale (XV) en
opérant
dans les conditions décrites précédemment pour faction d'un dérivé organo-
magnésien
ou organo-lithien de formule générale Ar-Mg-X ou Ar-Li sur un produit de
formule
générale (V).
Ix produit de formule générale (XVI) est transformé en produit de fornnzle
générale (I) dans laquelle Het, Ar, R,, R2, R3, R4 et X sont définis comme
précédemment, par action de (acide trifluorométhanesulfonique, ou d'un acide
de
Lewis, sur le produit de formule générale (XVI) en opérant dans les conditions
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
32
décrites précédemment pour faction de (acide trifluorométhanesulfonique, ou
d'un
acide de Lewis, sur un produit de formule générale (IV).
L'action d'un hydrocarbure aromatique ou d'un hétérocycle aromatique
Ar-H, tel que défini précédemment, en présence d'acide
trifluorométhanesulfonique ou
d'un acide de L.ewis, sur un produit de formule générale (XV) dans laquelle
Het, Rl,
Ri, R3, R.,, et X sont définis comme précédemment, conduit à un produit de
formule
générale {I) dans laquelle Ar est défini comme précédemment et R représente un
radical -COOR., dans lequel R4 représente un radical alcoyle de 1 à 4 atomes
de
carbone.
Les mélanges réactionnels obtenus par les divers procédés décrits précédemment
sont
traités suivant des méthodes classiques physiques (évaporation, extraction,
distillation,
chromatographie, cristallisation par exemple) ou chimiques (formation de sels
par
exemple).
Les composés de formule (I) peuvent être éventuellement transformés en sels
d'addition avec un acide minéral ou organique par action d'un tel acide au
sein d'un
solvant organique tel qu'un alcool, une cétone, un éther ou un solvant chloré.
Ces sels
font également partie de l'invention.
Les isomères optiques des produits de formule générale (I) peuvent être
obtenus selon les méthodes habituelles de séparation à partir du produit
racémique
correspondant. Il est particulièrement avantageux d'effectuer la séparation
par
chromatographie en phase liquide à haute performance en utilisant une phase
stationnaire chirale de type Pirkle modifiée en éluant avec un solvant
convenable.
Comme phase stationnaire chirale peut être utilisée de préférence une phase
dont le sélecteur chiral, qui est de préférence la 3,5-dinitro-phénylalanine,
est éloigné
de la silice par un bras anlinoalcoyle contenant 3 à 14 atomes de carbone fixé
sur les
fonctions amines d'une silice arninopropyle et dont les fonctions sillanols
libres sont
bloquées par des radicaux trialcoylsilyles.
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
33
Cette phase chirale peut être définie par la structure suivante
O-Si(R')3
4 /(CHi)~- NHCO --(CHZ)nNHCO-CH~N-G3
Si, I H
p O-Si(R")3 Ha
O-Si(R") 3 CsHs
dans laquelle les symboles R', identiques ou différents, et R", identiques ou
différents,
représentent des radicaux alcoyles contenant 1 à IO atomes de carbone, G3
représente
un groupe éiectro-attracteur et n représente un nombre entier compris entre 3
et 13
0
inclusivement, dont la porosité est voisine de 100 A
La phase chirale peut être préparée par action sur une silice aminopropyle de
(anhydride d'un acide aminoalcanoïque contenant 4 à 14 atomes de carbone dont
la
fonction amine est protégée par un groupement protecteur tel que le radical
tert-
butoxycarbonyle, suivie du blocage d'une partie des fonctions silanols par des
radicaux
Si(R')3 tels que définis précédemment, puis, après élimination des groupements
protecteurs de la fonction amine, de fanûdification au moyen d'un aminoacide
de
formule générale
H
HO-CO-~-NH-G3
çHa
C6H5
dans laquelle G3 est défini comme précédemment, et enfin blocage des fonctions
silanols résiduelles par des radicaux Si(R")3 tels que définis précédemment.
Généralement, faction de l'anhydride d'un acide aminoalcanoïque protégé sur
la silice aminopropyle est effectuée en opérant dans un solvant organique
anhydre tel
que le diméthylformamide à une température voisine de 20°C.
Le blocage des fonctions silanols par des groupements -Si(R'3) tels que
définis
précédemment est effectuée par action d'un halogénotrialkylsilane sur la
silice
CA 02315144 2000-06-13
WO 99!33834 PCTIFR98/02804
34
aminopropyle greffée par des restes aminoalcanoyles en opérant dans un solvant
organique tel que le chlorure de méthylène en présence d'un agent basique tel
que la
PYri~e.
L'élimination des groupements protecteurs des restes aminoalcanoyles
s'effectue généralement, lorsque le groupement protecteur est un radical tert-
butoxycarbonyle, par action de (acide trifiuoroacétique dans un solvant
organique tel
que le chlorure de méthylène.
L'amidification au moyen de phénylalanine dont la fonction amine est
protégée est effectuée en présence d'un agent de condensation tel que la
N-éthoxycarbonyl-2-éthoxy-1,2-dihydro-quinoléine en opérant dans un solvant
organique anhydre tel que le diméthylformamide.
Le blocage des fonctions silanols résiduelles par des radicaux -Si(R")3 tels
que définis précédemment est généralement effectué au moyen de triallcylsilyl-
imidazole en opérant dans un solvant organique tel que le chlorure de
méthylène.
La silice aminopropyle peut être préparée par action de faminopropyl-
triéthoxysilane sur une silice dont la porosité est voisine de 100 t~ en
opérant en
présence d'imidazole dans un solvant organique anhydre tel qu'un hydrocarbure
aromatique comme le toluène.
Comme le montrent les exemples ci-après, les nouveaux produits de formule
générale (I), qui inhibent la farnésyle transfërase et/ou la farnésylation de
Ia protéine
Ras, présentent des propriétés antiturnorales et antileucémiques remarquables.
La présente invention a également pour objet toute composition
pharmaceutique contenant au moins un produit de formule générale en
association
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
avec un ou plusieurs diluants ou adjuvants pharmaceutiquement acceptables
qu'ils
soient inertes ou biologiquement actifs.
Les nouveaux produits de formule générale (I) peuvent se présenter sous forme
de sels
non toxiques et pharmaceutiquement acceptables. Ces sels non toxiques
comprennent
5 les sels avec les acides minéraux (acides chlorhydrique, sulfurique,
bromhydrique,
phosphorique, nitrique) ou organiques (acétique, propionique, succinique,
maléfique,
hydroxymaléique, benzoïque, fumarique, méthanesuifonique, trifluoroacétique ou
oxalique) ou avec les bases minérales (soude, potasse, lithine, chaux) ou
organiques
(amines tertiaires comme la triéthylamine, la pipéridine, la benzylamine)
selon la nature
10 des composés de formule générale (I) .
La présente invention concerne également (utilisation des composés de formule
générale (I) selon (invention pour la préparation de compositions
pharmaceutiques
utiles pour inhiber la farnésyle transférase, et plus particulièrement pour
inhiber la
15 farnésylation de l'oncogène ras.
Notamment, la présente invention concerne (utilisation des composés de formule
générale (I) selon (invention pour la préparation de compositions
pharmaceutiques
utiles pour le traitement des maladies liées à des proliférations cellulaires
par inhibition
de la farnésyle transférase et en particulier pour le traitement des maladies
liées à des
20 proliférations cellulaires, surexprimant l'une quelconque des oncoprotéines
H-Ras, N-
Ras ou K-Ras, ou présentant une mutation de fun quelconque des oncogènes ras
correspondants.
L'invention concerne en particulier (utilisation des composés de formule
générale (I)
25 selon (invention pour la préparation de compositions pharmaceutiques utiles
pour le
traitement des maladies liées à des proliférations cellulaires, malignes ou
bénignes, des
cellules de divers tissus et/ou organes, comprenant les tissus musculaires,
osseux ou
conjonctifs, la peau, le cerveau, les poumons, les organes sexuels, les
systèmes
lymphatiques ou rénaux, les cellules mammaires ou sanguines, le foie,
(appareil
30 digestif, le colon, le pancréas et les glandes thyroïdes ou adrénales,
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
36
et incluant les pathologies suivantes : le psoriasis, la restënose, les
tumeurs solides, le
sarcome de Kaposi, les carcinomes, le cholangiocarcinome, le choriocarcinome,
le
neuroblastome, la tumeur de Wilms, la maladie de Hodgkin, les mélanomes, les
tératocarcinomes, les gliomes, les myélomes multiples, les leucémies
lymphocytaires
chroniques, les lymphomes granulocytaires aigus ou chroniques, et
les cancers tels que les cancers du pancréas, du colon, du poumon, de (ovaire,
du sein,
du cerveau, de la prostate, du foie, de l'estomac, de la vessie ou des
testicules.
L'invention concerne tout particulièrement l'utilisation des composés de
formule
générale (I) selon (invention pour la préparation de compositions
pharmaceutiques
utiles pour le traitement des cancers tels que les cancers du pancréas, du
colon, du
poumon, de (ovaire, du sein, du cerveau, de la prostate, du foie, de (estomac,
de la
vessie ou des testicules, et plus avantageusement le cancer du colon et du
pancréas, en
particulier du colon.
Les composés selon (invention peuvent également être utiles pour la
préparation de
médicaments pour le traitement et/ou la prévention des conditions
pathologiques liées
aux voies de signalisations cellulaires, associëes à la farnésyle transférase,
ou à leurs
conséquences ou symptômes.
Avantageusement, les composés selon la présente invention peuvent être
utilisés pour
pour la préparation de médicaments pour le traitement et/ou la prévention de
maladies
associées aux voies de signalisations cellulaires liées à Ras. Ainsi, les
composés selon
(invention peuvent être utilisés pour la préparation de médicaments dans le
traitement
et/ou la prévention des rejets de greffes (telles que les allogreffes)
(O'Donnel et al,
1995, Kidney International, vo1.48, supp1.52, p.S.29-33).
Egalernent, les composés selon (invention peuvent être utiles pour la
préparation de
médicaments pour inhiber fangiagénèse et agir sur la croissance tumorale
(J.Rak et al.,
Cancer research, 55, 4575-4580, 1995), ces propriétés anti-angiogénèse pouvant
être
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
37
également utiles pour le traitement de certaines formes de cécité liées à la
vascularisation rétinienne;
Les composés selon (invention peuvent également être utiles pour la
préparation de
médicaments pour le traitement et/ou la prévention
-de maladies liées à un dysfonctionnement (pro- ou anti-) apoptotique
comprenant en
particulier les cancers précédemment cités;
-de (hépatite delta et des virus associés (J.S.Glenn et al., Science, 25b,
1331-1333,
1992), ainsi que, et de façon non limitative, les virus Herpès, Pox, Epstein-
Barr,
Sindbis, et adeno;
-des maladies inflammatoires et/ou auto-immunes, telles que à titre
illustratif, les
polyarthrites, les rhumatismes polyarticulaires, Ies inflammations
intestinales, les
oedèmes pulmonaires, les infarctus du myocarde, les fibroses, les lupus
érythemateux,
tels que la maladie de Kaposi , les immuno-glomérulonéphrites, les diabètes
auto-
immuns;
-des maladies cardiovasculaires (artériosclérose ou autres lésions
artérielles), la
resténose après angioplastie ou chirurgie vasculaire;
-des maladies osseuses, de la régulation du métabolisme osseux, par exemple la
maladie de Paget, fhypercalcémie, les métastases osseuses, l'ostéoporose;
-des maladies associées à un niveau de cholesterol elevé, telles
(hypercholestérolémie,
fhyperlipidémie, fhyperpoprotéinémie, fhyperlipidémie néphrotique, ou
fathérosclérose (Massy et al, Lancet, 347, 102-103, 1996);
-des désordres neurodégénératifs, tels que la maladie de Parkinson,
d'Alzheimer, la
sclérose latérale amyotrophique, Ies troubles neurologiques associés aux
maladies
virales telles que le sida, les rétinites, les atrophies ou dégénérescences
spino-
cérébelleuses;
et pour la prévention et/ou le traitement des maladies suivantes : le SIDA en
particulier
ou également, le rein polykystique (D.L.Schaffner et al., American Journal of
Pathology, 142, 1051-1060, 1993), les neurofibromatoses, les fibroses
pulmonaires,
les arthrites, le psoriasis, les glomérulonéphrites, les formations de
cicatrices
hypertrophiques, les chocs endotoxiques;
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
38
ainsi que les syndrômes myéliodysplastiques, l'anémie aplastique, les lésions
ischémiques associées aux infarctus, les lésions associées aux accidents
vasculaires
cérébraux et , les arrhytmies, les athéroscléroses, les maladies du foie dues
à des
toxines ou (alcool, les maladies hématologiques, incluant notamment (anémie
chronique ou aplastique, les maladies dégénératives du système muscle-
squelette,
incluant notamment (ostéoporose et (arthrite, les fibroses kystiques, les
scléroses
multiples, les maladies du foie, les douleurs liées au cancer et les
rhinosinusites
sensibles à (aspirine'.
Le dit traitement peut être notamment effectué par inhibition de la croissance
tumorale, notamment par inhibition de la farnésyle transférase, ou encore par
inhibition
de la croissance de tumeurs exprimant foncogène ras activé.
Un autre objet de la présente invention est toute association d'un produit de
formule
générale (I) avec un ou plusieurs composés compatibles et pharmacologiquement
actifs et/ou un traitement radiothérapique; notamment pour administration de
façon
simultanée, séparée ou étalée dans le temps ; lesdits composés étant
préférentiellement
des principes actifs connus pour leur activité inhibitrice de la prolifération
cellulaire et
particulièrement pour leur activité dans le traitement du cancer; ils peuvent
être
préférentiellement des composés antiprolifératifs agissant à fun quelconque
des stades
de la voie de signalisation de foncogène ras comme un inhibiteur de tyrosine
kinase,
ou un autre inhibiteur de farnésyle transférase, ou un inhibiteur de HMG-Co-
réductase, ou les composés cytotoxiques utilisés habituellement dans le
traitement du
cancer;
Notamment, les autres traitements et/ou produits thërapeutiques pouvant être
utilisés
en association avec les produits de formule générale {I) peuvent être choisis
parmi des
médicaments antinéoplastiques , des anticorps monoclonaux, des thérapies
immunologiques ou des radiothérapies au des modificateurs des réponses
biologiques.
Les modificateurs des réponses incluent, de manière non limitative, les
lymphokines et
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98l02804
39
les cytokines telles que les interleukines, les interférons (a, (3 ou b) et le
TNF.
D'autres agents chimiothérapeutiques utiles dans le traitement des désordres
dus à la
prolifération anormale des cellules incluent, de manière non limitative, les
agents
alkylants tels que les moutardes à (azote comme la mechloretamirle, le
cyclophosphamide, le melphalan et le chlorambucil, des sulfonates d'alkyle
comme le
busulfan, les nitrosourées comme la carmustine, la lomustine, la sémustirte et
la
streptozocine, les triazènes comme la dacarbazine, les antimétabolites comme
les
analogues de (acide folique tel que le méthotrexate, les analogues de
pyrimidine
comme le fluorouracil et la cytarabine, des analogues de purines comme la
mercaptopurine et la thioguanine, des produits naturels tels que les
alcaloïdes de vinca
comme la vinblastine, la vincristine et la vendésine, des dérivés des
taxoides, des
inhibiteurs de topoisornérase tels que les dérivés de la camptothécine, des
épipodophyllotoxines comme fétoposide et le teniposide, des antibiotiques
comme la
dactinomycine, la daunorubicine, la doxorubicine, la bléomycine, la
plicamycine et la
mitomycine, des enzymes conune la L-asparaginase, des agents divers comme les
complexes de coordination du platine tel que le cisplatine, les urées
substituées telles
que fhydroxyurée, Ies dérivés de méthylhydrazine comme la procarbazine, les
suppresseurs adrénocoticoïques comme le mitotane et faminoglutéthymide, les
hormones et les antagonistes comme les adrénocorticostéroïdes comme la
prednisone,
'?0 les progestines comme le caproate d'hydroxyprogestérone, (acétate de
méthoxyprogestérone et (acétate de megestrol, les oestrogènes comme le
diéthylstilbestrol et féthynylestradiol, les antioestrogènes conome le
tamoxifène, les
androgènes comme le propionate de testostérone et la fluoxymesterone.
Les produits selon (invention peuvent être utilisés pour prévenir ou retarder
(apparition ou la réapparition des conditions pathologiques ou pour traiter
ces
conditions pathologiques.
Les produits selon (invention peuvent être administrés par voie orale,
parentérale ou
ou intrapéritonéale ou rectale, de préférence par voie orale.
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
Les compositions pour administration orale comprennent des comprimés, des
pilules,
des poudres ou des granulés. Dans ces compositions le produit actif selon
(invention
est mélangé à un ou plusieurs diluants inertes tels que saccharose, lactose ou
amidon.
Ces compositions peuvent comprendre des substances autres que les diluants,
par
5 exemple un lubrifiant tel que le stéarate de magnésium.
Comme compositions liquides pour administration orale peuvent être utilisées
des
émulsions pharmaceutiquement acceptables, des solutions, des suspensions, des
sirops,
des élixirs contenant des diluants inertes tel que Peau ou (huile de
paraffine. Ces
compositions peuvent également comprendre des substances autres que les
diluants,
10 par exemple des produits mouillants, édulcorants ou aromatisants.
Les compositions selon (invention pour administration parentérale peuvent être
des
solutions stériles aqueuses ou non aqueuses, des suspensions ou des émulsions.
Comme solvant ou véhicule, on peut employer le propylèneglycol, un
polyéthylèneglycol, des huiles vëgétales, en particulier (huile d'olive ou des
esters
15 organiques injectables par exemple foléate d'éthyle. Ces compositions
peuvent
également contenir des adjuvants, en particulier des agents mouillants,
émulsifiants et
dispersants. La stérilisation peut se faire de plusieurs façons, par exemple à
(aide d'un
filtre bactériologique, en incorporant à la composition des agents
stérilisants ou par
chauffage. Elles peuvent être également préparées sous forme de compositions
solides
20 stériles qui peuvent être dissoutes au moment de l'emploi dans de Peau
stérile ou tout
autre milieu stérile injectable.
Les compositions pour administration rectale sont des suppositoires qui
peuvent
contenir, outre le produit actif, des excipients tels que le beurre de cacao.
Les doses utilisées pour mettre en oeuvre les méthodes selon (invention sont
celles qui
25 permettent un traitement prophylactique ou un maximum de réponse
thérapeutique.
Les doses varient selon la forme d'administration, le produit particulier
sélectionné et
les caractéristiques propres du sujet à traiter. En général, les doses sont
celles qui sont
thérapeutiquement efficaces pour le traitement des désordres dus à une
prolifération
cellulaire anormale, et notamment un traitement cytostatique. Les produits
selon
CA 02315144 2000-06-13
WO 99133834 PCTIFR98102804
41
(invention peuvent être administrés aussi souvent et aussi longtemps que
nécessaire
pour obtenir (effet thérapeutique désiré.
Généralement, les doses sont comprises, chez fhomrne, entre 0,1 et 10000 mg/kg
par
jôur, préférentiellement comprises entre 100 et 2000 mg/kg par jour, de
préférence par
voie orale. Il est entendu que, pour choisir 1e dosage le plus approprié,
devront être
pris en compte la voie d'administration, le poids du malade, son état de santé
général,
son âge et tous les facteurs qui peuvent influer sur l'efficacité du
traitement.
D'une façon générale, le médecin déterminera ia posologie appropriée en
fonction de
l'âge, du poids et de tous les autres facteurs propres au sujet à traiter.
L'exemple C illustre des compositions selon (invention.
Les exemples suivants sont présentés à titre illustratif et non limitatif de
la
présente invention.
EXEMPLE la
Préparation du 4 8-éthano-2-[2-(2-méthoxmhényl)~ropènovll-8-phénol-
2.3.3a,4.8.8a-
hexahydro-1H-thiéno[2 3-flisoindole-3a-carboxvlate de méthyle-
(3aRS.4SR.8SR,8aRS)
Etape A
On chauffe, à 100°C pendant une heure, une solution de 45,77 g (0,4
mol) de
thiophène-3-carboxaidéhyde et 33>43 g (0,28 mol) de N-acétylglycine dans 75
cm3
d'anhydride acétique contenant 16,8 g (0,28 mol) d'acétate de sodium sec, dans
les
conditions décrites par Org. Synth., II, 1-3, puis on laisse refroidir la nuit
à une
température voisine de 0°C. Les cristaux formés sont filtrés, on
obtient alors 42,8 g
de cristaux beiges qui sont portés au reflux pendant quatre heures dans 150
cm3
d' eau et 400 cm3 d' acétone. Après refroidissement, les solvants sont
évaporés sous
pression réduite, et le résidu est purifié par recristallisation dans 350 cm3
d'eau. On
obtient ainsi 33,79 g (39%) d'acide 1-acétylamino-3-(3-thiényl)-propèn-2-
nique, sous
forme de fins cristaux jaunes dont la caractéristiqile est la suivante:
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
42
- point de fusion = 228°C
Etape B
On chauffe, au reflux pendant quatre heures, 33,78 g (89 mmol) d'acide 1-
acétylamino-3-(3-thiényl)-propèn-2-nique dans 360 cm3 d'une solution aqueuse
normale d' acide chlorhydrique, dans les conditions décrites dans Org. Synth,
II, 519-
20. Après trois heures de chauffage, des cristaux se forment et sont filtrés
après
refroidissement à 0°C. On obtient ainsi 22,4 g (99%) d'acide (3-
thiényl)pyruvique,
sous forme de fins cristaux blancs dont les caractéristiques sont les
suivantes:
- point de fusion = 203-4°C
- spectre de masse (IE) : M/Z = I70 (M+).
Etape C
A une solution, refroidie à 0°C, de 22,4 g (13 mmol) d'acide (3-
thiényl)pyruvique dans 150 cm3 de méthanol, on ajoute successivement 17,1 cm3
(21
mmol) de méthylvinylcétone et 7,2 g (18 mmol) d'hydroxyde de sodium en
pastille,
puis on agite à une température voisine de 20°C pendant deux heures.
Après
neutralisation avec 60 cm3 d'une solution aqueuse 3N d'acide chlorhydrique, le
précipité formé est essoré, lavé à l'eau, puis séché à 20°C. On obtient
ainsi 21,85 g
(70%) d'acide 6-(3-thiényl)-3-oxo-cyclohexan-1-ol-1-carboxylique, sous forme
d'une poudre jaune dont les caractéristiques sont les suivantes
- point de fusion = 204°C
- spectre de R.M.N. 1H (300 MHz, (CD3)~SO d6 avec ajout de quelques gouttes de
CD3COOD d4, d en ppm) : de 2,20 à 2,80 (mt, 4H : CHzCH~) ; 2,34 et 3,00 (2 d,
J =
14 Hz, 1H chacun : COCHZ) ; 3,66 (dd, J = 12,5 et 3 Hz,lH : ArCH) ; 7,06 (d, J
=
5Hz, 1H : H en 4 du thiényle) ; 7,24 (d large, J = 3 Hz, 1H : H en 2 du
thiényle) ; 7,36
(dd, J = 5 et 3 Hz, 1H : H en 5 du thiényle).
Etape D
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98102804
43
21,84 g (9,1 mmol) d'acide 6-(3-thiényl)-3-oxo-cyclohexan-1-ol-1-
carboxylique sont chauffés à reflux, pendant trois heures, dans 220 cm3 de
toluène en
présence de 2,2 g d'acide para toluène sulfonique. Le mélange réactionnel est
ensuite
refroidi à 5° et le précipité formé est filtré, lavé à l'éther
isopropylique puis séché à
50°C. On obtient ainsi 18,47 g (91°0) d'un mélange contenant
majoritairement de
l'acide 6-(3-thiényl)-3-oxo-cyclohexène-1-carboxylique-(RS), sous forme d'un
solide
brun, utilisé tel quel à l'étape suivante, dont les caractéristiques sont les
suivantes
- spectre de masse (IE) : M/Z = 222 (M+)
Etape E
A une solution de 18,45 g (8,3 mmol) d'acide 6-(3-thiényl)-3-oxo-
cyclohexène-1-carboxylique-(RS), dans 250 cm3 d'acétone sec, on ajoute
successivement 7,5 cm3 (12 mmol) d'iodure de méthyle et 16,8 cm3 (11,2 mol) de
1,8-diazabicyclo[5.4.0]undéc-7-ène goutte à goutte, puis on porte au reflux
pendant
deux heures trente minutes. Après filtration à chaud d'un insoluble et
concentration
des solvants sous pression réduite, le résidu est purifié par flash-
chromatographie sur
gel de silice (230-400 Mesh), en éluant au dichlorométhane. On obtient ainsi
14,84 g
(76 %) de 6-(2-thiényl)-3-oxo-cyclohexène-1-carboxylate de méthyle-(RS), sous
forme d'une poudre jaune dont les caractéristiques sont les suivantes
- point de fusion = 69°C
- spectre de masse (IE) : M/Z = 236 (M+)
- spectre de R.M.N. 1 H (250 MHz, CDC13, d en pprn) : de 2,05 à 2,55 (mt, 4H
CH2CH2) ; 3,77 (s, 3H : COOCH3) ; 4,33 (mt, 1H : ArCH) ; 6,85 (s, 1H : =CH) ;
6,91 (dd, J = 2,5 et 2 Hz, 1H : H en 2 du thiényle) ; 6,99 (dd, J = 5 et 2 Hz,
1H : H
en 4 du thiényle) ; 7,34 (dd, J = 5 et 2,5 Hz, 1H : H en 5 du thiényle).
Etape F
Une solution de 9,15 g (3,9 mmol) de 6-(3-thiényl)-3-oxo-cyclohexène-1-
carboxylate de méthyle-(RS) et de 3,56 cm3 (4,6 mmol) d'acide
trifluoroacétique dans
100 cm3 de dichlorométhane est portée au reflux. On ajoute alors, goutte à
goutte,
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98102804
44
16,9 g (6 mmol) de N-n.butoxyméthyl-N-triméthylsilylméthyl-benzylamine, qui
peut
être obtenue selon Chem. Pharm. Bull., 1985, 276, et on porte au reflux
pendant une
heure trente minutes. Le milieu réactionnel est ensuite agité à température
ambiante
pendant trois heures supplémentaires. Après agitation pendant une heure avec
environ
25 g de carbonate de potassium, la phase organique est concentrée et l'huile
jaune
obtenue est purifiée par chromatographie sur gel de silice (230-400 Mesh), en
éluant
avec un mélange dichlorométhane-acétate d'éthyle (99-1 en volumes). On obtient
ainsi
10,25 g (71%) de 2-benzyl-4-(3-thiényl)-7-oxo-octahydroisoindole-3a-
carboxylate de
méthyle-(3aRS,4SR,7aRS), sous forme d'un solide beige qui fond vers 35-
40°C, dont
les caractéristiques sont les suivantes
-spectre de masse (IE) : M/Z = 369 (M+)
- spectre de R.M.N. 1H (300 MHz, CDC13, d en ppm) ; 2,10 et de 2,45 à 2,705 (2
mts,
respectivement 1H et 3H : CH~CH2) ; 2,70 et 2,90 (2 d, J = 9,5 Hz, iH chacun :
CHI
en 3) ; 2,85 et 3,08 (respectivement t et dd, J = 9.5 Hz et J = 9.5 et 5,5 Hz,
1H chacun
: CHI en 1) ; 3,34 (dd, J = 9.5 et 5,5 Hz, 1H : CH en 7a) ; de 3.30 à 3,40
(mt, 1H : CH
en 4) ; 3,49 (s, 3H : COOCH3) ; 3,58 et 3,70 (2 d, J = 13,5 Hz, 1H chacun :
NCH2Ar)
6,78 (dd, J = 5 et 1.5 Hz, 1H : H en 4 du thiényle) ; 6,89 (dd, J = 3 et 1.5
Hz, 1H : H
en 2 du thiényle) ; 7,22 (dd, J = 5 et 3 Hz, 1H : H en 5 du thiényle) ; de
7,20 à 7,40
(mt, 5H : H aromatiques du benzyle).
Etape G
A 7 cm3 d'une solution 3M de bromure de phénylmagnésium dans l'oxyde de
diéthyle, on ajoute 20 cm3 de toluène et on évapore l'oxyde de diéthyle sous
pression
réduite. Après refroidissement à 5°C, on ajoute, goutte à goutte, une
solution de 2,58
g (7 mmol) de 2-benzyl-4-(3-thiényl)-7-oxo-octahydroisoindole-3a-carboxylate
de
~5 méthyle-(3aRS,4SR,7aRS) dans 10 cm3 de toluène et on agite vingt heures à
température ambiante. Après refroidissement à 0°C, on hydrolyse par
addition de 50
cm3 d'une solution aqueuse saturée de chlorure d'ammonium. La phase organique
est
décantée, lavée successivement par 10 cm3 d'une solution aqueuse saturée de
chlorure
d'ammonium puis par deux fois 10 cm3 d'eau, séchée sur sulfate de sodium et
concentrée sous pression réduite. Le résidu est purifié par flash-
chromatographie sur
CA 02315144 2000-06-13
WO 99!33834 PCTIFR98/02804
gel de silice (230-400 Mesh) en éluant par un mélange cyclohexane-acétate
d'éthyle
(80-20 en volumes), on obtient ainsi 1,28 g {52%) de 2-benzyl-7-hydroxy-7-
phényl-4-
{3-thiényl)-octahydroisoindole-3a-carboxylate de méthyle-(3aRS,4SR,7RS,7aRS),
sous forme d'une poudre jaune, dont les caractéristiques sont les suivantes
5 - point de fusion =120°C
-spectre de masse (IE) : M/Z = 447 (M+)
Etape H
A une solution de 0,72 g (1,6 mmol) de 2-benzyl-7-hydroxy-7-phényl-4-(3-
thiényl)-octahydroisoindole-3a-carboxylate de méthyle-{3aRS,4SR,7RS,7aRS) dans
8
10 cm3 de dichlorométhane, on ajoute 0,8 cm3 (10,4 mmol) d'acide
trifluorométhanesulfonique. Après quatre heures d'agitation à tempêrature
ambiante,
le milieu réactionnel est refroidi à 5°C , dilué avec 100 cm3 de
dichlorométhane et on
coule 5 cm3 d'une solution aqueuse saturêe de carbonate de potassium. La phase
organique est décantée, lavée à l'eau, séchée sur sulfate de sodium, puis
agitée quinze
15 minutes en présence de 10 g de gel de silice (230-400 Mesh). Après
concentration du
solvant sous pression réduite, on obtient ainsi 680 mg (94%) de 2-benzyl-4,8-
éthano-
' 8-phényl-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylate de
méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une poudre jaune-pàle dont les
caractéristiques sont les suivantes
20 - point de fusion = 80°C
- spectre de R.M.N. 1H (400 MHz, CDC13, d en ppm) : 1,38 - 1,62 - 2,43 et 2,57
(4
mts,lH chacun : CH2CH2) ; 2,27 et 2,72 (respectivement t et d large, J = 9 Hz,
1H
chacun : CH2 en 1) ; 2,27 et 3,14 (2 d, J = 10 Hz, 1H chacun : CHZ en 3) ;
3,20 (d
large, J = 9 Hz, 1H : CH en 8a) ; 3,38 et 3,67 (2 d, J = 13 Hz, 1H chacun :
NCH2Ar) ;
25 3,59 (s, 3H : COOCH3) ; 3,64 (mt, 1H : CH en 4) ; 6,88 (d, J = 5 Hz, 1H : H
en 5) ;
6,94 (d, J = 5 Hz, 1H : H en 6) ; de 7,20 à 7,65 (mt, lOH : H aromatiques du
benzyle
et H aromatiques du phényle).
Etape I
On agite, pendant vingt heures à température ambiante, 645 mg (1,5 mmol) de
30 2-benzyl-4,8-éthano-8-phényl-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-
f]isoindole-3a-
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/OZ804
46
carboxylate de méthyle-(3aRS,4SR,8SR,8aRS) et 0,2 cm3 (3 mmol) de
chloroformiate
de vinyle dans 10 cm3 de dichlorométhane. Après évaporation du
dichlorométhane, le
résidu est agité, pendant deux heures au reflux dans 7 cm3 de méthanol et 3
cm3 d'une
solution 5N de gaz chlorhydrique dans l'isopropanol. Après concentration du
solvant
sous pression réduite, on ajoute 20 cm3 d'une solution aqueuse saturée de
carbonate
de sodium et on extrait trois fois par 20 cm3 de dichlorométhane. Les phases
organiques jointes sont lavées à l'eau, séchées sur sulfate de magnésium et
concentrées
. sous pression réduite, on obtient alors 460 mg (90%) de 4,8-éthano-8-phényl-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS), impur utilisé tel quel à l'étape suivante, sous forme
d'une
huile brune dont les caractéristiques sont les suivantes
-spectre de masse (IE) : M/Z = 339 (M+)
Etape J
A une solution de 1,01 g (3 mmol) de 4,8-éthano-8-phényl-2,3,3a,4,8,8a-
hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS) dans 30 cm3 de dichlorométhane, on ajoute successivement
710 mg (4 mmol) d'acide 2-(2-méthoxyphényl)propènoique, 770 mg (4 mmol) de
chlorhydrate de 1-éthyl-3-[(3-diméthylamino)propyl]carbodümide et 50 mg (0,4
mmol) d'hydrate de N-hydroxybenzotriazole. Après une nuit d'agitation à
température ambiante, on ajoute 15 cm3 de dichlorométhane, on lave avec deux
fois
15 cm3 d'eau, on sèche sur sulfate de magnésium et on évapore le solvant sous
pression réduite. Après purification par flash-chromatographie sur gel de
silice (230-
400 Mesh) en éluant par un mélange cyclohexane-acëtate d'éthyle (80-20 en
volumes), on obtient, après concentration du solvant sous pression réduite,
550 mg
(40%) de 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-phényl-2,3,3a,4,8,8a-
hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxyiate de méthyle-
(3aRS,4SR,8SR,8aRS), sous forme d'une poudre blanche dont les caractéristiques
sont les suivantes
- point de fusion = I71°C
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
47
-spectre de masse (IE) : M!Z = 499 (M+)
EXEMPLE lb
Préparation de l'acide 4.8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-phényl-
2.3,3a,4,8,8a-hexahydro-lH-thiénof2,3-flisoindole-3a-carboxylique-
(3aRS,4SR.8SR.8aRS)
380 mg (0,66 mmol) de 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl-
8-phényl-2,3,3a,4,8,8a-hexahydro-IH-thiéno[2,3-f]isoindole-3a-carboxylate de
méthyle-(3aRS,4SR,8SR,8aRS) sont chauffés à reflux, pendant quatre heures,
dans 30
cm3 d'éthanol en présence de 30 cm3 d'une solution aqueuse décinormale
d' hydroxyde de sodium. Le mélange réactionnel est ensuite concentré sous
pression
réduite et le résidu dissout dans 25 cm3 d'eau distillée. La phase aqueuse est
lavée
par trois fois 10 cm3 d'oxyde de diéthyle puis acidifiée par une solution
aqueuse
normale d' acide chlorhydrique jusqu' à un pH voisin de 2 en présence de 20
cm3
d' acétate d'éthyle. La phase organique est lavée à l'eau, séchée sur sulfate
de sodium
et concentrée sous pression réduite. Le résidu est purifié par
recristallisation dans 10
cm3 d'éthanol aqueux à 50%. On obtient ainsi 160 mg (50%) d'acide 4,8-éthano-2-
[2-(2-méthoxyphényl)propènoyl]-8-phényl-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-
f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS), sous forme de solide blanc
dont
les caractéristiques sont les suivantes
point de fusion = I75°C
- spectre de R.M.N. I H (250 MHz, (CD3)~SO d6, à une température de 393 K, d
en
ppm) : 1,36 - 1,55 - et de 2,00 à 2,20 (3 mts, respectivement 1H - 1H et 2H
CH~CH~) ; de 3,20 à 3,50 (mt, 3H : CHI en 1 et CH en 8a) ; 3,53 et 4,03
(respectivement d et d large, J = 12,5 Hz, 1H chacun : CHI en 3) ; 3,68 (s
large, 1H
CH en 4) ; 3,74 (s, 3H : ArOCH3) ; 5,56 et 5,69 (2 s, 1H chacun : =CHI) ; de
6,90 à
7,55 (mt, 11H : H aromatiques du phényle - H aromatiques du 2-méthoxyphényle -
H
enSetHen6).
EXEMPLE 2
CA 02315144 2000-06-13
WO 99133834 PCT/FR98I02804
48
PréRaration de l'acide 4 8-éthano-2-f 2-(2-méthoxyphényi)pronènoyll-8-(4-
méthylphényl)-2 3 3a 4 8 8a-hexahydro-1H-thiénof 2.3-flisoindole-3a-
carboxyligue-
t3aRS,4SR.8SR.8aRS)
Etape A
Une solution de 5,78 g (16 mmol) de 2-benzyl-4-(3-thiényl)-7-oxo-
octahydroisoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS), obtenus à
l'étape F
de l'exemple 1, et de 3,13 g (63 mmol) d'hydrate d'hydrazine dans 50 cm3 de
méthanol est portée au reflux pendant deux heures. Après concentration du
méthanol
sous pression réduite, le résidu est repris avec 200 cm3 de dichlorométhane,
lavé avec
quatre fais 10 cm3 d'eau distillée, séché sur sulfate de magnésium et
concentré sous
pression réduite. On obtient ainsi 5,72 g {93%) de 2-benzyl-7-hydrazono-4-(3-
thiényl)-octahydro-isoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS), sous
forme
d'une huile jaune, impure utilisée telle quelle à l'étape suivante, dant ies
caractéristiques sont les suivantes
-spectre de masse (iE) : M/Z = 383 (M+)
Etape B
A une solution de 5,72 g (15 mmol) de 2-benzyl-7-hydrazono-4-(3-thiényl)-
octahydro-isoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS) dans 200 cm3 de
tétrahydrofurane, on ajoute goutte à goutte une solution de 7,58 g (30 mmol)
d'iode
dans 100 cm3 de tétrahydrofurane et 6,27 cm3 (45 mmol) de triéthylamine, la
température du milieu réactionnel atteint 28-30°C. On maintient
l'agitation pendant
deux heures en laissant la température revenir vers 20°C. Après
addition de 200 cm3
d'acétate d'éthyle, les phases organiques sont lavées avec deux fois 100 cm3
d'une
solution aqueuse saturée en hydrogénocarbonate de sodium, puis avec deux fois
100
cm3 d'une solution aqueuse saturée en thiosulfate de sodium, séchées sur
sulfate de
magnésium et concentrées sous pression réduite. Après purification par flash-
chromatographie sur gel de silice (230-400 Mesh), en éluant avec un gradient
de
mélanges cyclohexane-acétate d'éthyle (de 90-10 à 10-90 en volumes), on
obtient 2,75
g (38%) de 2-benzyl-7-iodo-4-{3-thiényl)-1,2,3,4,5,7a-hexahydro-isoindole-3a-
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/OZ804
49
carboxylate de méthyle-(3aRS,4SR,7aRS), impur utilisé tel quel à l'étape
suivante,
sous forme d' une huile marron dont Ies caractéristiques sont les suivantes
-spectre de masse (IE) : M/Z = 480 (M~)
Etape C
S A une solution de 0,96 g {2 mmol) de 2-benzyl-7-iodo-4-(3-thiényl)-
1,2,3,4,5,7a-hexahydro-isoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS) et
de
0,1 g (0,086 mmol) de tétrakis(triphénylphosphine)palladium dans 9 cm3 de
toluène,
on ajoute successivement une solution de 0,27 g (2 mmol) d'acide 4-
méthylphénylboronique dans 4 cm3 de méthanol et 21 cm3 d'une solution aqueuse
2 N
de carbonate de sodium, puis on porte au reflux pendant deux heures. Après
retour à
température ambiante, le mélange réactionnel est extrait avec 100 cm3 d'
acétate
d'éthyle, lavé avec deux fois 50 cm3 d'eau distillée, séchê sur sulfate de
magnésium
puis concentré sous pression réduite. On obtient ainsi 0,89 g (100%) de 2-
benzyl-7-(4-
méthylphényl)-4-(3-thienyl)-1,2,3,4,5,7a-hexahydro-isoindole-3a-carboxylate de
méthyle-(3aRS,4SR,7aRS), impur utilisé tel quel à l'étape suivante, sous forme
d'une
huile jaune dont les caractéristiques sont les suivantes
-spectre de masse (IE) : M/Z = 443 (M+)
Etape D
A une solution de 0,89 g (2 mmol) de 2-benzyl-7-(4-mêthylphényl)-4-(3-
thiényl)-i,2,3,4,5,7a-hexahydro-isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,7aRS) dans 10 cm3 de dichlorométhane, maintenue à une température
voisine de 0°C, on ajoute goutte à goutte 1,08 cm3 (14 mmol) d'acide
trifluorométhanesulfonique. Le mélange réactionnel est agité pendant quatre
heures à
température ambiante puis refroidi à une température voisine de 0°C. On
ajoute alors 6
cm3 d'une solution aqueuse saturée en carbonate de potassium. La phase
organique
est séparée par décantation, lavée successivement par trois fois 10 cm3 d'eau
distillée
et par deux fois 5 cm3 d'une solution aqueuse saturée en chlorure de sodium,
sëchée
sur sulfate de magnésium et concentrée sous pression réduite. On obtient
ainsi, après
purification par flash-chromatographie sur gel de silice (230-400 Mesh) en
éluant par
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
un mélange cyclohexane-acétate d'éthyle (85-15 en volumes), 510 mg (57%) de 2-
benzyl-4,8-éthano-8-(4-méthylphényI)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-
f]isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS) sous forme d'une
poudre écrue, qui fond vers 35-40°C dont la caractéristique est la
suivante
5 -spectre de masse (IE) : M/Z = 443 (M+)
Etape E
En opérant comme à l'étape I de l'exemple 1, mais à partir de 1,58 g (3,5
mmol) de 2-benzyl-4,8-éthano-8-(4-méthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-
thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS) et de
0,45
10 cm3 (6,9 mmol) de chloroformiate de vinyle dans 20 cm3 de dichlorornéthane
pendant
quatre heures à température ambiante, puis en reprenant pendant une heure au
refiux
dans 20 cm3 de méthanol et 10 cm3 d'une solution 5N de gaz chlorhydrique dans
I'isopropanol, on obtient, après neutralisation par une solution aqueuse
saturée de
carbonate de potassium et extraction au dichlorométhane, 1,3 g (92%a) de 4,8-
ëthano-
15 8-(4-rnéthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-
carboxylate
de méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une huile brune, utilisée telle
quelle à
l' étape suivante, dont la caractéristique est la suivante
-spectre de masse (IE) : M/Z = 353 (M+)
Etape F
20 En opérant comme à l'étape J de l'exemple 1, mais à partir de 1,3 g (3,7
mmol)
de 4,8-éthano-8-(4-méthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-
fJisoindole-
3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), de 710 mg (4 mmol) d'acide 2-
(2-méthoxyphényl)propènoique, de 770 mg (4 mmol) de chlorhydrate de 1-éthyl-3-
[(3-diméthylamino)propyl]carbodümide et de 50 mg (0,4 mmoi) d'hydrate de
25 N-hydroxybenzotriazole dans 30 cm3 de dichlorométhane, pendant vingt heures
à
température ambiante, on obtient, après purification par flash-chromatographie
sur
gel de silice (230-400 Mesh) en éluant par un mélange cyclohexane-acétate
d'éthyle
(85-15 en volumes) puis recristallisation au pentane, 830 mg (40%) de 4,8-
éthano-2-
[2-(2-méthoxyphényl)pr~pènoyl]-8-(4-méthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
51
thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), sous
forme
d'une poudre jaune très pâle dont les caractéristiques sont les suivantes
- point de fusion = 104°C
-spectre de masse (IE) : M/Z = 513 (M+)
Etape G
En opérant comme à l'exemple lb, mais à partir de 620 mg (1,2 mmol) de
4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-méthylphényl)-2,3,3a,4,8,8a-
hexahydro-1 H-thiéno [2, 3-f] isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS), au reflux, pendant quatre heures dans 50 cm3 d'éthanol et
50
cm3 d'une solution aqueuse décinormale d'hydroxyde de sodium, on obtient,
après
purification par cristallisation dans le pentane, 310 mg (52%) d'acide 4,8-
éthano-2-
[2-(2-méthoxyphényl)propènoyl]-8-(4-méthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-
thiéno[2,3-f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS), sous forme d'une
poudre jaune très pâle dont les caractéristiques sont les suivantes
- point de fusion = 176°C
- spectre de R.M.N. 1 H (400 MHz, (CD3)ZSO d6, à une température de 393 K, d
en
ppm) : 1,34 - 1,53 - et de 1,95 à 2,10 (3 mts, respectivement 1H - 1H et 2H
CHZCH~) ; 2,38 (s, 3H : ArCH3) ; de 3,20 à 3,50 (mt, 3H : CHI en 1 et CH en
8a) ;
3,53 et 4;01 (respectivement d et d large, J = 12,5 Hz, 1H chacun : CH2 en 3)
; 3,65 (s
large, 1H : CH en 4) ; 3,73 (s, 3H : ArOCH3) ; 5,54 et 5,68 (2 s larges, 1H
chacun
=CHI) ; de 6,90 à 7,40 (mt, lOH : H aromatiques en ortho et méta du 4
méthylphényle
- H aromatiques du 2-méthoxyphényle - H en 5 et H en 6).
EXEMPLE 3
Isolement de l'énantiomère dextro~~yre de l'acide 4 8-éthano-2-f2-(2-
méthoxyphényl)propènoyll-8-(4-méth~lphényl)-2 3 3a 4 8,8a-hexahydro-lH=
thiénof2,3-flisoindole-3a-carboxxliaue-(3aRS 4SR 8SR 8aRS)
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
52
12,86 g d'acide 4,8-éthano-2-[2-{2-méthoxyphényl)propènoyl]-8-(4-méthylphényl)-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylique-
(3aRS,4SR,8SR,8aRS), obtenus à l'exemple 2, sont dédoublés sur une colonne de
silice chirale porteuse de greffons N-(3,5-dinitrobenzoyl)phénylalanine-(R),
en 5
injections successives et en éluant par un mélange de n-heptane-
dichlorométhane-
éthanol (50-50-1 en volumes) contenant 0,05% d'acide trifluoroacétique. En
recueuillant les premières fractions éluées (temps de rétention 28 mn), on
obtient,
après concentration du solvant saus pression réduite, 5,83 g de l'énantiomère
dextrogyre de l'acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-
méthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiëno[2,3-f]isoindole-3a-
carboxylique-
(3aRS,4SR,8SR,8aRS), sous forme d'une poudre blanche dont les caractéristiques
sont les suivantes
- spectre de masse (IE) : M/Z= 499 (M')
- pouvoir rotatoire: [cz],652= + 106,3 +/- I,5° (c = 0,5/ méthanol)
La silice chirale peut être préparëe de la manière suivante
Dans un tricot de 6 dm3, on met en suspension 948 g de silice amino-propyle
{100 ~1 - 10 pm - NH2 ; Macherey-Nagel) dans 3 dm3 de N,N-diméthylformamide.
On ajoute 180 g d'anhydride de (acide N-tert-butoxy-carbonylamino-l I-
undécanoïque
et on agite le mélange réactionnel pendant 18 heures à une température voisine
de
20°C. La silice est séparée par filtration et lavée successivement par
2 fois 2500 cm3
de dichlorométhane puis 2 fois 2500 cm3 de N,N-diméthylformamide. La silice
ainsi
lavée est remise en suspension dans 3 litres de N,N-diméthylformamide et on
ajoute
180 g d'anhydride de (acide N-tert- butoxycarbonylamino-11-undécanoïque puis
on
agite le mélange réactionnel pendant 18 heures à une température voisine de
20°C. La
silice est séparée par filtration, lavée successivement par 2 fois 2500 cm3 de
dichlorométhane, 2 fois 2500 cm3 de tétrahydrofurane, 2 fois 2500 cm3 de
méthanol
et 2 fois 2500 cm3 d'oxyde de diéthyle puis séchée sous pression réduite à une
température voisine de 20°C. On obtient ainsi 971 g de silice désignée
par
(appellation "BOC-C11-C3-silice" sous forme de poudre blanche dont la
structure est
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98102804
53
confirmée par le spectre infra-rouge et dont (analyse élémentaire (trouvée)
est : C %
=9,85;H%=2,05;N%=1,05.
Dans un tricot de 6 dm3, on met en suspension 971 g de silice "BOC-Cll-
C3-silice" dans 2500 cm3 de dichlorométhane et 470 g d'imidazole. On ajoute
goutte
à goutte 850 cm3 de dirnéthyloctylchlorosilane et on agite le mélange
réactionnel
pendant 16 heures à une température voisine de 20°C. Le solide obtenu
est séparé par
filtration et lavé successivement par 2 fois 2500 cm3 de dichlorométhane, deux
fois
2500 cm3 de méthanol, 2 fois 2500 cm3 de tétrahydrofurane, deux fois 2500 cm3
de
dichlorométhane et 2 fois 2500 cm3 d'oxyde de diéthyle puis séché sous
pression
réduite à une température voisine de 20°C. On obtient ainsi 1179 g de
silice désignée
par (appellation "BOC-C11-C3-silice-O-Si(CH3)2(CH2)7CH3" sous forme de
poudre blanche dont la structure est confirmée par le spectre infra-rouge et
dont
l'analyse élémentaire (trouvée) est : C % = 13,9 ; H % = 2,83 ; N % = 1,16.
Dans un tricot de 6 dm3, on met en suspension 1178 g de silice "BOC-C11-
C3-silice-O-Si(CH3)2(CH2)7CH3" dans 2500 cm3 d'une solution à 5 % en volume
d'acide trifluoroacétique dans le dichlorométhane. On agite à 20°C. La
silice est
séparée par filtration et lavée successivement par 2 fois 2500 cm3 de
dichlorométhane, 2 fois 2500 cm3 d'un mélange dichlorornéthane-düsopropyl-
éthylamine (70-30 en volumes), 2500 crn3 de dichlorométhane, 2 fois 2500 cm3
de
tétrahydrofurane, 2 fois 2000 cm3 de méthanol et 2 fois 2000 cm3 d'oxyde de
diéthyle
puis séchée sous pression réduite à une température voisine de 50°C. On
obtient ainsi
1080,5 g de silice désignée par (appellation "C11-C3-silice-O-
Si(CH3)2(CH2)7CH3"
sous forme de poudre blanche dont la structure est confirmée par le spectre
infra-
rouge et dont (analyse élémentaire (trouvée) est : C % = 12,6 ; H % = 2,44 ; N
% _
1,05.
Dans un ballon tricot de 6 dm3, on met en suspension 1080 g de silice "Cll-
C3- (silice)-O-Si(CH3)~(CH~)~CH3" dans 2500 cm3 de N,N-diméthylformamide séché
sur tamis moléculaire 4A. On ajoute 108 g de N-benzoyl-3,5-dinitro-D-
phénylalanine
et 75 g de N-éthoxycarbonyl-2-éthoxy-1,2-dihydroquinoléine. On agite le
mélange
CA 02315144 2000-06-13
WO 99133834 PCT/FR98102804
54
réactionnel pendant 1 nuit. La silice est séparée par filtration sur verre
fritté puis est
lavée par 2 fois 2500 cm3 de dichlorométhane, 2 fois 2500 cm3 de
tétrahydrofurane,
2500 cm3 de N,N-diméthytformamide et 2500 cm3 de dichlorométhane. La silice
ainsi
lavée est remise en suspension dans 2500 cm3 de N,N-diméthylformamide. On
ajoute
successivement 108 g de N-benzoyl-3,5-dinitro-D-phénylalanine et 75 g de N-
éthoxycarbonyl-2-éthoxy-1,2-dihydro-quinoléine puis on agite pendant une nuit
à
20°C. La silice est séparée par filtration sur verre fritté et est
lavée successivement par
2 fois 2500 cm3 de dichlorométhane, 2 fois 2500 cm3 de tétrahydrofurane, 2
fois 2500
cm3 de méthanol et 2 fois 2500 cm3 d'oxyde de diéthyle. Après séchage à
60°C sous
pression réduite {2,7 kPa), on obtient 1093,6 g de silice désignée par
(appellation
"DNB-D-Phe-C1~-C3 (silice)-O-Si(CH3)~(CH~);CH3", sous forme d'une poudre jaune
pâle dont la structure est confirmée par son spectre infra-rouge, et dont
(analyse
élémentaire {trouvée) est : C % = 14,5, H % = 2,4, N % = 1,68 .
Dans un ballon tricot de 4 dm3, on met en suspension 519 g de silice "DNB-
D-Phe-C11-C3 (silice)-O-Si(CH3)2(CH~)~CH3" dans 3000 cm3 de N,N-
diméthylformamide séché sur tamis moléculaire 4 ~. On ajoute 450 cm3 de
triméthylsilylimidazole en 15 minutes, puis on agite pendant une nuit. La
silice est
séparée par filtration et est lavée successivement par 2 fois 1500 cm3 de
tétrahydrofurane, 2 fois 1500 cm3 de méthanol, 2 fois 1500 cm3 d'acétone et 2
fois
1500 cm3 de dichlorométhane. Après séchage à une température de 60°C
sous
pression réduite (2,7 kPa), on obtient 519 g de silice désignée par
(appellation "DNB-
D-Phe-Cu-C3 (silice)-[O-Si(CH3)z(CH~)~CH3]-[O-Si(CH3)3]" sous forme d'une
poudre
jaune pâle dont la structure est confirmée par son spectre infra-rouge, et
dont (analyse
élémentaire (trouvée) est : C % =15,3, H % = 1,8, N % = 2,6 .
L'anhydride de (acide N-tert-butoxycarbonyl-11-amino-undécanoïque peut
être prépare de la manière suivante
On dissout 30,1 g d'acide N-tert-butoxycarbonyl-11-amino-undécanoïque
dans 480 cm3 d'acétate d'éthyle. On refroidit cette solution à 5°C
puis, en la
maintenant à cette température, on ajoute en 10 minutes une solution de 10,63
g de
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
1,3-dicyclohexylcarbodiimide dans 120 cm3 d'acétate d'éthyle. On agite le
mélange
réactionnel pendant 1 heure à 5°C puis pendant 16 heures à une
température voisine
de 20°C. On sépare le précipité formé par filtration et le lave par 30
cm3 d'acétate
d'éthyle. Le filtrat est concentré à sec sous pression réduite (2,7 kPa) â
30°C. Le solide
5 obtenu est séché à 20°C sous pression réduite (2,7 kPa). On obtient
ainsi, avec un
rendement voisin de 100%, 31 g d'anhydride de (acide N-tert-butoxycarbonyl-11-
amino-undécanoïque.
L'acide N-tert-.butoxycarbonyl-11-amino-undécanoïque peut être préparé de
selon J. Org. Chem., 41, 1350 (1976).
EXEMPLE 4
Préparation de l'acide 4,8-éthano-2-[2-(2-méthoxyphényl)~ropènoyll-8-(4-
trifluorométhyl-phénvl)-2,3,3a,4,8.8a-hexah~dro-1H-thiénof 2.3-flisoindole-3a-
carboxylique-(3aRS,4SR,8SR.8aRS)
Etape A
Sous atmosphère d'argon, on ajoute, par portions, 0,45 g de magnésium en
tournures à une solution de 4,5 g (18,6 mmol) de 4-trifluorométhyl-
bromobenzène
dans 40 cm3 d'oxyde de diéthyle, le reflux est maintenu pendant une heure
trente
minutes puis la solution brun-rouge obtenue est refroidie à 5°C et on
ajoute, goutte à
goutte une solution de 3,45 g (9,3 mmol) de 2-benzyl-4-(3-thiényl)-7-oxo-
octahydroisoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS), obtenu à l'étape
F
de l'exemple 1, dans 25 cm3 d'oxyde diéthyle. On agite alors à température
ambiante
pendant dix huit heures. Après hydrolyse avec lb cm3 d'une solution aqueuse
saturée
de chlorure d'ammonium et extraction à l'acétate d'éthyle, le résidu est
purifié par
cristallisation dans le pentane. On obtient ainsi 3,9 g (81%) de 2-benzyl-7-
hydroxy-4-
(3-thiényl)-7-(4-trifluorométhyl-phényl)-octahydroisoindole-3a-carboxylate de
méthyle-(3aRS,4SR,7RS,7aRS), sous forme d'un solide jaune-orangé pâteux, dont
la
caractéristique est la suivante
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
56
- spectre de masse (IE) : M/Z= 515 (M') .
Etape B
En opérant comme à l'étape H de l'exemple 1, mais à partir de 6,88 g (13
mmol) de 2-benzyl-7-hydroxy-4-(3-thiényl)-7-(4-trifluorométhyl-phényl)-
octahydro-
isoindole-3a-carbaxylate de méthyle-(3aRS,4SR,7RS,7aRS), de 30 cm3 d'acide
trifluorométhanesulfonique et de 3 cm3 d'anhydride trifluorométhanesulfonique
dans
cm3 de dichlorométhane, pendant soixante douze heures à température ambiante,
on obtient ainsi, après purification par flash-chromatographie sur gel de
silice (230-400
Mesh) en éluant par un mélange cyclohexane-acétate d'éthyle (98-2 en volumes),
860
10 mg (13%) de 2-benzyl-4,8-éthano-8-(4-trifluorométhyl-phényl)-2,3,3a,4,8,8a-
hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS), sous forme d'une meringue blanche, qui fond vers 40-
45°C
dont 1a caractéristique est la suivante
-spectre de masse (IE) : M/Z = 497 (M+)
Etape C
En opérant comme à l'étape I de l'exemple 1, mais à partir de 0,86 g (1,7
rnmol) de 2-benzyl-4,8-éthano-8-(4-trifluorométhyl-phényl)-2,3,3a,4,8,8a-
hexahydra-
1H-thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS) et de
0,2
cm3 (3,05 mmol) de chloroformiate de vinyle dans 10 cm3 de dichlorométhane
pendant dix huit heures à température ambiante, puis en reprenant pendant
quatre
heures au reflux dans 20 cm3 d'une solution 5N de gaz chlorhydrique dans
l'isopropanol, on obtient, après neutralisation par une solution aqueuse
saturée de
carbonate de potassium et extraction au dichlorométhane, 0,5 g (66%) de 4,8-
éthano-
8-(4-trifluorométhyl-phényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéna[2,3-f]isoindole-
3a-
carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une huile brune,
utilisée
telle quelle à l'étape suivante, dont la caractéristique est la suivante
-spectre de masse (IE) : M/Z = 407 (M+)
Etape D
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
57
A une solution de 400 mg {I,5 mmol) d'acide 2-(2-
méthoxyphényl)propènoique dans 15 cm3 de dichlorométhane contenant 3 gouttes
de
N,N-diméthylformamide, on ajoute 0,2 cm3 (1,75 mmol) de chlorure d'oxalyle et
on
porte à 40 °C pendant trente minutes. Après refroidissement, on ajoute,
goutte à
goutte, une solution de 0,61 g (1,5 mmol) de 4,8-éthano-8-(4-trifluorométhyl-
phényl)-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS) et de 303 mg (3 mmol) de triéthylamine dans 20 cm3 de
dichlorométhane et on agite pendant deux heures à température ambiante. Après
hydrolyse par addition de 20 cm3 d'eau, la phase organique est décantée, lavée
à l'eau
et concentrée sous pression réduite. Le résidu est purifié par flash-
chromatographie
sur gel de silice (230-400 Mesh) en éluant par un mélange cyclohexane-acétate
d'éthyle (80-20 en volumes). On obtient alors 500 mg (59%) de 4,8-éthano-2-(2-
(2-
méthoxyphényl)propènoyl]-8-(4-trifluorométhyl-phényl)-2,3,3a,4,8,8a-hexahydro-
1H-
thiéno(2,3-f7isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), sous
forme
d'une poudre jaune pâle dont les caractéristiques sont les suivantes
- point de fusion = 113°C
-spectre de masse (IE) : M/Z = 567 (M+)
Etape E
En opérant comme à lb, mais à partir de 300 mg (0,53 mmol) de
4,8-éthano-2-[2-(2-rnéthoxyphényl)propènoyl]-8-(4-trifluorornéthyl-phényl)-
2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS), au reflux, pendant quatre heures dans 40 cm3 de méthanol
et
10 cm3 d'une solution aqueuse décinormale d'hydroxyde de sodium, on obtient,
après purification par cristallisation dans le pentane, 243 mg (83%) d'acide
4,8-
éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-trifluorométhyl-phényl)-
2,3,3a,4,8,8a-
hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylique-{3aRS,4SR,8SR,8aRS), sous
forme d'une meringue blanche dont les caractéristiques sont les suivantes
- point de fusion = 155-60°C
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
58
- spectre de R.M.N. 1 H (250 MHz, (CD3)~SO d6, à une température de 383 K, d
en
ppm) : 1,38 - 1,61 et de 1,95 à 2,20 (3 mts, respectivement 1H - 1H et 2H :
CH2CH2)
de 3,20 à 3,45 (mt, 3H : CHI en 1 et CH en 8a) ; 3,53 et 4,04 (respectivement
d et d
large, J = I2,5 Hz, 1H chacun : CHZ en 3) ; de 3,65 à 3,80 (mt, 1H : CH en 4)
; 3,71
(s, 3H : ArOCH3) ; 5,58 et 5,70 (2 s, 1H chacun : =CH2) ; de 6,90 à 7,40 (mt,
6H : H
aromatiques du 2-méthoxyphényle - H en 5 et H en 6) ; 7,?0 et 7,83 (2 d
larges, J = 8
Hz, 2H chacun : H aromatiques du 4-trifluorométhylphényle).
EXEMPLE 5
Préparation du N-benzyl-4,8-éthano-2-[2-(2-méthoxvt~hényl)propènoyl]-8-(4-
trifluorométhy 1-phényl )-2.3,3a.4,8,8a-hexahydro-1 H-thiéno[2,3-flisoindole-
3a-
carboxamide-(3aRS,4SR,8SR,8aRS)
A une solution de 442 mg (0,8 mmol) d'acide 4,8-éthano-2-[2-(2-
méthoxyphényl)propènoyl]-8- (4-trifluorométhyl-phényl)-2, 3,3 a,4,8,8a-
hexahydro-1 H-
thiéno[2,3-f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS) dans 10 cm3 de
dichlorométhane, on ajoute successivement 154 mg (0,8 mmol) de chlorhydrate de
1-
éthyl-3-[(3-diméthylamino)propyl]carbodümide, 86 mg (0,8 mmol) de benzylamine
et 11 mg (0,08 mmol) d'hydrate de N-hydroxybenzotriazole. Après vingt heures
d' agitation à température ambiante, le solvant est concentré sous pression
réduite et le
résidu est purifié par flash-chromatographie sur gel de silice (230-400 Mesh),
en
éluant par un mélange cyclohexane-acétate d'éthyle-acide acétique (50-48-2 en
volumes). On obtient ainsi 178 mg (35%) de N-benzyl-4,8-éthana-2-[2-(2-
méthoxyphényl)propènoyl-8-(4-trifluorométhyl-phényl)-2,3,3a,4,8,8a-hexahydro-
1H
thiéno[2,3-f]isoindole-3a-carboxamide-(3aRS,4SR,8SR,8aRS), sous forme d'une
poudre blanche dont les caractéristiques sont les suivantes
- point de fusion = 227°C
- spectre de R.M.N. 1H (250 MHz, (CD3)~SO d6 avec ajout de quelques gouttes de
CD3COOD, à une température de 383 K, d en ppm) : 1,36 - 1,57 et de 2,00 à 2,20
(3
mts, respectivement 1H - 1H et 2H : CHZCHZ) ; de 3,15 à 3,40 (mt, 2H : CHZ en
1) ;
3,38 et 4,16 (respectivement d et d large, J = 12,5 Hz, 1H chacun : CHI en 3)
; 3,57
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
59
(mt, 1H : CH en 8a) ; 3,68 (s, 3H : ArOCH3) ; 3,86 (s large, 1H : CH en 4) ;
4,24 (AB
limite, 2H : NCHzAr) ; 5,54 et 5,68 (2 s, 1H chacun : =CHI) ; de 6,80 à 7,40
{mt, 11H
H en 5 - H en 6 - H aromatiques du 2-méthoxyphényle et H aromatiques du
benzyle)
7,68 et 7,79 (2 d larges, J = 8 Hz, 2H chacun : H aromatiques du 4-
trifluorométhylphényle) ; 7,95 (mf résiduel : CONH).
EXEMPLE b
Préparation de l'acide 4.9-éthano-2-f2-(2-méthoxyphén I~_2-propèn-1-oyll-10-(4-
méthylphényl)-2,3.3a.4,10 l0a-hexahydro-1H-indolo(2 3-flisoindole-3a-
carboxylique-
(3aRS,4SR.lOSR.lOaRS)
Etape A
A une solution refroidie à 0°C de 20 g (0,098 mol) d'acide {3-
indolyl)-
pyruvique, qui peut être obtenu selon Org. Synth., 1939, 19, 1-3, dans I30 cm3
d'éthanol an ajoute successivement 8,3 g (0,118 mol) de méthylvinylcétone et
120
cm3 d'une solution aqueuse normale d'hydroxyde de sodium, puis on agite à une
température voisine de 0°C pendant une heure. Après neutralisation avec
120 cm3
d'une solution aqueuse normale d'acide chlorhydrique et concentration de
l'éthanol, le
précipité formé est essoré, lavé à l'eau, puis séché à 50°C. On obtient
ainsi 24 g (88%)
d'acide 6-(3-indolyl)-3-oxo-cyclohexan-1-oI-1-carboxylique, sous forme d'une
poudre
beige dont les caractéristiques sont les suivantes
- point de fusion = 210°C
- spectre de R.M.N. 1H (300 MHz, (CD3)ZSO d6, d en ppm) : 1,96 - de 2,20 à
2,40 et
2,76 (3 mts, respectivement 1H - 2H et 1H : CH~CH~) ; 2,36 et 3,09 (2 d, J =
14 Hz,
1H chacun : COCH2) ; 3,86 (dd, J = 12,5 et 3,5 Hz, 1H : ArCH) ; 5,25 (mf
étalé, 1H
OH) ; 6,97 et 7,05 (2 t, J = 7,5 Hz, 1H chacun : H en 5 et H en 6 de l'indole)
; 7,25 (d,
J = 3,5 Hz, 1H : H en 2 de l'indole) ; 7,32 (d, J = 7,5 Hz, 1H : H en 7 de
l'indole) ;
7,64 (d, J = 7,5 Hz, 1H : H en 4 de l'indole) ; 10,84 (s large, 1H : NH de
l'indole) ;
12,68 (mf étalé, 1H : COOH).
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
Etape B
115 g (0,421 mol) d'acide 6-(3-indolyl)-3-oxo-cyclohexan-1-ol-1-carboxylique
sont chauffés à reflux, pendant 24 heures, dans 500 cm3 de tétrahydrofurane et
1 dm3
d'une solution aqueuse normale d'acide chlorhydrique. Le mélange réactionnel
est
5 extrait avec 3 fois 200 cm3 d'acétate d'éthyle, séché sur sulfate de
magnésium et
concentré sous pression réduite. Le précipité obtenu est lavé à l'éther
isopropylique
puis séché à 60°C. On obtient ainsi 96,4 g (90%) d'acide 6-(3-indolyl)-
3-oxo-
cyclohexène-1-carboxylique-(RS) sous forme d'un solide orange dont les
caractéristiques sont les suivantes
10 - point de fusion = 170°C
- spectre de R.M.N. 1H (300 MHz, (CD3)aS0 d6, d en ppm) : de 2,05 à 2,45 (mts,
4H
CH~CH2) ; 4,48 (s large, 1H : ArCH) ; 6,52 (s, 1H : COCH=) ; 6,96 (d, J = 3
Hz, 1H
H en 2 de l'indole) ; 7,04 et 7,13 (2 t, J = 7,5 Hz, 1H chacun : H en 5 et H
en 6 de
l'indole) ; 7,38 (d, J = 7,5 Hz, 1H : H en 7 de l'indole) ; 7,63 (d, J = 7,5
Hz, 1H : H en
15 4 de l'indole) ; 10,95 (s large, 1H : NH de l'indole) ; 13,20 (mf étalé, 1H
: COOH).
Etape C
A une solution de 96,4 g {0,378 mol) d'acide 6-(3-indolyl)-3-oxo-cyclohexène-
1-carboxylique-(RS), dans 765 cm3 d'acétone, on ajoute successivement 75 g
(0,529
mol) d'iodure de méthyle et 69 g (0,453 mol) de 1,8-diazabicyclo[5.4.0]undéc-7-
ène
20 goutte à goutte, puis on porte au reflux pendant une heure. L'acétone est
ensuite
concentrée, puis le résidu est agité avec 1 dm3 d'eau. Après refroidissement à
10°C, le
précipité formé est essoré, lavé avec 500 cm3 d'éther de pétrole, puis purifié
par flash-
chromatographie sur gel de silice (230-400 Mesh), en éluant au
dichlorométhane. On
obtient ainsi 70,7 g (70 %) de 6-(3-indolyl)-3-oxo-cyclohexène-1 carboxylate
de
25 méthyle-(RS), sous forme d'une paudre jaune dont les caractéristiques sont
les
suivantes
- point de fusion =154°C
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98102804
61
- spectre de R.M.N. 1H (300 MHz, (CD3)ZSO d6, d en ppm) : de 2,10 à 2,45 (mts,
4H
CH~CH~) ; 3,66 (s, 3H : COOCH3) ; 4,51 (s large, 1H : ArCH) ; 6,65 (s, 1H
COCH=) ; 6,98 (d, J = 3 Hz, 1H : H en 2 de l'indole) ; 7,04 et 7,13 (2 t, J =
7,5 Hz,
1H chacun : H en 5 et H en 6 de l'indole} ; 7,39 (d, J = 7,5 Hz, 1H : H en 7
de
l'indole) ; 7,64 (d, J = 7,5 Hz, 1H : H en 4 de l'indole) ; 10,97 (s large, 1H
: NH de
l'indole) ,
Etape D
Une solution de 20 g (0,077 mol) de 6-(3-indolyl)-3-oxo-cyclohexène-1
carboxylate de méthyle-(RS), et de 0,57 cm3 d'acide trifluoroacétique dans 240
crn3
de dichlorométhane est portée au reflux. On ajoute alors, goutte à goutte, 25
g (0,089
mol) de N-n.butoxyméthyl-N-triméthylsilylméthyl-benzylamine, qui peut être
obtenue
selon Chem. Pharm. Bull., 1985, 276 et porte au reflux pendant une heure. Le
milieu
réactionnel est alors refroidi à 20°C. Après agitation pendant trente
minutes avec
environ 40 g de carbonate de potassium, la phase organique est concentrée et
l'huile
1~ jaune obtenue est purifiée par flash-chromatographie sur gel de silice (230-
400 Mesh),
en éluant avec un mélange cyclohexane-acétate d'éthyle (70-30 en volumes). On
obtient alors 13,3 g (45%) de 2-benzyl-4-(3-indolyl)-7-oxo-octahydroisoindole-
3a-
carboxylate de méthyle-(3aRS,4SR,7aRS), sous forme d'une meringue jaune, dont
les
caractéristiques sont les suivantes
- spectre de R.M.N. 1H (300 MHz, CDC13, d en ppm) : 2,20 et de 2,50 à 2,75 (2
mts,
respectivement 1H et 3H : CH2CH2) ; 2,79 et 2,94 (2 d, J = 9,5 Hz, 1H chacun :
CH2
en 3) ; 2,81 et 3,18 (respectivement t et dd, J = 9,5 Hz et J = 9,5 et 5 Hz,
1H chacun
CHI en 1) ; 3,37 (dd, J = 9,5 et 5 Hz, 1H : CH en 7a) ; 3,46 (s, 3H : COOCH3)
; 3,59
et 3,68 (2 d, J = 13 Hz, 1H chacun : NCH2Ar) ; 3,74 (dd, J = 10,5 et 3,5 Hz,
1H : CH
en 4) ; 6,88 (d, J = 3 Hz, 1H : H en 2 de l'indole) ; 7,03 et 7,I7 (2 t, J =
7,5 Hz, 1H
chacun : H en 5 et H en 6 de l'indole) ; de 7,25 à 7,40 (mt, 6H : H en 7 de
l'indole et
H aromatiques du benzyle) ; 7,46 (d, J = 7,5 Hz, 1H : H en 4 de 1'indole) ;
8,02 (s
large, 1H : NH de l'indole).
Etape E (SON 2807)
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98I02804
62
Une solution de 40 g (0,0995 mol) de 2-benzyl-4-(3-indolyl)-7-oxo-
octahydroisoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS), et de 85 g
(1,7 mol) d'hydrate d'hydrazine dans 400 cm3 de méthanol est portée au reflux
pendant deux heures. Après concentration du méthanol sous pression réduite, le
résidu est repris par 400 cm3 de dichlorométhane, lavé avec trois fois 150 cm3
d'eau distillée, séché sur sulfate de magnésium et concentré sous pression
réduite. On obtient ainsi 41 g (98%) de 2-benzyl-7-hydrazono-4-(3-indolyl)-
octahydroisoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS) sous forme
d'une meringue jaune dont les caractéristiques sont les suivantes
- spectre de R.M.N. 1H (400 MHz, CDC13, d en ppm) : nous observons le
mélange des deux isomères dans les proportions 70/30.
* de 1,90 à 2,55 (mt, 4H en totalité : CH2CH2) ; de 2,65 à 3,20 (mt, 4H en
totalité: CH2 en 3 et CH2 en 1) ; 3,39 et 3,44 (2 s, 3H en totalité : COOCH3)
;
de 3,55 à 3,90 (mt, 2H en totalité : CH en 4 et CH en 7a ) ; 3,65 et 3,73 (2
s, 2H
en totalitë : NCH2Ar) ; 4,96 et 5,00 (2 s larges, 2H en totalité : NH2) ; b,85
(s
large, 1H : H en 2 de l'indole) ; de 6,95 à 7,60 (mt, 9H : H aromatiques) ;
8,03
et 8,05 (2 s larges, 1H en fatalité : NH de l'indole).
Etape F
A une solution de 41 g (0,0985 mol) de 2-benzyl-7-hydrazono-4-(3-indolyl)-
octahydroisoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS) dans 1 dm3 de
tétrahydrofurane on ajoute 30 g (0,30 mol) de triéthylamine et goutte à goutte
une
solution de 50,4 g (0,197 mol) d'iode dans 400 cm3 de tétrahydrofurane. Après
addition de 200 cm3 d'acétate d'éthyle, les phases organiques sont lavées avec
deux
fois 100 cm3 d'une solution aqueuse saturée en hydrogénocarbonate de sodium,
lavées
avec deux fois 100 cm3 d'une solution aqueuse saturée en thiosulfate de
sodium,
lavées deux fois avec 100 cm3 d'une solution aqueuse saturée en chlorure de
sodium,
puis séchées sur sulfate de magnésium et concentrées sous pression réduite.
Après
purification par chromatographie sur gel de silice (230-400 Mesh), en éluant
avec un
mélange cyclohexane-acétate d'éthyle (80-20 en volumes), on obtient 29,8 g
(58%) de
2-benzyl-7-iodo-4-(3-indolyl)-1,2,3,4,5,7a-hexahydro-isoindole-3a-carboxylate
de
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
63
méthyle-(3aRS,4SR,7aRS) sous forme d'une meringue blanche dont les
caractéristiques sont les suivantes
- spectre de R.M.N. 1H (300 MHz, CDC13, d en ppm) : 2,44 (mt, 1H: 1H du CH2 en
5) ; de 2,55 à 2,95 (mt, 3H : l'autre H du CH2 en 5 - 1H du CH2 en 3 et 1H du
CH2
en 1} ; de 3,00 à 3,10 (mt, 2H : l'autre H du CH2 en 3 et l'autre H du CHZ en
1) ; de
3,45 à 3,85 (mt, 2H : CH en 4 et CH en 7a) ; 3,52 (s, 3H : COOCH3) ; 3,60 et
3,70 (2
d, J = 14 Hz, 1H chacun : NCH2Ar) ; 6,52 (mt, 1H : =CH en 6) ; 6,95 (d, J =
2,5 Hz,
1 H : H en 2 de l'indole) ; 7,06 et 7,16 (2 t, J = 7,5 Hz, 1 H chacun : H en 5
et H en 6
de l'indole) ; de 7,20 à 7,40 (mt, 6H : H en ? de l'indole et H aromatiques du
benzyle)
; 7,53 (d, J = 7,5 Hz,1H : H en 4 de l'indole) ; 8,04 (s large, 1H : NH de
l'indole).
Etape G
A une solution de 26,8 g (0,052 mol) de 2-benzyl-7-iodo-4-(3-indolyl)-
1,2,3,4,5,7a-hexahydro-isoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS) et
de
3,5 g de tétrakis(triphénylphosphine)palladium dans 540 cm3 de toluène, on
ajoute
successivement une solution de 7,82 g (0,0575 mol) d'acide 4-
méthylphénylboronique
dans 295 cm3 de méthanol et 550 cm3 d'une solution aqueuse 2N de carbonate de
sodium, puis on porte au reflux pendant une heure. Après dilution avec 100 cm3
d'eau
distiliée, le mélange réactionnel est extrait avec 150 cm3 d'acétate d'éthyle,
lavé avec
trois fois 150 cm3 d'une solution aqueuse saturée en chlorure de sodium, séché
sur
sulfate de magnésium puis concentré sous pression réduite. On obtient, après
purification par flash-chromatographie sur gel de silice (230-400 Mesh) en
éluant par
un mélange de cyclohexane et d'acétate d'éthyle (80-20 en volumes), 17,7 g
(71%) de
2-benzyl-7-(4-méthylphényl)-4-(3-indolyl)-1,2,3,4,5,7a-hexahydro-isoindole-3a-
carboxylate de méthyle-(3aRS,4SR,7aRS), sous forme d'une meringue rose dont la
caractéristique est la suivante
- spectre de R.M.N. 1H (300 MHz, CDC13, d en ppm) : 2,3? (s, 3H : ArCH3) ;
2,52
(dd, J = 9,5 et 6,5 Hz, 1H : 1H du CH2 en 1) ; 2,59 et 2,80 (2 mts, 1H chacun
: CH2
en 5) ; 2,87 et 3,08 (2 d, J = 10 Hz, 1H chacun : CH2 en 3) ; 3,02 (t, J = 9,5
Hz, 1H
l'autre H du CH2 en 1) ; 3,52 (s, 3H : COOCH3) ; 3,54 et 3,67 (2 d, J = 14 Hz,
1H
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
64
chacun : NCH2Ar) ; de 3,65 à 3,85 (mt, 2H : CH en 4 et CH en 7a) ; 6,19 (mt,
1H
=CH en 6) ; 6,97 (d, J = 3 Hz, 1H : H en 2 de l'indole) ; 7,07 et 7,17
(respectivement
t, J = 7,5 Hz et mt, 1H et 3H : H en 5 et H en 6 de l'indole et les 2H
aromatiques en
ortho du CH3) ; de 7,20 à 7,40 (mt, 8H : H en 7 de l'indole - les 2H
aromatiques en
mëta du CH3 et H aromatiques du benzyle) ; 7,61 (d, J = 7,5 Hz, 1H : H en 4 de
l'indole) ; 8,00 (s large, 1H : NH de l'indole).
Etape H
3,5 g (0,0073 mol) de 2-benzyl-7-(4-méthylphényl)-4-{3-indolyl)-1,2,3,4,5,7a-
hexahydro-isoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS) et 10 g (0,066
mol)
d'acide trifluorométhanesulfonique sont chauffés à 70°C pendant une
heure. Le
mélange réactionnel est refroidi à une température voisine de 0°C et on
ajoute 100
cm3 d'une solution aqueuse normale d'hydroxyde de sodium puis on extrait avec
100
cm3 d'acétate d'éthyle. La phase organique est séparée par décantation, lavée
à l'eau
distillée, séchée sur sulfate de magnésium et concentrée sous pression
réduite. On
obtient ainsi, après purification par flash-chromatographie sur gel de silice
(230-400
Mesh) en éluant par un mélange cyclohexane-acétate d'éthyle (95-05 en
volumes),
0,55 g (15,7%) de 2-benzyl-4,10-éthano-10-(4-méthylphényl)-2,3,3a,4,10,10a
hexahydro-1H-indolo(2,3-f]isoindole-3a-carboxylate de méthyle
(3aRS,4SR,lOSR,lOaRS) sous forme d'une poudre blanche, dont les
caractéristiques
sont les suivantes
- point de fusion : 92°C
- spectre de R.M.N. 1H (400 MHz, CDC13, d en ppm) : 1,44 - 1,62 et 2,54 (3
mts,
respectivement 1H - 1H et 2H : CH2CH2) ; de 2,25 à 2,35 (mt, 2H : 1H du CH2 en
1
et 1H du CH2 en 3) ; 2,42 (s, 3H : ArCH3) ; 2,77 (d large, J = 10 Hz : l'autre
H du
CH2 en 1) ; 3,21 (d large, J = 10 Hz, 1H : l'autre H du CH2 en 3) ; 3,25 (d
large, J =
8,5 Hz, 1H : CH en IOa) ; 3,43 et 3,65 (2 d, J = 14 Hz, 1H chacun : NCH2Ar) ;
3,48
(s, 3H : COOCH3) ; 3,89 (s large, 1H : CH en 4) ; de 7,00 à 7,10 - de 7,15 à
7,40 et
7,51 (respectivement 2 mts et d , J = 7,5 Hz, I1H en totalité : H aromatiques)
; 7,43
(d, J = 8 Hz, 2H : les 2H aromatiques en méta du CH3) ; 7,58 (s large, 1H :
NH).
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
Etape I
A une solution de 0,5 g (0,001 mol) de 2-benzyl-4,10-éthano-10-(4-
méthylphényl)-2,3,3a,4,10,10a-hexahydro-1H-indolo[2,3-f]isoindole-3a-
carboxylate
de mëthyle-(3aRS,4SR,lOSR,lOaRS) dans 10 cm3 de dichlorométhane, on ajoute
5 0,125 cm3 (0,0015 mol) de chloroformiate de vinyle puis le mélange
réactionnel est
porté au reflux pendant trois heures. Après évaporation du dichlorométhane, le
résidu
est purifié par flash-chromatographie sur gel de silice (230-400 Mesh) en
éluant par un
mélange de cyclohexane et d'acétate d'éthyle (80-20 en volumes). On obtient
ainsi, 0,5
g (100%) de 4,10-éthano-10-(4-méthylphényl)-2-vinyloxycarbonyl-2,3,3a,4,10,10a-
10 hexahydro-1H-indolo[2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,lOSR,lOaRS) sous forme d'une poudre blanche dont les
caractéristiques
sont les suivantes
point de fusion : 142°C
- spectre de R.M.N. 1H (250 MHz, (CD3)2S0 d6, à une température de 373 K, d en
15 ppm) : 1.44 - 1,68 et 2,13 (3 mts, respectivement 1H - 1H et 2H : CH2CH2) ;
2,43 (s,
3H : ArCH3) ; de 3,30 à 3,50 (mt, 3H : CH2 en 1 et CH en 10a) ; 3,45 (s, 3H
COOCH3) ; 3,55 et 4,05 (d, J = 12,5 Hz, IH chacun : CH2 en 3) ; 3,90 (s large,
1H
CH en 4) ; 4,55 et 4,83 (2 dd, respectivement J = 6 et 1,5 Hz et J = 14 et 1,5
Hz, 1H
chacun : =CH2) ; de 6,90 à 7,05 et de 7,30 à 7,50 (2 mts, 8H en totalité
20 H aromatiques) ; 7,32 (dd, J = 14 et 6 Hz, 1H : OCH=) ; 9,96 (mf, 1H : NH).
Etape J
Une solution de 4,2 g (0,0092 mol) de 4,10-éthano-10-(4-méthylphényl)-2-
vinyloxycarbonyl-2,3,3a,4,10,10a-hexahydro-lH-indolo[2,3-f]isoindole-3a-
carboxylate
de méthyle-(3aRS,4SR,lOSR,lOaRS) 170 cm3 de méthanol est agitée pendant vingt
25 quatre heures à température voisine de 20°C dans 50 cm3 d'une
solution 6N de gaz
chlorhydrique dans le dioxane. Après évaporation du solvant, on obtient 3,6 g
(92%)
de chlorhydrate de 4,10-éthano-10-(4-méthylphényl)-2,3,3a,4,10,10a-hexahydro-
1H-
indolo[2,3-f]isoindole-(3aRS,4SR,lOSR,lOaRS), sous forme de poudre grise dont
les
caractéristiques sont les suivantes
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
66
- point de fusion : > 260°C
- spectre de R.M.N. 1H (300 MHz, (CD3)zS0 d6, d en ppm) : 1,47 - 1,72 et de
2,25 à
2,45 (3 mts, respectivement 1H - 1H et 2H : CHZCH~ ; 2,44 (s, 3H : Ar CH3) ;
3,00 -
3,20 et de3,30 à 3,80 (3 mts, respectivement 1H- 1H et 3H : CH2 en 1 - CH2 en
3 -
CH en l0a) ; 3,46 (s, 3H : COOCH3) ; 3,83 (s large, 1H : CH en 4) ; 6,97 et de
7,15 à
7,50 (mt, 8H en totalité : H aromatiques) ; 9,38 et 9,63 (2 mfs, 1H chacun :
NH2+Cl-) ;
10,40 (s, 1H : NH).
Etape K
A une solution de 230 mg (0,0013 mol) d'acide 2-(2-
méthoxyphényl)propènoïque dans 10 cm3 de dichlorométhane contenant 0,3 cm3 de
N,N-diméthylformamide on ajoute goutte à goutte une solution de 0,12 cm3
(0,0013
mol) de chlorure d'oxalyle dans 8 cm3 de dichlorométhane. Le mélange
réactionnel est
encore agité pendant une heure à une température voisine de 20°C puis
refroidi à une
température voisine de 0°C et coulé goutte à goutte dans une solution
de 500 mg
(0,0012 mol) de 4,10-éthano-10-(4-méthylphényl)-2,3,3a,4,10,10a-hexahydro-1H-
indolo[2,3-f]isoindoIe-(3aRS,4SR,lOSR,lOaRS) dans 10 cm3 de dichlorométhane et
0,3b crn3 (0,0026 mol) de triéthylamine en maintenant la température au
voisinage de
0°C. Le mélange réactionnel est encore agité pendant quatre heures à
une température
voisine de 20°C et versé dans 30 cm3 d'eau distillée. La phase
organique est séparëe
par décantation, lavée par deux fois 30 cm3 d'eau distillée puis par trois
fois 10 cm3
d'une solution aqueuse normale d'acide chlorhydrique, séchée sur sulfate de
magnésium et concentrée sous pression réduite. Après purification par flash-
chromatographie sur gel de silice (230-400 mesh), en éluant avec un mélange
cyclohexane-acétate d'éthyle (75-25 en volumes), on obtient 240 mg (37%) de
4,10-
éthano-2-[2-(2-méthoxyphényl)-2-propèn-1-oyl]-10-(4-méthylphényl)-
2,3,3a,4,10,10a-hexahydro-1H-indolo[2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,lOSR,lOaRS) sous forme de solide blanc dont les caractéristiques
sont les
suivantes
- point de fusion > 260°C
CA 02315144 2000-06-13
WO 99!33834 PCTIFR98102804
67
- spectre de R.M.N. 1H (400 MHz, (CD3)2S0 d6, à une température de 393 K, d en
ppm) : 1,38 - 1,60 et 2,12 {3 mts, respectivement 1H - 1H et 2H : CHZCHZ) ;
2,42 (s,
3H : ArCH3) ; de 3,20 à 3,45 (mt, 3H : CH2 en 1 et CH en 10a) ; 3,44 {s, 3H
COOCH3) ; 3,52 et 4,06 (respectivement d et d large, J = 12,5 Hz, 1H chacun :
CH2
en 3) ; 3,73 (s, 3H : ArOCH3) ; 3,84 (s large, 1H : CH en 4) ; 5,54 et 5,80 (2
s larges,
1H chacun : =CHZ) ; de 6,90 à 7,10 et de 7,15 à 7,45 (mt, 12H en totalité
H aromatiques) ; 9,75 (mf, 1H : NH).
Etape L
b10 mg (0,0011 mol) de 4,10-éthano-2-[2-(2-méthoxyphényl)-2-propèn-1-
oyl]-10-(4-méthylphényl)-2,3,3a,4,10,10a-hexahydro-1H-indolo[2,3-f]isoindole-
3a-
carboxylate de méthyle-(3aRS,4SR,lOSR,lOaRS) sont chauffés à reflux, pendant
cinq
heures, dans 20 cm3 de dioxane en présence de 5 cm3 (0,005 mol) d'une solution
aqueuse normale d'hydroxyde de sodium. Le mélange réactionnel est ensuite
concentré sous pression réduite et le résidu dissout dans 25 cm3 d'eau
distillée. La
phase aqueuse est lavée par une fois 20 cm3 de dichlorométhane puis acidifiée
par une
solution aqueuse normale d'acide chlorhydrique jusqu'à un pH voisin de 1. On
extrait
avec 2 fois 20 cm3 de dichlorométhane. La phase organique est séparée par
décantation, lavée à l'eau distillée, séchée sur sulfate de magnésium et
concentrée sous
pression réduite. Le sofide obtenu est purifié par recristallisation dans du
méthanol. On
obtient ainsi, 90 mg (15 %) d'acide 4,10-éthano-2-[2-(2-méthoxyphényl)-2-
propèn-1-
oyl]-10-(4-méthylphënyl)-2,3,3a,4,10,10a-hexahydro-1H-indolo[2,3-f]isoindole-
3a-
carboxylique-{3aRS,4SR,lOSR,lOaRS) sous forme de poudre blanche dont les
caractéristiques sont les suivantes
- point de fusion = 190°C
- spectre de R.M.N. 1H (400 MHz, (CD3)2S0 d6, à une température de 413 K, d en
ppm) : 1,37 - 1,59 et 2,13 (3 mts, respectivement 1H - 1H et 2H : CH2CH2) ;
2,43 (s,
3H : ArCH3) ; de 3,20 à 3,50 (mt, 3H : CH2 en 1 et CH en l0a) ; 3,56 et 4,04
(2 d, J
= 12,5 Hz, 1H chacun : CH2 en 3) ; 3,76 (s, 3H : ArOCH3) ; 3,86 (s large, 1H :
CH
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98102804
68
en 4) ; 5,56 et 5,68 (2 s larges, IH chacun : =CH2) ; de 6,90 à 7,05 et de
7,25 à 7,50
(2 mts, 12 H en totalité : H aromatiques) ; 9,46 (mf, 1H : NH).
EXEMPLE 7
.5 Préparation de l'énantiomère dextro~yc~e du N-(3-p~rridyl)méthyl-4.8-éthano-
2-[2-(2-
méthoxyphényl)propènoyl]-8-(4-méth~phényl)-2.3.3a.4,8.8a-hexahydro-lH-
thiéno[2,3-f]isoindole-3a-carboxamide-(3aRS.4SR.8SR,8aRS).
En opérant comme à l'exemple 5, mais à partir de 500 mg (1 mmole) de
l'énantiomère
dextrogyre de l'acide 4,8-éthano-2-(2-(2-méthoxyphényl)propènoyl]-8-(4-
méthylphényl)-2,3,3a,4,8,8a-hexahydro-lH-thiéno[2,3-f]isoindole-3a-
carboxylique-
(3aRS>4SR,8SR,8aRS), de 108 mg (1 mmole) de 3-aminométhyl-pyridine, de 210 mg
(1,1 mmole) de chlorhydrate de 1-éthyl-3-[(3-diméthylamino)propyl]carbodiimide
et
de 15,3 mg (0,11 mmole) d'hydrate de N-hydroxybenzotriazole dans 20 cm3 de
dichlorométhane pendant 20 h. à température ambiante, on obtient, après
recristallisation dans l'éthanol aqueux à ?0%, 390 mg (66%) d'énantiomère
dextrogyre du N-(3-pyridyl)méthyl-4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-
8-
(4-mëthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f] isoindole-3a-
carboxamide-
(3aRS,4SR,8SR,8aRS), sous forme de cristaux blancs dont les caractéristiques
sont les
suivantes
- point de fusion =149~C
- spectre de masse (IE) : M/Z = 589 (M+)
- pouvoir rotatoire : [a]36s2° _ +142,7 +/- 2Q (c = 0,5 / méthanol).
CA 02315144 2000-06-13
WO 99133834 PCTIFR98/02804
69
L'énantiomère lévogyre du N-(3-pyridyl)méthyl-4,8-éthano-2-[2-(2-
méthoxyphényl)propènoyl]-8-(4-méthylphënyl)-2,3,3a,4,8,8a-hexahydro-lH-
thiéno[2,3-f]isoindole-3a-carboxamide-(3aRS,4SR,8SR,8aRS) peut être obtenu de
la
façon suivante
Etape A
En opérant comme à l'exemple 3, à partir de 12,86 g d'acide 4,8-éthano-2-[2-(2-
méthoxyphényl)propènoyI]-8-(4-méthylphényl)-2,3,3a,4,8,8a-hexahydro- 1H-
thiéno[2,3-f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS), mais en
recueillant les
secondes fractions éluées (temps de rétention 52 mn.), on obtient 5,52 g de
l'énantiomère lévogyre de l'acide 4,8-éthano-2-[2-(2-méthoxyphényl)propënoyl]-
8-(4-
méthylphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-
carboxylique-
(3aRS,4SR,8SR,8aRS), sous forme d'une poudre blanche dont les caractéristiques
sont les suivantes
- spectre de masse (IE) : M/Z = 499 (M+)
- pouvoir rotatoire : [a]365'° - -109 +/- 1,6~ (c = 0,5 / méthanol).
Etape B
En opërant comme à l'exemple 5, mais à partir de 500 mg (1 mmole) de
l'énantiomère
lévogyre de l'acide 4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-
méthylphényl) -2,3,3a,4,8,8a-hexahydro-1 H-thiéno[2, 3-f] isoindole-3a-
carboxylique-
(3aRS,4SR,8SR,8aRS), de 108 mg (1 mmole) de 3-aminométhyl-pyridine, de 210 mg
(1,1 mmole) de chlorhydrate de 1-éthyl-3-[(3-diméthylamino)propyl]carbodiimide
et
de 15,3 mg (0,11 mmole) d.hydrate de N-hydroxybenzotriazole dans 20 cm3 de
dichlorométhane pendant 20 h. à température ambiante, on obtient, après
CA 02315144 2000-06-13
WO 99!33834 PCT/FR98/02804
?0
recristallisation dans l'éthanol aqueux à 60%, 530 mg (90%) d'énantiomère
lévogyre
du N-(3-pyridyl)méthyl-4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-8-(4-
méthylphényl)-2,3,3a,4,8,8a-hexahydra-1H-thiéno[2,3-f]isoindole-3a-carboxamide-
(3aRS,4SR,8SR,8aRS), sous forme de .cristaux blancs dont les caractéristiques
sont les
suivantes
- point de fusion = 150qC
- spectre de masse (IE) : M/Z = 589 (M+)
- pouvoir rotatoire : [a]36;'° _ +145,7 +/- 2q (c = 0,5 / méthanol).
EXEMPLE 8
Préparation du 4 8 éthano 8 (4 méthoxyphénYl)-2-[2-(2-méthoxyphényl)pronènoyl]-
2 3 3a 4 8 8a hexahydro 1H thiéno[2 3-f]isoindole-3a-carboxvlate de méthvle-
(3aRS 4SR.8SR.8aRS).
Etape A
Sous atmosphère d'argon, on ajoute 1,02 g (9,5 mmoles) de 4-bromoanisole à une
suspension de 201 mg de magnésium dans 10 cm3 d'oxyde de diéthyle et 2 cm3 de
tétrahydrofurane. Après disparition du magnésium, on ajoute 731 mg (3 mmoles)
de
chlorure de cérium, puis on refroidit à lOqC. On ajoute alors, goutte à
goutte, une
solution de 1,56 g (4,2 mmoles) de 2-benzyl-4-(3-thiényl)-7-oxo-
octahydroisoindole-
3a-carboxylate de méthyle-(3aRS,4SR,7aRS) dans 5 cm3 de toluène. Après une
nuit
d'agitation à température ambiante, on hydroyse par addition de 25 cm3 d'une
solution
aqueuse saturëe de chlorure d' ammonium. La phase organique est décantée,
lavée
successivement par 10 cm3 d'une solution aqueuse saturëe de chlorure
d'ammonium
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
71
puis par 10 cm3 d'eau, séchée sur sulfate d'ammonium et concentrée sous
pression
réduite. Le résidu est dissous dans 100 cm3 d'un mélange de toluène et
d'acétate
d'éthyle (80-20 en volumes) et on ajoute 15 g de gel de silice (230-400 Mesh).
Après
15 mn. d'agitation, la silice est filtrée. On obtient ainsi 1,37 g (68%) de 2-
benzyl-7-
hydroxy-7-(4-méthoxyphényl)-4-(3-thiényl)-octahydroisoindole-3a-carboxylate de
méthyle-(3aRS,4SR,7SR,7aRS), sous forme d'une huile orange très visqueuse dont
les
caractéristiques sont les suivantes
- spectre de masse (IE) : M/Z = 477 (M+).
Etape B
En opérant comme à l'étape H de l'exemple 1, mais à partir de 1,37 g (2,9
mmoles) de
2-benzyl-7-hydroxy-7- (4-méthoxyphényl)-4-(3-thiényl)-octahydroisoindole-3a-
carboxylate de méthyle-(3aRS,4SR,7SR,7aRS) et de 1,5 g (10 mmoles) d'acide
trifluorométhanesulfonique dans 15 cm3 de dichlorométhane, on obtient, après
purification par flash-chromatographie sur gel de silice (230-400 Mesh) en
éluant par
un mélange de cyclohexane et d'acétate d'éthyle (80-20 en volumes), 1,07 g
(80%) de
2-benzyl-4,8-éthano-8-(4-méthoxyphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-
f]isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une
huile
jaune dont les caractéristiques sont les suivantes
- spectre de masse (IE) : M/Z = 459 (M+).
Etape C
En opérant comme à l'étape I de l'exemple 1, mais à partir de 1,37 g (3
mmoles) de 2-
benzyl-4,8-éthano-8-(4-méthoxyphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno(2,3-
f]isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS} et de 639 rng de
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
72
chlorofomliate de vinyle pendant 4 h. dans 10 cm3 de dichlorométhane, puis en
reprenant le résidu pendant 5h. au reflux dans 5 cm3 d'une solution 2N d'HCl
dans le
méthanol et 10 cm3 de méthanol, on obtient 910 mg (82%) de 4,8-éthano-8-(4-
méthoxyphényl)-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-
carboxylate de
méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une huile jaune dont les
caractéristiques
sont les suivantes
spectre de masse (IE) : M/Z = 369 (M+).
Etape D
A une solution de 530 mg (3 mmoles} d'acide 2-(2-méthoxyphényl)propènoique et
de
545 mg (5,4 mrnoles) de triéthylamine dans 5 cm3 de dichlorométhane contenant
0,1
cm3 de N,N-diméthylformamide, on ajoute, goutte à goutte à OgC, 343 mg (2,7
mmoles) de chlorure d'oxalyle. Après 2 h. d'agitation à température ambiante,
la
solution est refroidie à OqC. On ajoute alors une solution de 910 mg (2,5
mmoles) de
4,8-éthano-8-(4-méthoxyphényl)-2,3,3a,4,8,8a-hexahydro-1 H-thiéno[2,3-
f]isoindole-
3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS) dans 10 cm3 de dichlorométhane.
Après une nuit d'agitation à température ambiante, on ajoute 10 cm3 d'eau. La
phase
organique est décantée, lavée à l'eau, séchée sur sulfate de sodium et
concentrée sous
pression réduite. Le résidu est purifié par flash-chromatographie sur gel de
silice (230-
400 Mesh) en éluant par un mélange de cyclohexane et d'acétate d'éthyle (70-30
en
volumes). On obtient ainsi 760 mg (69%) de 4,8-éthano-8-(4-méthoxyphényl)-2-[2-
(2-
méthoxyphényl) propènoyl]-2,3,3a,4, 8,8a-hexahydro-1 H-thiéno[ 2,3-f]
isoindole-3a-
carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une poudre blanche
dont
les caractéristiques sont les suivantes
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
73
- point de fusion =115gC
- spectre de masse (IE) : M/Z = 529 (M+).
EXEMPLE 9
Préparation de l'acide 4 8-éthano-8-(4-méthoxmhényl)-2-f2-(2-
méthoxyphényl)eronènoyll-2 3 3a 4 8 8a-hexahydro-1H-thiénof2 3-flisoindole-3a-
carboxyliaue-(3aRS 4SR 8SR 8aRS).
En opérant comme à l'exemple l', mais à partir de 340 mg (0,64 mmole) de 4,8-
éthano-8-(4-méthoxyphényl)-2-[2-(2-méthoxyphényl)propènoyl]-2,3,3a,4,8,8a-
~10 hexahydro-1H-thiéno(2,3-~isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS) et de 0,38 cm3 d'une solution aqueuse 5N d'hydroxyde de
sodium dans 4 cm3 de dioxane pendant 4 h. à 50~C, on obtient, après
purification par
chromatographie sur plaque préparative de gel de silice (épaisseur 0,2 mm,
élution par
des mélanges de cyclohexane et d'acétate d'éthyle de 50-50 à 5-95 en volumes),
120
mg (36%) d'acide 4,8-éthano-8-(4-méthoxyphényl)-2-[2-(2-
méthoxyphényl)propènoyl]-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-
carboxylique-(3aRS,4SR,8SR,8aRS), sous forme d'une poudre blanche dont les
caractéristiques sont les suivantes
- point de fusion =178QC
- spectre de masse (IE) : M/Z = 515 (M+).
EXEMPLE 10
CA 02315144 2000-06-13
WO 99133834 PCTIFR98/02804
74
Préparation du N (3-pyridyl)méthyl-8-(benzo-14-dioxan-6-vl)-4.8-éthano-2-f2-(2-
méthoxyphényl)pronèno~rll-2 3 3a 4 8 8a-hexahydro-1H-thiénof 2.3-flisoindole-
3a-
carboxamide-(3aRS 4SR 8SR,8aRS).
Etape A
A une solution refroidie à O~C de 1,35 g (2,8 mmoles) de 2-benzyl-7-oxo-4-(3-
thiényl)-octahydroisoindole-3a-carboxylate de méthyle-(3aRS,4SR,7aRS) et de
1,36 g
{10 mmoles) de benzodioxane dans 30 cm3 de dichlorométhane, on ajoute 3 g (20
mmoles) d'acide trifluorométhanesulfonique. Après 2 h. d'agitation à
température
ambiante, le milieu réactionnel est hydrolysé par addition de 20 cm3 d'une
solution
aqueuse saturée d'hydrogénocarbonate de sodium. La phase organique est
décantée,
lavée à l'eau, séchée sur sulfate de sodium et concentrée sous pression
réduite. Le
résidu est purifié par flash-chromatographie sur gei de silice (230-400 Mesh)
en éluant
par un mélange de cyclohexane et d'acétate d'éthyle (80-20 en volumes). On
obtient
ainsi 1,07 g (40%) de 8-(benzo-1,4-dioxan-6-yl)-2-benzyl-4,8-éthano-
2,3,3a,4,8,8a-
hexahydro-1H-thiéno(2,3-f]isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS), sous forme d'une huile jaune dont les caractéristiques
sont les
suivantes
- spectre de masse (IE) : M/Z = 487 (M+).
Etape B
En opérant comme à l'étape I de l'exemple 1, mais à partir de 584 mg (1,2
mmole) de
8-(benzo-1,4-dioxan-6-yl)-2-benzyl-4,8-éthano-2,3,3a,4,8,8a-hexahydro-1H-
thiéno[2,3-f]isoindole-3a-carboxylate de méthyle-(3aRS,4SR,8SR,8aRS) et de 25b
mg
(2,4 mrnoles) de chloroformiate de vinyle pendant 4 h. dans 5 cm3 de
dichlorométhane,
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98/02804
puis en reprenant le résidu pendant 2 h. au reflux dans 5 cm3 d'une solution
2N d'HC1
dans le méthanol et 5 cm3 de méthanol, on obtient 480 mg (99%) de 8-(benzo-1,4-
dioxan-6-yl)-4,8-éthano-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-
carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une huile jaune
utilisée
5 telle quelle dans la suite de la synthèse, dont les caractéristiques sont
les suivantes
- spectre de masse (IE) : M/Z = 397 (M+).
Etape C
En opérant comme à l'étape D de l'exemple 8, mais à partir de 250 mg (1,4
mmole)
d'acide 2-(2-méthoxyphényl)propènoique et de 282 mg (2,8 mmoles) de
triéthylamine
10 dans 15 cm3 de dichlorométhane contenant 0,1 cm3 de N,N-diméthylformamide,
et de
178 mg (1,4 mmole) de chlorure d'oxalyle, puis de 480 mg (1,2 mmole) de 8-
(benzo-
1,4-dioxan-6-yl)-4,8-éthano-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-
3a-
carboxylate de méthyle-(3aRS,4SR,8SR,8aRS) dans 5 cm3 de dichlorométhane, on
obtient, après purification par flash-chromatographie sur gel de silice (230-
400 Mesh)
15 en éluant par un mélange de cyclohexane et d'acétate d'éthyle (70-30 en
volumes),
435 mg (72%) de 8-(benzo-1,4-dioxan-6-yl)-4,8-éthano-2-[2-(2-
méthoxyphényl)propènoyl]-2,3,3a,4,8,8a-hexahydro-1H-thiéno[2,3-f]isoindole-3a-
carboxylate de méthyle-(3aRS,4SR,8SR,8aRS), sous forme d'une poudre blanche
dont
les caractéristiques sont les suivantes
20 - point de fusion = 148~C
- spectre de masse (IE) : M/Z = 557 (M+).
Etape D
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
76
En opérant comme à l'exemple l', mais à partir de 430 mg (0,77 mmole) de 8-
(benzo-
1,4-dioxan-6-yl)-4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-2,3,3a,4,8,8a-
hexahydro-1 H-thiéno [2, 3-f] isoindole-3a-carboxylate de méthyle-
(3aRS,4SR,8SR,8aRS) et de 0,46 cm3 d'une solution aqueuse 5N d'hydroxyde de
sodium dans 5 cm3 de dioxane pendant 4 h. au reflux, on obtient, après
purification par
flash-chromatographie sur gel de silice en éluant par un mélange de
cyclohexane et
d'acëtate d'éthyle (50-50 en volumes), 305 mg (73%) d'acide 8-(benzo-1,4-
dioxan-6-
yl)-4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-2,3,3a,4,8,8a-hexahydro-1H-
thiéno(2,3-f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS), sous forme d'une
poudre blanche dont les caractéristiques sont les suivantes
- point de fusion =168~C
- spectre de masse (IE) : M/Z = 543 (M+).
Etape E
En opérant comme à l'exemple 5, mais à partir de 300 mg (0,56 mmole) d'acide 8
(benzo-l,4-dioxan-6-yl)-4,8-éthano-2-(2-(2-méthoxyphényl)propènoyl]-
2,3,3a,4,8,8a
hexahydro-1H-thiéno[2,3-f]isoindole-3a-carboxylique-(3aRS,4SR,8SR,8aRS), de 60
mg (0,5b mmole) de 3-aminométhyl-pyridine, de 110 rng (0,6 mmole) de
chlorhydrate
de 1-éthyl-3-[(3-diméthylamino)propyl]carbodiimide et de 8 mg (0,06 mmole)
d'hydrate de N-hydroxybenzotriazole dans 20 cm3 de dichlorométhane pendant 20
h. à
température ambiante, on obtient, après purification par flash-chromatographie
sur gel
de silice (230-400 Mesh) en éluant par un mélange de dichlorométhane et de
méthanol
(90-10 en volumes), 190 mg (54%) de N-(3-pyridyl)méthyl-8-(benzo-1,4-dioxan-6-
yl)-4,8-éthano-2-[2-(2-méthoxyphényl)propènoyl]-2,3,3a,4,8,8a-hexahydro-1H-
CA 02315144 2000-06-13
WO 99/33834 PCTIFR98/02804
77
thiéno[2,3-f)isoindole-3a-carboxamide-(3aRS,4SR,8SR,8aRS), sous forme de
cristaux
blancs dont les caractéristiques sont les suivantes
- point de fusion =155~C
- spectre de masse (IE) : M/Z = 634 (M+)
Il fait partie des capacités normales de l'homme du métier de mettre en oeuvre
Ies
procédures décrites ci-dessus à partir des produits de départ correspondants
pour
préparer êgalernent et notamment les composés suivants:
Het Ar R X R1,R2 R3
s ~ _ C=CHI -OMe, H H
-COOMe
sous forme ~ ~ ou
/
racmique, -COOH
ou
l'nantiomre ou
dextrogyre -CONHBz
ou
i'nantiomre ou
lvogyre,
ou le
mlange des
2
nantiomres ~ ~"
/
sous forme S -COOMe C=CH2 -OMe, H H
racmique, ~ ~ ou
ou
l'nantiomre ~ -COOH
,
dextrogyre ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou le
mlange des
2 NH
nantiomres o
~N
I
/
sous forme s F; -COOMe C=CHZ -OMe, H H
racmique, ~ ~ ou
ou
l'nantiornre ~ -COOH
~
dextrogyre ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou Ie
mlange des ~
2 H
' _
nantiomres N
O
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98102804
78
sous forme S i -COOMe C=CH2 -OMe, H H
racmique, ~ ou
ou
l'nantiomre I ~ -COOH
dextrogyre / ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou le
mlange des ~
2
nantiomres O"NH
I ~N
sous forme S ~ ~ -COOMe C=CHZ -OMe, H H
racmique, ~ ~ o ou
ou
l' nantiomre -COOH
dextrogyre ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou le
mlange des ~
2
nantiomres O"NH
I ~N
sous forme ~ -COOMe C=CHa -OMe, H H
racmique, ~ ~ / ou
ou ~
~
/
l' nantiornre -COOH
dextrogyre ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou le
mlange des
2 ~
nantiomres o
""
I.
/
sous forme ~ -COOMe C=CHZ -OMe, H H
racmique, ~ ~ ou
ou ~
/
l'nantiomre ~ / -COOH
dextrogyre ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou le
mlange des ~
2
~
nantiomres o '""
I ~N
sous forme i F~ -COOMe C=CH2 -OMe, H H
racmique, ~ ~ ou
ou ~
/
l'nantiomre ~ , -COOH
dextrogyre ou
ou
l' nantiomre -CONHBz
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
79
lvogyre, ou
ou le
mlange des ~"
2 ~N
nantiomres
sous forme i ~ -COOMe C=CHZ -OMe, H H
ou ~ ou
racmique /
, ~
l'nantiornre , ~ -COOH
dextrogyre / ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou le
mlange des
2 ~
nantiomres o
""
I/
sous forme i ~ ~ -COOMe C=CH2 -OMe, H H
racmique, ~ ~ o ou
ou ~
/
l' nantiomre -COOH
dextrogyre ou
ou
l' nantiomre -CONHBz
lvogyre, ou
ou le
mlange des I
2 ~
nantiomres N"
o
~N
I //
EXEMPLE A
Evaluation de factivitë farnésvle transférase de composés selon (invention
L'activité farnésyle transférase est mesurée par la quantité farnësylée de
substrat K-ras ou de substrat dérivé du peptide correspondant à sa partie C-
terminale,
le groupement farnésyl étant apporté par le pyrophosphate de farnésyle (FPP).
Précisément, le substrat biotinylé utilisé, représentatif de K-ras : BIOT-
((3A) 3 -
S-K-D-G-(K)6 -S-K-T-K-C-V-I-M, est [3H] farnésylé sur sa cystéine C, par la
farnésyle transférase en présence de [3H]FPP. Il est ensuite mis en contact de
billes
CA 02315144 2000-06-13
WO 99133834 PCTIFR98/02804
PVT*-streptavidine (AMERSHAM)~, et est quantifié par scintillation de
proximité
(dosage SPA) entre le tritium et les billes PVT, grâce à l'interaction
streptavidine/biotine.
Expérimentalement, la farnésyle transférase purifiée selon le protocole ci-
joint,
5 est diluée pour ce dosage à une concentration telle qu'on obtienne une
consommation
en substrats inférieure à 30 %. Les concentrations molaires finales de chaque
substrat
sont ajustées à leur Km respectif : 50 nM pour le peptide K-ras biotinylé et
120 nM
pour le FPP, amenés sous 20 ~.1 dans un volume final de 100 ~.1 du mélange
réactionnel
à base de tampon HEPES 50 mM pH 7.5, MgCIZ 5 mM, KCl 40 mM, dithiothréitol 5
10 mM, Triton X100 0.01 %.
Les inhibiteurs à tester, dissous initialement à 1 mM dans un solvant adéquat
(DMF ou DMSO) sont dilués dans le tampon de dosage et sont ajoutés sous forme
de
10 ~1, en triplicate, dans le mélange réactionnel à une concentration 10 fois
supérieure
à leur concentration finale.
15 La réaction, effectuée dans des plaques de microtitrations OPTIPLATES 96~,
est initiée par l'enzyme et dure soixante minutes à 37°C. Elle est
stoppée par addition
de 150 ~.1 de mélange d'un tampon d'arrêt à pH 4 constitué de H3POa 0,2 M,
MgCl2
1.5 mM, BSA 0.5 % (p/v), azoture de sodium 0,05 % (p/v} contenant 200 pg de
billes
PVT-streptavidine.
20 Après agitation lente de trente minutes (paur éliminer de la
chemilurninescence), les plaques sont lues en [3H]CPM dans un compteur à
scintillation pour microplaques TOP COUN'I'~ (PACKARD) où elles sont
transformées en [3H]DPM à partir d'une gamme d'agent coloré atténuant la
scintillation (« quenching »).
25 Les pourcentages d'inhibition sont calculés par rapport à un témoin sans
inhibiteur après soustraction de toutes les valeurs de celle d' un blanc ne
contenant que
les substrats et le tampon.
Les CIso sont calculées ou mesurées à partir des inhibitions obtenues à neuf
concentrations différentes avec les logiciels Enzfitter~ ou Grafit~'.
CA 02315144 2000-06-13
WO 99133834 PCT/FR98/02804
81
Les composés selon (invention testés présentent des CI;a compris entre O.lnM
et
lOp.M.
EXEMPLE B
L'activité des composés selon (invention peut également être évaluée par la
capacité
desdits composës à inhiber la croissance en agar de clones issus de lignées
tumorales
humaines. Par exemple des cellules de la lignée de carcinome colique humain
HCT116,
fournies par fATCC, sont mises à pousser en monocouche dans un milieu de
culture,
Dubelcco modifié Eagle, contenant 2 rnM de L-glutamine, 200 U/ml de
pénicilline,
200 ~.g/ml de streptomycine complémenté par 10% en volumes de sérum de veau
foetal inactivé à la chaleur. Les cellules en croissance exponentielle sont
trypsinisées,
lavées au PBS et diluées à une concentration finale de 5000 cellules/ml dans
du milieu
de culture complet. Les inhibiteurs à tester, ou le solvant de contrôle sont
alors
ajoutés, sous un volume de 50 p,l, à 2,5 ml de suspension de cellules,
préparée
précédemment, on ajoute ensuite 0,4 ml d'une solution d'agar, Noble Difco,
maintenue
à 45°C puis on mélange. Le milieu ainsi obtenu est immédiatement jeté
dans des boites
de Pétri, maintenu cinq minutes à 4°C puis mis à incuber à 37°C
sous une atmosphère
de 5% de CO~. Les nombre de clones cellulaires (> 50 cellules) est compté
après
douze jours d'incubation à 37°C sous une atmosphère de 5% de CO2.
Chaque
inhibiteur est testé en duplicate aux concentrations finales en agar de 10, 1,
0,1 0,01 et
0,001 ~.g/ml. Les résultats sont exprimés en pourcentage d'inhibition de
clonogénicité
par rapport aux contrôles non traités. Les doses inhibitrices ICso sont
déterminées
graphiquement à partir des moyennes serai-logarithmiques des valeurs obtenues
pour
chaque concentration.
Les produits selon (invention inhibent de 50% la farnésylation de la protéine
Ras à des
concentrations comprises entre 0,1 nM et 100 p.M.
EXEMPLE C
CA 02315144 2000-06-13
WO 99133834 PCTIFR98/02$04
82
EXEMPLE A
On prépare, selon la technique habituelle, des gélules dosées à 50 mg de
produit actif
ayant la composition suivante
- Produit
actif........................................................................
50 mg
-
Cellulose......................................................................
......... 18 mg
-
Lactose........................................................................
.......... 55 rng
- Silice
colloïdale.....................................................................
. 1 mg
- Carboxyméthylamidon sodique............................................. 10
mg
-
Talc...........................................................................
............ 10 mg
- Stéarate de
magnésium........................................................ 1 mg
EXEMPLE B
On prépare selon la technique habituelle des comprimés dosés à 50 mg de
produit actif
ayant la composition suivante
- Produit actif
....................................................................... 50 mg
-
Lactose........................................................................
...........104
mg
-
Cellulose......................................................................
.........40
mg
-
Polyvidone.....................................................................
........10
mg
- Carboxymthylamidon sodique.............................................22
mg
-
Talc...........................................................................
...........IO
mg
- Starate de magnsium........................................................2
mg
- Silice
collodale......................................................................
2 mg
- Mlange d'hydroxymthylcellulose, glycrine, oxyde
de
titane (72-3,5-24,5) q.s.p. 1 comprim pellicul termin
245 mg
EXEMPLE C
On prépare une solution injectable contenant 50 mg de produit actif ayant la
composition suivante
- Produit
actif........................................................................
50 mg
Acide
benzoïque....................................................................
80 mg
- Alcool
benzylique..................................................................
0,06 ml
- Benzoate de
sodium............................................................. 80 mg
- Ethanol à 95
%...................................................................... 0,4 ml
CA 02315144 2000-06-13
WO 99/33834 PCT/FR98I02804
83
- Hydroxyde de
sodium............................................................ 24 mg
- Propylène
glycol.................................................................... 1,6
ml
- Eau........................................................... q.s.p 4 ml