Note: Descriptions are shown in the official language in which they were submitted.
CA 02328298 2000-10-10
WO 99153304 PCT/FR99100830
1
PROCÉDÉ D'ELECTRO-SÉPARATION D'UN ÉCHANTILLON BIOLOGIQUE ET
DISPOSITIF DE MISE EN OEUVRE
La présente invention concerne un procédé d'électro-séparation
d'une fraction nucléique à partir d'un lysat cellulaire, ainsi que tout
dispositif, notamment à usage unique, pour la mise en oeuvre dudit
procédé d'électro-séparation.
Différents procédés, mais aussi dispositifs, ont été à ce jour
proposés ou décrits, aux fins de séparer un matériel nucléique ou une
fraction nucléique, à partir d'un lysat cellulaire.
t o Par " séparation ", on entend de manière générique tout
processus permettant d'enrichir ou concentrer un milieu, isoler ou
déterminer (de manière qualitative et/ou quantitative) dans un milieu
complexe, au moins un matériel nucléique, c'est à dire de l'acide
désoxyribonucléique (ADN) et/ou de l'acide ribonucléique (ARN).
Conformément au document de la Société ISCO, dénommé
ISCO Applications (Bulletin 54, ~ Electroelution of Nucleic Acids and
Proteins from Gels, and Electrophoretic Concentration of Macromolecules
1989), mais aussi conformément au document US-G-4 164 464, i.l est
décrit un dispositif d'électro-élution, et non d'électro-séparation,
comprenant:
- un premier réservoir pour une première solution tampon,
comportant deux compartiment opposés, fermés chacun par une membrane
perméable, l'une de section importante, et l'autre de section faible, et
présentant chacune un seuil de coupure permettant de retenir le matériel
nucléique ou protéique d'intérët,
- un second réservoir pour une deuxième solution tampon,
identique ou différente de la première solution tampon, séparé du premier
réservoir par lesdites membranes,
- deux électrodes en contact électrique avec la seconde solution
tampon, générant un champ électrique traversant les deux membranes
perméables, de celle de section importante à celle de section faible, et donc
traversant la premiêre solution tampon.
Ce dispositif sert à concentrer une fraction nucléique ou
protéique, déjà relativement pure mais diluée, en disposant cette fraction
sur la membrane de section importante, et en recueillant sur la membrane
de section faible la même fraction, mais concentrée. La concentration est
CA 02328298 2000-10-10
WO 99/53304 l'CT/FR99/00830
2
obtenue du fait du transport des biomolécules par les lignes de champ
électrique, qui se concentrent au niveau de la membrane de faible section:
II ne s'agit donc ni d'un procédé; ni d'un dispositif de
séparation, au sens de la définition précédente, c'est à dire au sens où à
partir d'un milieu complexe on sépare ou isole un matériel biologique
d'intérêt.
Conformément à la figure 5 du document US-C- 5 415 758, il
est décrit un procédé d'électro-élution en parallèle, au sein d'une
multiplicité de puits 42 d'une plaque de titration 41. La plâque 41 est
1 o immergée dans un tampon 52, sans débordement de ce dernier à l'intérieur
de chaque puits 42, et chaque puits comporte une membrane 53 fermant
une ouverture 54 ménagée dans son fond, en sorte que une communication
osmotique puisse s'établir entre le tampon 52 et un tampon 55 disposé
dans chaque puits 42. Dans chaque puits 42 s'établit un champ électrique,
grâce à une cathode 24, distribuée entre les différents puits 42, et l'anode
unique 14. L'échantillon biologique 44, comportant un matériel nucléique,
par exemple une goutte de sang disposée sur un support poreux, est élué
par le flux électrolytique, en sorte que dans chaque puits le matériel
nucléique se trouve dissous ou distribué, pour un prélèvement ultérieur, par
20 exemple avec une pipette.
De manière générale, le document US-C-5 415 758 décrit un
procédé de traitement sous l'action d'un champ électrique en milieu liquide,
d'un échantillon biologique comprenant à la fois un matériel nucléique et un
matériel non nucléique, par exemple protéique, libres et mobiles dans ledit
25 milieu liquide sous l'action du champ électrique, procédé selon lequel
a) on dispose d'une solution tampon,
b) on dispose d'une membrane perméable, en contact d'un c&té
avec la solution tampon, et ayant un seuil de coupure prédéterminé pour
arrêter le matériel nucléique, du côté de ladite solution tampon, lors de sa
3o migration sous l'action du champ électrique,
c) on établit ledit champ électrique, en sorte que ses lignes de
force passent au sein de la solution tampon, et traversent la membrane
perméable.
d) on dispose l'échantillon biologique dans la solution tampon,
35 en amont de la membrane, selon le sens de circulation du matériel
nucléique sous l'action du champ électrique,
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99100830
3
En pratique, un tel procédé ne permet pas de séparer le matériel
nucléique de l'échantillon biologique, jusqu'au point d'éliminer pratiquement
tout matériel non nucléique, par exemple protéique.
D'autre part, aux fins de séparer un matériel nucléique, on
connaît la demande de brevet publiée sous le numéro WO 97/41219, qui
divulgue un procédé pour capturer des acides nucléiques à partir d'un
mélange constitué par exemple de cellules lysées. Le procédé nécessite de
déposer une électrode dans le mélange, d'appliquer à l'électrode un voltage
permettant d'attirer les acides nucléiques, puis d'enlever l'électrode
recouverte par les acides nucléiques. L'électrode recouverte des acides
nucléiques est alors plongée dans une solution permettant, par inversion du
courant, de libérer les acides nucléiques qui sont ensuite directement
amplifiables. Le voltage appliqué pour pouvoir effectuer une amplification
est de préférence de 0,5 à 3 volts pendant environ 30 secondes. Ce
~ 5 procédé, bien qu'utile pour séparer des plasmides contenus dans des
cellules E.coli lysées par chauffage, n'est pas adapté pour séparer l'ADN
et/ou l'ARN d'un lysat plus complexe de cellules, notamment provenant
d'un échantillon biologique.
Conformément à la figure 1 du document WO 97134908, il est
décrit un procédé de séparation d'un matériel nucléique à partir d'un
échantillon biologique, en deux étapes
- une première étape consiste à mettre en contact l'échantillon
biologique lysé avec un adsorbant, de manière à fixer séparément le
matériel nucléique,
- une deuxième étape consiste à relarguer ce matériel
nucléique, à partir de l'adsorbant.
Pour le refargage, on dispose dans un récipient 10 d'une
solution tampon, soumise à un champ électrique entre deux électrodes 20a
et 20b. Un récipient séparé 15, mais immergé dans ia solution tampon, est
disposé dans le récipient 10: Ce récipient communique avec le reste du
récipient 10, par l'intermédiaire d'un orifice 12, au travers duquel est
disposée une membrane 30 permettant d'arréter le matériel nucléique en
mouvement sous le champ électrique. Auprès de cet orifice est situé un
puits 60 de prélèvement du matériel nucléique. Et c'est dans fa partie 17
du récipient 15, qu'est disposé l'élément adsorbant duquel ori veut
relarguer le matériel nucléique.
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99/00830
4
Au terme de cet inventaire, aucun procédé n'apparaît permettre
de séparer de manière simple et efficace, un matériel nucléique d'un
matériel non nucléique, notamment protéique, à partir d'un lysat cellulaire
complexe.
La présente invention se propose d'apporter une solution à ce
problème non résolu.
Conformément à la présente invention, on a découvert qu'on
pouvait électro-séparer au moins le matériel nucléique d'un échantillon
biologique, de manière efficace, en traitant l'échantillon biologique
directement sous l'action d'un champ électrique en milieu liquide, et en
choisissant les conditions opératoires suivantes
- on applique le champ électrique directement à l'échantillon
biologique dans la solution tampon, pendant une durée limitée et définie,
d'une part par le temps suffisant pour l'arrivée sur la membrane arrêtant ie
matériel nucléique, et fa présence de matériel nucléique du côté de la
solution tampon, et d'autre part par le fait qu'au terme de ladite durée le
matériel non nucléique n'a pas migré et/ou demeure en cours de migration
vers ladite membrane,
- on prélève fe matériel nucléique au terme de ladite durée.
Par "ëlectro-séparation " dans la présente invention, on entend
que des molécules présentes ensemble dans un milieu, et pouvant
présenter des charges électriques identiques, sont distinguées les unes des
autres dans ledit milieu en raison de leurs cinétiques respectivement
différentes dans un même champ électrique.
Le procédé selon l'invention apporte l'avantage essentiel
d'obtenir rapidement et facilement une fraction nucléique exempte d'autres
constituants, notamment protéines, directement arnplifiable, à partir d'un
lysat cellulaire. On contrait les difficultés liées aux techniques
d'amplification, notamment pour les échantillons de type respiratoire, en ce
que la fraction à amplifier doit être exempte d'inhibiteurs. Par la mise en
oeuvre du procédé selon l'invention, les inhibiteurs protéiques des
techniques d'amplification sont pratiquement éliminés.
La fraction enrichie en matériel nucléique, comprenant l'ADN
et/ou l'ARN, que l'on obtient par la mise en oeuvre du procédé selon
l'invention, est directement amplifiable par les techniques couramment
CA 02328298 2000-10-10
W O 99/53304 PCT/FR99/00830
utilisées, telles que notamment la technique PCR pour les ADN et la
technique NASBA ou TMA pour fes ARN.
Dans un autre mode de réalisation selon l'invention, l'échantüfon
biologique est disposé sur une autre membrane, du côté de cette dernière
5 en contact avec la solution tampon.
Dans un mode de réalisation préféré selon l'invention, le temps
d'application du champ électrique est au plus de 30 minutes, et
préférentiellement compris entre 5 et 30 minutes.
Dans un mode de réalisation très préféré selon l'invention, la
durée de migration de la fraction nucléique est de 10 à 20 minutes, de
préférence encore de 15 minutes.
Dans un mode de réalisation préféré selon l'invention, la valeur
de la molarité de la solution tampon est au moins égaie à 0,1 mol/I, et
préférentiellement comprise entre 0,1 et 5 mol/I.
La molarité de la solution tampon étant comprise entre 0,1 et 5
mol/I, on peut effectivement, soit ne mettre qu'une méme solution tampon
dans les deux compartiments, soit mettre deux solutions tampon
différentes dans les deux compartiments.
La molarité de la solution tampon peut être la même dans les
deux compartiments et sera comprise entre 0,1 et 1 mol/I, de préférence
encore de 0,1 mol/I:
La molarité de la solution tampon peut être différente dans les
deux compartiments et sera respectivement de préférence de 0,1 molli
dans le premier compartiment et de 1 mol/I dans le second compartiment.
Dans un mode de réalisation préféré selon l'invention, le champ
électrique a une valeur comprise entre 100 et 250 V, et préférentiellement
égale à 150 V.
Dans un autre mode de réalisation très préféré selon l'invention,
la distance séparant l'échantillon biologique de la membrane perméable, en
suivant les lignes de force du champ électrique, est au moins égale à 30
mm, et préférentiellement à 75 mm.
Le lysat cellulaire à partir duquel on effectue le procédé selon
l'invention peut être un lysat cellulaire provenant d'une culture simple ou
complexe, c'est à dire comprenant différentes cellules, ou peut être
également un échantillon biologique, tel que notamment du sang, de l'urine
et un crachat de type respiratoire.
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99I00830
s
Le lysat cellulaire à partir duquel on obtient la fraction nucléique,
soumis ensuite au procédé selon l'invention, peut étre obtenu par
différentes techniques de lyse, notamment la lyse par choc mécanique, par
choc électrique et autres.
Dans un mode de réalisation préféré selon l'invention,
l'échantillon biologique résulte directement de la lyse d'un échantillon
cellulaire, notamment par voie mécanique ou électrique. Ce mode de
réalisation est effectué dans ie même dispositif, comme cela est décrit
ci-après.
Dans un autre mode de réalisation préféré selon l'invention, le
lysat cellulaire est obtenu à partir d'un prélèvement d'un liquide corporel,
par exemple sang ou crachat respiratoire.
Lorsque l'échantillon biologique est du sang, on préfère que le
pH de la solution tampon soit de 7.
~ 5 La membrane récupérant la fraction enrichie en matériel
nucléique présente un seuil de coupure prédéterminée, de préférence
inférieure à 100 kDa.
Lorsque l'échantillon biologique est du sang, la porosité de la
membrane à la cathode sera de préférence supérieure à 10 kDa.
Dans un mode de réalisation préféré selon l'invention, on ajoute
une protéinase à l'échantillon biologique.
Dans encore un autre mode de réalisation préféré selon
l'invention, la fraction enrichie en matériel nucléique est directement
soumise à une étape subséquente d'amplification.
La lyse cellulaire sera de préférence encore effectuée , par lyse
électrique en présence de protéinase K et d'un détergent.
Un second objet selon l'invention est un dispositif à usage
unique pour la mise en oeuvre d'un procëdé selon l'invention, comprenant
un support ou base, dans lequel sont rassemblés et intégrés, ainsi
3o qu'agencés entre eux, les différents moyens, notamment électrodes, requis
pour l'électroséparation, ainsi que des moyens d'interfaçage dudit support
avec l'extérieur, d'une part pour ie transfert des différents fluides ou
liquides vers etlou hors du support, dont l'échantillon biologique, la
solution
tampon, et la fraction enrichie en matériel nucléique, et d'autre part pour
l'alimentation et la commande des moyens électriques requis au moins pour
l'électroséparation, dont relie du champ électrique.
CA 02328298 2000-10-10
WO 99153304 PCT/FR99/00830
7
Dans un mode de réalisation préféré selon l'invention, le
dispositif comprend un moyen de réception de l'échantillon biologique; un
rëservoir pour la solution tampon, comportant un compartiment fermé par
la membrane perméable, communiquant à une extrémité opposée audit
compartiment avec le moyen de réception de l'échantillon biologique, ledit
réservoir étant destiné à recevoir une première solution tampon; et un
second réservoir pour une seconde solution tampon, identique ou différente
de la première solution tampon, séparé du premier réservoir uniquement par
ladite membrane; deux électrodes de génération du champ électrique, l'une
au contact de la première solution tampon, en amont de la membrane selon
le sens de circulation du matériel nucléique, et l'autre au contact de la
seconde solution tampon; et un moyen d'extraction de la fraction enrichie
en matériel nucléique du compartiment fermé par la membrane.
Dans un mode de réalisation très préféré selon l'invention, le
T5 réservoir comprend un autre compartiment, pour la réception d'au moins
une fraction obtenue à partir de l'échantillon biologique, disposé en amont
dudit compartiment selon le sens de circulation du matériel nucléique,
communiquant avec le moyen de réception de l'échantillon biologique.
Dans un autre mode de réalisation préféré selon l'invention, les
deux réservoirs communiquent respectivement avec des évents d'aération,
et avec au moins un cana! de remplissage.
Dans encore un autre mode de réalisation préféré selon
l'invention, un puits intermédiaire est disposé et communique entre le
moyen de réception de l'échantillon biologique et le premier réservoir.
Dans encore un autre mode de réalisation préféré selon
l'invention, le puits intermédiaire est pourvu de moyens permettant de lyser
un échantillon cellulaire.
Dans encore un autre mode de réalisation préféré selon
l'invention, fe puits intermédiaire est pourvu d'électrodes assurant une lyse
dudit échantillon cellulaire.
Dans encore un autre mode de réalisation préféré selon
l'invention, le dispositif comprend, communiquant les uns avec les autres,
un compartiment de réception du lysat, un puits intermédiaire de lyse, et un
compartiment de réception de la fraction enrichie en matériel nucléique.
Dans encore un autre mode de réalisation préféré selon
l'invention, le volume du compartiment de réception du iysat est supérieur
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99/00830
8
au volume du compartiment de réception de la fraction enrichie en matériel
nucléique.
Dans encore un autre mode de réalisation préféré selon
('invention, la proportion entre les volumes des compartiments de réception
du lysat et de réception de la fraction nucléique est comprise entre %2 et
1 /50, notamment entre 1 /5 et 1 /20.
Un troisième objet selon l'invention est l'utilisation du dispositif
décrit ci-dessus paur électro-séparer une fraction d'acides nucléiques à
partir d'un lysat cellulaire.
Un quatrième objet selon l'invention est l'utilisation de la
fraction électro-séparée par la mise en oeuvre du procédé selon l'invention
pour détecter etlou identifier des acides nucléiques directement après
amplification.
La Figure 1 représente shématiquement un appareil
~ 5 d'éléctroélution d'acides nucléiques et de protéines à partir d'un gel, et
de
concentration électraphorétique de macromolécules (Isco, Nebraska, USA),
que l'on utilise dans un procédé différent, à savoir d'électro-séparation
selon l'invention. Les compartiments A et B, dans lequel sont plongés deux
électrodes négative et positive respectivement, sont remplis de tampon
20 TBE 1x; le compartiment C, comprenant une partie C1 et une partie C2, et
le compartiment Cf sont remplis de tampon TBE 0.1 x. Une membrane de
dialyse est placée à l'interface des compartiments Cf et B (porosité
100 kDa), et des compartiments C1 et A (porosité 10 kDa).
La Figure 2 indique 1e pourcentage d'acides nucléiques de S.
25 epidermidis récupérés dans le compartiment Cf, après migration à partir
d'un lysat cellulaire obtenu par chocs mécaniques, déterminé par analyse
avec un appareil Vidas (BioMerieux, France), selon l'exemple 2. En abscisse
est représenté le temps de migration (minutes), et en ordonnée est
représenté le pourcentage d'acides nucléiques récupérés dans le
30 compartiment Cf, exprimé en unités relatives de fluorescence.
La Figure 3 présente !a cinétique de récupération des protéines
d'un lysat cellulaire. Le pourcentage des protéines du fysat bactérien est
récupéré dans le compartiment Cf, après migration à partir d'un lysat
cellulaire obtenu par chocs mécaniques, déterminé par dosage Bradford,
35 selon l'exemple 2. En abscisse est représenté le temps de migration
(minutes), et en ordonnée est représenté le pourcentage d'acides
CA 02328298 2000-10-10
WO 99/53304 PCTIFR99100830
9
nucléiques récupérés dans le compartiment Cf, exprimé en densité optique
(DO) à 595 nm.
La Figure 4 présente la cinétique de récupération d'acides
nucléiques à partir de lysat cellulaire. Le pourcentage d'acides nucléiques
de Staphycoccus epidermidis, récupéré dans le compartiment Cf après
migration à partir d'un lysat cellulaire obtenu par chocs électriques, est
déterminé par analyse avec un appareil Vidas, selon l'exemple 2. En
abscisse est représenté le temps de migration (minutes?, et en ordonnée est
représenté le pourcentage d'acides nucléiques récupérés dans le
compartiment Cf, exprimé en unités relatives de fluorescence.
Lâ Figure 5 présente l'amplification des acides nucléiques
purifiés à partir d'un lysat cellulaire. La quantité d'amplicons produits par
PCR à partir de 10 NI de molécules d'ADN est récupérée dans le
compartiment Cf, à partir d'un lysat cellulaire obtenu par chocs
~ 5 mécaniques, après différents temps de migration, selon l'exemple 2. En
abscisse est représenté ie temps de migration (minutes), et en ordonnée est
représenté le pourcentage d'acides nucléiques récupérés dans ie
compartiment Cf, exprimë en unités relatives de fluorescence.
La Figure 6 présente la quantité d'amplicons produits par
2o amplification PCR, après lyse de différentes concentrations initiales de
bactéries par chocs mëcaniques, et migration de leur matériel nucléique
pendant 15 minutes sous un champ électrique, selon l'exemple 2. En
abscisse est représenté le nombre de bactéries initiales pour 200 cul de
lysat, et en ordonnée est représenté le signal obtenu après PCR, exprimé en
25 unités relatives de fluorescence.
La Figure 7 illustre la quantité d'ampücons produits par
amplification TMA, après lyse de différentes concentrations initiales de
bactéries par chocs mécaniques, et migration de leur matériel nucléique
pendant 15 minutes sous champ électrique, selon l'exemple 2. En abscisse
30 est représenté le nombre de bactéries initiales pour 200 ,ul de lysat, et
en
ordonnée est représenté le signal obtenu après TMA, exprimé en DO x
1000.
La Figure 8 indique le pourcentage de protéines du sang
récupéré dans le compartiment Cf en fonction du temps de migration d'un
35 échantillon clinique sanguin lysé par chocs mécaniques, selon l'exemple 3.
En abscisse est représenté le temps de migration (minutes), et en ordonnée
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99/00830
est représenté le pourcentage de protéines récupéré dans le compartiment
Cf, exprimé en DO à 595 nm.
La Figure 9 indique le pourcentage de proteines d'un crachat
récupéré dans le compartiment Cf en fonction du temps de migration d'un
5 échantillon clinique de type respiratoire lysé par chocs mécaniques, selon
l'exemple 2. En abscisse est représenté le temps de migration (minutes), et
en ordonnée est représenté le pourcentage de protéines récupéré dans le
compartiment Cf, exprimé en DO à 595 nm.
La Figure 10 montre l'élimination des inhibiteurs de la PCR
t0 initialement présent dans l'échantillon clinique de type respiratoire. Elle
indique la quantité d'amplicons ADN produits par PCR à partir de
différentes quantités initiales d'ADN de S, epidermidis; selon l'exemple 5.
En abscisse est représenté le nombre de copies d'ADN initiales pour 10 NI
d'échantillon, et en ordonnées est représenté le signal obtenu après PCR,
exprimé en unités relatives de fluorescence.
La Figure 11 indique la quantité d'amplicons produits à partir de
différentes quantités initiales de bactéries lysées et déposées dans le
compartiment C1. Ghaque point représenté sur le graphe représente une
valeur moyenne obtenue à partir de 13 crachats et aspirations bronchiques
différents, selon l'exemple 5. En abscisse est représenté le nombre de
copies d'ADN initiales pour 200 ,ul d'échantillon, et en ordonnées est
représenté le signal obtenu après PCR, exprimé en unités relatives de
fluorescence.
La Figure 12 indique ia quantité d'amplicons produits à partir de
différentes quantités initiales de bactéries lysées par chocs mécaniques, et
déposées dans le compartiment C1, selon l'exemple 5. L'ëtude a été
réalisée en parallèle sur 4 crachats différents. En abscisse est représenté le
nombre de copies d'ADN initiales pour 200 ,ul d'échantillon, et en
ordonnées est représenté le signal obtenu après TMA, exprimé en DO x
1000.
La figure 13 représente un dispositif à usage unique selon
l'invention, vu en perspective.
La figure 14 représente une vue de dessous du dispositif
représenté à la figure 13.
La figure 15 représente représente une vue de dessus du
dispositif représenté à la figure 13.
CA 02328298 2000-10-10
WO 99/53304 PCTIFR99/00830
11
La figure 1 F représente représente une vue en. coupe, selon le
trait de coupe représenté à la figure 15, du dispositif selon la figure 13.
Exemple 1 : Mode opératoire général pour mettre en oeuvre le
procédé selon l'invention.
Le mode opératoire est basé sur l'utilisation d'un appareil
d'éléctroéfution d'acides nucléiques selon la figure 1. Un volume
d'échantillon biologique est déposé soigneusement au fond du
compartiment C1. Les deux électrodes du circuit sont reliées à un
générateur électrique. Une tension constante de 150 V est appliquée aux
bornes du générateur. L'intensité du circuit varie de 15 à 20 mA et la
température du tampon dans le compartiment C varie de 23 à 30°C. Les
molécules biologiques initialement déposées au fond du compartiment C1
migrent dans le champ électrique ainsi créé, à vitesse définie en fonction de
leur charge et de leur taille. Après différents temps de migration, la tension
aux bornes du générateur est arrêtée et les molécules ayant migré vers fa
cathode et de poids moléculaire apparent inférieur ou égal à 10 kDa sont
recueillies dans le compartiment Cf, dans un volume final de 200 ,ul.
L'échantillon ainsi récupéré est conservé dans la glace avant analyse.
L'échantillon biologique déposé dans ie compartiment C1 peut
étre un matériel nucléique et/ou protéique purifié ou non, un lysat
cellulaire,
provenant d'un échantillon biologique tei que le sang, l'urine et un crachat
de type respiratoire. Les lysats cellulaires étudiés ont été obtenus à partir
de S. epidermidis, bactérie à paroi Gram+ (A054). Ces bactéries sont
cultivées en milieu liquide BCC (Bouillon Coeur Cervelle, bioMerieux
410191. Avant lyse, elles sont mises en suspension, soit dans un
prélèvement clinique (crachat liquéfié et décontaminé, sang, plasma,
sérum, ....), soit en tampon de lyse (30 mM Tris-HCI, 5 mM EDTA, 100
mM NaCI pH 7.2). 300 ,ul de cette suspension cellulaire ont été lysés en
suivant essentiellement deux protocoles
- Protocole de Ivse oar chocs mécaniaues : 90 ,ul de billes de
verre de diamètre compris entre 90 et 150 Nm, 3 billes de fer de diamètre
2 mm et 5 billes de verre de diamètre 3 mm sont placés dans un tube
Faicon en présence de 300Ni de la suspension cellulaire, comme décrit dans
le brevet (FR-A-2 768 7431. 6 mg /ml final de protéinase K (PK) (E.C.
3.4.21.14 Boehringer-Mannheim, ref. 10927661 peut être ajoutée à la
suspension cellulaire. Le tube fermé est vortexé pendant deux minutes, à
CA 02328298 2000-10-10
W0 99/53304 PCTlFR99/00830
12
puissance maximale de l'appareil (Reax 2000, Heidolph). La suspension
bacterienne ainsi traitée et récupérée est déposée immédiatement dans le
compartiment C1 du dispositif décrit dans la Figure 1. Si la PK est présente
dans la solution cellulaire, une incubation supplémentaire de 15 minutes à
37°C est réalisée.
Protocole de I~se par choc électrique : 300 ,ul de la
suspension cellulaire sont déposés dans une cuve d'électroporation
caractérisée par une distance entre les deux électrodes de 2 mm, en
présence de 0.01 à 6 mg /ml final de PK: La cuve est placée dans un circuit
~ 0 électrique dont les paramètres sont choisis comme suit : tension 500 V,
résistance 186 Ohms, capacité de 500 ou 1500 ,uFD. Après lancement
d'une impulsion électrique, la décharge électrique se réalise en quelques
millisecondes entre les deux électrodes. Le lysat ainsi récupéré est déposé
immédiatement dans le compartiment A du dispositif décrit dans la Figure 1
~ 5 (FR-A-2 763 957).
Le pourcentage d'acides nucléiques recueilli du côté de la
cathode, après migration dans le compartiment Cf, est déterminé par
mesure de DO (densité optique) de l'échantillon récupéré à 260 nm. Le
pourcentage recueilli est égal au rapport de fa valeur de DO à 260 nm après
20 migration, sur la valeur de DO à 260 nm avant migration. De méme, la
quantité de protéines recueillies à la cathode après migration est
déterminée par dosage Bradford et lecture de DO à 595 nm. Le
pourcentage de protéines recueillies est égal au rapport de la quantité
protéique récupérée sur la quantité initiale.
25 La quantité des acides nucléiques récupérés du côté de la '
cathode après migration est vérifiée sur gel d'agarose 0.8% ; 10 NI de
l'échantillon sont déposés par puits, la migration électrophorétique est
réalisée sous voltage constant (150 V) et le gel est coloré au bromure
d'ethidium (BET) avant observation sous rayonnement - ultra-violet. En
30 parallèle, les protéines récupérées à 1a cathode après migration peuvent
être observées sur gel de polyacrylamide en présence de SDS (SDS-PAGE
10%); - 5 à 10 NI de l'échantillon sont déposés par puits, la migration
électrophorétique est réalisée sous intensité constante (25 mA), et le gel
est coloré au bleu de Coomassie.
35 La quantité d'acides nucléiques récupérés du côté de la cathode
est déterminée par détection spécifique selon une technique d'hybridation
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99100830
13
dite sandwich, en utilisant l'appareil Vidas commercialisé par bioMérieux
(France). Des sondes oligonucléotidiques de capture et de détection
spécifiques des acides nucléiques de S. epidermidis (EP-A-0 632 269) ont
été choisies. Les oligonucléotides de capture et de détection ont
respectivement pour séquence : 5'-GACCACCTGTCACTCTGTCCC-3' (SEQ
ID N° :1 ) et 5'-GGAAGGGGAAAACTCTATCTC-3' (SEQ ID N° :2).
La
sonde de détection est marquée par couplage avec la phosphatase alcaline
(AKP). L'hybridation spécifique de ces sondes avec les acides nucléiques
libérés dans le lysat est fonction de la quantité d'acides nucléiques
prësents, mais aussi de leur accessibilité pour les sondes utilisées.
Deux protocoles d'amplification spécifique des molécules d'ADN
et d'ARN de S. epidermidis ont été réalisés à partir des échantillons
recueillis après migration : un protocole PCR pour l'amplification de /'ADN
et un protocole NASBA pour l'amplification de l'ARNr16S et un protocole
TMA pour l'amplification de l'ARNr 16S.
-Protocole PCR : la technique de PCR suivie est celle décrite par
Goodman dans PCR Strategies, Ed : Innis, Gelford et Sninsky Academic
press 1995, pp 17-31. Deux amorces d'amplification ont été utilisées, elles
présentent les séquences suivantes
Amorce 1 : 5'-ATCTTGACATCCTCTGACC-3' (SEQ ID N ° :3)
Amorce 2 : 5'-TCGACGGCTAGCTCCAAAT-3' (SEQ ID N° :4)
Les cycles de température suivants ont été utilisés
1 fois 3 minutes à 94°C
2 minutes à 65 ° C
35 fois 1 minute à 72°C
1 minute à 94°C
2 minutes à 65°C
1 fois 5 minutes à 72°C
-Protocole TMA : la technique de TMA suivie est celle décrite
par US-A-5 554 516. Deux amorces d'amplification ont été utilisées, elfes
présentent les séquences suivantes
Amorce 1 . 5'-TCGAAGCAACGCGAAGAACCTTACCA -3' (SEQ
ID N° :5)
Amorce 2 : 5'-AATTCTAATACGACTCACTATAGGGAGGTT
TGTCACCGGCAGTCAACTTAGA -3' (SEQ ID N ° :6)
CA 02328298 2000-10-10
WO 99153304 PCT/FR99/00830
14
,ul ou 50 NI d'échantillon recueilli sont utilisés pour chaque
essai PCR et TMA, respectivement. Les amplicons produits par PCR sont
observés sur gel d'agarose 0.8% et quantifiés sur Vidas selon le protocole
décrit ci-dessus. Les amplicons produits par TMA sont détectés et
5 quantifés sur microplaque par hybridation avec une sonde de capture et
une sonde de détection, spécifiques de S. epidermidis, selon ia méthode
décrite par P. Cros et al., Lancet 1992, 240 :870. La sonde de détection
est couplée à la " Horse Radish Peroxidase " (HRP). Les deux ~ sondes
présentent les séquences suivantes
10 Sonde de capture : 5'-GATAGAGTTTTCCCCTTC-3' (SEQ ID
N° :7)
Sonde de détection : 5'-GACATCCTCTGACCCCTCTA -3' tSEQ
ID N° :8)
Exemple 2 : Cinétique de récupération d'acides nucléiques à
partir de lysat cellulaire.
Une suspension de Staphylococcus epidermidis (1-5.109
b./300,u1) est lysée par choc mécanique ou par choc électrique, comme
décrit dans le protocole général ci-dessus. 200 cul de chaque lysat sont
déposés au fond du compartiment C1. Le champ électrique est appliqué
2o pendant différents temps entre les deux électrodes. Les quantités d'acides
nucléiques ou de protéines présentes dans l'échantillon recueilli dans le
compartiment Cf sont déterminées par analyse avec un appareil Vidas ou
dosage Bradford, respectivement. La qualité des molécules récupérées a
été appréciée sur gel d'agarose ou d'acrylamide, en présence de SDS.
- LYsat cellulaire obtenu par choc mécaniaue
Les acides nucléiques du lysat ont migré dans le compartiment
Cf progressivement au cours du temps, comme montré à la figure 2. Après
60 minutes, la totalité du matériel nucléique du lysat est récupéré, quelque
soit la présence ou non de protéinase K pendant l'étape de lyse. Ce résultat
3o est en faveur d'une bonne libération et accessibilité des acides nucléiques
dans le lysat. Les molécules d'ADN récupérées ont le même profil de
migration sur gel d'agarose 0:8% qu'avant migration dans le lysat. En
présence de protéinase K pendant l'étape de lyse, comme montré à la
figure 3, seul un pourcentage négligeable de protéines est récupéré aprës
60 minutes, tandis qu'en l'absence de protéase, environ 50% de protéines
sont récupérées.
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99/00830
- L~at cellulaire obtenu par choc electrique.
En présence de PK pendant l'étape de lyse, comme montré à la
figure 4, les acides nucléiques du lysat migrent progressivement jusqu'à la
cathode. Après 60 minutes, un pourcentage important d'acides nucléiques
5 est récupéré. La récupération du matériel nucléique présent initialement
dans ce lysat est similaire à celle du matériel nucléique présent initialement
dans un lysat obtenu par choc mécanique (cf. ci-dessus). Par contre, en
absence de PK pendant l'étape de lyse, aucun acide nucléique ne peut être
détecté dans le compartiment Cf, même après 60 minutes de migration
10 (analyse Vidas et gel d'agarose 0.8%). Sur ge! d'agarose, les molécules
d'ADN et d'ARN du lysat récupérées sont observables séparément après
migration, alors qu'elles ne le sont pas initialement dans le lysat.
- Amplification des acides nucléiques purifiés à partir de Ivsat
cellulaire
15 Les bactéries S. epidermidis diluées dans 300 NI de tampon de
lyse sont lysées par choc mécanique en l'absence de PK, comme décrit
dans ie protocole général de l'exemple 1. 200,u1 du lysat sont déposés au
fond du compartiment C1. Un champ électrique est appliqué entre les deux
électrodes pendant différents temps. I_e matériel nucléique qui a migré dans
le compartiment Cf est amplifié par PCR (10 NI par essai) ou TMA (50 NI
par essai). La quantité d'amplicons produite est analysée par hybridation
spécifique sur Vidas ou microplaque, respectivement.
- Amplification PCR des molécules d'ADN récupérées après
migration
Pour 104 bactéries initiales lycées, déposées dans le
compartiment C1, différentes quantités d'amplicons sont produites, en
fonction du temps de migration. Pour 15 minutes de migration, comme
représenté à la figure 5, les molécules d'ADN récupérées permettent une
production optimale d'amplicons par PCR. Avant 15 minutes, une quantité
3o inférieure de molécules d'ADN sont récupérées. Pour 20 minutes et après,
une quantité supérieure de molécules d'ADN sont récupérées, mais de
qualité moins adaptée à une amplification PCR optimale. Plus la migration
dure, plus la structure de l'acide nucléique peut être altérëe. Afin d'obtenir
une amplification PCR optimale, un compromis entre quantité et qualité des
molécules d'ADN récupérées à la cathode doit être respecté. Ce résultat a
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99/00830
16
été confirmé en utilisant des suspensions initiales de S. epidermidis plus
concentrées (105-106 bactéries initiales /200,u1).
Comme représenté à le figure 6, l'ADN d'un nombre supérieur
ou égal à 1.103 bactéries initiales (/200NI) peut être amplifié et détecté,
après lyse mécanique des cellules et migration des constituants du lysat
sous champ électrique; soit 102 molécules d'ADN ou bactéries par essai
PCR, étant donné que le matëriel migré est récupéré dans 200 ,ul et que 10
,ul de ce matériel est utilisé pour chaque essai PCR. 102 molécules d'ADN
correspondent à la limite de sensibilité du protocole PCR, de façon
générale. Ce résultat démontre une grande sensibilité de rëcupération des
molécules d'ADN bactérien après lyse cellulaire par choc mécanique et
purification des molécules d'ADN intracellulaire par champ électrique en
solution.
- Amplification TMA des molécules d'ARN rëcur~érées après
migration
Comme représenté à la figure 7, l'ARN de au moins 40 bactéries
initiales (1200~r1) peut être détecté après lyse des bactéries, migration des
constituants cellulaires sous champ électrique et amplification
spécifique des ARNr16S de S epidermidis ; soit 10 bactéries initiales par
essai TMA, compte tenu que le matériel nucléique migré est récupéré dans
200 NI final, et que 50 NI sont ajoutés par essai TMA. Ce résultat témoigne
d'une grande sensibilité de récupération des molécules d'ARNr 16S
bactérien, après lyse par choc mécanique et purification des acides
nucléiques du lysat par champ électrique.
Exemple 3 : Cinétique de récupération d'acides nucléiques à
partir d' un échantillon sanguin.
L'échantillon sanguin est utilisé sans pré-traitement préalable.
200 ~I de cet échantillon clinique est déposé au fond du compartiment C1.
Un voltage de 150 V est appliqué entre les deux électrodes pendant
différents temps, puis le matériel récupérë du côté de la cathode dans le
compartiment Cf est analysé par dosage de protéines selon la méthode de
Bradford, et sur gel de polyacrylamide en présence de SDS iSDS-PAGE
10%).
Dans cet exemple, le pH du tampon TBE utilisé pour la migration
a été fixé à pIH 7.0, ie point isoélectrique de l'hémoglobine étant égal à
7Ø
Des membranes de 50 ou 100 kDa ont été placées à l'interface des
CA 02328298 2000-10-10
WO 99/53304 PCTIFR99/00830
17
compartiments Cf et B. Comme cela est représenté à la figure 8, après 60
minutes de migration, un pourcentage négligeable de protéines est récupéré
avec la membrane de 100 kDa, et 10% des protéines sont récupérées avec
la membrane de 50 kDa. A pH 7.0, seulement 10% des protéines
sanguines chargées négativement à pH 7.0 ont un poids moléculaire
apparent supérieur à 50 kDa et inférieur à 100 kDa. Un pourcentage
négligeable de protéines sont récupérées après 15 minutes de migration, en
utilisant indifféremment une membrane de 50 ou 100 kDa. Ces conclusions
ont été vérifiées sur gel de polyacrylamide en présence de SDS-PAGE 10%.
La porosité de la membrane sera préférentielement supérieure à 10 kDa,
afin de ne pas obtenir un pourcentage trop élevé de protéines.
Exemple 4 : Cinétique de récupération d'acides nuclëiques à
partir d'un échantillon de type respiratoire.
Avant utilisation, l'échantillon respiratoire est fluidifié,
décontaminé selon le protocole standard au N-acetyl-L-cysteine et à la
soude (NALC/NaOH); puis il est inactivé 20 minutes à 95°C.
Dans cet exempte, le tampon TBE utilisê pour la migration a un
pH égal à 8.3 ou 7.0, et des membranes de différentes tailles de pores ont
été placées à l'interface des compartiments Cf et B: 10, 50 ou 100 kDa.
Comme cela est représenté à la figure 9, à pH 8.3, 10% des protéines sont
récupérées après 30 minutes, et 70-80% après 60 minutes avec des
membranes de 50 ou 10 kDa, ce qui suggère que 70-80% des protéines du
crachat sont chargées négativement à ces pH et ont un poids moléculaire
apparent supérieur à 50 kDa. A pH 7.0, environ 0% des protéines sont
récupérées après 30 ou fi0 minutes de migration, quelque soit la taille des
pores de la membrane utilisée (dans la limite de sensibilité des techniques
de détection utilisées). A ce pH, les 55-60% des protéines préalablement
récupérées à pH 8.0 ne sont plus chargées négativement. Avec les
membranes de 10 ou 50 kDa, un pourcentage négligeable des protéines du
crachat est récupéré après 15 minutes de migration. On a vérifié ce point
sur gel de polycrylamide en présence de SDS-PAGE 10%.
Exemple 5 : Levée d'inhibition de protocoles d'amplification par
les échantillons de type respiratoire après migration.
Les échantillons de type respiratoire sont inhibiteurs des
réactions PCR et TMA. 200 ,ul de ces échantillons ont été déposés au fond
du compartiment C1 du système décrit Figure 1. Un voltage de 150 V
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99/00830
18
constant a été appliqué entre les deux électrodes pendant 15 minutes. Une
membrane de séparation entre Cf et B de 10 kDa a été choisie. Après
migration, l'échantillon récupéré dans le compartiment Cf (200 ,u!) a été
supplémenté avec différentes quantités d'acides nucléiques purifiés de S.
epidermidis. 10 NI ou 50 ,ul de cette solution ont été utilisés pour chaque
essai PCR ou TMA, respectivement. Comme représenté à la figure 10,
jusqu'à 102-103 copies initiales d'ADN peuvent être amplifiées dans 10 NI
d'échantillon migré. Ce résultat démontre que le crachat migré a perdu son
caractère inhibiteur de la PCR. Des résultats similaires ont été obtenus avec
l'amplification TMA.
1-5.109 S. epidermidis ont été ensemencés dans 300 ,ui de
crachat fluidifié, décontaminés et inactivés comme décrit dans l'exemple 4
ci-dessus. Ces cellules en suspension ont été lysées par choc mécanique en
absence de PK, et le lysat a migré pendant 15 minutes sous 150 V avec
~ 5 une membrane de 10 kDa entre les compartiments Cf et B, selon le schéma
présenté à la Figure 1. La quantité d'acides nucléiques bactériens récupérés
dans le compartiment Cf après migration a été quantifiée par analyse Vidas
spécifique de l'espèce bactérienne étudiée. L'expérience a été réalisée à
partir de différents crachats. En moyenne, 80% d'acides nucléiques S.
2o epidermidis sont récupérés. Ce résultat indique que les molécules de la
matrice du crachat ne gênent pas la migration des molécules d'ADN et
d'ARN du lysat bactérien dans le champ électrique, dans ces conditions. Au
contraire, il semble que l'environnement soit propice à une meilleure
récupération et/ou migration de ces molécules.
25 Amplification PCR:
Les bactéries S. epidermidis ont été ensemencées dans 300 ul
de crachat fluidifié, dëcontaminé, inactivé, puis lysées par choc mécanique
en absence de PK comme décrit dans !'exempte 1. 200 ,ui du lysat a migrë
pendant 15 minutes sous 150V avec une membrane de 10 kDa entre les
3o compartiments Cf et B. Le matériel nucléique présent dans l'échantillon a
été amplifié par PCR t10 ,ul par essai), et les ampücons produits ont été
quantifiés par analyse Vidas: Comme représenté à la figure 11, jusqu'à
104-103 bactéries initiales lysées (i200,u1 de lysat? peuvent être détectées
après migration et amplification des molécules d'ADN (soit 100-10
35 molécules d'ADN /10,u1 d'essai PCR). Ce résultat, d'une part confirme un
très bon rendement de récupération des molécules d'ADN bactérien du
CA 02328298 2000-10-10
WO 99153304 PCT/FR99100830
19
lysat dans le crachat, et d'autre part démontre une très bonne élimination
des inhibiteurs de la PCR initialement présents dans les crachats.
Amplification TMA:
De même que pour l'étude de l'amplification PCR décrite ci
avant, les bactéries S. epidermidis ont été ensemencés dans 300 ,ul de
crachat fluidifié, décontaminé, inactivé puis lysées par choc mécanique en
absence de PK. 200 pl du lysat a migré pendant 15 minutes sous 150V
avec une membrane de 10 kDa entre les compartiments Cf et A. Les
molécules d'ARNr présentes dans l'ëchantillon récupéré ont été amplifiées
90 par TMA (50 ,ul par essai), et les amplicons produits ont été quantifiés
par
hybridation spécifique sandwich sur microplaque. Comme représenté à la
figure 12, au moins 106-105 bactéries initiales lysées (i200p1 de lysat)
peuvent être détectées après migration et amplification des molécules
d'ARN (soit au moins 5.104-5.103 bactéries initiales /50 ,ul d'essai TMA).
Ce résultat démontre l'élimination des inhibiteurs de la TMA initialement
présents dans les crachats.
Exemple 6: Electro-séparation après lyse par chocs électriques.
1-5.1 O9 S. epidermidis ont été ensemencés dans 300 ,ul de
crachat fluidifié, décontaminé et inactivé comme décrit dans l'exemple 4.
Ces cellules en suspension ont été lysées par choc électrique en présence
de 102 mgiml final de PK et 2% final de LLS (Lithium Lauryl Sulfate,
Sigma). 200 pl de lysat a migré pendant 15 minutes sous 150 V avec une
membrane de 10 kDa entre les compartiments Cf et B, selon le shéma
présenté à la figure 1. Le matériel nucléique récupéré après migration (200
,ul ) a été amplifié par PCR spécifique de S. epidermidis ( 10 pl/essai), et
les
amplicons produits ont été quantifiés par analyse Vidas. Jusqu'à 104-105
bactéries initiales lysées (Iml) peuvent être détectées après migration et
amplification des molécules d'ADN (soit 100-10 molécules d'ADN/10 NI
d'essai PCR, ce qui représente la limite de sensibilité de la technique PCR
utilisée).
Conformément aux figures 13 à 16, on décrit ci-après un
dispositif à usage unique, c'est-à-dire consommable, ou jetable après
emploi, permettant de mettre en oeuvre le procédé d'électro-séparation
décrit et exemplifié précédemment.
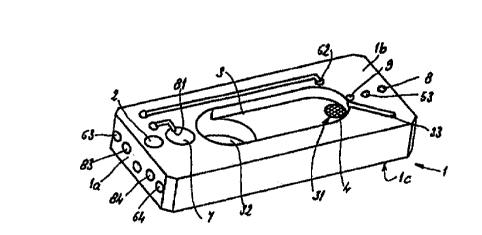
Un tel dispositif comprend un support 1, ou base, ayant
généralement une forme parallèlépipédique, comprenant notamment une
CA 02328298 2000-10-10
WU 99/53304 PCT/F'R99/00830
face supérieure 1 b, une face inférieure 1 c et un flanc latéral 1 a, montrés
sur les Figures 13 et 14:
De manière générale dans ce support 1, sont rassemblés et
intégrés, ainsi qu'agencés entre eux, les différents moyens, notamment
5 électrodes requis pour l'électro-séparation, ainsi que des moyens
d'interfaçage correspondant au flanc 1a du support 1 avec l'extérieur,
d'une part pour le transfert des différents fluides ou liquides vers et/ou
hors
du support 1, dont l'échantillon biologique traité, ie milieu liquide aqueux
(tampons) et la fraction enrichie en matière nucléique, et d'autre part pour
10 l'alimentation et la commande des moyens électriques requis au moins pour
1'électro-séparation, dont celle du champ électrique.
De manière non représentée, à titre d'exemple, les deux faces
1 a et 1 b du dispositif, ou carte, sont revêtues d'un film transparent,
étanche; adhérant au support, et fermant ies différents conduits et cavités
~ 5 représentés en surface aux figures 13 et 14.
Ce dispositif comprend encore
- un moyen de réception 2 de l'échantillon biologique traité
- un premier réservoir 3 pour un premier milieu liquide àqueux
(tampons TBE dilué à 10 fois), comportant lui-même un compartiment 31
20 fermé par une membrane 4 perméable, ayant par exemple une capacité de
l'ordre de 100 Nl, ainsi qu'un autre compartiment 32, ayant une capacité
de 1 ml, pour la réception d'au moins une fraction obtenue à partir d'un
échantillon biologique ; cet autre compartiment est disposé en amont du
compartiment 31 selon le sens de circulation du matériel nucléique, sous
l'effet du champ électrique, et communique lui-même avec le moyen de
réception 2 de L'échantillon biologique
- un second réservoir 5 pour un second milieu liquide aqueux
(par exemple tampon TBE, une fois concentré), identique ou différent du
premier liquide aqueux, séparé du premier réservoir 3, uniquement par la
membrane 4
- deux électrodes 61 et 62 pour générer un champ électrique,
communiquant avec deux plots 63 et 64 de contact électrique sur le flanc
1a ; l'une des électrodes, à savoir 61, ou cathode, est au contact du
premier milieu liquide aqueux dans le premier réservoir 3, et l'autre
électrode 62, ou anode, est au contact du second milieu aqueux dans le
second réservoir 5
CA 02328298 2000-10-10
WO 99/53304 PCT/FR99/00$30
21
- un moyen d'extraction 9 de la fraction enrichie en matériel
nucléique du compartiment 31 fermé par la membrane 4
Les deux réservoirs 3 et 5 communiquent respectivement avec
des évents d'aération 33 et 53, et avec au moins un canai de remplissage
34 communiquant en ce qui le concerne avec ie second réservoir 5.
Un puits intermédiaire 7 est disposé et communique entre le
moyen de réception 2 de l'ëchantillon biologique et le premier réservoir 3.
Ce puits n'est pas obligatoire, puisque le lysat peut être déposé
directement dans le compartiment 32. Ce puits 7 est pourvu de moyens
permettant de lyser un échantillon cellulaire pour obtenir une fraction
soumise ensuite à électra-séparation ; ces moyens sont des électrodes 81
et 82, permettant d'exposer l'échantillon à une ou plusieurs impulsions
électriques, conformément au procédé décrit par ailleurs dans la demande
de brevet frarfçais FR-A-2 7fi3 au nom de la Demanderesse. Ces électrodes
81 et 82 communiquent respectivement avec des plots de contact
électrique 83 et 84 prévus sur le flanc 1 a. II existe donc deux circuits
électriques, l'un associé aux électrodes 81 et 82, et l'autre associé aux
électrodes 61 et 62.
I - Prénaratian du dispositif
Avant de démarrer toute réaction, on remplit les réservoirs 3 et
5 de tampon. Ce dernier peut étre constitué par un tampon TBE (Tris-
Borate-EDTA1 dont la concentration varie d'un réservoir à l'autre. On
remplit le premier réservoir 3, supérieur, par le moyen de réception 2, avec
du tampon dilué dix fois, et le second réservoir 5, inférieur, par le canal 34
avec du tampon une fois concentré. On perce les évents d'aération 33 et
53 au niveau des films étanches recouvrant les faces 1 a et 1 b, afin de
permettre à l'air de s'échapper lors du remplissage des réservoirs.
1 ) Lyse
L'échantillon est introduit dans le moyen de réception 2 à !'aide
d'une pipette, manuellement ou par un automate. Le volume de
l'échantillon est compris entre 0 et 1 ml. II arrive alors dans le puits
intermédiaire 7 de lyse. La lyse est réalisée grâce à une décharge électrique
de 500 V pendant environ 1 seconde, entre les électrodes 81 et 82.
Dans le cas où le volume d'échantillon est supérieur à 50 cul,
plusieurs étapes de lyse sont réalisées les unes après les autres, les
CA 02328298 2000-10-10
WO 99153304 PCT/FR99100830
22
fractions lysées étant transférées au fur et à mesure dans le compartiment
32 de réception.
2) Electro-séparation
Une fois l'échantillon lysé et transfëré en totalité dans le
compartiment 32 de départ de I'électro-séparation, le premier circuit
électrique des électrodes 81 et 82 est ouvert, le deuxième des électrodes
61 et 62 est fermé. Les constituants du iysat chargés négativement vont
alors migrer jusqu'à l'anode 62. Les acides nucléiques étant fortement
négatifs migreront plus vite. On pourra donc les récupérer sélectivement
au-dessus de la membrane 4, au niveau du compartiment de réception 31
par le canal de prélèvement 9.
Le courant imposé pour cette migration est compris entre 0 et
30 mA, sous une tension de 150 V. La durée optimale de migration est
d'environ 15 minutes.
Afin de récupérer ies acides nucléiques, on vide le réservoir 3
supérieur jusqu'à ce qu'il n'y ait plus de liaison fluidique entre le
compartiment 32 et le compartiment de réception 31. On prélève alors
avec une pipette, par le canal 9, les 100 ,ul de tampon contenus dans le
compartiment 31. Le prélèvement peut se faire manuellement ou par
l'intermédiaire de l'automate.
On peut prévoir de récupérer aussi les protéines purifiées. Pour
cela, il faut effectuer deux passes successives d'électro-purification, la
première permettant de récupérer la fraction enrichie en acides nucléiques
et la deuxième la fraction enrichie en protéines. Dans ce cas précis, les
acides nucléiques doivent être récupérés entre ies deux passes, et sans
vider le réservoir 3 supérieur du tampon qui contient les protéines qui n'ont
pas fini de migrer.
Un dispositif tel que précédemment décrit peut ne comprendre
que trois électrodes. En effet, les deux cathodes 61 et 81, respectivement
affectées au circuit d'électro-séparation et au circuit de lyse, deviennent la
cathode commune aux deux circuits. Dans ce cas, la lyse de l'échantillon
biologique s'effectue dans le compartiment 32. Un tel dispositif peut étre
utilisé sur la tranche. II sera alors facile de l'intégrer dans un automate
grâce à ce gain de place.