Note: Descriptions are shown in the official language in which they were submitted.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-1
SYSTEME D'EXPRESSION INDUCTIBLE
La présente invention concerne un système d'expression inductible mettant
en oeuvre les séquences nucléotidiques codant pour un activateur
transcriptionnel
et un vecteur adénoviral recombinant comportant un gène d'intérêt placé sous
le
contrôle d'un promoteur inductible en trans par ledit activateur
transcriptionnel
sous une forme activée. Elle a également pour objet un vecteur adénoviral
recombinant portant une première cassette d'expression codant pour ledit
activateur transcriptionnel et une seconde cassette portant un gène d'intérêt
placé
sous le contrôle d'un promoteur inductible en trans par ledit activateur
transcriptionnel. L'invention a également pour objet une particule virale
infectieuse, une cellule, une composition pharmaceutique comprenant un tel
vecteur ou système d'expression ainsi que leur utilisation à des fins
thérapeutiques
ou prophylactiques. L'invention présente un intérêt tout particulier pour des
perspectives de thérapie génique, notamment chez l'homme.
La thérapie génique se définit comme le transfert d'information génétique
dans une cellule ou un organisme hôte. Le premier protocole appliqué à l'homme
a été initié aux Etats Unis en septembre 1990 sur un patient génétiquement
immunodéficient en raison d'une mutation affectant le gène codant pour
l'Adénine
Désaminase (ADA). Il s'agissait de corriger ou remplacer le gène défectueux
dont
le dysfonctionnement est à l'origine d'une maladie génétique par un gène
fonctionnel. Le succès relatif de cette première expérimentation a encouragé
le
développement de cette technologie qui a été depuis étendue au traitement
d'autres
maladies aussi bien génétiques qu'acquises (cancers, maladies infectieuses
comme
le SII3A...) dans le but de délivrer in situ des gènes thérapeutiques
améliorant la
pathologie. La plupart des stratégies utilisent des vecteurs pour véhiculer le
gène
thérapeutique vers sa cible cellulaire. De nombreux vecteurs tant viraux que
synthétiques ont été développés au cours de ces dernières années et ont fait
l'objet
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-2-
de nombreuses publications accessibles à l'homme du métier.
L'intérêt des adénovirus à titre de vecteurs de thérapie génique a déjà été
évoqué dans de nombreux documents de l'art antérieur. Ils infectent de
nombreux
types cellulaires, aussi bien des cellules en division que quiescentes, sont
non
S intégratifs et peu pathogènes. En outre, ils possédent un tropisme naturel
pour les
voies respiratoires. Ces propriétés particulières font des adénovirus des
vecteurs
de choix pour de nombreuses applications thérapeutiques et même vaccinales. A
titre indicatif, leur génome est constitué d'une molécule d'ADN linéaire et
bicaténaire d'environ 36 kb qui porte une trentaine de gènes intervenant dans
le
cycle viral. Les gènes précoces (El à E4 ; E pour early en anglais} sont
répartis en
4 régions dispersées dans le génome. Les régions E1, E2 et E4 sont
essentielles à
la réplication virale alors que la région E3 impliquée dans la modulation de
la
réponse immunitaire anti-adénovirus chez l'hôte ne l'est pas. Les gènes
tardifs (I,1
à LS ; L pour late signifiant tardif en anglais) codent majoritairement pour
les
protéines de structure et recouvrent en partie les unités de transcription
précoces.
Ils sont pour la plupart transcrits à partir du promoteur majeur tardif MLP
(pour
Major Late Promoter en anglais). En outre, le génome adénoviral porte à ses
extrémités des régions agissant en cis essentielles à l'encapsidation
constituées de
séquences terminales inversées (ITR) situées aux extrémités 5' et 3' et d'une
région
d'encapsidation qui suit l'ITR 5'.
Les vecteurs adénoviraux actuellement utilisés dans les protocoles de
thérapie génique sont dépourvus de la majeure partie de la région E1 afin
d'éviter
leur dissémination dans l'environnement et l'organisme hôte. Des délétions
supplémentaires dans la région E3 permettent d'accroître les capacités de
clonage.
Les gènes d'intérêt sont introduits dans (ADN viral à la place de Tune ou
(autre
région délétée. Cependant, Yimmunogénécité potentielle des protéines virales
encore exprimées peut dans certaines applications particulières s'opposer à la
persistance des cellules transduites et à l'expression stable du transgène.
Ces
inconvénients ont justifié ia construction de vecteurs de nouvelles
générations qui
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-3-
conservent les régions en cis (ITRs et séquences d'encapsidation) essentielles
à
l'encapsidation mais comportent des modificaxions génétiques supplémentaires
visant à supprimer l'expression in vivo de la plupart des gènes viraux (voir
par
exemple la demande internationale W094/28152). A cet égard, un vecteur dît
5 minimal, déficient pour l'ensemble des fonctions adénovirales représente une
alternative de choix.
La plupart des vecteurs développés à l'heure actuelle sont basés sur une
expression constitutive du transgène. Or il peut être souhaitable de limiter
l'expression du gène thérapeutique à un nombre restreint de types cellulaires.
10 L'expression tissu-spécifique peut être médiée par le biais de promoteurs
et
d'enhancers tissu-spécifiques ou de systèmes d'expression inductibles
répondant
à un événement cellulaire ou temporel spécifique.
De nombreux systèmes d'expression inductibles proposés actuellement
reposent sur l'emploi de promoteurs régulés par des facteurs de transcription
15 endogènes activés par un ligand inducteur particulier (hormones stéroïdes,
interféron, métaux lourds...). Un premier inconvénient est que ces systèmes
nécessitent la présence des facteurs activateurs endogènes au sein de la
cellule
cible. De plus, le niveau d'expression basal est souvent élevé en raison d'une
activation «bruit du fond» due aux substances cellulaires endogènes, qui peut
20 générer des effets secondaires non négligeables.
Un certain nombre de systèmes d'expression basés sur l'utilisation de
facteurs procaryotiques ont été mis en évidence au cours de ces dernières
années.
On peut citer par exemple ceux des opérons bactériens tétracycline (Gossen et
Bujard, 1992, Proc. Natl. Acad. Sci. USA 89, 5547-551), lactose (Miller et
25 Reznikoff (Eds), The operons, Cold Spring Harbor Laboratory), tryptophane
(Yanofsky et al., 1981, Nucleic acids Res. 9, 6647-6668), de la protéine 16 du
virus simplex de l'herpès (protéine trcms-activatrice VP16), ou de la protéine
Gal4
de levure (Webster et al., 1988, Cell 52, 169-178).
D'une manière générale, l'opéron de résistance à la tétracycline est codé par
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-4-
le transposon TnlO (I-fillen et al., 1984, J. Mol. Biol. 172, 185-201). La
régulation
est assurée par une courte séquence nucléotidique dite "opérateur" (tet O) qui
constitue un site de fixation de divers régulateurs. Ainsi, la fixation du
répresseur
tétracycline (tet R) ou de l'antibiotique tétracycline diminue
considérablement le
5 niveau de transcription. Au contraire, un effet d'activation est obtenu en
mettant
en oeuvre une protéine, désignée dans la littérature "trans-activateur
tétracycline
(tTA)" qui résulte de la fusion entre le tet R et les 130 acides aminés C-
terminaux
du domaine d'activation de la protéine VP 16 du virus simplex de l'herpès.
L'expression d'un gène rapporteur placé sous le contrôle de plusieurs copies
de tet
10 O en amont de séquences de base de la transcription (TATA box, site
d'initiation
de la transcription..) est détectable par co-expression du tTA et inhibée par
ajout
de tétracycline. La Tétracycline lie le tTA et empêche ainsi la transcription.
Ce
système est fonctionnel dans un contexte vecteur rétroviral (Paulus et al.,
1996, J.
Virol. 70, 62-67) et adénoviral (Neering et al., 1996, Blood 4, 1147-1155 ;
1 S Yoshida and Hamada, 1997, Biochem. Biophy. Comm. 230, 426-430 ; Massie et
al., 1998, J. Virol. 72, 2289-2296). Dans ce dernier cas, le trans-activateur
est
fourni en trans soit par infection d'une lignée établie exprimant le tTA par
un
vecteur adénoviral contenant un gène d'intérêt placé sous le contrôle
d'éléments
tet0 et du promoteur CMV soit par co-infection des cellules par deux vecteurs
20 adénoviraux, l'un contenant la cassette d'intérêt et l'autre exprimant le
tTA. Un
système réverse dans lequel l'expression du transgène est activée en présence
de
la tétracycline, a été développé en mutant la protéine de fusion tTA (Gossen
et al.,
1995, Science 268, 1766-1769). La protéine modifiée riTA ne lie en effet les
éléments tet0 qu'en présence de tétracycline. Une autre variante selon
laquelle
25 l'expression est contrôlée à deux niveaux (en absence de tétracycline et en
présence
d'oestradiol), est obtenue en fusionnant le tTA au domaine de liaison au
ligand du
récepteur aux oestrogènes (Iida et al., 1996, J. Virol. 70, 6054-6059).
Un autre système inductible repose sur l'emploi de récepteurs endogènes
afin de remédier à l'immunogénicité potentielle des trans-activateurs
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-5-
procaryotiques. A cet égard, les récepteurs des hormones stéroïdes ont fait
l'objet
de nombreuses publications. On peut citer plus particulièrement les récepteurs
aux
glucocorticoïdes (GR) (Israël et Kaufinan, 1989, Nucleic Acids Res. 17, 4589-
4604), à la progestérone (PR) (Gronemeyer et al., 1987, EMBO J. 6, 3985-3994)
5 et aux oestrogènes (ER) (Klein-Hitpa(3 et al., 1986, Cell 46,1053-1061 ;
Koike et
al., 1987, Nucleic Acids Res. IS, 2499-2513). Leur mode d'action est variable
puisqu'ils sont capables de trans-activer ou de trans-réprimer la
transcription selon
la cellule cible, le ligand hormonal et les éléments de régulation employés.
Pour ce
qui est de la trans-activation, le récepteur stéroïdien est sous sa forme
inactive
10 complexé à divers facteurs cellulaires dont certaines protéines de choc
thermique
(hsp pour heat shock protein en angïais). La fixation d'un ligand agoniste
(hormone
stéroïde) entraîne un changement de la conformation du récepteur. Cette
activation
s'accompagne de la dissociation des facteurs cellulaires, d'une translocation
nucléaire et augmente la capacité du récepteur à fixer une courte séquence
d'ADN
15 spécifique (séquence cible), ce qui permet l'interaction avec la machinerie
transcriptionnelle et l'induction de la transcription. Pour remplir leur
fonction, ces
récepteurs sont généralement organisés en 3 domaines fonctionnels,
respectivement
un domaine de trans-activation permettant l'activation de la transcription, un
domaine de liaison à l'ADN (séquence cible) et un domaine de liaison au ligand
20 (DLL).
Des récepteurs modifiés répondant préférentiellement à des ligands
synthétiques non naturels sont également proposés dans la littérature. Par
exemple,
Wang et al. (1994, Proc. Natl Acad. Sci. USA 91, 8180-8184) ont construit une
chimère activable par la molécule RU486 mais pas par la progestérone endogène,
25 qui résulte de la fusion du domaine de liaison au ligand du récepteur
tronqué de la
progestérone (OPR), du domaine de liaison à l'ADN de la protéine de levure
Gal4
et du domaine de trans-activation de la protéine VP16. Toutefois, l'activité
basale
reste élevée et la protéine chimère peut potentiellement interférer avec les
facteurs
transcriptionnels cellulaires. Des variants des récepteurs ER et GR modifiés
dans
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-6-
leurs domaines de liaison au ligand ont également été décrits. Ainsi, le
mutant ERT
obtenu par substitution de la glycine en position 521 du récepteur ER par une
arginine, est incapable de fixer les oestrogènes endogènes, mais peut être
activé par
des ligands synthétiques tel que le Tamoxifen, pour activer la transcription
régulée
5 par la séquence cible ERE (pour estrogen responsive element). Un variant
analogue a également été construit pour le récepteur GR, modifié en position
747
par substitution de l'isoleucine par une thréonine (Roux et al., 1996,
Molecular
Endocrynology 10, 1214-1226). Ce variant désigné GRd"' est incapable de fixer
les
glucocorticoïdes endogènes, mais peut être activé par des ligands synthétiques
tels
10 que la Dexaméthasone. Une fois activé, il reconnaît la séquence cible GRE
(pour
glucocorticoïde responsive element ; Cato et al., 1986, EMBO J. S, 2237-2240)
et stimule la transcription du promoteur qui lui est associé.
Un autre système d'expression inductible utilise le récepteur stéroïdien
d'insecte répondant à l'ecdysone (EcR). Le récepteur est activé par l'ecdysone
et
15 forme un hétérodimère avec la protéine ultraspiracle (USP) de la Drosophile
qui
se fixe à une séquence cible spécifique (EcRE pour ecdysone responsive
element)
pour activer la transcription. No et al. (1996, Proc. Natl. Acad. Sci. USA 93,
3346-3351) ont créé un récepteur mutant VgEcR obtenu par fusion du DLL du
récepteur EcR, d'un hybride entre le domaine de liaison à l'ADN des récepteurs
20 EcR et GR et du domaine de trans-activation de VP 16. Le mutant peut
former, en
présence de l'ecdysone ou de son analogue muristone A, un hétérodimère avec la
protéine USP ou son homologue humain, le récepteur de l'acide rétinoïque X
(RXR), et activer la transcription de gènes placés sous le contrôle d'une
séquence
hybride (5xE/GRE) comprenant les motifs répondant aux récepteurs EcR et GR.
25 Un tel système évite une éventuelle activation endogène.
Un autre système d'expression inductible décrit dans la littérature met en
oeuvre les immunophilines. Rivera et al. (1996, Nat. Med. 2, 1028-1032) ont
développé un système à deux composantes assemblées en présence d'un ligand.
Plus précisemment, la première composante est une fusion entre le facteur de
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-7_
transcription ZFHD1 (portant un domaine de liaison à l'ADN) et l'immunophiline
FKBP 12 et la deuxième composante est une fission entre Ie domaine de trans-
activation du facteur NFxB p65 et FRAP (FKBP 12-rapamycine-associated
protein). Le trans-activateur est activé sous forme d'un hétérodimère
associant les
5 deux composantes et la rapamycine liant les portions FKBP12 et FRAP qui peut
induire l'expression d'un transgène placé sous le contrôle des éléments-cibles
de
ZFHD 1.
Enfin, Dolwick et al. (1993, Mol. Phanma.col. 44, 911-917) ont identifié le
récepteur aryl hydrocarbon (AhR) impliqué dans le métabolisme des
xénobiotiques
10 et des substances chimiques élaborées par l'homme. L'AhR, sous forme
inactive
est complexé à divers facteurs cellulaires dont la protéine chaperonne hsp90.
La
fixation d'un ligand xénobiotique induit la dissociation du complexe, la
translocation du AhR dans le noyau, la formation d'un hétérodimère avec la
protéine Arnt (aryl hydrocarbon receptor nuclear translocator ; Hoi~'man et
al.,
15 1991, Science 252, 954-958). La fixation de fhétérodimère sur les éléments
cibles
de l'ADN nommés XRE (pour xenobiotique responsive elements) induit la
transcription des séquences géniques en aval. La séquence XRE est présente
dans
la région promotrice de nombreux gènes codant pour des enzymes impliquées dans
le métabolisme de drogues, telles que glutathione-S-transférase ou cytochrome
20 P4501 Al . AhR et Arnt possèdent un domaine responsable de la
reconnaissance de
la séquence cible, de f hétérodimérisation et de la liaison au ligand. La
majorité des
études de trans-activation par le biais du complexe AhR/Arnt utilise le ligand
2,3,7,8-tétrachlorodibenzo-p-dioxine (TCDD)
La présente invention propose un système d'expression inductible mettant
25 en oeuvre un vecteur adénoviral comportant un gène d'intérêt dont
l'expression est
régulée par un trans-activateur activable par l'apport de molécules
pharmacologiques exogènes. Ce système est basé plus particulièrement sur
l'utilisation d'un récepteur stéroïdien. Une fois activé, le complexe
récepteur/ligand
va se fixer sur sa séquence cible et permettre une activation en trans de
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99I02051
_g_
l'expression du gène thérapeutique. On a maintenant construit un vecteur
adénoviral recombinant contenant, en remplacement de la région E1, une
cassette
d'expression du récepteur stéroïdien mutant GRde" exprimé de façon
constitutive
par le promoteur précoce du cytomégalovirus (CMV) et, en remplacement de la
S région E3, une cassette d'expression du gène facteur IX (FIX) humain placé
en
aval du promoteur du virus MMTV (mouse mammary tumor virus) contenant la
séquence cible GRE. Les expériences qui suivent montrent la fonctionnalité
d'un
tel système inductible in vitro et in vivo. De façon analogue, le récepteur
ERT a
également été inséré dans la région E1 d'un adénovirus sous le contrôle du
10 promoteur CMV. Dans ce ca.s, la cassette inductible du gène FIX est régulée
par
la séquence ERE associée au promoteur minimal du gène TK (thymidine kinase)
de HSV (herpès simplex virus). Le troisième système étudié dans le cadre de la
présente invention met en oeuvre le récepteur modifié VgEcR et le récepteur
humain RXR dont les séquences ont été introduites dans la région E1 d'un
15 adénovirus. La cassette inductible présente dans la région E3 place l'ADNc
du FIX
sous Ie contrôle des éléments hybrides SxE/GRE.
La finalité de la présente invention est de remédier aux inconvénients des
vecteurs de thérapie génique actuels, en améliorant notamment la spécificité
(activation par des substances exogènes non toxiques et non par des facteurs
20 cellulaires endogènes) et l'inductibilité (activité basale en l'absence
d'inducteur
minimale et forte expression du transgène à l'état activé). L'objet de la
présente
invention peut être appliqué à divers protocoles de thérapie génique
nécessitant
l'expression de molécules solubles, telles que des molécules antitumorales
(anticorps, cytokines, chimiokines) ou dans tous les cas où l'expression du
gène
25 thérapeutique devra être régulée en fonction des besoins de l'organisme. Il
permet
également l'analyse des gènes dont l'expression est cytotoxique ou réduite à
certaines étapes du développement.
C'est pourquoi la présente invention a pour objet un système d'expression
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-9-
inductible comprenant
(i) les séquences nucléotidiques codant pour un activateur transcriptionnel
d'origine eucaryote ou virale et placées sous le contrôle des éléments de
régulation appropriés à leur expression dans une cellule ou un organisme
hôte , et
(ü) un vecteur adénoviral recombinant comportant un gène d'intérét placé
sous le contrôle d'un promoteur inductible susceptible d'être activé en
trans par ledit activateur transcriptionnel.
Aux fins de la présente invention, le terme «activateur transcriptionnel»
10 définit un polypeptide ou un ensemble de polypeptides exerçant une action
positive
sur la transcription c'est à dire ayant la capacité d'initier ou de stimuler
la
transcription d'un gène quelconque à partir d'éléments de régulation
appropriés
répondant audit activateur transcriptionnel. L'effet positif sur la
transcription est
de préférence médié directement par la liaison de l'activateur aux éléments de
1 S régulation mais peut l' être indirectement par l' intermédiaire de
facteurs)
cellulaire(s). De préférence, on a recours à un activateur transcriptionnel
ligand-
dépendant apte à lier une séquence d'ADN caractéristique (séquence cible) et à
activer le promoteur qui lui est associé. De tels activateurs
transcriptionnels sont
décrits dans l'état de la technique. On indique également que dans le cadre de
la
20 présente invention, l'activateur transcriptionnel peut être un polypeptide
unique
sous forme de monomère ou de muitimère (de préférence dimère) ou encore peut
résulter de l'association d'un ensemble de polypeptides formant un hétéromère
(de
préférence un ensemble de deux polypeptides formant un hétérodimère).
L'activateur transcriptionnel en usage dans la présente invention peut être
dérivé
25 d'un organisme quelconque d'origine eucaryote ou virale, notamment d'une
levure,
d'un insecte, d'un vertébré ou d'un virus ou peut avoir une origine mixte
c'est à
dire être formé de composantes d'origines diverses.
Un activateur transcriptionnel convenant à la mise en oeuvre de la présente
invention comprend au moins 3 types de domaines fonctionnels, respectivement
un
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
- 10-
domaine de trans-activation, un domaine de liaison à l'ADN (séquence cible) et
un
domaine de liaison au ligand (DLL). Dans le cadre de la présente invention,
l'ordre
des différents domaines est sans importance. De plus, ils peuvent être
répartis dans
la séquence en acides aminés de manière continue ou discontinue (avec
S éventuellement un chevauchement des résidus impliqués dans chaque fonction)
et
localisés sur un ou les polypeptide(s) formant ledit activateur
transcriptionnel. Par
ailleurs, il peut comprendre plusieurs domaines d'un même type. Un exemple
adéquate est constitué par l'hétérodimère développé par Rivera et al. (1996,
Nat.
Med. 2, 1028-1032) activé par la liaison de la rapamycine aux portions FKBP12
10 et FRAP.
Le terme «domaine de liaison au ligand» fait référence à la portion de
l'activateur transcriptionnel qui interagit avec un ligand-inducteur
approprié.
L'interaction DLL-inducteur place l'activateur transcriptionnel en état
activé, étape
nécessaire à l'activation transcriptionnelle. Le DLL est de préférence
localisé à
15 l'extrémité C-terminale du ou d'un polypeptide composant ledit activateur
transcriptionnel.
Le terme «domaine de liaison à l'ADN» fait référence à la portion de
l'activateur transcriptionnel qui interagit avec la séquence d'ADN cible
présente
au sein du promoteur inductible contrôlant l'expression du gène d'intérêt et
20 spécifique de l'activateur transcriptionnel choisi. Ladite séquence cible
est
généralement placée en amont d'une région promotrice contenant au moins une
TATA box et est composée de motifs reconnus par l'activateur transcriptionnel.
Ces motifs peuvent former une structure particulière (palindrome, répétitions
en
orientation sens ou inversée ...etc). Les séquences cibles adaptées à chaque
25 activateur transcriptionnel sont décrites dans la littérature. Pour
illustrer, on peut
citer
- la séquence cible GRE (pour glucocorticoïd responsive element)
comportant un motif TGTTCT (ou son complémentaire) reconnu
par un domaine de liaison à l'ADN dérivé du récepteur GR ou d'un
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-11-
analogue (GRa"'). Un exemple préféré est constitué par la séquence
5'GGTACANNNTGTTCT3' où N représente un nucléotide
quelconque ;
- la séquence cible ERE (pour oestrogen responsive element)
comportant un motif 5'AGGTCA3' (ou son complémentaire)
reconnu par un domaine de liaison à l'ADN dérivé du récepteur ER
ou d'un analogue (ERT). Un exemple préféré est constitué par la
séquence S'AGGTCANNNTGACC3' où N représente un
nucléotide quelconque ;
10 - la séquence cible UAS (pour upstream activating sequence) de
séquence S' CGGAGTACTGTCCTCCG3' (ou son
complémentaire) reconnue par un domaine de liaison à l'ADN
dérivé du récepteur Gal 4 de levure ou d'un analogue ;
- la séquence cible EcRE (pour ecdysone responsive element)
15 comportant un motif GACAAG (ou son complémentaire} reconnu
par un domaine de liaison à l'ADN dérivé du récepteur EcR ou
d'un analogue. Un exemple préféré est constitué par la séquence
5'GACAAGGGTTCAATGCACTTGTC3' ;
- ia séquence SxE/GRE de séquence S'AGGTCA?~TAGAACA3' (ou
20 son complémentaire) reconnue par un domaine de liaison à l'ADN
hybride entre EcR et GR ou d'un analogue,
- la séquence cible 5' TAATTANGGGNG3' où N représente un
nucléotide quelconque, reconnue par Ie facteur de transcription
ZFHD1
25 - la séquence cible XRE (pour xenobiotique responsive element) de
séquence 5 'CCTCCAGGCTTCTTCTCACGCAACTCC3'
reconnue par un domaine de liaison à l'ADN dérivé du récepteur
AhR ou d' un analogue.
CA 02341775 2001-02-27
WO 00/1Z741 PCT/FR99/02051
- 12-
Le terme «domaine de trans-activatiom> fait référence à la portion de
l'activateur transcriptionnel qui interagit avec la machinerie cellulaire pour
initier
ou stimuler la transcription génique dépendante de la séquence cible répondant
audit activateur. Ce domaine peut être issu d'un facteur de transcription
classique
S (NFxB, SP-1...) ou d'un facteur ligand-dépendant (récepteur stéroïdien,
immunophiline, AhR...). Un domaine comprenant les 130 acides aminés C-
terminaux de VP 16 convient tout particulièrement.
La trans-activation induite par l'activateur transcriptionnel en usage dans
le cadre de la présente invention peut être vérifiée simplement par des
techniques
conventionnelles, par exemple en suivant l'expression d'un gène donné placé
sous
le contrôle de la séquence cible adéquate ou la synthèse de son produit
d'expression (analyse selon Northern, Western, immunofluorescence...etc) en
présence du récepteur activé par l'inducteur. Un protocole détaillé est donné
dans
les exemples ci-après. Une différence d'un facteur d'au moins 2,
avantageusement
d'au moins 5 et, de préférence, d'au moins 10 reflète la capacité de trans-
activation
du système d'expression selon l'invention.
On peut illustrer ces définitions par l'exemple du récepteur GR. Son
domaine de trans-activation est localisé dans la partie N-terminale entre les
résidus
272 et 400 (Jonat et al., 1990, Cell 62, 1189-1204), le domaine de liaison à
l'ADN
de 66 acides aminés entre les résidus 421 et 487 (Lucibello et al., 1990, EMBO
J.
9, 2827-2834) et le domaine de liaison au ligand hormonal d'environ 300 acides
aminés dans la partie C-terminale (Kerpolla et al., 1993, Mol. Cell. Biol. 13,
3782-
3 791 ). Ce dernier domaine comprend également les séquences responsables pour
la dimérisation du GR, sa localisation nucléaire et l'intéraction avec les
protéines
hsp. La trans-activation est médiée par la liaison d'un dimère de récepteur à
la
séquence cible GRE.
Avantageusement, l'activateur transcriptionnel inclu dans le système
d'expression inductible selon l'invention comporte tout ou partie d'un domaine
dérivé d'un récepteur d'hormones stéroïdes choisi parmi le groupe constitué
par
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-13-
les récepteurs oestrogène (ER), glucocorticoïde (GR), progestérone (PR),
Vitamine D, ecdysone (EcR), minéralocorticoïde, androgène, hormone thyroïde,
acide rétinoïque et acide rétinoïque X ou encore d'une immunophiline ou d'un
récepteur aryl hydrocarbon (AhR).
Dans le cadre de la présente invention, on peut mettre en oeuvre un
récepteur modifié. Avantageusement, le récepteur modifié a perdu sa capacité
d'activation par un inducteur naturel et acquis une capacité d'activation par
un
inducteur non naturel et retient la capacité de trans-activation du récepteur
natif.
L'homme de l'art connaît la ou les modifications à effectuer à cet égard.
Elles
peuvent être diverses (délétion, substitution et/ou addition d'un ou plusieurs
résidus du récepteur naturel) et concerner un ou plusieurs domaines. De
manière
préférée, le domaine fonctionnel modifié présente une identité de séquence
avec
son equivalent natif d'au moins 70 %, avantageusement d'au moins 80 %, de
préférence d'au moins 90 % et, de manière tout à fait préférée d'au moins 95%.
15 Seion un premier mode de réalisation, on a recours à un récepteur modifié
dans son DLL de manière à être activable par un inducteur non naturel. Des
exemples préférés sont constitués par les mutants GRde'' (I747T) et ERT
(G521R)
déjà cités.
On peut également envisager de mettre en oeuvre un activateur
transcriptionnel chimère comprenant des polypeptides ou fragments
polypeptidiques variés. Avantageusement, il résulte de la fission ou de
l'association
de domaines fonctionnels d'origines différentes. En effet, il est possible
d'échanger
les domaines fonctionnels entre les différents récepteurs et toutes les
combinaisons
possibles entrent dans le cadre de la présente invention. Par exemple, pour
réduire
25 l'interférence avec les complexes récepteurs / ligands endogènes, on peut
envisager
de remplacer le domaine de liaison à l'ADN d'un récepteur stéroïdien par celui
d'un récepteur non humain (d'origine virale ou animale ou d'eucaryote
inférieur),
par exemple un récepteur stéroïdien animal, un récepteur de levure(Gal4)...,
la
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
- 14-
seule condition étant d'adapter la séquence cible au domaine de liaison à
l'ADN
retenu. Une telle adaptation est à la portée de l'homme de l'art. A titre
indicatif,
lorsque le domaine de liaison à l'ADN est issu de Gal4, le promoteur
inductible mis
en oeuvre contiendra les éléments UAS (LJpstream Activating Sequences)
répondant à Gal4. Par ailleurs, le domaine de trans-activation peut être issu
de
n'importe quel domaine d'activation transcriptionnel connu, notamment de la
protéine 16 du virus herpès simplex (VP16) ou de la p65 du facteur NFKB et en
particulier, de son extrémité C-terminale. Un activateur transcriptionnel
associant
un DLL dérivé d'un récepteur stéroïdien, un domaine de trans-activation dérivé
de
10 VP16 et un domaine de liaison à l'ADN de Gal4 ou d'un récepteur stéroïdien
convient à la mise en oeuvre de la présente invention. A cet égard, on
utilisera de
préférence les résidus 1 à 74 de Gal4. Mais d'autres combinaisons sont
également
envisageables.
Par ailleurs, on peut employer également un domaine fonctionnel hybride
1 S entre des fragments polypeptidiques différents. Un exemple possible est
constitué
par un domaine de liaison à l'ADN hybride entre les récepteurs EcR et GR,
reconnaissant une séquence cible hybride comportant les motifs répondant à
l'ecdysone et aux glucocorticoïdes.
Un activateur transcriptionnel préféré dans le cadre de la présente invention
20 est choisi parmi
(i) un polypeptide désigné GRdeX comprenant un domaine de liaison à l'ADN,
un domaine de trans-activation et un DLL dérivés d'un récepteur aux
glucocorticoïdes, ledit récepteur étant modifié dans son DLL, notamment
par substitution de l'isoieucine en position 747 par une thréonine ;
25 (ü) un polypeptide désigné ERT comprenant un domaine de liaison à l'ADN,
un domaine de trans-activation et un DLL dérivé d'un récepteur à
I'oestrogène, ledit récepteur étant modifié dans son DLL, notamment par
substitution de la glycine en position 521 par une arginine ;
CA 02341775 2001-02-27
WO 00/12741 PCT/i<R99/02051
-15-
(iii) un activateur transcriptionnel comprenant un premier polypeptide
comportant un DLL dérivé du récepteur à l'ecdysone, un domaine de
liaison à l'ADN hybride dérivé de ceux des récepteurs EcR et GR et un
domaine de trans-activation dérivé de la protéine virale VP 16 et un second
polypeptide dérivé de la protéine USP de drosophile ou d'un homologue
tel que le récepteur de l'acide rétinoïque X (RXR) humain ;
(iv) un activateur transcriptionnel comprenant un premier polypeptide
comportant un domaine de liaison à l'ADN dérivé du facteur de
transcription ZFHD 1 et un DLL dérivé de f immunophiline FKBP 12 et un
second polypeptide comportant un domaine de trans-activation dérivé du
facteur NF~cB p65 et un DLL dérivé de FRAP (FKBP 12-rapamycine-
associated protein) ; et
{v) un activateur transcriptionnel comprenant un premier polypeptide dérivé
du récepteur AhR et un deuxième polypeptide dérivé de la protéine Arnt.
De préférence, les activateurs transcriptionnels (i) et (ü) sont sous forme
d'homodimères et (iii) (iv) et (v) sont sous forme d'hétérodimères associant
le
premier et le second polypeptide et, éventuellement, l'inducteur.
Selon un mode de réalisation tout à fait avantageux, l'activateur
transcriptionnel est activé par liaison à un inducteur non naturel et n'est
pas ou peu
activé par un composé humain naturel.
Le terme «inducteur non naturel» se réfère à un composé qui n'est pas
trouvé naturellement dans l'organisme humain ou animal à qui la thérapie
utilisant
le système d'expression inductible selon l'invention est destinée. Il s'agit
de
préférence d'un inducteur synthétique qui n'est pas trouvé naturellement dans
un
organisme humain et dont la structure est légèrement différente de celle d'un
composé humain (endogène). Aux fins de la présente invention, un inducteur non
naturel est capable d'activer l'activateur transcriptionnel en usage dans le
cadre de
la présente invention, en particulier par liaison au DLL, afin d'initier ou
stimuler
la transcription dépendante de la séquence cible répondant audit activateur.
Le
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-16-
choix d'un inducteur non naturel adapté à l'activateur transcriptionnel retenu
est
à la portée de l'homme de l'art sur la base de l'état de la technique.
L'activation
de l'activateur transcriptionnel par l'inducteur non naturel peut se faire par
une
interaction covalente ou non covalente (électrostatique, hydrophobe, liaison
5 hydrogène ... etc). Par ailleurs, l'inducteur peut être constitué par un
composé
unique ou par un ensemble de molécules. Il appartient de préférence à la,
famille des
stéroïdes, rétinoïdes, acides gras, vitamines, hormones, xénobiotiques ou
antibiotiques.
Selon un mode de réalisation avantageux, ledit inducteur non naturel est
10 une substance synthétique administrable par voie orale. De préférence, il
est choisi
parmi le groupe constitué par la déxaméthasone, le tamoxifène, le muristérone
A,
l'ecdysone, la rapamycine et le 2,3,7,8-tétrachlorodibenzo-p-dioxine (TCDD) ou
un analogue quelconque de ces composés, de préférence peu ou pas toxique.
Les séquences codant pour l'activateur transcriptionnel compris dans le
15 système d'expression inductible selon l'invention sont placées sous le
contrôle des
éléments de régulation appropriés permettant l'expression dans une cellule ou
un
organisme hôte. Le terme «éléments de régulation appropriés» regroupent
l'ensemble des éléments permettant la transcription desdites séquences en ARN
et
la traduction en protéine. Parmi ceux-ci, le promoteur revêt une importance
20 particulière. II peut être isolé d'un gène quelconque d'origine eucaryote,
procaryote
ou même virale. Alternativement, il peut s'agir du promoteur naturel du gène
endogène. Par ailleurs, il peut être constitutif ou régulable. En outre, iI
peut être
modifié de manière à améliorer l'activité promotrice, supprimer une région
inhibitrice de la transcription, rendre un promoteur constitutif régulable ou
vice
25 versa, introduire un site de restriction...... On peut mentionner, à titre
d'exemples,
les promoteurs eucaryotes des gènes PGK (Phospho Glycérate Kinase), MT
(metallothioneine ; Mc Ivor et al., 1987, Mol. Cell Biol. 7, 838-848), le
promoteur
précoce du virus SV40 (Simian Vrus), le LTR du RSV (Rous Sarcoma Virus), le
promoteur TK-HSV-1, le promoteur précoce du virus CMV (Cytomegalovirus)
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-17-
et les promoteurs gouvernant l'expression des gènes adénoviraux tardifs (MLP)
et
précoces (ElA, E2A, E3 ou E4). Mais, il peut également être intéressant de
réguler l'expression de l'activateur transcriptionnel. Selon une première
variante,
son expression peut être contrôlée par sa séquence cible spécifique
(autoactivation
5 et/ou activation par le récepteur sauvage endogène activé par le ligand
endogène).
Par exemple, on aura recours aux éléments ERE ou GRE pour l'expression d'un
activateur transcriptionnel comportant un domaine de liaison à l'ADN dérivé de
ER ou GR (ERT ou GRd°"). i3ne autre possibilité est l'emploi d'un
promoteur
régulable choisi parmi ceux de l'art antérieur. A cet égard, l'utilisation
d'un
10 promoteur stimulant l'expression dans une cellule tumorale ou cancéreuse
peut être
avantageuse. On peut citer notamment les promoteurs des gènes MUC-1
surexprimé dans les cancers du sein et de la prostate (Chen et al., 1995, J.
Clin.
Invest. 96, 2775-2782), CEA (pour carcinoma embryonic antigen) surexprimé dans
les cancers du colon (Schrewe et al., 1990, Mol. Cell. Biol. 10, 2738-2748),
15 tyrosinose surexprimé dans les mélanomes (Vile et al., 1993, Cancer Res.
53,
3860-3864), ERB-2 surexprimé dans les cancers du sein et du pancréas (Harris
et
al., 1994, Gene Therapy I, 170-175) et a-fétoprotéine surexprimée dans les
cancers du foie (Kanai et al., 1997, Cancer Res. 57, 461-465). On indique que
le
promoteur précoce du Cytomégalovirus (CMV) est tout particulièrement préféré.
20 Bien entendu, les éléments de régulation appropriés peuvent en outre
comprendre des éléments additionnels améliorant l'expression (séquence
intronique, séquence terminatrice de la transcription...) ou encore le
maintien dans
une cellule hôte. De tels éléments sont connus de l'homme de l'art.
Lorsque l'activateur transcriptionnel en usage dans le cadre de la présente
25 invention est composé par un ensemble de polypeptides, ceux-ci peuvent être
produits à partir de séquences nucléotidiques polycistroniques (placées sous
le
contrôle d'un promoteur unique) mettant en oeuvre un site d'initiation de la
traduction de type IRES pour initier la traduction du second cistron. On peut
également employer un promoteur bidirectionnel dirigeant l'expression de deux
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-18-
gènes placés de part et d'autre. On peut aussi générer des cassettes
d'expression
indépendantes comportant chacones des éléments de régulation appropriés tels
que
ceux cités auparavant. Les cassettes peuvent être portées par un même vecteur
d'expression au par des vecteurs différents.
5 Les séquences employées dans le cadre de la présente invention peuvent
être obtenues par les techniques classiques de biologie moléculaire, par
exemple
par criblage de banque à l'aide de sondes spécifiques, par immunocriblage de
banque d'expression, par PCR au moyen d'amorces adéquates ou par synthèse
chimique. Les mutants peuvent être générés à partir des séquences natives par
10 substitution, délétion et/ou addition d'un ou plusieurs nucléotides en
mettant en
oeuvre les techniques de mutagénèse dirigée, de PCR, de digestion par les
enzymes
de restriction et ligation ou encore par synthèse chimique. La fonctionnalité
des
mutants et des constructions peut être vérifiée par les techniques de l'art.
La deuxième composante du système d'expression inductible selon
15 l'invention est un vecteur adénoviral recombinant comportant au moins un
gène
d'intérêt placé sous le contrôle d'un promoteur inductible susceptible d'être
activé
en trans par ledit activateur transcriptionnel.
On aura de préférence recours à un vecteur adénoviral dépourvu de tout
ou partie d'au moins une région essentielle à la réplication sélectionnée
parmi les
20 régions E1, E2, E4 et L1 à L5, afin d'éviter sa propagation au sein de
l'organisme
hôte ou de fenvironnement. Une délétion de la majorité de la région El est
préférée. Avantageusement, elle s'étend des nt 454 à 3328 mais peut également
englober des séquences additionnelles en 5' et 3' à la condition de ne pas
interférer
avec la fonction d'encapsidation. De préférence, le gène pIX n'est pas inclu
dans
25 la délétion de E1. En outre, elle peut être combinée à d'autres
modifications)
touchant notamment les régions E2, E4 et/ou L1-L5, dans la mesure où les
fonctions essentielles défectives sont complémentées en Crans au moyen d'une
lignée de complémentation etlau d'un virus auxilliaire. A cet égard, on peut
avoir
recours aux vecteurs de seconde génération défectifs pour les fonctions E1 et
E4
CA 02341775 2001-02-27
WO 00/1274I PCT/FR99/02051
- 19-
ou E1 et E2 (voir par exemple les demandes internationales W094/28152 et
W097/04119). Pour illustrer ce mode de réalisation, on peut citer un vecteur
combinant une délétion au sein de la région E 1 et une mutation thermosensible
affectant le gène DBP (pour DNA Binding Protein en anglais) de la région E2A
5 (Ensinger et al., 1972, J. Virol. 10, 328-339). Pour ce qui est de la région
E4, elle
peut être délétée en totalité ou en partie. Une délétion partielle de la
région E4 à
l'exception des séquences codant pour les cadres de lecture ouverts (ORF) 3
et/ou
6/7 est avantageuse dans la mesure où elle ne nécessite pas de complémentation
de
la fonction E4 (Ketner et al., 1989, Nucleic Acids Res. 17, 3037-3048). Dans
le
10 but d'augmenter les capacités de clonage, le vecteur adénoviral recombinant
peut
en outre être dépourvu de tout ou partie de la région E3 non essentielle.
Selon
cette alternative, il peut être intéressant de conserver néanmoins les
séquences E3
codant pour les polypeptides permettant l'échappement au système immunitaire
de
l'hôte, notamment la glycoprotéine gpl9k (Gooding et al., 1990, Critical
Review
15 of Immunology 10, 53-71). Selon une autre alternative, on peut employer un
vecteur adénoviral minimal retenant essentiellement les ITRs (Inverted
Terminal
Repeat) 5' et 3' et la région d'encapsidation et défectif pour l'ensemble des
fonctions virales.
Par ailleurs, l'origine du vecteur adénoviral du système d'expression
20 inductible selon l'invention, peut être variée aussi bien du point de vue
de l'espèce
que du sérotype. II peut dériver du génome d'un adénovirus humain ou animal
(canin, aviaire, bovin, murin, ovin, porcin, simien...) ou encore d'un hybride
comprenant des fragments de génome adénoviral d'au moins deux origines
différentes. On peut citer plus particulièrement les adénovirus CAV-1 ou CAV-2
25 d'origine canine, DAV d'origine aviaire ou encore Bad de type 3 d'origine
bovine
(Zakharchuk et al., Arch. Virol., 1993, 128: 171-176 ; Spibey et Cavanagh, J.
Gen.
Virol., 1989, 70: 165-172 ; Jouvenne et al., Gene, 1987, 60: 21-28 ; Mittal et
al.,
J. Gen. Virol., 1995, 76: 93-102). Cependant, on préférera un vecteur
adénoviral
d'origine humaine dérivant de préférence d'un adénovirus de sérotype C,
CA 02341775 2001-02-27
WO OO/I2741 PCT/FR99/02051
-20-
notamment de type 2 ou 5.
Le gène d'intérêt en usage dans la présente invention, peut être issu d'un
organisme eucaryote, d'un procaryote d'un parasite ou d'un vinas autre qu'un
adénovims. II peut être isolé par toute technique conventionnelle dans le
domaine
5 de l'art, par exemple par clonage, PCR ou synthèse chimique. Il peut être de
type
génomique (comportant tout ou partie de l'ensemble des introns), de type ADN
complémentaire (ADNc, dépourvu d'intron) ou de type mixte (minigène). Par
ailleurs, il peut coder pour un ARN antisens et/ou un ARN messager (ARNm) qui
sera ensuite traduit en polypeptide d'intérêt celui-ci pouvant être (i)
intracellulaire,
10 (ü) incorporé dans Ia membrane de la cellule hôte ou (iii) secrété. II peut
s'agir
d'un polypeptide tel que trouvé dans la nature (natif), d'une portion de celui-
ci
(tronqué), d'un mutant présentant notamment des propriétés biologiques
améliorées ou modifiées ou encore d'un polypeptide chimère provenant de la
fusion
de séquences d'origines diverses. Par ailleurs, le gène d'intérêt peut coder
pour un
15 ARN anti-sens, un ribozyme, ou encore un polypeptide d'intérêt.
Parmi les polypeptides d'intérêt utilisables, on peut citer plus
particulièrement les chémokines et cytokines (interféron a, (3 ou y,
interleukine
(IL), notamment l'IL,-2, l'IL-6, l'IL-10 ou encore l'IL-12, facteur nécrosant
des
tumeurs (TNF), facteur stimulateur de colonies (GM-CSF, C-CSF, M-CSF...),
20 MIP-loc, MIP-lai, RANTES, protéine de chémoattraction des monocytes telle
que
MCP-1...), les récepteurs cellulaires (notamment reconnus par le virus HIV),
les
ligands de récepteur, les facteurs de coagulation (Facteur VIII, Facteur IX,
thrombine, protéine C), les facteurs de croissance (FGF pour Fibroblast Growth
Factor, VEGF pour Vascular Endothelial Growth Factor), les enzymes (uréase,
25 rénine, métalloprotéinase, nitric oxide synthétase NOS, SOD, catalase,
lécithine
cholestérol acyl transférase LCAT...), les inhibiteurs d'enzyme (al-
antitrypsine,
antithrombine III, inhibiteur de protéase virale, PAI-1 pour plasminogen
activator
inhibitor), les antigènes du complexe majeur d'histocompatibilité de classe I
ou II
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-21 -
ou polypeptides agissant sur (expression des gènes correspondants, les
polypeptides capables d'inhiber une infection virale, bactérienne ou
parasitaire ou
son développement, les polypeptides agissant positivement ou négativement sur
l'apoptose (Bax" Bcl2, BcIX...), les agents cytostatiques (p21, p 16, Rb), les
5 immunoglobulines en totalité ou en partie (Fab, ScFv...), les toxines, les
immunotoxines, les apolipoprotéines (ApoAI, ApoAIV, ApoE...), les inhibiteurs
d'angiogénèse (angiostatine, endostatine...), les marqueurs (ji-galactosidase,
luciférase....) ou tout autre polypeptide ayant un effet thérapeutique pour
l'affection
ciblée.
10 Plus précisemment, dans le but de traiter un dysfonctionnement héréditaire,
on utilisera une copie fonctionnelle du gène défectueux, par exemple un gène
codant pour le facteur VIII ou IX dans le cadre de (hémophilie A ou B, la
dystrophine (ou minidystrophine) dans le cadre des myopathies de Duchenne et
Becker, l'insuline dans le cadre du diabète, la protéine CFTR (Cystic Fibrosis
15 Transmembrane Conductance Regulator) dans le cadre de la mucoviscidose.
S'agissant d'inhiber (initiation ou la progression de tumeurs ou cancers, on
mettra
de préférence en oeuvre un gène d'intérêt codant pour un ARN anti-sens, un
ribozyme, un produit cytotoxique (thymidine kinase de virus simplex de
l'herpès 1
(TK-HSV-1), ricine, toxine cholérique, diphtérique, produit des gènes de
levure
20 FCYI et FURI codant pour l'uracyle phosphoribosyl transférase et la
cytosine
désaminase.....), une immunoglobuline, un inhibiteur de la division cellulaire
ou des
signaux de transduction, un produit d'expression d'un gène suppresseur de
tumeur
(p53, Rb, p73, DCC....), un polypeptide stimulateur du système immunitaire, un
antigène associé à une tumeur (MUC-1, BRCA-l, antigènes précoces ou tardifs
25 (E6, E7, Ll, L2...) d'un virus à papillome HPV....), éventuellement en
combinaison
avec un gène de cytokine. Enfin, dans le cadre d'une thérapie anti-HIV, on
peut
avoir recours à un gène codant pour un polypeptide immunoprotecteur, un
épitope
antigénique, un anticorps (2F5; Buchacher et al., 1992, Vaccines 92, 191-195),
le
domaine extracellulaire du récepteur CD4 (sCD4 ; Traunecker et al., 1988,
Nature
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-22-
331, 84-86) une immunoadhésine (par exemple un hybride CD4-immunoglobuline
IgG ; Capon et al., 1989, Nature 337, 525-531 ; Byrn et al., 1990, Nature 344,
667-670), une immunotoxine (par exemple fusion de l'anticorps 2F5 ou de
l'immunoadhésine CD4-2F5 à l'angiogénine ; Kurachi et al., 1985, Biochemistry
24,
5 5494-5499), un variant trans-dominant (EP 0614980, W095/16780), un produit
cytotoxique tel que l'un de ceux mentionné ci-dessus ou encore un IFNa, ou
Vii.
Un des gènes d'intérêt peut également être un gène de sélection permettant
de sélectionner ou identifier les cellules transfectées ou transduites. On
peut citer
les gènes néo (codant pour la néomycine phosphotransférase) conférant une
10 résistance à l'antibiotique 6418, dhfr (Dihydrofolate Réductase), CAT
(Chloramphenicol Acetyl transférase), pac (Puromycine Acétyl-Transferase) ou
encore gpt (Xanthine Guanine Phosphoribosyl Transferase). D'une manière
générale, les gènes de sélection sont connus de l'homme de l'art.
Par ailleurs, la cassette d'expression du gène d'intérêt peut, en outre,
15 inclure des éléments additionnels améliorant son expression ou son maintien
dans
la cellule hôte (origines de réplication , éléments d'intégration dans le
génome
cellulaire, séquences introniques, séquences poly A de terminaison de la
transcription, leaders tripartites...). Ces éléments sont connus de l'homme de
l'art.
En outre, le gène d'intérêt peut également comporter en amont de la région
20 codante une séquence codant pour un peptide signal permettant sa sécretion
de la
cellule hôte. Le peptide signal peut être celui du gène en question ou
hétérologue
(issu d'un gène quelconque sécrété ou synthétique).
La cassette d'expression du gène d'intérêt peut être insérée à un endroit
quelconque du génome adénoviral. Avantageusement, elle est introduite en
25 remplacement de la région E3. Lorsque le vecteur adénoviral recombinant
comporte plusieurs gènes d'intérêt, ceux-ci peuvent être placés sous le
contrôle des
mêmes éléments génétiques (cassette polycistronique utilisant un site interne
d'initiation de la traduction de type IRES pour réinitier la traduction du
second
cistron) ou d'éléments indépendants. Dans ce cas, ils peuvent être insérés
dans une
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
- 23 -
même région adénovirale (par exemple en remplacement de E3) ou dans des
régions différentes (par exemple en remplacement de E3 et d'une autre région
délétée).
Dans le cadre de la présente invention, l'expression du gène d'intérêt est
5 contrôlée par un promoteur inductible par un activateur transcriptionnel tel
que
défini ci-avant. Au sens de la présente invention, un promoteur inductible
comprend au moins une séquence cible répondant à l'activateur transcriptionnel
mis en oeuvre et associée de manière opérationnelle à un promoteur minimal.
Les
séquences cibles ont été définies auparavant et sont décrites dans la
littérature
10 accessible à l'homme de l'art (pour rappel, ERE, GI:tE, EcRE, UAS, SxE/GRE,
XRE...). On indique que l'on peut employer une séquence homologue modifiée par
rapport à la séquence native mais exerçant une fonction de régulation
similaire ou
améliorée. Ces modifications peuvent résulter de l'addition, de la délétion
et/ou de
la substitution d'un ou plusieurs nucléotides ou de fusion entre deux
séquences
15 cibles différentes. On peut mettre en oeuvre une ou plusieurs séquences
cibles, par
exemple de 1 à 25, avantageusement de 1 à 10 et, de préférence, de 1 à 7,
éventuellement placées en tandem et dans une orientation quelconque par
rapport
à la TATA box. Elles) est (sont) généralement insérées) dans le promoteur
inductible en amont du promoteur minimal, jusqu'à plusieurs centaines de
paires
20 de bases de celui-ci. Un exemple de promoteur inductible par un activateur
transcriptionnel dérivé du GR, est le LTR du virus MMTV (mouse mammary
tumor virus) qui contient l' élément GRE et des séquences promotrices
adéquates.
Un promoteur minimal comprend essentiellement une TATA box et un site
d'initiation de la transcription fonctionnels dans une cellule ou un organisme
hôte.
25 Ces éléments sont classiques dans le domaine de l'art concerné. On peut
citer plus
particulièrement les promoteurs minimaux des gènes TK, CMV et HSP (promoteur
minimal du gène de protéine de choc thermique de drosophile dépourvu de
l'enhancer).
En outre, le promoteur inductible en usage dans le cadre de la présente
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-24-
invention peut comporter des éléments supplémentaires améliorant le niveau de
transcription ou le limitant à certains tissus particuliers (de type
enhancer). Ces
éléments supplémentaires peuvent de manière alternative être insérés dans une
région génique non codante.
5 Selon un premier mode de réalisation, les séquences nucléotidiques codant
pour l'activateur transcriptionnel et leurs éléments de régulation sont
portées par
le vecteur adénoviral recombinant du système d'expression selon l'invention.
Les
cassettes d'expression du gène d'intérêt et de l'activateur transcriptionnel
peuvent
être localisées dans la même région du génome adénoviral ou en des endroits
10 différents et en orientation sens ou anti-sens l'une par rapport à l'autre.
L'orientation anti-sens est préférée. Un exemple préféré est fourni par un
vecteur
El' E3- dans lequel chacune des cassettes est insérée à la place des séquences
adénovirales délétées.
Selon une autre variante, les séquences nucléotidiques sont portées par un
15 vecteur d'expression indépendant autre que le vecteur adénoviral
recombinant en
usage dans le système d'expression selon l'invention. Il peut s'agir d'un
vecteur
synthétique (lipides cationiques, liposomes polymères ...), d'un plasmide ou
encore
d'un vecteur viral. Il peut être éventuellement associé à une ou plusieurs
substances
améliorant l'efficacité transfectionnelle edou la stabilité du vecteur. Ces
substances
20 sont largement documentées dans la littérature accessible à l'homme de
l'art (voir
par exemple Felgner et al., 1987, Proc. West. Pharmacol. Soc. 32, 11 S-121 ;
Hodgson et Solaiman , 1996, Nature Biotechnology 14, 339-342 ; Remy et al.,
1994, Bioconjugate Chemistry 5, 647-654). A titre illustratif mais non
limitatif, il
peut s'agir de polymères, de lipides notamment cationiques, de liposomes, de
25 protéines nucléaires ou encore de lipides neutres. Ces substances peuvent
être
utilisées seules ou en combinaison. Une combinaison envisageable est un
vecteur
recombinant plasmidique associé à des lipides cationiques (DOGS, DC-CHOL,
spermine-chol, spermidine-chol etc...) et des lipides neutres (DOPE).
Le choix des plasmides utilisables dans le cadre de la présente invention est
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-25-
vaste. II peut s'agir de vecteurs de clonage et/ou d'expression. D'une manière
générale, ils sont connus de l'homme de l'art et nombre d'entre eux sont
disponibles commercialement mais il est également possible de les construire
ou les
modifier par les techniques de manipulation génétique. On peut citer à titre
5 d'exemples les plasmides dérivés de pBR322 (Gibco BRL), pUC (Gibco BRL),
pBluescript (Stratagène), pREP4, pCEP4 (Invitrogene) ou encore p Poly (Lathe
et al., 1987, Gene 57, 193-201). De préférence, un plasmide mis en oeuvre dans
le cadre de la présente invention contient une origine de replication assurant
l'initiation de la replication dans une cellule productrice et/ou une cellule
hôte (par
10 exemple, on retiendra l'origine ColEl pour un plasmide destiné à être
produit dans
E. coli et le système oriP/BBNAl si l'on désire qu'il soit autoreplicatif dans
une
cellule hôte mammifère, Lupton et Levine, 1985, Mol. Cell. Biol. 5, 2533-2542
;
Yates et al., Nature 313, 812-815). II peut en outre comprendre un gène de
sélection permettant de sélectionner ou identifier les cellules transfectées
15 (complémentation d'une mutation d'auxotrophie, gène codant pour la
résistance à
un antibiotique...). Bien entendu, il peut comprendre des éléments
supplémentaires
améliorant son maintien et/ou sa stabilité dans une cellule donnée (séquence
cer qui
favorise le maintien monomérique d'un plasmide (Summers et Sherrat, 1984, Cell
36, 1097-1103, séquences d'intégration dans le génome cellulaire).
20 S'agissant d'un vecteur viral, on peut envisager un vecteur dérivant d'un
adénovirus, d'un rétrovirus, d'un vines associé à l'adénovirus (AAV), d'un
virus
de l'herpès, d'un alphavirus, d'un parvovirus, d'un poxvirus (fowlpox,
canaripox,
virus de la vaccine notamment de la souche MVA (Modified Virus Ankara) ou
Copenhagen... etc) ou d'un foamyvirus. On aura de préférence recours à un
25 vecteur non réplicatif et, éventuellement, non intégratif.
Les rétrovirus ont la propriété d'infecter et de s'intégrer majoritairement
dans les cellules en division et à cet égard sont particulièrement appropriés
pour
l'application cancer. Un vecteur rétroviral convenant à la mise en oeuvre de
la
présente invention comporte les séquences terminales LTR, une région
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-26-
d'encapsidation et les séquences nucléotidiques codant pour l'activateur
transcriptionnel dont l'expression est contrôlée par le promoteur rétroviral
(dans
le LTR 5') ou par un promoteur interne tel que cité ci-dessus. Il peut dériver
d'un
rétrovirus d'une origine quelconque (marin, primate, felin, humain etc...) et
en
5 particulier du MoMuLV (Moloney marine leukemia virus), MVS (Marine sarcome
virus) ou Friend marine retrovirus (Fb29). II est propagé dans une lignée
d'encapsidation capabie de fournir en trans les polypeptides viraux gag, pol
et/ou
env nécessaires à la constitution d'une particule virale. De telles lignées
sont
décrites dans la littérature (PA317, Psi CRIP GP + ~-12 etc...). Le vecteur
10 rétroviral selon l'invention peut comporter des modifications notamment au
niveau
des LTRs (remplacement de la région promotrice par un promoteur eucaryote) ou
de la région d'encapsidation (remplacement par une région d'encapsidation
hétérologue, par exemple de type VL30) (voir les demandes françaises 94 08300
et 97 05203).
15 Un vecteur adénoviral convient tout particulièrement pour l'expression de
l'activateur transcriptionnel envisagé dans le cadre de la présente invention.
On
aura de préférence recours à un vecteur défectif ayant l'une des
caractéristiques
précitées. En particulier, les vecteurs adénoviraux recombinant (portant la
cassette
d'expression inductible du gène d'intérêt) et indépendant (portant la cassette
20 d'expression de l'activateur transcriptionnel) sont de préférence tous deux
déficients pour la fonction E 1 par délétion de tout ou partie de la région E
1 ou
mutation non fonctionnelle. Le cas échéant, l'un ou l'autre ou les deux
peuvent
être en outre déficients) pour au moins l'une des fonctions E2, E4, Ll, L2,
L3, L4
et/ou L5. De même, une délétion de tout ou partie de la région E3 peut être
25 envisagée pour l'un ou les deux vecteurs.
Selon un mode de réalisation avantageux, les vecteurs viraux (vecteur
adénoviral recombinant et, le cas échéant, ledit vecteur viral indépendant)
faisant
partie du système d'expression selon l'invention peuvent être sous la forme de
vecteur ADN ou de particule virale infectieuse.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-27-
La présente invention concerne également un vecteur adénoviral
recombinant comprenant
(i) les séquences nucléotidiques codant pour un activateur transcriptionnel
placées sous le contrôle des éléments de régulation appropriés à leur
5 expression dans une cellule ou un organisme hôte, et
(ü} un gène d'intérêt placé sous le contrôle d'un promoteur inductible
susceptible d'être activé en trans par ledit activateur transcriptionnel.
Le vecteur adénoviral recombinant selon l'invention peut coder pour un
activateur transcriptionnel ayant les caractéristiques définies auparavant
qui, sous
10 forme activé par un inducteur tel que décrit précédemment, a la capacité
d'initier
ou d'activer la transcription d'un gène contrôlé par un promoteur inductible
comprenant une séquence cible spécifique dudit activateur transcriptionnel
telle que
décrite ci-dessus.
De manière alternative, le vecteur adénoviral recombinant selon l'invention
15 peut coder pour un activateur transcriptionnel procaryotique et, notamment,
un
polypeptide comprenant un DLL et un domaine de liaison à l'ADN dérivé d'un
répresseur de l'opéron tétracycline (tetR) et un domaine d'activation de la
transcription quelconque. II s'agit de préférence du polypeptide désigné dans
ia
littérature <ctrans-activateur tétracycline» tTA (Gossen et Bujard, 1992,
Proc. Natl.
20 Acad. Sci. USA 89, 5547-SS1) dans lequel le tetR isolé du transposon TnlO
est
fusionné en phase aux 130 acides aminés C-terminaux de la protéine virale
VP16.
Dans ce cas, on mettra en oeuvre un inducteur non naturel activant le tTA, tel
que
la doxycycline, la tétracycline ou un analogue agoniste. Bien entendu, les
caractéristiques de ia cassette d'expression inductible du gène d'intérêt sont
les
25 mêmes que précédemment, mis à part la présence d'une ou plusieurs
séquences)
cibles) répondant à l'activateur transcriptionnel procaryotique. S'agissant de
tTA,
la séquence cible est constituée par l'opérateur tétracycline (tet0). Dans le
cadre
de la présente invention, on préfère tout particulièrement la combinaison "tet
O -
promoteur minimal" donnant lieu à un promoteur dont le niveau de base de la
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
- 28 -
transcription est naturellement très faible mais activable par l'inducteur tTA
et
répressible par la tétracycline.
ll n'est pas nécessaire de revenir sur le squelette du vecteur adénoviral
recombinant selon l'invention dans la mesure où il répond aux caractéristiques
déjà
5 mentionnées.
La présente invention concerne également une particule virale infectieuse
comprenant un vecteur adénoviral recombinant selon l'invention.
Les techniques de préparation des vecteurs adénoviraux sont largement
documentées dans la littérature. Dans un premier temps, le génome est
reconstitué
10 par recombinaison homologue dans la lignée 293 (voir notamment Graham et
Prevect, 1991, Methods in Molecular Biology, Vol 7, Gene Transfer and
Expression Protocole ; Ed E. J. Murray, The Human Press Inc, Clinton, NJ) ou
dans Escherichia coli (Chantier et al., 1996, J. Virol. 70, 4805-4810 ;
W096/17070). Il est ensuite nécessaire de propager le vecteur afin de
constituer
15 un stock de particules virales le contenant. On utilise à cet effet des
lignées de
complémentation fournissant en crans les produits d'expression viraux pour
lesquels le vecteur est defectif. Par exemple, les virus délétés de E 1
peuvent être
propagés dans la lignée 293, établie à partir de cellules de rein embryonnaire
humain (Graham et al., 1977, J. Gen. Virol. 36, 59-72). Pour ce qui est des
20 vecteurs de seconde génération, on peut avoir recours à des lignées
complémentant
deux fonctions virales essentielles, telles que celles décrites par Yeh et al.
(1996,
J. Virol. 70, 559-565), Krougliak et Graham (1995, Human Gene Therapy 6, 1575-
1586), Wang et al. (1995 Gene Therapy 2, 775-783), Lusky et al. (1998, J.
Virol.
72, 2022-2033) et dans les demandes internationales W094/28152 et
25 W097/04119. Une autre alternative repose sur l'emploi d'un élément viral
supplémentaire, désigné "virus auxiliaire" pour complémenter au moins en
partie
les fonctions défectives d'un vecteur adénoviral recombinant. Les virus
auxiliaires
de l'art antérieur consistent en un génome adénoviral, éventuellement délété
d'une
région essentielle pour laquelle le vecteur recombinant ne nécessite pas de
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-29-
complémentation.
L'invention concerne également un procédé de préparation d'une particule
virale, selon lequel
(i) on introduit un vecteur adénoviral recombinant selon l'invention dans
5 une cellule de complémentation capable de complémenter en trans
ledit vecteur, de manière à obtenir une cellule de complémentation
transfectée,
(ü) on cultive ladite cellule de complémentation transfectée dans des
conditions appropriées pour permettre la production de ladite
10 particule virale, et
(iii) on récupère ladite particule virale dans la culture cellulaire.
Bien entendu, la particule virale peut être récupérée du surnageant de
culture mais également des cellules. Une des méthodes couramment employée
consiste à lyser les cellules par des cycles consécutifs de
congélation/décongélation
1 S pour recueillir les virions dans le surnageant de lyse. Ceux-ci peuvent
être amplifiés
et purifiés selon les techniques de l'art (procédé chromatographique,
ultracentrifi.~gation notamment à travers un gradient de chlorure de
césium...).
La présente invention concerne également une cellule eucaryote
comprenant un système d'expression inductible, un vecteur adénoviral
recombinant
20 selon l'invention ou infectée par une particule virale selon l'invention.
Aux fins de
la présente invention, une telle cellule est constituée par toute cellule
transfectable
par un vecteur ou infectable par une particule virale, tels que définis ci-
avant. Une
cellule de mammifère et notamment humaine convient tout particulièrement. Il
peut
s'agir d'une cellule primaire ou tumorale d'une origine quelconque, notamment
25 hématopoïétique (cellule souche totipotente, leucocyte, lymphocyte,
monocyte ou
macrophage...), muscuïaire (cellule satellite, myocyte, myoblaste, muscle
lisse...),
cardiaque, pulmonaire, trachéale, hépatique, épithéliale ou fibroblaste.
La présente invention a également pour objet une composition
pharmaceutique un système d'expression inductible, un vecteur adénoviral
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-30-
recombinant, une particule virale ou une cellule hôte seion l'invention en
association avec un véhicule acceptable d'un point de vue pharmaceutique.
Une composition selon l'invention est plus particulièrement destinée au
traitement préventif ou curatif de maladies par thérapie génique (y compris
5 immunothérapie) et s'adresse plus particulièrement aux maladies
prolifératives
(cancers, tumeurs, dysplasies...etc), aux maladies infectieuses et notamment
virales
(induites par les virus de l'hépatite B ou C, le HIV, l'herpès, les
rétrovirus....etc),
aux maladies génétiques (mucoviscidose, myopathies, hémophilie, diabète...) et
aux
maladies cardiovasculaires (resténose, ischémie, dislipidémie...).
10 Une composition selon l'invention peut être fabriquée de manière
conventionnelle en vue d'une administration par voie locale, parentérale ou
digestive. En particulier, on associe une quantité thérapeutiquement efficace
de
l'agent thérapeutique ou prophylactique à un support acceptable d'un point de
vue
pharmaceutique. Les voies d'administration envisageables sont multiples. On
peut
15 citer par exemple la voie intragastrique, sous-cutanée, intracardiaque,
intramusculaire, intraveineuse, intraartérielle, intrapéritonéale,
intratumorale,
intranasale, intrapulmonaire ou intratrachéale. Pour ces trois derniers modes
de
réalisation, une administration par aérosol ou instillation est avantageuse.
L'administration peut avoir lieu en dose unique ou répétée une ou plusieurs
fois
20 après un certain délai d'intervalle. La voie d'administration et les doses
de virus
appropriées varient en fonction de divers paramètres, par exemple, de
l'individu,
de la pathologie, du gène d'intérêt à transférer, de la voie d'administration.
A titre
indicatif, les préparations à base de particules virales peuvent être
formulées sous
forme de doses comprises entre 104 et 10'4 ufp (unités formant des plages),
25 avantageusement 105 et 1013 ufp et, de préférence, 106 et 1012 ufp. Lorsque
l'on
met en oeuvre un ou des vecteur(s), des doses comprenant de 0,01 à 100 mg
d'ADN, de préférence 0,05 à 10 mg et, de manière tout à fait préférée, 0,5 à 5
mg
peuvent être envisagées.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-31 -
La formulation peut également inclure un diluant, un adjuvant ou un
S
excipient acceptable d'un point de vue pharmaceutique, de même que des agents
de solubilisation, de stabilisation, de préservation. Une composition préférée
est
sous forme injectable. Elle peut être formulée en solution aqueuse, saline
(phosphate, monosodique, disodique, magnésium, potassium....) ou isotonique.
Elle peut être présentée en dose unique ou en multidose sous forme liquide ou
sèche (poudre, lyophilisat...) susceptible d'être reconstituée de manière
extamporanée par un diluant approprié.
La présente invention est également relative à l'utilisation thérapeutique ou
10 prophylactique d'un système d'expression inductible, d'un vecteur
adénoviral
recombinant, d'une particule virale ou d'une cellule hôte selon l'invention
pour la
préparation d'un médicament destiné au transfert et à l'expression dudit gène
d'intérêt dans une cellule ou un organisme hôte et, en particulier, au
traitement du
corps humain ou animal par thérapie génique. Selon une première possibilité,
le
15 médicament peut être administré directement in vivo (par exemple par
injection
intraveineuse, dans une tumeur accessible, dans les poumons par aérosol, dans
le
système vasculaire au moyen d'une sonde appropriée...). On peut également
adopter l'approche ex vivo qui consiste à prélever des cellules du patient
(cellules
souches de la moëlle osseuse, lymphocytes du sang périphérique, cellules
20 musculaires...), de les transfecter ou infecter in vitro selon les
techniques de l'art
et de les réadminister au patient après une étape d'amplification éventuelle.
La
prévention et le traitement de nombreuses pathologies peuvent être envisagés.
Une
utilisation préférée consiste à traiter ou prévenir les cancers, tumeurs et
maladies
résultant d'une prolifération cellulaire non désirée. Parmi les applications
25 envisageables, on peut citer les cancers du sein, de l'utérus (notamment
ceux
induits par les papillomas virus), de la prostate, du poumon, de la vessie, du
foie,
du colon, du pancréas, de l'estomac, de l'oesophage, du larynx du système
nerveux
central et du sang (lymphomes, leucémie etc...). Elle est également utile dans
le
cadre des maladies cardiovasculaires, par exemple pour inhiber ou retarder la
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-32-
prolifération des cellules de muscles lisses de la paroi vasculaire
(resténose). Enfin
pour ce qui est des maladies infectieuses, l'application au SIDA peut être
envisagée.
L'invention s'étend également à une méthode pour le traitement des
5 maladies par thérapie génique, caractérisée en ce que i'on administre à un
organisme ou à une cellule hôte ayant besoin d'un tel traitement un système
d'expression inductible, un vecteur adénoviral recombinant, une particule
virale ou
une cellule hôte selon l'invention.
Enfin, l'invention concerne également un activateur transcriptionnel
10 comprenant un DLL et un domaine de trans-activation dérivé d'un récepteur
stéroïdien et un domaine de liaison à l'ADN hétérologue, notamment dérivé de
la
protéine de levure Gal4. Un tel activateur transcriptionnel est obtenu en
échangeant
par les techniques de biologie moléculaire le domaine de liaison à l'ADN du
récepteur stéroïdien par celui de Gal4 (en particulier porté par les résidus 1
à 74).
15 Un hybride ERT ou GRd°" et Gal4 est tout à fait préféré.
On indique que l'ensemble des dénominations utilisées dans la présente
demande sont conventionnelles dans le domaine de l'art et que la portée inclut
aussi les équivalents fonctionnels, c'est à dire tout polypeptide, domaine,
gène,
composé obtenu par modification d'un polypeptide, domaine, gène, composé natif
20 et présentant une activité de même nature, voire sensiblement augmentée.
La Figure 1 est une représentation schématique de la quantité de FIX
produite 144 h après transfection transitoire des cellules 293 par les
plasmides
pTG13064 (CMV-GRde"), pTG6242 (LTR MMTV-FIX, sens) et pTG13063 (LTR
25 MMTV-FIX, anti-sens).
La Figure 2 : Évaluation de l'effet Dose / Réponse Dexaméthasone dans
des cellules A549. L'infection des cellules est réalisée avec une MOI = 50
avec
AdTG13092 ou AdTG13088. L'induction par la dexaméthasone est réalisée en
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-33-
faisant varier la concentration de 10'9 à 10''M.
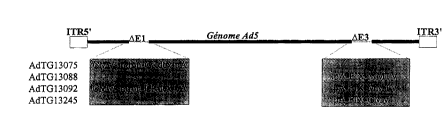
La Figure 3 : Représentation schématique des constructions AdTG13075,
AdTG13088, AdTG13092 et AdTG13245.
La Figure 4 (a, b, c et d) : Evaluation in vivo du système inductible Grdex
5 / Dexaméthasone avec les différentes constructions testées dans les souris
C57B1/6. Les valeurs présentées sont les moyennes des valeurs mesurées dans
chacune des souris traitées.
La Figure 5 (a, b, c et d) : Evaluation in vivo du système inductible Grdex
Dexaméthasone avec les différentes constructions testées dans les souris SCòD.
10 Les valeurs présentées sont les moyennes des valeurs mesurées dans chacune
des
souris traitées.
La Figure 6 : Evaluation d'un effet Dose / Réponse Dexaméthasone in vivo
dans des souris SCID.
La Figure 7 : Représentation schématique de vecteurs adénoviraux dérivant
15 du plasmide pTg6401 de première et de deuxième générations.
La présente invention est illustrée, sans pour autant être limitée, par les
exemples suivants.
EXEMPLES
20 Les constructions décrites ci-dessous sont réalisées selon les techniques
générales de génie génétique et de clonage moléculaire, détaillées dans
Maniatis et
al., (1989, Laboratory Manual, Cold Spring Harbor, Laboratory Press, Cold
Spring
Harbor, NY ou une édition plus récente) ou selon les recommandations du
fabricant lorsqu'on utilise un kit commercial. Les étapes de clonage sont
réalisées
25 dans les souches E. coli SK (hsdR, mcrA), DHSa [(recAl, endAl, hodRl7 (r-m-
),
supE44 thi-1, gyrA (nalr)] ou NM522 (supE, thi, (lac-proAB), OhsdS, (r-m-),
(F'
proAB, lacIq, ZOM15) et celles de recombinaison homologue dans la souche E.
coli BJ 5183 (Hanahan, 1983, J. Mol. Biol. 166, 557-580). S'agissant de la
CA 02341775 2001-02-27
WO 00/12741 PCT1FR99/02051
-34-
réparation des sites de restriction, la technique employée consiste en un
remplissage des extrémités 5' protubérantes à l'aide du grand fragment de
l'ADN
polymérise I d'E. coli (Klenow, Boehringer Mannheim). Les fragments d'ADN
sont purifiés à l'aide du kit de purification d'ADN GeneCleanllR (BiolOlInc.).
Par
5 ailleurs, les fragments de génome adénoviral employés dans les différentes
constructions décrites ci-après, sont indiqués précisément selon leur position
dans
la séquence nucléotidique du génome de l'Ad5 telle que divulguée dans la
banque
de données Genebank sous la référence M73260.
En ce qui concerne la biologie cellulaire, on a recours aux lignées
10 cellulaires 293 (Graham et al, 1977, supra ; disponible à l'ATCC sous la
référence
CRL1573), A549 E1+ (WO94/28152), A549 (ATCC CCL-185) et Vero (ATCC
CCL-81). Il est entendu que d'autres lignées cellulaires peuvent être
utilisées. Les
cellules sont maintenues en culture à 37°C en atmosphère humide
enrichie à 5% de
COZ dans du milieu DMEM (Dulbecco's Modified Eagie Medium, Gibco BRL)
15 complémenté avec 1 mM de glutamine, 1% d'acides aminés (Gibco BRL), 40pg/1
de gentamycine et 10% de sérum de veau foétal (SVF,Gibco BRL). La transfection
et la transduction des cellules est réalisée selon les techniques de l'art
(précipitation
au phosphate de calcium...)
20 EXEMPLE 1 . Construction d'un vecteur adénoviral co-exprimant
l'activateur transcriptionnel ERT et le gène FIX régulé par les
séquences ERE.
L'ADNc du gène sauvage ER est contenu dans le plasmide pSGI-HEO
25 (Tors et al., 1989, EMBO J. 8, 1981-1989). Le domaine de liaison aux
oestrogènes
du récepteur ER (fragment BamHI XbaI) est remplacé par celui du mutant ERT
(G521R) porté par le fragment NotI-XbaI de pCre-ERT (Feil et al., 1996, Proc.
Natl. Aca.d. Sci. USA 93, 10887-10890). Les séquences ERT sont insérées dans
le
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-35-
site EcoRI du vecteur de transfert pTG6600. A titre indicatif, pTG6600 est un
vecteur p polyII (Lathe et al., 1987, Gene 57, 193-201) dans lequel sont
insérées
les séquences Ad5 1 à 458, le promoteur précoce CMV, les séquences d'épissage
hybrides trouvées dans le plasmide pCI (Promega Corp, comprenant le site
5 donneur d'épissage de l'intron 1 du gène ~i-globine humaine et le site
accepteur
d'épissage du gène d'immunoglobuline de souris), les séquences de
polyadénylation du virus SV40 et les séquences Ad5 3328-5788. Une telle
construction est à la portée de l'homme de l'art. Le vecteur ainsi obtenu
pTG6237
contient la cassette d'expression CMV-ERT présente dans la région E1. La
10 construction finale désignée pTG6246 est reconstituée par recombinaison
homologue (Chartier et al., 1996, J. Virol. 70, 4805-4810) entre le fragment
Pacl
Bst EII isolé du vecteur précédent et pTG4656 linéarisé par CIaI. Ce dernier
est
un plasmide adénoviral E1- E3- contenant dans E1 Ie gène LacZ sous le contrôle
du promoteur MLP (décrit dans la demande FR97 06757). Ainsi le génome
15 adénoviral porté par pTG6246 comprend la cassette CMV-ERT dans la région E1
et est délété de la région E3.
L'ADNc du FIX humain (Anson et al, 1984, EMBO J. 3, 1053-1060) est
cloné sous forme d'un fragment BamHI isolé d'un plasmide de l'art antérieur
(par
exemple décrit dans le brevet 88 14635) et inséré en aval du promoteur minimal
20 TK-HSV précédé de la séquence ERE (Klein-Hitpass et al., 1986, Cell 46,1053-
1061). La cassette est introduite dans le site BgIII de pTG4664 en orientation
sens
et antisens (donnant respectivement pTG13227 et pTG13228). Le plasmide
pTG4664 comprend les nucléotides 25838 à 320004 de l'Ad5 délétés des
nucléotides 27871 à 30748 de la région E3. Une recombinaison homologue avec
25 le plasmide pTG6401 digéré par SfrI (comportant le génome Ad5 délété des
régions E1 et E3) permet de générer les vecteurs adénoviraux E1- E3- portant
la
cassette inductible ERF./TKp-FïX en orientation sens et antisens dans la
région E3.
La construction sens (correspondant au sens de transcription de E3) est
dénommée
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-36-
pTG13235 et la construction anti-sens pTG13236.
Les vecteurs doublement recombinants contenant les cassettes d'expression
CMV-ERT et EREfTKp-FIX à la place des régions E1 et E3 respectivement sont
générés par recombinaison homologue entre les fragments portant la cassette
5 inductible FIX isolés des vecteurs pTG13227 et pTG13228 et le vecteur
pTG6246.
On obtient pTG13233 et pTG13234 selon l'orientation de la cassette inductible.
EXEMPLE 2 . Construction d'un vecteur adénoviral co-exprimant
l'activateur transcriptionnel GRde= et le gène FIX régulé par
10 les séquences GRE.
L'ADNc du récepteur GRdex porté par le fragment EcoRI (2,7Kb) du
plasmide pHGl (Kumar et al., 1987, Cell Sl, 941-951) est cloné dans le site
EcoRI
du vecteur pTG6600, pour donner pTG13064. Le vecteur adénoviral pTG13075
15 contenant la cassette d'expression CMVp-GRdex en remplacement de la région
EI
et délété de la majorité de la région E3 est obtenu par recombinaison
homologue
entre le fragment Pacl Bst EII isolé du vecteur précédent et pTG4656 linéarisé
par
CIaI.
Le fragment BamHI contenant l'ADNc du FIX humain est inséré en aval
20 du LTR de MMTV contenant la séquence GRE (Cato et al., 1986, EMBO J. S,
2237-2240). La cassette est ensuite introduite en orientation sens et antisens
dans
le site BgIII de pTG4664 bordant les séquences E3 délétées. Les vecteurs de
transfert sont désignés pTG6242 (sens) et pTG13063 (anti-sens). Une
recombinaison homologue avec le plasmide pTG6401 digéré par SfrI (comportant
25 Ie génome adénoviral délété des régions E1 et E3) permet de générer les
vecteurs
adénoviraux E1' E3' portant la cassette inductible LTR MMTV-FIX en orientation
sens et antisens dans la région E3. La construction sens (identique au sens de
transcription de E3) est dénommée pTG13082 et la construction anti-sens
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-37-
pTGI 3088.
Une recombinaison homologue avec le plasmide pTG13075 permet de
générer les vecteurs adénoviraux E l' E3' portant la cassette inductible LTR
MM'TV-FIX en orientation sens et antisens dans la région E3 et la cassette CMV-
5 GRd"'' dans la région E1. La construction sens (identique au sens de
transcription
de E3) est dénommée pTG13083 et la. constriction anti-sens pTG13092 (sens de
transcription inverse pour les cassettes FIX et GRdex)_
EXEMPLE 3 . Construction d'un vecteur adénoviral co-exprimant
10 l'activateur transcriptionnel VgEcR et le gène FIX régulé par
tes séquences 5zE/GRE.
Le plasmide pVgRXR (In Vitrogen) comprend les deux sous-unités
composant l'activateur transcritionnel activable par l'ecdysone ou son
analogue
15 muristérone A. La première est composée du récepteur de l'ecdysone (VgEcR)
modifié au niveau de trois acides aminés du domaine de liaison à l'ADN de
façon
à obtenir une séquence analogue à celle du récepteur GR et fusionné en phase
au
domaine de trans-activation de VP16 et la seconde du récepteur de l'acide
rétinoïque humain RXR (No et al., 1996, Proc. Natl. Acad. Sci. USA 93, 3346-
20 3351). Les deux ADNc codant pour VgEcR et RXR dirigés par les promoteurs
CMV et RSV respectivement sont modifiés par introduction d'un intron en 5' des
séquences codantes (intron de pCI pour CMVp-VgEcR et intron (3-globine de
lapin pour RSVP-RXR) et sont introduits dans la région El d'un vecteur
adénoviral selon la technique précédente.
25 Les séquences codant pour le FIX humain sont introduites en aval d'un
promoteur inductible comprenant la séquence cible SxE/GRE couplée au
promoteur minimal ~hsp (pIND ; In Vitogen). Comme précédemment, la cassette
est introduite dans les deux orientations dans le site BgIII de pTG4664. La
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-38-
recombinaison homologue avec pTG6401 digéré par SfrI permet de générer les
plasmides portant la cassette inductible dans la région E3 en orientation sens
ou
ante-sens.
On obtient le vecteur adénoviral doublement recombinant par
S recombinaison homologue avec le vecteur de transfert contenant les séquences
VgEcR et RXR.
EXEMPLE 4 : Production des adénovirus.
10 Les vecteurs adénoviraux recombinants contenant les cassettes
d'expression des activateurs et/ou du FIX sont libérés des plasmides
correspondants (pTG13083, pTG13092, pTG13233, pTG13234...) par digestion
PacI avant d'être transfectés dans la lignée de complémentation 293. Le lysat
cellulaire est récolté, soumis à trois étapes successives de
15 congélation/décongélation afin de libérer les particules virales puis
clarifié par
centrifugation à 3500 rpm pendant 5 min. Les virions présents dans le
surnageant
peuvent être éventuellement amplifiés par passage sur une lignée permissive
(293
ou A 549-E1+) et purifiés sur gradient de chlorure de césium selon les
techniques
de l'art. Le stock adénoviral est dialysé dans un tampon de formulation
approprié
20 tel que décrit dans W098/02522 (par exemple saccharose 1M, NaCI 150 mM,
MgCl2 lmM, Tris-HCI 10 mM et Tween 80 0,1 %). Le titre viral est déterminé en
unités infectieuses par dosage de la protéine DBP par immunoffuorescence
(L,usky
et al., 1998, J. Virol. 72, 2022-2032) ou en nombre de particules virales par
mesure
spectrophotométrique à 260 nm.
25 Un vecteur contrôle est construit en insérant l'ADNc du facteur IX humain
sous le contrôle du promoteur CMV isolé du plasmide pCI (Proméga). La cassette
d'expression constitutive est introduite dans la région E3, donnant pTG13231
(orientation sens) et pTG13232 (orientation anti-sens). Les virions sont
produits
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-39-
selon la même méthodologie que ci-dessus.
Une recombinaison homologue entre les plasmides pTG13231 et
pTG13232 et le plasmide pTG6401 linéarisé par Srfl permet d'obtenir
respectivement les plasmides pTG13244 et pTG13245 portant la cassette
5 d'expression constitutive CMV-FIX en orientation sens et antisens dans la
région
E3.
EXEMPLE 5 : Evaluation in vitro du système inductible par GRdei.
10 Les vecteurs de transfert pTG13064, pTG6242 et pTG13063 portant
respectivement les cassettes CMV-GRdeX, LTR MMTV-FIX (sens) et LTR
MMTV-FIX (anti-sens) sont transfectées de manière transitoire dans les
cellules
293 (Spg d'ADN pour 106 cellules). En outre, le plasmide pTG13064 est co-
transfecté avec soit pTG6242 ou pTG13063. Les cultures sont poursuivies en
15 présence de dexaméthasone (10~ M) ou en son absence. Les surnageants
cellulaires sont prélevés 48, 96, 120 et 144 heures après transfection et la
quantité
de FIX produite est déterminée par ELISA (kit Asserachrom ; Diagnostica
Stago).
Les résultats présentés dans la Figure 1 montrent une induction de la
production
de FIX en présence de l'activateur GRdeX activé par la dexaméthasone. Le
20 récepteur exprimé par pTG13064 est donc fonctionnel dans la mesure où à
l'état
activé (en présence de dexaméthasone), il peut se fixer sur les motifs GRE du
MMTV et induire la transcription du gène FIX. L'activité basale du système est
très faible. En effet, la quantité de FIX produite en l'absence de
dexaméthasone ou
de pTG13064 est faible, voire négligeable.
25 La cinétique d'expression du FIX en fonction du temps montre que le
niveau de production maximal est atteint 120 h après la transfection. Au delà,
la
concentration stagne ce qui peut s'expliquer par l'état des cellules (à
confluence)
et un appauvrissement du milieu et probablement en dexaméthasone.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-40-
L'efficacité du système a également été évalué par infection adénovirale en
présence de dexaméthasone ou non. Les cellules hôtes non permissives Vero ou
A549 sont infectées par les virions AdTG13083 ou AdTG13092 portant les
cassettes CMV-GRd"' et MMTV-FIX (sens pour le premier virus et anti-sens pour
5 le second) ou co-infectées par les adénovirus AdTG13075 (CMV-GRdeX> et
AdTG13082 (MMTV-FIX sens) ou AdTG13088 (MMTV-FIX anti-sens). On
utilise une MOI (multiplicité d'infection) de 100 pour les expériences
d'infection
et 50 pour chacun des virus dans les cas de co-infection. La quantité de F1X
produite dans les surnageants de culture est dosée par ELISA.
10 Dans les cellules Vero, l'expression du FIX n'est quantifiable qu'après
infection par les virions AdTG13092 portant les deux cassettes et en présence
de
l'inducteur. Aucune induction n'a lieu en absence de dexaméthasone ou du
récepteur GRd"'. Il est à noter que ces cellules n'expriment pas le GR
sauvage.
En cellule A549, le FIX est produit en présence de dexaméthasone dans les
15 cellules infectées par AdTG13088 ou AdTG13092. II est à noter que ces
cellules
expriment le GR sauvage. Cependant le niveau de FIX est différé dans le temps
en
l'absence de GRd"' (virion AdTG13088).
En conclusion, le système inductible mettant en oeuvre le récepteur GRd'
et la dexaméthasone est fonctionnel dans les constructions dans lesquelles la
20 cassette inductible MMTV-FIX est en orientation anti-sens (AdTG13088 et
AdTG13092). Par ailleurs, le système d'induction en cis (cassettes portées par
un
seul virus) est sensiblement plus productif qu'un système en trans mettant en
oeuvre deux virus, notamment dans les cellules Vero.
Par ailleurs, l'étude a été reproduite en faisant varier les MOI. Les cellules
25 Vero sont infectées par le virus AdTG13092 à une MOI de 10, 50 ou 100. A
titre
de contrôle, on utilise l'AdTG13075. Le dosage du FIX est effectué 48 et 72 h
après l'infection. On observe une production de FIX quelque soit la MOI
employée, mais le niveau optimal d'expression est obtenu pour une MOI de 50.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-41 -
On a également fait varier la concentration en inducteur de 10-9 à 10-5 M.
A forte concentration, la dexaméthasone s'avère cytotoxique se traduisant par
une
moindre expression du FIX. A faible concentration (10-g M et au delà),
l'induction
n'est pas efficace. L'optimum se situe à 10-~ M.
S Une analyse de l'effet « dose-réponse » plus détaillée a été conduite en
faisant varier la concentration en Dexaméthasone de 10'9 à 10-' M. Cette étude
a
été réalisée en cellules A549 exprimant le récepteur GR sauvage. Une
activation
peut par conséquent avoir lieu par le biais de ce récepteur activable par la
Dexaméthasone. En réalité, on observe pour une concentration en Dexaméthasone
10 de 10-8 M, que l'expression du Facteur IX ne peut être induite qu'après
infection
par le vecteur AdTG13092 codant pour le récepteur modifié GRd°". Cette
concentration est ailleurs trop faible pour permettre l'activation du
récepteur GR
endogène (Figure 1). Par conséquent, nous avons montré que l'induction du gène
rapporteur peut se faire de façon contrôlée et sélective, y compris en
présence du
15 récepteur GR sauvage, en utilisant des doses de ligand plus faibles. Cet
aspect est
important en vue d'applications in vivo, conditions naturelles pour lesquelles
le
récepteur GR sauvage est exprimé.
EXEMPLE 6 : Evaluation in vivo du système inductible par GRdex.
Le virus AdTG13092 est injecté par voie intraveineuse à des souris
immunocompétentes C57B1/6 à raison de 4x108 ou 8x108 ui. La dexaméthasone
est administrée aux animaux par voie intrapéritonéale à une concentration de
100
ltg pendant 3 jours consécutifs (à J0, J1 et J2). Les sérum sont prélevés
régulièrement à partir du 3ième jour suivant l'infection et la quantité de FIX
produite est évaluée par ELISA. On observe dans ces conditions une production
significative de FIX.
CA 02341775 2001-02-27
WO 00/12741 PCTlFR99/02051
-42-
EXEMPLE 7 : Evaluation in vivo du système inductibte GRdex dans des
souris immunocompétentes.
Les virus AdTG13092, AdTG13088 et AdTG13245 sont injectés par voie
5 intraveineuse à des souris immunocompétentes C57BI/6 à raison de 5X108 iu.
Les
virus AdTG13088 et AdTG13075 (Figure 3) sont également co-injectés à raison
de SXlOg iu chacun.
La phase d'induction est réalisée en injectant par voie intrapéritonéale
100 p.g de Dexaméthasone pendant 3 jours consécutifs (à JO-JI-J2, J21-J22-J23
IO et J42-J43-J44).
Les sérums des souris traitées sont prélevés à différents temps afin
d'évaluer la production du Facteur IX par la technique ELISA.
Les résultats (Figures 4a, b, c et d) montrent que
- l'expression du gène rapporteur Facteur IX est induite par la
15 Dexaméthasone aussi bien après injection du vecteur AdTG13092
contenant la cassette d'expression du trans-activateur GRd"' ainsi que
la cassette inductible MMTV-FIX, qu'après co-injection de deux
vecteurs portant chacun l'une de ces cassettes d'expression ;
- l'expression du FIX est également induite par la Dexaméthasone après
20 injection du vecteur AdTG13088 seul. Dans ce cas, le niveau
d'expression du FIX reste stable au cours des trois inductions. Cette
induction est réalisée par le biais du récepteur GR sauvage, exprimé par
les cellules murines et activable par la Dexaméthasone. Néanmoins, on
peut noter qu'à la première induction, le niveau d'expression du FIX
25 est 10 fois inférieur à celui obtenu dans le cas des souris exprimant le
récepteur modifié GRd"' .
- aucune expression n'est détectée en absence de Dexaméthasone, quel
que soit le vecteur injecté. On peut valablement en conclure que les
CA 02341775 2001-02-27
WO 00/12'741 PCT/FR99/02051
- 43 -
quantités de glucocorticoïdes endogènes sont trop faibles pour
permettre l'activation du promoteur MMTV via le récepteur GR
sauvage ;
- en présence du récepteur modifié GRd"', le niveau d'expression du F1X
5 est comparable au promoteur constitutif CMV.
EXEMPLE 8 : Evaluation in vitro du système inductible par GRd°z
dans des
souris immunodéficientes.
10 Les virus AdTG13092, AdTG13088 et AdTG13245 (voir Figure 3) sont
injectés par voie intraveineuse à des souris immunodéficientes scidlscid à
raison de
5X108 iu. Les virus AdTG13088 et AdTG13075 sont également co-injectés à
raison de SXlOg iu chacun. L'induction est réalisée en injectant par voie
intrapéritonéale 100 pg de Dexaméthasone pendant 3 jours consécutifs (à JO-Jl-
J2,
15 J21-J22-J23 et J42-J43-J44).
Les sérums des souris sont prélevés à différents temps afin d'évaluer la
production du FIX par la technique ELISA.
Les résultats (Figures Sa, b, c et d) sont comparables à ceux observés dans
le cas de souris immunocompétentes
20 - l'expression du FIX est induite après injection de Dexaméthasone chez
les souris exprimant le récepteur modifié GRa"' (injection AdTG13092
ou AdTG13088+AdTG13075). Le niveau d'induction chute d'un log
après la deuxième et la troisième injections de ligand, puis reste stable
pendant la durée de l'expérience (7 mois). Les niveaux d'induction sont
25 comparables en cis (injection d'un vecteur adénoviral unique) et en
trans (injection de deux vecteurs adénoviraux} ;
- l'expression du FIX est induite par la Dexaméthasone après injection
du vecteur AdTG13088, par le biais du récepteur GR sauvage. Le
CA 02341775 2001-02-27
WO 00/12741 PC'f/FR99/02051
-44-
niveau d'induction est stable au cours du temps ;
- aucune expression basale du FIX n'est détectée en absence de
Dexaméthasone, quel que soit le vecteur injecté ;
- le niveau d'induction en présence du GRd~' est comparable à
S l'expression du gène liée au promoteur constitutif CMV (du moins lors
de la première induction) ;
- des études complémentaires ont permis de montrer la présence de
l'ADN viral par Southern blot, ainsi que l'expression du GRd"' par
Northern blot, après injection du vecteur AdTG13092 ou AdTG13075
10 (au moins jusqu'à 56 jours après injection des vecteurs adénoviraux).
EXEMPLE 9 : Evaduation d'une dose-réponse in vivo dans des souris
immunodéficientes..
15 Les vecteurs AdTG13092 et AdTG13088 sont injectés par voie
intraveineuse à des souris immunodéficientes scidlscid à raison de 5X108 iu.
L'induction est réalisée en injectant par voie intrapéritonéale 50 ou 5 lzg de
Dexaméthasone pendant 3 jours consécutifs (à JO-J1-J2 et J21-J22-J23). Les
sérums sont prélevés à différents temps afin d'évaluer la production du FIX
par
20 ELISA.
Des études préalables ont permis de montrer que l'injection de 3X100 p,g,
3X50 pg ou 3X20 pg de Dexaméthasone permet d'obtenir des niveaux d'induction
équivalents. Dans cette étude, les inventeurs ont identifié une dose de ligand
permettant d'activer l'expression du gène rapporteur via le récepteur modifié
GRa"'
25 apporté par un vecteur adénoviral (AdTG13092), mais incapable d'activer
cette
expression par le biais du GR endogène (injection AdTG13088).
L'injection de 3X5 p.g de Dexaméthasone permet d'activer l'expression du
FIX en présence du GRd"', mais est incapable d' activer cette expression par
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
- 45 -
l'intermédiaire du GR endogène (Figure 6). Cette dose permet par conséquent
d'activer l'expression du transgène de façon contrôlée et sélective, même en
présence du récepteur sauvage.
5 EXEMPLE 10 : Mise au point d'un système d'ezpression inductible capable
de prévenir le développement d'une réponse immunitaire
après administration in vivo de vecteur adénoviral.
Les vecteurs adénoviraux représentent un système de choix pour transférer
10 un gène thérapeutique chez un patient. Cependant, l'expression du transgène
est
généralement transitoire. Pour cette raison, il est nécessaire de répéter les
administrations du vecteur adénoviral afin d'assurer une expression prolongée
du
gène thérapeutique. Malheureusement, une première injection d'adénovirus
entraîne fréquemment le développement d'une réponse immunitaire qui empêche
15 toute nouvelle administration. Dans le cadre de la présente invention, les
inventeurs
ont développé une nouvelle approche reposant sur l'expression d'une molécule
immunosuppressive capable d'empêcher la mise en place de cette réponse
immunitaire anti-adénovirus. Pour cela, les inventeurs ont inséré le gène
codant
pour l'interleukine-10 (IL,-10) dans un système d'expression inductible porté
par
20 un vecteur adénoviral. L'expression régulée et contrôlée de l'iL-10 permet
ainsi
la mise au point de protocoles pour lesquels la réadministration de vecteurs
portant
le gène thérapeutique est possible.
a) Implication de la réponse immunitaire dans la persistance des adénovirus
25 recombinants
- Réponse immunitaire cellulaire
Vecteur délété des régions EI et E3
L'importance de la réponse immunitaire a été mise en évidence lors
d'expériences réalisées dans des souris immunocompétentes ou immunodéficientes
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-46-
(Yang Y., F. A. Nunes, K. Berencsi, E. E. Furth, E. Gijncz~l and J. M. Wilson.
1994, Proc. Natl. Acad. Sci. USA. 91 :4407-4411). Ainsi, l'expression du gène
rapporteur IacZ est transitoire après injection du vecteur adénoviral dans des
souris
immunocompétentes, mais stable dans des souris immunodéficientes. Ces études
5 suggèrent donc que les cellules transduites sont détnzites par les
lymphocytes T
cytotoxiques (CTL). En outre, il a été montré que la génération des CTL est
induite par les particules virales injectées, et non seulement par les
protéines virales
néo-synthétisées.
10 vecteur délété des régions El, E3 et E4 ou E2a
Les délétions des régions E4 ou E2a font disparaître toute expression
résiduelle de protéine virale. Toutefois, la toxicité n'est pas diminuée en
éliminant
la région E2a. Par contre la délétion de la région E4 conduit à une diminution
significative de la toxicité hépatique après injection intraveineuse. Malgré
une
15 persistance de l'ADN, l'expression du transgène est toutefois souvent
réduite de
façon importante.
- Réponse immunitaire humorale
Plus de 85% de la population mondiale est immunisée contre l'adénovinus
20 et possède des anticorps anti-adénovirus dirigés contre les sérotypes 2 ou
5. Si
aucune ré-infection ne se produit, le titre en anticorps neutralisants chute
pour
atteindre un niveau indétectable au bout de 2 ans. Ces anticorps peuvent
empêcher
la fixation du virus sur le récepteur membranaire et sa translocation dans le
cytoplasme.
25 Quelles que soient les délétions du génome adénoviral, le système
immunitaire humoral est susceptible de reconnaître les protéines de la capside
virale
et de produire des anticorps neutralisants anti-adénovirus. Des stratégies
d'immunosuppression sont donc requises pour permettre une réadministration.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-47-
b) Stratégie d'immunosuppression de la réponse immunitaire humorale
L'interleukine-10 est connue pour avoir des propriétés
immunosuppressives et a montré des résultats prometteurs dans le cas des
rejets
de greffe et dans des traitements anti-inflammatoires. L'IL-10 est secrétée
par de
5 nombreuses cellules (monocytes / macrophages, cellules T, cellules B après
activation par un antigène) et a de nombreuses cellules cibles (dont les
monocytes
/ macrophages, les cellules B, les cellules T, les neutrophiles et les
cellules
endothéliales). Elle a un effet pléïotropique et possède des activités
immunostimulatrices ou immunosuppressives selon le type cellulaire. Les
10 interleukines-10 humaine et de rat sont très homologues, 84 % d'homologie
au
niveau nucléotidique et 73% au niveau protéique.
L'II,-10 a un effet immunosuppresseur sur les monocytes/macrophages.
Elle inhibe la production des cytokines pro-inflammatoires et des chimiokines,
ainsi
que l'expression du CMH de classe II et des molécules de co-stimulation. Elle
15 limite aussi la durée de la réponse inflammatoire des granulocytes et des
éosinophiles.
A l'opposé, l'IL-10 stimule la viabilité, la sécrétion d'anticorps et
l'expression du CMH de classe II des lymphocytes B. Elle possède également un
rôle de stimulation sur les mastocytes et sur les cellules T CD8+.
Globalement, l'IL-
20 10 a toutefois un très fort effet immunosuppresseur.
Les propriétés anti-inflammatoires et immunosuppressives de l'II,-10
pourraient intervenir dans la suppression de la production d'anticorps
neutralisants
contre fadénovin.is recombinant. En effet, la co-injection d'adénovirus codant
pour
l'IL-10 et pour la ~i-galactosidase empêche l'induction de la réponse
immunitaire
25 contre le virus et la production de CTL, permettant ainsi une expression
prolongée
du gène rapporteur .
Cependant, une immunosuppression prolongée est associée à des effets
secondaires non négligeables il est donc souhaitable d'obtenir une
immunosuppression de façon transitoire et régulable.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
- 48 -
c) Système inductible selon l'invention
Le système que nous avons développé est basé sur l'induction par les
hormones. En effet, celles-ci vont se fixer sur leur récepteur nucléaire,
constitué
5 d'un domaine de fixation à l'hormone, d'un domaine de fixation à l'ADN et
d'un
domaine de transactivation. Après changement conformationnel et fixation sur
les
éléments cibles localisés au niveau de l'ADN, la transcription du gène situé
en aval
du promoteur régulable sera ainsi activée. Afin d'éviter toutefois
l'activation par
les hormones endogènes, éléments non contrôlables, les inventeurs ont choisi
10 d'utiliser des récepteurs modifiés au niveau du domaine de fixation à
l'hormone.
Ces récepteurs mutés tels que les récepteurs aux oestrogènes ou à la
progestérone
sont capables de répondre à des ligands exogènes synthétiques, mais pas aux
hormones endogènes.
Les inventeurs ont développé un système basé sur le récepteur aux
1 S glucocorticoïdes modifié, GRd"', capable d'induire l'expression du
transgène situé
en aval des éléments GRE (Glucocorticoïd Responsive Element) après activation
par la dexaméthasone, mais pas pa.r les glucocorticoïdes endogènes. Au cours
de
cette étude, différents vecteurs adénoviraux exprimant fIL-10 de façon
inductible
ont été générés, afin d'évaluer leurs effets sur la réponse immunitaire anti-
20 adénovirus.
d) Génération des vecteurs adénoviraux
Tous les vecteurs adénoviraux dérivent du plasmide pTg6401 comportant
le génome de l'adénovirus humain de type 5 délété des nucléotides 459 à 3327
25 (région )E1) et des nucléotides 28 592 à 30 470 (région )E3).
Insert en E1 : Le gène modifié GRd'~ est introduit dans la région El du
génome de l'adénovirus de type 5 par recombinaison homologue entre le plasmide
pTg6401 et le plasmide de transfert contenant l'ADNc GRd"' sous contrôle du
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-49-
promoteur CMV (Cytomegalovims), d'un intron chimérique (pCI; Promega) et
d'un signal de polyadénylation du SV40.
Insert en E3 : L'ADNc de fIL-10 de rat (Feng L., W.W. Tang, J.C. Chang
5 and C.B. Wilson. 1993. Biochem. Biophys Res. Commun.. 192 :452-45) a été
obtenu par PCR inverse sur les ARNm totaux de cellules de rat au moyen des
oligonucléotides OTG12237 (CTAGTCTAGA CCACCATGCT TGGCTCAGCA
CTGCT=SEQ ID N° 1) et OTG12243 (TTTATAGCGG CCGCTCAATT
TTTCATTTTG AGTG=SEQ ID N° 2), par 30 cycles de dénaturation (1
minute
10 à 95°C), hybridation des amorces (1 minute à 65°C) et
extension (1 minute à
72°C). L'ADNc est placé en aval de 4 éléments de réponse aux
glucocorticoïdes
GRE (Glucocorticoïd Responsive Element) contenus dans le promoteur LTR du
MMTV (Mouse Mammary Tumor Virus). Cette cassette d'expression est
introduite dans le plasmide de transfert délété de la région E3 dans
l'orientation
15 anti-sens par rapport à la région E3 sauvage de l'adénovirus.
Une recombinaison homoiogue de ce vecteur de transfert avec les vecteurs
adénoviraux Ad-GRd~' ou pTg6401 permet de générer respectivement soit un
vecteur portant la cassette d'expression de l'activateur en E1 et la cassette
inductible en E3 en orientation antisens (Ad-GRd"'-MMTV/IL,-10-E4 sauvage)
soit
20 un vecteur contenant uniquement la cassette d'induction en E3 (Ad-DEl-
MMTV/11,10-E4 sauvage).
L'ADNc de l'IL-10 de rat a également été placé sous contrôle du
promoteur CMV. Cette cassette d'expression constitutive a été insérée dans la
région E3 de pTg6401 en orientation antisens (Ad-DEI-CMV/11,10).
25 Toutes les constructions de deuxième génération sont obtenues par
recombinaison homologue entre le plasmide de transfert contenant les cadres de
lecture 3 et 4 (ORF3,4) de la région E4 et les vecteurs de première génération
précédents.
L'ensemble des constructions de première et de deuxième générations sont
CA 02341775 2001-02-27
WO 00/I2741 PCT/FR99/02051
-50-
illustrées dans la Figure 7.
e) Evaluation de l'expression de l'IL-10 in vitro
Transfection transitoire dans des cellules 293
Les cellules 293 sont transfectées par les plasmides de transfert contenant
les cassettes d'expression de l'interleukine-10 de rat en présence ou non de
la
cassette d'expression de l'activateur GRd"'. Elles sont mises en culture en
présence
ou non de dexaméthasone ( 10-' M) en DMEM 10% S VF. Les surnageants sont
prélevés à différents temps afin d'analyser l'expression du transgène.
10
Validation in vitro des adénovirus recombinants dans des cellules A549
et IfERO
Les cellules A549 et VERO sont ensemencées la veule à 3.105 cellules dans
des plaques de 6 puits. Les cellules sont infectées à une MOI de 50 avec les
15 différents préstocks viraux dans 250 pl DMEM 2% SVF. Après 30 minutes
d'adsorption à 37°C, 3m1 de DMEM 2% SVF sont r'àjoutés sur les cellules
en
présence ou non de dexaméthasone 10-'M. Les surnageants sont prélevés à
différents temps afin d'analyser l'expression du transgène.
20 Quantification de 1 'expression de I 'IL-! 0 de rat par test ELISA (Enzyme
Linked Immunosorbent Assay)
La détection de l'IL-10 de rat est réalisée à l'aide du kit OptEIA~
(Pharmingen). Les kits sont utilisés selon les spécifications des fabricants.
L'induction de l'IL-10 par la dexaméthasone a été évaluée par transfection
25 transitoire des plasmides de transfert dans des cellule 293. La capacité
d'induction
est analysée en co-transfectant le vecteur de transfert MMTV-IL10 avec ie
vecteur
exprimant le trans-activateur GRd'~. La transfection du plasmide MMTV-IL10
seul
indiquera le niveau d'expression de l'IL-10 en absence du trans-activateur. De
plus,
le niveau d'induction est comparé à l'expression constitutive de l'IL-10 sous
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
-51-
contrôle du promoteur CMV, en transfectant également ce plasmide dans les
cellules 293. L'induction est réalisée en présence ou non de dexaméthasone à
une
concentration de 10' M. Les surnageants de culture sont prélevés 72 et 120
heures
après la transfection afin de quantifier l'IL-10 par kit ELISA . La co-
transfection
5 des plasmides MMTV-IL,10 et GRd"' en présence de dexaméthasone permet
l'induction de l'IL-10 (50 ng / ml à 120 H post-transfection).
Les inventeurs ont démontré que l'apport du trans-activateur GRd"' et du
ligand dexaméthasone permet une induction de l'expression de l'IL,-10 sous
contrôle du promoteur inductible MMTV.
10 L'efficacité d'induction de l'IL-10 par la dexaméthasone couplée au GRC"'
a été évaluée in vitro par infection des cellules humaines A549 et des
cellules
simiennes VERO avec les vecteurs Ad-MMTV-IL10 ~ AdGRd"' ou Ad-GRd'~-
MMTV-IL10. Ces deux types d'infection permettent d'évaluer l'efficacité
d'induction en trans ou en cis. Les cultures cellulaires sont réalisées en
présence
15 ou non de dexaméthasone 10'' M. Les quantités d'IL-10 obtenues seront
comparées à celle obtenues après infection par Ad-CMVIL-10 exprimant cette
cytokine de façon constitutive. D'autre part, l'induction de l'IL,-10 est
comparée
à celle du facteur TX humain inséré dans les mêmes constructions, évaluées in
vitro
au préalable. Les surnageants sont prélevés à 24, 48, 72 et 96 heures post-
infection
20 afin de quantifier l'IL-10 et le facteur IX produits, au moyen de kits
ELISA .
En cellules VERO, l'expression de l'II,-10 est induite lorsque les cellules
sont co-infectées par Ad-MMTV-IL10 + Ad-CMV-GRa"' en présence de
dexaméthasone, pour atteindre 50,8 ng/ml 96 heures après infection. En absence
du ligand, I'IL-10 est à peine détectable (1,2 ng/ml). Au contraire, en
absence du
25 trans-activateur GRd~', aucune induction significative de l'expression de
l'IL-10 ne
peut être notée (3 ng/ml en présence de dexaméthasone, correspondant à
l'expression résiduelle obtenue en transfection transitoire ; 0,7 ng/ml en
absence
de dexaméthasone).
Les inventeurs ont donc pu démontrer qu'en cellules VERO, l'expression
CA 02341775 2001-02-27
WO 00112741 PCT/FR99/02051
-52-
de l'IL-10 peut être induite par la dexaméthasone couplée au GRd"' en « trams
»,
lorsque les deux cassettes d'expression sont portées par deux vecteurs
adénoviraux
différents.
En cellules AS49, ils ont également pu vérifier la fonctionnalité du système
S inductible en « trans ». En effet, la concentration en IL-10 atteint 32,3
ng/ml en
présence de dexaméthasone après co-infection par les vecteurs Ad-MMTV-IL,10
+ Ad-CMV-GRd"'. En absence de ligand, la cytolcine est indétectable.
L'expression
de l'IL-10 est également induite par la dexaméthasone après infection par le
vecteur Ad-MMTV-IL10 seul. Cette activation se fait par le biais du récepteur
GR
10 sauvage exprimé par les cellules A549.
CA 02341775 2001-02-27
WO 00/12741 PCT/FR99/02051
LISTE DE SEQUENCES
<110> TRANSGENE
<120> SYSTEME D'EXPRESSION INDUCTIBLE
<130> D17688
<140>
<141>
<160> 2
<170> PatentIn Ver. 2.1
<210> 1
<211> 35
<212> ADN
<213> Séquence artificielle
<220>
<223> OTG12237
<400> 1
ctagtctaga ccaccatgct tggctcagca ctgct 35
<210> 2
<211> 34
<212> ADN
<213> Séquence artificielle
<220>
<223> OTG12243
<220>
<400> 2
tttatagcgg ccgctcaatt tttcattttg agtg 34