Note: Descriptions are shown in the official language in which they were submitted.
CA 02342990 2000-12-15
WO 99/6591a PCT/FR99/01359
DERIUES DE L'ARTEMISININE, LEUR PROCEDE DE PREPARATION ET LES COMPOSITIONS
PHARMACEUTIQUES QUI LES CONTIENNENT
La présente invention concerne de nouveaux dérivés d'artémisinine, leur
procédé de
préparation et les compositions pharmaceutiques qui Ies contiennent.
L'artémisinine est un principe actif isolé de Artemisia annual. L., bien connu
pour son activité
contre la malaria.
De nombreux dérivés d'artémisinine sont décrits, pour leurs propriétés contre
la malaria
(IN 173339), dans le traitement de ~la toxoplasmose (US 5486535), ou encore
pour leur
activité anticancéreuse comme par exemple les dimères d'artémisinine décrits
dans la demande
lo WO 9701548.
Les composés de la présente invention, de par leur structure originale, sont
nouveaux, et
présentent des propriétés pharmacologiques particulièrement intéressantes en
tant qu'agents
antitumoraux.
Plus spécifiquement, la présente invention concerne les composés de formule
(I)
R-O-A
dans laquelle
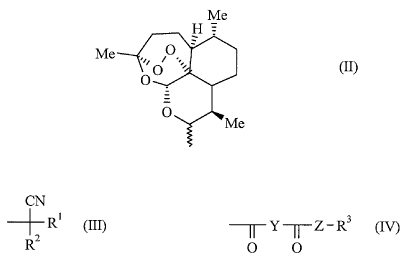
~ R représente le radical de formule (II)
Me
H
Me ,,~ O, :,~
o (n)
O
O_
~ A représente
CN
G
- un groupement de formule (III) : -Ç-R'
Rz
2()
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
2
dans iequei - R' représente un groupement aryle, aryle substitué, hétéroaryle
ou hétéroaryle substitué,
- RZ représente un atome d'hydrogène, ou un groupement alkyle (C,-C~)
linéaire ou ramifié substitué ou non,
- ou un groupement de formule (IV) : -C-Y-C-Z-R3 (f~
II II
~ ~
dans lequel - Y représente un groupement alkylène (CZ-C~4) linéaire ou ramifié
substitué ou non, alkénylène (Cz-C,4) linéaire ou ramifié substitué ou non,
alkynyiène (C2-C,4) linéaire ou ramifié substitué ou non, phén~lène,
phénvlène substitué, naphtylène, ou naphtylène substitué,
- Z représente un atome d'oxygèné, de soufre, ou un groupement NR'Z où R'2
peut prendre les mêmes valeurs que R2,
- R3 représente un groupement de formule (III) tel que défini précédemment,
étant entendu que
- par aryle on entend un groupement phényle, naphtyle, phénanthryle,
fluorényle ou anthryle,
- par hétéroaryle, on entend tout groupement mono ou bicyclique aromatique
contenant de 5 à
10 atomes et pouvant contenir de 1 à 3 hétéroatomes choisis parmi oxygène,
azote ou soufre,
- le terme "substitué" affectant les expressions "aryle", "hétéroaryle",
"phénylène",
"naphtylène", signifie que ces groupements sont substitués par un ou plusieurs
radicaux,
identiques ou différents, choisis parmi alkyle (C1-C6) linéaire ou ramifié,
hydroxy, alkoxy
{C,-C6) linéaire ou ramifié, alkoxycarbonyle (C~-C6), polyhalogénoalkyle (C1-
C6) linéaire ou
ramifié, aryloxy (non substitué ou substitué par un ou plusieurs groupements,
identiques ou
différents, choisis parmi hydroxy, alkyle (C~-C6) linéaire ou ramifié, alkoxy
(C~-C6) linéaire
ou ramifié, polyhaïoaénoalkyle (C,-C6} linéaire ou ramifié, ou atomes
d'halogène), nitro,
amino, alkylamino (C~-C~) linéaire ou ramifié, dialkylamino (C1-C6) linéaire
ou ramifié,
2~ alkylcarbonylamino, cyano ou atomes d'halogène (fluor, chlore, brome ou
iode), ou deux
atomes de carbone adjacents peuvent être substitués par un groupement
aikylènedioxy,
- ie terme "substitué" affectant les expressions "alkyle", "alkylène",
"alkénylène", "alkynylène"
signifie que ces groupements sont substitués par un ou plusieurs radicaux,
identiques ou
différents, choisis parmi hydroxy, alkoxy (C,-C6) linéaire ou ramifié,
polyhalogénoalkyle,
amino ou atomes d'halogène (fluor, chlore, brome ou iode),
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99101359
3
leurs énantiomères et diastéréoisomères, ainsi que leurs sels d'addition à un
acide ou une base
pharmaceutiquement acceptable.
Parmi les acides pharmaceutiquement acceptables, on peut citer à titre non
limitatif les acides
chlorhydrique, bromhvdrique, sulfurique, phosphonique, acétiqué,
trifluoroacétique, lactique,
pyruvique, malonique, succinique, glutarique, fumarique, tartrique, maléïque,
citrique,
ascorbique, oxalique, méthane sulfonique; camphorique, etc...
Parmi les bases pharmaceutiquement acceptables, on peut citer à titre non
limitatif (hydroxyde
de sodium, l'hydroxyde dé potassium, la triéthylamine; la tertbutylamine,
etc...
Les composés préférés de l'invention sont ceux pour lesquels
- A représente un groupement de formule (III),
- A réprésente un groupement de formule (IV),
- Z représente un atome d'oxygène,
- Z représente un groupement NR'2,
- Y représente une chaïne alkylène ou alkénylène (C2-CI4), substituées ou non,
15 - Y représente un phénvlène ou un naphtyléne, substitués ou non,
- R' représente un groupement aryle ou aryle substitué.
De faon avantageuse, l'invention concerne les composés de formule (I) pour
lesquels A
représente
un groupement de formule (III) où R' représente un groupement phényle
substitué ou non et
20 RZ représente un atome d'hydrogène ou un groupement méthyle,
ou un groupement de formule (IV) où Y représente unè chaîne -(CHZ)~ où n ést
teI que
2 < n <_ 7, Z représente un atome d'oxygène ou un groupement NR'2 et R~
représente un
groupement de formule (III) où R' représente un groupement phényle ou naphtyle
substitués
ou non et RZ représente un atome d'hydrogène ou un groupement méthyle.
2~ Encore plus spécifiquement, l'invention concerne Ies composés de formule
(I) qui sont
- le 2-(4-bromophénvll-2-dihydroartémisininyl-acétonitrüe,
- le 2-phényl-2- dihydroartémisininyl-acétonitrile,
- le 1,4-succincte de [(~-chlorophényl)(cyano)méthyle] et de
dihydroartémisininyle,
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
4
- ie 4-{{{4-bromophényl)(cyano)méthyl](méthyl)amino}-4-oxobutanoate de dihydro-
artémisininyle.
Les énantiomères, diastéréoisomères ainsi que les sels d'addition à un acide
ou une base
pharmaceutiquement acceptable des composés préférés de l'invention font partie
intégrante de
l'invention.
L'invention s'étend également au procédé de préparation des composés de
formule (I)
caractérisé en ce que l'on utilise comme produit de départ le composé de
formule (V)
R~OH (V)
dans laquelle R est tel que défini précédemment,
lo sur lequel on condense
- dans des conditions de catalyse acide, un composé de formule (VI)
i
R~-Ç-OH (~)
dans laquelle R' et R' sont tels que définis précédemmènt,
pour conduire au composé de fornnule (I/a), cas particulier des composés de
formule (I)
R~O~C~Rz
(va)
Ra
I>
dans laquelle R, R' et R2 sont tels que définis précédemment,
- ou un composé de formule {VII)
HO-~-Y-COOH (VII)
O
dans laquelle Y est défini comme précédemment, (ou le chlorure d'acide ou
(anhydride
2o correspondants),
CA 02342990 2000-12-15
WO 99165914 PCT/FR99/01359
pour conduire au composé de formule (VIII)
RIO-~-Y-COOH (VIII)
O
dans laquelle R et Y sont définis comme précédemment,
sur lequel on fait réaUir dans des conditions de catalyse acide, en présence
d'un agent de
couplage, ou après transformation en chlorure d'acide correspondant,
~ un composé de formule (VI) pour obtenir le composé de formule (I/b), cas
particulier des
composés de formule (I)
CN
R~~~~~~O-~-Y-~-O-Ç-R' (Ilb)
O O R2
dans laquelle R, R'. R' et Y sont tels que définis précédemment,
o ~ un composé de formule (IX)
CN
R~- i -~,z (I~
Rz
dans laquelle R', R' et R'z sont tels que définis précédemment,
pour conduire au composé de formule (Ilc), cas particulier des composés de
formule (I)
R.2 CN
RvwwO-C-y-C-N-C-R' (I/c) '
II II 12
O O R
dans laquelle R, R'. R2, R'2 et Y sont tels que définis précédemment;
~ ou un composé de t'ormule (X)
CN
R - i - SH (X)
Rz
dans laquelle R' et R- sont tels que définis précédemment,
CA 02342990 2000-12-15
W0 99/65914 6 PCT/FIt99/OI359
pour conduire au composé de formule (I/d), cas particulier des composés de
formule (I)
CN
RIO-C-Y-C-S-C-R' (I/d)
II fl ~
O O RZ
dans laquelle R, Y, R' et R2 sont définis comme précédemment,
les composés (I/a) à (I/d) formant l'ensemble des composés de formule (I) et
pouvant être
purifiés selon une technique classique de séparation, que l'on transforme, si
on le souhaite, en
leurs sels d'addition à un acide ou à une base pharmaceutiquement acceptable,
et dont on
sépare éventuellement les isomères optiques ou géométriques selon des
techniques classiques
de purification.
Le composé de formule (V} est aisément accessible à (homme de l'art par
réduction classique
1c> de 1'artémisinine (commerciale). Les composés de formule (VI} sont obtenus
par condensation
classique d'un sel de cyanure sur la cétone de formule (XI)
~ R2
c~)
dans laquelle R' et RZ sont définis comme précédemment.
Les composés de formule (IX) sont obtenus par l'action d'une amine R'zNH2 dans
laquelle R'2 a
15 la même définition que précédemment sur le composé de formule (VI).
Les composés de formule (X) sont obtenus par l'action d'HZS en présence d'un
catalyseur
comme AI20~ par exemple sur le composé de formule (VI).
Un autre procédé a~.~antageux de l'invention concerne la préparation des
composés de
formule (I) pour lesquels A représente un groupement de formule (IV},
caractérisé en ce que
2c~ l' on utilise comme produit de départ, un composé de formule (VII)
HO-i -Y-COOH (VII)
O
dàns laquelle Y est tel que défini précédemment, (ou le chlorure d'acide ou
l'anhydride
correspondants},
sur lequel on condense
CA 02342990 2000-12-15
WO 99/65914 PCTIFR99/01359
- en présence d'un agent de couplage, un composé de formule (IX)
CN
R1 Ç-NHR'Z (IX)
R2
dans laquelle R', RZ et R'2 sont définis comme précédemment,
pour conduire au composé de formule (XII)
R2 R'2
R'-C-N-C-Y-COOH (XII)
! ll
CN O
dans laquelle R', R2, R'' et Y sont tels que définis précédemment,
sur lequel on condense un composé de formule (~ pour ôbtenir Ie composé de
formule (I/c),
cas particulier des composés de formule (I)
R~2 CN
RIO-C-Y-C-N-C-R~ (I/c)
O O R2
1o dans laquelle R, Y, R', R2 et R'2 sont tels que définis précédemment,
- un composé de formule (VI)
CN
i
R'-Ç-OH
RZ
dans laquelle R' et R' sont définis comme précédemment,
pour conduire au composé de formule (XIII)
CN
R'-Ç'O-~-Y-COOH (XIII)
R O
dans laquelle R', R' et Y sont définis comme précédemment,
sur lequel on condense un composé de formule (~ pour obtenir le composé'de
formule (I/b),
cas particulier des composés de formule (I)
CN
RIO-C-Y-C-O-C-R' (I/b)
II ~Z
O O R
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99101359
g
dans laquelle R, Y, R' et RZ ont la même définition que précédemment,
- ou un composé de formule (X)
CN
R'-. ~ - SH (X)
R2
dans laquelle R' et Rr sont définis comme précédemment,
pour obtenir le composé de formule (XIV)
CN
R'-Ç-S-ë-Y-COOH (XIV)
Rz O
dans laquelle R', R' et Y sont tels que définis précédemment,
sur lequel on condense un composé de formule (V) pour obtenir le composé de
formule {Ild),
cas particulier des composés de formule (I)
CN
R~.O_ë_Y_ II S I Rl {Ud)
O O RZ
IU
dans laquelle R, Y, R' et RZ sont définis comme précédemment,
les composés (Ilb), (L c) et (Ild) pouvant être purifiés selon une technique
classique de
séparation, que l'on transforme, si on Ie souhaite, en leurs sels d'addition à
un acide ou à une
base pharmaceutiquement acceptable, et dont an sépare éventuellement les
isomères optiques
I a ou géométriques selon des techniques classiques de purification.
Les composés de formule (I) possèdent d'intéressantes propriétés
pharmacologiques. Ils ont
une excellente cytotoxicité irr vitro non seulement sur des lignées
leucémiques mais également
sur des lignées de tumeurs solides, ét ont également une action sur le cycle
cellulaire. Ces
propriétés permettent leur utilisation en thérapeutique en tant qu'agents
antitumoi-aux.
2o La présente invention a également pour objet les compositions
pharmaceutiques contenant les
produits de formule (I). leurs isomères optiques au un de leurs sels
d'addition à une base ou un
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
g
acide pharmaceutiquement acceptables, seul ou en combinaison avec un ou
plusieurs excipients
ou véhicules inertes, non toxiques.
Parmi les compositions pharmaceutiques selon l'invention, il sera cité plus
particulièrement
cellès qui conviennent pour l'administration orale, parentérale, nasale,
rectale, perlinguale,
oculaire ou respiratoire. et notamment les comprimés simples ou dragéifiés,
les comprimés
sublinguaux, les sachets. les paquets, les gélules, ies glossettes, lès
tablettes, les suppositoires,
les crèmes, les pommades, les gels dermiques, les préparations injectables ou
buvables, les
aérosols, lés gouttes oculaires ou nasales.
La posologie utile varie selon l'âge et Ie poids du patient, la voie
d'administration, Ia nature de
lt~ l'indication thérapeutique et des traitements éventuellement associés et
s'échelonne entre 0,1 et
400 mg par jour, en une ou plusieurs administrations.
Les Exemples suivants illustrent l'invention et né la limitent en aucune
façon.
Dans les Exemples qui suivent, on adoptera comme convention de nomenclature
{ I R,4S,5R,9R,13 S)-1: 5.9-triméthyl-11,14, i 5-trioxatétracyclo[ 10.3
.1.04°'3.OR° i3]hexadéc-10-yle
Me
H
l~e~ C
R _ ~ôp ~~' _ radical dihydroartémisininyle
p
EXEMPLE 1 : (S) 2-(.t-Bromophényl)-2-dihydroartémisininyloxy-acétonitrile
RIO-ÇH ~ Br
CN
A une solution de dihvdroartémisinine (1,5 g ; 5,3 mmoles) dans 20 mI de
CHZCIz sec, on
ajoute 1,7 g (8 mmolesl dè 2-(4-bromophényl)-2-hydroxyacétonitrile à -
20°C. Après addition
2c~ de BF~/Et20 (0,1 ml : 0,8 mmoles), la solution est laissée remonter à
température ambiante.
Après un traitement classique, Ie composé du titre est séparé par
chromatographie sur colonne
de silice, puis recristallisé dans de l'éther de pétrole.
Point de f~~sinn : 125- I?9°C
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99101359
Microanalyse élémentaire
C H N
Calculé ~ 7, 7~ .i, 90 2, 93
r~ Trouvé S 7, 80 b, 0 7 2, 85
5 EXEMPLE 2 : (R) 2-(4-Bromophényl)-2-dihydroartémisininyloxy-acétonitrile
Lors de la séparation par chromatographie décrite dans l'Exemple l, on obtient
le produit du
titre.
Pvirrt de îTrsivrr .~ I ~ht-1-l3 °C
Microanalyse élémentaire
lo C H N
°o Calculé 57,73 3,90 2,93
'% Trvtrvé J 7, J 2 ~, 88 2, 65
EXEMPLE 3 : {R) 2-(4-Fluorophényl)-2-dihydroartémisininyloxy-acétonitrile
On procède comme dans l'Exemple 1 en remplaçant le 2-(4-bromophényl)-2-
hydroxyacétonitrile par Ie 2-(4-fluorophényl)-2-hydroxyacétonitrile.
Poire de ~îrrsion : 122-123 °C
Micrvarralyse élémentaire
C H N
'% Calcula f6,17 6, 7E 3, 3b
'% Trouvé bb, I6 6, 74 3, 33
Les Exemples 4 à 16 sont obtenus suivant le même procédé à partir des nitriles
appropriés.
EXEMPLE 4 : (S) 2-Phényl-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dihvdroartémisinine et 2-pltényl-2-hydroxyacétonitrile.
P()rrrl de t(SlyIT : 133-137°C
CA 02342990 2000-12-15
WO 99!65914 PCTIFR99/01359
11
EXEMPLE 5 : (R) 2-Phényl-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dihydroartémisinine et 2-phényl-2-hydroxyacétonitrile.
Puit~t de;~uriurr : 98-!00°C
EXEMPLE 6 : (S) 2-(3,4-Diméthoxyphényl)-2-dihydroartémisininyloxy-acétonitrite
s Produits de départ : dihvdroartémisinine et 2-(3,4-diméthoxyphényl)-2-
hydroxyacétonitrile.
Hrsile
EXEMPLE 7 : (R} 2-(3,4-Diméthoxyphënyl)-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dihvdroartémisinine et 2-(3,4-diméthoxyphényl)-2-
hydroxyacétonitrile.
Huile
1o EXEMPLE 8 : (R) 2-(2-Fluorophényl)-2-dihydroariémisininyloxy-acétonitrile
Produits de départ : dihydroartémisinine et 2-{2-fluorophényl)-2-
hydroxyacétonitrile.
Puir~t deaîusivf~ : !20-124°C
EXEMPLE 9 : (R) 2-(3-Fluorophényl)-2-dihydroartémisininyioxy-acétonitrile
Produits de départ : dihydroartémisinine et 2-(3-fluorophényl)-2-
hydroxyacétonitrile.
1 ~ Point de, fie Sion : 13l -13-I °C
EXEMPLE 10 : (R) 2-(2-Bromophényl)-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dihvdroartémisinine et 2-(2-bromophényl)-2-
hydroxyacétonitrile.
Point de usivn : 128-I?9°C
EXEMPLE 11 : (R) 2-(3-Bromophényl)-2-dihydroartémisininyloxy-acétonitrile
2c} Produits de départ : dihvdroartémisinine et 2-(3-bromophényl)-2-
hydroxyacétonitrile.
Point de fi~.sivn : I-l~-1-l6°C
CA 02342990 2000-12-15
WO 99/GS914 PCT/FR99/01359
12
EXEMPLE 12 : (R) 2-(4-Chlorophényl)-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dihvdroartémisinine et 2-(4-chlorophényl)-2-
hydroxyacétonitrile.
Peint de fusion : ht 2-I -J~ °C
EXEMPLE 13 : (R) 2-{2-Chlorophényl)-2-dihydroariémisininyloxy-acétonitrile
Produits de départ : dihydroartémisinine et 2-(2-chlorophényl)-2-
hydroxyacétonitrile.
Point de fusion : 13î-I-l0°C
EXEMPLE 14 : (R} 2-(3-Chlorophényl)-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dih~~droartémisinine et 2-(3-chlorophényl)-2-
hydroxyacétonitrile.
Point de rrsion : 132-13.5°C
lo EXEMPLE 15 : 2-(4-Nitrophényl)-2-dihydroartémisininyioxy-propanenitrile
Produits de départ : dihvdroartémisinine et 2-(4-nitrophényl)-2-hydroxy-
propanenitrile.
EXEMPLE 1G : 1,4-Succincte de [(2-hromophényl)(cyano)méthyleJ
et de dihydroartémisininyle
RIO-~-(CH2)2-~-O-ÇH
O O CN
Br
~S~ade A : Acide -l-dihvdroartémisininyloxy-~-oxobutanoi'que
Le produit du titre est obtenu classiquement par condensation de l'acide
succinique ou de son
anhydride sur Ia dihydroartémisinine.
~S'tade B : l,.l-,S'uccinare de ~(2-bromophényl)(cyano)méthylJ et de
dihydroartémisininyle
A une solution du composé obtenu au stade A (2,0 g ; S,2 mmoles) dans 20 ml de
CHZCIz sont
2t> ajoutés le 2-(2-bromophényl)-2-hydroxyacétonitrile (1,7 g ; 8,0 mmoles),
le DCC (1,7 g ;
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
13
8,2 mmoles) et la Dri2~P {0,1 g ; 0,8 mmoles) à 0-S°C. La réaction est
agitée 4 heures puis le
solide blanc formé est filtré. La phase organique obtenue est concentrée sous
pression réduite
et chromatographiée sur colonne de silice (éluant : acétate d'éthyleléther de
pétrole}. Le
produit du titre est obtenu sous forme d'un solide blanc.
Microanalyse élémentaire
C H N
"o Calculé X6,06 .5,.58 2,42
o,~ Trouvé 3 6, 28 .i, 60 2, 3l
EXEMPLE I7 : 1,4-Succincte de [{2-chlorophényl)(cyano)méthyle]
lt~ et de dihydroartémisininyle
On procède comme dans l'Exemple 16 en remplaçant, dans le stade B, le 2-(2-
bromophényl)-2-
hydraxyacétonitrile par le 2-(2-chlorophényl)-2-hydroxyacétonitrile.
Microanalyse élémentaire
C H N
°« Calculé 60; 73 6, 04 2, 62
"« Trouvé fi0, 91 6,1 S 2, 69
Les Exemples 18 à 27 sont obtenus selon le même procédé en remplaçant dans le
stade B le
2-(2-bromophényl)-2-hvdroxyacétonitrile par le réactif approprié.
EXEMPLE IS : 1,4-Succincte de [(phényl)(cyano)méthyle] et de
dihydroartémisininyie
2o Produit de départ : 2-Phényl-2-hydroxyacétonitrile.
Point de,f't~sion : I-l2-I-i-I°C
EXEMPLE a19 : 1,4-Succincte de [(4-chlorophényl)(cyano)méthyle]
et de dihydroartémisininyle
Produit de départ : 2-É-1-Chlorophényl)-2-hydroxyacétonitrile
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
EXEMPLE 20 : 1,4-Succincte de {1-cyano-I-phényléthyle} et de
dihydroartémisininyle
Produit de départ : 2-Phényl-2-hydroxypropanenitrile.
EXEMPLE 21 : 1,4-Succincte de [(3,4-diméthoxyphényl)(cyano)méthyleJ
et de dihydroartémisininyle
Produit de d~art : 2-(3,4-Diméthoxyphényl)-2-hydroxyacétonitrile.
EXEMPLE 22 : 1,4-Succincte de [(1,3-benzodioxol-5-yl)(cyano)méthyleJ
et de dihydroartémisininyle .
Produit de départ : 2-( 1.3-Benzodioxol-5-yl)-2-hydroxyacétonitrile.
EXEMPLE 23 : 1,4-Succincte de [(2,4-diméthoxyphényl){cyano)méthyleJ
et de dih~droartémisininyie
Produit de départ : 2-(2.4-Diméthoxyphényl)-2-hydraxyacétonitrile.
EXEMPLE 24 : 1,4-Succincte de [(4-nitrophényl)(cyano)mëthyleJ
et de dihydroartémisininyle
Produit de départ : 2-(4-Nitirophényl)-2-hydroxyacétonitrile.
1 ~ EXEMPLE 25 : 1,4-Succincte de [(4-méthoxyphënyl)(cyano)méthyleJ
et de dihydroartémisininyle
Produit de départ : 2-(4-Méthoxyphényl)-2-hydroxyacétonitrile.
EXEMPLE 26 : 1,4-Succincte de [(4-cyanophényl}(cyano)méthyleJ
et de dihydroartémisininyle
2u Produit de départ : 2-(4-Cvanophényl)-2-hvdroxyacétonitrile.
CA 02342990 2000-12-15
WO 99/65914 PCT/F'R9910I359
EXEMPLE 27 : 1,4-Succincte de {[(4-benzyloxy-3-méthoxy)phényl][cyano]méthyle}
et de dihydroartémisininyle
Produit de déRart : 2-[(4-Benzyloxy-3-méthoxy)phényl]-2-hydroxyacétonitrile.
EXEMPLE 28 : 1,4-Succincte de [(4-bromophényl)(cyano)méthyl] et de
dihydroartémisininyle
Produit de départ : 2-(4-Bromophényl)-2-hydroxyacétonitrile.
EXEMPLE 29 : 1,9-Azélaate de [(2-bromophényl)(cyano)méthyle]
et de dihydroartémisininyle
R,nNwO-ë-(C~)~-.--ë-O-ÇH
O O CN
Br
lo On procède comme dans l'Exemple 16 en remplaçant dans le stade A l'acide
succinique par
l'acide azélaïque.
Micrvanalyse élén~er~taire
C H N
",~ C.'alcnlé X9,27 f.68 2,16
1 s . "o Ti-otn~é .5~, ~ 0 6, -~~l 2, 25
EXEMPLE 30 : 1,8-Subérate de cyano(phényl)méthyle et de dihydroartémisininyle
On procède comme dans l'Exemple 16 en remplaçant dans le stade A l'acide
succinique par
l'acide subérique et dans le stade B le 2-(2-bromophényl)-2-
hydroxyacéfonitrile par le
2-phényl-2-hydroxyacétonitrile.
2o EXEMPLE 31 : 1,6-Hexanedioate de [(2-chlorophényl){cyano)méthyle]
et de dihydroartémisininyle
On procède comme dans l'Exemple 16 en remplaçant dans le stade A l'acide
succiniqûe par
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99101359
16
l'acide hexanédioïque et dans le stade B le 2-(2-bromophényl)-2-
hydroxyacétonitrile par le
2-{2-chlorophényl)-2-h~~droxyacétonitrile.
EXEMPLE 32 :1,2-Phtalate de cyano(phényl)méthyle et de dihydroartémisininyle
On procède comrrie dans l'Exemple 16 en remplaçant dans le stade A l'acide
succinique par
l'acide phtalique et dans le stade B ie 2-(2-bromophényl)-2-
hydroxyacétonitrile par le
2.-phényl-2-hydroxyacétonitrile.
Mici~oat~alyse élén~efilaire
C' X N
'% Calculé 68,12 .i, 90 2, S6
% Trouvé 68, 36 6, 06 2, 68
EXEMPLE 33 : 1,2-Phtalate de cyano(2-bromophényl)méthyle
et de dihydroartémisininyle
On procède comme dans l'Exemple 16 en remplaçant dans le stade A l'acide
succinique par
l'acide phtalique.
Point de, firsiorr : I53-I ~~ °C
EXEMPLE 34 : t,4-(E)-2-Butènedioate de [(2-chlorophényl)(cyano)méthyl]
et de dihydroartémisininyle
On procède comme dans l'Exemple 16 en remplaçant dans le stade A l'acide
succinique par
l'acide (E}-2-butènedioïque et dans le stade B le 2-(2-bromophényl)-2-
hydroxyacétonitrile par
le 2-{2-chlorophényl)-~-hydroxyacétonitrile.
EXEMPLE 35 : 1,4-(2.3-Dichloro)succinate de [(2-chlorophényl)(cyano)méthyle]
et de dihydroartémisininyle
On procède comme dans l'Exemple 16 en remplaçant dans le stade A l'acide
succinique par
l'acide 2,3-dichlorosuccinique et dans le stade B le 2-(2-bromophényl)-2-
hydroxyacétonitrile
2~ par le 2-(2-chiorophém~I)-2-hydroxyacétonitrile.
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
17
EXEMPLE 36 : 1,4-2.2-Diméthylsuccinate de [(2-chlorophényl)(cyano)méthyle]
et de dihydroartémisininyle
On procède comme dans l'Exemple 35 en remplaçant l'acide 2,3-
dichlorosuccinique par l'acide
2,2-diméthylsuccinique.
EXEMPLE 37 : 1,8-(.l-Bromo-1,8-naphtalène-dicarboxylate) de
(phényl)(cyano)méthyle
et de dihydroartémisininyle
On procède comme dans l'Exemple 16 en remplaçant dans le stade A l'acide
succinique par
l'acide 4-bromo-1,8-naphtalènedicarboxylique et dans le stade B le 2-(2-
bromophényl)-2-
hydroxyacétonitrile par le 2-phényl-2-hydroxyacétonitrile.
1o EXEMPLE 38 : 4-{[Cvano(phényl)méthyljamino)-4-oxobutanoate
de dihydroartémisininyle
On procède comme dans l'Exemple 18 en remplaçant le 2-phényl-2-
hydroxyacétonitrile par le
2-phényl-2-aminoacétonitrile.
EXEMPLE 39 : 4-{(Cyano(2-chlorophényl)méthyljamino}-4-oxobutanoate
de dihydroartémisininyle
On procède comme dans l'Exemple 17 en remplaçant le 2-(2-chlorophényl)-2-
hydroXyacétonitrile par le 2-(2-chlorophényl)-2-aminoacétonitrile.
EXEMPLE 40 : 4-({[Cvanoj[(3-méthoxy-4-benzyloxy)phényljméthyl}amino)-4-
oxobutanoate de dihydiroartémisininyle
2o On prôcède comme dans l'Exemple 27 en remplaçant le 2-[(3-méthoxy-4-
benzyloxy)phényl]-2-
-hydroxyacétonitrile par le 2-{ (3-méthoxy-4-benzyloxy)phénylJ-2-
aminoacétonitrile.
CA 02342990 2000-12-15
WO 99/65914 PCT/F'R99101359
18
EXEMPLE 41 : 4-{[I-Cyano-1-phényléthyl]amino}-4-oxobutanoate
de dihydroartémisininyle
On procède comme dans l'Exemple 20 en remplaçant le 2-phényl-2-hydroxy-
propanenitrile par
le 2-phényl-2-aminopropanenitrile.
EXEMPLE 42 : 4-{[C~~ano(phényl)méthyl][méthyl]amino}-4-oxobutanoate
de dihydroartémisininyle
Stade A : 2-(Méthylamino)-2 phénylacétonitrile
Dans une solution de NaHS03 ( 12 mmol dans 4 ml d'eau), Ie benzaldéhyde ( 11
mmol) est
ajouté sous agitation. Lorsqu'un précipité blanc s'est formé, 28 ml d'une
solution aqueuse à
1to 25 % de méthylamine sont ajoutés goutte à goutte puis 12 mmol de cyanure
de potassium sont
ajoutés à 0°C. La réaction est agitée à températurè ambiante jusqu'à la
fin de la réaction. Après
un traitement classique. le produit du titre est obtenu pur.
Stade B : Acide .l-~(éyano(phényJ)méthylJ(méthyl)aminoJ-~-oxobutanoique
Un mélange du composé obtenu au stade A (9 mmol), d'anhydride succinique (7,5
mmol) et de
I5 pyridine ( I ml) dans du chlorure de méthylène (30 ml) est agité toute la
nuit. Après un
traitement classique, le produit du titre est obtenu pur.
Stade C : .~-~jCyaraa(phényl)méthylJ~méthylJamino~-4-oxobutanoate de
dihydroartémisininyle
Un mélange de dihydroartémisinine (4,6 ml), du composé obtenu au stade B (5,5
ml), de DCC (6,9
20 mmol) et de DMAP (0.2 mmol) est agité à température ambiante. A la fin de
la réaction, on procède à un
traitement classique et le produit du titre est purifié par chromatographie
sur colonne de silice.
Pc» rn de~'usion : I-i~-I,t8°C
Micr-oana~se élémentaire
C H N
2s % Calctrlé b.5,61 7.08 5,50
~' o Tro2roé 6~. ~ ' %. 09 .5.56
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
19
EXEMPLE 43 : 4-{[Cyano(4-chlorophényl)méthyl)-[méthyl)amino}-4-oxobutanoate de
dihydroartémisininyle
On procède comme dans l'Exemple 42 en remplaçant le benzaldéhyde par ie 4-
chlorobenzaldéhyde.
Point de fusion : I-12-I-1~°C
Microanalyse élémentaire
y H N
"o Calculé 61,-/8 6,-l~ 5,12
'% Trouvé bl,.i~ 6,49 4,90
o EXEMPLE 44 : 4-{[Cyano(4-fluorophényl)méthyl]-[mëthy!)amino}-4-oxobutanoate
de
dihydroartérnisininyle
On procède comme dans l'Exemple 42 en remplaçant le benzaldéhyde par le 4-
l'ïuorobenzaldéh~de.
Point de, fusion : 143-l -f~ °C
15 Microanalyse élémentaire
C' H N
"'~ Calculé 63, 38 6, 63 .i, 28
"" Trouvé 63. I ' 6, 43 4, 95
Les exemples 45 à 48 sont obtenus en procédant comme dans l'Exemple I en
remplaçant le
2c~ 2-(4-bromophényl}-2-hvdroxy acétonitrüe par le nitrile approprié.
EXEMPLE 45 : (S} 2-(2-Bromophényl)-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dihydroartémisinine et 2-(2-bromophényl)-2-hydroxy
acétonitrile
Microanalyse élémentaire
C H N
2~ "o Calculé ~~, î~ x,90 2,93
"'~ Trouvé ~ 7, 8-I .S, 83 2, 82
CA 02342990 2000-12-15
WO 991b5914 PCT/FR99/01359
EXEMPLE 46 : (S) 2-(3-Bromophényl)-2-dihydroartémisininyloxy-acétonitrile
Produits de départ : dihvdroartémisinine et 2-(3-bromophényl)-2-hydroxy
acétonitrile
Microanalvse élémentaire
C H N
s '% Calculé 57, 7.5 3, 90 2, 93
'% Trouvé 3 7, 9.~ 3, 92 2, 92
EXEMPLE 47 : (S) 2-{3-[3-(Trifluorométhyl)phénoxy]phényl}-2-dihydroartémi-
sininyloxy-acétonitrile
Produits de dévart : dihvdroartémisinine et 2-{3-[3-
(trifluorométhyi)phénoxy]phényl}-2-
l o hydroxy-acétonitrile
Microana7 sy -e élémentaire
C H N
o C.'alculé 6-l, 39 3. 76 2, 50
o Trouvé 64, 5-l ~, 81 2, 38
15 EXEMPLE 48 : (R) 2-{3-[3-(Trifluorométhyl)phénoxy]phényl}-2-
dihydroartémisini-
nyloxy-acétonitrile
Produits de d~art : dihvdroartémisinine et 2-{3-[3-
(trifluorométhyl)phénoxy]phényl}-2-
hvdroxy-acétonitrüe
Microanalyse élémentaire
20 C H N
'% Calcielé 64,39 ~, 76 2,50
"r~ Trorvé b4, 82 ~, 97 2, 44
Les Exemples 49 à 56 sont obtenus en procédant comme dans l'Exemple 42 en
remplaçant
dans le stade :~. le benzaldéhyde par Ie réactif approprié,
- dans le stade B. l'anhydride succinique par le réactif approprié.
CA 02342990 2000-12-15
WO 99165914 PCT/FR99101359
21
EXEMPLE 49 : 4-{[(4-Bromophényl)(cyano)méthyl](méthyI)amino}-4-oxobutanoate
de dihydroartémisininyle
Produits de départ : Stade A : 4-Bromobenzaldéhyde
Stade B : Anhydride succinique
Micrvartalyse élémemaire
C H N
° a Calculé ~ 6, 86 ~, 96 4, 74
"a Trouvé X6,98 6,17 4,53
EXEMPLE 50 : 4-{[(Cyano[phényl]méthyl)(méthyl)amino]carbonyl)benzoate de
1 cs dihvdroartémisininyle
Produits de départ : Stade A : Benzaldéhyde
Stade B : Anhydride phtalique
iLlicroarralyse élémeruaire
C H N
1, "« C.'alculé h8, ~ b b, 47 5, 00
"n 7ï~ouvé 6b', 3 7 b, 68 .5, 23
EXEMPLE 51 : 4-{[Cyano(phényl)méthy!](méthyl)amino}-4-oxo-2-butènoate de
dihydroartémisininyie
Produits de départ : Stade A : Benzaldéhyde
2U Stade B : Acide 2-butènedioique
Micr~oanal.~.se élémentaire
C' H N
'% C.'alcztlé 6~, 8 7 6, 71 S, 49
~' o Trouvé 6~, 96 6, 96 .ï, 43
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
22
EXEMPLE 52 : 4-{[Cyano{2,4-diméthylphényl)méthylJ(méthyl)amino}-4-oxobu-
tanoate de dihydroartémisininyle
Produits de départ : Stade A : 2,4-diméthylbenzaldéhyde
Stade B : Anhydride succinique
Microanalyse élémentaire
c H N
'% Calculé Gb, 6.5 7, 46 5,18
'% Trouvé 66, 93 7, 71 4, 96
EXEMPLE 53 : 4-{[Cyano(2-fluorophényl)méthylJ{méthyl)amino}-4-oxobutanoate de
lo dihydroartémisininyle
Produits de dé art : Stade A : 2-Fluorobenzaldéhyde
Stade B : Anhydride succinique
Microattalyse élénaentaire
C H N
"o Calculé 63, 38 6, 65 .5, 28
'% Trouvé b3, ~-l 6, 86 S,19
EXEMPLE S4 : 4-{[Cyano(3-fluorophényl)méthylJ(méthyi)amino}-4-oxobutanoate de
dihydroartémisininyle
Produits de départ : Stade A : 3-Fiuorobenzaldéhyde
z0 Stade B : Anhydride succinique
Microcrttalyse é7éntetttaire
C' H N
'% Calculé 63, 38 6. 6~ S, 28
"o Trotwé 63, 39 6, 87 ~, 08
CA 02342990 2000-12-15
WU 99165914 PCT/FR9910I359
23
EXEMPLE 55 : 4-{[Cyano{2-bromophényl)méthyl](méthyl)amino}-4-oxobutanoate de
dih~~droartémisininyle .
Produits de départ : Stade A : 2- Bromobenzaldéhyde
Stade B : Anhydride succinique
~licroanalys~ élémentaire
C H N
'~~, Calculé ~b,86 .i,9b 4,74
"r~ Trouvé .ï 6, 92 .5, 96 4, 68
EXEMPLE 56 : 4-[(Cyano{3-[3-(trifluorométhyl)phénoxy]phényl}méthyt)(méthyl)
1o amino]-4-oxobutanoate de dihydroartémisininyle
Produits de départ : Stade A : [3-(Trifluorométhyl)phénoxyjbenzaldéhyde
Stade B : Anhydride succinique
Microanalyse élémentaire
C H N
1~ '% Calculé 62,49 x,84 4,16
"o Trouvé h2, 7~ 6, 08 3, 94
Les Exemples 57 à 6 7 sont obtenus en procédant comme dans l'Exemple 16 en
remplaçant
dans le stade B le 2-(''-bromophényl)-2-hydroxyacétonitrile par I'acétonitrile
approprié.
EXEMPLE 57 : 4-{[(4-Bromophényl)(cyano)méthyl]amino}-4-oxobutanoate de
20 dihydroartémisininyle
Produit de départ : 2-(4-Bromophényl)-2-aminoacétonitrile
Point de,~usion : 16.i-167°C
Micruay:alose élémefuaire
C H N
2, '% Calculé X6,16 ~, 76 4,85
Trouvé 56, 29 ~, 8l 5,14
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
24
EXEMPLE 58 : 4-{[(4-Chlorophényl)(cyano)méthyl]amino}-4-oxobutanoate de
dih~~droartémisininyle
Produit de départ : 2-(4-Chlorophényl)-2-aminoacétonitrile
Poire de fusion : 16-l-l b~ °C
Microanalyse élémentaire
C H N
'% Calculé 60, 8-1 6, 24 5, 25
"r~ Trouvé <0, 86 6, 24 ~, 43
EXEMPLE 59 : 4-{[{~-Fluorophényl){cyano)méthyl]amino}-4-oxobutanoate de
1 u dihy droartémisininyle
Produit de départ : 2-(4-Fluorophényl}-2-aminoacétonitrile
Point de usion : !59-l62°C
Microanahyse élémentaire
C H N
ls °o Calculé X2,78 6,.11 ~,-l2
'% Trotwé 62, 86 6, -?9 5, 62
EXEMPLE 60 : 4-{[(Phényl)(cyano)méthyl]amino}-4-oxobutanoate de dihydro-
artémisininyle
Produit de départ : 2-Phényl-2-aminoacétonitrile
20 Pc~itat de fusion : 1~3-LS-l°C
Microanalyse élémentaire
C H N
'% C.'adculé 65, Oa 6, 87 5, 62
o Trouvé b5, 20 6, 88 5, 69
CA 02342990 2000-12-15
WO 99165914 PCT/FR99/01359
EXEMPLE 61 : 4-{[(2-Bromophényl)(cyano)méthyl]amino}-4-oxobutanoate de
dihy droartémisininyle
Produit de départ : 2-(2-Bromophényl)-2-aminoacétonitrile
~C)ü)t de fT.ISlOY7 : 136-IJ9°C'
J Mlct"Oat7alVSe G'IG'YJielllaire
C H N
Calculé X6,16 3, 76 4,85
"o Tr-auvé ~ 6, 31 ~, 78 S,11
EXEMPLE 62 : 4-{[(3-Bromophényl)(cyano)méthyl]amino}-4-oxobutanoate de
1o dih~~droartémisininyle
Produit de départ : 2-(3-Bromophényl)-2-aminoacétonitrile
Point de,fusion : 1~3-1.56°C
Micrvanalvse élénzerataire
C H N
1 ~ '% Calculé .56,16 3, 76 4, 85
°'~ Trouvé ~6,1î x,65 4,71
EXEMPLE 63 : 4-{[(3-Chlorophényl)(cyano)méthyi]amino}-4-oxobutanoate de
dih~ droartémisininyle
Produit de départ : 2-(3-Chlorophényl)-2-aminoacétonitrile
2o Poïnt de~'usiorr : 1.5.l-l.i~°C
Microanalyse éléntentaire
C' H N
'% C.'alculé 60, 8-l 6, 24 ~, 25
'% Trouvé 60, 9~ 6, 02 S, 24
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
26
EXEMPLE 64 : 4-{((2-Fluorophényl)(cyano)méthyl)amino}-4-oxobutanoate de
dihydroartémisininyle
Produit de départ : 2-(2-Fluorophényl}-2-aminoacétonitrile
Pvirn de ~rtsion : 161-162°C
Microanalyse élémentaire
C. H N
"" Calculé ~2, 78 6, ~hl ~, 42
'% Trouvé 62, 91 6. I 1 5, 31
EXEMPLE 65 : 4-{[Cyano(2-naph#yl)méthyl)amino}-4-oxobutanoate de dihydro-
lo artémisininyle
Produit de départ : 2-(?-Naphtyl)-2-aminoacétonitrile
Pvinl de~'u.sivrr : 127-129°C
Microanalyse élémentaire
C H N
1 ~ °" Calculé 67, 8 î 6, 61 x,11
"" Trouvé 67, 88 6, 71 4, 96
EXEMPLE 6G : 4-({Cyano[4-(diméthylamino)phényl)méthyl}amino)-4-oxobutanoate
de dihydroartémisininyle
Produit de départ : 2-[4-(Diméthylan~ino)phényl]-2-aminoacétonitrile
2o Poir~l de usiort : 160-l62°C
Microar~alvse élémeruaire
C' H N
"o C."alculé 6.31 -.26 7, 76
'% Trouvé 6.~, ~ 0 '. 2 7 7, 49
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
27
EXEMPLE 67 : 4-{[(3-Fluorophényl)(cyano)méthyl)amino}-4-oxobutanoate de
dihydroartémisininyle
Produit de départ : 2-(3-Fluoraphényl)-2-aminoacétonitrile
Point de fusion : 1 ~l6-I -i8°C
Microanalyse élémentaire
C H N
'% C.'alculé 62, 78 b, ~f4 ~; 42
'~ o Trouvé 62, 91 6,11 5, 31
EXEMPLE 68 : 4-{[Cyano(2-chlorophényl)méthyl](méthyl)amino}-4-oxobutanoate de
lo dihydroartémisininyle
On procède comme dans l'Exemple 42 en remplaçant dans Ie stade A le
benzaldéhyde par le 2-
Chlorobenzaldéhyde.
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
28
ETUDE PHARMACOLOGIQUE
Les exemples suivants permettent de mettre en évidence les propriétés
cytotoxiques des
composés de l'invention ainsi que léur action sur le cycle cellulaire.
EXEMPLE A : Cytotoxicité des composés
Trois lignées cellulaires ont été utilisées
- 2 leucémies murines : L1210, P388
- I carcinome pulmonaire humain; non à petites cellules, A549
Les cellules sont cultivées dans du milieu de culture RPMI 1640 complet
contenant i 0 % de
sérum de veau foetal. 2 mM de glutamine, 50 unités/ml de pénicilline, 50 pg/ml
de
lo streptomycine et 10 mM d'Hépès.
Les cellules sont réparties dans des microplaques et exposées aux composés
cytotoxiques.
Elles sont ensuite incubées le temps nécessaire à un doublement cellelulaire.
Le nombre de
cellules viables est ensuite quantifié par un essai colorimétrique, le
Minoculture Tétrazolium
Assay (Carmichael J:, De Graff W. G., Gazdar A.F., Minna J.D. ànd Mitchell
J.R., Evaluàtion
t> of a tetrazolium-based semi-automated colorimetric assay : assessment of
chemosensitivity
testing, Cancer Res., 47, 936-942, 1987).
Les résultats obtenus montrent une bonne cytotoxicité générale sur les lignées
L1210 et f 388.
Par ailleurs des propriétés cytotoxiques vis-à-vis de tumeurs solides comme la
lignée A549 ont
pu être mises en évidence.
2« EXEMPLE B : Action sur le cycle cellulaire
Les cellules L1210 sont incubées pendant 21 heures à 37°C en présence
de différentes
concentrations en produits testés. Les cellules sont ensuite fixées par de
l'éthanol à 70
(V/V), lavées 2 fois dans du PBS et incubées 30 minutes à 20°C dans du
PBS contenant
100 pglml de RNAse et 50 p.g/ml de iodure de propidium. Le pourcentage en
phase G2+M est
calculé et les résultats sont exprimés suivant une classification déterminée
en fonction du
pourcentage des cellules accumulées en phase G2+M après 21 heures par rapport
au témoin
(témoin : 20 %). Les composés de l'invention montrent une accumulation à plus
de 60 % des
CA 02342990 2000-12-15
WO 99/65914 PCT/FR99/01359
29
cellules en phase G2-W après 21 heures pour des concentrations en produits
allant de 0,5 à
50 ~M.
Par ailleurs, les composés de l'invention montrent une induction de l'apoptose
aux doses
cytotoxiques.
a EXEMPLE C
Comprimés dosés à 10 mg de (R) 2-{4-bromophényl)-2-dihydroartémisininyl-
acétonitrüe
Formule de préparation pour 1000 comprimés
(R) 2-(4-bromophénvl)-2-dihydroartémisininyl-
acétonitrile..................x:................:........10 g
Amidon de blé
...............................................................................
..........:.....................15 g
Amidon de
maïs...........................:...............................................
..................................15 g
Lactose...........................,............................................
..................................................65 g
Stéarate de Mg ....................................
......................................................... ........ . 2 g
Silice ... ....
...............................................................................
..................................:. 1 g
i-iydroxypropylcellulose
.:..............:..:........................:.................:................
................... 2 g