Note: Descriptions are shown in the official language in which they were submitted.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
1
Compositions pharmaceutiques comprenant des 4-quinolones
La présente invention concerne des compositions pharmaceutiques
comprenant des 4-quinolones ou des composés dérivés.
Un cancer est un désordre des gènes somatiques au cours duquel des
dysfonctionnements génétiques s'amplifient au fur et à mesure que le processus
tumoral
progresse de l'état de lésion précancéreuse à celui de transformation maligne,
la tumeur
cancéreuse devenant métastasique et souvent résistante aux médicaments
cytotoxiques.
En dépit des efforts très importants conduits dans tous les pays développés,
en particulier à travers des programmes de recherche expérimentale et
clinique, la
mortalité due aux différents cancers (tumeurs solides et néoplasies
hématologiques)
demeure inacceptablement élevée. Dans de nombreux pays, la mortalité par
cancer est
au second rang, juste après les maladies cardio-vasculaires.
En termes de cancers nouvellement diagnostiqués, la répartition entre
tumeurs solides et néoplasies hématologiques (moëlle osseuse, sang, système
lymphatique) montre que 9 cancers sur 10 sont des tumeurs solides. Au
contraire de ce
qui est observé en oncologie hématologique (succès thérapeutiques dans 40 à 90
% des
cancers des cellules du sang), seulement un petit nombre de tumeurs solides
avancées
ou disséminées répondent aux seuls traitements chimiothérapeutiques. C'est en
partie
pour cette raison que la mortalité globale par cancer a cru aux U.S.A. entre
1973 et
1992.
II n'est malheureusement pas sûr que cette tendance pourra s'inverser
seulement par l'apparition, à côté de l'arsenal chimiothérapeutique établi, de
nouveaux
médicaments antitumoraux tels que les taxanes (paclitaxel et docetaxel) qui
interfèrent
avec la formation des microtubules (W.P. Mc Guire et al., Am. Intern. Med.,
1989), les
inhibiteurs de topoisomérases I dérivés de la camptothécine (topotecan et
irinotecan), la
vinorelbine (nouvel alcaldide issu de la pervenche), la gemcitabine (nouvel
antimétabolique cytotoxique), le raltitrexed (inhibiteur de la thymidylate
synthétase) et la
miltefosine (premier représentant de la famille des alkyl-lysophospholipides).
Ces
traitements s'ajoutent, soit en première intention, soit en seconde intention,
aux
médicaments dont l'activité spécifique est maintenant bien reconnue comme la
doxorubicine, le cisplatine, la vincristine, le méthotréxate, le 5-
fluorouracile.
La grande majorité des traitements classiques de chimiothérapie ou à base
de ces nouveaux composés consiste en l'administration de composés hautement
cytotoxiques soit en monothétrapie soit en polythérapie. L'efficacité
thérapeutique de ces
traitements est fréquemment limitée par l'intensité des effets secondaires qui
oblige à
réduire le nombre d'administration et la durée des traitements, alors que pour
certaines
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
2
tumeurs solides, les protocoles thérapeutiques en intensification de dose
améliorent
l'efficacité.
Un autre des difficiles problèmes actuels de la chimiothérapie anticancéreuse
est dû au fait que de nombreuses populations de cellules malignes présentent
une
résistance importante aux substances cytotoxiques établies. Le plus souvent
cette
situation résulte de l'existence de gènes de multi-résistance - ou ,.de la
fréquence de
mutations génétiques chez certains types de tumeurs. Ainsi, le fraitément des
cancers
nécessite de nouvelles approches, complémentaires de celles actuellement mises
en
oeuvre, et destinées à mieux lutter contre l'extension et l'hétérogénéité de
la charge
tumorale et l'acquisition de la résistance "multi-drogues cytotoxiques".
Une première approche est celle de la prévention ou du traitement des
cancers « multidrogue-résistants » (MDR) par' l'utilisation de substances
inhibant ou
entrainant la réversibilité de la résistance MDR associée ou non à
l'expression du
transporteur membranaire de la glycoprotéine-P. Une telle approche est décrite
dans US
5,726,184. D'autres approches nouvelles, semblent déjà prometteuses. C'est le
cas de
l'induction de l'apoptose, de l'inhibition de l'angiogénèse tumorale et des
processus
métastasiques sans parler de la thérapie génique ou de l'immunothérapie.
Les inventeurs se sont intéressés à une approche différente. L'objectif
recherché était de rendre la population de cellules tumorales plus sensible
aux
traitements anticancéreux de référence afin d'atteindre un double bénéfice
1 ) augmenter l'activité cytotoxique donc l'efficacité de médicaments
anticancéreux cytotoxiques, et
2) diminuer la fréquence et la sévérité de certains effets secondaires grâce à
la réduction de posologie qui pourrait suivre l'induction de l'augmentation de
l'efficacité
anti-tumorale.
C'est cette stratégie qui est à l'origine de la découverte de compositions
capables d'induire une augmentation très significative de l'activité
cytotoxique de
médicaments anticancéreux éprouvés. Les inventeurs se sont intéressés à un
groupe
particulier de dérivés originaux de la famille des 3-aryl-4-quinolones. Ces
compositions
ont la capacité soit de stimuler le recrutement de cellules clonogènes au sein
de la
tumeur rendant celle-ci plus sensible au traitement conventionnel par des
agents
çytotoxiques, soit d'inhiber la prolifération de cellules clonogènes,
contribuant ainsi à la
régression de la tumeur. Elles ont l'avantage de ne pas êtré cytôtoxiques par
elles-
mêmes, à la différence d'une part des inhibiteurs de tyrosine kinases de la
famille des 3-
aryl-4-quinolones essentiellement 7-chloro, décrites dans WO 98/17662 et
revendiquées
dans le traitement des tumeurs bénignes ou malignes, et plus spécifiquement
pour traiter
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
3
le psoriasis, les néoplasies en particulier épithéliales ainsi que pour le
traitement des
leucémies et des atteintes du système immunitaire et, d'autre part, des
dérivés de 2-aryl-
4-quinolones décrits dans W094/02145 pour leurs propriétés antitumorales
intrinsèques.
X.Mingxia et al. (Bopuxue 1993 ; 927-929) ont décrit la synthèse de dérivés de
4-
S quinolone aux propriétés oestrogéniques et antiostéoporotiques. Y. L.
Kanghou et al.
(Zhogguo Haiyang Yaowu. 1989 ; 8 : 2-9) ont synthétisé des nouveaux dérivés de
4-
quinolone décrits comme antispamodiqués et antiarhytmiques. M. Croissy et al.
ont
proposé un procédé de synthèse par cyclisation thermique pour la préparation
de 2- et
de 4- quinolones (Heterocycle 1'997, 45, 683-690) tandis que Price et al.
comparent les
spectres infrarouge d'une série de dérivés de 2 ét 4 quinolones (Aust. J.
Chem. 1959 ;
12 : 589-600).
La présente invention a ainsi pour objet l'utilisation, dans le traitement des
cancers avec au moins un antitumoral choisi parmi les agents cytotoxiques,
d'un
composé ayant une activité sur la prolifératiôn de cellules clonogènes dans
les tumeurs,
mais dépourvu d'activité antitumorale intrinsèque (permettant une utilisation
thérapeutique) et choisi parmi les composés de formules
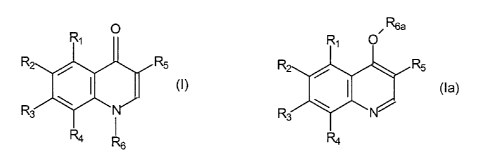
O ~ R6a
R5
(I) et (la)
. ,6 Ra
dans lesquelles
R, est choisi parmi H, OH, les groupes alkyle en C1-C4, alkényle en C2-C4,
alkoxy en C1-C4, phényle ou un groupe phényle 1 à 3 fois substitué par des
groupes
choisis parmi H, OH, un groupe -OCOR,, R, étant un groupe alkyle eri C1-C4, un
groupe
-O-SOZ-R'~, R', étant un groupe alkyle en C1-C4 ou un groupe CF3, et un groupe
-NR,6R», R,6 et R~~ étant choisis indépendamment l'un de l'autre parmi
l'hydrogène, les
groupes alkyle en (C1-C4), alkènyle en C2-C4, phényl alkyle (C1-C4), un groupe
phényl
alkyle (C1-C4) 1 à 3 fois substitué sur le groupe alkyle par des groupes
choisis parmi H,
OH et alkoxy, en C1-C4, ou un groupe diméthylaminoalkyle (C1-C4), ou formant
ensemble et avec l'atome d'azote un hétérocycle à 5 ou 6 chaînons compbrtant
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
4
éventuellement un ou plusieurs hétéroatomes choisis parmi l'oxygène, l'azote
ou le
soufre, ou un groupe méthylpipérazinyle,
R2, R3 et R4 sont choisis indépendamment l'un de l'autre parmi H, OH, un
groupe
alkyle en C1-C4, un groupe alkoxy en C1-C4, un groupe -OCO-R~, et un groupe
dérivé
S d'un ose, au moins l'un des substituants RZ, R3 ou R4 étant autre que H, et
RZ et R3
pouvant former ensemble un groupe méthylènedioxy,
R5 est un groupe phényle ou un groupe phényle 1 à 3 fois substitué par des
groupes choisis parmi H, OH, un groupe alkoxy en C1-C4, un groupe -OCOR~, un
groupe phényl(alkoxy en C1-C4), un groupé -O-SOZ-R',, R', étant un groupe
alkyle en
C1-C4 ou un groupe CF3, un groupe benzylamino et un groupe dérivé d'un ose,
R6 est choisi parmi H, un groupe alkyle en C1-C4, alkényle en C2-Cq., un
groupe -
CO-R8 et un groupe -A-R9,
Rsa, est choisi parmi un groupe alkyle en C1-C4, alkényle en C2-C4, un groupe -
CO-R$ et un groupe -A-R9,
R8 étant un groupe alkyle en C1-C4,
A étant un groupe alkylène en C1-Cq.,
R9 étant choisi parmi les groupes hétérocycliques à 5 ou 6 chaînons ayant.1 à
4
hétéroatomes choisis parmi l'oxygène, le soufre et l'azote, les groupes CN,
hydroxy
-COOR,a, -CONR"R,2, un groupe -NR~3R,4, un groupe -CORS, et OS02R16,
R,o, R", R;2, R,3, R,4 et R,5 étant indépendamment choisis parmi un atome
d'hydrogène, un groupe alkyle en C1-C4 et un groupe phényl(alkyle en C1-Cç),
R,6 étant choisi parmi un groupe phényle et un groupe alkyl(C1-C4) phényle,
R4 et R6 pouvant en outre former ensemble un.groupe -CO-CH2-CHZ-,
Les agents cytotoxiques.peuvent être utilisés à leur dose habituelle et, dans
ce cas, leur efficacité est améliorée, ou à des doses plus faibles compte tenu
de
l'augmentation de leur efficacité antitumorale, pour réduire la sévérité des
effets
secondaires (ex : leucopénie, nausées, vomissements,:..) presque constamment
rencontrés.
La présente invention a également pour objet une composition ayant une
activité sur la prolifération de cellules clonogènes dans lés tûmeurs en -
interférant sur la
génération de cellules clonogènes, soit par stimulation de la prolifération et
recrutement,
soit par inhibition de la prolifération, et qui comprend une quantité efficace
d'un composé
de formules
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
O ~ Rsa
Rs R5
(I) et (la)
. ,6 Ra
dans lesquelles
5 R, est choisi parmi H, OH, les groupes alkyle én C1-Cç, alkényle en C2-C4,
alkoxy en C1-C4, phényle ou un groupe phénylé 1 à 3 fois substitué 'par des
groupes
choisis parmi H, OH, un groupe -OCOR,, R~ étant un groupe alkyle en C1-C4, un
groupe
-O-SOZ-R'~, R', étant un groupe alkyle en C1-C4 ou un groupe CF3, et un groupe
-
NR,6R", R,6 et R" étant choisis indépendamment l'un de l'autre parmi
l'hydrogène, les
groupes-alkyle en C1-C4, alkènyle en C2-C4, phényl alkyle (C1-C4), un groupe
phényl
alkyle (C1-C4) 1 à 3 fois substitué sur le groupe alkyle par des groupes
choisis parmi H,
OH et alkoxy en C1-C4, ou un groupe diméthylaminoalkyle (C1-C4), ou formant
ensemble et, avec l'atome d'azote un hétérocycle à 5 ou 6 chaînons comportant
éventuellement un ou plusieurs hétéroatomes choisis parmi l'oxygène, l'azote
ou le
soufre, ou un groupe méthylpipérazinyle,
R2, R3 et R4 sont choisis indépendamment l'un de l'autre parmi H, OH, un
groupe
alkyle en C1-C4, un groupe alkoxy en C1--C4, un groupe -OCO-R,, et un groupe
dérivé
d'un ose, RZ et R3 pouvant former ensemble un groupe méthylènedioxy,
R5 est un groupe phényle ou un groupe phényle 1 à 3 fois substitué par des
groupes choisis parmi H, OH, un groupe alkoxy en C1-C4, un groupe -OCOR,, un
groupe phényl(alkoxy en C1-C4), un groupe -O-SOZ-R'~, R', étant un groupe
alkyle en
C1-Cç ou un groupe CF3, un groupe benzylamino et un groupe dérivé d'un ose,
R6 est choisi parmi H, un groupe alkyle en C1-C4, alkényle en (C2-C4), un
groupe -CO-Re et un groupe -A-R9,
R6a est choisi parmi un groupe alkyle en C1-C4, alkényle en C2-C4, un groupe -
CO-R8 et un groupe -A-R9,
R8 étant un groupe alkyle en C1-C4,
A étant un groupe alkylène en C1-Cq.,
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
6
R9 étant choisi parmi les groupes hétérocycliques à 5 ou 6 chaïnons ayant 1 à
4
hétéroatomes choisis parmi l'oxygène, le soufre et l'azote, les groupes CN,
hydroxy,
-COOR,o, -CONR"R,2, un groupe -NR,3R~4, un groupe -CORS, et -OS02R16
R,o, R", R,Z, R,3, R;4 et R,5 étant indépendamment choisis parmi un atome
d'hydrogène, un groupe alkyle en C1-Cq. et un groupe phényl(alkyle en C1-C4),
R16 étant choisi parmi un groupe phényle et un groupe alkyl(C1-C4) phényle
R4 et R6 pouvant en outre former ensemble un groupe -CO-CH2-CH2-.
La présente invention a également pour objet des composés nouveaux, à
savoir des composés de formules
O , Rsa
Rs Rs
et
rw6
dans lesquelles
R, est choisi parmi H, OH, les groupes alkyle en C1-C4, alkényle en C2-Cq.,
alkoxy en C1-C4, phényle ou un groupe phényle 1 à 3 fois substitué par des
groupes
choisis parmi H, OH', un groupe -OCOR~; R~ étant un groupe alkyle en C1-C4; un
groupe
-O-S02-R',, R', étant un groupe alkyle en C1-Cç ou un groupe CF3, et un groupe
-
NR,6R", R,6 et R,~ étant choisis indépendamment l'un de l'autre parmi
l'hydrogène, les
groupes alkyle en C1-C4, alkènyle en C2-Cç, phényl alkylé (C1-C4), un groupe
phényl.
alkyle (C1-C4) 1 à 3 fois substitué sur le groupe alkyle par des groupes
choisis parmi H,
OH et alkoxy en C1-C4, ou un groupe diméthylaminoalkjrle (C1-C4), ou formant
ensemble et avec l'atome d'azote un hétérocycle à S ou 6 chaînons comportant
éventuellement un ou plusieurs hétéroatomes choisis parmi ¿'oxygène, l'azote
ou le
soufre, ou un groupe méthylpipérazinyle,
R2, R3 et R4 sont choisis indépendamment l'un de l'autre parmi H, OH, un
groupe
alkyle en C1-C4, un groupe alkoxy en C1-Cq., un groupe -OCO-R,, et un groupe
dérivé
d'un ose, RZ et R3 pouvant former ensemble un groupe méfhylènedioxy,
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
7
R5 est un groupe phényle ou un groupe phényle 1 à 3 fois substitué par des
groupes choisis parmi H, OH, un groupe alkoxy en C1-C4, un groupe -OCOR~, un
groupe phényl(alkoxy en C1-C4), un groupe -O-SOz-R'~, R'~ étant un groupe
alkyle en
C1-C4 ou un groupe CF3, un groupe benzylamino et un groupe dérivé d'un ose,
R6 est choisi parmi H, un groupe alkyle en C1-C4, alkényle en (C2-C4), un
groupe -CO-R8 et un groupe -A-R9,
Rsa est choisi parmi un groupe alkyle en C1-C4, alkényle en (C2-C4), un groupe
-
CO-R8 et un groupe -A-R9,
R8 étant un groupe alkyle en C1-C4,
A étant un groupe alkylène en C1-C4,
R9 étant choisi parmi les groupes hétérocycliques à 5 ou 6 chaînons ayant 1 à
4
hétéroatomes choisis parmi l'oxygène, le soufre et l'azote, les groupes CN,
hydroxy,
-COOR,o, -CONR"R,z, un groupe -NR,3R,4, un groupe -CORPS, et -OS02R16
Rio, R», RAZ, R13, R,4 et R,5 étant indépendamment choisis parmi un atome
d'hydrogène, un groupe alkyle en C1-C4 et un groupe phényl(alkyle en C1-C4),
R,6 étant choisi parmi un groupe phényle et un groupe alkyl(C~-C4) phényle,
R4 et R6 pouvant en outre former ensemble un groupe -CO-CHz-CHz-.
à l'exclusion des composés où : ,
R,, Rz, R4, R6 = H, R3 = OH et R5 est un groupe phényle, 4-méthoxyphényle, 2,4-
diméthoxyphényle et 2,5-diméthoxyphényle,
R~ = OH ou OCH3, Rz = H, R3 = OCH3, R4 = H, R5 = 4-méthoxyph~nyle et. R6 = H,
R1 = OCH3, R2 = H , R3 = OCH3, R4 = H, R5 = 4-methoxyphényle et Rg = CH3
R, = OH, Rz = H, R3 = OH, R4 = H, R5 = 4-hydroxyphényle et R6 = CH3,
R, = H, Rz = H, R3 = OCH3, R4 = H, R5 = phényle et R6 = H,
R, = H, Rz = H, R3 = OCH3, R4 = H, R5 = phényle et R6 = CH3,
R, = H, Rz = H, R3 = OH, R4 = OCH3, RS = phényle et R6 = H,
R,, Rz, R3, R4, R6 = H et RS = phényle ou 4-méthoxyphényle,
R,, Rz, R3, R4, = H, R5 = phényle ou 4-méthoxyphényle et R6= COCH3,
R,; Rz, R3, R4, = H, R5 = phényle et R6= CH3,
R,, Rz, R3, R4, R6 = H et R5 = 4-méthoxyphényle, 2-méthoxyphényle ou 4-'
methylphényle.
Un .grôupe particulier des composés est celui constitué par [es composés de
formules I ou la selon lesquelles
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
8
R1 est choisi parmi H, OH, les groupes alkyle en C1-C4, alkényle en C2-C4,
alkoxy en
C1-C4, phényle ou un groupe phényle 1 à 3 fois substitué par des groupes
choisis parmi
H, OH, un groupe -OCOR7, R7 étant un groupe alkyle en C1-C4, un groupe -O-S02-
R'7, R'7 étant un groupe alkyle en C1-C4 ou un groupe CF3, et un groupe
benzylamino,
S R2, R3 et R4 sont choisis indépendamment l'un de l'autre parmi H, OH, un
groupe alkyle en C1-C4, un groupe alkoxy en C1-C4, un groupe -OCO-R7, et un
groupe
dérivé d'un ose et R2 et R3 pouvant former ensemble un groupe méthylénedioxy,
R5 est un groupe phényle ou un groupe phényle 1 à 3 fois substitué par des
groupes choisis parmi H, OH, un groupe alkoxy en C1-C4, un groupe -OCOR7, un
groupe phényl(alkoxy en C1-C4), un groupe -O-S02-R'7, R'7 étant un groupe
alkyle en
C1-C4 ou un groupe CF3, un groupe benzylamino et un groupe dérivé d'un ose,
Rg est choisi parmi H, un groupe alkyle en C1-C4, un groupe -CO-Rg et un
groupe -A-Rg,
Rga est choisi parmi un groupe alkyle en C1-C4, un groupe -CO-Rg et un
groupe -A-Rg,
Rg étant un groupe alkyle en C1-C4,
A étant un groupe alkylène en C1-C4,
Rg étant choisi parmi les groupes hétérocycliques à 5 ou 6 chaînons ayant 1
à 4 hétéroatomes choisis parmi l'oxygène, le soufre et l'azote, le groupe CN,
un groupe -
COOR10, -CONR11 R12, un groupe -NR13R14, et un groupe -COR15,
R10, R11, R12, R13, R14 et R15 étant indépendamment choisis parmi un
atome d'hydrogène, un groupe alkyle en C1-C4 et un groupe phényl(alkyle en C1-
C4),
R4 et R6 pouvant en outre former ensemble un groupe -CO-CHZ-CHZ-.
Un autre groupe particulier des, composés est celui constitué par les composés
de formules I ou la dans lesquelles
R5 est un groupe phényle, 4-méthoxyphényle, 2,4-diméthoxyphényle et 2,5-
diméthoxyphényle,
Un autre groupe particuler des composés est celui constitué par les composés
de
formules I ou la dans lesquelles
R, est choisi parmi les groupes alkyle en C1-C4, alkényle en C2-C4, phényle
ou un groupe phényle 1 à 3 fois substitué par des groupes choisis parmi H, OH,
un
groupe -OCOR,, R, étant un groupe alkyle en C1-C4, ûn groupe -O-SOZ-R'~, R',
étant ûn
groupe alkyle en C1-C4 ou un groupe CF3, et un groupe -NR,6R", R,6 et R" étant
choisis
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
9
indépendamment l'un de l'autre parmi l'hydrogène, les groupes alkyle en C1-C4,
alkènyle en C2-C4, phényl alkyle (C1-C4), un groupe phényle alkyle (C1-C4) 1 à
3 fois
substitué sur le groupe alkyle par des groupes choisis parmi H, OH et alkoxy
en C1-C4,
ou un groupe diméthylaminoalkyle (C1-C4), ou formant ensemble et, avec l'atome
d'azote un hétérocycle à 5 ou 6 chaînons comportant éventuellement un ou
plusieurs
hétéroatomes choisis parmi l'oxygène, l'azote ou le soufre, ou un groupe
méthylpipérazinyle,
et R2, R3 et R4 sont choisis parmi un atome d'hydrogène et un groupe alkoxy en
C1 _C4.
Un autre groupe particulier de composés est celui constitué par les
composés de formules I ou la dans lesquelles
R1, R2, R3 et R4 sont choisis parmi un atome d'hydrogène et un groupe alkoxy
en C1-C4.
Dans les définitions qui précédent on désigne par groupe dérivé d'un ose un
groupe qui forme avec .le reste de la molécule un hétéroside. Par hydrolyse,
ces
hétérosides sont susceptibles de donner un composé de formule I ou la avec un
groupe
hydroxy et un ose. Les oses peuvent être notamment monosaccharidique (glucose,
rhamnose) ou disaccharidique (par exemple rutinose).
Dans le traitement chimiothérapeutique des cancers par des agents
cytotoxiques, les composés de formules (I) et (la) peuvent être administrés au
début des
traitements chimiothérapeutiques soit en une fois, soit sur plusieurs jours au
début de
ces traitements (par exemple pendant 5 à 7 jours) et, en fonction du protocole
chimiothérapeutique, au début de chaque cycle de traitement (par exemple
pendant 2 à
5 jours) au cours de chaque cure.
Les composés de formules (I) et (la) sont avantageusement administrés par
perfusion (généralement en 1 à 3. heures) à des doses de 1 à 50 mg/kg/jour ou
40 à
2000 mg/mz/jour.
Afin d'obtenir un éffet maximal sur la production (inhibition ou stimulation)
de
cellules clonogènes, les composés de formules (I) et (la) doivent être
administrés de telle
manière que les concentrâtions tissulaires obtenues soient les plus élevées
qu'il est
possible d'envisager.
Pour les protocoles de traitement dans les phases aiguës des cures, la voie
intraveineuse est à privilégier en utilisant
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
- des solutés de perfusion prêts à l'emploi (poches, flacons ...) destinés à
être
administrés tels quels par perfusion intraveineuse à l'aide d'une ligne de
perfusion et
selon le débit recommandé
- des lyophilisats à remettre en solution pour la perfusion intraveineuse à
S l'aide des solutés pharmaceutiques connus de l'homme de l'art ;
- pour les traitements d'entretien, il est également possible d'envisager la
voie orale lorsque le traitement de la chimiothérapie privilégie
l'administration de
cytostatiques par voie orale. A cette fin, pourront être utilisés des lyocs
(pour absorption
orale ou perlinguale), des comprimés à libération instantanée ou retardée, les
solutions
10 orales, les suspensions, les granulés, les gélules ...
Les agents cytotoxiques peuvent être choisis parmi
i) des agents intercalants, notamment la doxorubicine (Adriamycine), la
daunorubicine, l'épirubicine, l'idarubicine, la zorubicine, l'aclarubicine, la
pirarubicine, l'acridine, la mitoxanthrone, l'actinomycine D, l'acétate
d'eptilinium ;
ü) des agents alkylants choisis parmi les dérivés du platine (cisplatine,
carboplatine,
oxaliplatine) ;
iii) un composé choisi parmi les autres groupes d'agents alkylants
- cyclophosphamide, ifosfamide, chlormétrine, melphalan, chlorambucil,
estramustine,
- busulfan, mitomycine C,
- nitrosourées : BCNU (carmustine), CCNU (lomustine), fotémustine,
streptozotocine,
- triazènes ou dérivés : procarbazine, dacarbazine,
- pipobroman,
- éthylène-imines : altretamine, triéthylène-thiophosphoramide, .
iv) un composé choisi parmi les autres groupes d'agents anti-métaboliques
- antifoliques : méthotrexate, raltitrexed,
- antipyrimidiques : 5-fluorouracil (5-FU), cytarabine (Ara-C),
- hydroxyurée
- antipuriques : purinéthol, thioguanine, pentostatine, cladribine
- inducteurs de la synthèse de nucléosides cytotoxiques : gemcitabine,
v) un composé choisi parmi les autres groupes d'agents tubûlo-affins
- vinca-alcaldides désorganisant le fuseau mitotique : vincristine,
vinblastine,
vindésine, navelbine
- agents bloquant la dépolymérisation du fuseau mitotique : paclitaxel,
docetaxel
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
11
- agents induisant des cassures de l'ADN par inhibition de la topoisomérase II
étoposide, téniposide
- inhibiteurs de la topoisomérase I induisant des coupures de l'ADN :
topotécan,
irinotécan,
vi) un agent scindant, fragmentant l'ADN, telle la bléomycine,
vii) un des composés suivants ; plicamycine, L-asparaginase, mitoguazone,
dacarbazine,
viii) un stéroïde progestatif anticancéreux : médroxy-progestérone, mégestrol,
ix) un stéroïde oestrogénique anticancéreux : diéthylstilbestrol ; fosfestrol
tétrasodique,
x) un anti-oestrogène : tamoxifène, droloxifène, raloxifène, amino-
gluthétimide,
xi) un anti-androgène stéroïdien (ex cyprotérone) ou un anti-androgène non
stéroïdien (flutamide, nilutamide).
En particulier, les composés de formule (I) et (la) peuvent être associés à
tous les traitements par les agents cytotoxiques majeurs utilisés dans les
polychimiothérapies des tumeurs solides tels
- la doxorubicine
- les agents alkylants : oxazophorines (cyclophosphamide, ifosfamide,
chlorambucil, melphalan)
- les nitrosourées
- la mitomycine C
- les anti-métabolites comme le méthotrexate, le 5-FU, l'Ara-C, la
capécitabine
- les agents interférant avec la tubuline : vinca-alcaldides (vincristine,
vinblastine,
vindésine, navelbine), les taxoïdes (paclitaxel, docétaxel), les dérivés des
épipodophyllotoxines (étoposide, téniposide)
- la bléomycine
- les inhibiteurs de la topoisomérase I : topotécan, irinotécan.
De même, les composés de formule (I) et (la) peuvent être associés aux
traitements par les agents cytotoxiques majeurs utilisés en oncohématologie
pour le
traitement des cancers du sang
- maladie de Hodgkin : cyclophosphamide, mechloréthamine, chlorambucil,
melphalan, ifosfamide, étoposide, doxorubicine, daunorubicine ; ,
- leucémies aiguës : méthotrexate, 6-mercaptopurine, cytarabine, vinblastine,
vincristine, doxorubicine, daunorubicine, L-asparaginase ;
- lymphomes malins non hodgkiniens : mechloréthamine, chlorambucil,
cyclophosphamide, melphalan, ifosfamide, methotrexate, cytarabine,
vinblastine,
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
12
vincristine, étoposide, doxorubicine, daunorubicine, carmustine, lomustine,
cisplatine ;
- leucémies lymphôides chroniques : méchloréthamine, chlorambucil,
cyclophosphamide, melphalan, ifosfamide.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
13
D'une manière générale, les composés de formule (I) et (la) peuvent être
préparés selon les schémas réactionnels suivants
SCHEMAI
R, R,
Toluène
refl ux R5
EtOOC
H
Diphényléther
Biphényl
SCHEMA II
~ R6a
R2 / R5 R2 / R5 R2 / ~ R5
~ I ~I ~ I I ~
H R3 ~ ~ R3 ~ N
R4 Ra R6 Ra
Comme réactif alkylant, on peut utiliser un réactif de type XR6 où X = I, Br,
CI.
En outre, il est possible de transformer une partie ou la totalité des groupes
alkoxy en groupes hydroxy selon des méthodes connues. De même les groupes
hydroxy
peuvent être transformés en ester ou en sulfonate selon les méthodes connues,
les
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
14
sulfonates pouvant, à leur tour, étre convertis en groupes alkènyle, phényle
ou phényle
substitué et - NR,6R,~ selon les méthodes connues.
De même, il est possible de convertir selon des méthodes connues un
groupe -A-COOR,o dans laquelle Rio est un groupe alkyle ou phénylalkyle en un
groupe
-A-COOH et de convertir un groupe -A-COOH en un groupe -A-CONR"R,Z.
Les composés dans lesquels R4 et R6 forment un groupe -CO-CHZ-CH2-
peuvent être obtenus par cyclisation d'un composé dans lequel R4 = H et R6 = -
CHZ-CH2-
COOH.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
EXEMPLE 1
3-Phényl-1,4-dihydro-4-quinolinone (composé 2) CRL 8326
a) cz~Formylphénylacétate d'éthyle
i
~o , o
0
5 Sous atmosphère d'azote, 4,50 g (0,11 mol) d'hydrure de sodium à 60%, lavé
préalablement avec de l'éther de pétrole, sont mis en suspension dans 35 ml
d'éther.
Le ballon est placé dans un.bain de glace. Dans un premier temps, 7,60 ml
(0,09 mol)
de formiate d'éthyle sont additionnés au mélange initial, puis 10 ml de
phénylacétate
d'éthyle (0,06 mol) sont ajoutés très lentement (surveiller le dégagement
d'hydrogéne
l0 pour éviter l'emballement de la réaction). L'addition effectuée, la
solution est agitée à
35°C pendant 3-4 h. Le mélange devient blanc pâteux. Au cours de
l'agitation, il est
indispensable de veiller à ce que la réaction ne s'emballe pas (si nécessaire,
ajouter
de l'éther). Le mélange réactionnel est filtré, le solide blanc obtenu est
lavé avec de
l'éther. Ce dernier est dissous dans l'eau puis la solution résultante est
acidifiée par
15 HCI 10%. Le composé final est extrait par de l'acétate d'éthyle (deux
fois). La phase
organique est séchée sur MgS04 puis évaporée sous pression réduite pour donner
10,00 g (71%) d'c~formylphénylacétate d'éthyle sous forme d'huile incolore.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
16
b) (~-3-Anilino-2-phényl-2-propénoate d'éthyle (Composé 1)
/
~tooc
/
N
H
Une solution d'aniline (1,40 ml, 15,36 mmol) et d'a-formylphénylacétate
d'éthyle (3,25
g, 1,1 eq) dans le toluène (20 ml) est chauffée à reflux pendant 18 h. Après
refroidissement, le mélange est dilué avec du toluène (10 ml) puis .acidifié
par HCI
10%. Après extraction, la phase organique obtenue est séchée sur MgS04 puis
évaporée sous pression réduite. Le résidu est purifié par chromatographie sur
colonne de silice (éluant: EP/AcOEt 7:3) pour donner 2,46 g (60%) du composé 1
(isomère Z) sous forme d'une huile jaune.
~ IR (film): v 3296, 1664, 1622, 1599, 1584 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.34 (t, 3H, J = 7.2 Hz, CH3), 4.29 (q, 2H, J =
7.2 Hz,
CHz), 7.01-7.07 (m, 3H, HA~), 7.26-7.40 (m, 7H, HA~), 7.44 (d, 1 H, J = 12.8
Hz, =CH),
10.37 (d large, 1 H, J = 12.8 Hz, NH).
~ 13C RMN (62.90 MHz, CDC13): 8 14.4, 59.8, 102.9, 115.5 (2), 122.6, 126.0,
127.9
(2), 129.4 (2), 129.6 (2), 137.9, 140.7, 143.6, 169.2.
~ MS (ionspray): m/z 268 (M+H)+
~ Anal. calculé pour C~~H~~N02: C, 76.38; H, 6.41; N, 5.24. Trouvé: C,76.15;
H, 6.30;
N, 5.29.
c) 3-Phényl-1,4-dihydro-4-quinolinone (Composé 2) - CRL 8326
CRL8326
N
H
Sous agitation, le composé 1 (1,10 g, 4,11 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (1,70 g) et de diphényl éther
(13,10 g)
z5 chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, la
quinolone 2 précipite dans le milieu réactionnel. Ce produit est recueilli par
filtration
puis rincé par de l'éther de pétrole. Après séchage, 859 mg (94%) du composé 2
sont
obtenus sous forme de cristaux blancs.
~ PF 253-254°C (EtOH)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
17
~ IR (KBr): v 1628, 1615, 1583, 1562, 1515 cm-'
~ 1 H NMR (250 MHz, DMSO-ds): â 7.25-7.42 (m, 4H, HAr), 7.57-7.74 (m, 4H,
HA~),
8.15 (s, 1 H, =CH), 8.20 (d, 1 H, J = 7.5 Hz, HAr), 12.00 (s large, 1 H, NH).
13C RMN (62.90 MHz, DMSO-ds): 8 118.2, 119.7, 123.3, 125.4, 125.6, 125.8,
127.8
(2), 128.4 (2), 131.5, 136.2, 138.1, 139.3, 174.7.
~ MS (ionspray): m/z 222 (M+H)+
~ Anal. calculé pour C~SH~~NO: C, 81.43; H, 5.01; N, 6.33. Trouvé: C, 81.65;
H, 4.80;
N, 6.10.
l0 EXEMPLE 2
8-Méthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 4)-CRL 8328
a) (2~-3-(2-Méthoxyanilino)-2-phényl-2-propénoate d'éthyle (composé 3)
i
~ ooc
i
N
H
OMe
. . Une solution de 2-méthoxyaniline (1,20 ml, 10,64 mmol) et d'a-
formylphénylacétate
d'éthyle (2,25 g, 1,1 eq) dans le toluène (20 ml) est chauffée à reflux
pendant 18 h.
Après refroidissement, lé mélange réactionnel est dilué avec du toluène (10
ml) puis
acidifié par HCI 10%. Après extraction, la phase organique obtenue est séchée
sur
MgS04 puis évaporée sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice (éluant CHZCIZ) pour donner 2,15 g (68%)
du
z0 composé 3 (isomère Z) sous forme d'une huile jaune.
~ IR (KBr): v 3295, 1667, 1617, 1589, 1509 cm-'
~ 1 H RMN (250 MHz, CDC13): â 1.28 (t, 3H, J = 7.2 Hz, CH3), 3.87 (s, 3H,
OCH3),
4.26 (q, 2H, J = 7.2 Hz, CH2), 6.81-7.00 (m, 3H, HA~), 7.16-7.44 (m, 6H, HA~),
7.42 (d,
1 H, J = 12.5 Hz, =CH); 10.49 (d large, 1 H, J = 12.5 Hz, NH).
~ 13C RMN (62.90 MHz, CDC13): 8 14.2, 55.6, 59.6, 103.1, 110.6, 112.1, 121.0,
122.0,
125.7, 127.7 (2), 129.3 (2), 130.1, 138.1, 142.2, 147.8, 168.7.
~ MS (ionspray): m/z 298 (M+H)+
~ Anal. calculé pour C~$H~9N03: C, 72.71; H, 6.44; N, 4.71. Trouvé: C, 72.60;
H, 6.65;
N, 4.70.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
18
b) 8-Méthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 4) - CRL 8328
0
\
CRL8328
N
H
OMe
Sous agitation, le composé 3 (1,10 g, 3.70 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (1,52g) et de diphényl éther
(11,60 g) à
250°C. Après 10 min, le chauffage est stoppé. Lors du refroidissement,
le produit final
4 précipite dans le milieu réactionnel. Ce produit est recueilli par
filtration puis rincé
par de l'éther de pétrole. Après séchage, 762 mg (82%) du composé 4 sont
obtenus
sous forme de cristaux blancs.
l0 ~ PF : 148-149°C (EtOH)
~ IR (KBr): v 1624, 1618, 1577, 1553, 1527 cm-'
~ 1 H RMN (250 MHz, DMSO-ds): â 4.00 (s, 3H, OCH3), 7.25-7.41 (m, 5H, HA~),
7.67
(d large, 2H, J = 7.8 Hz, HA~), 7.75 (dd, 1 H, J = 3.0, 7.5 Hz, HA~), 7.90 (s,
1 H, =CH),
11.64 (s large, 1 H, NH).
~ 13C RMN (62.90 MHz, DMSO-d6): 8 56.7, 111.2, 117.3, 120.5, 123.3, 126.8,
127.3,
128.4 (2), 128.8 (2), 131.1, 136.8, 138.4, 149.3, 174.8.
~ MS (ionspray): m/z 252 (M+H)+
~ Anal. calculé pour C~6H~3N02: C, 76.48; H, 5.21; N, 5.57. Trouvé: C, 76.18;
H, 5.00;
N, 5.60.
EXEMPLE 3
6-Méthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 6) - CRL 8488
a) (~-3-(4-Méthoxyanilino)-2-phényl-2-propénoate d'éthyle (composé 5)
/
Me0 \tOOC \
N
H
Une solution de 4-méthoxyaniline (1,76 g, 14,29 mol) et d'a-
formylphénylacétate
d'éthyle (3,02 g, 1,1 eq) dans le toluène (20 ml) est chauffée à reflux
pendant 18 h.
Après refroidissement, le mélange réactionnel est dilué avec du toluène (15
ml) puis
acidifié par HCI 10%. Après extraction, la phase organique obtenue est séchée
sur
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
19
MgS04 puis évaporée sous pression réduite. Le résidu est repris dans le
méthanol où
le composé 5 (isomère Z) cristallise (2,68 g, 63%).
~ PF : 64-65°C (MeOH)
~ IR (KBr): v 3290, 1661, 1609, 1584, 1517 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.29 (t, 3H, J = 7.2 Hz, CH3), 3.78 (s, 3H,
OCH3),
4.26 (q, 2H, J = 7.2 Hz, CHz), 6.85 (d, 2H, J = 9.0 Hz, HA~), 6.96 (d, 2H, J =
9.0 Hz,
HA~), 7.24-7.41 (m, 6H, HA~ + =CH), 10.27 (d large, 1 H, J = 12.5 Hz, NH).
13C RMN (62.90 MHz, CDC13): â 14.4, 55.6, 59.7, 101.7, 114.9 (2), 117.2 (2),
125.8,
127.9 (2), 129.4 (2), 134.4, 138.1, 144.8, 155.6, 169.4.
l0 ~ MS (ionspray): m/z 298 (M+H)+
~ Anal. calculé pour C~aH~9N03: C, 72.71; H, 6.44; N, 4.71. Trouvé: C, 73.00;
H, 6.42;
N, 4.87.
b) 6-Méthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 6) - CRL 8488
o i
Me0 \ \
~,
N
Sous agitation, le composé 5 (600 mg, 2,02 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (885 mg) et de diphényl éther
(6,5 g)
chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, la
quinolone 6 précipite dans le milieu réactionnel. Ce produit est recueilli par
filtration
2o puis rincé par de l'éther de pétrole. Après séchage, 411 mg (81 %) du
composé 6 sônt
obtenus sous forme de cristaux blancs.
~ PF : 355-356°C (lavage EtOH)
~ IR (KBr): v 3214, 1624, 1600, 1591, 1549, 1512 cm''
~ 1 H RMN (250 MHz, DMSO-ds): â 4.00 (S, 3H, OCH3), 7.26-7.41 (m, 4H, HAr),
7.54-
7.61 (m, 2H, HA~), 7.73 (d, 2H, J = 8.0 Hz, HA~), 8.11 (s, 1 H, =CH), 12.00 (s
large, 1 H,
NH).
~ MS (ionspray): m/z 252 (M+H)+
~ Anal. calculé pour C~6H~3NOz: C, 76.48; H, 5.21; N, 5.57. Trouvé: C, 76.29;
H, 5.37;
N, 5.67.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
EXEMPLE 4
6-Méthoxy-1-méthyl-3-phényl-1,4-dihydro-4-quinolinone (composé 7)-CRL 8379
o i
Me0 \ \
CRL8379
N
CH3
5 Sous atmosphère d'azote, 200 mg (0,79 mmol) du composé 6 sont solubilisés
dans
10 ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
additionnés
successivement 823 mg de carbonate de potassium (7,5 eq), puis 0,15 ml
d'iodure de
méthyle (3 eq). La réaction est agitée à température ambiante pendant 18 h.
Les
solvants sont évaporés. Le résidu obtenu est repris dans le CHZCIZ et lavé par
deux fois
Io par de l'eau. La phase organique obtenue est séchée sur MgS04, puis
évaporée sous
pression réduite. Le solide brut est recristallisé dans l'éthanol pour donner
200 mg (95%)
du dérivé 7.
~ PF : 156-157°C (lavage EtOH)
~ IR (KBr): v 1627, 1616, 1576, 1560, 1507 cm-'
15 ~ 1 H RMN (250 MHz, DMSO-ds): 8 3.87 (s, 3H, NCH3), 3.91 (s, 3H, OCH3),
7.27-7.42
(m, 4H, HA~), 7.68 (d, 1 H, J = 9.0 Hz, HA~), 7.73-7.77 (m, 3H, HAN), 8.25 (s,
1 H, =CH).
13C RMN (62.90 MHz, DMSO-ds): 8 40.2, 55.4, 105.9, 118.5, 121.7, 125.4, 126.3,
127.8 (2), 128.3 (2), 134.5, 136.1, 143.0, 155.8, 173.4.
~ MS (ionspray): m/z 266 (M+H)+
20 ~ Anal. calculé pour C~~H~SN02: C, 76.96; H, 5.70; N, 5.28. Trouvé: C,
77.33; H, 5.79;
N, 5.09.
EXEMPLE 5
7-Méthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 9)-CRL 8359
a) (~-3-(3-Méthoxyanilino)-2-phényl-2-propénoate d'éthyle (composé 8)
i
\cooc \
Me0 / N
H
Une solution de 3-méthoxyaniline (1,55 ml, 13,79 mol) et d'a-
formylphénylacétate
d'éthyle (2,92 g, 1,1 eq) dans le toluène (20 ml) est 'chauffée à reflux
pendant 18 h.
Après refroidissement, le mélange réactionnel est dilué avec du toluène (15
ml) puis
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
21
acidifié par HCI 10%. Après extraction, la phase organique obtenue est séchée
sur
MgS04 puis évaporée sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice (éluant: CH2C12) pour donner 2,30 g
(56%) du
composé 8 (isomère Z) sous forme d'un solide jaune qui cristallise dans le
méthanol.
~ PF : 49-50°C (MeOH)
~ IR (KBr): v 3305, 1665, 1588 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.29 (t, 3H, J = 7.2 Hz, CH3), 3,79 (s, 3H,
OCH3),
4.25 (q, 2H, J = 7.2 Hz, CH2), 6.53-6.61 (m, 3H, HAr), 6.16-7.35 (m, 6H, HAr),
7.39 (d,
1 H, J = 12.5 Hz, =CH), 10.32 (d large, 1 H, J = 12.5 Hz, NH).
1o ~ 13C RMN (62.90 MHz, CDC13): 8 14.4, 55.2, 59.9, 101.6, 103.0, 108.0 (2),
126.0,
127.9 (2), 129.5 (2), 130.5, 137.9, 142.0, 143.5, 160.8, 169.2.
~ MS (ionspray): m/z 298 (M+H)+
~ Anal. calculé pour C~$H~9N03: C, 72.71; H, 6.44; N, 4.71. Trouvé: C, 72.56;
H, 6.61;
N, 4.54.
b) 7-Méthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 9)-CRL 8359
o i
w
CRL8359
Me0 / N
H
Sous agitation, le composé 8 (600 mg, 2,02 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (885 mg) et de diphényl éther
(6,50 g)
2o chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, la
quinolone brute précipite dans le milieu réactionnel. Ce produit est recueilli
par
filtration puis rincé par de l'éther de pétrole. Ce dernier est ensuite repris
dans de
l'éthanol à chaud. Après refoidissement, le solide insoluble est filtré pour
donner 477
mg (94%) du composé 9 sous forme de cristaux blancs.
~ PF : 297-298°C (lavage EtOH)
~ IR (KBr): v 3225, 1634, 1616, 1591, 1560, 1519 cm-'
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.86 (s, 3H, OCH3), 6.95 (dd, 1 H, J = 2.5,
8.8 Hz,
HAr), 6.97 (d, 1 H, J = 2.5 Hz, HAr), 7.23-7.40 (m, 3H, HAr), 7.70 (d, 2H, J =
9.0 Hz, HAr),
8.07 (s, 1 H, =CH), 8.10 (d, 1 H, J = 8.8 Hz, HAr), 11.81 (s large, 1 H, NH).
~ 13C RMN (62.90 MHz, DMSO-ds): 8 55.9, 99.4, 113.9, 120.1, 120.7, 126.8,
128.0,
128.3 (2), 128.9 (2), 136.7, 138.3, 141.5, 162.3, 174.8.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
22
~ MS (ionspray): m/z 252 (M+H)+
~ Anal. calculé pour C~6H~3N02: C, 76.48; H, 5.21; N, 5.57. Trouvé: C, 76.80;
H, 5.39;
N, 5.66.
EXEMPLE6:
5,8-Diméthoxy-1-méthyl-3-phényl-1,4-dihydro-4-quinolinone (composé 11)-
CRL8353
a) (27-3-(2,5-Diméthoxyanilino)-2-phényl-2-propénoate d'éthyle (composé 10)
OMe /
~ OOC
N
H
OMe
1o Une solution de 2,5-diméthoxyaniline (1,76 g, 11,49 mmol) et d'a-
formylphénylacétate
d'éthyle (2,43 g, 1,1 eq) dans le toluène (20 ml) est chauffée à reflux
pendant 18 h.
Après refroidissement, le mélange réactionnel est dilué avec du toluène (10
ml) puis
acidifié par HCI 10%. Après extraction, la phase organique obtenue est séchée
sur
MgS04 puis évaporée sous pression réduite. Le résidu isolé est cristallisé
dans le
1s méthanol, puis filtré sur verre fritté pour donner 2,71 g (72 %) du composé
10.
~ PF : 93-94°C (MeOH) .
~ IR (KBr): v 3262, 1672, 1605, 1590, 1514 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.32 (t, 3H, J = 7.2 Hz, CH3), 3.76 (s, 3H,
OCH3),
3.91 (s, 3H, OCH3), 4.30 (q, 2H, J = 7.2 Hz, CHZ), 6.47 (dd, 1 H, J = 2.8, 8.9
Hz, HA~),
20 6.65 (d, 1 H, J = 2.8 Hz, HA~), 6.81 (d, 1 H, J = 8.9 Hz, HA~), 7.20-7.45
(m, 6H, HAN +
=CH), 10.45 (d large, 1 H, J = 12.5 Hz, NH).
13C RMN (62.90 MHz, CDC13): 8 14.4, 55.7, 56.3, 59.9, 99.8, 103.7, 105.4,
111.6,
126.0, 127.9 (2), 129.5 (2), 131.1, 138.1, 142.0, 142.5, 154.3" 168.8.
~ MS (ionspray): m/z 328 (M+H)+
25 ~ Anal. calculé pour C~9HZ~N04: C, 69.71; H, 6.47; N, 4.28. Trouvé: C,
70.02; H, 6.52;
N, 4.18.
b) 5,8-Diméthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 11) CRL 8353
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
23
OMe O
CRL8353
\
N
H
OMe
Sous agitation, le composé 10 (1,20 g, 3,66 mmol) est additionné rapidement et
ce,
rapidement, à une solution de biphényle (1,52 g) et de diphényl éther (11,60
g)
chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, le
produit final 11 précipite dans le milieu réactionnel. Le produit brut est
recueilli par
filtration puis rincé par de l'éther de pétrole. Ce dernier est repris dans de
l'éthanol. La
suspension est chauffé à reflux sous agitation. Après refroidissement et
filtration, 753
mg (73%) du composé 11 sont obtenus sous forme de cristaux blancs.
~ PF : 231-232°C (lavage EtOH)
~ IR (KBr): v 1617, 1576, 1558, 1524 cm''
~ 1 H RMN (250 MHz, DMSO-d6): 8 3.75 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 6.67
(d,
1 H, J = 8.8 Hz, HA~), 7.14 (d, 1 H, J = 8.8' Hz, HA~), 7.23-7.39 (m, 3H,
HA~), 7.58-7.61
(m, 2H, HA~), 7.74 (s, 1 H, =CH), 11.20 (s large, 1 H, NH).
13C RMN (62.90 MHz, DMSO-ds): â 56.3, 56.4, 104.0, 111'.4, 117.1, 122.3,
126.4,
127.8 (2), 128.6 (2), 132.2, 135.7, 136.3, 141.8, 153.2, 174.6.
~ MS (ionspray): m/z 282 (M+H)+
~ Anal. calculé pour C~~H~5NO3: C, 72.58; H, 5.37; N, 4.98. Trouvé: C, 72.83;
H, 5.26;
N, 5.09.
2o EXEMPLE 7
5,8-Diméthoxy-1-méthyl-3-phényl-1,4-dihydro-4-quinolinone (composé 12) - CRL
8383
OMe O /
\ \
/ CRL8383
N
OMe CH3
Sous atmosphère d'azote, 400 mg (1,42 mmol) du composé 11 sont solubilisés
dans
15 ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
additionnés
successivement 1,47 g de carbonate de potassium (7,5 eq), puis 0,26 ml
d'iodure de
méthyle (3 eq). La réaction est agitée à température ambiante pendant 6 h. Les
solvants
sont évaporés. Le résidu obtenu est repris dans le CH2C12 et lavé par deux
fois par de
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
24
l'eau. La phase organique obtenue est séchée sur MgS04, puis évaporée sous
pression
réduite. Le résidu est purifié sur colonne de gel de silice (éluant:
CH2CI2/AcOEt 7:3) pour
donner 293 mg (70%) du dérivé 12.
~ PF : 125-126°C (lavage AcOEt)
~ IR (KBr): v 1631, 1592, 1569 cm-'
~ 1 H RMN (250 MHz, CDC13): â 3.86 (s, 3H, NCH3), 3.90 (s, 3H, OCH3), 4.03 (s,
3H,
OCH3), 6.71 (d, 1 H, J = 9.0 Hz, HAr), 7.05 (d, 1 H, J = 9.0 Hz, HAr), 7.26-
7.36 (m, 3H,
HAr),7.42 (s, 1 H, =CH), 7.66 (d, 2H, J = 7.8 Hz, HAr).
13C RMN (62.90 MHz, CDCI3): 8 46.7, 56.9, 57.1, 105.6, 115.0, 120.2, 123.4,
126.8,
l0 127.9 (2), 128.9 (2), 134.5, 135.5, 143.8, 155.2, 175.8.
~ MS (ionspray): m/z 296 (M+H)+
~ Anal. calculé pour C~BH~~N03: C, 73.20; H, 5.80; N, 4.74. Trouvé: C, 72.88;
H, 5.96;
N, 4.94.
EXEMPLE 8
6,7-Diméthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 14)-CRL 8355
a) (2~-3-(3,4-Diméthoxyanilino)-2-phényl-2-propénoate d'éthyle (composé 13)
i
Me0 ~tOOC
Me0 N
H
Une solution de 3,4-diméthoxyaniline (1,50 g, 9,79 mmol) et d'a-
formylphénylacétate
2o d'éthyle (2,07 g, 1,1 eq) dans le toluène (20 ml) est chauffée à reflux
pendant 18 h.
Après refroidissement, le mélange réactionnel est dilué avec du toluène (10
ml) puis
acidifié par HCI 10%. Après extraction, la phase organique obtenue est séchée
sur
MgS04 puis évaporée sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice (éluant: CH2CIz) pour donner 1,92 g
(60%) du
composé 13 sous forme d'une huile qui cristallise dans le méthanol.
~ PF : 107-108°C (MeOH)
~ IR (KBr): v 3270, 1658, 1615, 1587, 1519 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.29 (t, 3H, J = 7.2 Hz, CH3), 3.84 (s, 3H,
OCH3),
3.86 (S, 3H, OCH3), 4.25 (q, 2H, J = 7.2 Hz, CHZ), 6.54-6.58 (m, 2H, HAr),
6.80 (d, 1 H,
J = 9.2 Hz, HAr), 7.21-7.48 (m, 6H, HAr + =CH), 10.30 (d large, 1 H, J = 12.5
Hz, NH).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
13C RMN (62.90 MHz, CDC13): 8 14.3, 55.9, 56.2, 59.7, 101.0, 101.9, 106.9,
112.3,
125.8, 127.9 (2), 129.5 (2), 134.5, 138.0, 144.5, 145.0, 149.9, 169.3.
~ MS (ionspray): m/z 328 (M+H)+
~ Anal. calculé pour C~9H2~N04: C, 69.71; H, 6.47; N, 4.28. Trouvé: C, 69.83;
H, 6.63;
5 N, 4.26.
b) 6,7-Diméthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 14) - CRL 8355
o i
Meo
CRL8355
Me0 N
H
Sous agitation, le composé 13 (500 mg, 1,53 mmol) est additionné par petites
portions et ce, rapidement, à une solution de biphényle (675 mg) et de
diphényl éther
(4,90 g) chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors
du
refroidissement, le produit final 14 précipite dans le milieu réactionnel. Ce
produit est
recueilli par filtration puis rincé par de l'éther de pétrole. Après séchage,
391 mg
(91 %) du composé 14 sont obtenus sous forme de cristaux gris.
15 ~ PF : 331-332°C -(lavage EtOH)
~ IR (KBr): v 3228, 1620, 1600, 1590, 1545, 1508 cm-'
~ 1 H RMN (250 MHz, DMSO-ds): b 3,85 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 7.02
(s,
1 H, HA~), 7.23-7.40 (m, 3H, HA~), 7.57 (s, 1 H, HA~), 7.73 (d, 2H, J = 8.2
Hz, HA~), 8.04
(s, 1 H, =CH), 11.82 (s large, 1 H, NH).
20 ~ 13C RMN (62.90 MHz, DMSO-ds): 8 55.5, 55.7, 99.0, 104.8, 118.8, 119.8,
126.1,
127.8, (2), 128.4 (2), 134.9, 136.6 (2), 146.7, 152.8, 173.5.
~ MS (ionspray): m/z 282 (M+H)+
~ Anal. calculé pour C17H15NOs: C, 72.58; H, 5.37; N, 4.98. Trouvé: C, 72.85;
H,
5.54; N, 5.17.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
26
EXEMPLE 9
5,7-Diméthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 16) CRL8352
a) (Z)-3-(3,5-Diméthoxyanilino)-2-phényl-2-propénoate d'éthyle (composé 15)
OMe
\tOOC \
Me0 N
S H
Sous atmosphère d'azote, 1,54 g (10,05 mmol) de 3,5-diméthoxyaniline et 2,12 g
(1,1
eq) d'c~formylphénylacétate d'éthyle dans 20 ml de toluène sont agités à
reflux
pendant 18 h. Après refroidissement, le mélange réactionnel est dilué avec du
toluène
(20 ml), acidifié avec HCI à10% puis extrait. La phase organique est séchée
sur
MgS04, filtrée puis évaporée sous pression réduite. Le résidu obtenu est
repris dans
du méthanol où le composé 15 cristallise. Le produit est recueilli par
filtration. Le filtrat
est, quant à lui, entreposé dans un congélateur à -78°C où le dérivé 15
cristallise de
nouveau. Les deux portions réunis conduisent à l'obtention de 2,47 g (75%) du
composé 15 (isomère Z).
is '~ PF : 75-76°C (MeOH)
~ IR (KBr): v 3274, 1664, 1618, 1593 cm-'
~ 1 H RMN (250 MHz, CDC13): â 1.27 (t, 3H, J = 7.2 Hz, CH3), 3.71 (s, 6H,
OCH3),
4.23 (q, 2H, J = 7.2 Hz, CHZ), 6.10-6.14 (m, 3H, HA~), 7.18-7.37 (m, 6H, HA~ +
=CH),
10.27 (d large, 1 H, J = 12.5 Hz, NH).
~ 13C RMN (62.90 MHz, CDC13): b 14.4, 55.4 (2), 59.9, 94.2 (2), 94.7, 103.1,
126:1,
127.9 (2), 1-29.5 (2), 137.8, 142.5, 143.4, 161.8 (2), 169.3.
~ MS (ionspray): m/z 328 (M+H)+
~ Anal. calculé pour C~9H2~NOç: C, 69.71; H, 6.47; N, 4.28. Trouvé: C, 69.42;
H, 6.29;
N, 4.30.
b) 5,7-Diméthoxy-3-phényl-1,4-dihydro-4-quinolinone (composé 16) - CRL8352
OMe O /
\ \
/ CRL8352
Me0 N
H
Sous agitation, le composé 15 (1,20 g, 3,67 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (1,52 g) et de diphényl éther
(11,60 g)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
27
chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, la
quinolone 16 précipite dans le milieu réactionnel. Ce produit est recueilli
par filtration
puis rincé par de l'éther de pétrole. Après séchage, 650 mg (63%) du composé
16
sont obtenus sous forme de cristaux blancs.
~ PF : 254-255°C (lavage EtOH)
~ IR (KBr): v 3268, 1631, 1598, 1567, 1522 cm'
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.81 (s, 3H, OCH3), 3.90 (s, 3H, OCH3), 6.36
(d,
1 H, J = 2.0 Hz, HA~), 6.45 (d, 1 H, J = 2.0 Hz, HA~), 7.32-7.42 (m, 3H, HA~),
7.69 (d, 2H,
J = 7.0 Hz, HA~), 8.01 (s, 1 H, =CH), 11.81 (s, 1 H, NH).
1o ~ 13C RMN (62.90 MHz, DMSO-ds): b 55.5, 55.7, 91.2, 94.5, 111.4, 121.6,
126.1,
127.9 (2), 128.6 (2), 135.7, 136.5, 143.5, 161.4; 161.8, 174.3.
~ MS (ionspray): m/z 282 (M+H)+
~ Anal. calculé pour C~~H~SNOg: C, 72.58; H, 5.37; N, 4.98. Trouvé: C, 72.31;
H, 5.40;
N, 5.23.
EXEMPLE 10
5,7-Diméthoxy-3-phényl-1-méthyl-1,4-dihydro-4-quinolinone (composé 17~)-CRL
8489
OMe O
\
Me0 / N
CHI
2o Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 16 sont additionnés
à 10
ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
successivement
ajoutés 734 mg de KZC03 anhydre (7,5 eq), puis 0,13 ml d'iodure de méthyle (3
eq). La
réaction est agitée à température ambiante pendânt 18 h. Les solvants sont
évaporés.
Le résidu est repris dans le CHZCIz et lavé par deux fois par de l'eau. La
phase
organique obtenue est séchée sur MgS04, puis évaporée sous pression réduite.
Le
résidu brut est purifié sur colonne de silice (éluant: CH2CI2/AcOEt 9:1 ) pour
donner 162
mg (77%) du dérivé 17.
~ PF : 179-180°C (lavage ethanol)
~ I R (KBr): v 1634, 1611, 1588, 1506 cm-'
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
28
~ 1 H RMN (250 MHz, CDC13): b 3.68 (s, 3H, NCH3), 3.90 (s, 3H, OCH3), 3.94 (s,
3H,
OCH3), 6.24 (d, 1 H, J = 2.2 Hz, HAr), 6.37 (d, 1 H, J = 2.2 Hz, HAr), 7.20-
7.38 (m, 3H,
HAr), 7.44 (s, 1 H, =CH), 7.60-7.64 (m, 2H, HAr).
13C RMN (62.90 MHz, CDC13): 8 41.7, 55.5, 56.3, 89.9, 94.6, 112.8, 123.9,
126.9,
128.0 (2), 129.1 (2), 135.8, 140.8, 144.3, 162.8, 163.1, 175.8.
~ MS (ionspray): m/z 296 (M+H)+
~ Anal. calculé pour C~BH~~N03: C, 73,20 ; H, 5.80; N, 4.74. Trouvé: C, 73,37
; H,
5.67; N, 4,95.
l0
EXEMPLE 11
3-(4-Méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 19)-CRL 8327
a) a-Formyl-4-méthoxyphénylacétate d'éthyle
Sous atmosphère d'azote, 4,08 g (0,10 mol) d'hydrure de sodium à 60% dans
l'huile
sont mis en suspension dans 35 ml d'éther. Le ballon est placé dans un bain de
glace. Dans un premier temps, 6,86 ml (0,08 mol) de formiate d'éthyle sont
additionnés au mélange initial, puis 10 ml de p-méthoxyphénylacétate d'éthyle
(0.06
2o mol) sont ajoutés très lentement (surveiller le dégagement d'hydrogéne pour
éviter
l'emballement de la réaction). L'addition effectuée, la solution est agitée à
35°C
pendant 3-4 h. Le mélange devient blanc pâteux. Au cours de l'agitation, il
est
indispensable de veiller à ce que la réaction ne s'emballe pas (si nécessaire,
ajouter
de l'éther). Le mélange réactionnel est filtré, le solide blanc obtenu est
lavé avec de
l'éther. Ce dernier est dissous dans l'eau puis la solution résultante est
acidifiée par
HCI 10%. Le composé final est extrait par de l'acétate d'éthyle (deux fois).
La phase
organique est séchée sur MgS04 puis évaporée sous pression réduite pour donner
9,60 g (77%) d'a-formyl-4-méthoxyphénylacétate d'éthyle sous forme d'une huile
brune.
b) (~-3-Anilino-2-(4-méthoxyphényl)-2-propénoate d'éthyle (composé 18)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
29
/ OMe
\tOOC
N
H
Une solution d'aniline (1,85 ml, 20,30 mmol) et d'a-formyl-4-
méthoxyphénylacétate
d'éthyle (4,96 g, 1,1 eq) dans le toluène (15 ml) est chauffée à reflux
pendant 18 h.
Après refroidissement, le mélange réactionnel est dilué avec du toluène (10
ml) puis
acidifié par HCI 10%. Après extraction, la phase organique obtenue est séchée
sur
MgS04 puis évaporée sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de silice (éluant: EP/CHZCIZ 4/6) pour donner 4,29
g
(71 %) du composé 18 (isomère Z) sous forme d'une huile jaune.
~ IR (film): v 3302, 1665, 1621, 1600, 1584 cm-'
l0 ~ 1 H RMN (250 MHz, CDCI3): â 1.30 (t, 3H, J = 7.2 Hz, CH3), 3.83 (s, 3H,
OCH3),
4.24 (q, 2H, J = 7.2 Hz, CH2), 6.87-7.00 (m, 5H, HA~), 7.24-7.33 (m, 4H, HA~),
7.36 (d,
1 H, J = 12.5 Hz, =CH), 10.26 (d large, 1 H, J = 12.5 Hz, NH).
13C RMN (62.90 MHz, CDC13): 8 14.3, 55.1, 59.8, 102.4, 113.3 (2), 115.4 (2),
122.3,
129.6 (2), 130.2, 130.5 (2), 140.7, 143.0, 158.0, 169.4.
~ MS (ionspray) : m/z 298 (M+H)+
~ Anal. calculé pour C~8H~9N03: C, 72.71; H, 6.44; N, 4.71. Trouvé: C, 72.47;
H, 6.63;
N, 4.50.
c) 3-(4-Méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 19) - CRL 8327
OMe
O
\ \
CRL8327
N
H
Sous agitation, le composé 18 (1,81 g, 6,09 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (2,30 g) et de diphényl éther
(17,58 g)
chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, la
quinolone 19 précipite au sein du milieu réactionnel. Ce produit est recueilli
par
filtration puis rincé par de l'éther de pétrole. Après séchage, 1,40 g (91 %)
du composé
19 sont obtenus sous forme de cristaux blancs.
~ PF : 292-293°C (EtOH)
~ IR (KBr): v 1629, 1607, 1562, 1561, 1516 cm~'
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.77 (s,. 3H, OCH3), 6.94 (d, 2H, J = 8.8 Hz,
HAr),
7.31 (t, 1 H, J = 7.8 Hz, HAr), 7.54-7.67 (m, 4H, HAr), 8.09 (s, 1 H, =CH),
8.19 (d, 1 H, J =
7.8 Hz, HAr), 11.96 (s, 1 H, NH).
13C RMN (62.90 MHz, DMSO-d6): 8 55.5, 113.7 (2), 119.6, 119.8, 123.4, 126.0,
5 126.3, 129.2, 129.9 (2), 131.6, 138.5, 140.2, 158.3, 175.1.
~ MS (ionspray): m/z 252 (M+H)+
~ Anal. calculé pour C~6H~3N02: C, 76.48; H, 5.21; N, 5.57. Trouvé: C, 76.08;
H, 5.03;
N, 5.60.
1o EXEMPLE 12
8-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 21) - CRL
8329
a) (ZJ-3-(2-Méthoxyanilino)-2-(4-méthoxyphényl)-2-propénoate d'éthyle (composé
20)
/ OMe
\tOOC
N
H
OMe
Une solution de 2-méthoxyaniline (1,25 ml, 11,08 mmol) et d'a-formyl-4-
méthoxyphénylacétate d'éthyle (2,70 g, 1,1 eq) dans le toluène (20 ml) est
chauffée à
reflux pendant 18 h. Après refroidissement, le mélange réactionnel est dilué
avec du
2o toluène (10 ml) puis acidifié par HCI 10%. Après extraction, la phase
organique
obtenue est séchée sur MgS04 puis évaporée sous pression réduite. Le résidu
est
purifié par chromatographie sur colonne de silice (éluant: CHZCIz) pour donner
1,96 g
(54%) du composé 20 (isomère Z) sous forme d'une huile jaune qui cristallise
dans le
méthanol.
~ PF : 58-59°C (MeOH)
~ IR (KBr): v 3316, 1665, 1640, 1614, 1596 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.31 (t, 3H, J = 7.2 Hz, CH3), 3.83 (s, 3H,
OCH3),
3.87 (s, 3H, OCH3), 4.28 (q, 2H, J = 7.2 Hz, CHZ), 6.87-7.07 (m, 6H, HAr),
7.28 (d, 2H,
J = 8.8 Hz, HAr), 7.39 (d, 1 H, J = 13.0 Hz, =CH), 10.39 (d large, 1 H, J =
13.0 Hz, NH).
~ 13C RMN (62.90 MHz, CDC13): 8 14.5, 55.3, 55.8, 59.8, 102.9, 110.8, 112.2,
113.4
(2), 121.1, 122.0, 130.5, 130.7 (3), 141.8, 148.0, 158.0, 169.1.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
31
~ MS (ionspray): m/z 328 (M+H)+
~ Anal. calculé pour C~9HZ~N04: C, 69.71; H, 6.47; N, 4.28. Trouvé: C, 69.39;
H, 6.40;
N, 4.52.
b) 8-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 21)
CRL 8329
CRL8329
Sous agitation, le composé 20 (1,30 g, 3,97 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (1,36 g) et de diphényl éther
(10,40 g)
1o chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement du
milieu réactionnel, le produit précipite. 972 mg (87%) du composé 21 sont
ainsi
recueillis par filtration sous forme de cristaux blancs.
~ PF : 192-193°C (EtOH)
~ IR (KBr): v 3250, 1611, 1545 cm'' .
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.79 (s, 3H, OCH3), 4.05 (s, 3H, OCH3), 6.96
(d,
2H, J = 8.8 Hz, HAr), 7.21-7.29 (m, 2H, HA~), 7.62 (d, 2H, J = 8.8 Hz, HAN),
7.75 (dd, 1 H,
J = 2.8, 7.0 Hz, HA~), 7.86 (s, 1 H, =CH), 11.57 (s large, 1 H, NH).
13C RMN (62.90 MHz, DMSO-dfi): 8 55.1, 56.1, 110.7, 113.4 (2), 116.8, 120.0,
122.9, 126.5, 128.3, 129.4 (2), 130.1, 136.7, 148.5, 158.0, 174.6.
~ MS (ionspray): m/z 282 (M+H)+
~ Anal. calculé pour C»H~5N03: C, 72.58; H, 5.37; N, 4.98. Trouvé: C, 72.50;
H, 5.55;
N, 5.11.
EXEMPLE 13
6-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 23)-CRL 8490
a) (27-3-(4-Méthoxyanilino)-2-(4-méthoxyphényl)-2-propénoate d'éthyle (composé
22)
/ OMe
Me0 \tOOC \
N
H
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
32
Une solution de 4-méthoxyaniline (1,47 g, 11,94 mmol) et d'a-formyl-4-
méthoxyphénylacétate d'éthyle (2,92 g, 1,1 eq) dans le toluène (25 ml) est
chauffée à
reflux pendant 18 h. Après refroidissement, le mélange réactionnel est dilué
avec du
toluène (15 ml) puis acidifië par HCI 10%. Après extraction, la phase
organique
obtenue est séchée sur MgS04 puis évaporée sous pression réduite. Le résidu
est
purifié par chromatographie sur colonne de silice (éluant: CH2CI2) pour donner
2,89 g
(74%) du composé 22 (isomère Z) sous forme d'un solide jaune qui cristallise
dans le
méthanol.
~ PF : 90-91 °C (MeOH)
~ IR (KBr): v 3283, 1660, 1613, 1586, 1518 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.32 (t, 3H, J = 7.2 Hz, CH3), 3.79 (s, 3H,
OCH3),
3.84 (s, 3H, OCH3), 4.27 (q, 2H, J = 7.2 Hz, CH2), 6.87-7.02 (m, 6H, HAN),
7.27-7.33
(m, 3H, HA~ + =CH), 10.24 (d large, 1 H, J = 13.0 Hz, NH).
13C RMN (62.90 MHz, CDCI3): â 14.4, 55.2, 55.5, 59.6, 101.2, 113.3 (2), 114.9
(2),
116.8 (2), 130.5 (2), 134.4, 141.2, 155.4, 157.9, 169.5.
~ MS (ionspray): m/z 328 (M+H)+
~ Anal. calculé pour C~9HZ~NO4: C, 69.71; H, 6.47; N, 4.28. Trouvé: C, 69.99;
H, 6.62;
N, 4.10.
2o b) 6-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 23)-CRL
8490
/ OMe
O
Me0 \ \
J
N
H
Sous agitation, le composé 22 (1,00 g, 3,05 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (1,35 g) et de diphényl éther
(9,80 g)
chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, la
quinolone 23 précipite dans le milieu réactionnel. Ce produit est recueilli
par filtration
puis rincé par de l'éther de pétrole. Après séchage, 790 mg (92%) du composé
23
sont obtenus sous forme de cristaux blancs.
~ PF : 335-336°C (lavage EtOH)
~ IR (KBr): v 3212, 1621, 1607, 1588, 1557, 1515 cm-'
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
33
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.78 (s, 3H, OCH3), 3.85 (s, 3H, OCH3), 6.95
(d,
2H, J = 8.8 Hz, HAr), 7.29 (dd, 1 H, J = 3.0, 9.0 HZ, HA~), 7.54 (d, 1 H, J =
9.0 HZ, HAr),
7.60 (d, 1 H, J = 3.0 Hz, HA~), 7.68 (d, 2H, J = 8.8 Hz, HA~), 8.06 (s, 1 H,
=CH), 12.0 (s
large, 1 H, NH).
~ 13C RMN (62.90 MHz, DMSO-ds): 8 55.1, 55.3, 104.7, 113.3 (2), 118.4, 119.9,
122.0, 125.3, 126.7, 128.7, 129.4 (2), 133.9, 155.6, 157.9, 173.9.
~ MS (ionspray): m/z 282 (M+H)+
~ Anal. calculé pour C~~H15NO3: C, 72.58; H, 5.37; N, 4.98. Trouvé: C, 72.77;
H, 5.40;
N, 4.80.
EXEMPLE 14
6-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-quinolinone (composé 24)-
CRL 8378
OMe
O
Me0 \ \
CRL8378
N
CHI
Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 23 sont solubilisés
dans
10 ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
additionnés
successivement 736 mg de carbonate de potassium (7,5 eq), puis 0,13 ml
d'iodure de
méthyle (3 eq). La réaction est agitée à température ambiante pendant 18 h.
Les
solvants sont évaporés. Le résidu obtenu est repris dans l'acétate d'éthyle et
lavé par
2o deux fois par de l'eau. La phase organique obtenue est séchée sur MgS04,
puis
évaporée sous pression réduite. Le residu est purifié sur colonne de silice
(éluant:
CHZCI2/AcOEt 9:1 ) pour donner 188 mg (90%) du composé 24 sous forme de
cristaux
blancs.
~ PF : 139-140°C (EtOH)
~ IR (KBr): v 1608, 1559, 1512 cm-'
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.78 (s, 3H, NCH3), 3.87 (s, 3H, OCH3), 3.90
(s,
3H, OCH3), 6.96 (d, 2H, J = 8.8 Hz, HA~), 7.38 (dd, 1 H, J = 3.0, 9.3 Hz,
HA~), 7.65-7.72
(m, 4H, HA~), 8.20 (s, 1 H, =CH).
13C RMN (62.90 MHz, DMSO-ds): 840.3, 55.1, 55.4, 105.8, 113.3 (2), 118.3,
118.4,
121.6, 127.7, 128.4, 129.4 (2), 134.5, 142.5, 155.7, 157.9, 173.5.
~ MS (ionspray): m/z 296 (M+H)+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
34
~ Anal. calculé pour C~BH»N03: C, 72.95; H, 6.12; N, 4.73. Trouvé: C, 73.06;
H, 6.01;
N, 4.60.
EXEMPLE15:
7-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 26)-CRL8358
et 5-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 27)-
CRL8491
a) (2~-3-(3-Méthoxyanilino)-2-(4-méthoxyphényl)-2-propénoate d'éthyle (25)
/ OMe
\tOOC \
Me0 N
H
Une solution de 3-méthoxyaniline (1,75 ml, 15,57 mmol) et d'a-formyl-4-
méthoxyphénylacétate d'éthyle (3,81 g, 1,1 eq) dans le toluène (25 ml) est
chauffée à
reflux pendant 18 h. Après refroidissement, le mélange réactionnel est dilué
avec du
toluène (15 ml) puis acidifié par HCI 10%. Après extraction, la phase
organique
obtenue est séchée sur MgS04 puis évaporée sous pression réduite. Le résidu
est
purifié par chromatographie sur colonne de silice (éluant: CH2C12) pour donner
3,57 g
(70%) du composé 25 (isomère Z) sous forme d'un solide blanc qui cristallise
dans le
méthanol.
~ PF : 60-61 °C (MeOH)
~ IR (KBr): v 3306, 1668, 1626, 1600, 1586 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.29 (t, 3H, J = 7.2 Hz, CH3), 3.79 (s, 3H,
OCH3),
3.82 (s, 3H, OCH3), 4.25 (q, 2H, J = T:2 Hz, CHZ), 6.53-6.61 (m, 3H, HA~),
6.88 (d, 2H,
J = 8.8 Hz, HA~), 7.19 (t, 1 H, J = 8.0 Hz, HA~), 7.25 (d, 2H, J = 8.8 Hz,
HAN), 7.34 (d, 1 H,
J = 12.5 Hz, =CH), 10.25 (d large, 1 H, J = 12.5 Hz, NH).
13C RMN (62.90 MHz, CDCI3): 8 14.4, 55.3 (2), 59.9, 101.5, 102.6, 107.9,
108.0,
113.4 (2), 130.3, 130.5, 130.7 (2), 142.1, 143.0, 158.1, 160.9, 169.5.
~ MS (ionspray): m/z 328 (M+H)+
~ Anal. calculé pour C~9H21N04: C, 69.71; H, 6.47; N, 4.28. Trouvé: C, 69.47;
H, 6.63;
N, 4.41.
b) 7-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 26) -
CRL8358
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
/ OMe
O
\ I \ CRL8358
Me0 / N/
H
Sous agitation, le composé 25 (1,00 g, 3,05 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (1,35 g) et de diphényl éther
(9,80 g)
chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refroidissement, la
5 quinolone 25 précipite dans le milieu réactionnel. Ce produit est recueilli
par filtration
puis rincé par de l'éther de pétrole. Le solide blanc obtenu est lavé de
nouveau avec
de l'éthanol. Après séchage, 440 mg (51 %) du composé 26 sont obtenus.
~ PF : 306-307°C (lavage EtOH)
~ IR (KBr): v 3225, 1636, 1590, 1560, 1517 cm-'
10 ~ 1H RMN (250 MHz, DMSO-d6): b 3.78 (s, 3H, OCH3), 3.86 (s, 3H, OCH3), 6.91-
6.97
(m, 4H, HA~), 7.65 (d, 2H, J = 8.8 Hz, HA~), 8.01 (s, 1 H, =CH), 8.09 (d, 1 H,
J = 8.8 Hz,
HA~), 11.74 (s large, 1 H, NH).
13C RMN (62.90 MHz, DMSO-ds): 8 55.1, 55.4, 98.8, 113.3 (2), 119.4, 120.1,
125.4,
127.4, 128.5, 129.4 (2), 137.0, 141.0, 157.9, 161.7, 174.4.
15 ~ MS (ionspray): m/z 282 (M+H)+
~ Anal. calculé pour C»H~SN03: C, 72.58; H, 5.37; N, 4.98. Trouvé: C, 72.80;
H, 5.51;
N, 4.78.
c) 5-Méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 27)-
20 CRL8491
OMe O / OMe
\ \
J
N
H
Le filtrat obtenu précédemment (qui a contenu le composé 26) est évaporé pour
donner 43 mg (5%) du composé 27.
~ PF : 215-216°C (EtOH)
25 ~ IR (KBr): v 1664, 1628, 1573, 1518 cm-'
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.77 (s, 3H, OCH3), 3.80 (s, 3H, OCH3), 6.73
(d,
1 H, J = 7.8 Hz, HA~), 6.92 (d, 2H, J = 8.8 Hz, HA~), 7.05 (d, 1 H, J = 7.8
Hz, HAN), 7.47 (t,
1 H, J = 7.8 Hz, HAr), 7.53 (d, 2H, J = 8.8 Hz, HA~), 7.85 (s, 1 H, =CH),
11.74 (s large,
1 H, NH).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
36
13C RMN (62.90 MHz, DMSO-ds): 8 55.5, 56.2, 104.6, 110.6, 113.7 (2), 116.7,
122.0, 129.1, 130.2 (2), 132.3, 136.1, 142.6, 158.4, 160.4, 175.1.
~ MS (ionspray): m/z 312 (M+H)+
~ Anal. calculé pour C»H~5N03: C, 72.58; H, 5.37; N, 4.98. Trouvé: C, 72.36;
H, 5.19;
N, 5.13.
EXEMPLE16:
5,8-Diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone(composé 29) - CRL
8351
a) (~-3-(2,5-Diméthoxyanilino)-2-(4-méthoxyphényl)-2-propénoate d'éthyle
(composé 28)
Une solution de 2,5-diméthoxyaniline (1,07 g, 7,00 mmol) et d' a-formyl-4-
méthoxyphénylacétate d'éthyle (1,71 g, 1,1 eq) dans le toluène (15 ml) est
chauffée à
reflux pendant 18 h. ApPès refroidissement, le mélange réactionnel est dilué
avec du
toluène (15 ml) puis acidifié par HCI 10%. Après extraction, la phase
organique
obtenue est séchée sur MgS04 puis évaporée sous pression réduite. Le résidu
isolé
est cristallisé dans le méthanol, puis filtré sur verre fritté pour donner
1,30 g (52%) du
composé 28.
~ PF : 65-66°C (EtOH)
~ IR (KBr): v 3288, 1667, 1593, 1514 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.30 (t, 3H, J = 7.2 Hz, CH3), 3.75 (s, 3H,
OCH3),
3.82 (s, 3H, OCH3), 3.90 (s, 3H, OCH3), 4.28 (q, 2H, J =,7.2 Hz, CHZ), 6.44
(dd, 1 H, J
= 2.8, 8.9 Hz, HA~), 6.63 (d, 1 H, J = 2.8 Hz, HA~), 6.80 (d, 1 H; J = 9.0 Hz,
HA~), 6.88 (d,
2H, J = 8.8 Hz, HA~), 7.26 (d, 2H, J = 8.8 Hz, HA~), 7.31 (d, 1 H, J = 12.5
Hz, =CH),
10.37 (d large, 1 H, J = 12.5 Hz, NH).
13C RMN (62.90 MHz, DMSO-ds): 8 14.4, 55.3, 55.7, 56.4, 59.9, 100.0, 103.3,
105.2, 111.6, 113.4 (2), 130.5, 130.6 (2), 131.3, 141.4, 142.4, 158.1, 154.4,
169.0
~ MS (ionspray): m/z 358 (M+H)+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
37
~ Anal. calculé pour CZOHZ3N05: C, 67.21; H, 6.49; N, 3.92. Trouvé: C, 66.97;
H, 6.56;
N, 4.08.
b) 5,8-Diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 29)
C RL 8351
CRL8351
Sous agitation, le composé 28 (1.10 g, 3,08 mmol) est additionné par petites
portions
et ce, rapidement, à une solution de biphényle (3,00 g) et de diphényl éther
(7,51 g)
chauffée à 250°C. Après 10 min, le chauffage est stoppée. Lors du
refroidissement, la
1o quinolone 29 précipite dans le milieu réactionnel. Ce produit est recueilli
par filtration
puis rincé par de l'éther de pétrole. Après séchage, 680 mg (71 %) du composé
29
sont obtenus sous forme de cristaux blancs.
~ PF : 124-125°C (EtOH)
~ IR (KBr): v 3282, 1618, 1580, 1560, 1532 cm-'
~ 1 H RMN (250 MHz, DMSO-ds): b 3.74 (s, 3H, OCH3), 3.77 (s, 3H, OCH3), 3.93
(s,
3H, OCH3), 6.66 (d, 1 H, J = 8.8 Hz, HA~), 6.92 (d, 2H, J = 9.0 Hz, HA~), 7.13
(d, 1 H, J =
8.8 Hz, HA,), 7.52 (d, 2H, J = 9.0 Hz, HA~), 7.68 (s, 1 H, =CH), 11.12 (s
large, 1 H, NH).
13C RMN (62.90 MHz, DMSO-d6): 8 55.0, 56.2, 56.3, 103.8, 111.2, 113.2 (2),
117:0,
122.0, 128.5, 129.6 (2), 132.1, 135.0, 141.8, 153.2, 157.9, 174.7.
~ MS (ionspray): m/z 312 (M+H)+
~ Anal. calculé pour C~BH~~NOç: C, 69.44; H, 5.50; N, 4.50. Trouvé: C, 69.29;
H, 5.40;
N, 4.55.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
38
EXEMPLE 17
6,7-Diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone(composé 31) -
CRL 8354
a) (27-3-(3,4-Diméthoxyanilino)-2-(4-méthoxyphényl)-2-propénoate d'éthyle
(composé 30)
/ OMe
Me0 ~tOOC
.
Me0 N
H
Une solution de 3,4-diméthoxyaniline (1,76 g, 11,49 mmol) et d'a-formyl-4-
méthoxyphénylacétate d'éthyle (2,81 g, 1,1 eq) dans le toluène (20 ml) est
chauffée à
reflux pendant 18 h. Après refroidissement, le mélange réactionnel est dilué
avec du
toluène (10 ml) puis acidifié par HCI 10%. Après extraction, la phase
organique
obtenue est séchée sur MgS04 puis évaporée.sous pression réduite. Le résidu
est
purifié par chromatographie sur gel de silice (éluant: EP/AcOEt 7/3) pour
donner 2,67
g (65%) du composé 30 sous forme d'un solide jaune pâle.
~ PF : 88-89°C (EtOH)
~ IR (KBr): v 1663, 1620, 1586, 1522, 1513 cm-'
~1 H RMN (250 MHz, CDC13): 8 1.30 (t, 3H, J = 7.2 Hz, CH3), 3.82 (s, 3H,
OCH3), 3.85
(s, 3H, OCH3), 3.87 (s, 3H, OCH3), 4.28 (q, 2H, J = 7.2 Hz, CHz), 6.44 (dd, 1
H, J =
2.8, 9.0 Hz, HAr), 6.63 (d, 1 H, J = 2.8 Hz, HA~), 6.80 (d, 1 H, J = 9.0 Hz,
HA~), 6.88 (d,
2H, J = 8.8 Hz, HA~), 7.26 (d, 2H, J = 8.8 Hz, HA~), 7.31 (d, 1 H, J = 12.5
Hz, =CH),
10.37 (d large, 1 H, J = 12.5 Hz, NH).
13C RMN (62.90 MHz, CDC13): 8 14.5, 55.3, 56.0, 56.3, 59.8, 101.0, 101.5,
106.9,
112.3, 113.4 (2), 130.4 (2), 130.7, 134.9, 144.0, 145.0, 150.0, 158.0, 169.6.
~ MS (ionspray): m/z 358 (M+H)+
~ Anal. calculé pour C2oH23N05: C, 67.21; H, 6.49; N, 3.92. Trouvé: C, 67.49;
H, 6.63;
N, 3.82.
b) 6,7-Diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 31)
CRL 8354
OMe
O /
Me0 ~ ~ I ~ CRL8354
Me0 / NJ
H
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
39
Sous agitation, le composé 30 (900 mg, 2,52 mmol) est additionné par
petites portions et ce, rapidement, à une solution de biphényle (1,18 g) et de
diphényl
éther (8,05 g) chauffée à 250°C. Après 10 min, le chauffage est stoppé.
Lors du
refroidissement, le produit final précipite au sein du milieu réactionnel. Ce
produit est
recueilli par filtration puis rincé abondamment par de l'éther de pétrole.
Après séchage,
667 mg (85%) du composé 31 sont obtenus sous forme de cristaux blancs.
~ PF : 310-311 °C (lavage EtOH)
~ IR (KBr): v 3218, 1618, 1606, 1589, 1547, 1515 cm-'
~ 1 H RMN (250 MHz, DMSO-ds): 8 3.76 (s, 3H, OCH3), 3.83 (s, 3H, OCH3), 3.86
(s,
3H, OCH3), 6.92 (d, 2H, J = 8.8 Hz, HA~), 6.99 (s, 1 H, HA~), 7.54 (s, 1 H,
HA~), 7.65 (d,
2H, J = 8.8 Hz, HAN), 7.97 (s, 1 H, =CH), 11.74 (s large, 1 H, NH).
13C RMN (62.90 MHz, DMSO-ds): 8 55.0, 55.4, 55.6, 98.9, 104.7, 113.2 (2),
118.5,
119.7, 128.8, 129.4 (2), 134.8, 135.9, 146.6, 152.7, 157.8, 173.6.
~ MS (ionspray): m/z 312 (M+H)+
~ Anal. calculé pour C~8H~7N04: C, 69.44; H, 5.50; N, 4.50. Trouvé: C, 69.19;
H, 5.33;
N, 4.65.
EXEMPLE18:
5,7-Diméthoxy-3-(4-méthdxyphényl)-1,4-dihydro-4-quinolinone (composé 33) -
CRL 8337
a) (Z)-3-(3,5-Diméthoxyanilino)-2-(4-méthoxyphényl)-2-propénoate d'éthyle
(composé 32)
OMe / ~Me
\tOOC \
Me0 N
H
Sous atmosphère d'azote, 4,59 g (29,96 mmol) de 3,5-diméthoxyaniline et 7,32 g
(1,1
eq) d'a-formyl-4-méthoxyphénylacétate d'éthyle dans 20 ml de toluène sont
agitées à
reflux pendant 18 h. Après refroidissement, le mélange réactionnel est diluë
avec du
toluène (20 ml), acidifié avec HCI à10% et extraite. La phase organique est
séchée sur
MgS04 , filtrée puis évaporée sous pression réduite. Le résidu obtenu est
repris dans du
méthanol où le composé 32 cristallise. Le produit est recueilli par
filtration. Le filtrat est,
3o quant à lui, entreposé dans un congélateur à -78 °C où le composé 32
cristallise de
nouveau. Les deux portions réunies conduisent à l'obtention de 6,10 g (57%) du
composé 32 (isomère Z).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
~ PF : 93-94°C (EtOH)
~ IR (KBr): v 1666, 1608, 1588, 1513 cm~'
~ 1 H RMN (250 MHz, CDC13): 8 1.30 (t, 3H, J = 7.2 Hz, CH3), 3.78 (s, 6H,
OCH3),
3.84 (s, 3H, OCH3), 4.26 (q, 2H, J = 7.2 Hz, CHz), 6.13-6.16 (m, 3H, HA~),
6.89 (d, 2H,
s J = 7.5 Hz, HA~), 7.25-7.34 (m, 3H, HA~ + =CH), 10.27 (d large, 1 H, J =
12.5 Hz, NH).
13C RMN (62.90 MHz, CDCI3): 8 14.4, 55.2, 55.3, 55.4, 59.9, 94.0 (2), 94.5,
102.6,
113.3 (2), 130.1, 130.6 (2), 142.5, 142.8, 158.1, 161.8 (2), 169.4.
~ MS (ionspray): m/z 358 (M+H)+
1o b) 5,7-Diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 33)
-
CRL 8337
OMe O / OMe
/ ~ - CRL8337
Me0 N
H
Le composé 32 (3,1 g, 8,67 mmol) est additionné par petites portions et ce,
rapidement, à une solution de biphényle (8,45 g) et de diphényl éther (21,13
g)
15 chauffée à 250°C. Après 10 min, le chauffage est stoppé. Lors du
refrôidissement, le
produit final précipite au sein du milieu réactionnel. Le produit est
recueilli par filtration
puis rincé par de l'éther de pétrole. Après séchage, 900 mg du composé final
33 sont
obtenus sous forme de cristaux blancs. Le filtrat est, quant à lui, évaporé
puis repris
par de l'éther de pétrole pour donner une pâte visqueuse. Le surnageant est
éliminé
2o et le résidu est dissous dans de l'acétate d'éthyle où le produit final
précipite de
nouveau. Après filtration sur verre fritté et séchage, 750 mg du composé 33
sont
recueillis. Le rendement global de la réaction est de 62%.
~ PF : 262-263°C (lavage EtOH)
~ IR (KBr): v 3261, 1625, 1606, 1557, 1519, 1511 cm-'
25 ~ 1 H RMN (250 MHz, DMSO-d6): b 3.76 (s, 6H, OCH3), 3.82 (s, 3H, OCH3),
6.30 (d,
1 H, J = 2.0 Hz, HAr), 6.49 (d, 1 H, J = 2.0 Hz, H,~r), 6.90 (d, 2H, J = 7.5
Hz, HA~), 7.52
(d, 2H, J = 7.5 Hz, HA~), 7.75 (s, 1 H, =CH), 11.45 (s large, 1 H, NH).
13C RMN (62.90 MHz, DMSO-ds): 8 55.5, 55.7, 56.1, 91.6, 94.9, 111.8, 113.6
(2),
121.8, 129.2, 130.1 (2), 135.4, 144.0, 158.3, 161.9, 162.2, 174.8.
3o ~ MS (ionspray): m/z 312 (M+H)+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
41
EXEMPLE 19
5-Hydroxy-7-méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé
34) - CRL 8492
OH p / OMe
J
Me0 N
H
Le composé 33 (1,00 g, 3,21 mmol) est solubilisé dans 30 ml de N,N-
diméthylformamide anhydre (DMF). Quinze gouttes de HBr 48% dans H20 sont
additionnés à la solution. La réaction est agitée à 90°C pendant 5 h.
Le DMF est
évaporé et le résidu est repris dans 15 ml de CHZCIZ et 15 ml d'HZO. Après
extraction,
la phase organique est séchée sur MgS04, puis évaporée. Le produit obtenu est
recristallisé dans l'éthanol pour donner 762 mg (80%) du composé 34.
~ PF : 236-237°C (EtOH)
~ IR (KBr): v 3206, 1667, 1610, 1557, 1515, 1448 cm-'
~ 1 H RMN (250 MHz, DMSO-d6): 8 3.77 (s, 3H, OCH3), 3.81 (s, 3H, OCH3), 6.19
(d,
1 H, J = 2.5 Hz, HA~), 6.43 (d, 1 H, J = 2.5 Hz, HA,), 6.96 (d, 2H, J = 8.8
Hz, HA~), 7.60
(d, 2H, J = 8.8 Hz, HAN), 8.07 (s, 1 H, =CH), 12.23 (s large, 1 H, NH), 14.99
(s, 1 H, OH).
13C RMN (62.90 MHz, DMSO-ds): 8 55.1, 55.4, 89.5, 96.4, 108.3, 113.4 (2),
118.0,
126.9, 129.6 (2), 138.5, 141.4, 158.2, 163.0, 163.4, 179.1.
~ MS (ionspray): m/z 298 (M+H)+
EXEMPLE 20
5-Hydroxy-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-d i hydro-4-qu i no l
inone
(composé 35)- CRL 8377
CRL8377
Sous atmosphère d'azote, 760 mg (2,56 mmol) du composé 34 sont solubilisés
dans
15 ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
additionnés
successivement 706 mg de carbonate de potassium (2 eq), puis 0,16 ml d'iodure
de
méthyle (1 eq). La réaction est agitée à température ambiante pendant 2 h. Les
solvants
sont évaporés. Le résidu obtenu est repris dans l'acétate d'éthyle et lavé par
deux fois
par de l'eau. La phase organique obtenue est séchée sur MgS04, puis évaporée
sous
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
42
pression réduite. Le solide brut est lavé avec de l'acétate d'éthyle chaud
pour donner
710 mg (89%) du dérivé 35.
~ PF : 166-167°C (lavage AcOEt)
~ IR (KBr): v 1648, 1615, 1561, 1516 cm-'
~ 1 H RMN (250 MHz, CDCI3): â 3,74 (s, 3H, OCH3), 3.83 (s, 3H, OCH3), 3.88 (s,
3H,
NCH3), 6.17 (d, 1 H, J = 2.5 Hz, HA~), 6.38 (d, 1 H, J = 2.5 Hz, HA~), 6.95
(d, 2H, J = 7.5
Hz, HA~), 7.50 (s, 1 H, =CH), 7.54 (d, 2H, J = 7.5 Hz, HA~), 15.22 (s, 1 H,
OH).
13C RMN (62.90 MHz, DMSO-d6): 8 41.4, 55.3, 55.5, 89.1, 96.4, 109.0, 113.8
(2),
120.0, 126.4, 129.7 (2), 142.0, 142.2, 159.0, 164.3, 165.1, 179.6.
~ MS (ionspray): m/z 312 (M+H)+
~ Anal. calculé pour C~$H~~NO4: C; 69.44; H, 5.50; N, 4.50. Trouvé: C, 69.27;
H, 5.67;
N, 4.47.
EXEMPLE 21
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-trifluorométhanesufonate-1,4-dihydro-
4-quinolinone (composé 36)-CRL8493
F
F F
I/O
Sous atmosphère d'azote, 200 mg (0,64 mmol) du composé 35 sont solubilisés
dans
15 ml de CHZCIZ anhydre et 0,16 ml de pyridine (3 eq) à 0°C. A cette
solution sont
additionnés 0,32 ml d'anhydride triflique (3 eq) à 0°C. La réaction est
agitée à
température ambiante pendant 1,5 h. Les solvants sont évaporés. Le résidu
obtenu est
repris dans le CHZCIZ et lavé par deux fois par une solution saturée
d'hydrogénocarbonate de sodium. La phase organique obtenue est séchée sur
MgS04,
puis évaporée sous pression réduite. Le résidu est purifié par
chromatographie' sur
colonne de silice (éluant: AcOEt/EP 4:6) pour donner 201 mg (71 %) du dérivé
36.
~ PF : 184-185°C
~ IR (KBr): v 1628, 1593, 1513 cm-'
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
43
~ 1 H RMN (250 MHz, CDC13): â 3,76 (s, 3H, NCH3), 3.81 (s, 3H, OCH3), 3.94 (s,
3H,
OCH3), 6.71 (s, 1 H, HA~), 6.74 (s, 1 H, HA~), 6.89 (d, 2H, J = 8.5 Hz, HA~),
7.51 (d, 2H, J
= 8.5 Hz, HA~), 7.52 (s, 1 H, =CH).
13C RMN (62.90 MHz, DMSO-ds): b 41.2, 55.1, 56.4, 99.5, 106.7, 113.2, 113.4
(2),
121.1, 127.2, 129.8 (2), 143.0, 143.1, 149.0, 158.3, 160.9, 172.9.
~ MS (ionspray): m/z 444 (M+H)+
EXEMPLE 22
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-vinyl-1,4-dihydro-4-quinolinone
(composé 37)-CRL8494
OMe
\ U
Me0 / N
CH3
Sous atmosphère d'azote, 62 mg de tétrakistriphénylphosphine palladium (0) et
54
mg de chlorure de lithium sont mis en suspension dans 4 ml de N,N-
diméthylformamide
(DMF) anhydre. Parallèlement, 400 mg (0,90 mmol) du composé 36 et 0,4 ml (1,5
eq) de
vinyltributylétain sont dissous dans 10 ml de N,N-diméthylformamide (DMF)
anhydre. A
l'aide d'une aiguille de transfert, la solution contenant le triflate est
versée à la première
solution. Le mélange réactionnel final est agité à 90°C pendant 1,5 h.
Après
refroidissement, le solvant est évaporé. Le résidu est repris avec de
l'acétate d'éthyle,
puis lavé par une solution de fluorure de potassium à 10%. La phase organique
obtenue
2o est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu est
purifié par
chromatographie sur colonne de silice (éluant: CHZCIZ/AcOEt 7:3) pour donner
200 mg
(69%) du composé 37.
~ PF : 130-131 °C (AcOEt/EP)
~ IR (KBr): v 1624, 1603, 1582, 1506 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 3.68 (s, 3H, NCH3), 3.80 (s, 3H, OCH3), 3.90 (s,
3H,
OCH3), 5.29 (dd, 1 H, J = 1.8, 11.00 Hz, =CHZ), 5.45 (dd, 1 H, J = 1.8, 17.3
Hz, =CHZ),
6.59 (s, 1 H, HA~), 6.89 (d, 2H, J = 8.8 Hz, HA~), 6.91 (s, 1 H, HAN), 7.45
(s, 1 H, =CH),
7.52 (d, 2H, J = 8.8 Hz, HA~), 8.10 (dd, 1 H, J = 11.0, 17.3 Hz, CH"inye)~
13C RMN (62.90 MHz, CDC13): 8 41.3, 55.2, 55.4, 97.4, 111.7, 113.5 (2), 114.4,
118.8, 122.5, 127.8, 129.9 (2), 139.8, 140.8, 142.8, 144.2, 158.6, 161.3,
177.2.
~ MS (ionspray): m/z 322 (M+H)+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
44
~ Anal. calculé pour CZOH,9N03: C, 74.75; H, 5.96 N, 4.36. Trouvé: C, 74.97;
H, 6.16;
N, 4.44.
EXEMPLE 23
5-Ethyl-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-quinolinone
(composé 38) )- CRL 8393
OMe
O
\
Me0 / N
CHI
Sous atmosphère d'azote, 200 mg (0,62 mmol) du composé 37 sont solubilisés
dans
ml d'acétate d'éthyle. A cette solution sont additionnés 20 mg de palladium
sur
10 charbon (10%). L'hydrogénation est effectuée à l'aide d'un appareil de Parr
sous 50 psi
d'hydrogène à température ambiante pendant 7 h. Le catalyseur est éliminé par
filtration
sur célite. Le filtrat est évaporé sous pression réduite. Le résidu est
purifié par
chromatographie sur colonne de silice (éluant: CHzCl2/AcOEt 9:1 ) pour donner
160 mg
(79%) du composé 38.
15 ~ PF : 124-125°C (AcOEt)
~ IR (KBr): v 1634, 1610, 1586, 1557, 1508 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.29 (t, 3H, J = 7.2 Hz, CH3), 3.44 (q, 2H, J =
7.2 Hz,
CHZ), 3.67 (s, 3H, NCH3), 3.80 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 6.51 (d, 1
H, J = 2.5
Hz, HAr), 6.74 (d, 1 H, J = 2.5 Hz, HAr), 6.91 (d, 2H, J = 8.8 Hz, HAr), 7.44
(S, 1 H, =CH),
7.52 (d, 2H, J = 8.8 HZ, HAr).
13C RMN (62.90 MHz, CDC13): 8 15.4, 28.8, 40.5, 54.4 (2), 94.9, 112.5, 112.6
(2),
118.4, 121.8, 127.4, 129.1 (2), 139.6, 142.7, 149.8, 157.5, 160.3, 176.3.
~ MS (ionspray): m/z 324 (M+H)+
~ Anal. calculé pour C2oH2, N03: C, 74.28; H, 6.55; N, 4.33. Trouvé: C, 74.50;
H, 6.31;
N, 4.50.
EXEMPLE 24
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-phényl-1,4-dihydro-4-qûinolinone
(composé 39)- CRL 8394
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
Me
Me0
Sous atmosphère d'azote, 100 mg (0,22 mmol) du composé 35 et 17 mg de
tétrakistriphénylphosphine palladium (0) sont dissous dans 4 ml de dioxane. La
solution
est agitée à température pendant 30 minutes. 42 mg (1,5 eq) d'acide
phénylboronique
5 dissous dans 2 ml d'éthanol sont additionnés à la solution réactionnelle,
puis 2 ml d'une
solution saturée d'hydrogénocarbonate est ajoutée. Le mélange biphasique est
agité à
reflux pendant 3 h. Après refroidissement, le dioxane est évaporé, la phase
aqueuse
obtenue est extraite avec de l'acétate d'éthyle (2 x 5 ml). La phase organique
est lavée
avec une solution saturée de chlorure de sodium. La phase organique est séchée
sur
1o MgS04, puis évaporée sous pression réduite. Le résidu est purifié par
chromatographie
sur colonne de silice (éluant: CHZCIZ/AcOEt 9:1 ) pour donner 60 mg (71 %) du
composé
39.
~ PF : 204-205°C
~ IR (KBr): v 1635, 1612, 1579, 1558, 1510 cm-'
15- ~ 1 H RMN (250 MHz, CDC13): 8 3.78 (s, 3H, NCH3), 3.80 (s, 3H, OCH3), 3.93
(s, 3H,
OCH3), 6.75 (d, 1 H, J = 2.2 Hz, HA~), 6.77 (d, 1 H, J = 2.2 Hz, HA~), 6.85
(d, 2H, J = 8.8
Hz, HA~), 7.26-7.34 (m, 5H, HAr), 7.48 (d, 2H, J = 8.8 Hz, HAr), 7.53 (s, 1 H,
=CH).
13C RMN (62.90 MHz, CDC13): 8 41.4, 55.4, 55.7, 97.9, 113.6 (2), 115.5, 115.6,
118.8, 122.8, 126.4, 127.5 (2), 128.1 (2), 130.1 (2), 141.2, 143.2, 143.8,
146.8, 158:6,
2o 160.8, 175.7.
~ MS (ionspray): m/z 372 (M+H)+
~ Anal. calculé pour C24H21NOs: C, 77.61; H, 5.70; N, 3.77. Trouvé: C, 77.27;
H,
5.81; N, 3.59.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
46
EXEMPLE 25
5,7-Diméthoxy-3-(4-méthoxyphényl)-1méthyl-1,4-dihydro-4-quinolinone (composé
40) - CRL 8340
OMe O / OMe
- CRL8340
Me0 N
CH3
Sous atmosphère d'azote, 500 mg (1,61 mmol) du composé 33 sont additionnés à
20
ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
successivement
ajoutés 1,66 g de K2C03 anhydre (7,5 eq), puis 0,30 ml d'iodure de méthyle (3
eq). La
réaction est agitée à température ambiante pendant 18 h. Les solvants sont
évaporés.
1o Le résidu est repris dans le CHzCl2 et lavé par deux fois par de l'eau. La
phase
organique obtenue est séchée sur MgS04, puis évaporée sous pression réduite.
Le
résidu brut est purifié sur colonne de silice (éluant: CHZCIZ/AcOEt 9:1 ) pour
donner 418
mg (80%) du dérivé 40.
~ PF : 172-173°C (lavage EtOH)
~ IR (KBr): v 1636, 1610, 1587, 1505 cm-'
~ 1 H RMN (250 MHz, DMSO-d6): 8 3.76 (s, 3H, NCH3), 3.77 (s, 3H, OCH3), 3.79
(s,
3H, OCH3), 3.86 (S, 3H, OCH3), 6.43 (S, 1 H, HA~), 6.49 (S, 1 H, HA,.), 6.91
(d, 2H, J = 8.5
Hz, HA,-), 7.54 (d, 2H, J = 8.5 Hz, HA,.), 7.92 (S, 1 H, =CH).
13C RMN (62.90 MHz, DMSO-ds): b 40.9, 55.0, 55.5, 55.8, 90.5, 94.5, 111.8,
113.1
(2), 121.2, 128.4, 129.7 (2), 141.0, 143.9, 157.8, 161.9, 162.2, 173.9.
~ MS (ionspray): m/z 326 (M+H)+
EXEMPLE 26
1-Allyl-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé
41)-CRL8495 et 4-(Allyloxy)-5,7-diméthoxy-3-(4-méthoxyphenyl)quinoline
(composé 42)CRL 8496
a) 1-Allyl-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone
(composé 41)- CRL8495
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
47
Sous atmosphère d'azote, 200 mg (0,64 mmol) du composé 33 sont additionnés à
10
ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont ajoutés
successivement 666 mg de carbonate de potassium anhydre (7,5 eq), puis 0,17 ml
de
bromure d'allyle (3 eq). Après 5 h d'agitation, 3 eq de bromure d'allyle sont
de nouveau
ajoutés au mélange réactionnel. La réaction est agitée à température ambiante
pendant
18 h. Les solvants sont évaporés. Le résidu obtenu est repris dans l'acétate
d'éthyle et
lavé par deux fois par de l'eau. La phase organique obtenue est séchée sur
MgS04, puis
évaporée sous pression réduite. Le résidu obtenu est purifié par
chromatographie sur
1o colonne de silice (éluant: CHZCIZ/AcOEt 7:3) pour donner 25 mg (11 %) du
composé 42
et 160 mg (71%) du dérivé 41.
~ PF 169-170°C
~ IR (KBr): v 1629, 1610, 1581, 1511 cm-'
~ 1 H RMN (250 MHz, CDCI3): â 3.82 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 3.95 (s,
3H, - .
OCH3), 4.63-4.65 (m, 2H, CHZ), 5.20 (d, 1 H, J = 17.0 Hz, =CH2), 5.32 (d, 1 H,
J = 11.3
Hz, =CH2), 5.92-6.07 (m, 1 H, CH=), 6.27 (d, 1 H, J = 2.0 Hz, HAN), 6.35 (d, 1
H, J = 2.0
Hz, HA~), 6.91 (d, 2H, J = 8.8 Hz, HA~), 7.45 (s, 1 H, =CH), 7.60 (d, 2H, J =
8.8 Hz, HA~).
13C RMN (62.90 MHz, CDCI3): b 55.1, 55.2, 55.6, 56.0, 90.2, 94.2, 112.6, 113.2
(2),
118.1, 123.3, 127.9, 129.9 (2), 131.2, 139.3, 143.3, 158.4, 162.3, 162.8,
175.6.
~ MS (ionspray): m/z 352 (M+H)+
~ Anal. calculé pour C21 H21 NOa: C, 71.78; H, 6.02; N; 3.99. Trouvé: C,
72.03; H,
5.88; N, 3.80.
b) 4-(Allyloxy)-5,7-diméthoxy-3-(4-méthoxyphenyl)quinoline (composé 42)-CRL
8496
i
OMe O~ ~ OMe
\ \ \
/ i
Me0 N
~ huile
~ IR (KBr): v 1617, 1567, 1512 cm-'
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
48
~ 1 H RMN (250 MHz, CDC13): 8 3.87 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 3.96 (s,
3H,
OCH3), 4.16 (d, 2H, J = 6.0 Hz, CH2), 5.01 (d, 1 H, J = 8.5 Hz, =CHZ), 5.15
(d, 1 H, J =
17.0 Hz, =CHZ), 5.78-5.89 (m, 1 H, =CH), 6.56 (d, 1 H, J = 2.0 Hz, HAr), 6.99
(d, 2H, J =
8.8 Hz, HAr), 7.06 (d, 1 H, J = 2.0 Hz, HAr), 7.58 (d, 2H, J = 8.8 Hz, HAr),
8.74 (s, 1 H,
Ha,r).
13C RMN (62.90 MHz, CDCI3): b 55.3, 55.5, 56.0, 75.0, 99.3, 100.5, 111.9,
113.8
(2), 117.8, 125.4, 127.8, 130.8 (2), 133:6, 152.7, 153.2, 157.0, 159.0, 159.8,
160.7.
~ MS (ionspray): m/z 352 (M+H)+
~ Anal. calculé pour C21 H21 NOa: C, 71.78; H, 6.02; N, 3.99. Trouvé: C,
71.67; H,
5.93; N, 4.21.
EXEMPLE 27
1-(3-Butényl)-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone
(composé 43)-CRL 8497 et 4-(3-Butényloxy)-5,7-diméthoxy-3-(4-
méthoxyphényl)quinoline (composé 44)-CRL 8498
a) 1-(3-Butényl)-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone
(composé 43)-CRL 8497 ,
Sous atmosphère d'azote, 500 mg (1,61 mmol) du composé 33 sont additionnés à
10
2o ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont ajoutés
successivement 1,67 g de carbonate de potassium anhydre (7,5 eq), puis 0,82 ml
de 4-
bromobut-1-éne (5 eq). La réaction est agitée à température ambiante pendant
18 h. Les
solvants sont évaporés. Le résidu est repris dans l'acétate d'éthyle et lavé
par deux fois
par de l'eau. La phase organique obtenue est séchée sur MgS04, puis évaporée
sous
pression réduite. Le produit brut est purifié par chromatographie sur colonne
de silice
(éluant: CHZC12/AcOEt 7:3) pour donner 47 mg (8%) du composé 44 et 335 mg
(57%) du
dérivé 43.
~ huile
~ IR (KBr): v 1633, 1612, 1592, 1579 cm~'
~ 1 H RMN (250 MHz, CDC13): b 2.52 (q, 2H, J = 7.0 Hz, CH2), 3.75 (s, 3H,
OCH3),
3.84 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 3.99 (t, 2H, J = 7.0 Hz, CHZ), 5.03
(dd, 1 H, J
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
49
= 1.5, 17.2 Hz, =CHZ), 5.09 (d, 1 H, J = 9.8 Hz, =CH2), 5.67-5.81 (m, 1 H,
=CH), 6.23
(d, 1 H, J = 2.5 Hz, HAr), 6.30 (d, 1 H, J = 2.5 HZ, HAr), 6.84 (d, 2H, J =
8.8 HZ, HAr),
7.34 (s, 1 H, =CH), 7.51 (d, 2H, J = 8.8 Hz, HAr).
13C RMN (62.90 MHz, CDC13): 8 32.3, 53.0, 55.1, 55.2, 56.0, 89.7, 93.9, 112.7,
' 113.1 (2), 118.4, 122.8, 128.0, 129.8 (2), 133.1, 139.6, 142.8, 158.3,
162.3, 162.9,
175.5.
~ MS (ionspray): m/z 352 (M+H)+
~ Anal. calculé pour C22H23NOa: C, 72.31; H, 6.34; N, 3.83. Trouvé: C, 72.63;
H,
6.14; N, 3.72.
1o
b) 4-(3-Butényloxy)-5,7-diméthoxy-3-(4-méthoxyphényl)quinoline (composé 44)-
CRL8498
OMe O / OMe
i
Me0 / NJ
. huile
~ IR (KBr): v 1616, 1568, 1514 crn-'
~ 1 H RMN (250 MHz, CDC13): 8 2.31 (q, 2H, J = 7.0 Hz, CHz), 3.68 (t, 2H, J =
7.0 Hz,
CHZ), 3.86 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 3.96 (s, 3H, OCH3), 4.96-5.03
(m, 2H,
=CHZ), 5.60-5.77 (m, 1 H, =CH), 6.54 (d, 1 H, J = 2.5 Hz, HAr), 6.99 (d, 2H, J
= 8.8 Hz,
HAr), 7.04 (d, 1 H, J = 2.5 Hz, HAr), 7.56 (d, 2H, J = 8.8 Hz, HAr), 8.72 (S,
1 H, HAr).
~ 13C RMN (62.90 MHz, CDCI3): 8 34.4, 55.2, 55.5, 56.0, 73.6, 99.6, 100.4,
111.8,
113.8 (2), 116.5, 125.3, 127.8, 130.8 (2), 134.7, 152.7, 153.2, 156.9, 159.0,
160.2,
160.6.
~ MS (ionspray): m/z 352 (M+H)+
~ Anal. calculé pour C22H23N04: C, 72.31; H, 6.34; N, 3.83. Trouvé: C, 72.56;
H,
6.44; N, 4.02.
EXEMPLE 28
1-[2-(1,3-Dioxolan-2-yl)éthyl]-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 45)-CRL 8499 et 4-[2-(1,3-Dioxolan-2-yl)éthoxy]-5,7-
3o diméthoxy-3-(4-méthoxyphenyl)quinoline(composé 46)-CRL 8500
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
a) 1-[2-(1,3-Dioxolan-2-yl)éthyl]-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-
dihydro-4-
quinolinone (composé 45)-CRL 8499
M
Sous atmosphère d'azote, 500 mg (1,61 mmol) du composé 33 sont additionnés à
5 10 ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
ajoutés
successivement 1,67 g de carbonate de potassium anhydre (7,5 eq), puis 0,94 ml
de 2-
(2-bromoéthyl)-1,3-dioxolane (5 eq). Le milieu réactionnel est agité à
température
ambiante pendant 18 h. Les solvants sont évaporés. Le résidu est repris dans
l'acétate
d'éthyle et lavé par deux fois par de l'eau. La phase organique obtenue est
séchée sur
1o MgS04, puis évaporée sous pression réduite. Le produit brut est purifié par
chromatographie sur colonne de silice (CHZCIZ/AcOEt 7:3) pour donner 139 mg
(21 %) du
composé 46 et 450 mg (68%) du dérivé 45.
~ PF : 141-142°C
~ IR (KBr): v cm-'
15 ~ 1 H RMN (250 MHz, CDC13): â 2.20-2.28 (m, 2H, CHZ), 3.81 (s, 3H, OCH3),
3.90 (s,
3H, OCH3), 3.93 (s, 3H, OCH3), 3.85-4.05 (m, 4H, CH2), 4.18 (t, 2H, J = 7.5
Hz, CH2),
4.97 (t, 1 H, J = 3.8 Hz, CH), 6.34 (d, 1 H, J = 2.2 Hz, HAr), 6.42 (d, 1 H, J
= 2.2 Hz, HAr),
6.90 (d, 2H, J = 8.8 Hz, HAr), 7.48 (s, 1 H, =CH), 7.58 (d, 2H, J = 8.8 Hz,
HAr).
13C RMN (62.90 MHz, CDCI3): 8 31.7, 48.4, 55.2, 55.3, 56.1, 65.1 (2), 89.6,
94.3,
20 101.6, 112.8, 113.3 (2), 123.4, 128.1, 129.9 (2), 139.5, 142.9, 158.5,
162.6, 163.0,
175.6.
~ MS (ionspray): m/z 412 (M+H)+
~ Anal. calculé pour C23H25NO6: C, 67.14; H, 6.12; N, 3.40. Trouvé: C, 67.41;
H,
5.95; N, 3.17.
b) 4-[2-(1,3-Dioxolan-2-yl)éthoxy]-5,7-diméthoxy-3-(4-méthoxyphenyl)quinoline
(composé 46)-CRL 8500
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
51
'o
OMe O / OMe
U
i
Me0 / N
~ hUlle
~ IR (KBr): v 1616, 1568, 1514 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.91 (q, 2H, J = 7.0 Hz, CH2), 3.73-3.88 (m, 6H,
CH2),
3.85 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 3.96 (s, 3H, OCH3), 4.84 (t, 1 H, J =
4.7 Hz,
CH); 6.54 (d, 1 H, J = 2.5 Hz, HAr), 6.98 (d, 2H, J = 8.8 Hz, HA~), 7.05 (d, 1
H, J = 2.5
Hz, HA~), 7.54 (d, 2H, J = 8.8 Hz, HA~), 8.71 (s, 1 H, HA~).
13C RMN (62.90 MHz, CDC13): 8 34.5, 55.2, 55.5, 56.0, 64.7 (2), 70.3, 99.2,
100.3,
102.0, 111.8, 113.8 (2), 125.4, 127.7, 130.8 (2), 152.6, 153.1, 156.9, 159.0,
160.2,
l0 160.7.
~ MS (ionspray): m/z 412 (M+H)+
~ Anal. calculé pour C23H25NOs: C, 67.14; H, 6.12; N, 3.40. Trouvé: C, 66.81;
H,
6.30; N, 3.62.
EXEMPLE 29
N,N-Diéthyl-2-[5,7-diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]acétamide (composé 47) - CRL 8349
CRL8349
Sous atmosphère d'azote, 1,0 g (3,21 mmol) de composé 33 est solubilisé dans
30 ml
de N,N-diméthylformamide (DMF) anhydre. 115 mg (1,5 eq) d'hydrure de sodium,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions~au
milieu réactionnel (réaction exothermique). Le 2-chloro-N,N-diéthylacétamide
(0,88 ml, 2
eq) diluée dans 5 ml de N,N-diméthylformamide (DMF) anhydre est ajouté au
milieu. La
réaction est chauffée pendant 3 h à 90°C. Après refroidissement, de
l'eau est verséé sur
le mélange réactionnel qui est extrait ensuite par de l'acétate d'éthyle (deux
fois). La
phase organique est séchée sur MgS04, puis évaporée sous pression réduite. Le
résidu
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
52
obtenu est purifié par chromatographie sur colonne de silice (CHZCI2/AcOEt
7:3) pour
donner 1,17 g (86%) du composé 47.
~ PF : 245-246°C (lavage EtOH)
~ IR (KBr): v 1655, 1630, 1613, 1581 cm-'
~ ~ H RMN (250 MHz, CDC13): â 1.15 (t, 3H, J = 7.2 Hz, CH3), 1.27 (t, 3H, J =
7.2 Hz,
CH3), 3.40-3.45 (m, 4H, CHZ), 3,81 (s, 3H, OCH3), 3.83 (s, 3H, OCH3), 3.92 (s,
3H,
OCH3), 4.70 (s, 2H, NCHZCO), 5.98 (d, 1 H, J = 2.0 Hz, HAr), 6.32 (d, 1 H, J =
2.0 Hz,
HAr), 6.88 (d, 2H, J = 8.5 HZ, HAr), 7.34 (S, 1 H, =CH), 7.56 (d, 2H, J = 8.5
HZ, HAr).
13C RMN (62.90 MHz, CDC13): 8 13.0, 14.4, 40.9, 41.5, 54.8, 55.1, 55.2, 56.1,
89.8,
94.3, 112.5, 113.2 (2), 123.2, 128.0, 130.0 (2), 140.3, 143.8, 158.4, 162.3,
162.8,
164.8, 175.8.
~ MS (ionspray): m/z 425 (M+H)+
~ Anal. calculé pour C24H28Nz05: C, 67.91; H, 6.65; N, 6.60. Trouvé: C, 68.14;
H,
6.80; N, 6.45.
EXEMPLE 30
2-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo1,4-dihydro-1-quinolinyl]acétate
d'éthyle (composé 48) - CRL 8360 et 2-{[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-
quinolinyl]oxy}acétate d'éthyle (composé 49)-CRL 8502
2o a) 2-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo1,4-dihydro-1-
quinolinyl]acétate
d'éthyle (composé 48) -CRL 8360
OMe
CRL8360
O\
Sous atmosphère d'azote, 150 mg (0,48 mmol) de composé 33 sont solubilisés
dans
10 ml de N,N-diméthylformamide (DMF) anhydre. 173 mg (1,5 eq) d'hydrure de
sodium,
préalablement lavés dans de l'éther de pétrole, sont additionnés par pétites
portions au
milieu réactionnel (réaction exothermique). Une solution de bromoacétate
d'éthyle (0,11
ml, 2 eq) est ajoutée au milieu. La réaction est chauffée pendant 2,5 h à
90°C.~ Après
refroidissement, de l'eau est versée sur le mélange réactionnel qui est
ensuite agité
pendant 15 min. La solution est extraite par de l'acétate d'éthyle (deux
fois). La phase
organique est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu
obtenu
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
53
est purifié par chromatographie sur colonne de silice (CHZCIZ/AcOEt 7:3) pour
donner
et19 mg (10%) du composé 49 et 120 mg (63%) de dérivé 48.
~ PF : 238-239°C (AcOEt/EP)
~ IR (KBr): v 1747,1635, 1614, 1582 cm-1
~ 1 H RMN (250 MHz, CDCI3): 8 1.25 (t, 3H, J = 7.2 Hz, CHZCH3), 3.81 (s, 3H,
OCH3),
3.87 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 4.26 (q, 2H, J = 7.2 Hz, CHZCH3), 4.66
(s, 2H,
CH2C0), 6.07 (d, 1 H, J = 2.0 Hz, HAr), 6.36 (d, 1 H, J = 2.0 Hz, HAr), 6.89
(d, 2H, J =
8.5 Hz, HAr), 7.38 (s, 1 H, =CH), 7.56 (d, 2H, J = 8.5 Hz, HAr).
13C RMN (62.90 MHz, CDC13): 8 14.1, 55.0, 55.2, 55.3, 56.2, 62.2, 89.4, 94.4,
112.5, 113.4 (2), 124.0, 127.7, 130.1 (2), 139.8, 143.6, 158.7, 162.8, 163.2,
167.4,
175.9.
~ MS (ionspray): m/z 398 (M+H)+
~ Anal. calculé pour C22H23N06: C, 66.49; H, 5.83; N, 3.52. Trouvé: C, 66.23;
H,
6.96; N, 3.75.
b) 2-f [5,7-Diméthoxy-3-(4-méthoxyphényl)-4-quinolinyl]oxy}acétate d'éthyle
(composé 49)-CRL 8502
o\/o
OMe OJ'~ / OMe
\
\ \ \/
i
Me0 / N
~ hUlle
~ IR (KBr): v 1739, 1617, 1569, 1514 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.26 (t, 3H, J = 7.2 Hz, CH2CH3), 3.86 (s, 3H,
OCH3),
3.92 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 4.20 (q, 2H, J = 7.2 Hz, CHzCH3), 4.21
(s, 2H,
CHZCO), 6.56 (d, 1 H, J = 2.2 Hz, HAr), 6.99 (d, 1 H, J = 8.8 HZ, HAr), 7.06
(d, 2H, J =
2.2 Hz, HAr), 7.61 (d, 2H, J = 8.8 Hz, HAr), 8.74 (s, 1 H, =CH).
~ 13C RMN (62.90 MHz, CDCI3): 8 14.3, 55.4, 55.7, 56.2, 61.1, 68.3, 99.6,
100.6,
111.3, 114.2 (2), 125.1, 126.9, 130.9 (2), 152.8, 153.4, 156.8, 158.9, 159.4,
161.0,
168.5.
~ MS (ionspray): m/z 398 (M+H)+
~ Anal. calculé pour C22H23N06: C, 66.49; H, 5.83; N, 3.52. Trouvé: C, 66.55;
H,
5.72; N, 3.46.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
s4
EXEMPLE 31
[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]acétonitrile
(composé 50)-CRL 8372 et f[5,7-Diméthoxy-3-(4-méthoxyphényl)-2-
quinolinyl]oxy}acétonitrile (composé 51)-CRL 8503
a) [5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]acétonitrile
(composé 50)- CRL 8372
OMe O / OMe
\ \/
CRL8372
Me0 ~ N
CN
Sous atmosphère d'azote, 200 mg (0,64 mmol) du composé 33 sont solubilisés
dans
15 ml de N,N-diméthylformamide (DMF) anhydre. A cette solution sont ajoutés
successivement 665 mg de carbonate de potassium anhydre (7,5 eq), puis 0,13 ml
de
bromoacétonitrile (3 eq). La réaction est agitée à température ambiante
pendant 18 h. Le
carbonate de potassium est éliminé par filtration et les solvants sont
évaporés. Le résidu
est repris dans l'acétate d'éthyle et lavé par deux fois par de l'eau. La
phase organique
obtenue est séchée sur MgS04, puis évaporée sous pression réduite. Le solide
brut est
recristallisé dans le méthanol pour donner 27 mg (12%) du composé 51 et 140 mg
(62%)
du dérivé 50.
~ PF : 256-257°C (EtOH)
~ IR (KBr): v 2216, 1660, 1607 cm-1
~ 1 H RMN (250 MHz, CDCI3): 8 3.82 (s, 3H, OCH3), 3.96 (s, 6H, OCH3), 4.83 (s,
2H,
CH2), 6.24 (d, 1 H, J = 2.0 Hz, HAr), 6.43 (d, 1 H, J = 2.0 Hz, HAr), 6.91 (d,
2H, J = 8.8
Hz, HAr), 7.34 (s, 1 H, =CH), 7.51 (d, 2H, J = 8.8 Hz, HAr).
13C RMN (62.90 MHz, DMSO-ds): â 39.4, 55.1, 55.8, 56.0, 90.7, 94.8, 111.5,
113.1
(2), 115.9, 122.5, 127.6, 129.7 (2), 139.8, 142.5, 158.2, 162.3, 162.5, 174.2.
2s ~ MS (ionspray): m/z 351 (M+H)+
~ Anal. calculé pour C2pH18N204: C, 68.56; H, 5.18; N, 8.00. Trouvé: C, 68.67;
H,
5.03; N, 7.78.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
b) {[5,7-Diméthoxy-3-(4-méthoxyphényl)-2-quinolinyl]oxy}acetonitrile
(composé 51)-CRL 8503
CN
OMe ~ / OMe
\ \ \/
i
Me0 / N
5 ~ huile
~ IR (KBr): v 1616, 1572, 1516 cm-'
~ 1 H RMN (250 MHz, CDCI3): â 3.88 (s, 3H, OCH3), 3.96 (s, 3H, OCH3), 4.03 (s,
3H,
OCH3), 4.39 (s, 2H, OCHZ), 6.63 (d, 1 H, J = 2.0 Hz, HAr), 7.04 (d, 2H, J =
8.8 Hz, HAr),
7.09 (d, 1 H, J = 2.0 Hz, HAr), 7.55 (d, 2H, J = 8.8 Hz, HAr), 8.77 (s, 1 H,
HAr).
10 ~ 13C RMN (62.90 MHz, CDC13): 8
~ MS (ionspray): m/z 351 (M+H)+
~ Anal. calculé pour C2pH 18N204: C, 68.56; H, 5.18; N, 8.00. Trouvé: C,
68.79; H,
4.95; N, 7.78.
15 EXEMPLE 32
N-[3-(Diméthylamino)propyl]-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 52) - CRL 8357 et N-{2-[5,7-Diméthoxy-3-(4-
méthoxyphényl)-4-quinolyl]oxy}propyl-N,N-diméthylamine (composé 53)-CRL 8504
a) N-[3-(Diméthylamino)propyl]-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
20 quinolinone (composé 52) - CRL 8357
CRL8357
Sous atmosphère d'azote, 300 mg (0,96 mmol) du composé 33 sont solubilisés
dans
20 ml de N,N-diméthylformamide (DMF) anhydre. 35 mg d'hydrure de sodium (1,5
eq),
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions au
25 milieu réactionnel (réaction exothermique). Le chlorure de 3-
diméthylaminopropyle (234
mg, 2 eq) dissous dans 5 ml de N,N-diméthylformamide (DMF) anhydre est ajouté
au
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
56
milieu réactionnel. La réaction est chauffée pendant 2 h à 90°C. Après
refroidissement,
le solvant est évaporé. Le résidu est repris dans le CHZCIZ et l'eau. Après
extraction, la
phase organique est séchée sur MgS04, puis évaporée sous pression réduite. Le
résidu
obtenu est purifié par chromâtographie sur colonne de silice (Et20/MeOH 8:2,
puis
CHZC12/MeOH 9:1 ) pour donner 50 mg (13%) du composé 53 et 191 mg (50%) du
dérivé
52.
~ huile
~ IR (KBr): v 1636, 1609, 1594, 1514 cm-1
~ 1 H RMN (250 MHz, CDC13): â 1.91-1.97 (m, 2H, CHZ), 2.18 (s, 6H, CH3), 2.25
(t,
2H, J = 7.2 Hz, CHz), 3.78 (s, 3H, OCH3), 3.86 (s, 3H, OCH3), 3.90 (s, 3H,
OCH3),
4.07 (t, 2H, J = 7.2 Hz, CHZ), 6.31 (d, 1 H, J = 2.0 Hz, HAr), 6.34 (d, 1 H, J
= 2.0 Hz,
HAr), 6.87 (d, 2H, J = 8.5 HZ, HAr), 7.52 (S, 1 H, =CH), 7.55 (d, 2H, J = 8.5
HZ, HAr).
13C RMN (62.90 MHz, CDC13): s 25.7, 45.0 (2), 51.0, 55.0, 55.2, 55.4, 55.9,
89.7,
94.0, 112.7, 113.4 (2), 122.8, 128.0, 129.8 (2), 139.9, 142.9, 158.2, 162.3,
162.7,
175.5.
~ MS: m/z 397 (M+H)+
~ Anal. calculé pour C23H28N204: C, 69.68; H, 7.12; N, 7.07. Trouvé: C, 70.14;
H,
6.90; N, 7.21.
2o b) N-f2-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}propyl-N,N-
diméthylamine (composé 53)-CRL8504
Me0
~ huile
~ IR (KBr): v 1617, 1568, 1514 1246 cm-'
~ 1 H RMN (250 MHz, CDCI3): â 1.85-1.91 (m, 2H, CHZ), 2.36 (s, 6H, CH3), 2.45
(t, 2H,
J = 7.0 Hz, CHZ), 3.71 (t, 2H, J = 7.0 Hz, CHZ), 3,86 (s, 3H, OCH3), 3.93 (s,
3H,
OCH3), 3.97 (s, 3H, OCH3), 6.56 (d, 1 H, J = 2.2 Hz, HAr), 6.99 (d, 2H, J =
8.8 Hz, HAr),
7.05 (d, 1 H, J = 2.2 HZ, HAr), 7.50 (d, 2H, J = 8.8 Hz, HAr), 8.70 (S, 1 H,
HAr).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
57
13C RMN (62.90 MHz, CDC13): b 26.6, 44.1 (2), 55.5, 55.7, 56.3, 56.4, 72.4,
99.6,
100.7, 111.6, 114.0 (2), 125.6, 127.9, 131.2 (2), 153.0,.. 153.2, 156.7,
158.9, 159.9,
160.9.
~ MS (ionspray): m/z 397 (M+H)+
~ Anal. calculé pour C23H28N204: C, 69.68; H, 7.12; N, 7.07. Trouvé: C, 69.53;
H,
6.92; N, 7.16.
EXEMPLE 33
N-[3-(Diméthylamino)éthyl]-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
l0 quinolinone (composé 54) - CRL 8350 et N-{2-[5,7-Diméthoxy-3-(4-
méthoxyphényl)-
4-quinolyl]oxy}éthyl-N,N-diméthylamine (55)-CRL8505
a) N-[3-(Diméthylamino)éthyl]-5,7-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 54) - CRL 8350
OMe
CRL8350
/N~
Sous atmosphère d'azote, 300 mg (0,96 mmol) du composé 33 sont solubilisés
dans
10 ml de N,N-diméthylformamide (DMF) anhydre. 35 mg d'hydrure de sodium (1,5
eq),
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions au
milieu réactionnel (réaction exothermique). Le chlorure de 3-
diméthylaminoéthyle (206
mg, 2 eq) dissous dans 5 ml de DMF anhydre est ajouté au milieu réactionnel.
La
2o réaction est chauffée pendant 2-3 h à 90°C. Après refroidissement,
le solvant est
évaporé. Le résidu est repris dans le CH2CI2 et l'eau. Après extraction, la
phase
organique est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu
obtenu
est purifié par chromatographie sur colonne de gel de silice traité par de la
triéthylamine
(éluant CH2CI2/MeOH 99,5:0,5) pour donner 55 mg (15%) du composé 55 et 221 mg
2s (60%) du dérivé 54.
~ PF : 172-173°C (EtOH)
~ IR (KBr): v 1637, 1609, 1594, 1514 cm-1
~ 1 H RMN (250 MHz, CDCI3): 8 2.26 (s, 6H, CH3), 2.64 (t, 2H, J = 7.2 Hz,
CHZ), 3.76
(s, 3H, OCH3), 3.84 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 4.03 (t, 2H, J = 7.2
Hz, CHZ),
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
58
6.29 (d, 2H, J = 2.0 Hz, HAr), 6.84 (d, 2H, J = 8.8 Hz, HAr), 7.40 (s, 1 H,
=CH), 7.52 (d,
2H, J = 8.8 Hz, HAr).
13C RMN (62.90 MHz, CDCI3): â 45.6 (2), 51.9, 55.1, 55.2, 56.0, 56.8, 89.5,
94.0,
112.7, 113.2 (2), 123.0, 128.0, 129.9 (2), 139.7, 143.0, 158.3, 162.4, 162.9,
175.5.
~ MS : m/z 383 (M+H)+
~ Anal. calculé pour C22H26N204: C, 69.09; H, 6.85; N, 7.32. Trouvé: C, 68.87;
H,
7.01; N, 7.49.
b) N-{2-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}éthyl-N,N-
1o diméthylamine (55)-CRL8505
I
~N~
OMe Jr / OMe
\ \ u
Me0 ~ N
~ PF : 100-101 °C (EtOH)
~ IR (KBr): v 1616, 1577, 1566, 1512, 1243 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 2.16 (s, 6H, NCH3), 2.46 (t, 2H, J = 6.5 Hz,
NCHZ),
3.73 (t, 2H, J = 6.5 Hz, OCHZ), 3,77 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 3.97
(s, 3H,
OCH3), 6.55 (d, 1 H, J = 2.2 Hz, HAr), 6.99 (d, 2H, J = 8.8 Hz, HAr), 7.05 (d,
1 H, J = 2.2
Hz, HAr), 7.56 (d, 2H, J = 8.8 Hz, HAr), 8.71 (s, 1 H, HAr).
13C RMN (62.90 MHz, CDCI3): 8 45.6 (2), 55.3, 55.5, 56.0, 58.8, 71.7, 99.2,
100.4,
111.8, 113.8 (2), 125.4, 127.7, 130.9 (2), 152.8, 153.3, 157.0, 159.1, 160.5,
160.7.
~ MS (ionspray): m/z 383 (M+H)+
~ Anal. calculé pour C22H26N204: C, 69.09; H, 6.85; N, 7.32. Trouvé: C, 68.87;
H,
6.69; N, 7.47.
EXEMPLE 34
5,8-Diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé 56) -
CRL 8371
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
59 '
OMe O / OMe -
CRL8371
/ N
I
OMe CH3
Sous atmosphère d'azote, 400 mg ( 1,28 mmol) du composé 29 sont additionnés à
20
ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont
successivement
ajoutés 1,33 g de KZC03 anhydre (7,5 eq), puis 0,24 ml d'iodure de méthyle (3
eq). La -
réaction est agitée à température ambiante pendant 18 h. Les solvants sont
évaporés.
Le résidu est repris dans le CHZCIZ et lavé par deux fois par de l'eau. La
phase
organique obtenue est séchée sur MgS04, puis évaporée sous pression réduite.
Le
résidu brut est purifié sur colonne de silice (éluant: CHZCIZ puis AcOEt) pour
donner 313
mg (75%) du dérivé 56.
~ PF : 78-79°C (AcOEt/EP)
~ IR (KBr): v 1630, 1589, 1568, 1511 cm~'
~ 1 H RMN (250 MHz, CDC13): 8 3.82 (s, 3H, NCH3), 3.87 (s, 3H, OCH3), 3.90 (s,
3H,
OCH3), 4.04 (s, 3H, OCH3), 6.70 (d, 1 H, J = 8.8 Hz, HAr), 6.92 (d, 2H, J =
8.8 Hz, HAr),
7.05 (d, 1 H, J = 8.8 Hz, HAr), 7.40 (s, 1 H, =CH), 7.60 (d, 2H, J = 8.8 Hz,
HAr).
~ 13C RMN (62.90 MHz, CDC13): 8 46.8, 55.3, 56.9, 57.1, 105.4, 113.5 (2),
114.9,
120.0, 123.1, 127.8, 130.0 (2), 134.5, 143.4, 143.8, 155.1, 158.6, 176Ø
~ MS (ionspray): m/z 326 (M+H)+
~ Anal. calculé pour ClgH1gN04: C, 70.14; H, 5.89; N, 4.30. Trouvé: C, 69.85;
H,
5.75; N, 4.13.
EXEMPLE 35 : N,N-Diéthyl-2-[5,8-diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-
dihydro-1-quinolinyl]acétamide (composé 57)-CRL 8380
OMe
CRL8380
~N~
Sous atmosphère d'azote, 300 mg (0,96 mmol) du composé 29 sont solubilisés
dans
15 ml de N,N-diméthylformamide (DMF) anhydre. 35 mg (1,44 mmol, 1,5 eq) de
NaH,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions au
milieu réactionnel (réaction exothermique). Le 2-chloro-N,N-diéthylacétamide
(2 eq) est
ajouté. La réaction est chauffée pendant 3 h à 90°C. Après
refroidissement, le solvant
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
est évaporé. Le résidu est repris dans de l'acétate d'éthyle. La phase
organique est'
lavée par de l'eau, séchée sur MgS04, puis évaporée sous pression réduite. Le
résidu
obtenu est purifié par chromatographie sur colonne de silice (CHZCI2/AcOEt
7:3) pour
donner 258 mg (63%) du composé 57.
5 ~ PF : 162-163°C (AcOEt)
~ IR (KBr): v 1653, 1627, 1604, 1570, 1513 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.17 (t, 3H, J = 7.0 Hz, CH3), 1.28 (t, 3H, J =
7.0 Hz,
CH3), 3.36 (q, 2H, J = 7.0 Hz, CHZ), 3.45 (q, 2H, J = 7.0 Hz, CHz), 3,73 (s,
3H, OCH3),
3.80 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 5.02 (s, 2H, CHZCO), 6.65 (d, 1 H, J =
9.0 Hz,
10 HA~), 6.87 (d, 2H, J = 8.8 Hz, HA~), 6.98 (d, 1 H, J = 9.0 Hz, HA~), 7.29
(s, 1 H, =CH),
7.61 (d, 2H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDC13): 8 13.1, 14.1, 40.6, 41.1, 55.2, 57.2, 57.5, 58.5,
105.5, 113.3 (2), 114.9, 119.9, 123.3, 127.7, 130.1 (2), 134.2, 143.2, 143.6,
155.3,
158.6, 166.4, 1'76.1.
15 ~ MS (ionspray): m/z 425 (M+H)+
~ Anal. calculé pour C24H28N205: C, 67.91; H, 6.65; N, 6.60. Trouvé: C, 68.29;
H,
6.78; N, 6.43.
EXEMPLE 36
20 2-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]acétate
d'éthyle (composé 58) - CRL 8381 et 2-{[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-
quinolinyl]oxy}acétate d'éthyle (composé 59)-CRL 8506
a) 2-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]acétate
d'éthyle (composé 58) - CRL 8381
Me
CRL8381
Sous atmosphère d'azote, 300 mg (0,96 mmol) du composé 29 sont solubilisés
dans
15 ml de N,N-diméthylformamide (DMF) anhydre. A 0°C, 35 mg (1,5 eq) de
NaH,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions à la
solution réactionnelle (réaction exothermique). Une solution de bromoacétate
d'éthyle
(0,22 ml, 2 eq) diluée dans 5 ml de DMF est ajoutée au milieu. La réaction est
chauffée
pendant 3 h à 90°C. Après refroidissement, de l'eau est versée sur le
mélange
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
61
réactionnel. La solution réactionnelle est extraite par de l'acétate d'éthyle
(deux fois). La
phase organique obtenue est séchée sur MgS04, puis évaporée sous pression
réduite.
Le résidu obtenu est purifié par chromatographie sur colonne de silice
(CHZCIZ/AcOEt
7:3) pour donner 47 mg (12%) de composé 59 et 212 mg (55%) de dérivé 58.
~ PF : 116-117°C (lavage Et20)
~ IR (KBr): v 1752, 1634, 1592, 1572, 1514 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.28 (t, 3H, J = 7.0 Hz, CH3), 3.77 (s, 3H,
OCH3), -
3.81 (s, 3H, OCH3), 3.85 (s, 3H, OCH3), 4.25 (q, 2H, J = 7.0 Hz, CHZ), 4.90
(s, 2H,
CHZ), 6.69 (d, 1 H, J = 8.8 Hz, HA~), 6.89 (d, 2H, J = 8.8 Hz, HA~), 6.99 (d,
1 H, J = 8.8
Hz, HAr), 7.30 (s, 1 H, =CH), 7.60 (d, 2H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDCI3): 8 14.2, 55.2, 56.5, 56.9, 59.1, 61.4, 105.6, 113.4
(2),
114.1, 119.7, 123.6, 127.5, 130.0 (2), 133.5, 142.9, 142.9, 155.1, 158.7,
168.3, 176.1.
~ MS (ionspray): m/z 398 (M+H)+
~ Anal. calculé pôur C22H23NOs: C, 66.49; H, 5.83; N, 3.52. Trouvé: C, 66.19;
H,
5.96; N, 3.72.
b) 2-{(5,8-Diméthoxy-3-(4-méthoxyphényl)-4-quinolinyljoxy}acétate d'éthyle
(composé 59)-CRL8506
~ PF : 90-91 °C (lavage Et20)
~ IR (KBr): v 1763, 1611, 1590, 1517 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.24 (t, 3H, J = 7.0 Hz, CH3), 3,86 (s, 3H,
OCH3),
3.90 (s, 3H, OCH3), 4.05 (s, 3H, OCH3), 4.20 (q, 2H, J = 7.0 Hz, CHZ), 4.23
(s, 2H,
CHZ), 6.83 (d, 1 H, J = 8.8 Hz, HA~), 6.96 (d, 2H, J = 8.8 Hz, HA~), 7.00 (d,
1 H, J = 8.8
Hz, HA~), 7.63 (d, 2H, J = 8.8 Hz, HA~), 8.88 (s, 1 H, =CH).
13C RMN (62.90 MHz, CDC13): â 14.3, 55.4, 56.2, 56.5, 61.1, 70.1, 106.3,
107.3,
114.2 (2), 116.8, 126.7, 127.6, 131.1 (2), 142.5, 149.2, 149.9, 152.1, 158.4,
159.6,
168.5.
~ MS (ionspray): m/z 398 (M+H)+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
62
~ Anal. calculé pour C22H23NOs: C, 66.49; H, 5.83; N, 3.52. Trouvé: C, 66.17;
H,
6.01; N, 3.67.
EXEMPLE 37
1-[3-(Diméthylamino)propyl]-5,8-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 60)-CRL8507 et N-{2-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-
quinolyl]oxy}propyl-N,N-diméthylamine (composé 61)-CRL 8508 -
a) 1-[3-(Diméthylamino)propyl]-5,8-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 60)-CRL 8507
Sous atmosphère d'azote, 300 mg (0,96 mmol) du composé 29 est solubilisé dans
10
ml de N,N-diméthylformamide (DMF) anhydre. A 0°C, 35 mg (1,5 eq) de
NaH,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions à la
solution réactionnelle (réaction exothermique). Le chlorure de 3-
diméthylaminopropyle
15, (305 mg, 2 eq) dissous dans 5 ml de N,N-diméthylformamide (DMF) anhydre
est ajouté
au milieu réactionnel. La réaction est chauffée pendant 3 h à 90°C.
Après
refroidissement, de l'eau est versée sur le mélange réactionnel. La solution
réactionnelle
est extraite par de l'acétate d'éthyle (deux fois). La phase organique obtenue
est séchée
sur MgS04, puis évaporée sous pression réduite. Le résidu obtenu est purifié
par
2o chromatographie sur colonne de silice (AcOEt/NH3 95:5 puis 1 % MeOH) pour
donner 46
mg (12%) de composé 61 et 283 mg (74%) de dérivé 60.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
63
~ huile
~ IR (film): v 1629, 1598, 1569, 1512 cm~'
~ 1H RMN (250 MHz, CDCI3): b 1.84 (t, 2H, J = 7.0 Hz, CHZ), 2.11 (s, 6H, CH3),
2.11-
2.16 (m, 2H, CH2), 3,77 (s, 3H, OCH3), 3.84 (s, 3H, OCH3), 3.86 (s, 3H, OCH3),
4.42
(t, 2H, J = 7.0 Hz, CHZ), 6.67 (d, 1 H, J = 8.8 HZ, HAr), 6.87 (d, 2H, J = 8.8
HZ, HAr),
6.99 (d, 1 H, J = 8.8 Hz, HAr), 7.52 (s, 1 H, =CH), 7.59 (d, 2H, J = 8.8 Hz,
HAr).
13C RMN (62.90 MHz, CDC13): 8 28.5, 45.0 (2), 55.2, 56.0, 56.1, 56.7, 56.9,
105.5,
113.4 (2), 114.2, 120.5, 122.8, 128.0, 129.9 (2), 133.1, 143.3, 143.5, 155.1,
158.6,
176.2.
~ MS (ionspray): m/z 397 (M+H)+
~ Anal. calculé pour C23H28N204: C, 69.68; H, 7.12; N, 7.07. Trouvé: C, 69.77;
H,
6.80; N, 7.03 .
b) N-~2-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4.-quinolyl]oxy}propyl-N,N-
diméthylamine (composé 61)-CRL 8508
OMe
~ huile
~ IR (film): v 1611, 1588, 1515 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.69-1.75 (m, 2H, CHZ), 2.11 (s, 6H, CH3), 2.19
(t, 2H,
J = 7.0 Hz, CHZ), 3.68 (t, 2H, J = 7.0 Hz, CHZ), 3,84 (s, 3H, OCH3), 3.93 (s,
3H,
OCH3), 4.02 (S, 3H, OCH3), 6.80 (d, 1 H, J = 8.8 HZ, HAr), 6.92 (d, 2H, J =
8.8 Hz, HAr),
7.48 (d, 1 H, J = 8.8 HZ, HAr), 7.56 (d, 2H, J = 8.8 HZ, HAr), 8.84 (S, 1 H,
=CH).
13C RMN (62.90 MHz, CDC13): 8 28.3, 45.4 (2), 55.4, 56.2, 56.5, 56.7, 73.4,
105.9,
107.0, 114.0 (2), 117.4, 127.7, 128.0, 131.1 (2), 142.6, 149.5, 149.9, 152.1,
159.4,
160.1.
~ MS (ionspray): m/z 397 (M+H)+
~ Anal. calculé pour C23H28N204: C, 69.68; H, 7.12; N, 7.07. Trouvé: C, 69.43;
H,
\N~
OMe 0 / OMe
~ , NJ
6.99; N, 6.88.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
64
EXEMPLE 38
N-[3-(Diméthylamino)éthyl]-5,8-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 62) - CRL 8382 et N-{2-[5,8-Diméthoxy-3-(4-
méthoxyphényl)-4-quinolyl]oxy}éthyl-N,N-diméthylamine (composé 63) - CRL 8370
a) N-[3-(Diméthylamino)éthyl]-5,8-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 62) - CRL 8382 -
CRL8382
/N~
Sous atmosphère d'azote, 300 mg (0,96 mmol) du composé 29 sont solubilisés
dans
l0 10 ml de N,N-diméthylformamide (DMF) anhydre. A 0°C, 35 mg (1,5 eq)
de NaH,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions à la
solution réactionnelle (réaction exothermique). Le chlorure de 3-
diméthylaminoéthyle
(280 mg, 2 eq) dissous dans 5 ml de N,N-diméthylformamide (DMF) anhydre est
ajouté
au milieu réactionnel. La réaction est chauffée pendant 3 h à 90°C.
Après
refroidissement, de l'eau est versée sur le mélange réactionnel. La solution
réactionnelle
est extraite par de l'acétate d'éthyle (deux fois). La phase organique obtenue
est séchée
sur MgS04, puis évaporée sous pression réduite. Le résidu obtenu est purifié
par
chromatographie sur colonne de silice (CHZCI2/AcOEt 7:3) pour donner 40 mg (11
%) de
composé 63 et 236 mg (64%) de dérivé 62.
~ PF : 69-70°C (lavage Et20)
~ IR (KBr): v 1627, 1590, 1570, 1514 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 2.23 (s, 6H, CH3), 2.61 (t, 2H, J = 7.0 Hz,
CH2), 3,78
(s, 3H, OCH3), 3.85 (s, 3H, OCH3), 3.87 (s, 3H, OCH3), 4.44 (t, 2H, J = 7.0
Hz, CH2),
6.66 (d, 1 H, J = 9.0 Hz, HA~), 6.88 (d, 2H, J = 8.8 Hz, HA~), 6.99 (d, 1 H, J
= 9.0 Hz,
HA~), 7.44 (S, 1 H, =CH), 7.60 (d, 2H, J = 8.8 Hz, HA,.).
13C RMN (62.90 MHz, CDC13): b 45.8 (2), 55.3, 55.8, 56.5, 56.9, 59.6, 105.4,
113.4
(2), 114.0, 1,20.3, 123.1, 128.0, 130.0 (2), 133.3, 143.1, 143.3, 155.1,
158.6, 176.1.
~ MS (ionspray): m/z 383 (M+H)+
~ Anal. calculé pour C22H26N204~ C, 69.09; H, 6.85; N, 7.32. Trouvé: C, 68.78;
H,
6.67; N, 7.16.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
b) N-~2-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}éthyl-N,N-
diméthylamine (composé 63) - CRL 8370
I
~N~
Jr
OMe
OMe /
J
N
OMe
~ huile
5 ~ IR (film): v 1611, 1582, 1514 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 2.16 (s, 6H, NCH3), 2.48 (t, 2H, J = 6.5 Hz,
CHZ), 3.75
(t, 2H, J = 6.5 Hz, CH2), 3,87 (s, 3H, OCH3), 3.96 (s, 3H, OCH3), 4.05 (s, 3H,
OCH3),
6.82 (d, 1 H, J = 8.8 Hz, HA~), 6.94 (d, 2H, J = 8.8 Hz, HA~), 7.00 (d, 1 H, J
= 9.0 Hz,
HA~), 7.59 (d, 2H, J = 9.0 Hz, HA~), 8.85 (s, 1 H, =CH).
10 ~ 13C RMN (62.90 MHz, CDC13): 8 45.7 (2), 55.5, 56.2, 56.5, 58.9, 71.9,
105.8, 107.1,
114.0 (2), 117.4, 127.7, 128.0, 131.1 (2), 142.6, 149.6, 149.9, 152.1, 159.4,
160.3.
~ MS (ionspray): m/z 383 (M+H)+
~ Anal. calculé pour C22H26N204: C, 69.09; H, 6.85; N, 7.32. Trouvé: C, 68.77;
H,
6.80; N, 7.22 .
EXEMPLE 39
1-[2-( 1,3-Dioxolan-2-yl)éthyl]-5,8-d iméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-
4-
quinolinone (composé 64) -CRL8509 et 4-[2-(1,3-Dioxolan-2-yl)éthoxy]-5,8-
diméthoxy-3-(4-méthoxyphenyl)quinoline (exemple 65)-CRL8510
a) 1-[2-(1,3-Dioxolan-2-yl)éthyl]-5,8-diméthoxy-3-(4-méthoxyphényl)-1,4-
dihydro-4-
quinolinone (composé 64)-CRL8509
Sous atmosphère d'azote, 300 mg (0,96 mmol) du composé 29 sont additionnés à
10
ml de N,N-diméthylformamide (DMF) anhydre. A cette suspension sont ajoutés
successivement 1,00 g de K2C03 anhydre (7,5 eq), puis 0,34 ml de 2-(2-
bromoéthyl)-1,3-
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
66
dioxolane (3 eq). Le milieu réactionnel~est agité à température ambiante
pendant 18 h.
Les solvants sont évaporés. Le résidu est repris dans l'acétate d'éthyle et
lavé par deux
fois par de l'eau. La phase organique obtenue est séchée sur MgS04, puis
évaporée
sous pression réduite. Le produit brut est purifié par chromatographie sur
colonne de
silice (AcOEt puis AcOEt/MeOH 95:5) pour donner 105 mg (26%) du composé 65 et
240
mg (61 %) du dérivé 64.
~ huile
~ IR (film): v 1631, 1596, 1568, 1512 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 2.12-2.19 (m, 2H, CHz), 3.81 (s, 3H, OCH3), 3.89
(s,
3H, OCH3), 3.90 (s, 3H, OCH3), 3.80-3.97 (m, 4H, CH2), 4.53 (t, 2H, J = 7.2
Hz, CHZ),
4.83 (t, 1 H, J = 4.4 Hz, CH), 6.70 (d, 1 H, J = 9.0 Hz, HAr), 6.91 (d, 1 H, J
= 8.8 Hz, HAr),
7.03 (d, 2H, J =.9.0 Hz, HA~), 7.49 (s, 1 H, =CH), 7.62 (d, 2H, J = 8.8 Hz,
HA~).
13C RMN (62.90 MHz, CDCI3): 8 34.7, 53.5, 55.4, 56.7, 57.1, 65.1 (2), 102.0,
105.7,
113.6 (2), 114.2, 120.6, 123.3, 128.1, 130.1, 133.3 (2), 143.0, 143.4, 155.3,
158.7,
176.3.
~ MS (ionspray): m/z 412 (M+H)+
~ Anal. calculé pour C23H25N04: C, 67.14; H, 6.12; N, 3.40. Trouvé: C, 66.82;
H,
6.28; N, 3.31.
2o b) 4-[2-(1,3-Dioxolan-2-yl)éthoxy]-5,8-diméthoxy-3-(4-
méthoxyphenyl)quinoline
(composé 65)-CRL8510
o~
~,o
OMe O / OMe
\ \
~ , NJ
OMe
~ huile
~ IR (film): v 1611, 1584, 1572, 1517 cm-'
~ 1 H RMN (250 MHz, CDC13): â 1.86-1.93 (m, 2H, CHZ), 3.70-3.84 (m, 6H, CHZ),
3.81
(s, 3H, OCH3), 3.91 (s, 3H, OCH3), 4.00 (s, 3H, OCH3), ; 4.80 (t, 2H, J = 5.0
Hz, CH),
6.77 (d, 1 H, J = 8.5 Hz, HA~); 6.90 (d, 1 H, J = 8.5 Hz, HA~), 6.96 (d, 2H, J
= 8.5 Hz,
HAr), 7.55 (d, 2H, J = 8.5 Hz, HA~). 8.81 (s, 1 H, =CH).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
67
13C RMN (62.90 MHz, CDC13): 8 34.5, 53.5, 56.1, 56.3, 64.7 (2), 70.5, 102.0,
105.7,
107.0, 113.9 (2), 117.2, 127.5, 127.9, 131.0 (2), 142.4, 149.4, 149.7, 152.0,
159.3,
159.9.
~ MS (ionspray): m/z 412 (M+H)+
~ Anal. calculé pour C23H25NOa: C, 67.14; H, 6.12; N, 3.40. Trouvé: C, 67.31;
H,
6.36; N, 3.56.
EXEMPLE 40
5-Hydroxy-8-méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone (composé
66)-CRL 8391
OMe
OH O
\ \
J
N
H
OMe
Sous atmosphère d'azote, 1,00 g (3,22 mmol) du composé 29 est solubilisé dans
15
ml de N,N-diméthylformamide (DMF) anhydre, puis 10 gouttes d'une solution
d'HBr à
48% dans H20 sont additionnées. La réaction est agitée à reflux pendant 2 h.
Les
solvants sont évaporés. Le résidu est repris dans le CHzCl2 et lavé par deux
fois par de
l'eau. La phase organique obtenue est séchée sur MgS04, puis évaporée sous
pression
réduite. Le résidu brut est purifié sur colonne de silice (éluant:
CH2C12/AcOEt 9:1 ) pour
donner 850 mg (89%) du dérivé 66.
~ PF : 169-170°C (EtOH)
~ IR (KBr): v 3254, 3222, 1651, 1612, 1589, 1567, 1515 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 3.71 (s, 3H, OCH3), 3.84 (s, 3H, OCH3), 6.55 (d,
1 H, J
= 8.8 Hz, HA~), 6.86 (d, 2H, J = 8.8 Hz, HAN), 6.92 (d, 1 H, J = 8.8 Hz, HA~),
7.43 (d, 2H,
J = 8.8 Hz, HA~), 7.56 (s, 1 H, =CH), 10.21 (s large, 1 H, NH), 13.56 (s, 1 H,
OH).
13C RMN (62.90 MHz, CDC13): 8 55.3, 56.4, 106.5, 113.1, 113.9 (2), 114.0,
120.9,
126.7, 129.9 (2), 130.3, 137.3, 139.4, 154.3, 158.9, 180.6.
~ MS (ionspray): m/z 298 (M+H)+
~ Anal. calculé pour C"H,5N04: C, 68.68; H, 5.09; N, 4.71. Trouvé: C, 69.03;
H, 5.32;
N, 4.66.
3o EXEMPLE 41
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
68
5-Hydroxy-8-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-quinolinone
(composé 67) - CRL 8392
OMe
OH O /
N
OMe CH3
Sous atmosphère d'azote, 850 mg (2.86 mmol) du composé 66 sont solubilisés
dans -
15 ml de N,N-diméthylformamide (DMF) anhydre. A cette solution sont
successivement
ajoutés 790 mg de KZC03 anhydre (2 eq), puis 0,18 ml ml d'iodure de méthyle (1
eq). La
réaction est agitée à température ambiante pendant 18 h. Les solvants sont
évaporés.
Le résidu est repris dans le CH2C12 et lavé par deux fois par de l'eau. La
phase
organique obtenue est séchée sur MgS04, puis évaporée sous pression réduite.
Le
1o résidu brut est purifié sur colonne de silice (éluant: CH2CI2/AcOEt 9:1 )
pour donner 863
mg (97%) du dérivé 67.
~ PF : 140-141 °C (AcOEt/EP)
~ I R (KBr): v 1636, 1621, 1571, 1563, 1517 cm~'
~ 1 H RMN (250 MHz, CDC13): â 3.84 (s, 3H, NCH3), 3.85 (s, 3H, OCH3), 4.15 (s,
3H,
OCH3), 6.68 (d, 1 H, J = 8.8 Hz, HAr), 6.96 (d, 2H, J = 8.8 Hz, HA~), 7.11 (d,
1 H, J = 8.8
Hz, HA~), 7.53 (s, 1 H, =CH), 7.54 (d, 2H, J = 8.8 Hz, HAN), 14.80 (s, 1 H,
OH).
13C RMN (62.90 MHz, CDC13): 8 47.3, 55.4, 57.8, 108.8, 113.8 (2), 115.4,
118.2,
120.0, 126.5, 129.8 (2), 131.9, 141.0, 145.5, 156.6, 158.9, 179.9.
~ MS (ionspray): m/z 312 (M+H)+
~ Anal. calculé pour C~BH"N04: C, 69.44; H, 5.50; N, 4.50. Trouvé: C, 69.76;
H, 5.32;
N, 4.69.
EXEMPLE 42
8-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-trifluorométhanesufonate-1,4-dihydro-
4-quinolinone (composé 68)-CRL8511
F
F~F
O
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
69
Sous atmosphère d'azote, 400 mg (1,28 mmol) du composé 67 sont solubilisés
dans
15 ml de CH2CIz anhydre et 0,32 ml de pyridine (3 eq) à 0°C. A cette
solution sont
additionnés 0,65 ml d'anhydride triflique (3 eq) dilué dans 5 ml de CH2C12
anhydre à 0°C.
La réaction est agitée à température ambiante pendant 1,5 h. Les solvants sont
évaporés. Le résidu obtenu est repris dans le CHZCIZ et lavé par deux fois par
une
solution saturée d'hydrogénocarbonate de sodium. La phase organique obtenue
est
séchée sur MgS04, puis évaporée sous pression réduite. Le produit brut est
recristallisé
dans l'acétate d'éthyle pour donner 397 mg (70%) du dérivé 68.
~ PF : 179-180°C (AcOEt)
~ IR (KBr): v 1630, 1610, 1592, 1560, 1515 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 3.78 (s, 3H, NCH3), 3.93 (s, 3H, OCH3), 4.05 (s,
3H,
OCH3), 6.85 (d, 2H, J = 8.8 Hz, HA~), 6.98 (d, 1 H, J = 8.8 Hz, HAr), 7.03 (d,
1 H, J = 8.8
Hz, HA~), 7.46 (s, 1 H, =CH), 7.53 (d, 2H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDC13): 8 46.3, 54.4, 55.6, 110.8, 112.8 (2), 116.1,
121.1,
122.4, 125.9, 128.9 (2), 132.7, 141.2, 143.6, 149.2, 158.0, 173Ø
~ MS (ionspray): m/z 444 (M+H)+
EXEMPLE 43
8-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-vinyl-1,4-dihydro-4-quinolinone
(composé 69)-CRL8512
Sous atmosphère d'azote, 31 mg (6% mol) de tétrakistriphénylphosphine
palladium
(0) et 54 mg de chlorure de lithium sont mis en suspension dans 2 ml de N,N-
diméthylformamide anhydre. Parallèlement, 200 mg (0,45 mmol) du composé 68 et
0,2
2s ml (1,5 eq) de vinyltributylétain sont dissous dans 5 ml de N,N-
diméthylformamide
anhydre. A l'aide d'une aiguille de transfert, la solution contenant le
triflate est versée à
la première solution. Le mélange réactionnel final est agité à reflux pendant
1 h 30.
Après refroidissement, le solvant est évaporé. Le résidu est repris avec de
l'acétate
d'éthyle, puis lavé par une solution de fluorure de potassium à 10%. La phase
organique
3o obtenue est séchée sur MgS04, puis évaporée sous pression réduite. Le
résidu est
purifié par chromatographie sur colonne de silice (éluant: EP/AcOEt 6:4) pour
donner
123 mg (85%) du composé 69.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
~ PF : 104-105°C (lavage Et20)
~ IR (KBr) : v 1623, 1591, 1560, 1514 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 3.80 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 4.02 (s,
3H,
NCH3), 5.17 (dd, 1 H, J = 1.9, 10.7 Hz, =CHZ), 5.30 (dd, 1 H, J = 1.9, 17.5
Hz, =CHZ),
5 6.90 (d, 2H, J = 8.8 Hz, HAr), 7.00 (d, 1 H, J = 8.3 Hz, HAr), 7.21 (d, 1 H,
J = 8.3 Hz,
HAr), 7.42 (s, 1 H, =CH), 7.58 (d, 2H, J = 8.8 Hz, HAr), 7.97 (dd, 1 H, J =
10.7, 17.5 Hz,
CHvinyle)~
13C RMN (62.90 MHz, CDC13): 8 47.1, 55.3, 56.2, 112.0, 112.9, 113.5 (2),
122.1,
124.0, 126.7, 127.8, 129.8 (2), 132.8, 134.1, 140.3, 144.0, 149.7, 158.6,
177Ø
10 ~ MS (ionspray): m/z 322 (M+H)+
~ Anal. calculé pour C2oH,9N03: C, 74.75; H, 5.96; N, 4.36. Trouvé: C, 74.53;
H, 5.78;
N, 4.10.
EXEMPLE 44
15 5-Ethyl-8-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-quinolinone
(composé 70) - CRL 8414
Sous atmosphère d'azote, 190 mg (0,60 mmol) du composé 69 sont solubilisés
dans
15 ml d'acétate d'éthyle. A cette solution sont additionnés 19 mg de palladium
sur
2o charbon (10%). L'hydrogénation est effectuée à l'aide d'un appareil de Parr
sous 50 psi
d'hydrogène à température ambiante pendant 7 h. Le catalyseur est éliminé par
filtration
sur célite. Le filtrat est évaporé sous pression réduite. Le résidu est
purifié par
chromatographie sur colonne de silice (éluant: CHZCI2/AcOEt 9:1 ) pour donner
155 mg
(81 %) du composé 70.
25 ~ PF : 94-95°C (AcOEt)
~ IR (KBr) : v 1624, 1588, 1567, 1511 cm-'
~ 1 H RMN (250 MHz, CDCI3): b 1.27 (t, 3H, J = 7.2 Hz, CH3), 3.37 (q, 2H, J =
7.2 Hz,
CH2), 3.82 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 4.03 (s, 3H, NCH3), 6.94 (d, 2H,
J = 8.8
Hz, HAr), 7.00 (d, 1 H, J = 8.3 Hz, HAr), 7.04 (d, 1 H, J = 8.3 Hz, HAr), 7.43
(s, 1 H, =CH),
30 7.56 (d, 2H, J = 8.8 Hz, HAr).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
71
13C RMN (62.90 MHz, CDC13): 8 17.0, 29.4, 47.1, 55.5, 56.5, 113.6, 113.9 (2),
122.8, 125.3, 127..5, 128.4, 130.1 (2), 134.1, 139.9, 143.8, 148.5, 158.8,
177.6.
~ MS (ionspray): m/z 324 (M+H)+
~ Anal. calculé pour CZOH2,N03: C, 74.28; H, 6.55; N, 4.33. Trouvé: C, 74.50;
H, 6.41;
N, 4.23.
EXEMPLE 45
8-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-phényl-1,4-dihydro-4-quinolinone
(composé 71) - CRL 8405
CRL8405
Sous atmosphère d'azote, 200 mg (0,45 mmol) du composé 68 et 32 mg de
tétrakistriphénylphosphine palladium (0) sont dissous dans 8 ml de dioxane. La
solution
est agitée à température ambiante pendant 30 minutes. L'acide phénylboronique
(84 mg,
1,5 eq) dissous dans 5 ml d'éthanol est additionné à la solution
réactionnelle, puis 5 ml
d'une solution saturée d'hydrogénocarbonate est ajoutée. Le mélange biphasique
est
agité à reflux pendant 3 h. Après refroidissement, le dioxane est évaporé, la
phase
aqueuse obtenue est extraite avec de l'acétate d'éthyle (2 x 5 ml). La phase
organique
est lavée avec une solution saturée de chlorure de sodium. La phase organique
est
séchée sur MgS04, puis évaporée sous pression réduite. Le résidu est purifié
par
2o chromatographie sur colonne de silice (éluant: AcOEt/EP 6:4) pour donner
105 mg
(60%) du composé 71.
~ PF : 180-181 °C (AcOEt)
~ IR (KBr) : v 1629, 1588, 1565, 1511 cm''
~ 1 H RMN (250 MHz, CDC13): s 3.78 (s, 3H, OCH3), 4.00 (s, 3H, OCH3), 4.12 (s,
3H,
NCH3), 6.86 (d, 2H, J = 8.8 Hz, HAr), 7.03 (d, 1 H, J = 8.3 Hz, HAr), 7.09 (d,
1 H, J = 8.3
Hz, HAr), 7.23-7.32 (m, 5H, HAr); 7.48 (S, 1 H, =CH), 7.52 (d, 2H, J = 8.8 Hz,
HAr).
13C RMN (62.90 MHz, CDC13): 8 47.2, 55.4, 56.5, 112.3, 113.7 (2), 122.5,
125.8,
126.9, 127.4 (2), 127.5, 128.1, 128.3 (2), 130.1 (2), 133.3, 136.4, 144.2,
144.4, 149.7,
158.7, 175.6.
~ SM (ionspray): m/z 372 (M+H)+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
72
~ Anal. calculé pour CZ4HZ,N03: C, 77.61; H, 5.70; N, 3.77. Trouvé: C, 77.87;
H, 5.89; '
N, 3.69.
EXEMPLE 46
5-Benzylamino-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-
quinolinone (composé 72) - CRL8424
CRL8424
Dans un tube scellé, le composé 36 (200 mg, 0,45 mmol) et la benzylamine (0,24
ml,
2,2 mmol) sont dissous dans le dioxane (2 ml). La solution finale est chauffée
à 100°C
pendant 16 h. Après refroidissement et évaporation du solvant, le résidu est
purifié par
chromatographie sur colonne de silice traitée avec de la triéthylamine
(éluant: EP/AcOEt
4:6) pour donner 150 mg (83%) du dérivé 72.
~ PF : 176-177°C (AcOEt)
~ IR (KBr): v 3174, 1632, 1607, 1570, 1557, 1508, 1471 cm-'
~ 1 H RMN (250 MHz, CDCI3): b 3.62 (s, 3H, NCH3), 3.77 (s, 3H, OCH3), 3.82 (s,
3H,
CH3), 4.44 (d, 2H, J = 5.6 Hz, CHz), 5.85 (s, 1 H, HA~), 5.87 (s, 1 H, HA~),
6.94 (d, 2H, J
= 8.8 Hz, HAr), 7.22-7.33 (m, 3H, HAr), 7.38-7.41 (m, 3H, =CH + HAN), 7.48 (d,
2H, J =
8.8 Hz, HA~), 11.02 (t, 1 H, J = 5.6 Hz, NH).
13C RMN (62.90 MHz, CDC13): 8 41.6, 47.3, 55.2, 55.5, 85.2, 89.7, 108.1, 113.8
(2),
122.0, 127.1, 127.4 (2), 128.1, 128.7 (2), 130.2 (2), 138.8, 140.5, 144.4,
153.8, 158.8,
163.6, 178.9.
~ SM (ionspray): m/z 401 (M+1 )+
~ Anal. calculé pour C25H24N20s: C, 74.98; H, 6.04; N, 6.99. Trouvé: C, 75.25;
H,
5.89; N, 7.13.
EXEMPLE 47
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
73
3-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]propanoate
de méthyle (composé 73) - CRL 8404
OMe
CRL8404
Sous atmosphère d'azote, 400 mg (1,30 mmol) du composé 33 sont additionnés à
15 ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement 1,33 g de KZC03 anhydre (7,5 eq), puis 0,5 ml de 3-
bromopropionate
d'éthyle (3 eq). Le milieu réactionnel est agité à température ambiante
pendant 18 h. Les
solvants sont évaporés. Le résidu est repris dans l'acétate d'éthyle puis lavé
par deux
fois par de l'eau. La phase organique obtenue est séchée sur MgS04, puis
évaporée
1o sous pression réduite. Le produit brut est purifié par chromatographie sur
colonne de
silice (CHZC12/MeOH 98:2) pour donner 170 mg (32%) du dérivé 73.
~ PF : 128-129°C (AcOEt)
~ IR (KBr): v1720, 1634, 1609, 1590, 1513 cm-1
~ 1 H RMN (250 MHz, CDCI3): 8 1.22 (t, 3H, J = 7.2 Hz, CH3), 2.86 (t, 2H, J =
6.8 Hz,
CHZ), 3.81 (s, 3H, OCH3), 3.91 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 4.15 (q, 2H,
J =
6.8 Hz, CH2), 4.37 (t, 2H, J = 6.5 Hz, CHZ), 6.30 (d, 1 H, J = 2.0 Hz, HAN),
6.36 (d, 1 H, J
= 2.0 Hz, HA~), 6.90 (d, 2H, J = 8.8 Hz, HA~), 7.57 (d, 2H, J = 8.8 Hz,
HA~),7.59 (s, 1 H,
=CH).
13C RMN (62.90 MHz, CDC13): 8 14.2, 33.2, 49.2, 55.4, 55.6, 56.4, 61.5, 89.8,
94.4,
112.9, 113.6 (2), 123.6, 128.0, 130.3 (2), 140.1, 142.8, 158.8, 162.9, 163.4,
170.8,
175.8.
~ MS (ionspray): m/z 412 (M+H)+
~ Anal. calculé pour C23HZSNOs: C, 67.14; H, 6.12; N, 3.40. Trouvé: C, 67.37;
H, 5.89;
N, 3.47.
EXEMPLE 48 : '
3-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]propanenitrile (composé 74) - CRL 8412
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
74
CN
Sous atmosphère d'azote, 300 mg (1,00 mmol) du composé 33 sont additionnés à
15 ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés _
successivement 1,00 g de KzC03 anhydre (7,5 eq), puis 0,37 ml de 3-
bromopropionitrile
s (3 eq). Le milieu réactionnel est agité à température ambiante pendant 24 h.
Les
solvants sont évaporés. Le résidu est repris dans l'acétate d'éthyle et lavé
par deux fois
par de l'eau. La phase organique obtenue est séchée sur MgS04, puis évaporée
sous
pression réduite. Le produit brut est purifié par chromatographie sur colonne
de silice
traitée avec de la triéthylamine (CHZCIZ/MeOH 95:5) pour donner 130 mg (54%)
du
1o dérivé 74.
~ PF : 120-121 °C (Et20)
~ IR (KBr): v 2243, 1636, 1615, 1566, 1512 cm-1
~ 1 H RMN (250 MHz, CDCI3): 8 2.88 (t, 2H, J = 6.5 Hz, CHz), 3.81 (s, 3H,
OCH3),
3.91 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 4.83 (t, 2H, J = 6.5 Hz, CH2), 6.16
(d, 1 H, J =
15 2.0 Hz, HA~), 6.37 (d, 1 H, J = 2.0 Hz, HA~), 6.89 (d, 2H, J = 8.8 Hz,
HAr), 7.45 (s, 1 H,
=CH), 7.53 (d, 2H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDC13): 8 17.5, 48.9, 55.4, 55.7, 56.4, 89.5, 94.2, 112.8,
113.6 (2), 116.5, 124.5, 127.5, 130.3 (2), 138.8, 142.5, 159.0, 163.2, 163.8,
176Ø
~ MS (ionspray): m/z 365 (M+H)+
20 ~ Anal. calculé pour Cz,HzoN204: C, 69.22; H, 5.53; N, 7.69. Trouvé: C,
65.97; H, 5.71;
N, 7.53.
EXEMPLE 49
[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]acétonitrile
25 (composé 75) - CRL 8413
OMe O / OMe
\ \/
N
OMe
CN
Sous atmosphère d'azote, 200 mg (0,64 mmol) du composé 29 sont solubilisés
dans
15 ml de N,N-diméthylformamide anhydre. A cette solution sont ajoutés
successivement
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
665 mg de carbonate de potassium anhydre (7,5 eq), puis 0;09 mol de
bromoacétonitrile
(2 eq). La réaction est agitée à température ambiante pendant 18 h. Le
carbonate de
potassium est éliminé par filtration et les solvants sont évaporés. Le résidu
est repris
dans l'acétate d'éthyle et lavé par deux fois par de l'eau. La phase organique
obtenue
5 est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu brut
est purifié
par chromatographie sur colonne de silice (éluant: CHZCIZ/AcOEt 7:3) pour
donner 115
mg (51 %) du dérivé 75.
~ PF : 207-208°C (AcOEt)
~ IR (KBr): v 2216, 1628, 1594, 1571, 1511 cm-1
10 ~ 1 H RMN (250 MHz, CDC13): â 3.81 (s, 3H, OCH3), 3.90 (s, 3H, OCH3), 3.97
(s, 3H,
OCH3), 5.15 (s, 2H, CHz), 6.76 (d, 1 H, J = 9.1 Hz, HA~), 6.89 (d, 1 H, J =
8.8 Hz, HA~),
7.11 (d, 2H, J = 9.1 Hz, HAN), 7.29 (S, 1 H, =CH), 7.53 (d, 2H, J = 8.8 Hz,
HAr).
13C RMN (62.90 MHz, CDCI3): 8 45.2, 55.4, 57.0, 57.3, 106.6, 113.7 (2), 115.3,
115.4, 119.8, 125.1, 126.8, 130.1 (2), 132.6, 141.1, 142.8, 155.2, 159.2,
176.4.
15 ~ MS (ionspray): m/z 351 (M+H)+
~ Anal. calculé pour C2pH18N204: C, 68.56; H, 5.18; N, 8.00. Trouvé: C, 68.75;
H,
4.99; N, 8.04.
20 EXEMPLE 50
5,7-diacétoxy-3-[4-(acétoxy)phényl]-1-méthyl-1,4-dihydro-4-quinolmone (composé
76)-CRL 8513
Ac O / OAc
Ac0 / N
I
CH3
25 Sous atmosphère inerte, 200 mg (0,61 mmol) du composé 40 sont solubilisés
dans 15
ml de dichlorométhane. A 0°C, 0,35 ml (3,7 mmol, 6 eq) de tribromure de
bore sont
additionnés goutte à goutte (réaction exothermique) au mélange réactionnel. La
solution
finale est agitée à température ambiante pendant 96 h. La réaction est
hydrolysée par
addition (goutte à goutte) d'eau, puis neutralisée avec une solution
d'hydroxyde de
3o sodium à 10% (pH= 6-7). Le produit final est recueilli par filtration puis
rincé avec de
l'éthanol (140 mg, 80%, PF 316°C (EtOH). Sous atmosphère d'azote, ce
composé est
solubilisé dans 2 ml de pyridine et 2 ml d'anhydride acétique à 0°C. La
réaction est
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
76
agitée à température ambiante pendant 48 h. Les solvants sont évaporés. Le
résidu
obtenu est repris dans le CHZCI2 et lavé par deux fois avec de l'eau. La phase
organique
obtenue est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu
est
purifié par chromatographie sur colonne de silice (élûant: CH2CIz/AcOEt 7:3)
pour donner
235 mg (86%) du dérivé 76.
~ PF : 219-220°C (AcOEt/EP)
~ IR (KBr): v 1769, 1751, 1635, 1618, 1600, 1504 cm-' -
~ 1 H RMN (250 MHz, DMSO-ds): 8 2.28 (s, 6H, CH3), 2.33 (s, 3H, CH3), 3.84 (s,
3H,
NCH3), 6.94 (d, 1 H, J = 2.2 Hz, HAr), 7.15 (d, 2H, J = 8.8 Hz, HA~), 7..40
(d, 1 H, J = 2.2
l0 Hz, HA~), 7.62 (d, 2H, J = 8.8 Hz, HA~), 8.25 (s, 1 H, =CH).
13C RMN (62.90 MHz, DMSO-dfi): 8 20.9, 21.2, 41.2, 107.4, 112.6, 117.0, 120.9,
121.3 (2), 121.5, 129.8 (2), 132.8, 142.4, 143.6, 149.3, 151.1, 152.6, 168.7,
168.9,
169.4, 173.1.
~ SM (ionspray): m/z 410 (M+1 )+
~ Anal. calculé pour C22H1gN0,: C, 64.54; H, 4.68; N, 3.42. Trouvé: C, 64.77;
H,
4.75; N, 3.25.
EXEMPLE 51
5,8-diacétoxy-3-[4-(acétoxy)phényl]-1-méthyl-1,4-dihydro-4-quinolmone acétate
(composé 77) - CRL8460
Ac O / OAc
CRL8460
/ N
I
OAc CH3
Sous atmosphère inerte, 200 mg (0,61 mmol) de composé 56 sont solubilisés dans
15
ml de dichlorométhane. A 0°C, 0,35 ml (3,7 mmol, 6 eq) de tribromure de
bore sont
additionnés goutte à goutte (réaction exothermique) au mélange réactionnel. La
solution
finale est agitée à température ambiante pendant 96 h. La réaction est
hydrolysée par
addition (goutte à goutte) d'eau, puis neutralisée avec une solution
d'hydroxyde de
sodium à 10% (pH= 6-7). Le produit est recueilli par filtration puis rincé par
de l'éthanol
(131 mg, 75%). Sous atmosphère d'azote, ce composé est solubilisé dans 2 ml de
pyridine et 2 ml d'anhydride acétique à 0°C. La réaction est agitée à
température
ambiante pendant 48 h. Les solvants sont évaporés. Le résidu obtenu est repris
dans le
CHZC12 et lavé par deux fois avec de l'eau. La phase organique obtenue est
séchée sur
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
77
MgS04, puis évaporée sous pression réduite. Le résidu est purifié par
chromatographie
sur colonne de silice (éluant: CHZC12/AcOEt 9:1 ) pour donner 149 mg (79%) du
dérivé
77.
~ PF : 183-184°C (AcOEt/EP)
~ IR (KBr): v 1775, 1756, 1628, 1598, 1562, 1513, 1499 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 2.29 (s, 3H, CH3), 2.37 (s, 3H, CH3), 2.42 (s,
3H,
CH3), 3.89 (S, 3H, NCH3), 6.92 (d, 1 H, J = 8.5 Hz, HAr), 7.08 (d, 2H, J = 8.8
Hz, HAr),
7.26 (d, 1 H, J = 8.5 Hz, HAr), 7.39 (s, 1 H, =CH), 7.54 (d, 2H, J = 8.8 Hz,
HAr).
13C RMN (62.90 MHz, CDCI3): 8 21.3, 21.4, 21.5, 45.4, 117.9, 121.5 (2), 121.9,
123.0, 127.3, 130.0 (2), 132.4, 135.8, 137.1, 144.5, 148.7, 150.1, 169.1,
169.7, 170.3,
174.5.
~ SM (ionspray): m/z 410 (M+1 )+
~ Anal. calculé pour C22H1gN0,: C, 64.54; H, 4.68; N, 3.42. Trouvé: C, 64.66;
H,
4.82; N, 3.53.
EXEMPLE 52
4-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]butanenitrile
(composé 78) - CRL8420 et ~[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-
quinolyl]oxy~butanenitrile (composé 79)-CRL 8514
1) 4-[5,7-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]butanenitrile (composé 78) - CRL8420
CRL8420
Sous atmosphère d'azote, 200 mg (6,43 mmol) du composé 33 sont solubilisés
dans
30 ml de N,N-diméthylformamide (DMF) anhydre. 19 mg (1,2 eq) d'hydrure de
sodium,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions au
milieu réactionnel (réaction exothermique). Le 4-chlorobutyronitrile (0,12 ml,
2 eq) est
ajouté au milieu. La réaction est chauffée pendant une nuit à 90°C.
Après
refroidissement et évaporation du DMF, de l'eau est versée sur le mélange
réactionnel
3o qui est extrait ensuite par de l'acétate d'éthyle (deux fois). La phase
organique est
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
78
séchée sur MgS04, puis évaporée sous pression réduite. Le résidu obtenu est
purifié par
chromatographie sur colonne de silice traitée avec de la triéthylamine
(CHZCIZ/AcOEt
9:1 ) pour donner 110 mg (45%) du composé 78 et 40 mg (16%) du composé 79.
~ PF : 100-101 °C (éther)
~ IR (KBr): v 2244, 1635, 1615, 1569, 1541, 1512 cm''
~ 1 H RMN (250 MHz, CDC13): â 2.07-2.16 (m, 2H, CHZ), 2.38 (t, 2H, J = 6.9 Hz,
CH2CN), 3.74 (s, 3H, OCH3), 3.87 (s, 6H, OCH3), 4.11 (t, 2H, J = 6.9 Hz,
NCHZ), 6.24 -
(d, 1 H, J = 1.9 Hz, HA,), 6.31 (d, 1 H, J = 1.9 Hz, HA~), 6.80 (d, 2H, J =
8.8 Hz, HAr),
7.40 (s, 1 H, =CH), 7.47 (d, 2H, J = 8.8 Hz, HA~).
~ 13C RMN (62.90 MHz, CDC13): 8 14.5, 24.2, 51.5, 55.2, 55.6, 56.2, 89.4,
94.6,
112.7, 113.4 (2), 118.7, 123.7, 127.7, 130.1 (2), 139.3, 142.9, 158.7, 162.9
(2), 175.8.
~ SM (ionspray): m/z 379 (M+1 )+
~ Anal. calculé pour C22H22N20a: C, 69.83; H, 5.86; N, 7.40. Trouvé: C, 69.56;
H,
6.00; N, 7.25.
2) {(5,7-Diméthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}butanenitrile (composé
79)-
CRL 8514
CN
OMe ~ OMe
Me0 / NJ
~ PF : 94-95°C (éther)
~ IR (KBr): v 2240, 1616, 1577, 1512 cm''
~ 1 H RMN (250 MHz, CDC13): 8 1.76-1.87 (m, 2H, CH2), 2.32 (t, 2H, J = 7.2 Hz,
CHZCN), 3.72 (t, 2H, J = 7.2 Hz, OCHZ), 3.85 (s, 3H, OCH3), 3.92 (s, 3H,
OCH3), 3.96
(s, 3H, OCH3), 6.56 (d, 1 H, J = 2.2 Hz, HAr), 6.99 (d, 2H, J = 8.8 Hz, HA~),
7.05 (d, 1 H,
J = 2.2 Hz, HA,), 7.48 (d, 2H, J = 8.8 HZ, HA~). 8.69 (S, 1 H, HA,.).
13C RMN (62.90 MHz, CDCI3): b 14.0, 26.3, 55.4, 55.6, 56.3, 71.9, 99.6, 100.7,
111.5, 114.1 (2), 119.5, 125.5, 127.6, 130.9 (2), 152.9, 153.3, 156.7, 159.3,
159.6,
160.8.
~ SM (ionspray): m/z 379 (M+1 )+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
79
~ Anal. calculé pour C22H22N20a: C, 69.83; H, 5.86; N, 7.40. Trouvé: C, 69.95;
H,
5.97; N, 7.31.
EXEMPLE 53
4-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]butanenitrile
(composé 80) - CRL8421 et ~[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-
quinolyl]oxy}butanenitrile (composé 81)-CRL8501 -
1) 4-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
1o quinolinyl]butanenitrile (composé 80)
CRL8421
Sous atmosphère d'azote, 400 mg (1,28 mmol) du composé 29 sont additionnés à
10
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
1,35 g de carbonate de potassium anhydre (7,5 eq), puis 0,35 ml de 4-
chlorobutyronitrile
(3 eq). La réaction est agitée à 90°C pendant 18 h. Les solvants sont
évaporés. Le
résidu est repris dans le CHzCl2 et lavé par deux fois par de l'eau. La phase
organique
est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu obtenu
est purifié
par chromatographie sur colonne de silice traitée avec de la triéthylamine
(éluant:
2o CHZCI2/AcOEt 7:3) pour donner 180 mg (37%) du composé 80 et 274 mg (56%) du
dérivé 81.
~ PF : 126-127°C (éther)
~ IR (KBr): v 2242, 1631, 1596, 1557, 1512 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.97-2.08 (m, 2H, CHZ), 2.27 (t, 2H, J = 7.2 Hz,
CHzCN), 3.74 (s, 3H, OCH3), 3.85 (s, 3H, OCH3), 3.86 (s, 3H, OCH3), 4.45 (t,
2H, J =
7.2 Hz, NCHZ), 6.67 (d, 1 H, J = 9.1 Hz, HA~), 6.82 (d, 2H, J = 9.1 Hz, HA~),
7.00 (d, 1 H,
J = 9.1 Hz, HAr), 7.38 (s, 1 H, =CH), 7.53 (d, 2H, J = 9.1 Hz, HAr).
13C RMN (62.90 MHz, CDCI3): â 14.3, 26.4, 55.2, 56.5, 56.1, 56.8, 105.6, 113.4
(2),
114.2, 118.8, 120.1, 123.4, 127.5, 129.9 (2), 132.6, 142.2, 143.0, 155.0,
158.6, 176.1.
~ SM (ionspray): m/z 379 (M+1 )+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
~ Anal. calculé pour C22H22Nz04: C, 69.83; H, 5.86; N, 7.40. Trouvé: C, 69.65;
H,
5.72; N, 7.49.
2) ~[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}butanenitrile (composé
81)-
5 CRL8501
~ PF : 117-118°C (éther)
~ IR (KBr): v 2247, 1612, 1584, 1514, 1497 cm-'
10 ~ 1 H RMN (250 MHz, CDCI3): 8 1.79-1.90 (m, 2H, CH2), 2.34 (t, 2H, J = 7.2
Hz,
CHZCN), 3.76 (t, 2H, J = 7.2 Hz, OCHZ), 3.87 (s, 3H, OCH3), 3.97 (s, 3H,
OCH3), 4.05
(s, 3H, OCH3), 6.85 (d, 1 H, J = 8.8 Hz, HAr), 6.96 (d, 1 H, J = 8.8 Hz, HAr),
7.02 (d, 2H,
J = 8.8 Hz, HAr), 7.53 (d, 2H, J = 8.8 HZ, HAr), 8.85 (S, 1 H, HAr).
13C RMN (62.90 MHz, CDC13): 8 14.2, 26.4, 55.5, 56.3, 56.6, 72.2, 106.2,
107.3,
15 114.2 (2), 117.1, 119.6, 127.3, 128.1, 131.1 (2), 143.0, 149.2, 150.0,
152.1, 159.4,
159.6.
~ SM (ionspray): m/z 379 (M+1 )+
~ Anal. calculé pour C22H22NZOa: C, 69.83; H, 5.86; N, 7.40. Trouvé: C, 69.48;
H,
5.70; N, 7.22.
EXEMPLE 54
1-(2-Hydroxyéthyl)-5,8-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-quinolinone
(composé 82)-CRL8515 et 2-{[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-
quinolyl]oxy~-1-éthanol (composé 83)-CRL 8516
1) 1-(2-Hydroxyéthyl)-5,8-diméthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 82)-CRL8515
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
81
Sous atmosphère d'azote, 500 mg (1,61 mmol) du composé 29 sont additionnés à
20
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
1,66 g de carbonate de potassium anhydre (7,5 eq), puis 0,34 ml de 2-
bromoéthanol (3
eq). La réaction est agitée à 90°C pendant 24 h. Les solvants sont
évaporés. Le résidu
est repris dans l'acétate d'éthyle et lavé par deux fois par de l'eau. La
phase organique
est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu obtenu
est purifié
par chromatographie sur colonne de silice traitée avec de la triéthylamine
(éluant:
CHzCl2/AcOEt 7:3) pour donner 330 mg (57%) du composé 82 et 147 mg (25%) du
l0 dérivé 83.
~ PF : 126-127°C (AcOEt)
~ IR (KBr): v 3296, 1628, 1591, 1568, 1512 cm-'
~ 1 H RMN (250 MHz, CDCI3 + DZO): â 3.82 (s, 3H, OCH3), 3.85 (s, 3H, OCH3),
3.88 (s,
3H, OCH3), 3.97 (t, 2H, J = 5.0 Hz, CH2), 4.58 (t, 2H, J = 5.0 Hz, CH2), 6.67
(d, 1 H, J
= 8.8 Hz, HA~), 6.85 (d, 2H, J = 8.8 Hz, HAr), 7.01 (d, 1 H, J = 8.8 Hz, HA~),
7.50 (d, 2H,
J = 8.8 Hz, HA~), 7.56 (s, 1 H, =CH).
13C RMN (62.90 MHz, CDC13): 8 55.3, 56.4, 56.8, 61.3, 62.1, 105.0, 113.1 (2),
114.4, 120.0, 121.2, 127.9, 129.6 (2), 133.0, 143.4, 144.6, 154.9, 158.2,
176Ø
~ SM (ionspray): m/z 356 (M+1 )+
~ Anal. calculé pour C2pH21 NOS: C, 67.59; H, 5.96; N, 3.94. Trouvé: C, 67.29;
H,
6.11; N, 4.07.
2) 2-~(5,8-Diméthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}-1-éthanol (composé
83)-CRL 8516
OMe
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
82
~ PF : 124-125°C (AcOEt)
~ IR (KBr): v 3238, 1612, 1583, 1514, 1498 cm-'
~ 1 H RMN (250 MHz, CDCI3 + DZO): 8 3.58 (t, 2H, J = 4.5 Hz, CHZ), 3.77 (t,
2H, J =
4.5 Hz, CH2), 3.84 (s, 3H, OCH3), 3.95 (s, 3H, OCH3), 4.02 (s, 3H, OCH3), 6.88
(d, 1 H,
J = 8.8 Hz, HAN), 6.94 (d, 2H, J = 8.8 Hz, HA~), 7.00 (d, 1 H, J = 8.8 Hz,
HA~), 7.55 (d,
2H, J = 8.8 Hz, HA~) 8.81 (s, 1 H, HAr).
13C RMN (62.90 MHz, CDC13): 8 55.4, 56.2, 57.3, 61.7, 76.3, 107.2, 107.7,
114.4
(2), 117.2, 127.0, 127.7, 130.8 (2), 142.4, 149.0, 150.4, 152.3, 159.6, 160Ø
~ SM (ionspray): m/z 356 (M+1 )+
1o ~ Anal. calculé pour C2pH21 N05: C, 67.59; H, 5.96; N, 3.94. Trouvé: C,
67.78; H,
5.79; N, 4.05.
EXEMPLE 55
p-Toluenesulfonate de 2-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolyl]éthyle 4- (composé 84)-CRL8517
OMe
OMe O
u
N
OMe
_1I
o I¿ ~
0
Sous atmosphère d'azote, 180 mg (0,5 mmol) du composé 82 sont additionnés à 10
ml de CHZCIZ anhydre. A cette solution sont ajoutés 0,21 ml de triéthylamine
(3 eq), puis
2o à 0°C 145 mg de chlorure de p-toluènesulfonyle (1,5 eq). Le mélange
réactionnel est
ensuite agité à température ambiante pendant 24 h. La solution organique est
lavée par
deux fois avec de l'eau. La phase organique obtenue est séchée sur MgS04, puis
évaporée sous pression réduite. Le résidu obtenu est purifié par
chromatographie sur
colonne de silice (éluant: CH2CIz/AcOEt 7:3) pour donner 185 mg (72%) du
composé 84.
~ PF : 85-86°C (AcOEt/EP)
~ IR (KBr): v 1631, 1596, 1557, 1512 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 2.29 (s, 3H, CH3), 3.79 (s, 3H, OCH3), 3.82 (s,
3H,
OCH3), 3.88 (s, 3H, OCH3), 4.39 (t, 2H, J = 5.0 Hz, CH2), 4.60 (t, 2H, J = 5.0
Hz, CHZ),
6.65 (d, 1 H, J = 8.8 Hz, HAr), 6.90 (d, 2H, J = 8.8 Hz, HAr), 6.95 (d, 2H, J
= 8.8 Hz,
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
83
HAr), 7.08 (d, 1 H, J = 8.8 Hz, HAr), 7.29 (S, 1 H, =CH), 7.51 (d, 2H, J = 8.8
Hz, HAr),
7.54 (d, 2H, J = 8.8 Hz, HAr).
13C RMN (62.90 MHz, CDC13): b 21.5, 55.3, 56.4, 56.7, 56.8, 68.9, 105.3, 113.5
(2),
114.3, 120.0, 123.1, 127.5 (2), 129.8 (2), 130.0 (2), 131.8, 132.3, 142.5,
143.1, 145.3,
155.2, 158.8, 176Ø
~ SM (ionspray): m/z 510 (M+1 )+
~ Anal. calculé pour C27H27NO,S: C, 63.64; H, 5.34; N, 2.75. Trouvé: C, 63.89;
H,
5.40; N, 2.60.
1o EXEMPLE 56
3-[5,8-D i méth oxy-3-(4-méthoxyphényl)-4-oxo-1,4-d i hydro-1-
quinolinyl]propanenitrile (composé 85)-CRL 8518
Sous atmosphère d'azote, 100 mg (0,20 mmol) du composé 84 sont additionnés à 3
ml de diméthylsulfoxyde anhydre. A cette suspension sont ajoutés 18 mg de
cyanure de
sodium (2 eq). Le mélange final est agité à température ambiante pendant 48 h.
La
solution est diluée avec de l'acétate d'éthyle et lavée par deux fois par de
l'eau. La
phase organique est séchée sur MgS04, puis évaporée sous pression réduite. Le
résidu
obtenu est purifié par chromatographie sur colonne de silice traitée avec de
la
triéthylamine (éluant: CH2Clz/AcOEt 7:3) pour donner 30 mg (40%) du composé
85.
~ PF : 79-80°C (AcOEt/EP)
~ IR (KBr): v 2252, 1631, 1596, 1562, 1512 cm-'
~ 1 H RMN (250 MHz, CDC13): b 2.89 (t, 2H, J = 5.0 Hz, CHZ), 3.81 (s, 3H,
OCH3), 3.90
(s, 3H, OCH3), 3.93 (s, 3H, OCH3), 4.64 (t, 2H, J = 5.0 Hz, CH2), 6.74 (d, 1
H, J = 8.8
Hz, HAr), 6.91 (d, 2H, J = 8.8 Hz, HAr), 7.08 (d, 1 H, J = 8.8 HZ, HAr), 7.44
(s, 1 H, =CH),.
7.60 (d, 2H, J = 8.8 Hz, HAr).
13C RMN (62.90 MHz, CDCI3): 8 19.8, 55.1, 55.4, 56.9, 57.1, 106.1, 113.7 (2),
114.5, 117.2, 120.2, 127.3, 130.2 (2), 132.6, 141.9, 142.6, 155.5, 159.0,
176.3.
~ SM (ionspray): m/z 364 (M+1 )+
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
84
~ Anal. calculé pour C21 H20NZOa: C, 69.22; H, 5.53; N, 7.69. Trouvé: C,
68.93; H,
5.35; N, 7.77.
EXEMPLE 57
3-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]pentanenitrile (composé 86) - CRL8463 et ~[5,8-Diméthoxy-3-(4-
méthoxyphényl)-4-quinolyl]oxy}pentanenitrile (composé 87)-CRL8519 -
1) 3-[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]pentanenitrile (composé 86) - CRL8463
CRL8483
Sous atmosphère d'azote, 400 mg (1,28 mmol) du composé 29 sont additionnés à
15
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
1,33 g de carbonate de potassium anhydre (7,5 eq), puis 0,44 ml de 5-
chlorovaléronitrile
I5 (3 eq). La réaction est agitée à 80°C pendant 5 h. Les solvants sont
évaporés. Le résidu
obtenu est repris dans le CHzCIz et lavé par deux fois par de l'eau. La phase
organique
obtenue est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu
obtenu
est purifié par chromatographie sur colonne de silice traitée avec de la
triéthylamine
(éluant: CHZCIZ/AcOEt 9:1 ) pour donner 150 mg (30%) du composé 86 et 300 mg
(59%)
2o du dérivé 87.
~ PF : 126-127°C (AcOEt)
~ IR (KBr): v 2241, 1627, 1590, 1569, 1517 cm-'
~ 1 H RMN (250 MHz, CDC13): â 1.54-1.66 (m, 2H, CHz), 1.85-1.97 (m, 2H, CHZ),
2.33
(t, 2H, J = 7.0 Hz, CHzCN), 3.80 (s, 3H, OCH3), 3.89 (s, 6H, OCH3), 4.41 (t,
2H, J =
25 7.0 Hz, NCHZ), 6.71 (d, 1 H, J = 8.9 Hz, HA~), 6.89 (d, 2H, J = 8.8 Hz,
HAr), 7.04 (d, 1 H,
J = 8.9 Hz, HA~), 7.39 (s, 1 H, =CH), 7.59 (d, 2H, J = 8.8 Hz, HA,).
13C RMN (62.90 MHz, CDC13): S 17.0, 22.6, 30.0, 55.3, 56.8, 56.9, 57.2, 105.6,
113.5 (2), 114.4, 119.2, 120.3, 123.3, 127.7, 130.0 (2), 133.0, 142.5, 143.2,
155.2,
158.7, 176.1.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
~ SM (ionspray): m/z 393 (M+1 )+
~ Anal. calculé pour C23H24NzOa: C, 70.39; H, 6.16; N, 7.14. Trouvé: C, 70.65;
H,
5.99; N, 7.26.
5 2) {[5,8-Diméthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}pentanenitrile
(composé
87)-CRL8519
~ PF : 126-127°C (AcOEt)
10 ~ IR (KBr): v 2244, 1612, 1584, 1515 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.65-1.70 (m, 4H, CH2), 2.15 (t, 2H, J = 7.0 Hz,
CHzCN), 3.67 (t, 2H, J = 7.0 Hz, OCH2), 3.87 (s, 3H, OCH3), 3.95 (s, 3H,
OCH3), 4.04
(S, 3H, OCH3), 6.83 (d, 1 H, J = 8.8 Hz, HAr), 6.95 (d, 2H, J = 8.8 Hz, HAr),
7.01 (d, 1 H,
J = 8.8 Hz, HAr), 7.53 (d, 2H, J = 8.8 Hz, HAr), 8.85 (S, 1 H, HAr).
15 ~ 13C RMN (62.90 MHz, CDC13): 8 16.7, 22.3, 28.8, 55.5, 56.2, 56.6, 73.2,
106.1,
107.1, 114.0 (2), 117.2, 119.6, 127.5, 128.2, 131.2 (2), 142.6, 149.3, 150.0,
152.1,
159.5, 159.8.
~ SM (ionspray): m/z 393 (M+1 )+
~ Anal. calculé pour C23H24N204: C, 70.39; H, 6.16; N, 7.14. Trouvé: C, 70.13;
H,
20 6.30; N, 7.31.
EXEMPLE 58
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-pipéridino-1,4-dihydro-4-quinolinone
(composé 88)- CRL8425
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
86
CRL8425
Dans un tube scellé, le composé 36 (90 mg, 2,03 mmol) et de la pipéridine (0,1
ml,
1,0 mmol) sont dissous dans le dioxane (2 ml). La solution finale est chauffée
à 100°C
pendant 6 h. Après refroidissement et évaporation du solvant, le résidu est
purifié par
s chromatographie sur colonne de silice traitée avec de la triéthylamine
(éluant: EP/AcOEt
4:6) pour donner 60 mg (75%) du composé 88.
~ PF : 197-198°C (AcOEt/EP)
~ IR (KBr): v 1633, 1601, 1572, 1506, 1465 cm-'
~ 1 H RMN (250 MHz, CDCI3): â 1.50-1.65 (m, 2H, CHZ), 1.70-1.90 (m, 4H, CH2),
2.90-
3.20 (m, 4H, CH2), 3.67 (s, 3H, NCH3), 3.81 (s, 3H, OCH3), 3.89 (s, 3H, OCH3),
6.23
(d, 1 H, J = 2.2 Hz, HA~), 6.45 (d, 1 H, J = 2.2 Hz, HAr), 6.91 (d, 2H, J =
8.8 Hz, HAr),
7.38 (s, 1 H, =CH), 7.54 (d, 2H, J = 8.8 Hz, HAr).
13C RMN (62.90 MHz, CDCI3): b 24.6, 26.1 (2), 41.7, 54.6 (2), 55.3, 55.4,
90.6,
100.2, 113.7 (2), 114.6, 123.1, 128.9, 130.2 (2), 139.9, 145.1, 156.8, 158.6,
162.1,
175.5.
~ SM (ionspray): m/z 379 (M+1 )+
~ Anal. calculé pour C23H26NZOs: C, 72.99; H, 6.92; N, 7.40. Trouvé: C, 73.27;
H,
7.12; N, 7.26.
EXEMPLE 59
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-pyrrolidino-1,4-dihydro-4-quinolinone
(composé 89) - CRL8434
CRL8434
Dans un tube scellé, le composé 36 (100 mg, 2,2 mmol) et de la pyrrolidine
(0,10 ml,
1,2 mmol) sont dissous dans le dioxane (4 ml). La solution finale est chauffée
à 100°C
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
87
pendant 6 h. Après refroidissement et évaporation du solvant, le résidu est
purifié par
chromatographie sur colonne de silice traitée avec de la triéthylamine
(éluant: EP/AcOEt
3:7) pour donner 80 mg (97%) du composé 89.
~ PF : 201-202°C (AcOEt/EP)
~ IR (KBr): v 1630, 1605, 1570, 1511, 1449 cm-'
~ 1 H RMN (250 MHz, CDC13): â 1.88-1.93 (m, 4H, CH2), 3.35-3.40 (m, 4H, CH2),
3.63
(s, 3H, NCH3), 3.82 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 6.04 (d, 1 H, J = 2.2
Hz, HAr),
6.20 (d, 1 H, J = 2.2 Hz, HA~), 6.93 (d, 2H, J = 8.8 Hz, CHZ), 7.34 (s, 1 H,
=CH), 7.56 (d,
2H, J = 8.8 Hz, HAr).
~ 13C RMN (62.90 MHz, CDCI3): 8 25.9 (2), 41.3, 52.2 (2), 55.3, 55.4, 87.3,
94.1,
111.5, 113.8 (2), 122.2, 128.8, 129.8 (2), 139.4, 144.8, 152.1, 158.5, 162.1,
175.5.
~ SM (ionspray): m/z 365 (M+1 )+
~ Anal. calculé pour C22H24NzOs: C, 72.51; H, 6.64; N, 7.69. Trouvé: C, 72.31;
H,
6.53; N, 7.50.
EXEMPLE 60
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-morpholino-1,4-dihydro-4-quinolinone
(composé 90) - CRL8435
CRL8435
Dans un tube scellé, le composé 36 (150 mg, 0,33 mmol) et de la morpholine
(0,15
ml, 1,69 mmol) sont dissous dans le dioxane (4 ml). La solution finale est
chauffée à
100°C pendant 6 h. Après refroidissement et évaporation du solvant, le
résidu est purifié
par chromatographie sur .colonne de silice traitée avec de la triéthylamine
(éluant:
EP/AcOEt 1:9) pour donner 120 mg (93%) du dérivé 90.
~ PF : 194-195°C (AcOEt)
~ IR (KBr): v 1636, 1606, 1583, 1557, 1503, 1446
~ 1 H RMN (250 MHz, CDC13): 8 3.05-3.17 (m, 4H, CHZ), 3.71 (s, 3H, NCH3), 3.82
(s,
3H, OCH3), 3.92 (s, 3H, OCH3), 3.95-4.00 (m, 4H, CHZ), 6.32 (d, 1 H, J = 2.2
Hz, HA~),
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
88
6.44 (d, 1 H, J = 2.2 Hz, HA~), 6.93 (d, 2H, J = 8.8 Hz, CHz), 7.42 (s, 1 H,
.=CH), 7.53 (d,
2H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDC13): 8 41.8 (2), 53.5 (2), 55.4, 55.5, 67.4, 91.4,
100.4,
113.8 (2), 114.8, 123.6, 128.7, 130.3 (2), 140.1, 145.3, 156.0, 158.8, 162.3,
175.4.
~ SM (ionspray): m%z 381 (M+1 )+
~ Anal. calculé pour C22H24NzOa: C, 69.46; H, 6.36; N, 7.36. Trouvé: C, 69.72;
H,
6.47; N, 7.30.
EXEMPLE 61
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-5-(1-méthylpipérazino)-1,4-dihydro-4-
quinolinone (composé 91) - CRL8436
CRL8436
Dans un tube scellé, le composé 36 (100 mg, 0,22 mmol) et de la N-
méthylpipérazine
(0,13 ml, 1,1 mmol) sont dissous dans le dioxane (2 ml). La solution finale
est chauffée à
100°C pendant 5 h. Après refroidissement et évaporation du solvant, le
résidu est purifié
par chromatographie sur colonne de silice traitée avec de la triéthylamine
(éluant:
CH2CIz/MeOH 97:3) pour donner 80 mg (90%) du dérivé 91.
~ PF : 205-206°C (AcOEt/EP)
~ IR (KBr): v 1632, 1610, 1558, 1531, 1513 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 2.40 (s, 3H, NCH3), 2.76-2.80 (m, 4H, CHz), 3.15-
3.20
(m, 4H, CHz), 3.70 (s, 3H, NCH3), 3.81 (s, 3H, OCH3), 3.90 (s, 3H, OCH3), 6.31
(d,
1 H, J = 2.2 Hz, HA~), 6.45 (d, 1 H, J = 2.2 Hz, HA,), 6.92 (d, 2H, J = 8.8
Hz, HA~), 7.42
(s, 1 H, =CH), 7.52 (d, 2H, J = 8.8 Hz, HA~).
~ 13C RMN (62.90 MHz, CDC13): 8 41.9, 45.9, 52.7 (2), 55.3 (2), 55.4 (2),
91.4, 100.7,
113.8 (2), 114.6, 123.5, 128.7, 130.3 (2), 140.2, 145.1, 155.6, 158.7, 162.2,
175.4.
~ SM (ionspray): m/z 394 (M+1 )+
~ Anal. calculé pour C23H27NsOs: C, 70.21; H, 6.92; N, 10.68. Trouvé: C,
69.89; H,
7.02; N, 10.81.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
89
EXEMPLE 62
5-Diéthylamino-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-
quinolinone (composé 92) - CRL8437
OMe
CRL8437
Dans un tube scellé, le composé 36 (100 mg, 2,2 mmol) et de la N,N-
diéthylamine
(0,11 ml, 1,1 mmol) sont dissous dans le dioxane (4 ml). La solution finale
est chauffée à
100°C pendant 24 h. Après refroidissement et évaporation du solvant, le
résidu est
purifié par chromatographie sur colonne de silice traitée avec de la
triéthylamine (éluant:
EP/AcOEt 2:8) pour donner 40 mg (50%) du composé 92.
~ huile
~ IR (film): v 1634, 1599, 1582, 1511 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.07 (t, 6H, J = 7.2 Hz, CH3), 3.34 (q, 4H, J =
7.2 Hz,
CHZ), 3.67 (s, 3H, NCH3), 3.81 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 6.20 (d, 1
H, J = 2.2
Hz, HAr), 6.42 (d, 1 H, J = 2.2 Hz, HA~), 6.91 (d, 2H, J = 8.8 Hz, HAr), 7.39
(s, 1 H, =CH),
7.54 (d, 2H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDCI3): 8 11.9 (2), 41.7, 46.6 (2), 55.3, 55.4, 90.1,
102.2,
113.7 (2), 115.0, 129.5, 128.8, 130.2 (2), 139.7, 145.2, 154.1, 158.6, 161.8,
175.3.
~ SM (ionspray): m/z 367 (M++1 )
~ Anal. calculé pour C22H26NZOs: C, 72.11; H, 7.15; N, 7.64. Trouvé: C, 71.84;
H,
6.99; N, 7.76.
EXEMPLE 63
5-Allylamino-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-quinolinone
(composé 93)-CRL8520
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
Me0
Dans un tube scellé, le composé 36 (100 mg, 2,2 mmol) et de l'allylamine (84
~I, 1,1
mmol) sont dissous dans le dioxane (2 ml). La solution finale est chauffée à
100°C
pendant 18 h. Après refroidissement et évaporation du solvant, le résidu est
purifié par
5 chromatographie sur colonne de silice traitée avec de la triéthylamine
(éluant: EP/AcOEt
3:7) pour donner 71 mg (90%) du dérivé 93.
~ PF : 154-155°C (AcOEt/EP)
~ IR (KBr): v 1641, 1616, 1568, 1510 cm-'
~ 1 H RMN (250 MHz, CDCI3): ~ 3.66 (s, 3H, NCH3), 3.83 (s, 3H, OCH3), 3.87 (s
large,
l0 5H, CHZ + OCH3), 5.17 (dd, 1 H, J = 1.3, 10.2 Hz, CHZ=), 5.32 (dd, 1 H, J =
1.3, 17.2
Hz, CHZ=), 5.85 (d, 1 H, J = 2.0 Hz, HA~), 5.91 (d, 1 H, J = 2.0 Hz, HAr),
5.85-6.02 (m,
1 H, CH=), 6.94 (d, 2H, J = 8.8 Hz, HA~), 7.39 (s, 1 H, =CH), 7.47 (d, 2H, J =
8.8 Hz,
HA~), 10.71 (s large, 1 H, NH).
13C RMN (62.90 MHz, CDCI3): 8 41.6, 45.6, 55.2, 55.5, 85.0, 89.3, 108.0, 113.8
(2),
15 116.3, 121.9, 128.1, 130.3 (2), 134.4, 140.5, 144.4, 153.9, 158.8, 163.7,
178.9.
~ SM (ionspray): m/z 351 (M+1 )+
~ Anal. calculé pour C21 H22NzOs: C, 71.98; H, 6.33; N, 7.99. Trouvé: C,
72.24; H,
6.25; N, 8.08.
20 EXEMPLE 64
5-(4-Méthoxybenzylamino)-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-
quinolinone (composé 94)-CRL8521
Me0
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
91
Dans un tube scellé, le composé 36 (200 mg, 0,45 mmol) et de la 4-
méthoxybenzylamine (0,30 ml, 2,2 mmol) sont dissous dans le dioxane (2 ml). La
solution finale est chauffée à 100°C pendant 16 h. Après
refroidissement et évaporation
du solvant, le résidu est purifié par chromatographie sur colonne de silice
traitée avec de
la triéthylamine (éluant: EP/AcOEt 1:1 ) pour donner 168 mg (86%) du dérivé
94.
~ PF : 144-145°C (AcOEt/EP)
~ IR (KBr): v 1638, 1613, 1572, 1521, 1509, 1465 cm-' -
~ 1 H RMN (250 MHz, CDCI3): 8 3.65 (s, 3H, NCH3), 3.78 (s, 3H, OCH3), 3.80 (s,
3H,
OCH3), 3.82 (s, 3H, OCH3), 4.36 (d, 2H, J = 5.4 Hz, , CHz), 5.85 (d, 1 H, J =
2.2 Hz,
1o HA~), 5.89 (d, 1 H, J = 2.2 Hz, HAN), 6.84 (d, 2H, J = 8.5 Hz, HA~), 6.94
(d, 2H, J = 8.8
Hz, HA~), 7.31 (d, 2H, J = 8.5 Hz, HA~), 7.40 (s, 1 H, =CH), 7.48 (d, 2H, J =
8.8 Hz, HA~),
10.93 (t, 1 H, J = 5.4 Hz, NH).
13C RMN (62.90 MHz, CDC13): s 41.4, 46.6, 55.1, 55.3, 55.4, 85.1, 89.6, 108.0,
113.7 (2), 114.0 (2), 121.8, 128.0, 128.6 (2), 130.1 (2), 130.8, 140.4, 144.3,
153.6,
158.7, 163.5, 178.8.
~ SM (ionspray): m/z 431 (M+1 )+
~ Anal. calculé pour C26H26NzOa: C, 72.54; H, 6.09; N, 6.51. Trouvé: C, 72.80;
H,
r
5.98; N, 6.71.
EXEMPLE 65
5-Amino-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-quinolinone
(composé 95) - CRL8461
CRL8461
Sous atmosphère d'azote, 100 mg (0,23 mmol) du composé 94 sont solubilisés
dans 3
ml d'acide trifluoroacétique. La réaction est agitée à 65°C pendant 1
h. L'acide est
évaporé. Le résidu obtenu est repris dans l'acétate d'éthyle et lavé par deux
fois avec
une solution de soude à 10%. La phase organique obtenue est séchée sur MgS04,
puis
évaporée sous pression réduite. Le résidu est purifié par chromatographie sur
colonne
3o de silice de silice traitée avec de la triéthylamine (éluant: EP/AcOEt 3:7)
pour donner 50
mg (69%) du composé 95.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
92
~ PF : 161-162°C (AcOEt/EP)
~ IR (KBr): v 3446, 3381, 1635, 1610, 1569, 1511 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 3.62 (s, 3H, NCH3), 3.82 (s, 3H, OCH3), 3.84 (s,
3H,
OCH3), 5.92 (d, 1 H, J = 2.2 Hz, HA~), 5.98 (d, 1 H, J = 2.2 Hz, HA~), 6.94
(d, 2H, J = 8.8
s Hz, HA~), 7.11 (s large, 2H, NH2), 7.40 (s, 1 H, =CH), 7.49 (d, 2H, J = 8.8
Hz, HAr).
13C RMN (62.90 MHz, CDCI3): 8 41.5, 55.3, 55.5, 87.1, 93.8, 108.4, 113.8 (2),
121.8, 128.1, 130.2 (2), 140.9, 144.2, 153.7, 158.8, 163.2, 179.1.
~ SM (ionspray): m/z 311 (M+1 )+
~ Anal. calculé pour C18H18N203: C, 69.66; H, 5.85; N, 9.03. Trouvé: C, 70.01;
H,
l0 5.69; N, 8.92.
EXEMPLE 66
5-{[(Diméthylamino)éthyl]amino}-7-méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-
dihydro-4-quinolinone (composé 96) - CRL8462
u
CRL8462
Me0
Dans un tube scellé, le composé 36 (200 mg, 0,45 mmol) et de la N,N-
diméthylethylènediamine (0,25 ml, 2,2 mmol) sont dissous dans le dioxane (2
ml). La
solution finale est chauffée à 100°C pendant 5 h. Après refroidissement
et évaporation
2o du solvant, le résidu est purifié par chromatographie sur colonne de silice
traitée avec de
la triéthylamine (éluant: CH2CI2/MeOH 97:3) pour donner 155 mg (90%) du dérivé
96.
~ PF : 130-131 °C (lavage éther) ,
~ IR (KBr): v 1637, 1608, 1572, 1509, 1467 cm-'
~ 1 H RMN (250 MHz, CDC13): b 2.33 (s, 6H, CH3), 2.68 (t, 2H, J = 7.2 Hz,
CH2), 3.36-
2s 3.39(m, 2H, CHZ), 3.63 (s, 3H, NCH3), 3.81 (s, 3H, OCH3), 3.88 (s, 3H,
OCH3), 5.85
(d, 1 H, J = 2.2 Hz, HAr), 5.93 (d, 1 H, J = 2.2 Hz, HA,.), 6.93 (d, 2H, J =
8.8 Hz, HAr),
7.38 (s, 1 H, CH=), 7.46 (d, 2H, J = 8.8 Hz, HA~), 10.51 (s large, 1 H, NH).
13C RMN (62.90 MHz, CDCI3): 8 41.1, 41.6, 45.6 (2), 55.3, 55.5, 58.0, 85.1,
88.8,
108.0, 113.8 (2), 122.0, 128.1, 130.3 (2), 140.6, 144.5, 153.8, 158.8, 163.8,
178.9.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
93
~ SM (ionspray): m/z 382 (M+1 )+
~ Anal. calculé pour CZZH2,N303: C, 69.27; H, 7.13; N, 11.02.~.Trouvé: C,
68.93; H,
6.94; N, 10.98.
EXEMPLE 67
7-Méthoxy-3-(4-méthoxyphényl)-1-méthyl-1,4-dihydro-4-quinolinone (composé 97)
- CRL8464 -
CRL8464
Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 26 sont additionnés à
10
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
735 mg de carbonate de potassium anhydre (7,5 eq), puis 0,13 ml d'iodure de
méthyle (3
eq). La réaction est agitée à température ambiante pendant 24 h. Les solvants
sont
évaporés. Le résidu est repris dans le CHZCIZ et lavé par deux fois par de
l'eau. La
phase organique obtenue est séchée sur MgS04, puis évaporée sous pression
réduite.
Le résidu est purifié par chromatographie sur colonne de silice traitée avec
de la
triéthylamine (éluant: AcOEt) pour donner 171 mg (81 %) du composé 97.
~ PF : 154-155°C (AcOEt/EP)
~ IR (KBr): v 1622, 1570, 1549, 1511 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 3.69 (s, 3H, NCH3), 3.79 (s, 3H, OCH3), 3.88 (s,
3H,
OCH3), 6.61 (d, 1 H, J = 2.2 Hz, HA~), 6.88 (d, 2H, J = 8.8 Hz, HAN), 6.94
(dd, 1 H, J =
2.2, 8.8 Hz, HA~), 7.51 (s, 1 H, =CH), 7.53 (d, 2H, J = 8.8 Hz, HA~), 8.42 (d,
1 H, J = 8.8
Hz, HA~).
13C RMN (62.90 MHz, CDCI3): S 40.7, 55.4, 55.6, 97.7, 112.4, 113.7 (2), 121.3,
121.4, 128.0, 129.3, 129.8 (2), 141.6, 141.9, 158.7, 162.6, 175.5.
~ SM (ionspray): m/z 296 (M+1 )+
~ Anal. calculé pour C~BH~~NO3: C, 73.20; H, 5.80; N, 4.74. Trouvé: C, 73.45;
H, 5.63;
N, 4.97.
EXEMPLE 68
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
94
[7-Méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]acétonitrile
(composé 98)-CRL8522
Me0
C:N
Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 26 sont additionnés à
10
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
736 mg de carbonate de potassium anhydre (7,5 eq), puis 0,15 ml de
bromoacétonitrile
(3 eq). La réaction est agitée à température ambiante pendant 18 h. Les
solvants sont
évaporés. Le résidu obtenu est repris dans le dichlorométhane et lavé par deux
fois par
de l'eau. La phase organique obtenue est séchée sur MgS04, puis évaporée sous
pression réduite. Le produit brut est recristallisé dans l'acétate d'éthyle
pour donner 84
mg (37%) du composé 98.
~ PF : 206-207°C (AcOEt)
~ IR (KBr): v 2240, 1622, 1576, 1513 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 3.82 (s, 3H, OCH3), 3.97 (s, 3H, OCH3), 4.91 (s,
2H,
CH2), 6.71 (d, 1 H, J = 2.2 Hz, HAr), 6.94 (d, 2H, J = 8.8 Hz, HAr), 7.05 (dd,
1 H, J = 2.2,
8.8 Hz, HAr), 7.51 (s, 1 H, =CH), 7.53 (d, 2H, J = 8.8 Hz, HAr), 8.47 (d, 1 H,
J = 8.8 Hz,
HAr).
13C RMN (62.90 MHz, CDC13): 8 40.7, 55.4, 55.6, 97.7, 112.4, 113.7 (2), 121.3,
121.4, 128.0, 129.3, 129.8 (2), 141.6, 141.9, 158.7, 162.6, 175.5.
~ SM (ionspray): m/z 321 (M+1 )+
~ Anal. calculé pour C~9H~6N203: C, 71.24; H, 5.03; N, 8.74. Trouvé: C, 71.88;
H, 4.89;
N, 8.77.
EXEMPLE 69
2-[7-Méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]acétate
d'éthyle
(composé 99) - CRL8465
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
CRL8465
Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 26 sont additionnés à
10
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
736 mg de carbonate de potassium anhydre (7,5 eq), puis 0,24 ml de
bromoacétate
5 d'éthyle (3 eq). La réaction est agitée à 90°C pendant 3 h. Les
solvants sont évaporés.
Le résidu est repris dans le dichlorométhane et lavé par deux fois par de
l'eau. La phase
organique est séchée sur MgS04, puis évaporée sous pression réduite. Le résidu
obtenu
est purifié par chromatographie sur colonne de silice traitée avec de la
triéthylamine
(éluant: AcOEt) pour donner 220 mg (84%) du composé 99.
10 ~ PF : 138-139°C (AcOEt)
~ IR (KBr): v 1747, 1619, 1581, 1515, 1472 cm'
~ 1 H RMN (250 MHz, CDC13): 8 1.27 (t, 3H, J = 7.2 Hz, CH3), 3.83 (s, 3H,
OCH3), 3.90
(s, 3H, OCH3), 4.26 (q, 2H, J = 7.2 Hz, CHZ), 4.74 (s, 2H, CH2), 6.55 (d, 1 H,
J = 2.2
Hz, HA~), 6.94 (d, 2H, J = 8.8 Hz, HAr), 6.98 (dd, 1 H, J = 2.2, 8.8 Hz, HA~),
7.53 (s, 1 H,
15 =CH), 7.59 (d, 2H, J = 8.8 Hz, HA~), 8.47 (d, 1 H, J = 8.8 Hz, HAr)-
13C RMN (62.90 MHz, CDCI3): 8 14.2, 54.1, 55.3, 55.6, 62.3, 97.5, 112.9, 113.6
(2),
121.2, 122.0, 127.6, 129.6, 129.8 (2), 141.2, 141.8, 158.8, 162.8, 167.4,
175.8.
~ SM (ionspray): m/z 368 (M+1 )+
~ Anal. calculé pour Cz~H2~N05: C, 68.65; H, 5.76; N, 3.81. Trouvé: C, 68.93;
H, 5.93;
2o N, 3.98.
EXEMPLE 70
N,N-Diéthyl-2-[7-méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]acétamide (composé 100) - CRL8466
CRL8466
I:UN((:H2C:H~)Z
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
96
Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 26 sont solubilisés
dans
ml de N,N-diméthylformamide anhydre. 26 mg (1,5 eq) d'hydrure de sodium 60%,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions au
milieu réactionnel (réaction exothermique). Le 2-chloro-N,N-diéthylacétamide
(0,20 ml, 2
5 eq) est ajouté au milieu. La réaction est chauffée pendant 18 à 90°C.
Après
refroidissement, de l'eau est versée sur le mélange réactionnel qui est
extrait ensuite par
de l'acétate d'éthyle (deux fois). La phase organique est séchée sur MgS04,
puis _
évaporée sous pression réduite. Le résidu obtenu est purifié par
chromatographie sur
colonne de silice (AcOEt) pour donner 230 mg (82%) du composé 100.
10 ~ PF : 166-167°C (AcOEt)
~ IR (KBr): v 1647, 1627, 1587, 1513, 1471 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.15 (t, 3H, J = 7.2 Hz, CH3), 1.30 (t, 3H, J =
7.2 Hz,
CH3), 3.42 (q, 4H, J = 7.2 Hz, CH2), 3.81 (s, 3H, OCH3), 3.84 (s, 3H, OCH3),
4.74 (s,
2H, CHZ), 6.40 (d, 1 H, J = 2.2 Hz, HAN), 6.89 (d, 2H, J = 8.8 HZ, HAr), 6.93
(dd, 1 H, J =
2.2, 8.8 Hz, HA~), 7.46 (s, 1 H, =CH), 7.56 (d, 2H, J = 8.8 Hz, HAN), 8.44 (d,
1 H, J = 8.8
Hz, HA~).
13C RMN (62.90 MHz, CDC13): 8 13.1, 14.7, 41.2, 41.7, 54.2, 55.4, 55.6, 98.0,
112.0, 113.7 (2), 121.5, 121.9, 128.0, 129.7, 130.0 (2), 141.6, 142.2, 158.8,
162.7,
164.7, 175.9.
~ SM (ionspray): m/z 310 (M+1 )+
~ Anal. calculé pour C23H26NzO4: C, 70.03; H, 6.64; N, 7.10. Trouvé: C, 70.27;
H, 6.76;
N, 7.05.
EXEMPLE 71
3-[7-Méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]propanenitrile
(composé 101) - CRL8467
CRL8467
CN
Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 26 sont additionnés à
10
3o ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
1,35 g de carbonate de potassium anhydre (7,5 eq), puis 0,35 ml de 1-
bromopropionitrile
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
97
(3 eq). La réaction est agitée à température ambiante pendant 18 h. Les
solvants sont
évaporés. Le résidu est repris dans..le dichlorométhane et lavé par deux fois
par de l'eau.
La phase organique obtenue est séchée sur MgS04, puis évaporée sous pression
réduite. Le résidu est purifié par chromatographie sur colonne de silice
traitée avec de la
s triéthylamine (éluant:AcOEt) pour donner 175 mg (74%) du composé 101.
~ PF : 179-180°C (AcOEt/EP)
~ IR (KBr): v 2248, 1624, 1582, 1550, 1512 cm-'
~ 1 H RMN (250 MHz, CDC13): â 2.91 (t, 2H, J = 6.6 Hz, CHZCN), 3.82 (s, 3H,
OCH3),
3.94 (s, 3H, OCH3), 4.39 (t, 2H, J = 6.6 Hz, NCH2), 6.64 (d, 1 H, J = 2.2 Hz,
HA~), 6.93
(d, 2H, J = 8.8 Hz, HA~), 7.01 (dd, 1 H, J = 2.2, 8.8 Hz, HA~), 7.57 (d, 2H, J
= 8.8 Hz,
HA~), 7.63 (s, 1 H, =CH), 8.49 (d, 1 H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDC13): 8 17.8, 48.2, 55.5, 55.9, 97.7, 111.8, 113.9 (2),
116.5, 121.7, 122.6, 127.4, 130.0 (2), 130.5, 140.0, 140.6, 159.1, 163.1,
175.8.
~ SM (ionspray): m/z 335 (1V1+1 )+
~ Anal. calculé pour CzoH~8N203: C, 71.84; H, 5.43; N, 8.38. Trouvé: C, 71.62;
H, 5.55;
N, 8.19.
EXEMPLE 72
3-(7-Méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-quinolinyl]propanoate
2o d'éthyle (composé 102) - CRL8468
Me0
CRL8468
Sous atmosphère d'azote, 200 mg (0,71, mmol) du composé 26 sont additionnés à
10
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
735 mg de carbonate de potassium anhydre (7,5 èq), puis 0,27 ml de 3-
bromopropionate
d'éthyle (3 eq). La réaction est agitée à température ambiante pendant 18 h.
Les
solvants sont évaporés. Le résidu est repris dans le CHZCI2 et lavé par deux
fois par de
l'eau. La phase organique ést séchée sur MgS04, puis évaporée sous pression
réduite.
Le résidu obtenu est purifié par chromatographie sur colonne de silice traitée
avec de la
3o triéthylamine (éluant: AcOEt) pour donner 166 mg (61 %) du composé 102.
~ PF : 138-139°C (AcOEt/EP)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
98
~ IR (KBr): v 1730, 1618, 1579, 1548, 1514 cm'
~ ~ H RMN (250 MHz, CDC13): 8 1.18 (t, 3H, J = 7.0 Hz, CH3), 2.84 (t, 2H, J =
6.6 Hz,
CHZCO), 3.79 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 4.11 (q, 2H, J = 7.0 Hz,
OCHZ), 4.37
(t, 2H, J = 6.6 Hz, NCH2), 6.70 (d, 1 H, J = 2.2 Hz, HAr), 6.89 (d, 2H, J =
8.8 Hz, HAr),
6.95 (dd, 1 H, J = 2.2, 8.8 Hz, HAr), 7.56 (d, 2H, J = 8.8 Hz, HAr), 7.71 (s,
1 H, =CH),
8.44 (d, 1 H, J = 8.8 Hz, HAr).
13C RMN (62.90 MHz, CDC13): 8 14.1, 33.3, 48.4, 55.3, 55.7, 61.4, 97.7, 112.0,
113.7 (2), 121.5, 121.6, 127.8, 129.8 (2), 129.8, 140.3, 141.8, 158.7, 162.7,
170.7,
175.5.
~ SM (ionspray): m/z 382 (M+1 )+
~ Anal. calculé pour C22H2sNOs: C, 69.28; H, 6.08; N, 3.67. Trouvé: C, 68.98;
H, 5.90;
N, 3.55.
EXEMPLE 73
N-[3-(Diméthylamino)éthyl]-7-méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 103) - CRL8469 et N-f2-[7-Méthoxy-3-(4-méthoxyphényl)-4-
quinolyl]oxy}éthyl-N,N-diméthylamine (composé 104)-CRL8523
1)N-[3-(Diméthylamino)éthyl]-7-méthoxy-3-(4-méthoxyphényl)-1,4-dihydro-4-
quinolinone (composé 103) - CRL8469
Me0
/N~
CRL8469
Sous atmosphère d'azote, 200 mg (0,71 mmol) de composé 26 sont solubilisés
dans
15 ml de N,N-diméthylformamide (DMF) anhydre. A 0°C, 26 mg (1,5 eq) de
NaH,
préalablement lavés dans de l'éther de pétrole, sont additionnés par petites
portions au
mélange réactionnel (réaction exothermique). Une solution de chlorure de 3-
diméthylaminoéthyle (205 mg,2 eq) dans 5 ml de DMF est ajoutée au milieu. La
réaction
est chauffée pendant 18 h à 90°C. Après refroidissement, de l'eau est
versée sur le
mélange réactionnel, puis ce dernier est agité pendant 15 min. La solution est
extraite
par de l'acétate d'éthyle (deux fois). La phase organique est séchée sur
MgS04, puis
3o évaporée sous pression réduite. Le résidu obtenu est purifié par
chromatographie sur
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
99
colonne de silice (éluant: AcOEt, puis AcOEt2/MeOH 97:3) pour donner 180 mg
(72%) de
composé 103 et 30 mg (12%) de dérivé 104.
~ PF : 142-143°C (AcOEt)
~ IR (KBr): v 1616, 1572, 1546, 1512 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 2.29 (s, 6H, NCH3), 2.68 (t; 2H, J = 6.9 Hz,
CHZ), 3.80
(s, 3H, OCH3), 3.89 (s, 3H, OCH3), 4.11 (t, 2H, J = 6.9 Hz, CHZ), 6.74 (d, 1
H, J = 2.2
Hz, HA~), 6.89 (d, 2H, J = 8.8 Hz, HA~), 6.95 (dd, 1 H, J = 2.2, 8.8 Hz, HAN),
7.57 (d, 2H,
J = 8.8 Hz, HA~), 7.59 (s, 1 H, =CH), 8.44 (d, 1 H, J = 8.8 Hz, HA~).
13C RMN (62.90 MHz, CDC13): â 45.8 (2), 51.3, 55.3, 55.6, 57.3, 97.7, 112.1,
113.6
1o (2), 121.2, 121.6, 128.0, 129.6, 129.7 (2), 140.7, 141.7, 158.6, 162.6,
175.4.
~ SM (ionspray): m/z 353 (M+1 )+
~ Anal. calculé pour CZ~HZ4N203: C, 71.57; H, 6.86; N, 7.95. Trouvé: C, 71.43,
H, 6.99;
N, 8.09. .
2) N-f2-[7-Méthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy}éthyl-N,N-diméthylamine
(composé 104)-CRL8523
~ huile
~ IR (film): v 1620, 1566, 1515, 1492 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 2.20 (s, 6H, CH3), 2.53 (t, 2H, J = 6.0 Hz,
CHZ), 3.77
(t, 2H, J = 6.0 Hz, OCHZ), 3.87 (s, 3H, OCH3), 3.95 (s, 3H, OCH3), 7.01 (d,
2H, J = 8.8
Hz, HAN), 7.21 (dd, 1 H, J = 2.2, 8.8 Hz, HA~), 7.40 (d, 1 H, J = 2.2 Hz,
HA~), 7.56 (d, 2H,
J = 8.8 Hz, HA~), 8.17 (d, 1 H, J = 8.8 Hz, HA~), 8.75 (s, 1 H, HA~).
~ 13C RMN (62.90 MHz, CDC13): 8 45.8 (2), 55.5, 55.6, 59.1, 71.2, 107.3, 114.3
(2),
119.0, 119.5, 122.8, 123.9, 128.2, 130.6 (2), 151.0, 153.8, 159.4, 159.7,
161Ø
~ SM (ionspray): m/z 353 (M+1 )+
~ Anal. calculé pour CZ~H24N203: C, 71.57; H, 6.86; N, 7.95. Trouvé: C, 71.67,
H, 6.97;
N, 7.89.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
EXEMPLE 74
100
4-[7-Méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-qu inolinyl]butanenitrile
(composé 105) - CRL8470 et {[7-Méthoxy-3-(4-méthoxyphényl)-4-
quinolyl]oxy)butanenitrile (composé 106)-CRL8524
1) 4-(7-Méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]butanenitrile
(composé 105) - CRL8470
CRL8470
Sous atmosphère d'azote, 200 mg (0,71 mmol) du composé 26 sont additionnés à
10
1o ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
735 mg de carbonate de potassium anhydre (7,5 eq), puis 0,20 ml de 4-
chlorobutyronitrile (3 eq). La réaction est agitée à 80°C pendant 18 h.
Les solvants sont
évaporés. Le résidu est repris dans le CH2CI2 et lavé par deux fois par de
l'eau. La
phase organique est séchée sur MgS04, puis évaporée sous pression réduite. Le
résidu
obtenu est purifié par chromatographie sur colonne de silice traitée avec de
la
triéthylamine (éluant: AcOEt) pour donner 80 mg (32%) du composé 105 et 130 mg
(53%) du dérivé 106.
~ PF : 151-152°C (AcOEt)
~ IR (KBr): v 2252, 1621, 1575, 1552, 1509 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 2.22-2.30 (m, 2H, CHZ), 2.46 (t, 2H, J = 7.2 Hz,
CHZCN), 3.83 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 4.28 (t, 2H, J = 7.2 Hz,
NCH2), 6.76
(d, 1 H, J = 2.2 Hz, HA~), 6.95 (d, 2H, J = 8.8 Hz, HAr), 7.00 (dd, 1 H, J =
2.2, 8.8 Hz,
HA~), 7.59 (d, 2H, J = 8.8 Hz, HAN), 7.61 (s, 1 H, =CH), 8.49 (d, 1 H, J = 8.8
Hz, HAr).
13C RMN (62.90 MHz, CDCI3): 8 14.7, 24.6, 51.0, 55.4, 55.9, 97.6, 112.4, 113.9
(2),
118.5, 121.7, 122.2, 127.6, 129.9 (2), 130.1, 140.5, 140.8, 159.0, 163.1,
175.6.
~ SM (ionspray): m/z 349 (M+1 )+
~ Anal. calculé pour C21H2oNzO3: C, 72.40; H, 5.79; N, 8.04. Trouvé: C, 72.07;
H, 5.65;
N, 7.93.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
101
2) ~[7-Méthoxy-3-(4-méthoxyphényl)-4-quinolyl]oxy)butanenitrile (composé 106)-
CRL8524
~ huile
~ IR (film): v 2248, 1620, 1565, 1514 cm-'
~ 1 H RMN (250 MHz, CDCI3): 8 1.87-1.97 (m, 2H, CH2), 2.43 (t, 2H, J = 7.2 Hz,
CH2),
3.80 (t, 2H, J = 7.2 Hz, CHZ), 3.86 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 7.02
(d, 2H, J =
8.8 Hz, HA,), 7.21 (dd, 1 H, J = 2.2, 8.8 Hz, HAN), 7.41 (d, 1 H, J = 2.2 Hz,
HA,), 7.49 (d,
2H, J = 8.8 Hz, HA~), 8.02 (d, 1 H, J = 8.8 Hz, HA~), 8.74 (s, 1 H, HA,).
13C RMN (62.90 MHz, CDC13): 8 14.2, 26.3, 55.5, 55.6, 71.2, 107.5, 114.4 (2),
118.5, 119.1, 119.9, 123.1, 123.2, 127.7, 130.6 (2), 151.0, 153.7, 158.8,
159.5, 161Ø
~ Anal. calculé pour CZ~HzoNpOg: C, 72.40; H, 5.79; N, 8.04. Trouvé: C, 72.21;
H, 5.93;
N, 8.12.
EXEMPLE 75
N,N-Diéthyl-3-[7-méthoxy-3-(4-méthoxyphényl)-4-oxo-1,4-dihydro-1-
quinolinyl]propanamide (composé 107)-CRL8525
Sous atmosphère d'azote, 330 mg (1.1 mmol) du composé 26 sont additionnés à 10
ml de N,N-diméthylformamide anhydre. A cette suspension sont ajoutés
successivement
1.18 g de carbonate de potassium anhydre (7,5 eq), puis 546 mg de l'acide 3-
bromopropionique (3 eq). La réaction est agitée à 80°C pendant 48 h.
Les solvants sont
évaporés. Le résidu est repris dans le CHZCIz et lavé par deux fois par de
l'eau. La
phase organique est séchée sur MgS04, puis évaporée sous pression réduite.
Sous
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
102
atmosphère d'azote, le composé brut est solubilisé dans 10 ml de CHZCIZ
anhydre. A
0°C, 263 mg (2,1 mmol) de diméthylaminopyridine et 275 mg (1,4 mmol)
d'EDCI sont
additionnés à la solution réactionnelle. La réaction est agitée 10 minutes à
0°C, avant
d'ajouter 0,15 ml (1,4 mmol) de diéthylamine. La solution finale est agitée 2
h à 0°C, puis
24 h à température ambiante. La phase organique est lavée plusieurs fois à
l'eau. La
phase organique est séchée sur MgS04, puis évaporée sous pression réduite. Le
résidu
obtenu est purifié par chromatographie sur colonne de silice (AcOEt) pour
donner 140 -
mg (26%) du composé 113.
~ PF : 158-159°C (AcOEt)
~ IR (KBr): v 1633, 1570, 1550, 1513 cm-'
~ 1 H RMN (250 MHz, CDC13): 8 1.03 (t, 3H, J = 7.2 Hz, CH3), 1.07 (t, 3H, J =
7.2 Hz,
CH3), 2.83 (t, 2H, J = 7.0 Hz, COCHz), 3.16 (q, 2H, J = 7.0 Hz, NCHZ), 3.36
(q, 2H, J =
7.0 Hz, NCH2), 3,82 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 4.52 (t, 2H, J = 7.0
Hz,
NCH2), 6.83 (d, 1 H, J = 2.2 Hz, HA~), 6.94 (d, 2H, J = 8.8 Hz, HA~), 6.98
(dd, 1 H, J =
2.2, 8.8 Hz, HA~), 7.61 (d, 2H, J = 8.8 Hz, HA~), 7.79 (s, 1 H, =CH), 8.49 (d,
1 H, J = 8.8
Hz, HA~).
13C RMN (62.90 MHz, CDC13): 8; 13.1, 14.4, 32.0, 40.7, 42.0, 49.1, 55.5, 55.9,
97.9,
111.9, 113.8 (2), 121.7, 121.9, 128.0, 129.9 (2), 130.1, 140.6, 141.8, 158.8,
162.8,
168.5, 175.7.
~ SM (ionspray): m/z 409 (M+1 )+
~ Anal. calculé pour C24H28Nz04: C, 70.57; H, 6.91; N, 6.86. Trouvé: C, 70.21;
H,
6.80; N, 6.77.
EXEMPLE 76
7-Méthoxy-3-(4-méthoxyphényl)-1-[2-(2H-1,2,3,4-tétrazol-5-yl)éthyl]-1,4-
dihydro-4-
quinolinone (composé 108)-CRL8474
Me0
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
103
Sous atmosphère d'argon, 150 mg (0.45 mmol) du composé 101 et 0,19 ml (0,67
mmol) d'azoture de tributylétain sont solubilisés dans 20 ml de toluène
anhydre. La
solution réactionnelle est agitée à 105°C pendant 48 h. Après
refroidissement, le solvant
est évaporé sous pression réduite. Le résidu obtenu est purifié par
chromatographie sur
colonne de silice (CHZCI2/MeOH 97:3) pour donner 152 mg (90%) du composé 108.
~ PF : 245-246°C (lavage MeOH)
~ IR (KBr) v 1617, 1556, 1524, 1511 cm-1 -
~ 1 H RMN (250 MHz, CDCI3): â 3.46 (t, 2H, J = 7.0 Hz, CH2), 3.79 (s, 3H,
OCH3),
3.93 (s, 3H, OCH3), 4.60 (t, 2H, J = 7.0 Hz, CHZ), 6.86-6.93 (m, 3H, HAr),
6.97 (dd, 1 H,
1o J = 2.2, 8.8 Hz, HAr), 7.43 (d, 2H, J = 8.8 Hz, HAr), 7.64 (s, 1 H, =CH),
8.38 (d, 1 H, J =
8.8 HZ, HAr).
13C RMN (62.90 MHz, DMSO-ds): 8 25.1, 51.8, 55.4, 55.8, 97.6, 113.1, 113.9
(2),
121.5, 121.9, 127.7, 129.6, 130.0 (2), 140.7, 142.0, 158.9, 163.1, 175.7.
~ SM (ionspray): m/z 378 (M+1 )+
~ Anal. calculé pour C2pH 1 gN5O3: C, 61.91; H, 5.20; N, 17.19. Trouvé: C,
62.00; H,
5.19; N, 17.30.
Les résultats des essais pharmacologiques, présentés ci-après, mettent en
évidence
les propriétés des composés de formule (I) et (la).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
104
1 - Activité cytotoxique sur des lignées cellulaires non-clonogènes en
culture (test Mn)
L'influence des composés de formule (I) et (la) sur les cellules non-
clonogènes a été
évaluée à l'aide du test colorimétrique MTT (T. Mosman. J. Immunol Methods
1983 ; 65
55-63, J. Carmichael et al. Cancer Res. 1987 ; 47 : 936-942).
Le principe, du test MTT est basé sur la réduction mitochondriale par les
cellules
vivantes métaboliquement actives du produit MTT (bromure de 3-(4,5-
diméthylthiazol-2
y1)-2,5 diphényltétrazoliûm) de couleur jaune én un produit de couleur bleue,
le
formazan. La quantité de formazan ainsi obtenue est directement
proportionnelle à la
quantité de cellules vivantes présentes dans le ou (les) puits) de culture.
Cette quantité
de formazan est mesurée par spectrophotométrie.
Les lignées cellulaires sont maintenues en culture monocouche à 37° C
dans des
boîtes de culture à bouchon fermé contenant du milieu de base MEM 25 MM HEPES
(Minimum Essential Medium). Ce milieu est bien adapté à la croissance d'une
gamme de
cellules variées diploïdes ou primaires de mammifères. Ce milieu est ensuite
additionné
- d'une quantité de 5% de SVF (Sérum de Veau Foetal) décomplémenté à
56° C
pendant 1 heure,
- de 0,6 mg/ml de L-glutamine,
- de 200 IU/ml de pénicilline,
- de 200 pg/ml de streptomycine,
- de 0,1 mg/ml de gentamicine.
Les 12 lignées cellulaires cancéreuses humaines qui ont été utilisées ont été
obtenues auprès de l'American Type Culture Collection (ATCC, Rockville, MD,
USA).
Ces 12 lignées cellulaires sont
- U-373MG (code ATCC : HTB-17) et U-87MG (code ATCC : HTB-14) qui sont
deux glioblastomes,
- SW1088 (code ATCC : HTB-12) qui est un astrocytome,
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
105
- A549 (code ATCC : CCL-185) et A-427 (code ATCC : HTB-53) qui sont deux
cancers du poumon non-à-petites-cellules,
- HCT-15 (code ATCC : CCL-225) et LoVo (code ATCC : CCL-229) qui sont deux
cancers colorectaux,
S - T-47D (code ATCC : HTB-133) et MCF7 (code ATCC : HTB-22) qui sont deux
cancers du sein,
- J82 (code ATCC : HTB-1 ) et T24 (code ATCC : HTB-4) qui sont deux cancers de
la vessie,
- PC-3 (code ATCC : CRL-1435) qui est un cancer de la prostate.
Au plan expérimental : 100 p1 d'une suspension cellulaire contenant 20 000 à
50 000
(selon le type cellulaire utilisé) cellules/ml de milieu de culture sont
ensemencés en
plaques multi-puits de 96 puits à fond plat et sont mis à incuber à
37°C, sous atmosphère
comprenant 5% de C02 et 70% d'humidité. Au bout de 24 heures d'incubation, le
milieu
de culture est remplacé par 100 NI de milieu frais contenant soit les
différents composés
à tester -à des concentrations variant de 10 5 à 10 10 M- soit le solvant
ayant servi à la
mise en solution des produits à tester (condition contrôle). Après 72 heures
d'incubation
dans les conditions définies ci-dessus, le milieu de culture est remplacé par
100 NI d'une
solution jaunâtre de MTT dissous à raison de 1 mg/ml dans du RPMI 1640. Les
microplaques sont remises à incuber pendant 3 heures à 37°C puis
centrifugées pendant
10 minutes à 400 g. La solution jaunâtre de MTT est éliminée et les cristaûx
de formazan
bleu formés au niveau cellulaire sont dissous dans 100 p1 de DMSO. Les
microplaques
sont ensuite mises sous agitation pendant 5 minutes. L'intensité de la
coloration bleue
résultant donc de la transformation du produit MTT jaune en formazan bleu par
les
cellules encore vivantes au terme de l'expérience est quantifiée par
spectrophotométrie à
l'aide d'un appareil de type DYNATECH IMMUNOASSAY SYSTEM aux longueurs
d'onde de 570 nm et 630 nm correspondant respectivement aux longueurs d'ondes
d'absorbance maximale du formazan et au bruit de fond. Un logiciel intégré au
spectrophotomètre calcule les valeurs moyennes de densité optique ainsi que
les valeurs
de déviation standard (Dév. Std.) et d'erreur standard sur la moyenne (ESM).
A titre d'exemple, on donnera dans les tableaux la, Ib, Ic et Id les résultats
de la
densité optique moyenne, exprimés en pourcentage par rapport à la densité
optique
moyenne mesurée dans la condition contrôle (posée égale à 100%), obtenus à la
concentration de 10-5 M sur les 12 lignées cellulaires tumorales précitées
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
106
m u7m m os In v m n m N ~'!o
M r r N r N < O r r N
* * * , 11 * * * * * * * * *
~ H ~ V) fn ~ N ~ tA
Z Z Z Z N
N h r m m m M N M m h O N
M N ~ ID'In M h M
m m m m m m m m m m rn m
P Q ~ V m m ~ ~ r M m
h r P9r N c'f N N N ~ N O
M
O
N * * * * * * * ~ * * +1 * +1 +I
H x N N V7 ~ ff7* ~ V1 ~ fn V7 O
Z Z co m Z ff7 Z Z Z ~
Z Z Z
Q o _ I N n o h N ,~ ~ N ,~
ri c
O ~ O O ~ 00fOmfM O N m O tmYi
M m 4'fr m N 10 r C9 r h M
m N N ~ N M ef'h r ~f r e"7~ ..
~ O
* * * * * ~ * ~ * * * * +I *
fn ~ N N V7 t V7 N ~ fA ~ f/71~ O
Z Z Z Z Z Z Z Z Z ~
V
Q InIc>In m v N M m N M N 1o M
'
~ r N c t m m 1f1~ N a0 a ~'1
P O) 07 01 Of M 01 ~t m m h
N ? m N ~ ~ m m
M '
Q ~ N N ~ N M p
" * *E*z +1~*s * * ** * * *t v * *~
N m 1A ~ r r z N Z IA r
IA
m r m
h m m m O ~ ~ ~ ~
m m m
H
h N P ~ 10 m M t0 N h N N M ~
N M r ~ r r N r N * 0
+1 O r * r
* * * * +1 * tA ~ * * M V7 *
, ff7V) ~ ~ (A m * ~ ~ 1 m VJ
1.P M In M e> Z m m : Z m
Z Z Z Z Z
n
: O r ..
~ ~ ~ o ~ ~ ~
al m ~ m
Z
<n m uf m m ~ m oy o r I
M 1
r N et N N Q M = ~ N r r N N
* * + * * M * r * * +1 t1 t1
~ ~ M H V7 (A N +1 * fn * f/7N ~
* * ~
4 1 M M m M Z ~ m ,r,,r 1~ m
_ Z Z Z Z Z Z Z Z
J an0? O~fO~f~ m O m m O m W Om1Ohf
fn m m M N N ~ m P7 M Of O~
m O
N ' N N ' M tO
N N N N N N P'1r
H ~ * * * * * * * * fA * * * *
: . Z fA M , , (A ~ Z ~ fA f/)~'
Z Z Z Z Z II
U N m m N m N M r h rn N ,
m o
d
J2 p h 1A 0D N I Of ~ tf1If>07 W
Q ,p
J m m Of m ! W M r m m m h
W
U
IAIA h M r m M 1f) r ~ r
1= N C
WN * r r * +1 r r r r N * *
~ +I* , ~ * W * * x ~ Z O
~ N ~ * ~ ~ ~
Z ~
~ Z o
t 1AIA fD 1"1 Ql ~ Q1 t ~ p
p
C
J m m m m m m m m M 1~ Oi O
U
N ~ m et M M ~ W m 01
M ~ ~f M r ~ r N r N r r N
* * * * * N
(n ff7fA (I7(A
m v m d' M * * * * * * +1 +l
Z Z Z Z Z m " m d. h m x ~ o
~ ~ ~ ~ ~ Z
r ~ ~
m O G~7m ~ aN001 0mDM CMDtm0m am0
d
m M m Ir m ~ M N N V h m 117M 0D
r N c'i C
C
_
2 * Z x ! +1 +1 ~ 2 ~ 2 Z x
Z Z O
3 0 m N m ~ M m v N ~ 1o
O p O E
N r m Ol I ~ m O N m n m p~
r
m m t O W m_1C
D i
('M W N M r 1f1V 00 ~ h t0 N N m
N
N r R N M r r N r N r
M * * * N * * * * +1 * * * * r
1n ~ N (A foiN x fn (A ~ fA fn fn
10
*
M m h ~ ~ m o h In m m In 1. h Z
Z Z Z Z Z Z Z Z Z
Q OI ImfIm m m m O ~ h n Of
m Ol r O O N
f l
7
~ N r ' M N N M t
<L* M ~ * (f N r * * * * r
M " * M * * * * ~ (n (n (n * *
(A ~ , fA (A ~ ~
1~ ~ h o~ ~ ID M tD m r Z at d. ,a
Z Z Z ' Z Z Z Z d
.
Q m ~ ~ ~ ~ ~ r ~ ~
r r C
O
T
O
INU E
m r~m rn n o m o N M u7 1.
O N N N N M ~ In In IA IA ~ 1(fN
~ O
J M M M M M M M M M M M M M
0 m m m m m m m m m m m m m m
ip
Z J J J J J J J J J J J J J J
Q' 2~0.'C 2~ 0 d' 2' 2~ 2' 2~ 0 ~' >
' ' ' 0
'
. . . .
U U U U U U U U U U U U U 11
U
+I
v x
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
107
M ~ et M 10 N aD ~ u7 ~ ~ O Of
N * M N t1 r r ~ r r O
* N * * * ao * * * * * * * N
~ N N tn (A(n
i ~ *
N Z C M Z
Z Z Z .
NN r N ~ N : r ~ O
aOD~ t0 0h0~ 0hDO O0I ~ ~ ~. O
0 p01
00 Of M N h 10 offa0O f7 1 h N V
~
h M r N r N r ~ r r
NY~ ~~ M~',~ ~~,~Z ~~'M~'NZ ~~ N~ N~tIZN~ C
~,
~ fl
N r ~ M t N V Of ~ 07N
N M 01 N h
01 0D 0D aDOf aD
aD N M 1D N 01 Iff N N 1~1~ 01
r r , r r
*~,t0~~'I~'*~'tiZ*i * *N *N *~,*~*~,*t
N a ao w ~ Z Z
r op ~ r M
a M O ~ 0
r O aMD~ O O 1 ~ W a~0a00
0
r M r N r r tff O! 07 N ~ tp p
' M
~ V ~ ~C N fh M N M r r H7
N * * * * * * t1 * * * * *
~ ?~ ~ t E ~ N U7 x N tn~ N
G
r t r tD M r O O M r a0 r M M
' Z Z Z Z Z
~ N ~ N < Of 1A c O p1 N N ~ N OI ..
a0 OD 00 ~ 0D i0 ~ O) a0 O 01h O ,
N
N fG:N h M ~ r W 10 N M
N r N M ' ~ O r O
h * * M * N r * N N N r r O * n
V ~ ~ * ~ * * V! * * M * w * N N
fn ~ N N fA(A ~ * ~ M
r tD M ~O l0 1p Z ~c7f0 N N Z
Z Z Z Z Z
a~OtMDOf aODV' OOf~ ~ Of th00 0 ~ N
Z
h r ~ M N M ~ ~ ~ M ~ M N N
~! * * * * * M * * ~ ~ * *
~ x (n M ~ x N N N ~ N ;
J CO i O r t !v7t0 M N h H Z N
Z Z Z Z Z Z
M M ~ ~ et CD 00 hpQ ~ O O pp h
'
r O
fn1Wf1 07 ~ O N c'1M M Of M O O O7 O
d' N N N O
r r N ~ < M e")N * * r * M ~ 11
F-+1 t1 * Z * t1 * * fn f/7* x Z ~
~, ~ , ~ ~ ~' !!J ~
()r A 00 N M N O h O N r , y
Z Z Z
J= 0 N O N ~ ~ 0 0 M O
~
1 OI a . ~ 0 Q ~
0 0 7 J
U O
N a0 ef ~ h O W l1 O~ N V
O N
W
N r ~ N O r
Z M * Z * 10 Z * Z * * .
~ i Z Z ~ Z
W W 101 a0
0
J ONf~ CO 0 0 007001~ 0 001007e 007O
~
~
U
N N M aD h ~ N N
r O c7 r r ~ M r r r N r r O
+1 * * * * . * ~ * * +I* *
~ , ~' ~ Z ~ N N7 f/)~ N fn f!)
,
i- h 1A M N N M N Z W N h m ~
Z Z Z Z Z
e< N r
O a0 h 1A Of O 007O 0010M0~ O O
N
O d0 N N V IO 1(1~ h O ~!M IffC
o M N M N r M ~ e1 N M r ~ C
D . * * * * * * * * * ~ * * * 7.
* $ V7 ~ tp N ViN t~ O o ~ , O
, Z Z Z Q M ~ ~
M ' Z Z Z o
3 r ~ r op o ~. ~ O y~ E
a ~
N a~or n ~ ~ ~ ~ ~ ~ m T n ~ ~o
r
N ~ t0 a! 0f m h N OI H
V r
< ~ ' N
ehn* * * ~ +1 * * * +I * + ~ ~ * m
~ ~ Z ~ ~ f/7~ N ' N y N
~ ~
M N ao ao uf h r Z p Z op
O Z o Z
'~1 ~ < O~fN OOI' O f O O
7
O Iff~ aD O H1 h t0 ~ t0 N t M OI r
r r N N e r
N
r r r O
N * M * * * r * * * * * * *
~ ~ Z ~ fn ~ ~ (A x ~ x ~ ~
Z Z
0Qr ~ ~ 1~ W ~fIM M f7 N Iff~ C1
0 h ~ N W ~ h ~ h ~ 0 0 h C
M
0 O O 0 0 0 t
0 D J0 0
N
T
w
Z 00 Ql O O r N h 0 Q! O r N M r
O N 1(7f0 h h h 0 h h 0 0 0 c0 01 d
h o 0 c '
J M M M M M M M M M M M M M M
O ao ao ao o ao m ao o as o m roW ao m
a a a
Z J J J J J J J J J J J J J J >
~ ' ' ' '
2 2 Q 2~ 2 2~ C. 2'~' 2~ 2~ 2~2~ 2~ II
7 U U U U U U U U U U U U U U
~ *
x
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
108
h O m h N m V7 N ~: r m m
N r r M N r m ~ r ~ N tt
* * * * * * * tn * * * M
~ N ~ !n ! (n * ~ (n M ~ n
z a ~ z M z ' z
z z
h u,~ M ,,.,z ~ N
m
r h N1 Of N M ~ N m M
N m m m m ~ m C7 m 10 ' m r
Y7 1~ 1 m M V h N r m <
N < _ ~ ~ N r
h r N ~ N ao * M N m N
Z ~ ~ ~ '
~ ~
N M ~ m aM0 n aN0O M ~ ~ r
< r
h m M ~ m N m O ~ h
V - m ~ N
u~m * * * * _ * '~'~* * * * * ~
~ Z ~ ' ~ * ~ ~ V7 tn V7 ~ fA tn
~
Q 1. M m m N N h t0 u'f1(f N N m h
Z Z Z Z Z
h m tNff~ M ~ ~ h ~ Ohi a00m 0m1
m Iv h ~ N m m m N ~ M < N
N
Q M 1'f'M N M ~ N' N r M N N
h * * * * +1.~.~* * * * '~'~* * *
~ ~ ~ (n ~ ~ N H V7 fA ~ (n N ~ f/7
Z Z M Z N 1A Z h
2 Z Z Z
m m M h r m N N ~ N P ~"~m m
a f~ ~ tG f~O r ~ O ~ O ~ ~ m
m m m m h <
M m r ~ N M X17< m m m p~h N7
h M N M ~ M N r
* ~ * * * * * * * * ~.~j* *
~ ~ ~ U7 ~ N W (A N ~ , * ~' I
Z Z f7 m N
Z Z 2
V ~ m ~ N N ~ N ~ N N m
~ h M 0 h 0 O m M
m
a 0 t m i O ~ 0 O 1
0 1 0 0 < f f O
1~ ~ h M ~ O~h m V m m m
' "
< r N r ~ r r P' M N M O
* ~ * * +~ * * * * * +.*
~ * ~ ~ s z t * . N
~
J h m ~ h M h m N N m m _
o~D 001M h m a~Dm ' ~' h
t00 tmD
N
m ~T m m M h ~ 00M ~ m N ~:
r N N r r r < N N N r
JH * * * * * * * * * * * * +~ +1
~ ~ ~' (n ~ ~ ~ ~ ~"~~ ~ ~ N N
Z ~ o
U a ao h h osm m v o m a:Z v
Z
J2 ~ ' M M N M m M O N ~7 ~ O O
W Q O a I o r
f 0 0 0
Ci
r ~ M h W h < N m ~ a0
W N r < N N r N M r N 'Q r
IL~ * * + * * * * Z * * * * *
~ V7 # (n ~ !n ~ V7 ~ ~ ~
Z Z Z Z
M m m N m m N et M r O ~ t7
O h M' M M V m m N h h W O
J h O7 p1 O1 m O7 m ~ m ~ h h m
N C9 < H ~ Iffef h M N tTm
r h M ~ t~ r
* ~ * I * V M +~ fV ~ M '~ *
N $ VJ * N * * tn * Z +~Z 2
Z Z ~ M ~ (I72 ~ Z
Z 2
i- M N m m m If7~ M , N h V
O1 0 0m1N O n Ohlr ~ 0 0mfm
r <
m t ~l7m ~ 00M N Q h M N h
_ M ~ M
m N r r r N et ~ ~ r
~ r*. ; ~ * ~ v ~ ~
z Z ~ ~ t Z .
h
O h o0 N r h ~ h er m N
N N M r
~ N ~ ~ ~ ~ ~ * ~ ~ ~ * N *
x ~ z ~ z ~ ~ ~
m r N ~ N Yf
o N ~ ~ rn m m ~ m m
m
r m M U7 h h m W m M N
O ~ r m r m
~ hx *i *~ N ~ *~N N Hf M *,h
*. *~*x *s *N *~ *~
Z
aQN Of N M m < m N ~ m m m
M
7 m ~ ~ W N 0M0 m a<0ON7N hp ONfm E
t O
W
N M et ~tfN M ~ O e- ~ f7~ 1f)
O Of m ~ O O r e- N N I N M M
N
M M M '1 ~ ~ V ~ ~ ? ~ V V
m m C0 m m m m m m m m m m
J J J J J J J J J J J J J J
2' C' ~ 2' 2'd' Q'2~ 2' 2~ 2~ d'2' 2'
U U U U U U U U U U U U U U
v
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
109
~ N ~ h f0 N N M 0 h 0
'7 r N
M M r P r N N -
V * * * ~ ~ * * +I ~ * ~ * ,~
Z " ~' Z i ~ Z V7 Z Z " Z v
a 0 r N M r M . et Of
'1 Z
r h
0010~fM' Of aO~ ~ 00)~ 00f0 0070
00 M p~ p aDr ~: N M O
h O N c'7- r O M P7 r
N * ~ * * ~ * +l * * r * * * O
# N ~ ~ ~ ~ (/~~ N * ~' tn Vl V
h ~
0 M r r ~ .p 1A h f M
Z Z _ Z
Z
O N ~ N N ~ 0 0
0 ~ C a
D 0
h [: N a001 1~ W l7 N e1 r
~ N N r ~ r '1 N ' O
* * * * t1 * M N ~
Z . ~ ; x Z * Z x
~ r Z
N I 0Dt0 i~'f ~ tD N
_ ~
m agio~ rn ~ ~ ~ ~
'
z
N aD ~ 0 ~ M 0 Of N M 1 ~ p
N r ' M ' f ~ _ r ~
'
Q P C9e ~ ~ * r
h * * f * * +I * * * M * * * V
$ * ~ N ~ fA t/7N !A , f/7!n
~ h o ?
r N rn N M Z ~ N 2 N a Z a
Z Z Z Z
~ O7 N 00 N 10 Il7O N ~ ~
~
O 0 h N 0 ~ r O7 0 r
~i
V r 0 r M O 0 ? O
h 0 M ? D
r N N M M ~ r r r
< * I
V * * * * * * * * u7 * ~ * * a
# ~ ~ ~ ~ ~ (A N M u) ~, ~1 .
Z Z Z Z Z Z
v h ~ N v m en M M t0 ao
0
0 n ~ GOpV 001~ 0 00ih Oh70Nf
01 M ~
a0 N M 0 ~ O~ r h M M
t~'f'M ~ ~ ~ r 1h ~ V N
7 '~ * * * * * +I ~ * * * * *
o ~ m ~ Z Z ~ N M H N N V7
N ~ ~ ~p
h ~ ~ Z Z o ap N o ~
J O ~ N N m n 0 Z Z Z Z p
0 0 n 0
I e~ 0 0 0 0 a
O 7 r 7 1 f 7 D
(n a0 01 ~ t0 N N h 07 V M O
llJ~ N N r M V N N N' M O
JH ~Z ~Z *~.V ~ M~'~~ N r N 0 0DZ~ II
*tp * *
Z Z
h Z 2 Z O
7 p
J2 O O fh tD IvN O ~f 0 O 0 ~O
~ h 01 h O
J r
U O
V
W 0 t0 t0 O~ M h h r M 0D ~ N N G
N O r r N r M N * r r -
tL N * * * N * * * fn * +I * *
Z~ ~ ~ ~ ~ ~ ~ N fn r H ~ ~
Z Z Z Z Z Z
Z
h h 0 t0 ~ 0D ~ 0 tf7aO
)
C O ~ < ~ ~ M ~ OM10 0W10f o00O0fO
J
Ci
00 ih 0D N N ~ r et Gp fD r N
r N r e~
r
* r N
N * * * m ~ * +I N * * * * +I
2 ~' ~ 2 Z ~ N ~ N , H H fn
h ~
f-n r N p h Z - en ~p In ,..Z
Z Z Z Z
r Q r
O07~ r ~ M O 0 000~ 00f
d
N Of V N r N r 0 N ~ ~ N C
00 r V -r M r N N ~ r r r C
o * * * * '~* +I * * * * * +I
N fn h ~ fA~,.~(A N V7 N N V7 ,~ O
r h ~ t h ~ ~p ao ~ ~ Of h ~
Z Z Z Z Z Z Z Z Z
(n p01t00W ~ M Q010010 ~ ON!I
p
('Of ~ 0 N r O 0 0 r r h r N
~
N ~"~V 1h M ~ V 'p
M * t1 * * * * +I * * * * * * 0
h ~ Z ~ ~ ~ ~ s VJ V7 fA (r7V7 fW 'o
~'! o ~n h N N a
M N N ao ~ o~ ~ Z ~ Z Z Z Z
Z
r N r ~
r r r r N
7
Of M r 10 ~ ~ H W r h ~ v
r N r r r N N N '
* * * * * * ~ ~,j* +l * N *
, (A ~ ~ flJ# Z * Z Z Z
M Z
0QM ~ N CV Z Yf 1(1N M h ~ Z
Z ~ Z G!
On)OOf ~ ~ ~ n 0 N O 0 G
~ O 0 O N
7 f f T
uNl
~ n ~o ~ ~ ~ ~ ~ ~~o8 ~ r-
V~ ~ ' ~ d
J O O ~ ~ ? ~ < tY V ~ V ~ V
m O O O m O O m O O O
Z J J J J J J J J J J J J J >
Q' 2~ 2' C' 2'2' 2' ~ 2~ 2' ~ C.'2' II
U U U U U U U U U U U U U
*
x
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
110
Ces résultats montrent que ces produits de formule (I) et (la) présentent un
pouvoir
antitumoral faible. Ces produits non cytotoxiques induisent, lorsque c'est le
cas, une
inhibition de la prolifération cellulaire globale de ces lignées seulement à
la concentration
de 10-5 M et cette inhibition à quelques exceptions près ne dépasse pas 30 %.
Aux autres
concentrations testées seuls quelques effets marginaux peuvent être mis en
évidence.
2. - Détermination de la dose maximale tolérée (DMT)
L'évaluation de la dose maximale tolérée a été réalisée chez des souris
B6D2F1/Jico
âgées de 4 à 6 semaines. Les composés ont été administrés par voie
intrapéritonéale à
des doses croissantes s'échelonnant de 2,5 à 160 mg/kg. La valeur de la DMT
(exprimée en mg/kg) est déterminée à partir de l'observation du taux de survie
des
animaux sur une période de 14 jours après une administration unique du produit
considéré. L'évolution pondérale des animaux est également suivie pendant
cette
période. Lorsque que la valeur de la DMT est supérieure à 160 mg/kg, la valeur
de la
DMT est assimilée à 160 mg/kg par défaut.
Les résultats de l'estimation de la dose maximale tolérée (DMT) sont
rassemblés dans le
tableau II suivant
TABLEAU II
Dose maximales tolérées
Com oss DMT m /k
CRL
CRL8326 Exem le > 160
1
CRL8327 Exem le > 160
11
CRL8328 Exem le 80
2
CRL8329 Exem le > 160
12
CRL8337 Exem le > 160
18
CRL8340 Exem le > 160
25
CRL8349 Exem le > 160
29
CRL8350 Exem le > 160
33
CRL8351 Exem le . 40
16
CRL8352 Exem le > 160
9
CRL8353 Exem le > 160
6
CRL8354 Exem le > 160
17
CRL8355 Exem le > 160
8
CRL8357 Exem le 80
32
CRL8358 Exem le > 160
15
CRL8359 Exem le > 160
5
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
111
CRL8360 Exem le > 160
30
CRL8371 Exem le 40
34
CRL8372 Exem le > 160
31
CRL8377 Exem le > 160
20
CRL8378 Exem le > 160
14
CRL8379 Exem le > 160
4
CRL8380 Exem le > 160
35
CRL8381 Exem le > 160
36
CRL8382 Exem le > 160
38
CRL8383 Exem le > 160
7
CRL8391 Exemple > 160
40
CRL8392 Exem le > 160
41
CRL8393 Exem le > 160
23
CRL8394 Exem le > 160
24
CRL8404 Exem le > 160
47
CRL8405 Exem le > 160
45
CRL8412 Exem le > 160
48
CRL8413 Exem le > 160
49
CRL8414 Exem le > 160
44
CRL8420 Exemple > 160
52
CRL8460 Exem le > 160
51
CRL8424 Exem le > 160
46
CRL8425 Exemple > 160
58
CRL8434 Exem le > 160
59
CRL8435 Exem le > 160
60
CRL8436 Exem le > 160
61
CRL8437 Exem le > 160
62
CRL8461 Exem le > 160
65
CRL8462 Exem le > 160
66
CRL8464 Exem le > 160
67
CRL8465 Exem le > 160
69
CRL8466 Exem le > 160
70
CRL8467 Exem le > 160
71
CRL8468 Exem le > 160
72
CRL8470 Exem le > 160
74
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
112
A de très rares exceptions près, les produits de cette famille ne présentent
pas de toxicité
directe et peuvent donc être utilisés in vivo à des concentrations tissulaires
élevées, donc
à des posologies fortes.
3. Propriété d'amplification de la réponse antitumorale des associations « 4-
quinolones-médicaments cytotoxiques» sur lignées cellulaires non-clonogènes -
en culture
La propriété inattendue des 4-quinolones revendiquées se rapporte à une
activité
amplificatrice de la réponse anti-tumorale de médicaments cytotoxiques établis
lorsque
une 4-quinolone est ajoutée au traitement conventionnel. Cette propriété
d'amplification
de la réponse thérapeutique standard (avec ses avantages revendiqués :
majoration de
l'efficacité et optimisation du rapport bénéfice/risque) est mise en évidence
par les
résultats des études in vitro décrites ci-après.
L'activité antitumorale in vitro de l'association des « composés de formules
(I) et
(la) combinés à différents cytotoxiques connus et utilisés en chimiothérapie »
a été
évaluée sur les deux lignées cellulaires tumorales humaines d'origine
colorectale HCT-15
et LoVo à l'aide du test colorimétrique MTT comme décrit dans le paragraphe
précédent
intitulé « 1-Activité cytotoxique sur des lignées cellulaires non-clonogènes
en culture (test
MTT) ». .
A titre d'exemple non limitatif, les résultats obtenus sur la lignée HCT-15
sont
donnés ci-après. Dans cet exemple, les composés ~ de formules (I) et (la), à
la
concentration de 10-5M (non significativement cytotoxique), ont été combinés
avec l'
adriamycine (concentration 10-'M) ou avec l'étoposide (concentration 10-6M).
Les
concentrations de 10'M pour l' adriamycine et de 10-6M pour l'étoposide
représentent
respectivement les concentrations des deux cytotoxiques qui inhibent de 50%
(1C50) la
croissance cellulaire in vitro de la lignée HCT-15. Le gain d'activité
antitumorale obtenu
avec le traitement « composés de formules (I) ou (la) » combinés à « l'
étoposide 10~M
par rapport à l'activité antitumorale l'étoposide utilisé seul (traitement de
référence) est
calculé de la même manière.
L'association CRL8370 (composé 63) 10-5M- adriamycine 10-'M permet d'inhiber
la croissance de la lignée cellulaire HCT-15 de 15,2% de plus (en valeur
absolue) que l'
adriamycine 10-'M utilisée seule. L' adriamycine 10-'M inhibe la prolifération
de la lignée
HCT-15 de 42,8% et le traitement combiné CRL8370 10-5M + adriamycine 10-'M de
58%
d'ou le gain d'activité de 15,2% (58% - 42,8%) du traitement combiné par
rapport à
l'activité à l' adriamycine utilisé seule.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
113
Dans les mêmes conditions que ci-dessus, la combinaison d'autres produits
revendiqués à ces mêmes cytotoxiques a conduit aux amplifications de réponse
anti-
tumorale suivantes
- avec adriamvcine 10-~ M
CRL8327com os 19 +16,0%
CRL8358com os 26 +23,0%
CRL8424(compos 72) +15,0% -
- avec étoaoside 10-6 M
CRL8327com os 19) +20%
CRL8340com os 40 +16%
CRL8350com os 54 +15,5%
CRL8353com os 11 +16,0%
CRL8354com os 31 +15%
CRL8358com os 26 +22%
CRL8370com os 63) +23%
CRL8383com os 12 +23%
CRL8382(compos 62) +27%
Les résultats obtenus sur la lignée cellulaire LoVo sont de même amplitude que
ceux obtenus sur la lignée HCT-15.
Ces exemples non limitatifs indiquent ainsi que, même si les composés de
formules (I) et (la) ne présentent pas d'activité cytotoxique lorsqu'ils sont
utilisés seuls,
[voir paragraphe précédent intitulé « 1-Activité cytotoxique sur des lignées
cellulaires
non-clonogènes en culture (test MTT) »], ils augmentent de manière
significative l'activité
antitumorale des cytotoxiques utilisés à ce jour en chimiothérapie lorsqu'ils
sont
combinés avec ces derniers.
De fait, l'amplification de réponse antitumorale est plus importante puisque,
à titre
d'exemple pour le composé CRL 8370, le gain d'activité obtenu avec la
combinaison
(+15,20%) représente une amplification de l'ordre de 35% (soit 15,2/42,8 =
35,5%) par
rapport à l'activité de l'adriamycine seule.
Ces résultats montrent qu'il est ainsi possible, grâce aux traitements
combinés,
entre ces composés de formules (I) ou (la) non cytotoxiques avec un
cytotoxique usuel,
d'obtenir une activité antitumorale plus importante qui ne pourrait être
obtenue avec le
cytotoxique considéré utilisé seul que si ce dernier était utilisé à une
concentration bien
plus élevée, ce qui - par voie de conséquence - augmenterait également de
façon
considérable les effets secondaires indésirables du protocole thérapeutique
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
114
conventionnel. Les composés de formules (1) ou (1a) améliorent donc le ratio
bénéfice
thérapeutique/risque de chaque chimiothérapie conventionnelle.
On donnera ci-après des exemples de modalité d'utilisation des composés
de formule (I) et (la) dans des protocoles de mono ou polychimiothérapie par
des agents
cytotoxiques. Dans ces protocoles, les composés de formule (I) et (la) seront
appelés,
pour simplifier, "4-quinolone".
A. Tumeurs solides
1 °/ Cancers du poumon
1.1. Non à petites cellules (stade avancé)
- au protocole recommandé (T. Le Chevalier et al., J. Clin. Oncol. 1994 ; 12 :
360-
367) sont ajoutées les perfusions intraveineuses d'une 4-quinolone
dose voie jours
4-quinolone 40-2000 mg/m2/jour J~, J8, J,5, J2Z,
ou 1 - 50 mg/kg/jouri.v. J29, et J3s
erfusion de 1 h
3h
navelbine 30 mg /mz/jour i.v. J,, J8, J,S, J2z,
J29, et J3s
cisplatine 120 mg/m2 i.v. J, et J29
Cette cure est à répéter 8 fois.
1.2. A petites cellules (stade avancé)
- au protocole recommandé CAV ou VAC (B.J. Roth et al., J. Clin. Oncol. 1992
; 10 : 282-291 ) sont ajoutées les perfusions de 4-quinolone
dose voie jours
4- uinolone 40-2000 m /m2/jour
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
115
ou 1 - 50 mg/kg/jouri.v. J, ,
erfusion de
1 h 3h
cyclosphophamide 1000 mg /m2 i.v. J,
bolus
doxorubicine 40 50 mg/m2 i.v. J,
bolus
vincristine 1 1,4 mg/m2 i.v. J, -
bolus
(max 2 m )
Cette cure est à répéter 6 fois tous les 21 jours.
- au protocole recommandé Pt-E (B.J. Roth et al., J. Clin. Oncol. 1992 ; 10
282-291 ) sont ajoutées les perfusions de 4-quinolone.
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, - JS
erfusion de 1 h
3h
cisplatine 20 mg mg /m2/jour i.v. J, - J5
perfusion de 20
60
minutes
toposide 80 mg/m2/jour i.v. J, - J5
erfusion de 60 minutes
chaque cycle est répété tous les 21 jours et la cure comprend 6 cycles.
1.3. Cancer bronchique non à petites cellules, localement avancé ou
métastatique
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
116
~ monochimiothérapie
dose voie jours
4-quinolone 40-2000 mg/mz/jour J,, J8, J,5
ou 1 - 50 mg/kg/jouri.v. puis 1 semaine/repos
erfusion de 1 h -
3h
gemcitabine 1000 mg/m2/jour i.v. J,, J8, J,5
perfusion de 0,5 puis 1 semaine/repos
heure
la cure pouvant comporter la répétition de ce cycle de 4 semaines.
~ association gemcitabine/cisplatine
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, -J5, J8 -J,5
perfusion de 1
h 3h
gemcitabine 1000 mg/m2/jour i.v. J,, Ja, J,5
perfusion de 0,5
heure
cisplatine 20 mg/m2/jour i.v. J,
perfusion de 20-60
minutes
la cure comportant la répétition de ce cycle tous les 21 jours.
2°/ Cancers du sein
- protocole CMF en traitement adjuvant du cancer du sein opérable (G.
Bonnadonna et al., N. Engl. J. Med. ;1976 ; 294 : 405-410)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
117
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, J,4
erfusion de 1 h
3h
cyclophosphamide100 mg /m2/jour orale J, J,4
mthotrexate 40 mg/mz i.v. J, et J8
bolus
5-FU 600 mg/m2 i.v. J, et J8
chaque cycle est répété tous les 28 jours et la cure comporte 6 cycles.
- protocole AC (B. Fisher et al., J. Clin. Oncol. ; 1990 ; 8 : 1483 - 1496) en
traitement adjuvant
dose voie jours
4-quinolone 40-2000 mg/mz/jour
ou 1 - 50 mg/kg/jouri.v. J,
erfusin de 1 h
3h
doxorubicine 60 mg /m2 i.v. J,
bolus
cyclophosphamide 600 mg/mz i.v. J,
bolus
chaque cycle est répété tous les 21 jours et la cure comporte 4 cycles.
- cancers du sein avec métastases
- dans le protocole FAC (A.U. Buzdar et al., Cancer 1981 ; 47 : 2537 - 2542)
et
ses différentes adaptations, les perfusions de 4-quinolone sont ajoutées
selon le schéma (non limitatif) suivant
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
118
dose voie jours
4-quinolone 40-2000 mg/mz/jour J,-JS et
J$-J,2
ou 1 - 50 mg/kg/jouri.v. ou J, -J5
perfusion de
1 h 3h
5-FU 500 mg /m2/jour i.v. J, et J8
ou J, -JZ
_
bolus
doxorubicine 50 mg/m2 i.v. J, ou
bolus J, et JZ
cyclophosphamide 500 mg/m2 bolus i.v.J,
ou orale J,
chaque cycle est répété toutes les 3 semaines jusqu'au diagnostic d'une
nouvelle progression de la maladie.
- dans le protocole CAF (G. Falkson et al., Cancer 1985 ; 56 : 219 - 224)
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, -J,4
erfusion de 1
h 3h
cyclophosphamide 100 mg /m2/jour orale J,-J,4
doxorubicine 30 mg/m2 i.v. J, et J8
bolus
5-FU 500 mg/m2 i.v. J, et JB
bolus
chaque cycle est répété tous les 28 jours jusqu'au diagnostic d'une nouvelle
progression de la maladie.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
119
- dans le protocole CMF
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J,-J5 et J8-J,2
erfusion de 1
h 3h
cyclophosphamide 600 mg /mz/jour I.v. J, et J8
bolus
mthotrexate 40 mg/m2/jour i.v. J, et J8
bolus
5-FU 600 mg/m2/jour i.v. J, et J8
bolus
ce cycle est à répéter toutes les 3 à 5 semaines et la cure comporte 6 cycles.
- dans le protocole CMF-VP
dose voie jours
J, -Js
4-quinolone 40-2000 mg/mz/jour J8-J,2
ou 1 - 50 mg/kg/jour.v. J,5-J,9
perfusion de Jzz-J26
1 h 3h
cyclophosphamide 2 2,5 mg /kg/jourorale chaque jour
mthotrexate 25 50 mg/m2/jouri.v. J,, J8,J,5,
J22
5-FU 300 500 mg/m2/jouri.v. J,, J8 J,S,
J22
vincristine 0,6 1,2 mg/m2/jouri.v. J,, J8 J,S,
JZz
prednisone 30 mg/m2/jour orale de J, J,o
cette cure est à répéter toutes les 4 semaines.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
120
- dans le protocole FEC
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -JS
ou 1 - 50 mg/kg/jouri.v. et J8-J,2
erfusion de 1
h 3h
5-FU 600 mg /m2/jour i.v J, et J$
pirubicine 50 mg/mz i.v. J,
cyclophosphamide600 mg/m2 i.v. J,
cette cure est à répéter toutes les 3 semaines.
- dans le protocole MMC-VBC (C. Brambilla et al., Tumori, 1989 ; 75 : 141-144)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -J5
ou 1 - 50 mg/kg/jouri.v. et J,5-J,9
-
erfusion de 1
h 3h
mitomycine 10 mg /m2 i.v J,
C
bolus
vinblastine 50 mg/m2/jour i.v. J, et J,5
bolus
cette cure est à répéter tous les 28 jours jusqu'au diagnostic de progression
de
la maladie.
- dans le protocole NFL (S.E. Jones et al., J. Clin. Oncol. 1991 ; 9 : 1736 -
1739)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
121
dose voie jours
4-quinolone 40-2000 mg/mz/jour J, -JS
ou 1 - 50 mg/kg/jouri.v.
perfusion de 1
h 3h
mitoxantrone 10 mg /m2 i.v J,
bolus
5-FU 1000 mg /m2 i.v J, -J3
en perfusion de
24 heures
leucovorine 100 mg/m2 i.v. J,
bolus
la cure comporte deux cycles espacés de 21 jours puis nécessite une
évaluation.
Les perfusions de 4-quinolone peuvent également être associées au traitement
des cancers du sein avec métastases lorsque un taxoïde est utilisé, par
exemple:
- avec paclitaxel (F.A. Holmes et al., J. Natl Cancer Inst. 1991 ; 83 : 1797 -
1805) dans le traitement des formes avec métastases éventuellement
résistantes aux anthracyclines
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, - J5
perfusion de 1
h 3h
paclitaxel 175 mg /m2 i.v J,
en perfusion de
3 24 heures
Ce cycle est répété tous les 21 jours jusqu'à ce qu'une nouvelle progression
de la maladie soit diagnostiquée.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
122
- avec docetaxel (C.A. Hudis et al., J. Clin. Oncol. 1996 ; 14 : 58 -65), dans
le
cancer du sein localement avancé ou métastatique, résistant ou en rechute ,
après chimiothérapie cytoxique (ayant comporté une anthracycline) ou en
rechute au cours d'un traitement adjuvant
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, - J5
erfusion de 1 h
3h
docetaxel 100 mg Im2 i.v J,
ou 60-100 mg/m2
en
perfusion de 1
heure
ou de 24 heures
Ce cycle est répété tous les 21 jours pour une cure de 2 cycles ou jusqu'à
apparition d'une progression de la maladie.
- dans les protocoles d'intensification de dose, associant une transplantation
de
cellules médullaires autologues et de cellules-souches du sang périphérique,
en consolidation du traitement de première intention, par exemple
- protocole CPB (W.P. Peters et al., J. Clin. Oncol. 1993 ; 11 : 132 -
1143), dans lequel la perfusion i.v. de cellules-souches a lieu les jours J_,,
Jo
et J,
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J~ J_,
erfusion de 1 h
3h
cyclophosphamide 1875 mg /m2 i.v J~ J~
en perfusion de
1 heure
cisplatine 55 mg/m2/jour i.v. J~ J~
en perfusion continue
de
24 heures
carmustine 600 mg/m2/jour i.v. J_3
BCNU en perfusion de
2 heures
- protocole CTCb (K. Antman et al., J. Clin. Oncol. 1992 ; 10 : 102 -
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
123
110), dans lequel la perfusion i.v. de cellules-souches a lieu le jour Jo
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J_, J_,
erfusion de 1 h
3h
cyclophosphamide 1500 mg /m2 i.v J_, J_3
en perfusion continue
de
24 heures 4 doses)
thiotepa 125 mg/m2 i.v. J_, J_3
en perfusion continue
de
24 heures 4 doses
carboplatine 200 mg/m2 i.v. J_, J_3
en perfusion continue
de
24-heures(4 doses
- protocole CTM (L.E. Damon et al., J. Clin. Oncol. 1989 ; 7 : 560-571
et I.C. Henderson et al., J. Cellular Biochem. 1994 (Suppl 18B) : 95) dans
lequel la perfusion i.v. de cellules-souches hématopoïetiques a lieu le jour
Jo
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J_6 J_,
erfusion de 1 h
3h
cyclophosphamide 1500 mg /mz/jour i.v J~ J_3
en perfusion de
1 heure
thiotepa 150 mg/m2/jour i.v. J_6 J_3
en erfusion de
2 heures
mitoxantrone 10 - 15 mg/m2 i.v. J.~ J_3
en perfusion de
1 heure
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
124
3°/ Cancers gynécologiques
3.1 Cancer de l'ovaire
- pour le traitement des carcinomes ovariens, en particulier métastatiques
i) protocole PAC (G. A. Omura et al. J. Clin. Oncol. 1989 ; 7 : 457 - 465) :
les
perfusions de 4-quinolones sont administrées selon le schéma suivant
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jour' i.v. J, -J5
erfusion de 1 h
3h
cisplatine 50 mg /m2 J,
(ou 40 -90 mg/m2) i.v.
perfusion de 1 2
heures
doxorubicine 50 mg/mz bolus i.v. J,
(ou 30 50 m /m2
cyclosphosphamide 1000 mg/m2 i.v. J,
perfusion de 1 2
heures
ou 200 600 m /m2)
ce cycle est répété tous les 21 à 28 jours et la cure comporte 8 cycles.
ü) protocole altretamine, d'après A. Marietta et al. (Gynecol. Oncol. 1990 ;
36:
93 -96)
dose voie jours
4-quinolone 40-2000 mg/mz/jour J~ -J5
ou 1 - 50 mg/kg/jouri.v. J$-J,2
erfusion de 1 h
3h
altretamine 200 mg /m2/jour J, -J15
diviss en 4 doses orale
la cure comportant deux cycles, espacés de 28 jours.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
125
ü) protocole paclitaxel : les 4-quinolones peuvent être ajoutées au protocole
de paclitaxel tel qu'il a été décrit par W.P. Mc Guire et al. (Ann. Intern.
Med.
1989 ; 111 : 273 - 279)
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 -50 mg/kg/jour i.v. J,-J3
erfusion de 1 h 3h
paclitaxel 135 mg /m2
perfusion de 3 heuresi.v. J,
ou de
24 heures
la cure comportant deux de ces cycles, espacés de 28 jours (avec évaluation
à l'issue).
pour le traitement des carcinomes ovariens métastatiques et réfractaires, les
4-quinolones peuvent être ajoutés au protocole de seconde intention, à base
de topotécan
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jour i.v. J, -J5
erfusion de 1 h 3h
topotecan 1,5 mg /m2/jour
perfusion de 0,5 heurei.v. J, -J5
la cure comportant deux cycles, espacés de 21 jours (avec évaluation à
l'issue)
d'après A.P. Kudelka et al. (J. Clin. Oncol. 1996 ; 14 : 1552 - 1557).
3.2 Tumeurs trophoblastiques
- chez les patientes à faible risque, les 4-quinolones pourront être associées
au
protocole décrit par H. Takamizawa et al. (Semin. Surg. Oncol. 1987 ;
3 : 36 - 44)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
126
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, -J5
perfusion de 1
h 3h
methotrexate (MTX) 20 mg /jour i.m. J,-J5
dactinomycine 0,5 mg /jour en i.v. J, -J5
bolus
(DACT)
(protocole MTX-DATC).
3.3 Cancers de l'utérus
- les 4-quinolones peuvent également être associées au protocole CAV (ou
VAC) selon le schéma ci-après
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 -50 mg/kg/jouri.v. J~-J3
perfusion de 1 h
3h
cyclophosphamide 750 - 1200 mg/m2 i.v. J,
en perfusion
doxorubicine 45 -50 mg/m2 i.v. J,
en erfusion
vincristine 1,4 mg/m2 i.v. J,
la cure comportant la répétition de ce cycle tous les 21 jours.
- dans le protocole FAP
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 m /k i.v. J, -J5
/jour
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
127
erfusion de 1
h 3h
fluorouracile 600 mg/m2/jour i.v. J,, J8
(5-FU)
doxorubicine 30 mg/m2 i.v. J,
cisplatine 75 mg/m2 i.v. J,
la cure comportant la répétition de ce cycle tous les 21 ou 28 jours.
4°/ Cancers du testicule
- les 4-quinolones peuvent également être associées aux protocoles du cancer
des testicules
Protocole BEP dose voie jours
:
4-quinolone 40-2000 mg/mz/jour
ou 1 - 50 mg/kg/jouri.v. J, -JS
perfusion de 1 h
3h
blomycine 30 mg/m2 i.v. J~
en erfusion
toposide 100 mg/m2/jour i.v. J, -J5
en perfusion
cisplatine 20 mg/m2/jour i.v. J, -J5
la cure comportant 3 cycles, à raison de 1 cycle tous les 21 jours.
5°/ Cancers de la vessie
- les 4-quinolones peuvent être associées au protocole CISCA2 (aussi appelé
PAC)
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, -J5
erfusion de 1 h
3h
cis latine 50 m /m2 i.v. J,
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
128
cyclophosphamide 600 mg/mz i.v. J,
en erfusion
doxorubicine 75 mg/m2 i.v. J,
en perfusion
le cycle étant à répéter toutes les 3 semaines.
- dans le protocole MVAC (d'après CN Sternberg et I., J. Urol. 1988 ; 139 :
461 -
469)
dose voie jours
4-quinolone 40-2000 mg/mz/jour J,-J3
ou 1 - 50 mg/kg/jouri.v. J,5-J,s
perfusion de 1 h Jzz-Jzs
3h
mthotrexate 30 mg/m2 bolus i.v. J,, J,S,
Jzz
vinblastine 3 mg/mz i.v. Jz ou
J2, J,s,
Jzz
doxorubicine 30 mg/m2 bolus i.v. J2
cisplatine 70-100 mg/mz i.v. J, ou J2
perfusion de 1 h
ce cycle étant répété toutes les 4 à 5 semaines, au minimum pour 2 cycles.
6°/ Carcinomes naso-pharyngés I Cancers de la téte et du
cou
- Les 4-quinolones peuvent être valablement associées aux protocoles de
polychimiothérapie utilisés dans le traitement de ces cancers
6.1 Cancers naso-pharyngés
- protocole ABVD
Dose voie jours
4-quinolone ~ 40-2000 mg/m2/jour~ J, -J3
~
ou 1 - 50 mg/kg/jouri.v. J8-J,o
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
129
erfusion de 1 h u J,5-J,~
3h
doxorubicine 30 mg/m2/jour i.v. J, et J8 ou
J,5
blomycine 10 mg/mZ/jour i.v. J, et J8 ou
J,5
vinblastine 6 mg/m2/jour i.v. J, etJBOU J,5
dacarbazine 200 mg/m2/jour i.v. J, et J8 ou
J,5
la cure comportant 1 à 6 cycles répétés à raison de 1 cycle toutes les 4
semaines.
6.2 Cancers de la tête et du cou avec métastases
- dans le protocole Pt-FU (ex : pour les cancers du pharynx) : d'après le DVAL
Study Group (New Engl. J. M. 1991 ; 324 : 1685 - 1690)
dose voie jours
4-quinolone 40-2000 mg/ma/jour
ou 1 - 50 mg/kg/jouri.v. J, -J5
erfusion de 1 h
3h
cisplatine 100 mg/m2 i.v. J,
erfusion de 1 heure
fluorouracile (5-FU)~ 1000 mg/m2/jour ~ i.v. ~ J, -J5
perfusion continue
la cure comportant deux cycles, à raison de 1 cycle toutes les 3 semaines.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
130
7°! Sarcomes des tissus mous
Les 4-quinolones peuvent être introduites dans un protocole tel que le
protocole CYVADIC
- d'après H.M. Pinedo et ai. (Cancer 1984 ; 53 : 1825)
dose voe jours
J,-J5
4-quinoione 40-2000 mg/mz/jour J8-J,a
ou 1 - 50 mglkg/jouri.v. J,5'J17
erfusion de 1 h
3h
cyclophosphamide 500 mg/m2 bolus i,v. J2
(Cy)
vincristine (V} 1,5 mg/mzljour i.v. J,, J$,J,S
bolus
doxorubicine (A) 50 mglm2 boius i.v. J~
dacarbazine (D!C) 250 mglm2ljour .v. J,-JS
erfusion de 15
minutes
!a cure comportant la répétition de ce cycle toutes les 4 semaines, d'abord
pour 2 cycles.
8°I Cancer de !a rostate hormono-refractaire avec métastases
- dans le protocole VBL-estramustine, d'aprés G.R. Hudis et al. (J. Cün.
Oncoi.
1992 ; 10 : 1754 : 1761 }
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
131
Dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J3, J8-J,o
ou 1 - 50 mg/kg/jouri.v. J,5-J", J22-Jz4
erfusion de 1 h J29-J3,, J3s-Jss
3h
vinblastine 4 mg/m2/jour bolusi.v. J,, J8,J,5, Jz2,
J29, Jss
estramustine 200 mg/m2 tid orale chaque jour pendant
6
(600 mg/m2/jour) semaines
un cycle de traitement durant 6 semaines et étant suivi de 2 semaines
d'intervalle libre.
9°I Cancers des cellules germinales
i) pour les tumeurs de pronostic favorable
- protocole Pt-E, d'après G.J. Bosl et al. (J. Clin. Oncol. 1988 ; 6 : 1231 -
1238)
Dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J , -J5
perfusion de 1 h
3h
cisplatin (Pt)20 mg/m2/jour i.v. J,-J5
perfusion de 20
60
minutes
toposide (E) 100 mg/m2/jour i.v. J,-J5
perfusion de 1 heure
la cure comportant 4 cycles, à raison de 1 cycle tous les 21 ou 28 jours.
ü) pour les tumeurs avec métastases
- protocole PEB, d'après S.D. Williams et al. (N. Eng. J. Med. 1987 ; 316
1435-1440):
Dose voie jours
4- uinolone 40-2000 m /mz/'our J,-J5
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
132
ou 1 - 50 mg/kg/jouri.v. J 9-J"
perfusion de 1 J,6-J,$
h 3h
cisplatine (P) 20 mg/m2/jour i.v. J , -J5
perfusion de 20
60
minutes
toposide (E) 100 mg/m2/jour i.v. JZ, J9, J,6
erfusion de 1
heure
blomycine (B) 30U (ou mg)/jour i.v. J,-J5
bolus
la cure comportant 4 cycles, à raison de 1 cycle tous les 21 jours.
10°/ Cancers du rein
- carcinome rénal métastatique : les 4-quinolones peuvent être introduites
dans le protocole décrit par M. J. Wilkinson et al. (Cancer 1993 ; 71 : 3601-
3604):
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -JS
ou 1 - 50 mg/kg/jouri.v. J8-J,5
erfusion de 1
h 3h
floxuridine 0,075 mg/kg/jouri.v. J, -J,4
perfusion continue
la cure comportant deux cycles espacés de 28 jours.
- néphroblastome : les 4-quinolones peuvent être introduites dans le protocole
DAVE
dose voie jours
4-quinolone 40-2000 mg/mZ/jour J, -J3
ou 1 - 50 mg/kg/jouri.v. J8-J,o
erfusion de 1
h 3h
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
133
dactinomycine 0,6 mg/m2/jour i.v. J,, J8
doxorubicine 30 mg/mz/jour i.v. J,, J$
cyclophosphamide 200 mg/m2 /jour i.v. J,, J8
erfusion de 1 heure
à raison d'un cycle toutes les 3 à 4 semaines.
1 1 °/ Cancers du tube digiestif
11.1 Cancers de l'oesophagé
- les 4-quinolones peuvent être introduites dans le protocole FAP selon
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -J3
ou 1 - 50 mg/kg/jouri.v. J8-J,o
perfusion de 1
h 3h
5-fluorouracile 600 mg/m2 i.v. J,; J8
(5-FU)
doxorubicine 30 mg/m2 i.v. J ,
cisplatine 75 mg/m2 i.v. J,
ce cycle étant répété toutes les 3 à 4 semaines.
11.2 Cancers de l'estomac
- dans les carcinomes gastriques avancés et/ou avec métastases
- protocole EAP (d'après P. Preusser et al. , J. Clin. Oncol. 1989 ; 7 : 1310)
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, -J5, J8-J,o
erfusion de 1
h 3h
toposide 120 mg/m2/jour i.v. J3, J4, JS ou
perfusion de 1 J4-J6
heure
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
134
doxorubicine 20 mg/m2/jour i.v. J,, J,
bolus
cisplatine 40 mg/m2/jour i.v. J2, J8
erfusion de 1
heure
à raison de 1 cycle tous les 28 jours.
- protocole FAMtx : d'après J.A. Wils et al. (J. Clin. Oncol. 1991 ; 89 :
827):
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jouri.v. J, -J3
erfusion de 1 h
3h
fluorouracile (5-FU)1500 mg/mz bolus i.v. J,
(F)
1 heure prs le mthotrexate _
doxorubicine (A) 30 mg/m2 bolus i.v. J,5
mthotrexate (Mtx) 1500 mg/mz i.v. J,
perfusion de 30 minutes
la cure comportant d'abord deux cycles, espacés de 28 jours.
- chez certains malades, ce protocole ou sa variante (l'épirubicine remplaçant
la doxorubicine) pourront être utilisés selon le schéma suivant
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
135
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 - 50 mg/kg/jour i.v. J, -J3
erfusion de 1 h 3h
fluorouracile (5-FU)1500 mg/m2 i.v. J,
doxorubicine (A) 30 mg/m2 bolus i.v. J, = FAMTx
ou
pirubicine (A) 60 mg/m2 bolus i.v. J, = FEMTx
mthotrexate 1500 mg/m2 i.v. J,
perfuser avant le
5-FU
leucovorine 15 mg/m2/jour orale J2-J4
12°/ Cancers colo-rectaux
- les 4-quinolones peuvent étre introduites dans le protocole de trâitement
S adjuvant FU-Levamizole du cancer colo-rectal (d'après C.G. Moertel et al. ,
N. Eng. J. Med. 1990 ; 322 : 352)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -JS
ou 1 - 50 mg/kg/jouri.v. JZS-Js,
erfusion de 1 h
3h
5-fluorouracile 450 mg/m2/jour bolusi.v. J,-JS
5-fluorouracile 450 mg/m2 bolus i.v. Jzs
lvamisole 50 mg tid orale 3 jours/semaine
une semaine
sur
deux
le traitement en bolus par le 5-FU étant répété chaque semaine après la
phase d'induction J, - J5, pendant .52 semaines ; celui par une 4-quinolone
étant répété sur le même rythme, le jour du bolus de 5-FU puis les 2 jours
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
136
suivants.
- pour le traitement du cancer colo-rectal, refractaire au traitement par 5-
fluorouracile (5-FU) et avec métastases
- d'après M.L. Rothenberg et al. (J. Clin. Oncol. 1996 ; 14 : 1128-1135)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -J3, JS-J,o,
J,5-J",
ou 1 - 50 mg/kg/jouri.v. J22-J24
perfusion de 1
h 3h
irinotecan 125 mg/m2/jour i.v. J,, Je, J,S,
J22
la cure comportant deux cycles, espacés de 42 jours.
13°/ Sarcomes de Ka~osi
- les 4-quinolones peuvent étre associées aux deux protocoles utlisant des
antracyclines formulées en liposomes
i) protocole décrit par P.S. Gill et al. (J. Clin. Oncol. 1995 ; 13 : 996-
1003) et
C.A. Presant et al. (Lancet 1993 ; 341 : 1242-1243)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J3
ou 1 - 50 mg/kg/jouri.v. et J,5-J"
erfusion de 1
h 3h
daunorubicine liposomale20 mg/m2/jour i.v. J,, J,5
erfusion de 1
heure
la cure comportant deux cycles répétés à 28 jours d'intervalle avant d'évaluer
les effets.
ü) protocole de M. Harrison et al. (J. Clin. Oncol. 1995 ; 13 : 914-920)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
137
dose voie jours
4-quinolone 40-2000 mg/m2/jour J~ -J3
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1
h 3h
doxorubicine 20 mg/m2 i.v. J~
liposomale perfusion de 30
minutes
la cure comportant deux cycles répétés à 28 jours d'intervalle avant d'évaluer
les effets.
14°/ Mélanomes métastatigues
- les 4-quinolones peuvent également étre incorporées aux protocoles
combinés de traitement des mélanomes malins métastatiques
- protocole DTIC/TAM : d'après G. Cocconi et al. (N. Eng. J. Med. 1992 ; 327
516), la cure comprenant la répétition de 4 cycles, à raison de 1 cycle tous
les 21 jours, selon le schéma ci-après :. _
dose voie jours
4-quinolone 40-2000 mg/mz/jour J, -J5
ou 1 - 50 mg/kg/jour i.v.
erfusion de 1 h 3h
dacarbazine 250 mg/m2/jour i.v. J, -J5
(DTIC) perfusion [15 30 min.
si cathter
central] ou [30 min. si
perfusion
priphri ue dans 250 ml
tamoxifen (TAM)20 mg/m2/jour orale J, -J5
la cure comportant 4 cycles à raison de 1 cycle tous les 21 jours.
15°I Carcinome neuroendocrine
- les 4-quinolones peuvent être associées au protocole décrit par C.G. Moertel
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
138
et al. (Cancer 1991 ; 68 : 227)
- protocole Pt-E
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -J3
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
toposide 130 mg/mz/jour i.v. J, -J3
perfusion de 1 heure
cisplatine 45 mg/m2/jour i.v. J2, J3
erfusion de 1 heure
la cure comportant deux cycles répétés tous les 28 jours.
16°/ Cancer du pancréas
- adéno-carcinome pancréatique de stade avancé : les 4-quinolones
peuvent être associées au traitement par gemcitabine, selon le protocle de
M. Moore et al. (Proc. Am. Soc. Clin. Oncol. 1995 ; 14 : 473)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J3, J8-J,o,
Jas,
ou 1 - 50 mg/kg/jouri.v. JZZ,J2s, Jss,
J43, Js,
erfusion de 1 h
3h
gemcitabine 1000 mg/m2 i.v. J,, J8, J,s,
Jzz, JZ9,
perfusion de 0,5 J3g,J43, puis
heure Js, puis
une fois/semaine
pendant 3 semaines
puis 1 semaine
repos
et valuation
B. Onco-hématologie
1°/ Leucémies algues de l'adulte
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
139
1.1. Leucémie lymphoblastique gigue
1.1.1. Protocole de Linker
Les 4-quinolones peuvent être ajoutées aux protocoles de Linker -
Chimiothérapie d'induction et chimiothérapie de consolidation . (voir C.A.
S Linker et al. Blood 1987 ; 69 : 1242-1248 et C.A. Linker et al. Blood 1991 ;
78
2814-2822) selon les schémas suivants
i) chimiothérapie d'induction
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J5, J8-J,z,
J,5-
ou 1 - 50 mg/kg/jour i.v. J,9
erfusion de 1 h 3h
daunorubicine 50 mg/m2 bolus i.v. J,, J2, J3
toutes les 24 heures
(30 mg/m2
chez les atients de +
de 50 ans)
vincristine 2 mg bolus i.v. J,, Ja, J,S,
J22
prednisone 60 mg/m2/jour oraleJ, -J2a
L-asparaginase 6000 U/m2 i.m. J"-J2$
ü) chimiothérapie de consolidation (régime A)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J5, J8-J,2
ou 1 - 50 mg/kg/jouri.v.
perfusion de 1 h
3h
daunorubicine 50 mg/m2 bolus i.v. J,, JZ
toutes les 24 heures
vincristine 2 mg bolus i.v. J,, J$
prednisone 60 mg/m2/jour orale J~ -J,a
diviss en 3 doses
L-asparaginase 12000 U/m2 i.m. JZ, J4, J,, J9
et J,a
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
140
la cure de consolidation A comprend 4 cycles consécutifs tels que celui décrit
ci-dessus = Cycles 1, 3, 5 et 7.
iii) chimiothérapie de consolidation (régimes B et C)
Les régimes décrits ci-dessous correspondent aux cycles de consolidation 2,
4, 6 et 8 (régime ,B) et 9 (régime C), décrits par C.A. Linker et al.
rgime B : dose voie jours
4-quinolone 40-2000 mg/mz/jour J,-J5, J8-J,z
ou 1 - 50 mg/kg/jouri.v.
perfusion de 1
h 3h
Ara-C 300 mg/m2 i.v. J,, J4, J8, J"
perfusion de 2
heures
tniposide 165 mg/mz i.v. J,, J4, Je, J"
perfusion de 2
heures
4 c cles
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
141
rgime C : dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -J5
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
mthotrexate 690 mg/m2 i.v. J,-J2
perfusion continue
de 42
heures
leucovorin 15 mg/m2 orale JZ-JS
toutes les 6 heures
1.1.2. Protocole de Hoelzer
Les produits revendiqués pourront être ajoutés aux cytotoxiques de ce
protocole de polychimiothérapie (D. Hoelzer et al., Blood 1984 ; 64 : 38-47,
D. Hoelzer et al. , Blood 1988 ; 71 : 123-131 ) selon le schéma suivant
i) chimiothérapie d'induction / Phase 1 : .
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J5, J8-J,Z,
J,5-J,9
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
daunorubicine 25 mg/mz i.v. J,, J8, J,S,
Jzz
vincristine 1,5 mg/m2 i.v. J,, J8, J,S,
J22
(maximum 2 mg)
prednisone 60 mg/mz orale J,-JZ$
L-asparaginase 5000 U/m2 i.m. J,-J,4
(maximum 2 mg)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
142
ü) chimiothérapie d'induction / Phase 2
La phase 2 de l'induction pourra être réalisée comme suit
dose voie jours
4-quinolone 40-2000 mg/m2/jour J29-J33~ Jss-Jao,
,
ou 1 - 50 mg/kg/jouri.v. J43-J47
erfusion de 1 h
3h
cyclosphosphamide 650 mg/m2 i.v. Jz9, J43, J5,
(maximum 1000 mg)
cytarabine 75 mg/m2/jour i.v. J3,-J34, J3g-J41,
perfusion de 1 J45-J48~ Jsz-Jss
heure
mercaptopurine 60 mg/m2 orale Jz9-J5,
methotrexate 10 mg/mz/jour i.v. J3,, J38, J45,
Jsz
(maximum 15 mg)
iii) chimiothérapie de ré-induction / Phase 1
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, -J5, J8-J,z,
ou 1 - 50 mg/kg/jouri.v. J,5-J,9, Jzz-Jz6
erfusion de 1
h 3h
doxorubicine 25 mg/m2/jour i.v. J,, J8, J,S,
Jzz
dexamethasone 10 mg/m2/jour orale J,-Jz$
vincristine 1,5 mg/m2/jour orale J,, J8, J,Set
(maximum 2 mg) Jzz
iv) chimiothérapie de ré-induction / Phase 2
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
143
dose voie jours
4-quinolone 40-2000 mg/m2/jour
ou 1 -50 mg/kg/jouri.v. J3,-J35, Jse-J4z
erfusion de 1
h 3h
cyclophosphamide 650 mg/m2 i.v. Jz9
(maximum : 1000
mg)
cytarabine 75 mg/mz i.v. J3, -J34, J38-J4,
thioguanine 60 mg/mz orale Jz9-J4z
1.2. Leucémies myéloïdes aiguës
1.2.1. Traitement de l'adulte de tout âge
Les 4-quinolones peuvent être ajoutées, selon le schéma ci-dessous, au
traitement incorporant la dose standard de cytarabine antérieurement décrit
par R.O. Dilleman et al. (Blond, 1991 ; 78 : 2520-2526), Z.A. Arlin et al.
(Leukemia 1990 ; 4 : 177-183) et P.H. Wiernik et al. (Blond 1992 ; 79 : 313-
319)
dose voie jours
4-quinolone 40-2000 mg/mz/jour J, -J,z
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1
h 3h
cytarabine 100-200 mg/m2/jouri.v. J, -J~
en erfusion continue
daunorubicine 45 mg/m2/jour i.v. J, -J3,
en bolus ou
(30 mg/mz/jour J8-J,o
si ge
>_ 60 ans)
ou
mitoxantrone 12 mg/m2 i.v. J, -J3
en bolus quotidien
ou
idarubicine 13 mg/m2 i.v. J, -J3
en bolus uotidien
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
144
1.2.2. Traitement de l'adulte d'âge inférieur à 60 ans
i) chimiothérapie d'induction
Ce cycle d'induction incorpore l'administration de cytarabine à forte dose
selon
le schéma suivant
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J,o
ou 1 - 50 mg/kg/jouri.v.
perfusion de 1 h
3h
Ara-C (cytarabine)2000 mg/m2/jour i.v. J, -J6
en perfusion de 2
heures,
toutes les 12 heures
daunorubicine 60 mg/mz/jour i.v. J4-Js
en perfusion continue
de 24
heures
ou
cytarabine 3000 mg/m2/jour i.v. J,-J6
. .en perfusion de
1 heure,
toutes les 12 heures
daunorubicine 45 mg/m2 bolus i.v. J,-J9
toutes les 24 heures
(afin de réduire le risque de toxicité S.N.C., en cas d'insuffisance rénale,
ajuster la posologie de cytarabine à la clairance de la créatinine)
d'après L.E. Damon et al. (Leukemia 1994 ; 8 : 535-541), G.L. Phillips et al.
(Blond 1991 ; 77 : 1429-1435) et G. Smith et al. (J. Clin. Oncol. 1997 ; 15
833-839).
ü) chimiothérapie de consolidation
Le cycle, décrit ci-après, sera répété 8 fois, à raison de 1 cycle toutes les
4 à 6
semaines (d'après R.J. Mayer et al., N. Engl J. Med. 1994 ; 331 : 896-903):
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-JS
ou 1 - 50 m /k
/cour
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
145
erfusion de 1 h
3h
cytarabine 3000 mg/mz i.v. J,, J3,
JS
en perfusion de
3 heures
toutes les 12 heures
(4 cycles)
puis 100 mg/m2/jour
c tarabine toues les 12 heuress.c. J,
daunorubicine 45 mg/m2 bolus i.v. J,
(4 cycles)
iii) chimiothérapie de consolidation (avec forte dose de cytarabine)
Le cycle, décrit ci-après, devra étre. répété 2 fois et est adapté d'après
G.L.
Phillips et al. (Blond 1991 ; 77 : 1429-1435) ; S.N. Wolff et al. (J. Clin.
Oncol.
1989 ; 7 : 1260 -1267) ; R.J. Mayer et al. (N. Engl J. Med. 1994 ; 331 : 896-
903)
dose voie jours
4-quinolone 40-2000 mg/m2/jour i.v. J,-J,o
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
cytarabine 3000 mg/m2 i.v. J, -J6
1 heure toutes les
12 heures
daunorubicine 30-45 mg/m2/jour i.v. J,-J9
bolus
1 fois/jour
1.2.3. Traitement de l'adulte d'âge égal ou supérieur à 60 ans
Les substances revendiquées pourront étre ajoutées aux protocoles de
chimiothérapies de consolidation ci-après
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
146
i) selon R.O. Dilman et al. (Blond 1991 ; 78 ; 2520-2526), Z.A. Arlin et al.
(Leukemia 1990 ; 4 : 177-183), P.H. Wiernik et al. (1992 ; 79 : 313-319)
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J, -Js
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
cytarabine (Ara-C)100-200 mg/mz i.v. J,-JS
perfusion continue
de 24
heures
daunorubicine 30-45 mg/m2/jour i.v. J,, J2
bolus
OU
mitoxantrone 12 mg/mz/jour i.v. J,, J2
bolus
ou
idarubicine 13 mg/m2/jour i.v. J,, Jz
bolus
-S ü) selon R.J. Mayer et al. (N. Engl. J. Med. 194 ; 331 : 896-903)
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-J6
ou 1 - 50 mg/kg/jour
perfusion de 1
h 3h
cytarabine 100 mg/m2 i.v. J,-J5
perfusion continue
de 24
heures (4 cycles)
puis
cytarabine 100 mg/m2 s.c. J,, J5
toutes les 12 heures
daunorubicine 45 mg/m2/jour i.v. J,
bolus (4 cycles)
iii) selon C.A. Linker et al. (Blond 1993 ; 81 : 311-318), N. Chan et al.
(Blond 1993 ;
81 : 319-323) et A.M. Yeager at al. (N. Eng. J. Med. 1986 ; 315 : 145-147)
Ce protocole comprend une transplantation de moëlle osseuse autologue
(pratiquée le jour Jo)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
147
dose voie jours
4-quinolone 40-2000 mg/mZ/jouri.v. J_,-J_2
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
busulfan 1 mg/kg qid orale J_, J~
(au total 16 doses)
toposide 60 mg/kg/jour i.v. J_3
perfusion de 10
heures
OU
dose voie jours
4-quinolone 40-2000 mg/mz/jouri.v. J_9-J_,
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
busulfan 1 mg/kg qid orale J_9 J~
cyclophosphamide50 mg/kg/jour i.v. J_5 J_z
perfusion- de 1
heure
iv) en cas de transplantation de moëlle osseuse allogène HLA-compatible selon:
P.J. Tutscha et al. Blood 1987 ; 70 : 1382-1388,
F.R. Applebaum et al., Ann. Int. Med. 1984 ; 101 : 581-588
dose voie jours
4-quinolone 40-2000 mg/mz/jouri.v. J_,-J_,
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
busulfan 1 mg/kg qid orale J_, J~
(au total 16 doses)
cyclophosphamide60 mg/kg/jour i.v. J_3 J_2
perfusion de 1
heure
2°/ Leucémies chroniques de l'adulte
2.1 Leucémie myéloïde chronique
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
148
En phase myéloblastique, les 4-quinolones peuvent être ajoutées au
traitement HU-Mith, décrit par C.A. Koller et al. (N. Engl. J. med. 1986 ; 315
1433-1438)
dose voie jours
J, - Js
4-quinolone 40-2000 mg/m2/jour i.v. J8-J,Z
ou 1 - 50 mg/kg/jour J,5-J,s
erfusion de 1 h J22-Jzs
3h
hydroxyure 500 mg/jour orale tous les jours
quotidien pendant
mithramycine25Ng/kg/jour i.v. 3 semaines puis
erfusion de 2-4 3 fois/semaine
heures
2.2 Leucémie lymphocytaire chronique
2.2.1 Protocole FCG-CLL
Les 4-quinolones peuvent être ajoutées aux combinaisons "chlorambucil
pulsé" telles que décrites par E. Kimby et al. (Leuk. Lymphoma 1991 ; 5
(Suppl.) 93-96) et par le FCGCLL (Blond 1990 ; 75 : 1422-1425)
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-J5, J_8-J,2,
J,5-J22
ou 1 - 50 mg/kg/jour
erfusion de 1
h 3h
chlorambucil 0,1 mg/kg/jor orale 1 fois/jour
_ou
chlorambucil 0,4 mg/kg/jour orale J,
tous les 14 jours
_et
prednisone 75 mg/jour orale J,-J3
2.2.2 Protocole fludarabine-CdA
d'après H.G. Chun et al. (J. Clin. Oncol. 1991 ; 9 : 175-188), M.J. Keating et
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
149
al. (Blond 1989 ; 74 : 19-25 / J. Clin. Oncol. 1991 ; 9 : 44-49) et A. Saven
et
al. (J. Clin. Oncol. 1995 ; 13 : 570-574)
dose voie jours
4-quinolone 40-2000 mg/m2/jour i.v. J, -J8
ou 1 - 50 mg/kg/jour (1 fois/mois
pour 6
erfusion de 1 h 12 cycles)
3h
fludarabine 25-30 mg/m2/jour i.v. J,-J5
perfusion de 30
minutes
[toutes les 4 semaines
pour
6 12 cycles)
ou
cladibrine 0,09 mg/kg/jour i.v. J,-J,
en perfusion continue
[1 cycle tous les
28 35
jours pour 1 9
cycles
mdiane : 4 c cles
3°I Maladies lymphoprolifératives
3.1 Maladie de Hodgkin
Les 4-quinolones peuvent être incorporées aux protocoles de
polychimiothérapie utilisés classiquement pour le traitement du lymphome de
Hodgkin
3.1.1 Protocole AVDB
d'après G. Bonnadonna et al. (Cancer Clin. Trials 1979 ; 2 : 217-226) et G.P.
Canellos et al. (N. Engl. J. Med. 1993 ; 327 : 1478-1484)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
150
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-J3, J,5-J,8
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
doxorubicine 25 mg/mz bolus i.v. J,, J,5
(A)
blomycine (B) 10 U/m2 bolus i.v. J,, J,5
vinblastine 6 mg/m2 bolus i.v. J,, J,5
(V)
dacarbazine 375 mg/m2 bolus i.v. J,, J,5
(D)
la cure comportant 6 à 8 cycles, à raison de 1 cycle tous les 28 jours.
3.1.2 Protocole MOPP/ABVD
d'après G. Bonnadonna et al. (Ann. Intern. fVled. 1986 ; 104 : 739-746) et G.
P. Canellos et al. (N. Engl. J. Med.,1993 ; 327 : 1478-1484)
Le protocole MOPP doit être alterné avec le protocole ABVD (cf. ~ 3.1.1 )
tous les 28 jours et la cure comporte 6 cycles
Protocole dose voie jours
MOPP :
4-quinolone 40-2000 mg/m2/jour i.v. J,-J3, J8-J"
ou 1 - 50 mg/kg/jour et J,4-J"
erfusion de 1 h
3h
mechlorethami6 mg/m2 bolus i.v. J,, J8
ne (M)
vincristine 1,4 mg/m2 bolus i.v. J,, JB
(O)
(pas de maximum)
procarbazine 100 mg/m2/jour orale J, -J,4
(P)
prednisone 40 m /m2/jour orale J,-J,4
P
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
151
3.1.3 Protocole Stanford V
d'après N.L. Bartlett et al. (J. Clin. Oncol. 1995 ; 13 : 1080-1088)
dose voie jours
J, -Js
4-quinolone 40-2000 mg/m2/jour i.v. J8-J,Z
ou 1 - 50 mg/kg/jour J,5-J,9
erfusion de 1 h J22-Jzs
3h
doxorubicine 25 mg/m2 i.v. J,, J,5
vinblastine 6 mg/m2 bolus i.v. J,, J,5
(4mg/m2 au cours
du cycle 3
si ge >_ 50 ans)
mechlorethamine6 mg/m2 bolus i.v. J,
(M)
vincristine 1,4 mg/m2 bolus i.v. J,, Jz2
(dose max : 2 mg)
[1 mg/mz au cours
du cycle 3
si e>_50ans
blomycine S U/m2 i.v. J8, Jzz
toposide 60 mg/mz orale J,S, J,s
prednisone 40 mg/m2/jour orale 1/fois semaine
(semaines
1_g)
la cure comportant 3 cycles à raison de 1 cycle tous les 28 jours.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
152
3.1.4 Protocole EVA
d'après G.P. Canellos et al. (Proc. Am. Soc. Clin. Oncol. 1991 ; 10 : 273)
dose voie jours
4-quinolone 40-2000 mg/mz/jouri.v. J,-J5
ou 1 - 50 mg/kg/jour
erfusion de 1
h 3h
toposide (E) 100 mg/m2 orale J,, JZ, J3
perfusion de 2
heures
vinblastine (V) 6 mg/m2 bolus i.v. J,
doxorubicine 50 mg/m2 bolus i.v. J,
(A)
la cure comportant 6 cycles, à raison de 1 cycle tous les 28 jours.
3.1.5 Protocole B-CAVe
d'après W.G. Harker et al. (Ann. Intern. Med. 1984 ; 101 : 440-446)
dose voie jours
4-quinolone 40-2000 mg/mz/jouri.v. J, -J3
ou 1 - 50 mg/kg/jour
perfusion de
1 h 3h
blomycine (B) 5 U/m2 bolus i.v. J,
lomustine (CCNU) 100 mg/m2 orale J, .
doxorubicine (A) 60 mg/mz bolus i.v. J,
_
vinblastine (Ve) 5 mg/m2 bolus i.v. J,
la cure comportant 8 cycles, à raison de 1 cycle tous les 28 jours.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
153
3.2. Lymphomes non hodgkiniens.
3.2.1. de bas grade de malignité
i)- protocole CVP
- d'après C.M. Bagley et al. (Ann. Intern. Med. 1972 ; 76 : 227 - 234) et C.S.
Portlock et al. (Blond 1976 ; 47 : 747 - 756)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-J5
ou 1 - 50 mg/kg/jouri.v.
perfusion de 1
h 3h
cyclophosphamide 300-400 mg/m2/jourorale J,, J5
(c)
vincristine (V) 1.4 mg/ m2 bolus i.v. J,
(max : 2 mg)
prednisone (P) 100 mg/m2/jour orale J,-J5
.
Ce cycle est répété tous les 21 jours jusqu'à réponse maximale
ü)- protocole I-COPA
- d'après RV Smalley et al. (N. Eng. J. Med. 1992 ; 327 : 1336 - 1341 )
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
154
dose voie jours
4-quinolone 40-2000 mg/m2/jour J,-JS
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
cyclophosphamide 600 mg/mz jour i.v. J,
(C)
vincristine (O) 1.2 mg/m2 bolus i.v. J,
max : 2 m
prednisone (P) 100 mg/m2/jour i.v. J, -J5
doxorubicine (A) 50 mg/m2 bolus i.v. J,
interfron-alpha 6 MU/m2 i.m. JZZ-Jzs
(I)
La cure comprend 8 à 10 cycles, à raison d'un cycle tous les 28 jours.
iii)- protocole fludarabine-CdA
- d'après P. Solol-Celigny et al. (Blond 1994 ; 84 (Supp. 1 ) : 383a), H.
Hoeschster et al. ; (Blond 1994 ; 84 (Suppl. 1 ) : 564a et A.C. Kay (J. Clin.
Oncol.
1992 ; 10 : 371 - 377)
dose voie jours
4-quinolone J 40-2000 mg/m2/jour J, -J,
ou 1 - 50 mg/kg/jouri.v.
perfusion de 1
h 3h
fludarabine 25 mg/m2 jour i.v. J, -JS
perfusion de 0.5
heure
_ou
fludarabine 20 mg/m2/jour i_v, J, -
et cyclophosphamide600 - 1000 mg/m2/jouri.v_ J,
ou cladribine 0.1 mg/m2/jour i.v, J, -J,
- perfusion de 24
heures
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
155
Pour la fludaribine, chaque cycle est répété tous les 28 jours ; pour la
cladribine, chaque cycle est répété tous les 35 jours.
S 3.2.2. de grade de malignité intermédiaire
i)- protocole CHOP ou CNOP
- d'après EM McKelvey et al. (Cancer 1976 ; 38 : 1484 - 1493), J.O Armitage
et al. (J. Clin. Oncol. 1984 ; 2 : 898 - 902) , S. Paulovsky et al. (Ann.
Oncol.
1992 ; 3 : 205 - 209)
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-J5
ou 1 - 50 mg/kg/jour
perfusion de 1
h 3h
cyclophosphamide 750 mg/m2 jour i.v. J,
(C)
doxorubicine (H) 50 mg/ m2 bolus i.v. J,
vincristine (O) 1.4 mg/ m2 bolus i.v. J,
(max : 2 mg)
prednisone (P) 100 mg/m2/jour orale J,-J5
(en 1 dose/jour)
pour le protocole CHOP
La mitoxantrone (N) peut être utilisée pour remplacer (protocole CNOP) la
doxorubicine chez les patients de plus de 60 ans (dose : 12 mg/m2 en bolus
i;v. au jour J1 de chaque cycle).
La cure par le protocole CHOP ou CNOP comprend 6 à 8 cycles à raison de 1
cycle tous les 21 jours.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
156
ii)- protocole MACOP-B
- d'après P. Klimo et al. (Ann. Intern. Med. 1985 ; 102 : 596 -
602) et I.A. Cooper et al. (J. Clin. Oncol. 1994 ; 12 : 769 - 778)
dose voie jours
J,-Js.Je-J,2
4-quinolone 40-2000 mg/m2/jour J,5-J22, J29-Jss
ou 1 - 50 mg/kg/jouri.v. J43-J4,, J5,-J6,
erfusion de 1 h J" -J,5
3h
methotrexate (M) 100 mg/mz bolus i.v. J8, J36, Jsa
puis 300 mg/mz
erfusion de 4 heures
leucovorin 15 mg qid orale J9. J3,, Jss
doxorubicine (A) 50 mg/m2 bolus i.v J,, J,S, J29,
J43
cyclophosphamide 350 mg/m2 bolus i.v J,, J5, J29
(~) J43e Js~, J~,
vincristine (O) 1.4 mg/ m2 bolus i.v. J8, Jz2, J36
(max : 2 mg) JSO, Js4. J,a
Chaque jour
pendant
prednisone (P) 75 mg/jour orale 12 semaines
blomycine (B) 10 U/ m2 bolus i.v. J22, Jso, J,8
Ce protocole de traitement s'étale sur 12 semaines et correspond à 1 cycle.
iii)- protocole VACOP-B
- d'après J.M. Connors et al. (Proc. Am. Soc. Clin. Oncol. 1990
; 9 :254)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
157
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-JS,JB-J,z
ou 1 - 50 mg/kg/jour J,5-Jzz, Jz9-J~,
perfusion de 1 J43-J4,, J5,-Js,
h 3h
J~, -Jas
etoposide (V) 50 mg/m2 i.v. J,5, J43 J"
etoposide 100 mg/m2 orale J,6, J", J44,
J4s
J~z Jas
doxorubicine (A) 50 mg/m2 bolus i.v J,, J,S, Jz9,
J4s
Js~. Jm
cyclophosphamide 350 mg/mz jour i.v J8, Jzz, Js6
bolus
Jso~ Jsa, J~a
vincristine (O) 1.2 mg/ m2 bolus i.v. J8, Jzz, J3s
Jso. Jsa, Jas
1/jour
prednisone (P) 45 mg/mz/jour orale pendant 1 semaine,
puis 4/jour les
11
semaines suivantes
Chaque cycle durant 12 semaines.
iv)- protocole m-BACOD / M-BACOD
- d'après M.A. Shipp et al. (Ann. Int. Med. 1986 ; 140 : 757 -
765) et A.T. Skarin et al. (J. Clin. Oncol. 1983 ; 1 : 91 - 98)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
158
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-J5, J8-J,2
ou 1 - 50 mg/kg/jour J,5-J,9
erfusion de 1 h
3h
methotrexate
(m) 200 mg/m2 i.v. J8, J,5
perfusion de 4
heures
ou ou
(M) 3000 mg/m2 i.v. J,5
erfusion de 4 heures
leucovorin 10 mg/mz qid orale Js, J,6
(6 doses au total)) oU J,s
blomycine (B) 4 U/m2 bolus i.v J,
doxorubicine 45 mg/m2 bolus i.v J,
(A)
cyclophosphamide600 mg/m2 bolus i.v J;
(C)
vincristine (O) 1.mg/ m2 bolus i.v. J,
dexamthasone . 6 mg/m2/jour orale Js -
(D)
La cure comportant 10 cycles, à raison de 1 cycle tous les 21 jours.
v)- protocole ProMACEICytaBOM
- d'après D.L. Longo et al. (J. Clin. Oncol. 1991 ; 9 : 25 - 38):
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
159
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-JS,JB-J,z
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
cyclophosphamide 650 mg/m2 i.v J,
(C) perfusion de 0.5
heure
doxorubicine (A) 25 mg/m2 bolus i.v J,
toposide 120 mg/mz i.v J,
perfusion de 1
heure
prednisone (P) 60 mg/jour orale J,
cytarabine 300 mg/m2 bolus i.v Ja
. . blomycine (B) 5 U/m2 bolus i.v JS
vincristine (O) 1,4 mg/ m2 bolus i.v J8
,
methotrexate 120 mg/m2bolus i.v Je
leucovorin 25 mg/m2 qid orale J
(4 doses au total)
La cure comportant 6 à 8 cycles, à raison de 1 cycle tous les 14 jours.
3.2.3. de grade de malignité bas ou intermédiaire
i)- protocole de sauvetage ESHAP
- en cas de récidive ou en cas d'échec du traitement de
première ligne, d'après W.S. Velasquez et al. (J. Clin. Oncol. 1994 ;
12 : 1169 - 1176)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
160
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J, -J5
ou 1 - 50 mg/kg/jour
erfusion de 1
h 3h
toposide (E) 40 mg/m2 i.v J,-J4
perfusion de 2
heures
mthylprednisolone 500 mg/jour i.v J,, J4
(S)
perfusion de 15
minutes
cytarabine (HA) 2000 mg/m2 i.v J5
perfusion de 3
heures
cisplatine (P) 25 mg/ m2/jour i.v. J, - J4
bolus
perfusion continue
de 24 heures
La cure comportant 6 cycles, à raison de 1 cycle tous les 28 jours.
ü)- protocole de sauvetage MINE
- en cas de récidive ou en cas d'échec du traitement de première ligne,
d'après F.
Cabanillas et al. (Semin. Oncol. 1990 ; 17 (Suppl. 10) : 28 - 33)
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-JS
ou 1 - 50 mg/kg/jour
erfusion de 1
h 3h
ifosfamide (I) 1330 mg/ m2 i.v. J,-J3
perfusion de 1
heure
mesna (M) 1330 mg/ m2 i.v. J, -J3
dans la perfusion
de
ifosfamide
puis 266 mg/ m2
bolus
4 et 8 heures
aprs
chaque dose de
ifosfamide
mitoxantrone (M) 8 mg/ m2 i.v. J,
perfusion de 15
minutes
toposide (E) 65 mg/m2/jour i.v J, -J3
perfusion de 1
heure
Ce cycle étant à répéter tous les 21 jours.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
161
3.3. Lymphomes non hodgkiniens : lymphome de Burkitt, lymphome à
petites cellules, lymphome lymphoblastique.
3.3.1. Protocole de Magrath
S - Les produits revendiqués pourront étre associés aux protocoles de Magrath
selon les schémas suivants
i)- cycle 1
- d'après I.T. Magrath et al. ( Blood 1984 ; 63 : 1102 - 1111 )
dose voie jours
4-quinolone 40-2000 mg/m2/jour i.v. J,-J5,
ou 1 - 50 mg/kg/jour J8-J,2
perfusion de 1 h
3h
cytarabine 30 mg/m2 intra- J,, J2, J3,
J,
thcale
cyclophosphamide 1200 mg/ m2 bolus i.v. J,
methotrexate 12.5 mg/m2 Intra- J,o
max : 12.5 m thcale
methotrexate 300 mg/m2/jour i.v J,o-J"
perfusion de 1 heure
puis
60 mg/mz/h
perfusion de 41
heures
leucovorin 15 mg/m2 bolus qid i.v A commencer
42
(8 doses successives) heures aprs
le dbut
de l'administration
de
mthotrexate
ü)- cycles 2 à 15
- d'après I.T. Magrath et al. (1984) également
dose voie jours
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
162
4-quinolone 40-2000 mg/mz/jouri.v. J,-J3
ou 1 - 50 mg/kg/jour J,o-J"
erfusion de 1
h 3h
cytarabine 45 mg/mz Intra-J,, JZ
thcale(cycles 2 et
3)
J,
(cycles 4 et
6)
Cyclophosphamide 1200 mg/m2 bolus i.v. J,
doxorubicine 40 mg/m2 bolus i.v. J,
vincristine 1.4 mg/m2 bolus i.v. J,
(max : 2 mg)
mthotrexate 12.5 mg/m2 Intra-J3.J,o
(max : 12.5 mg) thcale(cycles 2 et
3)
J,o
(cycles 4, 5,
6)
mthotrexate 300 mg/mz i.v. J,o, J"
perfusion de 1 (cycles 2 et
heure 6
puis J,4. J,s
60 mg/m2 (cycles 7 -
15)
perfusion continue
de 41 heures
leucovorin 15 mg/mz bolus i.v. Commencer la
qid 42e
(8 doses conscutives) heure du traitement
par mthotrexate
la cure comportant 14 cycles, à raison d'un cycle tous les 28 jours.
3.4 Macroglobulinémie de Waldenstr~m
3.4.1 Protocole CVP
d'après le protocole CVP décrit par M.A. Dimopoulous et al. (Blond 1994 ; 83
1452-1459) et C.S. Portlock et al. (Blond 1976 ; 47 : 747-756)
dose ~ voie ~ jours
4-quinolone 40-2000 mg/m2/jour i.v. ~ J,-JS
ou 1 - 50 mg/kg/jour
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
163
erfusion de 1
h 3h
cyclophosphamide 300-400 mg/m2/jourorale J, -J5
(C)
vincristine (V) 1,4 mg/mz/jour i.v. J,
bolus
(max : 2 mg)
prednisone (P) 100 mg/m2/jour orale J,-J5
la cure étant à poursuivre indéfiniment (1 cycle tous les 21 jours).
3.4.2 Protocole Fludarabine-CdA
d'après H.M. Kantarjian et al. (Blond 1990 ; 75 : 1928-1931 ) et M.A.
Dinopoulous et al. (Ann. Intern. Med. 1993 ; 118 : 195-198)
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-J5
ou 1 - 50 mg/kg/jour. .
perfusion de 1
h 3h
fludarabine 25-30 mg/m2 i.v. J,-J5
perfusion de 0,5
heure
ou
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J, -J,
ou 1 - 50 mg/kgljour
erfusion de 1
h 3h
cladribine (CdA) 0,09 mg/mz/jour i.v. J, -J,
perfusion continue
la cure comportant 6 à 12 cycles espacés de 28 jours dans le cas de la
fludarabine et 2 cycles espacés de 28 jours également dans le cas de la
cladribine.
3.5 Myélome multiple
3.5.1 Protocole MP
d'après R. Alexanian et al. (JAMA 1969 ; 208 : 1680-1685), A. Belch et al.
(Br.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
164
J. Cancer 1988 ; 57 : 94-99) et F. Mandelli et al: (N. Engl. J. med. 1990 ;
322
1430-1434)
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J,-JS
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
melphalan (M) 0,25 mg/kg/jour orale J,-JQ
prednisone (P) 100 mg/jour orale J,-J4
ou
dose voie jours
4-quinolone 40-2000 mg/m2/jouri.v. J, -JS
ou 1 - 50 mg/kg/jour
eriusion de 1 h
3h
melphalan (M) 9 mg/m2/jour orale J,-J4
prednisone (P) 100 mg/jour orale J,-J4
la cure comportant au moins 12 cycles, à raison de 1 cycle toutes les 4 à 6
semaines.
3.5.2 Protocole VAD
d'après B. Barlogie et al. (N. Engl. J. Med. 1984 ; 310 : 1353-1356)
dose ~ voie ~ jours
4-quinolone ~ 40-2000 mg/m2/jour ~ i.v. ~ J,-J5
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
165
ou 1 - 50 mg/kg/jour
erfusion de 1 h 3h
vincristine 0,4 mg/jour i.v. J,-J4
(V)
perfusion continue
de 24 heures
doxorubicine 9 mg/m2/jour i.v. J, -J4
(A)
perfusion continue
de 24 heures
dexamthasone 40 mg/jour i.v. J,-J4, J9-J,z,
J"-Jzo
(D)
3.5.3 Protocole MP-interferon a
d'après O. Osterborg et al. (Blond 1993 ; 81 : 1428-1434)
dose voie jours
4-quinolone 40-2000 mg/mz/jour i.v. J, -J5
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
melphalan (M) 0,25 mg/kg/jour orale J,-J4
prednisone (P) 2 mg/kgljour orale J, -J4
interfron-alpha7 MU/mZ/jour s.c. J,-J5, et
Jzz-Jzs
la cure comportant la répétion indéfinie de ce cycle, à raison de 1 cycle tous
les 42 jours.
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
166
3.5.4 Protocole VCAP ou VBAP
d'après S.E. Salmon et al. (J. Clin. Oncol. 1983 ; 1 : 453-461)
protocole VCAP
dose voie jours
4-quinolone 40-2000 mg/m2/jour i.v. J, -J5
ou 1 - 50 mg/kg/jour
erfusion de 1 h
3h
vincristine (V) 1 mg/m2 bolus i.v. J,
(max : 1,5 mg)
doxorubicine (A) 30 mg/m2 bolus i.v. J,
prednisone (P) 60 mg/m2/jour orale J, -J4
cyclophosphamide 125 mg/mz orale J,-J4
(C) perfusion de 1 heure
S protocole VBAP : le cyclophosphamide est remplacé par la carmustine
(BCNU), le reste étant identique
dose voie jours
carmustine 30 mg/mz i.v. J,
perfusion de 1
heure
C. TUMEURS DE L'ENFANT - Oncologie pédiatrique
Les 4-quinolones peuvent également étre incorporés aux protocoles
polychimiothérapeutiques de traitement des tumeurs pédiatriques afin
d'améliorer
l'efficacité antitumorale tout en réduisant la sévérité des effets secondaires
grâce à
l'action sur le recrutement et la mobilisation des cellules clonogènes et à la
possibilité de réduire les doses actives.
1°I Sarcome d'Ewing / Tumeur neuroectodermale primitive
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
167
Les 4-quinolones peuvent être introduites dans le protocole VCR-Doxo-CY-Ifos-
Mesna-E (E. D. Berger et al., J. Clin. Oncol. 1990 ; 8 : 1514 - 1524 ; W.H.
Meyer
et al., J. Clin. Oncol. 1992 ; 10 : 1737 - 1742)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - JS et
ou 1 - 50 mg/kg/jour i.v. J22 - J2, et
perfusion de 1 h 3h, J43 - J48 et
Js3 - Js8 et
vincristine 2 mg/m2 bolus i.v J,, J8, J,S,
J43
(dose maximale = 2 mg)
doxorubicine 30 mg/m2/jour i.v. J, - J3,
en perfusion de 24 heures J43 - Jas
cyclophos- 2,2 g/mz i.v. J, , J4s
phamide en perfusion de 0,5
heure
ifosfamide 1800 mg/mz/jour i.v.
en prfusion de 1 heure Jss - Js~
mesna 360 mg/m2 i.v. administr avec
en perfusion de 15 minutes cyclophosphamide
et
raison de 5 doses toutes ifosfamide
les 3
heures
toposide 100 mg/m2 i.v. J22 - Jzs
en perfusion de 1 heure
la cure comprend 6 à 10 de ces cycles en fonction de la sévérité initiale du
sarcome
et de l'amplitude de la réponse.
2°/ Leucémie lymphoblastique algue de l'enfant
2.1. Chimiothérapie d'induction (jours J, - J_3o)
Les 4-quinolones peuvent être ajoutées aux protocoles recommandés (P.S.
Gaynon et al., J. Clin. Oncol., 1993, 11, 2234-2242 ; J. Pullen et al., J.
Clin.
Oncol. 1993 ; 11 : 2234 -2242 ; J. Pullen et al., J. Clin. Oncol. 1993 ; 11 :
839
-849 ; V.J. Land et al., J. Clin. Oncol. 1994 ; 12 :1939 -1945)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
168
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - J5 ,
ou 1 - 50 mg/kg/jouri.v. J8-J", J,5 -J,8
,
perfusion de 1 h J22 - J2,
3h
vincristine 1,5 mg/mz bolus i.v J,, J8, J,S,
J22
(dose maximale -
2 mg)
L-asparaginase 6000 IU/m2 i.m. 3 fois/semaine
endant 3 semaines
prednisone 60 mg/m2 orale J, J28
en 3 doses/jour
daunorubicine 25 mg/m2/jour i.v. J,, J8, J,5 et
J22
en erfusion de 15
minutes
mthotrexate fonction de l'ge intrathcaleJ,S, J28
cytarabine fonction de l'ge intrathcaleJ,
en fonction du résultat de l'examen de la moëlle osseuse, le passage à la
phase de
consolidation se fait le jour J28 du protocole de traitement.
2.2. Chimiothérapie de consolidation / maintenance
Les 4-quinolones peuvent être introduites dans le protocole de maintenance
(P.S. Gaynon et al., J. Clin. Oncol. 1993 ; 11 : 2234 -2242 ; J. Pullen et
al., J.
Clin. Oncol. 1993 ; 11 : 839 -849 ; V.J. Land et al., J. Clin. Oncol. 1994 ;
12
1939 -1945) selon le schéma suivant
dose voie jours
4- uinolone 40-2000 m /m2/'our J, - J5, J,5
- JZO et
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
169
ou 1 - 50 mg/kg/jouri.v. J94 - J99, J,o,
- J,oe
perfusion de 1 J~o$ - J"3, J,z2
h 3h - J,Z,
cyclophosphamide 1000 mg/m2 i.v J,, J,S, J,ZZ
en erfusion de
0,5 heure
L-asparaginase 6000 U/m2 i.m. 3 fois/semaine
entre J9~ et
J,22
cytarabine 75 mg/m2/jour i.v./s.c.une squence de
4
en perfusion de jours dmarrant
15
minutes J2, J9, J,6 JZ3,
J,23,
J,ao
doxorubicine 25 mg/m2/jour i.v. J94, J,o,, J,oB
en perfusion de
15
minutes
mercaptopurine 60 mg/m2/jour orale J,-J93, J,as
fin de
traitement
mthotrexate 20 mg/m2/jour orale 1 fois/semaine
entre
J36 et J~z et
entre J~43
et la fin du
traitement
prednisone 40 mg/m2/jour orale 5 jours conscutifs
(diviss en 3 doses/jour) par mois entre
J~43 et
la fin du traitement
thioguanine 60 mg/m2/jour orale J,z2 - J135
vincristine 1,5 mg/m2 bolus i.v J94, J,o,, J~~a,
ensuite
(dose maximale 1 fois/mois entre
= 2 mg) J,43
et la fin du
traitement
mthotrexate fonction de l'ge intra- J,, Js, J,5 J22,
J,zs, J130
. , thcale puis 1 fois/3mois
entre J143 et
la fin du
traitement
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
170
3°/ Leucémie myéloïde algue de l'enfant
Les 4-quinolones sont ajoutées aux protocoles d'induction et de consolidation
/
maintenance selon les schémas suivants
3.1. Chimiothérapie d'induction
D'après Y. Ravindranath et al., J. Clin. Oncol. 1991 ; 9 : 572 -580 ; M.E.
Nesbit et al., J. Clin. Oncol. 1994 ; 12 : 127 - 135 ; RJ Wells et al., J.
Clin.
Oncol. 1994 ; 12 : 2367 - 2377)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - J5 ,
J,o - J,3
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
- . cytarabine selon l'ge intrathcaleJ,
daunorubicine 20 mg/m2/jour i.v. J, - J4 ,
J,o - J,3
en perfusion de 24
heures
cytarabine 200 mg/mz/jour i.v. J, - J4 ,
J,o - J,3
en perfusion de 24
heures
thioguanine 100 mg/m2/jour orale J, - J4
J,o - J,
,
diviss en 2 doses/jour 3
toposide 100 mg/m2/jour i.v. J, - J4 ,
J,o - J,3
en perfusion de 24
heures
dxamthasone 6 mg/m2 i.v./orale J, - J4
J,o - J
,
diviss en 3 doses/jour ,3
', ce cycle étant répété à 'partir de JzB.
3.2. Chimiothérapie de consolidatiôn / maintenance
D'après Y. Ravidranath et al., J. Clin. Oncol. 1991 ; 9 : 572 -580 ; M.E.
Nesbit
et al., J. Clin. Oncol. 1994 ; 12 : 127 - 135 ; R.J. Wells et al, J. Clin.
Oncol.
1994 ; 12 : 2367 - 2377)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
171
dose voie jours
cytarabine selon l'ge intrathcaleJ,, J28 , Jes
4-quinolone 40-2000 mg/m2/jour i.v. J, - J5 , Je
- J,3
ou 1 - 50 mg/kg/jour J28 - J33, J56
- Js,
erfusion de 1 h J89 - J94
3h
cytarabine 3000 mg/m2 i.v. J, - Jz, et
J8- J9
en perfusion de
3heures
toutes les 12 heures
L-asparaginase 6000IU/mz i.m.
3 heures aprs la
cytarabine
vincristine 1,5 mg/m2 bolus i.v. J28, J56
(dose maximale =
2 mg)
thioguanine 75 mg/mz/jour orale Jz8 - J84
cytarabine 75 mg/m2/jour i.v. J28 - J3,, J56
- Jss
bolus
cyclophosphamide 75 mg/m2/jour i.v. J28 - J3,, J56
- Jss
en perfusion de
0,5 heure
cytarabine 25 mg/m2/jour sc/i.v. J89 - J93
bolus
thioguanine 50 mg/m2/jour orale Je9 - J93
toposide 100 mg/m2/jour i.V. J89 , J92
en perfusion de
1 heure
dexamthasone 2 mg/m2/jour orale J89 - Jsz
daunorubicine 30 mg/mz i.v. J89
en perfusion de
15 minutes
4°/ Maladie de Hodgkin de l'enfant
Les 4-quinolones peuvent être ajoutées au protocole MOPP-ABVD selon EA
Gehan et al. (Cancer 1990 ; 65 : 1429 - 1437), SP Hunger et al. (J. Clin.
Oncol.
1994 ; 12 : 2160 - 2166) et MM Hudson et al. (J. Clin. Oncol. 1993 ; 11 : 100 -
108)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
172
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - JS et
J8 - J,2
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
mechlorthamine (M) 6 mg/mz bolus i.v. J,, J8
vincristine (O) 1,5 mg/mz bolus i.v. J,, J8
(maximum 2 mg)
procarbazine (P) 100 mg/m2/jour orale J, - J,4
prednisone (P) 40 mg/m2/jour orale J, - J,4
(diviss en 3 doses/j)
doxorubicine (A) 25 mg/m2/jour i.v. J29, J~3
en perfusion de
15 minutes
blomycine (B) 10 U/m2. i.v. J29, J43
en perfusion de
15 minutes
vinblastine (V) 6 mg/mz bolus i.v. J29, J43
(maximum 2 mg)
dacarbazine (D) 375 mg/mz i.v. J29, J43
en perfusion de
15 minutes
Ce cycle doit être répété 6 fois à raison de 1 cycle toutes les 8 semaines, la
cure comportant 6 cycles.
Si une transplantation de moëlle osseuse autologue (autogreffe) est prescrite,
le
protocole CVB décrit par R. Chopra et al. (Blond 1993 ; 81 : 1137 - 1145), C.
Wheeler et al. (J. Clin. Oncol. 1990 ; 8 : 648 - 656) et RJ Jones et al (J..
Clin.
Oncol. 1990, 8, 527-537) pourra être mis en oéuvre selon le schéma suivant
(l'allogreffe ayant lieu le jour Jo)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
173
dose voie jours
4-quinolone 40-2000 mg/mz/jour J_,, J_,
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
cyclophosphamide 1800 mg/m2/jour i.v. J_,, J~
en 2 perfusions
de 1 heure
carmustine (BCNU) 112 mg/m2/jour i.v. J.,, J~
en perfusion de
0,5 heure
toposide 500 mg/ma/jour i.v. J_,, J_6
en 2 perfusions
de 1 heure
5°/ Lymphome lymphoblastique de l'enfant
Les composés revendiqués pourront également étre associés aux protocoles de
chimiothérapie d'induction (A.T. Meadows et al., J. Clin. Oncol. 1989 ; 7 : 92
- 99
- C. Patte et al., Med. Ped. Oncol. 1992 ; 20 : 105 - 113 et A. Reiter et al.,
J.
Clin. Oncol. 1995 ; 13 : 359 - 372) et de chimiothérapie de maintenance
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
174
5.1 Chimiothérapie d'induction
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - JS ,
ou 1 - 50 mg/kg/jouri.v. "- JZZ ,
J24 - J2e
erfusion de 1 h
3h
cyclophosphamide 1200 mg/m2 i.v. J,
en perfusion de
0,5 heure
cytarabine selon l'ge intra-thcaleJ,
vincristine 1,5 mg/m2 bolus i.v. J3, J,o,
J", J24
(maximum 2 mg)
prednisone 60 mg/m2/jour orale J3 - JZ8
diviss en 3 doses/jour
daunorubicin 60 mg/m2 i.v. J"
en perfusion de
15 minutes
L-asparaginase 6000 U/mz/jour im J" - J3s
en perfusion de 3 fois/semaine
15 minutes
mthotrexate selon l'ge intra-thcaleJ", J_31
5.2 Chimiothérapie de maintenance
selon le schéma suivant
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
175
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - Js ,
ou 1 - 50 mg/kg/jouri.v. J,5 - J2o
, Jzs - J34
perfusion de 1 h
3h
cyclophosphamide 1000 mg/mz i.v. J, -
en perfusion de
0,5 heure
vincristine 1,5 mg/m2 bolus orale J,, J5,
,
(maximum 2 mg) (des cycles
2 10)
mthotrexate 300 mg/m2/jour i.v. J,5
(60% en perfusion
de 15
minutes et 40% en
perfusion
de 4 heures)
leucovorin 10 mg/m2/toutes orale J,6
les 4 h
daunorubicine 30 mg/m2 i.v. J29
en perfusion de
0,5 heure
methotrexate selon l'ge intra- J,, J8, J,5
thcale (cycle 1 ),
puis
1 fois/mois
(cycles 2
10)
la cure comportant 10 cycles
6°/ Neuroblastome pédiatrique
Le protocole de polychimiothérapie recommandé Doxo-E-Cy-Pt est adapté de
R.P. Castleberry et al. (J. Clin. Oncol. 1992 ; 10 : 1299 -1304), A. Garaventa
et
al. (J. Clin. Oncol. 1993 ; 11 : 1770 - 1779) et D.C. West et al. (J. Clin.
Oncol.
1992 ; 11 : 84 - 90)
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
176
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - J5,
ou 1 - 50 mg/kg/jouri.v. J28 - J35,
erfusion de 1 h J58 - Jss
3h
doxorubicine 25 mg/m2/jour i.v. J2, J3o,
J5a
_
en perfusion de
15 minutes
toposide 100 mg/mz orale/ Jz, J5, J3o,
J33,
en perfusion de nasogas-J58, J6,
1 heure
tri ue
cyclosphosphamide 1000 mg/m2 i.v. J3, J4, J3,,
J3z,
en perfusion de J59, Jso
0,5 heure
cisplatine 60 mg/m2 i.v. J, , J28,
J5s
en perfusion de
6 heures
L'évaluation de la réponse thérapeutique est faite après 9 semaines afin de
décider de l'attitude : résection chirurgicale, radiothérapie ou nouvelle
10
chimiothérapie.
7°/ Ostéosarcome pédiatrique
Les 4-quinolones peuvent étre ajoutés au protocole Doxo-Pt-Mtx-Lcv tel qu'il
est
décrit par M. Hudson et al. (J. Clin. Oncol. 1990 ; 8 : 1988 - 1997), PA
Meyers (J.
Clin. Oncol. 1992 ; 10 : 5 - 15), et V.H.C. Bramwell et al. (J. Clin. Oncol.
1992 ;
: 1579-1591 )
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
177
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - J5,
J2, -
ou 1 - 50 mg/kg/jouri.v. J26,
erfusion de 1 h J28 - J33
3h
doxorubicine 25 mg/m2/jour i.v. J, - J3
_
en perfusion de 24
heures
cisplatine 120 mg/m2 i.v. J,
en perfusion de 6
heures
methtrexate 12 mg/m2/jour i.v. J2,, JZ8
en perfusion de 1
heure
leucovorin 100 mg/m2 orale Jzz, Jzs
toutes les 6 heures
8°/ Rhabdomyosarcome de l'enfant
Le protocole Vcr-Dact-CY-Mesna (H. Maurer et al., Cancer 1993 ; 71 : 1904 -
1922 et LR Mandell et al., Oncology 1993 ; 7 : 71 - 83) peut inclure la
perfusion
i.v. des composés revendiqués selon le schéma suivant
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - J5, J8
- J,z,
ou 1 - 50 mg/kg/jouri.v. JZZ - J2,,
J43 - J4,
perfusion de 1 h
3h
vincristine 1,5 mg/mz bolus (max.i.v. J,, J8, J,S,
2 mg) J22, Jzs,
J36, J43e
J50 et J5~
dactinomycin 0,015 mg/kg bolus i.v: J, - J5, Jzz
~J - Jz,,
(dose journalire Jas - Jas
max : 0,5 mg)
.. cyclophosphamide2,2 g/m2 i.v. ~J,, J22,
J43
en perfusion de 1
heure
mesna 360 mg/m2 i.v. J,, J22, J43
en perfusion de 1
heure
toutes les 3 heures
pour 5
doses
A la fin de la 9é'"e semaine de traitement, l'efficacité doit étre évaluée
pour
décider des suites (chirurgie, radiothérapie, poursuite de la chimiothérapie).
CA 02381968 2002-02-12
WO 01/12607 PCT/FR00/02310
178
9°/ Tumeur de Wilms chez l'enfant
Dans le protocole Vcr - Dact tel qu'il est décrit par GJ D'Angio et al.
(Cancer,
1989 ; 64 : 349 - 360) et DM Green et al. (J. Clin. Oncol. 1993 ; 11 : 91 -
95)
dose voie jours
4-quinolone 40-2000 mg/m2/jour J, - J5, J$
- J,Z
ou 1 - 50 mg/kg/jour i.v. puis chaque
semaine
perfusion de 1 h 3h
J,
vincristine 2 mg/mz bolus i.V. puis chaque
semaine
(dose max : 2 mg)
dactinomycine 0,045 mg/kg bolus (P<_i.v. J,, puis toutes
3o kg) ies s
1,35 mg/m2 (P>30 kg) semaines
(dose max : 3 mg
Ce protocole étant démarré après la résection chirurgicale.
En cas de transplantâtion de moëlle osseuse autologue (auto-greffe) selon A.
Garaventar et al. (Med. Pediatr. Oncol. 1994 ; 22 : 11 - 14), le protocole E-
Thio-Cy pourra être modifié comme suit
dose voie jours
4-quinolone 40-2000 mg/mz/jour J_8 - J_,
ou 1 - 50 mg/kg/jouri.v.
erfusion de 1 h
3h
toposide 1800 mg/m2 i.v. J_8 .
(perfusion de 24
heures)
thiotepa ~ 300 mg/rri2/jour i.v. J_,, J_6,
J_5
en perfusion de 2
heures
cyclosphophamide 50 mg/kg/jour i.v. J~, J_3,
J_Z, J_,
en perfusion de 1
heure
la transplantation de moëlle osseuse ayant lieu à Jo.