Note: Descriptions are shown in the official language in which they were submitted.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
1
Dispositif transdermique comprenant un réservoir et
une matrice contenant le même principe actif.
s L'invention a pour objet un dispositif auto-adhésif destiné à
l'administration transdermique d'un principe actif, comprenant un double
réservoir formé d'au moins un compartiment central et d'au moins un
compartiment périphérique, ces compartiments étant caractérisés par le
fait qu'ils contiennent le même principe actif. Chacun de ces
1o compartiments présente une cinétique de diffusion à profil différent et
complémentaire. L'invention concerne encore un procédé de fabrication
de ce dispositif et son application comme médicament.
La présente invention se rapporte à des dispositifs transdermiques
is permettant préférentiellement l'administration transcutanée d'un principe
actif à partir d'au moins un compartiment réservoir et d'au moins un
compartiment matriciel, de façon à combiner les cinétiques de diffusion
cutanée et à réduire le temps de latence, afin d'améliorer la performance
et la sécurité du produit administré. En règle générale, un compartiment
2o réservoir est situé au centre du dispositif, tandis qu'un compartiment
matriciel constitue une zone périphérique autour de la partie centrale. II
peut aussi être prévu que le compartiment matriciel soit situé au centre et
que le compartiment réservoir constitue une zone périphérique autour de
la partie centrale. Le dispositif selon l'invention s'adresse tout
2s particulièrement aux principes actifs pour lesquels une action rapide est
recherchée avec un relais possible sous la forme d'une prolongation de
l'effet thérapeutique. L'action rapide est par exemple nécessaire dans les
cas du traitement local de la douleur, du sevrage tabagique, du traitement
hormonal substitutif chez l'homme. L'action prolongée, dans chacune de
3o ces situations permet de prolonger l'effet sans recourir à une autre
administration médicamenteuse via une forme galénique transdermique
ou autre.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
2
Les dispositifs transdermiques sont des formes pharmaceutiques
qui permettent l'administration percutanée de certains principes actifs. II
est reconnu que cette voie particulière d'administration médicamenteuse
présente des avantages tels que l'évitement du premier passage
s hépatique et une bonne tolérance du malade au traitement. Ses défauts
sont également connus, et plus particulièrement parmi eux, il faut citer
l'existence d'un temps de latence relativement important. Ce paramètre
définit l'intervalle de temps entre la pose du dispositif sur la peau et la
première apparition d'une quantité mesurable de médicament dans la
Io circulation sanguine, attestant le passage de ce dernier. Pallier cet
inconvénient, revient à administrer une forme transdermique selon un
rythme régulier, adapté à la pathologie traitée. Enfin, ce défaut commun
aux dispositifs transdermiques commercialisés à ce jour, écarte toute
possibilité de prescription dès lors qu'un soulagement thérapeutique
is immédiat ou rapide est demandé.
Ce temps de latence dépend de deux facteurs, à la fois de la
capacité de rétention d'un principe actif par les structures cutanées
superficielles telles que le stratum corneum, mais aussi de la technologie
choisie pour la réalisation du dispositif à proprement parler.
2o Parmi les dispositifs transdermiques, on distingue généralement les
dispositifs réservoir des dispositifs matriciels. Dans les dispositifs
réservoir, l'ingrédient actif est contenu dans un gel le plus souvent
hydroalcoolique, disposé entre un film support et une membrane de
contrôle. Dans le cas de dispositifs adhérant sur toute leur surface, une
2s couche d'une matière perméable à l'ingrédient actif et adhésive - ou
membrane intermédiaire de perméation - est présente entre la surface de
la peau et la membrane de contrôle de la libération. Dans les autres cas,
cette couche se situe en périphérie. Dans les dispositifs matriciels,
l'ingrédient actif est contenu dans une ou plusieurs couches matricielles
30 (généralement à base de polymères auto-adhésifs). Dans ce cas, un
contact direct avec la peau ne nécessite pas tout au moins la présence
d'une membrane intermédiaire de perméation.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
3
Dans le cas d'une technologie dite réservoir, le temps de latence
sera faible et généralement peu différent de celui observé avec une forme
topique type gel hydroalcoolique. Dans le cas d'une technologie dite
matricielle, le temps de latence est généralement plus important, dans la
s mesure où le principe actif sous forme dispersée ou dissoute dans un
polymère adhésif, doit préalablement migrer à travers ce milieu adhésif
avant de franchir le stratum corneum.
Le meilleur exemple dans l'art antérieur concerne les dispositifs
transdermiques à base d'estradiol et plus précisément le remplacement de
1o la forme réservoir originelle par une forme matricielle. Dans les années
90,
un premier dispositif hormonal est commercialisé ( ESTRADERM~ ), sous
la forme d'un réservoir renfermant de l'estradiol sous la forme d'un gel
alcoolique. Une membrane de protection transparente forme le réservoir à
proprement parler, tandis que du coté de la peau, ce même réservoir est
Is fermé à l'aide d'une membrane de contrôle. Cette dernière contrôle la
libération du principe actif et régularise la vidange du réservoir. Ce
dispositif peu esthétique s'est avéré relativement instable tout
particulièrement lors de conditions sévères de stress, où, suite à des
pertes en éthanol, des modifications des performances cinétiques ont été
2o plus tard mises en évidence.
Plus récemment, le méme laboratoire a mis au point un dispositif
transdermique de substitution ( ESTRADERM MX~), en optant pour une
forme matricielle via le mélange intime de l'estradiol et de composés
adhésifs. Cette forme plus élégante, adhésive sur la totalité de sa surface,
2s dépourvue de membrane de contrôle, est caractérisée par une vitesse de
libération beaucoup plus régulière.
Des études (Berner B et AI, CIin.Pharmacokinet 1994, 26 : 121-
134) ont montré dans le premier cas l'existence d'une cinétique de
diffusion de l'estradiol étroitement dépendante de celle de l'éthanol,
3o principal élément constitutif du gel contenu dans le réservoir. Ainsi la
déplétion progressive en éthanol freine la libération de principe actif. Dans
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
4
le second cas, celui d'une forme matricielle contenant l'estradiol en
solution ou en dispersion dans un polymère adhésif, le mécanisme de
régulation responsable de la diffusion du principe actif est plus régulier,
mais plus lent à se mettre en place. La comparaison entre ces deux
s technologies (Muller et AI, Eur.J.CIin.Pharmacol, 1996, 51 : 327-330)
semble indiquer l'existence d'une bioéquivalence limitée au critère de la
quantité absorbée (extent of absorption), et non étendue au critère vitesse
d'absorption (rate of absorption) . A notre connaissance , aucune forme
galénique transdermique ne permet d'associer les deux modes de
1o libération, pour un même principe actif et ne se présente sous la forme
telle que proposée dans cette demande de brevet.
Les caractéristiques techniques les plus représentatives de l'art
antérieur sont présentées plus particulièrement dans les demandes de
brevets WO 96/40355, WO 94/25069, WO 97/23227, WO 98/03137 ou
Is WO 92/05811. La mise au point des dispositifs décrits dans ces textes
demeure complexe et peu de réalisations ont été concrétisées à ce jour.
En effet, dans la majorité des situations thérapeutiques, il s'agit soit
d'administrer des quantités précises et différentes de principes actifs à
partir d'une même composition adhésive, soit de vouloir combiner des
2o profils de libération différents à partir d'une seule et même formulation
active. De telles formulations auront pour principales causes d'échec, soit
l'instabilité de deux principes actifs coexistant dans le mème adhésif et la
possible compétition au niveau de leurs vitesses respectives de passage
transcutané, soit l'impossibilité d'associer deux profils cinétiques
différents.
2s Une deuxième voie consiste à rapprocher plusieurs dispositifs
transdermiques contenant chacun un seul principe actif. De tels dispositifs
sont par exemple décrits dans WO 94/06383 ou WO 90/06736; dans cette
situation, il sera plus facile de maîtriser la quantité à administrer via un
ajustement de la surface concernée. En contrepartie, la surface totale est
3o importante et au delà de 40 - 50 cm2, des problèmes d'adhésion voire de
tolérance cutanée sont reconnus.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
s
D'autres descriptions plus minoritaires telles que WO 97/47305 ou
WO 96!19203 peuvent être décrites comme suit. Dans le premier cas il
s'agit de dispositifs matriciels adjacents préférentiellement soutenus par le
même support et protégés par le même protecteur, mais séparés par une
s distance maximale de 10 mm. Ce dispositif qui garantit la séparation de
deux compartiments ne permet cependant pas d'associer des modes de
libération différents à l'exception de ceux rendus possibles par les
formulations auto-adhésives. Dans le second cas, un premier
compartiment contenant le mélange de deux principes actifs est associé à
io un second compartiment ne renfermant plus qu'un seul des deux principes
actifs précédents. La réalisation d'une telle description paraît complexe et
passe par la combinaison obligatoire de deux principes actifs, c'est à dire
par leur nécessaire compatibilité physico-chimique . II ressort de nouveau
de cette analyse, qu'à notre connaissance, aucune forme galénique
Is transdermique ne permet d'associer les deux modes de libération, pour un
même principe actif et ne se présente sous la forme telle que proposée
dans cette demande de brevet.
Les solutions de l'art antérieur ne sont pas jugées très
2o satisfaisantes car elles ne constituent pas encore une réponse idéale aux
différentes contraintes rencontrées
- cinétique trop rapide à partir d'un patch réservoir ;
- temps de latence trop long pour un patch matrice! ;
- surface totale de contact faible ;
2s - synergie entre les techniques de diffusion.
Dans le domaine de l'administration transdermique, il apparaît
souhaitable, même dans le cadre d'une monothérapie, de disposer d'une
nouvelle solution technique permettant d'optimiser la délivrance d'un
3o principe actif dont on attend des effets immédiats puis réguliers.
C'est ce que propose la présente invention grâce à la réalisation
d'un dispositif d'administration transdermique à double cinétique formé
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
6
d'au moins un compartiment réservoir central, entouré d'une couronne
adhésive faisant office de second compartiment de diffusion ; chacun de
ces compartiments étant capable de libérer le méme principe actif selon
des caractéristiques de libération et de diffusion qui lui sont propres. Parmi
s les principes actifs pour lesquels une double action est recherchée, il faut
citer:
- les hormones androgéniques et plus spécialement la testostérone, la
méthyltestostérone, la fluoxymestérone,
- les anti-inflammatoires locaux et plus spécialement le piroxicam,
1o l'indométhacine, l'ibuprofène, le kétoprofène, le flurbiprofène, et autres
glucocorticoïdes locaux ;
les anesthésiques locaux et plus spécialement la lidocaïne, le fentanyl, la
tetraca ï ne ;
- les anxiolytiques et ou antidépresseurs et plus spécialement la
1s buspirone, la fluoxetine, le lorazépam; la rispéridone, la selegiline ;
- les antinauséeux comme la chlorpromazine, la promethazine, le
metoclopramide, la dompéridone ;
- les antiallergiques et plus spécialement la chlorpheniramine,
l'emedastine, le ketotifène; la mequitazine.
La présente invention a pour objet un dispositif d'administration
transdermique auto-adhésif à double cinétique d'un principe actif
comprenant au moins deux compartiments adjacents, en particulier
2s concentriques, l'un étant un compartiment de type réservoir et l'autre
étant
un compartiment de type matriciel, chacun de ces compartiments étant
conçu pour libérer le principe actif selon des caractéristiques de libération
et de diffusion propres à chaque compartiment.
3o Selon une première variante, la présente invention se rapporte à un
dispositif comprenant un compartiment central de type réservoir (2)
entouré d'au moins un compartiment central de diffusion de type matriciel
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
7
(6), et, selon une deuxième variante à un dispositif qui comprend un
compartiment central de diffusion de type matriciel (6a) entouré d'au
moins un compartiment de type réservoir (2a).
s Le principe actif est de préférence un composé androgénique et de façon
encore plus préférée la testostérone (17-hydroxandrost-4-ène-3-one).
En effet dans le cadre d'un traitement hormonal substitutif (TRT pour
« testosterone replacement therapy »), il est tout particulièrement
1o intéressant de permettre à la fois une administration rapide (qui mime les
pics de concentrations plasmatiques de cette hormone chez le sujet sain)
suivie d'une administration régulière (qui permet le maintien d'un taux
circulant supérieur à 10 nmole / litre). On notera qu'aucune des formes
transdermiques de testostérone commercialisée à ce jour ne remplit un tel
Is objectif car soit se présentant sous forme de patch réservoir (libération
rapide du principe actif), soit sous forme de patch matriciel à application
scrotale (libération rapide lié à la faible épaisseur de la peau du scrotum).
La présente invention concerne encore l'utilisation du dispositif selon
l'invention pour la préparation d'un médicament destiné à une thérapie de
2o remplacement de testostérone et en particulier une thérapie journalière,
hebdomadaire ou bi hebdomadaire de remplacement de testostérone,
pour le traitement d'au moins une pathologie choisie dans le groupe
constitué par le traitement et/ou à la prévention de fhypogonadisme, des
troubles de l'andropause, de l'impuissance sexuelle, des troubles de la
2s fertilité chez l'homme, de l'oligospermie, de l'éjaculation précoce.
Selon une variante préférée de l'invention, le dispositif transdermique
est tel que le compartiment de type matriciel comprend
- une matrice auto-adhésive monocouche ou multicouches contenant
30 le principe actif,
- et éventuellement au moins un agent de perméation c'est-à-dire un
agent promoteur d'absorption.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
8
Le compartiment de type matriciel contient essentiellement un matrice
auto-adhésive constituée à partir d'au moins un composé auto-adhésif
choisi dans le groupe constitué par les butylacrylate, éthylacrylate,
s butylméthacrylate 2-éthylhexylacrylate, isooctylacrylate, acide acrylique,
acide méthacrylique, vinylacétate, acide hydroxyéthylméthacrylique,
méthylméthacrylate, acrylate de méthyle, EVA (éthylène- acétate de
vinyle), dérivés caoutchoutiques, copolymères block SIS (styrène-
isoprène-styrène), SBS (styrène-butadiène-styrène), SEBS (styrène-
io éthylène-butylène-styrène), en association avec des résines collantes de
type résines de collophane, résines terpéniques, résines de synthèse
hydrogénées et avec des plastifiants de type polyoléfines, esters d'acides
gras et dérivés phtaliques. Ces matériaux susceptibles de réticuler pour
donner une matrice auto-adhésive seront appelés « matériaux de type
is copolymère acrylique dans la suite de la description ».
Ledit compartiment matriciel comprend une matrice auto-adhésive
monocouche ou multicouches. De préférence, elle comprend
2o a) 40 à 80 parties en poids de copolymères acryliques,
b) 5 à 20 parties en poids d'un solvant de la testostérone choisi parmi
- le N,N-diéthyl-m-toluamide (DEET),
- le 2 - octyl dodécanol,
- le crotamiton,
2s - le dipélargonate de propylène glycol.
c) 5 à 25 parties en poids d'un composé adjuvant de formation choisi
parmi
- la polyvinylpyrrolidone (PVP),
- les gommes xanthane,
30 -les dérivés cellulosiques comme par exemple la
carboxymethylcellulose sodique.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
9
d) 2 à 10 parties en poids d'une hormone type testostérone ou de l'un de
ses sels.
De façon avantageuse, on utilisera pour le compartiment
s périphérique (matrice adhésive active, nommée MAA dans la suite de la
description), un copolymère acrylique de masse moléculaire faible à
moyenne, à fonctionnalité acide, caractérisé par la présence d'acide
acrylique parmi les monomères de base lui conférant un indice d'acide
compris entre 30 et 50 ; ce copolymère ayant une teneur en acétate de
io vinyle comprise entre 1 et 10% en poids par rapport au poids total en
monomères de base. Ce copolymère acrylique (par exemple DURO-
TAK~ 387-2052 ou 87-2052 de la société NATIONAL STARCH &
Chemical) est un adhésif autoréticulé « prêt à l'emploi » disponible sous
la forme d'une solution organique de densité théorique proche de 0,92
Is g/cm3 et de viscosité Brookfield (à 25°C, 12 trs/min, mobile
n°3) voisine de
2800 mPa.s.
Parmi les polymères adjuvants de la matrice, qui conviennent selon
l'invention, on peut mentionner les dérivés cellulosiques et plus
particulièrement la carboxymethylcellulose sodique de masse moléculaire
2o comprise entre 90 000 et 700 000 Da, les dérivés de type alkylcellulose
comme l'hydroxyéthylcellulose ou l'hydroxypropylcellulose, les
polysaccharides de haut poids moléculaire et plus particulièrement les
gommes xanthanes, et les polymères de type 1-vinyl-2-pyrrolidone de
masse moléculaire comprise entre 2500 et 3 000 000 Da. Selon
2s l'invention, on utilisera de préférence la polyvinylpyrrolidone dont la
meilleure solubilité en milieu alcoolique facilite la dispersion dans une
matrice adhésive telle que décrite dans la présente invention .
Parmi les meilleurs solvants du principe actif, on retiendra soit des
3o composés bifonctionnels également intégrés à la composition de la phase
solvant du copolymère acrylique comme l'éthanol ou I'isopropanol, soit
des composés aliphatiques comme le N-N diéthyl-m-toluamide.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
Avantageusement, il a été mis en évidence la forte solubilité de la
testostérone dans le tétrahydrofuranne ainsi que la compatibilité de ce
solvant très polaire avec les principaux composants de la formulation ;
dans le cadre de la présente invention, on utilisera de préférence une
s solution de testostérone dans le THF afin de faciliter le mélange du
principe actif dans le copolymère acrylique adhésif.
Selon une autre variante, le dispositif transdermique selon l'invention
est tel que le compartiment de type réservoir comprend
1o - un gel hydroalcoolique comprenant le principe actif et au moins un
agent épaississant de préférence de type HPC
(hydroxypropylcellulose), HPMC (hydroxypropylméthylcellulose),
HC (hydroxycellulose), Carbomers,
une membrane de contrôle de libération du principe actif,
Is - un film de protection de la membrane de contrôle, et
- éventuellement au moins un agent de perméation.
II pourra en outre comprendre de façon avantageuse,
e) 35 à 50 parties en poids d'éthanol,
2o f) 46 à 50 parties en poids d'eau,
g) 0 à 20 parties en poids de N,N-diéthyl-m-toluamide (DEET),
h) 1 à 3 parties en poids d'hydroxypropylcellulose de bas poids
moléculaire,
i) 1,5 à 5,75 parties en poids d'une hormone type testostérone ou ester de
Zs testostérone.
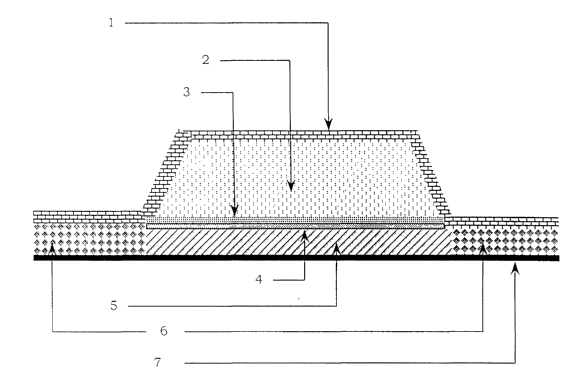
La figure 5 représente une réalisation classique du dispositif
transdermique selon l'invention, cette figure se veut être une illustration
non limitative de l'invention. Selon cette figure, la cote 1 représente un
film
3o support, la cote 2 représente un réservoir actif liquide (RAL), la cote 3
représente une membrane microporeuse, la cote 4 représente un film de
protection de la membrane, la cote 5 représente un adhésif, la cote 6
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
11
représente une matrice adhésive active (MAA) et la cote 7 représente un
film protecteur siliconé.
La figure 6 représente une deuxième réalisation du dispositif
s transdermique suivant l'invention. Selon cette réalisation, le dispositif
transdermique est composé d'un compartiment central de type matriciel
entouré de plusieurs couronnes de compartiments de type réservoir et de
type matriciel alternés.
II pourrait bien évidemment être prévu que le compartiment central
1o soit un compartiment de type réservoir entouré de plusieurs couronnes de
compartiments de type matriciel et de type réservoir alternés.
La figure 6 est une vue en coupe d'un dispositif qui comprend
~ soit des bandes adjacentes alternées de compartiments de type
réservoir et de compartiments de type matriciel,
1s ~ soit des couronnes de compartiments de type réservoir et de
type matriciel alternés entourant un compartiment central de
type matriciel qui a la forme d'un disque.
La cote 1 a représente un film support, la cote 2a représente un
réservoir actif liquide (RAL), la cote 3a représente une membrane
zo microporeuse, la cote 4a représente un film de protection de la
membrane, la cote 5a représente un adhésif, la cote 6a représente une
matrice adhésive active (MAA) et la cote 7a représente un film protecteur
siliconé.
2s Selon l'invention, on préconise également une variation qui permet
la présence d'antioxydants, sous la forme de quantités ajustées, dans le
but de renforcer la stabilité de la composition.
De préférence, le dispositif transdermique selon l'invention est tel
que le compartiment de type réservoir comprend au moins un matériau de
3o type hydrophile choisi dans le groupe constitué par les dérivés
cellulosiques, les gommes naturelles, les alcools polyvinyliques ou de type
hydrophobe choisi dans le groupe constitué par les élastomères
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
12
thermoplastiques, les dérivés caoutchoutiques, les résines acryliques, les
copolymères blocs ou encore des combinaisons telles que la combinaison
d'un polyacrylamide d'un isoparaffine et d'un alcool polyoxyéthylène et
est tel qu'il se présente sous forme liquide, solide ou semi-solide.
s De manière avantageuse, la membrane de contrôle de libération du
principe actif du compartiment de type réservoir comprend au moins un
composé choisi dans le groupe constitué par les butylacrylate, 2-
éthylhexylacrylate, isooctylacrylate, acide acrylique, acide méthacrylique,
vinylacétate, acide hydroxyéthylméthacrylique, méthylméthacrylate,
1o acrylate de méthyle, EVA, dérivës caoutchoutiques, copolymères block
SIS, SBS, SEBS, fluorure de polyvinylidène, polytétrafluoroéthylène,
polyéthylène, polypropylène, polycarbonate, polyéthersulfone, esters de
cellulose, chlorure de polyvinyle, fibres de verre, nylon.
1s Avantageusement , ce dispositif de type réservoir comprend un film
de protection de la membrane de contrôle de libération du principe actif
revêtu d'un agent anti-adhérent, ledit film étant un matériau choisi dans le
groupe constitué par les papiers siliconés, les polyesters siliconés ou les
polyesters fluorés.
De manière encore plus préférée, le compartiment central ou
réservoir actif liquide (nommé RAL dans la suite de la description),
comprendra un agent gélifiant de type hydroxypropycellulose de bas poids
moléculaire (par exemple KLUCEL EF ou HF~ de la société AQUALON),
2s la combinaison entre un polyacrylamide, une isoparaffine contenant 13 ou
14 atomes de carbone (C13-C14) et du laureth 7 (par exemple SEPIGEL
305~ de la société SEPPIC), un acide acrylique réticulé via la présence
d'allyl sucrose et d'allyl ethers de pentaerythritol (par exemple
CARBOPOL 974P~ de la société BF GOODRICH). Dans tous les cas de
3o préparation, des proportions variables d'eau et d'éthanol sont nécessaires,
dans des rapports respectifs compris entre 1 et 3.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
13
Parmi les meilleurs solvants du principe actif, on retiendra soit des
composés bifonctionnels également intégrés à la composition du RAL
comme l'éthanol ou I'isopropanol, soit des composés aliphatiques comme
s le N-N diéthyl-m-toluamide (DEET) ou le palmitate d'isopropyle.
Avantageusement, il a été mis en évidence l'existence de proportions
optimales entre ce dernier composant et le couple éthanol -DEET,
capables de favoriser les flux à partir du RAL.
1o Parmi les composants androgéniques qui conviennent selon
l'invention, on peut citer en particulier, la testostérone ou 17(3-
hydroxyandrost-4-en-3-one, ainsi que ses sels de type acétate, enanthate,
propionate, isobutyrate, undecanoate, et cypionate. On utilisera de
préférence comme composant stéroïdien la testostérone.
De façon préférée, le dispositif selon l'invention comprend un
support occlusif et inerte d'épaisseur comprise entre 10 et 100 Nm qui
protège la totalité du dispositif selon l'invention, il pourra être choisi
parmi
les films les plus souvent utilisés dans la formulation de dispositifs
2o transdermiques. Parmi les produits généralement utilisés, il faut citer les
composés polyoléfinique mono ou multicomposants de type polyéthylène,
polypropylène, mono ou biétirés, des composés de type polyester, les
complexes multicouches constitués des matières précédentes associés
par exemple à de fines couches d'aluminium, les complexes élastomères
2s thermoplastiques de type polyuréthane ou les associations de
copolymères d'acétate de vinyle et d'éthylène (EVA) sous forme de films
ou de mousse. De préférence, on utilisera un film multicouches à base de
polyoléfines modifiées et de préférence à base de copolymère éthylène-
acétate de vinyle (EVA).
Le film protecteur qui protège la totalité du dispositif mais qui devra
être retiré au moment de la pose, sera de préférence choisi parmi les
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
14
produits présentant de bonnes propriétés de découpe, inerte vis à vis des
composants du RAL et de la MAA, et dont les propriétés d'anti-adhérence
sont plus spécifiquement adaptées afin de permettre le maintien du
contact entre la MAA et le protecteur, simultanément au retrait de ce
s même film protecteur limité à la zone de contact avec le RAL. De
préférence, on utilisera un film polyester d'épaisseur comprise entre 50 et
100 microns avec un niveau d'anti-adhérence compris entre 25 et 50
N/cm.
En effet, au cours du développement du dispositif transdermique
1o selon l'invention, plusieurs essais ont été nécessaires et plus
particulièrement ceux destinés à sélectionner les matériaux destinés à
faciliter l'assemblage des deux compartiments. La partie centrale ou
réservoir actif liquide (RAL) comporte une membrane de contrôle de la
libération du principe actif, elle même protégée par un film protecteur. Les
1s caractéristiques de ce dernier sont en effet spécialement étudiées afin de
rendre solidaire ce film du protecteur à retirer au moment de l'application
du dispositif. Ce phénomène met en jeu plusieurs forces
- une force interfaciale d'adhésion entre l'adhésif principal constituant de
la
partie périphérique active (MAA) et le support (backing) du dispositif
Zo complet (dite F1 ),
- une force interfaciale d'adhésion entre ce même adhésif et le protecteur
du dispositif (dite F2),
- une force de rupture de l'adhésif (dite F3), de préférence selon un mode
cohésif.
2s Ainsi selon l'une des caractéristiques de l'invention, il s'est avéré
nécessaire de choisir une qualité de film protecteur telle que
F1 > F2, ce qui traduit la nécessité pour l'adhésif de se maintenir
sur le film support lors de sa séparation avec le film protecteur ;
F2 » F3, ce qui traduit la présence d'une rupture de ce même
3o d'adhésif vis à vis du film protecteur de la membrane de RAL, limité à la
périphérie de ce dernier.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
En ce qui concerne le promoteur d'absorption présent dans l'un ou
l'autre des compartiments, voire simultanément dans le RAL et la MAA, il
pourra être choisi parmi les composants connus de l'homme du métier
permettant d'améliorer les critères de flux et de quantités cumulées. De
préférence, on utilisera un agent de perméation choisi dans le groupe
constitué par les alcools, les glycols, les polyglycols, les amides du type
pyrrolidone et dérivés, les surfactants non ioniques de type polysorbates,
alkyléthers, poloxamers, les acides gras saturés ou insaturés à chaîne
carbonée contenant de 5 à 30 atomes de carbones (C5-C3o), les alcools
1o gras, les glycérides polyglycolysés seuls ou en mélange, les glycols esters
de propylène glycol ou de polyglycérol, les esters d'acides gras du type
polyol, les alkylglycéryl ether, le propylène glycol, la glycérine, les
polyoxyéthylène glycéryl, le sorbitan, les polyoxyéthylène sorbitan, le
polyoxyéthylène glycol, les esters de sucre, les huiles essentielles
1s terpéniques, le diéthyltoluamide, le crotamiton, les phospholipides, les
dérivés de la lécithine, l'isonononaonate de cétéaryle, les esters de
mannitan, les gommes xanthane et les dérivés cellulosiques.
Le dispositif final (RAL + MAA) sera conditionné dans une
2o protection étanche soit de type sachet, soit de type « emballage
pelliculé » (blister).
Le dispositif final selon l'invention présente de nombreux avantages
que l'on peut exposer comme suit
2s - par rapport aux formes transdermiques déjà commercialisées, la
présente invention permet (dans le cas d'une monothérapie à base de
testostérone) de réduire le temps de latence (élément caractéristique de la
technologie réservoir) et d'assurer un passage cutané régulier grâce à une
bonne adhésion (élément caractéristique de la technologie matricielle).
30 - en ce qui concerne le compartiment dénommé MAA, les
problèmes de solubilité de la testostérone dans l'adhésif ont été résolus
grâce à l'emploi de constituants plus particulièrement aptes à solubiliser
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
16
de fortes quantités de principe actif; il s'est avéré très judicieux
d'utiliser le
pouvoir solvant des composés organiques tels que le DEET. En
conséquence il a été possible d'incorporer dans un patch matriciel une
quantité de principe actif au cm2, sensiblement égale à celle présente
s dans le patch réservoir ANDRODERM~ ; la présente invention est
caractérisée par la présence d'une interface peau - patch largement
saturée en principe actif, responsable du passage transcutanée via un
phénomène de diffusion passive. Compte tenu de la forte solubilité de la
testostérone dans le solvant DEET, il a été nécessaire de parfaitement
1o maîtriser le procédé de fabrication et en particulier l'étape de séchage
afin
de garantir un état de saturation indispensable au fonctionnement du
patch matriciel. Une telle sursaturation, classiquement rencontrée dans la
formulation de dispositifs transdermiques, conduit dans de nombreux cas
à un état physico-chimique instable caractérisé par la survenue de
1s phénomènes de cristallisation. A l'image de brevets appartenant à
l'environnement de la formulation en question, la présence de PVP a
considérablement amélioré la stabilité physico-chimique du patch sans
remettre en question les caractéristiques pharmacotechniques de ce
dernier.
20 - en ce qui concerne le compartiment dénommé RAL, les
problèmes de solubilité de la testostérone dans un gel hydroalcoolique ont
été résolus grâce à l'emploi de constituants plus particulièrement aptes à
favoriser la stabilité de la testostérone. En conséquence l'agent gélifiant
qui a donné les meilleurs résultats d'écoulement et de consistance est le
2s KLUCEL HF; les meilleurs solvants du principe actif, compatibles avec la
présence d'éthanol sont le DEET et le palmitate d'isopropyle selon des
ratios définis avec précision. L'ensemble des constituants du RAL
permettent l'obtention d'un gel bien toléré au niveau cutané.
3o Les dispositifs transdermiques selon l'invention sont réalisés
suivant les techniques généralement employées par l'homme de l'art ; ces
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
17
techniques sont celles du mélange, de l'enduction, du séchage, du
contrecollage, de la refente et de la découpe.
La présente invention concerne encore un procédé de préparation du
dispositif transdermique auto-adhésif selon la présente invention
s comprenant les étapes de
d'une part ,
1 ) préparer un premier mélange contenant un principe actif et au moins
un agent de perméation,
2) déposer ce mélange sur une membrane de contrôle de libération du
1o principe actif,
d'autre part,
3) préparer un prémélange contenant un principe actif ,
4) ajouter au prémélange obtenu à l'étape 3 au moins un matériau de
type copolymère acrylique, susceptible de réticules pour donner une
1s matrice auto-adhésive,
5) enduire le mélange obtenu à l'étape 4 sur un film de protection de la
membrane,
6) entrecoller le film de protection enduit de l'étape 5 sur un film de
transfert
Zo puis
7) ôter le film de transfert de l'enduit obtenu à l'étape 6 et entrecoller
cet enduit sur le produit obtenu à l'issue de l'étape 2,
on obtient ainsi un assemblage qui doit encore être découpé.
2s De façon avantageuse, on préconise également un procédé de
fabrication dudit dispositif transdermique selon des étapes suivantes
1 ) préparer un prémélange de principe actif dans un mélange solvant (par
exemple à base de THF),
2) préparer un second prémélange à base d'adhésif, et de polymères ;
30 (dans ce dernier cas, il s'agit d'assurer la dispersion homogène de PVP,
solide finement pulvérisé dans un adhésif solution organique prêt à
l'emploi),
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
18
3) ajouter au prémélange 1 les quantités théoriques d'éthanol et de DEET
puis incorporer l'ensemble dans la préparation adhésive qui précède,
4) déposer directement le mélange homogène ainsi obtenu sur un film
protecteur de préférence de type polyester, de façon à obtenir une couche
s d'épaisseur comprise entre 50 et 150 g/m2 (exprimé en grammage sec),
5) sécher l'enduction ainsi obtenue afin d'évaporer les solvants de
fabrication et permettre la réticulation du copolymère acrylique, par
séchage progressif à une température comprise entre 50°C et
110°C, et
préférentiellement via des modes de séchage différents ; contrecoller sur
1o un film de transfert siliconé,
6) le produit obtenu en 5 constitue un produit intermédiaire ; il s'agit de la
matrice adhésive active (MAA),
7) réaliser un premier assemblage entre la membrane de contrôle et un
film protecteur de cette membrane,
1s 8) préparer un prémélange du principe actif dans un milieu
hydroalcoolique en présence de DEET,
9) incorporer un agent gélifiant par exemple de type KLUCEL HF de
manière à obtenir un gel homogène,
10) à l'aide d'un microdoseur, déposer une quantité précise de gel à la
2o surface de la membrane de contrôle,
11 ) réaliser un deuxième assemblage en déposant sur le gel un film
protecteur de façon à obtenir par soudage un ensemble étanche,
12) contrecoller sur le film protecteur de la membrane de contrôle, le
produit intermédiaire obtenu en 6) après avoir retiré le film de transfert.
Des variantes au procédé de fabrication tel que précédemment
décrit sont préconisées, caractérisées par
- la réalisation d'un prémélange distinct contenant la PVP et l'éthanol
(étape 2),
- la suppression du THF (étape 1 ),
- l'emploi d'un mode de séchage de type infra rouge court (étape 5).
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
19
a) fabrication du réservoir actif liguide (RAL)
cc) dans un mélangeur, réaliser une solution hydroalcoolique de
testostérone ; cette mise en solution ne présente aucune difficulté
particulière dans la mesure où les proportions de chaque constituant ont
été préalablement calculées en fonction des caractéristiques de solubilité
du principe actif ;
(3) incorporer au mélange aa, le N-N-diéthyl-m-toluamide en tant
qu'agent solvant du principe actif ;
y) incorporer dans le mélange a~ l'agent gélifiant ; cette étape doit plus
1o particulièrement éviter la formation de bulles et conduire à l'obtention
d'un
gel homogène de viscosité comprise entre 1000 et 6000 mPas ; la durée
de cette étape est comprise entre 1 hr et 3 hrs selon les quantités mises
en ceuvre et la vitesse d'agitation est comprise entre 150 et 200 trs / min.
En règle générale, il est préférable de laisser " mûrir " ce gel pendant 10 à
12 hrs avant de passer à l'étape suivante.
s) assembler mécaniquement les films polyéthylène de type COTRAN
9711 ~ (3M MEDICA) et polyester siliconé de type PET SiV1 F 74H
(REXOR) ; à la surface de la membrane de contrôle polyéthylène, déposer
une quantité précise du gel obtenu à l'étape a~y à l'aide d'une remplisseuse
2o doseuse de type Microvalve TS5000 ou équivalent ; déposer à la surface
du gel un film protecteur de la membrane de contrôle, de type DBLF
2050~ (DOW PLASTICS) et réaliser la soudure de l'ensemble de
préférence à l'aide d'ultrasons (Soudeuse Ultrasons SONICS & Matérials -
puissance 64 %, pression 1.5 à 2 bars).
b) fabrication de la matrice adhésive active (MAA)
a) dans un mélangeur, on réalise une solution de testostérone dans
le tetrahydrofurane ; compte tenu de fa forte solubilité de la testostérone
dans le THF qui est de l'ordre de 27% mlm, cette mise en solution sous
3o agitation ne présente aucune difficulté particulière ; une fois ce
prémélange réalisé, on incorpore également l'éthanol comme solvant de
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
fabrication, puis le N-N-diéthyl-m-toluamide en tant qu'agent solvant du
principe actif ;
(3) dans un mélangeur homogénéiseur, on incorpore
progressivement la polyvinylpyrrolidone sous agitation dans le copolymère
s acrylique « prêt à I 'emploi » ; cette étape doit conduire à la réalisation
d'un mélange homogène débarrassé de tout grumeau et l'une des
caractéristiques de ce procédé est de pouvoir être conduit à température
ambiante, ce qui présente un avantage par rapport à d'autres techniques
par exemple dites « hot melt » qui sont généralement plus
1o « stressantes » vis à vis du principe actif.
S) enduire le mélange homogène ainsi obtenu, à une température
comprise entre 50°C et 110°C sur un film protecteur siliconé de
type PET
SiV1 F74HMC (REXOR), à raison de 50 à 150 g/m2, grammage mesuré
sur le film sec.
Is cp) contrecoller sur un film de transfert siliconé.
c) assemblage entre RAL et MAL
a.) à partir du produit intermédiaire obtenu en bcp, ôter le film de transfert
et contrecoller directement sur le produit intermédiaire obtenu en a8.
d) l'assemblage ainsi réalisé doit généralement subir des étapes de
découpe finale avant conditionnement selon l'un ou l'autre des
systèmes possibles, sachet ou blister.
2s Le meilleur mode de mise en oeuvre de l'invention consiste à faire appel
à un dispositif transdermique dont le compartiment matriciel périphérique
contient, pour un total de 100 parties en poids (l'ensemble de ces
éléments n'est nullement limitatif mais est donné à titre d'illustration)
a) 63 à 73 parties en poids d'un copolymère acrylique adhésif et
3o autoréticulable, sous la forme d'une solution à environ 47,5 % plv de
copolymère 2-Ethylhexylacrylate, Butylacrylate, Acide Acrylique et, en
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
21
tant qu'agent de réticulation, d'acétylacétonate d'aluminium, ledit
copolymère adhésif « prêt à l'emploi » ayant une température de
transition vitreuse de l'ordre de - 50°C ;
b) 5 à 25 parties en poids de polyvinylpyrrolidone soluble également
s appelée polyvidone, produit obtenu par polymérisation de la n-
vinylpyrrolidone, de masse volumique comprise entre 400 et 550 g/1 et
de masse moléculaire comprise préférentiellement entre 44 000 et 54
000 ;
c) 9 à 15 parties en poids de N-N-diéthyl-m-toluamide (DEET) ou N,N
Io diéthyl-3-méthylbenzamide, comme agent de formulation, solvant du
principe actif dans la matrice adhésive ;
d) 4 à 6 parties en poids de testostérone sous forme libre ;
Le meilleur mode de mise en oeuvre de l'invention consiste à faire appel
à un dispositif transdermique dont le compartiment réservoir central
is contient, pour un total de 100 parties en poids (l'ensemble de ces
éléments n'est nullement limitatif mais est donné à titre d'illustration)
e) 35 à 50 parties en poids d'éthanol ;
f) 45 à 50 parties en poids d'eau ;
g) 0 à 20 parties en poids de N-N-diéthyl-m-toluamide (DEET) ou N,N
2o diéthyl-3-méthylbenzamide, comme agent de formulation, solvant du
principe actif dans le réservoir ;
h) 1 à 3 parties en poids d'hydroxypropylcellulose de bas poids
moléculaire ;
i) 1,5 à 5,75 parties en poids de testostérone sous forme libre.
Exemple 1
Dans un premier temps, on introduit dans un mélangeur 72 g de
testostérone et 271 g de tétrahydrofurane, et on agite à température
3o ambiante pendant au moins 15 minutes. Puis une partie aliquote de la
solution obtenue est isolée, soit un prélèvement de 70 g auxquels sont
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
22
rajoutés 45 g d'éthanol et 38 g de DEET. Ce prémélange est conservé
jusqu'à sa prochaine utilisation.
Dans un mélangeur homogénéiseur également appelé container de
transfert, on introduit 413 g de copolymère acrylique commercialisé par la
s société NATIONAL STARCH & Company sous le nom DURO-TAK 387
2052~. Puis sous agitation permanente et sous vide, on rajoute
progressivement par petites quantités de la polyvinylpyrrolidone,
commercialisée sous le nom de KOLLIDON K30 par la société BASF. La
polyvinylpyrrolidone n'est pas facilement soluble dans le milieu solvant du
io copolymère acrylique, et à ce stade de la fabrication, on constate que
l'addition du prémélange initial améliore significativement la capacité de la
polyvinylpyrrolidone à se disperser de manière homogène dans l'adhésif.
On maintient l'agitation jusqu'à obtention d'un mélange homogène,
puis si nécessaire on laisse dégazer le mélange pendant environ 30
Is minutes.
On transfère ce mélange final vers la trémie d'alimentation d'une
tête d'enduction qui permet de déposer sur un support polyester siliconé
une quantité de l'ordre de 120 ~ 10 g/m2. On sèche en appliquant un
gradient de température compris entre 50°C et 100°C afin
d'évaporer les
2o solvants de fabrication et permettre la réticulation de l'adhésif
acrylique.
En règle générale, il est souhaitable de parfaitement maîtriser cette étape
qui contribue largement à la qualité du produit fini ; selon la dite
invention,
à ce gradient de température est associé la possibilité de faire varier le
mode de séchage, en appliquant préférentiellement dans un premier
2s temps un mode dit « air chaud à jet impactant » puis dans un second
temps un mode dit « infra rouge court » . En fin de séchage, la matrice
adhésive, dite Mat, à l'état sec est contrecollée sur un film de transfert
siliconé. Les rouleaux ainsi obtenus sont ensuite refendus en produits
intermédiaires de plus faible largeur, et stockés avant d'être assemblés
3o avec le compartiment réservoir.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
23
Dans un second temps, on introduit dans un mélangeur 11,25 g de
testostérone et 224,75 g d'éthanol et on agite à température ambiante
jusqu'à totale dissolution. On ajoute dans le mélangeur, 49,90 g de N-
diéthyl-m-toluamide (DEET), 203,58 g d'eau et 10,0 g de KLUCEL HF. La
s réalisation d'un mélange homogène passe par l'emploi d'un mélangeur
pendant au minimum 1 h30, équipé d'un arbre d'agitation type "ancre" à
une vitesse variable entre 100 et 1200 trs/min. Une homogénéisation
finale est obtenue par l'emploi d'un Ultraturrax pendant quelques minutes.
1o Dans une troisième étape, le film polyéthylène (type COTRAN
9711 ) et le film polyester siliconé (de type PET SiV1 F 74H) sont découpés
sous la forme, de disques de surface égale à la surface de contact
prédéterminée de la partie centrale du dit dispositif. Ces disques sont
déposés sur l'enclume d'une soudeuse à ultrasons dans le cas d'un
Is procédé de fabrication discontinue.
Dans un quatrième étape, on dépose au centre du film de
polyéthylène une quantité nominale du gel (produit intermédiaire en
provenance de l'étape 2). Ce dépôt de l'ordre du gramme, s'effectue à
20 l'aide d'une doseuse remplisseuse de précision. Sur chaque dépôt ainsi
réalisé, on contrecolle le film protecteur (de type DBLF 2050), dont
l'accrochage peut éventuellement être amélioré via un prétraitement
chimique ou physique. Un assemblage intermédiaire est obtenu par
l'application d'ultrasons dans des conditions aptes à garantir l'étanchéité
2s du réservoir, le réservoir Res est ainsi obtenu.
Dans une cinquième étape, il s'agit de contrecoller le réservoir
obtenu précédemment au produit intermédiaire provenant de la première
étape de fabrication puis de réaliser la découpe finale du dispositif selon
30 l'invention.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
24
Exemple 2
On procède de façon analogue à l'exemple 1, en remplaçant le
copolymère acrylique DURO-TAK 387-2052 par un copolymère acrylique
s autoréticulable, sous la forme d'une solution à environ 28 % p/v de
Butylacrylate, de 2-Ethylhexylacrylate, d'Acide Acrylique, de 2-
hydroxyethylacrylate , de méthylméthacrylate et, en tant qu'agent de
réticulation, d'acétylacétonate d'aluminium et de t-amylperoxypivolate,
ledit copolymère adhésif « prêt à l'emploi » ayant une température de
Io transition vitreuse de - 26°C et étant commercialisé par la
société
NATIONAL STARCH & Chemical sous le nom DURO-TAK 87-2074~.
Exemple 3
1s On procède de façon analogue à l'exemple 1, en réduisant la
quantité du solvant du principe actif, soit une quantité de N-N-diéthyl-m-
toluamide dans le mélange avant enduction, de l'ordre de 6%.
Exemple 4
On procède de façon analogue à l'exemple 1, en remplaçant la
polyvinylpyrrolidone par un autre agent polymérique, de préférence la
carboxymethylcellulose sodique, commercialisée sous le nom de
CARMELLOSE~ sodique par la société AQUALON.
Exemple 5
On procède de façon analogue à l'exemple 1, en remplaçant la
polyvinylpyrrolidone par un autre agent polymérique, de préférence une
3o gomme xanthane, commercialisée sous le nom de KELTROL CR~ par la
société KELCO.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
Exemple 6
On procède de façon analogue à l'exemple 1, en remplaçant
l'hydroxypropylcellulose de bas poids moléculaire par un autre agent
s gélifiant, de préférence de type polymère acrylique hydrophile
commercialisé sous le nom de CARBOPOL 974P~ par la société BF
GOODRICH, ou de type polyacrylamide commercialisé sous le nom de
SEPIGEL 305~ par la société SEPPIC .
Io Exemple 7
On procède de façon analogue à l'exemple 1, en remplaçant le
copolymère acrylique DURO-TAK 387-2052 par un copolymère acrylique
non autoréticulable, sous la forme d'une solution à environ 28 % p/v de
15 Butylacrylate, de 2-Ethylhexylacrylate, d'Acide Acrylique, de 2
hydroxyethylacrylate, de methylmethacrylate ledit copolymère adhésif
prêt à l'emploi » ayant une température de transition vitreuse de -
26°C
et étant commercialisé par la société NATIONAL STARCH & Chemical
sous le nom DURO-TAK 87-2051~.
Exemple 8
On procède de façon analogue à l'exemple 1, en remplaçant le
copolymère acrylique DURO-TAK de type solution organique par un
copolymère acrylique en émulsion aqueuse à base de monomères
ethylacrylate, butylacrylate et butylmethacrylate, de viscosité comprise
entre 50 et 250 mPas et à teneur solide comprise entre 54,0 et 58,0%
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
26
Exemple comparatif C1
II s'agit du dispositif commercialisé sous la marque ANDRODERM
5mg/day~ par la société THERATECH ou de la version délivrant
s uniquement 2,5 mg / jour. Ce dispositif réservoir est constitué par un gel
alcoolique de testostérone à base d'hydroxypropylcellulose, renfermant
des agents promoteurs d'absorption tels que le méthyllaurate et le
glycérolmonooléate. La surface diffusante constituée d'une membrane de
contrôle est centrée autour d'une partie périphérique adhésive non active
1o qui permet le maintien du patch sur une zone d'application non scrotale.
Exemple comparatif C2
II s'agit du dispositif commercialisé sous la marque TESTODERM
1s TTS~ par la société ALZA qui délivre 5mg/jour de testostérone. Ce
dispositif réservoir de surface importante (60 cm2) est constitué par un gel
hydroalcoolique de testostérone à base d'hydroxypropylcellulose dépourvu
d'agents promoteurs d'absorption. La surface diffusante constituée d'une
membrane de contrôle est centrée autour d'une partie périphérique
2o adhésive non active qui permet le maintien du patch sur une zone
d'application non scrotale.
Des expériences complémentaires ont été effectuées afin de mettre
en évidence les quantités d'actifs libérés par un dispositif selon
l'invention.
2s
Tests 1 a et 1 b
Les tableaux 1 a et 1 b représentent respectivement les quantités de
testostérone libérée : la perméation ex vivo sur peaux animales soit en
3o quantités cumulées (Ng/cm2 - fig. 1 a), soit en flux (Ng/cm2/h - fig. 1 b)
en
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
27
fonction du temps (heures), dans le cas de dispositifs transdermiques non
associés, c'est à dire soit de type matriciel, soit de type réservoir.
Pour représenter le dispositif de type matriciel, une matrice de type
s Mat a été utilisée et pour représenter le dispositif de type réservoir, un
gel
de type Res a été utilisé.
Les résultats suivants ont été obtenus.
io Tableau 1 a
QC Permation
ex
vivo
peaux
souris
nude
Ng/cm2
h 0 2 3 4 6 8 9 12 24
Mat 0 6 8,19 15 29,41 44 51,6577,85 163,8
Res 0 21, 40 76, 160 232,1280 405, 1075
9 51 8
Tableau 1 b
Flux Permation
ex
vivo
peaux
souris
nude
Nglcm2lh
h 0 2 3 4 6 8 9 12 24
Mat 0 1,4 2,73 4,9 7,07 7,2 7,41 8,73 7,49
Res 0 10,9 18,1 36,5141,74 56,0547,9 41,93 55,76
is
Les résultats des tableaux 1 a et 1 b sont représentés
respectivement par les figures 1 a et 1 b.
Les courbes reliant des losanges (~) correspondent aux résultats
obtenus avec la matrice Mat et les courbes reliant des carrés (~)
2o correspondent aux résultats obtenus avec le dispositif Res.
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
28
Tests 2a et 2b
Les tableaux 2a et 2b représentent respectivement les quantités
libérées : la perméation de testostérone ex vivo sur peaux animales soit
s en quantités cumulées (pglcmz - fig. 2a), soit en flux (Ng/cm2/h - fig. 2b)
en
fonction du temps (h), dans le cas de dispositifs transdermiques de type
réservoir, respectivement au titre de Comparateur soit C1 soit C2.
Tableau 2a
Io
QC Permation
ex
vivo
peaux
souris
nude
Ng/cm2
h 0 2 3 4 6 8 9 12 24
C~ 0 37,2 90 148,1240 330 360 445,9 748,6
CZ 0 0 3,14 5,2 10,4115 17,5626,72 83,82
Tableau 2b
Flux Permation
ex
vivo
peaux
souris
nude
Nglcm2/h
h 0 2 3 4 6 8 9 12 24
C~ 0 18,6 38 55,45 50 45,48 42 28,9623,64
C2 0 0 1,04 2,06 2,42 2,37 2,4 2,62 3,84
is Les résultats des tableaux 2a et 2b sont représentés
respectivement par les figures 2a et 2b.
Les courbes reliant des losanges ( ~ ) correspondent aux résultats
obtenus avec le dispositif comparatif C1 (Androderm) et les courbes
reliant les carrés (~) correspondent aux résultats obtenus avec le
2o dispositif comparatif C2 (Testoderm).
Tests 3a et 3b
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
29
Pour réaliser les tests 3a et 3b une matrice de type Mat et un
réservoir de type Res ont été utilisés. Les résultats de ces tests sont
présentés dans le tableau ci-dessous. Les quantités de testostérone
libérée : la perméation ex-vivo sur peau animale en quantité cumulée
s (~.g/cm2) en fonction du temps (en heures) est présentée.
QC Permation
ex
vivo
peaux
souris
nude
Nglcm2
h 0 2 3 4 6 8 9 12 24
Mat 0 6 8,19 15 29,41 44 51,6577,85163,8
Res 0 21,9 40 76,51160 232,1280 405,81075
Plusieurs combinaisons de surface ont été réalisées : en associant
une matrice 30 cm2 et un réservoir 5 cm2, une matrice 30 cm2 et un
1o réservoir 10 cm2 puis une matrice 30 cm2 et un réservoir 15 cm2. Le
tableau suivant présente la quantité libérée de testostérone en fonction du
temps.
Tableau récapitulatif
1s
QC Permation
ex
vivo
peaux
souris
nude
Ng
h 0 2 3 4 6 8 9 12 24
Mat 30 0 180 245,7450 882,3 1320 1549,52335,5 4914
Res 10 0 219 400 765,1 1600 2321 2800 4058 10750
Mat 30
+ 0 399 645, 1215,12482, 3641 4349, 6393, 15664
7 3 5 5
Res 10
Res 5 0 109,5200 382,55800 1160,51400 2029 5375
Mat30+Res
0 289,5445,7832,551682,32480,52949,54364,5 10289
Res 15 0 328,5600 1147,652400 3481,54200 6087 16125
M at
30+ 0 508, 845, 1597, 3282, 4801,5749, 8422, 21039
5 7 65 3 5 5 5
Res 15
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
Les tableaux 3a et 3b représentent respectivement les quantités
libérées de testostérone ex vivo sur peaux animales en quantités
cumulées (Nglcm2), soit au bout de 2 heures (tableau 3a), soit au bout de
24 heures (tableau 3b) dans le cas d'un dispositif transdermique à double
s compartiment selon l'invention.
Tableau 3a
to
Quantits Cumules
2 hrs
Mat 30 Mat 30 + Res Mat 30 + Res Mat 30 + Res
5 10 15
180 289, 5 399 508
Tableau 3b
Quantits Cumules
24 hrs
Mat 30 Mat 30 + Res Mat 30 + Res Mat 30 + Res
5 10 15
4914 10289 15664 21039
Les résultats des tableaux 3a et 3b sont représentés respectivement par
les figures 3a et 3b.
La figure 3a correspond aux quantités cumulées à 2 heures et la
is
figure 3b correspond aux quantités cumulées à 24 heures.
Test 4
Pour réaliser le test 4 une matrice de type Mat et un gel de type
Res ont été utilisés.
2o Les quantités de testostérone libérée : la perméation ex vivo sur
peau animale en flux (l.~lcm2/h) ont été calculées et sont présentées dans
le tableau ci-dessous.
Permation
flux ex
vivo
peaux
souris
nulle
en
~g/cm2lh
h 0 2 3 4 6 8 9 12 24
Mat 0 1,4 2,73 4,9 7,07 7,2 7,41 8,73 7,49
Res 0 10,9 18,1 36,5141,7456,0547,9 41,9355,76
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
31
Plusieurs combinaisons ont été réalisées en associant une matrice
30 et un réservoir 10, une matrice 30 et un réservoir 5, puis une matrice
30 et un réservoir 15.
Le tableau suivant représente les quantités de testostérone libérée
s la perméation ex vivo sur peau animale en flux (~/unité/h).
Permation
ex
vivo
peau
souris
nude
wg/unit/h
h 0 2 3 4 6 8 9 12 24
Mat 0 42 81,9 147 212,1 216 222,3 261,9224,7
30
Res 0 109 181 365,1 417,4 560,5479 419,3557,6
Mat30
+ 0 151 262,9512,1 629,5 776,5701,3 681,2782,3
Res10
Res 0 54,5 90,5 182,55208,7 280,25239,5 209,65278,8
5
Mat
30 0 96,5 172,4329,55420,8 496,25461,8 471,55503,5
+Res
5
Res 0 163,5271,5547,65626,1 840,75718,5 628,95836,4
Mat
30 0 205,5353,4694,65838,2 1056,8940,8 890,851061,1
+
Res
15
La figure 4 représente les quantités libérées de testostérone ex vivo
sur peaux animales en flux (pg/cm2/h), dans le cas d'un dispositif
1o transdermique à double compartiment selon l'invention.
La courbe reliant des losanges (~) correspond aux résultats
obtenus avec la matrice 30, la courbe reliant les carrés (~) correspond
aux résultats obtenus avec le réservoir 10, la courbe reliant des triangles
1s (1) correspond aux résultats obtenus avec l'association matrice 30 +
réservoir 10, la courbe reliant les croix (x) correspond aux résultats
obtenus avec le réservoir 5, la courbe reliant des croix barrées
verticalement (~) correspond aux résultats obtenus avec l'association
CA 02392402 2002-05-23
WO 01/39754 PCT/FR00/03344
32
matrice 30 + réservoir 5, la courbe reliant les points (~) correspond aux
résultats obtenus avec le réservoir 15 et la courbe reliant des traits
verticaux (I) correspond aux résultats obtenus avec l'association matrice
30 + réservoir 15.
s
Ces tests mettent en lumière que le dispositif transdermique selon
l'invention permet à la fois de réduire le temps de latence et d'assurer un
passage cutané régulier.