Note: Descriptions are shown in the official language in which they were submitted.
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
DERIVES DE 1,1-DIOXO-2H-1,2-BENZOTHIAZINE-3-CARBOXAMIDES,LEUR PROCEDE DE
PREPARATION ET LES COMPOSITTONS PHARMACEUTICES QUI LES CONTIENNENT
La présente invention concerne de nouveaux dérivés de 1,1-dioxo-2H 1,2-
benzothiazine-3-
carboxamides, leur procédé de préparation et les compositions pharmaceutiques
qui les
contiennent, ainsi que leur utilisation pour le traitement des pathologies du
cartilage.
Les antünflammatoires actuellement commercialisés pour le traitement des
pathologies
articulaires comme l'arthrite ou (arthrose présentent en général une faible
affinité pour les
tissus cibles et nécessitent des administrations à doses élevées pour obtenir
l'effet
thérapeutique souhaité.
Ces administrations à forte dose de principes actifs ont pour conséquence une
augmentation de la fréquence des effets secondaires. Il est notamment connu
que la prise
1o d'ami-inflammatoires non stéroïdiens provoque une importante toxicité
gastrointestinale.
Il était donc particulièrement intéressant d'obtenir de nouveaux composés
capables
d'atteindre de manière ciblée le tissu cartilagineux et ainsi de limiter,
voire dé supprimer,
les effets indésirables observés avec les antünflarnmatoires existants.
Des dérivés de 1,1-dioxo-2H 1,2-benzothiazine-3-carboxamides ainsi que leur
utilisation
potentielle pour le traitement des pathologies du cartilage, ont déjà été
décrits dans J. Med. Chem. 1999, 42, 5235-40.
Cependant, ces dérivés ne présentent qu'une activité modeste sur l'expression
des
protéoglycanes protecteurs du cartilage.
Les nouveaux composés, objets de la présente invention, conservent la très
forte affinité
2o pour les tissus cartilagineux déjà décrite pour les dérivés de l'art
antérieur mais, en outre,
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
2
ils possèdent des propriétés protectrices du cartilage très nettement
supérieures à celles des
composës déjà décrits, ce qui, compte tenu de la proximité de leurs
structures, était tout à
fait imprévisible. Ces propriétés rendent donc les composés de l'invention
extrêmement
intéressants pour le traitement des pathologies telles que l'arthrite ou
l'arthrose.
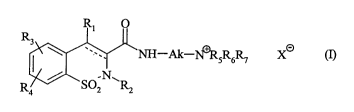
Plus spécifiquement, la présente invention concerne les composés de formule
(I)
R1 O
R3
NH Ak-I~RsR6R.~ X~ (1]
R / SO~N~RZ
4 2
dans laquelle
- représente une liaison simple ou double,
Rl représente un atome d'hydrogène ou un groupement hydroxy, alkoxy (Cl-C6)
1o linéaire ou ramifié, acyloxy (Cl-C6) linéaire ou ramifié, alkylsulfonyloxy
(C1-C6)
linéaire ou ramifié, arylsulfonyloxy ou arylalkoxy (C1-C6) linéaire ou
ramifié,
R2 représente un atome d'hydrogène ou un groupement alkyle (C1-C6) linéaire ou
ramifié,
R3 et R4, identiques ou différents, représentent chacun un atome d'hydrogène,
d'halogène ou un groupement alkyle (C1-C6) linéaire ou ramifié, hydroxy ou
alkoxy
(C1-C6) linéaire ou ramifié,
Ak représente une chaîne alkylène (C1-C6) linéaire ou ramifiée,
Rs, R6 et R7, identiques ou différents, représentent chacun un groupement
alkyle
(Cl-C6) linéaire ou ramifié,
ou bien Rs, R6 et R7, pris ensemble avec l'atome d'azote qui les porte,
forment un
hétérocycle azoté saturé ou insaturé,
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
3
X représente un atome d'halogène,
ainsi que ses isomères optiques lorsqu'ils existent,
à l'exclusion des composés pour lesquels, simultanément, _ _ _ _ représente
une liaison double, R~
représente un groupement hydroxy, R2, RS et R6, représentent chacun un
groupement méthyle,
R3 et R4 représentent chacun un atome d'hydrogène, et Ak représente un
groupement -(CHZ)s-
Par hétérocycle azoté saturé ou insaturé, on entend un groupement monocyclique
de 5 à 7
chaînons, saturé ou insaturé, aromatique ou non-aromatique, contenant un, deux
ou trois
hétéroatomes, l'un de ces hétéroatomes étant l'atome d'azote, et le ou les
hétéroatomes
supplémentaires éventuellement présents étant choisis parmi les atomes
d'oxygène, d'azote
1o ou de soufre, étant entendu que l'hétérocycle azoté peut être
éventuellement substitué par
un ou plusieurs groupements, identiques ou différents, alkyle (Cl-C6) linéaire
ou ramifié.
Les hétérocycles azotés préférés sont les groupements pyridyle et pipéridyle N-
substitué
par un groupement alkyle (Ci-C6) linéaire ou ramifié.
Les composés préférés de formule (I) sont ceux pour lesquels RZ représente un
groupement
alkyle (Cl-C6) linéaire ou ramifié.
Les composés préférés de formule (I) sont ceux pour lesquels X représente un
atome
d'iode.
Selon une variante avantageuse, les composés préférés de l'invention sont ceux
pour
lesquels R6 et R7, identiques ou différents, représentent chacun un groupement
alkyle (C2-
2o C6) linéaire ou ramifié.
Parmi les composés préférés de l'invention, on peut citer l'iodure de f 3-[(4-
hydroxy-2-méthyl-1,1-dioxo-2H-1,2-benzothiazin-3-yl)-carbonylamino]-propyl ~ -
diéthylméthylammonium.
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
4
L'invention s'étend également à un procédé de préparation des composés de
formule (n
caractérisé en ce que l'on met en réaction un composé de formule (II]
R3 O
(~
/ 502-OMe
R4 O
dans laquelle R3 et R4 ont la même signification que dans la formule (n,
en présence d'une base,
pour conduire au composé de formule (lL~
OH O
R3
~~ Rome ()~
/ -NH
R4 SOZ
dans laquelle R3 et R4 sont tels que définis précédemment,
que l'on met en réaction, lorsqu'on le souhaite, avec un composé de formule
(IV)
1o R'a - y, (ter)
dans laquelle R'a représente un groupement alkyle (C1-C6) linéaire ou ramifié,
et Yl
représente un groupement partant classique de la chimie organique,
pour conduire au composé de formule (V)
OH O
R3
Rome (V)
R4 / SOzN\R~a
dans laquelle R'2, R3 et R4 sont tels que définis précédemment,
composês de formule (~ ou (V) que l'on met en réaction, lorsqu'on le souhaite,
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
- soit avec un composé de formule (V~
R'i -Yz (V~
dans laquelle R'1 représente un groupement alkyle (C1-C6) linéaire ou ramifié,
acyle
(C1-C6) linéaire ou ramifié, alkylsulfonyle (Cl-C6) linéaire ou ramifié,
arylsulfonyle ou
5 arylalkyle (C1-C6) linéaire ou ramifié, et Yz représente un groupement
partant usuel de
la chimie organique,
pour conduire au composé de formule (VIn
OR'1 O
R3
Rome (VI>)
R4 / SOzN~Rz
dans laquelle R'1, Rz, R3 et R4 sont tels que définis précédemment,
1o - soit avec un agent de réduction approprié, pour conduire au composé de
formule (VIIl~
OH p
R3
Rome (VII17
R4 / SOaN~Rz
dans laquelle Rz, R3 et R4 sont tels que définis précédemment,
que l' on transforme éventuellement
* soit, par élimination, en composé de formule (IX), dans des conditions
classiques
de la chimie organique
O
R3
OMe (IX)
R / S02N~Rz
4
dans laquelle Rz, R3 et R4 sont tels que définis précédemment,
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
6
que l'on rëduit, lorsqu'on le souhaite, en composé de formule (X)
O
R3
OMe (X)
R / SO~N~RZ
4 2
dans laquelle RZ, R3 et R4 sont tels que définis précédemment,
soit par réaction avec un composé de formule (VI), pour conduire au composé de
formule (X1)
R'
O1 O
R3
Rome (X1)
Ra / SOzN~Ra
dans laquelle R'1, RZ, R3 et R4 sont tels que définis précédemment,
les composés de formules (~, (V), (VIS, (V~, (IX), (X) et (Xn formant
l'ensemble des
composés de formule (XI~
R1 O
R3
'~ ~ Rome (XIn
R / S02N~R2
dans laquelle _ _ _ _ , R1, RZ, R3 et R4 ont la même signification que dans la
formule (1~,
que l'on transforme en un composé de formule (X~
R1 O
R3
(
/ .N~
R4 S02 Ra
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
7
dans laquelle Rl, R2, R3, R4 sont tels que définis précédemment, Ak a la même
signification que dans la formule (1), et Z représente, soit un groupement X
tel que défini
dans la formule ()], soit un groupement NR'SR'6 dans lequel R'S et R'6,
identiques ou
différents, représentent chacun un groupement alkyle (C1-C6) linéaire ou
ramifié, ou
forment ensemble un hétérocycle azoté saturé ou insaturé, non aromatique,
que l'on met en réaction,
0 soit, lorsque Z représente un groupement NR'SR'6 tel que défini
précédemment, avec
un composé de formule (XIV)
R'7-X (XIV)
1o dans laquelle R'7 représente un groupement alkyle (C1-C6) linéaire ou
ramifié, et X a la
même signification que dans la formule (I),
pour conduire au composé de formule (Ia), cas particulier des composés de
formule (I)
R1 O
R3
\ ,yNH-Ak-I~R~sR~sR~7 OX (Ia)
R4 / SOaNwRa
dans laquelle Rl, R2, R3, R4, Ak, R'S, R'6, R'7 et X sont tels que définis
précédemment,
0 soit, lorsque Z représente un groupement X tel que défini précédemment, avec
un
composé de formule (XV)
NR"SR"6R"7 (XV)
dans laquelle R"5, R"6 et R"7 forment ensemble avec l'atome d'azote qui les
porte un
2o hétérocycle azoté aromatique,
pour conduire au composé de formule (Ib), cas particulier des composés de
formule (I)
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
8
Ri O
R3 ,
w~-~-~~~ R~~6R~~7 ~X (Ib)
R / SOZN~R2
4
dans laquelle Rl, R2, R3, R4, Ak, R"5, R"6, R"7 et X sont tels que définis
précédemment,
composés de formule (Ia) et (Ib) qui constituent l'ensemble des composés de
formule (I), que l'on purifie, le cas échéant, selon une technique classique
de
purification, et dont on sépare les isomères optiques, le cas échéant, selon
une
technique classique de séparation.
Le composé de formule (II) est obtenu à partir du composé de formule (XVI)
R3
O
,~ IV
R ~ _SOa
4
1o dans laquelle R3 et R4 ont la même signification que dans la formule (l',
selon le procédé décrit dans J. Med. Chem. 1999, 42, 5235-40.
Les dérivés de la présente invention ont démontré lors d'études biologiques un
tropisme
renforcé pour les tissus cartilagineux. Ces molécules ont, d'autre part, des
propriétés sur le
cartilage qui les rend particulièrement utiles pour le traitement des
pathologies telles que
l'arthrose et l'arthrite.
L'invention s'étend aussi aux compositions pharmaceutiques renfermant comme
principe
actif au moins un composé de formule (I) avec un ou plusieurs véhicules
inertes, non
toxiques et pharmaceutiquement acceptables. Parmi les compositions
pharmaceutiques
selon l'invention, on pourra citer plus particulièrement celles qui
conviennent pour
2o l'administration orale, parentérale (intraveineuse ou sous-cutanée),
nasale, les comprimés
simples ou dragéifiés, les comprimés sublinguaux, les gélules, les tablettes,
les
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
9
suppositoires, les crèmes, les pommades, les gels dermiques, les préparations
injectables,
les suspensions buvables, etc.
La posologie utile est adaptable selon la nature et la sévérité de (affection,
la voie
d'administration ainsi que selon l'âge et le poids du patient. Cette posologie
varie de 0,5 mg
à 2 g par 24 heures en une ou plusieurs prises.
Les exemples suivants illustrent (invention mais ne la limitent en aucune
façon.
Les produits de départ utilisés sont des produits connus ou préparés selon des
modes
opératoires connus.
Les structures des composés décrits dans les exemples ont été déterminées
selon les
1o techniques spectroscopiques usuelles (infrarouge, RMN, spectrométrie de
masse (SM)).
E~EEMPLE I ~ IOdur~ d~ ~3-ff4-hyciroxy-2-~méthyl-1,I-dxaxQ-2I1~1,2-
benzathiazin-â-
~llcarb0n~lamW al)~ra~yl~diethyimethylammonium
Stade A : N ~3-(diéthylatnino) propylJ-4-Izydroxy-2-méthyl l,l-dioxo-2H-1,2-
benzotlziazine-3-carboxamide
Une suspension de 10 mmoles de 4-hydroxy-2-méthyl-l,l-dioxo-2H 1,2-
benzothiazine-3-
carboxylate de méthyle (dont la préparation est décrite dans J. Med. Chem.
1999, 42, 5235-
40) et de 11 mmoles de 3-(diéthylamino)-propylamine dans le xylène est portée
à reflux
sous atmosphère inerte pendant 18 heures. Après refroidissement et
évaporation, le résidu
obtenu est purifié par chromatographie sur silice (éluant : gradient d'éthanol
dans le
2o dichlorométhane allant de 0 à 50 %, puis dichlorométhane/éthanol/ammoniaque
50/48/2),
puis recristallisé pour conduire au produit attendu sous la forme d'un solide
beige.
Point de. usion : 107-110°C
Stade B : Iodure de ~3 ~(4-lzydroxy-2-nzétlzyl-1,1-dioxo-2H-1,2-beuzothiaziu-3
yl)
carbonylaminoJpropylJdiétlzyltzzétlzylafnnzoniunz
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
A 10 mmoles du composé décrit dans le stade A précédent en suspension dans
l'acétone
sont ajoutés 2,5 ml d'iodure de méthyle, puis le mélange réactionnel est porté
à reflux sous
atmosphère inerte pendant 6 heures. Après retour à température ambiante et
évaporation du
mélange, le résidu obtenu est filtré, lavé, séché puis recristallisé, pour
conduire au produit
5 attendu sous la forme d'un solide beige.
Point de fusion : 169-171 °C
EXEMPLE ~ ~ Iadu~-e de f3-ff~-h~draxv-2-mé~~~i-~,~-diapo-~.~aT 1,~-
benzotb.la~in-3-
~llearbonylaminal t~ro~~ll~xriéth~lammanium
Le produit attendu est obtenu selon le procédé décrit dans le stade B de
l'exemple 1, à
10 partir du composé décrit dans le stade A de l'exemple 1 et d'iodure
d'éthyle.
Point de, union : 204-206°c
EXEMPLE 3 : Tpdu~r~ de ~- ~-h .d~c~~ -~-méth 1-1 1-dic~xo-2~ 1 2-~enza~hiazin-
~-
~ilGarbon~iam~inc~lb~l~~~rimé~bylammonium
Stade A : 4-(Ditnéthylamino)-butyron.itrile
A une suspension de 10 mmoles de chlorhydrate de diméthylamine, de 15 mmoles
de
carbonate de potassium et de 1 mmole d'iodure de potassium dans l'acétonitrile
est ajoutée,
à 50°C, une solution de 10 mmoles de 4-bromobutyronitrile dans le méme
solvant. Le
mélange est ensuite maintenu à cette température pendant 16 heures. Après
évaporation, le
résidu obtenu est repris par de l'acide chlorhydrique 1 N. La phase aqueuse
est lavée à
l'éther, neutralisée pax une solution de soude 1 N et réextraite plusieurs
fois à l'éther. Les
différentes phases organiques sont ensuite regroupées, séchées, filtrées et
évaporées pour
conduire au produit attendu sous la forme d'une huile foncée.
Stade B : 4-(Diméthylamino)-butylamine
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
11
A une suspension d'hydrure de lithium et d'aluminium (26,7 mmoles) dans
l'éther est
ajoutée, sous atmosphère inerte, à 0°C, une solution du composé obtenu
dans le stade A
précédent (17,~ mmoles) dans l'éther. Le mélange est ensuite ramené à
température
ambiante et laissé sous agitation à cette température pendant 1 heure. Après
hydrolyse
selon la méthode de Mihaïlovic (1 g d'eau, 1 g de soude 15 % et 3 g d'eau), le
milieu
réactionnel est filtré sur célite. L'évaporation du filtrat sous pression
réduite permet
d'isoler le produit attendu, sous la forme d'une huile claire.
Stade C : N ~4-(diméthylamiho)-butylJ-4-hydroxy-2-métlayl 1,1-dioxo-2H-1,2-
benzothiazine-3-carboxamide
1o Le produit attendu est obtenu selon le procédé décrit dans le stade A de
l'exemple 1, à
partir de 4-hydroxy-2-méthyl-1,1-dioxo-2H 1,2-benzothiazine-3-carboxylate de
méthyle
(dont la préparation est décrite dans J. Med. Chem. 1999, 42, 5235-40) et du
composé
obtenu dans le stade B précédent.
S~élect~ospraX) mlz : 354,13 ~M + H~J
Stade D : Iodure de ~4 ~(4-hydroxy-2-métl:yl 1,1-dioxo-2H-1,2-benzothiaziu-3
y1)
carbonylaminoJbutyl~triméthylammonium
Le produit attendu est obtenu selon le procédé décrit dans le stade B de
l'exemple 1 à partir
du composé décrit dans le stade C précédent et d'iodure de méthyle.
Point de, union : 240-242°C
2o E~ElI~TFLE 4 ~. I4dure de f 3-[E4..hydroxy-2-mëthyl-1,1-diaxo..2H
1,2..benzothiazïn-3-
l Garban lamino .ra l rïdïnïum
Stade A : N ,(3-lzydroxy propylJ-4-hydroxy-2-nzéthyl-1,1-dioxo-2H-1,2-
beuzothiazine-3-
carboxamide
Le produit attendu est obtenu selon le procédé décrit dans le stade A de
l'exemple 1, à
partir de 4-hydroxy-2-méthyl-l,l-dioxo-2H 1,2-benzothiazine-3-carboxylate de
méthyle
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
12
(dont la préparation est décrite dans J. Med. Chem. 1999, 42, 5235-40) et de 3-
amino-1-
propanol.
Stade B : N ~3-iodo propylJ-4-hydroxy-2-méthyl 1,1-dioxo-2H-1,2-behzotlziazihe-
3-
carboxamide
A 15 mmoles de triphénylphosphine et 15 mmoles d'imidazole en solution dans un
mélange éther/acétonitrile 75/25 sont ajoutées, par portions et à 0°C,
15 mmoles d'iode,
puis 10 mmoles du composé décrit dans le stade précédent en solution dans
l'éther. Le
mélange réactionnel est ensuite agité à température ambiante pendant 2 heures,
puis
hydrolysé et extrait à l'acétate d'éthyle. Les phases organiques rassemblées
sont lavées,
1o séchées, filtrées puis concentrées. Le résidu obtenu est purifié par
chromatographie sur
silice (éluant : dichlorométhane) pour conduire au produit attendu.
Stade C : Iodure de ~3 ~(4-hydroxy-2-mëthyl 1,1-dioxo-2H-1,2-behzothiazih-3
yl)
carbonylaminoJpropyl~pyridihium
Le produit attendu est obtenu à partir du composé décrit dans le stade
précédent, selon le
procédé décrit dans le stade B de l'exemple 1 en remplaçant l'iodure de
méthyle par la
pyridine.
EXEMPLE S ; Iadure d~ ~- 4-méthax -2-mëth t-1 1-dïaxo-2I~ ~. 2-beuzothia~in-3-
~IlGarho~~~ami~uul a~rp pyl~-tr~mé~h~lammc~~lum
Stade A : 4-Méthoxy-2-fraéthyl-1,1-dioxo-2H-1,2-benzotlaiazine-3-carboxylate
de métlayle
2o Une suspension de 10 mmoles de 4-hydroxy-2-méthyl-1,1-dioxo-2H 1,2-
benzothiazine-3-
carboxylate de méthyle (dont la préparation est décrite dans J. Med. Chem.
1999, 42, 5235-
40), de 20 mmoles de carbonate de potassium et de 15 mmoles de sulfate de
diméthyle
dans l'acétone est agitée à température ambiante sous atmosphère inerte
pendant 24 heures.
Après filtration, le mélange réactionnel est imité par 1 ml d'ammoniaque
concentrée, puis
évaporé. Le résidu obtenu est repris par de l'acétate d'éthyle et lavé à
l'eau. La phase
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
13
organique est ensuite séchée, filtrée et évaporée. Le résidu huileux obtenu
est alors purifié
par chromatographie sur silice (éluant : dichlorométhane) pour conduire au
produit attendu
sous la forme d'une huile claire qui cristallise.
Point de, usion : 79-80°C
Stade B : N ~3-(dimétlzylamiuo) propylJ-4-méthoxy-2-métlzyl 1,1-dioxo-2H-1,2-
bezzzothiaziue-3-carboxazzzide
Le produit attendu est obtenu selon le procédé décrit dans le stade A de
l'exemple 1 à partir
du composé décrit dans le stade A précédent et de 3-(diméthylamino)-
propylamine.
S~électrospraX) mlz : 354, I S ~M + M~' J
Stade C : Iodure de ~3 ~(4-fzzéthoxy-2-znéthyl 1,1-dioxo-2H-1,2-
bezzzotlziazi>z-3 yl)
carbonylanzifzoJpropyl~triméthylammohium
Le produit attendu est obtenu selon le procédé décrit dans le stade B de
l'exemple 1 à partir
du composé décrit dans le stade B précédent et d'iodure de méthyle.
S~électrosp~ay) nzlz : 368, I S ~M+J
1s E~EMFLE C : Iodure de f3~-f('4-acéaax~-~-mëth~l-1,1-dîaxa-~H 1,2-
henzathîazîn-3-~l)carban~laminalpra~a~l~trîmëth~lammanium
StadeA : 4 Acétoxy-2-méthyl 1,1-dioxo-2H-1,2-bezzzothiazine-3-carboxylate de
méthyle
A 10 mmoles de 4-hydroxy-2-méthyl-l,l-dioxo-2H 1,2-benzothiazine-3-carboxylate
de
méthyle (dont la préparation est décrite dans J. Med. Chem. 1999, 42, 5235-40)
en solution
2o dans l'éther sont ajoutées 11,5 mmoles de pyridine, puis, à 0°C,
11,5 mmoles de chlorure
d'acétyle. Le mélange réactionnel est ensuite agité à température ambiante
pendant
5 heures, puis hydrolysé et extrait par de l'acétate d'éthyle. Les phases
organiques
rassemblées sont lavées, séchées, filtrées puis concentrées. Le résidu obtenu
est purifié par
chromatographie sur silice (éluant : dichlorométhane) pour conduire au produit
attendu.
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
14
Stade B : Iodure de ~3 ~(4 acétoxy-2-nzéthyl 1,1-dioxo-2H-1,2-benzothiazin-3
yl)
carbouylaminoJpropyl)trinzétlzylammouiunz
Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l'exemple 5,
à partir du composé décrit dans le stade précédent.
EXEMI~LE 7 z Todure de ~3-f E4-h~draxy-2-méxh~l-1,1-dïoxa-3,4-dïhydro-2II 1,2-
b~n~athïazïn-â- 1 ~arhan lamïna ra ï trïm~th lammanium
StadeA : 4 Hydroxy-2-métlzyl-1,1-dioxo-3,4-dihydro-2H-1,2-benzothiazine-3-
carboxylate de fnétlzyle
A 10 mmoles de 4-hydroxy-2-méthyl-1,1-dioxo-2H 1,2-benzothiazine-3-carboxylate
de
1o méthyle (dont la préparation est décrite dans J. Med. Chem. 1999, 42, 5235-
40) dans le
méthanol sont ajoutées 10 mmoles de borohydrure de sodium, puis le mélange
réactionnel
est agité pendant 2 heures. Après évaporation du solvant, le résidu obtenu est
hydrolysé
puis extrait par de l'acétate d'éthyle. Les phases organiques rassemblées sont
lavées,
séchées, filtrées puis concentrées. Le résidu obtenu est purifié par
chromatographie sur
silice (éluant : dichlorométhane) pour conduire au produit attendu.
Stade B : Iodure de ~3 ((4-lzydroxy-2-nzéthyl 1,1-dioxo-3,4-dilzydro-2H-1,2-
bezzzothiazirz-
3 yl)carbouylanzinoJpropyl~trimétlzylatnmonium
Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l'exemple 5,
à partir du composé décrit dans le stade précédent.
~ EXEMPLE 8 ; Iodure ûe f3-f(4-.acëtoxy-2-.méthyI-l,l..dïoxa-3,4-dihydro-2hT
1,2-
henzalhïazin-3- L Garhan lamina ro I trïméth lammanium
Stade A : 4 Acétoxy-2-fnétlzyl 1,1-dioxo-3,4-dilzydro-2H-1,2-benzotlziazine-3-
carboxylate
de méthyle
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
Le produit attendu est obtenu selon le procédé décrit dans le stade A de
l'exemple 6, à
partir du composé décrit dans le stade A de l'exemple 7.
Stade B : Iodure de ~3 ~(4-acétoxy-2-méthyl l,l-dioxo-3,4-dilzydro-2H-1,2-
benzothiaziu-
3 yl)carbonylanzinoJpropylJtrinzéthylammonium
5 Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l'exemple 5,
à partir du composé décrit dans le stade précédent.
E~E1~TPTlE 9 : Todure de f3-lf~-m~~hyl-1,1-di0xo-2H 1,2-benzothiazin-3-yl)
Garbon~laminolt~rc~~~l~~rimétltylammnnium
Stade A : 2 Méthyl 1,1-dioxo-2H-1,2-benzotlziazine-3-carboxylate de méthyle
l0 A 10 mmoles du composé décrit dans le stade A de l'exemple 8 en solution
dans le
tétrahydrofurane sont ajoutées 10 mmoles de 1,8-diazabicyclo[5.4.0]undec-7-
ène, puis le
mélange réactionnel est agité à température ambiante pendant 4 heures. Après
hydrolyse et
extraction par de l'acétate d'éthyle, les phases organiques rassemblées sont
lavées, séchées,
filtrées puis concentrées. Le résidu obtenu est purifié par chromatographie
sur silice
15 (éluant : dichlorométhane) pour conduire au produit attendu.
Stade B : Iodure de ~3-~(2-métlzyl-1,1-dioxo-2H-1,2-benzothiazin-3
yl)carborzylanzinoJ
propylJtrimétlzylammonium
Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l'exemple 5,
à partir du composé décrit dans le stade précédent.
2o E~E1~1I'LE 1Q : Iodure de f3-!!2-méth~l-1,1-dioxo-â,4-dihydro-2I~ 1,2-
benzc~thiazin-
~-~l)carbonylaminolpro~yl~trimëthylammonium
Stade A : 2 Méthyl 1,1-dioxo-3,4-dilzydro-2H-1,2-benzothiazine-3-carboxylate
de
méthyle
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
16
Une solution du composé décrit dans le stade A de l'exemple 9 (10 mmoles) dans
le
méthanol' est placée sous hydrogène pendant une nuit en présence de Pd/C à 10
%. Après
filtration du catalyseur, le solvant est évaporé pour conduire au produit
attendu.
Stade B : Iodure de ~3-~(2-méthyl-1,1-dioxo-3,4-dihydro-2H-1,2-benzothiazin-3
yl)
carbonylanzinoJpropylJtziméthylammonium
Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l'exemple 5,
à partir du composé décrit dans le stade précédent.
E~ElfIP'LE 11 ; Iodure de f3-ff4-fnrara-toluènesulionylox~l-2-méthyl-1,1-dïoxo-
21
1 ~-ben~othia~ïn-3- l e~,r~on lamina ro l trimé~h Iammonium
la Stade~i : 2 Méthyi-4-(para-toluènesulfozzyloxy)-l,l-dioxo-2H-1,2-
benzotlziazizze-3-
earboxylate de fnéthyle
Le produit attendu est obtenu selon le procédé décrit dans le stade A de
l'exemple 6 en
remplaçant le chlorure d'acétyle par le chlorure de para-toluènesulfonyle.
Stade B : Iodure de ~3 ~(4-(para-toluènesulfonyloxy)-2-méthyl-1,1-dioxo-2H-1,2-
benzotlziazin-3 yl)carbonylaminoJpropylJtz~iméthylammonium
Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l'exemple 5,
à partir du composé décrit au stade A précédent.
E~~I'LE 1.~ : Iodure de f3-~1~4 fmëlhanesullon~loa~)-~-méthyl I,l.-dioxo-~.~1
1,~-
benzothïazin-~-yllcarbon~laminolprop~l~Iriméth~lammonium
StadeA : 2 Méthyl-4-(nzëtlzanesulfonyloxy)-1,1-dioxo-2H-1,2-benzotlziazi~ze-3-
carboxylate de méthyle
Le produit attendu est obtenu selon le procédé décrit dans le stade A de
l'exemple 6 en
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
17
remplaçant le chlorure d'acétyle par le chlorure de méthanesulfonyle.
Stade B : Iodure de ~3 ~(4-(méthafzesulfonyloxy)-2-méthyl-1,1-dioxo-2H-1,2-
benzotlziazin-3 yl)carbouylanzinoJpropylJtriméthylamnzouium
Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l' exemple 5,
à partir du composé décrit au stade A précédent.
E~~ELE l~ .~ Icadure c~e F~-'Iff4-benz~~axy-~-m~th~~~-l.,l-dlox~-~.~=1,~-
ben~nthiazln-
3-~l)eark~on~rlaminolura~uyl~triméthylammnnium
Stade A : 4-Benzyloxy-2-méthyl 1,1-dioxo-2H-1,2-be~zzothiazihe-3-carboxylate
de
méthyle
1o Le produit attendu est obtenu selon le procédé décrit dans le stade A de
l'exemple 6 en
remplaçant le chlorure d'acétyle par le chlorure de benzyle.
Stade B : Iodure de ~3 ~(4-benzyloxy-2-métlzyl l,l-dioxo-2H 1,2-benzotlziaziu-
3-
yl)carbouylaminoJpropylJtrimétlzylammoniunz
Le produit attendu est obtenu selon le procédé décrit dans les stades B et C
de l'exemple 5,
15 à partir du composé décrit au stade A précédent.
EXEMPLE 14 : bromure de f~-f(4-hydroxy-~-méthyl-I,1-diaxo-~ ~,~-benzorthxa~ln-
-~I~carT~nn~IamïnQlurat~~l~ d~éth~lmêthylammonium
Le produit attendu est obtenu selon le procédé décrit dans le stade B de
l'exemple 1, à
partir du composé obtenu au stade A de l'exemple 1 et de bromométhane.
2o EXEMPLE l~ : Chlorure de f3-[f4-hydrox~-~-mëth~I-l,l-dio~xo..~I 1,2-
benzathia2in-
~- 1 carbon lamin4 ro 1 diéth Iméth Iammanium
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
18
Le produit attendu est obtenu selon le procédé décrit dans le stade B de
l'exemple l, à
partir du composé obtenu au stade A de l'exemple 1 et de chlorométhane.
E~L1DE FHAI~1!!IACQLQGIUUE IDES L1ERIVES I7~E L~INVENTIQN
EXElI~H'LE lC : Etude harmacocinétî ue : étude de la distribution tissulaire
Cette étude a été réalisée avec des molécules marquées au 14C. L'étude de la
distribution
tissulaire a été réalisée par mesure directe de la radioactivité sur des
coupes de corps entier
selon la méthode suivante : des rats mâles de souche Sprague-Dawley ont reçu
par voie
intraveineuse ou par voie orale une dose de molécule marquée. Les animaux ont
ensuite été
sacrifiés à des temps allant de 5 mn à 24 h par inhalation d'éther et congelés
dans l'azote
liquide.
Des coupes ont alors été préparées avec un cryomicrotome et après
dessiccation, la
répartition de la radioactivité a été mesurée à (aide d'un analyseur d'images.
Les résultats obtenus avec les dérivés de (invention montrent que ces composés
ont un
tropisme renforcé pour les tissus cartilagineux.
Exemple 1"T : Ex~sressipn de l'a~rêcanne chez des chandrocytes articulaires
traitës uar
I?IL-l,
L'expression de l'agrécanne a été analysée par « northern-blot ». Des ARNs
totaux de
cultures de chondrocytes articulaires de veau (CAV) cultivées dans du DMEM +
10 % SVF
et traitées avec différentes concentrations des composés étudiés, en présence
de l'IL-1 (10
2o ng/ml), ont été extraits. 10 ~g d'AIZN totaux ont été fractionnés par
électrophorèse sur un
gel à 1 % d'agarose en présence d'un tampon MOPS-formaldéhyde, transférés sur
une
membrane de nylon et hybridés avec une sonde d'ADNc spécifique de l'agrécanne.
A titre d'exemple, le composé de l'exemple 1, à 10-6 et 10-8 M, stimule
l'expression de
CA 02432807 2003-06-20
WO 02/50049 PCT/FRO1/04135
19
l'agrécanne de 150 % et de 200 % respectivement, par rapport aux cultures
traitées avec 10
ng/ml d'IL-1.
A titre de comparaison, le "propoxicam N+" décrit dans la publication
J. Med. Chem. 1999, 42, 5235-5240, à 10-6 et 10-8 M, ne stimule l'expression
de
l'agrécanne que de 28 % et de 30 % respectivement, dans les mêmes conditions.
Ces rësultats démontrent que les composés de l'invention possèdent des
propriétés très
intéressantes de protection du cartilage.
EXEMPEE ~.~ ; Cc~u~t~c~sl~~arn u~arma,ceu~iaue
Formule de préparation pour 1000 comprimés dosés à 10 mg
1o Composé de l'exemple 1
...............................................................................
.............. 10 g
Hydroxypropylcellulose
...............................................................................
................. 2 g
Amidon de blê
...............................................................................
.............................. 10 g
Lactose........................................................................
................................................100 g
Stéarate de
magnésium......................................................................
............................ 3 g
Talc...........................................................................
........................:............................ 3 g