Note: Descriptions are shown in the official language in which they were submitted.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
METHODES ET COMPOSITIONS POUR LE TRAITEMENT DE
PATHOLOGIES RESPIRATOIRES
La présente demande concerne des compositions et méthodes pour le traitement
de pathologies respiratoires. Elle concerne également des compositions et
méthodes permettant de réguler la perméabilité paracellulaire de l' épithélium
pulmonaire. Les compositions et méthodes de l'invention reposent notamment
sur l'utilisation d'agents ou de conditions modulant la tension du
cytosquelette
des cellules épithéliales pulmonaires. L'invention est utilisable pour le
traitement
préventif ou curatif de pathologies variées, telles que asthme, allergies,
maladies
obstructives, etc., chez les mammifères, notaxninent les humains.
L'épithélium pulmonaire est le centre d'échanges très importants entre le
milieu
extérieur et l'organisme. Ces échanges peuvent s'effectuer soit à travers les
cellules de l'épithélium, soit par des réseaux parallèles. Ainsi, le transport
d'eau
ou d'électrolytes, ou encore l'absorption de petites molécules (poids
moléculaire
généralement inférieur à 1000 Da environ) au niveau de la muqueuse gastrique,
intestinale ou colique, s' effectue par voie transcellulaire, à travers les
cellules
épithéliales ou entérocytes. Par contre, l'absorption de grosses molécules et
le
passage de toxines ou de cellules immunitaires se fait principalement par voie
paracellulaire, au niveau de « jonctions serrées », qui sont disposées entre
les
cellules épithéliales.
Les jonctions serrées épithéliales (ou « tight junction », « TJ ») sont des
structures de liaison entre les cellules bordant les épithéliums muqueux (tube
digestif, poumons). Ces structures assurent et contrôlent le transport trans-
épithélial paracellulaire, de l' extérieur vers la sous-muqueuse, de
macromolécules variées (irritants, microorganismes). Ces structures permettent
également la migration de cellules immunitaires (e.g., immunocytes) vers
l'extérieur. Les jonctions serrées sont des structures souples constituées
d'un
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
2
assemblage complexe de protéines transmembranaires (occludines, claudines) et
de protéines cytoplasmiques (protéines zona ocludens ZO-1, ZO-2, ZO-3,
protéines AF7, cinguline ou 7H6, etc.), variable selon les épithéliums
considérés,
qui sont associées à des éléments du cytosquelette (filaments de myosine,
d'actine, étc.). En outre, des agents désorganisant le cytosquelette d'actine
ont
été montrées comme augmentant l'activité de la NO synthase dans les cellules
endothéliales (WO00/03746).
Dans des conditions physiologiques, le degré d'ouverture « partielle » de ces
j onctions serrées permet au système immunitaire local d' être renseigné sur
la
nature ou sur la « qualité » du contenu des voies aériennes.
Si l'épithélium intestinal et la structure des jonctions serrées de celui-ci
ont été
étudiés dans l'art antérieur, il existe aujourd'hui moins d'informations
concernant l'épithélium pulmonaire et le fonctionnement de ses jonctions
serrées.
Le processus de sensibilisation aux allergènes est un facteur de risque très
important dans le développement des allergies et de l' asthme. Toutefois, les
mécanismes par lesquels des allergènes sont capables d'initier le phénomène de
sensibilisation ne sont pas clairement documentés in vivo. Lorsque des
allergènes
sont inhalés, ils entrent en contact avec la paroi épithéliale pulmonaire qui
empêche leur introduction dans l'organisme et leur mise en contact avec les
cellules de l'immunité. Toutefois, pour qu'une sensibilité se développe, cela
implique que certains allergènes sont capables de traverser cet épithélium
pour
interagir avec les cellules immunitaires. Les conditions dans lesquelles ce
transfert est possible demeurent peu documentées in vivo. Ainsi, bien que
certains rapports suggèrent, sur des cultures de cellules in vitro, un rôle
des
jonctions serrées dans ce processus, aucune démonstration n'a été apportée de
l'implication de ces jonctions in vivo dans le développement d'une
sensibilisation. De même, si Gordon et al (Exp. Lung Res. 24 (1998) 659)
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
3
suggèrent un effet protecteur de la taurine sur les jonctions serrées, aucun
résultat
présenté n'établit de corrélation entre les jonctions serrées et un processus
de
sensibilisation ou de transfert d'allergènes à travers l'épithélium
pulmonaire.
Une corrélation entre l'état d'ouverture des jonctions serrées et la réponse à
des
allergènes d'origine aérienne a été suggérée au travers d'études
expérimentales
(WAN, H et al. J. Clin. Invest, 1999 ; 104(1) : 123-33) et par la mise en
évidence
chez le sujet asthmatique d'une corrélation entre la largeur des espaces
extracellulaires et le seuil de réponse respiratoire à l'inhalation
d'acétylcholine
(OHASHI et al. Aerugi 1990 Nov ; 39(11) : 1541-5). Cependant, ces
observations préliminaires n'ont pas été confirmées ou n'ont pas donné lieu à
de
nouvelles approches thérapeutiques.
La présente demande résulte de la mise en évidence d'un rôle in vivo des
jonctions serrées de l'épithélium pulmonaire dans le processus de
sensibilisation
aux allergènes. La présente demande découle également de la mise au point de
nouvelles stratégies thérapeutiques pour le traitement de pathologies
respiratoires, basées sur une modulation de la perméabilité para-cellulaire de
l'épithélium pulmonaire. En particulier, la présente demande propose, pour la
première fois, une approche thérapeutique des pathologies respiratoires basée
sur
l'emploi de composés ou conditions permettant de moduler la tension du
cytosquelette des cellules épithéliales pulmonaires. Cette approche permet
notamment de contrôler l'ouverture et ~la fermeture des jonctions serrées de
l'épithélium pulmonaire, sans nécessairement recourir à une synthèse protéique
de novo et/ou à des dégradations protéiques et/ou structurales importantes au
niveau de l'épithélium. Cette stratégie permet de réguler la perméabilité de
l'épithélium pulmonaire de manière spécifique, fine et réactive, et ainsi
d'agir sur
le transfert d'allergènes vers les cellules de l'inununité. Cette stratégie
est
particulièrement adaptée à l' obtention d'un effet biologique rapide et
contrôlable
dans le temps (réversible).
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
4
A cet égard, les résultats présentés dans la demande montrent que des
substances
susceptibles de relâcher les jonctions serrées épithéliales (peptide
activateur du
récepteur PAR-2, LPS) favorisent l'accumulation alvéolaire de neutrophiles et
éôsiriophiles, comme cela est observé dans les maladies broncho-pulmonaires
telles que l'asthme. Les résultats obtenus montrent également qu'une substance
chimique capable de réduire la perméabilité des jonctions serrées de
l'épithélium
pulmonaire empéche l'accumulation de neutrophiles et d'éosinophiles. Ces
résultats apportent la preuve que des molécules, agents, conditions ou
procédés
susceptibles de réduire ou supprimer l' ouverture des j onctions serrées de
l' épithélium alvéolaire ou bronchique pulmonaire offrent un intérêt dans le
traitement des affections pulmonaires, notamment celles caractérisées par
l'accumulation intrabronchique et alvéolaire de neutrophiles ou
d'éosinophiles,
en particulier l'asthme.
Un premier obj et de l' invention réside donc plus particulièrement dans
l'utilisation d'un composé modulant la tension du cytosquelette de cellules
épithéliales pulmonaires, pour la préparation d'un médicament destiné au
traitement préventif ou curatif de pathologies respiratoires, de préférence à
l'exclusion de l'hypoxie causée par ces pathologies, en particulier à
l'exclusion
de l'hypoxie causée par un dysfonctionnement pulmonaire. A ce titre, un
dysfonctionnement pulmonaire peut être causée par un emphysème, la fumée de
cigarettes, bronchite chronique, asthme, agents infectieux, pneumonite
(infectieuse ou chimique), lupus, arthrite rhumatoïde, désordres congénitaux
tels
que fibrose cystique, obésité et déficit héréditaire en a 1-antitrypsine.
L'hypoxie
est définie dans la présente demande comme la diminution en dessous du niveau
normal d'oxygène dans un tissu.
Un autre obj et de l' invention réside dans une méthode de traitement
préventif ou
curatif de pathologies respiratoires, comprenant l'administration à un sujet
d'une
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
quantité efficace d'un composé modulant la tension du cytosquelette de
cellules
épithéliales pulmonaires.
L'invention repose ainsi sur l'utilisation de composés modulant la tension et
5 l'état de contraction du cytosquelette des cellules de l'épithélium
pulmonaire.
Comme indiqué plus avant, cette approche permet de contrôler l'ouverture et la
fermeture des jonctions serrées de l'épithélium pulmonaire, sans
nécessairement
recourir à une synthèse protéique de novo et/ou à des dégradations protéiques
et/ou structurales importantes au niveau de l'épithélium.
Les protéines composant les jonctions serrées sont associées au cytosquelette
des
cellules qu'elles relient. Il est proposé dans le cadre de l'invention que la
tension
du cytosquelette puisse être modulée chez des sujets atteints de maladies ou
désordres respiratoires pour agir de manière non destructrice et transitoire
sur la
perméabilité de leur épithélium pulmonaire. Ainsi, la contraction du
cytosquelette doit favoriser l'ouverture des jonctions serrées, tandis qu'un
relâchement du cytosquelette (ou qu'une inhibition de la contraction) doit
favoriser la fermeture des jonctions.
On utilise donc préférentiellement dans le cadre de l'invention des composés
(ou
conditions) qui modulent la contraction du cytosquelette de cellules
épithéliales
pulmonaires (notamment humaines), de préférence sans moduler de façon
importante (substantiellement) la perméabilité de l'endothélium vasculaire
et/ou
l'hémodynamique circulatoire pulmonaire. Selon la condition à traiter, on
utilise
des composés qui inhibent la contraction du cytosquelette de cellules
épithéliales
pulmonaires, ou qui activent ou favorisent celle-ci.
L'activité du composé sur la tension du cytosquelette peut être directe ou
indirecte, c' est-à-dire dirigée sur les constituants mêmes du cytosquelette
ou sur
des régulateurs de sa tension. Bien que non limitatif, on préfère les composés
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
6
agissant de manière directe sur la tension du cytosquelette. En outre, on
préfère
également des composés présentant une activité sélective sur la tension du
cytosquelette, c'est-à-dire typiquement des composés qui n'affectent pas
directement la structure des protéines constitutives des jonctions serrées.
Un composé est considéré comme modulant la tension du cytosquelette lorsqu'il
module l'ouverture des jonctions serrées. Un effet inhibiteur de la
contraction ne
doit pas nécessairement être complet ou total, mais il suffit qu'il diminue la
contraction suffisamment pour réduire (ouverture des jonctions serrées
correspondant à une diminution minimale d'environ 30% de la perméabilité
paracellulaire de l'épithélium pulmonaire, préférentiellement d'environ 40%,
de
façon plus préférée d'environ 50%.
Différents types de composés peuvent être utilisés dans le cadre de la
présente
demande. Ainsi, au sens de l'invention, le terme « composé » doit être pris
dans
un sens large, c'est-à-dire comme désignant tout agent, substance,
composition,
condition, traitement ou procédé permettant de moduler la tension du
cytosquelette. Il s'agit avantageusement d'un agent (e.g., d'une molécule) ou
d'une combinaison ou association de molécules.
Selon un premier mode de réalisation préféré, on utilise des composés
inhibiteurs
(ou modulateurs) de la contraction de la chaîne légère de la myosine, ou des
composés inhibiteurs (ou modulateurs) de la dégradation de l'actine.
Un mode particulièrement préféré de mise en oeuvre de l'invention réside dans
l'utilisation de composés inhibiteurs de la contraction de la chaîne légère de
la
myosine ou de la dégradation de l'actine, préférentiellement des composés
inhibiteurs de la phosphorylation de la chaîne légère de la myosine.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
7
De tels composés inhibiteurs de la phosphorylation de la chaîne légère de la
myosine peuvent être des inhibiteurs de la kinase de la chaîne légère de la
myosine (MLCK).
Un exemple particulier d'inhibiteur sélectif de MLCK est le composé ML-7 {1
(5-i~donaphtalène-1-sulfonyl)=1H-hexahydro-1,4-diazepine} (Makishima -M. et
al. FEBS Lett. 1991; 287:175). D'autres exemples de tels inhibiteurs sont
notamment le composé ML-9 (Wilson DP.et al. J Biol Chem. 2001;13: 165) ou
d'autres non sélectifs: Wortmannin (Warashina A. Life Sci 2000;13: 2587-93),
H-7 (Piao Zf et al. Mol Cell Biol Res Commun 2001;4: 307-12) et KT 7692
(Warashina A. Life Sci 2000;13: 2587-93). Un objet préféré de l'invention
réside
dans l'utilisation de composés inhibiteurs de MLCK choisis parmi ML-7, ML-9,
Wortmannin, H-7 et KT 7692, seuls ou en combinaison. Des composés préférés
de l'invention sont des composés n'ayant pas d'effet significatif ou
substantiel
sur la perméabilité vasculaire et/ou l'hémodynamique circulatoire pulmonaire.
Dans un mode de réalisation particulier de l'invention, on utilise des
composés
inhibiteurs de MLCK à l'exception de BDM [2,3-butanedione 2-monoxime],
ML-7, ML-9 [1- (5-chloronaphthalene-1- sulfonyl) -1H-hexahydro-1, 4-diazepine
hydrochloride], wortmannin, H-7 [1- (5-isoquinoline sulphonyl) -2-
methylpiperazine dihydro-chloride], Fasudil (HA1077) [Hexahydro 1- (5-
isoquinolinesulphonyl) - 1 H- 1, 4- diazepine], W-7 [N- (6-Aminohexyl) -5-
chloro- 1-naphthalenesulfonamide] and A-3 [N- (6-Aminoethyl) -5-chloro-1-
naphthalenesulfonamide]. D'autres composés inhibiteurs de la phosphorylation
de la chaîne légère de la myosine peuvent être des activateurs de la myosine
phosphatase.
D'autres cibles agissant sur la tension du cytosquelette sont notamment les
protéines de liaison à la myosine, telles que par exemple la cinguline, ou les
molécules de jonction, telles que la cadherine-E, la catenine-a ou les
desmosomes. La modulation de l'activité ou de l'expression de ces protéines
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
8
permet de réguler la tension du cytosquelette, dans le cadre de la présente
invention.
Un objet particulier de l'invention réside donc dans l'utilisation d'un
modulateur
(notamment d'un inhibiteur) de l'activité ou de la structure ou de-(expression
des
molécules du cytosquelette. Le composé peut être par exemple un acide
nucléique antisens, une molécule synthétique, un fragment d'anticorps, etc.
Selon un autre mode de réalisation, on peut utiliser des composés inhibiteurs
de
la synthèse de protéines ou autres molécules assurant la liaison entre les
protéines
du cytosquelette et les protéines des jonctions serrées. Parmi les protéines
des
jonctions serrées, on peut citer notamment les protéines occludines,
claudines,
ZO-1, ZO-2, ZO-3, AF7 et 7H6. Un moyen selon l'invention de moduler
l'ouverture ou la fermeture des jonctions serrées réside donc dans la
régulation
de la synthèse des protéines de liaison entre le cytosquelette et les
protéines des
jonctions serrées. En stimulant cette synthèse, il est attendu un renforcement
des
liaisons entre les jonctions serrées et le cytosquelette, conduisant à une
plus
faible perméabilité de l'épithélium.
D'autres composés utilisables dans le cadre de l'invention sont par exemple
des
inhibiteurs de kinases activées par les mitogènes (MAPI~K), notamment de la
kinase MEK1 ou de la kinase-PI3, tels que les composés PD098,059 f 2-(Amino-
3-methoxyphenyl)-4H-1-benzopyran-4-one}(Alessi et al. J.Biol.Chem.1995; 270,
27589) ou LY294002 {2-(4-Morpholinyl)-8phenil-1(4H)-benzopyran-4-one}
(Vlahos et aI.J.Biol.Chem 1994;269: 5241).
D' autres molécules utilisables pour réguler, de manière indirecte, la tension
du
cytosquelette, sont des facteurs de croissance, tels que le facteur de
croissance
hépatique (HGF), le facteur de croissance endothélial (EGF) ou certaines
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
9
cytokines susceptibles d' être libérées par les immunocytes, telles que les
interleukines-l, -4, -13, ou les facteurs tels que IGF-1 ou l'interféron
gamma.
Une autre approche permettant de réguler de manière indirecte la tension du
cytosquelette repose sur l'utilisation de la taurine ou du peptide GLP2
(« glucagon-like peptide 2 ») ou encore des dérivés de ces derniers, qui
peuvent
permettre d'altérer la perméabilité de l'épithélium pulmonaire par un effet
indirect sur la contraction du cytosquelette. De même, certaines molécules
agissant sur des récepteurs situés au pôle apical des cellules épithéliales
(ex:
récepteurs aux protéinases; PAR-2) peuvent agir indirectement sur le
cytosquelette.
Un mode préféré de mise en oeuvre de l'invention comprend l'utilisation
d'agents
agissant de manière directe sur la tension du cytosquelette, notamment de
molécules inhibitrices de la contraction du cytosquelette, en particulier de
molécules inhibitrices de la contraction de la chaîne légère de la myosine, ou
inhibitrices de la dégradation de l'actine, préférentiellement des composés
inhibiteurs de la phosphorylation de la chaîne légère de la myosine.
Comme indiqué ci-avant, les composés utilisés sont avantageusement des
molécules, qui peuvent être sous forme isolée ou sous forme de combinaison,
d'extraits biologiques, etc. Ces molécules peuvent être synthétiques, semi-
synthétiques ou biologiques, notamment d' origine animale, virale, végétale ou
bactérienne.
La présente invention peut être utilisée pour le traitement ou la prise en
charge de
pathologies ou désordres du système respiratoire, notamment de l' asthme, des
allergies, des pathologies obstructives (bronchites, bronchiolites, emphysème,
etc), notamment lorsque ces pathologies ont un caractère chronique ou sévère.
Elle est particulièrement adaptée au traitement préventif ou curatif de
l'asthme
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
ou de diverses allergies (poussières, pollens, pollution, etc.) ainsi qu'au
traitement local d'inflammations pulmonaires. Elle est utilisable de manière
préventive chez des suj ets présentant des prédispositions ou une sensibilité
à ce
type de désordres, ou de manière curative, par exemple lors de crises ou sur
des
5 périôdes plus longues. Lés compositions et méthodes de l'invention
permettent
de réduire la souffrance ou les difficultés respiratoires des sujets,
d'atténuer les
symptômes ou la cause de ces désordres.
Un objet particulier de l'invention réside dans l'utilisation d'un composé tel
que
10 défini ci-avant pour la préparation d'un médicament destiné à contrôler,
notamment à réduire la perméabilité paracellulaire de l'épithelium pulmonaire
chez des suj ets atteints de maladies respiratoires, notamment d' affections
pulmonaires caractérisées par une accumulation intrabronchique et alvéolaire
de
neutrophiles ou d'éosinophiles, par exemple d'asthme ou d'allergie.
Un autre objet particulier de l'invention réside dans l'utilisation d'un
composé tel
que défini ci-avant pour la préparation d'un médicament destiné à réduire la
sensibilisation aux allergènes chez des sujets atteints ou sensibles aux
maladies
respiratoires, notamment aux affections pulmonaires caractérisées par une
accumulation intrabronchique et alvéolaire de neutrophiles ou d' éosinophiles,
par
exemple d' asthme ou d' allergie.
Un autre objet particulier de l'invention réside dans l'utilisation d'un
composé tel
que défini ci-avant pour la préparation d'un médicament destiné à réduire la
migration transépithéliale d'immunocytes et l'accumulation d'immunocytes dans
le poumon de sujets atteints d'une pathologie respiratoire, notamment d'une
affection pulmonaire caractérisée par une accumulation intrabronchique et
alvéolaire de neutrophiles ou d'éosinophiles, par exemple d'asthme ou
d'allergie.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
11
L'invention est également relative à des méthodes de traitement des conditions
indiquées ci-dessus, comprenant l'administration à un sujet atteint d'une
pathologie respiratoire ou sensible aux pathologies respiratoires, d'un
composé
ou traitement tel que défini ci-avant. De préférence, le composé ou traitement
est
administré dans une dose efficace pour-réduire la perméabilité-paracellulaire
de
l'épithelium pulmonaire et/ou pour réduire la sensibilisation aux allergènes
et/ou
pour réduire la migration transépithéliale d'immunocytes et l'accumulation
d'immunocytes dans le poumon.
Le composé peut être administré par différentes voies et sous différentes
formes.
Ainsi, le composé peut être sous forme liquide, solide ou en aérosol,
typiquement
sous forme de comprimé, gélule, aérosol, ampoule ou soluté buvable, solution
injectable, etc. On préfère des composés formulés sous une forme administrable
par voie locale (e.g., dans les voies aériennes (e.g., respiratoires)) ou par
voie
orale (solutés buvables, comprimés, ampoules, sirops, sprays, etc.). Le
conditionnement en aérosol est particulièrement préféré, lorsque cela est
possible. Bien entendu, d'autres formes d'administration sont possibles, comme
des injections (intradermique, sous-cutanée, intramusculaire, intraveineuse,
intra-
artérielle, intrapéritonéale, etc.), des pâtes, gels, suppositoires, etc.
Les composés peuvent être utilisés seuls ou en combinaisons et/ou en
association
avec d' autres agents actifs, comme par exemple d' autres substances actives
utilisées dans le traitement des maladies respiratoires. On peut citer par
exemple
les agonistes-[32 et les composés anti-cholinergiques, les corticostéroïdes,
les
anti-leulcotrienes, etc. Ces différents agents peuvent être utilisés en
combinaison
thérapeutique, et administrés sous forme séparée, combinée, étalée dans le
temps
ou concomitante.
Un autre objet de l'invention réside dans un produit ou une association
pharmaceutique comprenant au moins un composé modulateur de la tension du
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
12
cytosquelette de cellules épithéliales pulmonaires et au moins un autre agent
actif
sélectionné parmi les agonistes-(32, les composés anti-cholinergiques, les
corticostéroïdes et les anti-leukotriènes, en vue d'une utilisation combinée,
séparée ou espacée dans le temps.
Un autre objet de l'invention réside dans une composition pharmaceutique
comprenant au moins un composé modulateur de la tension du cytosquelette de
cellules épithéliales pulmonaires selon l' invention, préférentiellement un
composé inhibant la contraction de la chaîne légère de la myosine, plus
particulièrement un composé inhibant la phosphorylation de la chaîne légère de
la myosine, plus particulièrement un inhibiteur de la MLCK ou un activateur de
la myosine phosphatase, et un excipient acceptable sur le plan pharmaceutique,
ladite composition étant formulée préférentiellement pour une administration
par
voie orale ou aérienne. De préférence, la composition est sous forme d'aérosol
et
comporte un gaz porteur, ou sous forme de solution buvable.
Le composé modulateur de la tension du cytosquelette de cellules épithéliales
pulmonaires utilisé à titre d' actif pharmaceutique est mis en oeuvre dans des
quantités thérapeutiquement efficaces. Il est entendu que la dose achninistrée
peut
être adaptée par l'homme du métier en fonction du sujet (patient) à traiter,
de la
pathologie concernée, du mode d'administration, etc. Les quantités ou doses
des
composés administrées ou utilisées dans les compositions selon l'invention
peuvent être déterminées en fonction de leur capacité à moduler la tension du
cytosquelette de cellules épithéliales pulmonaires. Cette capacité et donc
l' évaluation de la dose à administrer peuvent notamment être déterminées par
le
protocole expérimental décrit dans l'exemple 7.
D'autres aspects et avantages de la présente invention apparaîtront à la
lecture
des exemples qui suivent, qui doivent être considérés comme illustratifs et
non
limitatifs.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
13
LEGENDE DES FIGURES
Figure 1 : Influence du ML-7 sur l'augmentation de la perméabilité
paracellulaire
pulmonaire -de la serunu albumine humaine marquée à-l' Iazs induite par la
perfusion infra-trachéale de LPS de Pseudomonas aeruginosa. Le LPS diminue
les taux de radioactivité mesurés au niveau des liquides de lavage
bronchoalvéolaires (LBAs) alors que, comparés aux témoins, ces taux sont
significativement plus élevés au niveau des poumons. Cette augmentation de la
perméabilité pulmonaire est supprimée par un pré-traitement des animaux au
ML7. En effet, des valeurs similaires aux valeurs témoins des taux de
radioactivité tant au niveau des LBAs que des poumons ont été mesurées chez
ces animaux.
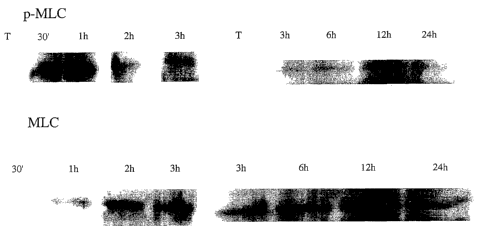
Figure 2 : Western blot des formes phosphorylées de la chaîne légère de
myosine
(p-MLC) et de la forme native (MLC) à la suite du traitement des cellules
bronchiques humaines NCI-H292 en culture par le LPS. Les temps d'incubation
sont indiqués sur chaque blot (T correspondant au témoin).
EXEMPLES
Exemple 1 : Réduction de la réponse inflammatoire bronchique par la
taurine
L'épithélium bronchique et alvéolaire possède des structures de liaison des
cellules épithéliales qui assurent un passage contrôlé des immunocytes dans
les
voies aériennes. Cet exemple montre que certaines molécules connues pour leur
effet d' augmentation de la perméabilité paracellulaire au niveau intestinal
tel que
le SLIGRL favorisent l'accumulation infra-alvéolaire d'immunocytes
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
14
(neutrophiles, macrophage) et que cet effet peut être prévenu (e.g., inhibé,
réduit)
par un traitement oral par la taurine.
Pour ce faire, quatre lots de ~ rats mâles Wistar (250-300 g) ont reçu pendant
10
jours unè eau de boisson contenant (lots l et 2) ou-ne contenant pas (lots 3
et 4)
de la taurine (5 %).
Au temps t = 10 j, les 4 lots d'animaux sont soumis à l'instillation
intranasale
lente de 200 ~.l de sérum physiologique contenant (lots 2 et 4) ou ne
contenant
(lots 1 et 3) 0,2 mg de SLIGRL.
Au temps t = 3 h après l'instillation infra-nasale, les animaux ont été
anesthésiés
pour la réalisation d'un lavage bronchoalvéolaire, puis sacrifiés.
Les résultats obtenus sont présentés dans le Tableau 1 ci-après.
Ces résultats montrent que l'instillation intranasale du SLIGRL entraîne, à t
= 3
h., l'accumulation d'éosinophiles et de neutrophiles dans le liquide de lavage
bronchoalvéolaire (BAL) chez les animaux contrôles mais pas chez ceux ayant
reçu la taurine (tableau 1). Ces résultats confirment in vivo l'implication
des
jonctions serrées dans la perméabilité aux immunocytes de l'épithélium
pulmonaire.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
Tableau 1 : Influence de la Taurine sur le niveau d'accumulation de
neutrophiles
et d'éosinophiles dans le liquide de lavage bronchoalvéolaire induite par
l'instillation intrasanale de SLIGRL chez le rat (moyennes + SD ; n = 10)
PAR Z (0,2 Taurine 10
mg/kg IN % + PAR
(mean ~
NaCI 0,9 PAR 2 NaCI 0,9 PAR 2
% %
SEM
Tot.
Leucocytes 960 + 112 6464 + 1728 + 111 2086 + 134
99 +
(mm3)
Mac3ophages945 + 25 5559 + 1651 + 72 1967 + 103
63 +
(mm )
Neutrophiles +
4+0,3 65641 34+3 343
(mm3)
Eosinophiles +
0,2+0,7 322 17~ 1 17+ 1
(mm3)
Lymphocytes144 ~ 11 297 ~ 28 22 ~ 8 22 + 8
(mm3)
* p < 0,05 from PAR 2 values ; ' : p < U,US trom lvaL1 vaines ; lin : m
miranasa~
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
16
Exemple 2 : Réduction de la réponse inflammatoire bronchique par le ML-7
Cet exemple montre que le ML-7 réduit l'accumulation infra-alvéolaire
d'immunocytes observée après perfusion intratrachéale de taurocholate associée
à l'ouverture des jonctions serrées.
Pour ce faire, trois lots de 8 rats mâles Wistar (250-300 g) ont reçu soit le
ML-7
par voie IP à la dose de 1 mg/kg/12h pendant 36 heures soit son solvant. Une
heure après la dernière injection, une instillation intratrachéale lente de
200 ~,1 de
sérum physiologique contenant (2 lots) ou ne contenant pas (lot témoin) 50 mM
de taurocholate.
Au temps t = 2 h après l'instillation intratrachéale, les animaux ont été
anesthésiés pour la réalisation d'un lavage bronchoalvéolaire, puis sacrifiés.
Les résultats obtenus sont présentés dans le Tableau 2 ci-après. Ils montrent
que
le composé ML-7 permet de réduire de manière significative l' accumulation
infra-alvéolaire d'immunocytes.
Tableau 2 : Influence du ML-7 sur le niveau d'accumulation d'immunocytes
dans le liquide de lavage bronchoalvéolaire induite par l'instillation
intratrachéale de taurocholate (5 mM/rat) chez le rat (moyennes ~ SD ; n = 8)
30
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
17
Tmoin Taurocholate ML-7 +
Taurocholate
Leucocytes 4032 ~ 919 35200 ~ 1270.84160 ~ 573
* _
Macrophages 3419 ~ 762 33288 ~ 155313585 ~ 398
*
Lymphocytes 166 ~ 68 3654 ~ 2443 101 ~ 44
*
Neutrophiles 445 ~ 113 5732 ~ 2279 473 ~ 216
*
Témoin : eau stérile perfusée 20 min par voie trachéale; Taurocholate 5 mM
perfusé par voie
trachéale; ML7 (1 mg/kg /12 h, 36 h IP) + Taurocholate
* p< 0.001 significativement different des valeurs temoins
Exemple 3 : Réduction de la réponse inflammatoire bronchique par le PD-
98059
Cet exemple montre que le PD-98059 (inhibiteur de la kinase MEK1), réduit
l'accumulation infra-alvéolaire d'immunocytes associée à l'ouverture des
jonctions serrées, observée après la perfusion infra-trachéale de taurocholate
(Tableau 3).
Pour ce faire, trois lots de 8 rats mâles Wistar (250-300 g) ont reçu soit le
PD-
98059 par voie IP (1 mg/kg/12 h, 36 h) soit son solvant (DMSO). Une heure
après la dernière administration, sous anesthésie à l'uréthane (25 mg/kg IP),
une
perfusion infra-trachéale lente de 200 ~.1 de sérum physiologique contenant (2
lots) ou ne contenant pas (lot témoin) 5 mM/rat de taurocholate est réalisée.
Les lavages broncho-alvéolaires (LBAs) ont été réalisés 2 heures après la
perfusion infra-trachéale de taurocholate ou de son solvant.
Tableau 3 : Influence du PD-98059 sur le niveau d'accumulation d'immunocytes
dans le liquide de lavage broncho-alvéolaire induit par la perfusion infra-
trachéale
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
18
de taurocholate (5 mM/rat) chez le rat (moyennes ~ SEM ; n=8). Résultat
exprimé
en nombre de cellules / mm3 de LBA.
Tmoin Taurocholate PD-98059 +
taurocholate
Leucocytes 5040 628 56637 9791 * 21424 3164*#
Macrophages 4582 586 40234 5799* 17956 2465*#
Lymphocytes 136 31 4251 940* 774 183*#
Neutrophiles 320 62 11769 5787* 2652 600*#
(Eosinophiles)0 602 173 27 27*#
Témoin : NaCI 0.9% stérile perfusée 20 min par voie infra-trachéale ;
taurocholate SmM :rat perfusé par voie trachéale ; PD-98059 (1 mg/kg/12 h, 36
h)
+ taurocholate.
* p<0.05 significativement différentes des valeurs témoins.
# p< 0.05 significativement différentes des valeurs taurocholates.
Exemple 4 : Inhibition par le ML7 de l'augmentation de la perméabilité
pulmonaire induite par le LPS de Pseudomonas aeruginosa chez le rat.
Cet exemple montre que le ML7 (inhibiteur de la kinase de la chaine légère de
la
myosine, MLCK) bloque de façon significative l'augmentation de la perméabilité
pulmonaire liée à la perfusion infra-trachéale de lipopolysaccharide (LPS ) de
Pseudomonas aeruginosa.
La perméabilité pulmonaire a été mesurée à l'aide d'un traceur, la sérum
albumine humaine marquée à l'Ilzs, lequel, après perfusion infra-trachéale,
est
mesuré dans les urines, le plasma, le tissu pulmonaire et les lavages broncho
alvéolaires.
Pour ce faire, trois lots de 6 rats mâles Wistar (200-225 g) ont reçu soit un
pré-
traitement de ML-7 par voie IP (3 mglkg puis 1 mg/kg 3 fois par jour pendant
48h) soit son solvant (éthanol 10%). Une heure après l'avant-dernière
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
19
administration de ML-7, sous anesthésie à l'uréthane (25 mg/kg IP), une
perfusion infra-trachéale lente de 150 ~,l d'une solution iso-osmolaire (5%
albumine bovine + PBS) additionnée du traceur contenant (2 lots) ou ne
contenant
pas (lot témoin) 1 ~g/rat de LPS, a été réalisée.
4 heures après- la perfusion infra-trachéale, les - urines, ie sang, les
lavages
broncho-alvéolaires (LBA) et les poumons ont été collectés puis la
radioactivité
has a été mesurée sur chacun de ces prélèvements.
Les résultats obtenus montrent que le LPS diminue les taux de radioactivité
mesurés au niveau des LBAs alors que, parallèlement, comparés à ceux des
témoins, ces taux sont significativement plus élevés au niveau des poumons.
Cette augmentation de la perméabilité pulmonaire est supprimée par un pré-
traitement des animaux au ML7. En effet, des valeurs similaires aux valeurs
témoins des taux de radioactivité, tant au niveau des LBAs que des poumons,
ont
été mesurées chez ces animaux (figure 1).
Chez les trois lots d' animaux testés, aucune différence dans les taux de
radioactivité mesurés au niveau plasmatique n'a été observée.
Ces résultats montrent que dans nos conditions expérimentales - extrapolables
à
l' asthme et autres pathologies respiratoires allergiques - le ML-7 ne possède
pas
d'effet sur les cellules endothéliales vasculaires susceptibles de modifier la
perméabilité de l'endothélium, son tonus (vasodilatation) et donc en général
sur
l'hémodynamique circulatoire pulmonaire (débit, oxygénation i.e. amélioration
de l'hypoxie).
De plus aucune trace de radioactivité n'a été retrouvée dans les urines.
En conclusion, cet exemple montre que le LPS de Pseudomonas aeruginosa
augmente la perméabilité paracellulaire au niveau pulmonaire favorisant
l'accumulation d'immunocytes au niveau pulmonaire et que cet effet peut être
prévenu par un traitement impliquant un bloqueur de la MLCK.
Exemple 5 : Réduction par le ML-7 de la réponse inflammatoire bronchique
induite par le LPS de Pseudomonas aeruginosa chez le rat.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
Cet exemple complète l' exemple précédent et illustre la réduction, par le
ML7, de
la réponse inflammatoire bronchique induite par le LPS de Pseudomonas
Aeruginosa administré par perfusion infra-trachéale. Le ML-7 réduit ainsi
5 l'accumulation infra-alvéolaire d'immunocytes.
Pour ce faire, trois lots de 7 rats mâles Wistar (200 - 225 g) ont été
utilisés. Les
animaux ont reçu soit un pré-traitement de ML-7 par voie IP (3 mg/kg puis 1
mg/kg, 3 fois par jour pendant 48h) soit son solvant (éthanol 10%). Une heure
après l'avant-dernière administration de ML-7, sous anesthésie à l'uréthane
(25
10 mg/kg IP), une perfusion infra-trachéale lente de 150 ~.1 d'une solution
iso-
osmolaire (5% albumine bovine + PBS) contenant (2 lots) ou ne contenant pas
(lot témoin) 1 ~,g/rat de LPS a été réalisée. 4 heures après la perfusion
intra-
trachéale, les lavages broncho-alvéolaires (LBAs) ont été réalisés.
Les résultats obtenus montrent que le LPS augmente les taux d'inununocytes
15 présents au niveau des LBAs et plus particulièrement des polynucléaires
neutrophiles. Cette augmentation de la neutrophilie est réduite par un pré
traitement des animaux au ML7 (Tableau 4).
Tableau 4 : Influence du ML7 sur le niveau d'accumulation d'immunocytes dans
20 le liquide de lavage broncho-alvéolaire induite par la perfusion infra-
trachéale de
LPS (1 ~.g/rat) chez le rat (moyennes ~ SEM ; n=7). Résultats exprimés en
nombre de cellules / mm3 de LBA.
Tmoin LPS ML-7 +
LPS
Leucocytes 5883 961 37968 6912 17243 2956
* * #
Macrophages 4760 738 16670 3060 10708 1713
*
Lymphocytes 188 70 2253 905 * 902 375
Neutrophiles 934 707 19045 4892 6587 1749
* * #
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
21
Témoin : Solution à 5% albumine bovine + PBS perfusée 20 min par voie intra-
trachéale ; LPS 1 p,g/rat perfusé par voie trachéale ; ML-7 (3 mg/kg puis 1
mg/kg
3 fois par jour pendant 48h IP) + LPS
'~ p<0.05 significativement différentes des valeurs témoins.
# p< 0.05 significativement différentes des valeurs LPS.
Exemple 6: Stimulation de la phosphorylation de la chaîne légère de
myosine des cellules épithéliales bronchiques humaines par le LPS.
Matériel : La lignée cellulaire humaine utilisée NCI-H292 a été obtenue de
l'American Type Culture Collection (Manassas, VA). Les réactifs utilisés,
milieu
RPMI 1640, sérum de veau fétal et autres réactifs de culture cellulaire ont
été
fournis par GIBCO, le cocktail d'inhibiteurs de protéases par ROCHE (1697498)
et le LPS (E.coli SO55 :BS) et autres réactifs par SIGMA.
Culture cellulaire : Les cellules NCI-H292 ont été cultivées sur un milieu
RPMI
1640 supplémenté avec 2 mM de L-glutamine, 100 U/ml penicilline,100 ~,g/ml de
streptomycine et 10% de sérum de veau fétal. Les cellules ont été cultivées à
37°C sous air humidifié contenant 5% de C02 et repiquées 2 fois par
semaine. Les
cellules ont été disséminées dans des plaques à 6 puits, chacun contenant
5..10 3
cellules. Au stade de confluence, les cellules ont été incubées dans du RPMI
1640
contenant 0.1 % de Serum Albumine Bovine (BSA) pendant une nuit. Les
cellules sont ensuite rincées avec du RPMI 1640 sans BSA et exposées au LPS
(2~,g/ml) ou au sérum physiologique comme témoin (NaCI 0.9%) pour des durées
allant de 30 mn à 24 heures.
Western Blot : Pour cette analyse, les cellules ont été lysées à différent
temps
après traitement au LPS avec un tampon RIPA (1% triton, 150mM NaCI, 1mM
EDTA, lOmM Tris pH7,4 et le cocktail d'inhibiteurs de protéases à la
concentration recommandée par le fournisseur). La forme phosphorylée de la
chaîne légère de myosine (p-MLC) et la forme non phosphorylée de la chaîne
légère de myosine (MLC-20) ont été détectées dans ces cellules aux temps 30mn,
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
22
1, 2 et 3 heures d'exposition au LPS ainsi qu'aux temps plus longs (6, 12 et
24
heures). Les protéines des cellules NCI-H292 exposées au LPS ont été séparées
par SDS-PAGE dans un gel de polyacrylamide à 15% et soumises au transfert
électrophorétique sur membrane de nitrocellulose dans 25 mM de Tris-amino,
192 mM de glycine-et 20% de méthanol. L'immunoprécipitation a été effectuée
avec un anticorps de chèvre anti-myosine phosphorylée humaine dilué au 1/500
(Santa Cruz Biotechnology Inc.) ou un anticorps monoclonal de souris anti-
myosine humaine (light chains 20 K, Sigma-Aldrich, Inc.) dilué au 1/1000, pour
la détection respective de p-MLC et de MLC-20. La peroxydase-Protein G
recombinante a été utilisée à la dilution 1/1000 comme anticorps secondaire.
Les
bandes immunomarquées ont été révélées par fluorographie avec le réactif ECL
(Enhanced chemiluminescence, Pierce, Perbio Science, Inc.).
Résultats : Par rapport au témoin (sérum pysiologique), il a été constaté une
augmentation quantitative de l'expression de la forme phosphorylée p-MLC dans
les cellules traitées au LPS maximale après 30mn et 1 heure d'exposition (fig.
2),
avec un retour aux valeurs contrôles en 6 heures. L' expression de la forme
non-
phosphorylée MLC-20 est faible quant à elle après 30mn et 1 heure de
traitement
au LPS et augmente progressivement dans le temps (fig. 2 : illustration des
analyses western-blot).
Conclusions: L'exposition des cellules bronchiques humaines au LPS entraîne
une augmentation rapide (30mn -1 heure) de la phosphorylation des chaînes
légères de myosine qui constituent le cytosquelette de ces cellules. Cette
phosphorylation traduit la contraction du cytosquelette et l'ouverture des
jonctions serrées favorisant ainsi la pénétration des allergènes et
l'accumulation
d'ünmunocytes dans les bronches.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
23
Exemple 7: Protocole expérimental pour déterminer in vitro les
concentrations actives plasmatiques en composés tests et susceptibles d'agir.
Le criblage in vitro de formulations pharmaceutiques peut être une méthode
efficace et rentable pour identifier le candidat tête de série avant les tests
in vivo.
Les cellules produisent des jonctions serrées qui inhibent le passage de
substances
en solution de bas poids moléculaire et le flux de courant électrique,
permettant
l'utilisation de résistance trans-épithéliale (RTE) comme corrélat de
perméabilité.
Mesure de la résistance électrique : les cellules humaines pulmonaires
croissent
jusqu'à confluence sur des inserts de membranes de cultures de cellules
poreuses
et leurs résistances électriques sont mesurées à l'aide d'un système de
résistance
électrique. Un insert sans monocouche cellulaire sert de témoin pour
déterminer
la résistance de base et les inserts avec des monocouches cellulaires à
confluence
traités avec du PBS servent de contrôles. Les LPS des Pseudomofaas aeruginosa
sont ajoutés à des concentrations variant de 1,0 ng/ml à 10 ~,l/ml et incubés
pendant 6 heures à 37°C. La résistance électrique trans-épithéliale
(ohms x
centimètre carré) est calculée à partir de l' équation suivante :
(RTEéchantillon -
RTEte",oi") x surface. Le LPS de Pseudomohas aerigihosa diminue la résistance
électrice de manière dose dépendante. La donnée obtenue correspondant à la
dose
maximale induisant une réponse avec la diminution maximale de la RTE est
considérée comme la réponse à 100% et est reportée pour les composés-tests.
Composés-tests : Utilisant le même protocole avec la dose maximale de LPS
(réponse à 100%), les composés-tests sont incubés 1 heure auparavant à des
concentrations variant de 10 ~M à 500 g.M. Les doses des composés-tests
retenues pour les investigations ou essais futurs sont les concentrations pour
lesquelles on constate une inversion de 50% de la düninution maximale de la
RTE induite par le LPS.
CA 02470442 2004-06-15
WO 03/053422 PCT/FR02/04506
24
Ce test peut être utilisé pour évaluer l'effet inhibiteur à 50% de composés-
tests
sur la diminution de la RTE suite à l'exposition au LPS de monocouches
cellulaires issues de cellules épithéliales bronchiques humaines (NCI-H292).