Note: Descriptions are shown in the official language in which they were submitted.
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
PROCÉDÉ ET DISPOSITIF POUR LE CRIBLAGE DE MOLÉCULES DANS
DESCELLULES
La présente invention est relative à un procédé et un dispositif
permettant de mettre en ceuvre des réactions sur une ou plusieurs cellules ou
sur des
tissus de cellules ou des réseaux de cellules ou entre des cellules.
L'entrée de molécules dans la cellule représente une étape clef en
biotechnologie. Le. plus .souvent, pour étudier cette étape, on doit cribler
en parallèle,
dans les mêmes conditions, les effets biologiques d'une famille de molécules.
La
quantité croissante de séquences d'ADN et d'autres molécules disponibles pour
être
l0 testées sur les cellules rend indispensable l'utilisation de procédés
automatisés, ayant
un caractère systématique et dotés de hauts rendements.
On connaît par le document WO01/07159 un dispositif permettant
de réaliser des protocoles biochimiques en série dans des microréacteurs.
Toutefois ce
dispositif ne permet pas de travailler sur des cellules.
Le document W095/34374 décrit un dispositif et un procédé
permettant de réaliser des microréactions en série. Toutefois, ce dispositif
et ce
procédé n'envisagent pas de mettre en ouvre des réactions dites de
transfection, dans
lesquelles un réactif pénètre dans me cellule. En effet, la cellule est un
organisme
vivant, hétérogène, dont la survie et la mise en réaction requièrent des
conditions
pauticulières, notamment en ce qui concerne les échanges gazeux. Ces
paramètres ne
sont pas pris en compte ni même envisagés dans ce document.
A l'heure actuelle, la plupart des méthodes de criblage de molécules
ne permettent pas d'utiliser des cellules vivantes, elles sont réalisées avec
des binômes
de molécules isolées. Dans le cas des criblages mettant en jeu des cellules
vivantes, les
molécules criblées pénètrent rarement dans les cellules, elles reconnaissent
seulement
des capteurs de surface, tels que par exemple des récepteurs.
Par exemple, la transfection de cellules par des familles d'ADN est
faite actuellement dans des boîtes comportant des puits répartis sous forme de
matrices. Ce procédé présente l'inconvénient de consommer d'importantes
quantités. de
réactif, de nécessiter des dispositifs lourds pour la détection des
interactions
moléculaires. En outre, les systèmes d'analyse de fluorescence en puits ont
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
2
l'inconvénient d'être d'une taille importante, la fluorescence propre des
plaques à
puits doit être prise en compte, l'analyse doit être faite puits par puits,
sans vision
globale de l' ensemble du dispositif
On connaît par J. Ziauddin et al., Nature, 411, 107-110, 2001, un
procédé de transfection automatisé : on dépose de l'ADN sous forme d'une
dispersion dans de la gélatine de façon matricielle sur une lame de verre.
Après
séchage, les emplacements comprenant l'ADN sont traitës par un agent de
transfection
lipidique puis la plaque est placée dans un milieu dans lequel sont réparties
des
cellules. Sur la lame de verre, l'ADN gélatinisé est présent sous forme solide
et la
lo transfection se fait en phase semi-solide en liant les molécules d'ADN à
des lipides
favorisant la pénétration de l'ADN dans les cellules adjacentes aux dépôts
d'ADN. On
obtient une matrice de cellules transfectées aux emplacements correspondant
aux
dépôts d'ADN. Toutefois cette méthode présente l'inconvénient d'être peu
précise et
non reproductible. L'accrochage par la gélatine ne permet pas de contrôler le
I5 décrochage de l'ADN transfecté. Il ne permet pas non plus d'améliorer
l'efficacité de la
transfection. Par ce procédé l'expression ou le blocage de l'expression d'une
quantité
suffisante de protéine peut difficilement être obtenu. En outre, une seule
sorte de
cellule peut être utilisée pour chaque lame de verre.
Il subsiste donc le besoin d'une méthode de transfection, et plus
2o généralement de mise en réaction de composés avec des cellules biologiques,
ladite
méthode étant automatisable, utilisant des quantités minimales de réactifs et
donnant
des résultats reproductibles. En outre, on souhaite pouvoir mettre en série
plusieurs
réactions dans une même cellule, pouvoir travailler sur des systèmes
cellulaires
complexes (2 types de cellules différentes), sur des tissus ou sur des rêseaux
25 cellulaires, et mettre en parallèle plusieurs systèmes cellulaires. On
souhaite
également que le génome des cellules utilisées puisse être préalablement
modifié afin
de préparer la détection des interactions moléculaires, par exemple par
l'introduction
de gènes de protéines fluorescentes.
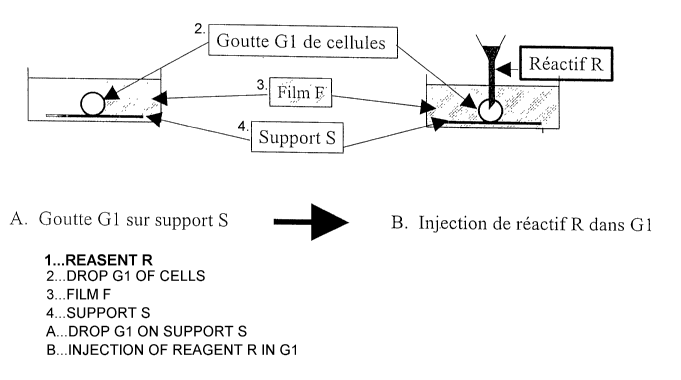
L'invention a donc pour objet un procëdé de mise en rëaction d'un
3o réactif R avec au moins une cellule C, ledit procédé étant caractérisé en
ce que
- la cellule C est déposée sur un support S comportant une surface
sensiblement plane, sous forme d'une goutte aqueuse sur ladite surface ;
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
3
- la surface sensiblement plane du support S sur laquelle a été
déposée la goutte aqueuse contenant Ia cellule G est recouverte par un film de
séparation F, permettant le passagé des gaz et empêchant l'évaporation des
gouttes
aqueuses déposées sur le support S, F étant non miscible avec le réactif R.
- la réaction entre le réactif R et la cellule C est déclenchée par
l'introduction du réactif R dans la goutte aqueuse contenant la cellule C.
Plusieurs
variantes existent pour l'introduction du réactif R dans la cellule C
Selon une première variante, une goutte aqueuse contenant la
cellule C est déposée sur le support S, une seconde goutte aqueuse contenant
le réactif
lo R est injectée, à I'aide de tout moyen d'injection approprié, directement
dans la goutte
contenant la cellule C. Une telle variante est illustrée par Ia figure 1.
Selon une seconde variante, une première goutte aqueuse est
déposée sur le support S puis une seconde goutte aqueuse est déposée sur le
méme
support à proximité de la première, l'une de ces gouttes contient la cellule
C, l'autre le
réactif R, la réaction du réactif R avec la cellule C, et éventuellement sa
transfection
dans la cellule C, est déclenchée par la fusion des deux gouttes. Le
déplacement et la
fusion des gouttes peuvent être obtenus par vibration au sein du support, par
déplacement électrophorétique des gouttes chargées électriquement ou par des
pinces
mécaniques ou optiques. Ils peuvent également être obtenus par une
modification des
propriétés de surface du support sous l'effet d'un champ électrique,
magnétique, par
un traitement optique ou thermique. Une telle variante est illustrée par la
figure 2.
Selon une troisième variante, le réactif R est fixé au support S ou
au film F, la cellule C est déposée sous forme d'une goutte aqueuse sur le
support S et
le réactif R est alors décroché du support S ou du film F afin de permettre sa
réaction
avec la cellule et éventuellement sa transfection dans la cellule. Cette
variante est
illustrée par Ies figures 3 et 7.
Dans la prësente invention, le terme de transfection est utilisé pour
désigner la pénétration d'une molécule d'un réactif, quel qu'il soit, dans une
cellule.
L'invention a également pour objet un dispositif permettant la mise
en réaction d'm réactif R avec une cellule C, ce dispositif étant caractérisé
en ce qu'il
comporte
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
4
- un support S comportant une surface sensiblement plane recouverte
d'un film de séparation F permettant le passage des gaz et empêchant
l'évaporation
des gouttes aqueuses déposées sur le support S, F étant non miscible avec le
réactif R,
- des moyens permettant le dépôt sur ladite surface et sous le film F,
de gouttes aqueuses contenant la cellule C,
- une enceinte à atmosphère contrôlée dans laquelle est placé le
support S de façon à permettre la survie de la cellule C.
Préférentiellement, le support S est constitué par Lme plaque qui peut
être en silicium, en verre ou en polymère, comme par exemple en polyuréthane,
en
1 o nylon, en polyester, en polyéthylène, en polypropylène, en
polyfluorocarbone, en
polyméthylméthacrylate (PMMA), en polycarbonate, en chlonme de polyvinyle
(PVC), en polydiméthylsiloxane (PDMS) ou en polysulfone.
Selon l'invention, l'accrochage des gouttes sur le support se fait par
capillarité, grâce aux forces de tension de surface. Préférentiellement, le
support S
présente une surface sensiblement plane comportant au moins un moyen destiné à
la
réception des gouttes aqueuses.
De préférence, le moyen destiné à la réception des gouttes aqueuses
consiste en des zones de la surface sensiblement plane du support S d'une
taille allant
de 5 p.m2 à 5 mm2.
2ô Selon une première variante, on peut prévoir que le support S
présente sur sa surface plane un caractère hydrophobe et comporte m.e ou
plusieurs
zones hydrophiles constituant ledit moyen de réception. Selon une autre
variante, on
peut également prévoir que le support S comporte sur sa surface plane des
cavités,
d'Lme profondeur allant de 1 micron à 1 millimètre, et constituant ledit moyen
de
réception. On peut également prévoir que le support S soit une plaque munie
d'excroissances de faible épaisseur, de 1 micron à I millimètre, disposées sur
sa
surface et destinées à favoriser l'accrochage des gouttes. Enfin, on peut
prévoir que le
support S soit une plaque munie d'au moins un f l, sur lequel viennent
s'accrocher les
gouttes. Le dépôt de deux gouttes sur le même moyen de réception va favoriser
la
3o fusion de ces deux gouttes et donc Ia réaction du réactif R avec la cellule
C. De
préférence, le support S présente sur sa surface plane un caractère hydrophobe
et
comporte une ou plusieurs zones hydrophiles constituant le moyen de réception.
Pour
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
conférer à la surface plane du support un caractère hydrophobe, celle-ci est
préférentiellement recouverte d'un matériau hydrophobe tel qu'un
polyfluorocarbone,
comme par exemple le polytétrafluoroéthylène ou Téflon ~, d'un silane conune
par
exemple le perfluorosilane. La zone hydrophobe du support peut consister en
une
5 structuration de surface dentelée à l'échelle nanométrique comme le «
silicium noïr »
utilisé en optique. Des exemples de lames commerciales de ce type sont les
lames
immunofluorescence 40 puits D2 mm super téflon, commercialisées par la société
MERCK EUROLAB division POLYLABO. Encore plus préférentiellement, le
support comporte en outre un second moyen de réception des gouttes superposé
au
io premier, comme par exemple une surface plane hydrophobe et des
excroissances de
faible épaisseur hydrophiles, ou une surface plane hydrophobe et des puits
hydrophiles, ou une surface plane hydrophobe et un fil hydrophile.
Selon une variante de l'invention, le support est doté d'une surface
dont les propriétés d'hydrophilie/hydrophobie peuvent varier sous l'influence
d'un
paramètre tel que la température, un champ électrique, un champ magnétique,
une
irradiation. Le support peut ainsi être actif, pour faire évoluer les gouttes
sur sa surface
en utilisant les principes de la microfluidique en goutte. Cela revient à
modifier
dynamiquement Ies propriétés de surface du support (par exemple les variations
en
énergie/tension de surface) pour faire bouger les gouttes de manière
contrôlée. Ainsi,
2o les gouttes de cultures cellulaires peuvent passer par différentes étapes
de réactions
conduites au sein du support : on peut faire fusionner deux gouttes qui se
rapprochent
(une avec le réactif et une autre avec les cellules par exemple).
Pour réaliser ce genre de support Shenderov et al. (« Electrowetting-
based aetuation of liq~cid d~oplets foi microfluidic applications", Applied
Physics
Letters, vol. 77, n°lI, p. 1725-1726, septembre 2000) décrit
l'utilisation de la
modification des énergies de surface d'une couche hydrophobe, lors de
l'application
d'un champ électrique : la tension de surface diminue avec l'intensité du
champ, la
surface devient moins hydrophobe, voir hydrophile. Le contrôle et le mouvement
du
champ électrique permettent de déplacer les gouttes de liquides sur cette
surface. Cette
3o méthode a été brevetée par la société Nanolytics (Shenderov et al. «
Actuators for
microfluidics without moving parts », n° US 6,565,727 ; 2003), mais
sans l'utilisation
de cultures cellulaires.
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
6
Une autre manière de modifier ces propriétés de surface consiste
en la modification physico-chimique de la couche surfacique du support,
toujours à
l'aide d'un potentiel électrique. Par exemple, le changement de conformation
d'une
couche de SAM (« self assembled monolayer », monocouche auto-assemblée, par
exemple des thiols modifiés, comprenant au moins une extrémité hydrophile et
une
chaîne hydrophobe), démontré par Lahann et al. (« A reversibly switching
surface »,
Science, vol. 299, p. 371-374, janvier 2003), permet de passer d'une
conformation
droite des molécules au sein de la couche superficielle, qui alors présente un
caractère
hydrophile, à une conformation courbée, dans laquelle elle présente un
caractèrè
l0 hydrophobe.
De la même manière, on peut utiliser la température comme
moyen de changer les propriétés de surface d'un support. Liang et al.
("Preparatior~ of
Composite-Crosslircked Poly (N Isopropylacrylemide) Gel Layer and
Churacteristics
of Reverse Hydrophilic-Hydrophobic Surface" Journal of Applied Polymer Science
72:1, 1999) décrit un polymère qui est hydrophile à faible températures
(<30°C) et
hydrophobe au-dessus. En intégrant un système de contrôle localisé de la
température
sous le substrat, on peut contrôler les propriétés de la surface.
On peut aussi mettre en place un support dont les propriétés de
la couche surfacique change avec l' application ou non de lumière (champs
2o électromagnétique). Ichimura et al. (« Light-driveh motion of liquids orc a
photoresponsive surface », Science, vol. 288, p. 1624-1626, juin 2000) décrit
une telle
surface : une couche de polymère (calix[4jresorinarene) dont le groupe
terminal
(azobenzene) peut changer de conformation isomérique aprës une
photoirradiation
asymétrique. Lorsqu'on expose ces groupes cycliques en conformation traces
(couche
hydrophile) aux UV (365nm), ils passent en conformation cis (hydrophobe). La
réaction est réversible en utilisant de la lumière bleue (436 nm). En
éclairant de façon
sélective et graduelle la couche de polymère, on peut déplacer des gouttes de
liquide
de maniëre contrôlée.
Selon une variante de l'invention, le réactif R est fixé au support S
3o avant le dépôt de la goutte aqueuse contenant Ia cellule C. De tels
dispositifs sont
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
7
connus de l'homme du métier pour d'autres utilisations : ce sont Ies puces à
ADN
telles que décrites par
- Eisen M.B., Spellman P.T., Brown P.O., Botstein D.
Cluster analysis and display of genome-wide expression patterns,
Proc Natl Acad Sci USA. 1998 Dec. 8; 95(25): 14863-8;
- Haab B.B., Dunham M.J., Brown P.O.,
Protein microarrays for highly parallel detecting and quantitation of
specific proteins and antibodies in complex solutions,
Genome Biol. 2001 Jan 22; 2(2): RESEARCH 0004.1-0004.13;
- Livache T., Bazin H., Caillat P., Roget A., Electroconducting
polymers for the construction of DNA or peptide arrays on silicon
chips, Biosens Bioelectron. 1998 Sep 15;13(6):629-34.
On peut appliquer le même principe à des molécules autres que des
polynucléotides. Des puces à molécules sont décrites dans : Kuruvilla et crl.,
Glucose
signalling with small molecule microarrays, Nertu~e (2002), 416 p. 653. Dans
tous les
cas, la molécule de réactif est d'abord accrochée sur la puce (par exemple par
accrochage covalent sur une lame de verre). Selon la présente invention, Ia
molécule
peut ëventuellement être décrochée après dépôt des gouttes aqueuses contenant
des
cellules sur la puce à molécules.
2o Le décrochage de la molécule de réactif peut être fait de façon
connue par l'un des moyens suivants
- photoclivage par des UV en utilisant un site de liaison du réactif au
support qui soit photoclivable comme illustré par la figure 5.
Et dans le cas où le réactif est un polynucléotide uniquement
- coupure de l'ADN double brin par des enzymes de restriction, ou
par d'autres nucléases,
- modification de la stringence d'hybridation : un changement de
concentration saline, de température ou de conditions Redox du milieu permet
de
séparer deux brins d'ADN.
3o Dans certains cas on prévoit que le réactif R reste fixé sur le
substrat.
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
8
Selon l'invention, la surface sensiblement plane du support S est
recouverte d'un film de séparation qui remplit trois fonctions
il prévïent une fusion des gouttes aqueuses non désirée,
- il empêche l'évaporation des gouttes aqueuses déposées sur le
support,
- il permet le passage des gaz, notamment OZ et CO2, ces deux
dernières fonctions étant destinées à permettre la survie des cellules dans
leurs
gouttes.
Le film F peut être de différentes natures
to - il peut s'agir d'un liquide non miscible avec l'eau comme par
exemple une huile. Jusqu'à ce jour, on savait utiliser l'huile pour conserver
certaines
cellules, toutefois, elle n'avait jamais été utilisée pour effectuer des
réactions sur des
cellules. Parmi les huiles utilisables dans le procédé et le dispositif selon
l'invention,
on peut citer notamment les huiles minérales et les huiles de silicone. On
peut
également utiliser comme liquide L un solvant organique non miscible avec les
composés à traiter (cellules et réactifs), tel que par exemple l'octane. De
préférence on
utilise une huile minérale légère.
- il peut également s'agir d'un gaz comme de l'air saturé en
humidité,
- il peut ensuite s'agir d'un film souple, solide, tel qu'un film en
PDMS ou polydiméthyl siloxane ou un film en nitrocellulose,
- il peut enfin s'agir d'un capot rigide alvéolé en matériau poreux, la
taille des alvéoles étant adaptée pour pouvoir contenir là goutte de cellules)
et
éventuellement de réactif. Selon une variante de l'invention, le capot rigide
alvéolé
peut être fonctionnalisé, dans chaque alvéole, par une molécule de réactif et
constituer
ainsi une puce à molécule ou une puce à nucléotide appelée à venir en contact
avec le
support sur lequel des gouttes de cellules ont été déposées de façon
symétrique par
rapport aux alvéoles. Cette variante de l'invention est illustrée par la
figure 7.
Lorsque le film de séparation est un gaz ou un liquide, de façon
3o avantageuse, le dépôt des gouttes aqueuses contenant une ou plusieurs
cellules ou un
réactif sur le support S et sous le film de séparation se fait au moyen de
fins
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
9
capillaires, comme illustré sur la figure I. De préférence, ces capillaires
sont reliés à
une pompe ou pousse-seringue permettant de contrôler le volume des gouttes.
Les réactifs ou les cellules peuvent être également dispensés par un
système classique comme ceux utilisés pour la fabrication des puces à ADN. On
peut
citer par exemple les systèmes piézoélectriques permettant de comprimer une
cavité et
d'éjecter une goutte par une buse. On peut se reporter à ce sujet à N. Takada
et girl.,
Proceeding of the SID, vol. 2711, 1986, 31-35.
Préférentiellement, les gouttes éjectées passent à travers le film de
liquide ou de gaz grâce à leur vitesse d'éjection et/ou par gravité, ce
liquide ou ce gaz
lo étant plus léger que la solution à déposer. Lorsque le film de séparation
est un film
solide ou un capot rigide, celui-ci est déposé sur le support, après dépôt des
gouttes
aqueuses de cellules et éventuellement de réactifs par les mêmes moyens que
décrit ci-
dessus.
Le déplacement et la fusion des gouttes peuvent être obtenus par
vibration au sein du support, par déplacement électrophorétique ou
électromagnétique
des gouttes chargées électriquement ou par des pinces mécaniques ou optiques.
Il peut
également être obtenu par une modification des propriétés de surface du
support
provoquées par l'application d'un champ électrique, magnétique ou m traitement
thermique ou optique.
2o Préférentiellement, le support S du dispositif est mobile, de façon à
permettre son déplacement d'un premier moyen de dépôt à Lui second moyen de
dépôt,
et êventuellement à d'autres moyens de dépôt. Le support S peut dans certains
cas être
constitué d'un film solide fixé à des rouleaux à ses deux extrémitës, les
rouleaux étant
munis de moyens de bobinage de façon à permettre le déplacement du film et
donc le
déplacement des gouttes qui ont été déposées dessus.
Généralement, le procédé selon l'invention prévoit le déplacement
du support S après le dépôt sur le support S de la première série de gouttes,
qu'il
s'agisse des gouttes de cellules ou des gouttes de réactif.
Selon l'invention le support S est placé dans une enceinte à
3o atmosphére contrôlée dont la température, l'hygrométrie et la teneur en COZ
sont
ajustées de façon à permettre la survie des cellules.
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
De tels dispositifs sont notamment des étuves à atmosphère
contrôlée. La température dans un tel dispositif peut varier de 3~ à
42°C, une
tempërature préférée se situant entre 36,5 et 37,5°C. La variation de
température peut
notamment être utilisée pour induire des différentiations cellulaires.
5 Le taux de C02 est préférentiellement maintenu entre 3 et 5%. Le
faux d'oxygène 02 est préférentiellement celui de l'air ambiant.
Par exemple, on peut prévoir de maintenir les cellules dans des
gouttes aqueuses sur le support S dans une étuve à 37°C, avec 95%
d'air, 5% de COZ
et 97% d'humidité.
10 On peut prévoir que la totalité du dispositif réactionnel : support,
film de séparation, moyens de dépôt, moyens de détection, etc. soient placés
dans
l'enceinte à atmosphère contrôlée.
On peut également prévoir que seuls les supports sur lesquels ont été
déposées les gouttes de cellules et le film de séparation soient placés dans
une
enceinte à atmosphère contrôlée.
De façon avantageuse, on peut prëvoir que les gouttes aqueuses
contenant une ou plusieurs cellules, un tissu cellulaire ou un réseau
cellulaire,
comportent un milieu de culture.
En effet, l'établissement de cultures de cellules dépend de l'aptitude
des cellules à maintenir leur prolifération et donc des conditions
indispensables à leur
croissance.
Avantageusement, on prévoit que les gouttes aqueuses de cellules
comprennent du MEM ou « minimal essential medium » commercialisé par la
société
GIBCO BRL sous la référence Cat. No. 12000-022.
Le milieu de culture peut également contenir d' autres constituants
tels que du sérum de veau, un ou plusieurs antibiotiques destinés à contrôler
la stérilité
du milieu, comme par exemple de la pénicilline.
On peut également prévoir d'utiliser dans le milieu de culture des
agents chimiques qui induisent la différentiation des cellules, comme par
exemple la
3o bromodéoxyuridine.
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
11
On peut également prévoir que les gouttes aqueuses dans lesquelles
les cellules C sont en culture soient gélifiées, à l'aide de tout agent
gélifiant connu,
comme par exemple de l' agar ou de la gélatine.
De façon avantageuse, les gouttes aqueuses contenant la ou les
cellules ou le tissu cellulaire ou le réseau de cellules, et/ou les gouttes
aqueuses
contenant le réactif, comportent un ou plusieurs constituants destinés à
favoriser la
transfection, comme par exemple des liposomes. De tels agents de transfection
sont
décrits notamment dans les documents WO 01/20015 et WO 98/33932.
D'autres moyens destinés à favoriser la transfection peuvent
io également être employés dans le dispositif de l'invention, tels que :
l'électroporation
ou la microprécipitation. Cas méthodes de transfection, bien connues de
l'homme du
métier, sont décrites notamment sur
http://opbs.okstate.eduhmelcher/MG/MGW4/MG43.html.
Selon l'invention, on peut en outre prévoir que le dispositif
comporte
- des moyens permettant d'apporter de l'énergie à une ou plusieurs
gouttes déposées siu le support ;
- des moyens de traitement optique d'une ou plusieurs gouttes
déposées sur le support ;
- des moyens d'application d'un champ magnétique ou d'un champ
électrique à une ou plusieurs gouttes déposées sur le support, notamment pour
permettre l'électroporation ;
- des moyens de détection focalisés sur une ou plusieurs gouttes
déposées sur le support.
Les moyens utilisés dans les disposïtifs selon l'invention seront
préférentiellement reliés à un dispositif de contrôle permettant
l'automatisation du
dispositif et du procédë salon l'invention.
Parmi les moyens d'apport d'énergie, on peut citer en particulier des
moyens de traitement thermique, qui peuvent consister par exemple en un
dispositif
3o chauffant susceptible d'être placé à proximité du support S ou fixé à ce
support et
destiné à porter les gouttelettes à une température appropriée. Par exemple,
le moyen
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
12
de chauffage peut consister en des fils conducteurs de l'électricité servant
également
de moyen de réception des gouttes.
Les moyens de détection sont notamment des dispositifs destinés à
mesurer la fluorescence ou la radioactivité d'une ou plusieurs gouttes ou des
cellules
contenues dans une ou plusieurs gouttes.
Les moyens de traitement optique sont notamment des moyens de
traitement aux rayons ultra-violets, ces derniers étant connus pour induire
une
réticulation entre des brins complémentaires d'ADN et entre ADN et protéines.
L'utilisation du dispositif etlou du procédé selon l'invention présente
1 o de nombreux avantages : on peut utiliser de très petites quantités de
matériaux : une
seule cellule par goutte permet de réaliser une expérience de transfection. On
peut
travailler avec des volumes de gouttes très petits, inférieurs à 1 micro
litre, de
préférence de 0,1 à 1000 nanolitres contenant 1 à 500 cellules, encore plus
préférentiellement de 0,1 à 10 nanolitres contenant 1 à 10 cellules.
Avantageusement,
on travaille sur des gouttes contenant de 1 à 100 cellules. On peut êgalement
prévoir
de travailler sur des volumes plus importants, notamment supérieurs au
microlitre (10
à 100p1, contenant 500 à 100 000 cellules). Ce procédé permet également
d'utiliser de
petites quantités de réactif. Le f lm de séparation F permet de contrôler les
échanges
gazeux du milieu de culture de la cellule et sa stérilité. Il permet aussi de
séparer des
gouttes dont on ne souhaite pas qu'elles réagissent ensemble. Enfin, ce
procédé permet
d'améliorer l'efficacité de la transfection : chaque cellule engagée dans le
procédé peut
être transfectée. Les cultures de cellules sous forme de gouttes sous le film
de
séparation peuvent se conserver au moins 24 heures et jusqu'à plusieurs jours
sans que
l'on observe de modifications notables de leur activité cellulaire (sans
influence
notable sttr la prolifération et la croissance des cellules).
Le procédé et le dispositif selon l'invention permettent également de
réaliser des batteries de réactions
Plusieurs gouttes aqueuses comprenant chacune au moins une
cellule peuvent être déposées sur le support S, lesdites gouttes étant isolées
les unes
des autres. De préférence, chacune de ces gouttes est placée dans un moyen de
réception distinct. Toutes les cellules peuvent être identiques, mais on peut
également
prévoir de placer des cellules différentes (au moins deux sortes de cellules
différentes)
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
13
dans les différentes gouttes. Des gouttes contenant le ou les réactifs sont
dêposées, à
proximité de chaque goutte contenant une cellule, de façon à permettre la
fusion d'une
goutte contenant le réactif approprié avec la goutte contenant la cellule
visée. Potu la
réalisation de batteries de réactions, on prévoit avantageusement un support
comprenant des moyens de réception disposés de façon régulière sous forme de
matrices, de façon à permettre l'automatisation du procédé.
De façon avantageuse, le support et les capillaires destinés à déposer
les gouttes aqueuses de cellules et de réactifs sont reliés à des moyens de
contrôle de
façon à permettre l'automatisation du procédé.
l0 Le procédé et le dispositif selon l'invention permettent donc de
réaliser simultanément et de façon automatisée un grand nombre de réactions
d'un
réactif sur une cellule en faisant varier la nature du réactif et de la
cellule, tout en
travaillant sur des volumes extrêmement réduits.
Parmi les cellules qu'il peut être intéressant d'étudier par ce procédé,
on peut citer notamment
- des cellules primaires,
- des hybridomes,
- des lignées de cellules : les cellules peuvent se perpétuer
éternellement et former ainsi des lignées,
- des cellules souches : elles sont obtenues à partir d'un prélèvement
chez l'animal ou à partir de biopsies,
- un morceau de tissu cellulaire (les cellules ne sont pas
individualisées)
- des mélanges des différents types de cellules énoncés ci-dessus.
Les cellules sont cultivées en milieu de culture (aqueux) de façon
connue. On peut également cultiver des cellules hétérogènes pendant plusieurs
jours et
utiliser ce mélange.
Selon une variante de l'invention, lorsque toutes les cellules à mettre
en réaction sur un même support sont identiques on peut procëder de la façon
3o suivante : le support est une plaque hydrophobe comportant des zones
hydrophiles, on
l'immerge dans une solution aqueuse contenant les cellules puis on la sort de
cette
solution en laissant le liquide en excès s'écouler. Les gouttes du milieu
contenant les
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
l4
cellules sont retenues dans les zones hydrophiles. Cette étape est suivie du
dépôt d'une
couche de film de séparation F et du dépôt des gouttes contenant un réactif ou
d'autres
cellules. Suivant la nature du film F (fluide ou solide), celui-ci est déposé
avant ou
après le dépôt des gouttes de réactif ou d'autres cellules.
Parmi les réactifs R susceptibles d'être utilisés dans le procédé et le
dispositif selon l'invention, on peut citer
Des molécules chimiques de toutes natures, notamment des
molécules organiques naturelles, des molécules issues de synthèse organique et
de
synthëse combinatoire, des molécules extraites d'échantillons biologiques et
des
i o molécules extraites d'échantillons biologiques modifiées par synthèse. On
peut citer
notamment les polynucléotides : les molécules d'ARN, simple brin et double
brin,
notamment les molécules d'ARNsi (petit ARN pour l'interférence) ; les
molécules
d'ADN, simple brin et double brin ; les molécules de PNA (de l'anglais «
peptidic
nucleic acid » ou acide nucléique peptidique) qui sont des chimères peptide-
acide
nucléique ; les ribozymes ; les ARN interférences double brin ou les protéines
et les
peptides. Parmi les protéines, on peut citer tout particulièrement les
facteurs de
transcription.
Les molécules de réactif peuvent être formulées en solution prête à
être déposée. Elles peuvent également être préparëes directement après dépôt
sur Ie
2o support, par exemple par synthèse, notamment par synthése organique, in
.rlt2l, ou par
transcription in vitro dans la goutte. Des molécules de type prion peuvent
aussi être
obtenues en goutte par réaction de polymërisation en chaîne ou PCR (de
l'anglais
"polymerisation chain reaction") peptidique avant leur transfection dans les
cellules.
Lorsque l'on utilise des molécules d'acides nucléiques, leur préparation peut
être faite
par PCR nucléique. Comme i1 a déjà été exposë ci-dessus, le réactif peut
également
être fixé au support.
Lorsque l'on emploie comme réactif de l'ADN, avantageusement
celui-ci est sous forme précipitée. De façon connue, on peut par exemple
utiliser le
phosphate de calcium. La précipitation de l'ADN peut également être faite dans
Ia
goutte aqueuse déposée sur le support par ftision avec une goutte du réactif
approprié.
Selon Lme variante du dispositif et du procédé selon l'invention, on
peut prévoir de faire plusieurs dépôts successifs destinés à être fusionnés
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
On peut prévoir de déposer successivement plusieurs réactifs
destinés à transfecter une même cellule et observer leurs effets cumulés ;
On peut également prévoir de déposer plusieurs gouttes de cellules
et les faire fusionner, de façon à reconstituer un réseau cellulaire de
cellules identiques
J OLl différentes afm de se rapprocher au plus près de conditions rencontrées
in vivo. Par
exemple, on peut reconstituer des réseaux de neurones à l'échelle de quelques
cellules
par la rencôntre de cellules gliales et de neurones pour les faire communiquer
au sein
d'une même goutte, ou des interactions entre les différents types de cellules
qu l
constituent la peau afin de mimer le comportement de celle-ci à l'échelle
cellulaire.
1 o On. peut également reconstituer un tissu cellulaire destiné à mimer le
comportement de l'épiderme en cultivant ensemble au sein d'une même goutte des
kératinocytes sur un tapis de collagène. On peut également cultiver ensemble
des
cellules souches de la peau en présence de cellules du follicule pilleur afin
d' étudier
leurs interactions.
15 Par exemple, on peut utiliser la transfection de rëactifs dans un
premier type de cellules de façon à déclencher une réaction cellulaire, telle
que la
production d'une protéine recombinante puis faire réagir cette première
population
cellulaire avec une population cellulaire d'un autre type par fusion avec une
autre
goutte.
2o Selon une variante de l'invention illustrée par la figure 8, on peut
également prévoir que Ie support soit muni de moyens de séparation permettant
de
sëparer deux types de cellules distincts mais autorisant le passage de petites
molécules
entre ces cellules. Un tel moyen de séparation est destiné à mimer une
barrière
biologique, telle que par exemple la barrière existant entre le sang et les
cellules
?5 cervicales. De tels moyens de séparation sont avantageusement disposés au
niveau des
moyens de réception, sur le support. Pour leur mise en ouvre, on prévoit de
déposer
une goutte aqueuse comprenant au moins une cellule d'un premier type d'un coté
du
moyen de séparation et une goutte aqueuse comprenant au moins une cellule d'un
second type de l'autre côté du moyen de séparation. La fusion des gouttes de
part et
3o d'autre du moyen de séparation permet une communication entre les cellules
par
l'intermédiaire de molécules susceptibles de diffuser au travers du moyen de
séparation. Cette communication peut alors être étudiée par tous moyens,
notamment
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
16
par l'ajout de réactifs sous forme de goutte aqueuse avant ou après Ia fusion
des
gouttes cellulaires. Par la transfection automatisée de ces gouttes, il est
possible
d'analyser le rôle biologique des facteurs transfectés dans une multicouche
biologique.
Les moyens de séparation utilisables selon cette variante de
l'invention sont des membranes artificielles telles que par exemple m filtre
en nitro-
cellulose, du silicium percé de nano-trous, un buvard en papier, un filtre en
tissu ; on
peut ëgalement prévoir d'utiliser un gel solide tel qu'un gel d'agarose, du
collagène ou
de la gélatine.
Le dispositif et le procédé selon l'ïnvention permettent d'automatiser
l'expression de protéines recombinantes obtenues par l'entrée d'ADN codant
dans les
cellules, de réaliser le criblage de molécules nucléiques destinées à modifier
(bloquer
ou au contraire augmenter) l'expression de gènes dans les cellules et de
rechercher des
séquences génomiques promotrices. Cette invention permet aussi d'étudier les
interactions entre des cellules de différents types, cette interaction étant
déclenchée
par le mélange des gouttes. Le dispositif et le procédé selon l'invention
permettent
d'obtenir une vue globale des effets biologiques de la réaction de molécules
de toutes
sortes avec des cellules, et notamment de l'entrée automatisée de molécules de
toutes
sortes dans des cellules.
Avantageusement, la détection globale des phénotypes cellulaires
engendrés par l'entrée des molécules dans les cellules sera réalisée à l'aide
de
molécules marquées, c'est-à-dire de molécules qui peuvent être détectées sans
porter
atteinte à l'intégrité du milieu qui les contient. On pense notamment aux
marqueurs
fluorescents, radioactifs ou à tout autre moyen de marquage connu de l'homme
du
métier.
L'un des avantages du procédé et du dispositif selon l'invention
réside dans le fait que la totalité des étapes de transfection et de
manipulation des
interactions cellulaires se fait en phase liquide qui favorise la culture
cellulaire en
milieu nutritif et les réactions enzymatiques.
De façon générale, le procédé et le dispositif selon l'invention
présentent les avantages suivants
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
17
- amélioration de l'efficacité de la transfection, par rapport à Ia
transfection faite de façon classique en puïts de culture ;
- plusieurs types cellulaires peuvent être testés sur un même support
au cours d'une même séquence de réactions ;
- plusieurs types de molécules peuvent être testées sur un même
support au cours d'une même séquence de réactions ;
- les réactifs peuvent être obtenus directement dans Ia goutte avant
fusion ;
- tous les réactifs sont prëparés de façon indépendante et en parallèle
lo à la préparation des cultures de cellules.
Parmi les applications du dispositif et du procédé selon l'invention,
on peut citer notamment la recherche de séquences à activité anti-sens : On
connaît,
par Dean et al., Carrent Opinion in Biotechnology, 12, 622 (2001),
l'utilïsation de
petites séquences d'ADN ou d'ARN pour bloquer la synthèse d'une protéine dans
les
cellules et chez (animal. Cette thérapie génique a ëté utilisée pour tester de
nouveaux
agents anti-viraux chez l'homme. Cependant, cette approche biotechnologique a
échoué maintes fois, l'utilisation d'un ou de plusieurs oligonucléotides ne
permettant
pas de bloquer l'expression d'une protéine. Lors de ces essais, en l'absence
de moyens
de criblage appropriés, les séquences des oligonucléotides utilisées étaient
choisies un
peu au hasard, parmi les séquences génomiques accessibles. Les
oligonucléotides
employés ne présentaient pas une affinité suffisante polir TARN cible et ne
perméttaient pas de bloquer sa traduction dans les cellules. Les molécules
d'ADN
synthétiques étant toxiques pour la cellule eucaryote, on cherche à en
utiliser des
quantités minimales. Pour bloquer l'expression d'un gène cible dans une
cellule, il faut
intervenir à quatre niveaux
- trouver la position de liaison optimale sir l'ARN, position qui
correspond généralement à une portion moins repliée dans la structure
quaternaire de
TARN ;
- trouver des séquences oligonucléotidiques présentant une haute
affinité pour l'ARN ;
- trouver des séquences oligonucléotidiques capables de pénétrer
dans une cellule eucaryote ;
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
18
- conserver les oligonucléotides non dégradés dans la cellule pendant
plusieurs jours.
Les deux premières étapes peuvent être réalisées à l'aide d'une puce
classique à oligonueléotides sur laquelle est testée l'hybridation d'une
famille
d'oligonucléotides à de l'ARN cible rendu fluorescent (on peut par exemple se
référer
aux travaux de Olejnik et al., NAR, 26, 3572 (1998)). Le procédé selon
l'invention va
permettre de tester la pénétration des oligonucléotides dans la cellule et
Leur stabilité.
Pour mettre en évidence la séquence optimale permettant de réduire
l'expression d'une protéine cible dans une cellule, on utilisera des
oligonucléotides
t0 modifiés, tels que par exemple des dérivés phosphorothioate, cette
modification
conférant à l'oligonucléotide concerné une résistance aux nucléases de
plusieurs jours.
Les molécules anti-sens peuvent aussi être constituées par des
duplexes d'ARN, appelées ARN interférences (ARNi), qui s'hybrident aux ARN
messagers en formant des triples hélices d'ARN (pour cette approche, on peut
se
référer à Elbashir et al., NatL~re, 411, 494-498 (2001)). Le procédé et le
dispositif
selon l'invention permettent également de cribler des séquences d'ARNi longues
(plasmidiques) et courtes (synthétiques).
Une autre application du procédé et du dispositif selon l'invention
concerne la production automatisée de protêines recombinantes en gouttes. La
2o transfection automatique devrait permettre de tester l'expression de
différents
fragments d'ADN codant ainsi que celle de différents mutants de ce même ADN.
L'expression automatisée de protëines recombinantes sur les dispositifs selon
l'invention peut être une alternative à la puce à protéines. Il n'est alors
plus nécessaire
de produire les protéines, de les purifier et de les accrocher sur un suppoxt
solide, les
protéines sont fabriquées de novo sur le dispositif.
Une autre application du procédé et du dispositif de l'invention est la
préparation et le criblage d'ARNsi. Les RNAsi ('RNA small interference' ou
petit
ARN pour l'interférence) sont des molécules double brin d'ARN capables de
bloquer
spécifiquement et efficacement l'expression de gènes dans des cellules en
culture et
3o chez l'animal. Les RNAsi ont été élues 'molécules de l'année 2002' par Ie
magasine
Science : ces molécules pourraient permettre en particulier des thérapies
innovantes en
cancérologie et en virologie. Elles ont aussi déjà permis de caractëriser la
fonction de
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
19
gènes jusqu'alors inconnue (T.Tuschl, Nature Biotechnoloay, voL20, May 2002,
p.446-448)
Pour fabriquer ces RNAsi, quatre voies ont été répertoriées. La
première utilise la chimie, les deux brins de l'ARNsi sont fabriqués chacun
dans un
synthétiseur d'acides nucléiques puis sont associés après synthèse (molécule
synthétique fabriquée à partir de phosphoramidite ARN décrit dans :
S.M.Elbaschir et
al., Nature, 4I1, 24 May 2001, 494-498). La deuxième utilise in vitro une ARN
polymérase, chaque brin de l'ARNsi est fabriqué de façon complémentaire par
rapport
à un brin d'ADN puis Ies deux brins sont associés après synthèse (exemple :
kit
1 o commercial pSilencer commercialisé par la société Ambion et kit commercial
HiScrib commercialisé par Ia société NEB Biolabs). La troisième utilise la
synthèse in
vivo dans les cellules eucaryotes ou dans les bactëries, les deux brins sont
fabriqués en
utilisant les RNA polymérases présentes in vivo. La quatrième utilise des ARN
longs,
simples ou double brins, (produits i~ vitYO ou i~c vivo) qui seront
transformés en petites
molécules (FNAsi) par les nucléases des cellules transfectées (R.Agami,
Carrent
Opinion in Chemical Biology, 2002, 6, 829-834).
Dans la présente invention c'est la deuxième voie qui peut être
appliquée, celle qui s' attache à fabriquer des RNAsi à partir de molécules
d'ADN
contenues dans un tube. On utilise cette voie en particulier car elle est
moins onéreuse
2o que celle qui consiste à fabriquer les RNAsi chimiquement. Il a aussi été
rapportë que
Ia structure des RNAsi synthétisés i~ vite°o est différente de celle
des RNAsi obtenus
chimiquement, elle permet d'obtenir une affinité plus importante dans le cas
de
l'hybridation des RNAsi obtenus in vitro avec les ARN cibles des cellules
transfectées. Ainsi le blocage de l'expression des gènes est meilleur avec des
RNAsi
obtenus in vitro qu'avec des RNAsi chimiques : meilleur e~cacité et besoin de
concentrations d'ARNsi moins élevées .
Cette variante de l'invention s'appuie sur un procédé de fabrication
des RNAsi sur un substrat solide. La présente invention propose de fabriquer
des
RNAsi en goutte à l'aide de deux matrices d'ADN contenant une séquence
promotrice
pour une ARN polymérase (de type SP6 ou T7 par exemple) et d'utiliser ce
formatage
en goutte pour transfecter, par fusion de gouttes, les molécules de RNAsi
double brin
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
dans des cellules cultivées en goutte sur un substrat solide. Les matrices
d'ADN
peuvent être fixées de façon covalente ou non covalente sur le substrat
solide.
Afin d'optimiser le blocage de l'expression d'un gène, il est
nécessaire de tester plusieurs séquence d'ARNsi le long du gène (au moins une
5 dizaine) et un intérêt considérable se toL~rne vers Ie criblage systématique
de plusieurs
gènes (par exemple plus de 5600 gènes bloqués chez le vers de terre : S.S.Lee
et al.;
Nature Genetics, 33, January 2003, 40-48).
Certaines qualités de séquences des RNAsi ont déjà été proposées
concernant le pourcentage de nucléotides GC par exemple, ou le Tm de
lo l'oligonucléotide correspondant, ou encore la taille de la molécules
(2lmer).
Cependant rien ne remplace l'expérience, le criblage est nécessaire, non
seulement
pour trouver la séquence optimale pour bloquer l'expression d'un gène mais
aussi
pour déterminer sa concentration ainsi son temps d'action dans la culture
cellulaire.
Pour réaliser ces différents criblages phénotypiques, il est possible
15 d'utiliser des puits de plastiques (format 96 trous ou 384), cependant nous
avons
montré que l'efficacité de transfection est meilleure dans des cultures de
cellules en
goutte (une concentration 5 fois plus faible de RNAsi a ëté utilisée pour
obtenir la
même efficacité de transfection et de blocage de l'expression d'un gène dans
des
cultures cellulaires en goutta plûtôt que dans des cultures cellulaires en
puits). De plus
20 l'analyse phénotypique du blocage de l'expression d'un gène est très
pertinente
lorsque les cellules ont été cultivées en goutte sur une lame de verre : les
cellules après
leur transfection sont fixées sur la lame de verre en petits tas distincts,
les niveaux
d'expression de gènes sont révélés par immunocytochimie fluorescente et
analysés
directement par scanner (détection directe du nombre de photons émis par Ies
cellules
marquées par les anticorps).
Applications potentielles
~ Caractérisation de Ia fonction de gènes (en particulier dans le
cas de gènes 'inaccessibles' par KO de souris transgéniques, les souris KO
meurent
avant la naissance)
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
21
~ Caractérisation de la fonction de plusieurs gènes dans plusieurs
types de cellules : criblage à haut débit nécessaire. C'est le cas de
l'analyse in vivo de
délétion génique.
~ Cancérologie : analyse du rôle de gènes dans l'angiogénèse
ainsi que dms la propagation de certains cancers. De plus, bloquer les gènes
indispensables à Ia réparation cellulaire, va permettre de rendre certaines
cellules
chimio-sensibles. La chimio-sensibilité peut être analysée sur puce.
~ Virologie. La propagation du virus VIH a été bloquée in vivo
grâce à l'utilisation de RNAsi (N.S.Lee et al., Nature biotechnology, vo1.19,
May
2002, 500-505)
EXEMPLES
Matériel et méthodes employés dans les exemples
Dëtection
La détection de la transfection par une molécule fluorescente se fait
en deux temps
- par une vue globale des points fluorescents,
- par analyse des points individuels pour créer une image
complexe.
La vue globale de la fluorescence se fait par détection bi-
paramétrique
- de la fluorescence de l'iodure de propidium = témoin de la
présence d'une cellule,
- de la fluorescence de la 'green fluorescent protein' GFP =
marqueur fluorescent vert témoin de l'expression de la protëine GFP.
L'image obtenue est ensuite analysée grâce à des systèmes de
quantification du signal et qui permettent de combiner Ies fluorescences de
séries de
points de mesures.
- analyse de la fluorescence des gouttes : les cellules peuvent être
analysées vivantes en gouttes sous la couche d'huile. Pour ces expériences,
nous
3o avons utilisé un microscope ~lympus O BX S 1 M et un microscope confocal
Leica ~.
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
22
- analyse de la fluorescence des cellules fixées : après fixation des
cellules par le PFA ou paraformaldéhyde (voir application ri 1) la lame de
verre
contenant les cellules recombinantes est utilisée comme une lame d'histologie.
Il est
possible de réaliser des expériences de marquage radioactif et de marquage
flûorescent. (voir application ri 5.2). La fluorescence totale de la Iame peut
être
analysée à l'aide d'un microscope classique. Nous avons aussi utilisé un
scanneur
classiquement utilisé dans des expériences de puce à ADN (Scanner : GenePix
4000B,
commercialisé par la société Axon Instrument). La précision dans ce genre
d'appareil
est de S pm, il est donc possible de visualiser une cellule à l'aide d'une
dizaine de
1o pixels.
La figure 4 illustre un exemple d'application du dispositif selon
l'invention : l'expression d'une protéine recombinante dans une suspension de
cellules
gliales et de l'activation d'une suspension de neurones.
Sur une lame de verre (support S) dans un récipient contenant une
huile minérale légère (film F) commercialisée par le Société Sigma, on injecte
- une goutte de cellules en suspension contenant en milieu aqueu.Y
(quelques nanolitres) une centaine de cellules gliales ;
- une goutte aqueuse contenant de l'ADN sous forme de sel de
phosphate de calcium (quelques picomoles) ;
- une goutte de cellules neuronales en suspension dans l'eau.
On fait d'abord fusionner les deux premières gouttes par
déplacement mécanique des 2 gouttes à l'aide de l'extrémité d'une pipette pour
obtenir la goutte G~ de cellules transfectées. La cellule gliale exprime ainsi
une
protéine recombinante. On fait alors fusionner cette goutte G1 avec la goutte
G?
contenant les neurones en suspension. Ceux-ci sont alors activés.
T. Transfection d'oli~onucléotides, criblage de séguences
capables de bloguer l'expression de gènes spécifiaues
Dans cet exemple, nous avons cherché à sélectionner des séquences
d'oligonucléotides capables de bloquer l'expression d'tin gène d'intérêt,
appelé cible
dans cet exemple. Pour mesurer l'activité antisens de ces oligonucléotides
nous avons
utilisé des lignées cellulaires stables exprimant la protéine cible en fusion
avec le
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
23
variant E-GFP (Green Fluorescent Protein de type E, con unercialisée par la
Société
Clontech). Ces lignées sont des outils précieux pour évaluer les performances
des
différents oligonucléotides : l'activité antisens est mesurée par diminution
de la
fluorescence des protéines reportrices. Afin de trouver un oligonucléotide qui
a une
activité antisens exceptionnelle, il est indispensable de réaliser le criblage
d'au moins
50 oligonucléotides de séquences différentes pour un même gène. Au cours de ce
criblage dans les .cellules,.nous avons recherché en particulier
l'oligonucléotide qui a
la plus grande affinité pour l'ARN cible et le plus grand pouvoir de
pénétrance dans la
cellule.
Expériences réalisées avec le dispositifselon l'invention
La transfection par le phosphate de calcium a été choisie car elle est
trës efficace : en utilisant des oligonucléotides marqués avec du cy5 (Cyanine
5), ces
oligonucléotides étant commercialisés par la Société Eurogentec, 70% de
cellules
HEK 293 (Human Embryonic Kïdney) et 80% de cellules COS (Chinese Ovary
Sarcoma) deviennent fluorescentes après un jour de culture (fluorescence
mesurée par
cytométrie de flux). D'autres méthodes de transfection faisant intervenir la
formation
de gouttelettes de lipide autour de l'ADN peuvent aussi être utilisées.
Expérience 1 a : transfection par fusion de gouttes
Pour un gène cible, nous choisissons 50 oligonucléotides de
séquences différentes. Nous nous sommes intéressés au blocage de l'expression
de la
sous unité bêta 2 de la caséine kinase. Les oligonucléotides sont synthétisés
sous
forme de résidus de 18 à 21 nucléotides de Long, et contiennent des liaisons
phosphorothioate capables de limiter leur dégradation par les nucléases.
Chacun de
ces oligonuclëotides est précipité sous forme de phosphate de calcium
(réaction
classique : 1~.1 d'oligonucléotide resuspendu dans l'eau à 1 mM est mëlangé à
100 p.l
de chlonire de calcium 0.25 M et à 100 ~l de tampon HBS (Chen et Okayama,
Biotechniques 1988, 6, 632-638). Pour réaliser la transfection dans une boite
de
plastique contenant 1 ml d'huile minérale, une goutte de 1 ~,l de chacun de
ces 50
précipités est fusionnée avec une goutte de 10 ~1 de cellules dans leur milieu
de
culture (DMEM commercialisée par la Société Gibco) (environ 5000 cellules
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
24
fibroblaste 3T3). Les gouttes sont placées au fond de la boite sur le support
plastique
sous l'huile.
L'activité antisens est mesurée après 2 jours de culture par
diminution de la fluorescence de la GFP exprimée en tandem avec la protéine
cible
dont on cherche à bloquer l'expression. La fluorescence des 50 gouttes est
observée
simultanément au microscope. Cette expérience est réalisée plusieurs fois en
parallèle
afin de s'assurer de la pertinence des résultats. Il est important de faire
ces 50 tests en
parallèle afin de comparer l'activité antisens de chacun des oligonucléotides.
Pour
observer la diminution de la fluorescence de la protéine cible, il est
possible soit
lo d'observer les cellules transfectées vivantes au microscope, soit de fixer
les cellules au
paraformaldéhyde (classiquement 4% de PFA). Pour la fixation des cellules, le
paraformaldéhyde est ajouté à volume égal à la goutte cellulaire pendant 10
minutes
puis l'ensemble gouttes + huile est rincée au PBS deux fois.
Expérience lb : photoclivage des oligonucléotides de la puce
cellulaire et transfection
Cette expérience est illustrée par la figure 3.
Nous avons utilisé une puce classique à ADN, la transfection est
obtenue après décrochage des olïgonucléotides du support solide. Les cellules
sont
cultivées à proximité des dépôts d'oligonucléotides sur la lame de verre.
2o Les oligonucléotides (commercialisés par la société Eurogentec)
sont accrochés par leur extrémité 5' aminée sur une lame silanisée (par
exemple une
lame Surmodics commercialisée par la société Motorola). L'ADN des dépôts est
complexé aux sels de phosphate de calcium (selon le même principe de
précipitation
de l'ADN que celui décrit dans l'application la) et gardé htunide sur la lame.
Les
cellules adhérentes 3T3 sont ensuite déposées en goutte à la surface des spots
d'oligonucléotides, l'ensemble est gardé sous 1 ml d'huile minérale pendant un
jour
en incubateur cellulaire : les gouttes peuvent être formées à la surface des
dépôts
d'ADN ou bien formées à l'aide d'une surface composite (hydrophile et
hydrophobe,
lame ProLabo décrite dans l'application ri 5). Le décrochage des
oligonucléotides,
3o complexés au calcium phosphate et situés sous les cultures cellulaires en
goutte, est
obtenu comme illustré sur la figure 5 par illumination de la lame par des UV à
365 nm
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
qui permettent de couper la liaison photoclivable introduite en 5' des
oligonucléotides
(en 3' du site aminé).
exemple d'oligonucléotide accroché, puis décroché par
photoclivage, puis finalement transfectë dans des cellules HEK 293 adj acentes
5 Nom Séquence Composition Modification
huGAPDH203F SEQ ID NO:1 20mers + site PC en 5'
P cy5 PC + site -
AACGACCACTTTGTCAAGCTCy5 + amine Cy5 en 3'
en 5' (dT)~
II- Transfectian d'ADN codant et expression de protéines
recombinantes
Dans cet exemple, nous nous sommes intéressés à l'expression
lo d'une famille de protéines dans les cellules eucaryotes. Pour l'instant, en
biologie
moléculaire, l'expression de protéines recombinantes est obtenue puits par
puits, par
transfection d'un ADN codant sur un tapis cellulaire. Par la transfection
parallélisée,
nous allons obtenir simultanément l'expression de plusieurs ADN codant pour
plusieurs protéines. Ce dispositif permet de tester plusieurs constructions
dans des
15 vecteurs d'expression d'un ou de plusieurs gènes.
Expériences réalisées avec le di~ositifselo~ l'invention
Application 2a : Expression de protéines recombinantes dans un type
de cellule.
Expression d'une famille d'ADN codant pour les kinésines
2o humaines à l'aide du dispositif selon l'invention
Les kinésines forment une famille de protéines présentant des
propriétés biochimiques similaires, ce sont des protéines motrices associées
aux
microtubules. Ces protéines se trouvent dans toutes les cellules eucaryotes.
Elles
permettent de transformer l'hydrolyse d'ATP en énergie mécanique et jouent un
rôle
25 fondamental dans Ie transport des organelles, des ARNm et des complexes
protéiques
le long des microtubules. Elles peuvent se déplacer du coté positif des microW
bules
(N-kinésines) ou du coté négatif (C-kinésines). Elles participent aussi aux
mouvements chromosomiques pendant la mitose et la méiose et jouent un rôle
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
2G
important lors de la division cellulaire. On peut notamment se reporier aux
publications suivantes
Ref l : Compton, D.A. (1999). New tools foi the mitotïc toolbox.
Science 286, 913-914. Miki, H., Setoy, M., Kaneshira, K., Hirokawa, N. (2001).
Pr~oc.
Natl. Acad. Sci. 98, 7004-7011.
Ref.2: fade, R.H., Kozielski, F. (2000). Structural links to
kinesin directionality and movernent. Nature Sty~uctural Biology 7, 456-460.
Ref.3: Kozielski, F., Svergun, D.L, Zaccai, G., ~Trade, R.H.,
Koch, M. (2001). The overall conformation of conventional kinesins studied by
small
1o angle x-f ay and neutron-scattering. J. Biol. Chem. 276, 1267-1275.
Avec le dispositif selon l'invention, nous avons obtenu l'expression
d'une vingtaine d'ADN codant pour ces kinésines en utilisant des plasmides
d'expression permettant d'exprimer en tandem la protéine d'intérêt et la GFP
(pcDNA3.I/CT-GFP-TOPO, commercialisé par la société InVitrogen). La
transfectïon
a été réalisée comme lors de l'application la : la fusion des gouttes est
obtenue sous
I ml d'huile, IO ng de plasmide précipité au phosphate de calcium est mis en
contact
avec une goutte de 10 p.l contenant environ 5000 cellules HEK 293 (human
embryonic
kidney). Après I jour de transfection, les gouttes de cellules HEK 293 sont
fluorescentes par expression de la protéine GFP dans les cellules. Il a été
possible
d'observer ces gouttes cellulaires sous huile au microscope confocal et de
localiser
précisément la compartimentation cellulaire pour chacune des kinésines
fluorescentes
exprimées dans ce dispositif.
application 2b : expression de protéines recombinantes dans un
dispositif selon l'invention en utilisant plusieurs types cellulaires.
Expression recombinante du facteur Pax6 par des cellules gliales
I O ng de plasmide contenant en tandem les gènes codant pour le facteur Pax6
et pour
la GFP (pcDNA3.l/CT-GFP-TOPO, commercialisé par la société InVitrogen)
précipité au phosphate de calcium (voir précipitation de l'ADN au phosphate de
calcium dans l'application la) est mis en contact avec une goutte de 10 pl
contenant
environ 5000 cellules gliales (cellules gliales radiales de cortex, post
natal, 2
divisions). Après 1 jour de culture, la goutte G1 de cellules gliales est
fusionnée à une
autre goutte G2 de 10 ~l contenant 5000 cellules corticales (culture primaire
corticale
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
27
isolée de cortex cérëbral post natal). Les cellules gliales recombinantes de
Gl
exprimant le facteur Pax6 sont par exemple capable d'induire la neurogenèse
des
cellules astrocytocales contenues dans G2.
Cette application est importante pour le criblage de nouveaux
médicaments à potentiel neurotrophique, par exemple dans la recherche de
composés
capables de régénérer des neurones dopaminergiques dans des cerveaux altérés
par la
maladie de Parkinson.
On peut par exemple se reporter à la publication suivante
ref. 4 : Heins et al., Glial tells gerterate >'teurorts: the yole of the
trartscriptioh factor Pax6, Natatre Neatroscience (2002) 5, 308 - 313
III- Transfection avec des virus ou des prions en milieu confiné
Le système selon l'invention peut être facilement confiné : la
formation des gouttes peut être réalisée mécaniquement sans intervention d'un
utilisateur, et ces dernières peuvent être conservées à l'abri des
contaminants par
maintien sous tme couche d'huile pendant plusieurs jours. La transfection de
virus
peut être obtenue de deux façons
- par fusion d'une goutte de cellules eucaryotes et d'une goutte de
virus
- par contamination de cellules par des échantillons cellulaires 'à
risque'
Dans les gouttes il est possible de produire le virus ou l'agent
pathogène (amplification et encapsulation) ou de le détecter (concentration
biologique
et réaction antigène-anticorps).
IV- Mise en évidence d'une séguence aénomiguepromotrice
Les ségueuces promotrices une~a3~tie du ~énona~eu corznZte
La technologie des gènes reporteurs et plus précisément des
constructions " région promotrice-activité reportrice " a été largement
utilisée pour la
caractérisation des régions régulatrices en amont des gènes. Les
microtechnologies
permettent aujourd'hui d'accroître considérablement le nombre de promoteurs
étudiés.
3o La régulation transcriptionnelle de ces régions peut être observée en temps
réel grâce
à l'utilisation d'un gène reporteur codant pour la GFP (Green Fluorescent
Protein). La
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
as
fluorescence de cette protéine peut être observée sans avoir à lyser les
cellules. Les
variations de fluorescence vont nous permettre d'étudier les cinétiques de la
régulation
transcriptionnelle d'un grand nombre de promoteurs en parallèle et en temps
réel.
Expëriences rëalisées avec le dispositifselon l'i~ve~tion
L'activité reportrice de gënes connus et induits par les radiations
ionisantes (par exemple, les gènes pS3, c-myc ) a été utilisée pour valider la
puce et le
modèle expérimental. Les séquences d'intérêt en amont des gènes P53 et c-myc
ont
été amplifiées puis clonées en amont du gène de la GFP dans le vecteur phrGFP
1 o (Genentech). La transfection a été réalisée comme lors de l'application 1
a : la fusion
des gouttes est obtenue sous huile, 10 ng de plasmide (phrGFP contenant les
sëquences d'ADN promotrices) précipité avec le phosphate de calcium est mis en
contact avec une goutte de 10 p,l contenant environ 5000 cellules de
kératinocytes
humains. Par sa localisation dans la peau, le kératinocyte représente un des
types
IS cellulaires les plus exposés aux irradiations in vivo. Après 1 jour de
transfection, les
gouttes des kêratinocytes sont fluorescentes par expression de la protéine GFP
dans
les cellules. La mesure de l'activité reportrice GFP est faite par lecture
globale de
fluorescence par microscopie couplée à mze caméra CCD (Charge Coupled Device).
V- Criblage de nouveaux médicaments.en gouttes
20 Remarque générale : dans l'industrie pharmaceutique, le criblage a
été réalisé pendant les dix dernières années sur des cibles protéiques
recombinantes.
Dans plusieurs exemples (tels que Ies rêcepteurs au glutamate) on s'est aperçu
que le
récepteur recombinant présent dans la membrane plasmique isolée n'était pas
tout à
fait dans sa conformation biologique, les rëcepteurs ont en particulier besoin
d'être co-
25 exprimés avec des protéines chaperones qui sont présentes dans les
synapses. On peut
par exemple se reporter â la publication suivante
Ref 5 : Ohnunaa et al . Gene exp~~ession of PSD95 in prefYOntal
cortex and hippocampus in schizophrenia.Neu~o~eport. (2000) ll (14): 3133-7.
Pour obtenir un résultat plus précis et plus proche du comportement
30 irz vivo, le criblage d'un ensemble de composés chimiques est désormais
envisagé sur
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
29
cellules vivantes. Dans ce cas le criblage se fait à l'aide d'un test
dynamique au cours
duquel les cellules sont maintenues en vie. Exemple de référence:
ref.6.~ Flzcorescent ïndicators for imaging p~otein
phosphorylation in single livïng tells, Sato et al, Nature Biotech (2002) 20,
28î-294).
Modèle d'étude : o-éalisation des .gouttes de cellLtles
Cette expérience est illustrée par Ia figure 6. Les cellules vivantes
sont déposées en gouttes homogènes sur w support solide. La réalisation de ce
dispositif cellulaire peut être facilité par l'utilisation d'une surface
composite
io (hydrophile et hydrophobe), lame de verre commercialisée par la société
ProLabo,
recouverte d'un film de téflon OO et contenant des puits circulaires
hydrophiles de 3
mm de diamètre. Un grand nombre de gouttes homogènes peut être réalisé par
simple
trempage du support dans une suspension cellulaire. Les gouttes sont ensuite
recouvertes d'une couche d'huile minérale pour éviter leur dessèchement et
favoriser
la survié cellulaire jusqu'au test de criblage. Les gouttes cellulaires
peuvent être
conservées sur ce type de support pendant plusieurs jours dans un incubateur
destiné à
la culture cellulaire. Pour cribler n-molécules différentes, n-gouttes de
composés à
tester sont déposées individuellement sur les gouttes cellulaires
préalablement
formées.
2o On peut également prévoir que des composés chimiques soient
greffés sur la surface du support (comme pour les oligonucléotides, dans
l'application
lb) puis décrochés ensemble (par exemple pax illumination ÜV). L'insertion
d'un site
photoclivable dans les molécules peut être obtenue par chimie combinatoire.
Un test simple de criblage dynamique (exemple : FRET
?5 fluorescence resonnance by electron transfer ou résonnante de fluorescence
par
transfert d'électrons) peut être utilisé pour mettre en évidence les
propriétés de
certains de ces composés.
S.l.Exemple de criblage : mesure de l'activité du récepteur
30 adrénergique
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
On peut se reporter à la publication suivante : ref. 7 : Ghanoacni et
al, Agonist induces conformational changes in the G protein coupling domain of
the
beta2 adrenergic receptor, PNAS (2001) 98, 11, 5997-6002.
Il est possible d'attacher une fluorescéine à l'une des cystéines
5 (cys265) du récepteur beta2 adrenergic pour rendre cette protéine
fluorescente
lorsqu'elle est insérée dans la membrane cellulaire. Pour tester les
propriétés
adrénergiques d'un nouveau médicament potentiel, nous mettons en contact sous
huile
une goutte de 100 nl contenant la molécule en solution et une gouïte de 1 ~.1
contenant
500 cellules recombinantes dans leur milieu de culture exprimant le récepteur
lo adrénergique recombinant et muté. L'induction de changement de conformation
du
récepteur par un agoniste est observée au microscope par une baisse de
l'intensité de
fluorescence de la fluorescéine contenue dans le récepteur adrénergique.
5 2 Exemple de criblage : immunocytochimie sur cellules
15 recombinantes
Après transfection, les cellules recombinantes peuvent être fixées sur
le support à l'aide de PFA (voir application ri 1). Dans le cas de
l'expression
recombinante de la sous unité bêta 2 de la caséine kinase avec le dispositif
selon
l'invention, nous avons utilisé un anticorps pour révéler l'expression de la
protéine
2o recombinante dans les cellules 3T3. (anticorps commercialisé par la société
Upstate
Biotechnology : Rabbit polyclonal anti-CI~2 beta antibody). On peut se
reporter à la
publication ref .8 : Alexandre E. Eseargueilet al., Mitotic Phosphorylation of
DNA
TopoisonZerase II by Protein Kinase CK2 Creates the MPM 2 Phosphoepitope on
Ser-
1=169, J. Biol. Chem. (2000), 275, Issue 44, 34710-347183.
VI- Variante de la puce à molécules
La figure 7 illustre cette variante : des gouttes de cellules dans un
milieu de culture sont déposées sous forme de matrice sur un support en
téflon. Un
capot en PDMS sur lequel sont greffées des molécules organiques d'une banque
de
3o criblage et comportant des alvéoles d'un volume sensiblement égal à celui
des gouttes
est posé sur le support. L'espacement des gouttes a été prévu pour une exacte
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
31
correspondance entre le support et le capot. Les molécules sont décrochées du
capot
par tout traitement approprié de façon à transfecter des cellules.
VII- Déplacement de gouttes dans un champ électrigue
Le déplacement de gouttes sur un support dont la tension de surface
varie avec l'application d'un champ électrique a été testée : sur le support
testé, de
nature hydrophobe à l'exception de plots hydrophiles, la tension de surface
diminue
avec l'intensité du champ, la surface devient moins hydrophobe, voir
hydrophile. Le
contrôle et le mouvement du champ électrique permettent de déplacez les
gouttes de
liquides sur cette surface. On a opéré le mouvement de gouttes de cellules
dans un
1o champ électrique de 1000V (une goutte de S~,L contenant une suspension
cellulaire de
cellule Hela à 106 cellules /ml, une goutte de 5~1 : bleu trypan dans du PBS
(1/5))
Le bleu trypan est un marqueur de viabilifié cellulaire. Cette réaction
de mélange de bleu trypan et de cellules a permis de vérifier que le champ
électrique
n'a pas W é les cellules car le % de cellules colorées ne dépassait pas 2%.
VIII- Transfection automatisée
La réalisation de transfections sur puces de cellules en goutte,
effectuées manuellement sur des lames commerciales, peut être transférée sur
un
automate de fabrication de micro batteries et permettre ainsi un mode
particulier de
transfection automatisée d'ADN. Pour cela, trois séries de dépôts successifs
de trois
gouttes sont réalisées sur la même puce, donc sur un même plot des lames
commerciales, les gouttes vont fusionner poux permettre le mélange des
réactifs et des
cellules.
Expérimentation
1. Préparation des échantillons:
On prépare une microplaque de 96 puits contenant les différents
échantillons à déposer : les solutions d'ADNs, le milieu de transfection, les
milieu x
cellulaires.
2. Dépôt des ADNs (olig_onucléotides simple brin produits de
PCR ou plasmides) à transfecter dans les cellules:
Le robot prélève dans la plaque de 96 puits 2 ~,L d'une solution
contenant un des ADNs et il dépose ensuite une goutte de 10 nL sur un des
plots de la
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
32
lame. Et ainsi de suite pour les différents ADNs. Nous avons donc déposé IOnL
d'oligonucléotide à la concentration IOnM (oligo: 5'SEQ ID NO:2
CGGAGGCGATGGTGTTGGA 3' - 20mer marqué en 5' par du CY3) et lOnL d'une
solution de plasmide codant pour la protéine GFP (pEGFP-Cl, Clonetech) à la
concentration de lmg/ml. La figure 9 est me photographie représentant la
plaque sur
laquelle ont été déposées les trois premières gouttes. ;
3. Dépôt de la solution de transfection sur les dots d'ADN à
transfecter
Pour cela, une goutte de 0.21 de 'siPORT' (Ambion), dilué au I/20
lo dans du PBS (protocole du fournisseur) est déposée sur chacun des plots et
mélangée
aux solutions d'ADN préalablement déposées.
4. Dépôt des cellules:
Nous avons déposé une goutte de 1 ~1 contenant 103 cellules HeLa
(concentration initiale de106 cellules /ml) sur chacun des plots contenant
déjà les
ADNs et le siPORT.
Après dépôt des cellules, les lames sont mises dans une boite de
Pétri contenant du PBS (pour éviter l'évaporation du milieu cellulaire). Elles
sont
ensuite transférées dans un incubateur à cellules (37°C, 5%C02) pendant
48 heures
pour permettre l'expression de la protéine EGFP.
2o Après cette étâpe de culture, les cellules sont fixées dans une
solution de paraformaldehyde (4% dans du PBS) pendant 20 minutes puis rincées
deux fois au PBS. Les lames sont ensuite montées dans du PBS, puis la
fluorescence
est observée au microscope.
L'observation des cellules au microscope Olympus BX52 montre
une fluorescence diffuse dans le cytoplasme pour la transfection avec l'oligo
Cy3. La
fluorescence est d'abord plus intense dans le noyau puis elle diffuse dans le
cytoplasme pour les cellules transfectées avec la GFP. Les témoins négatifs
(sans
cellule ou sans ADN) ne montrent pas de fluorescence.
CA 02492933 2005-O1-18
WO 2004/011938 PCT/FR2003/002298
263s84.ST25.txt
SEQUENCE LISTING
<110> COMMISSARIAT A L'ENERGIE ATOMIQUE
<120> PROCEDE ET DISPOSITIF POUR LE CRIBLAGE DE MOLECULES DANS DES CELLULES
<130> vCstsF263/84PCT
<160> 2
<170> Patentln version 3.1
<210> 1
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleotide
<400> 1
aacgaccact ttgtcaagct 20
<210> 2
<211> 19
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleotide
<400> Z
cggaggcgat ggtgttgga 19
1