Note: Descriptions are shown in the official language in which they were submitted.
CA 02492940 2005-O1-18
WO 2004/014928 PCT/FR2003/002330
NOUVEAUX COMPOSES GEM DIFLUORES, LEURS PROCEDES DE
PREPARATION ET LEURS APPLICATIONS
L'invention concerne un procédé pour la synthèse de composés gem difluorés.
Elle s'applique plus particulièrement, mais non exclusivement, à la
préparation de composés glycoconjugués et C-glycosides notamment pour la
fabrication de médicaments antitumoraux, antiviraux, hypoglycémiants, anti-
inflammatoires ou encore pour l'immunologie, la cosmétologie et la
préparation d'analogues glycopeptidiques de molécules antigel.
Ces dernières années, le nombre des recherches ayant trait aux molécules
organiques fluorées s'est considérablement accru. Cet enthousiasme
s'explique par la reconnaissance de l'impact du fluor dans l'activité
biologique
des molécules. En effet, les propriétés physiologiques des composës bioactifs
sont modifiées par l'introduction du fluor et les biochimistes sont demandeurs
de nouvelles méthodes d'introduction sélective du fluor.
Cependant, les principaux apports quant à des nouvelles molécules
biologiques importantes ont été faits essentiellement dans la monofluoration
et
la trifluoration.
L'introduction du groupe difluorométhylène CFZ a pourtant montré une réelle
importance dans des composés tels que la Gemcitabine~ (Gemzar, Lilly) et Ia
CA 02492940 2005-O1-18
-2
WO 2004/014928 PCT/FR2003/002330
Vinflunine~ (Pierre Fabre) qui sont actuellement en essai clinique comme
agents antitumoraux (Figure 1).
Cet intérêt pour la fluoration sélective de composés biologiques est lié à la
nature même de l'atome de fluor : son électronégativité (élément le plus
électronégatif), l' énergie de la liaison C-F (484 lcJ.mo1-1;
C-C : 348 kJ.mol-1).
Pour remplacer l'oxygène, le groupe difluorométhylène CF2 s'est révélé être
un candidat particuliérement attrayant
- D'une part, l'électronégativité de l'oxygène (3,5) est assez proche de
celle du groupe CF2 (3,3) ;
- D'autre part, lors des premières études menées en 1984 en remplaçant
l'oxygène d'un analogue de phosphate dans des structures de type
adénosine diphosphate (ADP), il a -été montré que le groupe CF2 était
un équivalent tétraédrique de l' oxygène par la disposition spatiale des
deux fluors, représentée sur la figure 2.
Par ailleurs, les électronégativités étant très voisines, les effets
électroniques
dus au remplacement sont minimisés.
Ainsi, des analogues de la phosphotyrosine et de la phosphosérine représentés
sur la figure 3 ont été récemment synthétisés.
Ces composés sont des inhibiteurs d' enzymes phosphatases qui interviennent
dans la transduction des signaux intracellulaires.
Par ailleurs, des synthèses d'analogues de composés glycoconjugués sont
étudiées avec attention. Ce sont des composés formés de la conjugaison entre
un sucre et un autre composé (aglycone) tel qu'un acide aminé (glycoprotéine,
glycopeptide), un lipide (glycolipide), un stéroïde ou un triterpène, un
alcaloïde, une cétone...
CA 02492940 2005-O1-18
-3
WO 2004/014928 PCT/FR2003/002330
En effet, ces derniers, avec entre autres les glycoprotéines et les
glycolipides
qui sont des constituants des membranes cellulaires, sont des composés
largement impliqués dans de nombreux processus biochimiques tels. que la
reconnaissance intercellulaire ou la régulation de croissance des cellules.
Pour
cette raison, les composés glycoconjugués sont d'un enjeu thérapeutique
considérable et trouvent des applications comme antitumoraux ou antiviraux.
Or, ces composés, en raison de la présence d'une liaison osidique (liaison
impliquant l' oxygène dit en position anomérique) sont fragiles vis-à-vis de
plusieurs systèmes enzymatiques dont les enzymes protéases et les enzymes
hydrolases.
Il est donc intéressant, pour conserver aux composants leurs propriétés
biologiques, de remplacer l' oxygène de la liaison osidique afm que cette
liaison ne soit plus dégradée par un processus enzymatique.
Des analogues où l' oxygène est remplacé par un groupement CH2 ont été
synthétisés, mais, en dépit d'un accroissement de la stabilité et d'un
encombrement stérique semblable à celui de l' oxygène, le groupement CHI ne
s' est pas révélé être un bon mime des propriétés biologiques du composé
initial.
25
D'autres classes de composés où l'oxygène est remplacé par un azote ou un
soufre et plus récemment par un groupe difluorométhylène sont étudiées afm
de conférer aux composés glycoconjugués une stabilité accrue en milieu
biologique.
Cette transposition O/CF2 semble particulièrement adaptée pour mimer
l' oxygène sur le plan électronique ; les deux atomes de fluor j ouant le rôle
des
deux doublets libres de l'oxygène (Figure 2).
Plusieurs équipes étudient l' accès à des C-glycosides (composés où l' oxygène
anomérique est remplacé par un caxbone) mais aucune méthode efficace
CA 02492940 2005-O1-18
-4
WO 2004/014928 PCT/FR2003/002330
applicable à la large gamme de sucres rencontrés dans les glycoconjugués (D-
glucose, D-galactose, D-galactosamine, D-glucosamine...) n'a été reportée à
ce ~ our.
L'invention a donc plus particulièrement pour but de résoudre ces
inconvénients.
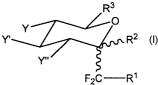
A cet effet, elle propose un composé C-glycoside gem-difluoré de formule
générale I
R3
O
Y _" 2
Y~ . R
Y"
F2C R~
où
R1 est un groupement comportant une chaîne alkyle substituée par au moins
une fonction amine, amide ou acide,
Rz est un atome d'hydrogène H ou une fonction alcool libre ou protégée,
R3 est notamment un groupement H, CH3, CH20H, CHZ-OGP où GP est un
groupe protecteur tel qu'un groupe alkyle, benzyle (Bn), triméthylsilyle
(TMS), tert-butyldiméthylsilyle (TBDMS), tert-butyldiphénylsilyle (TBDPS),
acétate (Ac)...,
Y, Y', Y" sont des groupes indépendants
Où Y, Y', Y" - H, OR, N3, NR'R", SR"' ...
avec R = H, Bn, Ac, TMS, TBDMS, TBDPS,...,
R', R" = H, alkyl, allyl, Bn,, tosylate (Ts), C(=O)-alkyl,
C(=O)-Bn,...,
R"' = H, alkyl, Ac.
En outre, ce composé de formule générale I pourra être préparé par une
réaction entre une lactone de formule générale II
CA 02492940 2005-O1-18
-5
WO 2004/014928 PCT/FR2003/002330
R3
O
Y. Y ~ i O
Y"~
où R3 est notamment un groupement H, CH3, CH2-OGP où GP est un
groupe protecteur tel qu'un groupe alkyle, benzyle (Bn), triméthylsilyle
(TMS), tert-butyldiméthylsilyle (TBDMS), tert-butyldiphénylsilyle
(TBDPS), acétate (Ac)...,
Y, Y', Y" sont des groupes indépendants
Où Y, Y', Y" = H, OR, N3, NR'R", SR"' ...
avec R = H, Bn, Ac, TMS, TBDMS, TBDPS,...,
R', R" - H, alkyl, allyl, Bn, tosylate (Ts), C(=O)-alkyl,
C(=O)-Bn,...,
R"' = H, alkyl, Ac.
et au moins un dérivé halogéné de formule générale XCFZC02R8, où X est un
halogène, en présence de zinc ou d'un dérivé de lanthanide et R8=alkyl,aryl..
.
Ledit dérivé de lanthanide pourra par exemple être le düodure de samarium
SmI2.
Selon une variante, ledit procédé pourra utiliser le zinc en association avec
du
titanocène.
La déoxygénation pour passer d'un composé de formule I où R2 = OH à un
composé de formule I où RZ = H pourra être réalisée pax exemple par
réduction directe ou radicalaire ou encore pax passage par des dérivés
acétates,
tosylates, xanthates, oxalates suivi par une réduction radicalaire.
Selon une variante, les composés gem-difluorés pourront plus précisément
avoir pour formule générale III
CA 02492940 2005-O1-18
-6
WO 2004/014928 PCT/FR2003/002330
R3
O
Y ~ R2
Y
Y"
F2C NR5R6
O
où RS et R6 = H ou un groupement fonctionnalisé ou non tel qu'une chaîne
carbonée fonctionnalisée portant entre autres une fonction amine, aminoacide,
aminoester, une chaîne peptidique, une protéine, un carbohydrate, un stéroïde
ou un triterpène, un alcaloïde, un lignane ou des composés d'intérêt
pharmacologique...
Selon une autre variante, les composés gem-difluorés pourront plus
précisément avoir pour formule générale IVa et IVb
R3 R3
O O
Y Y ~ _ R2 Y. Y ~ _ R2 NRSRs
NR5R6 Y~~S
F2C (CH2)n-~ R~ FOC R~
R9
IVa
où R5, R6, R~ et. R9=, H ou un groupement fonctionnalisé ou non tel qu'une
chaîne carbonée fonctionnalisée portant entre autres une fonction amine,
aminoacide, aminoester, une chaîne peptidique, une protéine, un carbohydrate,
un stéroïde ou un triterpène, un alcaloïde, un lignane ou des composés
d'intérêt pharmacologique.
Un des composés intermédiaires obtenus pour l'obtention de composés de
formule I pourra être un composé de formule générale V comportant une
fonction ester
CA 02492940 2005-O1-18
WO 2004/014928 PCT/FR2003/002330
R3
O
Y ~ R2
Y
Y" ~
F2C~ a
C02R
où R4 pourra être un groupe tel qu'un groupe alkyle, aryle, allyle, ce groupe
étant fonctionnalisé ou non.
Cette fonction ester -CO2R4 pourra être saponifiée pour obtenir l' acide de
formule VI
R3
O
Y
Y R
Y" /
F~C~
COaH
Cette fonction ester -CO2R4 pourra également être réduite en fonction alcool,
par exemple par le tétraborohydrure de sodium (NaBH4) ou le tétrahydrure de
lithium aluminium (LiAlH4) pour donner des composés C-glycosides de
formule générale VII
R3
O
Y
Y R
Y"~
H
F2C C2 OH
Ces composés de formule générale VII pourront eux-mêmes être oxydés en
aldéhyde par différentes méthodes telles que les méthodes de Swern, de I~ess-
Martin pour obtenir des composés de formule générale VIII
R3
O
Y
Y ~ OH
Y"~ O
F2C
~H
CA 02492940 2005-O1-18
_g_
WO 2004/014928 PCT/FR2003/002330
Les composés VIII sont aussi accessibles à partir des esters V après passage
au
thioester et réduction.
Ces composés VIII peuvent être obtenus sous la forme hémiacétalique.
Les composés non osidiques de formule I, où Rl= CH2-OH, pourront
également être oxydés en aldéhyde par l'une ou l'autre des méthodes citées
précédemment.
En outre, selon une autre variante, des composés de formule I où Rl = -COOH
pourront être utilisés dans une réaction de Ugi avec une amine, un aldéhyde et
5 6
un isonitrile pour obtenir des composés de formule III où R1 = -C(=O)-NR R .
Selon une dernière variante, des composés de formule générale I pourront être
obtenus par couplage d'un dérivé de sucre avec une amine, par exemple un
acide aminé ou un peptide.
Enfin, le groupe CF2 est particulièrement résistant aux processus de
dégradations biochimiques et il permet donc la synthèse de structures non
hydrolysables.
Les composés de formules générales I-VIII ainsi que leurs éventuels dérivés et
sels d' addition à un acide minéral ou organique pharmaceutiquement
acceptable pourront être présentés par exemple sous forme de comprimés,
gélules, dragées, solutions ou suspensions buvables, émulsions, suppositoires.
Outre les excipients inertes, non toxiques et pharmaceutiquement acceptables,
tels que l'eau distillée, le glucose, le lactose d'amidon, le talc, les huiles
végétales, l'éthylène glycol..., les compositions ainsi obtenues pourront
également contenir des agents de préservation.
D'autres principes actifs pourront être ajoutés dans ces compositions.
CA 02492940 2005-O1-18
WO 2004/014928 9 PCT/FR2003/002330
La quantité de composé selon l' invention et d' autres éventuels principes
actifs
dans de telles compositions pourra varier selon les applications, l' âge et le
poids du malade.
Des exemples de préparation de composés selon l'invention seront décrits ci-
après, à titre d'exemples non limitatifs.
Les abréviations rencontrées sont définies ainsi
éq. : équivalent
g : gramme
Hz : Hertz
mg : milligramme
MHz : mégaHertz
min.: minute
mL: millilitre
mmol: millimole
.mol: micromole
nmol : nanomole
Les exemples ci-après décrivent la préparation de composés glycoconjugués
gem-difluorés de formule générale I
R3
O
Y
Y. R2
Y"
F2C R~
Ces composés peuvent être synthétisés par différents procédés.
pour diminuer le nombre d'étapes lors de la synthèse de composés
glycoconjugués gem-difluorés, des lactones 1 ont été employées en tant
CA 02492940 2005-O1-18
WO 2004/014928 1~ PCT/FR2003/002330
qu'électrophiles (Figure 4). Les dérivés 2 ont été obtenus à partir des
lactones
1 par attaque du bromodifluoro acétate d'éthyle 3 en présence de zinc Zn ou
de düodure de samarium SmI2.
Il est à noter que cette méthode est générale et peut être appliquée à toutes
les
familles de glucopyranoses différemment substituées (Y, Y', Y" = OR, N3,
NRR', SR", ...), les lactones de départ étant facilement accessibles en une ou
plusieurs étapes à partir de produits commerciaux (pax exemple, dans la série
glucose, par oxydation en une étape de produits commerciaux).
SYNTHESE DE COMPOSES C-GLYCOSIDES INTERMEDIAIRES 6
ET 7 (Figures 5 et 6)
Dans l' exemple de la figure 5, dans un bicol de 100 mL surmonté d'un
réfrigérant et d'un robinet d'introduction, 0.82 g de zinc (Zn) activé sont
introduits (0.82 g, 12.5 mm-ol, 7 éq.). L'ensemble est mis sous vide et le
zinc
est chauffé au pistolet thermique pendant environ 5 min puis le vide est cassé
avec un ballon d' argon.
15 mL de tétrahydrofuranne (THF) anhydre sont aj outés et la solution obtenue
est portée à reflux. Le mélange, préparé sous argon et constitué de la lactone
4
(0.960 g, 1.782 mmol, 1 éq.), de bromodifluoro acétate d'éthyle BrCF2CO0Et
5 (0.69 mL, 5.346 mmol, 3 éq.) et de tétrahydrofuranne anhydre (15 mL) est
introduit.
L'ensemble est laissé à reflux pendant 2h30 (réaction suivie pax
chromatographie sur couche mince (CCM) avec comme éluant un mélange
acétate d'éthyle / cyclohexane 3/7), puis 30 mL d'acide chlorhydrique de
concentration 1N et du dichlorométhane sont aj outés à la solution.
CA 02492940 2005-O1-18
-11
WO 2004/014928 PCT/FR2003/002330
Les phases sont séparées et l' extraction est réalisée avec du dichlorométhane
(trois fois 10 mL de dichlorométhane sont successivement ajoutés à la phase
aqueuse et extraits), les phases organiques sont rassemblées, séchées sur
sulfate de magnésium (MgS04) anhydre, filtrées et concentrées à l'évaporateur
sous vide.
La séparation est réalisée par chromatographie sur une colonne de silice avec
comme éluant un mélange cyclohexane / acétate d' éthyle dans des proportions
de neuf pour un. Après concentration des fractions recueillies, le produit 6
se
présente sous la forme d'une huile jaunâtre avec un rendement pondéral de
~9% sous forme d'un seul diastéréoisomère.
Le composé 6 est obtenu avec un rendement pondéral de 62% si l'on utilise le
düodure de samarium en remplacement du zinc sous forme d'un mélange
séparable des deux diastéréoisomères (mélange 2 :1).
Les caractéristiques des appareils utilisés pour effectuer les analyses de
tous
les composés décrits dans la présente demande sont indiquées ci-dessous
Les spectres RMN 1H, 13C, 19F ont été enregistrés sur des
spectromètres BRUKER DPX 300 et DPX 600. En RMN 1H et 13C, le
tétraméthylsilane est utilisé comme référence interne. En RMN 19F, la
référence externe est le fluorotrichlorométhane CFCl3. Les déplacements
chimiques sont exprimés en partie par million (ppm), les constantes de
couplage J en Hertz (Hz).
Les abréviations suivantes ont été utilisées
s pour singulet, b pour un large singulet, d pour doublet, t pour triplet, q
pour
quadruplet, m pour multiplet ou massif, dd pour doublet de doublet. . .
Les spectres infrarouges sont tracés sur un appareil PERKIN-ELMER
PARAGON 500 FT-IR en film liquide sur cristal de chlorure de sodium ou en
CA 02492940 2005-O1-18
WO 2004/014928 12 PCT/FR2003/002330
pastille de KBr (pour les solides). Les fréquences d'absorption sont exprimées
en cn11.
Les spectres de mâsse ont été obtenus sur un spectrophotomètre JEOL AX 500
avec canon de FAB JEOL (Xe, 4kV, lOmA).
Les séparations par chromatographie sur colonne sont réalisées sous pression
légère en suivant les techniques de chromatographie sur silice Kieselgel 60
(230-400 Mesh, Merck).
Le suivi est assuré par chromatographie sur couches minces (CCM) avec des
plaques Kieselgel 60F-254-0.25mm. On appelle rapport frontal (Rf) le rapport
de la distance de migration d'un composé sur un support donné sur la distance
de migration d'un éluant.
Les analyses effectuées pour confirmer la structure du produit obtenu 6 sont
présentées ci-dessous
25
Chromatographie sur couche mince (CCM)
Rf = 0.55, éluant : acétate d'éthyle / cyclohexane 3/7
Données RMN
RMN 19F (2g2 MHz ; solvant : chloroforme deutéré (CDCl3))
-117.67, d, ZJF_F=256Hz ; -120.03, d, 2JF_F=256Hz
RMN 1H (300 MHz ; solvant : chloroforme deutéré (CDC13))
1.19, t, 3J-7.14Hz, 3H : CH3 (OEt) ; 3.52-3.70, m, 3H (HS+2H6 ) ; 3.90-3.95,
m, 3H : HZ+H3+H4 ; 4.18, q, 3J=7.14Hz, 2H : CH2 (OEt) ; 4.39-5.19, m, 8H : 4
CH2(OBn) ; 7.14-7.24, m, 20H : 4x 5 CH (Ph).
RMN 13C (75.5 MHz ; solvant : chloroforme deutéré (CDC13))
CA 02492940 2005-O1-18
WO 2004/014928 13 PCT/FR2003/002330
14.29, CH3 (OEt) ; 63.89, CH2 (OEt) ; 68.68, CH2 (C6) ; 73.06, CH ; 73.82 ,
75.47 , 75.67 , 76.37 : 4xCH2 (OBn) ; 77.83 , CH ; 78.62 , CH ; 83.79 , CH ;
96.59, dd, 2Jc_F=28.17Hz et ZJc_F=26.44Hz , -CF2C (OH)O- ;
112.79 , dd, iJc_F=263.6Hz et 1Jc_F=259.6Hz, CF2 ; 137-138 CH (Ph) ;
163.32, dd, 2Jc_F=31.6Hz et ZJc_F=3l.OHz, CFZCOOEt.
IR (cm 1)
4059.6 , 3478.5 , 3089.5 , 3064.3 , 3031.6 , 2923.7 , 2852.0 , 2257.3 , 2925.7
,
1875.4 , 1769.3, 1663.6 , 1605.9 , 1586.4 , 1497.3 , 1454.0 , 1396.7 , 1372.1
,
l0 1315.6,1087.7,1027.9,910.6,856.8,802.1,736.7,698.1,648.9,605.5,
540.9 , 462.7 .
Spectrométrie de masse : FAB+ (Xe, 4KV, matrice de 3-nitrobenzylalcool)
686(2%)= (M+Na)+, 663(4%)=M+, 661(6°/~), 572(3%)=(M-Bn)+,
554(3%)=(M-Bn-HZO)+, 463(4%), 391(12%), 307(14%), 289(12%),
271(16%), 181(96%), 154(100%), 136(84%), 107(50%), 91(100%), 81(46%),
69(40%), 55(76%), 43(64%), 29(20%)
La déoxygénation pour avoir accès aux dérivés 7 peut ensuite être réalisée par
différentes voies (réduction directe ou radicalaire, passage par des dérivés
acétates, tosylates, xanthates...).
La saponification a pu être réalisée de façon quasi quantitative dans diverses
conditions que ce soit avec l'hydroxyde de sodium, de potassium ou de
lithium en solution aqueuse dans l' éthanol ou le THF (Figure 6)
Dans un ballon contenant l'ester 6 (0.5 g, 1.75 mmol, 1 éq.) dans le
tétrahydrofurane : (5 mL) ou dans l' éthanol (5 mL) est additionnée une
solution aqueuse de lithine LiOH (2M, 0.75 mL, 2 éq.) ou une solution
aqueuse de soude NaOH (0.07 g, 1.6 mmol) puis, l'agitation est laissée
pendant douze heures. Le milieu est évaporé dans le cas de l'utilisation
CA 02492940 2005-O1-18
WO 2004/014928 14 PCT/FR2003/002330
d'éthanol, puis repris avec du dichlorométhane. Le mélange est acidifié par de
l' acide chlorhydrique HCl 1M, puis extrait plusieurs fois au dichlorométhane.
Les phases organiques sont rassemblées, séchées sur MgS04, filtrées et
concentrées.
Le produit obtenu est une huilé incolore et le rendement quantitatif.
Données RMN:
RMN 19F (CDC13, 282,5 MHz)
-117.4, d (2J F_F =258 Hz) ; -119.1, d (2J F_F =258 Hz).
RMN 1H (CDCl3, 300MHz):
3.40-3.60, m, 3H, H5 et H6 ; 3.90-4.00, m, 3H, H2, H3 et H4 ; 4.38-4.79, m, 8
H, 4 CHZ(OBn) ; 7.05-7.22, m, 20 H, H ar.
RMN 13C (CDCl3, 75,SMHz)
68.6 (C6) ; 72.2 (CS) ; 73.5, 75.5, 75.9, 76.4 (4 CH2(OBn)) ; 77.7, 78.5, 83.6
(C2; C3 et C4) ; 96.0, dd, ZJc_F=27.OHz et 2Jc_F=28.7Hz , -CF2C1(OH)O- ;
112.4 , dd, 1Jc-F=260.3Hz et 1Jc_F=259.2Hz, CF2 128.1, 128.2, 128.4, 128.8,
128.9, 129.0 (C ar.); 137.2, 137.7, 137.9, 138.6 (C ar. Quat) 163.6, dd, 2Jc
F=30.SHz et 2Jc_F=32.8Hz, CFZCOOH.
SYNTHESE D'UN COMPOSE GEM-DIFLUORE A PARTIR DES
COMPOSES 6 ET 7
~ Réaction avec les amines
CA 02492940 2005-O1-18
WO 2004/014928 15 PCT/FR2003/002330
Cette réactivité permet d'avoir accès à des composés très intéressants,
analogues de glycopeptides.
Des dérivés du composé 6 réagissent avec différentes amines pnmalres ou
secondaires pour conduire â des amides correspondants. Les amines utilisées
sont des amines aliphatiques, benzyliques ou aromatiques et des dérivés
d' acides aminés tel que la lysine (Figure 7)
Dans un ballon sous atmosphère inerte contenant le produit de départ 6 (50
mg ; 0,075 mmol ; 1 éq..) en solution et l'acétate de la Boc-lysine-OMe 8 (48
mg ; 0,15 mmol ; 2 éq.) dans le dichloroéthane DCE (3 mL), est additionné la
triéthylamine Et3N (53 ~,L ; 0,375 mmol ; 5 éq.). Le mélange est chauffé au
reflux pendant quarante huit heures puis le solvant est évaporé.
La purification du produit brut est réalisée par chromatographie sur une
colonne de silice avec comme éluant un mélange cyclohexane / acétate
d' éthyle dans des proportions de sept pour trois.
Après concentration, le produit 9 se présente sous la forme d'un solide jaune
pâle avec un rendement pondéral de 84%.
Données RMN:
RMN 19F (CDCl3, 282,SMHz)
-117.4, d, (2J F_F =259 Hz) ; -121.9, d, (ZJ F_F =259Hz).
RMN 1H (CDC13, 300MHz)
1.18-1.60, m, 15 H, (CH3)3C et (CH2)3 ; 3.06-3.19, m, 2 H, CH2N ; 3.52-3.69,
m, 6 H, HS ; H6 et C02CH3 ; 3.84-4.18, m, 4 H, H2; H3; H4 et CHN ; 4.36-
4.85, m, 8 H, 4 CH2Bn ; 5.01, d, J=8,3 Hz, 1 H, NHBoc ; 6.60, m, 1 H, NH ;
7.10-7.23, m, 20 H, H ar.
CA 02492940 2005-O1-18
-16-
WO 2004/014928 PCT/FR2003/002330
RMN 13C (CDC13, 75,SMHz)
22.7, 28.8 ((CH2)i) ; 28.9 ((cH3)3~) ; 32.5 (CH2) ; 39.6 (CH2N) ; 52.7
(C02CH3) ; 53.6 (CHN) ; 68.7 (C6) ; 73.6, 75.3, 75.8, 76.4 (4 CH2Bn) ; 72.1,
77.9, 78.6, 83.6 (C2, C3, C4 et C5) ; 96.1, dd, 2J~_F =27,4 Hz (CFZCO(OH)) ;
112.5, dd, 1Jc_F =261,7 Hz (CF2) ; 127.6, 127.7, 127.8, 128.3, 128.4, 128.5 (C
ar.) ; 137.5, .137.9, 138.0, 138.3 (C ar. quat.) ; 155.6 (COZMe) ; 163.7, dd,
~'Jc-F =27,4 Hz (CF2CONH) ; 173.3 (NHC02tBu).
Un dérivé glycosylé de l' alanine peut être obtenu à partir du composé 6
(Figure 8) ou du composé 7 (Figure 9) selon trois modes opératoires
différents
Le premier mode opératoire A est identique à celui utilisé pour le composé 9
dérivé de la lysine. Le rendement pondéral pour le composé 11 est de 30%
(Figure 8).
Le deuxième mode opératoire B (Figure 9) est le suivant
Dans un ballon sous atmosphère inerte contenant l'acide 7 (50 mg ; 7,87*10-3
mmol ; 1 éq.) dans le dichlorométhane DCM (2 mL), le BOP (Benzotriazol-1
yloxy-tris(dimethylamino)phosphonium hexafluorophosphate) (35 mg ;
7,87*10-3 mmol ; 1 éq.) et la düsopropyéthylamine DIEA (28 ~,L ; 0,016
mmol ; 2 éq.) sont introduits. Le milieu réactionnel est agité pendant une
heure
puis au milieu réactionnel une solution constituée de l'alanine 10 (11 mg ;
7,87*10-3 mmol ; 1 éq.) et de la DIEA (14 ~.L ; 7,87*10-3 mmol ; 1 éq.) dans
le
dichlorométhane (2 mL) est aj outée au milieu réactionnel. L' agitation est
maintenue pendant vingt quatre heures. Le milieu est alors lavé avec une
solution d'acide chlorhydrique HCl 1M. La phase organique est séchée sur
sulfate de magnésium, filtrée puis évaporée.
CA 02492940 2005-O1-18
WO 2004/014928 1~ PCT/FR2003/002330
Le produit brut est alors purifié sur une plaque préparative de silice en
utilisant
comme éluant un mélange cyclohexane / acétate d'éthyle dans des proportions
de sept pour trois.
Le produit 11 est obtenu sous la forme de cristaux blancs avec un rendement
pondéral de 77%.
Le troisième mode opératoire C (Figure 9) est le suivant
Dans un ballon sous atmosphère inerte contenant l'acide 7 (50 mg ; 7,87*10 3
mmol ; 1 éq.) dans le dichlorométhane (2 mL) est introduit le BOPCl (bis-(2-
oxo-3-oxazolidinyl)phosphinic chloride) (40 mg ; 0,016 mmol ; 2 éq.). Puis,
l' agitation est laissée pendant une heure avant d' additionner au milieu
réactionnel une solution constituée du dérivé de l' alanine 10 (22 mg ; 0,016
mmol ; 2 éq.) et de la diéthylamine DIEA (44 ~L ; 0,023 mmol ; 3 éq.) dans le
dichlorométhane (2 mL). L' agitation est maintenue pendant vingt quatre
heures puis le milieu est lavé avec une solution HCl 1M. La phase organique
est séchée sur sulfate de magnésium, filtrée puis évaporée.
Le produit brut est alors purifié sur une plaque préparative de silice en
utilisant
comme éluant un mélange cyclohexane / acétate d' éthyle dans des proportions
de sept pour trois.
Le produit 11 est obtenu sous la forme de cristaux blancs avec un rendement
pondéral de 44%.
Données RMN
RMN 19F (CDCl3, 282,5 MHz)
-118.0, d, (2JF_~ =259 Hz) ; -122.2, d, (2JF_F =259Hz).
CA 02492940 2005-O1-18
WO 2004/014928 1 g PCT/FR2003/002330
RMN 1H (CDCl3, 300 MHz)
1.26, d, 3J=7,2 Hz, 3 H, CH3 ; 3.50-3.66, m, 3 H, H5 et H6 ; 3.63, s, 3 H,
C02CH3 ; 3.89-3.96, m, 3 H, H2, H3 et H4 ; 4.40-4.81, m, 10 H, NH ; CHN et
4 CHaBn ; 7.11-7.21, m, 20 H, H ar.
RMN 13C (CDC13, 75,5 MHz)
16.7 (CH3) ; 47.2 (CHN) ; 51.7 (C02CH3) ; 67.3 (C6) ; 72.3, 73.9, 74.3, 75.0
(4 CH2Bn) ; 70.9, 76.2, 77.1, 82.2 (C2, C3, C4 et C5) ; 126.6-127.4, m (C
ar.) ; 136.5, 136.9, 137.0, 137.4 ~(C ar. quat.) ; 171.0 (C02Me).
Les réactions de couplage avec des acides aminés suivants tels que la
phénylalanine, la thréonine, la méthionine, la proline ainsi qu' avec un
dipeptide ont été réalisées en utilisant le BOPCl comme agent de couplage
c'est à dire èn suivant la même procédure que le mode opératoire C lors du
couplage avec l'alanine (Figure 10).
Le produit 12b est obtenu sous la forme de cristaux blancs avec un rendement
pondéral de 42% (Figure 11).
Données RMN
RMN 19F (CDC13, 282,5 MHz)
-117.7, d, (ZJg_g =261 Hz) ; -121.6, d, (2JF_F =261Hz).
RMN 1H (CDCl3, 300 MHz)
3.07, m, 2 H, CHZPh ; 3.44-3.67, m, 3 H, H5 et H6 ; 3.57, s, 3 H, C02CH3 ;
3.91-3.98, m, 3 H, H2, H3 et H4 ; 4.25-4.85, m, 10 H, NH, CHN et 4 CHZBn ;
7.00-7.14, 25 H, H ar.
RMN 13C (CDCl3, 75,5 MHz)
CA 02492940 2005-O1-18
WO 2004/014928 19 PCT/FR2003/002330
37.5 (CH2Ph) ; 52.4 (COZCH3) ; 53.1 (CHIA ; 68.3 (C6) ; 73.2, 75.0, 75.3,
76.0 (4 CHZBn) ; 72.0, 77.0, 78.2, 83.2 (C2, C3, C4 et CS) ; 127.3-129.3, m
(C ar.) ; 135.0, 137.5, 137.9, 138.0, 138.4 (C ar. quat.) ; 170.3 (COZMe).
Le produit 12c est obtenu sous la forme de cristaux blancs avec un rendement
pondéral de 28% (Figure 12).
Données RMN
RMN 19F (CDCl3, 282,5 MHz)
-118:3, d, (2Jg_g =257 Hz) ; -121.2, d, (2JF-F =257Hz).
RMN 1H (CDCl3, 300 MHz)
1.12, d, 3J=6,4 Hz, 3H, CH3 ; 3.48-3.64, m, 3H, H5 et H6 ; 3.7, s, 3H,
COZCH3 ; 3.89-4.00, m, 3H, H2, H3 et H4 ; 4.22-4.82, m, 11H, NH ; CHN,
CHOH et 4 CH2Bn ; 7.0-7.24, m, 20H, H ar.
RMN 13C (CDCl3, 75,5 MHz)
20.5 (CH3) ; 53.2 (C02CH3) ; 57.8 (CHIA ; 68.6 (CHOH) ; 68.7 (C6) ; 73.5,
75.4, 75.8, 76.4 (4 CHZBn) ; 72.2, 77.2, 78.4, 83.6 (C2, C3, C4 et C5) ; 128.1-
128.9 m (C ar.) ; 137.8, 137.9, 138.1, 138.7 (C ar. quat.) ; 170.5 (COZMe).
Le produit 12d est obtenu avec un rendement pondéral de 36% (Figure 13).
Données RMN
RMN 19F (CDC13, 282,5 MHz)
-117.4, d, (2Jg_g =260 Hz) ; -121.7, d, (2Jg_F =260Hz).
RMN 1H (CDCl3, 300 MHz)
CA 02492940 2005-O1-18
WO 2004/014928 2~ PCT/FR2003/002330
1.89-1.99, m, 2H, CH2 ; 2.09, s, 3H, SCH3 ; 2.46, t, 3J=7.0 Hz, 2H, CH2S ;
3.58-3.77, m, 3H, HS et H6 ; 3.68, s, 3H, COZCH3 ; 3.96-4.03, m, 3H, H2, H3
et H4 ; 4.43-4.88, m, 10H, NH ; CHN et 4 CH2Bn ; 7.14-7.30, m, 20H, H ar.
RMN 13C (CDC13, 75,5 MHz)
15.7 (CHZ) ; 29.9 (SCH3) ; 31.6 (CH2S) ; 51.8 (C02CH3) ; 53.2 (CHIA ; 68.6
(C6) ; 73.6, 75.4, 75.8, 76.4 (4 CH2Bn) ; 72.4, 77.4, 78.5, 85.6 (C2, C3, C4
et
C5) ; 128.1-128.9 m (C ar.) ; 137.9, 138.3, 138.5, 138.8 (C ar. quat.) ; 171.5
(C02Me).
15
Le produit 12e est obtenu sous la forme de cristaux blancs avec un rendement
pondéral de 32% (Figure 14).
Données RMN .:
RMN 19F (CDC13, 282,5 MHz)
-112.6, d, (2Jg_F =267 Hz) ; -113.7, d, (2JF-F =261Hz) ; -117.2 d (2JF_F =261
Hz) ; -117.3, d, (2JF_F =267Hz).
RMN 1H (CDC13, 300 MHz)
1.52-1.89, m, 4H, (CHZ)Z ; 3.5-3.63, m, 3H, H5 et H6 ; 3.67, s, 3H, C02CH3 ;
3.82-4.06, m, SH, CHZN ; H2 ; H3 et H4 ; 4.33-4.92, m, 9H, CHN et 4
CH2Bn ; 7.10-7.20, m, 20H, H ar.
Le produit 12f est obtenu sous la forme de cristaux blancs avec un rendement
pondéral de 17% (Figure 15).
RMN 19F (CDCl3, 282,5 MHz)
=117.6, d, (ZJF_F =257 Hz) ; -122.4, d, (~'JF_F =257Hz).
CA 02492940 2005-O1-18
-21 -
WO 2004/014928 PCT/FR2003/002330
RMN 1H (CDCl3, 300 MHz)
1,35, d ,3J=7,2 Hz, 3 H, CH3 , 3.05, m, 2 H, CHaPh ; 3.5-3.71, m, 3H, HS et
H6 ; 3.70, s, 3H, C02CH3 ; 3.89-4.01, m, 3H, H2 ; H3 et H4 ; 4.26-4.89, m,
11H, NH , 2 CHN et 4 CHZBn ; 6,05, m, 1H, NH ; 7.10-7.20, m, 25H, H ar.
Le composé 7 peut également être utilisé dans une réaction de UGI avec une
amine telle que la benzylamine 18, un aldéhyde 19 et un isonitrile tel que
l'isocyanate d'éthyle 20 pour les composés 13-17.
Il s'agit d'une voie d'accès vers la synthèse de composés thérapeutiques
(manno- et fucopeptides) qui sont des inhibiteurs de la liaison entre la
sélectine et le tétrasacharide sialyl LewisX (sLeX)
Les leucocytes jouent un rôle important dans de nombreux phénomènes
inflammatoires et immunologiques. Dans beaucoup de ces phénomènes, les
premières étapes sont des interactions entre les cellules endothéliales et les
leucocytes circulant dans le sang.
La recherche de molécules spécifiques à la surface des cellules, impliquées
dans ces interactions, a montré que les leucocytes et les cellules
endothéliales
possèdent à leur surface des lectines spécifiques appelées sélectines. Ce sont
des molécules d' adhésion cellulaire de la famille des molécules calcium
dépendantes. Le sLe" est un des ligands impliqués dans la liaison entre
sélectines, entraînant ainsi l'adhésion des leucocytes sur le tissu
endothélial
pour conduire à des formes aiguës de maladies telles que l' arthrose
rhumatismale, le psoriasis, le cancer.
Par conséquent, le développement de molécules inhibitrices de petite taille du
sLeX est une approche thérapeutique attractive.
CA 02492940 2005-O1-18
WO 2004/014928 22 PCT/FR2003/002330
Synthèse du composé 13 (Figure 17
Tous les réactifs sont dilués dans du méthanol sec afm d'obtenir une
concentration de 1M.
Dans un ballon de 25mL, une solution d'hexanal (0,081 mL ; 0,675 mmol) est
placée avec une solution de benzylamine 18 (0,059 mL ; 0,54 mmol) et le
mélange est agité sous argon pendant deux heures à température ambiante.
Puis, une solution d'isocyanoacétate d'éthyle 20 (0,074 mL ; 0,675 mmol) et
une solution de D-glucose gem-difluoré sous forme d' acide 7 (286 mg ; 0,45
mmol) sont ajoutées et le mélange est agité sous argon pendant vingt quatre
heures à température ambiante.
Le méthanol est ensuite évaporé et la purification du produit est réalisée par
chromatographie sur une colonne de silice avec comme éluant un gradient
d' acétate d' éthyle/cyclohexane allant dans des proportions de 1/9 à 2/8.
CCM
Rf = 0.18, éluant : acétate d' éthyle/cyclohexane 2/8.
Données RMN
RMN 19F (CDCl3)
-104,39 (d, 2JF_F=260,1Hz) ; -104,85 (d, 2JF_F=257,9Hz); -108,61 (d, 2JF
r=255,8Hz) ; -108,89 (d, ZJF_F=254,7Hz) ; -108,95 (d, 2JF_F=260,1Hz) ; -112,49
(d, 2JF_F=255,8Hz) ; -114,35 (d,'JF_F=254,7Hz) ; -116,17 (d, 2JF_F=257,9Hz).
RMN'H (CDC13)
0.69, t, 3H, H2o, 3JH19-H20=6~9HZ ; 0.90-1.10, m, 6H , 1.15, t, SH, Hl, 3JHi
HZ=7,lHz ; 3.41-3.74, m, 4H ; 3.78-3.99, m, 4H ; 4.07, q, 2H, HZ, 3JH1
H2=7,lHz ; 4.36-4.55, m, 4H ; 4.61-6.97, m, 8H ; 6.76, t, 0,7H, H5, 3JH4
Hs=S,SHz ; 6.82, t, 0,3H, HS rotaxnère, 3JHa-HS=5,3Hz ; 7.00-7.26, m, 25H,
HPh.
CA 02492940 2005-O1-18
WO 2004/014928 23 PCT/FR2003/002330
Spectrométrie de masse : (introduction directe, FAB+) : M+Na = 959,6
M+K = 975,7
Synthèse du comuosé 14 (Figure 181-
Tous les réactifs sont dilués dans du méthanol sec afm d' obtenir une
concentration de 1M.
Dans un ballon de 25 mL, une solution de triméthylacétaldéhyde (0,073 mL ;
0,675 mmol) est placée avec une solution de benzylamine 18 (0,059 mL ; 0,54
mmol) et le mélange est agité sous argon pendant deux heures à température
ambiante.
Puis une solution d'isocyanoacétate d'éthyle 20 (0,074 mL ; 0,675 mmol) et
une solution de D-glucose gem-difluoré sous forme d'acide 7 (286 mg ; 0,45
mmol) sont ajoutées et le mélange est agité sous argon pendant vingt quatre
heures à température ambiante.
Le méthanol est évaporé et la purification du produit est réalisée par
chromatographie sur une colonne de silice avec comme élûant un gradient
d'acétate d'éthyle/cyclohexane dans des proportions allant de 1/9 à 3/7.
Le produit obtenu est une huile j aune sous la forme de deux diastéréoisomères
qui sont séparés.
Analyses du 1'er diastéréoisomère 14a
CCM
Rf = 0.70, éluant : acétate d' éthyle/cyclohexane : 4/6.
Données RMN
RMN 19F (CDC13)
CA 02492940 2005-O1-18
_2q._
WO 2004/014928 PCT/FR2003/002330
-105,31 (d, 2JF-F=267,OHz) ; -106,69 (d, 2JF_F=267,OHz).
RMN 1H (CDCl3)
0.99, s, 9H, Hlg ; 1.16, t, 3H, Hl, 3JH1_~,=6,9Hz ; 3.39-3.65, m, 4H ; 3.90,
dd,
2H, J=8,9Hz ; 4.00-4.15, q, 3H, H2, 3JHi-Ha=6,9Hz ; 4.37, d, 1H, J=11,7Hz ;
4.49, t, 2H, J=10,7Hz ; 4.69-4.97, m, 7H ; 5.53, s, 1H, H~ ; 6.49, m, 1H, HS ;
7.08-7.27, m, 25H, HPh.
Spectrométrie de masse : (introduction directe, FAB+) : M+Na = 945,4.
Analyses du 2~"'e diastéréoisomère 14b
CCM
Rf = 0.65, éluant : acétate d' éthyle/cyclohexane : 4/6.
Données RMN
RMN 19F (CDC13)
-107,15 (d, 2JF_F=255,7Hz).
RMN 1H (CDC13)
1.02, s, 9H, Hl8 ; 1.16, t, 3H, H1, 3JH1_~=7,OHz ; 3.52-4.00, m, 9H ; 4.09, q,
ZH, H2, 3Jg1-H2=7,OHZ ; 4.33-4.86, m, 8H ; 4.97, dd, 2H, H16, Hl6>, 2JHi6-
Hi6°=17,3Hz ; 5.33, s, 1H, H~ ; 6.49, m, 1H, HS ; 6.98-7.27, m,
25H, HPh.
Spectrométrie de masse : (MA.LDI+) : M+Na = 945,4.
Synthèse du composé 15 (Figure 19)
Tous les réactifs sont dilués dans du méthanol sec afm d'obtenir une
concentration de 1M.
CA 02492940 2005-O1-18
- 25 -
WO 2004/014928 PCT/FR2003/002330
Dans un ballon de 25 mL, une solution de 3,4,5-triméthoxybenzaldéhyde 22
(0,132 g ; 0,675 mmol) est placée avec une solution de benzylamine 19 (0,059
mL ; 0,54 mmol) et le mélange est agité sous argon pendant deux heures à
température ambiante.
Puis, une solution d'isocyanoacétate d'éthyle 20 (0,074 mL ; 0,675 mmol) et
une solution de D-glucose gem-difluoré sous forme d'acide 7 (286 mg ; 0,45
mmol) sont ajoutées et le mélange est agité sous argon pendant vingt quatre
heures à température ambiante.
Le méthanol est évaporé et la purification du produit est réalisée par
chromatographie sur une colonne de silice avec comme éluant un gradient
d'acétate d'éthyle/cyclohexane allant dans des proportions de 119 à 3/7.
Le produit obtenu est une huile j aune sous la forme de deux diastéréoisomères
15a, 15b qui sont séparés.
~lnalXses du 1 'er diasténéoisomère I Sa
CCM
Rf = 0.41, éluant : acétate d'éthyle/cyclohexane : 4/6.
Données RMN
RMN 19F (CDCl3)
-111.63, s.
RMN'H (CDC13)
1.18, t, 3H, Hl, 3JHi-HZ=7,2Hz ; 3.38, t, 1H, J=6,6Hz ; 3.58, s, 9H, Hl~ 3.65,
s,
4H ; 3.93-4.14, m, 7H ; 4.40-4.53, m, 3H ; 4.70-4.87, m, 3H ; 4.86, dd, 2H,
CA 02492940 2005-O1-18
-26-
WO 2004/014928 PCT/FR2003/002330
Hls, His°, 2JHis-His°=16,9Hz ; 5.33, s, 1H ; 6.38, s, 1H, H~ ;
6.43, t, 1H, H5, 3JHa-
HS=4,SHz ; 6.90-7.25, m, 27H, HPh.
Spectrométrie de masse : (introduction directe, FAB+) : M+Na = 1055,7
Analyses du Ze"'e diastéréoisomére I Sb
CCM
Rf = 0.32, éluant : acétate d' éthyle/cyclohexane : 4/6.
Données RMN
RMN 19F (CDCl3)
-108,12 (d, 2JF_F=251,9Hz); -115,19 (d, ZJF_F=251,9Hz).
RMN'H (CDC13)
1.17, t, 3H, Hl, 3JH1_x~=7,OHz ; 3.32-3.41, m, 1H ; 3.65, s, 9H, Hl~ ; 3.70,
s,
3H ; 3.78-3.98, m, SH ; 4.08, q, 4H, H2, 3Jg1-H2=7~OHz ; 4.32, s, 2H ; 4.60,
dd,
2H, J=10,54Hz ; 4.67, s, 2H ; 4.87, s, 1H ; 5.09, s, 1H. ; 6.30, t, 1H, H5,
3JH4-
HS=4,9Hz ; 6.52, s, 2H, H~ .; 6.86-7.23, m, 27H, HPh.
Spectrométrie de masse : (introduction directe, FAB+) : M+Na = 1055,7
Synthèse du composé 16 (Figure 20)
Tous les réactifs sont dilués dans du méthanol sec afm d' obtenir une
concentration de 1 M.
Dans un ballon de 25 mL, une solution de benzaldéhyde (0,059 mL ; 0,675
mmol) est placée avec une solution de benzylamine 18 (0,059 mL ; 0,54
CA 02492940 2005-O1-18
WO 2004/014928 2~ PCT/FR2003/002330
mmol) et le mélange est agité sous argon pendant deux heures à température
ambiante.
Puis, une solution d'isocyanoacétate d'éthyle 20 (0,074 mL ; 0,675 mmol) et
une solution de D-glucose gem-difluoré sous forme d'acide 7 (286 mg ; 0,45
mmol) sont ajoutées et le mélange est agité sous axgon pendant vingt quatre
heures à température ambiante.
Le méthanol est évaporé et la purification du produit est réalisée par
chromatographie sur une colonne de silice avec comme éluant un gradient
d'acétate d'éthyle/cyclohexane allant dans des proportions de 1/9 à 3/7.
Le produit est obtenu sous la forme de deux diastéréoisomères 16a, 16b qui
sont séparés.
Anah~ses du 1'er diastéréoisomère 16a
CCM
Rf = 0.26, éluant : acétate d'éthyle/cyclohexane : 3/7.
Données RMN
RMN 19F (CDC13)
-111.66, s, 2F.
RMN'H (CDCl3)
1.15, t, 3H, Hl, 3JHi-HZ=7~OHz ; 3.52-3.79, m, 3H ; 3.83, dd, 1H, J=4,SHz ;
3.90-4.01, m, 4H ; 4.07, q, 2H, H2, J=7,OHz ; 4.36-4.52, m, 4H ; 4.68-4.82, m,
SH ; 4.94, dd, 2H, H16, 2JH16-H16'=15,8HZ ; 5.20, s, 1H, H~ ; 6.29, t, 1H, Hs,
3JH4-HS-4'~SHZ ; 6.96-7.23, m, 30H, HPh.
RMN 13C (CDC13)
CA 02492940 2005-O1-18
WO 2004/014928 2g PCT/FR2003/002330
14.2, Cl ; 41.6, C4 ; 52.0, 61.6, C2 ; 66.2, 68.5, 71.7, 73.5, 75.1, 75.4,
75.9,
77.5, 78.6, 83.5, 96.9, t, Clo, ZJcio-F=27,6Hz ; 114.3, t, C9, 1Jc-F=262,9Hz ;
126.9, 127.2, 127.7, 127.8, 127.9, 128.0, 128.1, 128.2, 128.3, 128.4, 128.5,
128.5, 128.6, 128.8, 130.0, .133.0, 136.3, 137.8, 138.0, 128.6, 165.1, t, C8,
2Je8_
F=26,4Hz ; 168.3 ; 169.7.
Spectrométrie de masse : (MALDI+) : M+Na = 965,5
M+I~ = 981,5
Analyses du 2e"'e diastéréoisomère 16b
CCM
,. ..
Rf = 0.71, éluant : acétate d'éthyle/cyclohexane : 5/5.
Données RMN
RMN 19F (CDCl3)
-107,71(d, 2JF_F=253,1Hz) ; -115,09 (d, ZJF_F=253,1Hz).
RMN 1H (CDC13)
1.16, t, 3H, Hl, 3JH1_x~,=7,OHz ; 3.35-3.40, m, 1H ; 3.51-3.70, m, 4H ; 3.84-
4.00, m, SH ; 4.08, q, 2H, H2, 3JH1_~=7,OHz ; 4.23, s, 1H ; 4.62, dd, 2H,
J=9,98Hz ; 4.67, s, 1H ; 4.81, d, 1H, J=3,8Hz ; 4.98, s, 1H ; 5,08, d, 1H, H16
ou H16~, ~JH16-H16'-1 ~, OHz ; 6.08, t, 1H, H5, 3JHa-HS=4,9Hz ; 6.76-6.85, m,
1H ;
6.95-7.29, m, 30H, HPh.
Spectrométrie de masse : (MA.LDI+) : M+Na = 965,4
M+I~ = 981,3
CA 02492940 2005-O1-18
_29_
WO 2004/014928 PCT/FR2003/002330
Synthèse du composé 17 (Figure 21)
Dans un ballon de 25 mL, le 1'er diastéréoisomère du (2- f Benzyl-[2,2-
difluoro-
2-(3 (R),4(S),5 (S)-tris-benzyloxy-6(R)-benzyloxymethyl-2(R)-hydroxy-
S tetrahydro-pyran-2-yl)-acetyl]-amino~-2-phenyl-acetylamino)-acetic acid
ethyl ester 16a (0,139 g ; 0.147 mmol) est placé avec 6,6 mL de méthanol et
une pointe de spatule de palladium sur charbon Pd/C 10%. Après avoir mis
sous vide, une baudruche d'hydrogène est installée et une agitation est
maintenue toute la nuit à température ambiante.
La solution est filtrée sur célite, puis évaporée pour donner le produit 17
sous
la forme de cristaux blancs.
Données RMN
RMN 19F (CD30D)
-108,37 d, 2JF_F=261,7Hz) ; -109,29 (d, ZJF_F=256,8Hz) ; -111,04 (d, ZJF_
F=261,7Hz) ; -115,44 (d, ZJF_F=256,8Hz) ; -120.50, s.
RMN 1H (CD3OD)
1.19, t, 3H, Hl, 3JHi-x~=7,lHz ; 3.39-3.52, m, 1H ; 3.59-3.98, m, 7H ; 4.04-
4.19, m, 2H ; 4.28, dd, 1H, 2J=17,7Hz ; 5.22, dd, 1H, H16, Hi6~, ZJHi6-
His°=17,7Hz ; 5.67, s, 1H, H~ ; 6.69-7.40, m, lOH, Hph.
Spectrométrie de masse : (introduction directe, FAB+) : M+Na=605,0
En série glucose la préparation de l'amide 21 est décrite (Figure 22)
Dans un ballon de 50 mL sous argon, l'ester 6 (0.193 g, 0.291 mmol, 1 éq.) est
dissous dans du dichlorométhane anhydre (5 mL). La p-méthoxybenzylamine
CA 02492940 2005-O1-18
WO 2004/014928 3~ PCT/FR2003/002330
22 (0.057 mL, 0.436 mmol, 1.5 éq.) est ajoutée et le mélange est laissé sous
agitation pendant une nuit. Ensuite, la solution est évaporée sous vide.
La purification est réalisée par chromatographie sur une colonne de silice
avec
comme éluant un mélange cyclohexane l acétate d' éthyle dans des proportions
de neuf pour un.
Après concentration, le produit 21 se présente sous forme d'un solide blanc
avec un rendement pondéral de 56%.
Les analyses effectuées pour confirmer la structure du produit obtenu 21 sont
présentées ci-dessous
CCM
Rf = 0.52 ; éluant : acétate d'éthyle / cyclohexane 3/7
Données RMN
RMN 19F (282 MHz ; solvant : chloroforme deutéré (CDC13))
-117.38, d, ~_F=257Hz ; -121.90, d, JF_F=257Hz
RMN 1H (300 MHz ; solvant : chloroforme deutéré (CDCl3))
3.3-5, m, 16H (cycle+4xOBn) ; 3.66, s, 3H : CH3 (OMe); 6.73,d, J=8.4Hz,
2H : 2CH (PMB); 7.07, d, J=8.4Hz, 2H : 2CH (PMB); 7.14-7.24, m, 20H
4x5 CH (Ph).
RMN13C (75.5 MHz ; solvant : chloroforme deutéré (CDCl3))
43.35, CH2 (PMB) ; 55.68, CH3 (OMe) ; 68.68, CH2 (C6) ; 73.06, CH ; 73.82 ,
75.47 , ~ 75.67 , 76.37 : 4xCH2 (OBn) ; 77.83 , CH ; 78.62 , CH ; 83.79 , CH ;
96.59 ,dd, J~_F=28.17Hz
CA 02492940 2005-O1-18
-31 -
WO 2004/014928 PCT/FR2003/002330
et J~_F=26.44Hz , -CFZCH(OH)O- ; 112.79 , dd, Jc_F=263.6Hz et J~_
F=259.6Hz, CFZ ; 114.60 , 2 CH (PMB) ; 137-13~ CH (Ph + PMB) ; 159.71 ,
C quat (C-OMe PBM) ;
163.32, dd, J~_F=31.6Hz et Jc_F=3l.OHz, CF2CONH.
° ~ Réduction de la fonction ester
'La transformation de la fonction ester des C-glycosides difluoroacétylés en
d'autres fonctions permet d'avoir accès à une large gamine de glycoconjugués.
La réactivité de cette fonction ester en a d'un groupe difluorométhylène a été
étudiée et notamment sa réduction.
La fonction ester des composés 2 (ou 6) est réduite en alcool par le
téiraborohydrure de sodium (NaBH4) ou le tétrahydrure de lithium aluminium
(LiAlH4) pour donner le composé 23 (Figure 22). La fonction alcool de ce
composé est ensuite oxydée en aldéhyde pour donner le composé 24 par
différentes méthodes telles que les méthodes de Swern, de Dess-Martin ...
Il est à noter que la réduction directe de la fonction ester en aldéhyde par
l'hydrure de düsobutylaluminium (DIBAH) est possible sur des composés non
osidiques.
~ Réduction d'un ester 25 en alcool 26 (Figure 23)
Dans un ballon de 25 mL sont placés l'ester 25 (30 mg ; 45 ilmol ; 1 éq.), le
tétraborohydrure de sodium NaBH4 (5 mg ; 134 nmol ; 3 éq.) et 5 mL
d'éthanol (EtOH).
La solution est laissée sous agitation à température ambiante pendant une
nuit,
puis est évaporée à sec sous vide.
CA 02492940 2005-O1-18
WO 2004/014928 - 32 PCT/FR2003/002330
Le précipité blanc est redissous dans 10 mL d' eau et 10 mL de
dichlorométhane.
Les phases sont séparées, la phase aqueuse est extraite au dichlorométhane
(deux fois 10 mL) puis les phases organiques sont regroupées, séchées sur
sulfate de magnésium anhydre et évaporées sous vide pour donner 24 mg de
l'alcool 26 (38 nmol) avec un rendement pondéral de 86%.
Les analyses effectuées pour confirmer la structure du produit obtenu 26 sont
présentées ci-dessous
CCM
Rf = 0,44 ; cyclohexane / acétate d' éthyle 8/2
Données RMN
RMN 19F (282 MHz, solvant : chloroforme deutéré (CDCl3))
- 110.68, dm, 2JF_F=259.7 Hz, JF_H non mesurable ; -117.8, dm, 2JF_F=259.7 Hz,
JF_H non mesurable
RMN 1H (300 MHz, solvant : chloroforme deutéré (CDCl3))
0.00, s, 6H (2x CH3 TBDMS) ; 0.84, s, 9H (3x CH3 TBDMS) ; 3.39-4.96, m,
15H ; 7.23-7.33, m, 15H (3x SCH Ph)
RMN 13C (75.5 MHz, solvant : chloroforme deutéré (CDC13)) - DEPT 135
-5.04 et -5.09 , 2CH3 (TBDMS) ; 26.25, 3 CH3 (TBDMS) ; 62.37, CHZ (C6) ;
64.16, CH2, t , 2Jc_F=31 Hz (CFZCHZOH) ; 73.23 , 74.87 et 75.64, 3x CH2
(OBn) ; 73.45 , 74.80 , 79.52 et 84.81 , 4x CH (C2 à CS) ; 78.15, CH, dd, 2Jc_
F=26 et 29 Hz ; 128.1-128.9, 3x 5 CH (OBn).