Note: Descriptions are shown in the official language in which they were submitted.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
PROCEDE D'OBTENTION D'UN HOMOPOLYMERE DU BUTADIENE
EN PRESENCE DE MONO-OLEFINE(S) A 4 ATOMES DE CARBONE
La présente invention concerne un procédé d'obtention d'un homopolymère du
butadiène-1,3
en présence d'une ou plusieurs mono-oléfine(s) de 4 atomes de carbone, par
exemple à partir d'une
coupe C4 de vapocraquage de naphta, cet homopolymère présentant des
caractéristiques de
microstructure et de macrostructure le rendant adapté pour être utilisé dans
des bandes de roulement
de pneumatique.
Les coupes C4 de vapocraquage de naphta contiennent essentiellement, selon une
fraction
massique typiquement comprise entre 20 et 50 %, du butadiène-1,3 et, selon une
fraction massique
comprise entre 70 et 40 %, des mono-oléfines comprenant du butène-1, du butène-
2 et de l'isobutène.
Selon que le vapocraquage de naphta est de type à basse sévérité (i.e.
réalisé à une
température inférieure à 800 C avec un temps de séjour de l'ordre d'une
seconde) ou bien à haute
sévérité (i.e. réalisé à une température atteignant près de 900 C avec un
temps de séjour de l'ordre
d'une demi-seconde), on obtient une coupe C4 présentant une fraction massique
de butadiène-1,3 qui
est respectivement plus réduite ou plus élevée, en proportion de la fraction
massique des mono-
oléfines.
En vue de procéder à la polymérisation sélective du butadiène-1,3 avec une
activité élevée à
partir d'une coupe C4 de vapocraquage de naphta, on procède en général à un
enrichissement de cette
coupe en butadiène-1,3 pour que celui-ci soit présent dans la coupe enrichie
selon une fraction
massique proche de 100 %. En effet, il s'avère que les mono-oléfines précitées
nuisent au rendement
de la réaction de polymérisation du butadiène-1,3.
Cet enrichissement de la coupe C4 présente l'inconvénient de nécessiter la
mise en oeuvre d'un
procédé de séparation complexe et, par conséquent, d'impliquer un coût
opératoire relativement élevé
en vue de l'homopolymérisation du butadiène-1,3.
C'est la raison pour laquelle on a cherché par le passé à polymériser
sélectivement le
butadiène-1,3 à partir d'une coupe C4 non enrichie, i.e. contenant du
butadiène-1,3 selon une fraction
massique inférieure ou égale à 50 %.
Le document de brevet américain US-A-3 066 128 présente un procédé de
polymérisation
sélective du butadiène à partir d'une coupe C4 de vapocraquage de naphta, qui
consiste à utiliser un
système catalytique à base d'un halogénure de cobalt ou de nickel et d'un
agent d'activation par
exemple constitué d'un alkylaluminium ou d'un chlorure d'alkylaluminium.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
2
Le document de brevet français FR-A-2 496 673 présente un autre procédé de
polymérisation
sélective du butadiène à partir d'une coupe C4 de vapocraquage de naphta, qui
consiste à utiliser à un
système catalytique à base d'un initiateur lithié.
Un inconvénient majeur de ces procédés de polymérisation sélective réside dans
les
rendements de polymérisation réduits en présence de mono-oléfines que leur
confèrent ces systèmes
catalytiques.
Le but de la présente invention est de remédier à cet inconvénient, et il est
atteint en ce que les
demanderesses ont découvert d'une manière inattendue qu'un système catalytique
à base d'au moins
- un monomère diène conjugué,
- un sel d'un ou plusieurs métaux de terre rare (métaux ayant un numéro
atomique compris
entre 57 et 71 dans le tableau périodique des éléments de Mendeleev) d'un
acide phosphorique
organique, ledit sel étant en suspension dans au moins un solvant hydrocarboné
inerte, saturé et de
type aliphatique ou alicyclique qui est compris dans ledit système
catalytique,
- un agent d'alkylation constitué d'un alkylaluminium de formule A1R3 ou
HA1R2i où R est un
groupe alkyl, et
- un donneur d'halogène constitué d'un halogénure d'alkylaluminium,
permet la polymérisation sélective du butadiène-1,3, en présence d'une ou
plusieurs mono-
oléfine(s) de 4 atomes de carbone, avec une activité catalytique élevée qui
est analogue à celle relative
à l'homopolymérisation du butadiène-1,3 en l'absence de mono-oléfine au moyen
du même système
catalytique, pour l'obtention d'un polybutadiène présentant des
caractéristiques de microstructure et de
macrostructure qui sont très proches de celles présentées par un polybutadiène
obtenu en l'absence de
mono-oléfine au moyen dudit système catalytique.
De préférence, cette polymérisation est réalisée à une température allant de
25 C à 100 C.
On notera que le procédé de polymérisation selon l'invention permet d'obtenir
avec une
activité élevée des polybutadiènes présentant des taux d'enchaînements cis-
1,4, mesurés selon la
technique de dosage par proche infrarouge (technique NIR , voir annexe 1),
qui sont supérieurs à
95,0 %, ainsi que des viscosités inhérentes, mesurées à 25 C à une
concentration de 0,1 g/dl dans le
toluène (voir annexe 3 pour la méthode de mesure), qui sont par exemple
supérieures à 2 dl/g et, à titre
encore plus avantageux, qui sont supérieures à 3 dl/g.
Avantageusement, le rapport molaire (agent d'alkylation/ sel de terre rare)
qui caractérise ledit
système catalytique présente une valeur allant de 1 à 15, pour l'obtention de
polybutadiènes avec une
activité catalytique améliorée qui présentent des taux d'enchaînements cis-
1,4, mesurés par cette
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
3
technique de dosage par proche infrarouge, qui peuvent être supérieurs à 97,0
%. Plus
avantageusement, ledit rapport molaire présente une valeur allant de 1 à 10,
en particulier de 1 à 5.
D'une manière générale, on notera également que les systèmes catalytiques
selon l'invention
permettent d'obtenir, en présence de ladite ou desdites mono-oléfine(s), des
polybutadiènes présentant
un indice de polydispersité Ip, mesuré par la technique de chromatographie
d'exclusion par la taille
(voir annexe 2), qui est inférieur à 2.
Ces caractéristiques combinées de viscosité inhérente supérieure à 2 et
d'indice Ip inférieur à 2
rendent les polybutadiènes obtenus par le procédé selon l'invention
particulièrement bien adaptés pour
être utilisés dans des bandes de roulement de pneumatique.
Avantageusement, le rapport massique (mono-oléfine(s)/ butadiène-1,3) est égal
ou supérieur
à 50 %. A titre encore plus avantageux, ce rapport massique est égal ou
supérieur à 100 % et, à titre
encore plus avantageux, ledit rapport massique est égal ou supérieur à 150 %.
Selon une autre caractéristique de l'invention, ladite ou lesdites mono-
oléfine(s) comprennent
le butène-1 et/ou le butène-2 et/ou l'isobutène.
Selon un exemple avantageux de réalisation de l'invention, le procédé
d'obtention selon
l'invention d'un homopolymère du butadiène-1,3 comprend la réaction dudit
système catalytique en
présence d'une coupe C4 de vapocraquage de naphta contenant, selon une
fraction massique comprise
entre 20 et 50 %, le butadiène-1,3 et, selon une fraction massique comprise
entre 70 et 40 %, des
mono-oléfines comprenant notamment du butène-1 et du butène-2.
De préférence, dans ledit système catalytique, ledit sel de terre rare est un
tris[bis(2-
éthylhexyl)phosphate] de terre(s) rare(s) et, à titre encore plus
préférentiel, ce sel de terre rare est le
tris[bis(2-éthylhexyl)phosphate] de néodyme.
Egalement à titre préférentiel, ce système catalytique comprenant le ou les
métaux de terre
rare selon une concentration égale ou supérieure à 0,005 mol/I et, à titre
encore plus préférentiel, selon
une concentration appartenant à un domaine allant de 0,0 10 mol/] à 0,060
mol/l.
A titre d'agent d'alkylation utilisable dans le système catalytique selon
l'invention, on peut
citer des alkylaluminiums tels que:
- des trialkylaluminiums, par exemple le triisobutylaluminium, ou
- des hydrures de dialkylaluminium, par exemple l'hydrure de
diisobutylaluminium.
On notera que cet agent d'alkylation est de préférence constitué de l'hydrure
de
diisobutylaluminium (appelé HDiBA dans la suite de la présente description).
CA 02506181 2010-12-06
4
A titre de donneur d'halogène utilisable dans le système catalytique selon
l'invention, on utilise de préférence des monohalogénures d'alkylaluminium et,
à titre
encore plus préférentiel, le chlorure de diéthylaluminium (appelé CDEA dans la
suite de la présente description).
De préférence, dans ledit système catalytique, le rapport molaire (donneur
d'halogène/sel de terre rare) appartient à un domaine allant de 2,0 à 3,5.
De préférence, dans ledit système catalytique, le rapport molaire (monomère
diène conjugué/sel) appartient à un domaine allant de 15 à 70.
De préférence, dans ledit système catalytique, ledit monomère diène
conjugué est le butadiène.
A titre de monomère diène conjugué utilisable pour préformer le système
catalytique selon l'invention, on utilise à titre préférentiel le 1,3-
butadiène.
On peut également citer le 2-méthyl 1, 3-butadiène (ou isoprène), les 2,3-di
(alcoyle en CI à C5) 1,3-butadiène tels que par exemple le 2,3 diméthyl-1, 3-
butadiène, le 2, 3-diéthyl-1, 3-butadiène, le 2-méthyl 3-éthyl 1,3-butadiène,
le 2-
méthyl 3-isopropyl 1,3-butadiène, le phényl 1,3-butadiène, le 1,3-pentadiène,
le 2,4-
hexadiène, ou tout autre diène conjugué ayant entre 4 et 8 atomes de carbone.
Selon une autre caractéristique de l'invention, ledit sel de terre rare est
constitué d'une poudre non hygroscopique ayant une légère tendance à
s'agglomérer à la température ambiante.
Selon un mode préférentiel de réalisation de l'invention, le solvant
hydrocarboné inerte dans lequel ledit sel de terre rare est en suspension est
un
solvant aliphatique ou alicyclique de bas poids moléculaire, tel que le
cyclohexane,
le méthylcyclohexane, le n-heptane, ou un mélange de ces solvants.
Selon un autre mode de réalisation de l'invention, le solvant utilisé pour la
suspension du sel de terre rare est un mélange d'un solvant aliphatique de
haut
poids moléculaire comprenant une huile paraffinique, par exemple de l'huile de
Vaseline*, et d'un solvant de bas poids moléculaire tel que ceux susmentionnés
(par
exemple le méthylcyclohexane).
* (marque de commerce)
CA 02506181 2010-12-06
4a
On réalise cette suspension en procédant à un broyage dispersif du sel de
terre rare dans cette huile paraffinique, de sorte à obtenir une suspension
très fine
et homogène du sel.
Selon l'invention, le procédé de préparation dudit système catalytique
consiste:
- dans une première étape, à réaliser une suspension dudit sel de terre rare
dans ledit solvant,
- dans une seconde étape, à ajouter à la suspension ledit monomère diène
conjugué,
- dans une troisième étape, à ajouter ledit agent d'alkylation à la suspension
comprenant ledit monomère pour l'obtention d'un sel alkylé, et
- dans une quatrième étape, à ajouter ledit donneur d'halogène au sel alkylé.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
Les caractéristiques précitées de la présente invention, ainsi que d'autres,
seront mieux
comprises. à la lecture de la description suivante de plusieurs exemples de
réalisation de l'invention,
donnés à titre illustratif et non limitatif, ladite description étant réalisée
en relation avec les dessins
joints, dans lesquels :
5 - la Fig. 1 est un graphique illustrant l'évolution du taux de conversion
(%) du butadiène-1,3
en polybutadiène en fonction du temps (min.), d'une part, pour un premier
essai de polymérisation
témoin réalisé en l'absence de mono-oléfine et, d'autre part, pour un
premier essai de
polymérisation selon l'invention réalisé en présence de butène-1 à titre de
mono-oléfine ;
- la Fig. 2 est un graphique illustrant l'évolution du taux de conversion (%)
du butadiène-1,3
en polybutadiène en fonction du temps (min), d'une part, pour un second essai
de polymérisation
témoin réalisé en l'absence de mono-oléfine et, d'autre part, pour un second
essai de
polymérisation selon l'invention réalisé en présence de butène-2 à titre de
mono-oléfine
- la Fig. 3 est un graphique illustrant l'évolution du taux de conversion (%)
du butadiène-1,3
en polybutadiène en fonction du temps (min), d'une part, pour un troisième
essai de polymérisation
témoin réalisé en l'absence de mono-oléfine et, d'autre part, pour un
troisième essai de
polymérisation selon l'invention réalisé en présence d'isobutène à titre de
mono-oléfine ;
- la Fig. 4 est un graphique illustrant l'évolution du taux de conversion (%)
du butadiène-1,3
en polybutadiène en fonction du temps (min), d'une part, pour un quatrième
essai de polymérisation
témoin réalisé en l'absence de mono-oléfine et, d'autre part, pour un
quatrième essai de
polymérisation selon l'invention réalisé en présence de butène-1 à titre de
mono-oléfine ;
- la Fig. 5 est un graphique illustrant l'évolution du taux de conversion (%)
du butadiène-1,3
en polybutadiène en fonction du temps (min), d'une part, pour un cinquième
essai de polymérisation
témoin réalisé en l'absence de mono-oléfine et, d'autre part, pour un
cinquième essai de
polymérisation selon l'invention réalisé en présence de butène-1 et de butène-
2 à titre de mono-
oléfine, et
-la Fig. 6 est un graphique illustrant l'évolution du taux de conversion (%)
du butadiène-1,3
en polybutadiène en fonction du temps (min), d'une part, pour un sixième essai
de polymérisation
témoin réalisé en l'absence de mono-oléfine et, d'autre part, pour un sixième
essai de
polymérisation selon l'invention réalisé en présence de butène-2 à titre de
mono-oléfine.
I. Préparation d'un système catalytique selon l'invention :
a) Synthèse d'une solution aqueuse de néodyme NdCli, 6H2O :
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
6
Dans un réacteur, on pèse 0,864 kg de Nd203 soit 5,10 moles de Nd.
On ajoute 27 kg d'eau déminéralisée. On ajoute lentement, à température
ambiante, 1,35 1
d'HCI concentré à 36 % en poids (d = 1,18).
La réaction Nd203 + 6 HCI + 9 H2O -> 2 NdC13, 6H2O est très exothermique.
Lorsque tout l'acide chlorhydrique a été ajouté, on porte la solution à
ébullition sous agitation
pendant 30 minutes, pour éliminer l'excès d'acide chlorhydrique. La solution
aqueuse de NdC13 est
limpide et de couleur mauve. Il ne reste pas de produit insoluble (Nd203).
Le pH de la solution, mesuré à 25 C, est corrigé par ajout d'environ 0,55 1
de soude à 2 moles par
litre. Le pH final est pratiquement égal à 4,5.
b) Synthèse d'un phosphate organique de sodium de formule [RO12P O ONa
(R=2-éthylhexyl):
Dans un réacteur contenant 24 kg d'eau déminéralisée, on dissout 0,612 kg de
NaOH en
pastilles, soit 15,3 mol. Dans un autre réacteur contenant 9 1 d'acétone, on
dissout 5,028 kg d'un acide
phosphorique organique (l'acide bis(2-éthylhexyl) phosphorique, répertorié
dans l'ouvrage Aldrich
sous la référence 23,782-5), soit 15,61 mol de cet acide.
A température ambiante, on verse la solution dudit acide phosphorique
organique dans la
solution de NaOH. La réaction est la suivante :
[RO]2P(O)OH + NaOH -> [RO]2P(O)ONa + H20-
Elle est légèrement exothermique, et l'on obtient une solution homogène
limpide. Le pH de la
solution, mesuré à 25 C, est égal à 5,4.
c) Synthèse d'un sel phosphaté de néodyme de formule f[ROI2P O O 2b[
d:
On verse sous vive agitation et à température de 36 C la solution aqueuse de
NdCl3i6H2O
obtenue au paragraphe a) ci-dessus sur la solution de phosphate organique de
Na obtenue au
paragraphe b) ci-dessus.
Il se forme immédiatement un précipité blanc très fin. On maintient le mélange
obtenu sous
agitation pendant 15 minutes, après l'addition de toute la solution aqueuse de
Nd C13,6H2O :
3 [RO]2P(O)ONa + NdC13,6H2O -* Nd[OP(O)[OR]2]3 + 3 NaCI + 6 H20-
On récupère par sédimentation le sel phosphaté de néodyme ainsi obtenu et on
le lave avec un
mélange de 45 litres d'eau déminéralisée et 15 litres d'acétone pendant 15
minutes. Le sel phosphaté
de néodyme est ensuite récupéré par centrifugation.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
7
Le pH des eaux mères est compris entre 3 et 4 à 25 C. Ces eaux mères
sont incolores
et limpides. Sur la dernière eau de lavage, le test analytique qualitatif des
chlorures est quasi-négatif
(la réaction est: NaCI + AgNO3 (milieu HNO3) - AgCI 1 + NaNO3).
On sèche le sel de néodyme ainsi lavé dans une étuve à 60 C, sous vide et
avec courant
d'azote pendant 72 heures.
Il est à noter que les étapes b) et c) décrites ci-dessus peuvent être
réalisées sans utilisation
d'acétone.
Les teneurs massiques en néodyme, déterminées à la fois par la technique de
titrage
complexométrique en retour par l'acide éthylène diamine tétracétique (EDTA) et
par la technique de
spectrométrie d'émission atomique couplée à un plasma induit (ICP/AES), sont
sensiblement
comprises entre 12,5 % et 12,8 % (pour un taux théorique 2 de 13,01 %, avec t
= [144,24 / 1108,50] x
100, où 144,24 g/mol = masse molaire du néodyme).
Pour chacune de ces deux techniques, les mesures de teneur en néodyme ont été
effectuées
après minéralisation acide du sel par voie humide, soit sur bain de sable en
système ouvert, soit en
micro-ondes en système fermé.
La technique de titrage complexométrique par dEDTA en retour consiste en un
titrage en
retour avec complexation du néodyme, par un excès d'EDTA (l'acide éthylène
diamine tétracétique),
dans lequel on dose dEDTA en excès à pH=4,6 par du sulfate de zinc.
On a utilisé un indicateur coloré avec détection photométrique du point
d'équivalence.
La technique de spectrométrie d'émission atomique couplée à un plasma induit
est une
technique d'analyse élémentaire basée sur l'observation des raies émises par
des atomes parvenus dans
un état excité au sein d'un plasma.
Les raies d'émission qui ont été utilisées pour l'analyse du néodyme
correspondent à des
longueurs d'onde de 406,109 nm et 401,225 nm.
Pour mettre en oeuvre cette technique de spectrométrie, on a réalisé un
étalonnage préalable
avec des sels témoin de néodyme présentant une teneur connue en néodyme.
Le tableau ci-après rend compte des teneurs en Nd obtenues au moyen de ces
deux techniques
(le nombre d'essais réalisés sur chaque échantillon de sel figure entre
parenthèses).
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
8
Échantillons de sels analysés Taux de Nd en % Taux de Nd en % Ecart relatif
entre les 2
obtenus par titrage obtenus par ICP/AES techniques
com lexométri ue
sel phosphaté de Nd 12,8 (9) 12,8 (3) 0%
RO 2P O O 3Nd
sel phosphaté de Nd 12,8(4) 12,6(3) 1,6%
RO]2P O O 3Nd
sel phosphaté de Nd 12,7 (6) 12,2 (4) 4%
RO 2P 0 0 3Nd
sel phosphaté de Nd 12,6 (6) 12,5 (4) 0,8 %
RO2PO03Nd
Acétyl acétonate de Nd 31,7 (6) 32,4 (4) 2,2 %
témoin
Oxalate de Nd 37,7(3) 38,0(3) 0,8 %
témoin
Les résultats obtenus par les deux techniques sont comparables (écart relatif
< 4%).
2) Synthèse du système catalytique selon l'invention à partir dudit sel
a) Composition de ce système cataltique :
Le système catalytique selon l'invention comprend un sel phosphaté de néodyme
tel que
synthétisé selon le paragraphe 1) ci-dessus, qui est en suspension dans un
solvant hydrocarboné inerte
de bas poids moléculaire (constitué de méthylcyclohexane, MCH en abrégé ci-
après). Ce système
catalytique comprend le néodyme selon une concentration de 0,02 M, et il est
caractérisé par les
rapports molaires relatifs suivants, par rapport au sel de néodyme :
- Sel de Nd / butadiène (Bd ci-après) / HDiBA / CDEA = 1 / 50 / 4 / 3 (nommé
catalyseur
4 dans la suite de la présente description) pour les témoins T1 et T2 et les
exemples de l'invention Il
;
et 12
- Sel de Nd / Bd / HDiBA / CDEA = 1 / 50 / 6 / 3 (nommé catalyseur 6 dans
la suite de la
;
description) pour les témoins T3 à T5 et les exemples de l'invention 13 à 15
- Sel de Nd / Bd / HDiBA / CDEA = 1 / 50 / 10 / 3 (nommé catalyseur 10 dans
la suite de
la description) pour le témoin T6 et l'exemple de l'invention 16.
b) Procédé de synthèse de ce système catalytique :
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
9
Première étape
On verse 15,6 g du sel de néodyme, à l'état de poudre, dans un réacteur de 1
litre
préalablement nettoyé de ses impuretés. On soumet ensuite ce sel à un
barbotage à l'azote par le fond
du réacteur pendant 15 minutes.
Seconde étape
Le sel de néodyme est mis en contact avec 448 ml de MCH à 30 C pendant 30
minutes.
Troisième étape
On introduit ensuite 38 g de butadiène à une température de 30 C.
Quatrième étape
On introduit ensuite 63 ml d'une solution 0,898 M d'HDiBA dans le MCH et on
rince la
tuyauterie avec 37 ml de MCH. L'ensemble est agité 15 minutes à 30 C.
Cinquième étape
On introduit dans le réacteur 44 ml de chlorure de diéthyaluminium à une
concentration
0,9682 M dans le MCH et on rince la tuyauterie avec 35 ml de MCH. On procède à
une préformation
du mélange ainsi obtenu à une température de 60 C pendant une durée (comptée
à partir de l'injection
du CDEA) qui est soit de 60 min pour le catalyseur 10 , soit de 120 min pour
les catalyseur 4 et
catalyseur 6 .
Sixième étape
On obtient ainsi environ 700 ml d'une solution de système catalytique. On
procède à la
vidange du réacteur et l'on transfère cette solution dans une bouteille
Steinie de 750 ml,
préalablement lavée, séchée et soumise à un barbotage d'azote.
On stocke finalement la solution catalytique sous atmosphère d'azote dans un
congélateur, à la
température de -15 C.
II. Essais de polymérisation du butadiène en l'absence ou en présence de mono-
oléfines :
On utilise à titre de réacteur de polymérisation une bouteille Steinie de
250 ml,
préalablement lavée et séchée. Les polymérisations sont réalisées à 50 C
pendant une durée variable.
Pour chaque polymérisation, on introduit dans cette bouteille Steinie du
cyclohexane que l'on
barbote 10 minutes à l'azote pour éliminer les impuretés, 5 ml de butadiène,
une quantité variable de
butène-1 ou de butène-2 ou d'isobutène (voir 1), 2), 3) et 4) ci-après) puis
une quantité variable du
système catalytique préparé suivant le I. ci-dessus.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
Le butène-1, le butène-2 et l'isobutène proviennent de la société Aldrich
(répertoriés
respectivement sous les références 29,505-1 ; 36,335-9 et 29,546-9). Tous ces
butènes ont été passés
sur alumine pour éliminer les impuretés.
Le rapport massique S/M (solvant cyclohexane / monomère butadiène-1,3) est
compris selon
5 les essais entre 8,3 et 12,6. Pour pouvoir comparer les essais entre eux
nous nous sommes placés dans
des conditions qui sont telles que le rapport volumique (volume de butadiène/
(volume de cyclohexane
+ volume de butène)) est constant.
La quantité de base catalytique en néodyme varie de 173 pmol à 432,9 mol pour
100 g de
butadiène, suivant l'essai réalisé.
10 Une fois chaque polymérisation terminée, on stoppe avec 1 ml
d'acétylacétone puis on ajoute
0,4 ml (pour les essais N 1 et N 2) ou 1 ml (pour les essais suivants)
d'antioxydant (N-1,3-
diméthylbutyl-N'-phényl-p-phénylènediamine) à une concentration de 20 g/l dans
le toluène.
La mesure du taux de conversion du butadiène-1,3 en polybutadiène en fonction
du temps
décrit la cinétique de polymérisation pour chaque essai.
L'indice de polydispersité Ip (voir annexe 2 jointe) et la viscosité inhérente
à 0,1 g/dl dans le
toluène, mesurée à 25 C (voir annexe 3 jointe), caractérisent la
macrostructure de chaque
polybutadiène obtenu.
1) Essais (N 1) Ti et Il d'homopolymérisation du butadiène-1,3 en présence de
butène-1
avec un catalyseur 4 :
Le tableau 1 ci-après mentionne les conditions de polymérisation suivies,
d'une part, pour un
premier essai témoin Ti dans lequel le milieu de polymérisation est
dépourvu de mono-oléfine et,
d'autre part, pour un premier essai selon l'invention Il dans lequel le milieu
de polymérisation
comprend du butène-1 à titre de mono-oléfine.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
11
Tableau 1 :
Conditions de polymérisation Polybutadiènes obtenus
Volume de Quantité Butène-1 / Durée Taux de Ip Microstructure Viscosité
système néodyme butadiène-1,3 de conversion inhérente
Essais catalytique ( mol de (rapport polym. (%) (dl/g)
(ml) Nd /100g massique, %) (min.) cis-1,4 1,2
de Bd) (%) (%)
1e' Essai 0,5 309,2 0 5 38,7
témoin Ti 10 72,3
S/M =12,6 15 88,1 2,97
(massique) 40 100 1,80 97,1 0 3,13
1" Essai 0,64 395,8 153 5 34,3
Invention Il 10 65,9
S/M = 10,7 15 82,7 3,11
(massique) 40 100 1,91 98,1 0 3,16
Ces résultats montrent, comme cela est visible à la Fig. 1, qu'un système
catalytique selon
l'invention, qui comprend ledit monomère diène conjugué, ledit sel de terre
rare d'un acide
phosphorique organique en suspension dans ledit solvant hydrocarboné inerte et
saturé, ledit agent
d'alkylation et ledit donneur d'halogène, permet d'homopolymériser le
butadiène-1,3 en présence de
butène-1 selon un rapport massique (butène-1/ butadiène-1,3) supérieur à 150
%, avec une activité
catalytique élevée analogue à celle relative à l'homopolymérisation du
butadiène-1,3 en l'absence de
butène-1 au moyen du même système catalytique (voir la similitude des courbes
de cinétique de
polymérisation des essais Il et Ti), pour l'obtention d'un polybutadiène
présentant des
caractéristiques de microstructure et de macrostructure très proches de celles
présentées par le
polybutadiène témoin de l'essai TI.
On notera que le taux d'enchaînements cis-1,4 dans le polybutadiène de l'essai
Il est proche
de celui du polybutadiène de l'essai Ti, ces taux étant tous deux supérieurs à
97,0 %.
On notera également que la viscosité inhérente du polybutadiène de l'essai Il
est très proche
de celle du polybutadiène de l'essai Ti, ces viscosités étant toutes deux
supérieures à 3,0 dl/g, et que
l'indice de polydispersité Ip du polybutadiène de l'essai Il est inférieur à
2,0, à l'instar de l'indice Ip
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
12
du polybutadiène de l'essai T1, ces caractéristiques rendant le polybutadiène
de l'essai II adapté pour
être utilisé dans des bandes de roulement de pneumatique tout comme le
polybutadiène de l'essai TI.
2) Essais (N 2) T2 et 12 d'homopolymérisation du butadiène-1,3 en présence de
butène-2
avec un catalyseur 4 :
Le tableau 2 ci-après mentionne les conditions de polymérisation suivies,
d'une part, pour un
second essai témoin T2 dans lequel le milieu de polymérisation est
dépourvu de mono-oléfine et,
d'autre part, pour un second essai selon l'invention 12 dans lequel le milieu
de polymérisation
comprend du butène-2 à titre de mono-oléfine.
Tableau 2
Conditions de polymérisation Polybutadiènes obtenus
Volume de Quantité Butène-2 / Durée Taux de Ip Microstructur Viscosité
système néodyme butadiène-1,3 de conversion e inhérente
Essais catalytique ( mol de (rapport polym. (%) (dl/g)
(ml) Nd /100g massique, %) (min.) cis-1,4 1,2
de Bd) (%) (%)
2ème Essai 0,7 432,9 0 5 50,5
témoin T2 10 87,1 1,69 97,6 0
S/M =11,9 15 97,5 1,72 97,0 0 2,44
(massique) 40 100 1,73 95,8 0 2,55
2 me Essai 0,7 432,9 74 5 50,7
Invention 12 10 86,7 1,73 97,5 0
S/M = 10,7 40 100 1,75 95,6 0 2,57
(massique)
Ces résultats montrent, comme cela est visible à la Fig. 2, que ledit système
catalytique selon
l'invention permet d'homopolymériser le butadiène-1,3 en présence de butène-2
selon un rapport
massique (butène-l/ butadiène-1,3) supérieur à 50 %, avec une activité
catalytique élevée analogue à
celle relative à l'homopolymérisation du butadiène-1,3 en l'absence de butène-
2 au moyen du même
système catalytique (voir la similitude des courbes de cinétique de
polymérisation des essais 12 et T2),
pour l'obtention d'un polybutadiène présentant des caractéristiques de
microstructure et de
CA 02506181 2005-05-13
13
macrostructure très proches de celles présentées par le polybutadiène témoin
de l'essai T2 (voir
notamment le taux d'enchaînements cis-1,4, la viscosité inhérente et l'indice
de polydispersité Ip).
Ces caractéristiques rendent également le polybutadiène de l'essai 12 adapté
pour être utilisé
dans des bandes de roulement de pneumatique, à l'instar du polybutadiène de
l'essai T2.
3) Essais (N 3) T3 et 13 d'homopolymérisation du butadiène-1.3 en présence
d'isobutène avec un catalyseur 6 :
Le tableau 3 ci-après mentionne les conditions de polymérisation
suivies, d'une part, pour un troisième essai témoin T3 dans lequel le milieu
de
polymérisation est dépourvu de mono-oléfine et, d'autre part, pour un
troisième
essai selon l'invention 13 dans lequel le milieu de polymérisation comprend de
l'isobutène à titre de mono-oléfine.
Tableau 3:
Conditions de polymérisation Polybutadiènes obtenus
Volume de Quantité Isobutène/ Durée Taux de [p Microstructure Viscosité
système néodyme butadiène-1,3 de conversion inhérente
Essais catalytique ( mol de (rapport polym. (%) (dl/g)
(ml) Nd /100g massique, %) (min.) cis-1,4 1,2
de Bd) (%) (%)
3 ""'Essai 0,46 284 0 10 39,4
témoin T3 20 74,8
S/M =11,6 40 94,9 1.77 > 97,4 < 0,8 2,72
(massique) 90 100 1,86 97.9 < 0,8 2,86
3 me Essai 0,52 322 144 10 48,3
Invention 13 20 83,0
S/M = 9,8 40 95,4 1,66 97.8 < 0,8 2,72
(massique) 90 100 1,84 97.2 < 0,8 2,80
Ces résultats montrent, comme cela est visible à la Fig. 3, qu'un système
catalytique selon
l'invention, qui comprend ledit monomère diène conjugué, ledit sel de terre
rare d'un acide
phosphorique organique en suspension dans ledit solvant hydrocarboné inerte et
saturé, ledit agent
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
14
d'alkylation avec un rapport molaire (agent d'alkylation/ sel de terre rare)
égal à 6 et ledit donneur
d'halogène, permet d'homopolymériser le butadiène-1,3 en présence d'isobutène
selon un rapport
massique (isobutène/ butadiène-1,3) supérieur à 100 %, avec une activité
catalytique élevée analogue à
celle relative à l'homopolymérisation du butadiène-1,3 en l'absence
d'isobutène au moyen du même
système catalytique (voir la similitude des courbes de cinétique de
polymérisation des essais 13 et T3),
pour l'obtention d'un polybutadiène présentant des caractéristiques de
microstructure et de
macrostructure très proches de celles présentées par le polybutadiène témoin
de l'essai T3.
On notera que le taux d'enchaînements cis-1,4 dans le polybutadiène de l'essai
I3 est proche
de celui du polybutadiène de l'essai T3, ces taux étant tous deux supérieurs à
97,0 %.
On notera également que la viscosité inhérente du polybutadiène de l'essai I3
est très proche
de celle du polybutadiène de l'essai T3, ces viscosités étant toutes deux
supérieures ou égales à 2,8
dl/g, et que l'indice de polydispersité Ip du polybutadiène de l'essai 13 est
inférieur à 2,0, à l'instar de
l'indice Ip du polybutadiène de l'essai T3, ces caractéristiques rendant le
polybutadiène de l'essai 13
adapté pour être utilisé dans des bandes de roulement de pneumatique tout
comme le polybutadiène de
l'essai T3.
4) Essais (N 4) T4 et 14 d'homopolymérisation du butadiène-1,3 en présence de
butène-
1 avec un catalyseur 6 :
Le tableau 4 ci-après mentionne les conditions de polymérisation suivies,
d'une part, pour un
quatrième essai témoin T4 dans lequel le milieu de polymérisation est
dépourvu de mono-oléfine
et, d'autre part, pour un quatrième essai selon l'invention 14 dans lequel le
milieu de polymérisation
comprend du butène-1 à titre de mono-oléfine.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
Tableau 4
Conditions de polymérisation Polybutadiènes obtenus
Volume de Quantité Butène-1 / Durée Taux de Ip Microstructure Viscosité
système néodyme butadiène-1,3 de conversion inhérente
Essais catalytique ( mol de (rapport polym. (%) (dl/g)
(ml) Nd /100g massique, %) (min.) cis-1,4 1,2
de Bd) (%) (%)
4 m` Essai 0,4 247 0 10 40,0
témoin T4 20 74,8
S/M = 11,8 40 91,9 1,96 > 97,4 < 0,8 3,11
(massique) 90 100 2,03 > 97,4 < 0,8 3,16
4 ` Essai 0,58 359 300 10 51,8
Invention 14 20 80,2
S/M = 8,3 40 98,7 2,14 > 97,4 < 0,8 3,10
(massique) 90 100 2,14 > 97,4 < 0,8 3,15
5 Ces résultats montrent, comme cela est visible à la Fig. 4, que ledit
système catalytique, de
rapport molaire (agent d'alkylation/ sel de terre rare) égal à 6, selon
l'invention permet
d'homopolymériser le butadiène-1,3 en présence de butène-1 selon un rapport
massique (butène-1/
butadiène-1,3) de 300 %, avec une activité catalytique élevée analogue à celle
relative à
l'homopolymérisation du butadiène-1,3 en l'absence de butène-1 au moyen du
même système
10 catalytique (voir la similitude des courbes de cinétique de polymérisation
des essais 14 et T4), pour
l'obtention d'un polybutadiène présentant des caractéristiques de
microstructure et de macrostructure
très proches de celles présentées par le polybutadiène témoin de l'essai
T4 (voir notamment le
taux d'enchaînements cis-1,4, la viscosité inhérente et l'indice de
polydispersité).
Ces caractéristiques rendent également le polybutadiène de l'essai 14 adapté
pour être utilisé
15 dans des bandes de roulement de pneumatique, à l'instar du polybutadiène de
l'essai T4.
5) Essais (N 5) T5 et 15 d'homopolymérisation du butadiène-1,3 en présence de
butène-
1 et de butène-2 avec un catalyseur 6 :
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
16
Le tableau 5 ci-après mentionne les conditions de polymérisation suivies,
d'une part, pour un
cinquième essai témoin T5 dans lequel le milieu de polymérisation est
dépourvu de mono-oléfine
et, d'autre part, pour un cinquième essai selon l'invention 15 dans lequel le
milieu de polymérisation
comprend du butène-1 et du butène-2 à titre de mono-oléfine. Le rapport butène-
1 et du butène-2 est
égal à 1.
Tableau 5:
Conditions de polymérisation Polybutadiènes obtenus
Volume de Quantité (Butène-1+ Durée Taux de Ip Microstructure Viscosité
système néodyme Butène-2) / de conversion inhérente
Essais catalytique (pmol de butadiène-1,3 polym. (%) (dl/g)
(ml) Nd /100g (rapport (min.) cis-1,4 1,2
de Bd) massique, %) (%) (%)
5 me Essai 0,46 284 0 10 42,2
témoin T5 20 77,6
S/M = 12,0 40 91,4 1,92 > 97,4 < 0,8 2,85
(massique) 90 100 1,98 98.2 < 0,8 2,96
Sème Essai 0,55 340 222 10 49,0
Invention 15 20 82,8
S/M = 9,2 40 99,3 1,5 > 97,4 < 0,8 2,87
(massique) 90 100 1,96 98.0 < 0,8 2,98
Ces résultats montrent, comme cela est visible à la Fig. 5, que ledit système
catalytique, de
rapport molaire (agent d'alkylation/ sel de terre rare) égal à 6, selon
l'invention permet
d'homopolymériser le butadiène-1,3 en présence de butène-1 et de butène-2
selon un rapport massique
((butène-1+ butène-2) / butadiène-1,3) supérieur à 200 %, avec une activité
catalytique élevée
analogue à celle relative à l'homopolymérisation du butadiène-1,3 en l'absence
de butène-1 et de
butène-2 au moyen du même système catalytique (voir la similitude des courbes
de cinétique de
polymérisation des essais 15 et T5), pour l'obtention d'un polybutadiène
présentant des
caractéristiques de microstructure et de macrostructure très proches de celles
présentées par le
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
17
polybutadiène témoin de l'essai T5 (voir notamment le taux d'enchaînements
cis-1,4, la viscosité
inhérente et l'indice de polydispersité).
Ces caractéristiques rendent également le polybutadiène de l'essai 15 adapté
pour être utilisé
dans des bandes de roulement de pneumatique, à l'instar du polybutadiène de
l'essai T5.
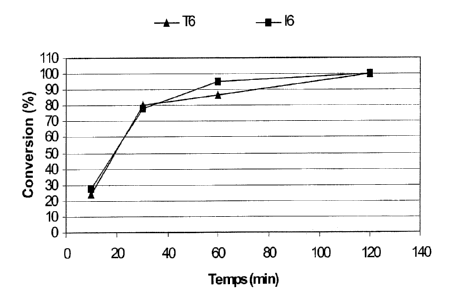
6) Essais (N 6) T6 et 16 d'homopolymérisation du butadiène-1,3 en présence de
butène-2
avec un catalyseur 10 :
Le tableau 6 ci-après mentionne les conditions de polymérisation suivies,
d'une part, pour un
sixième essai témoin T6 dans lequel le milieu de polymérisation est
dépourvu de mono-oléfine et,
d'autre part, pour un sixième essai selon l'invention 16 dans lequel le milieu
de polymérisation
comprend du butène-2 à titre de mono-oléfine.
Tableau 6 :
Conditions de polymérisation Polybutadiènes obtenus
Volume de Quantité Butène-2 / Durée Taux de Ip Microstructure Viscosité
système néodyme butadiène-1,3 de conversion inhérente
Essais catalytique ( mol de (rapport polym. (%) (dl/g)
(ml) Nd /100g massique, %) (min.) cis-1,4 1,2
de Bd) (%) (%)
6 me Essai 0,28 173 0 10 23,9
témoin T6 30 79,9
SIM =11,9 60 86,7 1,92 > 97,4 < 0,8 2,72
(massique) 120 100 1,95 > 97,4 < 0,8 2,80
6 me Essai 0,30 186 152 10 27,4
Invention 16 30 78,0
S/M = 10,0 60 95,1 1,98 > 97,4 < 0,8 2,66
(massique) 120 100 1,94 > 97,4 < 0,8 2,77
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
18
Ces résultats montrent, comme cela est visible à la Fig. 6, que ledit système
catalytique, de
rapport molaire (agent d'alkylation/ sel de terre rare) égal à 10, selon
l'invention permet
d'homopolymériser le butadiène-1,3 en présence de butène-2 selon un rapport
massique (butène-2 /
butadiène-1,3) supérieur à 150 %, avec une activité catalytique élevée
analogue à celle relative à
l'homopolymérisation du butadiène-1,3 en l'absence de butène-2 au moyen du
même système
catalytique (voir la similitude des courbes de cinétique de polymérisation des
essais 16 et T6), pour
l'obtention d'un polybutadiène présentant des caractéristiques de
microstructure et de macrostructure
très proches de celles présentées par le polybutadiène témoin de l'essai T6
(voir notamment le taux
d'enchaînements cis-1,4, la viscosité inhérente et l'indice de
polydispersité).
Ces caractéristiques rendent également le polybutadiène de l'essai 16 adapté
pour être utilisé
dans des bandes de roulement de pneumatique, à l'instar du polybutadiène de
l'essai T6.
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
19
ANNEXE 1:
Détermination de la microstructure des polybutadiènes obtenus.
On a utilisé la technique de dosage appelée proche infrarouge (NIR). Il
s'agit
d'une méthode indirecte faisant appel à des élastomères témoin dont la
microstructure a
été mesurée par la technique de RMN13C. On utilise la relation quantitative
(loi de Beer-
Lambert) existant entre la répartition des monomères dans un élastomère et la
forme du
spectre NIR de celui-ci. Cette technique est mise en oeuvre en deux étapes :
1) Etalonnage :
- On procède à l'acquisition des spectres respectifs des élastomères témoin
.
- On établit un modèle mathématique associant une microstructure à un spectre
donné, ceci à l'aide de la méthode de régression PLS (Partial Least Squares)
reposant sur une analyse factorielle des données spectrales. Les deux
documents
suivants traitent d'une manière approfondie de la théorie et de la mise en
oeuvre de
cette méthode d'analyse de données multi-variées :
(1) P. GELADI et B. R. KOWALSKI
Partial Least Squares regression : a tutorial ,
Analytica Chimica Acta, vol. 185, 1-17 (1986).
(2) M. TENENHAUS
La régression PLS - Théorie et pratique
Paris, Editions Technip (1998).
2) Mesure :
- On procède à un enregistrement du spectre de l'échantillon.
- On réalise le calcul de la microstructure.
CA 02506181 2010-12-06
ANNEXE 2 :
Détermination de la distribution des masses moléculaires des po[ybutadiènes
par la
technique de chromatographie d'exclusion par la taille (SEC).
a) Principe de la mesure
La chromatographie d'exclusion par la taille ou SEC (size exclusion
chromatography) permet
de séparer physiquement les macromolécules suivant leur taille à l'état gonflé
sur des
colonnes remplies de phase stationnaire poreuse. Les macromolécules sont
séparées par leur
volume hydrodynamique, les plus volumineuses étant éluées en premier.
b) Préparation du polymère
Il n'y a pas de traitement particulier de l'échantillon de polymère avant
analyse. Celui-ci est
simplement solubilisé dans du tétrahydrofurane à une concentration d'environ
lg/1.
c) Analyse SEC
L'appareillage utilisé est un chromatographe "WATERS alliance*". Le solvant
d'élution est le tétrahydrofurane, le débit est de 1 ml/min, la température du
système
de 35 C et la durée de l'analyse est de 30 min. On utilise un jeu de deux
colonnes
"styragel HT6E*" en série. Le volume injecté de la solution de l'échantillon
de
polymère est de 100 pl. Le détecteur est un réfractomètre différentiel "WATERS
10 2410*" et le logiciel d'exploitation des données chromatographiques est le
système
"WATERS MILLENIUM*".
ANNEXE3:
Détermination de la viscosité inhérente à 25 C d'une solution de
polybutadiène
à 0,1 g/dl dans le toluène, à partir d'une solution de polybutadiène sec.
* (marques de commerce)
CA 02506181 2010-12-06
21
PRINCIPE :
La viscosité inhérente est déterminée par la mesure du temps d'écoulement t de
la solution de
polymère et du temps d'écoulement t du toluène, dans un tube capillaire.
La méthode se décompose en 3 grandes étapes:
--> étapen 1 : préparation de la solution de mesure à 0,1 g/dl dans le toluène
;
-* étape n 2 : mesure des temps d'écoulement t de la solution de polymère et t
du toluène à
25 C dans un tube "Ubbelohde*";
-~ étape n 3 : calcul de la viscosité inhérente.
ETAPE N 1- Préparation de la solution de mesure à partir du polymère sec
Dans une bouteille de 250 ml lavée et étuvée à 140 C au minimum 10 heures, on
introduit 0,1
g de polymère sec (utilisation d'une balance de précision d'échelon e = 0,1
mg) et 100 nit de toluène
de pureté supérieure à 99,5 %.
On place la bouteille sur un dispositif d'agitation à secousses pendant 90
min. (voire plus si le
polymère n'est pas solubilisé).
ETAPE N 2 - Mesure des temps d'écoulement t du toluène et t de la solution de
polymère à
25 C:
1. Matériel :
- 1 cuve avec un bain thermostaté à 25 C 0,1 C pourvu d'un système de
refroidissement à
l'eau courante. La cuve est remplie par '/4 d'eau courante et 3/4 d'eau
déminéralisée.
- 1 thermomètre à alcool de type " PROLABO*", placé dans le bain
thermostaté avec une incertitude de 0,1 C.
- 1 tube viscosimétrique "Ubbelohde*" destiné à être placé en position
verticale dans le bain thermostaté.
* (marques de commerce)
CA 02506181 2005-05-13
WO 2004/046213 PCT/EP2003/012845
22
Caractéristiques des tubes utilisés:
- diamètre du capillaire: 0,46 mm ;
- capacité: 18 à 22 ml.
2. Mesure du temps d'écoulement tQ du toluène :
- rincer le tube par lavages au toluène ;
-introduire la quantité de toluène (pureté supérieure à 99,5 %) nécessaire à
la mesure
-vérifier que le bain thermostaté est à 25 C
-déterminer le temps d'écoulement to.
3. Mesure du temps d'écoulement de la solution de polymère t
-rincer le tube par lavages à la solution de polymère ;
-introduire la quantité de solution de polymère nécessaire à la mesure
-vérifier que le bain thermostaté est à 25 C.
-déterminer le temps d'écoulement t.
ETAPE N 3 - Calcul de la viscosité inhérente :
La viscosité inhérente est obtenue par la relation suivante :
17 . - l ln ~t)
inh C n
avec
C : concentration de la solution toluénique de polymère en g/dl ;
t : temps d'écoulement de la solution toluénique de polymère en centièmes de
secondes ;
t : temps d'écoulement du toluène en centièmes de secondes ;
rlinh : viscosité inhérente exprimée en dl/g.