Note: Descriptions are shown in the official language in which they were submitted.
DEMANDES OU BREVETS VOLUMINEUX
LA PRÉSENTE PARTIE I)E CETTE DEMANDE OU CE BREVETS
COMPRI~:ND PLUS D'UN TOME.
CECI EST ~.E TOME 1 DE 2
NOTE: Pour les tomes additionels, veillez contacter le Bureau Canadien des
Brevets.
JUMBO APPLICATIONS / PATENTS
THIS SECTION OF THE APPLICATION / PATENT CONTAINS MORE
THAN ONE VOLUME.
TRIS IS VOLUME 1 OF 2
NOTE: For additional vohxmes please contact the Canadian Patent Oi~ice.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
1
PROCEDE DE MISE EN EVIDENCE D'UN EVENEMENT MOLECULAIRE
DANS UNE CELLULE GRACE A DES PROTEINES MARQUEURS
FLUORESCENTES
La présente invention concerne un procédé de mise en évidence d'un
événement moléculaire particulier tel que fapoptose dans une cellule vivante.
La mise en évidence d'un événement moléculaire particulier tel, que
fapoptose dans une cellule vivante met habituellement en oeuvre un certain
nombre de
techniques telles que la détection par "Western blot" ou immunofluorescence de
protéines marqueurs telles que la protéine Bax ou les caspases activées qui
sont
impliquées dans les phénomènes d'apoptose.
Dans le cas des caspases, par exemples, les méthodes pour mesurer
l'activation de ces protéines dans les cellules sont pour (essentiel assez
complexes et
assez longues de mise en oeuvre.
~ Ainsi, dans la méthode "Western Blot", qui est la méïhôde habituelle
d'observation de l'activation des caspases, on utilise les anticorps dirigés
contre les
protéines qui sont substrats des caspases (Pare, caspase elle-même), et on
détecte
(apparition des bandes de poids moléculaire correspondant au produit de
protëolyse
correspondant.
La technique est laborieuse, implique de nombreuses étapes préparatives et
ne permet de mesurer (activation des caspases que sur une population
cellulaire et non
pas sur les cellules individuelles.
La technique d'immunofluorescence met en oeuvre des anticorps qui
reconnaissent de façon spécifique la forme active de la caspase et qui peuvent
être
utilisés pour la détecter au niveau unicellulaire sur des cellules fixées.
Cette technique
permet la détection sur cellules individuelles mais elle est laborieuse et
implique de
nombreuses étapes préparatives.
On utilise également des techniques mettant en oeuvre des sondes
fluorescentes chimiques. Il en existe différents types dans le çommerce, en
général il
s'agit des produits chimiques qui ont une forte affinité pour le site actif de
la protéase
et qui émettent un signal fluorescent une fois fixés à la caspase. Ces sôndes
sont
capables de pénétrer dans les cellules et peuvent permettre la mesure de
l'activité des
caspases par microscopie en fluorescence et/ou par cytométrie. Toutefois, leur
limite
est liée au protocole de charge et au coût qui empêche leur utilisation pour
des tests à
3 5 moyen ou à haut débit.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
2
Enfin, les sondes recombinantes basées sur la technologie FRET qui
utilisent des sondes obtenues par génie génétique que fon peut introduire dans
les
cellules par transfection transitoire ou stable. Ces sondes' sont constituées
par des
protéines fluorescentes (qui sont des mutants spectraux de la GFP) et le
signal détecté
est donné par le phénomène de transfert d'énergie de fluorescence. Le principe
est que
deux GFP mutants fusionnés en tandem et séparés par un linker contenant la
séquence
de clivage de la sonde donne un signal de transfert fluorescent (émission de
la
molécule accepteuse par excitation de la molécule donneuse car interagissant
entre
elles). Si la caspase coupe le linker, les deux protéines s'éloignent et le
signal disparaît.
Ces sondes orit fait (objet de quelques publications récentes mais la
difficulté est de détecter le signal Fret (la nécessité d'utiliser des filtres
adaptés en
microscopie et en cytométrie en limite (usage).
Le procédé selon la présente invention a pour objet la détection
d'événements moléculaires particuliers dans une cellule saris utiliser les
technologies
précédentes mais en pouvant utiliser la microscopie et la cytométrie sans que
cela
nécessite des préparations longues ou l'utilisation de réactifs
particulièrement coûteux.
En effet, conune on le constatera, le procédé selon la présente invention ne
nécessite aucune préparation compliquée d'échantillon.
Le coût est très faible puisque la sonde peut être fabriquée par la cellule
elle-même et la mesure peut être faite sur cellule unique par microscopie à
fluorescence ou en cytométrie de flux.
Il est possible de fabriquer des animaux transgéniques avec ce type de
technologie et on a la possibilité d'effectuer des transferts de ce test sur
des
mieroplaques afin de créer des plateformes à haut débit.
Le procédé de mise en évidence de la survenue d'un événement
moléculâire particulier dans un cellule selon la présente invéntion est
caractérisé en ce
que
- on détecte la "solubilisation" d'une protéine marqueur "fixée"
(respectivement la
"fixation" d'une protéine marqueur "solubilisée") qui est un marqueur direct
ou
indirect de la survenue de l'événement moléculaire particulier,
- laquelle protéiné marqueur est présente dans la cellule avant la détection
précédente,
- la cellule étant, avant la détection, soumise à une perméabilisation de la
membrane .
plasmique qui libère la protéine solubilisée dans le milieu extracellulaire,
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
3
- ,.. la présence de la protéine marqueur étant alors détectée dans la cellule
ou le milieu
extracellulaire par tout moyen approprié, ce qui permet de déterminer si la
solubilisation, respectivement la fixation, ont eu lieu et donc l'événement
moléculaire correspondant.
La protéine marqueur est la plupart du temps constituée d'une composante
sensible qui subira la solubilisation (ou la fixation) et d'une composante
indicateur
permettant la détection. Comme on le verra, il s'agit souvent d'une protéine
fluorescente.
La composante sensible peut être une protéine qui est liée directement avec
(événement moléculaire que fon souhaite observer, c'est-à-dire que c'est
précisément
sa solubilisation ou sa fixation qui constitue (événement moléculaire que l'on
veut
mesurer, ou bien élle peut être une protéine liée indirectement à (événement
moléculaire à mesurer et susceptible de subir une solubilisation ou une
fixation suite à
(induction de cet événement moléculaire ; c'est le cas, par exemple, de la
protéolyse
induite par les caspases lors de fapoptose.
En tout état de cause, la protéine composante sensible doit subir une
solubilisation, respectivement une fixation, lorsque (événement moléculaire se
produit.
On entend, dans la présente description, désigner par "fixation" d'une
protéine, (ancrage subcellulaire, par exemple membranaire, nuéléaire, au
niveau de
l'espace mitochondrial intermembranaire, etc..., et de préférence membranaire,
ou la
compartimentation au niveau subcellulaire de ladite protéine de façon telle
que la
protéine ne puisse diffuser dans le milieu extracellulaire lors de la
perméabilisation de
la cellule. De même, par "solubilisation" cellulaire de la protéine on entend
dësigner la
présence de la protéine marqueur sous forme de protéine libre dans le cytosol
cellulaire, de façon telle que la protéine puisse diffuser dans le milieu
extérieur lors de
la perméabilisation de la cellule.
Lorsque fon réalise la perméabilisation sélective de la membrâne
plasmique, si la protéine marqueur est fixée, c'est-à-dire si elle est ancrée
au niveau
subcellulaire, notamment sur une membrane compartimentée, elle va rester fixée
dans
la cellule et ne va pas passer dans le milieu extracellulaire ; au contraire,
si la protéine
est soluble, c'est-à-dire présente dans le cytosol, elle va migrer dans le
milieu
extracellulaire.Dans ces conditions,._on observera dans le premier cas une
cellule
marquée, et dans le second cas une cellule non marquée. .
Le marquage de la cellule étant de préférence un marquage par
fluorescence, il est alors aisé, de détecter par microscopie de fluorescence
ou par
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
4
cytométrie les cellules marquées et non marquées. Ceci ne nécessite pas de
préparation
de (échantillon, à féxception de la perméabilisation.
Il est théoriquement possibTé d'utiliser d'autres types de marquage qui
permettraient de distinguer la présence de la protéine marqueur dans la
cellùle ou, au
S contraire, son absence, mais il est certain que, compte tenu du
développement des
techniques de fluorescence, c'est cette technique qui sera préférée.
La perméabilisation sélective de la membrane plasmique aboutit donc,
dans une population cellulaire exprimant de façon homogène le marquage, à la
discrimiùation des cellules dans lesquelles (événement moléculaire a eu lieu
car le
signal fluorescent sera maintenu (ou respectivement perdu) spécifiquement dans
cette
sous population cellulairë.
L'analyse par cytométrie en flux permet d'évaluer de façon quantitative le
pourcentage de la population cellulaire dans laquelle (événement moléculaire
mesuré a
eu lieu et fournit un test simple pour évaluer (effet activateur ou inhibiteur
des drogues
qui interagissent avec ledit événement moléculaire.
L'approche décrite ici ne nécessite qu'une manipulation expérimentale très
réduite (pas de fractionnement, pas de procédures de fixation et d'incubation
avec
anticorps, pas d'électrophorèse, pas de microscopie). Le temps cumulé de
récupération
des cellules, de perméabilisation, et d'analyse est inférieur à 30 minutes
(plusieurs
heures voire jours pour les autres techniques).
Elle permet la mesure du paramètre d'intérêt au sein même de la cellule
sans induire d'artefacts liés au frâctionnement (WB) ou à la fixation et à
l'utilisation de
détergents à doses élevées (immunofluorescence).
Enfin, cette technique présente un coût expérimental minime (pas de
réactifs, pas d'anticorps).
La protéine marqueur peut être produite transitoirement dans la cellule
grâce à un vecteur d'expression de ladite protéine, mais il est possible
également de
prévoir l'expression constitutive de cette protéine marqueur dans des lignées
cellulaires
ou des animaux transgéniques qui pourront ainsi devenir des outils de
détection de
l'événement moléculaire. Dans le cas de fapoptose par exemple, ces outils
permettront
de tester les produits ayant des propriétés pro ou anti-apoptotiqùes sans
avoir à réaliser
les transfections par des vecteurs appropriés à chaque essai.
La technique permettant l'expression d'une protéine marqueur est connue
dans la technique antérieure, les plasmides ou vecteurs utilisables
dépendront, bien
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
entendu, de la cellule, de même que les promoteurs et les différents éléments
de
régulation de l'expression.
De même, les techniques permettant l'expression constitutive d'une
protéine marqueur sont connues, elles consistent à introduire dans fun des
chromosomes de la cellule un système d'expression stable ou inductible de la
protéine
marqueur par des méthodes de type recombinaison, par exemple.
Dans un mode de réalisation préféré de (invention, la protéine marqueur
est constituée par une protéine de fusion comportant
- une protéine sensible proprement dite qui subit une solubilisation,
respectivement
une fixation, lors de la survenue de l'événement moléculaire,
- un fragment fluorescent, notamment une protéine fluorescente y "green
fluorescent protein", "red fluorescent protein" ou toute molécule qui en
dérive ou
qui possède des propriétés similaires de fluorescence.
Dans les exemples, ôn a utilisé les protéines EGFP, DsRed2, HcRed et
copGFP, mais on peut utiliser d'autres protéines telles que les mutants
spectraux des
protéines précédentes.
On peut, de façon générale, considérer que les protéines marqueurs seront
de deux types, un premier dans lequel la composante sensible est constituée
par
l'élément protéique qui subit la solubilisation ou la fixation, cet événement
moléculaire
étant ce que fon veut directement mesurer. C'est le cas par exemple de Bax,
comme
cela sera décrit plus complètement ci-après. Dans l'autre type de protéine
marqueur, la
composante sensible peut être un fragment protéique qui est solubilisé ou fixé
suite à
l'interaction avec la protéine qui subit (événement moléculaire que l'on veut
mesurer.
C'est le cas, par exemple, de l'activation des caspases : la protéine marqueur
sera une
protéine de fusion comportant le site de clivage de la protéase et, de part et
d'autre de
ce site de clivage, un site d'ancrage à la membrane et une protéine
fluorescente Ainsi,
lors de (activation de la protéase, la composante indicateur, c'est-à-dire la
protéine
fluorescente, sera solubilisée par clivage.
Dans ce dernier cas, la protéine d'ancrage pourra notamment être choisie
parmi les domaines transmembranaires connus, il pourra s'agir notamment d'un
domaine trânsmembranaire exogène fusionné à (extrémité de la protéine
fluorescente
par l'intermédiaire d'un linker qui comportera le site de clivage de la
protéase.
Dans ce qui va suivre et dans les exemples, le domaine transmembranaire .
qui a été testé est un court domaine C-terminal présent dans la classe de
protéines dite
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
-6
"TA protéine" (Tail Anchored proteins). Il a été conféré à cette -portion
transmembranaire une spécificité mitochondriale par mutation mais il est
possible
d'utiliser d'autres cassettes protéiqûes d'ancrage dans .la membrane, par
exemple le
domaine transmembranaire à 1'N-terminal, séquence de myristilation _ ou de
palmitoylation par exemple, ou adressé à d'autres membranes (membrane
plasmique,
membrane du reticulum endothélien, Golgi par exemple), pourvu que la partie
fluorescente reste exposée dans le cytosol.
La technique peut être appliquée à des protéines naturellement dotées de
cette propriété ou à des protéines arüficiellement construites à ces fins.
Là présente invention concerne donc un procédé de mise en évidence de la
survenue d'un événement moléculaire particulier, et ceci, en utilisant une
protéine
marqueur.
-Comme cela est illustré par les exemples ci-après, le procédé objet de
l'invention peut être mis en ouvre en couplant la mise en évidence de la
survenue de
l'ëvénement moléculaire à la mesure du cycle cellulaire, notamment la mesure
de la
distribution de la population cellulaire dans les différentes phases du cycle
cellulaire.
En particulier, un tel couplage peut être mis en aeuvre lorsque l'événement
moléculaire à détecter est l'activation de Bax (voir exemple 6a ci-dessous),
ou
l'activation d'une caspase telle que la caspase 3 (voir exemple 6a).
Mais la présente invention concerne également
- les protéines marqueurs utiles dans la mise en oeuvre de ce procédé et qui
comportent une composante sensible qui subira la solubilisation (la fixation)
et une
composante indicateur qui permettra la détection.
Il s'agira de préférence d'une protéine de fusion où la composante
indicateur est une protéine fluorescente, comme cela a été mentionné
précédemment.
Selon un mode de réalisation, une protéine marqueur conforme à
l'invention comporte une composante sensible dont la séquence est codée par un
acide
nucléique comprenant une séquence choisie parmi les séquences SEQ ID
N°1, 3, 5, 7,
9, 11 et 13.
Selon un autre mode de réalisation, une protéine marqueur objet de
l'invention comporte une composante sensible dont la séquence comprend une
séquence choisie parmi les séquences SEQ ID N°2, 4, 6, 8, 10, 12 et 14.
L'invention concerne également
- les vecteurs exprimant, dans un environnement cellulaire approprié, une
protéine
3 5 marqueur,
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
7
- les cellules transformées exprimant une protéine marqueur de façon stable.
ou
transitoire, lesdites cellules pouvant être des cellules tumorales, de
préférence des
cellules tumorales humaines.
L'invention concerne des animaux transgéniques non humains dont au
moins un certain type de cellules exprime une protéine marqueur.
L'invention concerne également un kit de mise en oeuvre du procédé selon
fun des modes de réalisation précédents, comportant
- des cellules transformées ; et/ou
- un vecteur ; etlou
- un animal transgénique,
tels que mentionnés précédemment.
L'invention a en outre pour objet un procédé pour évaluer l'activité d'un
composé anticancéreux candidat.
Un tel procédé comprend la mise en aeuvre d'un procédé de mise en
évidence de la survenue d'un événement moléculaire particulier dans une
cellule
tumorale, de préférence d'origine humaine, transformée exprimant une protéine
marqueur.
Dans le cadre de l'invention, un « composé » est défini -comme étant
n'importe quel type de molécule, biologique ou chimique, naturelle,
recombinante ou
synthétique. Par exemple, un composé peut être un acide nucléique (e.g., un
oligonucléotide), une protéine, un acide gras, un anticorps, un
polysaccharide, un
stéroïde, une purine, une pyrimidine, une molécule organique, un radical
chimique,
etc... Le terme « composé » couvre également les fragments, dérivés, analogues
structurels ou combinaisons de ceux-ci.
Une cellule . eucaryote exploite diffërentes stratégies pour activer de
manière appropriée les voies de transduction du signal en réponse aux stimuli
spécifiques. Outre au contrôle de type transcriptionnel (la molécule active
est
synthétisée de novo) ou post-traductionnelle (la molécule signal déjà présente
subit une
modification qui la rend active (par exemple une protéolyse ou une
phosphorylation)
ou par interaction protéine-protéine, la cellule dans certains cas met en
place une
stratégie de compartimentalisation : la molécule active est déjà exprimée dans
la
cellule, mais elle est piégée dans un compartiment subcellulaire oû elle ne
peut pas
exercer son activité (ex. libération de facteurs pro-apoptotiques de la
matrice
mitochondriale, recrutement de facteur à la membrane plasmique).
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
ô
Dans certains cas, ce type de stratégie comporte non seulement un
changement de distribution intracellulaire mais aussi un changement de
solubilité de la
protéine qui peut être sous forme cytosoliqué soluble dans sa forme inactive
et
membranaire dans sa forme active, ou vice versa (ex. protéines pro-
apoptotiques de la
famille de Bcl-2, facteurs de transcription activés par le réticulum
endoplasmique). Ce
type d'événement peut être donc mis en évidence par microscopie et par
cytometrie en
flux grâce à la construction d'une protéine de fusion avec une protéine
fluorescente
(voir exemple ci-dessous : sonde pour mesurer l'activation de Bax).
De la même manière, il est possible d'appliquer ce type d'approche à
(utilisation de prôtéines marqueurs auxquelles a été dbnnée artificiellement
la
propriété de changer de phase par rapport au signal à mesurer. En particulier,
on peut
construire des protéines marqueurs recombinants pour mesurer l'activité des
protéases
intracellulaires. Dans ces prôtéines marqueurs, la protéine fluorescente est
accrochée à
une membrane intracellulaire par fusion à un domaine transmembranaire par le
biais
d'une séquence linker qui contient le site de clivage de la protëase dont on
veut
mesurer l'activité. C'est ce type d'approche qui a été retenu avec la sonde à
caspase 3
décrite dans les exemples.
L'étape de perméabilisation n'est pas en théorie indispensable, en effet il
est
possible par microscopie à fluorescence par exemple de détecter la présence de
la
fluorescence, soit dans le cytosol, soit sur les membranes ou dans les
compartiments
dans lesquels elle est fixée, toutefois la perméabilisation des cellules
permet une
automatisation du processus et constitue le mode de mise en oeuvre préféré de
la
présente invention.
Afin de permettre le relarguage sous forme soluble dans le milieu
extracellulaire de la protéine marqueur fluorescente, on peut utiliser toutes
les
technologies appropriées et connues de (homme du métier. On préfèrera utiliser
notamment la perméabilisation à la digitonine à des concentrations comprises
entre 1
et 100 ~,M/ml et de préférence 5 à 50 ~,M/ml, mais il est également possible
d'utiliser
d'autres détergents tels que les saponines à très faibles doses par exemple à
0,5 à
10 ~,M/ml, de préférence de (ordre de 1 ~.M., la streptolysine 0 (20-500
ng/ml) ou des
cycles de congélation/décongelation. . , .
Ceci permet de faire une détection, par exemple en cytométrie en flux qui
est évidemment beaucoup plus sensible et automatisable que les autres
techniques,
même si celles-ci sont également utilisables, par exemple un lecteur de
microplaques,
un microscope à fluorescence ou un microscope confocal par exemple.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
9
Les procédés selon la présente invention sont intéressants dans la mise en
évidence d'un grand nombre de phénomènes moléculaires mais, en particulier,
dans
l'étude des propriétés anti-apoptotiques, ou pro-apoptotiques de molécules
destinées à
être utilisées comme médicaments.
L'apoptose est un processus de mort cellulaire très conservé et regulé,
constitué par une cascade d'événements moléculaires qui entraînent la cellule
vers la.
dégradation et la mort (1). Les dysfonctionnements de l'apoptose sont à
l'origine de
nombreux cancers (défaut d'apoptose) et sont aussi impliqués dans la
pathogénie des
processus neurodégénératifs (excès d'apoptose) (1).
La phase finale de l'apoptose est constituée par la dégradation des
structures cellulaires, d'une part par (effet de l'activation d'une classe
spécifique de
«cystéine protéases», les caspases, d'autre part par l'activation
d'endonucléases qui
dégradent la chromatine nucléaire (1).
Une cellule qui subit le processus de mort cellulaire programmée est
1 S caractérisée par des nombreux signes morphologiques et biochimiques plus
ou moins
spécifiques. Certaines modifications morphologiques peu spécifiques sont
facilement
détectables par simple observation en microscopie optique telles la
condensation
cellulaire, la formation de « blebs » sur la membrane plasmique, ou
(apparition d'une
perméabilité de cette dernière à l'iodure de propidium. Certains colorants
nucléaires
(Hoechst, Dapi) qui révèlent la morphologie du noyau, permettent de visualiser
la
dégradation/condensation de la chromatine. Ce dernier paramètre est également
détectable par électrophorèse du matériel génomique d'une population
cellulaire avec
apparition de (aspect typique en « barreaux d'échelle » (DNA ladder), et au
niveau
unicellulaire par microscopie et cytométrie en flux grâce au principe du
TUNEL,
marquage colorimétrique ou fluorescent titrant la quantité d'extrémités libres
de DNA
produites par l'action des endonucléases apoptotiques. Parmi les autres signes
généralement mesurés, on compte :. l'activation des caspases (Western Blot,
cytométrie
en flux), la protéolyse des substrats des caspases activées (Western Blot), et
(exposition de la phosphatidylsérine sur le feuillet externe de la membrane
plasmique
(cytoméirie en flux).
En amont des processus décrits ci-dessus, il existe différentes voies de
signalisation intracellulaire qui poussent la cellule à s'engager 'dans un
processus
d'autodestruction (c'est l'initiation de l'apoptose) : ces stimuli d'induction
apoptotique
sont divers, et les. cascades de signalisation intracellulaire qui leur
correspondent
peuvent varier selon ~le stimulus inducteur et/ou le modèle cellulaire.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
Certains de ces événements moléculaires précoces représentent des étapes
clefs pro-apoptotiques, et la possibilité de les détecter spécifiquement avec
une bonne
sensibilité ouvre par exemple la voie au screening de composés actifs anti- ou
pro-
apoptotiques.
5 La relocalisation de la protéine Bax du cytosol à la membrane des
mitochondries est un événement précoce et générique lors de la signalisation
de
l'apoptose (2). La relocalisation de Bàx, suivie d'une homo-oligomérisation,
est la
cause de la libération du cytochrome c qui entraîne sans possibilité de retour
la mort de
la cellule en provoquant l'activation de la caspase 9, puis celle de la
caspase 3 (2). Bax
10 est une protéine cytosolique globulaire dont la structure primaire lui
permet d'êire
classée dans la famille des Bcl-2. Les travaux de Youle (2) ont largement
contribué à
la compréhension du rôle joué par les différents domaines de Bax dans . sa
relocalisation et sa redistribution, cependant sa structure secondaire était
inconnue
jusqu'à l'étude de Tjandra qui a permis son élucidation par résonance
magnétique
nucléaire (RMN) (2). La conformation du domaine C-terminal de Bax; constitué
de
l'hélice oc9 comportant 22 résidus s'est avérée d'une importance majeure. Dans
la
forme soluble cytosolique de la protéine, cette hélice repose dans une cavité
hydrophobe et la relocalisation dépend d'un changement conformationnel de Bax
qui
expose l'hélice hors de la poche hydrophobe : le domaine C-terminal de Bax
e<exposé»
possède alors un tropisme pour la membrane mitochondriale. C'est ce changement
de
conformation qui peut être mis en évidence par le procédé selon l'invention,
comme
cela sera décrit dans les exemples.
D'autres caractéristiques et avantages de la présente invention apparaîtront
à la lécture des exemples ci-après et en se reportant aux figures annexées sur
lesquelles
- la figure 1 représente une microscopie à fluorescence d'un clone cellulaire
humain
(clone 10) obtenu à partir d'une ligne' e HeLa qui exprime de façon stable la
protéine
chimérique GFP-Bax à T = 0 et T = 300 s sans perméabilisation et avec
perméabilisation à la digitonine et les courbes correspondant aux points a, b
et c ;
- les figures 2, A, B et C, monirent des profils de fluorescence de la
population dé
clone 10 dans diverses conditions (voir exemples) ;
- les figures 3, A et B, représentent la variation d'activation de Bax dans
diverses
conditions (voir exemples)
- la figure 4 représente un histogramme de l'activation de Bax dans diverses
conditions
(voir exemples) ;
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
11
la figure 5 représente le plasmide pEGFP-Bax ;
- la figure 6 représente la quantification de la caspase 3 ;
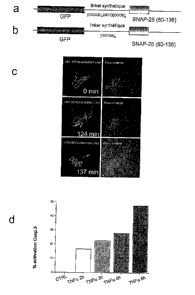
- la figure 7 illustre la mise au point d'une sonde à caspase 3 ancrée à la
face interne de
la membrane plasmique.
a) Représentation schématique de la protéine de fusion GFP-DEVD-SNAP(80-136)
et
b) du contrôle non clivable (même protéine de fusion sans site consensus pour
la
protéase). c) Libération de la protéine fluorescente dans le cytosol suite à
son clivage
observé par microscopie confocale dans deux cellules de neuroblastome humain
SH-
SYSY transfectées de façon transitoire et traitées par la staurosporine. d)
Mesure par
cytometrie, en flux, du pourcentage de cellules présentant une caspase 3
activée dans
une population de cellules humaines HeLa transfectées transitoirement avec la
protëine
GFP-DEVD-SNAP(80-136).
- la figure 8 illustre la mise au point d'une sonde à caspase 3 ancrée à la
face externe
de la membrane mitochondrïale interne.
a) Représentation schématique de la protéine de fusion GFP-DEVD-ANT2 et b) du
contrôle non clivable (même protéine de fusion sans site consensus pour la
protéase).
c) Localisation mitochondriale de la protéine de fusion (GFP-DEVD-ANT) dans
des
cellules simiennes COS-7 co-transfectées avec un marqueur mitochondrial
spécifique
(mt-dsRed2). d) Détection par cytometrie en flux du' clivage de la protéine de
fusion
GFP-DEVD-ANT2 comparée au contrôle non clivable et à la protéine GFP-DEVD-
cbSTMRR dans des cellules HeLa transfectées transitoirement et dans lesquelles
l'apoptose a été induite par différents stimuli (Staurosporine l~,M ou I1V
200mJ/cm2).
e) Libération de la protéine fluorescente dans le cytosol suite à son clivage
observé par
microscopie confocale dans deux cellules humaines HeLa co-transfectëes de
façon
transitoire avec GFP-DEVD-ANT et HcRed-DEVD-CbSRR et traitées à la
staurosporine. La quantification du clivage et de la diffusion du signal
fluorescent dans
le cytosol et effectué en mesurant l'augmentation du signal fluorescent
respectivement
vert et rouge dans une région du noyau.
- la figure 9 illustre la mise au point d'une sonde à caspase 3 à ancrage
nucléaire.
a) Représentation schématique de la protéine de fusion H2B-DEVD-GFP et b) du
contrôle non clivable (même protéine de fusion sans site consensus pour la
protéase).
c) Distribution ~ de la protéine fluorescente dans des cellules humaines HeLa
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
12
transfectées de façon transitoire : à gauche cellules non traitées
(distribution nucléaire),
à droite cellules traitées à la staurosporine (distribution cytosolique). d)
Libération de
la protéine fluorescente dans le cytosol suite à son clivage, observée par
microscopie
confocale dans une cellule HeLa co-transfectée de façon transitoire avec H2B-
DEVD-
GFP et HcRed-DEVD-CbSRR (sonde à caspase 3 ancrée à la membrane
mitochondriale externe) et traitées à la staurosporine. La quantification du
clivage et de
la diffusion du signal fluorescent respectivement du noyau au cytosol pour la
protéine
H2B-DEVD-GFP et . du cytosol au noyau pour la protéine IicRed-DEVD-cb5 est
effectué en mesurant l'augmentation du signal fluorescent respectivement, vert
dans
une région cytosolique de la cellule, et rouge dans une région du noyau. e)
Evaluation
par cytometrie en flux de la fonctionnalité de la sondé par quantification du
pourcentage de rétention de la fluorescence après perméabilisation dans une
population
de cellules HeLa iransfectées transitoirement avec la protéine H2B-DEVD-GFP et
son
contrôle non clivable.
- la figure 10 illustre la mise au point de sondes pour mesurer l'activité des
caspases 8
et 2.
a) Représentation schématique de la protéine de fusion GFP-IETD-cb5-TMD-RR et
b)
GFP-IETD-SNAP(80-136). c) Evaluation par cytometrie en flux de la
fonctionnalité de
la sonde par quantification du pourcentage de rétention de la fluorescence
dans une
population de cellules HeLa transfectées transitoirement avec la protéine GFP-
IETD-
cb5-TMD-RR et GFP-IETD-SNAP(80-136) et traitées au TNFalfa. d) Représentation
schématique de la protéine de fusion GFP-IETD-H2B. e) Distribution de la
protéine
fluorescente dans des cellules HeLa transfectées de façon transitoire : à
gauche,
cellules non traitées (distribution nucleaire), à droite, les mêmes cellules
traitées 3
heures à la staurosporine (distribution cytosolique).
- la figure 11 représente la mesure couplée de l'activation de Bax et du cycle
cellulaire.
Les cellules du clone 10 exprimant de façon stable la protéine de fusion GFP-
Bax sont
traitées avec différentes drogues agissant comme agents proapoptotiques et/ou
agents
cytostatiques. La mesure de l'activation de Bax est réalisée comme décrit
précédemment par évaluation de la rétention de la fluorescence après
pennéabilisation
à la digitonine. Dans le tampon de perméabilisation, de l'iodure de propidium
(0,4-08
mg/ml) a été rajouté et les cellules sont incubées pendant 30 minutes à
4°C. La
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
13
distribution des cellules dans les différentes phases du cycle cellulaire se
lit sur la base
de leur intensité de flûorescence dans le rouge (PI). La figure montre comment
la
lecture simultanée da~ïs les canaux FL1 (GFP) et FL3 (ADN) permet d'évaluer en
même temps l'effet pro-apoptotique de l'activation de Bax et l'effet sur le
cycle
cellulaire (modification de la distribution dans les phases G1, S, G2/M). De
plus, elle
permet d' évaluer si l' activation de Bax a lieu dans une phase préférentielle
du cycle
cellulaire. En haut, cellules contrôle non traitées (C) et cellules traitées à
la
staurosporine (ST 0.1) (pas d'effet sur le cycle et induction de l'activation
de Bax
dans toutes les phases du cycle).
En bas, traitement à la camptothecine (CAM) (blocage en phase S, activation de
Bax
préférentiellement en phase G1) ; traitement à la colcemide (COLC)
(accumulation en
phase G2, activation de Bax en toutes les phases du cycle) ; traitement à la
daunorubicine (DNR) (accumulation en phase G2, activation de Bax en phase S).
-.la figure 12 représente la xénogreffe de lignées exprimant un biocapteur
fluorescent.
a) Image en microscopie confocale (lOX) d'une coupe d'une tumeur solide
générée
par xénogreffe sous cutanée des cellules clone 10 (exprimant de manière stable
GFP-
Bax) dans des souris « nude ». Marquage des noyaux (Hoechst) et cellules avec
Bax
activé (GFP-Bax). A droite, le détail d'une cellule avec GFP-Bax relocalisé
aux
mitochondries (GFP-Bax ) et marquage nucléaire correspondant (Hoechst), b)
Image
en microscopie confocale (lOX) d'une coupe d'une tumeur solide générée par
xénogreffe sous cutanée des cellules clone 23 (exprimant de manière stable la
protéine
copGFP-DEVD-cbSTMD-RR) dans des souris « nude ». Marquage des noyaux
(Hoechst) et distribution du biocapteur (sonde caspase 3). A droite, le détail
de la
distribution mitochondriale de la sonde recombinante à plus fort
grossissement. c)
Dans une tumeur clone 23 xénogreffée, provenant d'une souris traitée par
etoposide
(40 mg/kg/jour pendant 4 jours), apparition des cellules ayant activé la
caspase 3
(flèches) (distribution cytosolique de la fluorescence).
EXEMPLE 1 - ACTIVATION DE LA PROTÉINE BAX
L'exemple ci-après décrit un test simple permettant de détecter les
changements conformationnels de la protéine Bax lors de l'induction de
fapoptose.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
14
Comme cela a été indiqué précédemment, dans une cellule normale Bax est
repliée de façon telle que son extrémité C-terminale trës hydrophobe est
protégée par
le reste de la molécule (2). Au cours de l'induction de fapoptose, la protéine
subit un
changement confonnationnel qui modifie ses propriétés, (exposition de son
extrémité
C-terminale induisant une relocalisation mitochondriale de Bax. Dans cette
forme Bax
se comporte comme une protéine membranaire insérée de façon stable dans la
membrane externe mitochondriale.
L'utilisation d'une protéine chimérique obtenue par la fusion de la GFP à
l'extrémité N-terminale dé Bax fournit une sonde recombinante fluorescente
indiquant
la localisation de Bax.
La protéine chimérique garde les mêmes propriétés que la protéine native
et en particulier la capacité de subir la modification conformationnelle et la
relocalisation à la mitochondrie lors de l'induction de fapoptose.
Le modèle mis en oeuvre utilise un clone dit "clone 10".
Il s'agit de cellules HeLa (fumeur du col de (utérus humain) qui ont été
transfectées par la technique du calcium phosphate avec un plasmide pEGFP-Bax
codant pour la protéine chimérique de fusion GFP-Bax sous le contrôle du
promoteur
viral CMV et qui confère une résistance à la généticine.
Le vecteur. de base utilisé est un vecteur commercial PEGFP-C3 (Figure 5)
de la société Clontech dans lequel on insère, sous le contrôle du promoteur
CMV,
fADNc de Bax fusionné en phase à son extrémité 5' à l'ADNc de la GFP privé de
son
codon stop.
Quatré jours après la transfection, les cellules sont exposées à une
concentration de 1 mg/ml de généticine 6418 qui est progressivement réduite à
0,1 mg/ml au cours de la semaine suivante. Aprês 2 semaines, on isole un
certain
nombre de clones résistants à la génétieine que fon sélectionne au microscope
à
fluorescence;
Le clone 10 contient un pourcentage élevé de cellules uniformément
fluorescentes au niveau cytosolique et ce marquage est stable dans le temps,
environ
10 passages). Les cellules sont maintenues en culture en DMEM 10% FCS, 0,1
mg/ml
de généticine.
Le test-repose alors sur l'observation au microscope à fluorescence ou en
cytométrie de flux des cellules dans lesquelles Bax n'est pas activée et est
donc répartie
uniformément dans le cytosol et des cellules dans lesquelles Bax ayant été
activée à la
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
suite d'une induction d'apoptose le signal fluorescent est agrégé autour des
mitochondries, la protéine Bax étant alors dite "fixée".
Pour mettre en évidence la fixation ou la solubilisation. de Bax, on traite la
population contrôle et la population traitée avec l'agent apoptotique par de
la trypsine
5 afin de les détachées de leur boîte de culture. Les cellules sont ensuite
resuspendues
dans une solution saline intracellulaire en présence de 50 ~,M de digitonine,
les cellules
sont ensuite analysées en cytométrie en flux et la fluorescence de la GFP est
mesurée
dans le canal FLl.
Des cellules ainsi traitées sont représentées à la figure 1 et montrent qu'on
10 observe une chute d'intensité de fluorescence très forte dans les cèllules
pour lesquelles
Bax n'a pas été activée, (image étant tout d'abord uniformément fluorescente
puis cette
fluorescence ayant quasiment disparue au bout de 300 secondes.
Au contraire, lorsque Bax a étê activée, on constate que la fluorescence est
redistribuée aux mitochondries et résiste à la perméabilisation, comme cela
ressort des
15 mesures quantitatives effectuées dans les courbes correspondantes.
La figure 2 montre différents profils de fluorescence en FLl de la
population clone 10 avec ou sans perméabilisation et en présence de différents
agents
pro-apoptotiques.
"A" montre le profil de fluorescence de la population clone 10 contrôle
avec ou sans perméabilisation. Comme (indique le déplacement du pic de
distribution
vers la gauche, le signal fluorescent est sensible au traitement à la
digitonine.
"B" montre le profil cytométrique en FL1 d'une population traitée par un
agent pro-apoptotique (selenite 20 ~,M, 6 h) activant Bax. En comparant les
'profils
obtenus avec ou sans inducteur et après perméabilisation, on peut observer que
sous
inducteur apoptotique le signal fluorescent est devenu résistant au traitement
de
perméabilisation.
En "C", la même différence est observée sous induction de fapoptose par
staurosporine (1 ~.M, 6 h) ou TNFa (10 ng/ml, 6 h + CHX 10 ~,M).
EXEMPLE 2 - QUANTIFICATION DE LA RELOCALISATION DE BAX A LA
MITOCHONDRIE SOUS INDUCTION APOPTOTIQUE
La technique permet d'évaluer (induction de Bax en mesurant le
pourcentage de cellules dans lesquelles la relocalisation de Bax à la
mitochondrie a ~eu
lieu.
Avec cette approche, il est possible
- d'analyser si l'expression d'un gène induit ou non (activation de Bax et
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
16
- d'évaluer de façon quantitative le pouvoir pro-apoptotique ou cytoprotecteur
d'une
drogue.
Pour évaluer le pouvoir d'activation de Bax d'un gène exogène, le clone 10
est transfecté avec fADNc de la protéine d'intérêt en association avec un
autre ADNc
codant pour un marqueur fluorescent spectralement différentiable de la GFP et
ayant
une localisation subcellulaire, membranaire ou compartimentée (résistant à la
perméabilisation), par exemple la DsRed adressée à la matrice mitochondriale
(mtDsRed). Dans ce dernier cas, après perméabilisation, l'intensité de
fluorescence
enregistrée dans le canal FL1 (GFP) donne toujours l'indication du niveau
d'activation
de Bax, tandis que l'intensité du signal en FL3 (DsRed) indique si la cellule
surexprime
ou non la protéine d'intérêt.
En pratiquant une mesure biparamétrique sur clone 10, il est donc possible
de corréler l'activation de Bax à la surexpression d'une protéine d'intérêt.
Les résultats indiqués aux figures 3A et 3B mettent en évidence le
pourcentage d'une population cellulaire qui a subi la relocalisation de Bax à
la
mitochondrie suite à un traitement pharmacologique.
La figure 3A représente l'évolution dans le temps d'une population
cellulaire iraitée avec 20 ~,M de selenite en (absence (courbe D) et en
présence (courbe
E) d'un inhibiteur et avec 40 nM de staurosporine en (absence et en présence
du même
inhibiteur B.
Grâce à cette technique, on observe que le cinétique d'activation de Bax
n'est pas modifiée par (inhibiteur lors du traitement avec le selenite, alors
qu'au
_ contraire cet inhibiteur est actif sur la staurosporine.
De même, l'histogramme de la figure 4 représente le pourcentage des
cellules dans lesquelles Bax a été activée après traitement de 24 h avec 40 nM
de
staurosporine, 50 ~,M de ceramide ou TNF 0,1 ng/ml en présence de
cycloheximide,
sous (influence de rayonnements U.V.
Cette technique permet donc de distinguer les propriétés pro-apoptotiques
de différents agents.
30, Elle , présente . de nombreux avantages par rapport aux techniques
actuellement disponibles pour évaluer (activation de Ba:x et sa relocalisation
à la
rnitochondrie qui se base sur des fractionnements subcellulaires et des
quantifications
par Western Blot de la quantité de protéines Bax présentes dans les
différentes
fractions ou par immunofluorescence avec des anticorps qui reconnaissent
spécifiquement la protéine qui a subi le changement conformationnel
d'activation.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
17
Par rapport à ces techniques, l'approche décrite précédemment ne nécessite
qu'une manipulation expérimentale très réduite (le temps cumulé est inférieur
à 30 min
par rapport à 24 h pour les autres techniques) et elle permet la mesure du
paramètre
d'intérêt au sein même de la cellule sans induire d'artefacts liés au
fractionnement ou à
la fixation et à (utilisation de détergents à doses élevées
(immunofluorescence) et
présente un coût expérimental minime.
EXEMPLE 3 - MESURE DE L'ACT1VITE DE LA CASPASE 3 AU COURS DE
L'APOPTOSE
Les principaux effecteurs de l'apoptose sont les caspases, cystéines
protéases caractérisées par une spécificité absolue pour un aspartate en
position P1
dans leur site de clivage. Ces enzymes contiennent toutes une séquence
pentapeptidique identique dans leur site actif et participent, avec d'autres
protéases
comme la calpaïne, aux nombreux événements protéolytiques qui ont lieu dans
une
cellule en apoptose, aboutissant au clivage de substrats protéiques jouant un
rôle clé
dans les fonctions cellulaires normales (protéines du cytosquelette, protéines
nucléaires
ou enzymes de réparation de l'ADN).
L' activation des caspases peut emprunter deux grandes voies. Lâ première est
la voie <anitochondriale», où la protéine Apaf 1 interagit avec la procaspase-
9, en
présence de dATP et de cytochrome c, libéré à partir de l'espace
intermembranaire des
mitochondries, pour former <d'apoptosome», permettant ainsi l'activation de la
caspase-9 (clivage auto catalytique de la procaspase-9) puis de la caspase-3.
L'autre
voie est celle des récepteurs de la superfamille des récepteurs du TNF sur la
membrane
plasmique. L'interaction de TNFR1 ou de Fas (CD95 ou APO-1) avec leur ligand
naturel ou un anticorps monoclonal agoniste permet l'assemblage d'un complexe
rilultiprotéique cytoplasmique appelé DISC (death-inducing signaling complex)
et
l'enclenchement de la cascade apoptotique par activation de la procaspase-8.
Il existe actuellement un nombre limité de méthodes qui ont déjà étë
mentionnées précédemment et dont aucune n'est parfaitement satisfaisante pour
mesurer l'activation des caspases.
Dans le cadre de la présente invention, on utilise une nouvelle sonde
recombinante utilisable en microscopie et en cytométrié pour mesurer
l'activité des
caspases dans les cellules apoptotiques.
Cetté nouvelle sonde est constituée d'une protéine de fusion dans laquelle
une protéine fluorescente quelconque, DsRed2 ou EGFP, est reliée par un court
linker
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
18
contenant le site de consensus de la caspase 3 à une séquence transmembranaire
assurant l'ancrage spécifique de Ia sonde à la membrane externe
mitochondriale.
La séquence correspondante est décrite dans SEQ ID N° 1.
La partie soulignée correspond au linker synthétique contenant la séquence,
de clivage pour Ia caspase 3, puis le domaine transmembranaire du cytochrome
b5
muté auquel a été conféré une spécificité d'adressage mitochondrial.
Lors de (induction de fapoptose, la caspase 3 activée clive la séquence
DEVD contenue dans le Iinker qui a été interposé entre la protéine
fluorescente et la
séquence transmembrânaire. La GFP préalablement fixée devient une protëine
soluble
dans le cytosol de 1a cellule.
Le signal fixé dans les cellules dans lesquelles la caspase 3 n'est pas
activée devient soluble dans les cellules dans lesquelles Ia caspase est
activée.
Les cellules sont cultivées sur lamelles en verre et transfectées avec le
vecteur décrit précédemment, elles sont montées sur une chambre d'incubation
dans un
I S milieu salin et observées au microscope à fluorescence. Avant ou pendant
l'observation, elles sont traitées avec l'agent pro-apoptotique. L'activation
de la caspase
3 et sa cinétique peuvent être mises en évidence par simple observation de la
modification de la distribution intracellulaire du signal fluorescent qui, de
mitochondrial, devient rapidement cytosolique une fois Ia caspase activée.
Mais il est plus commode de mesurer (activation de la caspase par
cytométrie en flux.
La population contrôle et la population traitée avec l'agent apoptotique sont
détachées de leurs boîtes de culture par traitement à la trypsine, les
cellules sont
ensuite xesuspendues dans une solution saline intracellulaire en présence de
50 ~M da
digitonine, les cellules sont ensuite analysées en cytométrie en flux et la
fluorescence
de la GFP est mesurée en canal FL1.
La technique présentée permet d'évaluer l'activation de la caspase 3 en
mesurant le pourcentage de cellules dans lesquelles le clivage du capteur
fluorescent a
eu lieu.
Avec cette approche, il est dbnc possible
- d'analyser si (expression d'un gène induit ou non l'activation de la caspase
3 et
- d'évaluer de façôn quantitative le pouvoir pro-apoptotique ou cytoprotecteur
d'une
drogue.
Ainsi, la figure 6 reprësente la quantification de l'action de Ia caspase 3
dans une population de cellules HeLa traitées avec différents inducteurs
apoptotiques
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
19
irradiation UV (200 mJ/cm2), TNFa 100 ~.g/ml, staurosporine 1 q.M pendant 6 h
et
staurosporine 1 ~.M en présence d'inhibiteur de caspases (ZVAD 50 ~,M).
En parallèle est représentée la quantification d'un autre paramètre
âpoptotique (la dépolarisation mitochondriale qui dans ce modèle d'induction
de
fapoptose dépend de l'activation des caspases.
Bien entendu, ce procédé est directement généralisable à (ensemble des
caspases et d'autres protéases qui peuvent être introduites dans des systèmes
différents
et pour lesquelles l'homme du métier saura réaliser le vecteur correspondant.
EXEMPLE 4 - AUTRES STRATEGIES D'ANCRAGE SUBCELLULAIRE DE LA
SONDE
La sonde à caspase 3 décrite supra est basëe sur un ancrage membranaire
constitué par
un court domaine transmembranaire qui s'enchâsse dans la membrane
mitochondriale
externe (segment C-terminal du cytochrome b5 muté). Ce domaine protéique
confère
donc à la protéiné de fusion une distribution mitochondriale et la propriété
d'être
résistante vis-à-vis d'une pennéabilisation sélective de la membrane
plasmique. Il est
montré dans cet exemple que le principe du test est extensible à d'autres
stratégies
d'ancrage subcellulaire qui impliquent une résistance du signal fluorescent à
la
perméabilisation de la membrane plasmique. Le type d'ancrage peut ne pas étre
nécessairement représenté par un domaine transmembranaire proprement dit mais
tout
simplement par un domaine protéique qui, de par ses interactions moléculaires
ou ses
modifications post-traductionnelles, confère à la protéine fluorescente à
laquelle il est
fusionné un état « ancré» mais potentiellement diffusible dans le cytosol ou
dans
l'ambiance extracellulaire après clivage 'par la protéase d'intérêt. De plus,
la
localisation subcellulaire spécifique (membrane plasmique, noyau, espace
mitochondrial intermembranaire) peut donner des informations supplémentaires
sur
l'accessibilité des substrats aux protéases et, donc, sur la localisation
intracellulaire des
activités protéolytiques.
Exemple 4a : Sof2de à caspase 3 ancrée à la face ihte~f~e de la m.emb~ane
plasmigue.
Dans cette protéine de fusion, le domaine d'ancrage intracellulaire est
constitué par
une portion de la protéine marine SNAP-25. SNAP-25 est une protéine impliquée
dans le processus de.. fusion de vésicules sécrétoires et elle se localise sur
la face
cytosolique de la membrane plasmique par pahnitoylation de trois résidus de
cystéine.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
On a isolé le domaine minimal de palmitoylation de SNAP-25, qui est constitué
des
acides aminés 80-136 (SEQ ID N°4), et on l'a fusionné à la protéine
fluorescente via le
linker contenant le site de clivage de la caspase 3.
Cette protéine de fusion se localise donc à la membrane plasmique et son
signal
5 fluorescent est résistant à la perméabilisation par la digitonine.
L'activité protéolytique
de la caspase 3 clive le linker, provoque une redistribution de la
fluorescence dans le
cytosol et le signal est perdu après pennéabilisation. (Fig. 7). En cytométrie
en flux,
cette sonde donne des résultats tout à fait comparables à la sonde ancrée à la
membrane
mitochondriale externe précédemment décrite.
10 Exemple 4b : Sofade à caspase 3 ar~c~ée à la face externe de la memb~~ahe
mitochohdriale inter~TZe
Dans ce deuxième exemple, le domaine protéique utilisé pour ancrer la sonde
est
représenté par la séquence éntière du translocateur adenylique mitochondrial
(ANT2)
(SEQ ID N°8). Il s'agit d'une protéine intégrale de la membrane interne
15 mitochondriale dont l'extrémité N-ter est exposée dans l'espace
intermembranaire. La
protéine fluorescente avec son linker clivable a donc été fusionnée à cette
extrémité.
Il a ainsi été montré que : (i) cette protëine de fusion se localise
cérrectement à la
mitochondrie ; (ü) la protëine fluorescente est clivable par la caspase 3 ; et
(iii) le
signal de fluorescence devient sensible à la permeabilisation après le clivage
de la
20 caspase 3 (Fig. 8).
Cette protéine de fusion se comporte donc bien comme une sonde pour la mesure
de
l'activité de la caspase 3, selon le principe de mesure décrit dans la
présente demande.
Cet exemple montre également que le procédé selon l'invention permet d'obtenir
des
.informations supplémentaires sur la distribution spatiale de l'activité
protéolytique
étudiée : dans ce cas, bïen que piégée dans l'espace intennembranaire, la
sonde peut
être clivée par la caspase 3, ce qui démontre que cet espace intracellulaire
devient
accessible au cours de l'apoptose à des protéines cytosoliques telle que la
caspase 3.
Exemple 4c : Sofzde à cas~aase 3 à afac~a~e Tzucléaiy~e
Ce troisième exemple montre que l'ancrage intracellulaire peut être obtenu par
effet
. d'interactions protéine-protéine et protéine-acide nucléique très stables.
On a obtenu une sonde à caspase 3 à localisation nucléaire en fusionnant la
protéine
fluorescente à la protéine histone 2b via le linker clivable par la caspase 3.
La protéine
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
21
de fusion H2B-GFP contrôle (sans séquence spécifique pour la câspase 3) se
locâlise
dans le noyau de façon trés stable : grâce à son interaction âvec la
chromatine (ADN)
au sein des nucleosomès (complexes multiprotéiques), elle ne diffuse pas,
comme le
démontre la résistance du signal fluorescent lors de la perméabilisation de la
membrane plasmique. Au cours de l'apoptose, même dans les phases tardives qui
comportent la dégradation de l'ADN provoquée pax le clivage internucléosomal
de la
chromatine par les endonucléases spécifiques de l'apoptose, la protéine
fluorescente
reste piégée dans les nucléosomes et sa distribution suit la distribution de
la chromatine
en donnant l'image des noyaux picnotiques caractéristiques de l'apoptose.
La protéine H2B-DEVD-GFP, dans laquelle la séquence de clivage par la caspase
3 a
été insérée dans le linker entre l'histone (SEQ ID N°10) et la GFP, se
comporte de la
même manière que la sonde contrôle dans les cellules non traitées. En
revanche, dans
les cellules traitées par un inducteur apoptotique, la fluorescence de la GFP
diffuse en
dehors du noyau lors de 1°activation de la caspase 3 et se distribue de
façon uniforme
dans le cytoplasme. Cette fluorescence devient sensible à la perméabilisation
de la
membrane plasmique. Les expériences de perméabilisation montrent que cette
protéine
se comporte bien comrüe une sonde permettant la mesure de l'activité de la
caspase 3
dans le noyau cellulaire (Fig. 9).
EXEMPLE 5 - APPLICATION DU. PRINCIPE DU PROCEDE SELON
L'INVENTION A DES SONDES MESURANT D'AUTRES ACTIVITES
PROTEOLYTIOUES
L'approche de mesure mise au point pour la caspase 3 a été étendue à deux
autres
protéases impliquées dans la mort cellulaire programmée.
On a construit des protéines de fusion GFP-cbSTMRR et GFP-SNAP(80-136) qui
portent, dans le linker reliant la protéine fluorescente et le segment
d'ancrage, le site
consensus sensible à la caspase 8 (IETD) qui est la principale caspase «
initiatrice
pro-apoptotique. De la même manière, on a construit une protéine de fusion GFP-
H2B
qui contient, dans la séquence linker, la séquence consensus sensible à la
caspase 2
(VDVAD), protéase à localisation nucléaire. Lès composantes sensibles ainsi
utilisées
ont pour séquences SEQ ID N°6 et 14 (pour la caspase 8), et SEQ ID
N°12 (pour la
caspase 2). Ces protéines sont clivables et la quantification de l'activité
protéolytique
peut être réalisée en cytometrie comme montré pour la caspase 3 (Fig. 10).
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
22
EXEMPLE 6 - EXEMPLES D'APPLICATION DU TEST EN CYTOMETRIE EN
FLUX ET DANS DES MODELES TUMORAUX EXPERIMENTAUX IN VIVO
Dans cet exemple, on montre deux autres applications des sondes et du prôcédé
objet
de l'invention : la première concerne la mise au point d'un test couplé
biparamétriqué
en cytométrie en flux, la seconde décrit l'application des biocapteurs dans
l'évaluation
de l'activité des anticancéreux dans des modèles animaux.
Exemple 6a : mesure coulée à celle du cycle cellulairre
Il est possible d'appliquer la technique dans des tests doubles dans lesquels
la mesure
de l'événement moléculaire révélé par la sonde spécifique est couplée à la
mesure d'un
autre paramètre cellulaire tel que le cycle cellulaire. La mesure du cycle
cellulaire peut
être réalisée de façon classique en rajoutant à la suspension cellulaire
perméabilisée
une concentration suffisante d'iodure de propidium (0,4-0,8 mg/ml). Les
cellulés sont
incubées pendant 30 minutes pour laisser le temps au PI de s'intercaler dans
l'ADN
genomique, puis analysées en cytométrie en flux en mesurant à la fois la
fluorescence
« verte » (FL1= signal du biocapteur recombinant basé sur GFP ou autre
protéine
fluorescente émettant dans le vert) et la fluorescence dans le « rouge » (FL3=
intensité
du PI correspondant au contenu de chromatine de chaque cellule, permettant la
lecture
du cycle cellulaire).
La technique permet donc de suivre de façon simultanée la distribution de la
population cellulaire dans les différentes phases du cycle et la survenue de
l'événement
moléculaire spécifiquement détecté par la sonde. En particulier, cette
technique offre
deux avantages principaux
- elle permet de détecter une éventuelle relation entre l'activation du
processus
moléculaire étudié et une phase déterminée du cycle cellulaire ;
- utilisée dans le criblage des molécules candidats anti-cancéreux, elle
permet
d'identifier en même temps les composés ayant une activité cytostatique
simple,
les composés ayant une activité proapoptotique simple, et les composés à la
fois
cytostatiques et proapoptotiques.
La figure 11 montre l'efFet de quelques drogues Pro-apoptotiques utilisées
comme
agent anticancéreux dans le test couplé « activation de .Bax/cycle celluhire »
(voir
légende). De la même manière, on a réalisé avec succès le test couplé «
activation de la
caspase 3/cycle cellulaire » (non montré).
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
23
Exe~z~le 6b : Application des biocapteu~s dans l'évaluation de l'activité des
anticancéreux i~c vivo chez la som°is~o~teuse de xéno~r~effe tu~co~czle
La xénogreffe sous-cutanée de lignées cellulaires tumorales humaines dans des
souris
« nude » (dépourvues d'immunité cellulaire) représente un modèle préclinique
classique pour l'évaluation de l'efficacité in vivo des nouvelles molécules à
p~tentiel
anticancéreux. Cependant, cette évaluation se base généralement sur la simple
mesure
de la taille et de la croissance des tumeurs implantées, et ne permet donc pas
de relier
l'effet « macroscopique » de la molécule testée à un effet moléculaire précis.
Le présent exemple montre que l'approche xénogreffe est applicable aux lignées
cellulaires qui expriment de façbn stable les biocapteurs recombinants pour la
mesure
de l'activation de Bax et de la caspase 3.
Ces lignées (appelées respectivement clone 10 et clone 23), injectées en sous-
cutané
chez des souris « nude » forment, au bout de quelques jours, des tumeurs
solides
fluorescentes.
Ces dernières représentent un modèle d'un nouveau genre pour l'évaluation in
vivo de
l'efficacité de nouvelles molécules à potentiel anticancéreux puisqu'elles
renseignent
sur l'activité moléculaire spécifique du produit testé au niveau du tissu
tumoral (Fig.
12) tout en permettant les mesures morphométriques macroscopiques classiques,
ce qui
rend donc possible une corrélation « effet moléculaire/effet sur la croissance
tumorale » ifz vivo.
CA 02531225 2006-O1-03
WO 2005/012913 PCT/FR2004/001678
24
BIBLIOGRAPHIE
1) Ferri I~.F., Kroemer G. (2001). Organelle-specific initiation of cell death
pathways. Nat. Cell. Biol. 3(11):E255-63
2) Suzuki M., Youle R.J., Tjandra N. (2000). Structure of Bax : coregulation
of
dimer formation and intracellular localization. Cell 10;103(4):645-54
DEMANDES OU BREVETS VOLUMINEUX
LA PRÉSENTE PARTIE DE CETTE DEMANDE OU CE BREVETS
COMPRI~:ND PLUS D'UN TOME.
CECI EST L,E TOME 1 DE 2
NOTE: Pour les tomes additionels, veillez contacter le Bureau Canadien des
Brevets.
JUMBO APPLICATIONS / PATENTS
TRIS SECTION OF THE APPLICATION / PATENT CONTAINS MORE
THAN ONE VOLUME.
THIS IS VOLUME 1 OF 2
NOTE: For additional valumes please contact the Canadian Patent Office.