Note: Descriptions are shown in the official language in which they were submitted.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
1
"Procédé de traitement par voie chimique d'un
milieu liquide chargé en nitrates, dispositif pour
traiter un tel milieu liquide et applications"
La présente invention concerne un procédé de
traitement par voie chimique d'un milieu liquide chargé
en nitrates.
L'invention concerne également un dispositif pour
traiter un tel milieu liquide et les applications de ce
procédé.
Les effluents liquides résultant du drainage des
sols de cultures sont soumis à une réglementation vïsant
à réduïre la quantité de polluants contenus dans ces
effluents.
Parmi ces polluants, les nitrates sont plus
particulièrement visés.
Dans le cadre des cultures de tomates hors sol sous
serre par exemple, les effluents liquides provenant des
eaux de drainage peuvent contenir une concentration en
nitrate allant jusqu'à 3 g/L pour un débit maximum de
31 m3/j our/hectare .
Or, le rejet de ces eaux est nuisible pour
l'environnement, la concentration en nitrates maximum
acceptable pour l'environnement étant, dans le passé,
estimée à 50 mg/L et actuellement à 25 mg/L.
Un traitement biologique de ces effluents est
possible mais présente deux inconvénients majeurs, à
savoir la présence de composés organiques non facilement
biodégradables dans les effluents nécessitant un ajout
significatif de méthanol ainsi que la prêsence de
micro-organismes ce qui est peu souhaitable à proximité
du lieu de culture.
Dans ce contexte, l'invention vise un procédé de
traitement d'un milieu liquide chargé en nitrates
permettant de réduire la çoncentration en nitrates et
n'entraînant pas la formation d'autres espèces polluantes
pouvant nuire à l'environnement. L'invention réside
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
2
également dans un dispositif permettant de traiter un
milieu liquide chargé en nitrates et dans les
applications possibles du procédé de l'invention.
A cet effet, le procédé de l'invention comprend au
moins une étape de mise en contact entre du zinc et le
dit milieu liquïde dont le pH est inférieur à 4.
Dans le procédé de l'invention, il est prévu que le
pH du dit milieu liquide soit maintenu fixe par
ajustement régulier consistant à ajouter une quantité
appropriée d'acide dans le milieu liquide.
De préférence, l'acide utilisé est de l'acide
chlorhydrique.
Dans ce cas, l'ajustement de pH peut être effectué
au moins toutes les demi-heures pendant la durée du
traitement.
De plus, la température du milieu liquide pendant
l'étape de mise en contact peut être supérieure à 20°C
mais peut également être approximativement de 20°C.
Selon un premier aspect du procédé de l'invention,
le zinc est sous forme de poudre.
Dans ce cas, le rapport massique entre le zinc et
les nitrates en solution est de préférence d'au moins 5.
De façon préférentielle, le milieu liquide est
soumis à une agitation. Dans ce cas, l'agitation peut
être réalisée par des pulsations ou des mélangeurs
statiques.
Avantageusement, le milieu liquide subit une
agitation d'une vitesse d'au moins 0,55 m/s.
Le procédé de l'invention permet de traiter un
milieu liquide dont la concentration initiale en nitrates
est supérieure à 25 mg/L et également supérieure à
50 mg/L.
Selon un second aspect du procédé de l'invention, le
zïnc est sous forme de copeaux.
Dans ce cas, il est préférable que les copeaux de
zinc soient dégraissés et rincés à l'eau distillée.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
3
Dans ce cas également, il est avantageux que la
surface de contact du zinc avec le milieu liquide soit
d'au moins 0,0156 m2/L et plus avantageusement d'environ
0, 25 m2/L.
Dans le procédé de l'invention, le milieu liquide
peut être constitué par des eaux de drainage dans
lesquelles la concentration en nitrates peut être
supérieure à 1 g/L.
Avantageusement, le débit de circulation du milieu
liquide au contact du zinc est supérieur à 0,005 m/s et
de préférence d'environ 0,01 m/s.
Selon l'invention, le procédé peut comprendre en
outre une étape d'électrolyse du milieu liquide.
Cette étape d'électrolyse peut consister à faire
circuler le milieu liquide 68 dans au moins une cellule
d'électrolyse 110a, 110b, 110c, 1104, 110e, 110f dans
laquelle un courant circule entre deux électrodes
respectivement anodique 109a, 109b, 109c, 109d et
cathodique 108a, 108b, 108c.
De préférence, chaque électrode cathodique 108a,
108b, 108c est réalisée par compression de grains de
charbons entre deux plaques perforées 116b, 116b' dans
lesquels au moins un moyen formant électrode 117 est
enfoncé en étant relié au pôle négatif d'un générateur.
Très préférentiellement, l'électrode anodique 109a,
109b, 109c, 109d est réalisée par compressïon de copeaux
de zinc entre deux plaques perforées 118a, 118a', 118b,
118b' dans lesquels au moins un moyen formant électrode
119b, 119c est enfoncé en étant relié au pôle positif
d'un générateur.
En outre, il est préférable que le milieu liquide 68
circule dans au moins six cellules d'électrolyse 110a,
110b, 110c, 110d, 110e, 110f.
Avantageusement, le pH du milieu liquide est
maintenu supérieur à 5 et de préférence égal à 10 pendant
toute la durée de l'étape d'électrolyse.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
4
Le potentiel appliqué entre les électrodes anodique
109a, 109b, 109c et cathodique 108a, 108b, 108c-est de
préférence d'environ 2 Volts pour un courant compris
entre 1,5 et 1,8 Ampères par litre de solution traitée.
L'invention concerne également un dispositif de
traitement par voie chimique d'un milieu liquide chargé
en nitrates comprenant au moins une enceinte de réduction
des nitrates 56 comportant une entrée de liquide 57, au
moins une couche de zinc 70, 85a, 85b, 85c, 99a, 99b,
99c, 99d, 99e, 99f, 99g, un moyen de circulation du dit
milieu liquide 59 à travers la dite couche de zinc et une
sortie du milieu liquide 58 de l'enceinte 56.
Avantageusement, l'enceinte de réduction des
nïtrates 56 est verticalement disposée et comporte au
moins une couche de zinc 70, 85a, 85b, 85c, 99a, 99b,
99c, 99d, 99e, 99f, 99g qui est transversalement disposée
sur toute la largeur de l'enceinte 56 et qui est réalisée
par compression de copeaux de zinc entre deux plaques
perforées 71, 72, 86a, 86a', 86b, 86b', 86c, 86c',
l'entrée de liquide 57 est disposée dans la partie
inférieure de l'enceinte 56, la sortie de liquide 58 est
disposée dans la partie supérieure de l'enceinte 56 et le
dispositif comporte en outre une pompe à recirculation 59
permettant d'assurer la circulation et recirculation du
liquide depuis l'entrée 57 jusqu'à la sortie 58 en
traversant toutes les couches de zinc 70, 85a, 85b, 85c,
99a, 99b, 99c, 99d, 99e, 99f, 99g.
De préférence, la hauteur de chaque couche de zinc
70, 85a, 85b, 85c, 99a, 99b, 99c, 99d, 99e, 99f, 99g est
inférieure à 10 cm.
En outre, l'enceinte 56 peut comporter un système
d'agitation du liquide 75 permettant d'agiter le liquide
circulant dans l'enceinte 56 au-dessus de chaque couche
de zinc 70, 85a, 85b, 85c, 99a, 99b, 99c, 99d, 99e, 99f,
99g en formant une zone d'agitation correspondante 78,
92a, 92b, 92c, 99a1, 99b1, 99c1, 99d1, 99e1, 99f1, 99g1.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
De préférence, la vitesse d'agitation du liquide
dans chaque zone d'agitation 78, 92a, 92b, 92c, 99a1,
99b1, 99c1, 99d1, 99e1, 99f1, 9981 est environ de
0,85 m/s. '
5 Avantageusement, au moins une zone d'agitation sur
deux est reliée à un régulateur de pH.
Dans ce cas, le régulateur de pH peut comporter au
moins une sonde 93a, 93b, 93c mesurant le pH dans la zone
d'agitation correspondante 78, 92a, 92b, 92c, 99a1, 99b1,
99c1, 99d1, 99e1, 99f1, 99g1, un boîtier de commande 94
et une pompe à circulation d'acide 95.
De préférence, le pH du milieu liquide est maintenu
à une valeur inférieure à 6 par le régulateur de pH et
très préférentiellement à une valeur comprise entre 2
et 3.
Aussi, la vitesse de circulation du liquide dans
l'enceinte 56 est de préférence d'environ 0,01 m/s.
Enfin, l'enceinte 56 comporte avantageusement au
moins trois couches de zinc 70, 85a, 85b, 85c, 99a, 99b,
99c, 99d, 99e, 99f, 99g.
Le dispositif de l'invention peut comprendre en
outre une enceinte de réduction du zinc 106 dans lequel
circule le liquide 68 en sortie de l'enceinte de
réduction des nitrates 56.
Dans ce cas, l'enceinte de réduction du zinc 106
comprend au moins une cellule d'électrolyse 110a, 110b,
110c, 110d, 110e, 110f.
Préférentiellement, chaque électrode cathodique
108a, 108b, lOBc des cellules d'électrolyse respectives
110a, 110b, 110c, 110d, 110e, 110f est réalisée par
compressiôrï de grains de charbons entre deux plaques
perforées 116b, 116b' et en ce qu'au moins un moyen
formant électrode 117 est enfoncé dans lés grains de
charbon et relié au pôle négatif d'un générateur de
courant.
Très préférentiellement, chaque électrode anodique
109a, 109b, 109c, 109d des cellules d'électrolyse
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
6
respectives 110a, 110b, 110c, 110d, 110e, 110f est
réalisée par compression de copeaux de zinc entre deux
plaques perforées 118a, 118a'; 118b, 118b' et en ce qu'au
moins un moyen formant électrode 119b, 119c est enfoncé
dans les copeaux de zinc et relié au pôle positif d'un
générateur de courant.
Aussi, l'enceinte de réduction du zinc 106 peut
comprendre au moins trois cellules d'électrolyse 110a,
110b, 110c, 110d, 110e, 110f.
De préférence, l'enceinte de réduction du .zinc 106
est verticalement disposée et les électrodes anodiques
109a, 109b, 109c, 109d et cathodiques 108a, 108b, 108c
formant les cellules d'électrolyse correspondantes 110a,
110b, 110c, 110d, 110e, 110f sont transversalement
disposées sur toute la largeur de l'enceinte 106 de façon
que tout le liquide circulant dans l'enceinte 106
traverse les cellules d'électrolyse, l'entrée du liquide
111, 115 est disposée dans la partie inférieure de
l'enceinte 106, la sortie de liquide 115 est disposée
dans la partie supérieure de l'enceinte 106 et le
dispositif de l'invention comporte en outre une pompe à
recirculation 113 permettant d'assurer la circulation et
recirculation du liquide depuis l'entrée 111, 115 jusqu'à
la sortie 112 en traversant toutes les cellules
d'électrolyse 110a, 110b, 110c, 110d, 110e, 110f.
L'enceinte 106 peut comprendre en outre un
régulateur de pH maintenant le pH du milieu liquide
circulant dans l'enceinte de réduction du zinc 106 à une
valeur supérieure à 7.
Le procédé et le dispositif de l'invention peuvent
être utilisés pour traiter tout milieu liquide chargé en
nitrates mais également pour traiter les eaux de drainage
de cultures.
L'invention sera mieux comprise et d'autres buts,
avantages et caractéristiques de celle-ci apparaîtront
plus clairement à la lecture de la description qui suit
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
7
et qui est faite au regard des dessins annexés sur
lesquels .
- la figure 1 représente l'évolution des
concentrations en nitrates dans le mïlieu liquide en
fonction du temps de traitement lorsque de la poudre de
zinc est utilisée;
- les figures 2a et 2b représentent l'évolution
des concentrations en azote correspondant à un facteur
près aux concentrations en nitrates et nitrites dans le
milieu liquide en fonction du temps de traitement avec et
sans ajustement du pH ;
- les figures 3a et 3b représentent l'évolution
des concentrations en azote correspondant à un facteur
près aux concentrations en nitrates et nitrïtes dans le
milieu liquide en fonction du temps de traitement selon
la fréquence d'ajustement du pH ;
- les figures 4a et 4b montrent l'évolution des
concentratïons en azote correspondant à un facteur près
aux concentrations en nitrates et nitrites dans le milieu
liquide en fonction du temps de traitement selon la
température du milieu réactionnel;
- la figure 5 représente l' évolution de Ln [NOz-]
en fonction du temps de traitement ;
- la figure 6 représente l'évolution de la
concentration en nitrites dans le milieu liquide en
fonction du temps de traitement selon la nature des
métaux utilisés ;
- la figure 7 représente l'évolution de la
concentration en nitrites dans le milieu liquide en
fonction du temps de traitement selon la vitesse
d'agitation du milieu liquide ;
- la figure 8 représente l'évolution de Ln C/Co
en nitrites en fonction du temps de traitement selon la
vitesse d'agitation du milieu liquide ;
- la figure 9 représente l'évolution de la
concentration en nitrites dans le milieu liquide en
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
8
fonction du temps de traitement selon le pH du milieu
liquide ;
- la figure 10 reprsente l'volution de la
concentratio n en nitrates dans le milieu liquide en
fonction du temps de traitement selon la masse de poudre
de zinc util is ;
- la figure 11 reprsente l'volution de la
concentratio n en nitrates dans le milieu liquide en
fonction du temps de traitement selon que le zinc utilis
est sous for me de poudre ou de copeaux ;
- la figure 12 reprsente l'volution de la
concentratio n en nitrates dans le milieu liquide en
fonction du temps de traitement lorsque des copeaux de
zinc sont iliss et selon le pH du milieu liquide ;
ut
- la figure l3 reprsente l'volution de la
concentratio n en nitrates dans le milieu liquide en
fonction du temps de traitement selon la concentration
initiale en nitrates ;
- la figure 14 reprsente l'volution de la
concentratio n en nitrates dans le milieu liquide en
fonction du temps de traitement lorsque le milieu liquide
est initiale ment charg en nitrates ;
- la figure 15 reprsente l'volution de Ln C/Co
en nitrates en fonction du temps de traitement selon les
masses et rmes de zinc utiliss ;
fo
- la figure 16 reprsente l'volution du log
d( [NOS-] en fonction du log (Zn) ;
/dt)
- la figure 17 reprsente l'volution de ln
d( [NOz-] en fonction du ln (Zn) selon le pH du milieu
/dt)
liquide ;
- la figure 18 reprsente l'volution de Ln C/Co
en nitrates en fonction du temps de traitement selon le
pH du milieu liquide ;
- la figure 19 reprsente l'volution du log
d ( [NO2-] en fonction du log (H+) selon le pH du milieu
/dt)
liquide ;
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
9
- la figure 20 représente l'évolution du log
d ( [NOZ-] /dt) en fonction du log (N02-) selon le pH du
milieu liquide ;
- la figure 21 représente l'évolution du log
d ( [NOz-] /dt) en fonction du log (NOz-) selon le pH du
milieu liquide ;
- la figure 22 représente l'évolution du log
d ( [NOZ-] /dt) en fonction du log (NOS-) à pH 4 ;
- la figure 23 représente l'évolution des
concentrations en nitrates et en nitrites en fonction du
temps de traitement lorsque le milieu liquide est
constitué par les eaux de draïnage ;
- les figures 24a et 24b représentent l'évolution
des concentrations en nitrates et en nitrites en fonction
du temps de traitement lorsque le milieu liquide est
constitué par les eaux de drainage selon la température
du milieu réactionnel et lorsque le pH est ajusté toutes
les demi-heures ;
- les figures 25a et 25b représentent l'évolution
des concentrations en nitrates et en nitrites en fonction
du temps de traitement lorsque le milieu liquide est
constitué par les eaux de drainage selon la température
du milieu réactionnel lorsque le pH est ajusté tous les
quart d'heures pendant la première heure de traitement
puis toutes les demi-heures ;
- la figure 26 représente l'évolution de la
concentration .en nitrites en fonction du temps de
traitement selon le pH du milieu liquide ;
- la figure 27 est une représentation schématique
du dispositif de l'invention selon un premier mode de
réalisation ;
- la figure 28 représente l'évolution de la
concentration en nitrites en fonction du temps de
traitement selon le pH et la masse de copeaux de zinc
utilisés lorsque le milieu liquide est traité dans le
dispositif de l'invention ;
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
- la figure 29 représente l'évolution de la
concentration en nitrites en fonction du temps de
traitement selon le pH et la masse de copeaux de zinc
utilisés lorsque le milieu liquide est traité dans le
5 dispositif de l'invention ;
- la figure 30 représente l'évolution de Ln C/Co
en nitrites en fonction du temps de traitement lorsque le
milieu liquide est traité dans le dispositif de
l'invention ;
10 - la figure 31 est une représentation schématique
du dispositif de l'invention selon un second mode de
réalisation ;
- la figure 32 est une représentation schématique
du dispositif de l'invention selon un troisième mode de
réalisation lorsqu'il comprend êgalement un dispositif de
réduction du zinc ;
- la figure 33 est un agrandissement de la partie
cerclée notée XXXIII de la figure 32.
Les conditions expérimentales des résultats
présentés sur les figures 1 à 4 correspondent à
l'utilisation d'une solution aqueuse d'un volume de 250
ml contenant des nitrates dans laquelle 10 grammes de
zinc sous forme de poudre sont ajoutés.
Le pH initial de la solution de nitrates est de
3,60, ce pH étant obtenu par ajout d'une quantité
appropriée d'acide chlorhydrique dans la solution.
De plus, cette solution est soumise pendant toute
la durée du traitement à une agitation continue réalisée
par un agitateur magnétique.
En référence à la figure 1, la courbe 1
représentant l'évolution de la concentration en nitrates
dans une solution maintenue à une température de 80°C,
diminue depuis une concentration initiale en nitrates de
150 mg/L jusqu'environ 15 mg/L au bout de 2 heures de
traitement ce qui correspond à un taux de conversion
de 90%.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
11
Les résultats présentés sur la figure 1 montrent
que les nitrates peuvent être réduits par le zinc en
solution.
Les résultats d'une étude paramétrique permettant
de mettre en évidence les paramètres influant sur
l'élimination des nitrates par le zinc pour optimiser les
conditions de traitement sont présentés sur les figures 2
à 4.
A cet effet, les figures 2 à 4 présentent
l'évolution des concentrations en azote correspondant à
un facteur près aux concentrations respectives en
nitrates et en nitrates sous forme d'histogrammes.
Plus prëcisément, les concentrations en nitrates
sont obtenues en multipliant la concentration en azote
par quatre et les concentrations en nitrates sont
obtenues en multipliant la concentration en azote par
trois.
A cet effet, les figures 2a et 2b présentent
l'évolution des concentrations en azote lorsque la
solution est maintenue à une température de 80°C et sur
lesquels les barres noires 3a, 3b correspondent aux
concentrations en nitrates et les barres grises 4a, 4b
correspondent aux concentrations en nitrates.
En référence à la figure 2a, il apparait une faible
réduction de la concentration en nitrates ainsi qu'une
faible augmentation de la concentration en nitrates pour
une durée de traitement de 2,25 heures.
Dans le cas de la figure 2b, le pH a êté maintenu à
une valeur inférieure à 6 par ajout d'acide chlorhydrique
dans la solution pendant le traitement. I1 apparaît une
très nette différence d'efficacité en terme de réduction
des nitrates entre les résultats présentés sur la figure
2a et ceux de la figure 2b puisque, dans ce dernier cas,
la concentration en nitrates est inférieure à 200 mg/L au
bout de 30 minutes de traitement et est nulle au bout
d'une~heure de traitement.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
12
En référence à la figure 3a, l'efficacité de
traitement en terme de réduction des nitrates en solution
est illustrée par les barres noires 5a lorsque le pH de
la solution est maintènu à un pH inférieur à 6 par
ajustement effectué une fois par heure pendant le
traitement et pour une température du milieu réactionnel
de 20°C.
Au contraire, en référence à la figure 3b, lorsque
cet ajustement de pH est effectué toutes les demi-heures
pendant le traitement la concentration de nitrates
représentée par la barre noire est nulle au bout
d'1 heure de traitement.
I1 est ainsi possible d'obtenir une réduction
totale des nitrates en un temps court en travaillant à la
température ambiante si un ajustement de pH permettant de
maintenir la solution à un pH inférieur à 6 est effectué
régulièrement pendant le traitement au moins toutes les
demi-heures.
Les figures 4a et 4b correspondent à l'évolution
des concentrations en nitrates illustrées par les barres
noires 7a, 7b, et en nitrates illustrées par la barre
grise 8a lorsque le pH de la solution est maintenu à une
valeur inférieure à 6 pendant le traitement et pour des
températures du milieu réactionnel différentes. Les
résultats de la figure 4a correspondant à une température
de la solution de 50°C et ceux de la figure 4b c à une
température de la solution de 80°C.
Il apparaît que la vitesse de disparition des
nitrates est supérieure à la température de 80°C à la
vitesse de disparïtion des nitrates lorsque cette
températurè est maintenue à 50°C.
En effet, au bout de 30 minutes de traitement, la
concentration en nitrates est inférieure à 200 mg/L
lorsque la température du milieu est de 80°C alors que
pour une température de 50°C la concentration en nitrates
est quasiment identique à la concentration initiale en
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
13
nitrates d'environ 920 mg/L au bout d'une demi-heure de
traitement.
Les résultats présentés sur les figures 2, 3 et 4
mettent en évidence que l'ajustement du pH et plus
généralement l'acidité du milieu réactionnel est un
premier paramètre à prendre en considération dans le
procédé de l'invention et que la température du milieu
réactionnel est également un paramètre influant sur
l'efficacité du traitement.
Ces résultats montrent également qu'il est possible
d'obtenir une réduction satisfaisante des nitrates en
solution à température ambiante à condition d'effectuer
un ajustement de pH régulier.
Enfin, ces résultats montrent surtout que l'ajout
de zinc dans un milieu liquide chargé en nitrates permet
d'obtenir une élimination totale des nitrates pouvant
être obtenue en moins d'1 heure de traitement à partir
d'une concentration en nitrates de plus de 800 mg/L.
De plus, un dosage par absorption atomique a montré
que dans les conditions décrites précédemment, la
concentration en zinc dans la solution après traitement
reste inférieure à 5 mg/L.
Il est possible de mettre en équation les réactions
mises en jeu par le traitement et faisant intervenir les
nitrates et le zinc, ce dernier intervenant comme
réducteur, de la façon suivante .
N03~ + Zn + 3H+ ~ HNOZ + Zn2+ + Hz0
2HN02 + 2Zn + 4 H+ -~ Nz0 + 2Zn~+ + 3H20
2 NOz- + 3 Zn + 8H+ ~ Nz + 4H20 + 3Zn2+
NOz- + 3 Zn + 8H+ -~ NH4+ + 2 H20 + 3 Zn2+
Conformément aux résultats expérimentaux présentés
sur les figures 1 à 4, la réaction d'oxydoréduction
impliquant les nitrates et le zinc en milieu acide
entraîne la formation d'acide nitreux et donc de nitrites
en solution.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
14
Les réactions précitées d'oxydoréduction sont
consommatrices de protons, ce qui est conforme aux
résultats précédemment décrits mettant en évidence la
nécessité de maintenir un pH acide pour assurer, en un
temps satisfaisant, la réduction totale des ions nitrates
en solution.
Ainsi, deux étapes peuvent être considérées à
savoir une première étape consistant à transformer les
nitrates en nitrates et la seconde consistant à
transformer les nitrates en protoxyde d'azote.
Par conséquent, la réduction des nitrates par le
zinc a été étudiée afin de comprendre et d'optimiser la
réaction de réduction des nitrates dans sa totalité,
d'autant plus que des tests préliminaires ont montré une
différence importante entre les vitesses de réduction des
nitrates et des nitrates, la vitesse de réduction des
nitrates étant largement supérieure à celle des nitrates.
La méthode utilisée pour doser les nitrates en
solution au cours du traitement est un dosage
colorimétrique par spectrophotométrie d'absorption
moléculaire.
Cette méthode est normalisée et son principe réside
dans la diazotation de l'amino-4-benzènesulfonamide par
les nitrates en milieu acide et sa copulation avec le
dichlorure de N-(naphtyl -1) diamino-1, 2 éthane qui
conduit à un complexe coloré pourpre pouvant être dosé
par spectrophotométrie.
L'équilibre entre les nitrates et les nitrates peut
évoluer rapidement, il est donc nécessaire de procéder au
dosage des nitrates le plus tôt possible après le
prélèvement~en le conservant à 4°C.
En ce qui concerne le mode opératoire, les lectures
s'effectuent à la longueur d'onde de 543 nm et les
réactifs impliqués sont les suivants .
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
Acide orthophosphorique(d=1.70) 100m1
Réactifs de diazotation .
- Amino-4-benzènesulfonamide 40g
5 - Dichlorure de N-(naphtyl-1) diamino-1, 2 éthane 2g
- Acide orthophosphorique 100m1
- Eau permutée q.s.p 1000m1
Solution mère étalon d'azote nitreux (N02) à 300mg/L
- Nitrite de sodium 492.8mg
10 - Eau permutée q.s.p 1000m1
Solution fille étalon d'azote nitreux (N02) à 1mg/1
- dilution 1/100 solution mère
15 La composition des fioles de volume 50 ml utilisées
pour les courbes d'étalonnage est présentée dans le
Tableau 1 suivant .
Numro des
fioles T I II III IV V VI
Solution
fille talon 0 1 2.5 5 7.5 10 15
lmg/1 (ml)
Eau permute
(ml) 50 49 47.5 45 42.5 40 35
[N-NOz-]
(mg/1) 0 0.02 0.05 0.1 0.15 0.2 0.3
[NOz-] (mg/1)
0 0.07 0.16 0.33 0.49 0.66 0.99
Tableau 1
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
16
Le matériel utilisé est le suivant .
- Spectrophotomètre Cary 50 bio, W visible
- Pipette LABMATE de volume 1000-5000 1 pour la
régulation manuelle du pH et le prélèvement des
échantillons
- pH-mètre Sartorius Professional Meter PP-15
- Agitateur en Téflon Eurostar digital IK (50-2000
trs/min)
- Balance sartorius LA 2305
- Régulateur de pH CONSORT 8305
Les mesures de réduction des nitrates sont
effectuées à partir d'une solution initiale titrée à
1 g/L de nitrates et sont réalisées à partir de nitrite
de sodium.
La réduction est effectuée dans un réacteur batch,
c'est à dire dans un bécher à température ambiante.
Le volume inïtial de la solution de nitrates est de
1 litre et le pH a été maintenu constant manuellement
tout au long de la réaction par ajout régulier d'acide
chlorhydrique 2M.
L'agitation de la solution est réalisée avec un
barreau aimanté en téflon et le zinc est ajouté dans la
solution de nitrates sous forme de poudre.
Les échantillons d'un volume de 4 ml qui sont
prélevés à intervalles réguliers sont filtrés puis dilués
par 1000 dans une fiole de 500 ml afin de respecter la
gamme étalon ( [NOZ] de 0 à 1 mg/L) .
50 ml sont alors prélevés de cette dernière
solution obtenue et sont introduits dans un bécher de
50 ml auquêl a été ajouté 1 ml de réactif prêcédemment
décrït.
La figure 5 présente l'évolution linéaire,
illustrée par la droite 9, du logarithme népérien de la
concentration en nitrates. en fonction du temps de
traitement exprimé en minutes, lorsque le pH de la
solution est maintenu à 5 pour une masse de zinc de 10 g.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
17
I1 apparaît que la cinétique de réduction des
nitrates à un ordre partiel de 1 par rapport aux
nitrates, l'équation de la droite étant de y = 0,4469 x +
7,5918.
A partir de cette droite 9, il est possible de
calculer K' dans l'équation suivante:
v (vitesse de réaction) - k' [NOz_]
D'après les résultats illustrés sur la figure 5, k'
est égal à -0,4469 min~l.
La Figure 6 présente l'évolution de la
concentration en nitrates exprimée en mg/L en fonction du
temps de traitement exprimé en minutes pour trois métaux
de natures différentes qui sont ajoutés dans la solution
dè nitrates dans des proportions stoechiométriques.
La courbe 10 représente l'évolution de la
concentration en nitrates lorsque 10 g de poudre de zinc
sont ajoutées dans la solution de nitrates, la courbe 11
représente l'évolution de la concentration en nitrates
lorsque 8,54 g de poudre de fer sont ajoutées à la
solution de nitrates, et enfin la courbe 12 illustre
l'évolution de la concentration en nitrates lorsque
4,13 g de poudre d'aluminium sont ajoutés dans la
solution.
Dans le cas de l'aluminium, il n'apparaît aucune
diminution de la concentration en nitrates au cours du
traitement et dans le cas du fer, bien que la
concentration en nitrates diminue, cette concentration
reste très supérieure à celle obtenue lorsque l'on ajoute
du zinc.
Ces résultats confirment la potentialité réductrice
inattendue du zinc sur les nitrates puisque avec
l'aluminium il semble qu'aucune réduction des nitrates
n'apparaît au bout d'une heure de traitement malgré un
potentiel standard de réduction plus fort que le zinc
(E°(Zn) - -0,763 V et E°(A1). - -1,66 V) alors que pour le
fer de potentiel standard intermédiaire (E° (Fe) - -0,44
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
18
V), il apparaît une faible réduction des nitrates bien
inférieure à celle obtenue avec le zinc.
Les figures 7 et 8 représentent respectivement
l'évolution de la concentration en nitrites et du
logarithme népérien de C/Co en nitrites en fonction de la
durée du traitement exprimée en minutes selon la vitesse
d'agitation de la solution traitée.
La courbe 13 de la figure 7 correspond à une
agitation de 0,55 m/s, la courbe 14 correspond à une
agitation de 0,825 m/s et la courbe 15 correspond à une
vitesse d'agitation de 1,1 m/s.
On constate que la vitesse d'agitation influe
considérablement sur la cinétique de réduction et qu'une
vitesse minimum de 0,825 m/s est préférable pour ne pas
limiter la vitesse de réactïon.
En considérant que le~ procédé de réduction des
nitrites comprend trois étapes, à savoir le transfert des
nitrites vers la surface métallique, la réaction à la
surface et le transfert des produits vers le volume du
liquide, et que cette dernière étape peut être négligée
si on considère que la totalité des nitrites est
transformée en azote, le transfert des nitrites vers la
surface active est un processus purement physique basé
sur le gradient de concentration comme force motrice et
l'équation de base est la suivante:
_dC = KAOC
dt
L'équation peut être facilement intégrée pour
obtenir le résultat suivant:
ln ~ = KAt
Co
Le coefficient de transfert de masse - K va
dépendre des conditions hydrodynamiques et donc notamment
de la vitesse d'agitation du milieu liquide.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
19
Les résultats présentés sur la figure 8 sont
conformes aux résultats de la figure 7 mais exprimés de
façon à mettre en évidence la variation du coefficient de
transfert de masse puisque la droite 16 de la figure 8
correspondant à une vïtesse d'agitation de 0,55 m/s a
pour êquation y - -0,1309x + 0,8922, la droite 17
correspondant à une vitesse d'agitation de 0,825 m/s a
pour équation y - -0,4826x + 0,8265 et la courbe l8
correspondant à une vitesse d'agitation de 1,1 m/s a pour
équation y = 0,4554x + 0,5543.
I1 apparaît que les résultats obtenus pour, une
vitesse d'agitation de 0,825 m/s et de 1,1 m/s sont
quasiment identiques.
Cela peut être expliqué par le fait que l'on vient
de dépasser la vitesse minimale de mise en suspension
totale qui peut être estimé approximativement à 0,84 m/s
(0,85 m/s pour les particules ayant un diamètre de
70 microns), la vitesse minimale pour les particules de
500 microns pouvant être estimée à 12 m/s ce dont il
résulte que ces particules resteront dans le fond du
bécher avec un certain mouvement.
Une fois la totalité de la surface de zinc
disponible, il n'apparaît aucune évolution dans le
comportement du système, c'est-à-dire entre les résultats
obtenus à 0, 825 m/s et à 1, 1 m/s, ce qui laisse imaginer
que le paramètre clé est la surface du contact de zinc
disponible et que, par conséquent, turbuliser
l'écoulement à partir d'un certain seuil n'apporte rien
en terme d'efficacité du procédé.
La figure 9 illustre l'évolution de la
concentration en nitrates en fonction du temps de
traitement exprimé en minutes selon le pH de la solution.
Sur cette figure, la courbe 19 correspond à un pH
égal à 11, la courbe 20 correspond à un pH - 8 et la
courbe 21 à un pH égal à 5..
'Ces résultats confirment que la réduction des
nitrates par le zinc est plus rapide à pH acide et permet
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
d'obtenir un taux de conversion des nitrates de 100% pour
des temps de réaction relativement courts, c'est-à-dire
de l'ordre de 16 minutes.
En revanche, lorsque le pH est supérieur à 6, la
5 vitesse de réaction de réduction des nitrates est
considérablement diminuée, ce ralentissement pouvant
s'expliquer par la diminution du nombre de protons en
solution mais également par la formation d'un précipité
d'hydroxyde de zinc qui se dêpose sur la poudre de zinc
10 et réduit considérablement la surface d'échange alors que
nette dernière est un paramètre important dans le procédé
de l'invention.
La figure 10 présente à cet effet l'évolution de la
concentration en nitrates en fonction du temps de
15 traitement exprimé en minutes pour différentes masses de
poudre de zinc, et donc pour différentes surfaces
d'échange, dans la solution de nitrates.
La courbe 22 correspond 'a une masse de zinc de 5g,
et la courbe 23 correspond à une masse de zinc de lOg.
20 Il apparaît que plus la masse de zinc ajoutée en
solution est élevée, plus le temps nécessaire à la
réduction totale des nitrates diminue ce qui peut
s'expliquer par l'augmentation de la surface de contact
entre le zinc et la solution aqueuse de nitrates.
I1 est intéressant industriellement de travailler
avec des copeaux de zinc au lieu de la poudre de zinc, ce
qui permet notamment d'éviter la présence de particules
de zinc en suspension dans la solution à traiter.
Cependant, lors de l'utilisation de copeaux de zinc
il est préférable que ces copeaux contiennent 5%
d'impuretés et souillés par la graisse soit dégraissés et
rincés à l'eau déminéralisée.
Les expériences menées avec les copeaux de zinc et
dont les résultats sont présentés ci-après consistent à
ajouter les copeaux de zinc. dans un volume de 1, 5 litres
d'une~solution de nïtrites et de réaliser l'agitation de
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
21
la solution de nitrates par un agitateur mécanique muni
d'un mobile en Téflon.
La figure 11 illustre la comparaison entre
l'évolution de la concentration en nitrates exprimée en
mg/L en fonction du temps de traitement exprimé en
minutes lorsque le zinc est utilisé sous forme de poudre
et celle lorsque le zinc est utilisé sous forme de
copeaux pour un pH maintenu constant à 5 pendant toute la
durée de l'expérience dans la solution, la vitesse
d'agitation de cette solution étant de l,l m/s.
La courbe 24 correspond à l'utilisation de copeaux
de zinc pour une surface d'échange de 0,04 m2 et la courbe
25 correspond à l'utilisation de poudre de zinc pour une
surface d'échange de 4,14 m~.
A partir de ces deux courbes, il apparaît que la
réduction des nitrates est plus lente avec les copeaux de
zinc ce qui peut s'expliquer par la diminution de la
surface d'échange qui est environ 100 fois plus faible
dans le cas des copeaux comparés au cas de la poudre.
Cependant, la diminution de la surface d'échange.
résultant de l'utilisation de copeaux de zinc peut être
compensée par un abaissement du pH comme le montre les
résultats présentés sur la figure 12.
Sur cette figure, qui représente l'évolution de la
concentration en nitrates en fonction dti temps de
traitement exprimé en minutes, la courbe 26 correspond à
un pH de la solution maintenu à 5, la courbe 25
correspond à un pH de la solution maintenu à 4, la courbe
24 correspond â un pH de la solution maintenu à 3 et la
courbe 23 à un pH de la solution maintenu à 2.
I1 résulte de ces résultats qu'en utilisant des
copeaux de zinc avec une surface d'échange de 0,04 m2
seulement par litre de solution et pour une vitesse
d'agitation de 1,375 m/s, il est possible à pH 2
d'obtenir une réduction totale des ions nitrates dans une
solution de concentration initiale en nitrates de 1 g/L
en un temps de traitement de 80 minutes avec une
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
22
consommation totale en acide chlorhydrique à 2M de 97 ml
qui a permis de maintenir le pH à sa valeur initiale
pendant toute la durée du traitement.
L'augmentation de la vitesse de réaction avec la
diminution du pH de la solution des nitrites est conforme
aux résultats précêdemment obtenus avec la poudre de zinc
et une solution chargée en nitrates.
D'autre part, la vitesse de réductïon des nitrites
est quasiment identique quelle que soit la concentration
initiale en nitrites comme le montrent les résultats
présentés sur la figure 13 qui représente l'évolution de
la concentration en nitrïtes en fonction du temps de
traitement exprimé en minutes, sur laquelle la courbe 29
correspond à l'utilisation d'une solution de nitrites de
concentration initiale en nitrites de plus de 2000 mg/L
la courbe 28 à une concentration initiale en nitrites
d'environ 1500 mg/L et la courbe 27 à une concentration
initiale en nitrites de 1000 mg/L.
Les courbes 27 à 29 correspondent à des traitements
effectués à un pH 2 ajusté pendant toute la durée du
traitement, avec une masse de copeaux de 15,79 g
correspondant à une surface d'échange de 0,04 mz par litre
de solution et à une vitesse d'agitation de 1,375 m/s.
D'après les résultats de la figure 13, quelle que soit la
concentration initiale de nitrites, la réductïon totale
des nitrites en solution est obtenue en un temps de
traitement approximativement identique de 60 minutes.
Des essais avec les copeaux de zinc ont également
été menés à partir d' une solution chargée en nitrates de
concentration initiale de 1 g/L et préparée à partir de
nitrate de potassium.
La réduction est effectuée dans un réacteur batch
dans lequel 15,79 grammes de copeaux de zinc sont ajoutés
dans la solution de nitrate d'un volume de 1 litre.
Le pH est maintenu .constant manuellement à une
valeur de 2 pendant toute la durée du traitement par
ajout régulier d'acide chlorhydrique 2M.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
23
Le traitement est effectué à température ambiante
et la figure 14 présente l'évolution de la concentration
en nitrates dans la solution de nitrates 'en fonction du
temps de traitement exprimé en minutes.
D'après les résultats de la figure 14, la
concentration en nitrates pendant les 25 premières
minutes de traitement augmente pour atteindre une
concentration maximum d'environ 280 mg/L puis pour
aboutir après 75 minutes de traitement, à une
concentration réduite en nitrates de 0,5 mg/L.
Une mesure complémentaire de la concentration en
nitrates après 75 minutes de traitement montre une
concentration finale en nitrates de 0 mg/L.
Ces résultats confirment la réduction des nitrates
et des nitrates par ajout de copeaux de zinc dans une
solution de nitrates à température ambiante et à pH
acide.
Les figures 15 à 22 illustrent des résultats
expérimentaux permettant expliquer les phénomènes induits
par la présence de zinc dans une solution de nitrates et
pour mettre en évidence les paramètres impliqués dans les
réactions de réduction.
En effet, la cinétique de réduction dépend
directement des réactions à la surface du zinc mais
également des phênomènes de transfert des ions nitrates
vers le zinc.
Lorsque la vitesse de mise en suspension totale des
particules de zinc, dans le cas de l'utilisation de
poudre de zinc, est atteinte, le transfert des ions
nitrates dans le liquide vers le zinc est limité par la
diffusion. Le flux transféré s'écrit de la manière
suivante:
3 5 N- dC =K . S . o C . ~ f dC = ~K.S.dt
dT coi-~ o
~ln ~ =K.S.t
Co
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
24
La figure 15 représente l'évolution de ln (C/Co) en
fonction du temps de traitement exprimé en secondes pour
des masses et des formes de zinc différentes, à savoir
poudre et copeaux, et donc des surfaces de contact
différentes.
La droite 30 de la figure 15 correspond à
l'utilisation de copeaux de zinc pour une surface de
contact de 0,004 mz, la droite 31 correspond à
l'utilisation de poudre de zinc pour une surface de
contact de 2,07 mz et la droite 32 illustre'les'résultats
obtenus avec de la poudre de zinc pour une surface de
contact de 4,14 m2.
La pente de chaque droite représente le produit K x
S qui peut permettre de déterminer K à condition de
pouvoir déterminer la surface.
Lorsque le zinc est utilïsé sous forme de poudre,
les calculs de surface sont approximatifs du fait que
cette poudre est constituée d'un mélange de particules
sphériques de diamètre compris entre 10 et 500
micromètres.
L'estimation de la surface est basée sur le
diamètre médian donné par le granulomètre.
Pour les copeaux, l'estimation de la surface est
faite à partir de mesures de surface et de pesée.
En considérant que l'on se trouve en régime
d'agitation correcte, il est possible de faire une
première estimation des coefficients de transfert de
matière comme présenté sur le Tableau 2 suivant.
Masse Zinc Surface d'change K.S K
(g) (m2) (s-1) (m 2s-1)
Poudre 5 2, 07 2 . 5 1, 208 .
. 10-3 10-3
10 4, 14 7'10-3 1, 691 .10-3
Copeaux 15.79 0,00395 5.10-6 1.266.10-3
Tableau 2
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
D'après ces résultats, le coefficient de transfert
pour les copeaux est très proche de celui obtenu avec de
la poudre ce qui implique que les conditions
hydrodynamiques sont comparables et que l'on peut ainsi
5 considérer que les effets observés ne sont uniquement dus
qu'à la cinétique chimique.
En ce qui concerne la réaction de réduction des
nitrates à la surface du zinc, cette réaction est
hétérogène, irréversible et notamment caractérisée par un
10 dégazage d'azote. Les ordres partiels par rapport à
chaque constituant correspondent au coefficient
stoechiométrique.
I1 est donc nécessaire de déterminer les ordres
partiels par rapport à chaque constituant et il suffit
15 pour cela d'isoler chaque constituant conformément à la
méthode d'isolement d'Ostwald qui consiste à mettre un
large excès de tous les réactifs par rapport à chaque
constituant étudié.
La réaction de base tenant compte de toutes les
20 interactions possibles peut être présentée de la façon
suivante:
a NOZ- + b H+ + c Zn ~ N2 + d NH40H + f H20 + c Znz+
25 Dans cette équation il n'est pas tenu compte de la
formation possible mais non démontrée de NOx.
La vitesse de réaction des nitrates peut être
exprimée de la façon suivante:
_ d' a~2~ - k [NOz-] aZn° [H+] b= k' [NOS-] a avec k' = k Zn°
[H+] n
En réalisant des expériences avec des
concentrations constantes pour les constituants autres
que les nitrates, il est pôssible de déterminer l'ordre
partiel par rapport aux nitrates.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
26
En ce qui concerne l'étude pour le zinc, comme la
réaction à la surface est hétérogène, la comparaison doit
être effectuée en utilisant un seul type de zinc et en
considérant que la surface de zinc disponible est
proportionnelle à la masse de zinc.
Les essais ont été réalisés avec de la poudre de
zïnc de concentration 5 g/L et 10 g/L pour deux pH
différents respectivement de 4 et de 5.
Les résultats sont présentés sur la figure 16 sur
laquelle la droite 33 représente l'évolution du log
d [NOz/dt] en fonction du log (Zn) .
Ces résultats devraient montrer une légère
différence au niveau de l'ordonnêe â l'origine mais des
faibles concentrations en protons ont une incidence
insignifiante.
L'ordre partiel avec les copeaux de zinc à pH 2 et
pH 3 a également été étudié et les résultats sont
présentés sur la figure 17 sur laquelle comme pour la
figure 16 le log d[NOa]/dt est exprimé en fonction du log
(Zn) et sur laquelle la droite 34 correspond à un pH de 3
et la courbe 35 correspond à un pH de 4.
A partir de ces résultats représentant la vitesse
de réduction des nitrites en fonction du pH pour une même
masse de zinc, on trouve c=0,744 et k'=0,093.
L'ordre partiel par rapport aux nitrites avec les
copeaux de zinc varie légèrement selon le pH mais on
donne une moyenne de 0,749 ce qui est en.accord avec le
résultat précédent. Bien entendu, on ne retrouve pas
cette même constante pour les deux pH étudiés.
En ce qui concerne l'étude pour le pH, cette étude
a été effectuée successivement avec de la poudre de zinc
et des copeaux de zinc.
Les résultats sont représentés sur la figure 18 qui
exprïme l'évolution de Ln (C/Co) en nitrites en fonction
du temps de traitement et sur laquelle la courbe 36
correspond à un pH de 5, la courbe 37 correspond à un pH
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
27
de 4, la courbe 38 correspond à un pH de 3 et enfin la
courbe 39 correspond à un pH de 2.
Le calcul de l'équation de ces courbes montre que
les corrélations Ln (C/Co) - f (t) ne sont pas des droites
et que par conséquent, à partir de cette première
approximation et en utilisant la théorie de Van't Hoff,
la réaction ne peut pas avoir un ordre partiel de 1 par
rapport aux protons.
De plus, il apparaît une différence flagrante de
comportement du système entre un pH de 2 et un pH de 4 et
5 et ce, conformément à ce qui est représenté sur la
figure 19 sur laquelle la courbe 40 représente la vitesse
de réduction des nitrites en fonction du log [H+] pour
des pH de X et la courbe 41 correspond à des pH X.
La dïfférence de comportement pour ces deux gammes
de pH provient de mécanismes réactionnels différents et
doit mener à des proportions différentes entre les
produits de la réaction.
En fait, le système évolue progressivement d'un
mécanisme vers un autre avec un changement important aux
alentours d'un pH de 4.
En ce qui concerne l'étude pour les nitrites, des
essais concernant l'ordre partiel pour les nitrites ont
été menés en deux parties pour deux pH différents.
La figure 20 représente l'évolution du log d[NOZ]/dt
en fonction du log [N02] pour 2 pH différents, à savoir un
pH de 2 comme illustré par la courbe 42 et un pH de 3
comme illustré par la courbe 43.
A partir de cette évaluation de l'ordre partiel par
rapport aux protons à pH bas, il apparaît qu'en
augmentant le pH, l'ordre partiel par rapport aux
nitrites diminue.
Dans le même temps, l'analyse du mécanisme
réactionnel suggère la formation d'ammonium dont la
concentration augmente avec,la diminution du pH.
~En effectuant des analyses pour l'azote Kjeldahl,
cette supposition a été confirmée et les résultats réels
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
28
sont légèrement inférieurs aux prévisions théoriques,
c'est-à-dire d'approximativement de -15~.
Cette différence est probablement due à un
stripping partiel d'ammoniaque entre le moment de la
prise d'échantillon et le moment du dosage.
La figure 21 illustre les résultats obtenus dans
les mêmes conditions expérimentales que celles dont les
résultats sont représentés en figure 20, mais sur
laquelle la courbe 44 correspond à un pH de 4 à un pH
de 5.
I1 apparaît d'après ces résultats que lorsque le pH
est supérieur à 3,5-4, le changement de mécanisme se
produit et l'ordre partiel pour les nitrates se rapproche
de nouveau de celui obtenu à pH - 2 , mais les conditions
n'étant pas les mêmes, on ne retrouve pas le même
mécanisme.
En outre, il a été décelé moins d'ammonium dans la
solution traitée ce qui peut être attribué, d'une part au
mécanisme réactionnel dans lequel une partie de
l'ammonium est utilisé pour réduire les nitrites en
utilisant le zinc comme catalyseur, et d'autre part au
stripping de l'ammoniaque qui s'accélère avec le passage
vers des pH neutres.
De plus, l'utilisation des copeaux de zinc change
la donne puisque la faible surface de contact ne permet
pas au zinc de jouer le double rôle de réducteur e,t de
catalyseur.
La figure 22 sur laquelle la courbe 46 représente
l'évolution de l'ordre partiel par rapport aux nitrites
avec des copeaux de zinc à pH 4 met en évidence, de par
la dispersion des points observés sur cette figure, le
changement de priorité en fonction de la concentration
des produits intermédiaires, à savoir NOz- et NH4+.
Cette étude sur la cinétique chimique illustrée par
les figures 15 à 22 montre que plus le pH est acide, plus
la réduction est rapide mais que dans le même temps, on
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
29
favorise fortement la formation d'ammonium et davantage
d'acide est consommé.
La possibilité d'accélérer la réaction tout en
diminuant la formation de ce produit réside dans
l'utilisation d'une surface de contact plus importante
lors de l'utilisation de copeaux de zinc.
Si cette étude sur l' ordre partiel met en évidence
des paramètres clés dans la réaction de réduction, ces
tests sont tous effectués sur des solutions fabriquées à
partir de nitrate et de nitrite de sodium.
C'est pourquoi, des tests de réduction des nitrites
et des nitrates dans des eaux de drainage contenant une
forte proportion de nitrates mais contenant également une
multitude d'autres éléments chimiques sont effectués et
les résultats de ces tests sont présentés ci-après.
I1 convient en effet de vérifier si la réduction
des nitrates par le zinc est assurée en présence d'autres
composés minéraux susceptibles d'être également réduits
tels que les sulfates, et les phosphates ou d'autres
éléments pouvant limiter la réduction des nitrates et des
nitrites par un dépôt à la surface du zinc.
Les eaux de draïnage traitées présentent une
concentration en nitrate de 1,99g/L.
Ces eaux de drainage sont traités par ajout de 10 g
de poudre de zinc dans un volume de 250 ml d'eau de
drainage à une température d'environ 20°C, sous agitation
magnétique et à un pH initial de 3,6 obtenu par ajout
d'acide chlorhydrique.
La figure 23 illustre les résultats obtenus en
terme de concentration en nitrates présentée sous forme
d'histogrammes dans lesquels les barres noires 46
correspondent à la concentration en nitrates et les
barres grises 47 correspondent à la concentration en
nitrites.
On constate que la réduction totale des nitrates et
nitrites présents dans les eaux de drainage est atteinte
après 3 heures de traitement.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
Ce temps de réduction est quelque peu augmenté par
rapport au temps de réduction des nitrates et nitrates
dans une solution artificielle chargée en nitrates ce qui
peut s'expliquer par la présence de composés
5 perturbateurs présents dans les eaux de drainage.
Les figures 24a et 24b montrent l'influence de la
température de traitement sur le temps de réduction des
nitrates et des nitrates dans les eaux de drainage pour
un pH ajustë toutes les demi-heures et maintenu de cette
10 façon à une valeur inférieure à 6 par ajout régulier
d'acide chlorhydrique.
Sur les figures 24a et 24b, les concentrations en
nitrates sont représentés par les barres noires
respectives 48a, 48b et les concentrations en nitrates
15 sont représentées par les barres grises respectives
49a, 49b.
La fïgure 24a correspond à une température du
milieu réactionnel de 20°C et la figure 24b correspond à
une température du milieu réactionnel 80°C.
20 Comme dans le cas d'une solution artificielle de
nitrates, une élévation de la température du milieu
réactionnel permet de diminuer le temps de réaction, ce
dernier ayant été réduit d'approximativement 3 heures en
travaillant à 80°C par rapport aux résultats obtenus
25 à 20°C.
Comme pour une solution artificielle de nitrates,
l'ajustement régulier du pH du milieu réactionnel reste
un paramètre important permettant de diminuer le temps de
réaction mais également d'obtenir une bonne
30 reproductibilité des résultats.
A cet effet, les figures 25a et 25b mettent en
évidence l'importance de l'ajustement régulier du pH lors
de la réduction des nitrates et nitrates dans les eaux de
drainage.
La figure 25a représente les résultats obtenus en
terme~de concentration en nitrates représentés par les
barres noires 50a et en terme de concentration en
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
31
nitrates représentés par les barres grises 51a, lorsque
la température du milieu réactionnel est de 20°C et que
le pH est ajusté à une valeur inférieure à 6 tous les
quart d'heure pendant la première heure de traitement
puis toutes les demi-heures après la première heure de
traitement.
La figure 25b représente quant à elle l'évolution
de la concentration en nitrates représentée par les
barres noires 50b et l'évolution de la concentration en
nitrates représentée par les barres grises 51b lorsque la
température du milieu réactionnel est de 80°C pour un
ajustement de pH identique à celui correspondant aux
conditïons expérimentales de la figure 25a.
Une fois encore, on constate une amélioration de
l'efficacité de traitement lorsque la température du
milieu réactionnel augmente et on constate également, en
comparant les résultats de la figure 25a avec ceux de la
figure 24a et en comparant les résultats entre la
figure 25b et la figure 25a, que plus le pH est ajusté
régulièrement pendant le traitement, plus la réduction
des nitrates et des nitrates est élevée.
Ces résultats sont tout à fait conformes avec ceux
obtenus à partir d'une solution artificielle de nitrates.
La figure 26 montre l'évolution de la concentration
en nitrates dans les eaux de drainage lorsque 15, 79 g de
copeaux de zinc sont ajoutés à une solution de 1 litre
constituée d'eaux de drainage pour un pH maintenu
constant manuellement par ajout régulier d'acide
chlorhydrique 2M et pour une vitesse d'agitation de
1,37 m/s.
Lescourbes 52, 53 et 54 de la figure 26
correspondent respectivement à un pH de la solution
maintenu à 4,3 et 2 pendant toute la durée du traitement.
D'après ces résultats, il apparaît que les vitesses
de formation et de réduction des nitrates en solution
varient avec le pH et que lorsque le pH diminue ces
vitesses augmentent.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
32
Il apparaît également que la concentration maximum
en nitrites au cours du traitement est inférieure lorsque
le pH est maintenu à 2 par rapport à un pH maintenu à 3.
Ces résultats vont dans le même sens que les
résultats obtenus avec la poudre de zinc puisque à pH 2,
et comme représenté sur la figure 26, le rendement de
conversion des nitrites est de 100 au bout de 75
.minutes, et que de plus, la concentration en nitrates au
bout de 75 minutes de traitement qui a été mesurée est de
1,78 mg/L, cette dernière valeur respectant largement les
normes de rejet en vigueur.
On attribue le ralentissement de la réaction de
réduction des nitrates et des nitrïtes par rapport à la
solution artificielle à la présence de sulfates et de
phosphates qui participe dans les eaux de drainage aux
réactions induites.
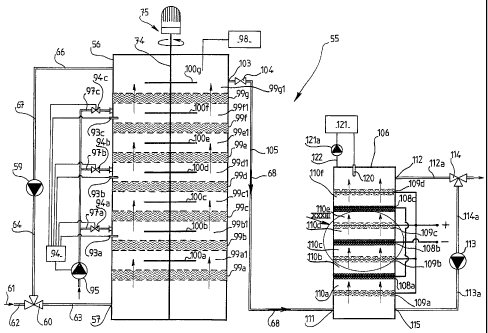
En référence à la figure 27, le dispositif de
l'invention 55 selon un premier mode de réalisation
comporte une première enceinte de traitement 56 en acier
inoxydable d'un volume de 40 litres et d'un volume utile
de 36 litres dont la partie inférieure comporte une
entrée de liquide 57 et dont la partie supérieure
comporte une sortie de liquide 58.
Une pompe à recirculation 59 permet d'assurer la
circulation du liquide dans l'enceinte 56 à un débit
d'environ 600 L/h depuis l'entrée de liquide 57 jusqu'à
la sortie de liquide 58 depuis laquelle le liquide
circule dans un premier conduit 66 jusqu'à une première
vanne trois voies 65 qui permet, soit d'évacuer le
liquide traité 68 contenu dans l'enceinte 56 en le
faisant circuler dans un deuxième conduit 69, soit de
faire circuler le liquide dans un troisième conduit 67
jusqu'à la pompe 59.
Depuis la pompe 59, le liquide circule alors dans
un quatrième conduit 64 jusqu'à une deuxième vanne trois
voies ~ 60 puis dans un cinquième conduit 63 jusqu'à
l'entrée de liquide 57.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
33
Le remplissage de l'enceinte 56 en début de
traitement s'effectue en faisant circuler le liquide à
traiter 61 dans un sixième conduit 62 puis dans le
cinquième conduit 63 via la deuxième vanne trois
voies 60.
Dans la première enceinte de traitement 56, une
couche de zinc 70 d' une hauteur d' environ 10 cm réalisée
par compression de copeaux de zinc 70a entre deux plaques
perforées 71, 72, est disposée transversalement dans la
partie basse de la première enceinte 56 sur toute la
largeur de l'enceïnte 56 de façon que tout le liquide
circulant dans l'enceinte traverse la couche de zinc 70.
L'agitation du milieu liquide dans l'enceinte 56
est assurée par un agitateur 73 comportant une tige
verticale 74 dont la rotation est assurée par un
moteur 75 à laquelle cette tige 74 est reliée et deux
mobiles d'agitation 76,77 solidaires de la tige
verticale 74 et respectivement dispôsées en dessous et au
dessus de la couche de zinc 70 en définissant des
première 78 et deuxième 79 zones d'agitation du liquide.
La vitesse d'agitation maximale de l'agitateur 73
dans le dispositif de l'invention selon le premier mode
de réalisation est de 0,84 m/s.
Le pH de la première zone d'agitation 78 est
contrôlé par une sonde pH 80 traversant l'enceinte 56 au
niveau de la zone 78 et est ajusté par un moyen
d'ajustement du pH 81 permettant d'ajouter de l'acide
chlorhydrique à 35~ en masse dans le liquide circulant
dans l'enceinte 56.
Ainsi, le milieu liquide à traiter circule au moins
une fois dans l'enceinte 56 en traversant la couche de
copeaux de zinc 70a et en étant soumis à une agitation
permanente et à une régulation de pH.
La figure 28 illustre les résultats obtenus en
terme de concentration en nitrites lorsqu'une solution de
concentration initiale en nitrates est de 2 g/L est
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
34
traité dans le dispositif 55 représenté en figure 27 avec
un débit de 1500 1/h assuré par la pompe 59.
La courbe 82 correspond à un traitement durant
lequel le pH est maintenu à 2 et dans lequel 6000 g de
copeaux de zinc sont utilisés pour réaliser la couche de
zinc 70.
La courbe 83 correspond quant à elle à un
traitement dans lequel le pH est maintenu à 3 et dans
lequel 5000 g de copeaux de zinc sont utilisés pour
réalïser la couche de zinc 70.
On constate que la réduction totale des nitrites
est obtenue à pH 2 pour une masse de zinc de 6000 g au
bout de 90 minutes de traitement.
Conformément à la courbe 83, en maintenant le pH de
la solution à 3 avec une masse de zinc de 5000 g, le pic
de nitrites formé présente un décalage d'environ 100
minutes par rapport au pic de nitrites de la courbe 82.
L'augmentation de la masse de zinc basée sur un
rapport surface de zinc disponible/volume de liquide
traité permettrait d'augmenter plus encore l'efficacité
de traitement.
La figure 29 illustre l'évolution et la
concentration en nitrites dans les eaux de drainage de
concentration initiale en nitrates de 1,99 g/L lorsque
ces eaux de drainage circulent dans le dispositif de
l'invention 55 représenté sur la figure 27 et pour un
débit de circulation du liquide dans l'enceinte 56 de
360 1/h.
En référence à la figure 29, la courbe 84 correspond
à un pH maintenu à 3 pour une masse de zinc de 6000 g, la
courbe 85 correspond à un pH maintenu à 3 pour une masse
de zinc de 758 g, la courbe 86 correspond à un pH
maintenu à 3 pour une masse de zinc de 1516 g, la
courbe 87 correspond à un pH maintenu à 3 pour une masse
de zinc de 378 g et enfin la courbe 88 correspond à un pH
mainténu à 2 pour une masse de zinc de 6000 g.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
Il apparaît, d'après ces courbes, que l'augmentation
de la masse de zinc et la diminution du pH permettent
d'augmenter l'efficacité de traitement.
En effet, à un pH de 2 et pour une masse de zinc de
5 6000 g, comme illustré par la courbe 88, un traitement de
105 minutes permet d'obtenir des eaux de drainage de
concentration nulle en nitrites et de concentration en
nitrates mesurée de 27 mg/L, soit sous le seuil de
50 mg/L.
10 Par conséquent, le dispositif de l'invention permet à
partïr d'eaux de drainage chargés à environ 2 g/L en
nitrates de réduire la quasi-totalité des nitrates par
obtention d'une concentration finale en nitrates de moins
de 30 mg/L tout en éliminant totalement les nitrites
15 formés au cours de la réaction de réductïon des nitrates
par le zinc.
Le tableau 3 présente la surface d'échange entre le
zinc et la solution lorsque des copeaux de zinc sont
utilisés et ce comparativement à l'utilisation de la
20 poudre de zinc.
Surface
Surf ace
Type Quantit par litre KA
z
totale (m
)
(m2/1 )
Poudre 108 4,14 4,14 0,414
3788 0,624 0,0156 0,0037
Copeaux de 7588 1,248 0,0312 0,0075
zinc 15168 2,504 0,0626 0,015
60008 10 0,25 0,06
Tableau 3
La figure 30 représente l'êvolution de Ln de (C/Co)
25 en nitrites par rapport au temps de traitement exprimé en
minutes et l'équation de la droite 88 obtenue de la
Figure 9, qui est de y - -.0,0523 x - 1,3604, permet de
calculer le coefficient d'échange dans le dispositif de
l'invention qui est de 0,006 kg/m2s.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
36
La figure 31 représente le dispositif 55 de
l'invention selon un second mode de réalisation dans
lequel le système d'entrée et de sortie du liquide de
l'enceinte 56 ainsi que le système de recirculation du
liquide dans l'enceinte 56 impliquant l'entrée de
liquide 57, la sortie de liquide 58, les deux vannes
trois voies 60, 65 et la pompe 59 sont identiques à ceux
du dispositif de l'ïnvention selon le premier mode de
réalisation représenté sur la figure 27 ainsi que le
système de remplissage et de vidage de l'enceinte 56.
Le dispositif représenté en figure 31 comporte trois
couches de zinc transversales 85a, 85b, 85c d'une hauteur
inférieure à 10 cm régulièrement répartis sur toute la
hauteur de l'enceinte 56 de façon que tout le liquide
circulant dans l'enceinte 56, circule à travers les trois
couches de zinc 85a, 85b, 85c qui sont réalisés par
compression de copeaux de~ zinc entre deux plaques
perforées respectives 86a, 86a'; 86b, 86b'; 86c, 86c',
chaque couche de copeaux de zinc 85a, 85b, 85c présentant
une hauteur comprise entre 7 et 10 cm.
Comme pour le dispositif représenté sur la figure 27,
l'agitation du milieu liquide est assurée par
l'agitateur 73 constitué de la tige verticale 74 reliée
au moteur 75 qui assure la rotation de la tige verticale
et de trois mobiles d'agitation 90a, 90b, 90c solidaires
de la tige verticale 74 et respectivement disposés dans
les zones d'agitation 92a, 92b, 92c respectivement
situées au-dessus de chaque couche de zinc 85a, 85b, 85c.
Au niveau de l' entrée de liquide 57, une sonde pH 91
est reliée à une pompe 92 pouvant injecter de l'acide
chlorhydrique dans le conduit 63 qui débouche sur
l'entrée de liquide 57 en faisant circuler l'acide à
travers un conduit 93 et une vanne deux voies 931
commandée par un boîtier de commande non représenté relié
à la sonde 91 et à la pompe.92.
Aïnsi, si le pH est trop élevé dans la zone
inférieure de l'enceinte 56, c'est-à-dire sous la
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
37
première couche de zinc 85a, une quantité d'acide
chlorhydrique appropriée est injectée dans l'enceinte 56
au niveau de l'entrée de liquide 57.
Dans chaque zone d'agitation 92a, 92b, 92c, une sonde
pH respective 93a, 93b et 93c mesure le pH et est reliée
à un boîtier 94 lui-même relié à une pompe d'injection
d'acide chlorhydrique 95.
Si l'une ou les sondes 93a, 93b, 93c détectent une
augmentation de pH, la pompe 95 commandée par le
boîtier 94 envoie une quantité d'acide chlorhydrique
appropriée à travers un conduit principal 96 et le
conduit 97a, 97b et/ou 97c reliant le conduit 96 à la
zone d'agitation 92a, 92b, 92c dans laquelle la sonde pH
respective 93a, 93b, 93c a détecté une augmentation
de pH.
Chaque conduit 97a, 97b, 97c comporte une vanne deux
voies correspondante 94a, 94b, 94c commandée par le
boîtier 94 et permettant à l'acide chlorhydrique
circulant dans le conduit 97a, 97b, 97c, d'être injecté
dans la zone d'agitation correspondante 92a, 92b, 92c.
Enfin, un détecteur de nitrates 98 permet de mesurer
à tout moment pendant le traitement la quantité de
nitrates présents dans la zone supérieure de l'enceinte
56 du dispositif de l'invention.
En référence à la figure 32, la première enceinte de
traitement 56 du dispositif de l'invention selon un
troisième mode de réalisation comporte sept couches de
zinc 99a, 99b, 99c, 99d, 99e, 99f, 99g réalisées de la
même façon que les couches de zinc 85a, 85b, 85c du
dispositif de l'invention représentés sur la figure 31.
Le dispositif représenté sur la figure 32 comporte
sept mobiles d'agitation correspondants 100 a, 100 b,
100c, 100 d, 100 e, 100 f, 100 g, respectivement disposés
dans chaque zone d'agitation 99a1, 99b1, 99c1, 99d1,
99e1, 99f1, 99g1 située au-dessus de chaque couche de
zinc cbrrespondant 99a, 99b, 99c, 99d, 99e, 99f, 99g.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
38
Le système d'ajustement du pH dans l'enceinte 56 est
identique à celui représenté sur la Figure 30 à ceci près
que les sondes pH 93a, 93b, 93c et les conduits
d'alimentation en acide respectifs 97a, 97b, 97c sont
disposés dans une zone d'agitation sur deux.
Le système d' ajustement du pH au niveau de la partie
inférieure de l'enceinte 56 n'est pas représentée sur la
figure 32 mais peut être présent et disposée de la même
façon que sur le dispositif représenté en figure 30.
Comme pour les premier et second modes de réalisation
de l'invention, la recirculation du liquide est assurée
par la pompe 59 les premier 66,, troisième 67,
quatrième 64 et cinquième 63 conduits et l'entrée du
liquide à traiter 61 dans l'enceinte 56 est assurée par
le sixième conduit 62, la vanne trois voies 60 et le
cinquième conduit 63.
Le dispositif représenté sur la figure 32 comporte
une sortie de liquide 103 indépendante du système de
recirculation du liquide qui débouche dans un conduit 105
à travers lequel le liquide traité 68 circule lorsqu'une
vanne deux voies 104 disposée au niveau du conduit 105
est ouverte, la commande de la vanne deux voies 104
n'étant pas représentëe sur la figure 32.
Le liquide traité 68 peut comporter une certaine
quantité de zinc en solution provenant de la présence des
copeaux de zinc dans l'enceinte 56 et de la circulation
du liquide à travers les couches de zinc 99a à 99g.
Or, les procédés et dispositifs de l'invention ont
pour but d'assainir un liquide chargé en nitrates sans le
polluer par d'autres composants afin qu'il soit non
nuisible pôur l'environnement.
Ainsi, pour réduire la quantité de zinc en solution
éventuellement présent dans la solution traitée 68, le
dispositif de l'invention 55 selon un troisième mode de
réalisation comporte en outre une deuxième enceinte de
traitement 106 reliée à la première enceinte 56 par le
conduit 105.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
39
La deuxième enceinte de traitement 106 d'un volume de
11 comporte trois électrodes cathodiques 108a, 108b, 108c
et quatre électrodes anodiques 109a, 109b, 109c, 109d qui
sont alternativement et transversalement disposées dans
l'enceinte 106 sur toute la largeur de l'enceinte 106 en
formant six cellules d'électrolyse respectives 110a,
110b, 110c, 110d, 110e, 110f de même hauteur et
régulïèrement réparties sur toute la hauteur de
l'enceinte 106.
Le liquide traité 68 dans la première enceinte 56
circule dans le conduit 105 et pénètre dans la partie
inférieure de l'enceinte 107 en traversant une première
entrée de liquide 111 puis circule dans l'enceinte 106
depuis la partie inférieure de l'enceinte 106 en
traversant les six cellules d'électrolyse 110a, 110b,
110c, 110d, 110e, 110f jusqu'à la partie supérieure de
l'enceinte 106 comportant une sortie de liquide 112.
La circulation du liquide à travers les cellules
d'électrolyse de l'enceinte 107 est assurée par une pompe
à recirculation 113.
Ainsi, le liquide sort de l'enceinte par la sortie
112 et circule dans un conduit 112a via une vanne trois
voies 114, dans les conduits 114a et 113a puis pénètre de
nouveau dans l'enceinte 107 par une deuxième entrée de
liquide 115 disposée également dans la partie inférieure
de l'enceinte 107.
Le liquide peut ainsi circuler plusieurs fois à
travers la série de cellules électrolyse dans l'enceinte
107 et le débit de la pompe est d'environ 0,5 m/s.
Au niveau de la .partie supérieure de l'enceinte 106,
une sonde pH 120 est reliée à un boîtier 121 qui commande
une pompe à injection 122 de soude qui, lorsque la sonde
120 détecte une baisse de pH, circule dans un conduit 122
débouchant dans la partie supérieure de l'enceinte 106.
En référence à la figure 33 qui est un agrandissement
de la'partie cerclée de la figure 32 et qui représente
deux cellules d'électrolyse 110c, 110d, l'électrode
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
cathodique 108b est réalisée par compression de grains de
charbon entre deux plaques perforées 116b, 116b' dans
lesquels une plaque métallique perforée 117 est enfoncêe
en étant reliée au pôle négatif d'un générateur de
5 courant non représenté.
Les électrodes anodiques 109b, 109c sont réalisées
par compression de copeaux de zinc entre deux plaques
perforées respectivement 118a, 118a'; 118b, 118b' et une
plaque métallique perforée 119b, 119c est enfoncée dans
10 les copeaux de zinc en étant reliée au pôle positif du
générateur de courant.
Les plaques perforées 118a, 118a'; 118b, 118b'; 116b,
116b' se présentent sous la forme de tamis permettant
d'éviter que soit des grains de charbon, soit des copeaux
15 de zinc ne se retrouve dans la solution.
Le générateur dëlivre une tension d'environ 2 Volts
pour un courant compris entre 1,5 et 1,8 Ampères par
litre de solution.
Bien entendu, la structure des électrodes anodiques
20 et cathodiques décrites en référence à la figure 33
s'appliquent à toutes les électrodes représentées sur la
figure 32.
Le tableau 4 représente les résultats en terme de
réduction de la concentration de zinc dans l'enceinte 106
25 en fonction du pH de la solution circulant dans les
cellules d'électrolyse 110a, 110b, 110c, 110d, 110e,
110f, de la concentration initiale en zinc dans le
liquide 68 et de la géométrie de l'électrode anodique.
35
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
41
Gomtrie C
Gomtrie de fina
Essai Co en p de l~lectrod le Remarques
H
n zinc l'lectrod
e anodique e en
cathodique zinc
Essai
arrt au
bout de 90
1 8g/L 4,5-5 plaque volumique -
min (forte
odeur de
Chlore)
Une grande
partie de
Zn
_ reste sous
1~
2 Sg/L plaque volumique - forme de
10,5 dpt au
f ond de
l'enceinte
Au bout de
5
heures il
reste un
1~
3 lg/L plaque volumique - dpt de
10,5
zinc au tond
de
l'enceinte
Modification
4 8g/L 4,5-5 volumique volumique 3g/L de l'aspect
des copeaux
de zinc
Dure de
l'essai 4
~ l
g
8g/L ~ volumique volumique ~L heures - pas
5
~ de dpt de
zinc au fond
Tableau 4
L'électrode cathodique utilisée dans les cinq essais
5 correspond à celle décrite précédemment en référence aux
figures 32 et 33.
En ce qui concerne la géométrie de l'électrode
anodique, l'électrode anodique mentionnée comme 'plaque'
dans le Tableau 4 consiste en une simple plaque de zinc
perforée reliée au pôle + du générateur.
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
42
Pour les essais 4 et 5, l'électrode anodique utilisée
et mentionnée comme 'volumique' correspond à celle
décrite précédemment en référence aux figures 32 et 33.
L'essai n°1 a été arrêté au bout de 90 minutes à
cause d'une forte odeur de chlore qui se dégageait de
l'enceinte 106, l'essai n°2 n'a pas donné de résultat
probant puisque du zinc est retrouvé sous forme de dépôt
au fond de l'enceinte 106 et de la même façon pour
l'essai n°3, au bout de 5 heures de traitement, un dépôt
de zinc s'est constitué au fond de l'enceinte 106.
En revanche l'essai n°4 dans lequel la concentration
initiale en zinc dans le liquide 68 est de 8 g/L a
permis, à un pH compris entre 4, 5 et 5 et en travaillant
avec des électrodes anodiques et cathodiques volumiques,
d'aboutir à une solution dans laquelle la concentration
en zinc est de 3g/L. I1 a été cependant remarqué au cours
de cet essai une modification de l'aspect des copeaux de
zinc constituant l'électrode anodique.
En ce qui concerne l'essai n°5, pour une
concentration initiale en zinc de 8 g/L dans le
liquide 68, un pH compris entre 10 et 10,5 et des
électrodes anodiques et cathodiques conformes à celles
décrites en référence à la figure 33, la concentration
finale en zinc est de 15 mg/L au bout de quatre heures.
Il apparaît qu'il est donc nécessaire de travailler
avec.des électrodes anodiques et cathodiques conformes à
celles décrites en référence aux figures 32 et 33 et que
le pH de la solution traversant les cellules
d'électrolyse 110a, 110b, 110c, 110d, 110e, 100f soit de
préférence supérieur à 7.
Ainsi, ~le dispositif 55 de l'invention permet, dans
la première enceinte 56, de réduire considérablement la
quantité de nitrates présents dans les eaux de drainage
et dans la deuxième enceinte 106, qui est en série avec
la première enceinte 56, .d'éliminer le zinc résiduel
pouvant rester en solution dans la solution traitée 68,
ce qui permet très avantageusement d'obtenir une solution
CA 02541940 2006-04-06
WO 2005/035451 PCT/FR2004/002528
43
de concentration en nitrates et en zinc tout à fait
convenable pour être rejetée dans l'environnement.
Comme décrit précédemment, le procédé et le
dispositif de l'invention permettent de réduire la
concentration en nitrates à une valeur inférieure à
50 mg/L, cette valeur correspondant au seuil de
potabilité qui était fixé en France, le seuil de
potabilité étant à présent fixé à 25 mg/L.
Naturellement, la concentration en nitrates obtenue
par le procédé et le disposïtif de l'invention étant bien
inférieure à 50 mg/L, l'invention s'applique également à
des seuils de potabilité fixés à une valeur inférieure à
50 mg/L.
Bien entendu, le dispositif de l'invention ne se
limite pas aux modes de réalisation décrit précédemment
et en particulier le dispositif 55 peut comporter une
multitude de couches de zinc, de préférence d'épaisseur
limitée et de la même façon, le dispositif 106 peut
comporter une multitude de cellules d'électrolyse.
Aussi, le volume de l'enceinte 106 peut être
identique au volume de l'enceinte 56 ce qui permet
avantageusement de vider intégralement le liquide contenu
dans l'enceinte 56 dans l'enceinte 106.
De plus, selon les volumes des première 56 et
deuxième 106 enceintes, l'homme du métier adaptera un
débit optimum de circulation du liquide pour chacun de
ces dispositifs.
Enfin, la deuxième enceinte de traitement 106, bien
que présentée comme réduisant la quantité de zinc dans le
liquide 68 préalablement traité dans l'enceinte 56 de
réduction des nitrates, peut être utilisé indépendamment
de l'enceinte 56 pour réduire ou éliminer, de façon
générale, le zinc contenu dans tout milieu liquide traité
ou non préalablement.